Université du Québec
Laboratoire antidopage - INRS-Santé
Effets de la contamination microbienne sur la stabilité
des androgènes en milieu urinaire
Examinateur externe Examinateur interne et codirecteur de recherche Directrice de recherche Par
Stéphane Lapointe
B
.Sc. Chimie (U de M)
Mémoire présenté pour 1' obtentiondu grade de Maître es sciences (M.Sc.)
en Sciences Expérimentales de la Santé
Jury d'évaluation
Dr. Jean-Guy Bisaillon
Dr. Michel Sylvestre
Dr. Christiane Ayotte
(21 août 1998)
Résumé
La découverte et le raffmement des méthodes de synthèse des stéroïdes depuis 1937 a permis 1 'utilisation de leurs propriétés androgéniques et anabolisantes à des fins thérapeutiques et suprathérapeutiques. La prévention et le traitement des maladies reliées au métabolisme des stéroïdes androgènes anabolisants (AAS) ainsi que le besoin de dépister leur consommation à des fins illicites ont forcé le développement des tests visant à étudier le profil d'excrétion urinaire des stéroïdes en milieu clinique et dans les laboratoires antidopages. L'échantillonnage des urines n'est pas effectué de manière stérile, ce qui augmente les chances de contamination par un grand nombre de micro-organismes. Les conditions de stockage et de transport ne sont pas toujours idéales et peuvent être favorables à l'activité bactérienne qui pourrait causer des dommages à la structure des stéroïdes. L'analyse d'une urine dont les stéroïdes furent dégradés est ou devrait automatiquement être déclarée non valide.
n
est dans l'intérêt des patients, des athlètes et des laboratoires de s'assurer que l'analyse des stéroïdes est représentative de l'état de l'échantillon au moment de la collecte. Pour s'en assurer, on se fie à la présence de deux stéroïdes normalement présents à l'état de trace dans l'urine: les S(a/~)-androstandiones, et/ou des stéroïdes endogènes dans la fraction libre de-l'extraction. En effet, un grand nombre de micro-organismes pouvant contaminer les urines ont la capacité de déconjuguer les stéroïdes sulfo et glucuroconjugués puis oxyder les groupements hydroxyles, produisant ainsi les androstandiones. Les enzymes impliquées dans ces biotransformations, très répandues dans le règne animal et microbien, sont les 3(a/~) et 17(a/~)-hydrogénasesd'hydroxystéroïdes et les réductases.
Très peu d'études avaient été faites au moment de débuter celle-ci sur la stabilité des stéroïdes dans une urine stérile ou contaminée, en fonction de paramètres variables lors de la collecte, du transport et du stockage des échantillons avant l'analyse. De plus, on ne s'entendait pas de manière unanime sur les marqueurs de la dégradation des stéroïdes, ni sur les conditions de rejet de l'analyse d'une urine ayant subi des conditions de transport ou d'entreposage inadéquates. Nous avons·décidé d'entreprendre une série d'études comportant quatre volets principaux.
1) la stabilité de certains stéroïdes androgènes conjugués d'intérêt en fonction du temps, de la température et du pH.
2) l'isolement et l'identification des micro-organismes généralement retrouvés dans les urines d'adultes sains.
3) l'étude générale et plus particulière des effets d'une contamination bactérienne sur les stéroïdes d'urines soumises à des conditions favorisant l'activité bactérienne.
4) l'étude de l'inhibition de la dégradation des stéroïdes d'urines fortement contaminées.
Nous avons constaté, dans un premier temps, que tous les stéroïdes androgènes sulfo et glucuroconjugués étaient très stables lorsque soumis aux conditions pouvant être imposées à certaines urines avant leur analyse. La seule exception étant la déhydroépiandrostérone (DHEA) sulfoconjuguée. Nous avons recensé les micro-organismes de 177 urines et constaté que plus de 95% étaient contaminées avant l'analyse, généralement parE. coli ou une variété de
staphylocoques ou d'entérocoques. Nos expériences nous ont aussi permis de soutenir les résultats précédents du groupe de Ayotte et al., 1996 après avoir observé que la dégradation bactérienne des stéroïdes mène généralement à la déconjugaison des stéroïdes puis à leur oxydation, résultats reproduits à l'aide de standards authentiques et d'isolats bactériens ou de cellules en milieu artificiel. De plus, une souche bactérienne d'Aeromonas salmonicida a été incapable d'oxyder un stéroïde androgène sous sa forme glucuroconjugué tout en ayant de la facilité à oxyder la forme libre. Nous avons aussi observé la production de stéroïdes d'intérêt tels la testostérone et la Sa.-dihydrotestostérone à partir de précurseurs endogènes, soient la DHEA, l'androstèn-3~,17(3-diol et le Sa.-androstan-3~,17~-diol. Toutefois, la présence de ces
intermédiaires, aussitôt oxydés, dans le milieu fut très brève. Enfin, nous nous sommes assurés que la congélation des échantillons et l'utilisation des agents bactéricides NaN3 et HgCh sont des moyens efficaces d'éviter l'éventuelle dégradation d'une urine fortement contaminée.
La mesure de la variation du pH au cours de l'incubation de 177 urines nous a permis de conclure que le pH élevé d'une urine lors de son analyse indique bel et bien l'activité microbienne mais pas nécessairement la dégradation des stéroïdes. La différence des pH au moment de la collecte et de l'analyse n'est pas un meilleur paramètre. Nous pouvons conclure par contre que l'analyse
de stéroïdes endogènes et/ou des androstandiones dans la fraction libre de l'extraction est un signe évident de dégradation des stéroïdes.
Remerciements
J'aimerais remercier en tout premier lieu
Dr Christiane Ayotte
pour avoir accepté d'être ma directrice de recherche durant deux brèves années. Une femme remarquable qui a su surmonter de nombreuses épreuves pour arriver où elle est présentement, et qui sait partager ses conclusions lorsque le besoin s'en fait sentir.Un gros merci au
Dr Michel Sylvestre,
qui a bien voulu remplir le rôle de codirecteur de recherche. Ses conseils judicieux, son empressement et son incroyable disponibilité en font un directeur idéal aux yeux des étudiants l'ayant côtoyé.Les amis( es) et connaissances que je me suis fait sont nombreux mais il importe de souligner l'omniprésence et le soutient de
Diane Barriault
(assistante de recherche) et deYves
Hurtubise
(étudiant post doctorat). Ce sont là deux grands professionnels toujours prêts et jamais las de partager leur savoir. ·Alain Charlebois
etDanielle Goudreault
(assistants de recherche, laboratoire antidopage de Montréal),Jean-François Lévesque
(étudiant à la maîtrise sous la même direction) ainsi quele personnel du laboratoire
comptent également parmi les figures de premier plan au cours de ma maîtrise.Je m'en voudrais de ne pas mentionner l'amabilité de toutes les personnes reliées de près ou de loin à mon projet. Les nommer serait trop long mais sans leur aide le temps aurait été plus long ...
Enfm, un Merci tout particulier à ma conjointe
Magalie Joly
que j'ai connue au début de ma maîtrise et qui m'a supporté dans le meilleur et dans le pire. Merci à ma famille et mes amis pour leur appui et leur confiance, je vous aime tous très fort.Table des Matières
Remerciements
iiRésumé
iiiTable des Matières
viListe des Tableaux
viiiListe des Figures
ivChapitre 1 :
INTRODUCTION1.1 Les androgènes 1
1.1.1 Biosynthèse et métabolisme des stéroïdes 4
1.2 Biotransformation des stéroïdes 7
1.2.1 Revue des réactions biocatalytiques répertoriées 7
1.2.2 Les principales enzymes impliquées dans la biotransformation
des androgènes 13
1.3 Le milieu urinaire 16
1.3.1 L'urine 16
1.3.2 Microflore urinaire et stabilité des stéroïdes 17
1.4 Objectifs 21
Chapitre
ll :
MATERIEL ET METHODES2.1 Standards stéroïdiens 22
2.2 Réactifs 23
2.3 Préparation des courbes d'étalonnage 24
2.4 Isolement des stéroïdes urinaires 25
2.5 Échantillons biologiques 28
2.6 Stabilité thermique et chimiques des stéroïdes 29
2.7 Isolement et identification des micro-organismes 30
2.8 Dégradation bactérienne urinaire 32
2.9 Biotransformation de standards stéroïdiens par une bactérie en milieu minimal 34 2.10 Biotransformation de standards stéroïdiens p~ un lysat cellulaire d'
Aeromonas
salmonicida
362.11 Inhibition de la biotransformation bactérienne des stéroïdes en milieu urinaire 37
Chapitre
ill :
REsULTATS Er DISCUSSION3.1 Stabilité thermique et chimique des stéroïdes sulfo et glucuroconjugués 38 3.2 Isolement des micro-organismes urinaires et identification bactérienne 41
3.3 Dégradation bactérienne urinaire 43
3.3.1 Effets observés 43
3.3.2 Suivi de la dégradation urinaire en fonction du temps 46 3.3.3 Comparaison des effets de la dégradation d'une urine stérile par diverses
souches bactériennes 4 7
3.3.4 Comparaison du profil de dégradation de plusieurs urines inoculées
par une même souche bactérienne 49
3.4 Biotransformation des stéroïdes en milieu minimal 50
3.4.1 Biotransformation de stéroïdes par les cellules d'A. salmonicida en milieu
minimal 51
3.4.2 Dégradation de stéroïdes par un lysat cellulaire de la souche 80 53 3.4.3 Biotransformation de la déshydroépiandrostérone et de l'androstèndiol 54 3.4.4 Patron de biotransformation en conditions oxydantes de la
déshydroépiandrostérone, de l'androst-4-èn-3~,17~-diol et du
5a-androstan-3~,17~-diol 56
3.4.5 Biotransformation en conditions oxydantes d'un stéroïde glucuroconjugué 57 3.5 Inhibition de la dégradation du profil stéroïdien urinaire 60
Chapitre IV:
CoNCLUSION 61Bibliographie
65Liste des Abréviations
68Tableau 1
Tableau 2
Tableau 3
Tableau 4
Tableau 5
Tableau 6
Tableau 7
Liste des tableaux
Liste des différentes catégories des réactions de biotransfonnations Exemples de biotransformations bactériennes de stéroïdes
Bactéries urinaires Bactéries intestinales
Analyse CG/SM (mode SIM) des stéroïdes d'intérêts. RRT par rapport au standard interne : 17a-méthyl-5a-androstan-3~, 17~-diol (rnlz 435,4) Stéroïdes utilisés pour l'étude de la stabilité chimique et thermique Déconjugaison des standards à pH 5 et 9 après 3 ~. 7 et 14 jours
à-20 à 50
oc
8 10 18 19 27 39 40Tableau 8
Bactéries isolées dans des urines non stériles 41Tableau 9
Dégradation statistique des stéroïdes de 177 urines 44Tableau 10
Variation du pH des urines lors d'une incubation à 37oc
45Tableau 11
pH de dix urines non stériles incubées 7 jours à 37oc
46Tableau 12
Dégradation en fonction du temps 47Tableau 13
Dégradation de huit urines produite par l'inoculation individuellede trois souches bactériennes 49
Tableau 14
Biotransfonnation de stéroïdes par A. salmonicida en milieu minimal 51Tableau 15
Biotransfonnation des stéroïdes authentiques par A. salmonicidaen milieu minimal 53
Liste des figures
Figure 1
Exemple de quelques dérivés synthétiques de la testostérone 3Figure 2
La stéroïdogénèse 5Figure 3
Métabolisme des androgènes 6Figure 4
Voie catabolique microbienne menant à la dégradation totale des stéroïdes 9Figure 5
Biotransformation de la testostérone 19 par Corynebacterium spp.11
Figure 6
Biotransformation de la progestéronelS.
par Pseudomonas spp. 12Figure 7
Patron de dégradation du ~-sitostéroll par Pseudomonas spp.NCm 10590 en conditions aérobies 12
Figure 8
Description et identification des principales caractéristiques des HSDH 13Figure 9
Réactions enzymatiques catalysées par les isoformes de la 3~-HSDH 14Figure 10
Exemple de la diversité métabolique dans la production de testostéronepar biotransformation microbienne 20
Figure Il
Chromatogramme TIC d'une urine dégradée après 1 à 7 joursd'incubation à 37
oc
44Figure 12
Résumé des principales biotransformations des stéroïdes urinaires. 48Figure 13
Présentation des principales biotransformations observées 52Figure 14
Patron de transformation de la DHEA et de l' Aèndiol en testostérone 55Figure 15
Dégradation de la DHEA, de l' Aèndiol et de la 5a-Adiol par A. salmonicida 56Figure 16
Chromatogramme TIC de l'oxydation du diol libre par A. salmonicidaCHAPITRE!
INTRODUCTION
1.1 Les androgènes
Les androgènes forment l'une des quatre classes d'hormones stéroïdiennes (stéroïdes) dérivées du perhydro-1 ,2-cyclopentanophénantrène, aussi appelé gonane. Majoritairement sécrétés par les testicules, ils jouent un rôle très important lors de la différenciation du genre masculin étant responsables entre autre du développement et du maintien des caractéristiques sexuelles mâles primaires et secondaires:
Les AAS (stéroïdes androgènes anabolisants) forment l'ensemble des androgènes et des
anabolisants responsables de l'apparition des traits de masculinité: mue de la voix, pilosité, etc., et de l'augmentation de la masse musculaire. Chez l'homme la testostérone (T) est l'androgène le plus puissant tandis que la 5a-dihydrotestostérone (5a-DHT) est l'anabolisant par excellence.
Le découverte de ces deux intéressantes propriétés all3.it conduire à leur utilisation pour des fins thérapeutiques et non thérapeutiques. En effet, les Allemands furent les premiers à avoir utilisé
des stéroïdes mâles pendant la 2e guerre mondiale dans le but d'accroître leur agressivité, tandis que les Soviétiques consommaient de la testostérone peu de temps après pour améliorer leurs performances athlétiques [Wade, 1972].
Les nombreux AAS sont des dérivés synthétiques de la testostérone, de la 5a-DHT et de la 19-nortestostérone. lls furent premièrement développés dans le but d'augmenter les effets
anaboliques au détriment des effets androgéniques, et deuxièmement, pour réduire la vitesse de leur métabolisme afin d'obtenir un effet anabolique fort et prolongé à de faibles concentrations.
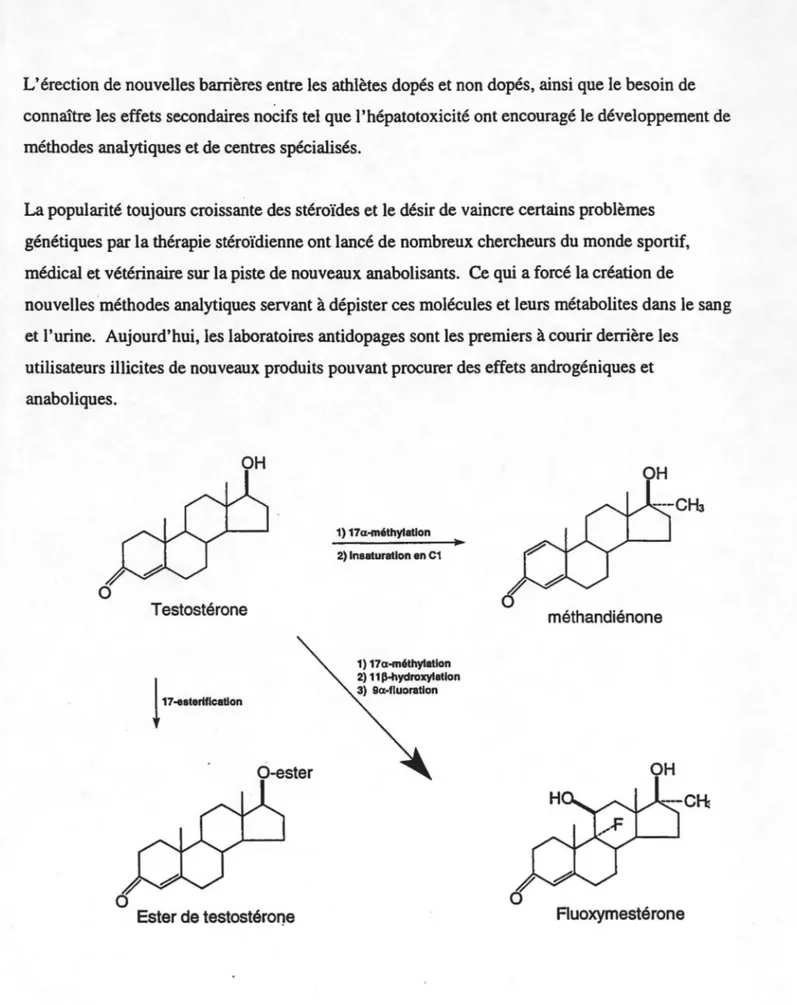
Quatre modifications chimiques principales ont mené à ces dérivés synthétiques : modification en c17 et en c3. modification de la structure cyclique et substitution des hydrogènes par différents radicaux. L'estérification du groupement 17~-0H a conféré un caractère plus liposoluble à la molécule, prolongeant son temps de demi-vie dans l'organisme. Jusqu'alors, on devait se limiter à 1' administration intra musculaire car la voie orale réduisait énormément 1' effet du stéroïde, on a donc procédé à l'alkylation en C17. [Voir les modifications à la structure cyclique (Figure 1) telles l'insertion de doubles liaisons créant la méthandiénone, ou l'addition de structures cycliques sur le cycle A]. D'autre part, l'aromatisation du cycle A en éliminant le groupement méthyl en C19, produisant les dérivés de la 19-nortestostérone aura permis d'agrandir la voie de synthèse vers les oestrogènes à potentiel anabolique. Enfin, l'insertion de radicaux Cl, F, OH, CH3, CHO, etc., créant par exemp~e la fluoxymestérone est une autre voie servant à augmenter le temps de demi-vie de la molécule dans l'organisme.
Les médecins se servent des AAS afin de traiter diverses conditions pathologiques telles : retard de croissance, ostéoporose, carcinome mammaire, aplasie médullaire, hypogonadisme, oedème de Quincke, traumatisme et brfilure grave [Wilson et Griffin, 1980], [Haupt et Rovere, 1984] et [Kopera, 1985]. Par contre, l'utilisation de quelques 10 à 20 AAS à des fins illicites a aussi atteint tous les paliers de notre société. Autrefois exclusivement réservés aux athlètes d'élite, ils sont de plus en plus utilisés par quiconque cherche à profiter de leurs propriétés, même s'il ne s'agit parfois que d'embellissement corporel.
L'érection de nouvelles barrières entre les athlètes dopés et non dopés, ainsi que le besoin de connaître les effets secondaires nocifs tel que 1 'hépatotoxicité ont encouragé le développement de méthodes analytiques et de centres spécialisés.
La popularité toujours croissante des stéroïdes et le désir de vaincre certains problèmes génétiques par la thérapie stéroïdienne ont lancé de nombreux chercheurs du monde sportif, médical et vétérinaire sur la piste de nouveaux anabolisants. Ce qui a forcé la création de
nouvelles -méthodes analytiques servant à dépister ces molécules et leurs métabolites dans le sang et l'urine. Aujourd'hui, les laboratoires antidopages sont les premiers à courir derrière les
utilisateurs illicites de nouveaux produits pouvant procurer des effets androgéniques et anaboliques. 1) 17a-méthylatlon 2) lnsaturatlon en C1 Testostérone méthandiénone 1) 17a-méthylatlon 2) 11 P-hydroxytatlon 3) Ga-fluoration 0-ester
Ester de testostérol')e Auoxymestérone
Figure 1 : Exemples de quelques d~rivés synthétiques de la testostérone.
1.1.1 Biosynthèse et métabolisme des stéroïdes
La scission de la chaîne latérale par l'action de la 20a, 22-C-27-desmolase dans le foie fait du cholestérol l'unique précurseur de tous les stéroïdes dans la biosynthèse humaine. C'est don~ de cette stéroïdogénèse, présentée à la Figure 2, que proviennent les androgènes, les oestrogènes, les prégnanes et les corticostéroïdes.
Par ailleurs, le métabolisme de la testostérone (Figure 3) mène à des composés stéroïdiens physiologiquement très actifs comme la 5a-DHT et l'estradiol ou à des composés inactifs tels l'androstérone (A) et l'étiocholanolone (Étio). L'activation ou l'inactivation est subséquente à l'action de certaines enzymes impliquées dans le métabolisme humain, soient: les 5(a/~)
réductases, les 17(a/~)-déshydrogénases d'hydroxystéroïdes (HSDH), les 3(a/~)-HSDH et 1' aromatase. Certaines de ces conversions peuvent être réversibles. Les principales voies de biosynthèses réunies dans les Figures 2 et 3 impliquent au moins une des quatre étapes suivantes selon Leunissen, 1979 :
a) Réduction de la double liaison en C4 et formation des 5( a/~)-androstanes, puis réduction subséquente du groupement 3-oxo en 3(a/~)-OH,
b) Réduction du groupement 20-oxo en 20(a/~)-OH, c) Oxydation du groupement 17 -OH en 17 -céto, d) Hydroxylation à différentes positions.
Malgré sa plus grande polarité, le métabolite libre d'un stéroïde demeure très liposoluble et devra être conjugué à une autre molécule le rendant hydrophile afin de pouvoir être excrété dans
l'urine. Les produits finaux seront donc liés à une ou deux molécules d'acide glucuronique ou de sulfate ou formeront des dérivés mixtes.
Les
métabolites androgéniques majeurs (A et Étio) se retrouvent à environ 90% sous la forme 3-glucuroconjuguée (A-G et Étio-G, voir Figure 3) et les androstandiols (Adiols) sont pratiquement complètement diglucuroconjugués. Par ailleurs, la déhydroépiandrostérone (DHEA) et les androstèndiols (Aèndiols) sont davantage sulfatés. Enfin, laT et l'épitestostérone (ÉpiT) se retrouvent sous les deux formes [Deslypere et al., 1981]...
/
-0 HOFigure 2: ~ stéroïdogénèse [Castagnetta et al.,
1990:
p. 2].1 1 1
iJ
~~éducüon
OH
H DihydrotestostéroneHO
Estradiol Testostérone~omatlsatlon
P-D111ucuro et sulfoconjugalson/
1) sa,p.réductlon 2) 171}-oxydatlon 3)3a~éductlon 0 - Glue. ou Sulfate.
Testostérone glucuronide et sulfate
Figure 3: Métabolisme des androgènes [Goodman & Gilman's, 1990].
Androstérone
1.2 Biotransformation des stéroïdes
Bien qu'on pourrait s'attendre à ce que la collecte des urines destinées à l'analyse des stéroïdes soit effectuée en conditions stériles, ce n'est pas le cas. En fait, la procédure la plus stérile serait la collecte par cathéter mais c'est aussi très fastidieux. On procède alors dans certains cas à la décontamination des voies d'excrétion externes et de la peau entourant ces régions, mais ce n'est pas toujours suffisant pour éliminer toute trace de micro-organismes. En outre, ces derniers se retrouvent en grand nombre dans la microflore intestinale, sur la peau et parfois dans l'urine même. ll n'est donc pas rare que les échantillons soient contaminés. D'autre part, un grand nombre de micro-organismes ont la capacité de biotransformer les stéroïdes, altérant ainsi les concentrations initiales. C'est donc le traitement que l'on porte aux échantillons, les espèces microbiennes présentes et leur nombre qui décidera du sort des stéroïdes urinaires.
n
est pourtant primordial que les échantillons demeurent intacts afin que 1' analyse soit intègre. Une étude menée par le groupe de Ayotte et al. en 1996 révèle que ce n'est pas toujours le cas. En effet, ils ont trouvé que près de 4% des analyses des échantillons urinaires furent déclarées non valides suite à la production d'androstandione, indiquant l'oxydation de stéroïdes. Les auteurs ont postulé que les modifications avaiC?nt été causées par des activités microbiennes. Hypothèse supportée par la détection dans les urines anormales de bactéries des groupes Staphylococcus spp. et Enterococcus spp.1.2.1 Revue des réactions biocatalvtigues répertoriées
Les transformations microbiennes des composés organiques sont connues de manière empirique depuis les débuts de l'histoire. Nous n'avons qu'à penser au processus de fermentation des fruits, des grains ou du lait. La production du vin 3000 ans avant J.-C. en témoigne tout autant. Mais ce sont les travaux de Louis Pasteur en 1857 sur la fermentation des sucres qui mirent à jour le pouvoir qu'a un micro-organisme d'effectuer une altération chimique précise sur un substrat particulier. La publication de ces travaux fut d'ailleurs intitulée 'La naissance de la
microbiologie' [Vallery-Radot, 1957].
Dès 1937, Mamoli et Verceil one ont démontré la conversion des stéroïdes 17 -céto en 17~-0H
lors de la fermentation par une levure [Mamoli et Vercellone, 1937]. Cette découverte rendait possible la synthèse de stéroïdes tels la testostérone pour des fins thérapeutiques. On a pu dès lors se rendre compte du très haut potentiel que possèdent les micro-organismes pour transformer les stéroïdes. Chamey et Herzog en 1967 et Mahato et Garai en 1997 ont présenté une liste exhaustive des multiples réactions biocatalytiques des micro-organismes. Le Tableau 1 présente une liste qui se limite toutefois aux exemples de biotransformations microbiennes pouvant affecter la structure des stéroïdes auxquels nous nous intéressons: T, 5a-DHT, DHEA et leurs métabolites. Comme on peut le constater, ces biotransformations comprennent une grande diversité de réactions d'oxydation, de réduction, d'isomérisation, d'addition, de réarrangement, d'élimination et de résolution de mélanges racémiques. ll importe aussi de mentionner qu'il existe un exemple de transformation microbienne à partir d'au moins un stéroïde pour chacune de ces réactions.
Tableau 1 Liste des différentes catégories des réactions de biotransformations 1. Oxydations
Nombreuses hydroxylations,
déshydrogénation (insertion d'une double liaison), époxydation,
oxydation d'un alcool en cétone ou en aldéhyde, oxydation d'une cétone en ester ou en lactone, aromatisation du cycle A sans dégradation,
dégradation du noyau stéroïdien (une séquence de réactions), coupure de la chaîne latérale en c20·
2.
Réductionsa) d'une cétone, d'un aldéhyde ou d'un acide en alcool b) d'une double liaison en position Ct. C4, Cs
3. Isomérisations :
ll.5 à Il. 4 et fl.S(ll) à fl. 4
4.
Additions diverses, réarrangements, éliminations5.
Résolutions de mélanges racémiquesLa biotransformation d'un stéroïde est une simple modification d'une de ses fonctions alors que sa minéralisation est une dégradation totale. Comme nous venons de le constater, un grand nombre de biotransformations peuvent altérer la structure d'un stéroïde. Talalay, 1957, Chamey et Herzog, 1967 et Owen et al., 1985 ont étudié la voie catabolique menant à la dégradation totale de stéroïdes suivant une cascade de réactions biochimiques présentes chez certains
micro-organismes. Comme on peut le remarquer à la Figure 4, cette voie requiert initialement une déshydrogénation en C1 d'une cétone a,~-insaturée en C3 précédée ou suivie, dépendant du
micro-organisme, d'une a-hydroxylation en C9• Les bactéries capables de ce genre de réactions
sont entre autres : Corynebacterium spp., Mycobacterium spp., Pseudomonas spp. et Nocardia spp. [Talalay, 1957], [Owen et al., 1985].
!
MBange de produlll · raa!mfqaes éle la
riductlou des groupemeull c:arbcntyl et c:UbouYJ
Produits de réduction
t
Figure 4: Voie catabolique nùcrobienne menant à la dégradation totale des stéroïdes [Chamey et Herzog, 1967: p. 49].
Plusieurs autres réactions biocatalytiques peuvent conduire à la conversion d'un stéroïde sans toutefois mener à sa minéralisation. L'oxydoréduction des groupements cétone ou hydroxyle eh 3 a/~ ou 17 a/~ avec ou sans insaturation en C4 ou en Cs sont des exemples fréquents. En voici
quelques-uns répertoriés par Mahato et Garai en 1997 qui tirent leur importance du fait qu'ils impliquent la conversion de stéroïdes naturels :
Tableau 2 Exemples de biotransformations bactériennes de stéroïdes
Substrat(s) Produit(s) Bactérie(s)
Aèndiol (3~, 17~) T Corynebacterium, Micrococcus dehydrogenans, Flavobacterium, Nocardia
Aèndiol (3a, 17~) T, EpiT Penicillium, Steptomyces
DHEA Aèndione Alcali genes faecalis, Flavobacterium, E. coli
A, Etio, DHEA Aèndione Mycobacterium
T Aèndione Nocardia
Nixon et al., 1986 ont étudié le patron de dégradation de la testostérone par Corynebacterium spp. Le schéma présenté à la Figure 5 indique que dans ce cas précis la testostérone 19 fut transformée en 14 produits, notamment la Sa et la 5~-DHT
Z
et~. différents Adiols, l' Aèndione 10, la 5~-Adione ~.le 5~diol ~et l'Épiétiocholanolone {ÉpiÉtio) 15.6Jnœnnus
!
OB~
A diois...__
.!!. B!
/
/
yu
Bd''....
B BFigure 5 : Biotransformation de la testostérone 19 par Corynebacterium spp. [Nixon et al.,l985].
10
Un autre type· de réaction implique la scission de la chaîne latérale en C20 des cholestanes,
prégnanes et autres. Leur biotransfonnation en stéroïde d'intérêt pourrait aussi fausser les
concentrations et mener à l'analyse d'un faux négatif ou d'un faux positif. Dhar et al., 1993 ainsi que Owen et al., 1985 ont étudié ce type de transformation en condition aérobie présentée dans les figures 6 et 7. La première décrit notamment la biotransformation de la progestérone 18 en Aèndione 10 et en androsta-1,4-dièndione via la testostérone 19 et un certain nombre
d'intermédiaires. La deuxième décrit la minéralisation-du ~-sitostérol! au cours d'oxydations successives générant notamment l' Aèndione 10 et l'androstan-1,3-dièn-3,17-dione.
Figure 6: Biotransformation de la progestérone 18 par Pseudomonas spp. [Dhar et al., 1993].
HO
CO 3 + H ,o
Figure 7 : Patron de dégradation du B-sitostérol
!
par Pseudomonas spp. NCm 10590 en conditions aérobies [Owen et al., 1985].1.2.2 Les principales enzymes impliquées dans la biotransfonnation des androgènes Le groupe d'enzymes responsables de l'oxydoréduction des fonctions hydroxyle et cétone fait partie de deux super familles d'enzymes soient: les aldo-céto réductases (AKR) et les
déshydrogénases d'alcools à courte chaîne (SOR). Largement étudiées au cours des dernières années dans les modèles bactériens, animaux et humains, ces enzymes se subdivisent aussi en sous groupes plus spécifiques. La Figure 8 tirée d'une étude de caractérisation menée par Penning et al. en 1997 présente une brève description de ces enzymes et identifie les principales réactions èatalysées par les déshydrogénases d'hydroxystéroïdes (HSDH) appartenant à l'un ou
1' autre de ces groupes :
Aldo-céto réductases Déshydrogénases d'alcools
à
courte chaîne • Monomérique, 34 kDa• Structures "TIM-barrel" (a/~)
8
• Spécificité NAD(P)(H)• Tyr 55, Asp 50, Lys 84, His 117 conservés
/l~
• Multimérique, monomères 25 kDa • Patron Rossmann (~-a.-~-a.-~)2 • Spécificité NAD(P)(H) • Motif Tyr-X-X-X-Lys
/l~
r::C::es
Il BSDIIJ 1 ' - - - '~B:J
1 BSDBJ 1/l~
/l~
1 3a·BSDB
llt7~BSDB
ll20a-BSDB 1j3âïî(iBSD~ lu~HSDH llt7~BSDB
1Androgènes Estrogènes Progestanes Streptomyces Cortisol Estrogènes
ou Androgènes
Figure 8 : Description et identification des principaleS caractéristiques des ·HSDH [Penning et al., 1997].
Tel que décrit par Payne et al., 1997 et présenté à la Figure 9, les oxydoréductions effectuées par les HSDH dépendent de la nature des substrats et du cofacteur préférentiel. Les oxydations sont favorisées à pH -9 et les réductions le sont à pH -6. D'autre part, certaines oxydations auront lieu en présence de NAD+ et d'autres en présence de NADP. Bien que les exemples soient rares, l'action de certaines enzymes comme la 3~-HSDH type II est réversible. ll semble par ailleurs selon ces mêmes auteurs que les concentrations intracellulaires des cofacteurs ne soient pas les mêmes, étant grandement en faveur du NADPH et du NAD+ chez l'humain. Ce qui a pour conséquence de favoriser l'un ou l'autre des types de réactions selon la spécificité de l'enzyme.
3(3-hydroxystéroïdes déshydrogénases 1
&
-114 isomérases3J3-HSDH 1,
rn,
(II) 3J3-HSDH:rv,v
~
NAD+~
-HO 0 Pri&D~nolooe Progest~rone 00~
-~
NAD+ -DBEA Aodrostèodlooe_
_qSP
NAO+0~
-NADH H HSa.-Androatan-313. 17p,..dlol Dlbydrotatoatérone
3-cétostéroïdes réductases Dlhydroteatostâooe NAD PH
-
-~
H Sa-Aodroataa-313. 17j3-dlolFigure
9: Réactions enzymatiques catal~sées par les·isoformes de la 315-HSDH [Payne et al., 1997].ll existe une multitude d'autres enzymes plus ou moins spécifiques aux stéroïdes dont
nous ne traiterons pas ici. Mais il est quand même important de garder en mémoire
qu'une molécule, aussi originale soit elle, synthétique ou naturelle, pourra subir une modification mineure ou majeure de sa structure.
1.3 Le milieu urinaire
Afin de pouvoir isoler les facteurs pouvant influencer la dégradation des stéroïdes, il importe de
connaître le milieu étudié, soit l'urine.
1.3.1 L'urine
La formation de l'urine est un processus très complexe en soit qui implique de nombreux
mécanismes. Une personne en santé excrète chaque jour de 600 à 2500 mL d'urine. Cet volume
variera eri fonction de la quantité d'eau ingérée, de la température ambiante, de l'alimentation, de la transpiration, ainsi que de l'état mental et physique du sujet. Sa densité varie entre 1,001 et
1,035 et son pH, normalement légèrement acide, va de 4,7 à 8,0 (moyenne de 6,0). ll sera plus
acide si 1' alimentation est riche en protéines, car le catabolisme de ces dernières augmente la production du phosphate et du sulfate, ou si le sujet est très actif physiquement. Par contre,
l'urine a tendance à devenir alcaline au repos entre autre parce que l'urée se transforme en
ammoiliaque. Sa couleur est généralement jaune pâle ou ambrée, suivant le volume de la diurèse et la concentration de l'urine. Elle est ordinairement limpide mais elle peut devenir trouble par
précipitation de phosphate de calcium à pH alcalin et dépôt des sels de l'acide urique sous forme
de nuages roses à pH acide. Quant à l'odeur d'une urine fraîche, elle est souvent caractéristique des aliments et peut être modifier par son vieillissement [H.A. Harper, 1977].
L'urine compte aussi un grand nombre de constituants organiques et inorganiques. Parmi les constituants minéraux on retrouve quelques grammes de chlorures, de sodium, de phosphore, de
potassium, de soufre, de calcium, de magnésium ainsi que quelques traces d'iode, d'arsenic et de
plomb. Du côté des constituants organiques, quelques grammes d'urée, de créatinine,
d'ammoniaque et d'acide urique, et quelques mg de protéines et créatine, ainsi que des traces de
sucre, des acides organiques tels ascorbique, hippurique, oxalique, des bases puriques, des corps
cétoniques et des phénols sont présents. On retrouve également les métabolites des hormones dont font partie les androgènes ainsi que les métabolites des médicaments et d'autres substances [H.A. Harper, 1977].
1.3.2 Microflore urinaire et stabilité des stéroïdes
Très peu d'études portant sur la stabilité des stéroïdes conjugués dans l'urine d'un point de
vue
strictement chimique et thermique ont été faites. Toutefois, il a été démontré que leur mesure n'est pas altérée lorsque les échantil19ns sont conservés à -20 QC pendant plus d'un an [Robards et al., 1990]. Par contre, la contamination des urines est un troisième facteur d'importance majeure. En effet, nous avons vu plus tôt que les micro-organismes ont la capacité d'effectuer un grand nombre de réactions à partir des stéroïdes ou d'autres substrats. Le milieu urinaire est un milieu riche qui peut aussi bien favoriser l'activité microbienne que lui nuire étant donné la grande diversité moléculaire. Des moyens préventifs tels la congélation des urines peuvent être envisagés mais rien ne semble être certain. D'ailleurs, une autre équipe de chercheurs ont noté la production de testostérone dans une urine réfrigérée 6 mois à 4 Q C [Shanzer et al., 1995].La dégradation des stéroïdes urinaires se traduit généralement par une déconjugaison suivie d'une oxydation des groupements hydroxyles. Les stéroïdes déconjugués ainsi que ceux qui furent oxydés se retrouvent donc dans la fraction libre. Le résultat dépend toutefois des conditions. Hemrnersbach et al., 1996 rapportèrent une forte déconjugaison des stéroïdes des urines incubées 5 jours à 37 QC mais aucune de ceux des échantillons conservés à 20 QC et moins. La même étude a révélé une hausse significative des concentrations de 5(a/~)-androstan-3a,17~-diollibres
à 37 QC comparativement à -20 QC, conjuguée à une production d'androstandione ainsi qu'à une élévation du pH.
Des études récentes menées par Meers et Chow, 1990, Guillenwater et Clark, 1996 ainsi que Martin et al., 1995 ont permis de caractériser la microflore présente dans les urines recueillies en conditions aseptiques et non aseptiques. Un inventaire des espèces microbiennes incluant des bactéries Gram(-), des bactéries Gram(+) et des levures est présenté au tableau 3. TI est important de noter que l'isolement 'clinique' de ces bactéries nécessitait une population supérieure à 5x104 bactéries/mL, ce qui constitue un nombre d'unités viables considérable, toutefois atteint lors d'infections urinaires souvent contractées à cause de deux espèces bactériennes particulières, E. coli et Proteus spp. Selon ces travaux, il semble que ce soit des espèces de Klebsiella, de Pseudomonas, d'entérocoques et de staphylocoques qui sont les plus souvent retrouvées dans les urines.
Parallèlement, Hirayama
et al.,
1995 ont identifié les bactéries peuplant généralement la microflore intestinale humaine. Ces espèces bactériennes apparaissant au Tableau 4 ont ellesaussi de fortes chances de contaminer l'urine dû principalement à la proximité entre les régions
anale et vaginale chez la femme. Ici, on parle majoritairement des
Bacteroidaceâe,
desBifidobacteria
et des Streptocoques.Tableau 3
Micro-organismes urinaires
Gram-E.
coli
Klebsiella
spp.Proteus spp.
Enterobacter spp.
Citrobacter spp.
Morganella morg_anii
Pseudomonas spp.
Aeromonas spp.
Serratia spp.
Acinetobacter spp.
Providencia spp.
Salmonella spp.
Gram+
Enterococci
Staphylococci
CorYn,ebacterium spp.
StreJ!!ococci
.:&.· ';y,:, :"{ ~ *>-''~ ·,~~tfes ~~
r
qbes
->.,
,1 Candidaalbicans
Levures Meers et Chow, 1990 2 Gillenwater et Clark, 1996 3 Martin et al., 1995 %/191 bact.~ 12 11 8 7 6 4 9 8 4 16 %/14306 urines2 39,5 10,7 5,5 3 2,60,5
9,2 2,4 0,2 0,7 11,9 12,3 . ..•. :. :·:;;. ,• 13 1,4 '• ~-,,; 3 0,1 %/247 bact.3 47 9 10 2 50,5
21 5 1 . !.0,5
.... :. %/205 urines3 56 11 11 2 60,5
26 6 10,5
Tableau 4 Bactéries intestinales - . M . . . ,- --'. · Miitoritaites • :. _ . aJontaires ,,
-· : . · , Bacteroidaceae Clostridia Eubacteria C. peifringens Bifidobacteria Enterobacteriaceae Streptococcus Peptococcaceae Lactobacillus Hirayama et aL, 1995.ll est connu de la littérature que le pH et 1 'urée jouent un grand rôle dans la colonisation
bactérienne. Selon Lauvetz et al., 1995l'activité antibactérienne est directement proportionnelle à la concentration d'urée et inversement à l'acidité urinaire. D'un autre côté, la croissance des bactéries dans l'urine aura des répercussions sur le pH et la teneur en urée car certaines bactéries peuvent scinder l'urée et d'autres ne le peuvent pas. En effet, la même étude a révélé que sur 121 urines contaminées, deux tiers des bactéries isolées, dont principalement E. coli, étaient
incapables de scinder l'urée, tandis que l'autre tiers, principalement Proteus, en avait la capacité. Ces dernières transformaient l'urée en ammoniaque, ce qui avait pour effet d'augmenter le pH.
Par ailleurs, il ne semble pas que la mesure du pH soit indicatif de dégradation bactérienne des stéroïdes. En effet, Ayotte et al., 1996 ont démontré que seulement 50% des échantillons urinaires ayant un pH se situant entre 8 et 9 présentaient des signes de dégradation invalidant la mesure des stéroïdes ciblés (il faut' cependant spécifier que la dégradation dont on fait mention dans cet article n'invoque qu'une oxydation avancée des stéroïdes. Elle ne tient pas compte de la déconjugaison). De plus, seulement 4% des échantillons reçus ont présenté des signes
d'oxydation sévères au cours des trois dernières années.
ll semble que 1' oxydation des stéroïdes par les bactéries soit un phénomène plus connu de la littérature que ne 1' est la réduction, et ce autant en milieu urinaire que synthétique, même si les expériences réalisées dans l'urine sont rares. Par exemple, dans une expérience tentant de démontrer le mécanisme de l'épimérisation 3a-OH /3~-0H d'un acide biliaire par Clostridium peifringens,·McDonald a constaté que l'équilibre entre l'intermédiaire cétonique et l'hydroxyle
favorise grandement la formation de la cétone à pH 10,5 [McDonald et al., 1983]. Le même résultat fut observé lors de l'épimérisation en C17 de la méthénolone [Goudreault, 1990]. Owen
et Bilton en 1987 ont indiqué que les bactéries fécales réduisent les fonctions cétones en C3 et C17
des stéroïdes en conditions anaérobies mais que cette réduction n'a pas lieu en conditions aérobies, plus souvent retrouvées dans les milieux urinaires.
Plus directement lié au sujet de notre étude, Bilton souleva en 1995l'importance de garder les échantillons urinaires cliniques sous congélation s'ils ne sont pas immédiatement analysés.
L'auteur rapporte dans un schéma reproduit à la figure 10 les possibilités de formation de laT par transformation microbienne à partir de précurseurs tels le cholestérol, les acides biliaires,
l' Aèndione, l'androsta-1,4-dièn-3, 17-dione, les prégnanes et les stéroïdes C19 saturés et non
saturés. Certaines des bactéries mentionnées peuvent effectivement être souvent retrouvées dans 1 'urine, pensons à E. coli, Nocardia, Pseudomonas et Klebsiella. ll faut cependant noter que plusieurs d'entre elles ne se retrouveront jamais ou pratiquement jamais dans une urine à moins de l'introduire volontairement. De plus, certaines sont anaérobes et ne pourraient pas effectuer les réactions décrites en conditions aérobies.
Cholestérol (esters) Acldes bUlaires (conjugués)
Testostérone 1 Androst-4-èn-3, 17-dione Androst-1, 4-dlèn-3, 17-c:lione
~
. /
1l
~
Stéroïdes Cu urinaires lnsaturis Stéroïde. Ct9 urinaires saturés1-::-1
~
Liste abrégée des bactéries capables de transformations stéroïd.iennes urinaires Microflore Intestinale humaine
EscherkhiG coU Klebsklkl pneumo11ûu Btu:Uroûla frogilis Blfidobtu:terium Qostridium paraputrijicum Autres microbes A.rthoiNu:ter NocardiG PserulomoJUU A.grobtu:ûTÛim Brmbtu:terium FlawJbtu:ID:ium
Figure 10 : Exemple de la diversité métabolique dans la production de testostérone par biotransformation microbienne [Bilton, 1995].
1.4 Objectifs
L'objectif principal de ce projet de recherche était l'étude des effets de la contamination microbienne sur la stabilité des stéroïdes androgènes en milieu urinaire. Nous nous sommes d'abord proposé de cerner les causes potentielles de dégradation urinaire telles la température, le pH et la contamination microbienne, et d'en différencier les effets. Pour ce faire, nous avons premièrement étudié la stabilité thermique et chimique des stéroïdes authentiques en milieu
aqueux soumis à diverses conditions de pH et de température. Le but était de différencier la
déconjugaison thermique et chimique de la déconjugaison microbienne. Par la suite, nous nous
sommes proposé d'observer les effets d'une incubation de 96 à 120 heures à 37
oc
sur lesstéroïdes androgènes, de manière à caractériser de manière générale la dégradation microbienne des stéroïdes. Nous avons aussi isolé et identifié les espèces microbiennes se trouvant dans
quelques-unes de ces urines afin de voir s'il y avait correspondance entre les effets observés et les
microbes présents. Dans une troisième étape, nous avons tenté de reproduire certains de ces effets en milieux synthétique afin de discriminer le rôle du milieu et d'étudier des dégradations particulières. Nous avons également étudier l'inhibition de la dégradation en conservant les
urines à -20
oc
ou en utilisant des bactéricides minéraux de manière à s'assurer que ladégradation était bien due à la présence de micro-organismes et qu'il est possible de 1' éviter.
CHAPITREll
MATERIEL ET METHODES
2.
1
Standards stéroïdiens
Les standards stéroïdiens suivants provenaient de Sigma Chem. Co. (St.-Louis, MO, É.U.): le 5cx-androstan-3cx, 178.-diol, le 5cx-androstan-3fS-17B.-diol, 1' androstérone, 1' &ndrostérone glucuronide, la déhydroépiandrostérone, l'épiandrostérone, l'épiétiocholanolone (standard interne), 1' épi testostérone, 1' épitestostérone glucuronide, 1' étiocholanolone, 1' étiocholanolone glucuronide, la testostérone. Le 17a-méthyl-5a-androstan-3~,17~-diol (standard interne)
provenait d'Amersham/Searle Corporation (Oak:ville, ON, Canada). La Scx-androstan-3,17-dione, la 58.-androstandione, le 5cx-androstan-3cx-17fS-diol 17 -glucuronide, 1' androst-4-èn-dione,
1' androstérone sulfate, le déhydroépiandrostérone glucuronide, la déhydroépiandrostérone sulfate, l'épiandrostérone sulfate, l'épitestostérone, l'étiocholanolone sulfate, la testostérone glucuronide et la testostérone sulfate provenaient de Steraloids, Inc. (Wilton, NH, É.U.). La testostérone USP provenait de U.S.P.C. Inc. (Rockville, MD, É.U.).
2.2 Réactifs
L'acide acétique, le phosphate de sodium dibasique anhydre, le phosphate de sodium
monobasique, le carbonate de potassium, l'acétate de sodium, le bicarbonate de sodium et l'acide sulfurique étaient de qualité analytique et furent obtenus de J.T. Baker Chem. Co. (Phillipsburg, NJ, É.U.), de Fisher Scientific (Montréal, Qc., Canada), de BDH Canada (Ville St.-Laurent, Qc., Canada) ou de Malinckrodt (Paris, KY, É.U.). L'éther diéthylique, le dichlorométhane, l'hexane, le méthanol, l'acétate d'éthyle et l'éthanol étaient de qualité HPLC et furent obtenus de Caledon Lab. Ltd. (Montréal, Qc., Canada). L'enzyme lyophilisée contenant 1 500 000-2 000 000
d'unités/g de ~-D-glucuronidase type IX-A provenant de
Escherichia coli
fut obtenue de SigmaChem. Co. (St.-Louis, MO, É.U.). L'eau était purifiée par osmose inverse et filtrée par un système Milli-Q (Millipore, Ville St.-Laurent, Qué., Canada). L'azote, grade zéro, fut obtenu d'Air Liquide Canada Ltée (Montréal, Qué., Canada). Le MSTFA
(N-méthyl-triméthylsilyltrifluoroacétamide), le TMIS (triméthyliodosilane), l'éthanethiol et la triéthylamine furent obtenus d'Aldrich (Milwaukee, WI, É.U.).
Les tampons biologiques (MES, CAPS, TRIS et Bicine), l'urée, l'azoture de sodium, le dichlorure de mercure, 1 'EDT A, le carbonate de calcium, le sulfate ferreux heptahydraté, le sulfate de magnésium heptahydraté, le sulfate de manganèse monohydraté, le sulfate de zinc heptahydraté, le sulfate de cuivre pentahydraté, le chlorure de calcium hexahydraté, le borate de sodium dibasique heptahydraté, le phosphate de sodium dibasique anhydre, le phosphate de potassium monobasique anhydre, le sulfate d'ammonium, le glucose, la tryptone, l'hydrolysat de caséine, les extraits de levure et les cofacteurs provenaient tous de Sigma Chem. Co. (St.-Louis, MO, É.U.), Boehringer, Fisher Scientific (Montréal, Qué., Canada), ICN (Cleveland, Ohio, É.U.) ou Difco (Détroit, Michigan, É.U.).
2.3
Préparation des courbes d'étalonnage
Sept courbes d'étalonnage ont servi à la quantification. Des courbes de testostérone et d'épi testostérone furent préparées de la manière suivante: huit (8) solutions étalons furent
préparées en solubilisant des standards stéroïdiens dans une urine d'enfant prépubère de manière à obtenir des rapports T/ÉpiT se situant entre 0,54 et 10,73. La concentration finale des solutions étalons urinaires variait entre 1,8 et 352 ng/mL pour laT et entre 1,6 et 328 ng/mL pour l'ÉpiT. Les courbes d'androstérone et d'étiocholanolone furent préparées en ajoutant aux solutions étalons urinaires décrites ci-haut de l'A-G et de l'Étio-G dans des concentrations équivalentes à
332-2657 ng/mL d'A-L et 320-2561 ng/mL d'Étio-L. Les rapports A/Étio de ces standards variaient entre 0,13 et 8,30. Les courbes de 5(a/~)-androstandiones furent préparées en diluant les standards stéroïdiens dans du méthanol avant de les dériver et de les injecter. Les
concentrations finales variaient entre 0,5 et 40,0 ng/J.IL injecté. La courbe de
déhydroépiandrostérone fut préparée à l'aide de solutions étalons couvrant 2,5 à 1000 ng/mL de DHEA-L.
2.4 Isolement des stéroïdes urinaires
Les procédures utilisées pour isoler les stéroïdes urinaires destinés à l'analyse chromatographique sont les suivantes :
a) Stéroïdes libres et glucuroconjugués: 2,5 J.Lg d'épiétiocholanolone et 250 ng de 17a.-méthyl-5a.-androstan-3~-17~-diol (standards internes) furent ajoutés à 3,0 mL d'urine auxquels furent ajoutés 3,0 mL de tampon acétate (200 mM, pH 5,2). La préparation fut alors passée sur une
cartou~he
Sep-pak Cts® (Millipore, Ville St.-Laurent, Qc., Canada) préalablementconditionnée par le passage de 5 mL de méthanol et de 5 mL d'eau. La cartouche fut ensuite lavée avec 5 mL d'eau et 3 mL d'hexane et les stéroïdes furent élués en une seule fraction à l'aide de 5 mL de méthanol (débits: 1-5 rnUmin.). Le solvant fut évaporé à sec sous un jet d'azote à 50 °C. Le culot fut ensuite dissous dans 2 mL de tampon phosphate (200mM, pH 6,9) dont 1 mL fut transféré dans un autre tube de 15 mL de manière à obtenir un double de l'échantillon initial permettant d'extraire les stéroïdes libres en une première fraction et les stéroïdes libres +les stéroïdes glucuroconjugués en une deuxième fraction (voir extraction des libres ci-après). L'hydrolyse enzymatique fut effectuée suite à l'ajout de 50
f.LL
d'une solution de ~-D-glucuronidase type IX-A (de E. coli, 40 000 unités Fishman/mL) fraîchement préparée formant un mélange réactionnel incubé 1 heure à 50 °C. La température fut ensuite abaissée à la température ambiante et le pH du mélange ajusté à 8,5 en ajoutant 100 mg de tampon carbonate/bicarbonate (10:1 p/p). Les stéroïdes furent extraits avec 5 mL d'éther diéthylique en agitant sur Vortex et en centrifugeant 10 min. à 3000 rpm. La phase organique fut évaporée à sec sous azote et le résidu dissout dans 200f.LL
de méthanol puis transféré dans unRéactivial® de 200
J.LL.
Le résidu fut ensuite soumis à la dérivation selon la procédure décrite en b ). L'extraction des stéroïdes libres dans une matrice urinaire s'est faite de la même façon en excluant toutefois l'hydrolyse enzymatique tandis que les stéroïdes libres dans une matrice aqueuse tamponnée furent extraits en ajustant le pH de la solution à pH 9 puis en passant immédiatement à 1' étape de l'ajout de 1' éther diéthylique.b) Dérivation chimique: la dérivation TMS-éther, TMS-énol fut effectuée par l'addition de 50 J..LL d'un mélange de MSTFA: TMIS (0,1 M): éthanethiol50: 1 : 1. La solution fut chauffée dans un Réactivial® de 200
J.1L
bouché sous atmosphère d'azote à 70oc
pendant 30 minutes. La solution de TMIS fut préparée par l'addition de TMIS: triéthylamine: dichlorométhane 215: 35 : 1 sous atmosphère d'azote.Tous les stéroïdes furent identifiés à l'aide de standards stéroïdiens authentiques.
Conditions analytiques du CG/SM
Les analyses CG/SM étaient pratiquées sur un Hewlett Packard 5970 MSD (Hewlett Packard, Mississauga, Ont, Canada) couplé à un chromatographe en phase gazeuse, modèle 5890 (série
m
équipé d'échantillonneurs automatiques modèle 7673. L'instrumentation et les données étaient contrôlées par ordinateur Hewlett Packard Vectra VL2 sous Hewlett Packard MS Chemstations (séries DOS) software (version C.02.03). La séparation était obtenue sur une colonne capillaire HP-5 (190911-102) contenant 5% de polyméthyl phényl siloxane (25 rn x 0,25 mm x 0,33 J..Lm d'épaisseur) de Hewlett Packard.Les analyses de l'androstérone et de l'étiocholonalone étaient effectuées à l'aide d'un
chromatographe en phase gazeuse Hewlett.Packard 5890 (série
m
muni d'un échantillonneur automatique ainsi qu'un détecteur FID opérant sous HP 3365 Series II Chemstations (séries DOS) software (version B.02.04). Une colonne capillaire J&W, DB-1 faite de silicepolyméthylée (15 rn x 0,25 mm x 0,25 J..Lm d'épaisseur) (Chromatographie Specialties, Brockville, Ont., Canada).
Les analyses CG/SM étaient effectuées en injectant 1
J.1L
du dérivé TMS-éther, TMS-énol en mode débit non partagé (30 sec) dans un port d'injection débit partagé/non partagé muni d'un conduit interne en verre contenant de la laine de verre, tous deux silanisés. L'hélium était utilisé comme gaz vecteur et la programmation de température du four était la suivante : 100oc
(l min) à 200oc
à raison de 16 °C/min, à 301oc
à raison de ~.8 °C/min et finalement à 320oc
à raison de 20 °C/min. La température finale était maintenue pendant 5,5 min. La température du port d'injection était maintenue à 270oc
et la ligne de transfert à 315 °C. Le multiplicateur d'électronétait fixé à 200 eV de plus que le voltage obtenu de 1' ajustement automatique du détecteur sélectif de masse avec une ionisation par impact électronique à 70 eV durant l'analyse. Les analyses étaient effectuées en mode SIM ou scan. Les spectres de masse étaient obtenus en balayant la région rnlz 50 à rnlz 660 amu.
Chaque séquence analytique incluait l'analyse d'un mélange standardisé afin de vérifier la performance analytique du CG/SM. Le mélange contenait notamment de la testostérone, de l'épitestostérone (2 ng!JlL injecté) et du 17a.-méthyl-5a.-androstan-3~,17~-diol (standard interne) (5 ng/J.lL injecté). Un contrôle de qualité était effectué dans le but de vérifier la performance de la procédure entière à l'aide d'un échantillon urinaire contenant de la testostérone et de
l'épitestostérone ainsi que de l'androstérone et de l'étiocholanolone glucuroconjuguées.
Tableau 5 Analyse CG/SM (mode SIM) des stéroïdes d'intérêt. RRT par rapport au standard interne: 17a.-méthyl-5a.-androstan-3~,17~-diol (rnlz 435,4)
Stéroïdes RRT(min) Ions (mlz)
5( aJ~)-androstan-3a., 17~-diol 0,865 346,3 ; 331,3 ; 256,2 ; 241,2
5( aJ~)-androstan-3~, 17~-diol 0,934 346,3 ; 331,3 ; 256,2 ; 241,2
Sa.-androstan-3,17-dione 0,931 432,4 ; 290,2 ; 275,2
5~-androstan-3, 17 -di one 0,806 432,4 ; 290,2 ; 275,2
ll5 -androstèn-3~, 17~-diol 0,924 434,4; 344,3 ; 239,2; 129,1 /l4-androstèn-3,17 -dione 0,958 430,0; 415,0 Déhydroépiandrostérone 0,909 432,0; 417,0; 327,0 Sa.-dihydrotestostérone 0,943 434,4; 405,4; 143,1 5~-dihydrotestostérone 0,811 434,4; 405,4; 143,1 Epiandrostérone 0,914 434,4; 419,4; 239,2 Epi testostérone 0,968 432,4; 417,4 Testostérone 0,973 432,4; 417,4 27
2.5
Echantillons biologigues
Les échantillons urinaires utilisés provenaient de volontaires sains, hommes et femmes, âgés entre 18 et 40 ans et d'athlètes de diverses origines, recueillis dans le cadre de programmes nationaux et internationaux. Afin de prévenir toute dégradation, les urines furent congelées, passées sur filtres stérilisant Nalgene® 0,2 J.Lm (NalgeneBrand Products, Rochester, NY, É.U.), ou immédiatement utilisées. L'urine témoin fut filtrée et congelée à -20
oc
en petits volumes de moins de 100 mL de manière à ne décongeler que la fraction nécessaire à la fois, prévenant ainsi les variations provoquées par un gtand nombre de manipulations.2.6 Stabilité thermique et chimique des stéroïdes
Une solution mère de 1000 J.Lg/mL. fut préparée pour chacun des 9 stéroïdes suivants : DHEA-S, A-S, Étio-S, T-S, ÉpiA-S, DHEA-G, T-G, A-G et Étio-G. Les volumes nécessaires de ces solutions furent ajoutés à deux fioles jaugées de 25 mL contenant soit les sulfates soit les
glucuronides et 625
J.LL
d'une solution mère des deux standards internes de manière à obtenir des concentrations finales de 2000 ng/mL pour la DHEA, l'A, l'Étio et l'ÉpiA et de 200 ng/mL de T. Des solutions aqueuses tamponnées à l'aide de deux tampons biologiques, CAPS et MES (0,5 M) ont servi à compléter au trait de jauge en ajustant les pH à 5,0 et 9,0 respectivement. Lessolutions furent passées sur des filtres stérilisant Nalgene® 0,2 J.Lm et chacune d'elles fut distribuée par volumes de 4 mL dans des tubes stériles de 15 mL. Ces tubes furent ensuite
incubés à 20, 37 et 50 °C. Des aliquotes de 0,5 mL furent prélevés de chaque tube après 3 Y2, 7 et 14 jours puis congelés à -20
oc
jusqu'à l'analyse.De la même manière, trois solutions d'A, d'ÉpiA et d' Aèndiol de concentration égale à 20 J.Lg/mL furent incubées à 37 et 50
oc
pendant 14 jours dans les conditions décrites précédemment.2. 7 Isolement et identification de micro-organismes
Préparation des milieux de culture
• Luria Bertani (LB) : un litre de ce milieu de culture fut préparé en solubilisant lOg de tryptone, 5g d'extrait de levure et lOg de NaCl dans un litre d'eau distillée. La solution fut amenée tout près du point d'ébullition afin de bien dissoudre les solides, puis elle fut stérilisée dans un autoclave à l'aide d'un cycle liquide de 20 min., 15 psi et 120 °C.
• Milieu minimal MM30 (MM30) : un litre de milieu minimal stérile fut préparé en ajoutant 1 g de (N~hS04; 3 g de KH2P04; 6 g de Na2HP04; 3 mL d'une solution de sels minéraux; 100 mg d'une solution d'hydrolysat de caséine 5% et 50 mg d'une solution d'extraits de levure 5%. Le pH de la solution fut ajusté entre 5,0 et 9,0 par incréments de 0,5 unité en ajoutant du HCl ou du NaOH. La solution de sels minéraux fut préparée en mélangeant 0,5 mL des solutions stériles suivantes: EDTA 5%; CaC03 1%; FeS04•7H20 0,5%; MgS04•1H20 10%; MnS04•H20 10%
plus 0,5 mL du mélange 44 et 20 mL d'une solution de glucose 50%. Le mélange 44, pour sa part, fut préparé en solubilisant 250 mg d'EDTA, 1095 mg de ZnS04•1H20, 39,2 mg de CuS04•5H20, 20,1 mg de CaCh•6H20 et 17,7 mg de Na2B407•10H20 dans 100 mL d'eau
distillée contenant 5 gouttes d'acide sulfurique concentré.
Isolement des micro-organismes dans les urines
Afin de recenser les micro-organismes présents dans les urines, chacune d'elles fut incubée à 37
oc
dans un agitateur ro~tif réglé à 250 rpm. Après 18-24 bres un prélèvement de 5J.1L
fut étalé sur une gélose nutritive en condition aérobie. Chacune des colonies différentes qui apparurent après 18-48 bres d'incubation à 37oc
fut purifiée par repiquages successifs sur le même type de gélose. Par la suite, la souche purifiée fut inoculée dans 1 mL de milieu LB et incubée de 18-24 hres à 37 °C. La suspension bactérienne fut mélangée à un volume égal de glycérol 20% (v/v) pour être congelée à -80 °C.Isolement des micro-organismes pouvant être inclus lors de la réception des échantillons urinaires Trois
mL
de milieu LB furent prélevés à 1' aide des pipettes utilisées lors de 1' échantillonnage au laboratoire. Les volumes furent transférés dans 10 tubes non stériles de 15mL
servant à la procédure d'extraction. Après mesure du pH, les milieux furent ensuite incubés 96 bres à 37oc
dans un agitateur rotatif réglé à 250 rpm.Identification
Chaque isolat bactérien fut caractérisé sommairement en déterminant sa réponse au test de coloration de Gram, ainsi qu'au test de catalase et par une observation microscopique. L'identification au niveau du genre et de l'espèce fut réalisée en utilisant les galeries
d'identification bactérienne API (BioMérieux, St.-Laurent, Qué., Canada) ou Biolog (Biolog, Hayward, CA, USA) selon le protocole suggéré dans le livret de la compagnie. Les galeries API-20E ont servi à identifier les Enterobacteriaceae et les principaux bacilles à Gram (-) non fermenteurs, les galeries API-Staph ont servi à identifier les staphylocoques et les microcoques, et les galeries Biolog (-)et Biolog (+),couvrant des spectres plus larges qu'API, ont servi à
identifier les bactéries plus difficilement identifiables avec les autres galeries.
2.8
Dégradation bactérienne urinaire
Suivi de la dégradation urinaire en fonction du temps
Dix urines de pH connus provenant de volontaires sains et recueillies en conditions non stériles furent incubées à 37
oc
dans un bain thermostaté à même le pot de plastique de 120 mL servant à recueillir l'urine. Cinq mL furent prélevés stérilement à chaque 24 heures durant 7 jours et les pH furent mesurés avant la congélation des échantillons à -20 °C.Evaluation des effets de la dégradation sur les stéroïdes urinaires
Trois mL de chaque urine furent pipettés et versés dans un tube éprouvette stérile de 10 mL, lequel fut incubé de 96-120 hres à 37
oc
dans un agitateur rotatif réglé à 250 rpm. Unprélèvement de 5 J.LL était effectué après 18-24 hres dans le but d'isoler les bactéries présentes. À
la fin de la période d'incubation, les pH étaient mesurés puis les échantillons étaient analysés ou congelés à -20
oc
jusqu'à l'analyse.Transfert des facteurs causant la dégradation entre les urines
Un mL d'une urine non stérile dans laquelle la dégradation avait été démontrée au préalable fut transféré dans 19 mL d'une urine stérile contenue dans une fiole Erlenmeyer de 100 mL. L'urine fut incubée à 37
oc
pendant 6 jours sur un agitateur rotatif réglé à 250 rpm. Des aliquotes de 3 mL f1:1rent prélevés et congelés après 0, 24, 40 hres et 6 jours. Un décompte des unités viables fut effectué au moment de ces prélèvements en utilisant la méthode des dilutions sériales dans la saline 0,85% (plv) et étalement sur gélose.Mesure des effets de la dégradation de plusieurs urines causés par une même souche bactérienne Des suspensions de D.O. 6oo = 0,5 (suspensions standards) furent préparées à partir de cellules congelées des souches bactériennes
1*
(Corynebacterium renale), 10 (Corynebacteriumpseudodyphteriticum) et 106 (E. coli) incubées 18 hres dans 1 mL de milieu LB. Après mesure du pH, huit échantillons urinaires furent passés sur flltres stérilisant Nalgene® 0,2 J.Lm. Les inoculums furent préparés en transférant 100
J.1L
de chacune des suspensions bactériennes danshuit tubes éprouvettes de 15 mL contenant 3 mL de chacune des urines stériles. Les suspensions furent aussitôt incubées à 37
oc
sur un agitateur rotatif réglé à 250 rpm durant 5 jours. Un aliquote de toutes les urines fut congelé à -20oc
en attendant l'analyse.2.9 Biotransformation de standards stéroïdiens
par
une bactérie en milieu
minimal
Vérification de la biotransformation
L'inoculum fut préparé en inoculant une éprouvette stérile de 10 mL contenant 2 mL de milieu LB avec des cellules bactériennes congelées. La culture fut incubée à 37
oc
de 18-24 hres. Après centrifugation, le culot fut lavé deux fois avec une solution saline 0,85% (plv). Un volume de 100 ~L d'une suspension bactérienne standard fut inoculé dans 2 mL de MM30 contenant 10 000 ng/mL de stéroïde. La culture fut ensuite incubée 48 hres à 37 °C.Vérification de l'oxydation d'un stéroïde sous la forme libre et glucuroconiuguée On a ajouté à un tube stérile a de 50 mL, 43 nmoles de
5a-Androstan-3a,17~-diol-17-glucosiduronate et 9,5 mL de MM30 pH 9,0 préalablement équilibrée à 37 °C. Un autre tube stérile b contenait en plus 4300 nmoles de saccharolactone. Un troisième et dernier tube stérile c contenait 43 nmoles de 5a-Androstan-3a, 17~-diollibre au lieu du stéroïde conjugué et servait de témoin. Un volume de 500 ~d'une suspension bactérienne standard d'Aeromonas salmonicida
fut ajouté ( -109 bact.) à chacun des trois tubes préalablement équilibrés à 37 °C. Un volume de deux fois 200 ~ont été prélevés des tubes a et b et 1 x 200 ~du témoin après 0, 5, 15, 30, 45, 60, 90 et 120 min. 5 mL d'éther diéthylique et 25 ~de la solution de standards internes furent ajoutés et tous les tubes furent immédiatement agités au vortex puis congelés à -20
oc
jusqu'à l'analyse. Chacune des deux aliquotes des tubes a et ba servi à mesurer la quantité de stéroïde(s) dans les fractions libre et glucuroconjuguée tandis que seule la fraction libre fut extraite dans le cas du témoin suivant la procédure décrite en 2.4Patt:on d'oxydation des précurseu~ immédiats de la testostérone: la déhydroépiandrostérone. l'androstèn-36.176-diol et le Sa-adrostan-36.176-diol
Des cellules d'A.salmonicida furent induites en incubant pendant 18 hres à 37
oc
une suspension de ces cellules bactériennes congelées dans une éprouvette stérile contenant 1 mL de MM30 et 1mL de LB plus 0,05% (p/v) d'un des trois stéroïdes. Un volume de 100 ~d'une suspension bactérienne ·standard des cellules induites furent ajoutés à 10 mL de MM30 équilibré à 37
oc
etcontenant 40 J.lg de substrat. Les aliquotes furent ensuite incubés à 37
oc
et 200f.lL
furentprélevés après 0, 2, 5, 10, 30, 60, 120 min., 18 hres et 7 jours. Les prélèvements furent transférés dans des tubes contenant 25
f.lL
de la solution de standards internes et 5 mL d'éther diéthylique, puis congelés à -20 °C.Biotransformation de la déhydroépiandrostérone et de l'androstèn-36.176-diol par 27 micro-organismes différents
Vingt six souches bactériennes différentes isolées et identifiées au cours de ce travail (1,
,2,
10, 13, 14, 18, 19, 22, 24, 28, 30, 36, 38, 42, 43, 51, 55, 57, 61, 64, 67, 77, 80, 93, 95 et 106)* ainsi qu'une levure(@)* furent inoculées dans 1 mL de milieu LB. Les cultures furent incubées à 37 °C. Après 18 hres, les cellules furent centrifugées et lavées avec de la saline 0,85% (plv). La suspension bactérienne fut ajustée à une D.O. 600 = 0,5-1,0. Un volume de 100f.lL
de chacune des suspensions furent transférés dans 1,0 mL de MM30 pH 9,0 contenant 2000 ng de DHEA ou 500 ng d' Aèndiol. Les cultures fut incubé 48 hres à 37 °C.• Chaque souches bactériennes fut numérotée lors de l'identification, voire Tableau 6 section 3.2.
2.10 Biotransformation de standards stéroïdiens par un lysat cellulaire
d'
Aeromonas salmonicida
Préparation du lysat cellulaire
Une culture bactérienne congelée d'A. salmonicida a servi à inoculer 500
mL
de milieu LB. La nouvelle culture fut incubée de 18 à 24 bres à 37 °C. Après une centrifugation de 10 min. à 8000 rpm et deux lavages à la saline 0,85% (plv), on a induit les 3 a/~ et 17 a/~ HSDH ont été induites en ajoutant 0,01% (plv) d'un mélange de quantités équimolaires d'A, de DHEA, de Tet d'ÉpiT au culot bactérien suspendu dans 100mL
de milieu MM30. Après une incubation de 16 bres à 37 °C, la culture a été centrifugé et les cellules lavées à la saline puis le nouveau culot suspendu dans 4 volumes de tampon Hepes 10mM
pH 7,0. La suspension fut soniquée 15 sec et refroidie 45 sec dans un bain de glace. Le cycle fut répété 10 fois. Le lysat fut alors centrifugé 30 min. à18 000 rpm et congelé à -80
oc
par fractions de 1mL.
Biotransformation des standards stéroïdiens
Un volume de 100
J.1L
d'un lysat cellulaire a été ajouté à 14 nmoles de substrat et 100 nmoles de co-substrat (NAD+/NADP pour l'oxydation et NADHINADPH pour la réduction) dans un volume final de 300J.1L
ajusté à pH 6,0 (réduction) ou 9,0 (oxydation) à l'aide des tampons MES et Bicine 50mM,
respectivement.2.
1
1
I
nhibition de la biotransformation bactérienne des stéroïdes en milieu
urinaire
Après lecture du pH, deux urines fraîchement recueillies furent passées sur des filtres stérilisants Nalgene® 0,2 J.Lm. Sept aliquotes de 3,0 mL furent pipettés pour chacune des urines puis versés dans des tubes stériles de 10 mL contenant 100
J.1L
d'une suspension bactérienne standard provenant d'un mélange à part égale (en volume) des souches bactériennes1
(C. renale), 80 (A. salmonicida) et 106 (E. coli). Un l'remier aliquote non inoculé servait de blanc tandis qu'un deuxième ayant été inoculé servait de témoin. Une concentration de 1,0 mg/mL de NaN3 futajoutée à deux aliquotes, 1 ,0 mg/mL de HgCh à deux autres et 1 ,0 J.Lmole/mL de saccharolactone fut ajouté à la dernière aliquote. Le blanc fut immédiatement congelé à -20
![Figure 2: ~ stéroïdogénèse [Castagnetta et al., 1990: p. 2].](https://thumb-eu.123doks.com/thumbv2/123doknet/5513172.131549/14.922.32.891.45.1097/figure-stéroïdogénèse-castagnetta-et-al-p.webp)
![Figure 3: Métabolisme des androgènes [Goodman & Gilman's, 1990].](https://thumb-eu.123doks.com/thumbv2/123doknet/5513172.131549/15.920.72.891.47.1001/figure-métabolisme-des-androgènes-goodman-amp-gilman-s.webp)




![Figure 6: Biotransformation de la progestérone 18 par Pseudomonas spp. [Dhar et al., 1993]](https://thumb-eu.123doks.com/thumbv2/123doknet/5513172.131549/21.920.85.877.29.1035/figure-biotransformation-la-progestérone-par-pseudomonas-spp-dhar.webp)
![Figure 8 : Description et identification des principaleS caractéristiques des · HSDH [Penning et al., 1997]](https://thumb-eu.123doks.com/thumbv2/123doknet/5513172.131549/22.927.89.867.49.1026/figure-description-identification-des-principales-caractéristiques-hsdh-penning.webp)
![Figure 9: Réactions enzymatiques catal~sées par les·isoformes de la 315-HSDH [Payne et al., 1997]](https://thumb-eu.123doks.com/thumbv2/123doknet/5513172.131549/23.927.81.869.58.1032/figure-réactions-enzymatiques-catal-sées-isoformes-hsdh-payne.webp)