MARIE-CHRISTINE ROY
REGULATION DE LA SECRETION DE LA MMP-9
CHEZ L'ÉOSINOPHILE HUMAIN
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en médecine expérimentale
pour l'obtention du grade de maître es sciences (M.Sc.)
DEPARTEMENT DE MEDECINE FACULTÉ DE MÉDECINE UNIVERSITÉ LAVAL QUÉBEC 2010 © Marie-Christine Roy, 2010
Résumé
L'infiltration d'éosinophiles dans la muqueuse bronchique est caractéristique dans l'asthme. Pour passer du sang vers la muqueuse bronchique, l'éosinophile doit sécréter des proteases qui digéreront les protéines de la matrice extracellulaire ainsi que la membrane basale des vaisseaux sanguins. L'acide 5-oxo-6,8,ll,14-éicosatétraénoïque, un lipide bioactif, provoque une transmigration des éosinophiles en activant la sécrétion de plusieurs proteases dont la matrix metalloproteinase (MMP)-9 ainsi que l'urokinase et la plasmine, deux proteases du système plasminogène/plasmine. Il active la sécrétion de la MMP-9 via la voie signalétique extracellular signal-regulated kinase (ERK)-1/2. De plus, il est décrit que l'effet de ERK-1/2 sur la migration diminue en absence du système plasminogène/plasmine. Cette étude porte sur les interactions entre les différentes proteases impliquées lors de la migration du 5-oxo-ETE, plus précisément, la capacité de l'urokinase plasminogen activator (uPA) et de la plasmine à augmenter la sécrétion de MMP-9. Elle traite également de l'implication de la voie signalétique des ERK-1/2 dans la sécrétion de la MMP-9. Elle confirme que l'uPA et de la plasmine peuvent induire la sécrétion de la MMP-9. Elle valide également l'implication de la voie signalétique des ERK-1/2 lors de ce phénomène.
Avant-Propos
Ce mémoire représente l'accomplissement de deux années de travail. Durant ces années de maîtrise, j'ai eu la chance de côtoyer des gens extraordinaires qui m'ont aidé et conseillé dans la réalisation de mon projet. Leurs participations et leurs encouragements méritent d'être soulignés.
Tout d'abord, j'aimerais remercier mon directeur, Dr Michel Lavoilette, de m'avoir permis de joindre son équipe pour faire ma maîtrise. Merci de m'avoir fait confiance et d'avoir cru en ce projet. J'aimerais également remercier chacun des membres de l'équipe Laviolette non seulement pour les petits plus qu'ils ont apportés à mon projet, mais également pour avoir créé au cours des journées passées ensemble, une multitude de moments inoubliables. Un merci spécial aux étudiants, Anick, Véronique, François et Isabelle pour toutes les discussions qui m'ont permis d'avancer autant sur le plan de mes études que sur le plan personnel. Sans vous, je ne serais pas la personne que je suis aujourd'hui. Je m'ennuie déjà de vous retrouver le matin. Merci à Claudine pour chaque fois que je t'ai fait courir. Tes cheveux et ton rire vont me manquer! Merci à Nancy pour ton calme et positivisme contagieux qui m'ont souvent été d'un grand secours.
Finalement, j'aimerais remercier tous mes proches pour leur support et leurs encouragements. Merci à ma famille : au cours des années, nous avons bâti ensemble ce que je suis. Vous êtes donc responsables, en grande partie, de ma réussite. Merci à mon copain, Steph, pour ta patience et ton réconfort lors des moments plus difficiles. Merci d'être là à chaque jour pour enrichir mon quotidien, je t'aime! Merci, merci mille fois...
Merci à ceux qui ont cru et qui croient toujours en moi...
Table des matières
Résumé i Avant-Propos ii Table des matières iv Liste des figures vi Liste des abréviations vii Chapitre I : Introduction 1 1.1 L'asthme 1 1.2 Le remodelage bronchique 2 1.3 L'inflammation 5 1.3.1 Lemastocyte 8 1.3.2 Le macrophage alvéolaire 8 1.3.3 Le lymphocyte 9 1.3.4 Le neutrophile 10 1.3.5 L'éosinophile 11 1.4 Le recrutement de l'éosinophile 12 1.4.1 Le5-oxo-ETE 14 1.4.1.1 La signalisation induite parle 5-oxo-ETE 15
1.5 Les proteases impliquées dans la migration de l'éosinophile induite par le
5-oxo-ETE 15 1.5.1 La matrix metalloproteinase (MMP)-9 16
1.5.2 Le système plasminogène/plasmine 19
1.5.2.1 La plasmine 19 1.5.2.2 L'uPA et l'uPAR 20
1.5.2.3 Les interactions entre le système plasminogène/plasmine et la MMP-9 21
Chapitre II : Hypothèses et objectifs de recherche 23
Chapitre III : Matériel et méthodes 25
3.1 Sélection des sujets 25
3.2 Produits 25 3.3 Isolement des éosinophiles sanguins 26
3.4 Analyse de la sécrétion de la MMP-9 par les éosinophiles 26
3.4.1 Stimulation des éosinophiles 26 3.4.2 Récupération des surnageants 27
3.4.3 Immunobuvardages 27 3.5 Analyse de la phosphorylation des ERK-1/2 28
3.5.1 Stimulation des éosinophiles 28 3.5.2 Fractionnement de l'éosinophile 28
3.5.3 Immunobuvardages 29 3.6 Analyse statistique 29 Chapitre IV : Résultats 30
4.1 La sécrétion de la MMP-9 induite par l'uPA et la plasmine 30 4.2 L'influence des ERK-1/2 sur la sécrétion de la MMP-9 32 4.3 La modulation de la sécrétion de la MMP-9 par 1TL-5 34
4.4 L'inhibiteur de MEK-1 et 1TL-5 36 4.5 Cinétique de la sécrétion de la MMP-9 38
4.6 La sécrétion de la MMP-9 induite par l'uPA et la plasmine : méthode B sur 15
heures 40 4.7 Cinétique de la sécrétion de la MMP-9 induite par l'uPA et la plasmine: méthode B
sur 18 heures 42 4.8 Cinétique de l'activation des ERK-1/2 44
Chapitre V : Discussion 45
Conclusion 51 Bibliographie 52
Liste des figures
Figure 1. Schéma représentant les interactions des lésions épithéliales et de la réparation
aberrante avec les composantes inflammatoires dans l'asthme chronique 3 Figure 2. Caractéristiques histopathologiques du remodelage bronchique dans l'asthme 5
Figure 3. L'inflammation bronchique dans l'asthme 7
Figure 4. Le recrutement de l'éosinophile 13 Figure 5. Structure schématique des MMPs 18 Figure 7. Représentation schématique de la structure de l'uPA et l'uPAR 20
Figure 8. Sécrétion de MMP-9 induite par l'uPA et la plasmine 31 Figure 9. L'influence des ERK-1/2 sur la sécrétion de la MMP-9 induite par l'uPA et la
plasmine 33 Figure 10. L'influence de l'IL-5 sur la modulation de la sécrétion de la MMP-9 35
Figure 11. L'effet du PD 98059 sur la sécrétion de la MMP-9 au niveau de base 37
Figure 12. Cinétique de la sécrétion de MMP-9 39 Figure 13. Sécrétion de MMP-9 induite par l'uPA et la plasmine 41
Figure 14. Cinétique de la sécrétion de MMP-9 43 Figure 15. Activation des ERK-1/2 par l'uPA et la plasmine 44
Liste des abréviations
ATF amino terminal fragment ECP eosinophil cationic protein EDN eosinophil-derived neurotixin EPO eosinophil peroxydase
ERK extracellular kinase
GM-CSF granulocyte-macrophage colony-stimulating factor GPCR récepteur couple à une protéine G
GPI glycophosphatidylinositol 5-HEDH 5-hydroxy eicosanoid dehydrogenase 5-HETE 5-hydroxyeicosatetraenoic acid ICAM intercellular adhesion molecule IFN interferon
Ig immunoglobuline IL interleukine KD kringle domain
LMW low molecular weight LT leucotriène
MAPK mitogen-activated protein kinase MB membrane basale
MBP major basic protein
MCP monocyte chemoattractant protein MEC matrice extracellulaire
MMP matrix metalloproteinase
5-oxo-ETE acide 5-oxo-6,8,11,14-éicosatétraénoïque PAF platelet activating factor
PAI plasminogen activator inhibitor PG prostaglandine PI3K phosphoinositide 3-kinases
V l l l PKC protéine kinase C
PSGL P-Selectin glycoprotein ligand
RANTES regulated on activation normal T cell expressed and secreted TGF transforming growth factor
Th T helper
TIMP tissue inhibitor of metalloproteinase TNF tumor necrosis factor
TX thromboxane
uPA urokinase plasminogen activator
uPAR urokinase plasminogen activator receptor VCAM vascular cell adhesion molecule
Chapitre I : Introduction
1.1 L'asthme
L'asthme est une maladie inflammatoire chronique des voies respiratoires qui apparaît généralement au cours de l'enfance, mais qui peut également apparaître à n'importe quel moment au cours de la vie [1]. Elle se manifeste par des épisodes intermittents d'obstruction bronchique réversible et d'hyperréactivité des bronches. Les différents symptômes connus de l'asthme sont la dyspnée, la toux, l'oppression thoracique et la respiration sifflante. L'asthme cause une inflammation de la paroi bronchique, caractérisée, entre autres, par une infiltration de leucocytes comme les mastocytes, les éosinophiles et les lymphocytes T et un œdème [2]. Cette inflammation provoque un remodelage bronchique, qui constitue un changement dans la structure de la bronche. Les cellules structurales, comme les cellules épithéliales, les fibroblastes et les cellules musculaires lisses, modifient leur phénotype. Ces changements cellulaires modifient le fonctionnement de la bronche et causent notamment une hyperplasie et une hypertrophie du muscle lisse et une hypersécrétion de mucus. Jumelé à l'inflammation, ce remodelage causerait l'hyperréactivité bronchique et éventuellement la chronicité de l'asthme.
L'asthme est une maladie multifactorielle; c'est-à-dire qu'un seul facteur n'est pas suffisant pour déclencher la maladie. Elle est le résultat de prédispositions génétiques tel l'atopie et de facteurs environnementaux tels l'exposition aux allergènes, polluants et infections respiratoires [3]. En dépit du fait que l'étiologie de l'asthme demeure méconnue, on en connaît bien l'incidence. En 2003, plus de 2 millions de Canadiens étaient diagnostiqués asthmatiques [4], tandis que chez nos voisins du sud, c'est 30,2 million d'Américains qui, en 2004 avaient reçu durant leur vie le même diagnostic. Ainsi, aux États-Unis, l'asthme à lui seul représente des dépenses d'environ 16.1 milliards de dollars chaque année, ce qui constitue une charge énorme pour le système de santé [5]. Le contrôle des symptômes de l'asthme reste donc un des meilleurs moyens d'éviter des coûts exorbitants d'hospitalisation.
Plusieurs traitements sont présentement disponibles pour permettre d'atteindre cet objectif. Les bronchodilatateurs, ou pVadrénergiques, relaxent le muscle lisse pour en diminuer la contraction. Les corticostéroïdes, eux, ont un effet anti-inflammatoire, en agissant sur le niveau d'activation de plusieurs gènes impliqués dans l'inflammation [6]. Des anti-leucotriènes (LT) sont aussi disponibles, mais ils sont reconnus comme étant efficaces que chez certains asthmatiques, la raison n'étant pas connue [7]. Plusieurs autres traitements sont également à l'étude : les anticorps ciblant des cytokines, les antagonistes de récepteurs de chimiokine et les inhibiteurs de phosphodiesterase en sont quelques exemples [8]. Une nouvelle intervention, la thermobronchoplastie est une technique présentement en investigation qui vise à éliminer une partie du muscle lisse, retrouvé en plus grande quantité chez les asthmatiques, pour diminuer la bronchoconstriction [9].
1.2 Le remodelage bronchique
Tout d'abord, l'inflammation soutenue durant une longue période de temps est souvent citée comme la cause du remodelage [10]. Par contre, il a été démontré que chez certains patients, le remodelage peut survenir jusqu'à quatre ans avant l'apparition des symptômes, suggérant que cet élément survient tôt dans le développement de l'asthme [11]. De nouvelles théories ont donc émergé, dans lesquelles l'inflammation a toujours un rôle à jouer dans le remodelage, sans pour autant en être l'acteur principal, ou l'élément déclencheur. Parmi celles-ci, la théorie de l'unité trophique épithéliale-mésenchymale propose qu'il existe une communication entre l'épithélium et les cellules du mesenchyme. Cette communication peut être observée lors de la morphogénèse des poumons chez le fœtus. Puisqu'il existe des similitudes entre les processus du remodelage bronchique et celui de la morphogénèse des poumons [12], il est suggéré qu'une réactivation de cette communication survienne dans l'asthme, suite à l'endommagement epithelial caractérisant cette maladie [13]. Cette réactivation, accompagnée d'une incapacité du tissu à résoudre l'inflammation, ainsi que les changements structuraux liés à la réparation tissulaire, causée par des lésions chroniques de l'épithélium, mèneraient au remodelage.
Environmental Trioqers
Intact
Epithelium Epithelium Intact
AIRWAY
HYPERRESPONSIVENESS AIRWAY NARROWHG
ASTHMA SYMPTOMS
AIRWAY REMOOEUNG
Figure 1. Schéma représentant les interactions des lésions épithéliales et de la réparation aberrante avec les composantes inflammatoires dans l'asthme chronique
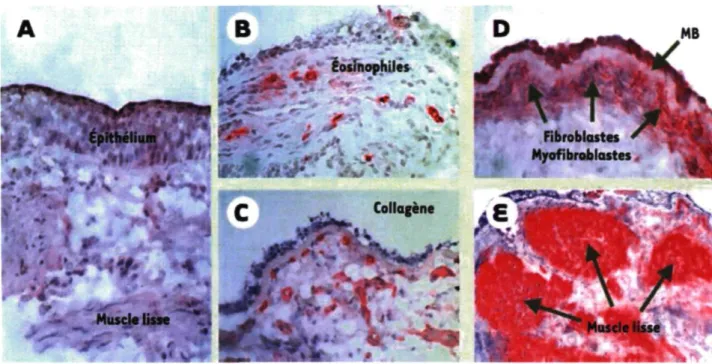
Bien que les causes en soient toujours incertaines, le remodelage est bien caractérisé. Sur une coupe provenant d'une biopsie bronchique d'un sujet non asthmatique (Figure 2A), l'épithélium est intact et la muqueuse bronchique ne présente pas d'infiltration de leucocytes, ni de fibrose sous-épithéliale et la masse musculaire est limitée. Par contre, sur des coupes de biopsies bronchiques de patients asthmatiques, on observe un epithelium desquamé et désorganisé (B, C et D). Pour tenter de se réparer, l'épithélium sécrète différents facteurs de croissance dont les epidermal growth factor, fibroblast growth factor et transforming growth factor-beta (TGF)-|3, ainsi que plusieurs cytokines et chimiokines [14]. Ces médiateurs, qui peuvent également être produits par d'autres types cellulaires, jouent un rôle tant dans l'inflammation que dans le remodelage. Le TGF-0, par exemple, peut participer au remodelage en agissant sur plusieurs cellules structurales. D peut avoir une influence sur le muscle lisse en contribuant à l'hyperplasie et l'hypertrophie des cellules musculaires lisses observées chez les asthmatiques (E) [15,16,17]. Chez le fibroblaste, il favorise la prolifération, la différenciation en myofïbroblastes ainsi que la sécrétion d'éléments de la matrice extracellulaire comme le collagène (C et D). L'épaississement de la membrane basale (MB) et la fibrose sous-épithéliale, qui consiste en un dépôt exagéré de laminine, de ténascine, de collagène, de fibronectine et de proteoglycan, sont retrouvés dans les bronches d'asthmatiques (C et D). Ces deux phénomènes du remodelage sont en partie causées par l'augmentation de myofïbroblastes, qui sont d'excellents producteurs de collagène I et III [18,19,20,21]. L'hyperplasie et hypertrophie des cellules caliciformes, ayant pour conséquence l'hypersécrétion de mucus, ainsi que l'augmentation de la vascularisation, font aussi partie des caractéristiques du remodelage [22].
Figure 2. Caractéristiques histopathologiques du remodelage bronchique dans l'asthme. Des immunomarquages ont été effectués sur des cryosections fixées en acétone en utilisant des anticorps reconnaissant spécifiquement les éosinophiles (B), les fibroblastes et les myofïbroblastes (D), le collagène de type IV (C) et les cellules musculaires lisses (E), suivis d'une révélation à la phosphatase alcaline [Benayoun L, Pretolani M. Le remodelage bronchique dans l'asthme : mécanismes et enjeux thérapeutiques. Médecine science, 2003.19:319-26.].
Chacune des cellules structurales touchées par le remodelage est activée par différents médiateurs dont des facteurs de croissance, des médiateurs lipidiques, des chimiokines ainsi que des cytokines de type Th2. En réponse aux différents stimuli qu'elles reçoivent, elles sécrètent à leur tour ces médiateurs et amplifient le remodelage et l'inflammation.
1.3 L'inflammation
L'inflammation dans l'asthme atopique est une composante importante. C'est un phénomène complexe dans lequel plusieurs types de cellules inflammatoires comme le lymphocyte, l'éosinophile, le mastocyte et le macrophage, mais aussi plusieurs médiateurs
pro-inflammatoires ont un rôle à jouer. On y retrouve trois étapes majeures, soit la sensibilisation, la réponse immédiate et la réponse tardive.
La sensibilisation est la première étape. Pour que celle-ci ait lieu, un allergène doit d'abord pénétrer dans la bronche. Celui-ci doit ensuite être capté par une cellule présentatrice d'antigène, telle la cellule dendritique. Cette dernière transformera l'allergène en différents epitopes et migrer vers les nœuds lymphatiques où elle les présentera aux lymphocytes T naïfs. C'est lors de ce contact que la cellule T se différencie en un type T helper (Th) 1 ou Th2. À ce moment, plusieurs facteurs comme les molécules de co-stimulation et les cytokines exprimées par la cellule dendritique sont importants puisqu'ils influenceront cette transformation de la cellule T. D'ailleurs, il semble que l'absence de l'interleukine (EL)-12 ait un rôle à jouer dans la différenciation Th2 lors du contact cellule dendritique-lymphocyte T [23]. Le lymphocyte Th2 différencié activera ensuite le lymphocyte B, entre autres par la sécrétion d'IL-4 et d'IL-13 et celui-ci produira en retour des immunoglobulines (lg) E spécifiques à l'antigène. Ces IgE se retrouveront dans la circulation sanguine et seront captés par les récepteurs FceR I et II des mastocytes et des macrophages respectivement [2]. C'est à la suite de ce processus complexe que les cellules inflammatoires sont sensibilisées.
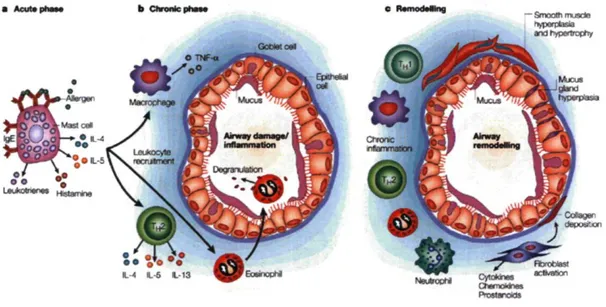
Ainsi, lorsque l'allergène entrera de nouveau dans la bronche, il se produira une réaction immédiate, puisque les cellules immunitaires de la bronche sont maintenant aptes à le reconnaître, grâce aux IgE présents à leur surface. Les mastocytes libéreront leur histamine et, conjointement aux macrophages alvéolaires, ils produiront des médiateurs lipidiques tels les Lts, les prostaglandins (PG) et le thromboxane (TX)A2 ainsi que différentes cytokines Th2 comme l'IL-3, 4, 5, 6 et le granulocyte-macrophage colony-stimulating factor (GM-CSF) (figure 3, a). À la suite de la sécrétion de ces médiateurs apparaîtront des symptômes tels la contraction du muscle lisse et l'œdème. La réaction immédiate prend généralement fin en l'espace d'une heure.
Pour ce qui est de la réaction tardive, elle survient entre trois à huit heures après le contact avec l'allergène. C'est à ce moment que le lymphocyte T et l'éosinophile font leur apparition dans la bronche. Sous l'action de différentes chimiokines (regulated upon activation, normal T-cell expressed, and secreted (RANTES), éotaxines, macrophage chemotactic protein (MCP)) et cytokines (IL- 4, 5, 13, GM-CSF et tumor necrosis factor (TNF)-a), sécrétées autant par les cellules structurales que par les cellules inflammatoires résidentes, les cellules endothéliales, les lymphocytes T et les éosinophiles vont s'activer et exprimer des molécules d'adhésion telles les vascular cell adhesion molecule-1 (VCAM-1), Vintracellular adhesion molecule-1 (ICAM-1), le very late antigen-4 (VLA-4), le CD1 lb et le CD 18 nécessaires à la migration de ces leucocytes. Ils se rendront dans la muqueuse bronchique où ils amplifieront la réponse inflammatoire tardive (figure 3, b) [24].
b Chronic phas.
QOtM ttt
Bpaheka
L-4 L-6 1-13
Nature Reviews | Immunology
Figure 3. L'inflammation bronchique dans l'asthme. [Gern JE, Busse WW. Relationship of viral infections to wheezing illnesses and asthma. Nature Reviews Immunology 2, 2002 132-138].
Les cellules inflammatoires remplissent donc des fonctions prépondérantes dans la physiopathologie de l'asthme. En contribuant à l'inflammation bronchique, elles participent, à différents degrés, au remodelage et à l'établissement des symptômes d'asthme et de Fhyperréactivité bronchique.
1.3.1 Lemastocyte
Le mastocyte est une cellule résidente de la bronche, comme elle l'est pour les autres tissus. Il est reconnu pour contribuer à la réparation tissulaire ainsi qu'à la défense de l'hôte [25]. Dans l'asthme, le mastocyte participe notamment à la réponse immédiate, grâce à ses récepteurs FcsR I, comme expliqué plus haut. Lors de cette réponse, il synthétise différents médiateurs lipidiques (PGD2 et LTC4) et dégranule des médiateurs préformés dont l'histamine, l'héparine, la tryptase et la chymase. Divers effets leurs sont attribués dont la bronchoconstriction, l'œdème, la sécrétion de mucus ainsi que l'activation et la prolifération des fibroblastes [26].
Également, le mastocyte pourrait intervenir dans la réponse tardive puisqu'il peut sécréter des chimiokines (IL-8 et 16, MCP-1) et des cytokines (IL-4, 5, 6, 13, interferon (jNF)-y, GM-CSF et TNF-a). En effet, plusieurs d'entre elles induisent l'activation et promouvoient la survie et la migration des lymphocytes et des éosinophiles, en plus d'augmenter l'expression de certaines molécules d'adhésion comme VCAM-1 et ICAM-1 par les cellules endothéliales [27].
1.3.2 Le macrophage alvéolaire
Le macrophage alvéolaire est la cellule prédominante retrouvée dans la bronche. Son rôle habituel est de diriger et de maintenir une inflammation minimale tout en éliminant les microorganismes qui essaient de pénétrer dans la bronche [28]. En ce qui a trait à l'asthme, le macrophage alvéolaire occupe une position plutôt ambiguë. E sécrète
différents médiateurs comme le platelet-activating factor (PAF), le LTB4, la PGF2 et le
TXA2, qui, en synergie avec les médiateurs du mastocyte, contribuent à l'amplification de la réponse immédiate. Ils participent tout autant à la réponse tardive en produisant des cytokines comme le GM-CSF, le TNF-a et l'IL-6 [2,29]. Cependant, il a été démontré qu'en retirant le macrophage alvéolaire de rats sensibilisés à l'ovalbumine, on obtient une hyperréactivité bronchique augmentée lors d'une provocation allergénique [30]. Cette étude confère au macrophage alvéolaire une fonction protectrice dans l'inflammation asthmatique. Le fait que le macrophage soit capable de produire des cytokines Thl, comme l'INF-y [31], est probablement essentiel à ce phénomène.
1.3.3 Le lymphocyte
Les lymphocytes T et les B interviennent dans l'inflammation asthmatique. Tout d'abord, les cellules B y participent en produisant des IgE spécifiques aux antigènes captés par les cellules présentatrices d'antigène. Une fois libérés, ces anticorps se fixent aux récepteurs Fcs de plusieurs autres cellules inflammatoires et induisent ainsi la réponse immédiate. Par contre, les cellules T interviennent autant dans la sensibilisation que dans les réponses immédiate et tardive. Elles dirigent la réponse immédiate en initiant la production d'IgE par l'activation des lymphocytes B. Elles dirigent aussi la réponse tardive en induisant l'activation d'autres cellules inflammatoires, dont l'éosinophile via des cytokines comme l'IL-5 et le GM-CSF. Les lymphocytes T CD4 + se présentent en deux sous-types majeurs, Thl et Th2. Les Th2 sont ceux qui dirigent l'inflammation allergique en produisant bon nombre de cytokines comme les IL-4, 5, 6, 9 et 13, et le GM-CSF [32]. De plus, en initiant la production d'IgE par l'activation des lymphocytes B, les Th2 supportent la réponse immédiate. Pour ce qui est de la réponse tardive, les Th2 y activent l'éosinophile via des cytokines (IL-5, GM-CSF). Les cytokines Th2 sont retrouvées en grande quantité au niveau de base dans les voies respiratoires de sujets asthmatiques [33,34], suggérant une implication importante de ces cellules. Des cytokines Thl comme l'INF-Y sont aussi retrouvées chez les patients asthmatiques, mais la question de savoir si les Thl ont un rôle dans l'augmentation ou plutôt dans la régulation de l'inflammation demeure sans réponse, puisqu'aucun consensus n'a été émis à ce sujet [35,36]. Dans
10 l'asthme, un débalancement entre ces deux groupes est observé, une majorité appartenant aux Th2 [37]. Ce débalancement pourrait d'ailleurs être l'une des causes des maladies atopiques et participer à leur développement.
Cependant, d'autres sous-types de lymphocyte T CD4 + sont également caractérisés : les Thl7 et les T régulateurs. Comparativement au Thl et Th2, les Thl7 ont été beaucoup moins étudiés jusqu'à maintenant. Toutefois, quelques études ont démontré que l'ARN messager de l'IL-17, la cytokine la plus produite par les Thl7, est exprimé et que la protéine est augmenté chez les asthmatiques [38,39]. En ce qui a trait aux T régulateurs, ils sont connus pour contrôler l'inflammation en sécrétant, entre autres, le l'IL-10. D a été démontré que, chez les asthmatiques atopiques, le nombre des cellules T productrices d'IL-10 est diminuée en comparaison aux contrôles sains [40]. Ceci signifierait qu'il y a une baisse de l'activité des T régulateurs, donc un moins bon contrôle de l'inflammation. Ces sous-types sont probablement impliqués dans l'asthme, mais d'autres études seront nécessaires pour confirmer leurs véritables actions.
1.3.4 Le neutrophile
Le neutrophile est le granulocyte sanguin retrouvé en plus grand nombre chez l'homme. D est le premier à migrer aux différents sites inflammatoires pour protéger l'hôte contre d'éventuelles infections. Une fois sur place, il relâche plusieurs médiateurs, comme les défensines et le LTB4, qui vont aider l'hôte à se débarrasser de l'infection. Par contre, la
participation du neutrophile dans l'asthme n'est pas parfaitement claire. Il a la capacité de sécréter d'autres médiateurs inflammatoires comme le PAF, les PGs, et le TXA2, qui pourraient être impliqués dans le processus asthmatique [2,41]. Le neutrophile est retrouvé en grande quantité dans les expectorations induites de certains patients souffrant d'asthme sévère. À l'opposé, il est peu retrouvé dans les cas asthmes légers ou modérés [42]. D semble donc être associé à l'asthme sévère.
11 Les patients souffrant d'asthme sévère prennent habituellement des corticostéroïdes de façon régulière pour traiter leurs symptômes. Fait intéressant, les corticostéroïdes sont connus pour inhiber l'apoptose chez le neutrophile. Par conséquent, ils en prolongent la survie [43]. Il est donc difficile de dire si, dans l'asthme sévère, la présence du neutrophile est belle et bien une manifestation de la maladie ou un effet du traitement.
1.3.5 L'éosinophile
L'éosinophile, comme le neutrophile, est un granulocyte. Ses granules sont riches en protéines cationiques telles la majeur basic protein (MBP), 1*eosinophil cationic protein (ECP), Yeosinophil-derived neurotixin (EDN) et Veosinophil peroxydase (EPO) [44]. Ce cocktail de protéines est fortement cytotoxique, particulièrement contre les parasites. Grâce à cette fonction, l'éosinophile a été associé à la défense de l'hôte, notamment lors d'infection parasitaire.
Le rôle de l'éosinophile dans la physiopathologie de l'asthme est reconnu depuis maintenant plusieurs années. On retrouve une hyperéosinophilie dans la circulation de patients asthmatiques, soit 10 à 15 % des granulocytes circulants, comparativement aux non-asthmatiques chez qui on retrouve seulement de 2 à 5 %. De plus, il a été démontré que l'éosinophilie est reliée à la sévérité de l'asthme, et que chez les asthmatiques, les éosinophiles ont des granules hypodenses, signe que les cellules sont activées [45,46,47]. L'éosinophile sera recruté dans la bronche et une fois sur place, il pourra dégranuler. Les quatre protéines cytotoxiques, mentionnées précédemment, seront libérées dans la muqueuse bronchique. Elles participeront à l'inflammation et au remodelage en contribuant à la desquamation de l'épithélium, puisqu'elles sont aussi toxiques pour les cellules épithéliales. De surcroît, l'éosinophile peut produire une panoplie de médiateurs comme du LTC4, du PAF, ainsi que des cytokines dont les IL-4, 5 et 13 et le TGF-p [48,49].
L'éosinophile sera donc impliqué dans la bronchoconstriction (LTC4), l'inflammation
12
1.4 Le recrutement de l'éosinophile
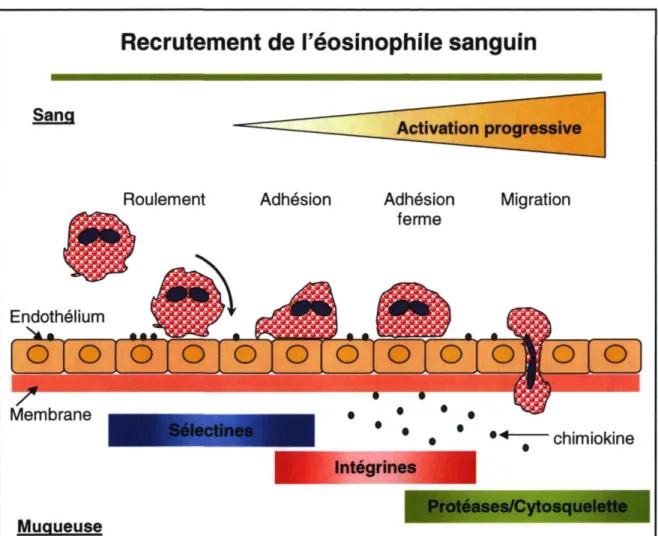
Pour intervenir dans l'inflammation asthmatique, l'éosinophile doit passer du sang vers la muqueuse bronchique. Il doit tout d'abord être activé par l'IL-5 et le GM-CSF, des cytokines Th2 libérées, entre autres, par le lymphocyte T. L'éosinopoïèse est enclenchée par l'EL-5 et le GM-CSF. Ces deux cytokines sont donc essentielles dans la maturation et l'activation de l'éosinophile [50,51]. L'éosinophile a également besoin d'être activé par des chimiokines, tel le RANTES et les éotaxines, qui sont principalement produites par les cellules épithéliales et endothéliales. Ensuite, l'éosinophile exprimera à sa surface des molécules d'adhésion comme VLA-4 et P-Selectin glycoprotein ligand (PSGL)-l. Au même moment, le lymphocyte va libérer de l'IL-4 et de l'IL-13 qui vont activer les cellules endothéliales qui vont, elles aussi, exprimer des molécules d'adhésion tels la P-sélectine et le VCAM-1. Les interactions de ces molécules (PSGL-1/P-sélectine et VLA-4/VCAM-1) vont permettre le roulement de l'éosinophile sur la paroi du vaisseau sanguin [52]. Cette étape garde l'éosinophile associé à l'endothélium, ce qui le rend beaucoup plus susceptible d'entrer en contact avec une concentration plus élevé de médiateurs attachés aux cellules endothéliales (effet juxtacrine). La cellule poursuivra ainsi son activation, ce qui permettra une adhésion plus ferme impliquant de nouvelles molécules : l'intégrine CDllb/CD18 de l'éosinophile et ICAM-1 des cellules endothéliales. Le VLA-4 et le VCAM-1 sont également impliqués dans l'adhésion ferme [52]. Une fois arrêté, l'éosinophile commence alors à se déformer en réarrangeant son cytosquelette. fl débute alors la sécrétion de proteases pour migrer à travers la couche de cellules endothéliales, la MB du vaisseau sanguin et la matrice extracellulaire (MEC) (figure 4).
Dans le processus de recrutement, les chimiokines sont particulièrement importantes. Elles participent à l'activation de l'éosinophile et dirigent sa migration. L'éosinophile exprime de façon constitutive le CCR3 et le CCR1, qui sont des récepteurs de chimiokines. En conséquence, il répond à toutes les chimiokines qui lient ces récepteurs, comme les RANTES, les éotaxines 1, 2, et 3, ainsi que les MCP-2, 3, et 4 [48]. Aussi, certains médiateurs lipidiques comme l'acide 5-oxo-6,8,ll,14-éicosatétraénoïque
(5-oxo-13 ETE), les leucotriènes et le PAF peuvent être impliqués dans le recrutement de l'éosinophile [53,54]. Bien que toutes ces molécules peuvent agir sur l'éosinophile, certaines d'entre elles sont plus aptes à induire son recrutement. Le 5-oxo-ETE fait partie de celles qui sont les plus efficaces en induisant une migration de 88% des cellules, in vitro [53].
Sang
Recrutement de l'éosinophile sanguin
Activation progressive
Roulement Adhésion Adhésion Migration
ferme
* & $
Endothelium
Muqueuse
14
1.4.1 Le 5-oxo-ETE
Le 5-oxo-ETE est un médiateur lipidique formé à partir de l'acide arachidonique (AA). Pour être transformé en oxo-ETE, l'AA sera d'abord pris en charge par la 5-lipoxygénase, qui ajoutera une molécule d'oxygène en position 5 pour obtenir de l'acide 5S-hydroperoxy-6,8,ll,14-éicosatétraénoïque. Puis, ce dernier sera transformé par une peroxydase en acide 5S-hydroxy-6,8,ll,14-éicosatétraénoïque (5-HETE), le substrat préférentiel de la 5-hydroxyeicosanoid dehydrogenase (5-HEDH). Cette enzyme, dépendante du NADP+, convertira le 5-HETE en 5-oxo-ETE. Les leucocytes ainsi que les
plaquettes en sont les principaux producteurs, puisqu'ils expriment la 5-HEDH. Comme la production de 5-oxo-ETE est dépendante du NADP+, c'est surtout dans des conditions
oxydantes, comme le stress oxydatif, que sa production est stimulée [55].
L'effet biologique principal du 5-oxo-ETE est le chimiotactisme. Il induit la migration des leucocytes et l'éosinophile est celui qui y répond le mieux. In vivo, le 5-oxo-ETE provoque une eosinophilic, suggérant son implication dans les maladies atopiques
[56]. In vitro, il induit une forte migration de l'éosinophile à travers une matrice de Matrigel MD[53]. De plus, d'autres effets biologiques, associés à la migration, lui sont
rattachés ; chez l'éosinophile, il induit une mobilisation de calcium, la polymérisation de l'actine, l'expression d'intégrines et la sécrétion de proteases [53,57,58,59]. De plus, dans un contexte inflammatoire comme l'asthme, plusieurs médiateurs sont présents de façon concomitante et agissent en synergie. Par exemple, le 5-oxo-ETE en combinaison avec le PAF déclenche une forte dégranulation de l'éosinophile, alors que séparément, ces médiateurs ne produisent pas cet effet [60]. Le 5-oxo-ETE pourrait donc être un facteur important dans la migration de ce leucocyte dans l'asthme.
15 1.4.1.1 La signalisation induite par le 5-oxo-ETE
Très peu de travaux décrivent la signalisation induite par le 5-oxo-ETE. Dans ces études, il est démontré que les voies signalétiques de la p38 mitogen-activated protein kinase (MAPK), des extracellular signal-regulated kinase (ERK)-1/2 et de la phosphoinositide 3-kinase (PI3K) sont activées par le 5-oxo-ETE et qu'elles sont principalement impliquées dans le chimiotactisme et la mobilisation de calcium [61,62,63]. Une étude publiée en 2008, décrit les principales voies signalétiques impliquées dans la migration et dans la sécrétion de la MMP-9 induites par le 5-oxo-ETE [64]. Cette étude a été effectuée chez l'éosinophile dans un modèle de migration in vitro, dans lequel l'éosinophile, attiré par le 5-oxo-ETE, doit passer à travers une matrice de Matrigel MD. Ces
travaux révèlent qu'en présence d'inhibteurs de la protein kinase C (PKC)-Ô, de la PKC-Ç, de la p38 MAPK et des ERK-1/2, la migration induite par le 5-oxo-ETE est diminuée. Ces voies signalétiques semblent donc être toutes impliquées dans ce phénomène. Par contre, seulement deux d'entre elles, soit la PKC-Ô et les ERK-1/2, sont impliquées dans la sécrétion de la MMP-9 [64].
1.5 Les proteases impliquées dans la migration de l'éosinophile
induite par le 5-oxo-ETE
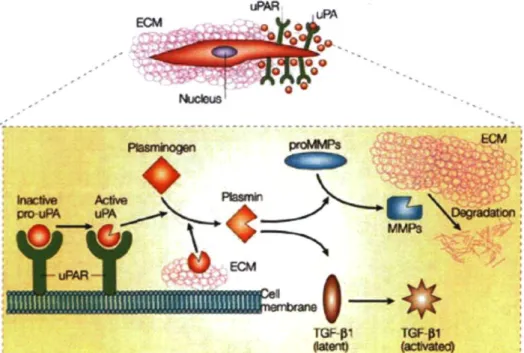
Pour migrer, l'éosinophile doit réarranger son cytosquelette et sécréter des proteases. Celles-ci lui permettent de digérer la MB, une couche dense de protéines située autour des vaisseaux sanguins, ainsi que la MEC, composée principalement de laminine, de collagène de type IV, de glycoprotéines et de proteoglycans. Sous l'effet du 5-oxo-ETE, deux proteases ont été décrites comme étant impliquées dans le phénomène de migration chez l'éosinophile : la matrix metalloproteinase (MMP)-9 et la plasmine [53]. Cette dernière est le membre actif du système plasminogène/plasmine et est générée par le clivage du plasminogène par l'urokinase plasminogène activator (uPA).
16
1.5.1 La matrix metalloproteinase (MMP)-9
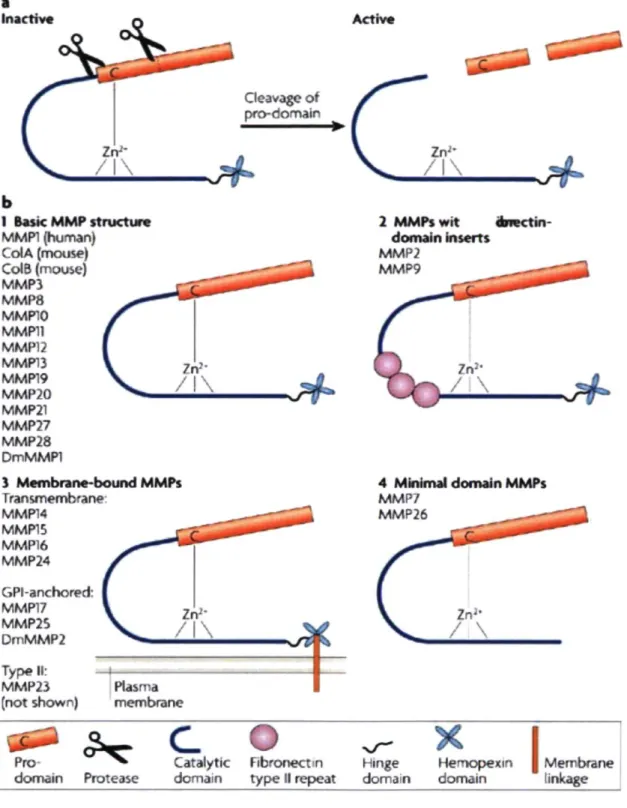
Les MMPs sont une famille d'enzymes protéolytiques dépendantes du zinc. Un ion de zinc est nécessaire à leur site catalytique pour qu'elles puissent être efficaces. La plupart d'entre elles sont sécrétées sous une forme pro-active. Le retrait du pro-domaine est impératif à leur activation, puisque sa présence rend le site catalytique inaccessible en formant un lien avec l'ion de zinc (figure 5a) [65]. La forme pro-MMP-9 a un poids moléculaire de 92 kDa et, une fois activé en MMP-9, elle a un poids de 82 kDa. Plusieurs enzymes, dont la cathepsine G et la trypsine, peuvent cliver le pro-domaine de la MMP-9. D'autres MMPs telles les MMP-2, MMP-3, MMP-7, MMP-10 et MMP-13 peuvent activer la MMP-9, la MMP-3 étant décrite comme la plus efficace. Une collaboration entre diverses enzymes peut également mener à l'activation de la MMP-9. La plasmine, par exemple, ne l'active pas directement. Par contre, elle active la MMP-3 qui active à son tour la MMP-9 [66]. L'activité de la MMP-9 est contrôlée par différents inhibiteurs. L'a2-macroglobuline, un inhibiteur de proteases universel, trappe la MMP-9 active et la retire de la circulation via des récepteurs scavenger. Les tissue inhibitors of matrix métalloprotéinases (TIMP)-l, 2, 3 et 4 ont tous une affinité pour la MMP-9, mais le TIMP-1 est le plus efficace. Une fois lié, le TIMP-1 inactive autant la pro-MMP-9 que la MMP-9 [67].
La MMP-9, appelée aussi gelatinase B, appartient plus particulièrement au groupe des gélatinases, nommées ainsi pour leur capacité à dégrader la gélatine. Elles ont également la possibilité de digérer la MB et plusieurs autres composantes de la MEC. Les gélatinases ont dans leur site catalytique trois domaines fibronectine répétés leur permettant de se lier entre autres à la laminine, l'élastine et aux collagènes, plus spécifiquement au collagène de type IV [68,69] (figure 4,b-2). La MMP-9 peut aussi activer différentes cytokines ou facteurs de croissance comme le TGF-P, le vascular endothelial growth factor et l'IL-8.
17 Généralement, la MMP-9 n'est pas produite par les cellules résidentes de la bronche. Toutefois, dans un contexte d'inflammation comme l'asthme, les cellules structurales comme les cellules épithéliales bronchiques et les fibroblastes peuvent produire de la MMP-9. La majorité des cellules inflammatoires impliquées dans l'asthme, telles les macrophages alvéolaires, les neutrophiles, les lymphocytes, les mastocytes et les éosinophiles, en produisent aussi. L'éosinophile est une des source majeure de MMP-9 [70]. Des médiateurs comme le complement component 5a (C)5a, le TNF-a, le PAF et le 5-oxo-ETE peuvent induire la production de la MMP-9 chez cette cellule [53,71,72,73]. Cette MMP semble être important dans l'asthme. En effet, elle a été détectée dans les expectorations induites, dans le lavage bronchoalvéolaire et dans le sang de sujets asthmatiques. Après une stimulation allergénique, la MMP-9 est également augmentée chez ce type de sujet. Un débalancement dans le ratio MMP-9/TIMP-1 est observé chez les asthmatiques, un ratio élevé correspondant à une exacerbation et un ratio faible à la phase chronique. De plus, le ratio MMP-9/TIMP-1 est corrélé à la réponse aux corticostéroïdes chez les patients asthmatiques; plus le ratio est élevé, plus le traitment est efficace. Un ratio faible, désignant, à l'inverse, une faible réponse à l'effet anti-inflammatoire des corticostéroïdes, pourrait donc indiquer une plus grande importance de la fibrose que de l'inflammation [74].
18 1 Bask MMP structure MMP1 (human) C olA (mouse) ColB (mouse) MMP3 MMP8 MMP10 MMPU MMP12 MMP13 MMP19 MMP20 MMP21 MMP27 MMP28 DmMMPl 3 Membrane-bound MMPs Transmembrane: MMP14 MMP15 MMP16 MMP24 GPI-anchored: MMP17 MMP2S DmMMP2 Type II: MMP23
(not shown) Plasma membrane
2 MMPs wit dncctin-domain inserts MMP2 MMP9 4 Minimal domain MMPs MMP7 MMP26 Pro domain
c
o
Protease Catalytic domain Fibronectin type II repeat Hinge domain
Hemopexir»
domain Membrane linkage
Nature Reviews | Molecular Cell Biology
Figure 5. Structure schématique des MMPs.[Page-McCaw A, Ewald AJ, Werb Z. Matrix métalloprotéinases and the regulation of tissue remodelling. Nat Rev Mol Cell Biol, 2007.8:221-33.]
1.5.2 Le système plasminogène/plasmine
19
1.5.2.1 La plasmine
La plasmine est générée par le clivage de son précurseur, le plasminogène, présent dans le sérum à une concentration d'environ 2 uM. Celui-ci est transformé en forme active par l'uPA, qui, une fois lié à son récepteur l'urokinase plasminogène activator receptor (uPAR), est beaucoup plus efficace (Figure 6). Son principal inhibiteur physiologique est l'a2-antiplasmine [75]. La plasmine est une protease à serine qui peut digérer des composantes de la MEC telles la laminine et la vitronectine . Elle peut également libérer ou activer des cytokines (TGF-P, IL-1) et des MMPs (MMP-1, 3, 7). La plasmine est aussi impliquée dans la signalisation. Quelques récepteurs ont été décrits pour cette enzyme, dont l'a-énolase et l'annexine U. Ceux-ci ont été étudiés chez le monocyte, le lymphocyte et le neutrophile. L'annexine II est impliquée dans la mobilisation de calcium et la liaison de la plasmine à ce récepteur provoquerait l'activation des ERK-1/2 [76]. L'a-énolase serait plutôt indiquée dans la génération de plasmine. Par contre, aucun de ces récepteurs n'a été décrit jusqu'à maintenant chez l'éosinophile.
uPAR
uPA
Nature R*vt«ws | Molecular C*U Biology
Figure 6. Représentation schématique de la génération de la plasmine. [Blasi F, Carmeliet P. uPAR: a versatile signalling orchestrator. Nat Rev Mol Cell Biol, 2002.3:932-43.].
20
1.5.2.2 L'uPA et l'uPAR
L'uPA est une molécule d'environ 53 kDa, sécrétée sous forme de pro-enzyme. Pour être activée, la pro-uPA doit se lier à son récepteur, l'uPAR. Dans cette position, la pro-uPA se retrouve près de la membrane plasmique où d'autres proteases, dont la plasmine, sont disponibles pour la cliver. La single-chain de la pro-uPA est ainsi séparée en deux sections qui sont toujours attachées ensemble par un lien disulfure. Les deux chaînes nouvellement formées changent de conformation pour devenir la two-chain, la forme active de la protease. L'uPA peut être divisée en trois régions fonctionellement indépendantes. Premièrement, on retrouve le domaine de facteur de croissance amino-terminal (GFD), puis le domaine kringle (KD). Ces deux domaines ensemble constituent le fragment amino-terminal (ATF), section qui se lie au récepteur. Finalement, on retrouve le domaine catalytique, nommé low molecular weight (LMW)-uPA, dans la portion carboxy-terminale de la molécule [77,78,79]. L'activité protéolytique de l'uPA est inhibée par les plasminogen activator inhibitor (PAD-1 et 2. Le PAI se lie à l'uPA two-chain attachée à l'uPAR et le complexe ainsi formé est internalise. L'uPA est ensuite dégradé, tandis que l'uPAR est recyclé et retourne à la surface de la cellule. De cette façon, le PAI contrôle l'activité et la quantité d'uPA près de la membrane plasmique [80].
21
L'uPAR, aussi appelé CD87, est un récepteur ancré à la membrane par un glycolylphosphatidylinositol (GPI) composé de trois domaines, Dl, 2 et 3. Il a un poids moléculaire de 35 kDa et il possède une grande affinité pour l'uPA, la pro-uPA et l'ATF [81]. Comme expliqué ci-haut, l'uPAR joue un rôle de premier plan dans l'activation de l'uPA et dans la génération de plasmine. En rapprochant la pro-uPA de la membrane, il augmente son taux d'activation et conséquemment, celui de la plasmine [82]. L'uPAR est connu pour se redistribuer au pôle migrant de la cellule pour ainsi concentrer l'action de l'uPA à l'endroit où se concentre la protéolyse, suggérant l'implication de celui-ci dans la migration cellulaire [83]. Il semble aussi avoir une fonction dans l'adhésion cellulaire. Une fois lié à l'uPA, l'uPAR expose une surface pouvant interagir avec la vitronectine, une composante de la MEC, modulant ainsi l'adhésion. Le complexe uPA-uPAR peut également se lier à des intégrines, comme CDllb/CD18, pour augmenter l'adhésion. De plus, l'uPAR lié à l'uPA peut participer à la signalisation intracellulaire. Par contre, étant donné que ce récepteur ne possède pas de domaine cytosolique, il ne peut signaler par lui-même. Pour ce faire, il doit s'associer à d'autres protéines qui, elles, en possèdent, dont les intégrines et les récepeurs couplés à une protéine G (GPCR) [84]. L'activation du CD87 chez différents leucocytes mène à la libération de calcium intracellulaire et à l'activation des ERK-1/2 [85].
L'éosinophile exprime l'uPA et l'uPAR. On sait que la génération de plasmine est impliquée dans la migration de l'éosinophile. Cependant, aucune étude n'a décrit les effets de l'activation de l'uPAR chez l'éosinophile.
1.5.2.3 Les interactions entre le système plasminogène/plasmine et la MMP-9
Plusieurs interactions sont décrites entre le système plasminogène/plasmine et la MMP-9. Ces interactions sont étudiées majoritairement chez les cellules cancéreuses, mais aussi chez le monocyte. L'activation de la MMP-9 par la plasmine est plutôt ambigiie. Certains l'ont décrite comme pouvant l'activer, d'autre non. Il semble que la présence d'une membrane plasmique soit l'élément clé. En effet, une étude démontre que la plasmine génère des formes actives de la MMP-9, que la liaison de la plasmine et de l'uPA
22
sur la membrane cellulaire accélère l'activation de la MMP-9 et qu'en absence de cellules dans le milieu, la plasmine dégrade la MMP-9 [86]. De plus, une autre étude suggère que l'uPA active directement la MMP-9. Par contre, les formes actives de MMP-9 générées de cette façon ont des poids moléculaires différents de ceux retrouvés généralement [87]. Finalement, chez le monocyte, il a été observé que l'activation de l'uPAR par l'uPA induit la sécrétion de la MMP-9 en activant la voie de signalisation intracellulaire des ERK-1/2 [85]. Les éléments du système plasminogène/plasmine exercent donc un contrôle sur l'activité de la MMP-9. Toutefois, il est difficile d'affirmer si cela ce produit par une activité protéolytique ou bien par l'augmentation de la production de la MMP-9 résultant de l'activation de la cellule par l'uPAR.
Chapitre II : Hypothèses et objectifs de recherche
L'éosinophile joue un rôle de premier plan dans l'asthme. Son infiltration dans la bronche lui permet de participer à l'inflammation en sécrétant différents médiateurs pro-inflammatoires. Il peut également promouvoir le remodelage en modulant les fonctions des cellules structurales. L'inflammation chronique et le remodelage favorisent les changements fonctionnels qui mèneront à l'apparition des symptômes de l'asthme.
L'éosinophile a un rôle tissulaire et doit donc migrer du sang vers la muqueuse bronchique. En réponse à une chimiokine, l'éosinophile exprimera des molécules d'adhésion et puis sécrétera des proteases qui lui permettront de digérer la MB du vaisseau sanguin et la MEC. La sécrétion des proteases est toutefois peu étudiée chez l'éosinophile.
Dans l'étude présente, nous nous sommes donc intéressés à la régulation des proteases sécrétées par l'éosinophile lors de sa migration. Nous nous sommes intéressés plus particulièrement à la migration induite par le 5-oxo-ETE, qui induit une forte migration en activant la MMP-9 et le système plasminogène/plasmine. Notamment, le 5-oxo-ETE favorise la sécrétion de la MMP-9 en activant la voie signalétique des ERK-1/2 [64]. De plus, cette étude a également permis d'observer qu'en diminuant la concentration de plasminogène dans le milieu de culture, c'est-à-dire en retirant le sérum, la voie des ERK-1/2 semble moins solicitée. Ces observations suggèrent qu'un ou plusieurs éléments du système plasminogène/plasmine sont importants dans l'activation de la voie des
ERK-1/2 lors de la migration induite par 5-oxo-ETE.
Sachant que la voie des ERK-1/2 est impliquée dans la sécrétion de la MMP-9 et que le système plasminogème/plasmine pourrait activer cette voie signalétique, nous postulons que l'uPA et la plasmine, deux proteases du système plasminogème/plasmine
induisent la sécrétion de la MMP-9 en activant la voie signalétique des ERK-1/2. Pour le démontrer, deux objectifs ont été fixés. Dans un premier temps, nous avons vérifié si l'uPA et la plasmine peuvent induire la sécrétion de la MMP-9. Dans un deuxième temps, nous avons vérifié si la voie signalétique des ERK-1/2 est impliquée dans cette sécrétion.
Chapitre III : Matériel et méthodes
3.1 Sélection des sujets
Vingt sujets asthmatiques, 11 femmes et 9 hommes, rencontrant les critères de l'American Thoracic Society pour le diagnostic de l'asthme ont été recrutés pour cette étude [88]. Les critères d'inclusion étaient d'avoir un asthme stable depuis plus de 3 mois et de n'avoir pris aucun corticostéroïde inhalé ni d'autres médications pour l'asthme autre que des agoniste p2 adrénergiques et ce sur une période de 3 mois et plus. Cette étude a été approuvée par le comité d'éthique de l'Hôpital Laval et tous les sujets ont donné leur consentement en signant un formulaire informatif écrit.
3.2 Produits
Le Dextran T-500 a été acheté chez GE Healthcare Bio-Sciences Inc. (Montréal, Canada), le lymphocyte separation medium chez Wisent Inc. (St-Bruno, Canada), le HBSS sans calcium/magnésium et le milieu RPMI 1640 chez Invitrogen Canada (Burlington, Canada), la BSA (fraction V) chez Sigma-Aldrich Canada (Oakville, Canada) et le FBS chez Multicell from Wisent (St-Bruno, Canada). L'IL-5 recombinante a été achetée chez Peprotech Inc. (Rocky Hill, USA), le 5-oxo-ETE chez Cayman Chemical (Ann Arbor, USA), l'uPA recombinant humain chez American Diagnostica Inc. (Stamford, USA), la plasmine chez Sigma-Aldrich Canada et le PD 98059 chez Calbiochem (La Jolla, USA). L'anticorps de souris anti-MMP-9 humain provient de R&D Systems Inc. (Minneapolis, USA) et l'anticorps de chèvre anti-souris couplé à une horseradish peroxydase de chez Jackson ImmunoResearch Laboratories Inc (West Grove, USA). Les anticorps de souris anti- phospho p42/p44 humain et de lapin anti-p42/p44 humain ainsi que les anticorps de chèvre anti-souris et de chèvre anti-lapin couplés à F horseradish peroxydase ont été achetés chez Cell Signaling Technology Inc. (Danvers, USA).
26
3.3 Isolement des éosinophiles sanguins
Un échantillon de 165 ml de sang est prélevé chez les sujets. Une première centrifugation est effectuée pour pouvoir retirer le maximum de plasma et de plaquettes du sang. Les globules rouges sont ensuite sédimentés avec du Dextran 3%. La fraction supérieure est récupérée et séparée selon la densité à l'aide de lymphocyte separation medium pour obtenir des granulocytes sans monocyte, ni lymphocyte. Une lyse des globules rouges restants parmi les granulocytes est ensuite effectuée par choc osmotique (hypotonique). Les éosinophiles sont finalement séparés des neutrophiles par sélection négative à l'aide d'un anticorps anti-CD16 conjugué à des billes magnétiques qui sont retenues lors d'un passage sur une colonne magnétique MACS. Les éosinophiles sont comptés et leur viabilité est vérifiée à l'aide de bleu de trypan sur un hématocymètre. Une coloration est effectuée pour vérifier la pureté qui, en générale, est égale ou supérieure à 95%.
3.4 Analyse de la sécrétion de la MMP-9 par les éosinophiles
3.4.1 Stimulation des éosinophiles
Deux méthodes ont été utilisées (A et B) pour stimuler les éosinophiles. Méthodes A :
Les éosinophiles fraîchement isolés sont resuspendus dans du RPMI complémenté de 10 % FBS pour obtenir une densité cellulaire de IO7 cellules/ml. La suspension est
préincubée pendant 30 minutes avec de l'EL-5 à une concentration finale de 10 ng/ml et s'il y a lieu avec du PD 98059 (10 uM). 50 ul de la suspension (500 000 cellules) sont transférés dans un tube Eppendorf de 1,5 ml. Les cellules sont traitées ou non avec du 5-oxo-ETE (1 uM), de l'uPA (0,2-50 nM) et de la plasmine (5-50 nM). Les éosinophiles sont ensuite incubés à une température de 37°C à des temps variant entre 1 et 18 heures.
27 Méthode B :
Les éosinophiles fraîchement isolés sont resuspendus dans du RPMI complémenté de 10 % FBS pour obtenir une densité cellulaire de IO6 cellules/ml. La suspension est
préincubée pendant 30 minutes avec de 1TL-5 à une concentration finale de 10 ng/ml. 500 ul de la suspension (500 000 cellules) sont transférés dans un puits d'une plaque 24 puits. Les cellules sont traitées ou non avec du 5-oxo-ETE (1 uM), de l'uPA (1-100 nM) et de la plasmine (0,03-100 nM). Les éosinophiles sont ensuite incubés à une température de 37°C à des temps variant entre 1 et 18 heures.
3.4.2 Récupération des surnageants
Une centrifugation à 4°C est effectuée pour arrêter la stimulation et culoter les cellules. Le surnageant est récupéré dans un tube Eppendorf et est centrifugé de nouveau pour s'assurer qu'il n'y ait plus de cellules. Le tampon Laemmli sans P-mercaptoéthanol est ensuite ajouté. L'échantillon est bouilli pendant 5 minutes et conservé à -80°c.
3.4.3 Immunobuvardages
Une séparation des protéines est d'abord effectuée sur un gel de polyacrylamine de 8% pour la MMP-9 (surnageants). Les protéines sont ensuite transférées sur une membrane de Polyvinylidene fluoride (PVDF) à 300 mA, 2 à 3 heures, à 4°C. Par la suite, la membrane est immergée pendant 1 heure à température pièce dans le Blotto (25 mM Tris-HCl, 0,2 M NaCl, 0,15% Tween 20 et 5% lait en poudre, pH 7,4), une solution de bloquage pour supprimer le marquage non spécifique. Puis, la membrane est trempée dans une solution de Blotto contenant l'anticorps anti-MMP-9, 1/500, et incubée ainsi à 4°C pendant toute la nuit. Le lendemain, la solution est changée pour celle contenant l'anticorps secondaire conjugué à une enzyme, la horseradish peroxydase (HRP) (anti-mouse HRP Jackson, 1/10000). Finalement, l'ajout d'ECL permet de détecter les protéines pas
28 chimioluminescence. Les graphiques représentent le dosage densitométrique de la MMP-9 active (82 kDa).
3.5 Analyse de la phosphorylation des ERK-1/2
3.5.1 Stimulation des éosinophiles
Les éosinophiles fraîchement isolés sont resuspendus dans du RPMI complémenté de 10 % FBS pour obtenir une densité cellulaire de IO6 cellules/ml. La suspension est
préincubée pendant 30 minutes avec de 1TL-5 à une concentration finale de 10 ng/ml. 500 ul de la suspension sont transférés dans des tubes à fond conique en polypropylene installés dans un bain agitateur rotatif à 37°C. Les cellules sont traitées avec de l'uPA 10 nM et de la plasmine 1 nM. Les éosinophiles sont ensuite incubés à des temps variant entre 1 minute et
15 minutes.
3.5.2 Fractionnement de l'éosinophile
Les cellules sont culotées et lysées (40 ul méthode A; 100 ul méthode B) dans un tampon de lyse froid (20 mM Tris (pH 7.5), 150 mM NaCl, 1 mM EDTA, 1 mM EGTA, 1% Triton X-100, aprotinine 10 ug/ml, leupeptine 10 ug/ml, 1 mM PMSF et une tablette d'inhibiteurs de phosphatases (Roche Diagnostic (Laval, Canada))). La suspension est déposée sur la glace pendant 10 minutes. Elle est ensuite vortexée à puissance maximale pendant 15 secondes, puis centrifugé pendant 10 minutes à vitesse maximale. Le contenu cytoplasmique se retrouve dans le surnageant qui est récupéré et dans lequel le tampon Laemmli avec 2% de p-mercaptoéthanol est ajouté. L'échantillon est bouilli pendant 5 minutes et conservé à -80°C.
29
3.5.3 Immunobuvardages
Une séparation des protéines est d'abord effectuée sur un gel de polyacrylamine de 8% pour la MMP-9 (surnageants) et de 12% pour les ERK-1/2 (lysats cellulaires). Les protéines sont ensuite transférées sur une membrane de Polyvinylidene fluoride (PVDF) à 300 mA, 2 à 3 heures, à 4°C. Par la suite, la membrane est immergée pendant 1 heure à température pièce dans le Blotto (25 mM Tris-HCl, 0,2 M NaCl, 0,15% Tween 20 et 5% (p/v) lait en poudre, pH 7,4). Puis, la membrane est trempée dans une solution de Blotto contenant l'anticorps approprié (anti-p42/p44 phosphoryle, 1/1000; anti-p42/p44, 1/1000) et incubée ainsi à 4°c pendant toute la nuit. Le lendemain, la solution est changée pour celle contenant l'anticorps secondaire adéquat, conjugué à une enzyme, la horseradish peroxydase (HRP) (anti-mouse HRP cell signalling, 1/20000; anti-rabbit HRP cell signalling, 1/20000). Finalement, l'ajoute d'ECL permet de détecter les protéines pas chimioluminescence.
3.6 Analyse statistique
Pour l'analyse descriptive des différents paramètres de l'étude, la valeur moyenne±sd a été utilisée pour les variables quantitatives tandis que les variables qualitatives ont eu leurs différentes valeurs représentées à l'aide des fréquences relatives et exprimées également en pourcentage. Cette étude consistait à mesurer pour chaque sujet différentes conditions. Pour la description statistique des données, l'approche de l'analyse de la variance à mesures répétées à deux facteurs a donc été choisie. Ainsi, le premier facteur étant le facteur associé à identifier la variabilité entre les sujets, facteur aléatoire. Le second facteur correspond aux différentes conditions, facteur fixe. La structure de la dépendance entre les observations a été définie par une matrice de covariances à structure symétrique. Le test Brown et Forsythe a été utilisé pour valider l'hypothèse d'homogénéité des variances alors que le test de Shapiro-Wilk a servi a valider l'hypothèse de normalité. Toute hypothèse nulle dont le seuil observé était inférieur à 0,05 était rejetée. L'ensemble des résultats a été analysé à l'aide du progiciel SAS version 8.2 (SAS Institute Inc., Cary, NC).
30
Chapitre IV : Résultats
4.1 La sécrétion de la MMP-9 induite par PuPA et la plasmine
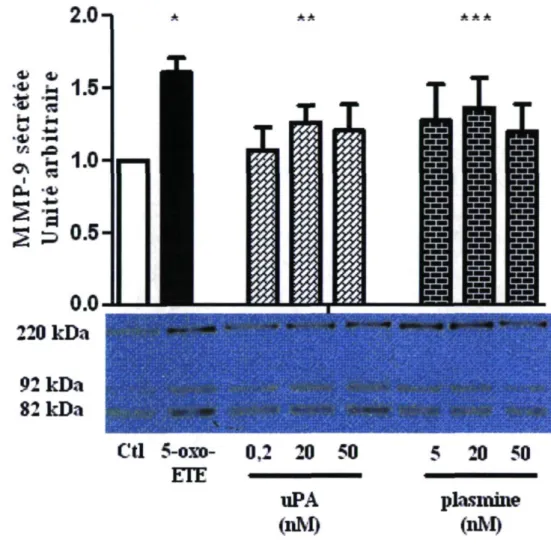
Le but de l'étude était de déterminer l'implication du système plasminogène/plasmine dans la sécrétion de la MMP-9 chez l'éosinophile sanguin. Nous avons donc vérifié si l'addition des éléments de ce système, l'uPA et la plasmine, dans le milieu pouvaient induire la sécrétion de la MMP-9. Des immunobuvardages de la MMP-9 ont été effectués avec les surnageants obtenus après différentes incubations selon la méthode A. Le 5-oxo-ETE a été utilisé comme contrôle positif. L'uPA et la plasmine induisent toutes deux une sécrétion de la MMP-9 par l'éosinophile, qui n'est toutefois pas significative en comparaison au contrôle (p= 0,07 et 0,14 respectivement). La concentration optimale de cette sécrétion est de 20 nM pour l'uPA et la plasmine (figure 8).
31
2.0 n
0.0
220 kDa
92 kDa
82 kDa
Ctl
5-oxo-ETE
0,2 20 50
uPA
(nM)
5 20 50
plasmine
(nM)
Figure 8. Sécrétion de MMP-9 induite par l'uPA et la plasmine. Les éosinophiles furent incubés avec l'uPA ou la plasmine pour 18 heures. Le 5-oxo-ETE (1 uM) fut utilisé comme contrôle positif. La photo représente un immunobuvardage typique de la MMP-9, n = 6; * p = 0,001; ** p = 0,07; *** p = 0,14 comparé au contrôle (IL-5 10 ng/ml).
32
4.2 L'influence des ERK-1/2 sur la sécrétion de la MMP-9
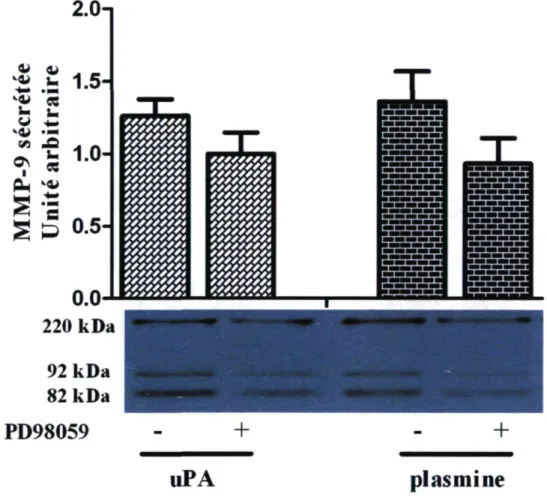
Nous avons ensuite vérifié si les ERK-1/2 étaient impliqués dans la sécrétion de la MMP-9 induite par l'uPA et la plasmine en utilisant le PD 98059, un inhibiteur spécifique non-compétitif de MEK-1. L'inhibition de MEK-1 prévient l'activation des ERK-1/2, puisque MEK-1 précède les ERK-1/2 dans la cascade de phosphorylation de cette voie signalétique. Le PD 98059 fut utilisé à une concentration de 10 uM. En présence de PD 98059, la sécrétion de la MMP-9 induite par l'uPA et la plasmine retourne au niveau de base. Ces données suggèrent donc une implication des ERK-1/2 dans l'activation de la sécrétion de la MMP-9 induite par l'uPA et la plasmine.
33
2.0n
K*> 2
1.5-h" h - ^ • —? S
1 0S 5 0.5-
■
?£$£$£
0.0-220 kDa
92 kDa
82 kDa
PD98059
+
+
uPA
plasmine
Figure 9. L'influence des ERK-1/2 sur la sécrétion de la MMP-9 induite par l'uPA et la plasmine. Les éosinophiles ont été incubés avec 20 nM d'uPA ou de plasmine pour 18 heures. Comme indiqué sur la figure, certains éosinophiles furent préalablement préincubés avec du PD 98059 (10 uM). La photo représente un immunobuvardage typique de la MMP-9, n = 6.
34
4.3 La modulation de la sécrétion de la MMP-9 par l'IL-5
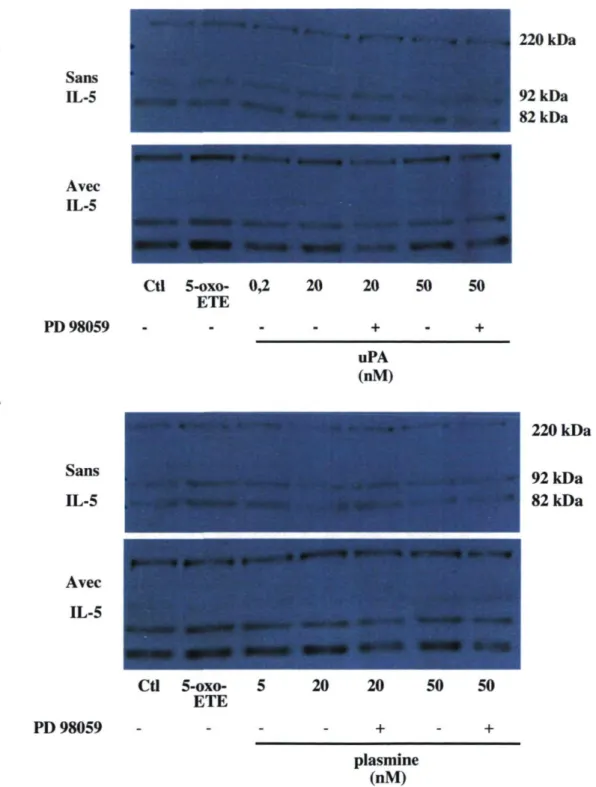
Il a été démontré que 1TL-5 augmente de façon significative la migration induite par le 5-oxo-ETE. La MMP-9 étant impliquée dans cette migration, nous nous sommes donc intéressés au rôle de l'IL-5 dans la sécrétion de MMP-9. Contrairement aux autres expériences, la moitié des éosinophiles fut préincubée en absence l'IL-5. L'autre moitié fut prétraitée, comme partout ailleurs, avec de l'EL-5. Les deux parties furent ensuite incubées dans les mêmes conditions d'uPA et de plasmine. La MMP-9 présente dans le surnageant fut analysée par immunobuvardage et ceux-ci furent comparés. Comme observé sur les images de la figure 10, en absence d'LL-5, aucun des produits utilisés ne semble moduler la sécrétion de la MMP-9 : le 5-oxo-ETE (A, B), l'uPA (A) et la plasmine (B) ne paraissent pas augmenter la sécrétion de la MMP-9. Le PD 98059 (A, B) ne semble pas non plus induire de diminution de sécrétion de base de la MMP-9. Par contre, en présence d'IL-5, les résultats suggèrent que le 5-oxo-ETE, l'uPA, la plasmine et l'inhibiteur de MEK 1 (A-B) modulent la sécrétion de la MMP-9 chez l'éosinophile. L'EL-5 semblerait donc nécessaire à l'éosinophile pour la sécrétion de la MMP-9 qui serait induite par l'uPA et la plasmine.
35 Sans IL-5 220 kDa 92 kDa 82 kDa Avec IL-5 PD 98059 Ctl 5-oxo-ETE 0,2 20 20 + 50 50 + Ctl 5-oxo-ETE uPA (nM) B 220 kDa 92 kDa 82 kDa Avec IL-5 > • — •*'"*• Ctl 5-oxo-ETE 5 20 20 50 50 PD 98059 - - + - + plasmine (nM)
Figure 10. L'influence de l'IL-5 sur la modulation de la sécrétion de la MMP-9. Les éosinophiles ont été incubés avec l'uPA (A) ou la plasmine (B) pour 18 heures. Comme indiqué sur la figure, certains éosinophiles furent préalablement préincubés avec de l'JX-5 (10 ng/ml) ou du PD 98059 (10 uM). Le 5-oxo-ETE (1 uM) fut utilisé comme contrôle positif. Les photos représentent des immunobuvardages de la MMP-9, n = 2.
36
4.4 L'inhibiteur de MEK-1 et l'IL-5
Dans la figure précédente, le PD 98059 ne semble pas avoir d'effet sur la sécrétion de la MMP-9 au niveau de base (sans IL-5). Cette figure suggère aussi que l'IL-5 est nécessaire pour que la sécrétion de la MMP-9 puisse être modulée. Par contre, on ne connaît pas l'effet du PD 98059 sur l'IL-5. Nous avons donc voulu exclure la possibilité que les diminutions induites par le PD 98059 découlent de l'inhibition de l'effet de l'EL-5. Pour ce faire, nous avons comparé la sécrétion de la MMP-9 d'éosinophiles incubés en présence d'IL-5, avec ou sans PD 98059. Aucune différence ne fut observée entre les deux conditions. La diminution de la sécrétion de la MMP-9 induite par l'uPA et la plasmine, observée en présence de PD 980959 ne semble donc pas être la conséquence de l'inhibition de l'effet l'IL-5.
37
92 kDa 82 kDa
PD98059
+
IL-5
Figure 11. L'effet du PD 98059 sur la sécrétion de la MMP-9 au niveau de base. Les éosinophiles furent incubés avec de l'IL-5 (10 ng/ml) avec ou sans PD 98059 (10 uM) pendant 18 heures. La photo représente un immunobuvardage typique de la MMP-9, n = 6.
38
4.5 Cinétique de la sécrétion de la MMP-9
Puisque les sécrétions de la MMP-9 induites par l'uPA ou la plasmine ne se sont pas avérées statistiquement significative, nous avons voulu déterminer si nous mesurions ces sécrétions au bon moments. Pour situer la sécrétion de MMP-9 dans le temps, nous avons effectué des cinétiques. La sécrétion induite par le 5-oxo-ETE, l'uPA et la plasmine semble s'intensifier après 9 heures d'incubation et se poursuit jusqu'à 15 heures. On observe ensuite, à 18 heures, une diminution de la sécrétion de la MMP-9.
39 IL-5 10 ng/ml
5-oxo-ETE
(luM)
uPA
(10 nM)
plasmine
(InM)
Temps (h)
0 1 3 6 9 12 15 18
Figure 12. Cinétique de la sécrétion de MMP-9. Les éosinophiles furent incubés avec du 5-oxo-ETE (1 uM) de l'uPA (20 nM) ou de la plasmine (20 nM) pendant 0, 1,3, 6, 9, 12, 15, et 18 heures. La photo représente un immunobuvardage typique de la MMP-9, n = 2. Bande du haut, MMP-9 dimérisée, 220 kDa; milieu, pro-MMP-9, 92 kDa; bas, MMP-9 active, 82 kDa.
40
4.6 La sécrétion de la MMP-9 induite par l'uPA et la plasmine :
méthode B sur 15 heures.
Puisque nous avons déterminé que le temps de sécrétion maximale est de 15 heures, nous avons repris les expériences afin de voir si la sécrétion serait plus stable. De plus, pour d'éviter les erreurs de manipulation qu'auraient pu causer les petits volumes de la méthode A, les expériences ont été refaites dans des volumes plus grands (méthode B). Les concentrations d'uPA et de plasmine ont été modifiées pour obtenir des points équidistants. Le temps d'incubation a également été ajusté de 18 heures à 15 heures pour s'assurer d'avoir une sécrétion maximale. Dans ce modèle, l'uPA et la plasmine induisent la sécrétion de la MMP-9 par l'éosinophile. De plus, la sécrétion induite par l'uPA à 3, 10, et 30 nM est statistiquement significative (p < 0,03, n = 6) (figure 13).
41 n = Cfl 5-oxo-ETE 4 6 6 6 4 2 2 2 6 6 4 4 4 1 3 10 30 100 0.03 0,1 0.3 1 3 10 30 100 uPA (nM) plvuame (nM) B 220 kDa 92 kDa 82 kDa
IL-5 5-oxo- uPA plasmine
ETE
Figure 13. Sécrétion de MMP-9 induite par l'uPA et la plasmine. (A) Les éosinophiles furent incubés avec différentes concentrations d'uPA ou de plasmine pour 15 heures. Le 5-oxo-ETE (1 uM) fut utilisé comme contrôle positif. (B) La photo représente un immunobuvardage typique de la MMP-9 à 15 heures (uPa, 10 nM; plasmine, lnM); *, p < 0,02; **, p < 0,03 comparé au contrôle (IL-5 seul).
42
4.7 Cinétique de la sécrétion de la MMP-9 induite par l'uPA et
la plasmine: méthode B sur 18 heures
La cinétique de la sécrétion de la MMP-9 a également été refaite selon la méthode B. La sécrétion induite par le 5-oxo-ETE, l'uPA et la plasmine semble se produire après 9 heures d'incubation jusqu'à 15 heures et on observe une diminution de la MMP-9 à 18 heures (figure 14). Ces résultats sont comparables à ceux obtenus avec la méthode A à plus petits volumes (figure 12).
43
IL-5
(10 ng/ml)
5-oxo-ETE
(IMM)
uPA
(10 nM)
Plasmine
(InM)
Temps (h) 0 6 9 12 15 18
Figure 14. Cinétique de la sécrétion de MMP-9. Les éosinophiles furent incubés avec du 5-oxo-ETE (1 uM) de l'uPA (10 nM) ou de la plasmine (1 nM) pendant 0, 6, 9, 12, 15, et 18 heures. Les photos représentent des immunobuvardages de la MMP-9. Bande du haut, MMP-9 dimérisée, 220 kDa; milieu, pro-MMP-9, 92 kDa; bas, MMP-9 active, 82 kDa, représentatif de n = 2.
44
4.8 Cinétique de l'activation des ERK-1/2
Pour évaluer de façon directe l'activation des ERK-1/2 par l'uPA et la plasmine, une cinétique de la phosphorylation des ERK-1/2 a été réalisée. L'uPA (10 nM) induit une phosphorylation des ERK-1/2 à 2 minutes 30 secondes. L'effet de la plasmine est beaucoup plus variable : sur l'image présentée ici, aucune phosphorylation n'est observée. Des cinétiques de la phosphorylation des ERK-1/2 ont été effectuées auparavant selon la méthode A. Elles ne sont pas présentées ici puisque l'anticorps était différent et que les films sont surexposés. Par contre, ces résultats préliminaires (n = 2) suggéraient une phosphorylation des ERK-1/2 à des temps variant entre 5 et 15 minutes. Il est donc possible que la plasmine possède, elle aussi, la capacité d'activer les ERK-1/2. Par contre, jusqu'à maintenant, elle est difficile à confirmer puisque la phosphorylation n'est pas apparu au même moment d'une expérience à l'autre, soit entre 2,5 minutes à plus de 15 minutes. D'autres expériences seront nécessaires pour confirmer l'activation des ERK-1/2 par la plasmine à un moment précis.
ERK-p ERK total
Temps (min) 0 1 2,5 5 7,5 10 15 0 1 2,5 5 7,5 10 15 uPA
(10 nM) plasmine (1 nM)
Figure 15. Activation des ERK-1/2 par l'uPA et la plasmine. Les éosinophiles furent incubés avec de l'uPA (10 nM) ou de la plasmine (1 nM) pendant 0, 1, 2,5, 5, 7,5, 10 et 15 minutes. Les photos représentent des immunobuvardages des ERK-1/2 phosphorylés et totaux (42 et 44 kDa), n = 1.
45
Chapitre V : Discussion
La MMP-9 est une protease de premier plan impliquée dans la migration de l'éosinophile. Elle est nécessaire à la dégradation de la membrane basale des vaisseaux sanguins et de la matrice extracellulaire lors de ce phénomène. Sa sécrétion est stimulée par différents médiateurs tels le C5a, le TNF-a, le PAF et le 5-oxo-ETE [53,71,72,73]. Jusqu'à maintenant, aucune étude n'a démontré l'implication d'autres proteases dans le phénomène de sécrétion de la MMP-9 chez l'éosinophile. Depuis plusieurs années, le Dr Laviolette et son équipe s'intéressent aux proteases impliquées dans la migration de l'éosinophile [53,89]. Dans une étude publiée en 2008, qui traite des voies signalétiques impliquées dans la migration de l'éosinophile, ils suggèrent que la voie des ERK-1/2 serait impliquée dans la sécrétion de la MMP-9 à long terme via le système plasminogène/plasmine [64]. Dans l'étude présente, nous nous sommes donc intéressés à comprendre le rôle du système plasminogène/plasmine dans la sécrétion de la MMP-9. Deux proteases de ce système furent sélectionnées; l'uPA et la plasmine. En effet, nous avons démontré qu'il est possible pour l'uPA et la plasmine d'induire une sécrétion de MMP-9.
Pour ce qui est de l'uPA, son effet maximal se produit à des concentrations semblables pour les deux méthodes utilisées, soit 20 nM pour la méthode A et 10 nM pour la méthode B; seule la sécrétion induite selon la méthode B s'est révélée significative. De plus, une étude de Menshikov et coll. publiée en 2006 a démontré un effet similaire de l'uPA chez les monocytes THP-1 [85]. Des monocytes ont été placés en présence d'uPA à des concentrations entre 20 et 200 nM et la sécrétion de MMP-9 dans le surnageant a ensuite été analysée par zymographie. Ils ont ainsi observé une augmentation de la sécrétion de la MMP-9. Cette étude est d'autant plus intéressante puisqu'elle démontre également que cette augmentation est directement reliée à la liaison de l'uPA à son récepteur et non à son activité catalytique. Des expériences supplémentaires devront être effectuées pour évaluer si, dans notre modèle, cette liaison est aussi importante.
Pour la plasmine, la sécrétion maximale de la MMP-9 se produit à 20 nM pour la méthode A et 1 nM pour la méthode B. D y a donc discordance en ce qui a trait aux