HAL Id: tel-01334855
https://tel.archives-ouvertes.fr/tel-01334855
Submitted on 21 Jun 2016
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Identification de nouveaux transcrits alternatifs du gène
CD20 humain, différentiellement exprimés dans les
hémopathies impliquant le lymphocyte B
Clementine Gamonet
To cite this version:
Clementine Gamonet. Identification de nouveaux transcrits alternatifs du gène CD20 humain, différen-tiellement exprimés dans les hémopathies impliquant le lymphocyte B. Génétique humaine. Université de Franche-Comté, 2015. Français. �NNT : 2015BESA3003�. �tel-01334855�
❯!✁✂✄☎✆✁✝✞✟✄✠☎✡ !☛☞ ✄
-COMTÉ
UFR SCIENCES MÉDICALES ET PHARMACEUTIQUES
ÉCOLE DOCTORALE HOMME ENVIRONNEMENT SANTÉ
Année universitaire 2014-2015
THÈSE
Pour l’obtention du diplôme de
Doctorat de l’Université de Franche-Comté
Spécialité : Sciences de la Vie et de la Santé
Par Clémentine GAMONET
Identification de nouveaux transcrits alternatifs du gène CD20 humain,
différentiellement exprimés dans les hémopathies impliquant le
lymphocyte B
Sous la direction du Dr Christophe FERRAND Et la codirection du Dr Marina DESCHAMPS
Soutenue le 12 Octobre 2015
Composition du jury
Directeur de thèse : Dr Christophe FERRAND Codirecteur de thèse : Dr Marina DESCHAMPS Rapporteurs : Pr Pierre FEUGIER
Dr Alexandra MARTINS Examinateurs : Pr Eric DECONINCK
Pr Olivier ADOTEVI Dr Bernard DRENOU
✸
✺
R
EMERCIEMENTS
Mes premiers remerciements vont au Docteur Christophe Ferrand, mon directeur de thèse, qui m’a épaulé
depuis ma première année de master jusqu’à la fin de cette thèse, ainsi qu’au Docteur Marina Deschamps ma
co-directrice de thèse. Merci à vous de m’avoir guidé durant mon apprentissage du métier de chercheur.
Je tiens ensuite à remercier les membres du jury qui ont jugé ce travail :
Le Professeur Erick Deconinck qui a accepté de présider ce jury,
Le Professeur Pierre Feugier et le docteur Alexandra Martins qui ont consacré du temps à la lecture et la
critique de mon manuscrit,
Le Professeur Olivier Adotévi et le Docteur Bernard Drénou qui ont expertisé ce travail.
Merci au Professeur Christophe Borg de m’avoir accueilli dans son équipe il y a plus de 6 ans maintenant, et à
l’ensemble des chercheurs de l’unité pour leurs conseils avisés durant toutes ces années : merci aux Professeurs
Philippe Saas, Olivier Adotévi, Francine Garnache-Ottou et aux Docteurs Sylvain Perruche et Yann Godet.
Merci également à Carole qui m’a présenté ce cher delta-CD20 et apprit à le connaître !
Merci à Anne et Charline, qui ont accepté la longue et fastidieuse tâche de relecture et correction de mon
manuscrit.
Merci à mes supers collègues grâce à qui les moments compliqués de la vie de chercheur sont si vite oubliés :
Elodie, ça n’a pas pâtassé depuis qu’on se connait, et tout a été bien plus facile avec toi à mes côtés. J’avais
bloqué mon 27 Mars, je bloquerai d’autres dates s’il le faut, et je serai là comme tu l’as été pour moi.
Anne Dup’, mon point de repère au grand bureau ! Toujours là pour me secourir en biomol et pour me
remonter le moral quand « ya rien qui sort en PCR», merci.
JR, Jean-Marie, Idir, mes acolytes sportifs. On a refait de nombreux matchs ensemble autour d’un petit force 5,
7 ou 10 pour le plus énervé d’entre nous. Quel plaisir de partager ces petits moments avec vous !
Merci à tous mes collègues, en particulier Sabéha, Fanny, Pat’, Francis, « Rérémy », Yann, Romain(s) L et V,
Laurent, Afag ainsi que tous ceux qui rendent l’ambiance de travail si agréable dans cette unité.
✻
Mais une thèse ne se joue pas qu’au labo, loin de là.
Alors un immense merci à mes amis, qui m’ont toujours permis de m’évader en toutes circonstances, et
continueront de le faire j’en suis sure.
Baptiste, Laurène, Marion, vous êtes loin et me manquez. Mais savoir que vous êtes là pour moi a toujours été
(et reste) très précieux. Merci d’être là.
Bastien, JB, Flo, Stef’, où que l’on soit, quoi que l’on fasse, les moments que l’on passe ensemble sont à chaque
fois plus drôles et plus agréables que les précédents, et j’espère que ça continuera très longtemps comme ça.
Merci d’être mes amis !
Merci à tous les lanceurs de disques, de Besançon et d’ailleurs. Ce sport m’a accompagné durant toute ma
thèse, et a largement contribué à mon équilibre durant ces années. Une pensée spéciale pour Alex, mon
compère de « galère » cette dernière année. Salbris, rédac’, coaching, ce ne fut pas toujours simple mais c’était
nettement plus drôle de partager ça avec toi.
Enfin, je garde le meilleur pour la fin afin de remercier ma famille. Ce n’est pas facile, car jamais je ne pourrai
les remercier assez.
Papis, Mamis, vous sentir les quatre si fiers de moi me rend très heureuse, et moi, je suis fière d’être votre
petite fille.
Merci à mes petits frères Timothée et Etienne, ma tatie Céline, Nina, Jeanne : les piliers de ma vie. Merci
d’être près de moi.
Papa, Maman, vous m’avez donné le goût des études et toujours encouragé à continuer. Grâce à votre
indéfectible aide, soutien, et bien plus encore, je suis arrivée au bout de ce long chemin universitaire. Vous
avez toujours cru en moi et avez toujours tout fait pour me faciliter la vie. Je vous aime fort.
Enfin, toi mon amoureux, merci d’être là avec moi, de m’avoir soutenu et d’avoir patienté à mes côtés durant
ces mois plus compliqués.
✼
R
ESUME
▲ ✜✢ ✣ ✤ ✥✦✢ ✧★✢ ✩✜✪✧ ✫✬ ✤✥✥✭ ✮✢ ✭ ✯✦✢ ✰✧✭ ✦ ✤✱ ✩✪ ✮✲✧✢ cd20 dans les lymphocytes B tumoraux, conduisant à la
synthèse d’une protéine tronquée nommée CD20 (puis D393-CD20), a été découverte au laboratoire en 2010. L’expression de D393-CD20 avait alors été associée à des cas de résistance au traitement par Rituximab, un AcMo anti-CD20.
L’objectif de ces travaux de thèse a alors été de caractériser l’épissage de cd20, et de déterminer l’implication de D393-CD20 dans l’acquisition de résistance au RTX.
Plusieurs modèles in vitro de résistance aux AcMo ont été mis en place afin d’évaluer la corrélation entre l’expression de D393-CD20 et la sensibilité aux anti-CD20.
Le séquençage de produits de PCR spécifique de CD20 a permis d’identifier 4 variants alternatifs en plus de D393-CD20, nommés D657-, D618-, D480- et D177-CD20 en raison de leurs tailles. Pour tous, le cadre de lecture est conservé malgré la perte d’une portion de cd20.
L’expression des 5 variants alternatifs a été évaluée par PCR à partir de prélèvements de patients atteints de pathologies B auto-immunes et cancéreuses, ainsi que chez des donneurs sains. L’épissage de cd20 dérégulé au sein des lymphocytes B tumoraux ainsi que lors d’une transformation par le virus EBV a été mis en évidence, de même qu’une dérégulation plus modérée lors de la survenue de pathologies auto-immunes.
Si les modèles in vitro de résistance démontrent que la présence de D393-CD20 n’est pas directement associée à la résistance aux AcMo, nous avons montré que ces derniers peuvent moduler l’épissage de cd20 par l’intermédiaire de voies de signalisation intra cellulaires.
D393-CD20 est pour le moment le seul variant pour lequel une protéine codée soit formellement identifiée, et son expression est directement associée à l’oncogenèse. L’identification de lymphocytes TCD4 spécifiques de cette protéine au cours de ces travaux rend possible le développement d’une stratégie d’immunothérapie ciblant D393-CD20.
Ces résultats ouvrent donc la voie à une étude plus approfondie du potentiel biomarqueur et du rôle pronostique de la dérégulation de l’épissage du gène codant CD20, cible prépondérante des stratégies thérapeutiques des pathologies impliquant le lymphocyte B.
✾
S
OMMAIRE
❘ ✳✴✵✶✳ ... 7
SOMMAIRE ... 9
LISTE DES FIGURES ... 13
LISTE DES ABRÉVIATIONS ... 15
INTRODUCTION ... 19
CHAPITRE 1 :LA PROTEINE CD20, MARQUEUR DES LYMPHOCYTES B ... 21
I. L’ontogénie B ... 21
I.1 Le développement du linéage B ... 21
I.1.1 De la cellule souche au LB mature naïf ... 21
I.1.2 L’activation des LB naïfs ... 22
I.1.2a Maturation des LB folliculaires ... 23
I.1.2b Développement des plasmocytes ... 25
I.1.2c Développement des LB-MEM ... 26
I.2 Spécificité des Lymphocytes B pour l’antigène ... 27
I.2.1 Réarrangement des gènes du BCR ... 27
I.2.2 Hypermutations somatiques ... 29
I.2.3 Commutation de classe ou switch isotypique ... 31
II. La molécule CD20 ... 34
II.1 Découverte et expression ... 34
II.2 Le gène CD20 ... 34
II.3 La protéine CD20 ... 35
II.3.1 Structure ... 35
II.3.2 Fonctions ... 36
II.3.2a Signalisation du BCR et flux calcique ... 36
II.3.2b CD20, BCR et flux calcique ... 39
CHAPITRE 2 :LE RITUXIMAB ET AUTRES ANTICORPS MONOCLONAUX ANTI-CD20 ... 41
I. Hémopathies B ... 41
I.1 Lymphomes B ... 41
I.1.1 Évènements oncogéniques au cours du développement des LB ... 41
I.1.1a Les translocations ... 41
I.1.1b Les mutations ... 44
✿ ❀
I.2 La LLC ... 47
I.2.1 Les anomalies génétiques marqueurs et facteurs pronostiques de la maladie ... 47
I.2.2 Les traitements de la LLC ... 47
I.3 Les maladies auto-immunes (MAI) ... 48
II. Les AcMo anti-CD20 ... 50
II.1 Historique de l’avènement du RTX ... 50
II.2 Mécanismes d’action du RTX ... 52
II.2.1 Les FcR ... 52
II.2.2 La phagocytose et la neutralisation de pathogènes ... 52
II.2.3 L’ADCC ... 53
II.2.4 L’activation du complément ... 55
II.2.5 La mort cellulaire directe (transduction de signaux) ... 57
II.2.5a L’induction d’apoptose ... 57
II.2.5b Le blocage des voies de survie ... 61
II.3 Développement de nouveaux AcMo ... 62
II.3.1 Les mécanismes de résistance au RTX ... 62
II.3.1a La modulation d’expression de CD20 ... 62
· Epigénétique ... 63
· Élimination des complexes CD20-RTX de la surface membranaire ... 63
II.3.1b L’altération du recrutement des effecteurs ... 64
II.3.1c Les modulations des voies de signalisation ... 64
II.3.2 Le développement de nouveaux AcMo ... 65
CHAPITRE 3 :L’EPISSAGE ALTERNATIF ... 69
I. L’épissage constitutif et alternatif ... 69
I.1 L’épissage ... 69
I.2 L’épissage alternatif ... 70
I.3 Le spliceosome ... 72
II. La régulation de l’épissage ... 75
II.1 L’épissage dépend de caractéristiques intrinsèques du pré-ARNm ... 75
II.1.1 La taille des exons et introns ... 75
II.1.2 La force de la séquence ... 75
II.1.3 La structure secondaire du pré-ARNm ... 76
II.2 L’action des protéines régulatrices ... 76
II.2.1 Les protéines de la famille SR ... 77
II.2.1a Structure ... 77
II.2.1b Fonction ... 78
II.2.2 Les protéines de la famille hnRNP ... 80
II.2.2a Structure ... 80
✿ ✿
II.2.3 Les voies de signalisation régulant l’épissage ... 83
III. Épissage alternatif et cancer ... 86
III.1 Les aberrations de l’épissage au cours de l’oncogenèse ... 87
III.1.1 Les anomalies des séquences régulatrices (mutations) ... 87
III.1.2 Les anomalies des protéines de l’épissage ... 89
III.1.2a SF3B1 ... 89
III.1.2b SRSF1 ... 90
III.1.2c hnRNP ... 90
III.1.3 Les anomalies des modifications post-traductionnelles ... 91
III.2 Les conséquences des aberrations de l’épissage ... 93
III.2.1 L’avantage prolifératif ... 93
III.2.2 La résistance aux traitements ... 95
III.3 Outils diagnostiques et thérapeutiques ... 96
III.3.1 Les variants alternatifs spécifiques des cancers peuvent-ils être utilisés comme outils diagnostiques ? ... 96
III.3.2 Le blocage et la reprogrammation de l’épissage... 97
III.3.3 Les variants alternatifs peuvent être ciblés à des fins thérapeutiques ... 101
RATIONNEL DE LA THESE ...103
RÉSULTATS ...107
DONNÉES PUBLIÉES ...109
Identification of new CD20 alternative splice variants differentially expressed in hematological malignancies ... 111
Lack of expression of an alternative CD20 transcript variant in circulating B cells from patients with pemphigus ... 139
The alternative CD20 transcript variant is not a surrogate marker for resistance to rituximab in patients with rheumatoid arthritis ... 143
CD20 alternative splicing isoform generates immunogenic CD4 helper T epitopes ... 147
DONNEES NON PUBLIEES ...161
I. Matériel et Méthodes ... 162
I.1 Echantillons biologiques, patients et lignées cellulaires ... 162
I.2 Mise en place de lignées résistantes ... 162
I.3 Traitements ... 162
I.4 Etude biochimique : Western Blotting, Immunoprécipitation, Fractionnement Sub cellulaire et extraction des radeaux lipidiques ... 163
I.5 Etude moléculaire: Extraction de l’ARN, reverse transcription, PCR... 164
II. Résultats ... 164
II.1 La protéine tronquée D393-CD20 est associée avec WT-CD20 au niveau des radeaux lipidiques de la membrane plasmique. ... 164
✿ ✷
II.2 Aucune corrélation ne peut être établie entre l’expression de D393-CD20 et l’acquisition de résistance aux AcMo.
... 165
II.3 Le traitement par RTX augmente l’expression de D393-CD20 ... 168
III. Discussion ... 170
DISCUSSION ...173
1. L’épissage de cd20 est modulé lors d’hémopathies B... 175
1.1 Cinq épissages alternatifs sont différemment exprimés lors de la survenue d’hémopathie ... 175
1.2 Les causes d’une modulation de l’épissage de cd20 ... 177
1.2.1 L’AID, une protéine clé de l’oncogenèse ... 177
1.2.2 Dérégulation de l’épissage lors de l’activation de l’AID ... 178
1.3 Le variant alternatif D393-CD20 est associé à la transformation maligne ... 178
2. Conséquences possibles de la dérégulation de l’épissage ... 180
2.1 L’épissage de cd20 comme facteur prédictif des LLC ... 181
2.2 Implication dans l’échappement tumoral ... 182
2.3 Développement d’immunothérapie ciblant les variants ... 183
Conclusions et perspectives ... 185
✿ ✸
L
ISTE DES
F
IGURES
❋❁ ❂❃❄❅✿❆❇ ❈❉❅ ❊● ❍❍❅■❅❏❑▼◆ ❖❈■ 5❑❁ ◗❃❅❙❅▼❊❚■ ❍ ❖● ◆❚❑❅▼❲ ... 22
Figure 2: Développement des cellules sécrétrices d'anticorps ... 25
Figure 3: Structure des loci des chaînes lourdes d’immunoglobuline humaine avant et après réarrangement ... 28
Figure 4: Structure des loci des chaînes lourdes d’immunoglobuline humaine avant et après réarrangement ... 29
Figure 5: Mécanisme d’hypermutations somatiques ... 30
Figure 6: Les isotypes d’immunoglobulines ... 32
Figure 7: La commutation de classe ... 33
Figure 8: Signalisation du récepteur à l’antigène des lymphocytes B (BCR) ... 37
Figure 9: Flux calcique déclenché par l’activation du BCR ... 39
Figure 10: Anomalies génétiques à l’origine de lymphomes B ... 42
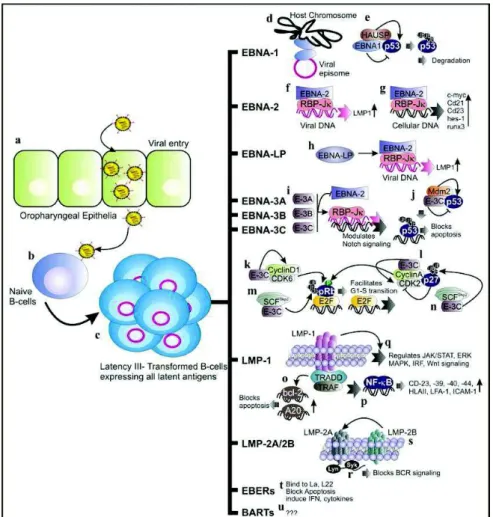
Figure 11: Implication des antigènes de latence dans la transformation maligne associée à l’EBV ... 45
Figure 12: Conséquences de la dégranulation des cellules Natural Killer (NK) ... 54
Figure 13: Les différentes voies d’activation du complément ... 56
Figure 14: Formation du Complexe d’attaque membranaire (CAM) par le système du complément ... 57
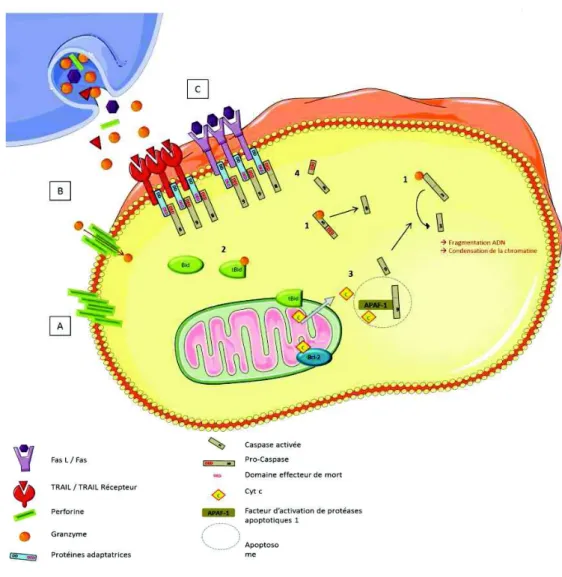
Figure 15: Les voies d’apoptoses extrinsèque et mitochondriale (ou intrinsèque) ... 59
Figure 16: Mort cellulaire apoptotique et non-apoptotique ... 61
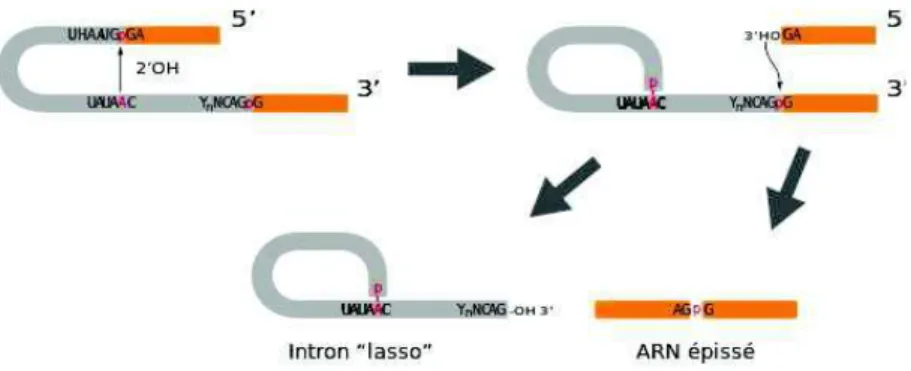
Figure 17: Deux réactions de trans-estérification permettent l’excision d’un intron ... 70
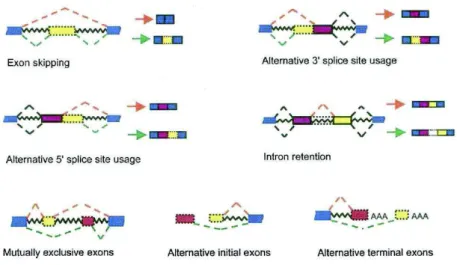
Figure 18: Différents types d'épissage alternatif ... 71
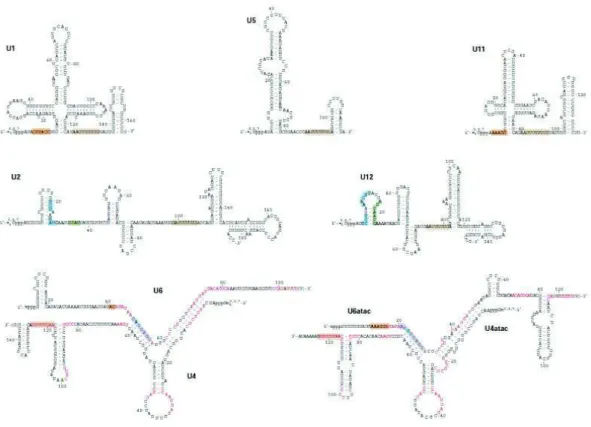
Figure 19: Séquence et structure des snRNA du spliceosome humain ... 72
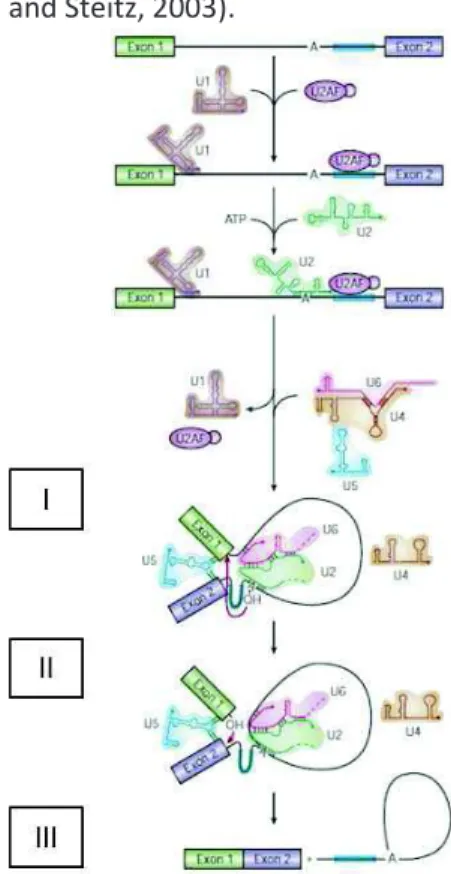
Figure 20: Assemblage du spliceosome et catalyse de l’épissage ... 73
Figure 21: Structure schématique des protéines de la famille SR ... 78
Figure 22: Modes d’action des protéines SR ... 79
Figure 23: Structure schématique des protéines snRNP ... 81
Figure 24: Modes d’action des protéines hnRNP ... 82
Figure 25: La phosphorylation régule l’activité des protéines SR ... 84
Figure 26: La méthylation de l’ADN module l’épissage ... 86
✿ ✹
Figure 28: L’épissage du gène codant le VEGF conduit à la synthèse de 2 familles d’isoformes ... 94
Figure 29: Schéma d’une molécule de pré-trans-épissage ... 99
Figure 30: Western Blotting anti-CD20 après Immunoprécipitation (IP) anti-CD20, fractionnement sub-cellulaire et extraction des radeaux lipidiques ... 165
Figure 31: Sensibilité aux AcMo anti-CD20 des lignées résistantes. Exemple de la lignée Raji. ... 166
Figure 32: Expression de WT- et D393-CD20 par les lignées Raji sauvages (WT) et résistantes aux AcMo RTX, OFA et GA101 ... 166
Figure 33: Expression de WT-CD20 à la surface des lignées Résistantes. Exemple de la lignée Raji ... 167
Figure 34: expression de D393-CD20 au cours de la culture... 167
Figure 35: Expression de WT- et D393-CD20 après traitement de PBMC par RTX ... 168
Figure 36: Expression de WT- et D393-CD20 après traitement de lignée B par RTX ... 169
Figure 37: Expression de WT- et D393-CD20 après inhibition d’AKT préalable au traitement de PBMC par RTX ... 169
✿ ✺
L
ISTE DES
A
BRÉVIATIONS
❳ ❨❨❆❨ ◆❁❙❅❨ ■ ❁❏❈ ❨ ◆❩●❆❨ ❏❑❁◆●❄❍ ▼❩●❏●◆ ❊●❏3 ❊ ❨ ❇❬❆❨ ◆❁ ❙❅❇ ❈ ▼● ❭❚ ❄❁❪● ❬ ❃◆ ❊ ❈❁ ◗❃❅ ❨ ❫❇❆❨ ◆❑❁❉3 ❑❁● ❏➊❫ ❏❙❃◆❅❙❇❅3 ■ ❁ ❏3 ▼❅❴❙❈3■❁❏3 ▼❅❵3 ◆❑❁❉3 ❑❁● ❏❁❏❙❃❁ ❑❅ ❨❛❜❆❨ ❍❃ ❄❁❏❁◆❝3❛❚ ❄❁■ ❁ ❙❁ ❏❁◆❜❏❙●❏❃◆ ❊❅3 ▼❅❴❅❏❙●❏❃◆ ❊❅3 ▼❅3 ❍❃❄❁ ❏❁◗❃❅❝3 ❍❚ ❄❁ ■❁❙❁◗❃❅ ❨❛❞ ❫ ❡❆❨❛❞● ❊❁ ❢❅ ❄3 ❑❁● ❏❣❫❏❙❃ ◆❁ ❏❂❡❁❂3 ❏❙❴❊❁❂3 ❏❙❁ ❏❙❃◆❑❁ ❪❊❅❍3 ❄❊3❍❄●❊❁ ❢❈ ❄3 ❑❁●❏ ❨ ❞❬❆❨ ◆❁ ❙❅❞❁❪●❬ ❃ ◆❊❈❁ ◗❃❅ ❤ ❲❨❋❋ ❆❲ ❣◆❅❊❊3 ◆❑❁❉3 ❑❁❏❂❢3 ◆❑●❄ ❲✐❞❆❲ ❣✐❅❊ ❊❞❅◆❅❍❑●❄❴❄❈◆❅ ❍❑❅❃ ❄❙❅▼◆❅❊❊❃❊❅ ▼❲ ❥ ✐❇❆◆ ❊❃▼❑❅❄❙❅❙❁ ❢ ❢❈❄❅❏❑❁3❑❁ ● ❏ ✐❇❞❆◆●■ ❍ ❊❅■ ❅ ❏❑3 ❄❁ ❑❚❙❅❑❅ ❄■❁❏❁❏❂❄❅ ❂❁● ❏❴❄❈ ❂❁●❏❙❅❑❅❄■ ❁❏3 ❏❑❊3◆●■ ❍❊ ❈■ ❅❏❑3 ❄❁❑ ❈ ✐❦ ❆✐❅❏❑ ❄❅❦❅❄■ ❁❏3 ❑❁❢ ✐ ❧♠❛❆✐❚◆ ❊●❍ ❖● ▼❍ ❖3■ ❁❙❅♥❧❚ ❙❄● ❙3 ❃ ❏●❄❃ ❪❁◆❁ ❏❅♥♠❏◆●❉❁❏❅❑❛❄❅ ❙❏❁ ▼●❏❅ ♦ ♣ TU♦ VW✬✯✢ ✣✢♣✭✉✢ ✪ ✰✩✜T❁▼❑● ◆●■ ❍3 ❑❁❪❁❊❁ ❑ ❈ ✐❣❑❅❄❆✐❣❑❅ ❄■ ❁ ❏3 ❊❅ ✈ ❇❨ ❦❆❇ ❁❨ ◆❚❊❦ ❊❚◆ ❈ ❄●❊ ❇✐❆✐❅❊❊❃❊❅ ▼❇ ❅ ❏❙❄❁❑❁ ◗❃❅ ▼ ❇✐❢❆✐❅❊❊❃❊❅▼✐❅❏❙❄❁❑❁ ◗❃❅ ▼❋●❊❊❁ ◆❃ ❊3 ❁ ❄❅▼ ❇ ❡ ❲✐❡❆❇ ❁ ❢ ❢❃▼❅❡3 ❄❂❅❲ ❣✐❅ ❊ ❊❡ ❚■❍ ❖●■3 ❴❊ ❚■ ❍ ❖●■❅❲❙❁ ❢❢❃ ▼❵❂❄3 ❏❙❅ ▼◆❅ ❊ ❊❃ ❊❅▼ ❙❬✇❛❆❙❈ ▼●❭ ❚❄❁❪●❏❃◆ ❊ ❈● ❑❁ ❙❅▼ ① ❜❲②❆❜❍▼❑❅ ❁❏❣ ❲3 ❄❄②❁❄❃▼ ❜ ③✐ ❆❜❭ ●❏③● ❁ ❏❁ ❏❂✐●■❍ ❊❅❭ ❜ ❩❨❆❜❃ ❄●❍❅3 ❏❩❅❙❁ ◆❁❏❅❨ ❂❅ ❏◆ ❚ ❜④❜❆❜❭●❏❁◆④❍❊❁ ◆❁❏❂❜❏❖3 ❏◆❅❄ ❜④④❆❜❭ ●❏❁◆④❍ ❊❁◆❁❏❂④❁ ❊❅❏◆❅❄ ❜⑤♠❆❜❭● ❏❃ ◆ ❊❈3 ▼❅ ⑥ ❋❨❇ ❇❆❋❨ ④❨ ▼▼●◆❁3❑❅❙❇❅ 3❑ ❖❇● ■3 ❁❏ ❋ ◆❆❋ ❄3 ❂■ ❅❏❑◆ ❄❁▼❑3 ❊❊❁▼3 ❪❊❅ ❋ ◆❞❆❋❈ ◆❅ ❍❑❅ ❃ ❄3 ❃❢❄3 ❂■ ❅ ❏❑❋ ◆
16
❋❇❨ : Food and Drug Administration = Agence américaine des produits alimentaires et de santé
H
❧❨✇ : Histone Acétyl-Transférase
❧❇ ❨✐ : Histone DéAcétylase
❖❏❞ ❬❛ : heterogenous nuclear RiboNucleoProtein = ribonucléoprotéines nucléaires hétérogènes
I
❫❋❬ : InterFéRon
❫ ❂ : Immunoglobuline
❫ ❂❧ : chaîne lourde de l’Ig ❫ ❡ ❆InterLeukine
❫❛ ✸ : Inositol-1,4,5-triPhosphate
❫❞ ❋ ❆❫❏❑❅❄❢❅❄●❏❞❅❂❃ ❊7 ❑●❄❚❋actor
❫④❜ : Intronic Splicing Enhancer
❫④④ : Intronic Splicing Silencer
❫✇❨❩ : Immunoreceptor Tyrosine-based Activation Motif
❫✇❫❩ : Immunoreceptor Tyrosine-based Inhibition Motif
L
❡ ❲ : Lymphocyte B
❡ ❲-FO : Lymphocyte B Folliculaire
❡ ❲-MEM: Lymphocyte B Mémoire
❡B-T: Lymphocyte B Transitionnel
❡ ❲-ZM : Lymphocyte B de la Zone Marginale
❡ ❡✐ : Leucémie Lymphoïde Chronique
❡✇ : Lymphocyte T M ❩❬❫ : MonoNucléose Infectieuse ❩❨❫ : Maladie Auto-Immune ❩ ❩❞ : MisMatch Repair N
❬❜ ③❧ : Non-Homologous End Joining = complexe de jonction non-homologue ❬⑦❆❬ 7 ❑❃ ❄7 ❊
⑦iller
❬-ter : N-terminale
O
♠❋❨ : Ofatumumab
♠❡④ : Organisme Lymphoïde Secondaire
P
❛❫❛ : PhosphatidylInositol-4,5-diPhosphate
17
❍ ❄❈-ARNm : ARN pré-messager
⑧
❞ ❆❞écepteur
❞ ❨G: Recombination-Activating Gene = gene activant la recombinaison
❞-CHOP : Rituximab + Cyclophosphamide, Hydrodaunorubicine, Oncovin et Prednisone
❞ ❞❩ : RNA-recognition motif
❞④ ④ : Recombination Signal Sequences = séquences signales de recombinaison
❞✇⑤ : Rituximab
S
▼❏❞❬ ❨ : small nuclear RNA
▼❏❞❬❛ : small nuclear RiboNucleoProtéin
④♠❨ : Séquences Oligonucléotidiques Antisens
④♠✐ ❜ : Store-Operated Calcium Entry = entrée de calcium basée sur les réserves
④❞ : Sérine Arginine
T
✇❡❞❆✇● ❊ ❊-Like Receptor
✇❬ ❋ : Tumor Necrossis Factor
U
19
21
Chapitre 1 : La protéine CD20, marqueur des lymphocytes B
⑩❶
L’ontogénie B
I.1 Le développement du linéage B
I.1.1 De la cellule souche au LB mature naïf
Le développement des LB débute, comme toutes les cellules hématopoïétiques, au sein de la moelle osseuse. La cellule souche à l’origine des leucocytes est le progéniteur multipotent qui sous la dépendance du facteur de transcription Pu.1 se différencie en précurseur myéloïde commun ou en précurseur lymphoïde précoce (Scott et al., 1994) (Fig 1).
Une fois engagées dans la voie lymphoïde, les cellules évoluent en précurseur lymphoïde multipotent à partir duquel peuvent être produits des lymphocytes T, B, Natural Killer (NK) et les cellules dendritiques (DC). La différenciation vers les LB au détriment des NK et DC est conditionnée par l’IL-7 (Tsapogas et al., 2011).
Les précurseurs sont alors nommés « pro-B », et une étape cruciale du développement de LB débute : les gènes codant les chaines des immunoglobulines sont réarrangés par les enzymes recombinases RAG1 et RAG2 avant d’être transcrits (Grundy et al., 2009) (Askary et al., 2014). Ce mécanisme qui permet l’expression d’une grande variabilité de récepteur des cellules B (BCR) au sein d’une population de LB, tout en gardant une très haute spécificité de ces récepteurs pour leurs antigènes respectifs, sera détaillé plus loin.
Au stade pré-B, le gène codant la chaine lourde de l’IgM (Igµ) est réarrangé. Une fois exprimée, la chaine lourde est associée avec une chaîne temporaire VpreB/!5 formant ainsi le pré-BCR (Burrows et al., 2002). L’exclusion allélique est alors enclenchée de manière à ce que le second chromosome ne soit pas réarrangé inutilement : il le sera uniquement si les réarrangements du premier allèle ne permettent pas l’expression d’une chaine lourde fonctionnelle.
La chaine légère de l’Ig est à son tour réarrangée et exprimée à la place de la chaine temporaire : le BCR ainsi assemblé et exprimé à la surface cellulaire définit le stade de LB immature. Dans la moelle osseuse, les LB sont en présence d’antigènes du soi circulant ou présentés par les cellules stromales. Les LB répondant à ces auto-antigènes sont considérés comme auto-réactifs et sont éliminés. Les LB survivants
22
quittent la moelle osseuse pour rejoindre la circulation sanguine afin de coloniser la rate et les autres organismes lymphoïdes (Fig 1).
Le dernier stade de maturation des LB est marqué par la co-expression de deux types d’Ig membranaires : les lymphocytes B matures naïfs expriment à la fois des IgM et des IgD grâce à un épissage alternatif du gène codant la chaine lourde des Ig (Enders et al., 2014). Ces LB sont prêts à répondre efficacement à un antigène et ils quittent la moelle osseuse pour entrer dans la circulation sanguine. Ces LB circulants parfois appelés transitionnels (LB-T) ont la capacité de coloniser le sang, la rate mais également la moelle osseuse afin de rencontrer l’antigène dont ils sont spécifiques.
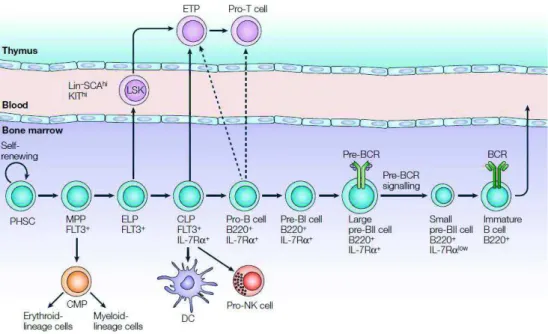
Figure 1: Développement schématique des lymphocytes B
Les flèches en trait continu correspondent à des voies de développement confirmées, contrairement aux flèches en pointillés. Les cellules souches pluripotentes hématopoïétiques (PHSC), les progéniteurs multipotents (MPP), les précurseurs lymphoïdes précoces (ELP) et les précurseurs lymphoïdes communs (CLP) sont définis par un phénotype Lin- c’est-à-dire qu’ils n’expriment aucun marqueur associé aux lignées matures CD3, CD8, B220, CD11b, CD19, GR1 et TER119. Les pro-B et pré-BI sont définis par les phénotypes B220+/CD43+ et B220+/CD43- respectivement puis l’expression d’un pré-BCR caractérise le stade pré-BII. Enfin, un BCR fonctionnel est exprimé sur les LB immatures qui quittent alors la moelle osseuse pour rejoindre la circulation sanguine. D’après Matthias & Rolink, Nat Rev Immunol 2005
I.1.2 L’activation des LB naïfs
Une fois dans les organismes lymphoïdes secondaires (OLS), la suite du développement des LB est conditionnée par la rencontre avec l’antigène qui va provoquer la différenciation des LB-T
23
IgMhiIgDhiCD21intCD23+ en 3 populations distinctes : les LB folliculaires (LB-FO), les LB de la zone marginale
(LB-ZM) et les LB non-conventionnels B-1.
La survie des LB-T est conditionnée par la stimulation du récepteur à l’antigène (BCR) par un antigène du soi. En cas de forte réponse du BCR, la protéine Bruton’s Tyrosine Kinase (BTK) (Cariappa et al., 2001) est activée et module deux voies de signalisation responsables de l’orientation vers une différenciation en
LB-FO. En revanche, une faible stimulation du BCR n’active pas BTK, ce qui permet une activation de la
signalisation via la protéine NOTCH-2, orientant la différenciation vers les LB-ZM (Saito et al., 2003). Cette théorie d’une différenciation B dépendante de l’intensité de réponse du BCR a été validée par de nombreux modèles murins : l’inactivation de CD21 (une protéine activatrice du BCR) induit une augmentation de LB-ZM au détriment des LB-FO alors que l’inverse est observé chez des souris dont l’inhibiteur CD22 du BCR n’est pas exprimé (Cariappa et al., 2001).
Les LB-FO représentent 80% des LB de la rate et constituent les centres germinatifs (CG) en proliférant suite à la rencontre avec l’antigène. Ils possèdent alors la capacité de se différencier en plasmocytes sécréteurs d’IgM à courte durée de vie.
Les LB-ZM quant à eux sont à même de répondre aux pathogènes sanguins de manière T-indépendante, et vont également collaborer avec les cellules NK invariant pour répondre aux antigènes lipidiques grâce à l’expression de CD1d (Bialecki et al., 2009). Ces LB sont les premières cellules B sécrétrices d’anticorps au cours d’une réponse immunologique, permettant ainsi de faire le lien entre immunité innée et immunité adaptative.
I.1.2a Maturation des LB folliculaires
Au sein des OLS, les LB naïfs migrent vers la zone-B sous l’influence de CXCL13 et s’accumulent au niveau de follicules lymphoïdes en attendant la rencontre avec leur antigène. Les antigènes reconnus peuvent être solubles ou fixés à la membrane de DC, cellules dendritiques folliculaires (DCf) ou de macrophages. Suite à la fixation d’antigène sur le BCR, ce dernier est internalisé et l’antigène dégradé pour être présenté à la surface de LB via les molécules du complexe majeur d’histocompatibilité (CMH) de classe II.
Les LB ainsi partiellement activés migrent vers la bordure des follicules à proximité de la zone riche en LT sous influence des cytokines CCL19 et CCL21 reconnues par le récepteur CCR7 des LB.
Les LB présentent ensuite le peptide chargé sur leurs molécules de CMH II à un LT spécifique du même peptide. La synapse qui se crée lors de cette interaction permet un échange de signaux nécessaire à la complète activation du lymphocyte B : la reconnaissance de l’antigène constitue le premier signal
24
d’activation du LB puis l’engagement de CD40 et de CD28 par respectivement CD40L et B7.1/ B7.2 est nécessaire pour la poursuite de la réponse B (Chevrier et al., 2012).
Certains antigènes ont la capacité d’activer les LB en absence de LT : ces antigènes sont en général de grosses molécules polysaccharidiques ou lipidiques capables de d’activer en même temps plusieurs molécules du BCR. Ce fort signal, associé à la stimulation de récepteurs Toll-like (TLR), permet l’activation du LB sans nécessiter une co-stimulation par un LT.
Une fois activés, les LB se divisent en 2 sous-populations.
Une première migre à l’extérieur des follicules, où ils prolifèrent et se différencient en plasmocytes sécréteurs d’anticorps de faible affinité appelés plasmoblastes à courte durée de vie permettant une réponse rapide à l’antigène.
La seconde sous-population, nommée centroblaste, retourne à l’intérieur des follicules pour débuter une phase de forte prolifération formant les CG (Bannard et al., 2013). Après avoir achevé leur intense prolifération les centroblastes subissent le processus d’hypermutations somatiques afin de modifier l’affinité des BCR pour l’antigène dont ils sont spécifiques et deviennent des centrocytes. Suite à ces modifications, les centrocytes expriment plusieurs facteurs pro-apoptotiques qui provoquent une apoptose systématique si le BCR n’est pas rapidement stimulé par son antigène spécifique (Siepmann et al., 2001). Les cellules ainsi sélectionnées vont devoir survivre à une seconde étape de sélection : leur survie dépend de l’engagement de CD40 par le CD40L exprimé par les lymphocytes T présents dans les CG (T-GC). Là encore, seuls les LB aux BCR les plus affins survivront. Afin de garantir une réponse immunitaire efficace, différentes chaines lourdes peuvent être synthétisées par un LB de manière à obtenir des Ig de même spécificité antigénique, mais aux propriétés effectrices variées : ce processus appelé commutation de classe sera détaillé ci-après.
La dernière étape du développement des LB consiste en la différenciation des centrocytes en plasmocytes
sécréteurs d’anticorps ou en LB mémoires (LB-MEM) (Fig 2). Ce devenir est déterminé par l’expression
entre autre du gène pax5, qui en cas de répression conduit à la production de plasmoblastes alors qu’une
25
Figure 2: Développement des cellules sécrétrices d'anticorps
Les cellules sécrétrices d’anticorps (ASC) produites à partir de cellules B1 sécrètent des anticorps (Ac) dits « naturels » indépendamment d’une rencontre avec un antigène. Les LB de la zone marginale peuvent se transformer en plasmocytes sécréteurs d’IgM dès la première semaine suivant la rencontre avec l’antigène puis meurent rapidement par apoptose. Après rencontre avec un antigène les LB folliculaires prolifèrent dans les CG et subissent une commutation de classe avant de se développer en plasmocytes sécréteurs d’antigènes ou en LB-MEM au cours de la 3ème semaine de réponse à un antigène.
D’après Shapiro-Selef & Calame, Nat Rev Immunol 2005
I.1.2b Développement des plasmocytes
Les plasmocytes sont les seules cellules de l’organisme capables de sécréter des Ac, et sont à ce titre primordial pour l’efficacité d’une réponse immunitaire. Les plasmocytes peuvent dériver de LB-ZM, LB-FO,
de LB activés dans les CG mais également de LB-MEM. Le premier stade de différenciation des cellules
sécrétrices d’anticorps est le plasmoblaste, caractérisé par une sécrétion d’anticorps en faible quantité associée à une capacité de prolifération et d’apprêtement d’antigènes aux LT.
Trois facteurs de transcription sont nécessaires à la maturation des plasmoblastes en plasmocytes sécréteurs d’une grande quantité d’anticorps constituant le stade terminal de différenciation des LB :
26
BLIMP1, IRF4 et XBP1(Klein et al., 2006). L’engagement de CD40 et la sécrétion d’IL-2 activent les voies de permettant la sécrétion des Ig et l’arrêt du cycle cellulaire.
Une fois activés, les plasmocytes sécrètent de fortes quantités d’Ig de différentes classes. Ces Ig circulent à travers tout l’organisme à la recherche de l’antigène dont ils sont spécifiques. L’antigène est ainsi ciblé par le système immunitaire en particulier par le système du complément et les phagocytes dont nous développerons les modes d’action dans le chapitre II.
Les plasmocytes ont une durée de vie d’environ deux semaines dans la rate, mais des cellules sécrétrices d’anticorps sont observées dans la moelle osseuse jusqu’à 1 an après une infection signifiant que la moelle osseuse est le site d’une production à long terme d’anticorps. Cette production est le fruit de la migration d’une sous population de plasmocytes vers la moelle osseuse grâce à un cocktail de cytokines.
I.1.2c Développement des LB-MEM
À la suite d’une réponse immunitaire, le système immunitaire garde en mémoire cette réponse pendant plusieurs années de manière à pouvoir répondre très rapidement et efficacement en cas de nouvelle
infection par le même antigène. Cette fonction est possible grâce aux cellules LB-MEM qui sont des LB
quiescents à longue durée de vie ayant la capacité de proliférer et de se différencier en plasmocytes très rapidement suite à la seconde rencontre avec un antigène à faible dose. Un des marqueurs phénotypique
des LB-MEM est l’expression de CD27.
Ces cellules sont principalement localisées au sein des OLS et ne nécessitent pas d’interaction avec les LT
pour être pleinement activées lors d’une seconde infection. Plusieurs sous populations de LB-MEM ont été
identifiées et deux voies distinctes de développement de ces populations se dégagent selon si la réponse primaire était dépendante ou non d’une stimulation par les LT (Berkowska et al., 2011).
Une partie des LB-MEM se développe au niveau des CG à partir de centrocytes ayant largement proliféré
et subi les maturations d’affinité du BCR et les commutations de classe.
Ces LB-MEM issus des CG (LB-MEM GC) sont caractérisés par une expression variée d’Ig membranaires de
hautes affinités et sont différenciés des LB naïfs et des LB-CG par l’expression des marqueurs L1, PD-L2, CD80 et CD73. Les plasmocytes à longue durée de vie (LLPC) participent également à la mémoire immunitaire puisqu’après une première activation ils poursuivent durant plusieurs années la sécrétion constitutive d’anticorps spécifiques de l’antigène. En revanche, ils n’ont pas les propriétés nécessaires au déclenchement d’une nouvelle réponse: ils n’expriment que peu de molécules de BCR à leur surface, et ne
27
peuvent proliférer. Ce sont donc les anticorps qu’ils sécrètent qui participent à la seconde réponse en fixant rapidement les antigènes circulant et permettant leur dégradation.
I.2 Spécificité des Lymphocytes B pour l’antigène
L’efficacité des LB dépend de sa capacité à reconnaitre des millions de pathogènes différents grâce à une
grande variabilité de son BCR. Alors que le génome humain est composé d’environ 105 gènes, plusieurs
dizaines de millions d’Ig différentes doivent composer le répertoire B.
Trois principaux mécanismes participant à l’élaboration d’un répertoire B diversifié et spécifique ont été découverts : le réarrangement des gènes codant les Ig permet une large diversité de BCR, les
hypermutations somatiques conduisent à la production de LB hautement affins pour leurs antigènes, et
la commutation de classe garantissant une réponse efficace contre un antigène en permettant la production d’anticorps spécifiques du même épitope mais aux propriétés effectrices variées.
I.2.1 Réarrangement des gènes du BCR
Le réarrangement des gènes codant les Ig du BCR a lieu dans la moelle osseuse au cours du développement des LB. Les Ig membranaires sont composées de deux chaines lourdes et de deux légères similaires entre elles associées par des ponts disulfures (Fig 6). Chaque chaine est composée d’une région constante (C) spécifiant la classe d’Ig à laquelle l’anticorps membranaire appartient, et d’une région variable (V) spécifique de l’antigène.
Les gènes codant la chaine lourde sont situés sur le chromosome 14 (Pott et al., 2013) et sont réarrangés au stade pro-B alors que ceux codant les chaines légères kappa (L") et lambda (L!) sont respectivement localisés sur les chromosomes 2 et 22 (Martín-Subero et al., 2002) et sont réarrangés au stade pré-B. La région variable de la chaine lourde humaine est composée de nombreux segments géniques, répartis en 3 loci nommés : V (pour Variabilité), D (pour Diversité) et J (pour Jonction) ce qui correspond à 84 segments potentiellement utilisables pour coder la région variable de la chaine lourde de l’Ig (51V, 27D et 6J)(Berg et al., 2002). Au niveau des chaines légères les segments D n’existent pas, réduisant le nombre de segments fonctionnels à 34 pour L! (30V et 4J) et 45 pour L" (40V et 5J) (Berg et al., 2002) (Fig 3).
28
L’association d’un fragment de chaque type (VDJ pour la chaine lourde et VJ pour les chaines légères) est nécessaire pour obtenir un gène fonctionnel. Ce réarrangement est dépendant des enzymes activatrices de la recombinaison des gènes (RAG-1 et RAG-2) (Fig 4).
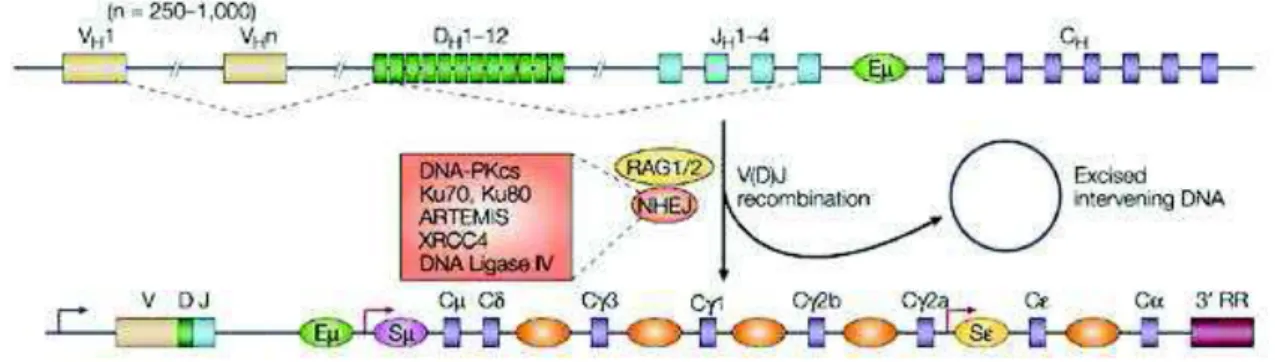
Figure 3: Structure des loci des chaînes lourdes d’immunoglobuline humaine avant et après réarrangement
Le locus est arrangé en segments variables (V), de diversité (D), de jonction (J) et constants (C). L’activation d’enzymes recombinases (RAG) puis du mécanisme de jonction d’extrémités non-homologue (NHEJ) permet d’accoler un segment V, un D et un J qui ensemble coderont la portion variable du BCR.
Adapté de Chaudhuri & Alt, Nat Rev Immunol 2004
Le réarrangement correspond pour la chaine lourde à la jonction aléatoire d’un fragment D à un fragment J puis la jonction du fragment D-J nouvellement constitué avec un fragment V. Pour la chaine légère, seuls un fragment V et un J sont joints. Ces fragments V(D)J composent une fois accolés un exon qui sera à son tour joint à l’exon codant la portion constante, situé en aval sur le même chromosome (Fig 3).
Le réarrangement est guidée par des séquences signales de recombinaison (RSS) qui flanquent chaque fragment. Le complexe RAG (RAG-1 + RAG-2) réalise une cassure sur un brin d’acide désoxyribonucléique (ADN) à la jonction de la portion codante et de la séquence RSS ce qui permet une réaction de trans-estérification conduisant à une cassure double brin de l’ADN et à la formation d’une extrémité « en épingle à cheveux » (Fig 4).
La jonction des extrémités laissées ainsi libres nécessite l’activation de la voie de signalisation de jonction d’extrémités non homologues (NEJH). La jonction est opérée par une endonucléase qui ajoute des nucléotides aux extrémités de chaque brin jusqu’à ce qu’un appariement soit possible (Hofle et al., 2000). Ces éliminations et ajouts de nucléotides contribuent largement à la diversité des BCR puisqu’ils modifient aléatoirement les zones de jonctions entre les segments V, D et J permettant ainsi la création d’une infinité de portions variables d’Ig possibles.
Dès qu’un appariement entre les deux fragments est possible, les quelques nucléotides restant non appariés sont dégradés, et la portion codante de la région variable de l’Ig est ainsi constituée.
29
Figure 4: Les étapes du réarrangement V(D)J
La séquence signal de recombinaison (RSS) est accolée à l’extrémité 3’ d’un domaine V et en 5’ du domaine J (A). Les enzymes RAG créent une brèche aux jonctions V-RSS et RSS-J (B-a) qui sont rapprochées pour créer une synapse (B-b). Une réaction de trans-estérification forme des structures « en épingle à cheveux » aux extrémités V et J (B-c) que le complexe NEJH accole (B-d). D’après Roth et al, Nat Rev Immunol 2003
I.2.2 Hypermutations somatiques
Le réarrangement des gènes permet la production d’un répertoire très large de récepteurs à l’antigène. De nouvelles modifications vont devoir être réalisées après la rencontre avec l’antigène spécifique de manière à encore diversifier le répertoire mais également accentuer la spécificité du BCR pour l’épitope. Ces mutations, appelées hypermutations somatiques ont lieu au cours de la réplication des centrocytes au sein des CG grâce à une enzyme désaminase AID (activation-induced deaminase). Ces mutations sont engendrées au niveau des régions variables des chaines du BCR, dans une région de 2Kpb autour de la région V(D)J (Odegard and Schatz, 2006).
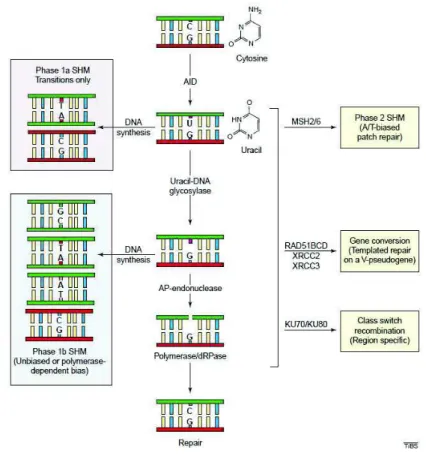
30
La première phase de ce phénomène consiste en la désamination par l’AID d’une base déoxycytidine (C) en déoxyuracile (U) (Muramatsu et al., 1999) transformant ainsi un appariement C:G en U:G. Cette anomalie provoque l’intervention de la machinerie de réparation de l’ADN.
La base U, anormalement présente dans l’ADN, peut être éliminée par l’Uracil-DNA glycosylase (UNG) et remplacée aléatoirement par l’un des 4 dNTP grâce à une ADN polymérase (Fig 5).
L’anomalie U:G causée par l’AID peut également être reconnue par une autre composante de la machinerie de réparation de l’ADN, nommée mismatch repair (MMR) : l’hétérodimère MSH2-MSH6 reconnait le mésappariement, se fixe à l’ADN au niveau de l’anomalie et recrute l’exonucléase 1 (EXO-1) qui dégrade les portions d’ADN anormales (Christmann et al., 2003). Afin de réparer l’ADN, une ADN polymérase de faible fidélité (ADNpol #) synthétise un nouveau brin d’ADN, porteur de nombreuses mutations au niveau des paires A:T.
Figure 5: Mécanisme d’hypermutations somatiques
L’enzyme AID (activation-induced deaminase) transforme une base cytosine (C) en uracile (U) par désamination entrainant une mutation. La base anormale peut être excisée par l’uracil-DNA glycosylase ou le système mismatch repair (MSH-2/6) et être remplacée aléatoirement, générant là aussi une mutation sauf si une AP-endonucléase puis une polymérase interviennent pour réincorporer une base C.
31
La survenue de mutations à haute fréquence (1/1.000pb comparée à 1/1.000.000pb lors d’une réplication normale) conduit à la synthèse d’Ig aux régions variables légèrement modifiées. Les LB seront ensuite sélectionnés selon leur affinité pour l’antigène : dans les CG, les cellules dendritiques folliculaires (DCf) captent et présentent à leur surface des antigènes sous forme de complexes immuns. Ils sont ensuite reconnus et apprêtés par les LB qui à leur tour les présentent au LTf qui envoient en retour aux LB un signal de survie (Allen et al., 2007). Les LB les plus affins captent plus rapidement les antigènes, les présentent en plus grande quantité et plus rapidement via leurs CMHII et sont donc les seuls à recevoir un signal de survie de la part des LTFH.
I.2.3 Commutation de classe ou switch isotypique
Les anticorps sécrétés sont capitaux pour l’efficacité de la réponse immunitaire grâce à leurs actions de neutralisation des pathogènes reconnus et de recrutement d’effecteurs immunitaires permettant l’éradication du pathogène.
Cinq classes d’Ig existent : IgM, IgD, IgG, IgA et IgE (Xu et al., 2012) (Fig 6). Ces Ig, bien que de structures similaires, présentent des fonctions effectrices différentes. Les IgM, sous forme pentamérique, sont les premiers détectables lors d’une réponse immunitaire.
Les IgG sont les Ig majoritaires dans le sang et dans l’espace extravasculaire. Quatre sous types d’Ig existent (IgG1 à 4), et permettent une élimination très efficace des pathogènes sanguins notamment les virus et bactéries. Les IgE sont concentrées dans les muqueuses où elles induisent le relargage d’histamine par les mastocytes et sont impliquées dans les réactions allergiques (Gould and Sutton, 2008). Enfin, les IgA sont spécialisées dans l’élimination des bactéries au sein des muqueuses (Woof and Kerr, 2004), de la peau, et sont présents dans les sécrétions glandulaires (mucus, colostrom entre autres).
Les 5 classes d’Ig sont déterminées par la portion constante de la chaine lourde dont les différences de structure confèrent aux différentes classes d’Ig des propriétés effectrices.
32
Figure 6: Les isotypes d’immunoglobulines
Chaque immunoglobuline est composée d’au moins 2 chaînes lourdes (VH, en bleu) et 2 chaînes légères (VL, en vert) associées entre elles par un ou plusieurs ponts disulfures. Les IgG, IgA, IgE et IgD ont deux domaines par chaîne légère et 4 par chaîne lourde. Les IgA sont le plus souvent associés en dimères par une chaîne J entre les premiers domaines constants de chaque monomère. Les IgM sont le plus souvent sous forme pentamérique liés par 4 liaisons disulfides ainsi que par une chaîne J.
D’après Actor et al, Immunology and Microbiology Chapter 3
Alors que les LB naïfs n’expriment à leur surface que des IgM et IgD, différents types d’Ig sont exprimés puis sécrétés au cours de la réponse immunitaire (Hennig et al., 2014).
Nous avons vu précédemment que le gène codant les Ig était constitué de plusieurs fragments géniques codant les régions variable et constante. Les portions codant les 5 différentes régions constantes µ, $, %, & et ' sont placées en aval du fragment VDJ réarrangé (Fig 7). Au cours du développement des LB, seul le domaine µ est utilisé. Le domaine $ est utilisé à partir du moment où le LB quitte la moelle osseuse pour rejoindre les OLS par un épissage alternatif du gène IgH : une petite région répétée riche en G entre Cµ et C$ peut parfois constituer un site accepteur cryptique pour Sµ médiant une commutation de classe non canonique par épissage alternatif (Arpin et al., 1998) (Enders et al., 2014).
33
Suite à la rencontre avec l’antigène, les domaines constants ', & et % doivent être exprimés pour permettre l’expression d’IgG, IgE et IgA à la place des IgM et IgD exprimés par les LB naïfs.
Cela résulte de la commutation de classe qui consiste à remplacer le gène codant la partie constante de la chaine lourde Cµ par un gène codant une autre partie constante, telle que C', C% ou C& (Fig 7) (Chaudhuri et al., 2007)(Xu et al., 2012).
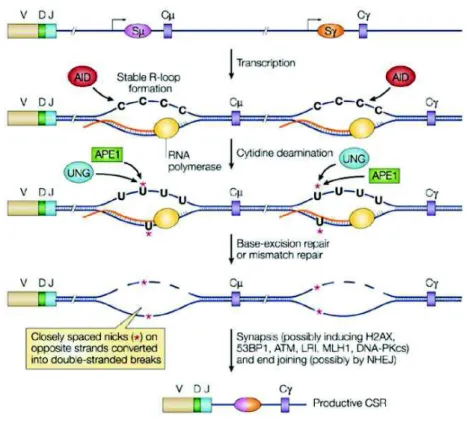
Chaque portion génique codant une partie constante d’Ig est précédée d’une région dite de « switch (S) » de 1 à 10kb constituée d’une séquence riche en C/G répétée. La commutation se fait entre deux sites S, un donneur et un accepteur, au cours de la réplication de l’ADN grâce à l’enzyme AID déjà impliquée dans le processus de SHM vu précédemment. L’AID agit sur l’ADN simple brin et nécessite donc l’ouverture de la double hélice d’ADN au moment de la transcription.
Figure 7: La commutation de classe
L’AID (activation-induced deaminase) désamine les résidus cytidine des régions switch. L’action du complexe de réparation de l’ADN provoque des cassures double brins par excision des bases anormales. Les extrémités sont alors liées entre elles par le complexe de jonction non-homologue (NHEJ) accolant le domaine VDJ au domaine constant en aval de la région switch désaminée. D’après Chaudhuri & Alt, Nat Rev Immunol 2004
34
La déamination par l’AID de plusieurs bases C au sein des séquences C/G répétées conduit à la formation de nombreux appariements U:G (Maul et al., 2011). La machinerie de réparation de l’ADN intervient alors, la base U est éliminé ce qui conduit à une cassure double brin de l’ADN.
Lorsqu’une cassure double brin a lieu dans deux régions S, l’ADN entre ces deux régions est excisé et les deux régions S accolées et jointes.
L’induction du switch isotypique dépend de plusieurs signaux envoyés par l’environnement des centrocytes. L’expression de l’AID est activée lors de la rencontre avec le LT dans le cas d’un antigène dépendant, ou suite à l’activation de plusieurs BCR simultanément dans le cas d’un antigène T-indépendant. L’activation de TLR et de récepteurs de la famille des Tumor Necrosis Factor Receptor (TNF-R) tels que BAFF-R, TACI (transmembrane activator and calcium modulator and cytophilin interactor) et BCMA (B cell maturation antigene) participe également à cette activation (Castigli et al., 2005).
II. La molécule CD20
II.1 Découverte et expression
En 1980, un anticorps spécifique des lymphocytes B a été découvert par l’équipe de Schlossman et Stashenko grâce à l’immunisation de souris par des cellules tumorales issues d’un lymphome de Burkitt. Cet anticorps, appelé anti-B1, a permis de mettre en évidence l’antigène CD20, nouveau marqueur spécifique des lymphocytes B (Stashenko et al., 1980).
L’expression de CD20 débute au stade pré-B du développement des LB et se termine au stade
plasmoblaste : les cellules pro-B et plasmocytes sont CD20- (Yamamura and Miyake, 2012).
De manière intéressante, cet antigène est conservé sur les LB tumoraux de leucémies et lymphomes, ce qui en a rapidement fait une cible thérapeutique potentielle (Nadler et al., 1981).
Bien que CD20 soit considéré depuis sa découverte comme un marqueur de la lignée B, quelques cas de lymphocytes T exprimant faiblement le CD20 ont été observés (Takami et al., 1998) (Sun et al., 2004) mais
l’existence des LT CD3+ CD20+ demeure controversée (Henry et al., 2010).
II.2 Le gène CD20
Le gène CD20 humain est localisé sur le chromosome 11 dans la région q12-q13 au sein d’un cluster de gènes appartenant à la famille MS4A (Tedder et al., 1989a). Cette famille regroupe 16 gènes (Zuccolo et
35
al., 2010) codant des protéines transmembranaires de séquences et structures similaires à CD20. Les plus connues outre CD20 sont la sous-unité du récepteur de haute affinité pour les IgE codée par le gène ms4a2, et la protéine adaptatrice HTM4 impliquée dans la régulation du cycle cellulaire et codée par ms4a3. Les séquences codant ces protéines présentent une forte homologie de séquences entre elles, principalement concernant les portions codant les 3 premiers segments transmembranaires. Cette homologie suggère une évolution de ces gènes depuis un précurseur commun.
Le gène cd20, également nommé ms4a1, a une taille de 15 kb et est composé de 8 exons. Le premier contient plusieurs sites d’initiation de transcription potentiels conduisant à des pré-ARNm de tailles différentes. Trois ARNm matures ont par ailleurs été observés. L’ARNm majoritaire a une taille de 2.8Kb et est composé des exons I, II et III en totalité. Deux ARNm alternatifs résultant de la présence de différents sites d’épissage en 5’ ont également été décrits (Tedder et al., 1989b) : l’un de 2.6Kb formé de l’exon I et de la seconde moitié de l’exon III, et un de 3.4Kb contenant en plus des exons I, II et III une large portion de l’extrémité 5’ du gène. Ces différents variants alternatifs de CD20 codent tous la même protéine puisque la région codante début au sein de l’exon 3 et est présente de manière identique au sein des 3 transcrits.
La traduction commence au 193ème nucléotide de l’exon 3 et se termine au 215ème nucléotide de l’exon 8
produisant une séquence codante de 894pb.
II.3 La protéine CD20
II.3.1 Structure
La protéine CD20 est ancrée dans la membrane plasmique grâce à 4 domaines transmembranaires. Les extrémités N-terminale (N-ter) et C-terminale (C-ter) sont intracytoplasmiques, et deux boucles extra cellulaires ont été mises en évidence : une petite d’environ 6 acides aminés (AA) entre les premier et deuxième segments transmembranaires, et une beaucoup plus importante de 40AA entre les 3èmes et
4ème segments transmembranaires. À l’intérieur de cette boucle, un pont disulfure relie les AA 163 et 187
créant une structure tridimensionnelle particulière qui s’avèrera être primordiale pour la reconnaissance de CD20 par certains anticorps monoclonaux (AcMo). À noter que l’existence de la plus petite des deux boucles extracellulaire a longtemps été soumise à controverse (Polyak et al., 1998), mais le développement d’anticorps monoclonaux ciblant un épitope conformationnel composé en partie de cette petite boucle semble définitivement confirmer sa présence (Teeling et al., 2006).
36 II.3.2 Fonctions
Malgré de nombreuses études publiées sur le sujet, la fonction précise de CD20 demeure mal comprise. Sa structure à 4 segments transmembranaires n’est pas sans rappeler celle des canaux ioniques, et plusieurs résultats montrent un rôle dans la signalisation calcique induite par la stimulation du BCR sans pouvoir pour autant conclure sur le rôle exact de CD20 (Li et al., 2004)(Walshe et al., 2008).
II.3.2a Signalisation du BCR et flux calcique
Les lymphocytes B font partie des principaux acteurs de l’immunité adaptative, en répondant aux pathogènes par une prolifération, différenciation, mais surtout la présentation d’antigènes aux lymphocytes T et la production d’anticorps spécifiques des antigènes reconnus. Le développement et la fonction des LB sont principalement déterminés par la signalisation via son récepteur de haute affinité pour les antigènes, le BCR (Fig 8).
37
Figure 8: Signalisation du récepteur à l’antigène des lymphocytes B (BCR)
(Haut) La fixation d’un antigène (1) sur le BCR active une cascade de protéines kinases (LYN, SYK) (2) par l’intermédiaire des co-récepteurs CD79a et b, ce qui conduit à la phosphorylation de PLC! (3) responsable de l’activation de nombreux facteurs de transcription (AP-1, NFkB, NFAT) par les voies de signalisation calciques (4), RAS/RAF/MEK/ERK (5) PI3K/AKT (6)(7).
(Bas) La signalisation du BCR est inhibée par CD22 et le récepteur Fc!RIIb qui recrutent les phosphatases SHP1 et SHIP1. D’après Packar & Cambier, F1000Prime Rep
Le BCR est composé d’une immunoglobine membranaire associée à deux protéines CD79a et CD79b transmembranaires reliées par une liaison disulfure. Cet hétéro-dimère également nommé Ig%/Ig* est le module de transduction du signal lors de la reconnaissance d’un antigène par le BCR. Les motifs tyrosine d’activation des immuno-récepteurs (ITAM) situés aux extrémités C-ter sont phosphorylées par des protéines tyrosine kinase telle que LYN. Les résidus ITAM ainsi phosphorylés recrutent la kinase SYK qui
38
sera elle-même activée par phosphorylation pour activer d’autres kinases du signalosome telle que la phospholipase C' (PLC'). L’activation des voies PI3K/AKT et MEK/ERK entre autres conduisent à la translocation nucléaire de facteurs de transcription régulant la présentation de l’antigène, la production de cytokine, la prolifération ou encore la différenciation des LB (Packard and Cambier, 2013).
LYN phosphoryle également les résidus ITIM (immunoreceptor tyrosine-based inhibitory motifs) des protéines inhibitrices de l’activation du BCR que sont CD22 et Fc'RIIb, ce qui conduit au recrutement des phosphatases SHP1, SHIP1 et PTEN qui par déphosphorylation des protéines SYK et CD79, entre autres, vont permettre la régulation des voies de signalisation en aval du BCR. Cette régulation est primordiale pour le contrôle de l’activation des LB puisque l’absence de ces protéines régulatrices conduit à une production anormale d’auto-anticorps, symptômes du développement d’auto-immunité (Pao et al., 2007) (O’Keefe et al., 1999).
La modulation de la concentration en calcium intracellulaire constitue dans tous les types de cellules l’une des principales voies de régulation de processus cellulaires telles que la prolifération et l’apoptose. Les ions calcium participent à la perméabilisation mitochondriale et au relargage du cytochrome-c et accélèrent la formation de l’apoptosome (Mattson and Chan, 2003).
Lors de la reconnaissance d’un antigène par un LB, la voie de signalisation du BCR est activée et conduit à la libération du calcium contenu dans les organites intracellulaires dont le réticulum endoplasmique. La diminution des stocks intra-cellulaires de calcium provoque une entrée de calcium via des canaux ioniques membranaires. Cet efflux ionique, fréquemment nommé « SOCE » (store-operated calcium entry), passe en grande majorité par des canaux formés par les protéines ORAI1 (Calcium release-activated calcium channel protein 1) et STIM1 (Stromal Interaction Molecule 1) (Fig 9).
39
Figure 9: Flux calcique déclenché par l’activation du BCR
(Haut) En absence d’activation du BCR les stocks d’ions calcium des réticulums endoplasmiques sont pleins et le domaine en main EF de STIM1 est occupé par un ion Ca2+.
(Bas) L’activation du BCR active les kinases LYN et SYK qui activent à leur tour la phospholipase-C gamma (PLC!) (1). Cette dernière hydrolyse du phosphatidylinositol4,5diphosphate (PIP2) en inositol tri-phosphate (IP3) et diacylglycérol (DAG). L’IP3 se fixe sur des récepteurs ancrés dans la membrane du réticulum endoplasmique (RE) ce qui provoque le relargage d’ions calciums (Ca2+) dans le cytoplasme (2). La diminution de la teneur en Ca2+ dans le RE est détectée par STIM1 qui s’homodimérise et transloque vers la membrane plasmique pour s’associer aux tétramères d’ORAI1 formant un canal calcique transportant les d’ions Ca2+ vers le RE pour restaurer les stocks en Ca2+ (3).
II.3.2b CD20, BCR et flux calcique
La protéine CD20 a été associée lors de nombreuses études à la signalisation en aval du BCR et particulièrement aux voies de signalisation calcique.
Une association entre CD20 et les chaines légères d’IgM et Igµ a été observée au sein des radeaux lipidiques de LB non activés grâce à des expériences d’immunoprécipitation (Polyak et al., 2008). Lors de l’activation du BCR, ce dernier se dissocie de CD20 avant d’être internalisé. La déplétion en cholestérol des
40
cellules, qui conduit à la dégradation des radeaux lipidiques, n’empêche pas la colocalisation de CD20 et du BCR mais en revanche ralentit leur dissociation suite à l’activation du BCR (Petrie and Deans, 2002). Une autre preuve en faveur d’un lien étroit entre les protéines CD20 et BCR est la démonstration d’une voie de signalisation commune en aval de ces deux molécules : l’effet des stimulations du BCR et de CD20 est abrogé identiquement par l’inhibition des kinases SYK, PI3K et Sérine/Thréonine Kinases (STK). Les flux calciques déclenchés par les voies de signalisation du BCR et de CD20 sont tous deux inhibés par le récepteur Fc'RIIb, récepteur inhibiteur responsable de la régulation négative de l’activation du BCR (Walshe et al., 2008).
En plus d’une association claire avec le complexe du BCR, de nombreuses études sont en faveur d’une implication de CD20 dans la signalisation calcique.
En 1993 Bubien et Tedder ont démontré qu’une expression ectopique de CD20 dans des lignée humaines initialement CD20 négatives augmente la conductance du calcium suite à la déplétion des stocks intracellulaires par la thapsigargin (Bubien et al., 1993). Les mêmes résultats ont été obtenus par l’équipe de Julie Dean qui a également montré que cette entrée de calcium était dépendante de la localisation de CD20 au sein des radeaux lipidiques (Li et al., 2003). Le développement d’un modèle murin pour lequel le
gène CD20 est inactivé (cd20-/-) révèle, malgré un développement et une maturation normale des LB, une
altération du flux transmembranaire de calcium dans les LB cd20-/- suite à la stimulation du BCR (Uchida
et al., 2004). De plus, une corrélation a été établie entre la génération de flux calcique à l’intérieur de lignées et l’expression du BCR : aucun flux calcique n’est déclenché après stimulation de CD20 dans des lignées ne possédant pas de BCR alors qu’un fort flux est observé chez les mêmes cellules exprimant fortement les protéines du BCR (Walshe et al., 2008).
L’ensemble de ces études semble corroborer l’hypothèse selon laquelle CD20 est une molécule impliquée dans la signalisation calcique en aval du BCR. Malgré la très forte similitude de structure entre le canal calcique ORAI1 et CD20, il semblerait que CD20 ne puisse être un canal calcique à part entière comme l’est ORAI1 en raison d’un manque de spécificité envers le calcium : des AA glutamate au sein des segments transmembranaires d’ORAI1 confèrent une grande affinité du canal pour les ions calcium. En revanche CD20 pourrait être un canal calcique annexe, responsable de la régulation de l’entrée calcique de type SOCE. Par ailleurs, l’absence d’impact majeur provoqué par l’inactivation de CD20 prône un rôle secondaire de cette protéine.
41
Chapitre 2 : Le Rituximab et autres Anticorps Monoclonaux anti-CD20
⑩❶
Hémopathies B
I.1 Lymphomes B
I.1.1 Évènements oncogéniques au cours du développement des LB
I.1.1a Les translocations
Parmi les lymphomes diagnostiqués dans le monde, 95+ sont d’origine B pour seulement 5+ d’origine T. Cette très grande prévalence s’explique par d’importants facteurs de risques de survenue d’anomalies au niveau de l’ADN au moment de plusieurs processus accompagnant le développement des lymphocytes B.
Environ 15 lymphomes B sont répertoriés par la classification de l’organisation mondiale de la santé basée sur les différences de pathogenèse mais également de traitement de ces diverses formes de lymphome B. Les différents lymphomes sont caractérisés par le stade de développement auquel se trouve le clone malin d’origine et par les propriétés acquises par ce clone (Fig 10).
Une grande majorité des lymphomes se développe à partir de cellules formant les CG (CG) ou issues de ces CG. Les hypermutations somatiques ainsi que la commutation de classe que subissent les centroblastes en forte prolifération augmentent le risque de survie d’un clone malin.
De nombreuses translocations chromosomiques sont impliquées dans l’oncogenèse des lymphomes et concernent le plus souvent les régions codant les chaines lourdes d’Ig (IgH)et certains oncogènes. Les cassures double brin de l’ADN au moment du réarrangement de la région variable du BCR et de la commutation de classe favorisent la survenue de ces anomalies chromosomiques.
42
Figure 10: Anomalies génétiques à l’origine de lymphomes B
La suractivation de l’oncogène myc par translocation chromosomique lors de la prolifération des centroblastes est à l’origine du lymphome de Burkitt.
Une dérégulation de l’expression de BCL-6 par les centroblastes est impliquée dans la survenue du lymphome B diffus à grandes cellules (DLBCL). Une inactivation du gène suppresseur de tumeurs PRDM1 (positive-regulatory-domain containing 1) inhibiteur de BCL-6 provoque un blocage de prolifération des plasmoblastes favorisant la survenue de DLBCL de type ABC (activated-B cells). La dérégulation de pax5 suite à une translocation chromosomique est associée aux lymphomes lymphoplasmacytoïdes (LPL). La surexpression de BCL-2 suite à une translocation chromosomique inhibe l’apoptose des centrocytes ce qui est une caractéristique des lymphomes folliculaires. Une surexpression de NFkB est par ailleurs fréquemment observée dans les cellules tumorales. D’après Klein & Dalla-Favera, Nat Rev Immunol 2008
Une translocation entre les chromosomes 11 et 14 impliquant le gène bcl-1 et celui codant la chaine lourde de l’Ig (IgH) est observée dans une grande majorité des cas de lymphomes à cellules du manteau (Meggendorfer et al., 2013). Cette translocation, qui constitue le premier évènement oncogénique, a lieu au moment du réarrangement VDJ dans la moelle osseuse et provoque une surexpression de la Cycline D1. Les anomalies supplémentaires nécessaires au déclenchement de la tumorigenèse surviennent au
niveau de cellules pré-germinales matures naïves LB CD5+ localisées dans la périphérie du follicule appelée
zone du manteau (Jares and Campo, 2008).
Les même types d’évènements conduisent au développement de lymphomes folliculaires : une translocation (14;18) place le gène bcl-2 sous le contrôle des séquences régulatrices des gènes codant les chaînes lourdes d’Ig ce qui induit une surexpression de BCL-2. 60% des patients atteints de cette pathologie sont porteurs de la translocation qui surviendrait là encore lors du réarrangement des gènes VDJ dans la