EFFETS DE LA COMBINAISON D'ACIDES GRAS
OMÉGA-3 À LONGUE CHAINE ET DE LEUCINE
SUR LA SENSIBILITÉ DU MÉTABOLISME
PROTÉIQUE À L'INSULINE CHEZ LES
BOUVILLONS
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en sciences animales
pour l'obtention du grade de Maître es Sciences (M.Sc.)
DEPARTEMENT DES SCIENCES ANIMALES
FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION UNIVERSITÉ LAVAL
QUÉBEC
2010
La sensibilité musculaire à l'insuline est associée à l'efficacité à synthétiser des protéines
chez le bouvillon. Cette sensibilité décroit tout au long de la vie, peut être améliorée par un
enrichissement des membranes musculaires en acides gras oméga-3 à longue chaine
(AGn-3LC) et cette réponse est proportionnelle à la quantité d'huile ingérée.
Indépendamment de la signalisation de l'insuline, la leucine peut également augmenter la
synthèse protéique. La présente étude montre qu'une injection abomasale quotidienne de
leucine haussant la concentration de leucine libre de 22 % dans le muscle combinée à une
perfusion continue et modérée de sept semaines d'huile de menhaden dans l'abomasum
enrichissant les glycérophospholipides du muscle semi-tendineux en AGn-3LC de 107 %
n'a pas augmenté l'utilisation corporelle du glucose ou des acides aminés de façon
synergique. Cette étude contribue au développement de la compréhension de la
régulation de l'anabolisme protéique des bovins en croissance par les AGn-3LC.
Abstract
Muscle sensitivity to insulin is associated with the efficiency in building proteins in steers and it decreases throughout life. It may be improved by the enrichment of muscle membranes in long-chain omega-3 polyunsaturated fatty acids (LCn-3PUFA) and the effect is dose-dependent to the dietary amount of oil. Leucine may also increase protein synthesis independently of insulin signaling. This study shows that a daily abomasal bolus administration of leucine raising the concentration of the free leucine pool by 22 % in muscle homogenates combined with a continuous seven-week moderate infusion of menhaden oil in the abomasum enriching glycerophospholipids of the semi-tendinosus muscle in LCn-3PUFA by 107 % did not differentially regulate the whole body glucose or amino acid disposals, as measured using the clamp technique. This study contributes to developing of the understanding of the regulation of protein anabolism in growing cattle by LCn-3PUFA.
Avant-propos
Un professeur m'a dit un jour avec le sourire en coin: « Une maîtrise, ça demande beaucoup de travail. Il faut vraiment vouloir en faire une pour pouvoir la terminer ». C'est seulement maintenant que je suis en mesure de comprendre ce sourire. Sous une vaste gamme d'expériences et d'émotions, ce projet m'a permis de contribuer à l'avancement des savoirs et de développer un nombre incalculable de compétences.
Je dois tout d'abord l'aboutissement de cette aventure à ma patiente directrice de maîtrise, la Dre Carole Thivierge, pour m'avoir fait confiance, pour sa supervision tantôt entre des pompes qui sonnent, tantôt depuis l'autre côté de l'océan et pour m'avoir fait découvrir les joies de l'habit de chirurgien à bottes de caoutchouc. Rien n'aurait été possible sans tes
idées, ton soutien et tes courriels. Merci Carole!
Pour sa disponibilité, ses conseils et les souvenirs de gants jusqu'à l'épaule, merci à mon codirecteur, le Dr Yvan Chouinard.
Merci au Conseil de recherches en pêche et agriculture du Québec, à la Fédération des producteurs de bovins du Québec, au Département des sciences animales, à l'Institut des nutraceutiques et des aliments fonctionnels, à la Faculté des sciences de l'agriculture et de l'alimentation de l'Université Laval et à Omega Protein inc. sans qui cette étude n'aurait pu se réaliser.
Un merci particulier pour les importants soins apportés par Richard Prince et O'Neil Fecteau à des animaux parfois doux, parfois rudes, mais toujours plus gros. Un merci spécial à Jérôme-Alexandre Maltais et Antoine Thuard pour leurs contributions dans la réalisation de cette étude. Un merci bien spécial à Micheline Gingras et Lyne Berthiaume pour les très complexes analyses de laboratoire et à Yvon Couture et Pascal Dubreuil pour les chirurgies et le suivi vétérinaire. Je salue également les consoeurs et confrères pour les uniques discussions de congélateur, d'escaliers et de micro-ondes.
et mes amis. Un merci particulier à mon père sans qui les études universitaires auraient
été beaucoup plus ardues.
Table des matières
Résumé ii Abstract iii Avant-propos iv Table des matières vii Liste des tableaux ix Liste des figures x Liste des abréviations (françaises et anglaises) xii
Introduction 1 Chapitre 1. Revue des travaux antérieurs 4
1.1. Métabolisme protéique des muscles squelettiques chez les bovins en croissance. 4
1.1.1. Régulation de la synthèse protéique par mTOR 6 1.1.2. Mécanismes régulant la dégradation protéique 9
1.1.3. Autres voies de régulation 9 1.1.3.1. Influence des apports alimentaires 9
1.1.3.2. Coordination hormonale 12
1.1.3.2.1. Glucagon 12 1.1.3.2.2. Somatotrophine 12
1.1.3.2.3. IGF-1 12 1.1.3.2.4. Insuline 13
1.1.3.2.4.1. Mesure de l'action de l'insuline sur l'anabolisme protéique 14 1.1.3.2.4.2. Voie de signalisation intracellulaire de l'insuline dans le muscle. 15
1.1.3.3. Stimulation de la synthèse protéique par les acides aminés 16 1.1.3.3.1. Effets additifs de l'insuline et des acides aminés sur l'anabolisme
protéique du muscle squelettique 17 1.1.3.3.2. Modulation par les acides aminés de l'action de l'insuline sur le
métabolisme du glucose 20 1.1.4. Régulations dues à la progression de la croissance 21
1.1.4.1. Déclin de la sensibilité musculaire à l'insuline avec l'âge et la maturité...24
1.1.4.2. Implication de l'IGF-1 dans la progression de l'âge et la maturité 25
1.2. Lipides et fonctions physiologiques 25
1.2.1. Acides gras 26 1.2.1.1. Participation à des molécules complexes 27
1.2.1.1.1. Glycérophospholipides 27 1.2.1.1.1.1. Membranes cellulaires 27
1.2.1.1.2. Triacylglycérols 28 1.2.1.2. Sources d'acides gras 29
1.2.1.2.1. Métabolisme des acides gras 29 1.2.1.2.2. Acides gras fournis par l'alimentation 30
1.2.1.2.2.1. Digestion et absorption des lipides alimentaires 30 1.2.1.2.2.2. Modification de la composition des lipides corporels par une
alimentation riche en AGn-3LC 31 1.2.1.2.2.3. Incorporation préférentielle des n-3 dans les
glycérophospholipides 34
1.3. Rations riches en AGn-3LC 35 1.3.1. Influence des glycérophospholipides sur l'action de l'insuline 35
1.3.1.1. Effet de l'environnement lipidique sur le fonctionnement des protéines
intramembranaires 35 1.3.1.1.1. Influence des AGn-3LC sur les récepteurs insuliniques du muscle..37
1.3.2. Diminution de l'accumulation des triacylglycérols 38 1.3.2. Régulation de l'utilisation des acides aminés et du glucose 39
Liste des ouvrages cités 44 Chapitre 2. Étude réalisée 61
2.1. Impact 62 2.2. Abstract 63 2.3. Introduction 64 2.4. Material and Methods 65
2.5. Results 73 2.6. Discussion 84 2.7. Conclusion 88 2.8. Acknowledgements 89 2.9. References 90 Conclusions générales 95
Liste des tableaux
Table 2.1. Feed and chemical compositions of the basal diet 67
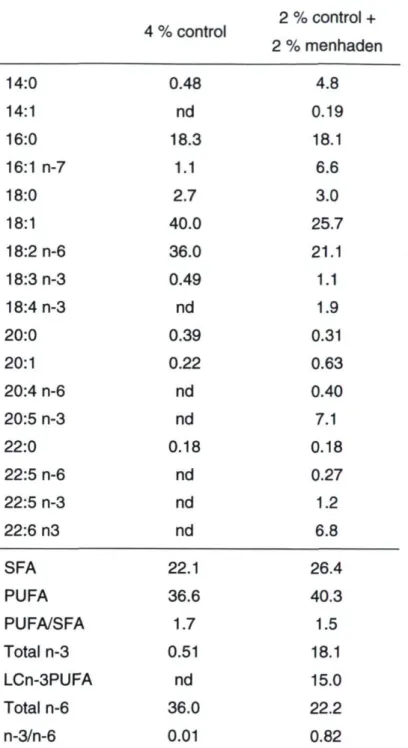
Table 2.2. Fatty acid composition of experimental oils (% of total) 69
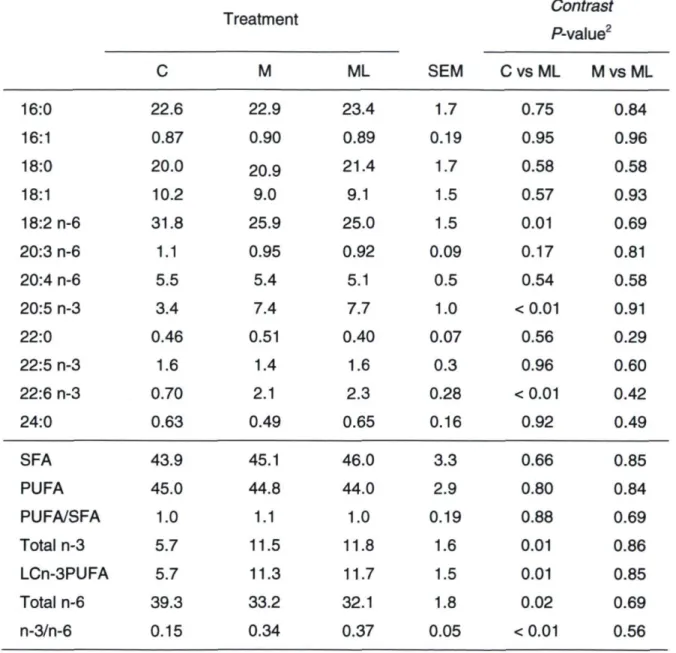
Table 2.3. Fatty acid composition (% of total) of the semi-tendinous membrane
phospholipids of steers enterally administrated during 7 continuous weeks a
control oil or a menhaden oil mixture that provided 15% LCn-3PUFA with or
without an iso-nitrogenous leucine supplement 74
Table 2.4. Fatty acid composition (% of total) of semi-tendinous intramuscular
triglycerides of steers enterally administrated during 7 continuous weeks a
control oil or a menhaden oil mixture that provided 15% LCn-3PUFA with or
without an iso-nitrogenous leucine supplement 76
Table 2.5. Performance measured during the experiment with plasma insulin
concentrations measured during pre-clamp, clamp periods and during the
amino acid injection trial of steers enterally administrated during 7
continuous weeks a control oil or a menhaden oil mixture that provided 15%
Figure 1.1. Principales voies métaboliques responsables du maintien de l'homéostasie
de la protéine corporelle et des acides aminés 5 Figure 1.2. Schéma de l'activation de la voie de signalisation mTOR régulant la
synthèse protéique dans les cellules musculaires 7 Figure 1.3. Évolution des taux de synthèse (•) et de dégradation (o) protéiques en
fonction de la quantité ingérée d'aliments chez plusieurs espèces en croissance (au-dessus de l'équilibre du bilan énergétique) et adultes (en
deçà de l'équilibre du bilan énergétique) 11 Figure 1.4. Relation entre le taux fractionnel de synthèse protéique musculaire et la
concentration en insuline plasmatique et le chez le rat recevant en perfusion diverses quantités d'insuline avec (o) ou sans (•) perfusion
d'acides aminés 19 Figure 1.5. Synthèse et dégradation des protéines en fonction de la croissance chez
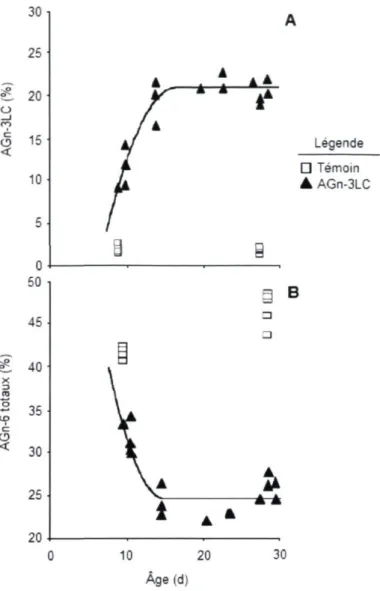
les bovins 23 Figure 1.6. Composition en AGn-3LC (A) et en AGn-6 totaux (B) des
glycérophospholipides des membranes du longissimus dorsi en fonction de l'âge chez des porcelets nouveau-nés nourris d'un lactoremplaceur riche
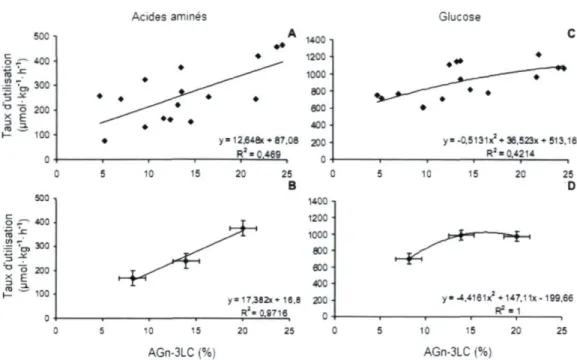
en AGn-3LC 34 Figure 1.7. Régressions entre les taux d'utilisation des paramètres mesurés durant un
verrouillage à 40 mUkg-1 h-1 d'insuline et le contenu en AGn-3LC des glycérophospholipides totaux du muscle semi-tendineux chez le bouvillon
en croissance 41 Figure 2.1. Plasma concentrations of individual or certain sums of amino acids during
the pre-clamp period of a steady nutritional state fed every 2 h in steers administrated either 0, 2% of menhaden oil or 2% menhaden oil + leucine
over 7 consecutive weeks 78 Figure 2.2. Panel A: Plasma concentrations of branched-chain amino acids (BCAA)
and glucose during the pre-clamp and the clamp periods; Panel B: Net disposal rates of amino acids and glucose during the steady hour of a 40
mUkg"1h"1 insulin clamp 80
Figure 2.3. Pilot data showing the effects of bolus administrations of leucine or alanine on blood glucose or plasma leucine and alanine concentrations in steers in
Figure 2.4. Concentrations of free amino acids in mixed protein homogenates of the semi-tendinous muscle sampled following a 7-h period after the
administration of leucine or alanine boluses to steers in a nutritional
Liste des abréviations (françaises et anglaises)
4E-BP1: eukaryotic initiation factor 4E-binding protein 1 AAL : acide a-linolénique C18:3 n-3
ADH : acide docosahexaénoïque C22:6 n-3 AEP : acide eicosapentaénoïque C20:5 n-3
AGn-3/6LC : acides gras polyinsaturés oméga-3/6 à longue chaine (20 carbones et plus) Akt: Akt8 virus oncogene cellular homolog
AL : acide linoléique C18:2 n-6 AMP : adenosine monophosphate ATP : adenosine triphosphate
elF4E/G: eukaryotic initiation factor 4E/G
FYVE: Fablp, YOTB, Vadp, and EEA1 domain-containing proteins G LUT 1/4: glucose transporter type 1/4
hVps34: vacuolar protein sorting 34 homolog IGF-1 : insulin-like growth factor-1
IGFBP : insulin-like growth factor binding protein IR: insulin receptor
IRS-1: insulin receptor substrate-1
MAP4K3: mitogen-activated protein kinase kinase kinase kinase 3 MSI : matière sèche ingérée par jour
mTOR: mammalian target of rapamycin p70S6K: 70 kDa ribosomal S6 kinase PI3K: phosphoinositide 3 kinase PKB: protein kinase B
PRAS40: proline-rich Akt substrate 40 kDa P/S: acides gras polyinsaturés / saturés
PX: phox homology domain-containing proteins Rheb: Ras homolog enriched in brain
Présente partout au Québec, l'industrie bovine constitue un pilier important de notre agriculture et du développement des régions. Comme tout autre type de production animale, il est intéressant pour la production bovine québécoise de développer des stratégies permettant d'améliorer la rentabilité des entreprises afin d'assurer la compétitivité sur les plans national et international. L'efficacité alimentaire des animaux influence grandement la rentabilité des entreprises bovines et est étroitement liée à la capacité d'utiliser les nutriments absorbés pour le gain. Augmentée, cette efficacité permet de produire une viande dans de plus courts délais et/ou avec le moins d'aliments possible. Pour l'améliorer, les producteurs de plusieurs pays, notamment le Canada et les États-Unis, ont présentement recours à l'utilisation d'implants hormonaux. Toutefois, leur emploi devient de plus en plus controversé aux yeux des consommateurs qui se soucient davantage de leur santé et demandent des approches plus naturelles. Depuis janvier
1989, l'usage d'hormones servant à stimuler la croissance bovine a été interdit par l'Union Européenne, stoppant du même coup les importations de boeufs ayant reçu des implants en provenance du Québec. Nous pouvons affirmer avec certitude que la controverse entourant l'emploi d'implants stimulateurs de croissance est bel et bien établie. Depuis janvier 2004, une interdiction nord-américaine de l'utilisation d'implants a déjà été imposée dans la production de veaux lourds.
En partie dans le but de trouver des pistes alternatives à l'emploi de ces composés, de nouveaux concepts nutritionnels et leur application à la production de bovins ont contribué à l'amélioration de cette efficacité alimentaire au cours de la dernière décennie. Les besoins en macronutriments ont bien été établis et nous en sommes davantage au fin raffinement. Une approche basée sur la physiologie musculaire a ainsi été étudiée afin de moduler la synthèse des protéines musculaires des bovins lors de la croissance.
Les muscles squelettiques sont un site majeur de l'action de l'insuline (Borkman et coll., 1993). Toutefois, durant la période néonatale, le bouvillon y devient peu à peu résistant. La sensibilité à l'action de l'insuline du métabolisme du glucose est connue pour être reliée en partie au contenu en AGn-3LC des glycérophospholipides des muscles et ce contenu peut être augmenté par l'ingestion d'huile de poisson (Storlien et coll., 1987; Liu et coll., 1994; Behme, 1996; Andersen et coll., 2008). Ainsi, il a été montré chez le rat qu'une
l'insuline (Liu et coll., 1994). Chez le bouvillon, le métabolisme du glucose répond quadratiquement à un enrichissement des membranes en AGn-3LC, montrant une stimulation maximale à 15 % d'AGn-3LC et sans effet notable additionnel d'un enrichissement à 24% d'AGn-3LC (Fortin ef coll., 2009). En plus des effets sur le métabolisme du glucose, des études antérieures ont montré que l'administration d'huile de menhaden pouvait restaurer une certaine sensibilité du métabolisme protéique à l'action de l'insuline chez le bouvillon d'abattage. L'activation de la machinerie cellulaire de traduction menant à la synthèse des protéines a été augmentée par la phosphorylation accrue de la voie de signalisation Akt-mTOR-p70S6K (Gingras et coll., 2007). De plus, cette réponse du métabolisme des acides aminés à l'ingestion d'huile de menhaden serait proportionnelle à la dose alimentaire (Fortin et coll., 2009). Enfin, tel que mis en lumière par des cinétiques de phenylalanine chez des porcelets (Bergeron et coll., 2007) et une première étude sur les bouvillons (Gingras et coll., 2007), une alimentation riche en AGn-3LC réduirait l'oxydation des acides aminés.
Conjointement à l'insuline, les acides aminés favorisent la synthèse protéique de façon efficace par la phosphorylation de mTOR et de ses effecteurs, et la leucine joue un rôle important dans cette régulation (Crozier et coll., 2005; Rennie et coll., 2006; Yang et coll., 2008). Toutefois, il est reconnu que les acides aminés, et particulièrement la leucine, peuvent avoir un impact négatif sur le système de transport du glucose dans les muscles et dans d'autres tissus en inhibant certaines étapes critiques de la voie de signalisation insulinique au niveau de la phosphorylation de la PI3K (Traxinger et Marshall, 1989; Patti et coll., 1998).
Considérant que : 1) la sensibilité musculaire à l'insuline régulant l'utilisation des acides aminés peut être rétablie en partie par des apports alimentaires en AGn-3LC menant à leur incorporation dans les glycérophospholipides des muscles squelettiques; 2) les suppléments alimentaires d'huile de poisson sous forme de gras protégé coûtent cher; est-il possible qu'un supplément alimentaire de leucine produise un effet complémentaire lorsque combiné à un apport modéré en huile de menhaden et permette une amélioration de l'utilisation corporelle des acides aminés? En raison de l'altération du transport du glucose dans le muscle par la leucine, il peut potentiellement y avoir des effets négatifs à une telle combinaison sur la protéosynthèse et sur les taux d'utilisation des acides aminés
régulation des métabolismes du glucose et des acides aminés en effectuant des verrouillages métaboliques de glucose et d'acides aminés.
Nous avons émis l'hypothèse qu'un apport intra-abomasal modéré d'huile de menhaden combinée à un supplément physiologique de leucine améliore l'utilisation des acides aminés à un niveau supérieur à l'administration d'huile de menhaden seule chez des bouvillons en croissance qui sont en bonne santé
Les objectifs spécifiques de cette étude sont :
1 ) Déterminer l'enrichissement en AGn-3LC des glycérophospholipides membranaires et des triacylglycérols du gastrocneimus;
2) Établir l'impact d'une administration unique de leucine sur les concentrations plasmatiques de glucose et d'insuline ainsi que sur celles des acides aminés libres du muscle squelettique;
3) Mesurer l'effet de l'administration combinée de leucine et d'AGn-3LC sur la sensibilité musculaire à l'insuline des métabolismes du glucose et des acides aminés par la technique du verrouillage hyperinsulinémique-euglycémique-euaminoacidémique;
Pour réaliser ces objectifs, des bouvillons ont reçu une perfusion intraabomasale continue d'huile de menhaden riche en AGn-3LC ou un mélange isoénergétique d'une huile témoin ayant une composition en acides gras similaire au gras du bœuf. Certains bouvillons recevant l'huile de menhaden ont reçu également une dose unique et isoazotée de leucine une fois par jour, laquelle était également administrée de façon intraabomasale.
1.1. Métabolisme protéique des muscles squelettiques chez
les bovins en croissance
Tous les animaux requièrent des acides aminés pour fabriquer leurs protéines qui serviront à la croissance, à la reproduction, à la lactation et au maintien des fonctions physiologiques. Les protéines corporelles sont une composante dynamique de l'organisme puisque celles-ci sont constamment renouvelées. Un modèle à deux compartiments peut être utilisé pour schématiser les principales voies du métabolisme protéique et leurs composantes (figure 1.1). Ces principales voies responsables du maintien des tissus protéiques corporels et de l'homéostasie des acides aminés sont la synthèse et la dégradation protéique, l'oxydation des acides aminés et la synthèse de novo dans le cas des acides aminés non essentiels (Young et Marchini, 1990). Il y a donc dépôt protéique corporel lorsque le taux de synthèse protéique est supérieur à celui de dégradation. Le présent mémoire ne traitera pas en détail du métabolisme de chacun des acides aminés mais plutôt de certains mécanismes sous-jacents.
Le flux métabolique corporel total d'un acide aminé est, par définition, égal à la somme des sorties du ou des acide(s) aminé(s) marqueur(s) dans le compartiment sanguin central, soit les quantités oxydées, excrétées et utilisées pour la synthèse des protéines (Grizard et coll., 1988). Puisque lors d'un état métabolique stable (ou « steady state »), le
Synthèse, protéique! Acides aminés Synthèse de novo ■ \ Excrétion . \ C
i \
Protéines (lait) Dégradation protéique Oxydation Urée et CO2 IngestionFigure 1.1. Principales voies métaboliques responsables du maintien de l'homéostasie de la protéine corporelle et des acides aminés.
Les flèches représentent les flux d'acides aminés et ces derniers peuvent être exprimés en quantité d'acides aminés metabolises par unité de temps.
Source : adaptée de Young et Marchini, 1990, et de Grizard et coll., 1988.
égal à l'absorption intestinale et la dégradation des protéines (et la synthèse endogène pour un acide aminé non essentiel) (Grizard ei* coll., 1988). La synthèse et la dégradation protéiques sont les composantes dominantes du flux total corporel d'acides aminés (Grizard et coll., 1988). La contribution d'un tissu ou d'un organe au flux total de synthèse protéique corporelle n'est pas nécessairement proportionnelle pour tous les tissus, dépendant d'une part de la vitesse respective de renouvellement des protéines (%/jour) et d'autre part de la taille du compartiment protéique considéré (Grizard et coll., 1988). En guise d'exemple, l'ensemble des muscles squelettiques (environ 36 % du poids vif vide) synthétise environ 29 % des protéines corporelles totales chez l'agneau âgé d'une semaine (Bénévent, 1971 ; Attaix et Arnal, 1987; Attaix et coll., 1988).
En plus d'être utilisés pour la synthèse des protéines, les acides aminés peuvent être utilisés comme source d'énergie afin de maintenir la concentration de glucose sanguin dans un écart normal pour soutenir les activités quotidiennes et pour fournir le glucose supplémentaire lors d'urgences. Ainsi chez les ruminants, pour qui la majorité des glucides alimentaires fermentescibles sont dégradés par les micro-organismes du rumen, les précurseurs principaux du glucose sont le propionate et dans une moindre part les acides aminés (Brockman, 1978). Lorsque l'approvisionnement en acide propionique est limité et que les exigences pour l'homéostasie du glucose ne sont pas rencontrées, des sources alternatives sont utilisées, comme entre autres, les acides aminés provenant des protéines corporelles. De plus, pour satisfaire les besoins énergétiques, les réserves lipidiques corporelles sont en partie mobilisées.
1.1.1. Régulation de la synthèse protéique par mTOR
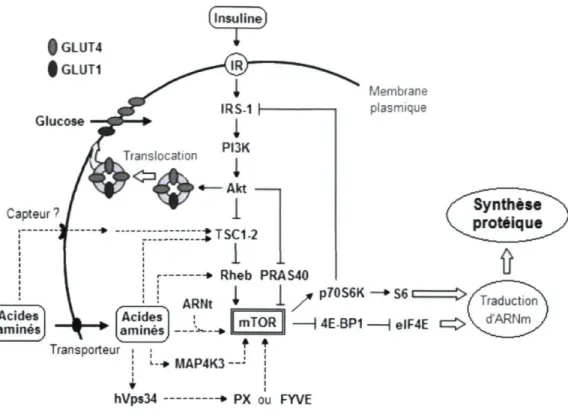
L'induction de la traduction de l'ARN messager est une phase essentielle et critique de l'initiation de la synthèse protéique. Cette induction passe par la protéine cible de la rapamycine des mammifères « mammalian target of rapamycin » (mTOR) qui y joue un rôle central dans le muscle squelettique (figure 1.2) (Dreyer et coll., 2006). En partie grâce à mTOR et à ses effecteurs, les cellules sont capables de détecter la teneur en nutriments de leur environnement direct et ainsi de s'adapter aux variations des apports sanguins de glucose et d'acides aminés (Yang et coll., 2008). La protéine mTOR est impliquée dans la
f GLUT1 Glucose Membrane plasmique MAP4K3 —' ~ » PX ou I
Figure 1.2. Schéma de l'activation de la voie de signalisation mTOR
régulant la synthèse protéique dans les cellules musculaires.
IR, insulin receptor, IRS-1, insulin receptor substrate-1; PI3K,
phosphoinositide 3 kinase; Akt, Akt8 virus oncogene cellular homolog;
TSC1-2, tuberous sclerosis complex-1-2, Rheb, Ras homolog enriched
in brain; PRAS40, proline-rich Akt substrate 40 kDa; GLUT1/4, glucose
transporter type 1/4; mTOR, mammalian target of rapamycine; p70S6K,
70 kDa ribosomal S6 kinase; BP1, eukaryotic initiation factor
4E-binding protein 1; S6, sous-unité ribosomale S6; elF4E, eukaryotic
initiation factor 4E; MAP4K3, mitogen-activated protein kinase kinase
kinase kinase 3; hVps34, vacuolar protein sorting 34 homolog; PX, phox
homology domain-containing proteins; FYVE, Fablp, YOTB, Vadp, and
EEA1 (early endosome antigen 1) domain-containing proteins.
Source : adaptée de Tremblay et coll., 2005; Haar et coll., 2007; Yang et
coll., 2008; Nobukuni et coll., 2007.
modulation des voies métaboliques et son sentier de régulation fait partie de la voie de signalisation de l'insuline (Xu et coll., 2001). Dans ce système, mTOR initie la traduction de l'ARN messager et la synthèse protéique par l'activation d'effecteurs proximaux dont les plus connus sont la p70S6K (aussi appelée S6K1) et la 4E-BP1 (Hara et coll., 1998; Dreyer et coll., 2006). La p70S6K est responsable de la phosphorylation de la petite sous-unité ribosomale S6. La phosphorylation de cette sous-sous-unité entraîne une augmentation de la traduction de certains ARNm encodant des protéines impliquées dans la synthèse protéique dont des protéines ribosomales et certains facteurs d'élongation (Pullen et Thomas, 1997; Tremblay, 2004). La 4E-BP1 (aussi appelé PHAS-1) régule la synthèse protéique à sa phase d'induction (Dreyer et coll., 2006). En fait, la 4E-BP1 liée à elF4E est un complexe qui est inhibiteur de la synthèse des protéines. Une fois phosphorylée, 4E-BP1 a une affinité réduite pour elF4E ce qui permet la formation d'un complexe avec elF4G pour ainsi permettre l'initiation de la traduction des ARNm.
1.1.2. Mécanismes régulant la dégradation protéique
De multiples voies protéolytiques sont responsables du recyclage des protéines pour le muscle squelettique, dont la voie lysosomale, la voie activée par le Ca2+, le système ubiquitine-protéasome et les proteases (par exemple, les caspases et la matrice métallo-protéases) (Whitehouse et coll., 2001; Combaret et coll., 2005). Des études récentes ont montré que la voie principalement responsable de la dégradation des protéines myofibrillaires est la voie dépendant du système ubiquitine-protéasome (Taillandier et coll., 2004). Ce système intracellulaire hautement spécifique est un système de marquage et de recyclage des protéines à dégrader. L'ubiquitination désigne la fixation spécifique d'une ou plusieurs unités ubiquitines (« tagging ») sur une protéine cible. Les protéasomes sont des complexes enzymatiques qui se trouvent dans le noyau, dans le cytosol et associés au reticulum endoplasmique (Peters er coll., 1994). La protéine musculaire est ainsi reconnue, marquée de plusieurs ubiquitines et découpée en peptides longs de 7 à 9 acides aminés par le complexe protéolytique du protéasome 26S. Ces acides aminés peuvent ensuite être recyclés.
La croissance somatique est le résultat d'interactions entre les facteurs environnementaux, l'approvisionnement de substrats à l'organisme par l'alimentation et le programme génétique (Breier et Gluckman, 1991). Le système endocrinien peut être envisagé comme le mécanisme par lequel ces interactions sont coordonnées et la croissance cellulaire est modulée (Breier et Gluckman, 1991).
1.1.3.1. Influence des apports alimentaires
Dans le cas des monogastriques, les acides aminés libres du sang proviennent de l'absorption par le tractus digestif des aliments digérés. Les acides aminés libres proviennent aussi du catabolisme des protéines corporelles. Le métabolisme protéique n'est pas constant au cours de la journée en raison, entre autres, de la prise intermittente d'aliments. Chez les ruminants par contre, les acides aminés absorbés proviennent en partie de la digestion des protéines microbiennes du rumen et des acides aminés alimentaires non dégradés dans le rumen (Kung et Rode, 1996). Les variations de l'état nutritionnel pendant la journée sont moins importantes chez les ruminants que chez les monogastriques, puisque les aliments séjournent dans le rumen et sa vidange est continuelle (Grizard et coll., 1988).
Les mécanismes par lesquels les aliments ingérés modulent les débits d'utilisation des acides aminés par les voies métaboliques sont nombreux. Parmis ceux-ci, on retrouve la loi d'action de masse selon laquelle toute augmentation de la concentration sanguine en substrat induit une augmentation de l'engagement d'un substrat dans une voie métabolique donnée (Grizard et coll., 1988; Young et Marchini, 1990). Ainsi, le taux d'oxydation de la leucine suit globalement, sur une période de 12 heures, la concentration en leucine plasmatique artérielle chez des vaches Holstein (Thivierge et coll., 2002). Ensuite, l'approvisionnement d'enzymes clées ou encore de molécules capables de réguler directement des enzymes clées peut également influer sur l'oxydation des acides aminés (Grizard et coll., 1988). Par exemple, la leucine absorbée peut être transaminée et ainsi produire l'acide a-céto-isocaproïque. Celle-ci inhibe la kinase responsable de l'inactivation de la déshydrogénase qui catabolise les trois acides aminés à chaine
ramifiée chez le rat (Block et coll., 1985). Ainsi, l'augmentation de la leucine absorbée stimule la dégradation de l'isoleucine et de la valine plasmatique chez des agneaux ayant ingéré des repas riches en leucine (Papet et coll., 1988).
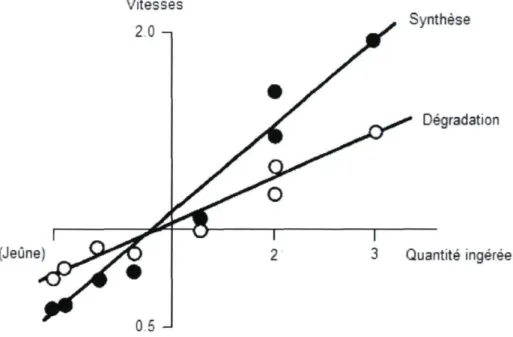
L'augmentation des quantités ingérées de nourriture au-delà du niveau permettant l'équilibre du bilan énergétique chez les animaux en croissance se traduit par une hausse de la masse protéique corporelle, à condition d'avoir un apport suffisant en acides aminés essentiels. Ceci se produit par une augmentation simultanée, mais supérieure, du taux de la protéosynthèse relativement à celui de la protéolyse (figure 1.3) (Reeds et Fuller, 1983). En effet, selon une étude effectuée chez des bouvillons en finition de 420 à 520 kg recevant une ration rencontrant 0 (jeûne), 100 ou 160 % des besoins en énergie d'entretien, la quantité de protéines synthétisées par les animaux était respectivement de 1740, 2100 et 2680 g/jour; tandis que celle de protéines dégradées était de 2037, 2090 et 2520 g/jour (Lobley et coll., 1987). Cette étude, jumelée aux résultats présentés à la figure 1.3, montre que proportionnellement à l'énergie ingérée, la synthèse protéique augmente à un taux supérieur relativement à la dégradation. Parallèlement, l'augmentation de la teneur en protéine de la ration, et plus particulièrement des teneurs en acides aminés essentiels, engendre aussi une augmentation des vitesses de synthèse et de dégradation des protéines corporelles chez le porc en croissance (Reeds et coll., 1981).
1.1.3.2. Coordination hormonale
Chez les ruminants comme chez les monogastriques, les flux d'acides aminés partagés entre la synthèse protéique et le catabolisme oxydatif sont régis par le système endocrinien (Brockman et Laarveld, 1986). Le contrôle endocrinien de la croissance implique des interactions complexes entre diverses hormones et facteurs de croissance, lesquelles peuvent agir systémiquement ou localement (Breier et Gluckman, 1991). Entre autres, le glucagon, l'insuline, les catecholamines, les glucocorticoïdes et l'hormone de croissance stimuleraient l'absorption hépatique des acides aminés essentiels (Fehlmann et coll., 1979).
(Jeûne)
Synthèse
Dégradation
Quantité ingérée
Figure 1.3. Évolution des taux de synthèse (•) et de dégradation (o) protéiques en fonction de la quantité ingérée d'aliments chez plusieurs espèces en croissance (au-dessus de l'équilibre du bilan énergétique) et adultes (en deçà de l'équilibre du bilan énergétique).
La synthèse, la dégradation et l'ingestion sont exprimés en nombre de fois la valeur constatée à l'équilibre du bilan énergétique.
1.1.3.2.1. Glucagon
Le glucagon est une hormone hyperglycémiante produite par le pancréas capable d'activer la néoglucogenèse, la glycogénolyse et la lipolyse (Brockman, 1978). En particulier, il favorise le prélèvement et la dégradation d'acides aminés par le foie chez le mouton (Brockman et coll., 1975) et permet la fabrication de glucose selon un mécanisme dépendant de l'AMP cyclique (Fehlmann et coll., 1979). À long terme, il peut donc être considéré comme une hormone catabolique (Brockman, 1978).
1.1.3.2.2. Somatotrophine
L'hormone de croissance bovine est une hormone polypeptidique produite par les glandes pituitaires. Elle stimule la croissance et la division cellulaires et augmente le catabolisme des gras. En effet, un apport exogène d'hormone de croissance chez le bovin augmente la synthèse protéique des muscles et du corps entier (Eisemann et coll., 1989a; 1989b). Toutefois, l'excès de cette hormone chez le mouton est associé à une diminution de la concentration et de l'action de l'insuline sur le métabolisme du glucose (effet diabétogène) (Parkes et Bassett, 1985). Son action sur la régulation de la croissance somatique peut se faire directement ou passer par une sécrétion d'IGF-1 de façon endocrine (par le foie) ou paracrine (par les tissus cibles) (Grizard et coll., 1988; Lobley, 1993). Il est maintenant documenté que la sécrétion de l'hormone de croissance diminue avec l'âge chez plusieurs espèces, incluant le bovin (Tucker et coll., 1974).
1.1.3.2.3. IGF-1
Tout comme l'hormone de croissance, le facteur de croissance IGF-1 est essentiel pour la croissance postnatale des mammifères (Breier et Gluckman, 1991) et continue à avoir des effets anaboliques chez l'animal adulte. L'IGF-1 est une hormone peptidique de 70 acides aminés qui possède une structure chimique semblable à celle de l'insuline. L'IGF-1 bovine et humaine est identique (Honegger et Humbel, 1986) et il est maintenant documenté qu'elle peut être produite par de nombreux sites (Daughaday et Rotwein, 1989). Elle circule en étant liée à des protéines de masse importante (IGFBP) afin d'accroitre sa demi-vie (Breier et Gluckman, 1991). Son action principale s'amorce avec la liaison à son récepteur présent sur plusieurs types de cellules et dans plusieurs tissus, ce récepteur
ayant une structure similaire à celui de l'insuline. L'IGF-1 peut également, dans une faible mesure toutefois, se lier à ce récepteur de l'insuline (Gluckman et coll., 1987) et mener à l'hypoglycémie.
1.1.3.2.4. Insuline
Cette hormone polypeptidique a des effets importants sur le métabolisme des protéines, glucides et lipides. Elle stimule l'incorporation des acides aminés dans les tissus corporels, incluant le foie et les muscles (Fafournoux et coll., 1982; Eckert et coll., 1999). Elle favorise l'entrée du glucose dans le muscle, le foie et les cellules adipeuses, et elle inhibe la néoglucogenèse (Eckert et coll., 1999). Enfin, elle stimule la lipogenèse dans le foie et les cellules adipeuses. Elle joue donc un rôle de premier ordre dans la disponibilité des substrats énergétiques en assurant un entreposage cellulaire de ces derniers (Brockman, 1978).
Les effets à court et long termes de l'insuline entrainent des réactions anaboliques essentielles à la croissance et au développement des tissus (Pessin et Saltiel, 2000). En plus de favoriser le transport de certains acides aminés au travers de la membrane plasmatique des cellules des muscles (Le Marchand-Brustel et coll., 1982), il est bien reconnu qu'elle favorise la synthèse protéique du muscle squelettique chez pratiquement toutes les espèces, tant monogastriques que ruminants. Par exemple, elle stimule la protéosynthèse chez le rat (Garlick et coll., 1983), l'utilisation des acides aminés chez le porcelet (Wray-Cahen et coll., 1998), l'utilisation des acides aminés et la synthèse protéique chez le fétus ovin (Liechfy et coll., 1992; Thureen et coll., 2000) et la synthèse protéique de l'arrière train chez l'agneau (Wester et coll., 2000).
L'insuline est sécrétée par les cellules B des îlots de Langerhans du pancréas en fonction de l'état nutritionnel et de l'activité physique. Ainsi, après les repas, la sécrétion d'insuline dans le sang est accélérée sous l'influence de la présence des aliments dans le tube digestif et de l'élévation de la glycémie chez les monogastriques (Marieb, 1999). Chez les ruminants, c'est principalement le propionate provenant du rumen qui est associé à la sécrétion d'insuline (Peters et coll., 1983). Tel que discuté précédemment, la quantité de nutriments livrés à l'intestin est plus constante chez les ruminants que chez les monogastriques. Une augmentation de la concentration en insuline plasmatique peut
néanmoins être enregistrée deux à quatre heures après un repas chez les ruminants (Brockman, 1978; Armentano er coll., 1984). De plus, une augmentation de l'insulinémie moyenne au cours de la journée peut être observée. Cependant, cette dernière augmentation s'expliquerait davantage par une réduction du catabolisme de l'hormone que par une augmentation de sa sécrétion (Grizard et coll., 1988).
L'insuline est une hormone anabolique ayant un effet majeur en réponse à un stimulus alimentaire (Pessin et Saltiel, 2000). Mais voyons comment peut se mesurer l'effet de cette hormone sur l'anabolisme protéique.
1.1.3.2.4.1. Mesure de l'action de l'insuline sur l'anabolisme protéique
Une perfusion exogène d'insuline dans le sang provoque une baisse de la concentration plasmatique d'acides aminés qui peut limiter la synthèse des protéines si la concentration en acides aminés n'est pas maintenue par un apport auxilière (Davis et coll., 2003). Cette chute de la concentration en acides aminés peut également stimuler les voies de dégradation des protéines (Wray-Cahen et coll., 1997). Une perfusion d'insuline exogène provoque également une baisse de la glycémie. Afin d'isoler les effets de l'insuline sur le métabolisme de la diminution des concentrations en acides aminés et de glucose sanguin, la technique de verrouillage des acides aminés à une concentration prédéterminée lors d'une hyperinsulinémie a été développée (Wray-Cahen et coll., 1997). Cette technique est utilisée conjointement avec un verrouillage de la concentration du glucose lors de l'hyperinsulinémie (DeFronzo et coll., 1979) et est nommée verrouillage hyperinsulimémique-euglycémique-euaminoacidémique. Elle permet le maintien de la concentration des acides aminés et du glucose à des concentrations prédéterminées, lors d'un apport exogène d'insuline, par des apports auxilières de glucose et d'un mélange d'acides aminés. La terminologie hyperinsulinémique signifie que la concentration de l'insuline est élevée au-dessus du niveaux de base; euglycémique signifie que la concentration du glucose est maintenue à la concentration basale; euaminoacidémique signifie que la concentration des acides aminés est maintenue aux concentrations basales. Les concentrations du glucose et des acides aminés sont généralement maintenues à plus ou moins 10 % des concentrations basales lors de l'utilisation de cette technique. Les effets sur l'utilisation des acides aminés et du glucose de l'insuline peuvent ainsi être isolés et mesurés. Il est aussi possible avec la technique de verrouillages
métaboliques de mesurer l'effet de l'insuline lors d'une hyperaminoacidémie (maintenir la concentration en acides aminés essentiels au-dessus du niveau de base) (Wray-Cahen ef coll., 1997). Cette méthode s'avère utile pour fournir un apport supérieur en acides aminés pour évaluer l'effet sur le métabolisme protéique. Lors de la période d'utilisation corporelle stable d'un verrouillage hyperinsulinémique, les taux d'utilisation des acides aminés s'expliquent en majorité par l'utilisation musculaire squelettique (55 %), selon des mesures faites chez l'humain (Ferrannini et coll., 1980; DeFronzo et coll., 1981).
Les apports alimentaires de nutriments influencent eux aussi la concentration sanguine de substrats qui, en retour, influence la relation entre le métabolisme et l'insuline. Ainsi, les repas d'un bovin peuvent affecter le métabolisme en modulant le système endocrinien (Armentano et coll., 1984). Il est démontré que la production totale quotidienne de glucose est semblable chez des bovins nourris deux ou douze fois par jour lorsque l'énergie ingérée est maintenue stable (Armentano et coll., 1984). Ainsi, une ration quotidienne alimentée en plusieurs petits repas permet de conserver un statut nutritionnel et un métabolisme stable lors des verrouillages hyperinsulinémiques. Elle permet aussi de maintenir la concentration plasmatique des acides aminés (Thivierge et coll., 2002).
1.1.3.2.4.2. Voie de signalisation intracellulaire de l'insuline dans le muscle
Afin de favoriser la synthèse protéique, mTOR peut d'abord être activé par une cascade de signalisation intracellulaire amorcée par l'insuline (figure 1.2). L'action de l'insuline est initiée par la liaison à son récepteur cellulaire transmembranaire qui est une tyrosine-kinase (IR). Cette dernière consiste en deux sous-unités aB identiques et liées par des ponts bisulfures en un complexe a2P2 homotypique, tout comme les récepteurs de l'IGF-1 (Frattali et Pessin, 1993; Pessin et Saltiel, 2000). Il existe cependant un récepteur hybride formé d'une moitié ap de récepteur de l'insuline et d'une moitié ap de récepteur de l'IGF-1 (Soos et Siddle, 1989; Frattali et Pessin, 1993). Ces récepteurs hétérotypiques peuvent lier à la fois l'insuline et l'IGF-1 avec une haute affinité et initier la même cascade de phosphorylation menant à l'anabolisme protéique (Frattali et Pessin, 1993; Yang et coll., 2008). L'insuline sous forme libre dans le sang se fixe donc d'abord au domaine de liaison a du récepteur sur la face extracellulaire de la membrane plasmique, ce qui provoque un changement de conformation et qui envoie un signal au travers de la membrane. Ce changement de conformation déclenche l'autophosphorylation du domaine catalytique p
qui transfère alors un groupement phosphate de l'ATP sur un groupement hydroxyle porté par une tyrosine d'une protéine substrat du récepteur de l'insuline dans le cytosol (IRS-1) (Eckert et coll., 1999; Pessin et Saltiel, 2000). Cela conduit ensuite à l'activation de la phosphatidyl-inositol-3-kinase (PI3K) et qui ultimement active la sérine/thréonine kinase Akt (également nommée PKB) (Tremblay et coll., 2005). Un effecteur direct d'Akt est la protéine tubérine du complexe hamartine-tubérine (TSC1-2) (Meley et coll., 2006). Akt phosphoryle donc la protéine TSC2, ce qui provoque la dissociation du complexe TSC1-2 et lève son effet inhibiteur sur mTOR (Kwiatkowski et Manning, 2005) par l'activation de la protéine Rheb (Tremblay et coll., 2005). Cependant, un second effecteur d'Akt est maintenant connu et porte le nom de PRAS40. Lors d'un manque de nutriments ou d'une inhibition métabolique des mitochondries, cette protéine se lie à mTOR et empêche son activité signalétique (Haar et coll., 2007). Akt peut néanmoins phosphoryler PHAS40 et ainsi lever l'inhibition de mTOR (Nascimento et Ouwens, 2009). Parallèlement, Akt favorise la translocation du transporteur de glucose 4 (GLUT4) des vésicules intracellulaires d'entreposage vers la membrane plasmique permettant une augmentation de l'absorption par la cellule du glucose sanguin (Pessin et Saltiel, 2000; Tremblay et coll., 2005). mTOR peut donc être activé par une cascade signalétique intracellulaire qui est déclenchée par la liaison de l'insuline à son récepteur et qui, parallèlement, stimule l'entrée du glucose dans la cellule musculaire. Toutefois, la voie signalétique de mTOR peut être activée directement par les acides aminés pour initier la synthèse protéique. La section suivante traite de ce sujet en détail.
1.1.3.3. Stimulation de la synthèse protéique par les acides aminés
Une protéine simple est constituée de différents acides aminés assemblés en chaîne repliée ensuite sur elle-même afin d'adopter une configuration particulière. Toutefois, ces acides aminés ne doivent pas être vus simplement comme des blocs de construction, puisque ceux-ci participent également à titre de signaux de régulation des fonctions cellulaires. Bien que la synthèse protéique soit stimulée par l'insuline, laquelle constitue généralement le signal d'un repas et d'une disponibilité en nutriments, il est important pour une cellule de l'initier seulement lorsque les acides aminés sont disponibles. Les acides aminés montrent une capacité de signaler à la cellule leur présence (Yang et coll., 2008). Nous pouvons nous demander si la réponse de mTOR et de ses effecteurs est attribuable
à la présence d'une plus grande quantité de tous les acides aminés ou à la présence d'un acide aminé en particulier.
À ce sujet, il fait consensus que l'action signalétique des acides aminés sur mTOR et ses effecteurs provient en majeure partie de la leucine. La leucine est en effet l'acide aminé ayant montré la plus grande capacité à stimuler la phosphorylation de p70S6K et de 4E-BP1, tel que rapporté dans des études chez le rat en croissance à jeun auxquels on a administré oralement de la leucine (Anthony et coll., 2000a; Anthony et coll., 2002a; Crozier et coll., 2005). Selon une étude d'Anthony et coll. (2000a) réalisée avec un acide aminé traceur, la synthèse protéique a même augmenté d'environ 40 % chez ces individus et était équivalente à celle des rats alimentés à volonté. La suggestion à l'effet que la leucine active p70S6K et 4E-BP1 est supportée par des études in vivo chez des porcelets (Suryawan et coll., 2008) et des rats (Anthony et coll., 2000b) à jeun ayant reçu des injections de rapamycine. La rapamycine est un inhibiteur spécifique de mTOR. Elle bloque les effets de la leucine sur p70S6K et 4E-BP1 et atténue l'effet stimulant de l'acide aminé sur la synthèse protéique dans le muscle. La synthèse protéique musculaire a également été stimulée chez des humains âgés dont le repas était supplémenté en leucine (Rieu et coll., 2006). Il est donc logique de penser que ce phénomène serait également applicable chez les bouvillons, malgré le faible nombre d'études sur le sujet.
Il est maintenant reconnu que mTOR est impliqué dans la reconnaissance de la disponibilité des acides aminés, et particulièrement de la leucine, mais le mécanisme d'action de la leucine sur mTOR n'est pas encore défini complètement (Kimball et Jefferson, 2006; Yang et coll., 2008). La régulation de la synthèse protéique par les voies signalétiques de mTOR devient de plus en plus complexe et plusieurs autres effecteurs en amont ou en aval de mTOR ont été identifiés (liboshi et coll., 1999; Long et coll., 2005; Findlay et coll., 2007; Nobukuni et coll., 2007). Ces voies de signalisation de mTOR ne sont pas discutées dans le présent mémoire.
1.1.3.3.1. Effets additifs de l'insuline et des acides aminés sur l'anabolisme protéique du muscle squelettique
Chez les animaux nouveau-nés, la synthèse protéique dans le muscle cardiaque, la peau et la rate est modulée par l'insuline et ne l'est pas par les acides aminés (Davis et coll.,
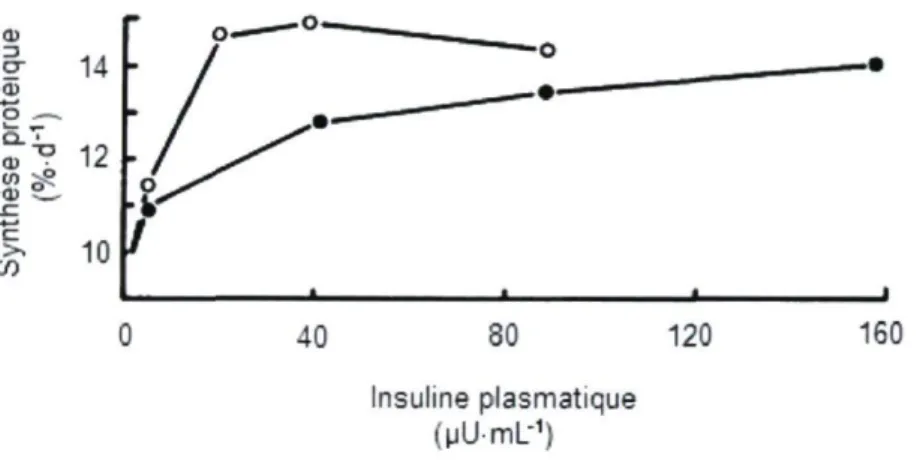
2003). Par contre, la plupart des viscères, dont le foie, les reins et le pancréas répondent à un apport en acides aminés, mais ils ne répondent pas à un apport d'insuline en l'absence d'apport exogèneauxiliaire d'acides aminés (Davis et coll., 2003). En revanche, dans le muscle squelettique, la stimulation de la synthèse protéique induite par l'alimentation est régulée à la fois par les acides aminés et par l'insuline (O'Connor et coll., 2003). En effet, le degré d'activation de p70S6K et de 4E-BP1 via mTOR dans le muscle squelettique est maximisé par l'effet additif des acides aminés et de l'insuline dans plusieurs études in vitro (Hara et coll., 1998; Parti et coll., 1998), ainsi que dans des études chez des rats en croissance (Garlick et Grant, 1988; Vary et coll., 1999; Balage et coll., 2001), des rats adultes (Long er coll., 2000) et des porcelets nouveau-nés (Escobar et coll., 2005). D'ailleurs, une étude chez des rats en croissance recevant en perfusion intraveineuse une solution d'insuline et de glucose a montré que l'apport d'une solution complète d'acides aminés causait une augmentation supérieure de la synthèse protéique (figure 1.4) (Garlick et Grant, 1988).
La stimulation de la synthèse protéique du muscle squelettique implique que cette régulation peut être indépendante de l'insuline. À l'aide de verrouillages hyperaminoacidémiques chez des porcelets de 7 jours d'âge à jeun dont la sécrétion d'insuline a été bloquée par une perfusion intraveineuse de somatostatine, une augmentation de la synthèse protéique proportionnelle à la dose d'acides aminés administrée a été observée (O'Connor et coll., 2003). Toujours chez le porcelet nouveau-né à jeun, il a été montré qu'une hausse physiologique de leucine plasmatique causée par une administration intraveineuse d'une dose unique haussait le taux fractionnel de synthèse protéique musculaire de 33 %. Pour ce faire, la leucine a augmenté la phosphorylation de p70S6K d'environ 125 % et de 4E-BP1 d'environ 200 %, sans toutefois avoir modifié la concentration de l'insuline plasmatique (Escobar et coll., 2005). Par contre, cette stimulation de la synthèse protéique par la leucine peut alternativement être indépendante de mTOR. Une étude chez des rats rendus diabétiques par une perfusion d'alloxane, un composé exerçant une toxicité sélective sur les cellules pancréatiques productrices d'insuline, a montré que l'administration orale de leucine n'avait pas d'effet sur l'activation des effecteurs de mTOR p70S6K et 4E-BP1 (Anthony et coll., 2002b). Néanmoins, la protéosynthèse était augmentée de 53 % chez ces rats. Dans une préparation de muscle de rats, une perfusion de leucine a augmenté de 60 à 70 % la
a i 3 CT 14 tti O . — , Q . ^ T U 12 g s? ■01 S _ - C c: ;-. lu <r> 40 80 Insuline plasmatique (uU-mL-1) 120 160
Figure 1.4. Relation entre le taux fractionnel de synthèse protéique musculaire et la concentration en insuline plasmatique chez le rat recevant en perfusion diverses quantités d'insuline avec (o) ou sans (•) perfusion d'acides aminés.
synthèse protéique sans changement d'activation de p70S6K ou 4E-BP1 (Bolster et coll., 2004). Au lieu de cela, la leucine a induit une augmentation de la phosphorylation d'elF4G et causé une association accrue d'elF4G avec elF4E. Enfin, il est important de noter que la leucine a la capacité de stimuler la sécrétion de l'insuline par les cellules p des îlots de Langerhans (Sener et Malaisse, 1980; Fahien et coll., 1988).
Les études présentées précédemment montrent que la leucine stimule la synthèse protéique à la fois par un mécanisme dépendant de l'insuline associé à la signalisation de mTOR à p70S6K et 4E-BP1 et également par un mécanisme indépendant de l'insuline encore inconnu qui pourrait impliquer la phosphorylation de elF4G et/ou son association avec elF4E (Kimball et Jefferson, 2006).
En plus de favoriser l'anabolisme protéique, la leucine peut en réduire la dégradation. Une étude effectuée chez des rats adultes et à jeun a montré qu'une ration supplémentée en leucine provoquait l'inhibition de la protéolyse dépendant de la voie ubiquitine-protéasome dans le muscle squelettique (Combaret et coll., 2005). L'augmentation de l'activité des protéasomes observée après un repas normal a aussi été évitée par l'ajout de leucine et le taux d'ubiquitination diminué de 25 %.
1.1.3.3.2. Modulation par les acides aminés de l'action de l'insuline sur le métabolisme du glucose
En plus d'offrir un effet additif à l'insuline sur l'anabolisme protéique, les acides aminés (et la leucine seule) peuvent également inhiber une étape critique de la signalisation du métabolisme du glucose dans le muscle squelettique. En effet, p70S6K a la capacité d'appliquer une rétroaction négative sur PI3K en diminuant son ampleur et sa durée d'association avec IRS-1 dans le muscle (figure 1.2). Cela a été montré par des études portant sur des myotubules L6 humaines incubées (Peyrollier et coll., 2000), des cellules musculaires de rats (Baum et coll., 2005) et des cellules de mammifères en général (Harrington et coll., 2004; Wullschleger et coll., 2006). Cependant, la diminution du transport du glucose semble comporter une partie indépendante de l'inhibition induite par la leucine de PI3K par p70S6K, car elle ne se produit pas en toutes circonstances. Chez des rats en croissance à jeun, une administration orale de leucine et de glucose provoquant des hausses plasmatiques physiologiques réduit l'ampleur et la durée
d'activation de PI3K, comparativement à l'effet de l'ingestion de glucose sans leucine (Baum et coll., 2005). Cependant, le transport du glucose n'est pas réduit avec la leucine. Selon cette étude, l'ingestion seule de leucine est également sans effet sur l'activité de la PI3K ou sur l'absorption cellulaire du glucose, même si la leucine est arrivée à activer elF4E. Ce dernier complexe est essentiel dans l'assemblage ribosomal pour la synthèse protéique. Dans une préparation de muscles squelettiques de rats, l'addition d'acides aminés essentiels (incluant la leucine) lors d'une incubation prolongée, où l'apport en acides aminés essentiels s'épuise, prévient l'augmentation du niveau basai du transport du glucose (et de celui induit par l'insuline) (Gulve et coll., 1991). Selon Tischler et coll. (1982), les effets de la leucine sur la synthèse protéique se produisent à la fois chez les rats nourris et à jeun, tandis que son effet sur l'inhibition de l'oxydation du glucose serait observé chez les rats à jeun. Contrairement à la plupart des acides aminés, la leucine, l'isoleucine et la valine sont transaminés rapidement dans les muscles squelettiques de rats (Goldberg et Odessey, 1972; Odessey et Goldberg, 1972). La capacité de ce tissu à les transaminer double et triple chez le rat pendant le jeûne (Buse et coll., 1972; Goldberg et Odessey, 1972; Meikle et Klain, 1972) lorsque l'utilisation du glucose chute et que la dégradation protéique augmente dans le muscle (Li et Goldberg, 1976). Lors d'un jeûne, l'oxydation de la leucine, mais d'aucun autre acide aminé (Chang et Goldberg, 1978), pourrait fournir une fraction mineure de l'énergie du muscle via l'oxydation des acyl-CoA, tel que démontré avec des incubations de muscle de diaphragme. La leucine pourrait peut-être ainsi réduire l'utilisation du glucose par le muscle chez ces animaux (Chang et Goldberg, 1978).
1.1.4. Régulations dues à la progression de la croissance
La période de croissance et de développement entre la naissance et le sevrage est cruciale pour la survie à long terme de l'organisme (Reeds et coll., 2000). Chez la plupart des mammifères, cette période d'allaitement en début de vie est associée à un taux de croissance rapide (Attaix et coll., 1988). Lors de cette période, le dépôt protéique est très élevé et est soutenu par une grande efficacité à transformer les protéines ingérées en protéines corporelles. Ceci est accompagné d'une différence marquée des taux individuels de croissance des différents tissus et d'une série de processus de maturation (Reeds et coll., 2000). Entre autres, on peut noter une croissance très rapide des intestins en raison
du passage d'une alimentation parentérale à intestinale et un développement également très rapide des muscles, sans doute afin de minimiser la période de vulnérabilité des nouveau-nés.
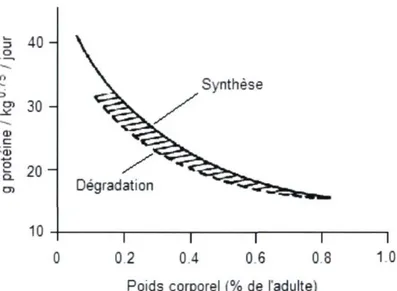
Toutefois, le taux élevé de rétention protéique diminue rapidement au cours des premiers mois de vie chez le rat (Goldspink et Kelly, 1984), le porc (Reeds et coll., 1980; Wray-Cahen et coll., 1997; Bergeron et coll., 2007), le mouton (Attaix et coll., 1988; Harris et coll., 1992) et l'humain (Denne et coll., 1991; 1994; 1995). Le fait que la vitesse de synthèse diminue plus rapidement que la vitesse de dégradation expliquerait cette baisse de dépôt protéique (figure 1.5). En effet, ce graphique réalisé à partir de données provenant de bovins suggère que l'animal adulte doit synthétiser deux à trois fois plus de protéine que le jeune animal pour déposer une quantité semblable de protéine dans la carcasse (Grizard et coll., 1988).
De tous les tissus, ce sont les muscles squelettiques qui produisent les gains de masse protéique les plus rapides au cours des premiers stades de vie (Young, 1974). Cette accretion des protéines musculaires plus rapide que les autres tissus résulte en une augmentation de la proportion des muscles squelettiques des espèces en général, passant d'environ 30 % des protéines corporelles chez le nouveau-né à environ 50 % chez l'adulte (Davis et coll., 2003). Toutefois, des études effectuées chez le mouton (Bryant et Smith, 1982; Pell et Bates, 1987; Lobley et coll., 1990), le rat (Lewis et coll., 1984; Davis et coll., 1991; Mays et coll., 1991) et le porc (Davis et coll., 1996) montrent que la capacité de l'organisme à déposer de la protéine musculaire est réduite grandement avec la maturité des animaux, ce qui inévitablement affecte leurs performances. Ce point est d'intérêt pour les sciences animales dans l'optique d'une optimisation de la production. Les modifications qu'engendre la progression de la maturité sur la composition corporelle laissent croire que certains mécanismes métaboliques doivent intervenir pour permettre ces changements.
1.1.4.1. Déclin de la sensibilité musculaire à l'insuline avec l'âge et la maturité
La capacité des muscles squelettiques à utiliser les acides aminés pour la construction ou le maintien des protéines diminue graduellement avec l'âge et ceci est dû, en partie, à un déclin de la sensibilité des muscles à l'insuline. Une étude effectuée chez des porcelets
o u . 4 0 -J? 30 a> ç a>
I 20
10 Synthèse Dégradation l 02 T 0.6 0.4 06 0.8 Poids corporel (% de l'adulte)"~I 10
Figure 1.5. Synthèse et dégradation des protéines en fonction de la croissance chez les bovins.
La surface hachurée représente les protéines retenues. Source : adaptée de Grizard et coll., 1988.
âgés de 7 et 26 jours et utilisant la technique du verrouillage hyperinsulinémique-euglycémique-euaminoacidémique montre que le taux de perfusion d'acides aminés nécessaire pour conserver la concentration plasmatique de lysine au niveau de base est plus élevé chez les jeunes porcelets (Wray-Cahen et coll., 1997). Toujours à l'aide de porcelets âgés de 7 et 26 jours, d'autres chercheurs ont remarqué que le taux d'utilisation des acides aminés chez les jeunes porcelets suite à une perfusion d'insuline était presque doublé, comparativement aux plus âgés (Davis et coll., 2002). Une autre étude a montré que l'abondance des récepteurs de l'insuline dans les muscles squelettiques de porcelets de 7 jours d'âge était le double de celle retrouvée dans les muscles de porcelets de 26 jours d'âge, tandis que l'abondance d'IRS-1 était semblable pour les deux groupes
(Suryawan et coll., 2001). Enfin, une dernière étude a montré que l'activité et la quantité d'Akt dans les muscles squelettiques sont plus faibles d'environ 82 % et 54 % respectivement chez des porcelets âgés de 26 jours que ceux âgés de 7 jours (Kimball et coll., 2002). Quant au contenu en mTOR de ces mêmes muscles, il était 25 % plus faible chez les porcelets plus âgés. Ces observations indiquent que la stimulation de l'utilisation corporelle des acides aminés par l'insuline s'atténue avec l'âge chez le porcelet. Puisque la baisse des acides aminés libres du sang provoquée par une injection intraveineuse d'insuline est moindre chez l'adulte que pendant la période de croissance chez la brebis (Prior et Christensen, 1978) et chez le mouton (Grizard et coll., 1987), il s'opère aussi une diminution de la réponse des tissus à l'insuline au cours du développement chez ces ruminants. Il est alors logique de penser qu'il peut en être de même chez les bovins, mais aucune étude n'a encore mesuré précisément ce paramètre en utilisant cette approche. En revanche, deux études montrent qu'à un âge plus avancé que la période néonatale, la croissance des bovins affecte la capacité de l'insuline à stimuler le métabolisme du glucose (Eisemann et Huntington, 1994; Eisemann et coll., 1997).
Eisemann et coll. (1997) ont effectué des verrouillages hyperinsulinémique-euglycémique chez sept jeunes bouvillons pesant 275 kg chacun et sept autres plus âgés ayant un poids vif de 490 kg chacun et ont montré que la moitié de l'utilisation maximale totale de glucose (perfusion + production endogène) est atteinte à une concentration en insuline de 125 et 418 uU-mL"1 chez les bouvillons de 275 et 490 kg respectivement. Les conclusions sont similaires en excluant la contribution hépatique (113 vs 237 uU-mL"1) ou en isolant spécifiquement les muscles des quartiers arrière (243 vs 488 uU-mL"1). Ces résultats indiquent que le métabolisme du glucose dans le muscle chez les bouvillons est plus
sensible à l'insuline que celui des boeufs plus âgés. Ceci suggère indirectement que la sensibilité du métabolisme protéique à l'insuline dans le muscle pourrait aussi diminuer avec l'âge des bovins.
1.1.4.2. Implication de l'IGF-1 dans la progression de l'âge et la maturité
La concentration plasmatique de base en IGF-1 varie également avec la croissance chez le bovin et de façon analogue à l'insuline. Selon une étude chez la vache Holstein (Abribat et coll., 1990), cette concentration débute à 102,0 ±11,3 ng-mL"1 24 h après la naissance et diminue à 50,2 ng-mL"1 le mois suivant. Elle remonte ensuite à 137,0 ng-mL'1 et reste stable jusqu'au dixième mois. Cette remontée de la quantité d'IGF-1 a été aussi observée chez des veaux mâles Holstein Frisons (Breier et coll., 1988) et est concomitante avec l'apparition des récepteurs de l'hormone de croissance dans le foie (Breier et Gluckman, 1991). Dans une autre étude chez des jeunes mâles Holstein Frison et Piémontais, l'âge a aussi eu un effet considérable faisant augmenter la concentration en IGF-1 plasmatique de 180 ng-mL"1 chez des veaux âgés de 7 mois à 437 ng-mL"1 chez des veaux de 14 mois (Pagano et coll., 2001). L'insuline et l'IGF-1 se ressemblant chimiquement, ils peuvent exercer leur action anabolisante par l'activation d'un même récepteur hybride. Ces hormones évoluent de façon analogue et dépendante du stade de développement (Abribat et coll., 1990). Il est depuis longtemps documenté que la sécrétion de l'hormone de croissance diminue avec l'âge chez plusieurs espèces, incluant le bovin (Tucker et coll., 1974).
1.2. Lipides et fonctions physiologiques
Les lipides forment un ensemble de molécules aux structures et aux fonctions variées dans le monde du vivant. Ils occupent plusieurs rôles dans l'organisme, incluant la constitution des membranes cellulaires. Ils servent également de messagers inter/intracellulaires, ainsi que de substrats métaboliques. Les lipides des systèmes biologiques sont soit hydrophobes (ne contenant que des groupes non polaires), soit amphipathiques (ils contiennent à la fois des groupes polaires et non polaires) (Garrett et Grisham, 2000). Ils sont constitués en majeure partie de liaisons non polaires carbone-hydrogène (Campbell, 1995).
La nature hydrophobe des molécules lipidiques est à l'origine de leur fonction de barrière efficace qui s'oppose au passage de molécules polaires à travers les membranes (Garrett et Grisham, 2000). Les glycérophospholipides, les triacylglycérols et les stéroïdes constituent trois grandes familles de lipides et sont synthétisés dans le reticulum endoplasmique lisse (Campbell, 1995).
1.2.1. Acides gras
Un acide gras est une macromolécule comportant une longue chaîne hydrocarbonée terminée par un groupe carboxylique (Garrett et Grisham, 2000). La très grande majorité des acides gras naturels est formée d'un nombre pair d'atomes de carbone (le plus souvent de 14 à 24). La biosynthèse des acides gras implique l'acétyl-coenzyme A, une coenzyme porteuse d'un groupement qui contient deux atomes de carbone. Les acides gras possédant une chaine hydrocarbonée de 20 à 24 atomes de carbone sont souvent nommés acides gras à longue chaine. Si ces atomes de carbone sont liés entre eux par des liaisons ioniques (où chaque carbone porte deux hydrogènes, sauf celui des extrémités méthyle et carboxyle qui en portent trois), l'acide gras est dit saturé (Eckert et coll., 1999). Si la chaine de l'acide gras contient une ou plusieurs liaisons covalentes entre les carbones, l'acide gras est dit insaturé (Eckert et coll., 1999). Un acide gras monoinsaturé ne possède qu'une unique liaison covalente, par opposition aux acides gras polyinsaturés qui en possèdent de deux à six (Hulbert et Else, 1999). Ces derniers se subdivisent en oméga-3 (n-3) et oméga-6 (n-6), selon la localisation de la première double liaison à partir de l'extrémité méthyle de la molécule. Cette nomenclature s'applique également aux acides gras monoinsaturés oméga-7 (n-7) et oméga-9 (n-9).
Les acides gras ont d'abord un rôle structural. Ils sont alors utilisés pour la synthèse de lipides plus complexes, notamment des glycérophospholipides qui forment les membranes des cellules et des organites. La composition en acides gras de ces glycérophospholipides donne aux membranes des propriétés physiques (élasticité, fluidité) particulières. Ensuite, les acides gras ont un rôle métabolique. Ils constituent une source d'énergie importante pour l'organisme et sont stockés sous forme de triacylglycérols dans les tissus adipeux. Lors d'un effort, en particulier lors d'un effort de longue durée, l'organisme va puiser dans ces réserves et dégrader les acides gras afin de produire de l'énergie sous forme d'ATP.
Enfin, les acides gras ont aussi un rôle de messager. Ils sont précurseurs de plusieurs messagers intra- et extracellulaires. Par exemple, les acides gras polyinsaturés et plus spécifiquement les n-6 sont précurseurs des eïcosanoïdes, hormones importantes dans plusieurs mécanismes de transduction des signaux à travers les membranes et dans les cellules (Needleman et coll., 1986). Elles interviennent notamment dans le processus d'inflammation et la coagulation sanguine.
1.2.1.1. Participation à des molécules complexes
Que ce soit pour d'accomplir une mission structurale ou de réserve d'énergie, les acides gras doivent se retrouver sous forme de molécules plus complexes.
1.2.1.1.1. Glycérophospholipides
Les lipides membranaires, tous amphipathiques, incluent les glycolipides, le cholestérol et quatre types majeurs de glycérophospholipides (Hulbert et Else, 1999). Comme décrit à la section suivante, les glycérophospholipides sont la structure de base des membranes cellulaires et ces derniers constituent une des plus grandes classes de lipides naturels (Garrett et Grisham, 2000). Un glycérophospholipide est une macromolécule formée d'une molécule de glycerol, de deux acides gras et d'un groupement phosphate (ester 3-phosphorique du 1,2-diacylglycérol). Le groupe 3-phosphorique estérifie divers groupes polaires (des alcools). Si l'alcool est la choline, l'éthanolamine, le glycerol, la serine ou l'inositol, les glycérophospholipides formés seront respectivement la phosphatidylcholine (plus connu sous le nom de lécithine), la phosphatidyléthanolamine, la phosphatidylglycérol, la phosphatidylsérine et le phosphatidylinositol. La nature des acides gras estérifiés sur un glycerol va également différencier les glycérophospholipides entre eux et aura des effets sur leurs propriétés chimiques et physiques (Garrett et Grisham, 2000).
1.2.1.1.1.1. Membranes cellulaires
Les membranes ont des fonctions cellulaires essentielles. Elles constituent la limite des cellules et des organites intracellulaires et sont le site de nombreuses réactions biologiques et de processus importants (Garrett et Grisham, 2000). Diverses hormones,
dont l'insuline et autres signaux et agents régulateurs, exercent leurs effets par une interaction avec des membranes (Garrett et Grisham, 2000). Le modèle de la mosaïque fluide, proposé par Singer et Nicholson (1972), est le modèle qui, selon l'avis général, décrit le mieux la disposition des molécules dans les membranes. Ce modèle est souvent employé pour décrire à la fois la composition et le comportement dynamique des membranes biologiques. Selon ce modèle, les glycérophospholipides de la bicouche forment une matrice bidimensionnelle, fondamentalement fluide, se comportant comme un solvant des protéines membranaires (Garrett et Grisham, 2000).
1.2.1.1.2. Triacylglycérols
La fonction principale des graisses (essentiellement des triacylglycérols) est d'emmagasiner de l'énergie (Campbell, 1995). Ces molécules résultent de l'estérification d'une molécule de glycerol à trois acides gras (Garrett et Grisham, 2000). Ceux-ci peuvent être identiques ou différents (Eckert et coll., 1999). Tout comme dans le cas des glycérophospholipides, la nature des acides gras qui composent la molécule déterminera ses propriétés chimiques et physiques (Eckert et coll., 1999) et influencera ses impacts biologiques (Kinsella et coll., 1990). Les graisses contenant des acides gras insaturés ont généralement des points de fusion bas, comparativement à celles qui contiennent des acides gras saturés (Eckert et coll., 1999).
Les triacylglycérols s'accumulent typiquement dans des vacuoles lipidiques des cellules adipeuses des Vertébrés (Eckert et coll., 1999). Les agrégats de triacylglycérols forment de volumineux globules qui occupent la plus grande partie de l'adipocyte (Garrett et Grisham, 2000). Ils s'accumulent également dans les cellules musculaires, qui contiennent moins de lipides et dont les agrégats lipidiques sont par conséquent bien plus petits (Garrett et Grisham, 2000). Néanmoins, les triacylglycérols intramusculaires sont les principaux lipides des muscles et sont également utilisés comme source d'énergie (Vessby, 2000).
Chez les bouvillons, la proportion de graisse augmente avec l'âge et la maturité. Des mesures effectuées sur 91 bouvillons Angus ont montré qu'à la naissance, la proportion de gras est seulement de 8 % (exprimé en pourcentage du poids corporel vide), alors que celle des muscles est d'environ 30 % (Perry et Arthur, 2000). Plus l'animal vieillit, plus