HAL Id: hal-02818381
https://hal.inrae.fr/hal-02818381
Submitted on 6 Jun 2020
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Dynamique, diversité et impact potentiel des virus de
microalgues du lac du Bourget
Aude Prunet
To cite this version:
Aude Prunet. Dynamique, diversité et impact potentiel des virus de microalgues du lac du Bourget. [Stage] Université Pierre et Marie Curie - Paris 6 (UPMC), Paris, FRA. 2008, 49 p. �hal-02818381�
Aude Prunet
Mémoire de Master 2: Biologie cellulaire et moléculaire Spécialité Microbiologie
Université Pierre et Marie Curie (Paris 6)
Dynamique, diversité et impact potentiel
des virus de microalgues du lac du Bourget
Stage encadré par Stéphan Jacquet
UMR CARRTEL: Centre Alpin de Recherche sur les Réseaux Trophiques des Ecosystèmes Limniques Station INRA d’Hydrobiologie Lacustre: 75, Avenue de Corzent, 74200 Thonon-les-Bains
Equipe BioFEEL: Biodiversité, Fonctionnement et Evolution des Ecosystèmes Lacustres
Remerciements
Je tiens tout d’abord à remercier Stéphan Jacquet pour son accueil chaleureux, son dynamisme et la confiance qu’il a su m’accorder lors des expériences.
Merci à Brigitte pour ses enseignements et sa patience (il en faut !), ainsi qu’à Marie-Hélène pour son aide et ses conseils. Merci beaucoup à toutes les deux pour votre grande gentillesse.
Je remercie également Pascal, pour avoir effectué tous les prélèvements et pour son aide lors de l’analyse des pigments. De plus, je tiens à le remercier pour sa disponibilité et sa bonne humeur
au quotidien. Les thésards (et oui !)
Lyria pour son soutien, son aide (quand j’en ai eu besoin) et sa gentillesse. Thomas pour ses conseils et les soirées où il est venu squatter.
L’ensemble du personnel de la station pour leur accueil. Enfin, je tiens à remercier tous les châtelains. Sans vous, ce stage n’aurait pas été le même.
Un grand merci donc pour tous ces bons moments partagés, pour votre soutien et votre compréhension.
Je pense plus particulièrement à Rozenn, Laura, Fatma et Mike pour toutes ces petites choses insignifiantes du quotidien qui m’ont beaucoup apportés.
Je finirais par un remerciement spécial à mes 6 petites mains pour leur aide précieuse ces derniers jours. Je ne sais pas ce que j’aurais fait sans elles.
Résumé
Dynamique, diversité et impact potentiel des virus de microalgues du lac du Bourget
La dynamique, la diversité et le rôle écologique des virus en milieu lacustre ont été jusqu’ici peu étudiés. Ce constat est d’autant plus vrai dès lors que l’on s’intéresse aux virus de microalgues eucaryotiques. L’étude présentée dans ce mémoire a été réalisée sur le lac du Bourget (le plus grand lac naturel français) à partir de prélèvements d’eau intégrée entre 0 et 20 m et effectués entre janvier et mai 2008. Les échantillons ont été analysés au moyen de techniques diverses telles que la cytométrie en flux et la PCR-DGGE. Parallèlement au suivi écosystèmique des différents compartiments planctoniques, une approche expérimentale a été utilisée afin d’appréhender l’impact de la lyse virale sur la mortalité des bactéries hétérotrophes et du phytoplancton comparativement à l’impact de la prédation par le microzooplancton. Au cours des mois, l’abondance phytoplanctonique augmentait, en lien avec l’évolution des principaux paramètres physico-chimiques tels que la température, passant de 2,43.103 cellules.ml-1 en février à 17,3.103 cellules.ml-1 en mai. La concentration des bactéries augmentait également au cours du temps, d’un facteur 3 entre janvier (1,5.106 cellules.ml-1) et avril (4,1.106 cellules.ml-1). Quant aux virus leur abondance chutait de 6,3 à 3,67.107 particules.ml-1. Un impact des virus sur la communauté bactérienne a pu être mis en évidence en février et en mars avec respectivement 78% et 39% de mortalité due à la lyse virale. Pour le phytoplancton, seul un impact a pu être relevé au cours du mois de février sur la population de Rhodomonas sp., mais avec une valeur de mortalité imputable aux virus très élevée, estimée à 67% (contre 33% pour le microzooplancton). Parallèlement on notait une diversité des cyanophages plus importante au cours des mois de mars et avril. Il ne nous a pas été possible d’apprécier la diversité des virus de microalgues eucaryotiques faute de temps mais des échantillons ont été conservés pour une analyse ultérieure par PCR-DGGE et/ou PFGE. Nos premiers résultats suggèrent que les virus semblent avoir un impact fonctionnel important mais de façon ponctuelle et sur des populations données. La mesure précise de la diversité reste à faire.
Sommaire
I. Introduction... 9
II. Matériels et Méthodes ... 15
1. Site d’étude ... 15
2. Stratégie d’échantillonnage... 16
3. Données physico-chimiques ... 17
4. Expériences de dilution... 17
5. Analyse des abondances et caractérisation des microalgues, des bactéries hétérotrophes et des virus ... 19
5.1. La cytométrie en flux ... 19
5.1.1. Principe... 19
5.1.2. Protocole d’analyse ... 20
5.2 Étude des pigments photosynthétiques par Chromatographie Liquide à Haute Performance (HPLC) ... 21
5.2.1.Principe... 21
5.2.2. Protocole... 21
5.3 Dénombrement des taxa phytoplanctoniques ... 22
6. Approche moléculaire de la diversité virale : PCR-DGGE ... 22
6.1 Principe ... 22
6.2 Protocole ... 23
7. Isolement de virus de microalgues lacustres par infection de culture... 23
III. Résultats ... 25
1. Evolution des grandes variables du lac du Bourget ... 25
1.1. Evolution de la température ... 25
1.2. Evolution de la concentration en nutriments... 25
1.3. Evolution du pH et de la concentration en oxygène dissous... 26
1.4. Transparence et météorologie ... 26
2. Dynamique des communautés phytoplanctoniques, bactériennes et virales... 26
2.1. Le phytoplancton... 26
2.1.1. Donnés acquises par cytométrie en flux ... 26
2.1.2. Chlorophylle a (acquise via la sonde et le dosage pigmentaire) ... 27
2.1.3. Comptages microscopiques des taxons... 27
2.2. Les bactéries hétérotrophes... 28
2.3. Les virus... 28
2.4. Relations entre les différents paramètres ... 29
3. Rôle fonctionnel des virus (agents de mortalité cellulaire)... 29
3.1. Efficacité de l’expérience de dilution ... 29
3.2. Impact des virus sur les différentes communautés planctoniques ... 30
4. Estimation de la richesse virale par PCR-DGGE... 32
5. Tentative d’isolement de virus... 33
Liste des abréviations
A: Adénine
ADN: Acide DésoxyriboNucéique ARN: Acide RiboNucléique BET: Bromure d’Ethydium BSA: Bovine Serum Albumine C: Cytosine
Chla: Clorophylle a CMF: Cytométrie en flux
COD: Carbone Organique Dissout
DGGE: Denaturating Gradient Gel Electrophoresis dNTP: désoxyNucléotide Tri-Phosphate
EDTA: EthyleneDiamineTetraacetic Acid FALS: Forward Angle Light Scatter FSC: Forward Scatter
G: Guanine
HDNA: High DésoxyriboNucleic Acid
HPLC: High Performance Liquid Chromatography INRA: Institut National de la Recherche Agronomique LDNA: Low DésoxyriboNucleic Acid
N: Azote P: Phosphore
PCR: Polymerisation Chain Reaction PFGE: Pulsed-field Gel Electrophoresis qsp: quantité suffisante pour
RALS: Right Angle Light Scatter SSC: Side Scatter
T: Thymidine
TAE: Tris-Ammonium-EDTA TE: Tris-EDTA
UV: Ultra-Violet
Liste des figures et tableau
Figure 1 : Evolution du nombre de publications (a) et de citations (b) dans le domaine de l’écologie virale marine (à gauche) ou des eaux douces (à droite). Source : Middelboe, Jacquet & Weinbauer (2008)
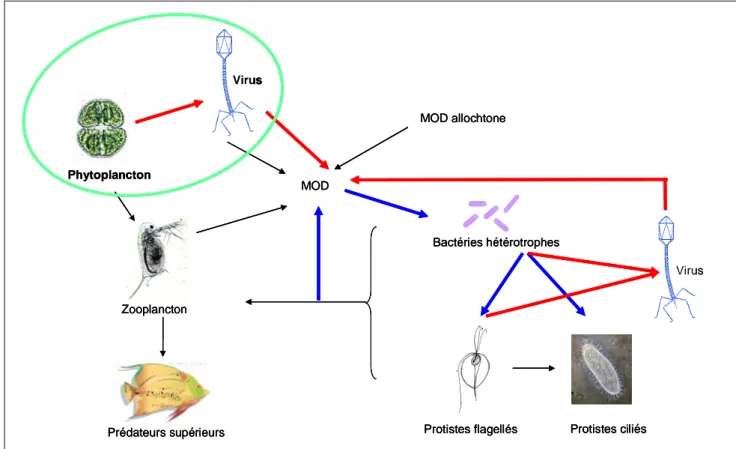
Figure 2: Schéma de la boucle microbienne (en bleu) et du court-circuit viral (en rouge) dans la chaîne trophique microbienne aquatique. La lyse virale des différents compartiments microbiens (phytoplancton et bactéries hétérotrophes) libère dans le milieu des virus ainsi que des débris cellulaires constituant des produits (protéines, acides nucléiques et autres composants cellulaires) riches en éléments azotés, phosphorés ou carbonés, potentiellement utilisables par les bactéries et le phytoplancton (Gobler et al., 1997, Noble et al., 1999). L’activité virale transforme donc le carbone particulaire en carbone dissous, court-circuitant ainsi le flux de carbone et de nutriments vers les consommateurs supérieurs.
Figure 3 : Situation géographique et carte bathymétrique simplifiée du lac du Bourget et de la
station de référence pour les prélèvements (le point B). Source :
http://www.ipgp.jussieu.fr/rech/lge
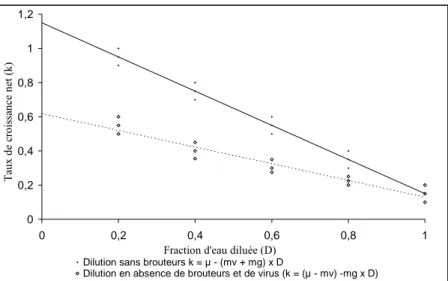
Figure 4 : Droites de régression théoriques obtenues lors de l’analyse de l’eau du lac diluée avec de l’eau filtrée contenant des virus (protocole standard utilisé pour déterminer le taux de broutage) ou exempte de virus. Les taux de croissance les plus importants sont attendus pour la dernière série de dilution en raison du retrait d’un facteur de mortalité supplémentaire (lyse virale). k = taux de croissance net du phytoplancton, µ = taux de croissance instantanée du phytoplancton, mg = mortalité due au broutage par le microzooplancton, mv = mortalité due à la lyse virale, D = fraction d’eau filtrée. D’après Evans et al. (2003).
Figure 5 : Evolution de la température (°C) du lac du Bourget entre janvier et mai 2008
Figure 6 : Dynamique de l’abondance du phytoplancton telle que mesurée par cytométrie en flux dans la couche d’eau intégrée 0-20m en sommant les différentes populations
Figure 7 : Abondance relative (donnée en %) des différentes classes algales du lac du Bourget de janvier à mai 2008
Figure 8 : Dynamique de l’abondance des bactéries hétérotrophes telle que mesurée par cytométrie en flux dans la couche d’eau intégrée 0-20 m
Figure 9 : Dynamique de l’abondance des virus telle que mesurée par cytométrie en flux dans la couche d’eau intégrée 0-20m
Figure 10 : Abondance des particules virales en fonction des dilutions pour les fractions filtrées sur 0,45 µm et 30 kDa au cours de l’expérience du mois de février
Figure 11 : Taux de croissance des bactéries hétérotrophes (jours-1) en fonction des dilutions pour l’expérience de février
Figure 12 : Taux de croissance du phytoplancton total (jours-1) en fonction des dilutions pour l’expérience de février
Figure 13 : Taux de croissance de Rhodomonas sp (jours-1) en fonction des dilutions au mois de février
Figure 14 : Profils DGGE obtenus pour les cyanophages. Les puits numérotés de 1 à 6 correspondent aux 6 prélèvements de janvier à mai
Tableau 1 : Programme PCR pour l’amplification d’un fragment d’ADN codant pour le gène de la capside virale g20 des cyanomyoviridae.
I. Introduction
L’intérêt scientifique porté aux écosystèmes aquatiques ne date pas d’aujourd’hui. Parce que ces derniers représentent la plus grande biosphère de notre planète (>70%), ils ont toujours été considérés avec beaucoup d’attention même si l’on ignore encore beaucoup de leur biologie et de leur fonctionnent écologique. Il y a encore deux décennies, les systèmes aquatiques étaient considérés de manière relativement simple avec la connaissance et l’étude plus ou moins détaillée d’une chaîne trophique linéaire, dite classique (Azam et al. 1983). Cette chaîne consiste en un transfert de la matière organique des maillons les plus élémentaires constitués par les organismes photosynthétiques (le phytoplancton) vers les compartiments supérieurs constitués par des organismes hétérotrophes de taille de plus en plus importante (zooplancton, poissons). À partir des années 1970-80, quelques chercheurs se sont alors intéressés à la structure et au fonctionnement des réseaux trophiques en considérant les organismes microscopiques. Ainsi est né le concept de boucle microbienne dans lequel le rôle primordial des microorganismes (en particulier les bactéries hétérotrophes) dans les flux de matière, notamment du cycle du carbone au sein de la colonne d’eau, a été mis en évidence (Pommeroy 1974, Azam et al. 1983, Hagström et al. 1988). Jusqu’à la fin des années 1980, début des années 1990, l’étude de la mortalité des organismes phytoplanctoniques et des bactéries se limitait très largement aux impacts liés aux organismes brouteurs (Azam et al. 1983, Sherr & Sherr 1993). Puis, comme nous allons le voir ci-après, la découverte de l’importance quantitative des virus et de leur rôle potentiel au sein des écosystèmes aquatiques marins et d’eaux douces allaient complexifier mais aussi affiner considérablement la compréhension du fonctionnement des écosystèmes aquatiques (Bergh et al. 1989, Proctor & Fuhrman 1990, Suttle et al. 1990).
Les virus sont de petites particules à l’organisation structurelle simple de prime abord. Ils possèdent un génome linéaire ou circulaire sous forme d’ADN ou d’ARN simple ou double brin empaqueté dans une enveloppe protéique (la capside). Ils sont incapables de se multiplier par eux-mêmes. Pour cela, ils infectent une cellule dont ils détournent la machinerie cellulaire. Ce sont donc des parasites obligatoires. Entités biologiques (de part leur composition en acides nucléiques) les plus petites connues à ce jour avec une taille moyenne inférieure à 60 nm, ils présentent une telle abondance dans les milieux aquatiques (>1030) que,
mis bout à bout, ils représenteraient une longueur totale de plus de 400 000 années lumières (Weinbauer & Rassoulzadegan 2004, Suttle 2007).
L’écologie virale est une science relativement jeune. En effet, les observations rapportées par Spencer (1955) de l’existence de virus marins puis par Torella et Morita en 1979 sur l’abondance des virus en milieu aquatique (>104 par millilitre) ont tout d’abord reçu peu d’attention. Ce n’est qu’à la fin des années 1980 lorsque Bergh et al. (1989) révélèrent leurs observations faites en microscopie électronique à transmission avec une abondance virale de l’ordre de 108 particules virales par millilitre dans différents écosystèmes que cette science vit réellement le jour. Dès lors, un intérêt accru de nombreux chercheurs pour les virus permit la validation de ces premiers résultats, puis la description de nombreux virus, et enfin un début d’explication quant au rôle des virus au sein des écosystèmes aquatiques (agents de mortalité, de diversification spécifique ou encore impliqués dans les cycles biogéochimiques). Cette science, grâce au développement et à l’application de nouvelles techniques, telles que la cytométrie en flux, les outils de la biologie moléculaire et de la bioinformatique (PCR-DGGE, PFGE, Métagénomique), a connu et continue à connaître un essor très important (Suttle 2007) même si de nombreuses questions restent bien évidemment en suspens (Brussaard et al. 2008). Cette avancée a été particulièrement marquée dans le domaine marin. Une simple recherche sur le « Web of Science » révèle en effet que l’on est passé de 1-2 articles par an à la fin des années 1980 à 20-30 articles par an dans les années 1990 pour arriver à plus de 100 articles publiés par an depuis 2004. Les citations de ces articles ont aussi augmenté de manière exponentielle avec plus de 3500 citations en 2006. Comparativement, on dénombre environ 30 articles publiés par an et un peu plus de 400 citations depuis 2004 dans le domaine de l’écologie virale des eaux douces (Middelboe et al. 2008) (Figure 1).
Publicat ions (a) 1991 1995 1999 2003 2007 30 20 10 0 Publicat ions (a) 1987 1991 1995 1999 2003 2007 120 90 60 30 0 Cita tio n s (b) 1987 1991 1995 1999 2003 2007 4000 3000 2000 1000 0 Cita tio n s (b) 1991 1995 1999 2003 2007 600 400 200 0
Figure 1 : Evolution du nombre de publications (a) et de citations (b) dans le domaine de l’écologie
virale marine (à gauche) ou des eaux douces (à droite). Source : Midddelboe, Jacquet & Weinbauer (2008).
Si les études portant sur les virus bactériophages ont été majoritairement réalisées en milieu marin, celles menées sur les écosystèmes lacustres se sont plutôt intéressées aux virus des cyanobactéries dans un premier temps (Suttle 2000, Wommack & Colwell 2000). Pourtant, les organismes photosynthétiques constituant la base de la chaîne trophique, leur lyse est susceptible d’engendrer des modifications importantes en terme de structure, de diversité et de dynamique des communautés microbiennes (Van Hannen et al. 1999). Dans les eaux douces, l’abondance des producteurs primaires (cyanobactéries et microalgues eucaryotiques) est généralement supérieure à celle observée en milieu marin (Maranger & Bird 1995). Les virus infectant ces populations ont donc probablement un rôle important au sein de ces écosystèmes dulçaquicoles et il est dès lors assez étonnant de constater le peu d’attention leur ayant été accordée jusqu’alors.
En tant qu’agents responsables de la lyse cellulaire, les virus ont un impact sur l’abondance des cellules qu’ils infectent, ainsi que sur la structure des communautés (Wommack & Colwell 2000). Ceci a des conséquences directes sur la régulation des populations phytoplanctoniques, notamment en limitant le développement des espèces majeures, concept connu sous le nom du « killing the winner » (que le meilleur perde !), ou en mettant fin à des efflorescences algales qui auraient échappé momentanément à ce contrôle par la mise en œuvre de mécanismes de résistance (Thingstad & Lignell 1997, Thingstad 2000, Jacquet et al. 2002, Thyrhaug et al. 2003, Brussaard 2004, Lennon et al. 2007).
L’action des virus en tant qu’agents de lyse cellulaire peut également avoir des répercussions indirectes sur les écosystèmes aquatiques et terrestres en perturbant les cycles biogéochimiques (impact sur les flux de carbone et sur le climat global). En effet, en lysant les organismes phytoplanctoniques, les virus réalisent un «court-circuit» dans le transfert de la matière organique vers les maillons supérieurs de la chaîne trophique (du phyto- vers le zooplancton), augmentant ainsi le pool de carbone organique dissous et particulaire (Wilhelm & Suttle 1999, Figure 2). La forme particulaire va en partie sédimenter et être séquestrée au fond des lacs et des océans, tandis que la forme dissoute va être convertie en dioxyde de carbone par la respiration bactérienne et la photodégradation dans les eaux de surface. La production bactérienne ainsi stimulée (Riemann & Middelboe 2002, Suttle 2005) par la présence d’une plus grande quantité de carbone entraîne une libération d’éléments nutritifs minéraux tels que les ions ammonium et orthophosphates. La matière organique est donc reminéralisée et un nouveau développement du phytoplancton et des bactéries dans les eaux de surface est possible grâce à cette manne nutritive. Les virus ont aussi potentiellement un rôle dans la régulation climatique via notamment la libération de diméthylsulfide dans l’atmosphère qui influence la formation de nuage et de pluie acide (Malin et al. 1998, Evans
et al. 2003, 2007). Cette libération a lieu après la lyse de certaines espèces
phytoplanctoniques efflorescentes telles que Phaeocystis pouchetii ou Emiliania huxleyi (Jacobsen et al. 1996, Castberg et al. 2002).
Bactéries hétérotrophes
Protistes flagellés Protistes ciliés MOD Zooplancton Prédateurs supérieurs MOD allochtone Virus Phytoplancton Virus Bactéries hétérotrophes
Protistes flagellés Protistes ciliés MOD Zooplancton Prédateurs supérieurs MOD allochtone Virus Phytoplancton Bactéries hétérotrophes
Protistes flagellés Protistes ciliés MOD Zooplancton Prédateurs supérieurs MOD allochtone Virus Phytoplancton Virus
Figure 2: Schéma de la boucle microbienne (en bleu) et du court-circuit viral (en rouge) dans la chaîne trophique microbienne aquatique. La lyse virale des différents compartiments microbiens (phytoplancton et bactéries hétérotrophes) libère dans le milieu des virus ainsi que des débris cellulaires constituant des produits (protéines, acides nucléiques et autres composants cellulaires) riches en éléments azotés, phosphorés ou carbonés, potentiellement utilisables par les bactéries et le phytoplancton (Gobler et al., 1997, Noble et al., 1999). L’activité virale transforme donc le carbone particulaire en carbone dissous, court-circuitant ainsi le flux de carbone et de nutriments vers les consommateurs supérieurs.
Les virus peuvent également jouer un rôle dans la diversification et l’évolution des microorganismes, qu’ils soient phytoplanctoniques ou bactériens, par transferts génétiques entre cellules, ainsi que sur leur propre diversité en intégrant dans leur génome des parties du génome de leur hôte (Weinbauer & Rassoulzadegan 2004, Ogunseitan 2008). Ces échanges de matériel génétique peuvent induire, soit une diminution de la diversité des espèces en augmentant le degré de similarité par transfert intra-spécifique, soit une augmentation de cette diversité lorsqu’il s’agit d’un transfert inter-spécifique.
Enfin, notons que les virus renferment probablement une diversité génétique colossale au sein des écosystèmes aquatiques, qu’il est critique d’étudier (Breitbart et al. 2002, 2004, Angly et al. 2006). Il est clair en effet que cette diversité est aujourd’hui très mal connue (Breitbart et al. 2008, Short & Short 2008).
Bien que l’on sache aujourd’hui que les virus jouent un rôle primordial dans les écosystèmes aquatiques, il existe un manque flagrant d’informations concernant les écosystèmes lacustres et en particulier pour les populations virales parasites du phytoplancton. L’objectif de l’étude proposé ici, qui s’intègre au projet régional PARAPHY s’intéressant à l’étude de la diversité et de la dynamique des parasites viraux et eucaryotiques du phytoplancton lacustre, est donc d’approcher le rôle fonctionnel et la diversité des parasites viraux du phytoplancton au sein des écosystèmes lacustres et plus particulièrement au sein du lac du Bourget. Au cours de ce travail de recherche, nous avons tenté plus précisément de suivre la dynamique temporelle des populations virales et phytoplanctoniques dans la zone euphotique du lac du Bourget par une analyse globale de l’abondance en cytométrie en flux, en parallèle avec un comptage par microscopie des différents taxa phytoplanctoniques. Le travail principal a été de tenter d’estimer l’importance du parasitisme viral sur la mortalité de la communauté phytoplanctonique de ce lac comparativement à la mortalité imputable à la prédation par les organismes zooplanctoniques. Dans ce but, nous avons utilisé une approche expérimentale consistant en une méthode de dilution des échantillons (Evans et al. 2003). Nous avons également entamé l’analyse de la diversité des cyanophages et des virus eucaryotiques (via l’utilisation de méthodes moléculaires d’empreintes génétiques telles que la PCR-DGGE et la PFGE) et l’isolement de certains virus à partir des cultures du laboratoire.
Les questions auxquelles nous avons tenté de répondre ont été les suivantes : - Quelle est la dynamique de la communauté phytoplanctonique et virale ?
- Quel est l’impact de la lyse virale sur la mortalité du phytoplancton comparativement à l’impact de la prédation par le zooplancton ?
- Quelle est la diversité des virus au sein de cet écosystème ?
- Peut-on isoler facilement des virus infectant les organismes phytoplanctoniques ou cyanobactériens du lac du Bourget ?
II. Matériels et Méthodes
1. Site d’étude
Le site d’étude a été le lac du Bourget (45°44’N, 05°51’W, 231,5 m d’altitude). Ce lac péri-alpin d’une superficie de 44,5 km2 est le plus grand lac naturel entièrement français. Formé il y a environ 19000 ans, il est le vestige d’un lac plus vaste issu des fontes glaciaires. La composition bicarbonatée et calcique de ces eaux résulte de la nature essentiellement calcaire du substrat géologique de son bassin versant. Orienté selon un axe Nord-Sud, il s’étend sur une longueur maximale de 18 km pour une largeur maximale de 3,4 km, et se caractérise par une profondeur maximale de 147 m (profondeur moyenne de 80 m). Le lac est principalement alimenté par trois rivières. D’après une estimation faite sur les 4 dernières années, la Leysse, qui traverse au sud la commune de Chambéry, contribue à 65% des apports, le Sierroz contribue à 25% des apports tandis que le Tillet, qui traverse à l’est la commune d’Aix-les-Bains, est responsable de 10% des apports. En période de crue du Rhône, le canal de Savières (exutoire) peut se déverser dans le lac mais il ne contribue qu’à moins de 1,5% des apports. La durée de renouvellement de ses eaux est de 8,5 ans (estimation faite en 2007) pour un volume d’eau de 3,6 milliards m3 (Jacquet et al. 2008).
Au cours des années 1970, des mesures de gestion ont été prises pour assainir le lac en proie à l’eutrophisation. Les travaux effectués alors, pour détourner le rejet des stations d’épuration des agglomérations avoisinantes vers le Rhône, ont permis de diminuer l’apport en azote et phosphore au lac. Ainsi, on est passé d’environ 150 tonnes d’apports de phosphore (estimation faite en 1983) à 33 tonnes aujourd’hui (calcul fait en 2007). Parallèlement, un suivi de la qualité des eaux a débuté en 1980. Aujourd’hui, cet écosystème est caractérisé par un statut trophique mésotrophe, en regard des critères édictés par l’Organisation de Coopération et de Développement Economiques (1982), notamment la concentration en phosphore total qui était de 22 µg/L en 2007. Même si la qualité des eaux du lac du Bourget a donc été très largement restaurée pendant les 25 dernières années, il reste en proie au développement d’une cyanobactérie filamenteuse toxique, Planktothrix rubescens, dont la dynamique de population et de production de toxines est relativement bien connue (Jacquet et
B
Figure 3 : Situation géographique et carte bathymétrique simplifiée du lac du Bourget et de la station
de référence pour les prélèvements (le point B). Source : http://www.ipgp.jussieu.fr/rech/lge/
2. Stratégie d’échantillonnage
L’échantillonnage a consisté en un prélèvement intégré de la colonne d’eau entre 0 et 20 m de profondeur au point B (point de référence, à l’endroit le plus profond du lac) afin d’avoir un aperçu global de la communauté phytoplanctonique présente dans la couche d’eau euphotique (Figure 3). Les prélèvements ont été effectués au moyen d’une pompe posée sur le pont du bateau et d’un tuyau de longueur approprié. Un volume d’eau total de 20 litres a été prélevé et stocké dans un jerrican, préalablement nettoyé avec l’eau du lac, et rempli à ras-bord afin d’éviter le plus possible les phénomènes de turbulence pendant le transport jusqu’au laboratoire. Les échantillons ont été conditionnés pour les différentes analyses dans les heures qui ont suivi les prélèvements dans l’optique de se rapprocher au maximum des conditions in
situ. Les dates de prélèvement ont été les suivantes : le 17 janvier, le 07 février, le 13 mars, le
3. Données physico-chimiques
Les données physico-chimiques, permettant d’obtenir un aperçu de l’état du système au moment des différents prélèvements, ont été relevées par la cellule technique du lac du Bourget et le laboratoire de chimie de l’INRA. Ces données ont été analysées afin d’expliquer, par la suite la dynamique des populations au cours des saisons.
4. Expériences de dilution
Le broutage et la lyse virale ont été identifiés comme étant des sources importantes de mortalité du bactérioplancton (Weinbauer & Peduzzi 1995, Jacquet et al. 2005) et du phytoplancton en milieu aquatique (Cottrell & Suttle 1995, Evans et al. 2003). De par leurs implications diverses dans les flux de matière et d’énergie au sein des réseaux trophiques microbiens, ces deux facteurs de mortalité ont des répercussions différentes sur l’écologie planctonique des lacs et plus généralement sur les cycles biogéochimiques. Ainsi, ils affectent différemment la structure, la diversité et la distribution des communautés microbiennes, et c’est pourquoi il paraît important d’étudier l’impact de chacun de ces facteurs et si possible de manière conjointe.
À partir d’une technique standard de dilution modifiée par Evans et al. (2003), il est possible en théorie d’estimer d’une part la mortalité du phytoplancton imputable aux prédateurs zooplanctoniques, et d’autre part en parallèle la mortalité imputable aux parasites viraux. Dans les expériences standard de dilution, le taux de croissance net du phytoplancton (k) est considéré comme étant le produit de la croissance instantanée (µ) et de la mortalité (m) du phytoplancton due au broutage (mg). Il est supposé que µ reste constant suivant le niveau de dilution (D) alors que mg est considéré comme dépendante de la densité des proies. Dans ce cas, le facteur de mortalité imputable aux virus est ignoré. Dans ces expériences, le diluant est généralement filtré sur une membrane <0,2 µm au travers de laquelle seuls les virus peuvent passer. Puisque les taux d’infection virale dépendent de la densité des hôtes, il peut être supposé que la mortalité due aux virus sur le phytoplancton est constante selon D et que par conséquent, l’estimation de µ inclue la composante ‘mortalité’ par les virus. Une estimation directe de la mortalité du phytoplancton imputable aux virus peut donc être obtenue en faisant la différence de la valeur de la pente des droites de régression obtenue lors de l’établissement des relations de k en fonction de D pour les différentes séries de dilution avec ou sans virus (mv = (mv + mg) – mg) comme cela est résumée sur la Figure ci-après (Figure 4).
0 0,2 0,4 0,6 0,8 1 1,2 0 0,2 0,4 0,6 0,8 1
Fraction d'eau diluée (D)
T au x de cro iss an ce n et (k )
Dilution sans brouteurs k = µ - (mv + mg) x D
Dilution en absence de brouteurs et de virus (k = (µ - mv) -mg x D)
Figure 4 : Droites de régression théoriques obtenues lors de l’analyse de l’eau du lac diluée avec
de l’eau filtrée contenant des virus (protocole standard utilisé pour déterminer le taux de broutage) ou exempte de virus. Les taux de croissance les plus importants sont attendus pour la dernière série de dilution en raison du retrait d’un facteur de mortalité supplémentaire (lyse virale). k = taux de croissance net du phytoplancton, µ = taux de croissance instantanée du phytoplancton, mg =
mortalité due au broutage par le microzooplancton, mv = mortalité due à la lyse virale, D = fraction
d’eau filtrée. D’après Evans et al. (2003).
Dans le cadre de nos expériences, la première série de dilution a consisté à diluer de l’eau brute en provenance du lac du Bourget avec de l’eau filtrée en série à travers une maille filtrante de 11 μm, puis sur fibre de verre (filtre GF/F) de porosité 0,7 μm (diamètre de 47 mm) et enfin sur un filtre de nitrocellulose de porosité 0,45 μm (diamètre de 47 mm) afin d’obtenir (en théorie) une eau ne contenant au final que des particules virales (voir Résultats). La deuxième série a consisté à opérer le même type de filtration, mis à part qu’une étape d’ultrafiltration tangentielle (à l’aide de cassettes d’ultrafiltration VIVAFLOW 200, porosité de 30 KDa, Vivascience) a été ajoutée à la filtration en série. Cette dernière étape a permis d’obtenir d’un côté de l’eau ultrapure exempte de toutes particules biologiques (dont les virus) nécessaire à cette expérience de dilution, de l’autre un faible volume de concentrat viral. Ce concentrat a été transféré dans un falcon de 50 mL conservé à –22°C afin d’effectuer par la suite des expériences d’analyse de la diversité virale par des approches de biologie moléculaire (PCR-DGGE et PFGE).
Les deux fractions ainsi obtenues ont été mélangées avec de l’eau du lac dans le but d’obtenir des pourcentages de 20, 40, 60, et 80% de l’eau brute de départ. De plus, des contrôles à 0 et 100% d’eau brute ont également été effectués afin d’évaluer l’efficacité des filtrations et obtenir les abondances initiales. Chaque dilution a été réalisée dans des bouteilles d’incubation de culture en polycarbonate de 2 L, préalablement lavées à l’acide chlorhydrique et rincées abondamment avec de l’eau bi-permutée. Les bouteilles ont été placées pendant 48
h sur une roue tournante en chambre de culture à 19°C et avec une alternance jour/nuit (14:10 h) sous une intensité lumineuse de 80 µmol quanta m-2 s-1 (Voir Photo en Annexe). Le suivi de l’abondance des communautés phytoplanctoniques, bactériennes et virales a été effectué à t0, t24 heure et à t48 heure par cytométrie en flux et l’analyse de la chlorophylle a totale à t0 et t48 a été réalisée par dosage et HPLC.
5. Analyse des abondances et caractérisation des microalgues, des bactéries hétérotrophes et des virus
5.1. La cytométrie en flux
5.1.1. Principe
Issue du milieu médical, la cytométrie en flux (CFM) est depuis une vingtaine d’années utilisée en routine pour l’analyse des microorganismes aquatiques. D’abord restreinte à la discrimination et l’énumération des populations phytoplanctoniques (Olson et al. 1985, Chisholm et al. 1988), elle a été par la suite, grâce à l’avènement des colorants fluorescents marqueurs des acides nucléiques, beaucoup utilisée pour analyser les bactéries hétérotrophes (Monger & Landry 1993, Li et al. 1995, Marie et al. 1996, 1997) puis, plus récemment les communautés virales (Marie et al. 1999, Brussaard et al. 2000). Il est à noter que de nombreux colorants existent sur le marché et ont été testés par de nombreux auteurs (Monger & Landry 1993, Marie et al. 1997, Lebaron et al. 1998).
La CFM est une technique qui permet la caractérisation individuelle, quantitative et qualitative de particules (cellules, virus…) en suspension dans un liquide. L’échantillon qui est mis sous pression est aspiré et se retrouve dans une chambre d’injection, dont la configuration particulière permet, sous l’action d’un liquide d’entraînement mis également sous pression, l’alignement en file indienne des cellules au sein d’un flux laminaire. Ces cellules sont ensuite soumises une à une à l’action d’une source lumineuse, un faisceau laser. Sous son action excitatrice, elles vont émettre des signaux optiques renseignant différents paramètres. Un premier paramètre nommé FALS (Forward Angle Light Scatter) ou FSC renseigne sur le diamètre relatif des particules au sein de l’échantillon. Un second paramètre nommé RALS (Right Angle Light Scatter) ou SSC informe sur la taille et la structure des cellules. Enfin, la fluorescence des cellules, qu’elle soit naturelle (fluorescence émise par les organismes photosynthétiques riches en pigments chlorophylliens, phycoérythrine ou phycocyanine) ou artificielle (fluorescence émise par les bactéries et virus après incubation
avec un fluorochrome) constitue le troisième et dernier type de paramètres qui peut être mesuré. Les données sont ensuite recueillies sur ordinateur et présentées sous forme de graphiques bi-paramétriques aussi appelés cytogrammes.
5.1.2. Protocole d’analyse
L’ensemble des analyses a été réalisé à l’aide du cytomètre FACSCalibur (Becton Dickinson) équipé d’une source laser fournissant 15 mW à 488 nm et de ses filtres standard. L’analyse d’1 mL d’échantillon (en triplicat) a été réalisée sans l’ajout de fixateur et de marqueur pour observer la dynamique de la communauté des picocyanobactéries mais également mettre en évidence la présence/absence de microalgues eucaryotiques. 2 µL de billes fluorescentes de diamètre calibré à 1 μm, issues d’une solution mère préparée précédemment à partir de 2 μL de billes (Molecular Probes Inc.) diluée dans 2 mL d’eau milliQ, ont été ajoutés aux échantillons comme standard interne. Deux configurations, c’est à dire deux analyses distinctes, ont ensuite été réalisées sur chaque échantillon. Le premier « setup » permettait l’analyse de la communauté des picocyanobactéries, le deuxième (avec des voltages et une valeur de seuil plus bas) permettait d’acquérir les populations de cyanobactéries et les microalgues eucaryotes de taille plus importantes.
L’analyse des communautés bactériennes hétérotrophes et virales a été faite ultérieurement après fixation d’ 1 mL d’échantillon au glutaraldéhyde 1% (concentration finale) pendant 15 minutes, cryogénisation une minute dans de l’azote liquide et conservation à -80°C. Avant leur analyse, les échantillons ont été décongelés à 37 °C pendant 2 minutes. Des triplicats ont été préparés comme suit : 10 (dilution finale au 1/50e pour les bactéries) ou 5 µL (dilution finale au 1/100e pour les virus) d’échantillons ont été dilués respectivement avec 485 ou 490 µL d’une solution de tampon TE (Tris-EDTA, pH = 8, autoclavé) filtré à travers 0,02 μm afin d’éliminer toute particule, auxquels ont été ajoutés 1 µL de billes calibrées comme standard interne et 5 µL d’un marqueur des acides nucléiques, le SYBR Green I (dilution finale au 1/10000). Le marquage a été réalisé pendant 30 minutes à température ambiante et à l’obscurité pour l’analyse des bactéries hétérotrophes et à l’obscurité pendant 15 minutes à température ambiante suivi de 10 minutes de chauffage à 75°C et 5 minutes de nouveau à température ambiante pour l’analyse des virus. Le chauffage des particules virales a permis ici une optimisation du marquage de celles-ci (Personnic 2003). Afin que les temps de marquage soient équivalents pour chaque échantillon, l’ajout de SYBR a été décalé de 1 à 2 minutes entre chaque tube.
Les fichiers (Listmodes) obtenus ont été analysés à l’aide du logiciel CYTOWIN (Vaulot 1989) disponible en libre accès sur le site de la station biologique de Roscoff : http://www.sbroscoff.fr/Phyto/cyto.htlm#cytowin.
5.2 Étude des pigments photosynthétiques par Chromatographie Liquide à Haute Performance (HPLC)
L’analyse en HPLC de la chlorophylle a et des autres pigments photosynthétiques majeurs nous a permis pour les expériences de dilution d’avoir une deuxième approche (en plus de la cytométrie en flux) pour estimer l’abondance du phytoplancton total et des différents groupes présents dans le lac à cette période.
5.2.1.Principe
Cette technique, communément utilisée pour l’étude des pigments photosynthétiques, permet la séparation, l’identification et la quantification des différents pigments et donc des différentes classes algales présentes dans un échantillon naturel. Son principe est basé sur l’interaction et le partage de solutés (constituants d’un mélange) entre deux phases, une phase solide stationnaire et une phase liquide mobile. C’est l’affinité des solutés pour chacune de ces phases qui détermine la vitesse de migration et le temps de rétention au sein du dispositif permettant ainsi la séparation des pigments. Les résultats sont obtenus sous forme de chromatogrammes à partir desquels il est possible de discriminer différents paramètres dont l’aire sous chaque pic. C’est à partir de ces paramètres que la biomasse de chaque groupe exprimé en pourcentage de la biomasse totale est calculée d’après la formule de Wilhelm et
al. (1991).
5.2.2. Protocole
Après filtration de 500 ml d’eau sur filtre GF/F de porosité 0,7 μm et de diamètre 47 mm, les filtres ont été cryogénisés dans de l’azote liquide une trentaine de secondes puis conservés dans des eppendorffs à -80°C. L’extraction des pigments a ensuite été réalisé d’après le protocole décrit par Jeffrey et al. (1996). Les échantillons analysés de cette façon ont été les suivants :
- 500 ml d’eau brute à t0
5.3 Dénombrement des taxa phytoplanctoniques
Le dénombrement des différents taxa phytoplanctoniques a été réalisé par F. Rimet (Ingénieur d’étude à l’INRA de Thonon) à partir d’un échantillon de 100 ml d’eau intégrée entre 0 et 20 m et fixé sur le bateau au moment du prélèvement par l’ajout de quelques gouttes de Lugol (réactif iodo-ioduré). 25 ml d’échantillon ont ensuite été préparés selon la technique d’Utermöhl (1958) et analysés à l’aide d’un miroscope inversé (Zeiss axiovert 135).
6. Approche moléculaire de la diversité virale : PCR-DGGE
La technique décrite ci-dessous nous a permis d’essayer d’évaluer la diversité virale d’un échantillon d’eau naturelle de la couche euphotique (0-20 m) du lac du Bourget à partir du concentrat viral obtenu lors des expériences de dilution.
6.1 Principe
La DGGE (Denaturing Gradient Gel Electrophoresis) est précédée d’une PCR (Polymerase Chain Reaction), procédé permettant l’amplification exponentielle d’une région cible du génome par la succession de trois étapes grâce à l’utilisation d’amorces spécifiques et d’une ADN polymérase thermo-résistante. Une étape de dénaturation permet la séparation des brins matrices, une étape d’hybridation permet aux amorces de venir s’hybrider de façon spécifique à leur séquence complémentaire et une étape d’élongation où l’enzyme synthétise les nouveaux brins. Lorsque la PCR est suivie d’une DGGE, comme c’est le cas ici, l’une des amorces employées possède en plus, en 5’, une queue riche en base Guanine et Cytosine (queue GC) permettant par la suite une stabilisation des fragments sous forme double brin. Les amplicons, de séquence nucléotidique différente, obtenus par PCR sont déposés sur un gel vertical de polyacrylamide à gradient linéaire dénaturant composé d’urée et de formamide. Les fragments soumis au champ électrique migrent alors selon leur séquence en base. Plus la molécule d’ADN est stable, plus la dénaturation des deux brins est retardée et plus la molécule migre loin dans le gel. Par la suite, la révélation des fragments sous ultraviolet est rendue possible par l’emploi de molécules intercalantes de l’ADN tel que le Bromure d’Ethidium (BET) ou le SYBR Gold/Green.
6.2 Protocole
Cette analyse a été réalisée à partir des concentrats viraux conservés à -22°C. Les échantillons ont été laissés à décongeler une nuit à 4°C, puis des aliquots de 250 μL ont été prélevés. Une PCR a été réalisée dans un thermocycler PTC-100 (MJ Research, Inc), à l’aide des amorces CPS1 (5’-queue GC – GTAG[T/A]ATTTTCTACATT GA[C/T]GTTGG-3’) et CPS8 (5’-AAATA[C/T]TT[A/G/T]CCAACA[T/A]ATGGA-3’). Ce jeu d’amorce a été choisi afin d’amplifier un fragment d’ADN du gène g20 spécifique des cyanophages et codant pour leur capside (Dorigo et al. 2004). Un mix PCR de 50 μL contenant 5 μlLde Tampon 10 X, 5 μL de dNTP (200 μM), 4 μL de chaque amorce CPS1/CPS8, 2,5 μL de BSA, 0,25 μL de Taq polymérase, 20 μlLd’ADN et 9,25 μL d’eau ultrapure qsp a été préparé. Le programme PCR utilisé a été défini selon le protocole de Dorigo et al. (2004).
Tableau 1 : Programme PCR pour l’amplification d’un fragment d’ADN codant pour le gène de la
capside viral g20 des cyanomyoviridae
Nb de cycle 1 35 1 Dénaturation 3 min à 94°C 15 s à 94°C -
Hybridation - 15 s à 46°C -
Elongation - 1 min à 73°C 4 min à 73°C
Après vérification des produits PCR par dépôt sur un gel d’agarose 1,5% de 7 μL d’échantillons, l’analyse DGGE a été effectuée à l’aide du système DGGE 2000 (CBS Scientific Compagny). 20 μL d’échantillons ont été déposés sur un gel de 0,75 mm d’épaisseur à 6% de polyacylamide et contenant un gradient dénaturant allant de 30 à 70%. La migration était de 16 h sous une tension de 100 V dans un bain de TAE 1X (40 mM Tris, 20 mM acétate de sodium, 1 mM d’EDTA) maintenu à 60°C. La coloration a été réalisé pendant 45 minutes avec du SYBR Gold (Molecular probes), avant de révéler les fragments sous rayonnement UV. Une photo du gel a été prise et analysée ultérieurement à l’aide du logiciel Kodak (1D 3,6 Image Analysis Sofware).
7. Isolement de virus de microalgues lacustres par infection de culture
L’essai d’isolement de virus infectant le phytoplancton a été effectué à partir de cultures du laboratoire. 7 espèces différentes provenant du lac du Bourget ont été testées (voir Annexe 1). Ces espèces ont été mises en cultures dans 50 ml de milieu composé afin d’obtenir des cultures en phase exponentielle de croissance.
L’isolement a été réalisé sur boîte de pétri, dans un milieu « semi-solide » (concentration en agar faible) composé de :
- 10 ml de culture
- 10 ml de milieu composé contenant une solution d’antibiotiques - 10 ml d’eau du lac préalablement filtrée sur 0,45 µm
- 9 ml d’une solution d’agar (6,92g.L-1 final)
La solution d’agar a été ajoutée au dernier moment après avoir mélangé et laissé reposer les 3 premières composantes pendant une heure. Les boîtes de pétri ont été réalisées en duplicats et laissées à incuber une semaine en chambre d’incubation (mêmes conditions que celles utilisées lors de l’expérience de dilution).
III. Résultats
1. Evolution des grandes variables du lac du Bourget 1.1. Evolution de la température
Entre les mois de janvier et mai, la température oscillait entre 4,8°C et 19,3°C entre 0 et 20 m. On observait logiquement une augmentation de la température entre les mois d’hiver et de printemps et ce de façon plus marquée vers la fin avril (Figure 5). On remarquait également une plus grande inertie au réchauffement entre 10 et 20 m (métalimnion) comparativement aux eaux de surface entre 0 et 10 m (épilimnion) (données non représentées).
0 10 20
Janvier (01) Février (07) Mars (13) Avril (01) Avril (16) Mai (28)
Dates de prélèvement Tem p ( °C )
Figure 5 : Evolution de la température (°C) du lac du Bourget entre janvier et mai 2008
1.2. Evolution de la concentration en nutriments
Les variations mesurées dans les concentrations des différents nutriments inorganiques et du carbone organique dissous (COD) étaient relativement faibles au cours de la période d’étude. Les concentrations moyennes en phosphate, ammonium, phosphore total, nitrates, azote total et silice étaient respectivement de 0,004 ± 0,001, 0,010 ± 0,006, 0,018 ± 0,003, 0,489 ± 0,077, 0,646 ± 0,099 et 2,274 ± 0,387 mg.L-1 (voir Annexe 2). La concentration moyenne en COD était quant à elle de 2,15 ± 0,06 mg.L-1. Le rapport N/P, susceptible de nous renseigner sur le caractère limitant du phosphore pour la croissance planctonique, diminuait de janvier à mi-avril avant de remonter progressivement au cours du mois de mai. Ce rapport restait toujours largement supérieur à 7, avec une valeur maximale de 48,7 et une valeur minimale de 23,5, suggérant le caractère permanent de la limitation par le phosphore.
1.3. Evolution du pH et de la concentration en oxygène dissous
Entre les mois de janvier et mai, le pH et la concentration en oxygène dissous évoluaient de la même façon. En effet, ces deux paramètres diminuaient en profondeur et augmentaient au cours du temps. Par exemple, le pH passait d’une valeur de 8,12 en surface en mars à 8,74 en avril, lorsque la concentration en oxygène dissous passait de 10,55 à 13,58 mg.L-1, en lien avec l’augmentation de la production phytoplanctonique (voir plus bas).
1.4. Transparence et météorologie
Entre les mois de janvier et mai, les eaux de surface devenaient de plus en plus opaques avec une transparence qui passait de 9,1 à 3,8 m avec un maximum de 10 m en février et un minimum de 3,7 m mi-avril. La zone euphotique résultante (calculée comme 2,5 fois la valeur de la transparence) était ainsi caractérisée : un maximum de 25 m et un minimum de 9,3 m. La durée d’insolation variait grandement au cours de cette période avec un minimum de 179 min fin mai et un maximum à 561 min mi-avril. Globalement l’ensoleillement a été relativement faible pendant la période d’étude, comparativement à une année type.
2. Dynamique des communautés phytoplanctoniques, bactériennes et virales 2.1. Le phytoplancton
2.1.1. Donnés acquises par cytométrie en flux
La cytométrie en flux nous a permis de discriminer la communauté des picocyanobactéries et deux autres populations également riches en phycoérythrine
Rhodomonas sp. (Cryptophycées) et des cyanobactéries filamenteuses, probablement P. rubescens (Jacquet et al. 2005, 2008). Pris dans sa totalité, l’abondance du phytoplancton
augmentait au fur à mesure de l’année (Figure 6) et ceci pouvait clairement être mis en relation avec l’augmentation de la température des eaux de surface et de l’ensoleillement. En raison de problèmes survenus lors de l’analyse du phytoplancton par cytométrie en flux au mois de janvier, aucun résultat n’a été obtenu pour ce mois-ci.
0 5 10 15 20
Février (07) Mars (13) Avril (01) Avril (16) Mai (28)
Dates de prélèvement Phy topl a nc ton (cel lu le s x 1 0 3 ml -1 )
Figure 6 : Dynamique de l’abondance du phytoplancton telle que mesurée par cytométrie en flux dans
la couche d’eau intégrée 0-20 m en sommant les différentes populations
2.1.2. Chlorophylle a (acquise via la sonde et le dosage pigmentaire)
Les données de chlorophylle a acquises via l’utilisation d’une sonde spectrofluorimétrique (Leboulanger et al. 2002) lors des différents prélèvements, ont révélé une augmentation de la concentration de ce pigment depuis le mois de janvier, avec une valeur minimale de 2,95 μg.ml-1 constatée le 17 janvier et une valeur maximale de 11,42 μg.ml-1 enregistrée le 28 mai. Une bonne corrélation était donc obtenue entre les données de chla et celles relatives au comptage en cytométrie en flux (r2 = 0,70) (voir Annexe). Nous n’avons pas pu obtenir les données HPLC probablement en raison de problèmes survenus au moment de l’extraction pigmentaire. Ce problème sera fixé ultérieurement.
2.1.3. Comptages microscopiques des taxons
Les dénombrements microscopiques des différents taxa phytoplanctoniques ont permis d’avoir à la fois un aperçu général de l’abondance mais également un aperçu du pourcentage de chaque taxon (Figure 7). Globalement, l’abondance du phytoplancton augmentait de janvier à avril. Les Cyanobactéries (représentées par Planktothrix rubescens) étaient abondantes au début de l’année 2008 (janvier-février). Au mois de mars les diatomées (Cyclotella cyclopuncta) dominaient tandis que les chlorophycées (Chlorella vulgaris et
Choricystis cf minor) augmentaient en avril. Les Cryptophycées (Rhodomonas minuta) étaient
abondantes pour les cinq premiers prélèvements étudiés. Enfin, le prélèvement de mai se distinguait des précédents car caractérisé par une abondance importante en Chrysophycées (Ochromonas sp) et une faible présence des Cryptophycées.
0% 20% 40% 60% 80% 100%
janvier (17) février (07) mars (13) avril (01) avril (16) mai (28)
Dates de prélèvement % en a bond anc e Conjuguées Chlorophycées Diatomées Chrysophycées Cryptophycées Dinophycées Cyanophycées
Figure 7 : Abondance relative (donnée en %) des différentes classes algales du lac du Bourget de
janvier à mai 2008
2.2. Les bactéries hétérotrophes
De janvier à mars, l’abondance des bactéries hétérotrophes ne variait que très peu et oscillait entre 1,55 et 1,88.106 cellules.ml-1. A partir du mois d’avril, une nette augmentation de l’abondance était observée avec un passage de 1,55.106 cellules.ml-1 mi-mars à 4,11.106 cellules.ml-1 début avril (Figure 8).
0 1 2 3 4 5
Janvier (17) Février (07) Mars (13) Avril (01) Avril (16) Mai (28)
Dates de prélèvement B actéri es H é téro tro p h es (c ell u les x 10 6 ml -1 )
Figure 8 : Dynamique de l’abondance des bactéries hétérotrophes telle que mesurée par cytométrie
en flux dans la couche d’eau intégrée 0-20 m
2.3. Les virus
L’abondance virale diminuait progressivement des mois de janvier à avril avec une valeur maximale de 6,3.107 particules.ml-1 au mois de janvier et une valeur minimale de 3,67.107 particules.ml-1 obtenue le 1er avril (Figure 9). Il était possible de discriminer plusieurs groupes
au sein de la communauté virale, nommée précédemment VLP1 à VLP4 (Duhamel et al. 2006). Ces différents groupes peuvent être discriminé sur la base de leur signature particulière en cytométrie en flux (voir Annexe 3). La population de VLP1 présente une abondance très supérieure aux autres. Les VLP2 sont relativement bien représenté. Quant aux VLP3 et VLP4 leur abondance est beaucoup plus faible et se développe de façon plus ponctuel.
0 1 2 3 4 5 6 7 8 9
Janvier (17) Février (07) Mars (13) Avril (01) Avril (16) Mai (28)
Dates de prélèvement P a rticu les vi rale s (x 10 7 ml -1 )
Figure 9 : Dynamique de l’abondance des virus telle que mesurée par cytométrie en flux dans la
couche d’eau intégrée 0-20 m
2.4. Relations entre les différents paramètres
Nous avons tenté d’établir les principales relations entre toutes les variables mesurées au travers du tableau présenté en Annexe 4 sous la forme de la valeur du coefficient de corrélation de Pearson. Ainsi nous avons trouvé qu’il existe des corrélations entre le phytoplancton, la chla et la température. Des relations existent également entre les groupes viraux et le phytoplancton. En effet, les groupes de VLP1 et VLP2 sont plutôt reliés aux picocyanobactéries alors que les deux autres groupes restant seraient plutôt reliés aux phytoplanctons eucaryotiques. Beaucoup de groupes différents sont négativement corrélés aux ions phosphates ce qui corrobore les résultats du rapport N/P.
3. Rôle fonctionnel des virus (agents de mortalité cellulaire) 3.1. Efficacité de l’expérience de dilution
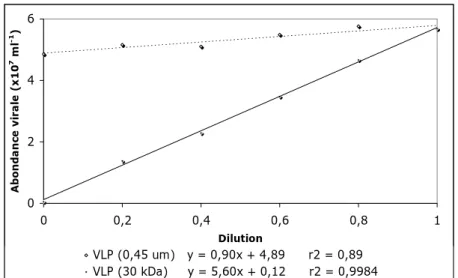
L’énumération des particules virales par cytométrie en flux nous a permis dans un premier temps de vérifier l’établissement des gradients de densité et donc de pression potentielle exercée par les parasites au sein des séries de dilution. On peut voir sur l’exemple de la Figure
10 que l’eau filtrée à travers 0,45 μm laissait bien passer les particules virales (ce qui était attendu) alors que l’eau ultrapure obtenue par ultrafiltration sur membrane de 30 kDa en était logiquement dépourvue. Sur l’ensemble des expériences conduites entre janvier et mai, nous avons obtenu un abattement viral variant entre 94% et 96%, ce qui constituait un très bon résultat. 0 2 4 6 0 0,2 0,4 0,6 0,8 1 Dilution Ab o n dan ce v irale (x 10 7 ml -1) VLP (0,45 um) y = 0,90x + 4,89 r2 = 0,89 VLP (30 kDa) y = 5,60x + 0,12 r2 = 0,9984
Figure 10 : Abondance des particules virales en fonction des dilutions pour les fractions filtrées à
travers 0,45 μm ou 30 kDa au cours de l’expérience du mois de février
3.2. Impact des virus sur les différentes communautés planctoniques
L’impact potentiel de la lyse virale vs. la prédation par le microzooplancton (flagellés, ciliés, héliozoaires) a été estimé pour les bactéries hétérotrophes et pour le phytoplancton considéré comme un tout (via la mesure de la chlorophylle a ou en additionnant tous les groupes observés en cytométrie en flux) ou population par population telle qu’observée en cytométrie mais également au regard des différents pigments. Le broutage était responsable d’environ 22% de la mortalité des bactéries hétérotrophes de janvier à mars. En revanche l’impact de la lyse virale était beaucoup plus variable et une valeur record était enregistrée au mois de janvier avec 78% de taux de mortalité. Cet impact viral diminuait en février et mars pour devenir équivalent à celui du broutage pour ce dernier mois (voir Annexe 5). Un exemple type de courbe obtenue est présenté Figure 11. Un résultat très intéressant était également obtenu en distinguant dans la communauté bactérienne les deux groupes HDNA et LDNA, révélant en fait que l’impact opérait presque (exception faite du mois de janvier avec un léger impact) exclusivement sur les HDNA, supposés représenter le groupe de cellules les plus actives (Bouvier et al. 2007).
0 0,2 0,4 0,6 0 0,2 0,4 0,6 0,8 1 Dilution T a ux de cro iss an ce m oyen d e s Hb act entr e t0 e t t48 (j ou rs -1) µm y= -0,15x + 0,32 r2 = 0,88 0,45 kDa y = -0,46x + 0,61 r2 = 0,95 30
Figure 11 : Taux de croissance des bactéries hétérotrophes (jours-1) en fonction des dilutions pour l’expérience de février
Aucun impact n’était observé sur l’ensemble de la communauté phytoplanctonique, quelque soit le descripteur (abondance totale, chla) utilisé. Un exemple du type des résultats obtenus est visualisable Figure 12. Seule une population riche en phycoérythrine déterminée par cytométrie en flux et identifié grâce aux comptages comme Rhodomonas sp. semblait avoir un impact au mois de février (Figure 13). La lyse virale était alors responsable de 67% de la mortalité de la population. 0 0,2 0,4 0,6 0,8 0 0,2 0,4 0,6 0,8 1 Dilution Ta ux de c roiss anc e moye ns d u phy topla n cton entre t0 e t t4 8 (jours -1 ) 0,45 µm y = 0,48x + 0,90 r2 = 0,95 30 kDa y = 0,32x + 1,01 r2 = 0,70
Figure 12 : Taux de croissance du phytoplancton total (jours-1) en fonction des dilutions pour l’expérience de février
0 0,2 0,4 0,6 0 0,2 0,4 0,6 0,8 1 Dilution Taux de cro issance m o yens des R ho dom on a s sp . e n tre t0 e t t4 8 (j o u rs -1) 0,45 µm y = -0,33x + 0,76 r2 = 0,16 30 kDa y = -1,10x + 1,14 r2 = 0,83
Figure 13 : Taux de croissance de Rhodomonas sp. (jours-1) en fonction des dilutions au mois de février
4. Estimation de la richesse virale par PCR-DGGE
L’analyse par PCR-DGGE de la diversité des cyanophages a montré une faible variation du nombre de bandes entre les mois de janvier (11 bandes dénombrés) et avril (13 bandes). Cependant, on constatait une diminution de la diversité au moins de mai avec la disparition de 5 bandes comparativement aux échantillons présentant le plus de diversité (Figure 14).
Figure 14 : Profils DGGE obtenus pour les cyanophages. Les puits numérotés de 1 à 6 correspondent
aux 6 prélèvements de janvier à mai.
Une estimation de la diversité des virus de microalgues eucaryotiques par PCR-DGGE devait également être faite au cours de ce stage. Malheureusement, en raison de problèmes techniques lors d’une étape de concentration des virus par ultracentrifugation, l’expérience n’a pu être menée à bien. Elle sera refaite ultérieurement à partir d’eau conservée. De la
même manière, nous n’avons pas encore de résultats à présenter en PFGE, l’utilisation de l’outil devant être optimisée.
5. Tentative d’isolement de virus
De multiples essais afin de définir la concentration d’agar nécessaire à la réalisation d’un milieu semi-solide propice au développement des microalgues ont été conduits. Cette étape réalisée, des expériences d’isolement ont été réalisées pour les prélèvements de mi-avril et de mai. Aucune plage de lyse n’a pue être visualisé à ce jour sur les différentes boîtes aux différents prélèvements.
IV. Discussion
La dynamique des populations phytoplanctoniques suivait un profil classique pour cette période de l’année avec une augmentation progressive de l’abondance totale. Cette augmentation (corroborée également par celle de la concentration en chlorophylle a) était corrélée positivement avec l’augmentation de la température des eaux du lac. Cet accroissement de biomasse était également corrélée négativement avec la transparence des eaux et la concentration en silice, suggérant l’utilisation de cette ressource par les diatomées (Cyclotella cyclopuncta et Fragilaria crotonensis principalement). La succession des différents groupes phytoplanctoniques était cohérente avec ce que l’on a l’habitude de voir sur le lac du Bourget avec notamment la présence de P. rubescens ou encore le développement de cryptophycées à la fin de l’hiver (Jacquet et al. 2008). Au total, ce sont 30 taxa qui ont pu être déterminés par observation directe mais seulement 5 d’entre eux représentaient l’essentiel de la biomasse pendant la période d’étude (hiver et début du printemps). Nos résultats ont également révélé une disparition quasi totale des Rhodomonas sp., remplacés par des Chrysophycées au printemps, suggérant que la première population ait pu être limitée par les ressources et/ou broutée efficacement et/ou encore ayant subit un impact viral fort. A cette période, les fortes valeurs de transparence suggéraient la mise en place de la phase des eaux claires corroborant le rôle ayant pu être joué par le zooplancton.
La communauté des bactéries hétérotrophes augmentait plus tardivement, au début du mois d’avril. Comme cela a été montré par ailleurs pour cette même période en 2008 (Thomas & Jacquet non publié), l’activité et la production bactérienne augmentaient également au fur et à mesure de l’avancement dans la saison, révélant l’importance de l’augmentation de la température sur le métabolisme cellulaire. Bien qu’aucune diminution de l’abondance du phytoplancton n’ait été observée à ce moment là et aucune corrélation significative entre bactéries et phytoplancton, il n’est pas exclu que les bactéries aient utilisé des produits d’excrétion ou des restes de cellules phytoplanctoniques en plus des éléments inorganiques pour croître. Le suivi de la proportion des bactéries HDNA et LDNA était très légèrement en faveur de ces dernières mais la proportion des HDNA augmentait au fur et à mesure de l’étude corroborant l’accroissement de l’activité cellulaire (Bouvier et al. 2007).
L’abondance des virus diminuait de janvier à début avril, puis augmentait par la suite. Nous avons observé que les deux groupes viraux VLP1 et VLP2, qui constituaient l’essentiel de la
communauté virale, étaient corrélés positivement respectivement avec la communauté des picocyanobactéries et la chla. Cela pouvait suggérer que certains de ces virus étaient majoritairement des cyanophages (voir plus bas). L’analyse détaillée des différents groupes viraux et du phytoplancton a également révélé que les VLP3 et les VLP4 (apparaissant nettement en avril) pouvaient être respectivement rattachés à des populations phytoplanctoniques eucaryotiques et à des populations phytoplanctoniques riches en phycoérythrine. Les virus présentant cette signature particulière pourraient donc être spécifiques d’organismes autotrophes, comme cela a déjà été suggéré dans le Léman, voisin, par Duhamel et al. (2006) ou ailleurs (Jacquet et al. 2002, Larsen et al. 2004). L’absence totale de corrélation entre les VLP4 et les bactéries hétérotrophes et/ou les picocyanobactéries tendaient d’ailleurs à confirmer cette hypothèse même si l’on sait que corrélation ne signifie pas cause à effet et qu’il faut rester prudent sur ce type de relations. D’ailleurs, nous n’avons observé aucune corrélation entre les VLP1 et les bactéries, résultat que l’on pouvait légitiment attendre et qui a été observé plusieurs fois par le passé sur les 3 lacs de la Région Rhône Alpe (Personnic 2007).
La dynamique des populations/communautés nécessite de s’intéresser notamment aux processus intervenant dans la croissance et la mortalité des organismes. Ainsi la mesure de la prédation et/ou de la lyse virale constitue un paramètre clef en écologie fonctionnelle. La technique de dilution modifiée que nous avons utilisée présente le grand avantage de permettre d’appréhender de façon directe et simultanée l’impact des virus et des prédateurs brouteurs sur les bactéries et/ou le phytoplancton (Evans et al. 2003, Jacquet et al. 2005, Baudoux et al. 2006, Kimmance et al. 2007, Tijdens et al. 2008). Nos expériences réalisées de janvier à mai ont montré qu’il semble exister un impact très fort des virus en février et en mars sur la communauté bactérienne avec un pourcentage de mortalité allant jusqu’à 78%. Comme nous l’avons dit plus haut, la majorité des virus aquatiques étant des bactériophages, ce résultat n’était donc pas très étonnant, bien que l’on pouvait aussi s’attendre en période hivernale à une prévalence du cycle lysogènique sur le cycle lytique faute notamment de conditions favorables au métabolisme des hôtes (Thomas & Jacquet non publié). La mortalité bactérienne imputable aux virus variait entre (23 et 78%) et ces valeurs ont déjà été rapporté pour le lac du Bourget ou d’autres écosystèmes comparables (Simek et al. 2001, Jacquet et al. 2005, Colombet et al. 2006). Clairement, les virus interviennent de manière très importante dans la mortalité procaryotique dans le lac du Bourget, même en période hivernale.
Un tel impact des virus n’a pu être mesuré que pour une seule population, Rhodomonas sp, au mois de février. Aucun autre impact n’a pu être mis en évidence suggérant possiblement l’absence réelle de lyse et donc du rôle mortel des virus durant la période de notre étude. Il n’existe à ce jour que quelques études ayant utilisé cette technique de dilution pour apprécier l’impact des virus sur la mortalité phytoplanctonique. Toutes ces études ont révélé l’applicabilité de la méthode mais aussi l’absence potentielle de lyse à certains moments (Baudoux et al. 2006, Kimmance et al. 2007, Tijdens et al. 2008). On note également, que lorsqu’un impact a pu être montré, celui-ci l’a été uniquement au printemps ou en été. Diverses raisons pourraient permettre d’expliquer l’absence de lyse : un faible pouvoir infectieux des virus, leur faible concentration comme cela est suggéré par les groupes VLP3 et VLP4 ainsi que celle des hôtes, rendant les contacts hautement improbables ou encore des conditions environnements défavorables. Le simple fait de trouver un impact en hiver sur la population de Rhodomonas, dans une phase de bloom, suggère néanmoins la possibilité d’un contrôle efficace sur certaines populations caractéristiques du phytoplancton du lac du Bourget.
On ne peut complètement exclure que l’absence de lyse notable sur le phytoplancton soit aussi indépendante de la méthodologie employée. Nous avons choisi de diluer nos échantillons avec de l’eau filtrée sur 0,45 µm afin de conserver la grande majorité des virus ; notamment les virus eucaryotiques qui peuvent être supérieures en taille à 0,2 µm (Larsen et
al. 2001, 2004). Il semble donc exclu que nous ayons éliminé les virus d’intérêt en utilisant ce
type de filtration. Toutefois, la succession et le temps nécessaire aux différentes étapes de filtration et d’ultrafiltration ont pu induire des pertes d’organismes (Personnic et al. en préparation). Une autre critique pouvant être faite ici concernait la durée des expériences : 48 h pouvant être considéré comme un temps d’incubation trop court pour observer un effet, en lien avec le temps de génération des populations. D’un autre côté, il eut été difficile d’incuber nos communautés plus de temps et en si faible volume (2 L) pour éviter les biais liés au confinement et au caractère potentiellement limitant des ressources nutritives (Kimmance et
al. 2007, Calbet et al. 2008).
En plus de la dynamique des communautés planctoniques et du rôle fonctionnel potentiel des virus sur la dynamique et la diversité du phytoplancton, nous avons commencé à appréhender la diversité virale du lac du Bourget. La technique de PCR-DGGE que nous avons utilisé nous a permis d’apprécier la diversité d’une famille de virus cyanophages grâce à l’emploi d’amorces amplifiant spécifiquement un gène codant une protéine de la capside (Marston et