Les neurones à calrétinine du striatum : comparaisons
inter-espèces et études anatomopathologiques
Thèse
Sarah Petryszyn
Doctorat en neurobiologie
Philosophiae doctor (Ph. D.)
Québec, Canada
© Sarah Petryszyn, 2017Les neurones à calrétinine du striatum : comparaisons
inter-espèces et études anatomopathologiques
Thèse
Sarah Petryszyn
Sous la direction de :
Martin Parent, directeur de recherche
André Parent, codirecteur de recherche
iii
Résumé en français
Chez les primates, les interneurones GABAergiques qui expriment la calrétinine (CR) sont les interneurones les plus abondants du striatum. Pourtant, à ce jour, leur rôle reste encore mal connu. L’utilisation de techniques d’immunohistochimie en association avec des mo-dèles animaux de la maladie de Parkinson, nous a permis de mieux caractériser ces inter-neurones. Une première série de travaux décrit pour la toute première fois la distribution et la composition neurochimique des interneurones CR+ chez la souris en condition normale. Ces données ont été directement comparées aux caractéristiques des interneurones CR+ chez les primates humains et non humains. Chez la souris, deux types morphologiques d’interneurones CR+ sont présents : l’un petit et l’autre de taille intermédiaire ; ils se répar-tissent de manière hétérogène dans le striatum dorsal. Chez le singe et l’humain, trois types morphologiques d’interneurones CR+ existent. En effet, en plus d’interneurones CR+ de petite taille et de taille intermédiaire, il existe des interneurones CR+ de grande taille qui appartiennent en majorité à la catégorie des interneurones cholinergiques du striatum. L’utilisation d’un modèle de souris transgénique Drd1a-tdTomato/Drd2-EGFP (D1/D2) a permis de confirmer que les interneurones cholinergiques exprimaient le récepteur à la do-pamine (DA) D2 et de démontrer que les interneurones CR+ chez la souris sont dépourvus des récepteurs D1 et D2. Dans une seconde série de travaux, nous avons cherché à savoir comment la distribution et la composition neurochimique des interneurones CR+ étaient affectées dans le modèle murin de la maladie de Parkinson. Du côté de la lésion 6-hydroxydopamine (6-OHDA), les souris présentent une forte dénervation DAergique du striatum, l’une des principales caractéristiques de la maladie de Parkinson. Dans ces cir-constances, seule la densité des interneurones CR+ de taille intermédiaire, dont 13 % appa-raissent immunoréactifs pour la tyrosine hydroxylase (TH), est significativement diminuée dans le striatum dorsal. Bien que le noyau accumbens (Acb) subisse également une forte baisse de son innervation DAergique induite par la lésion 6-OHDA, les interneurones CR+ présents dans l’Acb, dont certains sont aussi immunoréactifs pour la calbindine (CB), ne sont pas affectés en terme de nombre et de distribution. La troisième série de travaux nous a permis de reproduire ces analyses chez le primate grâce à l’utilisation du modèle animal de la maladie de Parkinson par intoxication au 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine
iv
(MPTP). Les résultats indiquent que la densité des interneurones CR+ de grande taille est fortement accrue dans le striatum des animaux intoxiqués par le MPTP. Cette forte aug-mentation de la densité des interneurones CR+ de grande taille est couplée à une augmenta-tion significative de la proporaugmenta-tion d’interneurones ChAT+/CR+. L’ensemble de ces don-nées suggère fortement que les interneurones striataux CR+ soient sensibles à une diminu-tion de la concentradiminu-tion en DA dans le striatum dorsal, qui caractérise la maladie de Parkin-son. Finalement, une quatrième série de travaux nous a permis de découvrir un regroupe-ment de cellules de petite taille et au phénotype D1 au sein même de l’Acb chez la souris D1/D2, suggérant l’existence d’un nouvel îlot de Calleja dans cette région du cerveau.
v
Résumé en anglais
In the primate striatum, GABAergic neurons that express calretinin (CR) are the most abundant interneurons. Their role within this major basal ganglia component is still un-known. Immunohistochemical techniques used in animal models of Parkinson’s disease allowed us to better characterize these interneurons. A first series of studies enabled us to provide the very first description of the distribution and neurochemical phenotype of the CR+ interneurons in mice striatum, under normal condition. Data was compared to similar findings that were gathered in human and non-human primates. In mice, two morphological phenotypes of CR+ interneurons are present: (1) small and (2) medium-sized CR+ interneu-rons, both distributed in a heterogeneous way within the dorsal striatum. In primates (both human and non-human), three morphological phenotypes of CR+ interneurons are present within the striatum. In addition to small and medium-sized CR+ interneurons, primates display large-sized CR+ interneurons, which mostly belong to the cholinergic interneurons of the striatum. The use of a double transgenic mouse model Drd1a-tdTomato/Drd2-EGFP (D1/D2) confirmed that the cholinergic interneurons express the dopaminergic (DA) recep-tor D2, while CR+ interneurons are devoid of D1 and D2. In a second study, we investigated how the distribution and the neurochemical phenotype of the CR+ interneurons are affected in the 6-hydroxydopamine (6-OHDA) mouse model of Parkinson’s disease. In the lesioned striatum, these mice displayed a strong DAergic depletion, one of the main hallmarks of Parkinson’s disease. Under these circumstances, only the density of the medium-sized CR+ interneurons, 13 % of which are immunoreactive for the tyrosine hydroxylase (TH), was decreased within the dorsal striatum. In the accumbens nucleus (Acb), the number and dis-tribution pattern of CR+ interneurons, which are also immunoreactive for calbindin (CB), were not affected, despite that the Acb was also significantly depleted in DA. In a third study, the state of the CR+ striatal interneurons was investigated in a simian model of Par-kinson’s disease, involving 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) intoxica-tion. Results indicate that the density of the large-sized CR+ interneurons is dramatically increased within the striatum of MPTP-intoxicated animals. This increase goes along with higher proportion of cholinergic interneurons expressing CR. Altogether, our data suggest that the CR+ interneurons are sensitive to a decrease of the DAergic level in the striatum
vi
that characterizes Parkinson’s disease. Finally, a detailed analysis of the Acb in the D1/D2 mice allowed us to detect the presence of a novel island of Calleja located within this brain region.
vii
Table des matières
RÉSUMÉ EN FRANÇAIS ...
IIIRÉSUMÉ EN ANGLAIS ...
VTABLE DES MATIÈRES ... VII
LISTE DES TABLEAUX ...
XIILISTE DES FIGURES ... XIII
LISTE DES ABRÉVIATIONS ET DES SIGLES ...
XVIREMERCIEMENTS ...
XIXAVANT-PROPOS ...
XXCHAPITRE 1 ... 1
CONTEXTE SCIENTIFIQUE ... 1
1 Le striatum ... 4
1.1 Description anatomique et neurochimique ... 4
1.2 Hodologie ... 7
1.2.1 Les afférences striatales ... 8
1.2.1.1 Les projections cortico-striées ... 8
1.2.1.2 Les projections nigro-striées ... 11
1.2.1.3 Les afférences striatales en provenance du noyau du raphé ... 11
1.2.1.4 Les projections thalamo-striées ... 12
1.2.1.5 Les projections subthalamo-striées ... 12
1.2.1.6 Les afférences en provenance du noyau pédonculopontin ... 13
1.2.1.7 Les afférences GABAergiques du striatum ... 13
1.2.2 Les efférences striatales ... 14
1.2.2.1 Les neurones de projection du striatum ... 14
1.2.2.2 Modèle fonctionnel des ganglions de la base (d’hier à aujourd’hui) ... 16
1.3 Les interneurones du striatum ... 18
1.3.1 Les interneurones cholinergiques du striatum ... 21
1.3.2 Les interneurones GABAergiques du striatum ... 25
2 Les interneurones à calrétinine... 31
2.1 Caractéristiques générales ... 32
2.1.1 Morphologie ... 32
2.1.2 Distribution ... 34
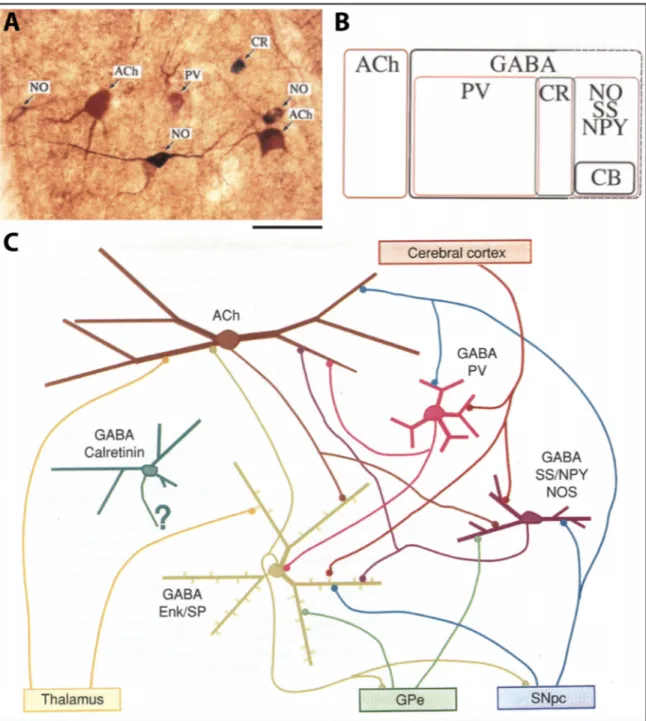
2.1.3 Composition neurochimique ... 36
2.1.4 Hodologie ... 38
2.2 La calrétinine : une protéine liant le calcium ... 38
2.2.1 Propriétés ... 38
2.2.2 Développement ... 40
viii
2.3.1 Ischémie et hypoxie ... 42
2.3.2 Schizophrénie ... 43
2.3.3 Syndrome de Gilles de la Tourette ... 43
2.3.4 La maladie de Huntington ... 44 2.3.5 La maladie de Parkinson ... 45 3 La maladie de Parkinson ... 47 3.1 Épidémiologie et symptomatologie ... 47 3.1 Anatomopathologie ... 49 3.2 Traitements ... 51 3.2.1 Traitements pharmacologiques ... 51 3.2.2 Traitements chirurgicaux ... 52 3.3 Étiologie ... 52 3.4 Modèles animaux ... 54
3.4.1 Injection unilatérale de 6-hydroxydopamine (6-OHDA) ... 54
3.4.2 Intoxication au MPTP ... 56
4 Problématique ... 59
CHAPITRE 2 ... 63
DISTRIBUTION AND MORPHOLOGICAL CHARACTERISTICS OF STRIATAL
INTERNEURONS EXPRESSING CALRETININ IN MICE: A COMPARISON WITH HUMAN AND NONHUMAN PRIMATES ... 631 Résumé ... 64
2 Abstract ... 65
3 Introduction ... 67
4 Material and Methods ... 69
4.1 Tissue preparation... 69
4.1.1 Mice. ... 70
4.1.2 Monkeys ... 70
4.1.3 Humans ... 71
4.2 Single immunostaining for calretinin ... 71
4.3 Single immunostaining for choline acetyltransferase ... 72
4.4 Double-immunostaining for calretinin and choline acetyltransferase ... 73
4.5 Data analysis ... 73
4.6 Statistical analysis ... 74
5 Results ... 75
5.1 Mice ... 75
5.2 Human and nonhuman primates ... 77
6 Discussion ... 78
6.1 The small striatal calretinin cells ... 78
6.2 The medium-sized striatal calretinin interneurons ... 81
ix
7 Acknowledgments ... 85
8 Figures ... 86
CHAPITRE 3 ... 91
CALRETININ INTERNEURONS OF THE STRIATUM IN NORMAL AND
6-OHDA-LESIONED MICE ... 911 Résumé ... 92
2 Abstract ... 93
3 Introduction ... 95
4 Material & Methods: ... 97
4.1 Animals ... 97
4.2 6-OHDA unilateral injection ... 97
4.3 Behavioral assessment ... 98
4.4 Tissue preparation... 98
4.5 Evaluation of DA depletion ... 98
4.6 Immunostaining for CR ... 99
4.7 Double-immunofluorescence for CR and TH ... 100
4.8 Data analysis ... 101 4.8.1 Analysis of TH immunoreactivity ... 101 4.8.2 Stereological analysis ... 101 4.8.3 Image analysis ... 102 4.8.4 Statistical analysis ... 103 5 Results ... 104
5.1 The 6-OHDA-lesioned mice exhibit a preferential rotation behavior ipsilateral to the lesion and a marked reduction of TH and DAT striatal immunoreativity ... 104
5.2 Small-CR+ interneurons are unaffected by 6-OHDA lesion ... 104
5.3 The density of medium-CR+ interneurons is significantly lower following 6-OHDA lesion ... 106
5.4 The distribution of CR+ interneurons in the Acb of sham and 6-OHDA-lesioned mice ... 107
5.5 Phenotype characterization of the medium-sized CR+interneurons which are decreased in 6-OHDA ... 108 6 Discussion ... 109 7 Conclusion ... 114 8 Acknowledgements ... 114 9 Figures ... 115 10 Supplementary material ... 123
CHAPITRE 4 ... 124
THE NUMBER OF STRIATAL CHOLINERGIC INTERNEURONS EXPRESSING
CALRETININ IS INCREASED IN PARKINSONIAN MONKEYS ... 124x
2 Abstract ... 126
3 Introduction ... 128
4 Materials and methods ... 129
4.1 Animals ... 129
4.2 MPTP intoxication ... 130
4.3 Bromo-deoxyuridine injections ... 130
4.4 Transcardiac perfusions ... 130
4.5 Nigral cell losses following MPTP intoxication ... 131
4.6 Striatal dopamine depletion following MPTP intoxication ... 132
4.7 CR immunostaining ... 133
4.8 CR and ChAT double-immunostaining ... 134
4.9 CR and BrdU double-immunostaining ... 134
4.10 Confocal imaging and statistical analysis ... 135
5 Results ... 135
5.1 Clinical and morphological effects of MPTP-induced dopamine denervation 135 5.2 Morphological characteristics and numerical densities of striatal CR+ interneurons ... 136
5.3 Double-immunostaining for CR and ChAT ... 138
5.4 Bromo-deoxyuridine labeling experiments ... 139
6 Discussion ... 139
6.1 The striatal CR+ interneurons in normal condition ... 140
6.2 The striatal CR+ interneurons in parkinsonian condition ... 140
6.3 Concluding remarks ... 143
7 Acknowledgements ... 144
8 Figures ... 145
9 Supplementary material ... 150
CHAPITRE 5 ... 155
A DENSE CLUSTER OF D
1+ CELLS IN THE MOUSE NUCLEUS ACCUMBENS .. 155
1 Résumé ... 156
2 Abstract ... 157
3 Acknowledgements and funding information ... 162
4 Figures ... 163
CHAPITRE 6 ... 165
DISCUSSION ... 165
1 Les interneurones striataux exprimant la calrétinine : différences inter-espèces ... 167
1.1 Nombre et distribution topographique ... 167
1.2 Caractéristiques morphologiques ... 169
xi
2 Effet de la variation du niveau de dopamine sur l’expression de la calrétinine
par les interneurones du striatum ... 175
2.1 Les interneurones exprimant la calrétinine dans un contexte parkinsonien chez le rongeur... 175
2.2 Les interneurones exprimant la calrétinine dans un contexte parkinsonien chez le singe ... 177
3 Le cas particulier des îlots de Calleja ... 179
4 Conclusion générale ... 180
xii
Liste des tableaux
Chapitre 3 :
Calretinin interneurons of the striatum in normal and 6-OHDA-lesioned mice
Table 3.1. List of primary antibodies used for immunostaining procedures. ... 120 Table 3.2. Regional distribution of interneurons expressing calretinin (CR) in the striatum of sham-lesioned mice. ... 121 Table 3.3. Neurochemical phenotype of interneurons expressing calretinin (CR) and the tyrosine hydroxylase (TH). ... 122
Chapitre 4 :
The number of striatal cholinergic interneurons expressing calretinin is increased in parkinsonian monkeys
Table 4.S1. Information on control and MPTP-intoxicated monkeys used in the present study. ... 151 Table 4.S2. List of primary antibodies used for immunostaining procedures. ... 152 Table 4.S3. Data on stereological counting of CR+ striatal interneurons in the caudate nucleus of control and MPTP-intoxicated monkeys... 153 Table 4.S4. Data on stereological counting of CR+ striatal interneurons in the putamen of control and MPTP-intoxicated monkeys. ... 154
Chapitre 6 : Discussion
Tableau 6.1. Résumé des principales données rapportées sur la description des
interneurones CR+ du striatum chez la souris (Petryszyn et al., 2014). ... 166 Tableau 6.2. Résumé des principales données rapportées sur les interneurones CR+ du striatum chez le primate (singe cynomolgus; Petryszyn et al., 2016). ... 167
xiii
Liste des figures
Chapitre 1 :
Contexte scientifique
Figure 1.1 Ouvrage de Thomas Willis intitulé Cerebri Anatome. ... 2
Figure 1.2. Organisation anatomique des ganglions de la base chez le primate et le rongeur. ... 6
Figure 1.3. Représentation schématique du circuit des ganglions de la base. ... 8
Figure 1.4. Les territoires fonctionnels du striatum chez le primate et le rongeur. ... 10
Figure 1.5. Morphologie d’un neurone de projection du striatum chez le rat. ... 15
Figure 1.6. Représentation des différentes catégories d’interneurones du striatum. ... 20
Figure 1.7. Morphologie des interneurones cholinergiques du striatum chez le rat et l’humain. ... 22
Figure 1.8. Représentation de l'équilibre DA et acétylcholine (ACh) au sein du striatum. . 25
Figure 1.9. Morphologie des interneurones NADPH+ chez le rat et l'humain. ... 26
Figure 1.10. Morphologie des interneurones PV+ chez le rat et l'humain. ... 28
Figure 1.11. Morphologie et distribution des interneurones TH+ du striatum chez le rat et l'humain. ... 29
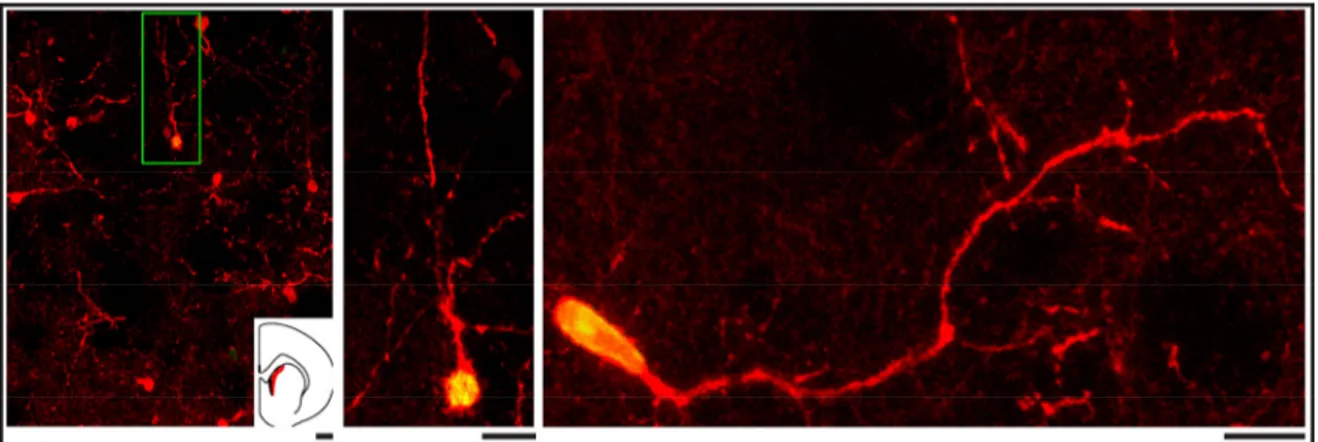
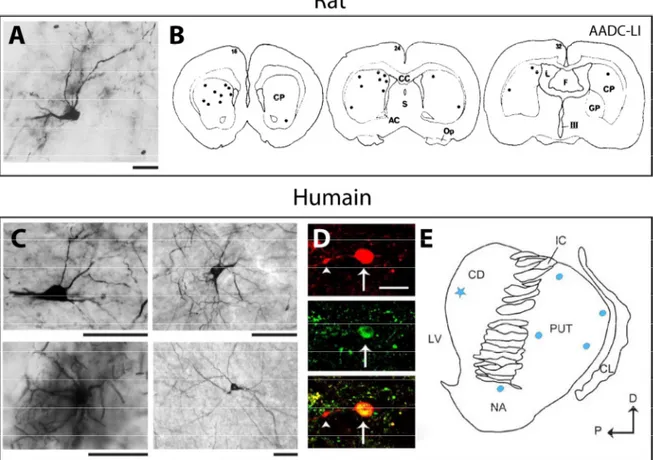
Figure 1.12. Morphologie des interneurones CR+ chez le rat et l'humain. ... 34
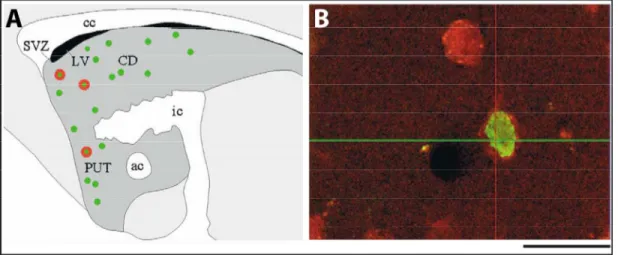
Figure 1.13. Distribution des interneurones CR+ chez le rat et chez l'humain. ... 35
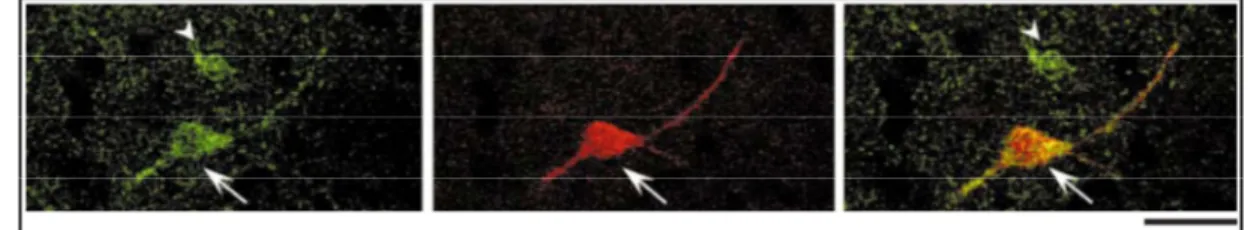
Figure 1.14. Colocalisation de la ChAT et de la TH dans les interneurones CR+ chez l'humain. ... 37
Figure 1.15. Expression du récepteur D5 par les interneurones CR+ chez le rat. ... 37
Figure 1.16. Neurogenèse striatale postnatale des interneurones CR+ chez le rat. ... 40
Figure 1.17. Neurogenèse postnatale dans le striatum chez le singe (Saimiri sciureus). ... 41
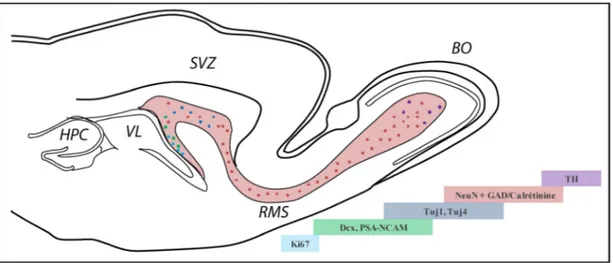
Figure 1.18. Schématisation de la neurogenèse le long de la voie de migration vers le bulbe olfactif. ... 42
Figure 1.19. Changement de phénotype des interneurones CR+ chez un modèle simien de la maladie de Parkinson. ... 46
Figure 1.20. Statuette représentant la posture typique du patient parkinsonien. ... 48
Figure 1.21. Illustration du mécanisme d'action de la 6-OHDA. ... 55
Figure 1.22. Illustration du principal mécanisme d’action du MPTP. ... 58
Chapitre 2 : Distribution and morphological characteristics of striatal interneurons expressing calretinin in mice: A comparison with human and nonhuman primates Figure 2.1. Morphological characteristics of striatal cells expressing calretinin (CR) in mice. ... 86
xiv
Figure 2.2. Topographical distribution of striatal cells expressing calretinin (CR) in mice. 87 Figure 2.3. Neurochemical features of striatal cells expressing calretinin (CR) or choline acetyl-transferase (ChAT) in Drd1a-TdTomato/Drd2-EGFP (D1/D2) mice... 88 Figure 2.4. Morphological features of striatal cells expressing calretinin (CR) in the squirrel monkey. ... 89 Figure 2.5. Morphological characteristics of striatal cells expressing calretinin (CR) in humans. ... 90
Chapitre 3 :
Calretinin interneurons of the striatum in normal and 6-OHDA-lesioned mice
Figure 3.1. Evaluation of dopaminergic depletion following a unilateral 6-OHDA lesion. ... 115 Figure 3.2. The interneurons expressing calretinin (CR) in the striatum of sham and 6-OHDA-lesioned mice. ... 116 Figure 3.3.The interneurons expressing calretinin (CR) in the nucleus accumbens (Acb) of sham and 6-OHDA-lesioned mice. ... 117 Figure 3.4. Medium-sized interneurons expressing calretinin (CR) in the nucleus
accumbens (Acb) of sham mice... 118 Figure 3.5. Neurochemical phenotype of interneurons expressing calretinin (CR) in the striatum of 6-OHDA-lesioned mice. ... 119 Figure 3.S1. Dopaminergic depletion in the nucleus accumbens (A) and the striatum (B) following a unilateral 6-OHDA lesion in mice. ... 123
Chapitre 4 :
The number of striatal cholinergic interneurons expressing calretinin is increased in parkinsonian monkeys
Figure 4.1. MPTP administration causes severe lesion of the dopaminergic nigrostriatal pathway. ... 145 Figure 4.2. Regional distribution of all CR+ interneurons in the striatum of control and MPTP monkeys. ... 146 Figure 4.3. Morphological features and regional distribution of the three types of
CR+interneurons throughout the striatum of control and MPTP monkeys. ... 147 Figure 4.4. The number of striatal cholinergic interneurons expressing CR is increased in MPTP monkeys. ... 148 Figure 4.5. A few BrdU-labeled cells are found within the striatum of normal and MPTP monkeys. ... 149 Figure 4.S1. MPTP administration causes severe lesion of the dopaminergic nigrostriatal pathway. ... 150
xv
Chapitre 5 :
A dense cluster of D1+ cells in the mouse nucleus accumbens
Figure 5.1. Localization and neurochemical content of a dense striatal cluster exclusively composed of D1+ cells. ... 163 Figure 5.2. Morphological features of the D1+ cells that compose thecluster in the nucleus accumbens. ... 164
xvi
Liste des abréviations et des sigles
5-HT sérotonine/sérotoninergique 6-OHDA 6-hydroxydopamine
ac commissure antérieure Acb noyau accumbens
ACh acétylcholine, cholinergique ADL antero-dorso-lateral
ADM antero-dorso-medial
AMPc adénosine monophosphate cyclique
AMPA α-amino-3-hydroxy-5-methyl-4-isoxazolepropionate AVL antero-ventro-lateral AVM antero-ventro-medial BrdU bromo-déoxyuridine C core cc corps calleux CB calbindine D28k Cd noyau caudé
ChAT choline acétyltransférase
CR calrétinine
CRIUSMQ Centre de Recherche de l’Institut Universitaire en Santé Mentale de Québec
D1/D2 Drd1a-tdTomato/Drd2-EGFP DA dopamine/dopaminergique DAB 3,3’diaminobenzidine
DAPI 4’, 6-diamidino-2-phenylindole
DARPP32 phosphoprotéine 32 régulée par la dopamine et l’adénosine mono-phosphate cyclique
DAT transporteur membranaire de la dopamine Dj-1 daisuke-junko-1
DLS striatum dorso-latéral DMS striatum dorso-médian FSI fast spiking interneurons
GABA acide γ-aminobutyrique
GAD glutamate décarboxylase GP globus pallidus
GPe segment externe du globus pallidus GPi segment interne du globus pallidus GPv globus pallidus ventral HL hypothalamus latéral ic capsule interne ICj îlot de Calleja
ICjM îlot majeur de Calleja (ou insula magna) IdU iodo-déoxyuridine
xvii
L-AAD acide L-amino aromatique-décarboxylase ou dopa décarboxylase LRRK2 leucine rich repeat kinase 2
LTS lower threshold spiking neurons
LV ventricule latéral MAO monoamine oxydase
mfb faisceau prosencéphalique médian MPP+ 1-methyl-4-phenylpyridinium
MPTP 1-methyl-4-phényl-1,2,3,6-tétrahydropyridine
NADPH-d nicotinamide adénine dinucléotide phosphate-diaphorase NeuN marqueur neuronal nucléaire
NK1-R récepteur à la neurokinine-1 NO oxyde nitrique
NOS oxyde nitrique synthase NPY neuropeptide Y
PAN phasically active neurons
PB phosphate buffer
PBS phosphate saline buffer
PD Parkinson’s disease
PFA paraformaldehyde
PINK1 PTEN-induced putative kinase 1
Put putamen
PV parvalbumine
RMS rostral migratory stream
S shell
SI substantia innominata SN substance noire
SNc substance noire compacte SNr substance noire réticulée SOM somatostatine
STN noyau subthalamique SVZ zone sous-ventriculaire TAN tonically active neurons
TBS tris-buffered saline
TO tubercule olfactif TH tyrosine hydroxylase UPS ubiquitine et protéasome VIP peptide intestinal vaso-actif
xviii
« Sur les montagnes le plus court chemin va d’un sommet à l’autre : mais pour suivre ce chemin il faut que tu aies de longues jambes »
xix
Remerciements
Je remercie tout d’abord, ma famille, qui m'a soutenue tout au long de mon projet de thèse.
Je tiens ensuite, à remercier mon directeur et mon co-directeur de thèse d'avoir accepté de diriger ma thèse et de m’avoir permis d'assister à de nombreux congrès internationaux et nationaux, afin de présenter mes résultats. Je les remercie pour leurs conseils et leur juge-ment qui m’ont permis d’aboutir à l’issue de la thèse et à la publication de 3 articles scienti-fiques originaux. Je remercie également chacun des membres du jury pour avoir accepté d’évaluer cette thèse.
Je suis reconnaissante envers mes collègues et, plus particulièrement Dave et Marie-Josée qui m’ont accompagnée au cours de ces années, ainsi que Maria et Laurent pour leurs re-gards avisés et leurs précieux conseils. Aussi, je remercie les nombreux stagiaires qui m'ont apporté de l'aide et de la distraction dans mes projets.
Je remercie allègrement mes deux collègues pétillantes du comité étudiants pour leur franc-parler, leur dynamisme et leur efficacité ; tous mes colocataires qui m’ont toujours encou-ragée et grâce à qui de belles amitiés ont pu naître. Sans surprise, je remercie la COSA. On se reverra un peu partout dans le monde, je l'espère et j’y tiens. Pour conclure, je souhaite remercier celui sans lequel je n’aurais jamais terminé ma thèse à l’heure qui l’est.
xx
Avant-propos
Les données rapportées dans cette thèse représentent le fruit de plus de quatre années de travail réalisé au sein du laboratoire du Docteur Martin Parent. Ce projet de thèse a été me-né sous la direction de mon directeur de recherche Martin Parent ainsi que de mon co-directeur, le Docteur André Parent. L’ensemble de ces données a fait l’objet de quatre ar-ticles scientifiques. Parmi ces arar-ticles, deux ont été publiés, un autre a été soumis, enfin un quatrième est en préparation. Trois de ces articles portent sur ce qui a été tout au long de cette thèse un fil conducteur : l’étude d’une population d’interneurones du striatum qui ex-prime une protéine de liaison au calcium : la calrétinine (CR). Ces interneurones ont été peu caractérisés dans la littérature en comparaison à d’autres types d’interneurones du striatum et ce pour plusieurs raisons qui seront évoquées tout au long de cette thèse. Toutefois, des données fondamentales obtenues préalablement au sein du laboratoire du Docteur André Parent ont montré que ces interneurones constituent, de par leur densité et leur hétérogénéi-té morphologique, une population neuronale atypique du striatum, particulièrement chez les primates (Cicchetti et al., 2000; Wu and Parent, 2000). Des informations concernant les interneurones CR+ ont été obtenues suite à des études visant à mieux comprendre les chan-gements qui peuvent affecter le striatum dans un contexte d’ischémie ou encore de neuro-genèse post-natale. Les interneurones CR+ ont également été étudiés dans certaines patho-logies affectant le striatum et dont les patients présentent de graves symptômes moteurs, comme c’est le cas dans la maladie de Huntington. Cependant, à ce jour, leur rôle reste en-core méconnu, que ce soit en condition normale ou pathologique. Ce projet de thèse avait pour but d’apporter de nouvelles connaissances concernant ces interneurones CR+, tout en formulant de nouvelles hypothèses sur ce qui pourrait affecter l’expression de cette protéine en conditions normale et pathologique.
Le premier chapitre décrit le contexte scientifique dans lequel se sont inscrites mes re-cherches. Après une introduction générale concernant la structure d’intérêt - le striatum - suivra un résumé des connaissances actuelles sur les interneurones CR+ en conditions nor-male et pathologique. Ce résumé sera suivi par une présentation succincte de la maladie de Parkinson, une pathologie affectant gravement le striatum, ce qui permettra l’introduction
xxi
un peu plus tard de la problématique de recherche de ce projet de thèse. Étant donné le ca-ractère de recherche inter-espèces des travaux présentés dans ce manuscrit, la description du contexte scientifique portera à la fois sur les connaissances accumulées chez les ron-geurs et chez les primates. Les quatre prochains chapitres (chapitre 2, 3, 4 et 5) résument l’ensemble des résultats qui ont émergé de ces travaux, tel que mentionné ci-dessous :
Le deuxième chapitre est une présentation des résultats d’une étude morphologique compa-rée des interneurones CR+ en condition normale chez la souris, le singe écureuil et l’humain. Cette étude a fait l’objet d’une publication dans Journal of Chemical
Neuroana-tomy en 2014. C’est grâce à l’utilisation de techniques d’immunohistochimie et
d’immunofluorescence qu’a pu être offerte la toute première description des caractéris-tiques morphologiques et neurochimiques des interneurones CR+ du striatum chez la souris et le singe écureuil. De plus, l’utilisation d’un modèle de souris transgéniques obtenues auprès d’un collaborateur, Docteur Jean-Martin Beaulieu, a permis de démontrer l’absence d’expression des récepteurs à la dopamine (DA) D1 ou D2 par les interneurones CR+ et de confirmer une nouvelle fois l’expression du récepteur D2 par une autre catégorie d’interneurones : les interneurones cholinergiques. La présence dans le laboratoire d’une banque de cerveaux de primates humain et non humains a permis de réaliser des observa-tions sur du tissu fixé chez les primates. Ma participation à ce travail a consisté à effectuer tous les marquages immunohistochimiques nécessaires chez les trois espèces, procéder à l’analyse détaillée au microscope de l’ensemble du matériel obtenu ainsi qu’à la rédaction et à l’illustration du manuscrit.
Le troisième chapitre rapporte les résultats d’une étude sur la distribution et le nombre des interneurones CR+ dans le striatum chez des souris contrôle et des souris ayant reçu une injection unilatérale intracérébrale de 6-hydroxydopamine (6-OHDA), constituant ainsi un modèle animal couramment utilisé de la maladie de Parkinson. Ce manuscrit est en prépara-tion pour être soumis prochainement dans Journal of neuropathology and experimental
neurology. Ce travail visait caractériser les effets d’une dénervation DAergique du striatum
sur les interneurones CR+, les résultats chez le rat retrouvés dans la littérature étant contra-dictoires. Notre étude rapporte pour la première fois des données obtenues chez la souris et met en évidence une diminution significative de la densité d’un type morphologique
xxii
d’interneurones CR+. Ces résultats démontrent que la dénervation DAergique du striatum affecte l’expression de la CR par les interneurones du striatum. Dans cette étude, j’ai con-tribué en effectuant l’ensemble des marquages immunohistochimiques, l’observation et l’analyse du matériel, l’analyse des résultats ainsi qu’à la rédaction et à l’illustration du manuscrit. Les injections intracérébrales de 6-OHDA ont été réalisées par Dave Gagnon, étudiant au doctorat, aidé par Marie-Josée Wallman, assistante de recherche dans le labora-toire du Docteur Martin Parent.
Le quatrième chapitre traite de la description des interneurones CR+ chez le singe macaque en conditions normale et dans un contexte parkinsonien. Les résultats de cette étude ont fait l’objet d’une publication dans le journal Neurobiology of disease en 2016. Cette étude morphologique et stéréologique détaillée a permis, pour la toute première fois, de décrire les caractéristiques morphologiques, la distribution topographique ainsi que la densité des différents types d’interneurones CR+ chez le macaque en condition normale. Ces données normatives ont servi à l’interprétation de changements induits par une dénervation DAer-gique striatale consécutive à une intoxication au 1-méthyl-4-phényl-1, 2, 3, 6-tétrahydropyridine (MPTP) chez le macaque, le modèle animal le plus robuste de la mala-die de Parkinson. L’observation d’une augmentation significative d’un type morphologique particulier d’interneurones CR+ a suggéré de procéder à une analyse quantitative détaillée utilisant un double marquage immunohistochimique. Cette dernière approche a permis de démontrer une augmentation significative de la proportion d’interneurones cholinergiques qui expriment la CR chez le singe intoxiqué au MPTP. Cette étude est issue d’une collabo-ration avec le laboratoire de Docteure Thérèse Di Paolo qui a participé à la réalisation du modèle des singes intoxiqués au MPTP, alors que Martin Parent et Dave Gagnon ont pro-cédé à la préparation des animaux. Ma contribution à cette étude a été de participer aux étapes permettant la préparation du tissu post-mortem, effectuer les marquages immuno-chimiques nécessaires à l’étude, procéder à l’observation que ce soit en microscopie confo-cale ou en lumière blanche des marquages réalisés ainsi que procéder à l’analyse des résul-tats, la rédaction et l’illustration du manuscrit.
Le cinquième chapitre rend compte d’une observation pour laquelle est entré en compte le principe de sérendipité puisque c’est après de longues heures d’observation du striatum
xxiii
provenant de souris doublement transgéniques Drd1a-tdTomato/Drd2-EGFP (D1/D2), qu’un potentiel îlot de Calleja a été découvert nichant dans le striatum ventral. Les données des-criptives qui en résultent ont fait l’objet d’une courte publication récemment acceptée pour publication dans la revue Synapse. La récurrence de cet îlot a donc été observée pour la première fois chez la souris D1/D2 ainsi que chez la souris C57Bl6 et GAD-GFP. Ma con-tribution dans cette étude est intervenue dès la préparation des animaux, la préparation du tissu fixé ainsi que des tissus ayant servi à l’injection intracellulaire, la réalisation des mar-quages immunohistochimiques ainsi que leur observation en microscopie confocale. Doc-teure Maria Gabriela Sánchez, une stagiaire post-doctorale, a été la première à noter l’existence de cette structure unique et a également participé aux marquages immunohisto-chimiques ainsi qu’à l’observation en microscopie confocale. Les injections intracellulaires ont été effectuées par Dave Gagnon. Enfin, j’ai grandement participé à la rédaction et à l’illustration du manuscrit.
Le sixième et dernier chapitre de la présente thèse est une discussion sur les principaux résultats obtenus dans l’intention d’en dégager une signification fonctionnelle. Cette section se termine par des conclusions qui débouchent vers de nouvelles perspectives d’étude.
Au sein du laboratoire du Docteur Martin Parent, j’ai également pu collaborer avec mes collègues, notamment dans l’article intitulé The fate of striatal neurons expressing D1 and
D2 receptors in a mice model of Parkinson’s disease accepté pour publication en 2016 dans
la revue Scientific reports. Mon collègue, Dave Gagnon en est le premier auteur. Ce travail a porté sur une fine description de la morphologie des neurones de projection du striatum chez la souris doublement transgénique D1/D2 en condition normale et chez des souris lé-sées unilatéralement avec la 6-OHDA. Ma contribution pour cet article dans lequel je suis 2ème auteur est d’avoir aidé à la mise en place du protocole évaluant la distribution régio-nale des neurones de projection et à l’acquisition en microscopie confocale d’une partie des données.
Durant mon projet de thèse, j’ai aussi participé à la réalisation d’un autre article dans le cadre d’une collaboration avec le Docteur Karl Fernandes et son étudiante en doctorat Lau-ra Hamilton, de l’Université de Montréal. L’article intitulé : AberLau-rant lipid metabolism in
xxiv
the forebrain niche suppresses adult neural stem cell proliferation in an animal model of Alzheimer's disease, a été publié en 2015 dans le journal Cell Stem Cell (Hamilton et al.,
2015). Cette étude portait sur l’influence des lipides dans la prolifération des cellules souches neuronales de la zone-sous-ventriculaire (SVZ) dans le contexte de la maladie d’Alzheimer. Dans cet article, j’ai contribué à la mise au point d’un marquage histochi-mique utilisant de l’ « oil red O » (ORO), qui permet de colorer les lipides, sur du tissu
1
Chapitre 1
2
L'une des premières descriptions détaillées et illustrées du striatum fut donnée par le méde-cin anglais Thomas Willis, dans son célèbre ouvrage Cerebri Anatome publié en 1664 (Fig. 1.1; Willis, 1664).
Figure 1.1 Ouvrage de Thomas Willis intitulé Cerebri Anatome. A) Page frontispice de
l’ouvrage; B) Illustration du striatum chez le mouton que l’on peut retrouver dans cet ouvrage (planche VIII), réalisée par l’un des collaborateurs de Thomas Willis, le célèbre architecte Christopher Wrens (Willis, 1664).
Le nom corpus striatum a été donné au striatum en raison de son allure striée. À l’époque le
corpus striatum comprenait ce que nous reconnaissons aujourd’hui comme le striatum et le
thalamus. Docteur Willis désigna le corpus striatum comme le siège du sensorium
com-mune, c’est-à-dire le lieu cérébral où convergent les perceptions sensorielles. Il lui attribua
également un rôle important dans le contrôle de la motricité, rôle qui fut confirmé par la suite. L’appellation de striatum fut évoquée pour la première fois en 1920 par Docteure Cécile Vogt-Mugnier et Professeur Oskar Vogt, un couple de neuroscientifiques ayant grandement contribué à l’avancement des connaissances en neuroanatomie (Vogt and Vogt, 1920). À cette époque, le couple Vogt soutenait que le striatum pouvait être impliqué dans la pathogenèse de la maladie de Parkinson, bien qu’aucune lésion du striatum n’eut été re-trouvée ou décrite (Parent and Parent, 2010). Au milieu du 20ième siècle, des auteurs ont postulé que le striatum pouvait inhiber le mouvement, mais l’idée que l’on se faisait du striatum a grandement évoluée au cours des années suivantes (Mettler and Mettler, 1942;
3
Delgado, 1979). Aujourd’hui, les données de la littérature attribuent au striatum un rôle essentiel dans l’initiation et l’exécution appropriée du mouvement ainsi que dans les pro-cessus d’apprentissage et de formation des habitudes (Graybiel et al., 1994; Hikosaka, 1998; Yin and Knowlton, 2006; Graybiel and Grafton, 2015). Pour cela, le striatum s’insère dans un réseau de nombreuses connections entre des structures corticales et sous-corticales. Ces dernières sont principalement constituées des ganglions de la base, auxquels le striatum appartient. D’un point de vue purement anatomique, les ganglions de la base comprennent aussi le globus pallidus (GP) qui se divise en segment interne (GPi) et externe (GPe) et se situent à la base du prosencéphale. D’autres structures cérébrales leur sont étroitement re-liées. C’est le cas de la substance noire (SN) qui se divise en partie compacte (SNc) et réti-culée (SNr), du noyau subthalamique (STN), mais aussi de certains noyaux du thalamus, du noyau pédonculopontin (PPN) et du noyau raphé dorsal. Ces structures se retrouvent parti-culièrement affectées dans la maladie de Parkinson où une dégénérescence des projections de la SNc vers le striatum est observée, entrainant des symptômes moteurs fortement han-dicapants (Hornykiewicz, 2006).
Avec les années, de nombreuses études ont conduit à une meilleure connaissance de la composition neuronale du striatum ainsi qu’à l’identification des projections afférentes et efférentes qui lui sont associées. Cependant le rôle de toutes les entités qui le composent n’est pas encore totalement clarifié. Dans ce projet, nous avons choisi de nous intéresser aux interneurones qui expriment la calrétinine (CR), une des dernières populations neuro-nales à avoir été identifiée au sein du striatum. Ces recherches complètent et prolongent de précieuses données qui ont déjà été produites et publiées dans notre laboratoire (Parent et al., 1995; Cicchetti et al., 2000; Wu and Parent, 2000).
La première partie de ce chapitre s’intitule Le striatum et vise à décrire en détails l’organisation anatomique, hodologique, cytoarchitecturale de cette structure intégratrice majeure des ganglions de la base. Cette première partie fournit également une description des différentes sous-populations d’interneurones présents au sein du striatum. La seconde partie, intitulée Les interneurones à calrétinine, résume l’ensemble des données concernant cette catégorie d’interneurones en conditions normale et pathologiques présentes dans la littérature. Une troisième partie, intitulée La maladie de Parkinson, traite des causes, des
4
symptômes, des principales thérapies, ainsi que des modèles animaux développés dans le contexte de cette maladie. Enfin, la quatrième partie de ce chapitre abordera la probléma-tique et les hypothèses de travail qui ont orientées nos recherches.
1 Le
striatum
1.1
Description anatomique et neurochimique
Le striatum est une structure particulièrement conservée chez l’ensemble des mammifères (Parent, 1997). Parmi les structures comprises dans les ganglions de la base, il représente la composante la plus volumineuse (Fig. 1.2). Chez le primate, il se divise en trois régions distinctes : le noyau caudé (Cd), le putamen (Put) et le noyau accumbens (Acb). Les deux premiers (Cd et Put) réfèrent à ce qu’on appelle plus généralement le striatum dorsal par opposition au striatum ventral dont l’Acb est la composante principale. Le Cd s’étend sur tout l’axe antéropostérieur des hémisphères cérébraux, formant une structure plus volumi-neuse à l’avant (la tête du Cd) qui s’allonge et se resserre tout au long de cet axe pour fina-lement s’étendre au long du thalamus (la queue du Cd). Il constitue la partie la plus mé-diane du striatum, portion qui se retrouve accolée tout au long des ventricules latéraux. Sur un plan frontal, le Put occupe la portion la plus latérale du striatum et se retrouve séparé du Cd par la capsule interne. Cette dernière est constituée par un faisceau de projections axo-nales allant ou provenant du cortex cérébral et qui s’étend tout au long de l’axe antéro-postérieur du striatum, séparant ainsi le Cd du Put. Des ponts de matière grise, connus aussi sous le nom de pontes grisei caudatolenticularis, relient le Cd et le Put.
Bien que le striatum soit conservé chez l’ensemble des mammifères, des différences exis-tent quant à son organisation anatomique (Parent, 1997). Parmi ces différences, notons que la capsule interne est absente chez les rongeurs puisque les fibres corticofuges et cortico-pètes ne forment pas un faisceau compact mais sont plutôt diffusément distribuées au sein du striatum. Ce dernier est alors appelé Cd-Put, ou parfois neostriatum chez les rongeurs. Cette définition exclut la partie ventrale du striatum (ou Acb) qui est également présente chez les rongeurs. L'Acb, quant à lui, est en continuité avec la substantia innominata
cauda-5
lement et le tubercule olfactif ventralement. Chez les primates comme chez les rongeurs, il est ségrégué en deux régions distinctes : le cœur (core) et la coque (shell). Une portion des fibres de la commissure antérieure est également retrouvée dans l’Acb. Dans sa partie la plus ventrale, l’Acb se fusionne avec la partie profonde du tubercule olfactif contenant éga-lement ce qu’on appelle les îlots de Calleja.
Ces îlots de Calleja sont pour la plupart constitués d’amas très denses de cellules de petite taille avec un diamètre inférieur à 15 µm. Plusieurs types d’îlots sont retrouvés à proximité de l’Acb mais également le long du tubercule olfactif. Parmi ces îlots, le plus volumineux est l’insula magna (ou l’îlot majeur) qui repose sur la bordure médiane du compartiment de la coque de l’Acb. Selon certains auteurs, ces îlots ne constitueraient qu’une seule structure et seraient entièrement reliés entre eux (de Vente et al., 2001). Leur rôle fait l’objet de spé-culations notamment à cause de leur proximité avec le tubercule olfactif.
6
Figure 1.2. Organisation anatomique des ganglions de la base chez le primate et le rongeur. A) Vue
sagittale des ganglions de la base suite à un marquage histochimique pour l’acétylcholinestérase chez le singe (Macaca fascicularis) [Modifiée de (Lanciego et al., 2012)]. B) Représentation schématique du stria-tum en vue frontale au niveau +4 mm par rapport à la commissure antérieure chez le singe (Macaca fasci-cularis) [Modifiée de (Martin and Bowden, 2000)]. C) Vue sagittale des ganglions de la base suite à un marquage histochimique pour l’acétylcholinestérase chez la souris [Modifiée de (Paxinos and Franklin, 2001)]. D) Représentation schématique du striatum en vue frontale au niveau + 0.86 mm par rapport au bregma chez la souris [Modifiée de (Paxinos and Franklin, 2001)]. ac : commissure antérieure; Acb : noyau accumbens C : coeur; cc : corps calleux; Cd : noyau caudé; ic : capsule interne; GP : globus palli-dus (i) interne et (e) externe; ICj : îlots de Calleja; IMCj : îlot majeur de Calleja; S : coque; LV : ventri-cule latéraux; PPN : noyau pédonculopontin; Put : putamen; SI : substantia innominata; SN : substance noire; STN : noyau sous-thalamique;.
Le striatum présente aussi une compartimentation neurochimique à laquelle on réfère sous le nom de « mosaïque striatale ». D’après cette appellation, il se divise en deux comparti-ments : un ensemble de petits îlots cellulaires que l’on appelle striosomes dispersés dans une région beaucoup plus vaste, la matrice extrastriosomale (Graybiel, 1990; Gerfen, 1992b; Gerfen, 1992a). Bien qu’ils n’occupent que 20 % du volume striatal et qu’ils appa-raissent dans le plan frontal sous forme d’îlots isolés, les striosomes sont en fait reliés
7
entre-eux sous la forme d’un labyrinthe. Ce labyrinthe très complexe s’étend dans l’ensemble de la matrice extrastriosomale, qui elle occupe 80 % du volume total du stria-tum (Graybiel, 1991). La spécificité de ces deux compartiments est qu’ils présentent une expression différentielle de certaines protéines, neuropeptides ou enzymes (pour revue, voir Crittenden and Graybiel, 2011). Entre autres, les striosomes expriment fortement le récep-teur µ-opiacé, un réceprécep-teur spécifique pour les enképhalines, ainsi qu’un faible niveau d'acétylcholinestérase (Graybiel and Ragsdale, 1978; Herkenham and Pert, 1981; Graybiel et al., 1986). La matrice extrastriosomale est, quant à elle, riche en acétylcholinestérase et renferme des neurones contenant un fort niveau de calbindine D28k (CB; Morrison et al., 1983; Gerfen, 1985; Gerfen et al., 1985). En plus de leur distinction neurochimique, ces deux compartiments striataux reçoivent des projections corticales spécifiques, la matrice étant innervée de façon différentielle par les aires corticales motrices, associatives et senso-rielles, alors que les striosomes sont préférentiellement innervés par les régions corticales de nature limbique (Crittenden and Graybiel, 2011). Le striatum ventral, quant à lui, a une composition neurochimique différente de sorte que seul le cœur contient un niveau impor-tant de CB (marqueur de la matrice), alors que la coque présente un marquage très faible pour cette protéine (Jongen-Rêlo et al., 1994; Prensa et al., 2003).
1.2 Hodologie
À la fin des années 1970, l’apparition de méthodes de traçage très sensibles par injections de marqueurs radioactifs et de différentes substances pouvant être transportées de manière rétro- et/ou antérograde a permis d’élucider la microcircuiterie striatale. Ces méthodes re-posent sur la capacité de transport de substances dans le neurone via le flot axonal. Elles ont permis de mieux comprendre les relations du striatum avec les autres composantes des ganglions de la base, tant chez les primates que chez les rongeurs.
8 1.2.1 Les afférences striatales
1.2.1.1 Les projections cortico-striées
Le striatum est impliqué dans une boucle de régulation motrice cortico-ganglions de la base thalamo corticale (Fig. 1.3).
Figure 1.3. Représentation schématique du circuit des ganglions de la base. Ce schéma
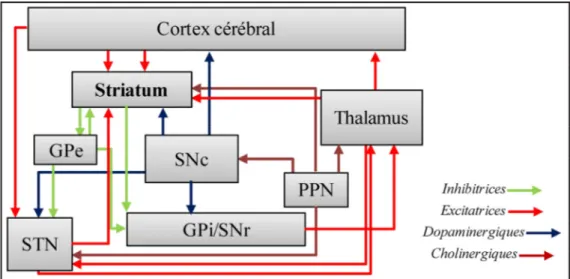
il-lustre les principales connections reliant les différentes structures appartenant aux ganglions de la base. Ce réseau joue un rôle important dans les fonctions motrices [Modifiée de (Lanciego et al., 2012)]. GP : Globus pallidus (i) interne et (e) externe; SN : substance noire (c) compacte et (r) réticulée; STN : noyau subthalamique.
Cette boucle constitue un circuit parallèle au circuit pyramidal (ainsi souvent appelé sys-tème extrapyramidal) et implique un relais au thalamus. Son action sur la motricité serait indirecte puisqu’aucune connexion avec les motoneurones n’a été observée jusqu’à présent. Pendant longtemps, le striatum a été considéré comme l’unique récipient des afférences corticales glutamatergiques au sein des ganglions de la base. Aujourd’hui, le STN est iden-tifié comme recevant, lui aussi, des projections glutamatergiques d’origine corticale (Redgrave et al., 2010). Les afférences corticales constituent une part majeure de l’innervation glutamatergique striatale. Chez le primate, l’injection de traceurs radioactifs dans le cortex cérébral moteur a permis de démontrer des projections cortico-striées princi-palement de nature ipsilatérale (Künzle, 1975). Les projections cortico-striées se projettent sur le striatum avec une organisation somatotopique précise. La partie du cortex moteur impliquée dans l’initiation des mouvements de la jambe se projette plus spécifiquement sur
9
la partie dorsolatérale du striatum alors que celle responsable de la mimique faciale innerve principalement la région ventro-médiane du striatum. Entre ces deux régions, projettent les neurones corticaux qui sont impliqués dans les mouvements des bras (Künzle, 1975; Künzle, 1977; Alexander et al., 1986).
Chez le primate, le territoire sensorimoteur du striatum reçoit principalement des projec-tions des aires motrices et sensorielles et inclut essentiellement la partie du Put située der-rière la commissure antérieure ainsi que la queue du Cd (Künzle, 1975; Künzle, 1977; Künzle, 1978; Miyata and Sasaki, 1984; Parent, 1990; Parent and Hazrati, 1995a). Des ex-périences de microstimulations électrophysiologiques dans le striatum démontrent l’existence d’une organisation somatotopique des projections corticales dans le Put post-commissural (Liles, 1975; Alexander and DeLong, 1985). Le territoire associatif, quant à lui, est principalement innervé par les aires corticales associatives. Ce territoire comprend l’essentiel de la tête du Cd ainsi que la partie antérieure du Put (Yeterian and Van Hoesen, 1978; Van Hoesen et al., 1981; Selemon and Goldman-Rakic, 1985). Finalement, le terri-toire limbique est en majorité innervé par les projections en provenance d’aires corticales limbiques et correspond au striatum ventral (Heimer and Wilson, 1975; Russchen et al., 1985). La description de cette topographie corticostriatale a permis de subdiviser le stria-tum des rongeurs et des primates en trois territoires fonctionnels, soit le territoire sensori-moteur, le territoire associatif et le territoire limbique (Fig. 1.4A; McGeorge and Faull, 1989; Parent, 1990). Des chevauchements entre ces trois territoires fonctionnels existent comme indiqués dans la figure 1.4, suggérant qu’ils ne sont pas totalement indépendants les uns des autres.
10
Figure 1.4.Les territoires fonctionnels du striatum chez le primate et le rongeur. Représentation des
différents territoires fonctionnels en fonction des afférences cortico-striatales. A) Représentation des trois territoires fonctionnels chez le primate. [Modifiée de (Parent, 1990)]. B) Représentation de territoires fonc-tionnels selon les afférences cortico-striatales chez le rongeur. [Modifiée de (McGeorge and Faull, 1989)]. ac : commissure antérieure; Acb : noyau accumbens; Cd : noyau caudé; ic : capsule interne; GP : globus pallidus (e) externe, (i) interne et (v) ventral; HL : hypothalamus latéral; Put : putamen; TO : tubercule olfactif.
Les données de la littérature, telles que révisées par Joel et Weiner en 2000, suggèrent que le Cd et le Put des primates correspondent respectivement à la portion dorso-médiane (DMS) et dorso-latérale (DLS) du striatum des rongeurs, l’Acb appartient, comme chez les primates, au territoire limbique (Joel and Weiner, 2000). Les études de traçage neuronal réalisées chez le rat confirment pour la plupart que le DMS reçoit principalement des pro-jections corticales sensorielles, que le DLS reçoit beaucoup de propro-jections motrices (Fig. 1.4B; McGeorge and Faull, 1989), alors que l’Acb des rongeurs est la cible préférentielle des projections limbiques (Groenewegen et al., 1980; Krayniak et al., 1981; Kelley and Domesick, 1982; Kelley et al., 1982; Phillipson and Griffiths, 1985).
11
1.2.1.2 Les projections nigro-striées
Le striatum reçoit des projections de plusieurs structures appartenant au mésencéphale. Parmi celles-ci, notons la SNc dont les projections vers le striatum constituent ce qu’on appelle la voie nigro-striée. Ces projections sont de nature DAergique et prennent leur ori-gine dans la portion ventrale de la SNc et de l’aire rétrorubrale qui correspondent respecti-vement aux groupes DAergiques A9 et A8 du mésencéphale (Dahlström and Fuxe, 1964; Schofield and Everitt, 1981). Les projections DAergiques de la SNc ont un rôle fonctionnel majeur dans le contrôle de la motricité. Ce sont ces projections qui dégénèrent dans la ma-ladie de Parkinson (Poirier and Sourkes, 1965; Hornykiewicz, 2006). Elles s’organisent de sorte que la SNc ventrale ainsi que l’aire rétrorubrale innervent préférentiellement la partie dorsale du striatum alors que l’Acb est en majorité innervé par la SNc dorsale et l’aire teg-mentaire ventrale. Selon plusieurs auteurs, les projections ascendantes en provenance du mésencéphale s’organisent de manière topographique comme le montrent les données re-cueillies à la fois chez les rongeurs (Nauta et al., 1974; Fallon and Moore, 1978; Nauta et al., 1978; Beckstead et al., 1979; Maurin et al., 1999; Bolam et al., 2000), et les primates (Szabo, 1980; Parent et al., 1983; Smith and Parent, 1986a; Lynd-Balta and Haber, 1994).
1.2.1.3 Les afférences striatales en provenance du noyau du raphé
Le striatum reçoit des afférences provenant du noyau dorsal du raphé. Le noyau dorsal du raphé appartient à un ensemble de noyaux (les noyaux du raphé) principalement sérotoni-nergiques (5-HT) et reconnus pour être impliqués dans la régulation des états de veille et de sommeil, de l’humeur ainsi que dans le contrôle de la douleur (Andén et al., 1966; Ungerstedt, 1971b). Les noyaux du raphé sont composés d’un ensemble de neuf noyaux distincts, correspondant aux groupes B1 à B9 (Dahlström and Fuxe, 1964; Hornung, 2003). Le noyau dorsal du raphé fait partie du groupe B6 et B7 qui se situent dans la partie rostrale (Hornung, 2003). Il est composé en majorité de neurones 5-HTergiques mais est également clairsemé de neurones catécholaminergiques. Les projections 5-HT vers le striatum existent à la fois chez les rongeurs et les primates (Jacobs et al., 1974; Lorens and Guldberg, 1974; Nauta et al., 1974; Jacobs et al., 1978; Parent et al., 1983; Smith and Parent, 1986a; Gagnon and Parent, 2014). Elles ont été très étudiées dans le contexte de la maladie de Parkinson
12
puisqu’elles contribueraient à certains des effets secondaires induits par la médication, telles que les dyskinésies induites par la L-Dopa (pour revue, voir Huot and Fox, 2013). En effet, le principal médicament donné aux patients parkinsoniens est un précurseur de la DA : la L-Dopa. Après plusieurs années de traitement, ce médicament donne généralement lieu à l’apparition de mouvements involontaires anormaux et stéréotypés, fortement handi-capants, que l’on nomme dyskinésies induites par la L-Dopa.
1.2.1.4 Les projections thalamo-striées
Bien que les afférences glutamatergiques provenant du cortex cérébral constituent une part importante de l’innervation striatale, le striatum reçoit également une innervation glutama-tergique provenant d’autres noyaux tels que le thalamus et le STN. Le thalamus constitue un important relai des projections sensorielles et motrices. Les projections thalamo-striées ont été mises en évidence à la fois chez les rongeurs et les primates (Parent et al., 1983; Beckstead, 1984; Berendse and Groenewegen, 1990; Nakano et al., 1990; Deschênes et al., 1996; Parent and Parent, 2005) et prennent origine dans la portion postérieure des noyaux intralaminaires du thalamus, principalement les noyaux parafasciculaire et centro-médian. Une fraction de ces projections thalamo-striées provient des noyaux de la ligne médiane et ceux de la région motrice ventrolatérale du thalamus (Freeman and Watts, 1947; McLardy, 1948; Droogleever Fortuyn and Stefens, 1951; Powell and Cowan, 1954; Cowan and Powell, 1956; Powell and Cowan, 1967; Smith et al., 2004; pour revue Smith et al., 2009).
1.2.1.5 Les projections subthalamo-striées
Les projections subthalamo-striées de nature glutamatergique ont été démontrées chez le rat, le chat et le singe (Nauta and Cole, 1978; Beckstead, 1983b; Smith and Parent, 1986a; Parent and Smith, 1987; Groenewegen and Berendse, 1990; Nakano et al., 1990; Parent and Hazrati, 1995b; Sato et al., 2000b). Elles constituent toutefois une innervation beaucoup moins massive que les afférences glutamatergiques en provenance du cortex et du thala-mus.
13
1.2.1.6 Les afférences en provenance du noyau pédonculopontin
Le striatum reçoit également une innervation de nature cholinergique en provenance du tronc cérébral d’après des résultats obtenus grâce à du traçage neuronal chez les rongeurs et les primates (Saper and Loewy, 1982; Parent et al., 1983; Smith and Parent, 1986a; Woolf and Butcher, 1986; Hallanger and Wainer, 1988; Nakano et al., 1990; Dautan et al., 2014). Ces projections ont pour origine le PPN ainsi que le noyau tegmentaire latérodorsal et s’ajoutent à l’apport cholinergique intrinsèque du striatum constitué par les interneurones striataux cholinergiques. Le PPN et le noyau tegmentaire latérodorsal appartiennent respec-tivement au noyaux cholinergiques Ch5 et Ch6 d’après la description fait par Mesulam (Mesulam et al., 1983). Ils sont fortement impliqués dans le contrôle de la motricité, le to-nus musculaire et la génération/maintien des cycles veille-sommeil (Skinner and Garcia-Rill, 1984; Steriade, 2004). D’après Dautan et collègues, qui ont utilisé une souche de rats transgénique ChAT-CRE, les afférences striatales cholinergiques et extrinsèques provenant du PPN forment des synapses de type excitatrice (synapse asymétrique) alors que les pro-jections intrinsèques provenant des interneurones striataux cholinergiques établissent majo-ritairement des synapses de type inhibitrice (synapse symétrique; Dautan et al., 2014; Dautan et al., 2016). L’intérêt suscité par le PPN dans le contexte de la maladie de Parkin-son est de plus en plus grand puisque l’atteinte de ce noyau serait impliquée dans les troubles de la marche, souvent observés chez les patients (pour revue, voir Ferraye et al., 2010; Goetz, 2013).
1.2.1.7 Les afférences GABAergiques du striatum
Quelques afférences de nature GABAergique projettent aussi vers le striatum. C’est no-tamment le cas du GPe, d’après des résultats obtenus grâce à l’utilisation du traçage neuro-nal chez le primate et le rat (Nauta and Cole, 1978; McBride and Larsen, 1980; Beckstead, 1983a; Spooren et al., 1996; Bevan et al., 1998; Kita et al., 1999; Sato et al., 2000a; Kita and Kita, 2001). C’est aussi le cas, semble-t-il, de l’aire tegmentaire ventrale, qui selon des données rapportées uniquement chez la souris, enverraient des projections GABAergiques vers le striatum (Brown et al., 2012). Il a récemment été suggéré, la possibilité que des
affé-14
rences DAergiques provenant de la SNc libèrent aussi du GABA, d’après des données ob-tenues chez la souris (Tritsch et al., 2012; Bray, 2014; Tritsch et al., 2016).
L’ensemble des données portant sur les nombreuses afférences striatales suggèrent un rôle intégrateur important de cette structure. Ces afférences striatales vont pouvoir agir directe-ment ou indirectedirecte-ment sur la composition neuronale du striatum et influencer potentielle-ment notre population d’intérêt que sont les interneurones CR+.
1.2.2 Les efférences striatales
1.2.2.1 Les neurones de projection du striatum
Les neurones de projection constituent la majorité de la population neuronale totale du striatum, soient environ 80 % chez les primates et 95 % chez les rongeurs (DiFiglia et al., 1976). Historiquement, ce sont les neurones « géants », peu nombreux, qui étaient considé-rés comme neurones de projection. Les très nombreux neurones de taille moyenne (15-20 µm) étaient perçus comme appartenant à la catégorie des interneurones. Ce n’est qu’au mi-lieu des années 1970, avec l’arrivée de méthodes de traçage neuronal, que la nature de pro-jection des neurones de taille moyenne a pu être établie (Grofová, 1975; Bunney and Aghajanian, 1976; Faull and Mehler, 1976; Graybiel et al., 1979). Ces neurones, à l’origine de la voie efférente du striatum, libèrent du GABA dans leurs structures cibles. Leurs pro-priétés morphologiques, en particulier la présence de nombreuses épines dendritiques, tel que présenté dans la figure 1.5, permet de les différencier des interneurones du striatum (DiFiglia et al., 1976; Graybiel et al., 1979; Pasik et al., 1988).
15
Figure 1.5. Morphologie d’un neurone de projection du striatum chez le rat. Reconstitution d’un
neurone de projection enregistré électrophysiologiquement et injecté consécutivement par de la bio-cytine. [Modifiée de (Kawaguchi et al., 1989)] A) Représentation de l’arbre dendritique épineux en fonction de la compartimentation neurochimique du striatum. B) Représentation de l’arborisation axonale en fonction des différents compartiments du striatum.
La composition neurochimique des neurones de projection permet également une différen-ciation des interneurones du striatum puisqu’ils expriment la phosphoprotéine neuronale régulée par la DA et l’adénosine monophosphate cyclique (dopamine-and AMPc-regulated
phosphoprotein 32 ; DARPP32) de même que la CB, contrairement aux interneurones
(Ouimet et al., 1984; Gerfen et al., 1985). Les neurones de projection se retrouvent aussi bien dans les striosomes que dans la matrice extrastriosomale du striatum et peuvent émettre des collatérales locales s’arborisant sur les neurones de projection voisins (Kitai et al., 1979; Wilson and Groves, 1980; Somogyi et al., 1981; Gerfen, 1988; Penny et al., 1988; Kawaguchi et al., 1989). Leurs caractéristiques électrophysiologiques de décharge sont telles qu’ils sont qualifiés de neurones phasiques (phasically active neurons ou PAN) (Kimura et al., 1990; Inokawa et al., 2010). En d’autres termes, ces neurones présentent une activité silencieuse qui peut être suivie par l’apparition de décharge durant ou avant l’exécution d’une tâche motrice. Les interneurones du striatum peuvent moduler l’activité des neurones de projection de manière post-synaptique ou encore pré-synaptique en agis-sant, par exemple, sur les afférences striatales qui se projettent sur les neurones de projec-tion. Ces derniers reçoivent sur leurs épines dendritiques une importante innervation en provenance du cortex cérébral (Parent and Hazrati, 1995a) et sont également l’une des cibles majeures des afférences DAergiques striatales. De ce fait, la libération de DA affecte
16
grandement l'activité de ces neurones et peut influencer indirectement les structures cibles des voies efférentes du striatum (Freund et al., 1984). Historiquement, deux catégories de neurones de projection ont été identifiées et résultent, d’après le schéma classique de l’organisation anatomique et fonctionnelle des ganglions de la base, en deux voies striato-fuges distinctes. Les neurones de la première catégorie expriment le récepteur DAergique D1. Ce récepteur est couplé à une protéine Gs et stimule, lorsqu’il est activé, la production d’adénosine monophosphate cyclique entrainant par la suite une dépolarisation du neurone et la libération de neurotransmetteur dans la structure cible (Beaulieu and Gainetdinov, 2011). Les neurones de projection D1+ contiennent aussi des neuropeptides tels que la dy-norphine et la substance P (Gerfen, 1988; Gerfen and Young, 1988; Le Moine et al., 1991). Dans la seconde catégorie, ils expriment le récepteur DAergique D2. Ce récepteur est cou-plé à une protéine G inhibitrice (Gi/o) et lorsqu’il est activé entraine une hyperpolarisation de la cellule (Beaulieu and Gainetdinov, 2011). La stimulation de ce récepteur ne permet pas la libération de neurotransmetteur dans les structures cibles. Les neurones D2+ contien-nent préférentiellement de l’enképhaline (Gerfen, 1988; Gerfen and Young, 1988; Le Moine et al., 1991). Encore une fois, leur composition en neuropeptides permet de les diffé-rencier des interneurones du striatum puisque ces derniers n’expriment pas de dynorphine, d’enképhaline, ni de substance P.
1.2.2.2 Modèle fonctionnel des ganglions de la base (d’hier à aujourd’hui)
Tel que mentionné précédemment, l’organisation des projections striatofuges est étroite-ment reliée à l’expression différentielle des récepteurs DAergiques exprimés par les rones de projection. Ainsi, d’après le schéma classique des ganglions de la base, les neu-rones qui expriment D1 et ceux qui expriment D2 sont respectivement à l’origine de la voie dite « directe » et « indirecte » (Gerfen and Young, 1988; Albin et al., 1989; Gerfen et al., 1990).
Selon ce schéma, les neurones de projection D1+ se projettent directement sur les neurones à l’origine des voies de sortie des ganglions de la base qui sont constituées par le GPi ou le noyau entopédonculaire chez les rongeurs et la SNr. Les neurones de projection D2+, en revanche, se projettent indirectement sur les structures de sortie des ganglions de la base.
17
Dans un premier temps, les neurones D2+ ciblent sur le GPe ou GP chez les rongeurs, qui se projette à son tour sur le STN. Enfin, le STN cible les structures de sortie des ganglions de la base (SNr et GPi). Les axones des neurones de la SNr et le GPi s’arborisent ensuite dans les régions thalamiques motrices qui se projettent à leur tour sur le cortex cérébral, complétant ainsi la boucle cortico-ganglions de la base thalamo-corticale. Ces projections ont été confirmées à la fois chez le rat et le primate avec cependant quelques subtiles diffé-rences (Parent and Hazrati, 1995a; Aubert et al., 2000).
Énoncé pour la première fois il y a plus de 20 ans, ce concept bimodal de l’organisation des projections striatofuges attribue respectivement à la voie directe et indirecte un rôle facilita-teur et inhibifacilita-teur sur le mouvement (Albin et al., 1989; Wichmann and DeLong, 1996). Bien qu’assez basique, cette vision a permis d’expliquer les symptômes moteurs consécu-tifs à une atteinte des ganglions de la base (Albin et al., 1989; Wichmann and DeLong, 1996). Dans cette perspective, les symptômes moteurs caractéristiques de la maladie de Parkinson (qui seront abordés plus tard dans ce chapitre) résulteraient d’une prédominance fonctionnelle de la voie indirecte sur la voie directe (Albin et al., 1989). La maladie impli-querait une hyperactivité des neurones excitateurs du STN, avec comme conséquence une forte inhibition des neurones prémoteurs thalamocorticaux, médiée par les neurones GA-BAergiques du GPi et de la SNr.
Le modèle bimodal a depuis lors été révisé pour plusieurs raisons. 1) Il a été montré que le striatum n’était pas la seule interface entre les ganglions de la base et le cortex cérébral puisqu’une voie dite « hyperdirecte » a été découverte au début des années 2000 (Nambu et al., 2002; Nambu, 2004). Cette voie se caractérise par une projection directe des structures corticales sur le STN. 2) D’après les résultats d’études de traçage neuronal, les neurones de projection du striatum ne se limitent pas à projeter à une seule cible, mais peuvent émettre des collatérales axonales dans les trois principales cibles du striatum (Kawaguchi et al., 1990; Parent et al., 2000; Wu et al., 2000; Lévesque and Parent, 2005). 3) Le modèle clas-sique attribue une grande importance au fait que ces neurones à l’origine des voies directe et indirecte expriment des récepteurs DAergiques différents. Cependant, plusieurs études démontrent l’existence de neurones qui expriment à la fois les récepteurs D1 et D2 chez les rongeurs (Surmeier et al., 1992; Surmeier et al., 1996; Aizman et al., 2000;
![Figure 1.13. Distribution des interneurones CR+ chez le rat et chez l'humain. A) Distribution des interneurones CR+ chez le rat, [Modifiée de (Bennett and Bolam, 1993a)]](https://thumb-eu.123doks.com/thumbv2/123doknet/6248195.162604/59.918.157.772.114.904/figure-distribution-interneurones-humain-distribution-interneurones-modifiée-bennett.webp)