O
pen
A
rchive
T
OULOUSE
A
rchive
O
uverte (
OATAO
)
OATAO is an open access repository that collects the work of Toulouse researchers and makes it freely available over the web where possible.This is an author-deposited version published in : http://oatao.univ-toulouse.fr/ Eprints ID : 11299
To cite this version :
Cadier, Juliette. Gestion des maladies infectieuses du chiot. Thèse d'exercice, Médecine vétérinaire, Ecole Nationale Vétérinaire de Toulouse - ENVT, 2014, 156 p.
Any correspondance concerning this service should be sent to the repository administrator: staff-oatao@inp-toulouse.fr.
ANNEE 2014 THESE : 2014 – TOU 3 – 4017
GESTION DES MALADIES INFECTIEUSES DU
CHIOT
_________________
THESE
pour obtenir le grade de DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement devant l’Université Paul-Sabatier de Toulouse
par
CADIER Juliette
Née, le 16 septembre 1989 à RECIFE (Brésil) ___________
Directeur de thèse : M. Stéphane BERTAGNOLI
___________ JURY PRESIDENT : M. Christophe PASQUIER ASSESSEURS : M. Stéphane BERTAGNOLI Mme Séverine BOULLIER
.
Professeur à l’Université Paul-Sabatier de TOULOUSE Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE
Ministère de l'Agriculture de l’Agroalimentaire et de la Forêt
ECOLE N ATION AL E VETERIN AIRE DE TOULOUSE
Directeur : M. Alain MILON
PROFESSEURS CLASSE EXCEPTIONNELLE
M. AUTEFAGE André, Pathologie chirurgicale
Mme CLAUW Martine, Pharmacie-Toxicologie
M. CONCORDET Didier, Mathématiques, Statistiques, Modélisation
M. CORPET Denis, Science de l'Aliment et Technologies dans les Industries
agro-alimentaires
M DELVERDIER Maxence, Anatomie Pathologique
M. ENJALBERT Francis, Alimentation
M. EUZEBY Jean, Pathologie générale, Microbiologie, Immunologie
M. FRANC Michel, Parasitologie et Maladies parasitaires
M. MARTINEAU Guy, Pathologie médicale du Bétail et des Animaux de Basse-cour
M. PETIT Claude, Pharmacie et Toxicologie
M. REGNIER Alain, Physiopathologie oculaire
M. SAUTET Jean, Anatomie
M. SCHELCHER François, Pathologie médicale du Bétail et des Animaux de Basse-cour
PROFESSEUR S 1° CLASSE
M. BERTHELOT Xavier, Pathologie de la Reproduction
M. BOUSQUET-MELOU Alain, Physiologie et Thérapeutique
M. DUCOS Alain, Zootechnie
M. FOUCRAS Gilles, Pathologie des ruminants
M. LEFEBVRE Hervé, Physiologie et Thérapeutique
PROFESSEUR S 2° CLASSE
Mme BENARD Geneviève, Hygiène et Industrie des Denrées alimentaires d'Origine animale M. BERTAGNOLI Stéphane, Pathologie infectieuse
Mme CHASTANT-MAILLARD Sylvie, Pathologie de la Reproduction M. DUCOS DE LAHITTE Jacques, Parasitologie et Maladies parasitaires
Mme GAYRARD-TROY Véronique, Physiologie de la Reproduction, Endocrinologie M. GUERRE Philippe, Pharmacie et Toxicologie
Mme HAGEN-PICARD Nicole, Pathologie de la Reproduction M. JACQUIET Philippe, Parasitologie et Maladies Parasitaires
M. LIGNEREUX Yves, Anatomie
M MEYER Gilles, Pathologie des ruminants M. PICAVET Dominique, Pathologie infectieuse
M. SANS Pierre, Productions animales
PROFESSEURS CERTIFIES DE L'ENSEIGNEMENT AGRICOLE
Mme MICHAUD Françoise, Professeur d'Anglais M SEVERAC Benoît, Professeur d'Anglais
MAITRES DE CONFERENCES HORS CLASSE
M. BAILLY Jean-Denis, Hygiène et Industrie des Denrées alimentaires d'Origine animale
M. BERGONIER Dominique, Pathologie de la Reproduction
Mlle BOULLIER Séverine, Immunologie générale et médicale
Mme BOURGES-ABELLA Nathalie, Histologie, Anatomie pathologique
M. BRUGERE Hubert, Hygiène et Industrie des Denrées alimentaires d'Origine animale
Mlle DIQUELOU Armelle, Pathologie médicale des Equidés et des Carnivores
M. JOUGLAR Jean-Yves, Pathologie médicale du Bétail et des Animaux de Basse-cour
Mme LETRON-RAYMOND Isabelle, Anatomie pathologique M. LYAZRHI Faouzi, Statistiques biologiques et Mathématiques M. MATHON Didier, Pathologie chirurgicale
Mme PRIYMENKO Nathalie, Alimentation
MAITRES DE CONFERENCES (classe normale)
M. ASIMUS Erik, Pathologie chirurgicale
Mme BENNIS-BRET Lydie, Physique et Chimie biologiques et médicales
Mlle BIBBAL Delphine, Hygiène et Industrie des Denrées alimentaires d'Origine animale Mme BOUCLAINVILLE-CAMUS Christelle, Biologie cellulaire et moléculaire
Mlle CADIERGUES Marie-Christine, Dermatologie M. CONCHOU Fabrice, Imagerie médicale
M. CORBIERE Fabien, Pathologie des ruminants
M. CUEVAS RAMOS Gabriel, Chirurgie Equine
Mme DANIELS Hélène, Microbiologie-Pathologie infectieuse
M. DOSSIN Olivier, Pathologie médicale des Equidés et des Carnivores
Mlle FERRAN Aude, Physiologie
M. GUERIN Jean-Luc, Elevage et Santé avicoles et cunicoles
M. JAEG Jean-Philippe, Pharmacie et Toxicologie
Mlle LACROUX Caroline, Anatomie Pathologique des animaux de rente Mlle LAVOUE Rachel, Médecine Interne
M. LIENARD Emmanuel, Parasitologie et maladies parasitaires M. MAILLARD Renaud, Pathologie des Ruminants
Mme MEYNAUD-COLLARD Patricia, Pathologie Chirurgicale M. MOGICATO Giovanni, Anatomie, Imagerie médicale
M. NOUVEL Laurent, Pathologie de la reproduction
Mlle PALIERNE Sophie, Chirurgie des animaux de compagnie
Mlle PAUL Mathilde, Epidémiologie, gestion de la santé des élevages avicoles et porcins Mme PRADIER Sophie, Médecine interne des équidés
M. RABOISSON Didier, Productions animales (ruminants)
Mme TROEGELER-MEYNADIER Annabelle, Alimentation
M. VOLMER Romain, Microbiologie et Infectiologie (disponibilité à cpt du 01/09/10)
M. VERWAERDE Patrick, Anesthésie, Réanimation
MAITRES DE CONFERENCES et AGENTS CONTRACTUELS
M. BOURRET Vincent, Microbiologie et infectiologie
Mme FERNANDEZ Laura, Pathologie de la reproduction ASSISTANTS D'ENSEIGNEMENT ET DE RECHERCHE CONTRACTUELS
Mlle DEVIERS Alexandra, Anatomie-Imagerie M. DOUET Jean-Yves, Ophtalmologie
Remerciements
A Monsieur le Professeur Christophe Pasquier
Professeur à l’Université Toulouse III Paul Sabatier. Praticien hospitalier
Virologie
Qui nous a fait l’honneur d’accepter la Présidence de notre jury de thèse, qu’il reçoive ici nos hommages respectueux.
A Monsieur le Professeur Stéphane Bertagnoli
Professeur à l’Ecole Nationale Vétérinaire de Toulouse Pathologie Infectieuse
Qui nous a fait l’honneur d’accepter de nous encadrer, aider et guider tout au long de la réalisation de ce travail. Merci pour votre disponibilité et votre gentillesse.
Madame le Docteur Séverine Boullier
Maître de Conférences à l’Ecole Nationale Vétérinaire de Toulouse Immunologie générale et médicale
Qui nous a fait le plaisir d’accepter de participer à notre jury de thèse, qu’elle reçoive ici nos plus sincères remerciements.
A Papa et Maman, pour votre soutient et votre amour inconditionnel. Je n’y serais
jamais arrivée sans vous !
A Colin, mon grand frère chéri, mon lunetton. Merci d’être toujours à l’écoute et pour tes bons conseils.
A Chloé, ma sœur (et ses plantes toitaires) qui m’a soutenue toutes ces années de prépa puis d’école. Merci de m’avoir accueillie tous les week-ends, je te le rendrai en tartes au citron !
A Clément, mon petit frérot, pour toutes ces années passées tous les deux, aux tournois de basket dans ta chambre, à toutes nos chamailleries et notre complicité. A Roberto, mon grand amour. Gracias por haberme esperado todos estos años, se nos vienen muchos más felices. Je t’aime.
« ¿Y mi vida? Dime, mi vida,
¿qué es, si no eres tú? » (Cernuda)
A Foued, et sa règle Josette. Merci de m’avoir supportée tous ces week-ends pour ta bonne cuisine !
A Paula, pour ta joie de vivre, ton sourire et tes brigadeiros !
A Anis la saucisse, tu es là depuis pas longtemps mais tu remplis déjà nos vies !
A Juju et Chinou, pour tous ces étés passés ensemble, et pour votre chaleureux accueil pendant le stage en rurale.
A Papi qui me manque et Manou avec qui j’aurais aimé partager plus.
A Michel et Mauricette, vous êtes devenus de véritables deuxièmes parents, merci de vous être occupés de moi pendant les années difficiles de la prépa et de m’accueillir toujours à bras ouverts.
A Tata Marie-Jo, Pipiou, Jérôme, JE et JB, pour tous ces étés passés ensemble. A toute la grande famille Cadier, bien trop nombreuse pour vous citer tous !
A Corentin et Maguy, mes chers parrains et marraine, j’ai bien de la chance de vous avoir !
A la familia Arroyo Aguirre, por haberme acogido siempre como una de ustedes y por haberme hacer sentir cómoda en su familia.
A Emilie, toujours présente dans les bons et les moins bons moments. Merci pour tous ces moments de rigolade, même quand il y avait du boulot (et des ptt à faire !) j’ai gardé le sourire grâce à toi. Et bien sûr sans oublier la petite Fifteen, la petite loutre gentille comme tout.
A Sophie, ma Soso, aussi blonde que moi (“ah bon??”), ma quiche royale, tu vas me manquer !
A Lucie, dite « Lucie Roger », pour ta motivation, ton soutien inconditionnel et ta force qui me surprendront toujours. Garde tes deux genoux et tes yeux sur la route !
A Caro, Elsa, Stéphanie, Thibault, Elodie, Sarah : vous avez été un super groupe ! A Popo, ma petite boule de poils, parce qu’on rigole dès qu’on est ensemble. A Mémé, ma poissonnière préférée du Vieux Port.
A Hélène, sans qui je n’aurais pas survécu à la prépa. Tu m’as aidé à relativiser les choses, à rigoler et à manger des salades « parfumées » à l’ail !
A Mélodie et Laurine, avec qui j’ai partagé deux superbes années. Merci pour tout ! A Audrey et Astrid, petites mais pleines de caractère ! Merci à vous !
A Andrea y Dani, por todos estos años en la Condamine, por todo lo que compartimos. Vamos a poder vernos mucha más ahora.
A Marion, pour ces années de collège pas toujours faciles. On a réussi à conserver cette belle amitié au fil des ans, merci !
A Marine et Charlotte, pour tous les délires du collège.
A Marie et Marguerite, mes mouths, on va bientôt fêter les 14 ans de notre rencontre ! Même si on ne se voit pas souvent, je sais qu’à chaque fois je vous retrouve comme si de rien était, une petite Cité de la Peur et ça repart !
A Paul, tu es parti trop tôt, mais je garde le souvenir de ta joie de vivre, de toutes ces après-midi à faire des moelleux, au bord de la piscine et à faire des émissions. Tu me manques.
A mon Simba, le chien de ma vie, qui m’a donné l’envie de devenir vétérinaire. A Lila
9
Table des matières
Table des Illustrations ...15
Liste des figures ... 15
Liste des tableaux ... 15
Liste des abréviations ...17
Introduction ...19
Première partie : Immunologie du jeune ...21
I. Développement du système immunitaire ... 21
A. Développement général ... 21
B. Particularités des carnivores ... 22
C. Limites de la protection immunitaire du nouveau-né ... 23
II. Le système immunitaire et les infections intra-utérines ... 23
III. Réponse immunitaire du nouveau-né ... 24
A. Rôle de la microflore intestinale ... 24
B. Immunité innée... 24
C. Immunité spécifique ... 25
IV. Transfert de l’immunité de la mère vers sa progéniture ... 26
A. Différents types de placentation ... 26
B. Sécrétion et composition du colostrum et du lait ... 27
C. Absorption du colostrum ... 28
D. Durée de protection passive ... 29
V. Echec du transfert passif ... 30
VI. Immunité à médiation cellulaire et colostrum ... 30
VII. Développement de l’immunité acquise chez les mammifères nouveau-nés ... 31
A. Immunité locale ... 31
B. Immunité systémique ... 31
C. Vaccination des jeunes ... 32
10
Deuxième partie : Monographies des maladies infectieuses du chiot ...35
I. Maladies infectieuses principales ... 35
A. Maladie de Carré ... 35 1. Agent infectieux ... 35 2. Circonstances d’apparition ... 37 3. Réservoir ... 37 4. Mode de transmission ... 37 5. Pathogénie ... 37 6. Période d’incubation ... 40 7. Population à risque ... 40 8. Facteurs favorisants ... 40 9. Signes cliniques ... 40 10. Prévention ... 42
B. Hépatite de Rubarth (ou hépatite infectieuse) ... 45
1. Agent infectieux ... 45
2. Circonstances d’apparition et animaux sensibles ... 45
3. Mode de transmission ... 45 4. Pathogénie ... 45 5. Période d’incubation ... 47 6. Population à risque : ... 48 7. Facteurs favorisants ... 48 8. Signes cliniques ... 48 9. Prévention ... 49 C. Parvovirose ... 51 1. Agent infectieux ... 51 a. Historique ... 51 b. Spectre d’hôtes ... 51
c. Pathogénicité des souches ... 52
d. Distribution des variants du CPV dans le monde ... 52
e. Caractéristiques physico-chimiques ... 53
2. Mode de transmission ... 53
11 4. Période d’incubation ... 55 5. Population à risque ... 56 6. Facteurs favorisants ... 56 7. Signes cliniques ... 56 8. Prévention ... 57 D. Rage ... 60
1. Historique et situation actuelle ... 60
2. Agent infectieux ... 61 3. Réservoir ... 62 4. Mode de transmission ... 63 5. Pathogénie ... 63 6. Période d’incubation ... 64 7. Population à risque ... 64 8. Facteurs favorisants ... 64 9. Signes cliniques ... 64 10. Prévention ... 65
II. Maladies infectieuses secondaires ... 67
A. Leptospirose ... 67 1. Agent infectieux ... 67 2. Circonstances d’apparition ... 67 3. Réservoir ... 68 4. Mode de transmission ... 68 5. Pathogénie ... 68 6. Période d’incubation ... 70 7. Population à risque ... 71 8. Facteurs favorisants ... 71 9. Signes cliniques ... 71 10. Prévention ... 72
B. Trachéobronchite infectieuse canine ou Toux de chenil ... 74
1. Agents infectieux ... 74
a. Bordetella bronchiseptica ... 74
12
c. Adénovirus Canin sérotype 2 ... 76
d. Mycoplasma spp. ... 77
e. Autres agents infectieux ... 77
2. Circonstances d’apparition ... 77
3. Réservoir ... 77
4. Mode de transmission, période d’incubation et animaux sensibles ... 77
5. Population à risque ... 78
6. Facteurs favorisants ... 78
7. Signes cliniques ... 79
8. Prévention ... 79
a. Vaccination... 79
i. Efficacité des vaccins ... 79
ii. Vaccins disponibles ... 80
iii. Protocole vaccinal ... 81
iv. Mise en place de l’immunité ... 82
v. Contre-indications ... 82
b. Mesures sanitaires et hygiéniques ... 82
C. Herpesvirose ... 83 1. Agent infectieux ... 83 2. Réservoir ... 83 3. Mode de transmission ... 84 4. Pathogénie ... 84 5. Période d’incubation ... 86 6. Population à risque ... 86 7. Facteurs favorisants ... 86 8. Signes cliniques ... 86 9. Prévention ... 87 D. Coronavirose ... 88 1. Les Coronavirus ... 88
2. Coronavirus entérique canin ... 89
a. Agent infectieux ... 89
13 c. Population à risque ... 90 d. Mode de transmission ... 90 e. Période d’incubation ... 90 f. Pathogénie ... 90 g. Signes cliniques ... 90 h. Prévention ... 91
3. Coronavirus respiratoire canin ... 91
E. Influenza ... 92 1. Agent infectieux ... 92 2. Signes cliniques ... 92 3. Prévention ... 93 F. Rotavirose ... 94 1. Agent infectieux ... 94 2. Mode de transmission ... 94 3. Pathogénie ... 94 4. Signes cliniques ... 94 5. Prévention ... 94 G. Reovirose ... 95
Troisième partie : Prévention des maladies infectieuses du chiot ...97
I. Problématique de la vaccination du jeune : notion de période critique ... 97
II. Protocoles de base et recommandations ...101
A. Recommandations de vaccination des chiens en Europe ... 101
B. Recommandations de vaccination des chiens aux Etats-Unis ... 105
1. Règlementation et recommandations ... 105
2. Tests sérologiques mesurant le taux en anticorps ... 107
C. Adaptation des protocoles ... 109
1. Responsabilité du vétérinaire ... 109
2. L’évaluation des risques pour adapter un protocole ... 109
3. Primovaccination : à partir de quel âge vacciner ? ... 110
4. A quel intervalle doit-on faire les rappels ? ... 111
14
6. Adaptation des protocoles aux catégories de chiens ... 115
III. Mesures sanitaires : prévention et gestion des infections dans les chenils ...117
A. Pour tous types de chenils... 117
1. Caractéristiques générales ... 117
2. Transmission des agents pathogènes ... 118
3. Gestion des maladies ... 120
4. Conception des bâtiments ... 122
5. Nutrition ... 124
B. Chenils permanents ... 125
1. Chenils d’élevage ... 125
2. Chenils de recherche ... 126
C. Chenils de transition ... 126
IV. Le développement comportemental du chiot ...128
A. Période prénatale : la vie intra-utérine ... 128
B. Période néo-natale : de la naissance à 15 jours ... 129
C. Période de transition : de 15 à 21 jours ... 130
D. Période de socialisation : de 3 semaines à 3 mois ... 131
E. Période juvénile : de 3 mois à la puberté ... 134
F. Défaut de socialisation ... 134
G. Comment gérer la période critique immunologique tout en permettant un bon développement comportemental ? ... 136
1. Risque infectieux et gestion de la période critique ... 136
2. Développement comportemental normal ... 137
Conclusion ... 141
Annexes ... 142
Différentes souches de vaccins disponibles en France ...142
Différents vaccins disponibles en France ...143
15
Table des Illustrations
Liste des figures
Figure 1: Schéma représentatif du développement du système immunitaire du veau (d’après Tizard,
2013)... 22
Figure 2 : Différents types de placentation chez l’Homme et les principaux animaux domestiques (d’après Day & Schultz, 2011) ... 27
Figure 3: Arbre phylogénétique du CDV basé sur l’analyse de l’hémagglutinine (d’après Harder et al., 2003)... 36
Figure 4: Schéma représentant la pathogénie de la maladie de Carré (d’après Greene, 2006a) ... 39
Figure 5: Chiot atteint par la maladie de Carré : écoulements oculaires muco-purulents, hyperkératose de la truffe et des coussinets (Martella et al., 2008) ... 42
Figure 6: Séquelles chez un animal qui a eu la maladie de Carré : Hypoplasie de l’émail (Martella et al., 2008)... 42
Figure 7: Schéma de la pathogénie de l’hépatite infectieuse canine (d’après Greene, 2006b). ... 47
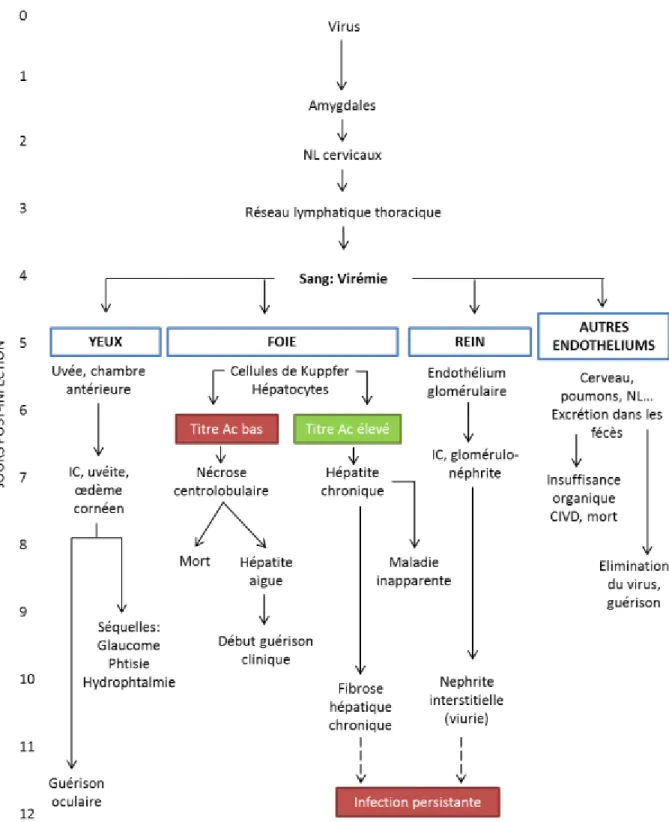
Figure 8: Schéma de la pathogénie de la parvovirose (d’après Greene, 2006c). ... 55
Figure 9: Arbre phylogénétique des Lyssavirus, montrant qu’il existe 7 génotypes principaux (d’après Malerczyk et al., 2009) ... 62
Figure 10: Schéma de la pathogénie de la leptospirose (d’après Greene, 2006e) ... 70
Figure 11: Schéma de la pathogénie de l’herpesvirose (d’après Greene, 2006g) ... 85
Figure 12: Arbre phylogénétique des Coronavirus (d’après Van Boheemen, 2012) ... 88
Figure 13: Courbe montrant la diminution des AC maternels en fonction de l’âge du chiot (d’après Greene (2006h) et Cassaleux & Fontaine (2006)). ... 99
Figure 14: Schéma représentant l’évolution du taux sérique en anticorps chez 2 chiots de la même portée ayant reçu des quantités de colostrum différentes (à partir de Day & Schultz, 2011) ... 100
Figure 15: Schéma récapitulatif du protocole de vaccination recommandé dans les RCP en France ... 104
Figure 16: Schéma récapitulatif du protocole de vaccination recommandé par le WSAVA et l’AAHA .... 107
Figure 17: Exemple d’aménagement d’un chenil avec 2 zones: avec et sans contact avec l’extérieur (d’après Grandjean et al. (2003)) ... 124
16
Tableau 1: Différents signes observables lors d’atteinte par le virus de la maladie de Carré (Greene,
2006a) ... 41
Tableau 2: Comparaison de la durée minimum de l’immunité (DOI) de différentes souches de CDV selon
la sérologie ou les épreuves virulentes (d‘après Schultz, 2006) ... 43
Tableau 3: Différents signes observables lors de l’hépatite infectieuse canine (d’après Greene, 2006b) 49 Tableau 4: Comparaison de la durée minimum de l’immunité (DOI) du CAdV-A sérotype 2 selon la
sérologie ou les épreuves virulentes (d’après Schultz, 2006) ... 50
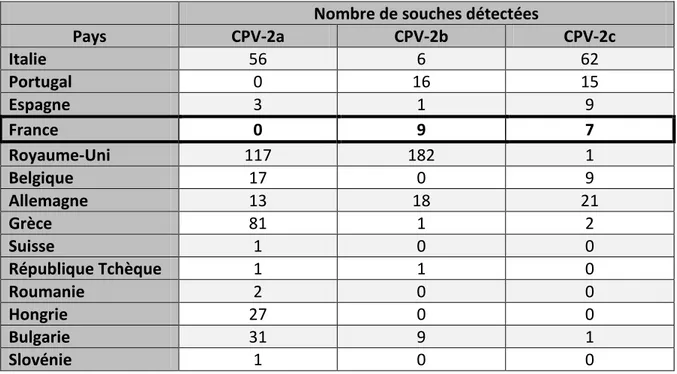
Tableau 5: Distribution des différents variants du parvovirus canin en Europe (Tableau modifié à partir
de Decaro & Buonavoglia (2012)) ... 53
Tableau 6: Comparaison de la durée minimum de l’immunité (DOI) du CPV-2 selon la sérologie ou les
épreuves virulentes (d’après Schultz, 2006) ... 59
Tableau 7: Comparaison du mode de transmission, de la période d’incubation, de l’excrétion pour les
différents agents infectieux responsables de la TBI (à partir de Buonavoglia & Martella (2007) et Greene (2006f)) ... 78
Tableau 8: Différents vaccins disponibles en France dirigées contre Bordetella bronchiseptica ou en
application intranasale (à partir de IRCP, 2013) ... 81
Tableau 9: Récapitulatif des protocoles recommandés dans les RCP des vaccins « core » disponibles en
France (d’après IRCP (2013), Fauchier (2012)) ... 102
Tableau 10: Récapitulatif des protocoles recommandés dans les RCP des vaccins « non core » disponibles
en France (d’après IRCP (2013), Fauchier (2012)) ... 103
Tableau 11: résumé des recommandations américaines émises par la WSAVA et la AAHA (d’après Sykes
(2012), Day et al. (2010), Welborn et al. (2011)) ... 106
Tableau 12: Comparaison des durées de protection des vaccins selon les RCP en France (a = IRCP, 2013)
et selon les données scientifiques (b = Greene (2006h), c = Schultz (2006), d = Day et al. (2010)). Légende : A : atténué, I : inactivé ... 113
Tableau 13: Définition des catégories de chiens selon leur mode de vie (d’après Greene, 2006h) ... 114 Tableau 14: Préconisations des intervalles de rappels selon la catégorie de chien (d’après Greene,
2006h) ... 115
Tableau 15: Mode de transmission et survie à l’extérieur des agents pathogènes affectant les chiots . 119 Tableau 16: Propriétés des principaux désinfectants et spectre d’action (d’après Greene, 2006i)
Légende : Bacilles AAR= acido-alcoolo-résistants ... 122
Liste des tableaux
17
Liste des abréviations
AAHA: American Animal Hospital Association
Ac : anticorps
AMM : Autorisation de Mise sur le Marché
AOM : Anticorps d’Origine Maternelle BALT: Bronchus-Associated Lymphoid Tissue
CAdV-A: Canine Adenovirus Type A CDV: Canine Distemper Virus CaHV-1: Canine Herpesvirus Type 1 CIVD : Coagulation intravasculaire disséminée
Core vaccines : vaccins essentiels CoV : Coronavirus
CCoV: Canine Coronavirus
CRCoV: Canine Respiratory Coronavirus CRV : Canine Rotavirus
CPV-2 : Canine Parvovirus Type 2 DDPP : Direction Départementale de la Protection des Populations
DOI : durée minimum de l’immunité EBLV-1: European Bat Lyssavirus Type 1 FVP: Feline Panleucopenia Virus
GALT: Gut-Associated Lymphoïd Tissue
IFN γ : Interféron γ Ig: Immunoglobuline LPS: Lipopolysaccharide
MRV: Mammalian orthoreovirus Non core vaccines : vaccins optionnels PAMP : pathogen-associated microbia pattern
PIV-5 : Parainfluenza Virus Type 5 RCP: Résumé des Caractéristiques du Produit
TBI : Trachéobronchite infectieuse TLR : Toll-like receptor
WSAVA: The World Small Animal Veterinary Association
Pour les protocoles vaccinaux : C: Maladie de Carré H : Hépatite infectieuse P : Parvovirose Pi : Virus Para-influenza L : Leptospirose R : Rage Bb : Bordetella bronchiseptica
19
Introduction
Le vétérinaire est l’un des premiers interlocuteurs des propriétaires de chiots nouvellement adoptés. La première consultation est l’occasion de commencer la vaccination et de donner des conseils sur l’éducation. Le vétérinaire doit poser les bonnes questions pour cerner le futur mode de vie du chien et pour choisir les vaccins à administrer.
L’adoption, entre 2 et 3 mois d’âge, est une période critique pour les chiots qui sont très sensibles aux maladies infectieuses, qui peuvent être mortelles. C’est aussi l’étape de socialisation qui est essentielle au bon développement comportemental du chiot. Quels sont les moyens de protection du jeune chiot face aux maladies infectieuses, tout en lui permettant un bon développement comportemental ?
Dans une première partie, nous étudierons l’immunité du jeune mammifère pour comprendre pourquoi le jeune est plus vulnérable que les adultes aux maladies infectieuses.
Dans une deuxième partie, nous verrons les principales maladies infectieuses qui affectent les jeunes. On se limitera aux maladies bactériennes et virales les plus communes chez les chiots. On s’intéressera à l’étiologie, notamment au mode de transmission des agents infectieux, à la pathogénie, aux signes cliniques et à la prévention de ces maladies. Nous ne discuterons pas des aspects diagnostiques ou thérapeutiques.
Dans une troisième partie, nous aborderons la prévention de ces maladies infectieuses. Nous verrons les protocoles de base et comment les adapter au mieux à chaque animal. Nous aborderons également les mesures sanitaires à mettre en œuvre pour prévenir la transmission des agents infectieux. Enfin, nous étudierons le développement comportemental du chiot et les mesures de prévention pour avoir un chiot correctement protégé contre les maladies infectieuses tout en étant équilibré.
21
Première partie : Immunologie du jeune
A la naissance, un mammifère passe d’un utérus stérile à un environnement où il est exposé à toute sorte de micro-organismes. Dans les heures suivant la naissance, il acquiert sur toutes ses surfaces une flore microbienne, comme par exemple dans le tractus gastro-intestinal. Pour survivre, l’animal doit maîtriser cette invasion bactérienne. La réponse acquise (ou spécifique) met un certain temps à se mettre en place et c’est la réponse innée (ou non spécifique) qui permet la résistance aux micro-organismes au début (Tizard, 2013).
Chez la plupart des animaux domestiques, le système immunitaire spécifique est compétent à la naissance mais naïf. Le développement de l’immunité spécifique dépend de la stimulation antigénique (Tizard, 2013).
Les mammifères nouveau-nés sont très vulnérables aux infections dans leurs premières semaines de vie. La mère joue alors un rôle essentiel en assurant le transfert passif d’anticorps (Tizard, 2013).
I.
Développement du système immunitaire
A. Développement général
Le développement du système immunitaire du fœtus suit toujours le même schéma chez les mammifères. Le premier organe lymphoïde à se développer est le thymus, suivi de près par les organes lymphoïdes secondaires : les nœuds lymphatiques, la pulpe blanche de la rate et les tissus lymphoïdes associés aux muqueuses (GALT, BALT). Les lymphocytes B apparaissent après le développement des nœuds lymphatiques et de la rate (Tizard, 2013).
Tizard (2013) donne l’exemple du développement progressif du système immunitaire du fœtus bovin, qui est semblable, mis à part les durées, chez tous les mammifères (Fig. 1).
22
Figure 1: Schéma représentatif du développement du système immunitaire du veau (d’après Tizard, 2013)
B. Particularités des carnivores
Le système immunitaire des carnivores présente certaines particularités. Au niveau de la réponse cellulaire, le thymus se développe entre les 23ème et 33ème jours de gestation (Boullier, 2003). Les lymphocytes colonisent le thymus le 35ème jour de gestation, puis les organes lymphoïdes secondaires : les nœuds lymphatiques à partir du 46ème jour et la rate vers 50 à 55 jours de gestation (Day, 2007). Par contre, la réponse humorale devient fonctionnelle plus tard, juste avant la mise bas. Les effecteurs de la réponse immunitaire non spécifique (complément, cellules phagocytaires) apparaissent en milieu de gestation (Tizard, 2013). Enfin, c’est à partir du 45ème jour de gestation que le fœtus est capable d’élaborer une réaction immunitaire basique, via la production d’anticorps ou le rejet d’une greffe (Person, 2003).
23
C. Limites de la protection immunitaire du nouveau-né
Malgré ce développement du système immunitaire, la protection immunitaire du nouveau-né présente quelques limites (Boullier, 2003).
A la naissance, le système immunitaire du chiot et du chaton est fonctionnel, mais sans la protection passive maternelle, ils sont très vulnérables face aux agents infectieux (Boullier, 2003).
Après la naissance, le jeune quitte l’environnement stérile de l’utérus et se retrouve dans une ambiance contaminée. La réponse aux agressions se met en place, mais de manière lente et efficace (Boullier, 2003).
Lors de la mise-bas, la mère sécrète une grande quantité d’hormones immunosuppressives comme les prostaglandines ou les glucocorticoïdes. Ces hormones imprègnent le jeune, ce qui va avoir plusieurs conséquences (Boullier, 2003) :
- Les glucocorticoïdes bloquent l’activité phagocytaire des neutrophiles et des macrophages et réduisent leur efficacité contre les bactéries et les virus. Ils diminuent les fonctions chimiotactiques des cellules immunitaires, qui mettent plus de temps à arriver sur un site infectieux.
- La diminution de l’activité phagocytaire des macrophages perturbe leur rôle de cellules présentatrices d’antigène. En conséquence, les lymphocytes T sont avertis tardivement de l’arrivée d’agents pathogènes.
II.
Le système immunitaire et les infections intra-utérines
Même si le fœtus n’est pas complètement sans défenses, il est moins capable de combattre une infection qu’un adulte. Son système immunitaire spécifique n’est pas encore fonctionnel et donc certaines infections peuvent passer inaperçues chez la mère et se révéler très sévères ou mortelles pour le fœtus. C’est le cas par exemple pour la rhinotrachéite infectieuse bovine (BHV-1) ou encore la toxoplasmose chez l’Homme (Tizard, 2013).
L’infection du fœtus entraîne une réponse immunitaire via les immunoglobulines. Ainsi, lorsque l’on retrouve des Immunoglobulines (Ig) dans le sérum d’un nouveau-né, on peut suspecter une infection in utero (Tizard, 2013).
Le stade immunologique pendant lequel le fœtus se contamine détermine les conséquences de l’infection. Par exemple, les porcelets infectés avec du parvovirus avant
24
55 jours post-conception vont être avortés ou mort-nés. Par contre, si l’infection a lieu après 72 jours, les porcelets développent des titres élevés en anticorps contre le parvovirus et vont survivre (Tizard, 2013).
III. Réponse immunitaire du nouveau-né
Après s’être développé dans l’environnement stérile de l’utérus, le nouveau-né se retrouve face à une grande quantité de micro-organismes à la naissance. Il a besoin de son immunité innée et spécifique pour éviter une invasion massive. L’immunité spécifique met du temps à se mettre en place et les concentrations en anticorps restent souvent très basses pendant un certain temps. C’est pour cela que l’immunité innée est essentielle pour la survie lors des premières semaines de vie (Tizard, 2013).
A. Rôle de la microflore intestinale
Le développement du système immunitaire du nouveau-né dépend beaucoup de la microflore intestinale. Sans elle, il ne peut pas développer complètement ses tissus lymphoïdes associés aux muqueuses (Tizard, 2013).
La flore commensale génère des motifs moléculaires nommés PAMP, « pathogen-associated microbia pattern », comme par exemple le LPS ou l’ADN bactérien. Ces PAMPs sont reconnus par les TLR, « Toll-like receptor », qui sont présents sur plusieurs types de cellules et qui ont un rôle dans l’immunité innée. Ces signaux favorisent le développement du système immunitaire (Tizard, 2013).
B. Immunité innée
Les nouveau-nés peuvent produire une large gamme de molécules antimicrobiennes, comme les lectines, les défensines, les lactoferrines ou encore le lysosyme (Tizard, 2013). Les TLR sont présents et fonctionnels chez le nouveau-né. Les neutrophiles sont présents pendant la vie intra-utérine et sont capables de phagocyter mais l’activité bactéricide s’acquiert plus tard (Tizard, 2013).
25
C. Immunité spécifique
Les mammifères nouveau-nés montrent une immunité spécifique asymétrique, plutôt de
type Th2 que Th1. Ils favorisent donc la réponse humorale (anticorps) plutôt que
l’immunité à médiation cellulaire (Tizard, 2013).
Ceci peut-être dû au fait que pendant la gestation, l’environnement du fœtus est marqué par deux élements (Person, 2003):
- une diminution importante des réponses lymphoïdes de type Th1 (immunité cellulaire et humorale)
- augmentation de la réponse non spécifique (cellules NK, cellules phagocytaires) et de type Th2 (qui entraîne la production d’anticorps)
Avant la naissance, ce déséquilibre entre Th1/Th2 a été démontré chez de nombreuses espèces et permet l’implantation du fœtus. Par contre, après la naissance, la protection contre de nombreuses maladies infectieuses nécessite plutôt une réponse de type Th1. Ce qui suggère que le système immunitaire du nouveau-né va être « éduqué » pour arriver à un équilibre approprié entre Th1/Th2 (Person, 2003).
Cela permet de justifier l’utilisation de vaccins atténués, qui orientent la réaction immunitaire vers une réponse Th1. Par contre, les vaccins inactivés qui orientent la réaction vers Th2 seraient à utiliser plus tardivement (Person, 2003).
La production d’IFN-γ est très limitée au début car ils peuvent causer des lésions placentaires. Cette production augmente régulièrement dans les 6 premiers mois de vie jusqu’à arriver au niveau des adultes à 1 an.
Pendant les 3 premiers mois de vie, les chiots ont une numération lymphocytaire plus élevée que les adultes. Cette différence est due à une plus grande proportion de LB CD21+ vis-à-vis des LT CD8+. L’involution du thymus commence vers 6 mois chez les chiots et les chatons.
Le mammifère nouveau-né est très sensible aux infections et peut être tué par des micro-organismes qui peuvent passer inaperçus chez l’adulte. Le jeune peut compter sur une « aide immunologique » supplémentaire : les anticorps transférés par la mère à sa progéniture via le colostrum. La mère peut également transférer des lymphocytes via le placenta au fœtus ou via le colostrum au nouveau-né.
26
IV. Transfert de l’immunité de la mère vers sa progéniture
A. Différents types de placentation
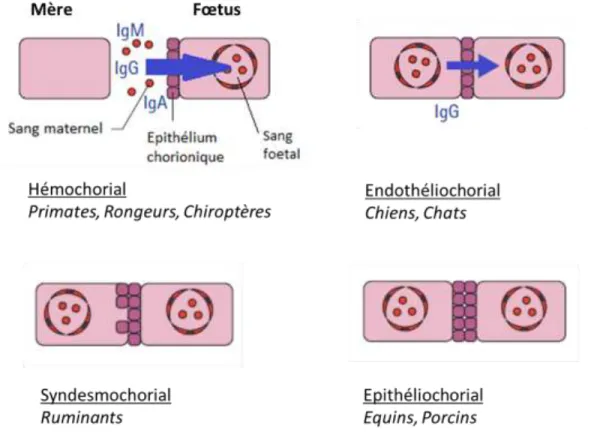
La voie de transfert des anticorps maternels vers le fœtus dépend de la structure du placenta.
Chez les humains et autres primates, le placenta est hémochorial. Le sang maternel est directement en contact avec le trophoblaste. Ce type de placentation permet un transfert direct d’IgG au fœtus mais pas d’Ig M, A ou E. Les IgG maternelles passent dans le sang fœtal et le bébé qui vient de naître a des niveaux d’IgG circulantes comparables à ceux de la mère (Tizard, 2013).
Chez les chiens et les chats, la placentation est de type endothéliochorial (Tizard, 2013). L’épithélium chorionique fœtal est en contact avec l’endothélium des capillaires maternels. Les circulations maternelle et fœtale sont séparées par 4 couches tissulaires : l’endothélium capillaire maternel, l’épithélium chorionique, le tissu conjonctif et l’endothélium capillaire fœtal (Boullier, 2003). Dans ces 2 espèces, seulement 5 à 15% selon les auteurs (5-10 % (Tizard, 2013) ou 10-15% (Boullier, 2003)) des IgG sont transférés directement via le placenta, car l’endothélium capillaire maternel retient les IgG maternelles dans les vaisseaux. La plupart des IgG est obtenue via le colostrum (Boullier, 2003).
Les ruminants ont un placenta de type syndesmochorial : l’épithélium chorionique fœtal est en contact avec le tissu utérin. Chez les porcins et les équins, la placentation est de type épithéliochorial: l’épithélium chorionique fœtal est en contact avec l’épithélium utérin. Dans ces types de placentation, le passage transplacentaire d’Ig est impossible. Les nouveau-nés dépendent entièrement des anticorps reçus via le colostrum (Tizard, 2013). Le schéma suivant résume les différentes caractéristiques de placentation (Fig. 2).
27
Figure 2 : Différents types de placentation chez l’Homme et les principaux animaux domestiques (d’après Day & Schultz, 2011)
B. Sécrétion et composition du colostrum et du lait
Le colostrum est constitué de l’accumulation des sécrétions de la glande mammaire durant les dernières semaines de gestation et de protéines transférées activement depuis le sang sous l’influence d’œstrogènes et de progestérone. Il est riche en IgG et IgA et contient dans une moindre mesure des IgM et IgE. Les IgG représentent 65-90% des anticorps présents dans le colostrum (Tizard, 2013).
Au fur et à mesure que la lactation progresse, le colostrum devient du lait et on voit apparaitre des différences entre les espèces (Tizard, 2013):
- Chez les primates, les IgA prédominent dans le colostrum et le lait
- Chez les porcins et les équins, les IgG prédominent dans le colostrum, alors que les IgA sont majoritaires dans le lait
- Chez les ruminants, les IgG prédominent dans le colostrum et le lait
- Chez le chien, le colostrum est riche en IgG et IgA, à des concentrations supérieures au sérum de la chienne. Par contre, le lait est significativement plus
28
riche en IgA qu’en IgG, et à une concentration supérieure que dans le sérum canin (Day, 2007).
C. Absorption du colostrum
Peu de temps après leur naissance, les jeunes mammifères commencent à téter et ingèrent le colostrum. L’activité des protéases de leur tractus digestif est réduite par les inhibiteurs de trypsine présents dans le colostrum. Les protéines colostrales ne sont pas détruites et arrivent intactes dans l’intestin grêle. Les Ig présentes dans le colostrum sont prises en charge par les récepteurs FcRn à Ig présents sur l’épithélium intestinal. Ces récepteurs sont présents également sur les cellules des canaux et des acini de la glande mammaire et sont sans doute impliqués dans la sécrétion d’IgG dans le colostrum (Tizard, 2013). Une fois qu’elles ont été prises en charge par les récepteurs FcRn, les Ig passent dans la circulation sanguine et lymphatique (Day, 2007). Le nouveau-né reçoit donc une « transfusion » massive d’immunoglobulines maternelles.
Les différentes espèces de mammifères se distinguent par plusieurs paramètres (Tizard, 2013):
- La sélectivité de la perméabilité intestinale diffère selon les espèces. Chez les porcins et les équins, l’absorption est sélective : les IgG et IgM sont préférentiellement absorbés, alors que les IgA restent dans le tractus intestinal. Par contre, chez les ruminants l’absorption n’est pas sélective, toutes les Ig sont absorbées.
- La durée de la perméabilité intestinale qui varie selon les espèces et la classe Ig. En général, la perméabilité est maximale juste après la naissance et elle diminue après 6 heures. Cela est dû au remplacement de l’épithélium intestinal qui porte les récepteurs FcRn par des cellules qui n’expriment pas le récepteur. On considère en général que l’absorption de tous les types d’Ig est presque nulle 24 heures après la naissance. Il semblerait que la prise de colostrum accélère le remplacement des cellules, alors qu’un retard de prise de colostrum peut prolonger ce délai jusqu’à 33 heures.
- Il semblerait que la présence de la mère augmente l’absorption intestinale d’Ig. Les mammifères nouveau-nés ont normalement des niveaux d’Ig sériques très bas. Lorsque l’absorption des Ig colostrales est réussie, les niveaux d’IgG sériques atteignent des niveaux comparables à ceux des adultes. On observe un pic d’Ig sériques dans les 12 à 24 heures après la naissance. Quand l’absorption se termine, le taux de ces anticorps
29
acquis passivement diminue progressivement à cause de processus métaboliques normaux. La vitesse de cette diminution dépend des différentes classes d’Ig et de leur concentration initiale. Le taux d’IgG maternelles diminue de moitié tous les 10 jours environ. La durée de protection par les AOM dépend donc de la quantité d’Ig ingérées par le jeune (Tizard, 2013).
Le nouveau-né est protégé contre les pathogènes rencontrés par la mère, qui sont ceux présents dans l’environnement et contre lesquels elle a été vaccinée (Boullier, 2003). Les sécrétions de la glande mammaire passent progressivement du colostrum vers le lait. Le lait des ruminants est riche en IgG1 et IgA, alors que celui des non ruminants est riche en IgA (Boullier, 2003). L’activité protéolytique se met progressivement en place et les IgG sont dégradées. Par contre, les IgA résistent aux protéases et persistent dans le tube digestif. Les IgA assurent une protection locale contre les infections entériques. Le lait n’apporte donc qu’une protection locale (Tizard, 2013).
Les IgG transférées au jeune via le colostrum sont le résultat de l’exposition antigénique de la mère et de la réponse des lymphocytes B. Ces IgG maternelles représentent son expérience immunologique. Les anticorps maternels agissent sur le système immunitaire du jeune pendant la période critique d’imprégnation et semblent exercer une influence sur le développement immunitaire du nouveau-né. Cette influence pourrait même être supérieure à certaines prédispositions génétiques. Ainsi, les anticorps maternels peuvent favoriser la réponse immunitaire envers certains antigènes et supprimer la réponse envers d’autres. Ils pourraient aussi influencer la polarisation Th1/Th2 et le développement ultérieur d’allergies (Tizard, 2013).
D. Durée de protection passive
La durée de protection passive dépend de la quantité d’IgG ingérées par le jeune qui se retrouve dans son sérum. La quantité ingérée dépend de nombreux facteurs (Boullier, 2003) :
- Facteurs maternels : la quantité d’IgG maternelles, la taille de la portée, l’accès à la mamelle
- Facteurs liés à la portée : la quantité de colostrum produite par la mère ne dépend pas du nombre de petits. Donc si la portée est de taille importante, chaque chiot recevra moins de colostrum
- Facteurs liés au nouveau-né : le moment de la prise de colostrum, le temps d’accès à la mamelle. La concentration sérique en IgG dépend de la quantité d’IgG
30
maternelles ingérées, de la vitesse de disparition des IgG et de la vitesse de croissance du nouveau-né car plus le chiot prend du poids, plus les IgG sont diluées.
V.
Echec du transfert passif
L’absorption des IgG du colostrum est nécessaire pour la protection du jeune contre les maladies septicémiques. L’apport continuel d’IgA ou d’IgG par le lait permet une protection contre les maladies entériques. L’échec de ces processus prédispose le jeune aux infections (Tizard (2013) et Day & Schultz (2011)).
Il existe 3 raisons d’échec du transfert passif via le colostrum (Tizard (2013) et Day & Schultz (2011)).
Il y a d’abord l’échec de production : la mère produit du colostrum en quantité ou en qualité insuffisante. Comme le colostrum est une accumulation de sécrétions pendant la fin de la gestation, une mise-bas prématurée va être associée à une quantité insuffisante de colostrum. On peut observer une perte de colostrum lors de lactation prématurée. Les niveaux d’IgG colostrales dépendent aussi de chaque individu.
Puis, il peut y avoir un échec d’ingestion : le jeune ne prend pas bien son colostrum. Les jeunes peuvent ne pas avoir assez de colostrum car le nombre de petits dans la portée est trop important pour la quantité produite par la mère. Les jeunes mères inexpérimentées peuvent être réticentes à être tétées. Le problème peut venir également du jeune qui peut être faible ou à des problèmes physiques (mamelles abimées, mâchoire malformée). Enfin, l’échec d’absorption est dû à une mauvaise absorption intestinale malgré une bonne prise de colostrum. Les échecs d’absorption intestinale sont très fréquents chez les poulains. On considère que 25% des poulains n’absorbent pas assez d’Ig.
VI. Immunité à médiation cellulaire et colostrum
Le colostrum contient beaucoup de lymphocytes (exemple : le colostrum de bovin contient 106 lymphocytes/mL), alors que le lait en est dépourvu. Les lymphocytes colostraux survivent plusieurs heures dans l’intestin du jeune (36h chez le veau) et peuvent pénétrer dans l’épithélium des plaques de Peyer pour arriver aux nœuds lymphatiques mésentériques. Deux heures après avoir reçu le colostrum, on peut retrouver les lymphocytes dans le sang du nouveau-né. Il est donc possible qu’une
31
immunité à médiation cellulaire soit transférée aux mammifères nouveau-nés. Il semblerait que ces lymphocytes aident les jeunes à se protéger face à des infections, mais le mécanisme demeure inconnu (Tizard, 2013).
Les lymphocytes T CD8+ présents dans le colostrum bovin peuvent produire de grandes quantités d’IFN-γ, ce qui pourrait influencer le développement précoce de réponses Th1 chez le veau. Ainsi, l’ingestion de colostrum maternel semble accélérer le développement des lymphocytes du veau (Tizard, 2013).
VII. Développement de l’immunité acquise chez les mammifères
nouveau-nés
A. Immunité locale
Les tissus lymphoïdes intestinaux des mammifères nouveau-nés répondent rapidement aux antigènes ingérés. Par exemple, les veaux vaccinés oralement contre le coronavirus à la naissance sont résistants à une souche virulente de coronavirus dans les 3 à 9 jours suivants. Cette résistance précoce est expliquée par la production spontanée d’IFN-α/β (Tizard, 2013).
La réponse immunitaire locale au niveau de l’intestin se fait majoritairement grâce aux IgA (Tizard, 2013).
B. Immunité systémique
Le transfert passif de l’immunité maternelle est une « épée à double tranchant ». Ce processus est essentiel pour la survie des jeunes et leur permet d’éviter des infections qui peuvent être mortelles. Par contre, la présence d’anticorps d’origine maternelle (AOM) à forte concentration inhibe le développement de l’immunité endogène du jeune, jusqu’à ce que ces protéines d’origine maternelle soient dégradées (Day, 2007).
32
Les anticorps maternels acquis par un jeune animal via l’ingestion de colostrum vont inhiber sa faculté à développer sa propre réponse immunitaire. Ainsi, les très jeunes animaux ne sont pas capables de répondre à une stimulation vaccinale. Cette inhibition se fait spécifiquement sur les lymphocytes B, alors que la réponse des lymphocytes T n’est pas affectée. Elle dépend des concentrations des anticorps maternels et de la dose vaccinale administrée (Tizard, 2013).
Deux mécanismes ont été proposés pour expliquer cette inhibition (Tizard, 2013) :
- La neutralisation rapide des vaccins viraux vivants par les AOM. Ainsi, la réplication virale est évitée et la quantité d’antigènes fournis aux lymphocytes B est insuffisante. Ce mécanisme ne permet pas d’expliquer l’inhibition de la réponse vis-à-vis de vaccins inactivés.
- Les AOM masquent les épitopes des antigènes vaccinaux, évitant la reconnaissance par les lymphocytes B du jeune.
Pour une certaine dose vaccinale, la réponse immunitaire peut être suscitée chez le jeune seulement lorsque le titre en AOM passe en dessous d’un seuil critique.
En l’absence d’AOM, le nouveau-né est capable de fabriquer des anticorps rapidement après sa naissance. Par exemple, les veaux n’ayant pas tété commencent à faire leurs propres anticorps à 1 semaine d’âge, alors que des veaux allaités ne commencent à en produire que vers 4 semaines (Tizard, 2013).
Les AOM acquis passivement protègent non seulement les nouveau-nés avant que leur système immunitaire ne soit complètement fonctionnel, mais aussi façonnent le « répertoire » des lymphocytes B des petits. Les AOM ont une grande influence sur le développement du système immunitaire du jeune (Tizard, 2013).
C. Vaccination des jeunes
Les IgG maternelles reconnaissent facilement les agents pathogènes rencontrés par le jeune et les neutralisent rapidement. Cela permet une bonne protection du jeune, mais elle retarde la mise en place de l’immunité spécifique (Boullier, 2003).
Les AOM transférés passivement aux jeunes bloquent la réponse vaccinale. On considère donc que l’immunité passive représente un obstacle à l’établissement de l’immunité active (Person, 2003).
33
Les vaccins à germes vivants atténués se basent sur une réplication chez l’animal vacciné, qui induit une petite infection capable de stimuler le système immunitaire (Th1>Th2) sans déclencher de lésions ou de signes cliniques. La neutralisation de ces agents infectieux par les AOM inhibe la réponse immunitaire (Person, 2003).
Pour les vaccins à germes inactivés, un effet similaire a été mis en évidence : les anticorps passifs peuvent éliminer plus rapidement les antigènes vaccinaux. Ils stimulent donc très peu le système immunitaire (Person, 2003).
Comme les AOM inhibent la synthèse des Ig chez le nouveau-né, ils empêchent leur vaccination efficace. Cette inhibition peut persister pendant plusieurs mois. La durée dépend de la quantité d’anticorps transférés et de la demi-vie des anticorps en question. Prenons l’exemple de la vaccination des chiots contre la maladie de Carré (Tizard, 2013). Les AOM absorbés par le chiot arrivent à un niveau maximal dans le sérum 12 à 24 heures après la naissance. Ce niveau diminue progressivement à cause du catabolisme normal des protéines. La demi-vie des anticorps contre la maladie de Carré et l’hépatite infectieuse est de 8,4 jours. En pratique, le niveau des AOM contre la maladie de Carré devient nul en moyenne vers 10 à 12 semaines.
Dans une population de chiots, la proportion d’animaux non-immunisés augmente progressivement de quelques individus à presque toute la population vers 10-12 semaines. Ainsi, très peu de chiots peuvent être vaccinés efficacement à la naissance, mais la plupart peuvent être protégés vers 10 à 12 semaines.
Si les maladies virales affectant le chiot n’étaient pas autant répandues, on pourrait attendre que les chiots aient plus de 12 semaines pour les vacciner afin d’assurer une vaccination efficace. Mais en pratique, ce délai implique de laisser sans aucune protection des chiots sensibles aux agents infectieux. Il n’est pas non plus envisageable de vacciner les chiots dès la naissance et à des intervalles très rapprochés. Il faut donc trouver un compromis.
Selon les recommandations, le plus jeune âge auquel on peut vacciner un chiot en espérant une bonne réponse immunitaire est de 8 semaines. Les chiots orphelins n’ayant pas reçu de colostrum peuvent être vaccinés dès 2 semaines. Il faut obligatoirement vacciner les chiots contre le CDV, CAdV-A, CPV. Une seconde dose doit être administrée 3-4 semaines plus tard.
34
D. Points essentiels sur l’immunité du jeune
Plusieurs éléments sont à retenir sur l’immunité du jeune (Tizard (2013) et Boullier (2003)). Ils permettent de comprendre la notion de période critique et les protocoles de vaccination.
- A la naissance, le système immunitaire du jeune est fonctionnel mais il est naïf : il peut répondre à une immunisation active, mais plus faiblement. Par conséquent, la réponse immunitaire du jeune est plus lente que celle de l’adulte.
- Les mammifères nouveau-nés sont protégés provisoirement contre les infections grâce aux immunoglobulines d’origine maternelle transférées passivement. Ce
transfert via le colostrum est indispensable : sans lui, le jeune est sans défenses
vis-à-vis des agents pathogènes.
- Ces AOM proviennent d’un transfert direct via le placenta (primates) ou par l’ingestion du colostrum riche en Ig rapidement après la naissance. Puis le lait assure une protection locale uniquement.
- Il faut vérifier la prise colostrale pendant les premières heures de vie, sans quoi le jeune animal sera très sensible aux infections.
- Les protocoles de vaccination doivent prendre en compte l’incapacité de produire une réponse immunitaire correcte en présence d’anticorps maternels.
35
Deuxième partie : Monographies des maladies infectieuses du
chiot
Cette partie traitera de l’étiologie (en particulier au mode de transmission de l’agent infectieux), de la pathogénie, des signes cliniques et de la prévention des principales maladies qui affectent les chiots. Nous avons choisi de ne pas discuter des aspects diagnostiques et thérapeutiques.
I.
Maladies infectieuses principales
Nous désignerons par « maladies infectieuses principales » les affections des chiots qui sont considérées comme graves. Elles sont caractérisées par une morbidité ou une mortalité très élevées, une transmission aisée ou une présence dans l’environnement très forte (Davis-Wurzler, 2006). C’est contre ces maladies que l’on utilise les vaccins dits « essentiels » ou « core vaccines ».
A. Maladie de Carré
1. Agent infectieux
L’agent infectieux responsable de la maladie de Carré est le Canine Distemper Virus (CDV), en français virus de la maladie de Carré. Il appartient au genre Morbillivirus et à la famille
Paramyxoviridae. C’est un virus à ARN simple brin négatif, enveloppé (Greene, 2006a).
A la surface du CDV, on trouve une protéine d’attachement du virus : l’hémagglutinine ou protéine H. Elle permet la fusion entre le virus et la cellule ou entre différentes cellules infectées, débouchant sur la formation de syncytia. L’hémagglutinine est utilisée pour distinguer les différents génotypes du CDV (Moraillon, 2002). Elle détermine le tropisme et la cytopathogénicité de la souche (Von Messling et al., 2001).
Chez le chien, les souches vaccinales atténuées n’ont pas l’effet immunosuppressif des souches sauvages. Par contre, les souches vaccinales classiques n’ont été efficacement
36
atténuées que vis-à-vis du chien, elles conservent donc un pouvoir pathogène résiduel pour les autres espèces cibles. Elles ne devraient pas être utilisées chez les autres espèces sensibles.
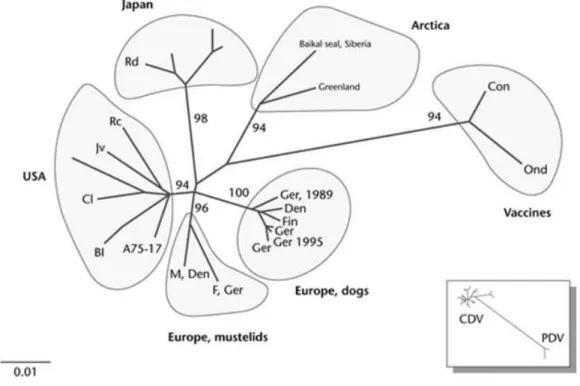
On a pu construire des arbres phylogénétiques du CDV en se fondant sur les séquences des régions codantes de la protéine H du CDV (Fig. 3). Cela permet de distinguer 5 groupes : les souches vaccinales (Convac et Onderstepoort), Européennes (chiens et mustélidés), Américaines, Japonaises, et de l’Antarctique (Harder, 2003). On peut voir que les souches qui sont proches partagent souvent une même aire géographique. On observe aussi que les souches vaccinales sont assez distinctes des autres souches.
Figure 3: Arbre phylogénétique du CDV basé sur l’analyse de l’hémagglutinine
Légende : Bl : léopard noir (zoo); Cl : léopard chinois (zoo); F: furret; Jv: sanglier; M : vison; Rc : raton laveur; Rd : chien viverrin; Den : Danemark; Ger : Allemagne; Con : souche Convac; Ond :
souche Onderstepoorf (d’après Harder et al., 2003)
Le CDV présente des caractéristiques physiques et chimiques à prendre en compte pour la lutte contre la maladie de Carré (Greene, 2006a). Le CDV est fragile dans le milieu
extérieur.
Il est sensible aux ultraviolets, à la chaleur (destruction par des températures supérieures à 50°C pendant 30 minutes) et à la sécheresse. Il est plutôt bien préservé par le froid (7 ans à -65°C) et par la lyophilisation, ce qui est utile pour la fabrication des vaccins. Le CDV est stable à un pH entre 4,5 et 9.
37
Le virus de la maladie de Carré est sensible aux désinfectants comme l’éther, le chloroforme, le formol dilué (<0,5%), le phénol (0,75%) et les ammoniums quaternaires (0,3%). La désinfection de routine dans les chenils et hôpitaux suffit normalement à
éliminer le CDV.
2. Circonstances d’apparition
On retrouve le CDV partout dans le monde. Il touche tous les canidés, aussi bien domestiques que sauvages (Deem et al., 2000).
3. Réservoir
Le virus de la maladie de Carré est capable d’infecter les carnivores des familles suivantes :
Canidae, Felidae (sauvages uniquement), Hyaenidae, Mustelidae (furet), Procyonidae, Ursidae et Viveridae (Deem et al., 2000). Il a dernièrement été responsable de foyers dans
des colonies de primates en captivité (Qiu et al., 2011).
4. Mode de transmission
La transmission du CDV se fait par contact direct entre des matières virulentes et les muqueuses, car la survie dans l’environnement est courte. Les principales sources de virus sont les aérosols et les sécrétions respiratoires contenant du virus. D’autres sécrétions corporelles comme l’urine, la salive, le jetage nasal et oculaire peuvent être infectieuses si elles sont sous forme d’aérosols (Greene, 2006a).
La voie de pénétration du virus dans l’organisme sain se fait par voie respiratoire. La transmission transplacentaire a été décrite mais elle reste anecdotique (Krakowka et
al.,1977).
Les animaux atteints sont très contagieux. En effet, l’excrétion virale peut durer jusqu’à 60-90 jours post-infection.
5. Pathogénie
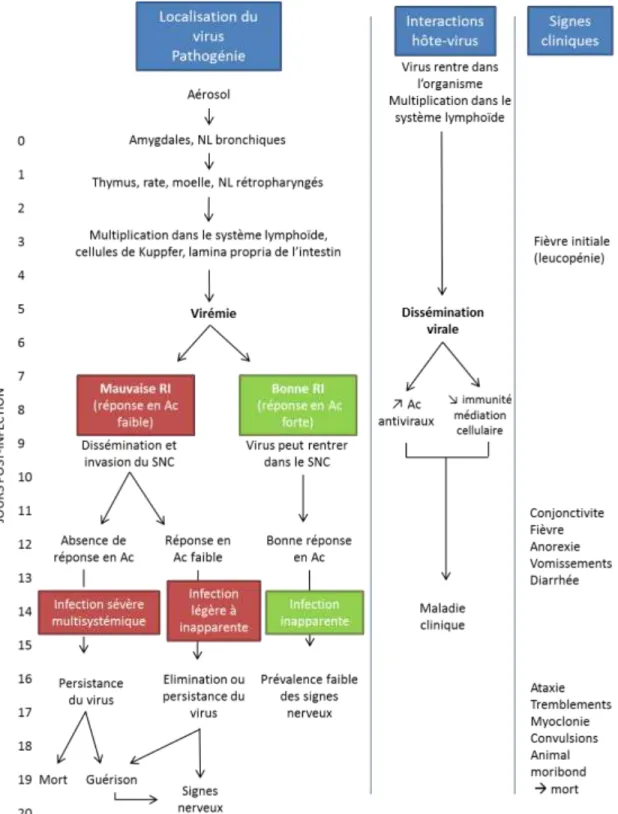
Après l’infection, il y a multiplication rapide du virus dans les macrophages, puis dissémination 2 à 4 jours après infection vers les organes lymphoïdes de proximité, comme les nœuds lymphatiques rétro-pharyngiens et les amygdales (Greene, 2006a).
38
On observe une première phase de virémie (4 à 6 jours post-infection) associée à l’infection des organes lymphoïdes (rate, foie, tissus lymphatiques de l’estomac et de l’intestin). Cette phase est généralement asymptomatique (Greene, 2006a).
Puis, il y a une deuxième phase de virémie (8 à 9 jours post-infection), au cours de laquelle le virus se dissémine dans les cellules épithéliales. C’est la phase symptomatique (Greene, 2006a).
39
Figure 4: Schéma représentant la pathogénie de la maladie de Carré (d’après Greene, 2006a) Légende : RI = réponse immunitaire, Ac = anticorps, NL= nœuds lymphatiques, SNC = système
40
6. Période d’incubation
La période d’incubation est estimée entre 1 et 4 jours (Greene, 2006a).
7. Population à risque
Tous les carnivores de tous âges représentent la population à risque vis-à-vis de la maladie de Carré. Cependant, les jeunes chiots, entre 3 et 6 mois, sont les plus touchés. En effet, on parle parfois de la « maladie du jeune âge ». Comme le virus est fragile, il faut obligatoirement un contact direct avec un chien infecté pour contracter la maladie (Greene, 2006a).
8. Facteurs favorisants
Plusieurs facteurs favorisent le développement de la maladie de Carré (Greene, 2006a): - La virulence de la souche
- L’âge: les animaux les plus atteints ont entre 3 et 6 mois. En effet, l’infection est possible à tout âge mais les chiots sont protégés jusqu’au sevrage (vers 6-12 semaines d’âge) par l’immunité maternelle et les adultes par la vaccination.
- Le statut immunitaire de l’animal: lorsque le chiot est stressé, immunodéprimé ou qu’il souffre d’autres infections, il est beaucoup plus sensible au CDV
- La forte densité d’animaux (chenils, expositions…)
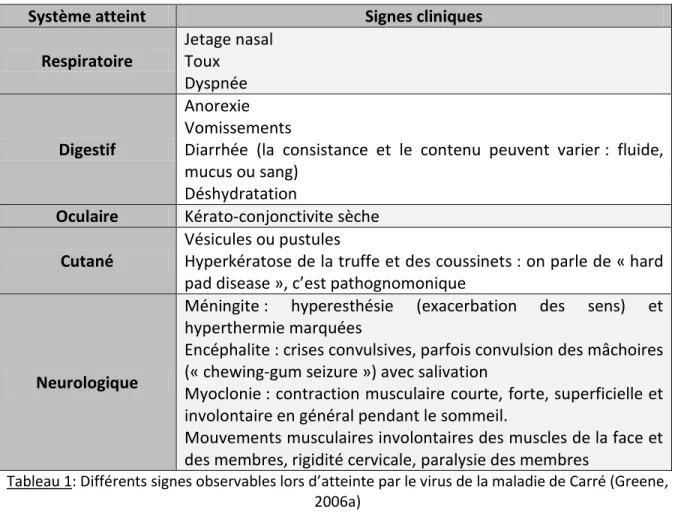
9. Signes cliniques
Lors de l’infection par le CDV, l’animal présente un premier pic d’hyperthermie discret. Puis très rapidement, on observe un deuxième pic d’hyperthermie accompagné par du jetage, une conjonctivite, de l’anorexie et une lymphopénie (Greene, 2006a).
Puis l’animal montre une variété de signes cliniques qui peuvent atteindre plusieurs organes à la fois (Tabl. 1, Fig.5).
41
Système atteint Signes cliniques
Respiratoire Jetage nasal Toux Dyspnée Digestif Anorexie Vomissements
Diarrhée (la consistance et le contenu peuvent varier : fluide, mucus ou sang)
Déshydratation
Oculaire Kérato-conjonctivite sèche
Cutané
Vésicules ou pustules
Hyperkératose de la truffe et des coussinets : on parle de « hard pad disease », c’est pathognomonique
Neurologique
Méningite : hyperesthésie (exacerbation des sens) et
hyperthermie marquées
Encéphalite : crises convulsives, parfois convulsion des mâchoires (« chewing-gum seizure ») avec salivation
Myoclonie : contraction musculaire courte, forte, superficielle et involontaire en général pendant le sommeil.
Mouvements musculaires involontaires des muscles de la face et des membres, rigidité cervicale, paralysie des membres
Tableau 1: Différents signes observables lors d’atteinte par le virus de la maladie de Carré (Greene, 2006a)
Lors d’infection transplacentaire, les chiots infectés présentent des signes cliniques pendant les premières 4 à 6 semaines de vie. La femelle montre des signes légers à inapparents. Selon le stade de gestation pendant lequel la femelle est atteinte, on peut avoir des avortements, de la mortinatalité ou des chiots très affaiblis à la naissance. S’ils survivent, les chiots souffrent souvent d’immunodéficience car les organes lymphoïdes primaires ont été touchés.
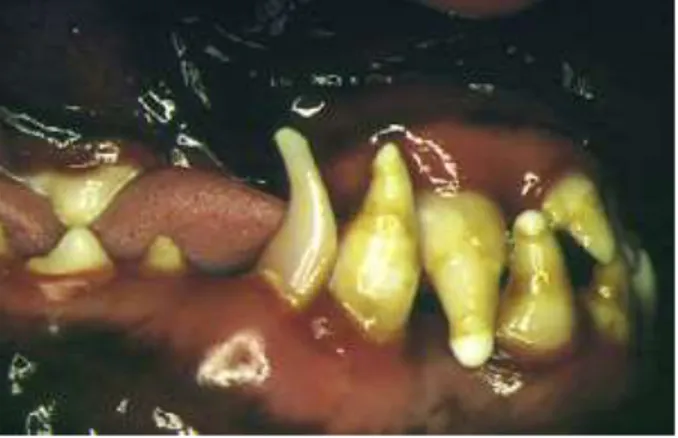
Si l’animal survit, il a souvent des séquelles. Par exemple, le chien peut développer une ostéosclérose métaphysaire des os longs, des signes neurologiques (encéphalite multifocale démyélinisante, connue comme « old dog encephalitis ») ou de l’hypoplasie de l’émail dentaire (Fig. 6).
42
Figure 5: Chiot atteint par la maladie de Carré : écoulements oculaires muco-purulents, hyperkératose de la truffe et des coussinets (Martella et al., 2008)
Figure 6: Séquelles chez un animal qui a eu la maladie de Carré : Hypoplasie de l’émail (Martella et al., 2008)
10. Prévention
Il existe deux types de vaccins contre la maladie de Carré : inactivé et vivant atténué. Le vaccin inactivé est moins efficace que le vivant atténué et il n’est plus utilisé actuellement (Greene, 2006a).
Le vaccin vivant atténué est souvent sous forme d’une valence inclue dans les vaccins multivalents (avec les valences contre la Parvovirose et l’hépatite infectieuse). Il assure une très bonne protection qui dure jusqu’à plusieurs années (CBIP, 2012).
L’administration du vaccin se fait par voie sous-cutanée. Lors d’une vaccination en urgence, on peut administrer le vaccin par voie veineuse. Cela ne fonctionne que sur des chiots ne présentant pas de symptômes.