INTERACTION DU ZOOPLANCTON ET DU C02 SUR LA COMPOSITION DU PHYTOPLANCTON ET SUR LE MAXIMUM DE CHLOROPHYLLE EN
PROFONDEUR
MÉMOIRE
PRÉSENTÉ
COMME EXIGENCE PARTIELLE
DE LA MAÎTRISE EN BIOLOGIE
PAR
CINDY P AQUETTE
Avertissement
La diffusion de ce mémoire se fait dans le respect des droits de son auteur, qui a signé le formulaire Autorisation de reproduire et de diffuser un travail de recherche de cycles supérieurs (SDU-522 - Rév.07-2011 ). Cette autorisation stipule que «conformément à l'article 11 du Règlement no 8 des études de cycles supérieurs, [l'auteur] concède à l'Université du Québec à Montréal une licence non exclusive d'utilisation et de publication de la totalité ou d'une partie importante de [son] travail de recherche pour des fins pédagogiques et non commerciales. Plus précisément, [l'auteur] autorise l'Université du Québec à Montréal à reproduire, diffuser, prêter, distribuer ou vendre des copies de [son] travail de recherche à des fins non commerciales sur quelque support que ce soit, y compris l'Internet. Cette licence et cette autorisation n'entraînent pas une renonciation de [la] part [de l'auteur] à [ses] droits moraux ni à [ses] droits de propriété intellectuelle. Sauf entente contraire, [l'auteur] conserve la liberté de diffuser et de commercialiser ou non ce travail dont [il] possède un exemplaire.»
J'aimerais tout d'abord remercier ma superviseure, Beatrix Beisner, qui m'a épaulée et soutenue tout au long dans ce projet, de l'élaboration de la problématique à l'analyse des données. J'aimerais aussi la remercier particulièrement pour le soutient et le temps investit dans la rédaction de l'a1ticle. L'équipe du laboratoire de recherche du Dr. Beisner a également été d'une aide essentielle. J'aimerais remercier Nicolas Fortin St-Gelais pour son aide avec les analyses statistiques, Laurent Fraser pour ses idées et ses conseils, ainsi qu'Alexandre Langlais-Bourassa pour son enthousiasme et sa motivation. J'aimerais également remercier Barnabé Kiepura et Evick Mestre pour leur assistance sur le terrain et en laboratoire. Katherine Velghe a aussi apporté une aide précieuse dans la préparation du travail de terrain. Je remercie aussi Alison Derry pour l'utilisation de la structure des mésocosmes. J'aimerais remercier la Station de Biologie des Laurentides ainsi que tout le personnel pour l'accueil à la station durant l'été 2015. Finalement, j'aimerais remercier le programme ÉcoLac du CRSNG pour le soutient fmancier durant ma maîtrise.
LISTE DES FIGURES ... vii
LISTE DES TABLEAUX ... ix
LISTE DES ABRÉVIATIONS ET DES ACRONYMES ... xi
LISTE DES SYMBOLS ET DES UNITÉS ... xiii
RÉSUMÉ ... xv
ABSTRACT ... xvii
INTRODUCTION ... 1
0.1 Revue de littérature ... 3
0.1.1 Systèmes aquatiques et changemtents climatiques ... 3
0.1.2 Influence du carbone sur le phytoplancton ... .4
0.1.3 Le maximum de chlorophylle en profondeur ... 7
0.1.4 Facteurs limitant la production du phytoplancton ... 10
0.1.5 Influence du zooplancton sur le phytoplancton ... 11
0.1.6 Expériences précédentes sur 1' influence des changements climatiques ... 12
0.2 Objectifs de recherche ... 15
0.3 Hypothèses et prédictions ... 16
CHAPITRE I INTERACTION EFFECTS OF ZOOPLANKTON AND C02 ON PHYTOPLANKTON COMMUNITIES ... 17
1.1 abstract ... 18
1.2 Introduction ... 19
1.3 Materials and methods ... 23
1.3 .2 Abiotic variables ... 26
1.3.3 Statistical analysis ... 26 1.4 results ... 29
1.4.1 Treatment application effictiveness ... 29
1.4.2 Phytoplankton conmmnities: spectral group ... 30
1.4.3 Phytoplankton communities :microscopie ennumeration ... 42
1.4.4 Zooplankton biomass ... .43
1.5 discussion ... 45
1.5.1 Phytoplankton composition: C02 and its interaction with zooplankton grazing ... 46
1.5.2 DCM responses to zooplankton and C02 emichment. ... .48
1.5.3 Zooplankton responses ... 50
1.6 Conclusion ... 52
CONCLUSION ... , ... 53
2.1 Conclusion du premier chapitre ... 53
2.2 Reconm1endations futures ... , ... 57
APPENDIX A TREA TMENT APPLICATIONS AND PHYSICO-CHEMICAL RESPONSES IN THE MESOCOSMS ... 59
APPENDIXB RELATIVE BIOMASS RESPONSES IN THE PHYTOPLANKTON COMMUNITIES ... 61
APPENDIX C PHYTOPLANKTON COMMUNITIES RESPONSES: MEANS, STANDARDS ERRORS AND P-VALUES ... 67
Figure Page
1.1 (a) Time series of epilimnetic C02 in the epilimnia of the mesocosms by treatment across 4 weeks, and (b) time series of total zooplankton
crustacean biomass ... 29 1.2 Contom plots of total chla biomass (!lg/L) time series across the photic
zone of Lac Croche as measured with the FP for total biomass in the
four treatments: -C+Z (a), -C-Z (b), +C+Z (c), +C-Z (d) ... 32 1.3 Contour plots ofBROWNS biomass time series in the four treatments
(!lg/L) as measured with the FP: -C+Z (a), -C-Z (b), +C+Z (c), +C-Z
(d) ... : ... 33 1.4 Contom plots of GREENS biomass time series in the four treatments
(1-lg/L) as measured with the FP: -C+Z (a), -C-Z (b), +C+Z (c), +C-Z
(d) ... 34. 1.5 Contour plots of CR YPTOS biomass time series in the fom treatments
(ug/L) as measured with the FP: -C+Z (a), -C-Z (b), +C+Z (c), +C-Z
(d) ... 35 1.6 Contour plots of CY ANOS biomass time series in the four treatments
(!lg/L) as measured with the FP: -C+Z (a), -C-Z (b), +C+Z (c), +C-Z
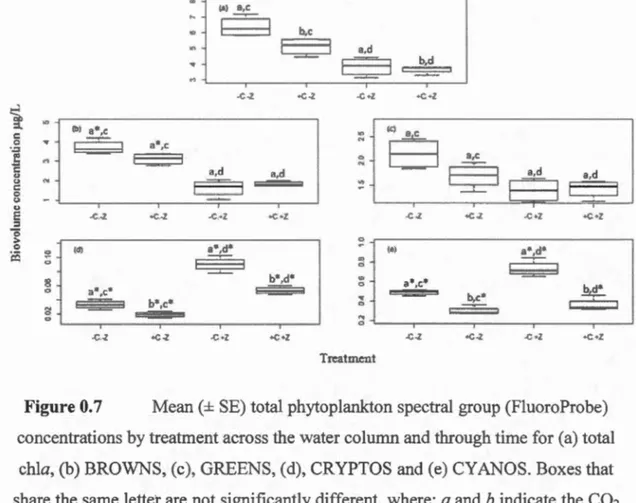
(d) ... 36 1.7 Mean(± SE) total phytoplankton spectral group (FluoroProbe)
concentrations by treatment across the water column and through time for (a) total chla, (b) BROWNS, (c), GREENS, (d), CRYPTOS and (e) CY ANOS. Boxes that share the same letter are not significantly
different, where: a and b indicate the
co2
main effects, and c and d indicate the zooplankton main effects. Asterisks (*) indicate where a significant simple effect (interaction) was present (although the sameletter for main effect may be indicated), as detailed in the text. ... 37 1.8 Treatment means (±SE) of the peak water colw1m biomass
concentrations (DCMsize) averaged across time for the spectral groups: (a) total chia, (b) BROWNS, (c), GREENS, (d), CRYPTOS and (e) CY ANOS. Boxes that share the same letter are not significantly
different, where: a and b indicate the
co2
main effects, and c and d indicate the zooplankton main effects. Asterisks (*) indicate where a significant simple effect (interaction) was present (although the sameletter for main effect may be indicated), as detailed in the text. ... .40 1.9 Treatment mean DCMdepth (±SE) averaged through time, as measured
for the spectral groups: (a) total chia, (b) BROWNS, (c), GREENS, (d), CRYPTOS and (e) CY ANOS. Boxes that share the same letter are not significantly different, where: a and b indicate the
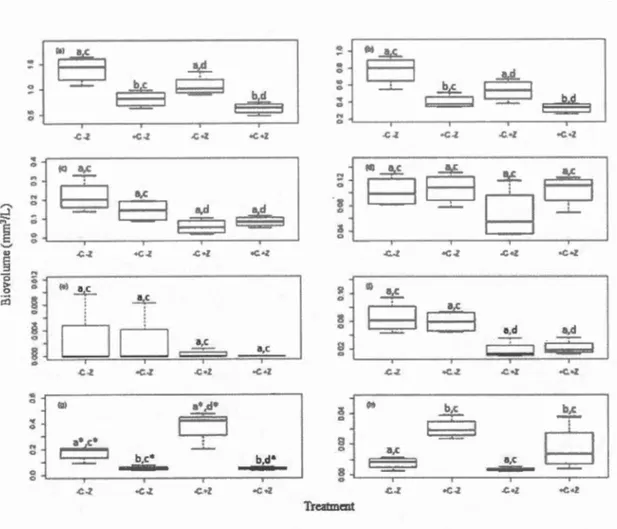
co2
main effects, and c and d indicate the zooplankton main effects. Asterisks (*) indicate where a significant simple effect (interaction) was present (although the same letter for main effect may be indicated), as detailed in the text. ... .41 1.10 Phytoplankton biovolumes (± SE) estimated microscopically fromsamples taken at 4.5m depth: (a) total biovolume, (b) chlorophytes, (c) chrysophytes, (d) cryptophytes, (e) euglenoids, (f) dinoflagellates, (g) cyanobacteria, (h) diatoms. Boxes that share the same letter are not significantly different, where: a and b indicate the
co2
main effects, and c and d indicate the zooplankton main effects. Asterisks (*) indicate where a significant simple effect (interaction) was present (although the same letter for main effect may be indicated), as detailed in the text. ... .43 B.l Relative biomass concentrations (f.lg/L) ofFP spectral phytoplanktongroups in the water column in the four treatments averaged through
time ... 62 B.2 Relative biomass concentrations (f.lg/L) ofFP spectral phytoplankton
groups in the DCM in the four treatments averaged through time ... 64 B.3 Relative biovolume (mm3/L) ofeach ofthe major phytoplankton groups
at 4.5m based on microscope counts in the four treatments averaged
Tableau Page
1.1 Variable abbreviations and transformations (if applicable) as used
throughout the text and in the analyses ... 28 1.2 Temporal means ofthe coefficients ofvariation (±SE) ofphytoplankton
biomasses in the water column, (CVprofite) (a); phytoplankton biomass concentration in the DCM (maximum concentration; CVocMsi=e) (b); and phytoplankton DCM depth (CVocMdepth) (c); as measured for the spectral groups; significant main effect p-values from the 2-way ANOV As are
shown ... 39 1.3 Means (±SE) ofzooplankton biomasses (J..Lg/L) from 2.5m and 4.5m
depths; significant main effect p-values associated to the 2-way ANOVAs are shown ... 44 A.l Mean(± standard error, SE) oftemporal mean C02 values (ppm) from the
epilirnnion (epi), metalinmion (meta), hypolimnion (hypo ), and of depth and temporal mean values of crustacean zooplankton (zoo) (J..Lg/L), pH, Dissolved oxygen (DO), total dissolved phosphorus (TDP) (J..Lg/L )and total dissolved nitrogen (TDN) (ppm) across depths. C02 and
zooplankton were analysed using 2-way ANOVA; pH and DO (%) were analysed using the Kruskal-Wallis test for non-normal data (interaction not testable) ... 60 C.l Mean concentration (J..Lg/L) (±Standard Error) of phytoplankton
Fluoroprobe concentration across the water colurnn (a); the size of the peak (DCMsize)(b); and the depth ofthe peak (DCMdepth) (c); significant p-values associated to ANOVA analyses are shown ... 68 C.2 Mean phytoplankton biovolume (rnn13/L) (±Standard Error) based on
microscope counts; significant p-values associated to ANOV A analyses are shown ... 69 C.3 Mean maximal electron transport rate (ETRmax) (relative value)(±
Standard EtTor) based on PhytoPAM estimates; significant p-values
C02 - Dioxyde de carbone
pC02- Perssion partielle du dioxyde de carbone
ppm - Parties par million
CCM - Mécanisme de concentration du carbone
Chia- Chlorophylle a
GREENS - Chlorophytes mesurés par le Fluoroprobe
CY ANOS - Cyanophytes avec les pigments phycocyanine mesurés par le Fluoroprobe
BROWNS - Diatomées, dinoflagellés et chrysophytes mesurés par le Fluoroprobe
CR YPTOS - Cryophytes et cyanophytes avec les pigments phycoerythrine mesurés par le Fluoroprobe
DO - Oxygène dissous
DOC - Dioxyde de carbone dissous
FP- Fluoroprobe
DCM- Deep chlorophyll maximum
MCP-Maximum de chlorophylle en profondeur
CCP- Couche de chlorophylle de profondeur
+Z-Présence de zooplancton crustacés -Z-Absence de zooplancton crustacés
+C- Emichissement en C02
-C- Absence d' emichissement en C02
DCMsi=e -Taille de la biomasse maximale de chlorophylle
DCMdepth-Profondeur du maximum de chlorophylle
CVprofile - Coefficiet de variation des valeurs de biomasse, représentant le degré au
quel la biomasse maximale est accentué relativement au reste de la biomasse dans toute la colonne d'eau pour chaque date
CV DCMsi=e -Coefficient de variation de la biomasse maximale à travers le temps
CV DCMdepth -Coefficient de variation de la profondeur à laquelle la biomasse
maximale a lieu à travers le temps
UV - rayons ultraviolets
pH- potentiel hydrogène P - phosphore
N- Azote
C- Carbone
m- Mètre ~-Micron L- Litre g-Gramme p-p-value < -plus petit > -plus grand
Les études examinant les conséquences de l'augmentation de la pression partielle de dioxyde de carbone (pC02) dans les écosystèmes d'eau douce (associée aux changements climatiques) étaient jusqu'à présent axées sur les effets directs sur le phytoplancton, démontrant une hausse de la productivité primaire, de la biomasse, ou une altération la composition de la communauté. Cependant, les dynamiques du phytoplancton dans les lacs ne sont pas uniquement régulées par les niveaux de pC02; la prédation par le zooplancton et par la stratification thermique y contribuent également. La biomasse du phytoplancton, telle qu'estimée par la chlorophylle a, dans plusieurs lacs tempérés se trouve principalement dans un maximum de chlorophylle en profondeur (MCP). Il est donc important de considérer cette strate pour comprendre la réponse du phytoplancton à l'augmentation de C02. Des réponses d'interaction entre le zooplancton et le co2 sont possibles, puisque le broutage (en plus du rôle des facteurs physico-chimiques) peut affecter les caractéristiques du MCP. Des expériences en mésocosme ont été menées dans un lac meso-oligotrophe nord tempéré associé à un important MCP estival pour estimer l'effet indépendant, ainsi que l'interaction entre le broutage par le zooplancton et l'augmentation de co2 dissous sur la communauté phytoplanctonique entière ainsi que sur les caractéristiques du MCP. Une interaction de l'effet du C02 et du broutage par Je zooplancton a eu lieu, influençant la biomasse du phytoplancton dans la colonne d'eau entière et dans le MCP. Le C02 a globalement eu un effet négatif inattendu sur la biomasse de phytoplancton. Nous n'avons pas observé d'effet du C02 sur les caractéristiques du MCP, mais le zooplancton y a eu des effets inattendus. Cette étude approfondie notre compréhension des conséquences des changements climatique sur la distribution verticale et la composition spécifique du plancton en lacs tempérés en élargissant nos connaissances à des conditions plus réalistes de la chaine alimentaire et de la stratification des lacs.
MOTS-CLÉS : Phytoplancton, stratification, carbone inorganique, sursaturation, changements climatiques
Studies examining the consequences of increased partial pressure of carbon dioxide (pC02) in freshwater ecosystems associated with climate change have focused on direct effects for phytoplankton, showing increases in primary productivity, biomass or altered composition. However, phytoplankton dynamics in lakes are regulated by more than pC02 levels, including predation by zooplankton and thermal stratification. Phytoplankton biomass, as estimated with chlorophyll a, in many stratified lakes occurs mainly in a deep chlorophyll maximum (DCM) layer, making the response to C02 increase important to understand here. Response interactions with zooplankton are also possible as grazing can affect DCM characteristics in conjunction with physico-chemical factors. Mesocosm experiments were conducted in a meso-oligotrophic north temperate lake with a strong summer phytoplankton DCM, to estimate the independent and interaction effects of zooplankton grazing and elevated pC02 on water colurnn phytoplankton communities and on DCM characteristics. Interaction of C02 effects with zooplankton grazing occurred, influencing water colU11111 and DCM phytoplankton biomass in severa] ways. Unexpectedly, C02 had an overall. negative effect on phytoplankton biomass. We did not observe effects of C02 on DCM characteristics, but there were some unexpected effects of zooplankton. This study furthers our understanding of the consequences of climate change on the vertical distribution and species composition of lake plankton by extending our understanding to more realistic food web and stratified lake conditions.
KEY-WORDS: Phytoplankton, stratification, inorganic carbon, supersaturation, climate change
Les changements climatiques des dernières décermies ont appor1é leur lot de per1urbations écosystèmiques. Entre autres, l'augmentation continuelle de gaz carbonique (C02) modifie l'équilibre des gaz dans l'atmosphère et affecte la croissance végétale ainsi que les précipitations. Indirectement, ces changements peuvent augmenter la teneur de dioxyde de carbone dans les lacs et en affecter la biodiversité. À la base de la chaîne trophique des systèmes aquatiques, les communautés planctoniques sont responsables d'une grande part de la production primaire dans les lacs d'eau douce. En broutant le phytoplancton, le zooplancton permet de faire passer les ressources de cette communauté algale aux niveaux trophiques supérieurs, affectant directement la dynamique et la structure de leur population. D'ailleurs, étant un produit nécessaire à la photosynthèse, la teneur en
co
2
d'un lac pourrait affecter le phytoplancton, alors que le moindre changement dans ce dernier peut affecter directement le zooplancton.Les études récentes effectués sur l'impact de l'enrichissement de C02 sur le phytoplancton en eaux douces étaient menées à petite échelle et ignoraient l'impact de la pression de prédation exercée par le zooplancton. Également l'importance de la structure verticale dans un lac, incluant le maximum de chlorophylle en profondeur (MCP) a été négligée. Or, de récentes évidences ont suggéré que la profondeur différentielle de broutage du zooplancton pouvait modifier la distribution verticale du phytoplancton. Le but de cette recherche consistait donc à tester expérimentalement 1' effet combiné du C02 et du brou tage par le zooplancton sur la communauté phytoplanctonique et sur le MCP en faisant des manipulations en mésocosmes. L'objectif de cette étude est d'apporter de nouvelles précisions sur l'effet des
changements climatiques sur la distribution verticale du plancton et sa composition spécifique.
Cette expérience a été réalisée au Lac Croche de la Station de Biologie des Laurentides, Saint-Hippolyte, Québec, Canada durant l'été 2015. L'introduction du présent mémoire contient l'état actuel des c01maissances sur le sujet étudié. Le Chapitre 1 est réalisé sous f01me d'article scientifique et a été soumis à une revue pour publication éventuelle.
0.1 REVUE DE LITTÉRATURE
0.1.1 Systèmes aquatiques et changemtents climatiques
Selon le principe de 1' exclusion compétitive élaboré par Hard in (1960), dans un milieu homogène à l'équilibre, le meilleur compétiteur pour l'élément limitant dominera le milieu. Or, dans les systèmes lacustres, notanunent dans les maximums de chlorophylle en profondeur (MCP), on trouve une grande variété d'espèces et de groupes de plancton ayant différents traits fonctionnels qui coexistent et qui compétitionnent pour les mêmes ressources limitantes. C'est cette contradiction avec la théorie de Hardin qui a menée au concept de « paradoxe du plancton » (Hutchinson, 1961 ). Effectivement, la présence d'une structure verticale bien définie (Kalff, 2002) et la succession temporelle des conditions abiotiques rend le principe de Hardin non applicable aux systèmes aquatiques, puisqu'ils ne sont pas homogènes et n'atteignent donc jamais l'équilibre, ce qui permet la coexistence de nombreux groupes de plancton (Hutchinson, 1961 ).
La coexistence et la composition chez le plancton est sujette à changements dans un contexte de changements climatiques. Les taux de dioxyde de carbone atmosphérique ont effectivement augmenté de 40% depuis le début de l'ère industrielle (Hartman et al., 2013) et sont toujours en hausse, menaçant de doubler le niveau actuel de
co
2
atmosphériques d'ici 2100 (Ciais et al., 2013). Contrairement aux océans qui sont des puits de C02 (Sabine et al., 2004), les lacs d'eau douce sont majoritairement des sources deco
2,
c'est-à-dire qu'ils émettent duco2
dans l'atmosphère (Jansson et al., 2000; Grimm et al., 2013) plutôt que de le fixer. Ces lacs sont donc sursaturés en C02. Ainsi, la pression partielle de gaz carbonique (pC02) des plans d'eau douce estnettement plus élevée que celle de l'atmosphère. Les changements climatiques risquent donc d'affecter indirectement les concentrations de co2 dans lacs et non pas directement.
Dans les environnements lacustres, la productivité du bassin versant et la respiration terrestre sont les deux vecteurs contrôlant principalement la pression pai1ielle du co2
(Maberly et al., 2013). Or, ces deux facteurs seront perturbés par les changements climatiques. La productivité est favorisé sous un régime de fortes précipitations (Zhang et al., 2007), de concentrations en C02 atmosphériques plus importantes et de température plus élevée (Long, 1991 ), ceci favorisant la respiration du sol (Hasler et al,. 20 16). Avec le lessivage des sols accru engendré par les pluies abondantes, la teneur en carbone organique dissous (COD) augmente dans les lacs. Le COD est ensuite métabolisé par les bactéries aquatiques et transfonné en co2 dissous (Jansson et al., 2000; Grimm et al., 2013). Ce phénomène est le facteur principal responsable de la sursaturation des lacs en C02 (Marcé et al., 20 15). Une autre cause possible de la sursaturation est l'apport au système en eaux chargées de COD provenant de l'érosion de minéraux ou de la respiration du sol dans le bassin versant (Marcé et al.,
2015).
0.1.2 Influence du carbone sur le phytoplancton
Avec le réchauffement climatique, la sursaturation des systèmes aquatiques ira en s'accroissant (Hasler et al., 2016), risquant d'affecter la biodiversité. De plus, même si la majorité des lacs sont sursaturés en C02 (Cole et al., 1994; Jonsson et al., 2003; Downing et al., 2006; Jansson et al., 2012), de récentes expériences ont démontré que le C02 peut tout de même être limitant pour le phytoplancton (Badger et al., 1998; Jansson et al., 2012). Le dioxyde carbone, même sans qu'il n'y ait de changement
dans la couleur de l'eau associé au lessivage des sols, peut modifier la communauté des producteurs primaires, à la base des systèmes aquatiques.
En eau douce, le carbone inorganique peut se retrouver sous trois formes, un équilibre qui dépend du pH de l'eau. Lorsque l'eau est plus acide (pH < 6,3), l'équilibre favorise le C02 dissous, alors que lorsque l'eau est plus basique (pH > 1 0,2), le carbonate domine. Quand le pH est intermédiaire (entre 6,3 et 10,2), l'équilibre favorise le bicarbonate (Hollan et al., 2012). Dans le processus de la photosynthèse, le phytoplancton utilise principalement le C02 comme source de carbone. Cependant, ce n'est pas tout le phytoplancton qui est autotrophe. Certaines espèces sont dites hétérotrophes, c'est-à-dire qu'elles acquièrent leur carbone sous forme organique, alors que d'autres sont mixotrophes et peuvent donc utiliser le co2, ou le carbone organique (Wetzel, 2001), alternant entre les deux stratégies.
Le co2 étant W1 produit nécessaire à la photosynthèse, des changements dans les
apports en co2 peuvent augmenter les taux de photosynthèse du phytoplancton. Étant
actuellement à des teneurs limitant la productivité du phytoplancton (Jansson et al.,
2012), Je carbone peut modifier la communauté ou la biomasse des producteurs
primaires. Effectivement, l'enzyme responsable de la fixation du carbone pour la photosynthèse, la ribulose-1 ,5-bisphosphate carboxylase/oxygénase (RubisCO), est seulement à la moitié de sa capacité de fixation lorsque le C02 est à 1' équilibre avec l'atmosphère (Badger et al., 1998). En résumé, en augmentant les précipitations (Zhang et al., 2007) et les orages (Jones et Mulholland, 1998), les changements climatiques augmentent indirectement la teneure en COD dans les lacs par Je lessivage accru des sols. Via la métabolisation de ce COD par respiration bactérienne, du C02 dissous est formé et est disponible pour le phytoplancton (Grimm et al.,
2013). Théoriquement donc, une augmentation en C02 devrait favoriser le
l'effet du C02 sur le plancton photosynthétique (ex. Urabe et al., 2003; Kim et al., 2006 ; Tortell et al., 2008; Low-Decarie et al., 2011; Jansson et al., 2012).
Pour compétitionner dans cet enviro1mement limité en C02, la majorité des groupes de phytoplancton, ont acquis différentes stratégies facilitant l'appmi du carbone, ou bien son utilisation (Low-Decarie et al., 2014). Ainsi, la plupart des espèces de phytoplancton ont développé des mécanismes de concentration du carbone (CCM) leur permettant d'augmenter la concentration de co2 au site de la photosynthèse
(Priee, 20 Il). Par exemple, w1e méthode consiste à pomper activement le
bicarbonate, lequel est largement plus commun que le C02 (Urabe et al., 2003; Maberly et al., 2009). Favorisant la croissance dans des environnements où le C02 est limité, ces mécanismes sont toutefois couteux énergiquement. Ainsi, dans un milieu chargé en C02, les algues possédant des CCM très efficaces sont désavantagées (Maberly et al., 2009). De plus l'efficacité du CMM varie d'un groupe taxonomique de phytoplancton à l'autre, les cyanobactéries ayant le plus performant. L'efficacité photosynthétique du phytoplancton va également différer d'un groupe à l'autre pour l'utilisation du C02, au niveau de l'enzyme RubisCO elle-même, dépendanm1ent de l'affinité de l'enzyme pour Je C02 plutôt que pour l'oxygè.ne (Low-Decarie et al., 2014). Un autre mécanisme utilisé par Je phytoplancton mixotrophe est l'utilisation
de carbone organique comme source de carbone alternative en plus du C02
(Laybourn-Parry, 2002). La mixotrophie est aussi une stratégie connue pour être
spécialement efficace lorsque la teneur en C02 est faible (Tittel et al., 2005). Dans un
contexte d'augmentation de C02, les organismes qui sont normalement les moins
efficaces pour acquérir et utiliser efficacement le co2 bénéficieront le plus de
l'augmentation de cette ressource (Low-Decarie et al., 2014).
Bref, des changements dans les concentrations de C02 d'un lac peuvent affecter la photosynthèse du plancton autotrophe, modifier les interactions de compétition entre
leur capacité à fixer et à utiliser ce carbone ainsi qu'à réagir rapidement aux fluctuations de C02 (Totell et al., 2002, Riebesell, 2004; Maberly et al., 2009,
Low-Decarie et al., 20 15). Étant donné que les algues sont les producteurs primaires du
réseau trophique aquatique, les répercussions de ces changements pourraient affecter
toute la chaîne alimentaire de l'écosystème.
0.1.3 Le maximum de chlorophylle en profondeur
Une caractéristique particulière dans la structure ve1iicale des lacs tempérés concerne
l'agrégation de phytoplancton qui se retrouve en eau moyennement profonde entre le métalimnion et 1 'hypolimnion dans certains lacs et océans, appelé le maximum de chlorophylle en profondeur ( e.g. Cullen, 1982; Klausmeier et Litchman, 2001;
Camacho, 2006). Typiquement, le MCP (« Deep Chlorophyll Maximw11 », ou DCM,
en anglais) d'un lac est une concentration maximale de chlorophylle qui est retrouvée
à une certaine profondeur, souvent à la thermocline ou près de la partie supérieure de 1 'hypolimnion, loin de la surface (Camacho 2006). Par ailleurs, ces formations ne
sont pas caractérisées par une plus grande quantité de chlorophylle par individus, mais plutôt par une biomasse extrêmement élevé des espèces par rapport à l'eau de
surface. Selon l~s lacs, les MCP peuvent être composés d'une seule espèce d'algue, mais on y retrouve souvent une variété d'espèces et de groupes qui coexistent (Gasol
et al., 1992; Miracle et al., 1992), en contradiction avec 1 'hypothèse d'exclusion
compétitive de Hardin (1960). Dans les MCP, les groupes d'algues généralement
retrouvés sont les chrysophycées (algues brun-jaune), les dinophytes, les
chlorophytes (algues vertes), les bacillariophycées (diatomées), les cryptophytes et les
cyanobactéries (algues bleu-vert) (Vincent, 1980; Reynolds et al., 1983; Pick et al., 1984; Galvez et al., 1988; Jackson et al., 1990; Finlay et al., 1991). Par ailleurs, par rapport aux espèces présentes dans l' épilimnion, les espèces de plancton du
métalimnion sont très constantes (Haffner et McNeely, 1989), c'est-à-dire qu'il y a
peu de changements temporels dans le métalimnion.
Comprenant w1e grande pati de la biomasse al gale (Fee, 1976; Gasol et al., 1992), les MCP ont une grande valeur écologique. Puisqu'ils contribuent à une pm·t importante de la production primaire (Moll et al., 1984; Wollmann et al., 2000), les MCP sont
d'autant plus importants dans les lacs oligotrophes pauvres en nutriments (e.g. Cullen, 1982; Saros et al., 2005). Effectivement, l'efficacité du réseau trophique, ainsi que sa structure et sa dynamique dépendent du rendement des producteurs primaires (Fennel et Boss, 2003; Tittel et al., 2003) qui sont à la base du cycle biogéochimique des ressources (Huisman et al., 2006).
0.1.3.1 Hypothèse de formation des MCP
Un facteur essentiel au maintien des populations de microorganismes phototrophes dans les MCP est la structure verticale des ressources (Carney et al., 1988; Clegg et al., 2007; De scy et al., 201 0). Ainsi, la principale théorie utilisée pour expliquer la
forn1ation des MCP est l'existence de forts gradients physiques de lumière et de nutriments présents dat1s les lacs et les océans. Selon cette hypothèse, les MCP se
produiraient à la profondeur de compensation entre ces deux facteurs, puisque la lumière décroit avec la profondeur, alors que les nutriments diminuent vers la surface (e.g. Fee, 1976; Mollet al., 1984; Coon et al., 1987). D'ailleurs, le MCP se produit normalement sous la thermocline où se trouve une richesse en nutriments, ainsi que des niveaux de lumière, de température et de turbulence plus faibles (Moll et Stoermer, 1982). La profondeur de la thermocline elle-même peut donc influencer le
MCP (Ouellet Jobin et Beisner, 2014). La distribution des nutriments dans les
systèmes aquatiques semble également interagir avec le broutage du zooplancton
Gervais et al. (2003) ont proposé la présence d'une fine échelle de distribution spatiale à 1' intérieur du MCP. Cette distribution serait le résultat de la position optimale pour chaque espèce dépendamment de leur capacité à faire face aux gradients de ressources (Y oshiyama et al., 2009) et permettrait le maintien de la diversité par la diminution de la compétition interspécifique au profit de la compétition intraspécifique (Miyazaki et al., 2006; Laird et Schamp 2008). En effet, il semble qu'un partitionnement vertical de l'espace par les espèces dans le MCP favorise une grande diversité dans cette couche, même avec un grand chevauchement
(spatial overlap) entre les espèces (Ouellet Jobin et Beisner, 2014).
Cullen (1982) a également proposé que le MCP était le résultat de la sédimentation passive du phytoplancton qui s'accumulait en eau profonde où le taux de sédimentation est plus faible. Étant mobile, le plancton photosynthétique est aussi capable d'ajuster volontairement sa position dans la colonne d'eau selon différents facteurs environnementaux (Clegg et al., 2007), notamment grâce à la photoréponse, laquelle aiderait les espèces stratifiantes à maintenir une position optimale dans le MCP (Heaney et Eppley 1981; Smayda, 1997). D'autres chercheurs ont suggéré que la croissance positive in situ des mixotrophes en profondeur expliquait les MCP ( e.g. Bird et Kalff, 1989). La croissance positive et la productivité in situ des autotrophes a également été hypothétisée (Fee, 1976; Fahnenstiel et Glime, 1 983; Moll et al., 1984). Finalement, des mécanismes impliquant l'évitement de la toxicité, la·symbiose entre le phytoplancton et les bactéries (Finlay et al., 1996) ou les migrations journalières des algues ont aussi été proposés pour expliquer les MCP (Salonen et al.,
1984; Arvola et al., 1992)
Ces hypothèses jouent certainement un rôle clé dans la distribution verticale du phytoplancton. Cependant, elles n'incluent explicitement pas les interactions trophiques des systèmes aquatiques. Effectivement, le rôle du zooplancton n'y est pas intégré, alors qu'il est bien connu qu'il affecte directement la population algale par le
broutage. Le zooplancton peut en effet filtrer jusqu'à 24% de l'eau d'un lac par jour (Sawatzky et al., 2006). De récentes évidences suggèrent donc que la profondeur différentielle de broutage, associée au transport de nutriments vers le métalimnion (causé par la sédimentation des exsudats, le broutage et la migration du zooplancton) serait le principal facteur responsable de la formation des MCP (Longhurst, 1976; Sarnelle, 1999; Pilati et Wurtsbaugh, 2003; Sawatzky et al., 2006). De plus, en broutant le phytoplancton de l'épilimnion, le zooplancton clarifie l'eau, ce qui augmente la pénétration de la lumière en profondeur et y permet la croissance du plancton photosynthétique (Pilati et Wurtsbaugh 2003; Christensen et al., 1995).
La plupart des mécanismes proposés pour expliquer la formation les MCP sont tout de même importants et pourraient plutôt agir à titre de facteurs permettant leur maintien ou leur contrôle. Dépendamment des caractéristiques propres à chaque lacs (la morphométrie, la biochimie, les patrons de mélange, etc.) ces facteurs auront plus ou moins d'importance (Camacho, 2006).
0.1.3 Facteurs limitant la production du phytoplancton
En plus d'un structure vet1icale bien définie, un autre facteur empêche l'hypothèse de l'exclusion compétitive (Bardin, 1960) de s'appliquer aux systèmes aquatiques. Effectivement, la productivité et la biomasse du phytoplancton ne sont pas régis par un seul facteur limitant; souvent une effet synergistique est observé entre plusieurs facteurs. Les ressources limitant typiquement le phytoplancton sont le C02, le nitrate et le phosphore. Le ratio de Redfield définit la proportion que chacun des ces éléments doit occuper dans le phytoplancton pour que sa croissance soit optimale (Libes, 2011 ). Durant les dernières décennies, les recherches se sont centrées sur le rôle du phosphore, puisque cet élément est naturellement disponible en très faible
quantité dans les systèmes aquatiques, alors que l'azote et le carbone étaient considérés en quantité suffisantes (Low-Decarie et al., 2014). L'idée qu'un seul élément peut limiter la croissance du phytoplancton provient de la loi du minimum (Liebig et al., 1841) stipulant qu'un seul élément à la fois peut limiter la productivité. Cependant, les activités humaines ont augmenté les concentrations d'azote et de phosphore naturellement disponibles dans les systèmes lacutres (Bennett et al., 2001; Fowler et al., 2013), rendant le C02 potentiellement limitant à son tour (Low-Decru·ie et al., 2014). De nombreuses évidences démontrent ainsi que différentes ressources peuvent co-limiter la productivité du phytoplancton (Harpole et al., 2011), ou même agir de façon synergétique (e.g. Elser et al., 2007). Toutefois, la concentration du phytoplancton dans un système ne dépendra pas uniquement de sa limitation en termes de ressources, mais aussi du niveau de prédation auquel il est soumis. Si les nutriments et le carbone peuvent agir de pair pour limiter le phytoplancton, il est ainsi possible qu'il en soit de même pour le carbone et la prédation.
0.1.5 Influence du zooplancton sur le phytoplancton
Le zooplancton crustacé fait du broutage sélectif sur les communautés de phytoplancton dans la colonne d'eau, ainsi que dans les MCP des lacs. Effectivement, certains groupes de zooplancton ont des préférences alimentaires qui dépendent de la qualité nutritive des proies, ce qui influence fortement les interactions de prédation sur le phytoplancton (DeMott, 1986). Les copépodes calanoïdes et cyclopoïdes, ainsi que certains cladocères auraient donc cet atout (DeMott, 1986), lequel procure un net avantage lorsqu 'il y a peu de proies nutritives (Lelm1an, 1976; Hughes, 1980). En sélectiormant ses proies en fonction de leur qualité nutritive, le zooplancton influence la composition de la communauté de phytoplancton.
Plusieurs zooplancton sont caractérisés par un comportement de migration, surtout les espèces de type brouteur du genre Daphnia. Durant la nuit, les brouteurs se retrouvent à la surface de l'eau où la qualité de la nourriture est supérieure (Cole et al., 2002).
Le jour, ils migrent dans les eaux profondes pour éviter la prédation par les poissons
planctonivores. Durant cette migration, le zooplancton transpo1ie les exsudats et les
produits d'excrétion, enrichissant l'hypolimnion et y favorisant la production
primaire (Fee, 1976). Ainsi, la distribution verticale du plancton animal est fonction
de leurs proies et de leurs prédateurs (Leibold 1990; Pinel-Alloul 1995; Masson et al., 2004).
0.1.4 Expériences précédentes sur l'influence des changements climatiques
L'effet du C02 sur le phytoplancton a principalement été étudié en milieu contrôlé ou
en milieu océanique. Plusieurs études en laboratoire ont démontré qu'une
augmentation de C02 favorisait le phytoplancton. Le C02 pourrait engendrer une augmentation de la biomasse (Urabe et al., 2003; Verspagen et al., 2014) ou de la
croissance des producteurs primaire (Qiu et Gao, 2002; Kim et al., 2006; Tortell et
al., 2008; Verschoor et al., 2013). Il a aussi été expérimentalement démontré que le
C02 intensifiait productivité primaire du phytoplancton (Qiu et Gao, 2002; Schippers
et al., 2004; Tortell et al., 2008, Jansson et al., 2012) et ce spécialement lorsque le
milieu était également enrichi en nutriments (Low-Decarie et al., 2015). Au contraire,
en milieu marin appauvri en nutriments, le
co2
peut diminuer 1, abondance decertains groupes de phytoplancton (Yoshimura et al., 2009).
Low-Decarie et al. (2011) ont produit une étude comparative portant sur l'effet du
C02 sur différents groupes de phytoplancton. Même si tous les groupes ont connu une
qui a été attribué à la perte d'énergie causée par leur CMM. Toutefois, dans le cadre
du projet « Carbon Addition Fertilization Ex periment » (CAFE) Hart (20 15) a évalué
in situ l'effet d'une augmentation de COz dans un lac nord tempéré méso-oligotrophe
et a eu des résultats contradictoires avec les études de laboratoire. Une augmentation
à court terme de la production primaire a été constatée, suivie par une disparition
quasi-complète du MCP. Plus précisément, les groupes d'algues ve11s et bruns ont
chuté, mais les cyanobactéries ont augmenté par rapport au contrôle. Parallèlement, le
zooplancton a connu un pic de croissance. Ces résultats démontrent que la survie
différentielle du phytoplancton n'a pas été causée par les différentes stratégies
d'utilisation du carbone, mais plutôt par le broutage sélectif du zooplancton, ce qui
correspond aux résultats de Pilati et Wurtsbaugh (2003) prédisant que le zooplancton
contrôle la strate de chlorophylle en profondeur.
Pilati et Wurtsbaugh (2003) ont effectivement étudié l'effet du broutage du
zooplancton sur le phytoplancton stratifiant. Ils ont effectué une étude en mésocosme
dans un lac oligotrophe ayant une couche de chlorophylle en profondeur (CCP) (Le
terme CCP est utilisé lorsqu'il n'y a pas un pic distinct de chlorophylle comme dans le cas du MCP, pour lequel le pic est plus défini. Les mécanismes de maintien, de contrôle
et de formation apparaissent être les mêmes pour les deux types de structure verticale
(Camacho 2006)) et ont mesuré l'effet du zooplancton brouteur et du transport de
nutriments en profondeur sur le CCP. Leurs résultats ont démontré que dans les
mésocosmes contenant des brouteurs, le phytoplancton épilimnétique diminuait au
profit du CCP et que le flux de nutriments était important. Dans les traitements sans
zooplancton, le CCP est disparu et il y a eu une augmentation algale en surface. Ces
résultats suggèrent que le broutage du zooplancton, couplé au mouvement descendant
des nutriments expliquerait le CCP.
Concernant 1' effet direct du COz sur le zooplancton, peu d'études ont été réalisées.
14
trouvé d'effet sur le zooplancton causé par une augmentation de COz. L'étude de Hart (2015) a quant à elle démontré un évitement du zooplancton pour l'épilimnion chargé artificiellement en COz. Cependant, le dioxyde de carbone peut davantage affecter le zooplancton indirectement, puisque tout changement dans le phytoplancton risque d'affecter le niveau trophique supérieur (Sterner et Elser, 2002; Van de Waal et al., 201 0). Le COz est effectivement connu pour modifier à la hausse le ratio carbone : nutriments dans le phytoplancton (Urabe et al., 2003). Or, plus ce ratio est élevée, moins la nourriture est nutritive pour le zooplancton (Van de Waal et al., 2010), diminuant sa croissance (Urabe et al., 2003). D'autres études ont donc conclu à un effet indirect négatif du COz, via un changement dans la composition stœchiométrique ou biochimique du plancton (Urabe et al., 2003; Rossoll et al., 2012; Lischka et al., 20 15).
Finalement, aucune étude n'a encore évalué l'effet combiné du COz et du broutage par le zooplancton sur la distribution verticale et la composition du phytoplancton. En regroupant les précédentes études, il est possible de croire qu'une augmentation en
COz dans un système aquatique produise une rapide augmentation de la croissance algale, suivie par un broutage accru du zooplancton, lequel consomme des proies de moins bonne qualité et devient à son tour moins nutritif, affectant l'écosystème en entier. Cependant, la disparition du MCP observée par Hart (20 15) est incomprise. La présente étude propose donc d'approfondir les connaissances sur 1' effet de l'enrichissement en carbone sur le phytoplancton en incluant le broutage du zooplancton comme principale variable influençant la dynamique et la distribution du phytoplancton et en tenant compte de la distribution verticale et du maximum de chlorophylle en profondeur aux analyses.
0.2 OBJECTIFS DE RECHERCHE
Les chercheurs s'intéressent depuis plusieurs années aux conséquences des changements climatiques et nombreuses sont les recherches évaluant les effets de la hausse des concentrations de dioxyde de carbone. En milieu aquatique, les recherches précédentes se sont majoritairement déroulées en laboratoire ou en milieu marin. Les recherches effectuées en lac d'eau douce ont ignoré à la fois Je rôle clé de la prédation par le zooplancton dans Je contrôle des populations de phytoplancton, ainsi que la distribution verticale de ce dernier et l'importance de maximum de chlorophylle en profondeur. L'objectif principal de cette étude est donc de palier à cette lacune dans les connaissances sur les changements climatiques en étudiant l'effet indépendant, ainsi que 1' interaction entre le brou tage par le zooplancton et le
co2
sur la communauté de phytoplancton et sa distribution vetiicale. Nous avons donc effectué une étude en mésocosme profond pour approfondir les c01maissances sur les effets de 1 'augmentation deco2
sur le plancton en écosystème d'eau douce.0.3 HYPOTHÈSES ET PRÉDICTIONS
Le but premier de cette recherche est d'évaluer l'effet d'w1e augmentation de C02 et du broutage par le zooplancton sur le maximum de chlorophylle de profondeur. Plusieurs hypothès'es de travail sont donc posées afin de répondre à ce but précis. H2 : Le phytoplancton est stimulé par l'enrichissement en C02 . Les traitements avec ajout de carbone auront une plus grande biomasse de phytoplancton, et la productivité primaire sera également plus élevée.
H2 : Le broutage du zooplancton est amplifié par le C02. Dans les traitements avec ajout de C02 , le broutage par le zooplancton est plus intense, en réponse à la rapide augmentation de phytoplancton.
H3 : Il va y avoir un changement dans la composition en espèces du phytoplancton selon les différents traitements. La présence de gros zooplancton limitant les algues brunes et vertes par le broutage et le
co
2
favorisant toutes les espèces (surtout celles ayant des CCM moins performants et celles ayant des exigences en C02 plus élevées). Le C02 et le zooplancton interagiront donc sur le phytoplancton.H3a: +C; + Z :plus de cyanobactéries, moins des autres espèces (groupes d'algues vertes et brunes).
H3b : +C;-Z :tous les groupes d'algues profitent d'une augmentation de C02. Les groupes verts et bruns profitent davantage, à cause de la disparition de 1 ms prédat urs.
H3c :- C;- Z les groupes ciblés par le broutage (algues brunes et vertes) augmentent. Diminution des cyanobactéries à cause de la compétition. H3d: -C; + Z: composition normale (contrôle).
INTERACTION EFFECTS OF ZOOPLANKTON AND C02 ON PHYTOPLANKTON COMMUNITIES
This chapter was written in the form of a scientific paper and will be re-submitted to a
0.1 ABSTRACT
Studies exammmg the consequences of increased partial pressme of carbon dioxide (pC02) in freshwater ecosystems associated with climate change have focused on direct effects for phytoplankton, showing increases in primary productivity, biomass or altered composition. However, phytoplankton dynamics in lakes are regulated by more than pC02 levels, including predation by zooplankton and thermal stratification. Phytoplankton biomass, as estimated with chlorophyll a, in many stratified lakes occurs mainly in a deep chlorophyll maximum (DCM) layer, making the response to C02 increase important to understand here. Response interactions with zooplankton are also possible as grazing can affect DCM characteristics in conjunction with physico-chemical factors. Mesocosm experiments were conducted in a meso-oligotrophic north temperate lake with a strong summer phytoplankton DCM, to estimate the independent and interaction effects of zooplankton grazing and elevated pC02 on water column phytoplankton communities and on DCM characteristics. Interaction of C02 effects with zooplankton grazing occurred, influencing water colurnn and DCM phytoplankton biomass in severa) ways. Unexpectedly, C02
had an overall negative effect on phytoplankton biomass. We did not observe effects of C02 on DCM characteristics, but there were some unexpected effects of zooplankton. This study furthers our understanding of the consequences of climate change on the vertical distribution and species composition of lake plankton by extending our understanding to more realistic food web and stratified lake conditions.
19
0.2 INTRODUCTION
Climatic changes in recent decades have brought a variety of ecosystem disturbances. Among these, the continuous increase of carbon dioxide (C02) bas altered the balance of gases in the atmosphere affecting growth of primary producers and precipitation (Zhang et al., 2007). In lakes and streams, increased soil runoff through heavier precipitation events has increased input of dissolved organic carbon (DOC) (Evans et al., 2005; Lennon et al., 2013). which is transformed to C02 by bacteria (Cole et al.,
1994; Del Giorgio et al., 1997; Jansson et al., 2000; Prairie et al., 2002; Sobek et al.,
2003; Grimm et al., 2013). Many temperate inland lakes are naturally supersaturated with C02 partial pressure (pC02) levels considerably higher than atmospheric pC02 (Kling et al., 1991; Jonsson et al., 2003). However, with climate change, the supersaturation of aquatic systems may further increase, with potential consequences for their biodiversity and functioning.
Changes in water C02 concentrations, even in supersaturated lakes, can lead to an increase in phytoplankton productivity (Urabe et al., 2003; Jansson et al., 2012), as demonstrated by recent studies showing C02 (Bad ger et al., 1998 ; Spijkerman, 201 0; Jansson et al., 2012). Many phytoplankton groups should theoretically benefit from greater C02 concentrations as the enzyme responsible for fixing carbon in photosynthesis, ribulose-1 ,5-bisphosphate carboxylase-oxygenase (RuBisCO), is at only half of its binding capacity when co2 is at equilibrium with the atmosphere (Badger et al., 1998). Indeed, severa! laboratory studies have demonstrated positive effects of C02 on photosynthetic plankton (ex. Urabe et al., 2003; Kim et al., 2006 ;
Torteli et al., 2008; Low-Decarie et al., 2011, Jansson et al., 2012; Low-Decarie et al., 20 15).
Variation in the response to elevated C02 levels are expected however amongst
phytoplankton taxa. This is because many, but not ali phytoplankton have evolved effective carbon concentration mechanisms (CCM) enabling them to utilize sources of carbon other than C02, such as bicarbonate (Maberly et al., 2009), and to better
concentrate C02 at the cellular leve! (Kaplan and Reinhold, 1999). However, CCM
physiology varies between different phytoplankton taxa, with cyanobacteria having more effective CCM than those that may be present in groups like chlorophytes and
diatoms, or chrysophytes which do not have CCM (Low-Decarie et al., 2014). While
CCM enable growth when C02 is limiting, these mechanisms are energetically expensive and when dissolved C02 is abundant, taxa with highly effective CCM may become competitively disadvantaged (Maberly et al., 2009). Phytoplankton also vary
in their C02-use efficiency owing to their RuBisCO specificity factor, which
determines the degree to which C02 versus 02 is preferred (Low-Decarie et al., 2014). Altered lake C02 concentrations can thus affect photosynthetic rates of
autotrophic plankton and modify the established competitive interactions between
different groups (Tortell et al., 2002; Low-Decru·ie et al., 2011), asper their ability to fix and use inorganic carbon and to react quickly to variation in C02 concentrations (Riebeseli, 2004; Maberly et al., 2009, Low-Decarie et al., 2014). However, not ali
phytoplankton are obligatory autotrophic. Many taxa include mixotrophic species that
cru1 either acquire their carbon via photosynthesis or by other organic growth factors ( e.g. glucose via osmotrophy), including phagotrophy of bacteria and smalier protists. The extent to which mixotrophy is a viable trait appears to also be influenced by C02 concentration, becoming more prevalent when concentrations are low (Tittel et al., 2005).
While the evidence is mounting that C02 affects phytoplankton primary production and composition, there has been little focus on how such effects might play out within a stratified lake environment. In most oligo- to mesotrophic temperate lakes, the majority of phytoplankton biomass, as estimated with chlorophyll a, is found in the deep chlorophyll maximw11 (DCM) during much of the summer-stratified period. We have little understanding of how this concentrated biomass layer will be affected by elevated inorganic carbon (pC02) levels, as to date, studies have been conducted in the lab or focused on epilimnetic responses (Fee, 1976; Moll et al., 1984; Coon et al., 1987, Klausmeier and Litchman, 2001 ), recent evidence has suggested that zooplankton grazing at different depths is also relevant. Similarly, the influence of zooplankton on the effects of elevated pC02 in freshwaters has also been ignored to date.
The DCM is located between the metalinmion and the hypolimnion, often at the them1ocline (e.g. Fee, 1976; Moll and Stoermer, 1982; Can1acho, 2006) and moW1ting evidence indicates that its significance may also be influenced by zooplankton grazing. Grazing results in greater transport of nutrients to the metalimnion (via exudates sedimentation, grazing and migrating zooplankton), while also reducing turbidity in epilimnetic waters, enabling the formation of DCMs (Longhurst, 1976; Sarnelle, 1999; Pilati and Wurtsbaugh, 2003; Sawatzky et al., 2006). Thus, in investigating the responses of lake phytoplankton communities to increased C02 concentrations, it will be necessary to also explore the responses of the biomass in the DCM, as the dominant phytoplankton structure, in conjW1ction with the top-down grazing by zooplankton.
To advance our understanding of lake plankton responses to climate change, and the role of co2 augmentation in particular, the next step is thus to investigate this question within a more realistic lake food web context. To this end, we conducted a manipulative lake mesocosm experiment to examine the potential interactions
between zooplankton grazmg and elevated pC02 on water column phytoplankton biomass, productivity, composition and on the DCM characteristics. We expected that C02 enriclunent would favour species without higWy effective CCM, such as the chlorophytes, over the cyanobacteria, but that selective grazing by zooplankton on smaller, more nutritious chlorophytes and clu·ysophytes could interact with such bottom-up responses. We focused on the pure C02 effect, so as to advance the more mechanistic knowledge base for this aspect of climate change, despite the fact that increasing inorganic concentrations in lakes are likely to also be accompanied by a
"brownification" phenomenon (e.g. Graneli, 2012). We further hypothesised that zooplankton grazing would influence the size and depth characteristics of the DCM,
with amplified herbivory at elevated C02 concentrations in response to stimulated phytoplankton productivity. This study should better enable prediction and understanding of the impacts of climate change related to co2 augmentation specifically on aquatic food webs.
0.3 MA TERIALS AND METHODS
The experiment was conducted over a four-week period in mesocosms anchored at
the deepest point in the west basin of the north temperate Lac Croche (Station de Biologie des Laurentides, University of Montreal), Saint-Hippolyte, Quebec, Canada
in summer 2015. Mesocosms consisted of lm diameter x 10m deep enclosures of
polyethylene plastic, open at the surface and closed to the surrounding water column.
This lake basin typically stratifies strongly in June (Gauthier et al, 2014) and a DCM
is generally present (Ouellet Jobin and Beisner, 2014). Once the lake had stratified,
16 mesocosms were installed (June 1 Oth 20 15) by filling each enclosure with filtered
(54jlm to exclude crustacean zooplankton) lake water taken equally from the
epilimnion, metalirnnion and the hypolimnion using a pump. Four treatments (each
replicated across four enclosures) were subsequently applied in a 2x2 factorial design
with two levels (none or added) of C02 addition and crustacean zooplankton. The
co2 effect was evaluated by artificially increasing levels ( +C) or leaving them at
an1bient (-C). To test the zooplankton grazing effect, zooplankton were excluded
from mesocosms (-Z) or added in (+Z).
The zooplankton treatment was created by first excluding crustacean zooplankton
from the lake water used to fill the mesocosms as previously described. For the +Z
treatment, we then collected crustacean zooplankton from the water column using
repeated vertical net hauls in the lake. These were added in equal mixtures (via
repeated aliquots being partitioned out from a well mixed concentrate) into the
zooplankton addition enclosures at ambient lake concentrations. After the mesocosm
installation and zooplankton addition, we waited ten days before beginning the four
For the experimental C02 additions, 18L botties were filled in the !ab with filtered (reverse osmosis) water from Lac Croche and then super-charged with C02 by adding
in 65g of dry ice to each bottle. This super-charged water was then added by
siphoning it into the appropriate mesocosm using a flexible Tygon tube rmming from
the bottle to the mesocosm and submersed at 20cm depth. The initial addition of this
super-charged water to the epilinmion of each +C mesocosm occurred the day prior to the first sampling resulting in pC02 concentrations around 2000ppm: four times
the C02 concentration in the unemiched mesocosms, and three times the lake concentration on that date. Subsequent C02 additions were done weekly based on in
situ measurements of pC02 with the goal of maintaining stable elevated
concentrations.
0.3.1 biotic variables
A portable spectofluorometer (FluoroProbe, bbe-Moldaenke, Kiel, Germany) was
used to estimate biomass and the vertical spatial distribution of different phytoplankton spectral groups: GREENS (chlorophytes), CYANOS (cyanophyta containing phycocyanin pigment), BROWNS ( diatoms + dinoflagellates + chrysophyta), CRYPTOS (cryptophyta
+
cyanophyta containing phycoerythrin pigment), and the total chlorophyll a concentration. Profiles at 25cm intervals were taken each morning, five times per week (Monday to Friday) in each mesocosm.For phytoplankton species identification and biovolume estimates, Lugol's fixed water sampl w r tak n at 4.5m d p (m talimnion) where the DCM typically occurs in the lake, by pumping water directly from the mesocosms into 125ml glass
botties using a Tempest sampling pump (Proactive Environmental Products). These
again four weeks later at the end of the experiment. Samples were later identified in
the !ab at 640X magnification using the Ütermohl method on an Olympus invetted
microscope. Phytoplankton biovolume was calculated using geometrie formulae (Hillebrand et al., 1999) and species abundances. Phytoplankton were then grouped
for statistical analysis into their major classes: chlorophytes, chrysophytes,
cryptophytes, euglenoids, dinoflagellates, cyanobacteria and diatoms.
Primary productivity was estimated by recording photosynthetic rates analysed with a PhytoPAM™ fluorometer (Walz, Germany) and using the maximum electron transport rate (ETRmax) estimated by the software. ETRmax values are good indicators of primary productivity levels, as they are representative of relative oxygen production rates (Korner and Nicklisch, 2002). There are many complicating assumptions and calculations required to estimate "real" primary productivity rates (in units of C-assimilation; j.lg L-1 h-1) and our relativized approach avoids these
potential pitfalls of variable estimation errors. Water samples for ETRmax estimation
were taken at 2.5m depth (epilimnion sample) and 4.5m depth (metalimnion sample)
from each mesocosm twice a week (including the same dates as the phytoplankton
fixed samples were taken). Estimates were based on individual group responses as
measured by the PhytoP AM (Blue = cyanobacteria, Green and Brown) and by the
total response across ali groups.
To evaluate the status of our -Z and +Z treatments, zooplankton were sampled once
per week by collecting separate 12 L pumped (Tempest) water samples each from the
epilimnion (2.5m) and the hypolimnion (6.5m). Water was filtered onto a 54j.lm-mesh
and zooplankton were then anesthetized with club soda and preserved in a 75% (final
concentration) ethanol solution. In the !ab, zooplankton were identified separately for
each depth sample (later combined to a mean value) using a binocular microscope
0.3.2 Abiotic variables
C02 concentrations at the surface of each mesocosm were analysed every 2 days
using an environmental gas analyser (EGM-4) and the headspace teclu1ique (Hope et
al., 1996). C02 profiles were also estimated weekly by analysing water pumped from
the metalimnion ( 4.5m) and the hypolimnion (6.5m). Other environmental variables
included dissolved oxygen (DO) concentrations, pH and temperature measured
weekly at every 0.5m using a YSI6600 multiparan1eter sonde. Total dissolved
phosphorus (TDP) and nitrogen (TDN) were estimated twice weekly by taking water
samples from 2.5m and 4.5m depth. The samples were then analysed in the laboratory
using the ascorbic acid-molybdate reduction method (Griesbach and Peters, 1991)
after persulphate oxidation and autoclaving for TDP. TDN samples were analyzed
with a continuous flow analyzer (ALPKEM Flow Solution IV) using an alkaline
persulfate digestion method, coupled with a cadmium reactor, following a standard
protocol (Patton and Kryskalla, 2003). Temporal means were calculated and
compared by depth strata for C02 and for water column means for nutrients, pH and DO (Tableau A.1).
0.3.3 Statistical analysis
Various response variables were assessed (Tableau 1.1). Total and relative (square
root transformed) biomasses of groups across the water column were estimated on
each sampling date using mean FluoroProbe (FP) profile values. For the DCM we
determined the depth at which maximum biomass in each FP group, including total
chlorophyll, occurred, for every day sampled (DCMdep111 ). The size of the peak was the value of the chlorophyll (group or total) at this depth (DCMsize). The relative
was calculated as a function of total chlorophyll maximum across these depths and normalised with a square root transformation. The degree to which the peak was accentuated relative to background biomass across the profile on each date was estimated by the coefficient of variation of biomass values across depths (CV profile=
standard deviation of the biomass values divided by the mean biomass values) Variation in phytoplankton peak size through tune was assessed by calculating the coefficient of variation of peak biomass (DCMsize) across the sampling dates
(CV DCMsi=e= standard deviation of the DCMsize measurements divided by the mean
DCMsi=e values). Variation of the depth at which the peak occun·ed through time was calculated with CV DCMdeprh (standard deviation of the DCMdeprh observations divided by the mean DCMdeprh values). Photosynthetic rates, as a proxy of primary productivity, were estimated by taking means of ETR111ax across the eplilnnetic and metalirnnetic samples (hereafter: water colurnn rates) and from only the metalirnnetic (hereafter: DCM rates). Ali FP analyses were conducted using observations from the photic zone of the lake only (to 7 rn depth; Gauthier et al., 2014). For phytoplankton microscope counts, mean and relative biovolumes of the main taxa and total cornnmnity were calculated across the two sampling dates, as results were similar to those obtained in separate timepoint analyses. Zooplankton densities were converted to biomass using published dry weight values (McCauley, 1984). A mean was calculated across the two sampling depths and then through time.
To test the main effects of C02 and zooplankton grazing, as weil as their interaction on each response variable, mode! I two-factor ANOVA was used. Simple effects were tested using the F-ratio, obtained by dividing the mean square value of each factor by their respective pooled error term (error mean square) and by calculating the resulting p-value. Ail analyses were conducted in R version 3.2.2 (R Development Core Team, 2015). When data could not be normalised (pH, DO), the Kruskal-Wallis
Tableau 0.1 Variable abbreviations and transformations (if applicable) as used throughout the text and in the analyses.
Variable name A bbrev iation
Transfor-mati on Overall water column biomass mean mean
Relative biomass of group in total mean square root
Maximum biomass DCMsize
Depth ofthe maximum biomass concentration DCMdepth FluoroProbe Relative biomass of group in DCM total
square root
(by group and biomass
total) Coefficient of variation within biomass
CV profile
pro fi les on each date
Coefficient of variation in DCMsize through
CYocMsize ti me
Coefficient of variation in DCMdepth through
CYocMdepth time
PhytoPAM Maximum electron transport rate;
(by group and proxy of primary productivity ETRmax
total) (water column and DCM rates)
Miscroscopic Mean biovolume oftwo samples
counts Relative community composition arcsin square
root Zooplankton
mean zooplankton biomass through time counts
co2
mean through time in epilimnion, Abioticmetalimnion and hypolimnion
variables Total dissolved phosphorus and nitrogen TDP, TDN
pH
0.4 RESULTS
0.4.1 Treatment application effictiveness
C02 concentrations in the +C mesocosms were effectively raised with greater values in the epilimnia (p<O.OOOl) and the metalimnia (p=0.04) of enriched mesocosms, but not in the hypolimnia (p>O.OS) (Tableau A.l). In the epilimnia of treated enclosures,
concentrations increased immediately following
co
2
additions and then slowlydecreased until the next addition (Fig. 1 a). Although C02 concentrations were higher,
mean pH (p>O.OS) and DO (p>O.OS) remained similar averaged across depths and unaffected by C02 enrichment (Tableau A.l). However, pH (p=0.002), DO (p=O.OOS)
and TDN (p=0.04) were ail significantly reduced in the +Z treatments (Tableau A.l).
Ttt~ernt"' •-<: •·C···~-·Z ~__r---, (b)
,
.. • ... ~ i" "' ...
-::::__
----~~~~~~
·
---·---
-::
::::::::::.-.-.-.-.-.-
.
.
.-.
·
_~·.-::::::.·---
~
0 175 80 185 190 19S da of earFigure 0.1 (a) Ti me series of epilimnetic C02 in the epilimnia of the mesocosms by treatment across 4 weeks, and (b) ti me series of total zooplankton
Overall, treatments in which crustacean zooplankton had been removed ( -Z) had almost no individuals, while densities in the +Z treatments were significantly
(p<O.OOO 1) higher with total biomass around 7-8 ~g/L (Tableau A.1 ). The zooplankton conununity varied minimally through time, with significant differences maintained between treatments throughout the experiment (Fig. 1.1 b ).
A DCM did form in the mesocosms, between 4 and 6m deep, the depth at which it normally also occurs in the lake (Ouellet Jobin & Beisner 2014). The strength of the DCM did vary between the treatments and through time however (Fig. 2).
0.4.2 Phytoplankton communities: spectral group
0.4.2.1 Qualitative spatial-temporal patterns
In the baseline treatment ( -C+ Z) most resembling lake conditions, total chlorophyll a
(chla) concentration remained low in the water colurnn throughout the experiment, with maximum concentration reaching 7 ~g/L (versus 12 ~g/L in the lake) (Fig. 1.2a). Removing zooplankton (-C-Z) led to the highest total chla concentration with a maximum of 12.8 ~g/L (Fig. 1.2b). Chia concentrations increased through time, mostly in the deeper water. Adding C02 to the baseline treatment (+C+Z) did not alter maximal biomasses from the baseline treatment, but greater mean ebla concentrations were observed through time (Fig. 1.2c). Finally, C02 emiclm1ent without zooplankton (+C-Z) (Fig. 1.2d) also increased chia concentration over time relative to the baseline condition, but to a lesser degree than without C02 (-C-Z).