© Camille Contant, 2020
Réponses physiologiques et désactivation des voies de
signalisation spécifiques de l'EGFR dans les cellules de
carcinome buccal humain par l'anéthol
Mémoire
Camille Contant
Maîtrise en sciences dentaires - avec mémoire
Maître ès sciences (M. Sc.)
Réponses physiologiques et désactivation des voies de
signalisation spécifiques de l'EGFR dans les cellules de
carcinome buccal humain par l'anéthol
Mémoire
Camille Contant
Sous la direction de :
Abdelhabib Semlali, directeur de recherche
Mahmoud Rouabhia, codirecteur de recherche
Résumé
Le cancer de la bouche est un problème de santé publique majeur. Les traitements des cancers buccaux incluent l’utilisation de la chirurgie, de la chimiothérapie et de la radiothérapie. Bien que fonctionnels, ces traitements présentent de nombreux effets indésirables. Il est pertinent de mettre au point une nouvelle génération de médicaments anticancéreux efficaces et spécifiques. L’objectif de cette étude est d’évaluer les propriétés antitumorales de l'anéthol (1-méthoxy-4-[(E)-1-propényl]-benzène), un composé extrait du fenouil et de l'anis, afin de caractériser ses effets sur des cellules de carcinome buccal. Pour ce faire, des cellules gingivales cancéreuses (Ca9-22), des cellules épithéliales gingivales primaires et des fibroblastes ont été traités avec différentes concentrations d’anéthol. La prolifération cellulaire et l'effet cytotoxique de l’anéthol sur les trois types cellulaires ont été mesurés respectivement par MTT et LDH, tout comme l’effet synergique avec le cisplatine. La mort cellulaire, l’autophagie et le stress oxydatif des Ca9-22 ont été mesurés par cytométrie en flux. La migration cellulaire a été évaluée par la capacité de cicatrisation alors que l’expression des protéines impliquées dans les voies de signalisation de l’EGFR (ERK1/2, p38, pJNK) a été étudiée par immunobuvardage. Nos résultats ont démontré que l’anéthol diminue de manière dose-dépendante la prolifération cellulaire et induit l’apoptose des cellules cancéreuses comparativement aux cellules gingivales normales. L’anéthol inhibe le stress oxydatif et favorise l’autophagie des Ca9-22. L’anéthol inhibe la transition épithélio-mésenchymateuse, réduit l’expression des métalloprotéases, ainsi que la production des protéines oncogènes, dont cyclineD1, mais augmente l’expression du gène suppresseur de tumeur p53. L’anéthol inhibe les voies de signalisation dépendantes de l’activation de l’EGFR et Wnt, et active le clivage des caspases et de PARP1. Enfin, l’anéthol montre une synergie avec le traitement par cisplatine. En conclusion, nos résultats obtenus suggèrent que l’anéthol pourrait être utilisé comme thérapie complémentaire ou alternative du cancer de la bouche.
Abstract
Oral cancer is a major public health problem. Treatments for oral cancer include the use of surgery, chemotherapy, and radiation therapy. Although functional, these treatments have many side effects. It is relevant to develop a new generation of effective and specific anticancer drugs. The objective of this study is to assess the antitumor properties of anethole (1-methoxy-4 - [(E) -1-propenyl] -benzene), a compound extracted from fennel and anise, in order to characterize its effects on oral carcinoma cells. To do this, cancerous gum cells (Ca9-22), primary gingival epithelial cells and fibroblasts were treated with different concentrations of anethole. Cell proliferation and the cytotoxic effect of anethole on all three cell types were measured respectively by MTT and LDH, as was the synergistic effect with cisplatin. Cell death, autophagy and oxidative stress of Ca9-22 were measured by flow cytometry. Cell migration was assessed by the healing capacity while the expression of proteins involved in EGFR signaling pathways (ERK1/2, p38, pJNK) and other proteins involved in cancer-signaling pathways was studied by immunoblotting. Our results showed that anethole dose-dependently decreases cell proliferation and induces cancer cell apoptosis compared to normal gingival cells. Anethole inhibits oxidative stress and promotes autophagy of Ca9-22. Anethole inhibits epithelial-mesenchymal transition, reduces the expression of metalloproteases, as well as the production of oncogenic proteins, as cyclinD1, but increases the expression of the tumor suppressor gene p53. Anethole inhibits Wnt and signaling pathways dependent on EGFR activation, and activates the cleavage of caspases and PARP1. Finally, our results show that this compound has a synergistic effect with cisplatine treatment. In conclusion, these results suggest that anethole could be used as a complementary or alternative therapy to oral cancer.
Table des matières
Résumé ... III Abstract ... IV Table des matières ... V Listes des figures ... VII Liste des abréviations ... IV Remerciements ... VII Avant-propos ... IX
Introduction ... 1
1. Problématique du cancer buccal ... 1
1.1 Définition, prévalence et étiologie ... 1
1.2 Symptômes, prévention et traitements ... 4
2. La médecine traditionnelle ... 6 2.1 Le fenouil ... 7 2.2 L’anis ... 9 2.2.1 L’anis vert ... 10 2.2.2 L’anis étoilé ... 11 2.3 L’anéthol ... 11
2.3.1 Origine et utilisation de l’anéthol ... 11
2.3.2 Propriétés chimiques de l’anéthol ... 12
2.3.3 Rôles de l’anéthol ... 13 2.3.3.1 Effet anticancérigène ... 13 2.3.3.2 Effet anti-inflammatoire ... 15 2.3.3.3 Effet antibactérien ... 16 2.3.3.4 Effet antifongique ... 17 2.3.3.5 Effet anthelminthique ... 17 2.3.3.6 Effet analgésique ... 18 2.3.3.7 Effet antioxydant ... 18 2.3.3.8 Effet antithrombotique ... 19 2.3.3.9 Effet gastro-protecteur ... 19 2.3.3.10 Effet vasorelaxant ... 19
2.3.3.11 Effet sur les constituants de la matrice extracellulaire ... 20
2.3.3.12 Effet anti-ostéoporotique ... 20
2.3.3.13 Effet insecticide ... 21
2.3.3.14 Effet antidiabétique ... 21
2.3.3.15 Effet hépatoprotecteur ... 21
2.3.3.16 Effet neuroprotecteur ... 22
2.3.3.17 Effet sur le développement embryonnaire ... 22
2.3.3.18 Effet sur la culture de racine ... 23
3. Potentiel de l’anéthol dans le traitement du cancer buccal ... 23
3.1 Effet sur le récepteur du facteur de croissance épidermique (EGFR) ... 24
3.1.1 Les MAPKinases ... 27
3.1.2 NF-kB ... 28
3.2 Wnt ... 29
3.4 Gènes suppresseurs de tumeur ... 31
3.5 La mort cellulaire ... 33
3.5.1 L’apoptose ... 34
3.5.2 La nécrose ... 36
3.5.3 L’autophagie ... 36
3.6 Remodelage de la matrice extracellulaire ... 38
3.7 Phase métastatique ... 41
4. Hypothèse et objectifs de recherche ... 43
4.1 Hypothèse de recherche ... 43
4.2 Objectifs de recherche ... 43
4.3 Pertinence du projet de recherche ... 44
Chapitre 1 : L'anéthol présente une forte activité anticancérigène en inhibant les voies de signalisation ERK1-2, P38 / JNK, NF-kB et Wnt et en déclenchant l'apoptose, l'autophagie et le stress oxydatif ... 45
1. Résumé ... 45
2. Article ... 46
2.1 Abstract ... 47
2.2 Introduction ... 48
2.3 Materials and Methods ... 50
2.4 Results ... 55 2.5 Discussion ... 59 2.6 Conclusion ... 62 2.7 References ... 63 2.8 Figure legends ... 66 2.9 Figures ... 68
Chapitre 2 : Résultats supplémentaires ... 77
1. Matériels et méthodes ... 77
1.1 Effet synergique de l’anéthol et de cisplatine sur les cellules de la lignée cellulaire Ca9-22 provenant d’un carcinome gingival ... 77
1.2 Analyses statistiques ... 77
2. Résultats ... 78
2.1 L’anéthol présente un effet synergique avec le cisplatine sur la prolifération des cellules cancéreuses buccales ... 78
3. Discussion ... 79
Conclusion et perspectives ... 81
Listes des figures
Liste 1 : Introduction, Chapitre 2 et Conclusion
Figure 1 . Organisation des composantes majeures de la cavité buccale. ... 1
Figure 2 . Cancers épidermoïdes de différentes régions de la cavité buccale. ... 2
Figure 3 . Incidence du cancer buccal et des lèvres pour 100 000 personnes parmi les populations âgées d’au moins 15 ans. ... 3
Figure 4 . Distribution des stades de cancer de la bouche au moment du diagnostic au Canada de 2011-2015. ... 4
Figure 5 . Structure chimique de la cisplatine. ... 5
Figure 6 . Évolution des indicateurs de progrès des pays définis par la Stratégie de l’OMS pour la médecine traditionnelle. ... 7
Figure 7 . Illustration du fenouil. ... 8
Figure 8 . Composé organique aromatique appartenant à la famille des phénylpropènes, présent dans l’huile du fenouil. ... 9
Figure 9 . Illustration des types d’anis. ... 10
Figure 10 . Structure chimique de l’anéthol. ... 12
Figure 11 . Récepteur de l’EGFR. ... 24
Figure 12 . Schéma de l’EGFR et des voies de signalisation en aval. ... 25
Figure 13 . Représentation schématique des inhibiteurs de kinases respectifs cliniquement approuvés, dont celle de la voie de l’EGFR. ... 26
Figure 14 . Schéma de la voie des MAPKinases regroupant ERK1/2, JNK et p38. ... 27
Figure 15 . Schéma résumant la voie canonique de NF-kB. ... 28
Figure 16 . La voie de signalisation Wnt/b-caténine. ... 29
Figure 17 . Le cycle cellulaire. ... 30
Figure 18 . Le gène suppresseur de tumeur p53. ... 32
Figure 19 . Les trois principaux modes de mort cellulaire. ... 34
Figure 20 . Schéma de la voie intrinsèque et extrinsèque de l’apoptose. ... 35
Figure 21 . Processus de l’autophagie. ... 37
Figure 22 . Schéma du rôle des MMPs et TIMPs sur la matrice extracellulaire. ... 39
Figure 23 . La transition épithélio-mésenchymateuse (TEM). ... 41
Figure 24 . L’anéthol potentialise l’effet du cisplatine des cellules cancéreuses buccales. 79 Figure 25 . Schéma synthèse illustrant les différents effets de l’anéthol in vitro sur des cellules gingivales cancéreuses (Ca9-22). ... 85
Liste 2 : Chapitre 1 - Article
Figure 1 : Anethole selectively inhibits the growth of oral cancer cells. ... 66
Figure 2 : Anethole induces apoptosis of oral cancer cells. ... 66
Figure 3 : Anethole inhibits the migration of oral cancer cells. ... 66
Figure 4 : Anethole induces autophagy of oral cancer cells. ... 66
Figure 5 : Anethol promotes the inhibition of oxidative stress in oral cancer cells. ... 66
Figure 6 : Anethole modules the expression of several genes of oral cancer cells. ... 67
Figure 7 : Anethole reduce the MMPs expression and increase TIMPs expression of oral cancer cells. ... 67
Figure 8 : Schematic diagram of hypothesized mechanism of anethole-induced selective killing of human oral cancer Ca9-22 cells. ... 67
Liste des abréviations
ADN Acide désoxyribonucléique
AKT PKB : Protéine kinase B
AMPc Adénosine monophosphate cyclique
AMPK Protéine kinase AMP-dépendante
An Annexine V
APC/C Complexe de promotion de l’anaphase
Arf ADP ribosylation factors
ARN Acide ribonucléique
ATG Autophagy-related gene
ATM Ataxia telangiectasia mutated
ATR Ataxia telangiectasia and Rad3 related
Bax Bcl-2-associated X protein
Bcl-2 B-cell lymphoma 2
CAK Kinase activant la Cdk
Cdk Cyclin-dependent kinase
Chk1/2 Checkpoint kinase 1/2
CHUL Centre hospitalier de l’Université Laval
CO2 Dioxyde de carbone
CXCR4 C-X-C Motif Chemokine Receptor 4
DISC Death-inducing signaling complex
DO Densité optique
E2F E2 factor
EDTA Éthylènediaminetétraacétique
EGFR Epidermal growth factor receptor
ErbB Erythroblastosis oncogene B
ERK1/2 Extracellular signal-regulated kinases
Fas Apoptosis antigen 1 (APO-1)
FBS Fetal bovin serum
FIP Focal adhesion Kinase interacting Protein
GAG Glycosaminoglycane
GEC Cellules épithéliales gingivales
GF Fibroblastes gingivaux
HMGB1 High–mobility group box 1
IAP Protéines inhibitrices de l’apoptose
IL Interleukin
JNK C-Jun N-terminal kinases
LDH Lactate déshydrogénase
LPS Lipopolysaccharides
MAPK Mitogen-activated protein kinases
Mdm2 Mouse double minute 2 homolog
MEK Rapidly Accelerated Fibrosarcoma
mTOR Mechanistic target of rapamycin
MMP Métalloprotéases matricielles
NF-κB Nuclear factor-kappa B
Noxa Phorbol-12-myristate-13-acetate-induced protein 1
OSCC Oral squamous cell carcinoma
p16 Cyclin-dependent kinase inhibitor 2A
p21 Cyclin-dependent kinase inhibitor 1
p27 Cyclin-dependent kinase inhibitor 1B
p38 P38 mitogen-activated protein kinase
p53 Tumor protein 53
PARP1 Poly [ADP-ribose] polymerase 1
P/S Pénicilline/Streptomycine
Pi Iodure de propidium
PI3K Phosphoinositide 3 -kinase
Puma p53 upregulated modulator of apoptosis
PTEN Phosphatase and TENsin homolog
RAF Rapidly Accelerated Fibrosarcoma
Rb Protéine du rétinoblastome
ROS Reactive oxygen species
RPMI Roswell Park Memorial Institute medium
RT Reverse transcriptase
Runx2
TIMP Runt-related transcription factor 2 Inhibiteurs de métalloprotéinase
TEM Transition épithélio-mésenchymateuse
TLR Toll-like receptor
TNF Facteur de nécrose tumorale
TRPA1 Transient receptor potential cation channel, subfamily A, member 1
TSC2 Tuberous sclerosis complex 2
Remerciements
Sans l’appui de plusieurs personnes, ce projet de recherche n’aurait sans doute pas été possible et aussi agréable à réaliser.
Je tiens tout d’abord à remercier mon directeur de recherche, le Dr Abdelhabib Semlali qui m’a donné l’opportunité d’évoluer au sein de son laboratoire sur un sujet passionnant combinant mon amour pour la recherche et la santé buccodentaire. Je lui suis reconnaissante pour la constance de son soutien, sa disponibilité, la confiance qu’il m’a témoignée et pour tout ce qu’il m’a appris. Je tiens également à remercier mon codirecteur, le Dr Mahmoud Rouabhia, pour son expertise et sa disponibilité pour répondre à mes questions.
Je souhaite aussi exprimer ma gratitude au Dre Fatiha Chandad qui m’a intégrée au sein du Groupe de recherche en écologie buccale (GREB) et qui a été présente lors de la réalisation de ce projet. Ensuite, j’aimerais remercier notre collaborateur à Héma-Québec, le Dr Lionel Loubaki, pour la réalisation de la cytométrie en flux. Merci également à mes enseignants, le Dr Luc Giasson, le Dr Daniel Grenier et la Dre Fatiha Chandad, qui m’ont offert des cours très enrichissants. Je remercie également la Dre Vanessa Houde qui a évalué mon mémoire avec soin.
De plus, je remercie mesdames Denise Fréchette, Catherine Auclair, Claudia Doré et Myra Gagnon pour leur travail administratif dans la réalisation de mon projet de maîtrise. Je remercie également Sylvie Maheux de sa grande générosité pour la révision de mon document. Pour son grand support moral tout au long de mon parcours, je tiens à remercier Sandra Racine.
Merci à tous les membres (anciens et actuels) que j’ai côtoyés et qui m’ont aidée. Je ne peux passer sous silence la contribution de ma collègue Humidah Alanazi. Elle m’a soutenue pendant ma maîtrise en répondant à mes questions techniques et en partageant de belles conversations.
Je tiens également à remercier la Dre Caroline Gilbert de m’avoir présentée au GREB et pour tout ce qu’elle m’a appris depuis mon début universitaire.
Je remercie les organismes subventionnaires, notamment les Fonds Émile-Beaulieu de la Faculté de médecine dentaire de l’Université Laval, qui ont supporté de près ou de loin mon projet de recherche.
Finalement, je tiens à exprimer ma très grande reconnaissance à ma maman (Linda), mon papa (Jacques), mon frère (Justin) et Maxime. Merci d’avoir cru en moi, de m’avoir appuyée dans mes décisions et de toujours me rappeler ma persévérance. Une mention spéciale à ma petite Lou.
Avant-propos
Ce mémoire présente l’ensemble des résultats de recherche obtenus au cours de ma maîtrise en sciences dentaires dans le laboratoire du Dr Abdelhabib Semlali à la Faculté de médecine dentaire de l’Université Laval. Ce projet a également été réalisé avec l’aide de mon codirecteur de recherche, le Dr Mahmoud Rouabhia et de notre collaboratrice au GREB, la Dre Fatiha Chandad. Ma collègue de travail, Humidah Alanazi m’a également aidée dans certaines questions techniques reliées à l’électrophorèses.
Mon stage de recherche effectué à l’été 2019, dans le cadre du cours SBM-3030 du Baccalauréat en sciences biomédicales de l’Université Laval, m’a été d’une grande utilité me permettant de me familiariser avec les techniques de laboratoire et la littérature sur ce sujet.
Le chapitre 1 introduit le sujet de recherche afin de mieux comprendre la problématique du cancer buccal, les traitements actuellement utilisés et l’utilisation potentielle de la médecine traditionnelle ainsi que de l’anéthol. Ce chapitre est suivi d’une brève revue de la littérature sur les propriétés bénéfiques de l’anéthol ainsi que son potentiel anticancéreux sur les différents mécanismes cellulaires.
Le chapitre 2 expose l’hypothèse, les objectifs et la pertinence de ce projet de recherche.
L’article scientifique intitulé : « Anethole exhibits strong anti-carcinogenic activity by
shifting ERK1-2, P38/JNK, NF-kB and Wnt signaling pathways and by triggering apoptosis, autophagy and oxidative stress » par Camille Contant, Mahmoud Rouabhia, Lionel Loubaki,
Fatiha Chandad and Abdelhabib Semlali et soumis le 2 septembre 2020 (9b4cac31-a8d4-4261-9501-128706eed34b) au Scientific Reports est présenté dans le chapitre 3. J’ai réalisé la majorité des expériences qui ont conduit à l’obtention des résultats de ce chapitre. Les expériences de mort cellulaire en cytométrie en flux ont été réalisées à Héma-Québec grâce à notre collaborateur, le Dr Lionel Loubaki. Les résultats de cytométrie en flux d’autophagie et de stress oxydatif ont été obtenus à la plateforme de cytométrie en flux du Centre hospitalier de l’Université Laval (CHUL). Les échantillons concernant les métalloprotéinases
ont été envoyés à Eve Technologies Corporation à Calgary pour effectuer les analyses. J’ai également écrit la première version de l’article sous la supervision de mon directeur et codirecteur de recherche. Finalement, la version finale a été validée par l’ensemble des auteurs.
Le chapitre 4 présente des résultats de recherches supplémentaires recueillis au cours de ma maîtrise. Non publiés à ce jour, ils traitent plus particulièrement de l’effet synergique de l’anéthol avec le cisplatine. Ces résultats pourront faire l’objet d’une publication ultérieure. Les expériences ont été réalisées en collaboration avec mon directeur de recherche.
Le chapitre 5 correspond à une discussion générale et met en évidence les résultats ainsi que les conclusions de ce projet. Les perspectives y sont également abordées.
Introduction
1. Problématique du cancer buccal
1.1 Définition, prévalence et étiologie
Le cancer buccal se définit par une prolifération et une propagation anormale des cellules de la bouche.[1] Problématique mondiale majeure de santé publique, il est la principale cause de
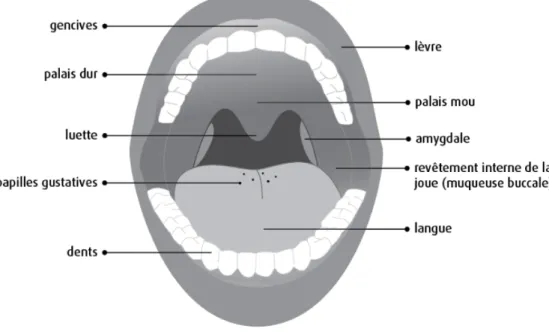
décès reliée à la maladie buccodentaire. Il peut toucher plusieurs régions telles que les lèvres, les gencives, les amygdales, la langue, les glandes salivaires, l’arrière de la gorge, le plancher de la bouche et le palais, l’intérieur des joues et l’oropharynx (Figure 1).[2, 3]
Figure 1 . Organisation des composantes majeures de la cavité buccale. (Tirée de Société canadienne du
cancer [4])
Les cinq principaux cancers de la bouche sont ceux de la langue (25-35 %), le plancher de la bouche (14-34 %), la muqueuse labiale et buccale (19-22 %), la gencive (12-14 %) et le palais (6-10 %) (Figure 2).[5-8] Toutefois, chez les enfants de moins de 16 ans, les cancers de
la mandibule (17,9 %), du palais (14,9 %), de la gencive (13,4 %), de la muqueuse alvéolaire (11,9 %), du maxillaire et de la langue (10,4 % chacun) sont prédominants.[5] De plus,
environ 90 % des cancers dans ces régions se développent sous forme de carcinome épidermoïde et affectent fortement la muqueuse buccale.[6, 9, 10] Ce type de tumeur maligne
est associé à un faible taux de survie. Les tumeurs des glandes salivaires, hématologiques, osseuses, mésenchymateuses et odontogènes composent les types tumoraux du pourcentage restant.[5, 11]
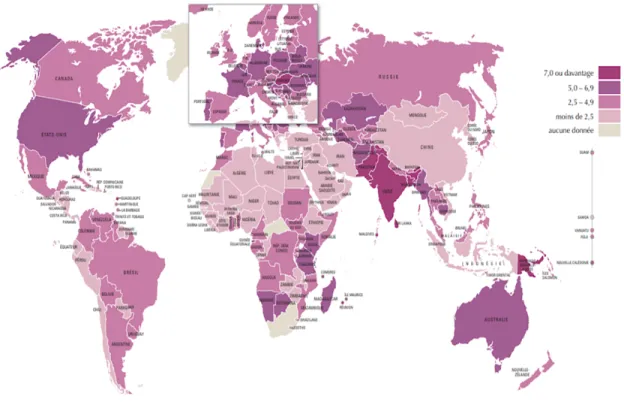
La prévalence du cancer buccal varie généralement en fonction des conditions socio-économiques.[1, 6, 16, 17] Au niveau mondial, l’incidence varie de 4 à 20 cas pour 100 000
personnes. Des données statistiques révèlent que les cas sont plus élevés dans les régions de l’Asie du Sud et du Sud-Est, de l’Europe de l’Est, de certaines régions d’Afrique et d’Amérique latine (Figure 3). Même si le rapport homme et femme diminue, il est courant d’observer une incidence plus élevée chez les hommes et les personnes âgées.[1] Cependant,
les carcinomes épidermoïdes localisés dans la gencive ont une prévalence similaire chez l’homme et la femme.[9]
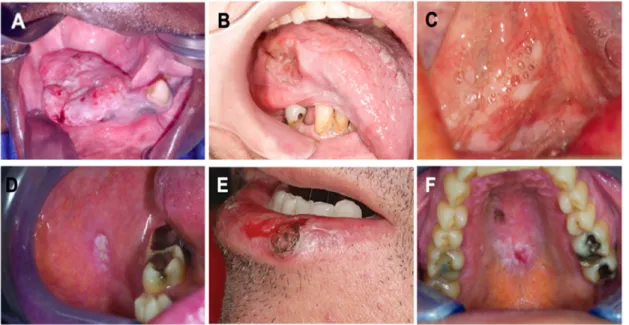
Figure 2 . Cancers épidermoïdes de différentes régions de la cavité buccale. A) Gencive. B) Langue. C)
Plancher de la bouche. D) Muqueuse buccale. E) Lèvre. F) Palais. (Tirée de Mupparapu et Shanti, Wong et Wiesenfeld, Chomik et coll., Cannon et coll., Vieira et coll.[3, 12-15])
Le cancer buccal est classé au 6e rang mondial des tumeurs malignes.[5, 6, 18, 19] Il s’agit
également du 11e type de cancer le plus courant à travers le monde causant plus de 145 000
morts par an. Au Canada, il représente plutôt le 13e cancer le plus fréquent.[20] De façon plus
précise, il s’agit du 8e cancer le plus fréquent chez l’homme et du 14e chez la femme. En
2019, la Société canadienne du cancer a estimé une prévalence de 5 300 diagnostics de cancer de la cavité buccale, dont 3 700 chez l’homme et 1 600 chez la femme. De ce nombre, 1 050 hommes et 430 femmes en mourront. Le taux élevé de décès est principalement expliqué par le diagnostic tardif du cancer.[21] Ce délai favorise également la formation de
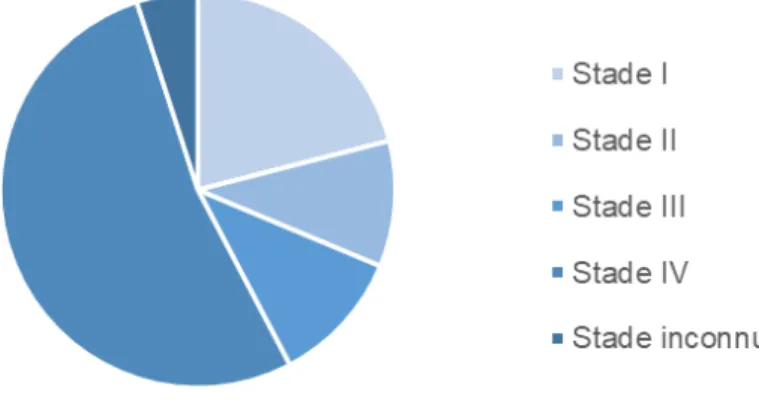
métastases. En effet, 52,7 % des cancers buccaux sont diagnostiqués au stade IV du développement selon les études du gouvernement du Canada de 2011 à 2015 (Figure 4).
Figure 3 . Incidence du cancer buccal et des lèvres pour 100 000 personnes parmi les populations âgées d’au moins 15 ans. Estimations de 2012. (Adaptée de La Fédération dentaire internationale[1])
La consommation de tabac, d’alcool et l’âge sont parmi les principales causes du cancer de la bouche.[1, 2, 22-24] Malnutrition, mauvaise hygiène buccale, exposition excessive au soleil,
présence d’infections, dont le papillomavirus, les maladies parodontales et les lésions persistantes sont également des facteurs de risque importants.[23] Bien que l’environnement
joue un rôle majeur dans l’étiologie multifactorielle de ce cancer, l’aspect génétique peut aussi avoir un impact considérable sur son développement.
1.2 Symptômes, prévention et traitements
Un diagnostic précoce et de la prévention peuvent permettre de réduire les risques de cancer buccal.[25] Il est fortement recommandé d’entretenir une bonne hygiène buccale, de consulter
régulièrement un professionnel de la santé buccodentaire et d’être vigilant aux différents signes et symptômes.[26, 27] Parmi les symptômes pouvant indiquer la présence d’un cancer,
on retrouve notamment des lésions persistantes, des saignements ou des taches inexpliqués, des changements dans la perception du goût, des sensations irrégulières, des engourdissements ou des douleurs, des nodules ou des ulcères, des changements de coloration, des troubles de déglutition, de la toux ou des maux de gorge persistants et des changements au niveau de la voix.[1, 2, 27].
L’utilisation d’agents topiques pour la chimioprévention sur les lésions buccales, notamment par des dérivés de rétinoïdes, de bléomycine, d’acétylcystéine, d’inhibiteurs de COX,
Figure 4 . Distribution des stades de cancer de la bouche au moment du diagnostic au Canada de 2011-2015. (Adaptée du Gouvernement du Canada [21])
d’interférons et de composés naturels, incluant le curcuma, pourrait permettre d’inhiber la formation d’une tumeur maligne.[28-30] Le traitement du cancer de la cavité buccale dépend
non seulement de l’emplacement, de la taille ou du stade de la tumeur, mais également des comorbidités, de l’état nutritionnel et de la tolérance du patient.[10, 31] Plusieurs traitements
pour le cancer sont en cours d’utilisation, soit la chirurgie, la chimiothérapie, la radiothérapie, l’hormonothérapie, l’immunothérapie et la greffe de cellules souches.[3, 32] Cependant, la
majorité des traitements repose sur une combinaison de chirurgie, de radiothérapie et de chimiothérapie. Plus précisément, les patients avec un diagnostic précoce sont généralement traités par chirurgie et radiothérapie alors que ceux présentant un stade plus avancé nécessiteront des traitements de chimiothérapie, notamment l’utilisation de cisplatine, de carboplatine, de 5-fluorouracile, de paclitaxel ou de docétaxel.[33] Le cisplatine, aussi connu
sous le nom de cis-diamminedichloroplatinum (II), est l’un des médicaments à base de platine le plus utilisé dans le traitement de chimiothérapie pour traiter divers types de cancer, dont les carcinomes (Figure 5).[34] Le cisplatine a la propriété d’interagir avec les bases de purines,
d’interférer avec les mécanismes de réparation de l’acide désoxyribonucléique (ADN) et d’induire des dommages à l’ADN favorisant ainsi l’apoptose des cellules cancéreuses. Cependant, il est généralement utilisé en combinaison avec d’autres composés puisque son action seule peut favoriser le développement d’une résistance au traitement de chimiothérapie.[34-36]
Les patients atteints de cancer de stade I ou II ont normalement un bon pronostic avec un taux de survie d’environ 80 % et 65 %.[10] Toutefois, les patients aux stades III ou IV ont un
taux de guérison de 30 %. De plus, 50 % des patients atteints du cancer buccal survivent
après 5 ans. En raison de la non-spécificité et de la toxicité du composé, les traitements actuellement utilisés présentent de nombreux effets secondaires dont une insuffisance rénale, une hépatite, une éruption cutanée, une diarrhée, une thyroïdite, une hypophysite, une pneumonie, des acouphènes, des nausées et vomissements, une neuropathie périphérique, une myélosuppression, une candidose, une ostéonécrose, une mucite buccale, de la fatigue et une perte de cheveux.[37-39]
De plus, 40 % des médicaments monomoléculaires modernes proviennent directement ou indirectement des extraits de plantes pour le traitement de divers maux.[40] Donc, la médecine
traditionnelle pourrait être une voie combinée ou alternative efficace dans le traitement du cancer, incluant celui de la cavité buccale.
2. La médecine traditionnelle
La médecine traditionnelle, aussi appelée médecine douce, alternative ou complémentaire, est utilisée depuis des milliers d’années.[41] L’Organisation mondiale de la Santé (OMS)
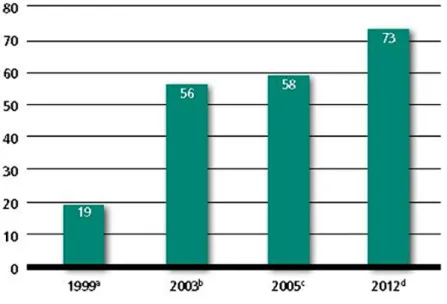
définit la médecine traditionnelle comme étant la somme des connaissances, des compétences et des pratiques reposant sur les théories, les croyances et les expériences propres à une culture dans l’objectif de maintenir les êtres humains en bonne santé. Dans cette catégorie de médecine, on retrouve notamment l’utilisation d’herbes médicinales, l’acupuncture et la pratique d’exercices énergétiques. Elle est donc employée à la fois pour prévenir, pour traiter et pour guérir des maladies physiques et mentales. Encore aujourd’hui, la médecine traditionnelle connaît une croissance considérable dans plusieurs pays (Figure 6).[42, 43] Avec la croissance mondiale de cette approche, il est possible d’observer
une augmentation de la recherche et de l’utilisation de produits naturels à base d’extraits de plantes. Toutefois, un manque d’informations précis quant à la composition, la bioactivité et le mode d’absorption de certains de ces extraits pourrait être une limitation associée à la médecine traditionnelle.[44] La toxicité, la couleur du composé, la solubilité et la
biodisponibilité pourraient aussi faire partie des limitations associées.[45] L’utilisation de
dérivé de plantes utilisé en médecine traditionnelle peut également être accessible plus facilement qu’une majorité des médicaments utilisés en médecine conventionnelle.[46] Une
utilisation non appropriée des extraits de plantes pourrait être associée à des effets indésirables tels que des lésions hépatiques et des réactions allergiques.[47, 48]
Les composantes médicinales des plantes sont extraites de ses différentes parties tels les fleurs, les graines, les feuilles, les fruits, la racine et la tige.[49] Les extraits de plantes
détiennent des propriétés aromatiques. De par leur composition chimique, on leur attribue également de multiples propriétés biologiques, telles que des activités antibactériennes, antifongiques, insecticides, antioxydantes, anti-inflammatoires et anticancérigènes.[49, 50] Les
plantes de la famille des Moracées (Moraceae) et des Apiacées (Apiaceae) représentent une grande proportion de plantes médicinales utilisées.[51-53] On retrouve parmi les plus
importantes, le fenouil et l’anis.
2.1 Le fenouil
Le fenouil (Foeniculum vulgare), une plante originaire de la région méditerranéenne, est connu depuis l’Antiquité.[54] On le retrouve dans de nombreuses régions du monde sur les
terrains incultes, secs et à l’état sauvage. Le fenouil peut également être cultivé à des fins médicinales puisqu’il est d’ailleurs très utilisé en médecine autochtone pour soigner divers
Figure 6 . Évolution des indicateurs de progrès des pays définis par la Stratégie de l’OMS pour la médecine traditionnelle. Nombre d’États membres disposant d’instituts de recherche nationaux en médecine
maux dont certains troubles respiratoires et gastro-intestinaux.[54, 55] Cette plante vivace fait
partie de la famille des Apiacées (Apiaceae) ou des Ombellifères (Umbelliferae) (Figure 7).[50, 54]
Le fenouil est constitué d’une racine ligneuse et d’une tige buissonnante et fusiforme pouvant atteindre une hauteur de 1,5 à 2,5 mètres.[50, 54] Les branches, finement ramifiées, sont de
forme cylindrique et striée en plus de présenter un phénotype luisant et brillant. Les feuilles sont minces et peuvent atteindre une longueur de 40 centimètres. Les fleurs jaunes sont réunies en ombelles de 7 à 10 centimètres. Finalement, les fruits sont des akènes ovoïdes d’une longueur d’environ 4 à 10 millimètres présents sous forme d’une graine sèche.
Il existe deux sous-espèces de fenouil, soit piperitum et vulgare dont les propriétés aromatiques sont différentes.[55] En effet, la sous-espèce piperitum a des graines amères, alors
que la sous-espèce vulgare possède des graines sucrées lui conférant une odeur à saveur anisée.[50] Cette dernière, étant la plus connue, est souvent utilisée comme aromatisants dans
divers produits, dont les produits de boulangerie, les plats de viande et de poisson, les glaces, les boissons alcoolisées, ainsi que dans la fabrication des produits cosmétiques et pharmaceutiques.[54, 55] À la propriété aromatique du fenouil s’ajoutent également des
Figure 7 . Illustration du fenouil A) Illustration du fenouil dans son ensemble. B) Fenouil sauvage. C) Fleurs.
propriétés stomachiques, digestives, carminatives, antispasmodiques, analgésiques, antiseptiques, insecticides, antithrombotiques, hépatoprotectrices, antidiabétiques, anticorrosives, antioxydantes, antibactériennes et antifongiques, anti-inflammatoires et antitumorales.[50, 54]
L’origine, les conditions écologiques et environnementales ainsi que le stade de maturation sont des facteurs prédominants quant à la composition chimique et plus particulièrement les propriétés volatiles de certains composés chimiques de la plante.[54, 56] Plusieurs études
suggèrent que le fenchone, l’estragole, l’α-phellandrene, le limonène et surtout le trans-anéthol sont les principaux composants organique de l’huile du fenouil.[54-57] Alors que
l’anéthol présente des caractéristiques fort intéressantes dans le traitement et la prévention du cancer,[58-65] l’estragole serait quant à lui plus inquiétant.[50, 66] En effet, des études ont
révélé une ressemblance structurale entre l’estragole et le méthyleugénol, un composé potentiellement cancérigène (Figure 8).
2.2 L’anis
L’anis, grandement utilisé en parfumerie, en confiserie ainsi que dans la fabrication d’apéritifs et de diverses liqueurs, est divisé en deux groupes, soit l’anis vert et l’anis étoilé (Figure 9).[67] Tous deux sont constitués en grande partie d’anéthol, et disposent de propriétés
médicamenteuses avantageuses. Cependant, en grande quantité, l’anis peut également s’avérer toxique.[67-70]
Figure 8 . Composé organique aromatique appartenant à la famille des phénylpropènes, présent dans l’huile du fenouil. A) Estragole. B) Méthyleugénol. (Adaptée de Manzoor et coll. [50])
2.2.1 L’anis vert
L’anis vert (Pimpinella Anisum) fait partie de la famille des Ombellifères (Umbelliferae).[69]
Originaire de la région méditerranéenne et de l’Afrique du Nord, l’anis était cultivé par les Égyptiens il y a plus de 4 000 ans pour ses propriétés digestives. Cette plante herbacée d’une hauteur de 30 à 50 cm est encore cultivée dans quelques régions, plus particulièrement dans la région méditerranéenne orientale, en Asie occidentale, au Moyen-Orient, au Mexique, en Égypte et en Espagne. On la reconnait par ses petites fleurs blanches disposées en ombelles terminales composées et ses petites graines allant du vert au jaune.[67] Les semences sont
effectuées en avril pour permettre la récolte en août.[67, 69] Les graines d’anis sont ensuite
utilisées pour leurs différentes propriétés, soit aromatiques, carminatives, analgésiques, désinfectantes, diurétiques, antibactériennes, antifongiques, insecticides et antivirales. L’anis vert serait également efficace pour le polissage des dents en plus d’avoir un effet de relaxant musculaire et nerveux.[69] Principalement composée de trans-anéthol, l’huile de l’anis vert contient également de l’estragole et d’autres composés en faible concentration.[69]
Figure 9 . Illustration des types d’anis. A) Plantation de l’anis vert. B) Graines de l’anis vert. C) Anis étoilé.
2.2.2 L’anis étoilé
L’anis étoilé (Illicium verum), aussi appelé badiane, fait partie de la famille des Illiciacées (Illiciaceae).[67, 70] Originaire du sud-ouest de la Chine et du Vietnam, on retrouve
présentement l’anis étoilé dans les régions tropicales et subtropicales de l’Asie.[68] À l’état
sauvage, ce petit arbre mesure généralement 8 à 15 mètres.[67, 70] Cependant, dans les
plantations, l’anis étoilé est généralement taillé pour être d’une hauteur de 3 à 6 mètres. Au niveau du feuillage, on retrouve des fleurs rouge pourpre et des fruits disposés en forme d’étoile. Les récoltes se font habituellement à deux reprises, soit au printemps et à l’automne. Le fruit, cueilli vert, est séché après maturation pour être utilisé moulu, broyé ou sous forme d’huile. Contrairement à l’anis vert, l’utilisation de l’essence d’anis étoilé a connu une croissance considérable dans l’industrie médicale et alimentaire.[68, 70-72] Il possède de
nombreuses propriétés gustatives et médicinales surtout au niveau gastro-intestinal, respiratoire et inflammatoire. L’anis étoilé agit comme antispasmodique, anti-inflammatoire, antifongique, anti-oxydatif, antimicrobien, antiviral, anti-rhumatisme, insecticide, carminatif, somnifère, diurétique et présente un potentiel anticancéreux. L’huile de l’anis étoilé est également principalement composée de trans-anéthol.[72] On y retrouve d’autres
composantes dont l’acide shikimique et l’estragole. Il est à noter qu’il existe un type d’anis étoilé japonais caractérisé par la présence des facteurs chimiques volatils toxiques, dont l’arsenic et le méthoxyeugénol, qui ne sont pas présents dans les autres types d’anis.[73]
2.3 L’anéthol
Cette section vise à mieux comprendre l’origine, l’utilisation actuelle et les propriétés chimiques de l’anéthol. De plus, une brève revue de la littérature permettra de mettre en évidence les diverses études démontrant les propriétés bénéfiques in vitro et in vivo de ce composé.
2.3.1 Origine et utilisation de l’anéthol
L’anéthol peut être extrait des différentes parties du fenouil, de l’anis vert et de l’anis étoilé, telles que les fleurs, les graines, les feuilles, les fruits et les racines.[49] Ce produit a été
reconnu pour son odeur de réglisse noire et ce composé possède un pouvoir sucrant au moins dix fois plus élevé que celui du sucre de table.[75, 76]
Autorisé par la « Food and Drug Administration », l’anéthol est grandement utilisé dans les industries pharmaceutiques, alimentaires, cosmétiques et de la parfumerie.[49, 77] Bien que
l’anéthol soit vendu librement en Belgique, en Italie et dans d’autres pays, certains pays interdisent sa vente pour son utilisation frauduleuse dans la fabrication de substances illicites notamment pour la fabrication de médicaments hallucinogènes et stimulants.[77]
2.3.2 Propriétés chimiques de l’anéthol
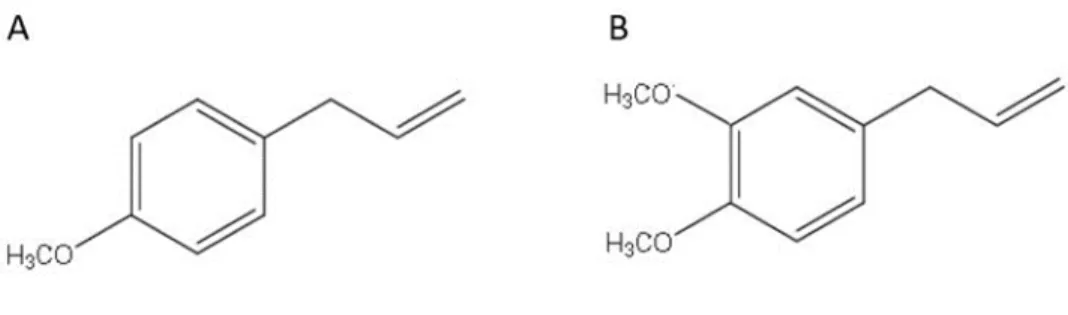
Lorsqu’extrait des plantes, environ 99 % des isomères se retrouvent sous la forme de trans-anéthol (1-methoxy-4-[(E)-prop-1-enyl]-benzène), indiquant que les groupements prioritaires se retrouvent de part et d’autre de la double liaison carbone-carbone.[75, 78, 79] Le
trans-anéthol est un phénylpropène, soit un hydrocarbure aromatique de neuf carbones et dix
hydrogènes, possédant une masse moléculaire de 148,2 g/mol (Figure 10).
Il est principalement reconnu pour son goût sucré ainsi que pour son odeur aromatique. Il s’agit d’un liquide hydrophobe incolore à l’état liquide, légèrement jaunâtre à plus de 23 oC
et blanchâtre lorsque congelé. L’anéthol est cependant très soluble dans l’alcool et miscible à l’éther ainsi qu’au chloroforme. Ce composé possède une température d’ébullition de 234 oC, une température de fusion de 21,3 oC, une densité relative de 0,986 à 0,991, une
pression de vapeur de 5,45 kPa et un indice de réfraction de 1,56. Notons que lorsque synthétisé chimiquement, l’anéthol présente une plus grande quantité d’impureté de cis-anéthol dont l’odeur est irritante et désagréable. De plus, le trans-cis-anéthol peut révéler des effets toxiques, lorsque consommé en trop grande quantité, notamment en provoquant des
réactions allergiques cutanées, des vertiges et des vomissements. Cependant, le cis-anéthol possède à la base une toxicité de 15 à 38 fois plus élevée pour l’animal que son isomère.
2.3.3 Rôles de l’anéthol
De nombreuses études sur l’anéthol ont permis de mettre en évidence ses nombreux rôles et effets potentiellement favorables. Ces rôles seront décrits dans les sous-sections suivantes.
2.3.3.1 Effet anticancérigène
Plusieurs équipes de recherche ont étudié l’effet anticancérigène de l’anéthol. Tout d’abord, Chen et deGraffenried [58] ont étudié l’effet anticancéreux et apoptotique de l’anéthol sur les
cellules MCF-7 et MDA-MB-231 du cancer du sein chez l’humain. Ils ont montré que l’anéthol a un effet dose-dépendant sur la prolifération des cellules cancéreuses indépendamment du récepteur d’œstrogènes. De plus, leurs études montrent que l’anéthol a un effet apoptotique en induisant le clivage des caspases et l’expression de p53, un gène suppresseur de tumeurs, dans les deux types cellulaires. Ainsi, les résultats de cette étude suggèrent que l’anéthol inhibe totalement la survie cellulaire et induit des événements apoptotiques in vitro dans les cellules du cancer du sein. Ghasemian et coll.[59] ont également
étudié les effets cytotoxiques de l’anéthol sur les cellules cancéreuses MCF-7 du cancer du sein. Pour ce faire, les auteurs ont utilisé des huiles de fenouil, contenant majoritairement de l’anéthol, provenant de trois régions distinctes d’Iran, soit Kerman, Azerbaïdjan et Golestan. Ils ont observé que chacune des huiles avait une cytotoxicité dose-dépendante sur les cellules étudiées. Cependant, ils ont observé que celles recueillies dans la province du Golestan présentaient une plus grande cytotoxicité. Finalement, ils ont pu montrer que l’expression de la protéine Bcl-2-associated X (Bax), une protéine proapoptotique, était régulée positivement alors que la protéine B-cell lymphoma 2 (Bcl-2), une protéine anti-apoptotique, était négativement régulée. Les résultats indiquent donc l’effet apoptotique induit par les huiles de fenouil contenant de l’anéthol sur les cellules cancéreuses. En plus, Shahbazian et coll.[60]
ont étudié la cytotoxicité du trans-anéthol sur deux lignées cellulaires du cancer du sein, MCF-7 et T47D, par l’utilisation de nanoparticules de trans-anéthol liposomales pégylées. La pégylation consiste à ajouter des chaînes de polyéthylène glycol au trans-anéthol pour
prolonger sa demi-vie et le stabiliser dans la circulation sanguine. L’utilisation de nanoparticules permet principalement d’améliorer le système de biodistribution. Ils ont observé qu’après 24 heures d’incubation en présence de nanoparticules de trans-anéthol, la cytotoxicité in vitro des cellules cancéreuses augmentait de 8 à 9 fois par rapport au contrôle. Les nanoparticules avaient également une stabilité, une efficacité d’encapsulation et de chargement du composé ainsi qu’une libération du médicament acceptables par rapport au contrôle. Par la suite, Elkady [61] a étudié l’effet anticancérigène de l’anéthol sur la lignée
cellulaire PC-3 du cancer de la prostate. Les résultats ont permis d’observer que l’anéthol inhibait la prolifération, la croissance clonale et la migration des cellules PC-3. Il a confirmé ses résultats en étudiant les protéines des cyclines et des gènes suppresseurs de tumeurs, la génération d’espèces réactives de l’oxygène (ROS), la perméabilité membranaire et lysosomale, l’activation des caspases et le rapport protéique apoptotique. Il a également noté que l’anéthol supprimait la translocation nucléaire du facteur de transcription NF-κB (nuclear factor kappa B). Ainsi, il a été proposé que l’anéthol pourrait être efficace dans le traitement du cancer de la prostate. De plus, Rhee et coll.[62] ont utilisé des cellules
cancéreuses de la prostate DU145 pour observer l’effet anti-métastatique de l’anéthol. L’anéthol a pour effet de diminuer le niveau d’acide ribonucléique (ARN) et de protéines du récepteur C-X-C Motif Chemokine 4 (CXCR4), un récepteur membranaire clé dans la médiation des métastases, et inversement il prolonge l’expression du gène Phosphatase and
TENsin homolog (PTEN), qui agit comme inhibiteur de la prolifération. L’anéthol a
également agi en diminuant la phosphorylation des protéines clés de la voie la phosphoinositide 3-kinase - protéine kinase B (PI3K-AKT) qui joue un rôle essentiel dans la survie et la croissance cellulaire. Les auteurs ont également observé une réduction des métalloprotéinases matricielles (MMPs)-2 et -9. Ensuite, Ha et coll.[63] ont étudié l’effet
antimétastatique de l’anéthol par l’utilisation in vitro des cellules DU145 du cancer de la prostate. Ils ont montré une diminution de l’expression de MMP-9, twist, de la kinase PI3K-AKT et de la vimentine. Inversement, l’anéthol augmente l’expression d’E-cadhérine, un marqueur épithélial. L’anéthol a également diminué l’adhésion aux plaques revêtues de vitronectine et a inhibé l’invasion dans la chambre de Boyden. Ainsi, les résultats suggèrent que l’anéthol a la capacité de réguler l’invasion et la migration des cellules DU145. Choo et coll.[64] ont également étudié l’effet antimétastatique de l’anéthol sur des cellules tumorales
de fibrosarcome humain HT-1080. Les résultats ont montré que l’anéthol a inhibé l’adhésion et l’invasion des cellules à la matrice et ce, de manière dose-dépendante. L’anéthol a également la capacité de diminuer l’expression des MMPs-2 et -9 et inversement d’augmenter l’expression de l’inhibiteur de métalloprotéinase (TIMP)-1. Finalement, l’anéthol avait la capacité d’inhiber la voie de signalisation AKT, extracellular
signal-regulated kinases (ERK), P38 mitogen-activated protein kinase (p38) et NF-kB. Finalement, en 1995, al-Harbi et coll.[65] ont utilisé un modèle in vivo de souris albinos suisses pour
étudier l’effet anticancéreux de l’anéthol. Pour ce faire, ils ont induit la formation d’une tumeur d’ascite d’Ehrlich dans la patte droite des souris par injection intramusculaire. Trois concentrations d’anéthol, administrées par voie orale sur une période de 60 jours, ont été utilisées, soient 250, 500 et 1 000 mg/kg. Les observations ont permis de démontrer que l’anéthol augmentait la survie des souris en plus de réduire le poids et le volume de la tumeur. Les analyses de cytotoxicité et de viabilité ont aussi montré que l’anéthol diminuait le nombre de cellules tumorales, le niveau d’acides nucléiques et augmentait la concentration de glutathion. L’anéthol avait également induit des changements histopathologiques similaires au cyclophosphamide, une molécule utilisée dans le traitement de certaines formes de cancers.
2.3.3.2 Effet anti-inflammatoire
Les effets anti-inflammatoires de l’anéthol ont été clairement reportés dans la littérature. Chen et deGraffenried [58] ont montré des propriétés anti-inflammatoires de l’anéthol en
agissant sur la voie de signalisation NF-κB sur les cellules MCF-7 et MDA-MB-231 du cancer du sein humain. La quantification de l’activité luciférase de NF-κB a permis de déterminer que l’anéthol inhibe les voies pro-inflammatoires de façon dose-dépendante. De plus, Moradi et coll.[80] ont utilisé un modèle de parodontite induite par injection de la
lipopolysaccharide (LPS) chez le rat pour observer l’effet anti-inflammatoire de l’anéthol en mesurant les niveaux d’interleukine-1β (IL-1β) et du facteur de nécrose tumorale alpha (TNF-α). L’administration par injection d’anéthol au niveau de la gencive palatine a permis d’inhiber de façon significative la production de cytokines plasmatiques pro-inflammatoires. L’anéthol pourrait ainsi jouer un rôle inhibiteur en régulant les canaux calcium et potassium
des cellules.[81, 82] Ainsi, l’anéthol pourrait éventuellement être utilisé dans le traitement de
maladies parodontales.[80] Aussi, Ritter et coll.[83] ont étudié l’effet anti-inflammatoire de
l’anéthol dans un modèle d’arthrite rhumatoïde chez le rat. En plus de diminuer significativement les dommages articulaires et la résorption osseuse, l’anéthol à 250 mg/kg, administré par gavage une fois par jour pendant 21 jours, a considérablement diminué la présence d’inflammation, notamment par une réduction des cytokines pro-inflammatoires. Finalement, Kim et coll.[84] ont utilisé un modèle murin de maladie pulmonaire obstructive
chronique pour évaluer l’effet de l’anéthol sur l’inflammation pulmonaire chronique. L’ajout d’anéthol a permis de réduire l’activité de la lactate déshydrogénase (LDH), le nombre de cellules immunitaires et la concentration sérique de cytokines pro-inflammatoires chez la souris. De plus, des changements histopathologiques favorables du poumon et une diminution de la pression artérielle ont été notés lorsque les souris étaient soumises par voie orale à 125 mg/kg d’anéthol. Ainsi, l’anéthol pourrait être un agent thérapeutique potentiel contre l’inflammation pulmonaire chronique.
2.3.3.3 Effet antibactérien
L’effet antibactérien de l’anéthol a été étudié par des équipes de recherches. Tout d’abord, Ghasemian et coll.[59] ont démontré l’effet bénéfique des composantes du fenouil comme
agent antibactérien. Après avoir isolé les différents extraits, les auteurs ont étudié l’effet de l’anéthol sur diverses espèces bactériennes. Les résultats ont permis d’observer une inhibition de la croissance bactérienne à des doses élevées (50 μg/mL), principalement chez
Escherichia coli et Staphylococcus aureus. Ainsi, l’anéthol pourrait être une alternative
efficace à la résistance aux antibiotiques. De plus, Korkmaz et coll.[85] ont effectué des études
sur le rôle antibactérien des dentifrices en gel à base de plantes en utilisant les espèces
Streptococcus mutans et S. aureus. L’anéthol constituait 52 % du dentifrice. L’activité
antimicrobienne du dentifrice contenant principalement de l’anéthol a été évalué en comparant la zone d’inhibition générée contre les microorganismes par rapport au contrôle utilisé, soit l’ampicilline à 35mg/mL. Les auteurs ont proposé que l’anéthol pourrait être en partie contribuer à de la prévention de l’accumulation bactérienne sur les dents et donc de la plaque dentaire. Une réduction de la charge bactérienne permet une meilleure protection de la cavité buccale en plus de réduire le risque de carie. Finalement, Kwiatkowski et coll.[86]
ont montré les propriétés bénéfiques de l’utilisation de l’anéthol en synergie avec la mupirocine, un antibiotique, sur des souches de S. aureus résistantes à la mupirocine. En premier lieu, les résultats ont montré l’effet antibactérien de cette synergie. En effet, les interactions ont permis d’augmenter la perméabilité membranaire ce qui modifie la concentration de produits intracellulaires. En deuxième lieu, les auteurs ont montré que l’association de l’anéthol à 2 % et de la mupirocine permettait de réduire la biomasse de biofilm en interagissant avec les protéines de surface. Ainsi, la combinaison des deux composés avait permis d’augmenter l’activité contre des souches de S. aureus résistantes.
2.3.3.4 Effet antifongique
Vieira et coll.[87] ont étudié l’effet du fenouil et l’anis sur l’espèce Candida albicans, un
important microorganisme commensal de la cavité buccale à l’origine des infections fongiques. Il est à noter que l’anéthol est le principal constituant de l’huile de ces deux plantes médicinales. Les auteurs ont observé une absence de cytotoxicité des composés utilisés sur les fibroblastes murins en plus de présenter une activité antifongique. Ainsi, les auteurs ont proposé que les huiles de fenouil et d’anis seraient potentiellement efficaces pour la prévention et le traitement de la candidose.
2.3.3.5 Effet anthelminthique
Camurça-Vasconcelos et coll.[88] ont étudié l’effet anthelminthique de l’anéthol sur des œufs
et des larves d’un nématode gastro-intestinal de mouton, soit Haemonchus contortus. L’utilisation d’anéthol a empêché l’éclosion d’au moins 98 % des œufs de parasite en plus d’inhiber 90 % du développement des larves. Les chercheurs ont également tenté l’expérience chez le murin où ils ont observé une diminution de 70 % de parasites. Cependant, les auteurs reconnaissent qu’il ne s’agit pas d’un modèle optimal puisque les larves provenaient des moutons. Ainsi, l’anéthol pourrait être une molécule potentielle pour le contrôle de parasites sans avoir d’impact majeur sur l’environnement en plus de diminuer les pertes économiques des petits producteurs de ruminants dans les pays tropicaux.
2.3.3.6 Effet analgésique
Une revue de la littérature a permis d’observer les études mettant en évidence l’effet analgésique de l’anéthol. En effet, Memon et coll.[89] ont démontré que l’anéthol joue
également un rôle sur l’afflux sélectif de calcium dans les neurones sensoriels sensibles de souris exprimant le canal cationique potentiel du récepteur transitoire, sous-famille A, membre 1 (TRPA1). Présent chez l’humain et chez l’animal, TRPA1 est un canal cationique situé sur la membrane plasmique de nombreux types cellulaires dont les neurones sensoriels.[90] Une stimulation accrue de TRPA1 par des signaux thermiques et mécaniques
entraîne l’apparition de différentes douleurs épisodiques et la présence d’inflammation.[90] Il
est à noter que l’ouverture de ce canal voltage-dépendant est influencée par une variété de signaux chimiques exogènes et endogènes. Ainsi, les études ont montré que l’anéthol possède une activité analgésique en activant et en désensibilisant le canal TRPA1 dans les neurones de souris.[89, 91] L’effet analgésique de l’anéthol a entre autres été observé chez la souris par
une diminution du léchage des pattes.[89] Wang et coll.[92] ont également montré le rôle
analgésique de l’anéthol chez les souris atteintes de douleurs neuropathiques, notamment en observant un changement de comportement et en améliorant la conduction du nerf sciatique. L’inhibition de la suractivation des astrocytes, cellules gliales ayant un rôle dans le maintien de la barrière hématoencéphalique, et des microglies, macrophages du système nerveux, favorise également une diminution de certaines cytokines inflammatoires dont le TNF-α, l’IL-6 et l’IL-1β.[92, 93] L’administration d’anéthol pendant 8 jours consécutifs chez la souris
favorise la diminution de douleurs neuropathiques, améliore les altérations comportementales, électrophysiologiques, histopathologiques et moléculaires en plus d’inhiber les facteurs inflammatoires.[92]
2.3.3.7 Effet antioxydant
L’effet antioxydant de l’anéthol a notamment été étudié par Shahriari et coll. [94] et Rhee et
coll.[95] En effet, Shahriari et coll.[94] ont démontré l’effet antioxydant de l’anéthol sur les
larves d’Ephestia kuehniella, une mite alimentaire. Ils ont observé une activité significativement accrue du superoxyde dismutase, de la peroxydase et de la catalase. Finalement, Rhee et coll.[95] ont montré que l’anéthol possède la capacité de réguler les ROS
et l’activité de l’enzyme mTOR (mechanistic target of rapamycin) grâce à ses propriétés antioxydantes et permet de contrôler la différenciation adipogénique des cellules souches mésenchymateuses humaines. Au stade initial, la présence des ROS dans les cellules souches était de 18 %. Après le traitement au peroxyde d’hydrogène, une augmentation à 82 % était notée alors que l’ajout d’anéthol (50 μM) pendant deux jours diminuait le niveau des ROS à 64 %. Ainsi, les auteurs ont montré que l’anéthol possède la capacité de fournir un signal anti-obésité, notamment en régulant le métabolisme cellulaire via ROS et mTOR.
2.3.3.8 Effet antithrombotique
Tognolini et coll.[96] ont étudié les propriétés antithrombotiques de l’anéthol par induction de
thromboembolie pulmonaire chez les cobayes et les rats. L’administration d’anéthol par voie orale a réduit de façon significative la paralysie des membres chez les animaux en favorisant l’activité antithrombotique.
2.3.3.9 Effet gastro-protecteur
Rosemayre et coll.[97] ont observé une activité gastro-protectrice significative de l’anéthol
(< 300 mg/kg) chez la souris sans modifier la sécrétion de mucus. Tognolini et coll.[96] ont
également remarqué l’activité gastro-protectrice de l’anéthol contre les dommages érosifs induits par l’éthanol chez le rongeur.
2.3.3.10 Effet vasorelaxant
Des équipes de recherches ont étudiés l’effet vasorelaxant de l’anéthol. Tout d’abord, Cabral et coll.[98] ont étudié le rôle de l’anéthol sur la relaxation des corps caverneux chez le rat dans
un objectif de contrôler la dysfonction érectile et l’éjaculation prématurée. Les auteurs ont constaté une augmentation de la production d’adénosine monophosphate cyclique (AMPc), un messager important des prostanoïdes relaxants, ce qui favorise une relaxation du muscle lisse des corpus caverneux. De plus, Boskabady et coll.[99] ont travaillé sur les propriétés
vasorelaxantes de l’anéthol sur les chaînes trachéales de cobaye. Les auteurs ont noté un effet bronchodilatateurs significatif de l’anéthol comparé à un produit contrôle. L’effet relaxant
pourrait en partie être expliqué par une ouverture des canaux potassiques des chaînes trachéales du cobaye. Finalement, Seo et coll.[100] ont démontré que l’anéthol prévenait
l’hypertension chez des rats exposés chroniquement au stress de contention ou à la nicotine de la cigarette. Les résultats ont montré que l’anéthol induisait une modification de la pression artérielle et agissait sur la régulation du tonus vasculaire comparativement au modèle contrôle. Cette différence indique que l’utilisation d’anéthol, à une dose de 125-250 mg/kg chez le rat, pourrait diminuer le risque de développer de l’hypertension et des maladies cardiovasculaires via l’inhibition du remodelage artériel, ses propriétés vasorelaxantes et anti-inflammatoires.
2.3.3.11 Effet sur les constituants de la matrice extracellulaire
Selon les travaux d’Andrulewicz-Botulińska et coll.,[49] l’anéthol présente des propriétés
bénéfiques sur les fibroblastes de la peau dans un modèle reconstitué in vitro. En effet, la concentration optimale d’anéthol, soit 1 μM, favorise la formation de collagène en inhibant l’activation des MMP-2 tout en évitant une formation excessive de glycosaminoglycanes (GAGs). Cependant, des concentrations élevées d’anéthol (> 100 μM) pourraient être à l’origine d’une formation excessive de collagène.
2.3.3.12 Effet anti-ostéoporotique
Shadamarshan et coll.[101] ont étudié l’effet de l’anéthol sur l’ostéogenèse, soit la constitution
et le développement du tissu osseux. Pour ce faire, ils ont utilisé des fibres de polycaprolactone (PCL)/polyvinylpyrrolidone (PVP) obtenues par la technique d’électrofilage. Cette technique permet de produire des nanofibres à partir de polymères chargés.[102] Afin de compléter le modèle, les chercheurs ont ajouté des cellules souches
mésenchymateuses de souris. Ils n’ont noté aucun effet cytotoxique de l’anéthol sur les cellules mésenchymateuses, ni sur l’épaisseur de la fibre, le gonflement, l’adsorption, la dégradation ou la biominéralisation des protéines. Cependant, la présence prolongée d’anéthol a favorisé la différenciation des ostéoblastes autant sur le plan cellulaire que moléculaire. De plus, les études suggèrent que l’anéthol a un effet sur la régulation positive du facteur de transcription lié à Runt 2 (Runx2), un facteur de transcription osseuse précoce
jouant un rôle dans le développement des dents. Les auteurs ont également noté une régulation positive de diverses molécules ayant un rôle dans la différenciation des ostéoblastes.[101] Par conséquent, l’anéthol pourrait avoir un rôle dans la régénération du tissu
osseux.
2.3.3.13 Effet insecticide
Tabanca et coll.[103] ont montré que l’anéthol pouvait être une molécule efficace pour attirer
Ceratitis capitata, une mouche méditerranéenne des fruits. Cette espèce a un impact ravageur
important lors de la culture des fruits et légumes. Ainsi, l’utilisation de différents produits, dont l’anéthol pourrait favoriser la culture des fruits et légumes sans utilisation de pesticides et ainsi avoir un effet positif sur l’environnement.
2.3.3.14 Effet antidiabétique
L’effet antidiabétique de l’anéthol a été étudié. Tout d’abord, Abou El-Soud et coll.[104] ont
étudié l’effet des huiles du fenouil, dont l’anéthol sur le diabète. Pour ce faire, ils ont utilisé un modèle de diabète chez le rat par injection de streptozotocine. Les auteurs ont noté que l’ingestion orale de l’huile favorisait une diminution de l’hyperglycémie en plus de corriger les anomalies pathologiques associées aux tissus pancréatiques et rénaux. Finalement, Sheikh et coll.[105] ont également utilisé un modèle de diabète de type II chez le rat par injection de
streptozotocine. Les auteurs ont montré que l’administration par voie orale de 80 mg/kg d’anéthol dissous dans de l'huile de maïs favorisait une diminution du taux de glucose plasmatique, de l’insuline, du poids corporel, de l’apport alimentaire et du glycogène hépatique. Une régulation favorable de l’activité des enzymes impliqués dans le métabolisme des glucides était également notable. Ainsi, les études effectuées chez le rat montrent que le
trans-anéthol pourrait être un composé potentiel pour contrôler le diabète de type II.
2.3.3.15 Effet hépatoprotecteur
Des chercheurs ont montré l’effet hépatoprotecteur de l’anéthol. Mostafa et coll.[106] ont
des rats présentant des symptômes d’hépatotoxicitié. Afin d’augmenter la stabilité physique de l’anéthol, les chercheurs ont encapsulé l’anéthol dans un système de délivrance transdermique. Les résultats ont montré, chez les animaux traités, une diminution des phosphatases alcalines, des aspartates transaminases, des alanines transaminases, de la bilirubine totale et directe, de l’albumine et de l’ammoniac. La modification de ces paramètres indique un potentiel de l’anéthol d’améliorer les troubles de la toxicité hépatique chez le rat. De plus, Da Rocha [107] a étudié l’effet hépatoprotecteur de l’anéthol chez un
modèle murin possédant des lésions causées par un excès d’acétaminophène. L’administration de 125 mg/kg d’anéthol par voie orale une fois par jour pendant sept jours aux souris a permis de diminuer l’inflammation et l’oxyde nitrique au niveau du foie. Les auteurs ont rapporté une diminution des taux de cytokines pro-inflammatoires TNF et IL-1, et une augmentation des taux de cytokines anti-inflammatoires, soit IL-10 et IL-4. Des changements histologiques, incluant la nécrose et la taille de la zone hépatocytaire, ont également été observés suggérant un effet bénéfique potentiel de l’anéthol.
2.3.3.16 Effet neuroprotecteur
Selon une étude de Ryu et coll.,[108] l’anéthol à une concentration de 10 µM réduit
significativement la mort cellulaire des cellules neuronales induite par la privation d’oxygène et de glucose suivi d’une réoxygénation. Ainsi les résultats suggèrent que l’anéthol agit comme un agent neuroprotecteur en diminuant les dommages neuronaux notamment par sa capacité de bloquer l’excitotoxicité, le stress oxydatif et le dysfonctionnement mitochondrial.
2.3.3.17 Effet sur le développement embryonnaire
Sa et coll.[109] ont expérimenté l’effet de l’anéthol sur le développement embryonnaire in
vitro chez les bovins. Une des principales causes du développement médiocre des ovocytes
et des embryons est le stress oxydatif. Dans ces modèles de culture des embryons in vitro, il est généralement possible de constater une augmentation de la production de ROS ce qui peut causer un dysfonctionnement mitochondrial, provoquer des lésions d’ADN, d’ARN et des protéines et inhiber la fusion sperme-ovocyte. La supplémentation du milieu de maturation avec l’anéthol (300 μg/mL) a permis d’améliorer à la fois la quantité et la qualité des
embryons bovins produits in vitro, et ce probablement grâce à sa capacité de réguler l’équilibre redox et la fonction mitochondriale.
2.3.3.18 Effet sur la culture de racine
Kochan et coll.[110] ont également pu observer les propriétés, in vitro, de l’anéthol sur les
racines de Panax quinquefolius, une vivace utilisée en médecine traditionnelle chinoise et associée aux forêts matures. Ils ont noté une augmentation, après 24 h à 72 h de traitement des racines, de la biosynthèse de ginsénosides et de saponines lors de l’ajout d’anéthol au milieu de culture. Ces composés sont produits comme métabolites secondaires des plantes et sont pharmacologiement actifs pour avoir des effets régulateurs sur les système nerveux, endocrinien, cardiaque et immunitaire. Un modèle in vitro de racines de P. quinquefolius en présence d’anéthol pourrait favoriser une production efficace et rapide de ginsénosides et de saponines.
3. Potentiel de l’anéthol dans le traitement du cancer buccal
La revue de littérature sur l’anéthol permet de découvrir et de comprendre ses nombreuses propriétés. Ainsi, il semblerait que l’anéthol ait un rôle anticancérigène.[58-65] Il sera donc
intéressant de comprendre les différentes voies de signalisation, spécialement celles de l’EGFR (MAPKinase et NF-kB), suivant lesquelles l’anéthol pourrait exercer un effet bénéfique comme agent anticancérigène. La compréhension de ces mécanismes d’action pourrait éventuellement permettre l’utilisation de l’anéthol dans la médecine traditionnelle comme traitement alternatif ou supplémentaire pour le traitement ou la prévention du cancer.
L’anéthol semble jouer un rôle important sur différentes molécules clés, dont celles impliquées dans les voies de signalisation, le cycle cellulaire, le fonctionnement des gènes suppresseurs de tumeurs, de la mort cellulaire et de la transition épithélio-mésenchymateuse. Pour étudier les effets de l’anéthol sur le cancer buccal, une lignée de carcinome épidermoïde gingival humain (Ca9-22) sera utilisée.[111]
![Figure 5 . Structure chimique de la cisplatine. (Tirée de Dasari et Tchounwou [34] )](https://thumb-eu.123doks.com/thumbv2/123doknet/2898523.74498/20.918.318.598.739.907/figure-structure-chimique-cisplatine-tirée-dasari-tchounwou.webp)


![Figure 10 . Structure chimique de l’anéthol. (Tirée de Andrulewicz-Botulińska [49] )](https://thumb-eu.123doks.com/thumbv2/123doknet/2898523.74498/27.918.293.621.611.724/figure-structure-chimique-l-anéthol-tirée-andrulewicz-botulińska.webp)