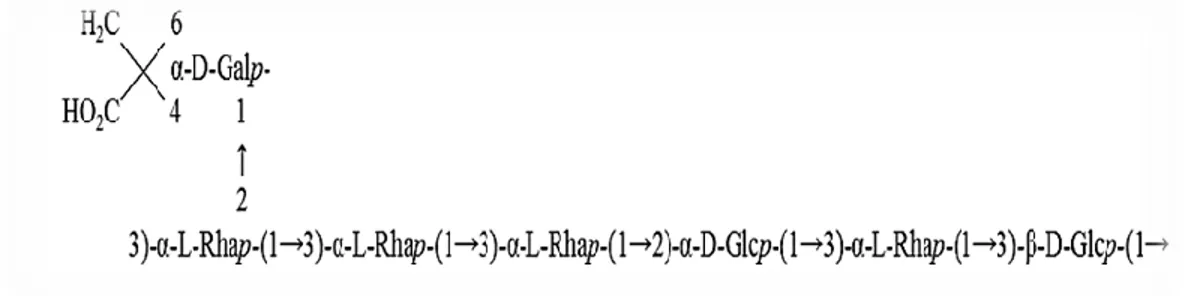© Annalisse Bertsch Socorro, 2021
Fermentation de coproduits de l'industrie laitière et
céréalière par lacticaseibacillus rhamnosus et
saccharomyces cerevisiae
Thèse
Annalisse Bertsch Socorro
Doctorat en microbiologie agroalimentaire
Philosophiæ doctor (Ph. D.)
II
FERMENTATION DE COPRODUITS DE L’INDUSTRIE
LAITIÈRE ET CÉRÉALIÈRE PAR LACTICASEIBACILLUS
RHAMNOSUS ET SACCHAROMYCES CEREVISIAE
Thèse
Annalisse Bertsch Socorro
Sous la direction de :
Gisèle LaPointe (directrice de recherche)
Denis Roy (co-directeur de recherche)
III
Résumé
Le perméat de lactosérum (PL) et le son de blé (SB) sont des coproduits de l’industrie laitière et céréalière hautement disponibles et généralement utilisés pour l’alimentation animale ou l’épandage. Dans un contexte d’économie circulaire, des bio-ingrédients durables et innovateurs peuvent être produits par la valorisation des co-produits afin de répondre à la demande de produits avec des bienfaits santé par les consommateurs. Par ailleurs, la fermentation est une alternative de recyclage biologique qui permet d’augmenter la disponibilité des composés bioactifs du SB et de produire des exopolysaccharides à partir du PL. Dans ce contexte, l’objectif de cette étude est d’obtenir un bio-ingrédient (BI) riche en polysaccharides et composés bioactifs par fermentation du mélange de PL/SB par trois souches de Lacticaseibacillus
rhamnosus R0011, ATCC 9595 et RW-9595M en monoculture ou en coculture avec Saccharomyces cerevisiae. Dans un
premier temps, les expériences ont visé l’évaluation de l’effet de la coculture sur la production d’exopolysaccharides (EPS) par les souches de L. rhamnosus dans du PL. La croissance des mono et cocultures en milieu liquide a été suivie par le compte microbiologique (CFU/mL), la viabilité (PMA-qPCR), la consommation du substrat (lactose) et la production des métabolites (acide lactique et EPS) pendant 48h sans contrôle de pH. L’analyse transcriptomique par RT-qPCR a été utilisée pour déterminer l’expression relative des gènes en coculture par rapport à la monoculture au cours de la fermentation. Un total de 34 gènes en lien avec l’opéron EPS, le métabolisme des sucres, le stress et l’environnement ont été ciblés. Pour l’obtention du bio-ingrédient le mélange de PL /SB a été fermenté en milieu solide par trois souches bactériennes en mono et coculture. L’évolution de la fermentation a été suivie par comptage microbiologique (CFU/g), par la consommation du lactose, le suivi de l’acidification, la détermination des protéines solubles, r la rhéologie et par microscopie électronique à balayage.Le milieu fermenté a été lyophilisé pour obtenir les BI. La composition des BI, le contenu en polysaccharides hydrosolubles (PSH) qui incluent les EPS, la capacité antioxydante et la bioaccessibilité in
vitro des composés phénoliques totaux et des acides phénoliques ont été comparés avec le son de blé non fermenté
(SBNF). Dans du PL, après 48 heures, les résultats ont révélé que la production d’EPS était améliorée de 39%, 49% et 42% en coculture pour R0011, ATCC 9595 et RW-9595M, respectivement. Des taux d’expression de l’opéron de EPS plus élevés ont été observés pour la souche la plus productrice d’EPS (RW-9595M) en coculture. La construction de réseaux de co-expression de gènes a révélé des corrélations communes entre l’expression de gènes liée aux opérons EPS, le métabolisme du sucre et le stress au cours de la production des EPS et la croissance des trois souches. Les propriétés des BI montrent que le mélange PL/SB c’est un produit riche en protéines, composés phénoliques, fibre alimentaire et polysaccharides solubles dont la quantité est rehaussée en présence de la levure principalement pour les souches ATCC 9595 et R0011. En général, les produits fermentés ont une teneur en composés phénoliques (TPC) liée et une activité antioxydante supérieure au SBNF. Cette différence est plus accentuée en monoculture par rapport à la coculture dans les différents BI. Le TPC total et l'activité antioxydante étaient 30% et 21% plus élevés en monoculture pour le BI obtenu avecRW-9595M par rapport à SBNF. Après la digestion in vitro, la bioaccessibilité des acides phénoliques totaux libres a été améliorée de plus de 40 % dans les BI par rapport au SBNF. Par la fermentation, on observe un enrichissemment en acide caféique libre hautement bioaccessible (superieur à 75%) dans les BI résultant de l’action des bactéries lactiques, ce qui n’a jamais été publié dans la littérature. Les BI obtenus en coculture par les souches RW-9595M et R0011 montrent un contenu significativement plus élevé en acides phénoliques liés qui diminuent lors de la digestion in vitro par rapport à la monoulture. Nos résultats donnent un aperçu de l’influence positive de l’interaction bactérie lactique-levure sur la stimulation
IV
de la biosynthèse des EPS et les propriétés bioactives du PL/SB fermenté, ce qui représente un progrès important dans la mise au point d’un procédé pour l’obtention d’un bio-ingrédient avec de vastes applications industrielles.
V
Abstract
Whey permeate (PL) and wheat bran (SB) are by-products from the dairy and cereal industries that are highly available and used for animal feed or spreading. In a circular economy, sustainable and innovative bio-ingredients can be produced through the valorization of food by-products to be able to respond to the demand for health products from consumers. In addition, fermentation is an alternative to biological recycling to increase the availability of bioactive compounds from SB and to produce exopolysaccharides from PL. In this context, the objective of this study is to obtain a bio-ingredient (BI) rich in polysaccharides and bioactive compounds by fermentation of the mixture of PL / SB by three strains of Lacticaseibacillus
rhamnosus R0011, ATCC 9595 and RW-9595M in monoculture or in coculture with Saccharomyces cerevisiae. Initially, the
experiments aimed at evaluating the effect of coculture on the production of exopolysaccharides (EPS) by the L. rhamnosus strains in PL. The growth of mono and coculture s in liquid medium was followed by the microbiological account (CFU / mL), the viability (PMA-qPCR), consumption of the substrate consumption (lactose) and the production of metabolite productions (lactic acid and EPS) during 48 h without pH control. Transcriptomic analysis by RT-qPCR was used to determine the relative expression of genes in coculture compared to monoculture during fermentation. In total 34 genes linked to the EPS operon, sugar metabolism, stress and the environment were targeted. To obtain the bio-ingredient, the PL / SB mixture was fermented in solid medium by the bacterial strains in mono and coculture. The progress of the fermentation progress was followed by microbiological account (CFU / g), by the consumption of lactose consumption, by the monitoring of acidification, the determination of soluble protein determinations, by rheology and by scanning electron microscopy. At the end, the fermented medium was lyophilized to obtain the BI. The composition of BI composition, the content of water-soluble polysaccharides content (WSP) which include EPS, the antioxidant capacity and the in vitro bioaccessibility of total phenolic compounds and phenolic acids were compared with unfermented wheat bran (UFWB). In PL, after 48 hours, the results revealed that EPS production was improved by 39%, 49% and 42% in coculture for R0011, ATCC 9595 and RW-9595M, respectively. Higher EPS operon expression rates were observed for the more EPS-producing strain (RW-9595M) in coculture. The construction of gene co-expression networks has revealed common correlations between gene expression linked to EPS operons, sugar metabolism and stress during the production of EPS production and the growth of the three strains. The properties of BI properties show that the fermented SB/PL mixture is rich in protein, phenolic compounds, dietary fiber and soluble polysaccharides, the amount of which is enhanced in the presence of yeast mainly for ATCC 9595 and R0011. In general, fermented products have a content of bound phenolic compounds (TPC) and an antioxidant activity greater than UFWB. This difference is more accentuated in monoculture compared to coculture in for different BI. Total TPC and antioxidant activity were 30% and 21% higher in monoculture for BI obtained from RW-9595M compared to UFWB. After in vitro digestion, the bioaccessibility of total free phenolic acids was improved by more than 40% in BI compared to UFWB. Through fermentation, we observe an enrichment in highly bioaccessible free caffeic acid (superior than 75%) in BI resulting from the action of lactic acid bacteria, which was not reported before in the literature. The BI obtained in coculture with RW-9595M and R0011 have a significantly higher content of bound phenolic acids which decrease during in vitro digestion compared to monoculture. Our results provide an overview of the positive influence of the lactic acid bacteria-yeast interaction on the stimulation of EPS biosynthesis and the bioactive properties of fermented PL / SB, which represents major progress in the development of a process for obtaining a bio-ingredient with wide industrial applications.
VI
Table des matières
Résumé ... iii
Abstract ... v
Liste des Figures ... viii
Chapitre 1 ... viii
Chapitre 2 ... viii
Chapitre 3 ... ix
Chapitre 4 ... ix
Liste des tableaux... xi
Chapitre 2 ... xi
Chapitre 3 ... xi
Annexes ... xi
Liste des abréviations ... xii
Remerciements ... xiv
Avant-propos ... xvi
Introduction ... 1
Chapitre 1. Revue de littérature ... 3
1.1. Les co-produits de l’industrie alimentaire une source de composés bioactifs ... 3
1.2. La fermentation et la biodisponibilité des nutriments ... 4
1.2.1. Monoculture et coculture ... 7
1.2.2. Fermentation en milieu solide et liquide (submergé)... 7
1.3. Perméat de lactosérum (PL) ... 8
1.3.1. Définition, composition et disponibilité ... 8
1.4. Son de blé ... 9
1.4.1. Définition, composition et disponibilité ... 9
1.5. Produits obtenus à partir de la fermentation du perméat de lactosérum ou du son de blé ... 10
1.6. Exopolysaccharides produit par les bactéries lactiques ... 11
1.7. Exopolysaccharides produits par Lacticaseibacillus rhamnosus ... 12
1.8. Utilisation des exopolysaccharides... 13
1.8.1. Industrie alimentaire ... 13
1.8.2. Aspects santé des EPS ... 13
1.8.3. Biosynthèse des EPS ... 15
1.8.4. Gènes impliqués dans la biosynthèse des EPS de L. rhamnosus RW-9595M ... 16
1.8.5. Gènes impliqués dans la résistance bactérienne au stress acide ... 18
1.9. Bio-ingrédients obtenus par fermentation du son de blé ... 19
1.9.1. La fibre alimentaire... 20
1.9.3. L’acide phytique ... 21
1.9.4. Les composés phénoliques ... 22
1.10. Utilisation des cocultures de levures-bactéries lactiques ... 25
1.11 Hypothèse et objectifs ... 28
Chapitre 2 ... 30
Resumé ... 30
Abstract: ... 31
2.1. Introduction... 32
2.2. Materials and methods ... 33
2.2.1. Strains and media ... 33
2.2.2. Mono- and coculture fermentation experiments ... 33
2.2.3. Monitoring of bacterial growth ... 34
2.2.4. Monitoring of sugar consumption and metabolite production ... 35
2.2.5. Relative gene expression ... 36
2.2.6. Statistical analyses ... 38
2.3. Results ... 38
2.3.1. Coculture of Lactobacillus rhamnosus strains and Saccharomyces cerevisiae ... 39
VII
c) Effect of coculture on exopolysaccharide (EPS) production ... 40
2.3.2. Analysis of relative gene expression in coculture ... 41
2.3.3. Gene co-expression networks ... 46
2.4. Discussion ... 48 2.5. Conclusions ... 51 Chapitre 3 ... 53 Resumé ... 53 Abstract ... 54 3.1. Introduction... 55
3.2. Materials and Methods ... 56
3.2.1. Bacteria and Culture Conditions ... 56
3.2.2. Fermentation ... 57
3.2.3. Monitoring of bacterial growth and pH determination ... 57
3.2.4. Viscosity Analysis ... 57
3.2.5. Scanning electron microscopy ... 57
3.2.6. Analysis of bioingredients and digested samples ... 58
3.2.7. In vitro simulation of digestion ... 58
3.2.8. Chemical analysis... 59
3.2.9. Determination of water-soluble polysaccharides (WSP) ... 59
3.2.10. Extraction and separation of free and bound fractions of phenolic compounds ... 60
3.2.11. Determination of total phenolic content (TPC) ... 60
3.2.12. Oxygen radical scavenging capacity (ORAC) assay... 60
3.2.13. Profiling of phenolic acids ... 61
3.3. Statistical Analyses ... 61
3.4. Results ... 61
3.4.1 Growth and metabolite production during fermentation of WB/WP ... 61
3.4.2. Viscosity of the fermented WB/WP mixtures ... 62
3.4.3. Chemical composition of bioingredients before and after digestion ... 64
3.4.4. Impact of fermentation and in vitro digestion on bioactive compounds and antioxidant activity 66 3.5. Discussion ... 73
3.5.1 Growth and metabolite production during fermentation of WB/WP ... 73
3.5.2. Composition of bioingredients before and after in vitro digestion ... 73
3.5.3. Impact of fermentation and in vitro digestion on bioactive compounds and antioxidant activity 74 3.6. Conclusions ... 77
3.7. Supplementary material ... 78
Discussion génerale ... 80
4.1. Objectif 1. Évaluer l’effet de la coculture sur la production d’exopolysaccharides (EPS) des bactéries lactiques en coculture avec la levure de boulangerie en condition de stress acide. ... 80
4.2. Objectif 2 Obtention d’un bio-ingrédient avec des propriétés bioactives (riche en fibre alimentaire, et polyphénols (antioxydants) au biais de la fermentation en solide du perméat de lactosérum (PL) et du son de blé (SB) par des bactéries lactiques et des levures. ... 82
4.3. Objectif 3 : Évaluation de l’effet du type de culture (mono et coculture) sur la bioaccessibilité et récupération des composés phénoliques (antioxydants) après digestion in vitro des bio-ingrédients. .... 85
Conclusions générales ... 87
Références ... 89
VIII
Liste des Figures
Chapitre 1
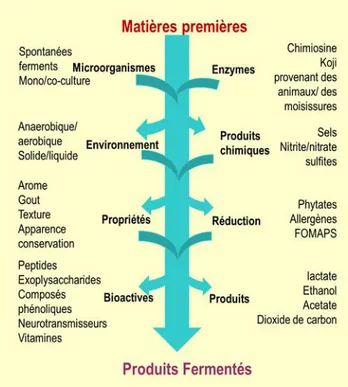
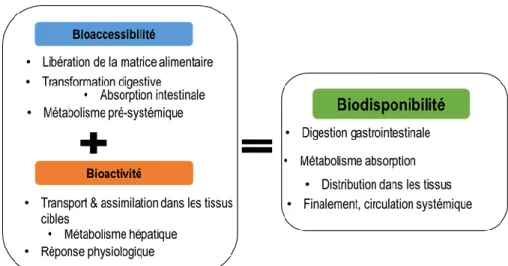
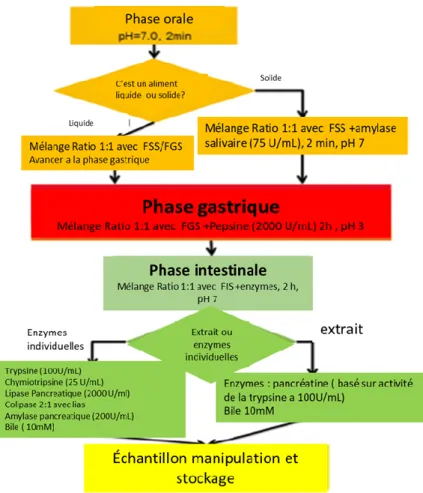
Figure 1. 1 Vue d’ensemble de la transformation des matières premières des produits fermentés (adapté de Marco et al. 2017) ... 4 Figure 1. 2 Événemment qui sont reliés à la biodisponibilité des composants des aliments (Thekur et al., 2020) 5 Figure 1. 3 Diagramme de la méthode de digestion InfoGest avec le fluide qui simule la salive (FSS), les fluid es gastriques (FGS) et les fluides intestinaux (FIS) (Adapté de Mineskus et al., 2014) ... 6 Figure 1. 4 Fractions du blé (adapté de Onipe et al., 2015) ... 9 Figure 1. 5 Produits pouvant être obtenus à partir du lactosérum et du perméat de lactosérum (adapté de Mollea et al.
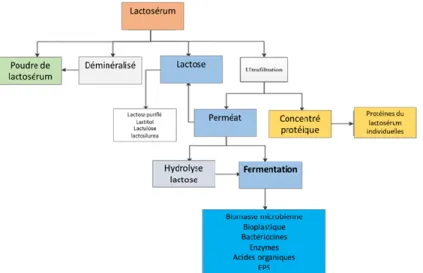
2013) ... 10 Figure 1. 6 Produits pouvant être obtenus à partir du son de blé (l‘auteure, 2020) ... 11 Figure 1. 7 Structure de la sous-unité répétée composant les EPS de Lacticaseibacillus rhamnosus RW-9595M, ATCC
9595 et R0011 (Van Calsteren et al., 2002). ... 13 Figure 1.8 Schèma général de différentes voies de conversion de sucres (lactose, galactose, glucose et rhamnose) et la
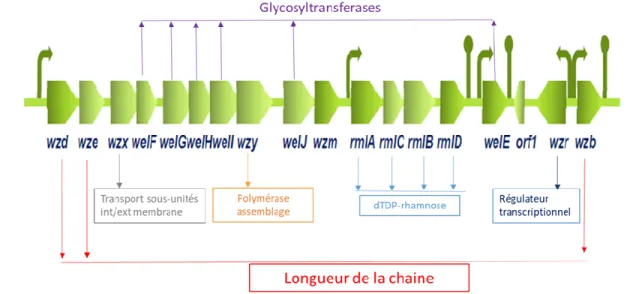
production des EPS par les bactéries lactiques (modifié de Welman and Maddox, 2003; BIO CYC, 2015). ... 16 Figure 1. 9 Organisation et fonction des groupes de gènes impliqués dans la biosynthèse des EPS chez
Lacticaseibacillus rhamnosus RW-9595M, ATCC 9595, R0011 et RW-6541M (Peant et al.; 2005)... 17
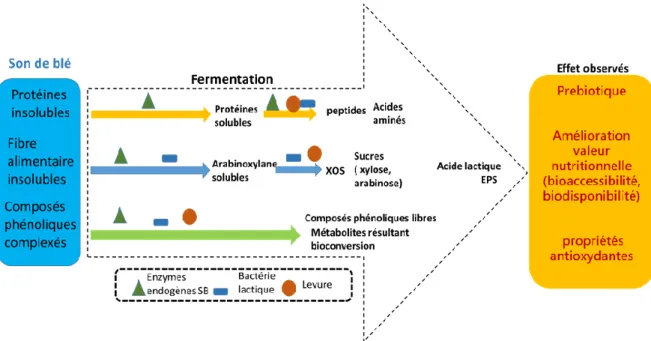
Figure 1. 10 Effets observés sur les principaux composants du son de blé par les enzymes endogènes, l’action
microbienne par des bactéries lactiques et les levures pendant la fermentation (l’auteure, 2020) ... 20 Figure 1. 11 Schema général de la bioabsortion des composes phénoliques libres et liés provenant des aliments riches
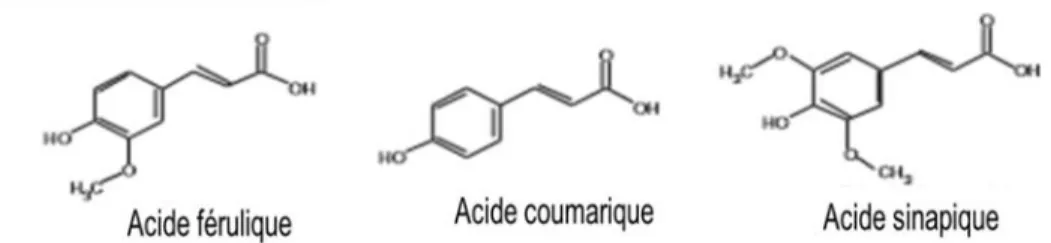
en fibre alimentaire adaptée de Palafox-Carlos et al. (2011). ... 23 Figure 1. 12 Structure des principales acides hydroxycinamiques du son de blé (Anson et al., 2012) ... 23 Figure 1. 13 Localisation de l’acide férulique dans le réseau de arabinoxylane du son de blé (adapté de Anson et al.,
2012) ... 24 Chapitre 2
Figure 2. 1.Growth of L. rhamnosus strains in mono (●; solid line) and coculture (--○--; dashed line) with S. cerevisiae (Δ). The cell concentrations were determined by viable cultivable counts expressed as CFU/mL (A, D, G), total cell counts by qPCR (■; solid line) and viable cell count by PMA-qPCR (--□--; dashed line) expressed as cells/mL for mono (B, E, H) and coculture (C, F, I) by Lactobacillus rhamnosus R0011 (A, B, C), ATCC 9595 (D, E, F) and RW-9595M (G, H, I), respectively. The values are the average of triplicate fermentations and error bars represent the standard error. ... 39 Figure 2. 2. Lactose consumption (Δ▲), lactic acid (□■) and exopolysaccharide (○●) production by L. rhamnosus R0011
(A, D); ATCC 9595 (B, E) and RW-9595M (C, F) in mono (solid symbols) and coculture (open symbols). The values are the average of three fermentations and the bars represent the standard error. ... 40 Figure 2. 3.Principal component analysis (PCA) on the basis of growth, viability, pH, sugar consumption, lactic acid and
exopolysaccharide production for L. rhamnosus R0011 (A); ATCC 9595 (B) and RW-9595M (C). Log CFU = viable cultivable counts in CFU/mL, log qPCR = total counts by qPCR and log PMA-qPCR = by PMA-qPCR in viable cells/mL; lactose, LA = lactic acid; pH and exopolysaccharides = EPS. ... 41 Figure 2. 4. Heat map representation of the ratio of relative gene expression involved in carbohydrate catabolism, EPS
operons, amino acid biosynthesis, lipid metabolism (cellular membrane, stress and cellular response) and other functions (microbial metabolism in diverse environments) over time (left to right 6, 9, 12, 15, 24 h) for L. rhamnosus strains R0011 (A); ATCC 9595 (B) and RW-9595M (C)... 42
IX
Figure 2. 5. Co-expression gene network of L. rhamnosus strains R0011 (1); ATCC 9595 (2) and RW-9595M (3) obtained using Cytoscape 3.4. The illustrated genes had a significant (P<0.05) strong correlation (correlation index > 0.8). The largest nodes (circle size) are those with the high level of degree. In the above Figure, the blue nodes had higher values of Betweenness Centrality (BC) and the orange nodes had lower BC values. Non-continuous traits show a co-expression pattern found for the three strains of L. rhamnosus R0011, ATCC 9595 M and RW-9595M.. 47 Chapitre 3
Figure 3. 1 Growth (A-C), pH (D-F), Lactose consumption (○, ●) ; Lactic acid production (Δ, ▲) (G-I) and soluble protein (J-L) change during fermentation by Lactobacillus rhamnosus R0011 in A,D,G,J; ATCC 9595 in B,E,H,K and RW-9595M in C,F,I L in mono (black) or coculture (gray) with the yeast S. cerevisiae. ... 62 Figure 3. 2 Scanning electron micrograph of wheat bran (WB) fermented 24 h using the EPS producing L. rhamnosus RW-9595M and S. cerevisiae. In panel A) the surface of unfermented wheat bran (WB and B) the surfaces of fermented wheat bran (WBF) covered by material resembling microorganisms and EPS by appearance. In the panels a higher magnification of the bacterial cells of L. rhamnosus RW-9595M (C and D), L. rhamnosus ATCC 9595 (E and F) or L.
rhamnosus R0011 (G and H) and EPS in mono and coculture are observed on the wheat bran fermented surface.
... 63 Figure 3. 3 Water soluble polysaccharide (WSP) content of bioingredients obtained in mono or coculture by the strains of
Lactobacillus rhamnosus R0011, ATCC 9595 and RW-9595M. Data with different letters in the same column are
significantly different (P<0.05) The data are the means of three independent experiments ± standard deviations (n = 3). ... 65 Figure 3. 4 A) Biplot of the results of the discriminant analysis of total (free and bound) phenolic content (TPC) and antioxidant activity (ORAC total) of bioingredients and digested samples. The B) Comparison of the percentage of TPC and C) antioxidant activity recovered (unabsorbed) in the bioingredients and unfermented sample (BWB). Data with different letters in the same column are significantly different (P<0.05) The data are the means of three independent experiments ± standard deviations (n = 3). ... 68 Figure 3. 5 Biplot of the results of the discriminant analysis (DA) of (A) free phenolic acid content of bio-products and digested samples (FS) (B) % bioaccessibility of free total phenolic acids (absorbed)* (C) % bioaccessibility of individual free phenolic acids* and (D) bi-plot of the results of DA of bioaccessibility in bio-products *Data with different letters in the same column are significantly different (P<0.05) The data are the means of three independent experiments ± standard deviations (n = 3)... 71 Figure 3. 6 (A) Biplot of the results of the discriminant analysis of bound phenolic acids (B) % of total phenolic acids recovered in DS (C) % bound individual phenolic acids recovered (unabsorbed) in DS (D) Biplot of the results of the discriminant analysis of the % of phenolic acids recovered (unabsorbed) in DS. Data with different letters in the same column are significantly different (P<0.05) The data are the means of three independent experiments ± standard deviations (n = 3)... 72 Figure 3.S. 1.The viscosity flow curve for a) the fermented substrates or the unfermented wheat bran (WB) in 24h. ………...……….………79 Figure 3.S. 2. A) Microbial growth of RW-9595M (□ ■) vs apparent viscosity (pa.s) (●○) at constant shear rate (100 s-1) after 24 h incubation in monoculture ... 80 Figure 3.S. 3. Heat map representation of free amino acid content of bioingredients and unfermented BWB substrate. .. 80 Chapitre 4
Figure 4. 1 Schéma des étapes de l’étape de l’étude de l’effect de la coculture ou monoculture sur la production d’EPS80 Figure 4. 2 Possibles interactions (co-expression) entre les gènes de différents groupes fonctionnels. les gènes qui ont été significativement surexprimés (p<0,05) en coculture (couleur rouge) par rapport au contrôle (monoculture). les gènes en couleur noire sont ceux qui en plus des autres sont fortement co-exprimés (indice corrélation >0,8 et significatifs p<0,05) avec un ou plusieurs gènes des souches de lactobacillus rhamnosus a) R0011 b) ATCC 9595 et c) RW-9595M. ... 81 Figure 4. 3 Schéma des étapes d’obtention des bio-ingrédients à partir du recyclage biologique du son de blé et du perméat de lactosérum. ... 83 Figure 4. 4 Schema des acides phénoliques présents dans les bio-ingrédients et leur effet potentiel sur la santé ... 86
X
Annexes
Figure S. 1. Affiche a présenté au Forum Techno Novalait 2018 l’affiche : Rehaussement de la production
d’exopolysaccharides par des souches de Lactobacillus rhamnosus en coculture avec Saccharomyces cerevisiae. ... 97 Figure 2.S. 1. Change in pH of medium fermented by Lactobacillus rhamnosus R0011, ATCC 9595 and RW-9595M in
mono and co culture fermentation……….103
Figure 2.S. 2. Acetic acid produced by Lactobacillus rhamnosus R0011, ATCC 9595 and RW-9595M in mono (M) and coculture (C) at 24 and 48h of fermentation.. ... 104
XI
Liste des tableaux
Chapitre 2
Table 2. 1.Relative expression ratio (RER) of genes involved in carbohydrate catabolism, EPS operons, amino acid biosynthesis and lipid metabolism, stress and cellular responses and other functions (microbial metabolism in diverse environments) of L. rhamnosus R0011 over 24 h during growth in whey permeate in coculture with S. cerevisiae. 43 Table 2. 2. Relative expression ratio (RER) of genes involved in the carbohydrate catabolism, EPS operon, amino acid biosynthesis and lipid metabolism, stress and cellular responses and other functions (microbial metabolism in diverse environments) of L. rhamnosus ATCC 9595 over 24h during growth in whey permeate in coculture with S. cerevisiae ... 44 Table 2. 3. Relative expression ratio (RER) of genes involved in the carbohydrate catabolism, EPS operon, amino acid biosynthesis and lipid metabolism, stress and cellular responses and other functions (microbial metabolism in diverse environments) of L. rhamnosus RW-9595M over 24h during growth in whey permeate in coculture with S. cerevisiae . ... 45 Chapitre 3
Table 3. 1 Bioprocessing combinations of the wheat bran/whey permeate (WB/WP) mixture and strains* to obtain the fermented bioingredients and in vitro product of digestion ... 58 Table 3. 2 Chemical composition (%DM) of bioingredients and control unfermented wheat bran (NFWB) ... 64 Table 3. 3 Composition of digested bioingredients and unfermented mixture of wheat bran and whey permeate (NFWB).
... 66 Table 3. 4 Total phenolic content (TPC) and antioxidant activity (ORAC) of bioingredients (A) and the digested samples (B)
... 67 Table 3. 5 Profile of free and bound phenolic acids of bioingredients and digested samples ... 70 Annexes
Table 2S.1 .Primer set used for the QPCR and PMA-QPCR for Lactobacillus strains ... 98 Table 2S.2 .Gene targets and parameters for RT-QPCR analysis by Taqman for strains of L.rhamnosus and the assessment of specificity towards L.rhamnosus strains and S.cerevisiae. ... 99 Table 2S.3 .Reference genes identified by the software Genorm for each time point of the fermentation for the three strains of Lactobacillus rhamnosus. ... 101 Table 2S.4 .Changes in the profile of phenolic acids by Lactobacillus rhamnosus R0011, ATCC 9595 and RW-9595M in mono and coculture during 48h of fermentation. ... 102
XII
Liste des abréviations
ACP ; PCA : analyse en composantes principales, principal component analysis ADN ; DNA : acide désoxyribonucléique. Desoxyribonucleic acid
ADNc ; cDNA : ADN complémentaire ; complementary DNA ADNr ; rDNA : ADN ribosomal ; ribosomal DNA
ANOVA : analyse de variance ; analysis of variance ARN ; RNA : acide ribonucléique ; ribonucleic acid ARNr; rRNA: ARN ribosomal; ribosomal RNA
ATCC : Collection de cultures types américaines ; American type culture collection EPS= Exopolysaccharide AX : arabinoxylane
AXOS : arabinoxyloligosaccharides XOS : xylololigosaccahrides CLS: corn liquor steep
DBO: demande biologique en oxygène LAB: bactéries lactiques; lactic acid bacteria PL : Perméat de lactosérum
MRS : Milieu De Man-Rogosa-Sharpe ; De Man-Rogosa-Sharpe broth PCR : réaction de polymérisation en chaîne ; polymerase chain reaction PMA : propidium monoazide
qPCR : PCR quantitative ; quantitative PCR
ORAC : Oxygen Radical Absorbance Capacity ou Capacité d'absorption des radicaux libres RIN : RNA Integrity Number
RT-qPCR : reverse transcription quantitative PCR SD : écart type ; standard deviation
SB; WB : Son de blé; wheat bran
SBNF ; UFWB: Son de blé non fermenté ; unfermented wheat bran UFC ; CFU : unité formatrice de colonie ; colony-forming unit YE: yeast extract
XIII
Ne retiens jamais ta flèche si l’unique chose qui te paralyse est la peur de manquer ta cible. Si tu ne prends pas de risques, tu ne sauras jamais quels changements tu devais mettre en œuvre. Chaque flèche laisse une trace dans ton cœur et c’est la somme des flèches qui fera de toi un meilleur tireur. (La voie de l’archer de Paolo Coello).
XIV
Remerciements
Pour commencer, je tiens à remercier ma directrice de recherche, la professeure Dr Gisèle LaPointe de m’avoir acuelli au Doctorat à l’ULaval au premier instant que je l’ai contactée. Ces longues années ont été très enrichissantes à vos côtés, merci pour m’avoir permis de vivre l’expérience d’enseignante au Québec au cours à distance de Microbiologie. Merci pour vos commentaires si pertinents et la patience de m’accompagner et de m’encourager jusqu’à la date.
En même temps je veux remercier le professeur Dr Denis Roy, mon co-directeur, d’avoir été le moteur des changements, des avancements de ma vie d’étudiante au doctorat puis ensuite du passage au monde professionnel québécois. Je n’oublierai pas vos conseils car ils m’ont permis d’être à la bonne place aujourd’hui.
À Audrey Riviere pour avoir transmis ses connaissances sans tabou, sans mystère, avec précision et rigueur sur le sujet de l’extraction de l’ARN, l’ADN, l’analyse de l’expression relative des gènes et la détermination de la viabilité des souches. Ta contribution a été clé pour réussir le changement d’orientation de mon sujet de thèse. Merci! À Mérilie Gagnon, pour être toujours souriante, prête à aider tout le monde; Alexandre Kennang, merci pour les discussions enrichissantes, pour m’aider à maitriser des outils qui m’ont permis d’optimiser l’analyse des mes données. Aux différents stagiaires Alex Vilbert, Karine Lariche, Alison Tozy, Celine Du et Sana Hmida qui tout au long des années m’ont accompagné dans la construction de cette œuvre. Marie Verheyde, un grand merci pour le grand ouvrage, la bonne compagnie lors des fermentations. Donatien Kabore ton stage au labo nous a permis de partager des expériences de vie et de découvrir le Burkina Faso. Je remercie le personnel du laboratoire INAF tel que Pascal Dubé, Véronique Richard, Patricia Savard, Diane Gagnon et Jacinthe Thibodeau pour leur assistance technique tout au long des différentes étapes de cette étude.
Je veux également remercier les organismes Novalait (bourse Danielle Rivard, 2017), l’Association des femmes diplômées des universités du Québec (AFDU Québec) – la faculté de Sciences de l’agriculture et l’alimentation de l’Ulaval (bourse 2015) et RECY-QUEBEC (bourse d’études supérieures, 2014) de m’avoir octroyé des bourses qui m’ont encouragé dans ma vie d’étudiante.
À Cillian Breatnach, Boris Marioni, Mathieu Persico et Emilie Desfossé-Foucault pour votre précieuse aide dans la correction de mon anglais et français, merci !
Aussi, Jose Luis Martinez, merci pour ton amitié, les discussions sérieuses de politique et le partage au labo. Carolina Rodriguez Daza, un grand merci pour être a mes côtés avec la solidarité Colombie-Venezuela, pour partager des bons moments, pour m’aider dans les moments difficiles, tu as été la meilleure voisine au bureau! Ana Sofia Larqué merci pour ta solidarité, ta spontanéité mexicaine! Monica Gil, mon amie, de nombreux rêves ont été discutés à la cafét.ria, des projets pour offrir des produits biotechnologiques au monde. La recherche de stabilité et d’indépendance dans notre nouveau pays.
XV
Je te remercie de ton aide, ta compagnie et de tes conseils dans les moments difficiles, je sais qu’un jour on va se rencontrer entre Victoria (BC) et Saint-Hyacinthe (Qc).
Pour ma gang vénézuélienne : Yelitza merci pour nous accueillir lors de notre arrivé en 2012. Camilche y Marion, merci de nous aider à nous préparer pour affronter l’hiver et mes débuts à l’ULaval. Roysbel, Marjorie, Zhandra et Placida merci de partager vos expériences, de nous intégrer dans les rencontres vénézuéliennes, mais aussi pour nous encourager dans les périodes difficiles, merci pour votre amitié! Son lo mejor de la ville!
À notre famille au Québec los compadritos Patricia y Daniel, avec Daniella y Toto, notre compagnie dans notre parcours venezoquébéco-canadien. À Gloria y Eder, nos frères adoptifs au Québec, merci pour votre amitié, votre appui inconditionnel. Vos parcours de vie personelle et professionnelle sont un grand exemple pour nous!
À Hazel, Lenis, Gianclaudio, Deokie y Miguel merci de votre confiance, pour me rappeler ce que j’étais capable de faire à l’UCV et me motiver à continuer cette aventure! Pour votre amitié sans frontières et distance (por creer en mi siempre, por su amistad aun en la distancia!)
À mes parents Antonio et Carmen Alicia, pour votre exemple, votre amour et pour votre positivisme. À Carolina, Antonio y Vanessa merci, pour former cette famille extra belle, pour continuer à maintenir l’union malgré la distance (gracias pour permanecer unidos, a todos los quiero mucho!) ♥.
Et à Heliosi mon compagnon d'aventure, d'amour, de cette folie: faire un doctorat dans la quarantaine et en mode émigration, merci de me suivre, d'avoir enduré tant d'instabilité étudiante, de m'écouter, de me donner la force d'avancer, je t’aime!♥♥
Askita, mon amie canine je te remercie ta compagnie, la tendresse de tes yeux, ta pacience, ton amour inconditionel et une tonne de beaux souvenirs, mon cœur sera toujours avec toi † ♥♥
XVI
Avant-propos
Ce manuscrit est composé de quatre chapitres. Le premier chapitre est une revue de la littérature pertinente sur la valorisation des coproduits (le perméat de lactosérum et le son de blé) dans les procédés de fabrication de produits fermentés comme l’obtention des exopolysacharides (EPS) par des bactéries lactiques et des bio-ingrédients avec des propriétés bioactives. Ce chapitre décrit aussi l'hypothèse de recherche, l'objectif principal de ce projet de doctorat et les objectifs spécifiques visés lors de la réalisation de cette thèse.
Cette thèse est présentée principalement sous forme d'articles scientifiques rédigés en anglais destinés à la publication dans des périodiques avec comité de lecture. Les chapitres correspondants (chapitres 2 et 3) sont précédés d'un résumé en français. Le chapitre 2, intitulé Enhanced exopolysaccharide production by Lactobacillus rhamnosus in coculture with
Saccharomyces cerevisiae a été publié dans le journal Appl. Sci. 2019, 9(19), 4026. Il décrit l'effet sur la production
d’exopolysaccharides de trois souches de Lacticaseibacillus rhamnosus en coculture avec la levure de boulangerie. La comparaison entre la mono- et la coculture est évaluée de façon intégrale lors de la fermentation (croissance, viabilité, consommation du substrat, production de métabolites) et l’analyse transcriptomique de l’expression relative des gènes concernés. En lien avec ce sujet la doctorante a présenté au Forum Techno Novalait 2018 l’affiche : Rehaussement de la production d’exopolysaccharides par des souches de Lactobacillus rhamnosus en coculture avec Saccharomyces
cerevisiae.
Le chapitre 3, intitulé « Fermentation of wheat bran and whey permeate by mono-cultures of Lacticaseibacillus rhamnosus strains and co-culture with yeast increases bioactive properties» a été a été publié dans le Journal Frontiers in Bioengineering and Biotechnology 2020, 8:956. Cet article décrit l’obtention de bio-ingrédients avec des propriétés bioactives par la fermentation d'un mélange de perméat de son de blé et de lactosérum (WB / WP) par chacune des trois souches de L. rhamnosus (R0011, ATCC 9595 et RW-9595M) capables de produire le même exopolysaccharide en monoculture ou en coculture avec S. cerevisiae; l’étude permet de voir l'influence du type de culture sur la composition chimique du bio-ingrédient et d’évaluer la teneur en composés phénoliques totaux libres et liés, l'activité antioxydante et le profil des acides phénoliques dans les bioproduits. Enfin, les bioproduits ont été soumis à une digestion in vitro afin de relier les propriétés à la bioaccessibilité et à la récupération des composés phénoliques.
Le chapitre 4 est dédié à une discussion et une conclusion générale pour l'ensemble du projet. Les limites de cette thèse et les perspectives de recherche y sont aussi décrites. Ce projet de doctorat a été effectué sous la direction de Gisèle LaPointe et la codirection de Denis Roy dans le cadre d’un projet Novalait et les Fonds de recherche du Québec – Nature et Technologie (FRQNT). La candidate a été récipiendaire de différentes bourses qui ont également contribué à la réalisation de ce projet: bourse Novalait Danielle Rivard (2017), bourse octroyée par l’Association des femmes diplômées des universités de Québec (AFDU Québec) – la faculté de Sciences de l’agriculture et l’alimentation de l’Ulaval (2015) et bourse d’études supérieures de RECY-QUEBEC (2014).
XVII
Tout au long du projet, la majorité des expériences au laboratoire ont été réalisées par la candidate au doctorat Annalisse Bertsch Socorro, même si plusieurs stagiaires ont contribué. La candidate a aussi rédigé la première version de tous les manuscrits et a conçu tous les Tableaux et les Figures. La directrice de thèse, Mme Gisèle LaPointe, a été la principale conceptrice du projet et a grandement contribué à l'interprétation des résultats et à la révision des manuscrits, tout comme M. Denis Roy, le codirecteur.
Tout au long des chapitres on adoptera la nouvelle classification taxonomique proposée en mars 2020 par Zheng et al, (2020) pour nommer les souches des bactéries lactiques utilisées dans les expriences: Lacticaseibacillus rhamnosus. Des exceptions seront faites lors de la publication réalisée avant cette date (chapitre 2) dans laquelle on utilisera le nom de
1
Introduction
Dans les dernières années, la forte forte demande d’aliments riches en fibres et composés bioactifs de la part des consommateurs a conduit l’industrie agroalimentaire au déploiement de stratégies afin de développer de nouveaux produits qui puissent répondre à ce besoin. Dans ce contexte, les coproduits ou les résidus alimentaires générés dans les processus de fabrication de nombreux produits alimentaires deviennent une source d'éléments nutritifs. Dans le cas de l’industrie laitière et céréalière, deux co-produits se démarquent : le perméat de lactosérum et le son de blé. Le premier est issu de l’opération d’ultrafiltration du lait lors de la fabrication de fromage et du yogourt grec et il est riche en lactose, en sels minéraux et en acide lactique (Prazeres et al., 2012). Le son de blé, quant à lui, représente 10-16% du grain de blé et il est récupéré comme coproduit lors de la mouture du grain pour l’obtention de la farine et il est riche en fibres, en protéines et en composés phénoliques (Anson et al. 2012). Ces deux co-produits sont le plus souvent utilisés comme aliments pour les animaux, pour le compost, ou ils sont simplement jetés sans prendre en compte leur charge contaminante pour l’environnement. En quête d’alternatives pour valoriser ces co-produits, la fermentation apparait comme une solution qui répond à la problématique environnemmentale. Les changements en composition et en propriétés fonctionnelles, sensorielles et nutritionnelles des co-produits agroalimentaires fermentés sont clés dans le développement de nouveaux bio-ingrédients naturels et santé.
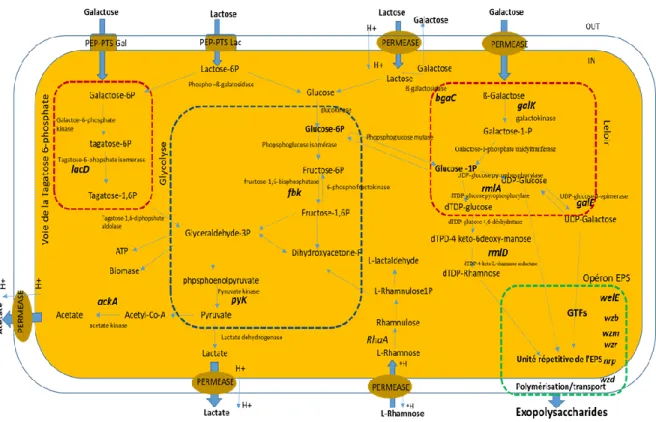
La production d’exopolysaccharides (EPS) avec des avantages reconnus pour la santé (prébiotique et immunomodulation), par des bactéries lactiques est une alternative intéressante de valorisation, mais leur production est limitée par de faibles rendements. Le PL peut être utilisé par les souches de Lacticaseibacillus rhamnosus R0011, ATCC 9595 et RW-9595M pour produire différentes quantités du même exopolysaccharides (EPS) (Van Calsteren et al., 2002). La souche RW-9595M est la plus productive de ces trois souches, avec 543 mg / L d'EPS sans contrôle du pH et entre 1611-2775 mg / L dans les fermenteurs utilisant du perméat de lactosérum comme milieu de culture à pH contrôlé (Macedo et al., 2002; Bergmaier
et al., 2003). Dans l’optique de l’amélioration des processus, différents auteurs ont signalé un effet positif sur la production
des métabolites, en particulier les bactériocines et les EPS, par la coculture entre les bactéries lactiques (LAB) et les levures (Cheirsilp et al. 2003). La coculture permet la coexistence de plusieurs microorganismes qui agissent ensemble dans la production du produit final comme le kéfir, le kimchi, le cacao et le levain (Smid et Lacroix, 2013). Cependant, les mécanismes moléculaires liés aux interactions microbiennes bactérie lactique-levure et leurs influences sur la biosynthèse des EPS ne sont pas encore élucidés. La construction des réseaux de co-expression de gènes en lien avec le métabolisme des sucres, du stress, la composition de la membrane celullaires et de l’opéron EPS peut donc contribuer à l’avancement des connaissances sur la production d’EPS.
Pour aborder l’amélioration des faibles rendements en EPS signalés précédemment, la coculture a été combinée avec la réalisation de fermentations en milieu solide avec le mélange son de blé et PL (SB/PL). Ceci est un procédé simple pour la production d’un bio-ingrédient riche en polysaccharides. Cette étude révèle que, pendant la fermentation, l'action des enzymes endogènes et bactériennes du son résultent en l’amélioration de la teneur totale en phénols. L’effet de la mono
2
ou coculture entre des souches de L. rhamnosus productrices d’EPS et la levure Saccharomces cerevisiae sur la composition du produit se manifeste principalement sur les acides phénoliques libres et liés ou de la teneur en polysaccharides hydrosolubles. Toutefois, la bioaccessibilité des acides phénoliques libres doit être vérifiée par un modèle de digestion in vitro, tout comme la récupération de la fraction insoluble des composés phénoliques liés qui pourrait atteindre le côlon. Ces composés insolubles pourraient devenir des substrats potentiels pour le microbiote, ce qui peut entraîner la production de métabolites avec une plus grande activité biologique (Valdes et al., 2015). En outre, les composés phénoliques peuvent altérer la composition du microbiote intestinal en favorisant la croissance des microorganismes bénéfiques qui à leur tour vont améliorer la biodisponibilité des composés phénoliques liés (Ozdal et al., 2016). Cependant, il existe peu d'informations sur la bioaccessibilité et les propriétés antioxydantes des composés bioactifs présents dans les ingrédients obtenus à partir de son de blé fermenté en coculture face à la monooculture. Dans ce contexte, les objectifs de cette étude sont d’évaluer l’effet de la coculture bactéries lactiques-levure de boulangerie sur l’expression relative des gènes en lien avec la production d’exopolysaccharides (EPS) bactérienne; sur la composition et la quantité des polysaccharides tout comme sur la bioaccessibilité des composés bioactifs du bio-ingrédient (BI) obtenu par la fermentation en milieu solide du mélange de PL/SB.
Une synthèse bibliographique sur la fermentation, la coculture, l’utilisation des co-produits comme le PL et le son de blé, les souches productrices d’EPS comme Lacticaseibacillus rhamnosus, la biosynthèse des produits comme les exopolysaccharides; le son de blé et ces composants fermentés sera exposée dans la prochaine partie de ce document, suivi par l’hypothèse, les trois grands axes de recherche et par les résultats. Nous terminerons cette thèse par la discussion générale, les conclusions et les perspectives.
3
Chapitre 1. Revue de littérature
1.1. Les co-produits de l’industrie alimentaire une source de composés bioactifs
L’Organisation mondiale de la Santé (OMS) a qualifié d’épidémie l’augmentation de l’obésité et les problèmes de poids. L’obésité est une accumulation de masse adipeuse dans le corps qui peut causer des effets nocifs pour la santé comme le syndrome métabolique, l’hypertension, le diabète type 2, les maladies cardiovasculaires, l'arthrose et certains types de cancer. En 2018, 63% des Canadiens de 18 ans et plus ont déclaré avoir une taille et un poids qui les classaient dans la catégorie des personnes obèses ou avec embonpoint (Statistique Canada, 2020). L’obésité a une étiologie multifactorielle qui comprend la prédisposition génétique, une diète de faible qualité, une consommation excédentaire en calories, la résistance à l’insuline ou l’inflammation systémique (Qing et Vatsala, 2015).
Heureusement, la plupart des maladies dégénératives peuvent être prévenues ou retardées par l’alimentation. L’Organisation Mondiale de la Santé (OMS) recommande donc à la population de consommer davantage de fruits, de légumes, de légumineuses, de céréales complètes et de fruits secs, en raison de leur teneur en fibres alimentaires et composés bioactifs qui agissent comme antioxydants dans nos cellules (Coman et Vodnar, 2019). Le défi de l’industrie alimentaire est de développer de nouveaux ingrédients alimentaires ou de nouvelles sources d’ingrédients bioactifs qui répondent aux besoins de la population.
Les processus de fabrication de nombreux produits alimentaires génèrent des co-produits ou des résidus alimentaires contenant une part considérable d'éléments nutritifs. Les déchets ou co-produits alimentaires réfèrent le plus souvent aux parties comestibles des produits destinés à la consommation humaine qui ont plutôt été jetées, perdues ou dégradées, et n'inclut pas les portions non comestibles ou indésirables des aliments (Bharat Helkar et Sahoo, 2016). Globalement, les pertes alimentaires comprennent tous les aliments comestibles jetés au cours de la chaîne d'approvisionnement, tandis que les déchets sont des résidus de charge organique élevée, éliminés lors de la transformation des matières premières en denrées alimentaires. Le terme «co-produit ou sous-produit » est de plus en plus utilisé et identifie les déchets qui peuvent devenir des substrats à valoriser. La valorisation est définie comme la post-transformation optimale des co-produits afin d’obtenir des nouveaux produits finis à valeur ajoutée (Banaszewska et al., 2014). La valorisation de co-produits contribue à l’écoefficacité des procédés et permet d’augmenter la compétitivé de l’entreprise dans le marché. Les co-produits alimentaires contiennent des composants hautement nutritionnels et fonctionnels, comme les polysaccharides, les vitamines, les minéraux, les fibres alimentaires et les composés bioactifs comme les flavonoïdes et le lycopène. Les sous-produits conservent des propriétés fonctionnelles comme la capacité de rétention d'eau, de gélification et d’épaississement (Verni et al., 2019).
Différentes approches sont utilisées pour la valorisation des co-produits: des traitements physiques (principalement la réduction de taille des particules, l’extrusion, la distillation et l’extraction des composés d’intérêts) ou des traitements biologiques comme la fermentation.
4
1.2. La fermentation et la biodisponibilité des nutriments
La fermentation est le processus par lequel les microorganismes ou des enzymes transforment des nutriments, synthétisent des métabolites secondaires et complètent d’autres activités physiologiques dans des conditions aérobies ou anaérobies (Chen et al., 2013). Il s’agit d’une technique ancestrale à l’origine des processus utilisés dans l’industrie pharmaceutique, énergétique, environnementale et des aliments pour animaux et humains.
Dans l’industrie agroalimentaire, les aliments et les boissons fermentés sont produits via la croissance microbienne contrôlée et la conversion enzymatique des macros et micro nutriments des aliments (Marco et al., 2017). La fermentation (Figure 1.1) permet la conservation des aliments à travers la formation de métabolites inhibiteurs de la croissance microbienne comme les acides organiques (acide lactique, acétique, formique et propionique), l’éthanol et les bactériocines). Elle est un moyen de renforcer la sécurité alimentaire par l’inhibition des pathogènes ou la dégradation de composés toxiques. De plus, les propriétés sensorielles ou nutritionnelles des produits alimentaires peuvent être améliorées (Bourdichon et al., 2012; Smid et Lacroix, 2013).
Figure 1. 1 Vue d’ensemble de la transformation des matières premières des produits fermentés (adapté de Marco et al. 2017)
Les produits fermentés peuvent avoir plusieurs bienfaits sur la santé tant au niveau immunitaire (effet sur les allergies), cognitif, intestinal, cardiovasculaire (diminution du taux de cholestérol) et nutritionnel par l’amélioration de la biodisponibilité des nutriments (Asghar. et al., 2017; Chilton et al., 2015; Marco et al., 2017). La biodisponibilité se définit comme la fraction
5
du composant ingéré disponible sur le site d’action pour une utilisation dans des fonctions physiologiques normales et est déterminée par des essais in vivo (Guerra et al., 2012). Elle se divise en trois étapes principales: la digestibilité et solubilité de l'élément dans le système gastro-intestinal, l'absorption de l'élément par les cellules intestinales et son transport et son incorporation à la circulation jusqu’à l'entité fonctionnelle ou cible (Etcheverry et al., 2012).
Selon Alegría et al., (2015) la biodisponibilité se divise aussi en deux concepts : la bioaccessibilité et la bioactivité (Figure 1.2) . La bioaccessibilité a été définie comme la fraction d’un composé qui est libéré de sa matrice alimentaire dans le tractus gastro-intestinal et devient ainsi disponible pour l'absorption intestinale (généralement analysé à partir de procédures in vitro). Cela inclut la séquence d'événements qui se produit pendant la digestion des aliments pour la transformation dans du matériel potentiellement bioaccessible, mais exclut l'absorption / l'assimilation par le tissu épithélial et le métabolisme présystémique (intestinal et hépatique). La bioaccessibilité est en fait le premier facteur limitant à la biodisponibilité (Coda et al., 2014; Thakur et al., 2020).
Figure 1. 2 Événemment qui sont reliés à la biodisponibilité des composants des aliments (Thekur et al., 2020)
Les méthodes d’analyses statiques (également appelées méthodes biochimiques) comprennent deux ou trois étapes de digestion (orale, gastrique et intestinale) dont les produits restent en grande partie immobiles dans un seul bioréacteur statique. Ces méthodes simulent un nombre limité de paramètres physiologiques de la digestion (comme la température, les enzymes, le pH, la composition chimique) et ne peuvent pas simuler les processus physiques comme le cisaillement, le mélange, l'hydratation, les changements des conditions au fil du temps ou le péristaltisme. Les systèmes statiques sont utilisés pour évaluer la bioaccessibilité, et peuvent être utilisés pour établir les tendances de bioaccessibilité relative en comparant la solubilité d'un composant dans différents aliments ou comme outil de dépistage ou de catégorisation (Alegría
et al., 2015). Le protocole statique standardisé de simulation de la digestion dans le tractus gastro-intestinal supérieur
publié par InfoGest ( Figure 1.3) est le fruit de plus de deux ans de travail impliquant des discussions approfondies entre des scientifiques appartenant à un large éventail de disciplines pertinentes afin de faciliter l’analyse des résultats (Minekus
6
Figure 1. 3 Diagramme de la méthode de digestion InfoGest avec le fluide qui simule la salive (FSS), les fluides gastriques (FGS) et les fluides intestinaux (FIS) (Adapté de Mineskus et al., 2014)
La bioactivité comprend des événements liés à la façon dont le nutriment ou le composé bioactif est transporté et atteint le tissu cible, son interaction avec les biomolécules, le métabolisme ou la biotransformation qu'il peut subir, la génération de biomarqueurs et les réponses physiologiques induites (Alegría et al., 2015). Les composés bioactifs sont des molécules qui possèdent des propriétés biologiques actives, par exemple les oméga-3 ou les antioxydants (MAPAQ, 2019). Dans ce même contexte, selon Hur et al., (2014) les antioxydants sont des molécules qui inhibent l'oxydation d'autres molécules, et ils sont largement utilisés dans les compléments alimentaires. Des taux élevés de radicaux libres (tels que les radicaux superoxydes ou hydroxyles), comme les espèces réactives de l'oxygène (ERO), dans notre corps sont nuisibles parce qu'ils réagissent facilement avec d'autres molécules des cellules et causent des dommages aux macromolécules biologiques (lipides, protéines, ADN et ARN). Ils peuvent entraîner des lésions tissulaires et initier une chaîne d'événements résultant dans le développement ou à la progression de plusieurs maladies (Rahbar Saadat et al., 2019). L'activité antioxydante est la capacité totale des antioxydants à éliminer les radicaux libres dans la cellule et dans les aliments.
L’amélioration de la biodisponibilité des nutriments des co-produits par la fermentation implique aussi l’établissement du procédé à suivre pour l’obtention du produit final. À ce niveau, il faut déterminer le type de culture à utiliser : monoculture
7
vs coculture (choix des souches, ratio inoculum) et la fermentation en milieu liquide vs milieu solide (composition milieu) tout comme les paramètres de température, de pH ou d’agitation.
1.2.1. Monoculture et coculture
Les fermentations peuvent être réalisées en utilisant un microorganisme unique (monoculture ou culture pure) comme agent de transformation du milieu de culture, ce qui est le cas lors de la production de biomasse pour la culture des probiotiques. Dans d’autres cas comme la production des aliments fermentés, le processus peut dépendre de la combinaison de plusieurs microorganismes (coculture ou culture mixte), lesquels agissent en concert pour produire les caractéristiques désirées dans le produit final (Smid et Lacroix, 2013). Les cocultures peuvent accomplir des activités plus complexes (versatilité) et elles tolèrent davantage les fluctuations de l’environnement (robustesse) que les monocultures. La versatilité et robustesse peuvent s’expliquer par la communication / symbiose entre les membres de la coculture qui peuvent ainsi s’échanger des métabolites ou des signaux moléculaires (Smid et Lacroix, 2013). Chaque cellule individuelle répond alors à la présence des autres souches dans la coculture. La seconde caractéristique clé est la division du travail entre les membres de la coculture qui permettent ainsi l’obtention des caractéristiques du produit final qui ne peuvent être expliquées que par la combinaison des métabolismes des individus constitutifs ou des sous-populations (Bader et al., 2010).
1.2.2. Fermentation en milieu solide et liquide (submergé)
La fermentation en milieu solide (FMS) fait référence au processus qui comprend une matrice solide contenant des nutriments à un taux d’humidité élevé pour supporter la croissance microbienne. C’est un système composé par une phase gazeuse continue, une pellicule liquide et une phase solide. Le substrat peut être divisé en deux catégories: le support inerte et le support nutritionnel. Le support inerte est un matériel poreux, chimiquement inerte et qui ne peut pas être dégradé par l’action microbienne (mousse de polyuréthane, résine macroporeuse, perlite ou vermiculite) à l’inverse du support nutritionnel (un fromage, la pâte des levains ou le pain, produits céréaliers comme le tourteau de soya ou le son de blé) qui lui peut subir l’action des microorganismes (Chen et al., 2013). Le type de support utilisé dans l’agroalimentaire est à la fois une source de carbone, d’azote ou des facteurs de croissance pour les microorganismes.
Chen et al. (2013) ont démontré que la fermentation en milieu solide a un taux d’humidité entre 12-80%, généralement 60%. La faible teneur d’eau dans la matrice est une contrainte pour les microorganismes qui doivent absorber les nutriments à partir du substrat solide par diffusion. La productivité du processus est élevée, mais hétérogène (Abu Yazid et al., 2017). La fermentation submergée ou liquide (FL), quant à elle, a un taux d’humidité supérieur à 95% avec un milieu composé principalement d’eau. Le milieu de culture est une phase continue liquide qui permet le mélange et dissolution homogène des nutriments et microorganismes sans restriction (Marco et al., 2017). La FL permet d’obtenir à la fin de la fermentation des produits qui doivent être concentré avant l’extraction ou séchage-lyophilisation par rapport à la FMS. La matrice solide
8
résultant de la FMS permet de façon simple le transport des nombreux microorganismes au tractus gastro-intestinal en promouvant la survie à long terme des microorganismes pendant la distribution et stockage de l’aliment (Marco et al., 2017).
La valorisation par la fermentation permet le recyclage biologique des co-produits et déchets alimentaires et la production de produits à haute valeur ajoutée, le but étant d’utiliser le co-produit comme additif alimentaire. Ceci permet de réduire les déchets et d’améliorer l’écoefficacité et la rentabilité industrielle. Cette approche naturelle permet aussi de répondre aux exigences des consommateurs préoccupés par la présence d’agents de conservation chimiques dans leurs aliments et qui recherchent des alternatives naturelles (Iriondo-DeHond et al., 2018). Dans cette étude, les co-produits de l’industrie laitière et céréalière seront utilisés dans le milieu de culture afin d’obtenir un bio-ingrédient dans un contexte de valorisation.
1.3. Perméat de lactosérum (PL)
1.3.1. Définition, composition et disponibilité
La consommation de fromage et yogourt par habitant au Canada a été de 4,2 et 2,5 kilogrammes avec une production de 510 000 et 388 000 Tonnes métriques en 2018, respectivement (Centre canadien d’information laitière, 2019). Dans les dernières années, le marché des yogourts a été en augmentation surtout avec la venue de la catégorie du yogourt grec (Chandan et Kilara, 2013).
La fabrication de ces deux types de produits laitiers génère du lactosérum et/ou du perméat de lactosérum qui sont des co-produits de l’industrie laitière. Approximativement 50% de la production mondiale de lactosérum provenant du fromage est traitée et transformée en divers produits destinés à l'alimentation humaine et animale. Environ la moitié de cette quantité est utilisée directement sous forme liquide, 30% sous forme de lactosérum en poudre, 15% sous forme de lactose et ses dérivés et le reste sous forme de concentrés de protéines de lactosérum (Mollea et al., 2013). L’ultrafiltration est utilisée pour concentrer les protéines du lactosérum ou du lait, par exemple pour produire du yogourt grec. Cette opération génère un co-produit liquide appelé perméat de lactosérum (PL) qui contient du lactose (80%); des sels minéraux et de l’acide lactique (Prazeres et al., 2012). Avec l’égouttage ou la centrifugation, le coproduit obtenu est connu sous le nom de lactosérum acide, car il contient aussi les protéines solubles, le lactate et une fraction majeure de calcium. Pour réussir la concentration du lait de 9% à 21-23% de matière sèche dans le yogourt, le processus rejette 75-80% de lactosérum généralement acide (Chandan and Kilara, 2013). Ces liquides sont hautement contaminants à cause de la présence importante de lactose (Parashar et al., 2016).
Les effluents de l’industrie laitière ont une charge organique biodégradable relativement élevée. La matière organique est causée par la présence des glucides et des protéines du lait (lactose et caséine). Les lipides (0,1-10,6 kg / m3) les solides
en suspension (0,1-22 kg / m3) et les nutriments (N et P) contribuent aussi au niveau de contamination (Prazeres et al., 2012). Les déchets provenant de l’industrie des produits laitiers représentent 20,6% (264.972 Tonnes/an) des résidus
9
organiques provenant de la province de Québec (Solinov, 2013). À l’échelle mondiale, la fabrication de fromage devrait avoir une croissance de 1,2 % par an et atteindre 21 millions de tonnes d'ici 2028 (OCDE-FAO, 2019) laissant présager les quantités importantes de perméat de lactosérum qui seront disponibles.
Au Québec, les usines de yogourt n’ont actuellement pas les équipements pour traiter le perméat ou le lactosérum produits pendant la fabrication du yogourt grec. Par conséquent, de nouvelles approches doivent être considérées pour revaloriser ce sous-produit. En effet, le lactosérum est utilisé la plupart du temps en alimentation animale ou en épandage sur les terres (Solinov, 2013). Une des alternatives possible est l’obtention de différents bioproduits par fermentation microbienne du lactosérum ou du perméat de lactosérum (Guimarães et al., 2010).
1.4. Son de blé
1.4.1. Définition, composition et disponibilité
La consommation de blé devrait s’accroître à l’échelle mondiale d’ici 2028 pour atteindre environ 330 millions de tonnes et continuera d’être destinée principalement à l’alimentation humaine (OCDE-FAO, 2019). Le son de blé constitue la fraction du grain de blé enveloppant l’amande farineuse et se compose de couches très fines récupérées lors de la mouture du grain pour l’obtention de la farine (Figure 1.4) : le péricarpe, le tégument séminal (testa), la bande hyaline et l’aleurone (cette dernière représente le 50% du son). Celui-ci représente 10-16% du grain de blé (Anson et al., 2012). En 2018, si la production de blé de mouture a été de 3 190 000 tonnes métriques au Canada, alors entre 319 000 et 510 000 tonnes métriques de son de blé ont été générées (Statistique Canada, 2019).
Figure 1. 4 Fractions du blé (adapté de Onipe et al., 2015)
Le son de blé est principalement composé de glucides (64,5 %), de protéines (15,5 %), de cendres ( 5,8 %) et de lipides (4,3 %) pour environ 90,1% de solides totaux (Balandrán-Quintana et al., 2015). Le son contient des protéines dans les
10
cellules de l’aleurone qui ont des structures chimiques différentes des glutines et gliadines présentes dans la farine de blé raffinée. Ce sont principalement des albumines et des globulines (Arte et al., 2015). Les glucides du son de blé sont complexes et contiennent des fibres alimentaires solubles et insolubles (Nordlund et al., 2013). Les polysaccharides non amidonnés principaux sont l’arabino-xylane (70%), la cellulose (24%) et les bêta-glucanes (6%) (Stevenson et al., 2012). En outre, le son contient des molécules bioactives qui ont des activités antioxydantes et antiinflammatoires comme l’acide phytique (2180-5220mg/100g), les composés phénoliques comme l’acide férulique (500-1500 mg/100g), les alkyl résorcinols (220-400 mg/100g) et la vitamine E (1,4 mg/100g) (Mateo et al., 2012).
1.5. Produits obtenus à partir de la fermentation du perméat de lactosérum ou du son de blé
Dans le contexte du recyclage biologique, le lactosérum et le lactose sont utilisés comme matière première du milieu de culture pour la fermentation afin d’obtenir des produits à valeur ajoutée (Prazeres et al., 2012). Par ailleurs, la fermentation permet de réduire la teneur en lactose, entraînant une diminution de la DBO et des coûts associés (Kilara and Patel, 1992). La littérature contient une panoplie d’alternatives d’utilisation du lactosérum ou du perméat provenant de l’industrie laitière. Le lactose peut être utilisé directement par des micro-organismes consommateurs de lactose ou, alternativement, des solutions de lactose préhydrolysées peuvent être utilisées comme substrat par les microorganismes (Guimarães et al., 2010). Il existe aussi des procédés (Figure 1.5) qui permettent l’obtention de la biomasse microbienne, des boissons et des bioproduits comme l’éthanol, l’enzyme lactase, de l’hydrogène, des acides acétique, propionique et lactique (Bergmaier et
al., 2003). Ce dernier est particulièrement intéressant, car c’est la matière première pour produire de l’acide polylactique
ou polyhydroxybutirate des composés biodégradables. Parmi ces bioproduits figurent également le biogaz (méthane), les enzymes (β-galactosidase et polygalactorunase) et d’autres composés comme le lactate d'ammonium,le butanol et le glycérol (Prazeres et al., 2012; Kargi and Uzunçar, 2013).
Figure 1. 5 Produits pouvant être obtenus à partir du lactosérum et du perméat de lactosérum (adapté de Mollea et al. 2013)
Des procédés sont déjà établis commercialement pour produire de l’éthanol (Guimarães et al., 2010; Parashar et al., 2016). Par contre, l’utilisation de coculture est peu répandue. Au cours des années 2000, le lactosérum ou le perméat de
11
lactosérum ont été employés pour produire des exopolysaccharides microbiens (Figure 15) par des bactéries lactiques ou des probiotiques (Bergmaier et al., 2003; Macedo et al., 2002).
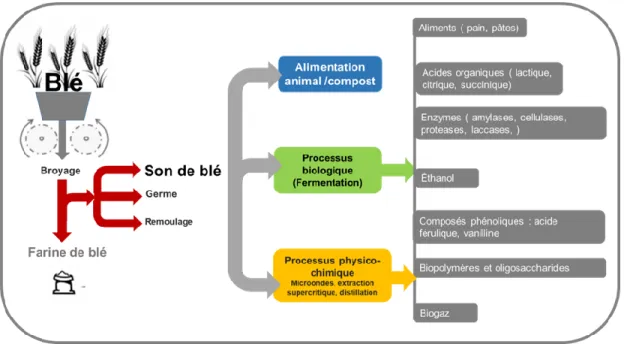
Le son de blé a été utilisé traditionnellement comme un supplément dans la formulation des aliments et comme une source de fibres alimentaires et de composés bioactifs. L’utilisation du son de blé a été limitée dans l’alimentation humaine parce qu’il peut exacerber les désordres gastro-intestinaux, par son fort goût amer et par la diminution des caractéristiques de qualité des produits comme la texture, l’extension et le volume de la pâte tout comme la couleur. Le cycle d’emploi du son de blé peut suivre différentes voies (Figure 1.6) dont le moyen le plus courant pour les éliminer est de l’utiliser comme aliment pour les animaux ou pour le compost. Cependant, pour alléger la charge environnementale et économique de ces pertes, différentes approches ont été explorées. L’une d’entre elles est la bioraffinerie afin de produire des biocarburants tels que l'éthanol et l’acide lactique, l’acide polyacide, les enzymes ou la vanilline, entre autres (ElMekawy et al., 2013; Prückler et al., 2015).
Figure 1. 6 Produits pouvant être obtenus à partir du son de blé (l‘auteure, 2020)
Le processus biotechnologique offre une variété d’outils pour modifier les matrices de céréales comme le son de blé pour obtenir des enzymes, des acides organiques, du biogaz, du bioéthanol, des antioxydants, des polysaccharides, des oligosaccharides et des aliments ou bio-ingrédients fonctionnels (Coda et al., 2019). Comme mentionné précédemment, le PL et le son de blé sont des coproduits qui, en raison de leur composition et de leur disponibilité, ont été ciblés dans cette étude comme substrats pour produire un bio-ingrédient riche en exopolysaccharides microbiens par un processus biologique.
12
Les bactéries lactiques (BL) sont les principales bactéries utilisées dans les fermentations alimentaires dans le monde. Ces bactéries sont utilisées comme probiotiques et ferments dans les produits laitiers, végétaux et carnés et représentent un marché avec une croissance estimée à 7% annuellement (de Vos, 2011). Les BL sont divisés en plusieurs genres comprenant, entre autres, Lactobacillus (actuellement comprends Leuconostoc selon la nouvelle clasification taxonomique proposé par Zheng et al., 2020), Lactococcus, Streptococcus,, Pediococcus et Enterococcus. Les bactéries lactiques peuvent produire un certain nombre de métabolites bioactifs pendant la fermentation comme des bactériocines, des amines biogènes, des peptides bioactifs et des exopolysaccharides.
En général, les exopolysaccharides (EPS) sont des polymères composés de longues chaînes d’unités répétitives de sucres simples et/ou de dérivés de glucides plus ou moins ramifiés excrétés par les cellules microbiennes (Ruas-Madiedo et al., 2002). Les EPS produits par les BL peuvent être associés par des liaisons covalentes à la cellule et l´enrober en forme de capsule ou être relâchés directement dans le milieu environnant (Rahbar Saadat et al., 2019). La production des EPS par les bactéries en général n´est pas liée à son utilisation comme source d´énergie, mais à une fonction de protection dans l´environnement naturel contre la dessiccation, la phagocytose et la prédation par les protozoaires, l´attaque des bactériophages, les antibiotiques, les composés toxiques, les bactériocines et le stress osmotique (Ruas-Madiedo et al., 2002; De Vuyst et al., 2001). Ils jouent un rôle important dans l´adhésion initiale et l´ancrage ferme des bactéries aux surfaces solides, la formation des biofilms, la séquestration des cations, la reconnaissance cellulaire et la pathogenicité (Patel et al., 2012).
Les EPS produits par les bactéries lactiques peuvent être des homopolysaccharides (des chaines composées par un seul type de sucre) ou des hétéropolysaccharides (HEPS) composés par quelques centaines ou plusieurs milliers d´unités répétitives de différents sucres comme le galactose, le glucose et le rhamnose (Lynch et al., 2018b). Ils peuvent contenir des composés non sucrés (organiques ou inorganiques) tels que des groupes phosphate, acetyl et pyruvate (Ruas-Madiedo
et al., 2002; Salazar et al., 2016 ;Van Calsteren et al., 2002).
1.7. Exopolysaccharides produits par Lacticaseibacillus rhamnosus
Lacticaseibacillus rhamnosus est une bactérie lactique entrant dans la fabrication de différents produits alimentaires,
notamment pour la production de fromage (comme flore secondaire) et de yogourt (comme probiotique) (Rioux, 2009). La souche L. rhamnosus RW-9595M provient de la collection de cultures du laboratoire de Génomique microbienne de l'Institut sur la nutrition et des aliments fonctionnels (INAF) de l'Université Laval (Sainte Foy, Québec, Canada). C’est une souche qui a été isolée à partir de sous-culture de L. rhamnosus ATCC-9595 (Manassas, VA, USA) (Dupont et al., 2000). La souche
L. rhamnosus RW-9595M est la BL productrice d'EPS la plus performante caractérisée à ce jour (environ 400 mg/L dans
le lait (Dupont et al., 2000) et 2767 mg/l dans un milieu synthétique, sous contrôle de pH (Macedo et al., 2002). La souche
L. rhamnosus ATCC 9595 produit une quantité beaucoup plus limitée d'EPS (116 mg/l dans un milieu synthétique). La