HAL Id: tel-00864198
https://tel.archives-ouvertes.fr/tel-00864198
Submitted on 20 Sep 2013HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Etude de l’applicabilité des échantillonneurs passifs
POCIS et Chemcatcher pour le suivi des pesticides en
milieux aquatiques.
Imtiaz Ibrahim
To cite this version:
Imtiaz Ibrahim. Etude de l’applicabilité des échantillonneurs passifs POCIS et Chemcatcher pour le suivi des pesticides en milieux aquatiques.. Autre. Ecole Nationale Supérieure des Mines de Saint-Etienne, 2013. Français. �NNT : 2013EMSE0692�. �tel-00864198�
NNT : 2013 EMSE 0692
THÈSE
présentée par
Imtiaz IBRAHIM
pour obtenir le grade de
Docteur de l’École Nationale Supérieure des Mines de Saint-Étienne
Spécialité :
SCIENCES ET GENIE DE L'ENVIRONNEMENT
Etude de l’applicabilité des échantillonneurs passifs POCIS et
Chemcatcher pour le suivi des pesticides en milieux aquatiques
Soutenue à Alès, le 06 juin 2013
Membres du jury
Président :
Pierre DOUMENQ
Professeur Laboratoire Chimie
Environnement, Aix-Marseille
Rapporteurs :
Richard GREENWOOD
Serge CHIRON
Professeur, Université de Portsmouth
Directeur de Recherche, Université de
Montpellier
Examinateur(s) :
Cécile MIEGE
Pierre DOUMENQ
Ingénieure de Recherche IRSTEA, Lyon
Professeur Laboratoire Chimie
Environnement, Aix-Marseille
Directeur(s) de
thèse :
Catherine GONZALEZ
Anne TOGOLA
Professeur, Ecole des Mines d’Alès
Chercheur, BRGM, Orléans
Valérie LAFOREST
Maitre de recherche, Ecole des Mines St
Etienne
REMERCIEMENTS
J’adresse ma profonde reconnaissance à mon directeur de thèse, Madame le Professeur Catherine Gonzalez (EMA), et Madame Anne Togola, Ingénieur Chercheur au BRMG, et co-encadrant principal de ce travail, de m’avoir fait l’honneur de m’accorder leur confiance, d’avoir supervisé avec rigueur mon travail de thèse, de m’avoir prodigué de précieux conseils.
Je tiens à remercier Madame Valerie Laforest, Maitre de recherche à l’Ecole nationale supérieure des Mines de St-Etienne (ENSM) et codirectrice de cette thèse, de m’avoir donné ma chance et de m’accorder sa confiance.
Je tiens à remercier Monsieur Miguel Lopez Ferber, directeur du laboratoire de Génie de l’environnement et de l’industrie (LGEI) de l’école des mines d’Alès (EMA), et Madame Laurence Amalric, responsable de l’unité de recherche « Chimie environnemental » au sein du département « Division des Laboratoires » du Bureau de recherche géologique et minière (BRGM), de m’avoir accueilli au sein de leur laboratoire.
J’exprime mes sincères remerciements à Monsieur Richard Greenwood et Monsieur Serge Chiron pour l’honneur qu’ils m’ont fait en acceptant d’être rapporteurs de mon manuscrit et pour la compréhension et les efforts qu’ils ont consentis. Je souhaite également adresser mes profonds remerciements à Madame Cécile Miège, Ingénieure de Recherche à l’IRSTEA, et à Monsieur le Professeur Pierre Doumenq, Professeur à l’université d’Aix Marseille, pour accepter de juger mon travail et de participer au jury de ma soutenance. Un grand merci à tous mes collègues de travail pour leur soutien et leur sympathie. Je citerai particulièrement Madame Sylvie Spinelli, technicienne supérieur à l’EMA, son aide très précieuse apportée tout au long de ce travail m’a permis d’apprendre énormément, mais aussi à travers ses qualités humaines, d’évoluer dans un environnement de travail très agréable. J’adresse également mes sincères remerciements à Madame Charlotte Coureau, technicienne au BRGM, pour ses conseils, son aide, son soutien technique et de son investissement en temps pour l’avancée de mes travaux.
Mes vifs remerciements à Murielle, Aziza, Yao, Christine, Guillaume, Liming, Thibault, Sébastien, Benjamin, Catherine, Jean-Philippe, Abdelatif, pour leur bonne humeur, leur disponibilité et surtout leur compréhension et leur aide de tous les instants. Une attention toute particulière à Madame Ingrid Bazin et Monsieur Majid El-Mossaoui pour leurs encouragements et leur soutien quotidien depuis mon arrivée aux laboratoires de l’EMA et du BRGM.
Merci aux membres du groupe BRL qui m’ont apporté un soutien technique sur les nombreuses campagnes d’échantillonnage, et d’avoir contribuer efficacement pour faciliter mon travail. Comment pourrais-je conclure autrement ces premières lignes qu’en adressant mes plus sincères remerciements à ma famille auprès de qui j’ai trouvé un soutien sans mesure. A ce titre, je souhaiterais dédier une pensée à mes parents et ma grande sœur, qui ont toujours répondu présents, et plus particulièrement mon épouse, qui a fait preuve d’une grande patience et qui a été d’un grand secours moral en toutes situations. Un grand merci à mes amis Eghere, Shirine et Mohamed, pour leur soutient et encouragements durant ces trois longues années.
Cette thèse a entièrement bénéficié des supports financiers de l’école des mines d’Alès et de l’institut Carnot (BRGM), qu’ils trouvent ici le témoignage de ma reconnaissance.
TABLE DES MATIERES
INTRODUCTION ...1
SYNTHESE BIBLIOGRAPHIQUE ...5
I -Composés phytopharmaceutiques ...5
I.1 : Définitions ...5
I.2 : Classification des pesticides ...5
a .Classification en fonction des organismes cibles ...5
b .Classification chimique ...6
I.3 : Lien activité/chimie ...6
I.4 : Consommation des pesticides ...8
I.5 : Effets écotoxicologiques et impacts sanitaires ...12
a .Impact sanitaire ...12
b .Impact environnemental ...13
I.6 : Réglementations des pesticides dans les masses d’eau ...14
a . Réglementations environnementales ...14
b . Réglementations sanitaires ...16
I.7 : Etat des lieux ...16
a .Suivi des pesticides dans les cours d’eau ...17
b . Suivi dans les eaux souterraines ...18
I.8 : Techniques d’analyses : méthodes d’extraction et instrumentations ...24
a .Méthodes d’extraction ...24
b .Les techniques d’analyse ...25
II -Surveillance de la qualité de l’eau ...28
II.1 : Stratégies et techniques d’échantillonnage classiques ...28
II.2 : Introduction à l’échantillonnage passif ...30
II.3 : Principe, théorie et modélisation ...30
a .Généralités ...30
b . L’échantillonnage en mode « équilibre » ...35
c . Échantillonnage en mode intégratif ...36
II.4 : Catégories d’échantillonneurs ...37
a . Échantillonneurs passifs pour polluants organiques apolaires ...37
b . Échantillonneurs passifs pour des polluants organiques polaires ...40
II.5 : Méthodologies de calibration ...47
a . Généralités ...47
b . Facteurs influençant la diffusion ...49
c . Méthode des corrections des Rs lab ...51
MATERIEL ET METHODES ...55
I.1 : Sélection des pesticides ...55
I.2 : Choix des échantillonneurs ...57
I.3 : Produits étalons et matériel ...57
II - Instruments analytiques ...58
II.1 : Méthodes instrumentales (HPLC-MS/MS) ...60
II.2 : Méthode instrumentale (UPLC-MS/MS) ...62
III - Validation en laboratoire des échantillonneurs sélectionnés ...68
III.1 : Calibration des Chemcatcher en laboratoire ...68
a . Sélection de la phase réceptrice ...68
b .Calibration échelle pilote en milieu renouvelé ...72
c . Calibration en milieu non-renouvelé (mode batch) ...76
III.2 : Calibration des POCIS en laboratoire ...79
a . Calibration échelle pilote en flux continu ...79
IV - VALIDATION IN-SITU ...84
IV.1 : Calibration en eau de surface : Essais canal BRL ...84
a . Description du site expérimental ...84
b . Démarche expérimentale ...85
IV.2 : Exercice d’inter-comparaison des échantillonneurs passifs ...86
a . Contexte ...86
b . Description des sites et des campagnes d’échantillonnage ...87
V - Applications environnementales ...90
V.1 : Diagnostic des cours d’eau : Guyane française (DOM) ...90
a . Contexte de l’étude ...90
b . Description des sites ...93
c . Exposition des échantillonneurs passifs ...93
d . Traitement des échantillons et analyses ...96
V.2 : Distribution spatiale et évolution temporelle des pesticides dans la nappe alluviale de l’Ariège. ...96
a . Contexte de l’étude ...96
b . Description des sites d’étude ...99
c . Exposition des échantillonneurs ... 100
d . Traitement des échantillons et analyses ... 101
V.3 : Distribution spatiale des pesticides dans le Lez ... 101
a . Contexte de l’étude ... 101
b . Description des sites d’étude ... 105
c . Exposition des échantillonneurs ... 106
d . Traitement des échantillons et analyses ... 108
e . Caractéristiques générales de l’eau sur les points d’exposition ... 109
Résultat et discussion : validation des outils ... 111
I.1 : Chemcatcher ... 111
a . Sélection de la phase réceptrice ... 111
b . Calibration échelle pilote en milieu renouvelé ... 115
c . Calibration en milieu non-renouvelé ... 125
I.2 : POCIS ... 130
a . Calibration échelle pilote en milieu renouvelé ... 130
I.3 : Comparaison des taux d’échantillonnage POCIS et Chemcatcher pour les pesticides ... 141
II -Validation in-situ ... 142
II.1 : Calibration en eau de surface : Essais canal BRL ... 142
a . Propriétés physico-chimiques de l’eau ... 142
b . Présence des pesticides dans l’eau ... 143
c . Accumulation des pesticides ... 144
d .Taux d’échantillonnage in-situ des pesticides calculés pour les POCIS ... 149
e .Taux d’échantillonnage in-situ des pesticides calculés pour les Chemcatcher ... 150
f . Conclusion ... 151
II.2 : Exercice d’inter-comparaison des échantillonneurs passifs ... 151
a . Cas de la Charente, eau de surface ... 151
b . Cas de l’étang de Thau : eau marine ... 155
II.3 : Approche d’une méthode d’extrapolation Rs Lab/Rs in-situ ... 160
a . Principe de l’approche ... 160
b . Méthodes de calcul ... 161
c . Résultats ... 164
d . Conclusion ... 165
II.4 : Validation des Rs in-situ calculés ... 168
a . Validation en eau de surface ... 168
b .Validation en eau souterraine ... 173
c . Conclusion ... 176
RESULTAT ET DISCUSSION : APPLICATIONS ENVIRONNEMENTALES... 177
I - Analyse qualitative et potentiel des échantillonneurs passifs pour un screening des pesticides ... 177
I.1 : Cas de la Guyane ... 177
a . Site de Cacao ... 177
b .Site de Javouhey ... 181
I.2 : Cas du Lez ... 183
a . Pesticides identifiés ... 183
b . Accumulation des pesticides par les Chemcatcher et POCIS ... 185
c . Distribution spatiale des pesticides ... 189
d . Conclusion ... 191
a . Composés identifiés dans les 5 piézomètres ... 192
b . Comparaison des méthodes d’échantillonnage ponctuel et POCIS ... 192
c . Distribution spatiale des pesticides ... 194
II - Analyse quantitative et intérêt métrologique des échantillonneurs passifs ... 195
II.1 : Cas du Lez ... 195
a . Répartition des niveaux de concentrations des pesticides ... 195
b . Analyse quantitative : POCIS vs Chemcatcher ... 198
c . Influence des vitesses d’écoulements sur les Rs ... 202
d . Conclusion ... 204
II.2 : Cas de l’Ariège (eaux souterraines) ... 204
a . Variabilité spatio-temporelle des niveaux de triazines ... 205
b . Impact de la circulation d’eau ... 210
c . Répartition des pesticides dans la colonne d’eau au point C ... 211
d . Conclusion ... 212
CONCLUSIONS ET PERSPECTIVES ... 213
REFERENCES BIBLIOGRAPHIQUES ... 219
ANNEXES ... 229
LISTE DES FIGURES
Figure 1 : Quantités de substances actives (en tonnes) vendues en France de 1998 à 2011
(IUPP, 2012). ...8
Figure 2 : Évolution du chiffre d’affaire des pesticides en France (en millions d’euros) (IUPP, 2011). ...9
Figure 3 : Répartition française des phytosanitaires selon le type de culture (Ecophyto R&D, 2010). ...10
Figure 4 : Interactions et transfert des pesticides dans les différents compartiments environnementaux (INRA, 2005). ...13
Figure 5 : Nombre de pesticides quantifiés en 2010 dans les cours d'eau en France et concentrations moyennes annuelles en µg/l pour chaque point de mesure. (Données ODE, Service de l'Observation et des Statistiques (SOeS)). ...19
Figure 6 : Frequence de quantification annuelle des pesticides dans les cours d’eau en métropole (en haut) et dans les DOM (en bas) pour l’année 2010. H=herbicide ; I=insecticide ; F=fongicide. *Substances interdites d’utilisation en France et dans l’UE (données ODE, Service de l'Observation et des Statistiques (SOeS)). ...20
Figure 7 : Nombre de pesticides quantifiés dans les eaux souterraines en France en 2010 et concentrations moyennes annuelles en µg/l pour chaque point de mesure. (Données ODE, Service de l'Observation et des Statistiques (SOeS)). ...22
Figure 8 : Frequence de quantification annuelle des pesticides dans les eaux souterraines en métropole (en haut) et dans les DOM (en bas) pour l’année 2010. H=herbicide ; I=insecticide ; F=fongicide. *Substances interdites d’utilisation en France et dans l’UE ...23
Figure 9 : Description d’une procédure d’extraction liquide-solide (SPE). ...24
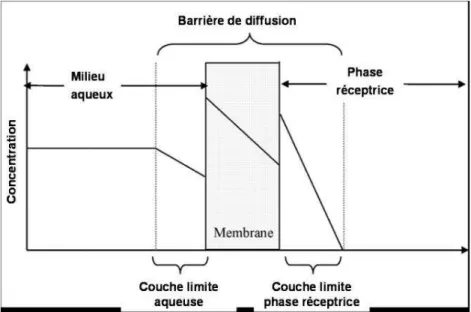
Figure 10 : Différentes phases d’accumulation correspondant au transfert de masse de composés de la phase aqueuse vers la phase réceptrice (). ...31
Figure 11 : Descriptions des différents milieux impliqués lors du transfert de masse des polluants vers la phase réceptrice d’un échantillonneur passif (Seethapathy et al, 2008). ....32
Figure 12 : Schéma présentant les concentrations aux bornes limites des différentes couches d’un échantillonneur passif. ...32
Figure 13 : Profils de concentration fournis par échantillonnage ponctuel et par échantillonnage passif (Bopp, 2004). ...37
Figure 14 : SPMD formé d’une membrane de perméation en LDPE remplie d’un polymère lipidique de synthèse, la trioléine (Huckins et al, 2007). ...38
Figure 15 : Dosimètre céramique avec et sans capsule (Nyoni et al, 2010). ...39
Figure 16 : Figure représentant un échantillonneur PDB (Nyoni, 2010). ...39
Figure 17 : Echantillonneur MESCO formé d’une membrane en LDPE, séparée par soudure en 4 segments distincts, contenant des tubes en silicone et des barreaux imprégnés d’une couche de PDMS (barreau Twister™) (Nyoni, 2010). ...40
Figure 18 : Configuration d’un échantillonneur POCIS (à gauche) et photo d’un POCIS (Alvarez et al, 2004). ...41
Figure 19 : Cage de déploiement conçue pour l’exposition des POCIS (Cefas)...42
Figure 20 : Modèle des Chemcatcher® (1ère génération), (Université Portsmouth) ...45
Figure 21 : Modèle des Chemcatcher (2ème génération) (Université Portsmouth). ...45
Figure 22 : Courbe d’accumulation dans un échantillonneur passif et zone linéaire correspondant au fonctionnement intégratif (Cw=constante) ...48
Figure 23 : Cinétique d’accumulation et d’élimination d’un PRC dans un échantillonneur passif sous condition isotropique (Tang et al, 2012) ...51
Figure 24 : Montage expérimental pour l’étude d’affinité des différents disques vis-à-vis des pesticides cibles ...70
Figure 25 : Principe de fonctionnement du pilote de calibration en flux continu. ...73
Figure 26 : Pilote en flux continu pour la calibration des Chemcatcher ...73
Figure 27 : Montage pour la calibration des Chemcatcher en milieu non renouvelé...79
Figure 28 : Pilote en flux continu pour la calibration des POCIS et montage sur carrousel. ..83
Figure 29 : Réseau de canaux BRL et réseau de distribution de l’eau du Rhône...85
Figure 30 : Localisation de l’étang de Thau ...87
Figure 31: Plateforme de déploiement situé sur l’étang de Thau (à gauche) et cages contenant les échantillonneurs passifs (à droite). ...88
Figure 32 : Réseau hydrographique de la Charente ...89
Figure 33 : District hydrographique de la Guyane (CBG, 2009). ...91
Figure 34 : Exposition des échantillonneurs POCIS sur le site de Cacao. ...94
Figure 35 : Exposition des POCIS sur le site de Javouhey. ...95
Figure 36 : Bassins versant de l’Ariège et de l’Hers Vif dans la région Midi-Pyrénées. ...97
Figure 37 : Formations géologiques du bassin versant de l’Ariège et de l’Hers Vif. ...98
Figure 38 : Points d’exposition des échantillonneurs POCIS sur le site de l’Ariège. ... 100
Figure 39 : Carte hydrogéologique simplifiée du bassin versant Lez-Mosson. ... 102
Figure 40 : Réseau hydrographique du bassin versant Lez-Mosson. ... 103
Figure 41 : Débordement de la vasque de la source du Lez. ... 104
Figure 42 : Déversoir et canal de restitution du débit réservé dans le Lez à 300 m en aval de la source... 104
Figure 43 : Apport d’eau du Rhône dans le Lez au droit de la station Lavalette situé en amont de Montpellier. ... 105
Figure 44 : Délimitation de la zone d’étude dans le Lez. ... 106
Figure 45 : Points d’exposition des échantillonneurs passifs. ... 107
Figure 46 : Exposition des échantillonneurs passifs dans la station hydrométrique près de la source du Lez. ... 107
Figure 47 : Localisation de la station Pierre Blanche, commune de Mauguio (Hérault) ... 108
Figure 48 : Chemcatcher (à gauche) et POCIS (à droite) en cours de montage dans les cages de déploiement. ... 109
Figure 49 : Suivi de la concentration des pesticides dans les béchers témoins. ... 112
Figure 50 : Évolution de la concentration de pesticides dans la phase aqueuse en présence des différents disques adsorbants : C18 (n=3), SDB-XC (n=3) et SDB-RPS (n=3). DIA et DEA : C18 (n=2), SDB-XC (n=3) et SDB-RPS (n=3). ... 113
Figure 51 : Comparaison des quantités accumulées dans les supports C18 (n=3), SDB-XC (n=3) et SDB-RPS (n=3). * C18 (n=2), SDB-XC (n=3) et SDB-RPS (n=2). ... 115
Figure 52 : Évolution des concentrations des pesticides en phase aqueuse durant la calibration des Chemcatcher en laboratoire sur le pilote à flux continu. ... 116
Figure 53 : Exemples d’accumulation des pesticides dans les Chemcatcher en fonction du temps d’exposition. ... 118
Figure 54 : Relation entre les taux d’échantillonnage du Chemcatcher et l’hydrophobicité des pesticides (LogKow). ... 120
Figure 55 : Comparaison des taux d’échantillonnage par familles chimiques (bleu : triazines, rouge : phénylurées, orange : chloroacétanilides, violet : phénylamides, gris : autres familles). ... 121
Figure 56 : Évolution des concentrations des pesticides dans la phase aqueuse (ratio C/C0) du bécher témoin. ... 125
Figure 57 : Cinétiques de disparition des composés dans la phase aqueuse en présence du Chemcatcher (C18/PES) (n=3). ... 126
Figure 58 : Forme linéarisée du modèle cinétique de premier ordre décrivant la disparition des pesticides de la phase aqueuse (n=3)... 127
Figure 59 : Comparaison des taux d’échantillonnage déterminés en milieu renouvelé (échelle pilote; n=2) et non-renouvelé, calculés par les méthodes 1 et 2 (n=3); ... 128
Figure 60 : Accumulation du métoxuron dans le POCIS (n=3). ... 131
Figure 61 : Accumulation non-linéaire dans le POCIS du flusilazole, cyprodinyl, prochloraze, bitertanol, diféconazole et le trifloxystrobine. ... 132
Figure 62 : Exemples d’accumulation du méthabenzthiazuron, de la diméthénamide, de la terbuthylazine, du métalaxyl, du néburon, et de la fenpropimorphe dans le POCIS.. ... 133 Figure 63 : Exemples d’échantillonnage intégratif du POCIS pour pour le prométryne, la terbutryne, la DIA, l’acétochlore, l’alachlore, l’imazalil, l’atrazine et le metconazole. ... 134 Figure 64 : Relation entre les taux d’échantillonnage du POCIS et l’hydrophobicité (LogKow) des pesticides étudiés (M= métamitron; C= chloroxuron; F=fenpropimorphe ). ... 136 Figure 65 : Taux d’échantillonnage des POCIS classés par familles chimiques de pesticides, du plus polaire au moins polaire (n=3). ... 137 Figure 66 : Comparaison des Rs moyens du POCIS pour différentes familles chimiques : urées, triazines, l azoles et amides (urées : n=11 ; triazines : n=14 ; azoles : n=11 ; amides : n=11). ... 139 Figure 67 : Taux d’échantillonnage (mL/j) des pesticides obtenus pour les Chemcatcher (C18/PES) et les POCIS version pharmaceutique. ... 141 Figure 68 : Taux d’échantillonnage par unité de surface (Rs/A en cm/j), ou coefficient global de transfert de masse (k0), pour le Chemcatcher (C18/PES) et le POCIS « version pharmaceutique ». ... 141 Figure 69 : Profils de concentration du métolachlore et du tébuconazole durant la campagne de calibration in-situ... 143 Figure 70 : Accumulation des pesticides dans les POCIS exposés durant 21 jours dans le canal BRL. ... 145 Figure 71 : Accumulation de la DIA et du métolachlore dans le POCIS. ... 146 Figure 72 : Quantités moyennes de pesticides accumulées dans les Chemcatcher polaires (C18/PES et SDB-XC/PES) déployés dans la Charente pendant 15 jours (n=3). ... 153 Figure 73 : Concentrations moyennes des pesticides dans la Charente calculés à partir des échantillonneurs passifs (POCIS et Chemcatcher) et de l’échantillonnage ponctuel. ... 154 Figure 74 : Quantités de pesticide accumulées par les Chemcatcher déployés dans l’étang de Thau. ... 157 Figure 75 : Concentrations moyennes des pesticides dans l’étang de Thau calculées à partir des Chemcatcher (C18/PES) et de l’échantillonnage ponctuel. Diuron (Ctwa : n=1). ... 158 Figure 76 : CTWA par les POCIS via les RsLab, Rs in-situ (mesuré), Rs in-situ (calculé) et concentrations mesurées par l’échantillonnage ponctuel à la source du Lez ... 169 Figure 77 : CTWA par les POCIS via les RsLab, Rs in-situ (mesuré), Rs in-situ (calculé) et concentrations mesurées par l’échantillonnage ponctuel sur le point amont Lavalette... 170 Figure 78 : CTWA par les POCIS via les RsLab, Rs in-situ (mesuré), Rs in-situ (calculé) et concentrations mesurées par l’échantillonnage ponctuel à la station Pierre Blanche. ... 170 Figure 79 : CTWA via le POCIS et mesurées via l’échantillonnage ponctuel dans l’eau souterraine en Ariège, au point D pour la campagne du mois de Mai. ... 173 Figure 80 : CTWA via le POCIS et mesurées via l’échantillonnage ponctuel dans l’eau souterraine en Ariège, au point B pour la campagne du mois de Mai. ... 174 Figure 81 : Distribution spatiales des pesticides identifiés via les POCIS dans les cours d’eau du site de Cacao. ... 179 Figure 82 : Distribution spatiales des pesticides identifiés via les POCIS dans les cours du site de Javouhey. ... 181 Figure 83 : Réplicats des quantités de pesticide accumulées dans les Chemcatcher déployés à la source du Lez ... 186 Figure 84 : Réplicats des quantités de pesticide accumulées dans les Chemcatcher déployés à la station Pierre Blanche (PB). ... 186 Figure 85 : Dépôt de vase dans les Chemcatcher exposés à la station Pierre Blanche du canal BRL. ... 187 Figure 86 : Réplicats des quantités de pesticide accumulées dans les POCIS déployés à la station Source du Lez ... 188 Figure 87 : Réplicats des quantités de pesticide accumulées dans les POCIS déployés à la station Pierre Blanche (PB). ... 188 Figure 88 : Concentrations des pesticides mesurées et calculées aux 4 points de mesure (Source du Lez, amont Lavalette, Station Pierre Blanche, aval Lavalette). ... 197
Figure 89 : Comparaisons des profils de Ctwa (POCIS et Chemcatcher) avec les profils de concentrations issues de l’échantillonnage ponctuel à la source du Lez. ... 199 Figure 90 : Comparaisons des profils de Ctwa (POCIS et Chemcatcher) avec les profils de concentrations issues de l’échantillonnage ponctuel (Amont Lavalette). ... 200 Figure 91 : Comparaisons des profils de Ctwa (POCIS et Chemcatcher) avec les profils de concentrations issues de l’échantillonnage ponctuel (Pierre Blanche). ... 201 Figure 92 : Comparaison des profils de concentrations mesurées et des Ctwa pour l’atrazine aux points A, D, E et C pour la période de mai à septembre. ... 207 Figure 93 : Comparaison des profils de concentrations mesurées et des Ctwa pour la DEA aux points A, D, E et C pour la période de mai à septembre. ... 208 Figure 94 : Comparaison des profils de concentrations mesurées et des Ctwa pour le métolachlore aux points A, B, D et E pour la période de mai à septembre. ... 209 Figure 95 : Influence de la circulation de l’eau sur la représentativité des Ctwa via POCIS pour la DEA au point de mesure B. ... 210 Figure 96 : Evolution spatio-temporelle des Ctwa de l’atrazine et la DEA, mesurées via le POCIS dans la colonne d’eau au point C... 211 Figure 97 : Evolution spatio-temporelle des Ctwa de la propazine, mesurées via le POCIS dans la colonne d’eau au point C... 212
LISTE DES TABLEAUX
Tableau 1 : Principales familles chimiques des pesticides ...7 Tableau 2 : Principales substances actives utilisées dans les cultures en France métropolitaine en 2006 (Grande cultures, viticulture, arboriculture) et 2007 (cultures légumières) (Afssa, 2009)...11 Tableau 3 : Normes de qualité environnementale pour les pesticides fixées par la DCE (EC, 2008) pour les eaux de surface. ...15 Tableau 4 : Exemples de phases adsorbantes utilisées pour l’extraction des pesticides dans les eaux. ...26 Tableau 5 : Exemples de méthodes d’analyse de pesticides par LC/MS. ...28 Tableau 6 : Normes régissant l’échantillonnage dans le cadre du suivi de la qualité des masses d’eau (AFNOR). ...29 Tableau 7 : Applications environnementales des POCIS et classes de composés échantillonnés dans les différents compartiments aquatiques. ...43 Tableau 8 : Caractéristiques physico-chimiques* des composés sélectionnés pour l’étude de thèse. ...56 Tableau 9 : Répartition des molécules entre les deux laboratoires. ...59 Tableau 10 : Gradient d’élution pour l’analyse des pesticides par HPLC (Waters 2695). ...60 Tableau 11 : Temps de rétention et paramètres de détection des pesticides par HPLC-ESI-MS2 (Micromass Quatro micro, Waters) ...61 Tableau 12 : Limites de quantification (LQ) et de détection (LD) pour les 22 composés analysés par HPLC-ESI-MS2 (Micromass Quatro micro, Waters). ...62 Tableau 13 : Gradient d’élution pour l’analyse de 27 composés (méthode PN1) par UPLC (ACQUITY Waters). ...63 Tableau 14 : Gradient d’élution pour l’analyse de 37 composés (méthode PN2) par UPLC (ACQUITY Waters). ...63 Tableau 15 : Temps de rétention et paramètres de détection des pesticides par UPLC-ESI-MS2 (Quatro Premier, Waters) (Liste PN1)...64 Tableau 16 : Temps de rétention et paramètres de détection des pesticides par UPLC-ESI-MS2 (Quatro Premier, Waters) (Liste PN2)...65 Tableau 17 : Valeurs des points d’étalonnage pour l’analyse des pesticides par UPLC-MS2 (Micromass Quatro micro, Waters). ...66 Tableau 18 : Critères de validation pour les analyses UPLC/MS/MS : Temps de rétention et ion ratio ...67 Tableau 19 : Caractéristiques des disques C18, SDB-XC et SDB-RPS ...68 Tableau 20 : Composés sélectionnés pour l’étude de la validation des Chemcatcher. ...69 Tableau 21 : Intervalles de prélèvement des échantillons d’eau et des Chemcatcher durant les 2 expériences de calibration. ...75 Tableau 22 : Pesticides sélectionnés pour l’étude de calibration des POCIS en laboratoire. 81 Tableau 23 : Références des points et des dates d’exposition des POCIS sur les sites de Cacao et de Javouhey, ...95 Tableau 24 : date de déploiement par site ... 101 Tableau 25 : Propriétés physicochimiques de l’eau et conditions hydrodynamiques d’exposition des échantillonneurs passifs (n=3). ... 109 Tableau 26 : Concentrations moyennes des pesticides dans la phase aqueuse durant le temps d’exposition. ... 117 Tableau 27 : Droites de régression décrivant l’accumulation des pesticides dans les Chemcatcher placés au niveau supérieur et inférieur du carrousel et les taux d’échantillonnages (Rs). ... 119
Tableau 28 : Comparaison des Rs de cette étude avec les valeurs disponibles dans la littérature. ... 123 Tableau 29 : Constantes cinétiques d’accumulation (kacc) et de partage (Ks/w). ... 127 Tableau 30 : Concentrations moyennes des pesticides dans la phase aqueuse durant la période d’exposition... 130 Tableau 31 : Taux d’échantillonnage (Rs) calculés pour 52 molécules lors de la calibration en laboratoire du POCIS « version pharmaceutique ». ... 135 Tableau 32 : Comparaison des taux d’échantillonnage des pesticides obtenus dans cette étude avec les valeurs disponibles dans la littérature. ... 140 Tableau 33 : Paramètres physico-chimiques mesurés durant la calibration in-situ sur le canal BRL. ... 142 Tableau 34 : Concentrations moyennes (ng/L) des composés dans la phase aqueuse. ... 143 Tableau 35 : Quantités de pesticides accumulées dans les Chemcatcher (duplicats) à différents intervalles de temps d’exposition. ... 148 Tableau 36 : Taux d’échantillonnage in-situ calculés après calibration dans le canal et Rs déterminées lors de la calibration en laboratoire. ... 149 Tableau 37 : Propriétés physicochimiques de l’eau de la Charente et autres paramètres d’exposition des échantillonneurs passifs (Miège et al, 2012). ... 152 Tableau 38 : Propriétés physicochimiques de l’eau de la Charente et autres paramètres d’exposition des échantillonneurs passifs (Miège et al, 2012). ... 156 Tableau 39 : Comparaison des taux d’échantillonnage en laboratoire et in-situ. ... 161 Tableau 40 : Comparaison des résultats de différentes méthodes de calcul des Rs in-situ. 163 Tableau 41 : Comparaison de la méthodologie de calcul pour les urées ... 163 Tableau 42 : Valeurs des Rs in-situ recalculés à partir du ratio moyen global (8 composés sans métabolites). *DIA : Rs in-situ calculé via le ratio (RsLab/Rs in-situ) de la DEA. ... 166 Tableau 43 : Paramètre d’exposition des POCIS dans le Lez. ... 168 Tableau 44 : Comparaison des écarts relatifs entre les concentrations prédites par les POCIS (via Rs in-situ mesuré et calculé), et les concentrations mesurées via l’échantillonnage ponctuel pour le site du Lez... 172 Tableau 45 : Comparaison des écarts relatifs entre les CTWA par les POCIS (via Rs in-situ mesuré et calculé), et les concentrations mesurées via l’échantillonnage ponctuel en Ariège au point de mesure D et B pour la campagne de Mai. ... 175 Tableau 46 : Identification des pesticides dans le site de Cacao. ... 180 Tableau 47 : Identification des pesticides dans le site de Javouhey. ... 182 Tableau 48 : Comparaison des résultats d’analyse des pesticides quantifiés sur les différents sites à partir des deux méthodes d’échantillonnage... 184 Tableau 49 : Distributions des pesticides identifiés par les échantillonneurs passifs... 190 Tableau 50 : Comparaison des résultats d’analyse qualitative des composés dans les échantillons d’eau et les échantillonneurs passifs (cas de l’Ariège) ... 193 Tableau 51. Comparaison des rapports de concentrations mesurées et des Ctwa calculés via RsLab (POCIS et Chemcatcher) et les rapports des vitesses d’écoulement. ... 203 Tableau 52 : Comparaison des rapports de Ctwa via Rs in-situ (POCIS) obtenus à une vitesse de 2,5 cm/s et des concentrations mesurées, et les rapports des vitesses d’écoulement. ... 203 Tableau 53 : Comparaison des variations des écarts entre les Ctwa et calculées à partir des valeurs mesurées via l’échantillonnage ponctuel au point B. ... 210
LISTE DES ANNEXES
ANNEXE 1 : Liste des 33 substances caractéristiques du bon état chimique. ... 229 ANNEXE 2 : Rendements de récupération des 22 pesticides (+atrazine d5) sur les Empore disques C18, SDB-XC et SDB-RPS, pour les essais d’affinité pesticides-Empore disques. 230 ANNEXE 3 : Validation de la circulation des fluides pour la calibration des POCIS en laboratoire. ... 231 ANNEXE 4 : Rendement d’extraction de 22 pesticides (+atrazine d5) par SPE (OASIS HLB) pour la calibration des Chemcatcher. ... 232 ANNEXE 5 : Rendement d’extraction de 60 pesticides par SPE (OASIS HLB) pour la calibration des POCIS en laboratoire. ... 233 ANNEXE 6 : Stabilité des concentrations dans l’eau durant les expérimentations Chemcatcher dans le pilote. ... 237 ANNEXE 7 : Cinétiques d’accumulations des pesticides dans le POCIS lors de la calibration des POCIS en laboratoire. ... 239 ANNEXE 8 : Accumulation des pesticides dans les Chemcatcher, site de Lavalette ... 247 ANNEXE 9 : Accumulation des pesticides dans les POCIS, site de Lavalette ... 249 ANNEXE 10 : Comparaison des profils de concentrations mesurées et des Ctwa pour la simazine aux points A, D, E et C pour la période de mai à septembre, sites de l’Ariège. .... 251 ANNEXE 11 : Niveaux piézométriques mesurés pendant les périodes d’exposition des POCIS ... 255
FINANCEMENTS :
Cette thèse s’est déroulée en collaboration entre l’Ecole des Mines d’Alès et le
BRGM, Centre de Recherche d’Orléans, et a bénéficié d’un financement de l’Institut
CARNOT-BRGM et d’un financement en propre de l’Ecole des Mines d’Alès
1
INTRODUCTION
Si les pesticides ont constitué un progrès dans la maîtrise des ressources alimentaires (augmentation des rendements agricoles) et l'amélioration de la santé publique (lutte contre les insectes vecteurs de maladies), le revers de la médaille est l’apparition fréquente de ces substances dans les milieux aquatiques. Malgré les avantages liés à l’utilisation de ces substances, de nombreuses questions se posent quant au devenir de ces composés dans l’environnement et leur toxicité vis-à-vis de l’homme et de son écosystème. Dans un souci de protection de la santé et de l’environnement, la réglementation des pesticides s’est donc accrue ces dernières années aussi bien au niveau national qu'international.
Les aspects réglementaires liés à la présence des pesticides dans les écosystèmes aquatiques répondent donc aux enjeux environnementaux et sanitaires.
L’établissement de la directive cadre sur l’eau (DCE) a permis de renforcer la politique globale de l’eau en termes de protection des ressources en eau. Elle vise à prévenir et réduire la pollution des eaux, promouvoir son utilisation durable, protéger l'environnement et améliorer l'état des écosystèmes aquatiques.
Dans le cadre de la DCE, la surveillance de la qualité des eaux repose sur un certain nombre de directives européennes, dont la directive 2006/11/CE concernant la pollution engendrée par certaines substances dangereuses déversées dans les milieux aquatiques et la directive 2008/105/CE établissant des normes de qualité environnementales (NQE) dans le domaine de l’eau. Cette directive fixe les limites de concentration tolérées dans les eaux de surface (continentales et côtières) pour un nombre de substances ou groupes de substances identifiés comme prioritaires en raison du risque significatif qu’elles présentent pour l'environnement aquatique. Ces NQE ont été définies principalement pour les substances prioritaires et ces valeurs sont spécifiques des substances détectées dans une eau de surface. Concernant les eaux souterraines, des normes de qualité ont été fixées par la directive européenne du 12 décembre 2006 (2006/118/CE). Les normes de qualité ne sont pas spécifiques aux composés, et la majorité des substances actives doivent respecter un seuil identique.
Compte tenu de la présence dans les masses d’eau de pesticides dangereux, un suivi régulier est nécessaire afin de contrôler la qualité de l’eau et de s’assurer du respect des normes fixées.
Au regard de la DCE, la mise en place de programmes de surveillance est obligatoire, afin d’évaluer et de suivre l’état écologique et l’état chimique des masses d’eau.
La surveillance des pesticides dans les différents milieux aquatiques nécessite une stratégie d’échantillonnage permettant d’obtenir un échantillon représentatif du milieu étudié. Les techniques d’échantillonnage traditionnellement utilisées lors des campagnes de surveillance sont basées sur des prélèvements ponctuels d’eau. Les différentes stratégies d’échantillonnage développées pour les programmes de surveillance des pesticides, précisent les fréquences de prélèvement adaptées pour un suivi sur le long terme de la qualité des masses d’eau. En France, dans le cadre DCE, ces fréquences d’échantillonnage sont définies pour les eaux de surface par la circulaire CE 2007/24, et pour les eaux souterraines par la circulaire CE 2005/14.
Concernant les pesticides inscrits dans la liste des 41 substances dangereuses et/ou prioritaires (DCE), la fréquence est fixée à 12 prélèvements par an et pour les pesticides compris dans la liste des substances jugées pertinentes, elle est de 4 prélèvements par an. Ces obligations sont règlementaires, mais ne permettent pas forcément d’accéder à un niveau d’information suffisant pour réellement caractériser ces milieux. Ces fréquences sont, cependant très faibles, et cela pose un problème de représentativité des échantillons
2 prélevés pour l’analyse. En effet, des informations pertinentes concernant les niveaux de contaminations (pollution ponctuelle ou pic de pollution diffuse) peuvent échapper à la surveillance.
Afin d’avoir une image fidèle et plus représentative du niveau réel de la pollution dans un milieu donné, les prélèvements ponctuels doivent être faits à un pas de temps plus réduit, permettant ainsi d’établir un profil plus précis de l’évolution de l’état de la contamination. Cependant, cela nécessite une logistique assez coûteuse avec d’importants volumes d’eaux à traiter et un investissement en temps non-négligeable.
Pour satisfaire aux nouvelles exigences de surveillance des milieux aquatiques et disposer de données fiables permettant de mieux caractériser la variation spatio-temporelle de la pollution dans les différents compartiments aquatiques, il est actuellement proposé une méthode alternative d’échantillonnage basée sur l’utilisation d’échantillonneurs passifs. Les échantillonneurs passifs ont été initialement développés et utilisés pour la surveillance de la qualité de l’air (Namiesnik et al, 2005), mais ce n’est qu’au cours de ces quinze dernières années qu’ils sont utilisés dans les milieux aquatiques pour le suivi de différentes catégories de polluants (Huckins et al. 1993). Cette méthode d’échantillonnage est basée sur l’utilisation de dispositifs capables de concentrer in-situ les micropolluants présents dans la phase dissoute du milieu aquatique. L’utilisation de ces outils présente plusieurs avantages : ils sont faciles à manipuler sur le terrain et ne consommant pas d’énergie, leur conditionnement et leur traitement sont relativement plus simples que ceux des échantillons d’eau.
De par leur grande capacité à concentrer les ultra-traces, ils permettent d’accroitre la sensibilité de l’analyse et d’atteindre ainsi des limites de détections basses. Cette capacité d’accumulation permet ainsi de mettre en évidence la présence de composés parfois indétectables via les méthodes d’échantillonnage classiques (Kot-Wasik et al. 2007).
L’un des intérêts majeurs de l’utilisation de ces dispositifs est qu’ils permettent un échantillonnage intégré dans le temps, donnant ainsi accès à la concentration moyenne du polluant (Ctwa : time weighted average concentration) en phase dissoute durant la période d’échantillonnage (Kot-Wasik et al. 2007), fournissant ainsi une image plus représentative du niveau moyen de contamination du milieu.
Il existe une grande variété d’échantillonneurs passifs actuellement disponibles, permettant l’analyse de polluants organiques aux propriétés extrêmement variées. Les propriétés intrinsèques des échantillonneurs doivent répondre à des spécificités inhérentes aux milieux d’échantillonnage et aux propriétés physicochimiques des polluants cibles.
Cependant, à l’état actuel des connaissances, l’applicabilité des échantillonneurs passifs en tant qu’outil d’analyse quantitative pour le suivi de polluants organiques est encore au stade de recherche. La maitrise et les connaissances de ces outils sont toutefois différentes selon les catégories d’échantillonneur.
Parmi les échantillonneurs conçus pour l’analyse des polluants organiques hydrophobes, les SPMD (Semi Permeable Membrane Device) sont les outils qui ont fait l’objet de plus de recherche, tant d’un point de vue qualitatif que quantitatif. Ces études portent également sur l’évaluation de leurs performances et de leurs limites d’application dans différents compartiments de l’environnement tels que l’air, les sédiments, les eaux côtières et continentales (eau de surface et souterraine), mais aussi les eaux usées. Dans les milieux aquatiques, cet outil permet notamment de quantifier des composés tels que les polychlorobiphényles (PCB) ou encore les hydrocarbures aromatiques polycycliques (HAP). D’autres types d’échantillonneurs pour les polluants organiques apolaires, tels que le
3 MESCO (Membrane Enclosed Sorptive Coating) et le Chemcatcher (version apolaire), présentent des aspects intéressants pour les applications quantitatives. La connaissance de ces outils est également très avancée.
Concernant les échantillonneurs de polluants organiques polaires, l’état des connaissances est plus limité. Les deux principaux outils utilisés sont le POCIS (Polar Organic Chemical Sampler) et le Chemcatcher (version polaire). Leur développement étant plus récent, leurs applications dans l’environnement concernent essentiellement des études qualitatives, pour un diagnostic de la présence de polluants dans un milieu, l’identification des flux de polluants et pour d’autres tests en lien avec l’impact écotoxicologique. Ces outils permettent de rechercher une variété de polluants de différentes classes chimiques, par exemple les composés pharmaceutiques et les pesticides.
L’évaluation de l’applicabilité des POCIS et des Chemcatcher dans la détermination des Ctwa des pesticides présents dans les masses d’eau requiert au préalable, une expérimentation en laboratoire pour calibrer l’échantillonneur passif afin de déterminer sous conditions contrôlées, les taux d’échantillonnage (Rs) pour les polluants cibles dans le milieu aquatique. Il existe toutefois une grande disparité entre les techniques de calibration répertoriées dans la littérature. En effet, ces techniques diffèrent entre elles, d’un point de vu exposition de l’échantillonneur (selon le montage expérimental utilisé), mais aussi au niveau des conditions d’exposition (type d’eau, température, niveau de turbulence, etc) (Greenwood et al, 2007). Les taux d’échantillonnage des pesticides disponibles dans littérature pour les Chemcatcher et les POCIS sont aussi limités, et leurs conditions d’obtention ne sont pas toujours bien détaillées. Etant donné que certains paramètres environnementaux (conditions hydrodynamiques, température, biofouling, etc) peuvent influencer la capacité d’échantillonnage passif, il est important d’évaluer l’impact que cela peut avoir sur la fiabilité des Rs et donc sur la détermination des Ctwa dans un milieu aquatique.
Afin de contribuer à l’évaluation de l’applicabilité des échantillonneurs passifs pour la surveillance des pesticides dans les milieux aquatiques, ce travail de cette thèse consiste à étudier et à comparer l’efficacité des échantillonneurs POCIS et Chemcatcher polaire pour la détermination des niveaux de concentration de 65 pesticides dans les masses d’eau de surfaces et souterraines.
Les objectifs de cette thèse sont multiples :
1- Evaluer en laboratoire, les capacités des POCIS et des Chemcatcher à échantillonner les pesticides sélectionnés, définir et comparer leur efficacité en tant qu’outils quantitatifs pour l’échantillonnage intégratif des molécules, via la détermination des taux d’échantillonnage.
2- Définir l’impact des conditions environnementales sur le fonctionnement intégratif des POCIS et des Chemcatcher lors d’exposition en milieu réel et déterminer des taux d’échantillonnage in-situ. Vérifier, sur des critères de répétabilité d’accumulation et de durée de fonctionnement intégratif l’applicabilité des outils, définir leur fiabilité dans la détermination de concentrations représentatives des niveaux réels de pollution dans les masses d’eau.
3- Evaluer les performances et limites d’application des échantillonneurs passifs pour une approche qualitative, afin de répondre à des problématiques environnementales liées à la présence des pesticides dans les eaux de surfaces et souterraines.
4 4- Dans le cadre de problématiques environnementales avérées, montrer les apports
mais aussi les limites des informations apportées par les échantillonneurs passifs
Le présent travail est décrit au travers de 4 chapitres :
o Le chapitre I est une étude bibliographique qui permet de décrire la problématique actuelle liée à la présence et à la surveillance des pesticides dans l’environnement, de présenter un état de l’art de la méthode d’échantillonnage passif et de faire un point sur l’état actuel des connaissances sur l’utilisation des échantillonneurs POCIS et Chemcatcher polaires.
o Le chapitre II décrit l’ensemble des expérimentations en laboratoire et les applications terrain mises en place pour évaluer les POCIS et les Chemcatcher, et présente les différents protocoles de traitement des échantillons (eaux, POCIS, Chemcatcher) et des méthodes d’analyse utilisées lors de ce travail de thèse.
o Le chapitre III est une discussion sur les résultats obtenus sur la partie validation laboratoire et in-situ des POCIS et des Chemcatcher pour le suivi quantitatif des pesticides dans les milieux aquatiques.
o Le chapitre IV aborde une discussion sur les résultats obtenus lors des études d’applicabilité des échantillonneurs passifs face à des problématiques environnementales liées à la présence des pesticides dans les masses d’eau.
5
SYNTHESE BIBLIOGRAPHIQUE
I-Composés phytopharmaceutiques
I.1 : Définitions
Les pesticides sont classiquement destinés à la protection des cultures afin de lutter contre des parasites, les mauvaises herbes, les insectes et les champignons. L'organisation des nations unies pour l'alimentation et l'agriculture (FAO) et l’organisation mondiale de la santé (OMS) définissent sous le terme « Pesticide » toute substance prévenant ou contrôlant les plantes ou animaux indésirables. Communément, le terme pesticide est largement employé, mais la profession agricole parle plutôt de produit phytosanitaire ou de produit agro-pharmaceutique. Ces produits sont composés d’une ou de plusieurs substances chimiques organiques ou minérales, d’origine naturelle ou synthétique. Jusqu’au début du 20ème siècle, ces produits phytosanitaires étaient essentiellement des dérivés de composés minéraux, par exemple les substances à base de sel de cuivre, de manganèse et d’arsenic. Vers les années quarante, avec le développement de la chimie de synthèse organique, sont apparues les premières molécules organiques de synthèse. Cette période marque notamment le début d’une expansion rapide des produits phytosanitaires dans le monde. L’emploi des pesticides organiques s’est constamment accru depuis les années 1990 (ORP, site web).
I.2 : Classification des pesticides
Deux classifications sont généralement utilisées pour différencier les pesticides : une classification fonction de l’agent parasite cible, et une classification dépendant de la structure chimique de la substance active (Sayen et al, 2012).
a.Classification en fonction des organismes cibles
Les pesticides sont ici regroupés en fonction de la nature des organismes visés et de leur mode d’action, dont les principaux sont les herbicides, les fongicides et les insecticides. - Les herbicides sont des produits destinés à la lutte contre les plantes adventices nuisibles aux plantes à protéger. Ils agissent généralement en tant que perturbateur de croissance, inhibiteur de l’activité photosynthétique, de la production de cellulose, de lipides et d’acides aminés (Hugh et al, 2012).
- Les fongicides agissent contre les champignons parasitaires ou bactéries causant des maladies dans les cultures comme le mildiou, l’oïdium et la pourriture grise. Les fongicides peuvent agir de différentes manières, notamment en bloquant le système respiratoire, en perturbant la biosynthèse et le métabolisme glucidique chez une plante (Kutcher et al, 2011; Berbegal et al, 2011).
- Les insecticides sont employés pour combattre les insectes ravageurs des cultures. Ces produits peuvent avoir une action neurotoxique, inhibitrice de la de la respiration et de la croissance cellulaire (Oakeshott et al, 2005; Das et al, 1995).
A côté de ces trois grandes classes de pesticides, on peut citer les acaricides (action contre les acarides et les araignées rouges), les rodenticides (action contre les rongeurs), les nématicides (action contre les vers du groupe des nématodes), les molluscicides (action
6 contre les limaces et escargots) et les corvicides (action contre les oiseaux ravageurs) (Calvet et al, 2005).
b.Classification chimique
Les pesticides sont ici regroupés en fonction de leurs caractéristiques chimiques. Compte-tenu de la variété de propriétés physicochimiques des pesticides commercialisés, il existe un nombre assez conséquent de familles chimiques : pesticides inorganiques, organiques et organométalliques.
Les pesticides inorganiques sont peu nombreux, mais certains sont utilisés en grande quantité comme la bouillie bordelaise, par exemple, qui est constituée de sulfate de cuivre. Les pesticides organométalliques sont des cations métalliques complexés par des ligands organiques du type dithiocarbamate.
Les pesticides organiques sont de loin les plus nombreux et les plus utilisés. Ils appartiennent à différentes classes ou familles chimiques (Barr et al, 2002). Les composés recensés au sein d’une même famille possèdent une structure chimique semblable et sont caractérisés par le même groupe d’atomes. Les principales familles de pesticides organiques sont regroupées dans le Tableau 1 comprenant les carbamates, les dithiocarbamates, les organochlorés, les organophosphorés, les pyréthrénoides, les triazines, les phénylurées et les sulfonylurées.
Les pesticides organochlorés et organophosphorés ont pour la plupart une action insecticide. Les carbamates sont des dérivés de l’acide carbamique, thiocarbamique et dithiocarbamique, et possèdent des propriétés à la fois herbicides et insecticides.
Les dithiocarbamates sont des composés dérivés de l’acide dithiocarbamique, et sont généralement utilisés en tant que fongicide. Ce sont à l’heure actuelle les fongicides organiques les plus employés (Sayen et al, 2012).
Les pyréthrénoides sont des insecticides qui attaquent le système nerveux en provoquant une paralysie. Les triazines sont pour la majorité des herbicides dont l'action principale a lieu par le système racinaire.
I.3 : Lien activité/chimie
Il n’existe pas de véritable lien entre la classification chimique d’un pesticide et son activité biologique. Certains composés appartenant à la famille des carbamates, par exemple, peuvent avoir une activité aussi bien herbicide, insecticide ou encore fongicide, alors que les organophosphorés sont majoritairement des insecticides et très peu sont des fongicides (Oakeshott et al, 2005). Par contre, les phénylurées et sulfonylurées ne comprennent que des herbicides. La liste non exhaustive du Tableau 1 montre la diversité des molécules phytosanitaires existantes et la grande variété de groupes fonctionnels. Comme les molécules phytosanitaires présentent des structures chimiques différentes, leur présence et leur devenir dans l’environnement seront donc dépendant de leurs propriétés physico-chimiques.
7 Tableau 1 : Principales familles chimiques des pesticides
Famille chimique Exemples de pesticide Classe
Phénoxycarboxyliques MCPA R1 =CH3 R2 = H R3 = CH2 Herbicides Triazines Atrazine R1 = NHCH(CH3)2 R2 = Cl R3 = NHCH2CH3 Herbicides Phénylurées Isoproturon R1 = (CH3)2CH R2 = H R3 = CH3 Herbicides Sulfonylurées Metsulfuron-methyl R1 = PhCO2OCH3 R2 = TCH3OCH3 R3 = H Herbicides Carbamates Chlorprophame R1 = CH(CH3)2 R2 = PhCl R3 = H Herbicides Aldicarbe R1 = N=CHC(CH3)2SCH3 R2 = CH3 R3 = H Insecticides Propamocarbe R1 = C3H7 R2 = CH2 CH2CH2N(CH3)2 R3 = H Fongicides Triazoles Tétraconazole R1 = H R2 = Fongicides Organophosphorés Malathion R1 = R2 = OCH3 R3 = CH-COOC2H5 -CH2COOC2H5 X = S Insecticides Foséthyl R1 = H R2 = OC2H5 R3 = OH X = O Fongicides
8 Pyréthrinoïdes Deltaméthrine R1 = R2 =R3 = Br Insecticides
I.4 : Consommation des pesticides
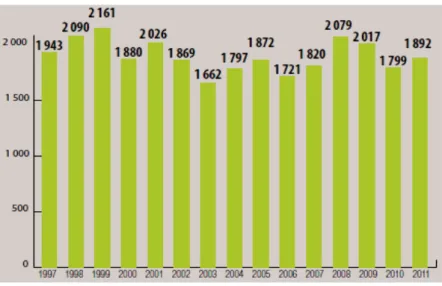
La nécessité de produire toujours plus de nourriture et une production agricole souffrant de pertes considérables dues à la résistance et à l’adaptation d'une grande variété de parasites, font que l’usage des pesticides est devenu une pratique agricole admise par les gouvernements et organismes internationaux (FAO, 1990). Il faut reconnaître que l'augmentation de la production est très prioritaire pour une majorité des régions du monde et cela ne peut pas être satisfait sans l'usage de pesticides. Le nombre de substances actives mondialement utilisées dans les traitements phytosanitaires est supérieur à 1300 (Tomlin, 2002). L'agriculture française en utilise environ 500 qui entrent dans la composition de plus de 3000 produits phytosanitaires commercialisés (ACTA, 2006). En France, les chiffres des ventes de produits phytopharmaceutiques destinés à l'agriculture sont publiés par l’union des industries pour la protection des plantes (UIPP, 2012). L’évolution des tonnages annuels montre une diminution globale de l’utilisation des pesticides depuis le début des années 2000, malgré une légère augmentation observée en 2007 et 2008, puisque l’on passe de près de 100 000 tonnes à 78 600 tonnes par an entre 2001 et 2008 (Figure 1).
Figure 1 : Quantités de substances actives (en tonnes) vendues en France de 1998 à 2011 (IUPP, 2012).
La forte diminution des usages des produits minéraux tels que le cuivre et le soufre (- 40 %) représente, cependant, un poids non-négligeable sur la décroissance de la consommation totale des pesticides. L’interdiction de molécules appliquées à de fortes quantités, l’apparition de nouvelles molécules actives efficaces à de très faibles doses, ainsi que différentes mesures mises en place pour la réduction des doses appliquées, ont contribué à diminuer significativement les consommations ces dernières années (Ecophyto R&D, 2010). En 2011, les ventes de produits phytosanitaires à l’échelle nationale atteignent 1,892 milliards d’euros (62700 tonnes de matières actives), affichant une croissance d’environ 5 % (Figure 2).
Les données sont très globales, il s’agit des chiffres à l’échelle nationale, mais très peu d’information par matière active sont disponibles, tout au plus des données agrégées par
9 grandes familles (herbicides/fongicides/insecticides). En France, les herbicides représentent environ 40 % des produits vendus, les fongicides 30 %, les insecticides 15 %, et les 15 % restant comprennent les nématicides, les rodenticides et les molluscicides (Ecophyto R&D, 2010).
Figure 2 : Évolution du chiffre d’affaire des pesticides en France (en millions d’euros) (IUPP, 2011).
Au sein de l’union Européenne, la France est le premier pays consommateur de pesticides et le quatrième au niveau mondial après les Etats-Unis, le Japon et le Brésil (ANSES, ORP ; 2010). Classée première dans la production agricole au sein de l’Union Européene (20% de production de denrées agricoles), la France dispose également de la plus grande surface agricole utilisée (SAU) avec près de 30 millions d’hectares (ANSES, 2010 ; ORP ; 2008). L’utilisation des pesticides se répartit en deux catégories :
Les usages agricoles : L’agriculture est la plus grande consommatrice de produits phytosanitaires avec plus de 90 % des utilisations. Leurs applications sont réparties sur différents types de culture (fruitière, maraichère, fourragère) avec l’essentiel consacré aux grandes productions telles que la culture du blé et du maïs. La nature des pesticides utilisés dépend essentiellement du type de culture. Un nombre limité de culture (céréales, maïs, colza et vigne), couvrant moins de 40% de la SAU nationale, consomment à elles seules près de 70 % des pesticides [ORP, 2008]. Ainsi, la vigne, avec moins de 3% de la SAU, représente 15 % des usages (Figure 3).
Usages non agricoles : Les 10 % d’usages non agricoles se répartissent entre les collectivités pour l’entretien des voiries et des espaces communaux (trottoirs, cimetières…), les sites industriels, et les particuliers (jardins, golfs) (ORP, 2008).
Si les pesticides ont constitué un progrès dans la maîtrise des ressources alimentaires (augmentation des rendements agricoles) et l'amélioration de la santé publique (lutte contre les insectes vecteurs de maladies), le revers de la médaille est l’apparition de résistance observée dès les débuts des années 1950 et la présence de ces substances dans les milieux aquatiques. Dans un souci de protection de la santé et de l’environnement, la réglementation des pesticides s’est donc accrue ces dernières années aussi bien au niveau national qu'international.
10 Figure 3 : Répartition française des phytosanitaires selon le type de culture (Ecophyto
R&D, 2010).
La mise sur le marché et le suivi post-homologation des produits phytosanitaires (PP) et des substances actives (SA) qui les composent sont strictement encadrés et harmonisés au niveau européen par la directive 91/414/CEE mise en application en 1993. Cette directive a très récemment été abrogée par le règlement (CE) n° 1107/2009, adopté le 21 octobre 2009 et entré en vigueur le 14 juin 2011. Ce dernier vise à réduire de façon sensible les risques liés aux pesticides ainsi que leur utilisation.
Ce dispositif législatif contient :
- un règlement (CE) n° 1107/2009 relatif à la mise sur le marché et l’évaluation des produits phytopharmaceutiques,
- une directive 2009/128/CE instaurant un cadre communautaire d’action pour parvenir à une utilisation des pesticides compatible avec le développement durable et à encourager le recours à la lutte intégrée et aux alternatives non chimiques,
- et une directive 2009/127/CE concernant les machines destinées à l’application des pesticides.
L’évaluation des SA entrant dans la composition des PP est réalisée au niveau communautaire par l'autorité Européenne de sécurité alimentaire (AESA). Cette évaluation permet de caractériser les propriétés intrinsèques de chaque substance et d'identifier les dangers et les risques qu'elle présente pour l'homme (applicateurs et consommateurs) et l'environnement. En France, l’Anses (agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail), réalise cette analyse via la direction du végétal et de l'environnement. Au niveau communautaire, un organe consultatif de la commission Européenne, le comité phytosanitaire permanent de la chaine alimentaire et de la santé animale (CPCASA) décide de l'inscription des SA à l'annexe 1 de la directive 91/414/CEE. Seules les SA inscrites à l'annexe 1 peuvent être utilisées dans des PP. L’Anses examine les dossiers de demande des PP et émet un avis sur lequel se base le ministère chargé de l'Agriculture pour accorder ou non l'AMM (autorisation de mise sur le marché). La base de données de la DG-Sanco précise le statut réglementaire des SA phytosanitaires en Europe, consultable en ligne via le lien électronique suivant :
11 En France, les PP ayant une autorisation de mise sur le marché ainsi que les usages phytosanitaires autorisés sont disponibles sur le site internet du Ministère de l’Agriculture et de la Pêche (base de données e-phy : http://e-phy.agriculture.gouv.fr). En Europe, la législation liée aux produits phytosanitaires peut être plus restrictive d’un pays membre à un autre. Par exemple le diuron, désherbant de la vigne est interdit en France mais pas au niveau européen. L’atrazine, désherbant du maïs a été interdite en Allemagne en 1993, depuis 2002 en France et en 2006 en Suisse. Des délais peuvent être accordés entre l’arrêt de la distribution et de l’utilisation d’une substance et la date d’interdiction. Par exemple l’acétochlore, interdit en 2008, était encore autorisé en France pour le désherbage du maïs jusqu’à fin 2011. Compte tenu des nombreux retraits de SA dans la composition des PP, des enquêtes sur les réelles utilisations des pesticides à l’échelle nationale ont été réalisées en 2006 et 2007 auprès des agriculteurs dans le cadre des travaux du plan d’action ORP (2006-2008). Le Tableau 2 présente quelques données de substances actives utilisées en métropole.
Tableau 2 : Principales substances actives utilisées dans les cultures en France métropolitaine en 2006 (Grande cultures, viticulture, arboriculture) et 2007 (cultures légumières) (Afssa, 2009).
Substance active Fonction principale Tonnages
Grandes cultures
Chlorméquat régulateur de croissance
1000-2000 Isoproturon herbicide Mancozèbe fongicide Trifluraline herbicide Acétochlore herbicide 500-1000 Chlorothalonil fongicide Chlortoluron herbicide Glyphosate herbicide Aclonifen herbicide Prochloraze fongicide 300-500 S-métolachlore herbicide Alachlore herbicide Métazachlore herbicide Pendiméthaline herbicide Viticulture
Soufre fongicide, acaricide > 10 000 Fosétyl-Al fongicide 1000-2000 Folpel fongicide Mancozèbe fongicide Glyphosate herbicide 100-500 Hydroxyde de cuivre fongicide
Sulfate de cuivre fongicide Aminotriazole herbicide Oryzalin herbicide Cymoxanil fongicide 50-100 Diuron herbicide Manèbe fongicide
12 Arboriculture Captane fongicide 100-500 Mancozèbe fongicide Thirame fongicide Zirame fongicide 30-100 Dithianon fongicide Tolylfluanide fongicide Chlorure de calcium fongicide Thiophanate méthyl fongicide Bromure de méthyle multiple
Cultures légumière
Mancozèbe fongicide > 100 Chlorothalonil fongicide
20-100 Vinchlorozoline fongicide
Sulfate de cuivre fongicide Iprodione fongicide 10-20 Pyrimicarbe insecticide Méthomyl insecticide Azoxystrobine fongicide Métaldéhyde molluscide < 10 Procymidone fongicide Méthiocarbe insecticide Bacillus thuringiensis insecticide Lambda-cyhalothrine insecticide Deltaméthrine insecticide
Le durcissement de la réglementation des pesticides au niveau européen et français n’est pas anodin. En effet, plusieurs études ont démontré les risques que pouvaient présenter les pesticides vis-à-vis de la santé de l’homme et de son environnement.
I.5 : Effets écotoxicologiques et impacts sanitaires
Malgré les avantages liés à l’utilisation de ces substances, de nombreuses questions se posent quant au devenir de ces composés dans l’environnement et leur toxicité vis-à-vis de l’homme et de son écosystème.
a.Impact sanitaire
La contamination de l’homme par les pesticides peut se faire à travers différentes voies, notamment lors de la consommation d’eau et d’aliments, par inhalation ou par contact avec la peau (cas des agriculteurs). Le risque de nuisance des pesticides ou de leurs produits de dégradation dépend de plusieurs facteurs comme leurs propriétés toxiques à court terme (effets aigus) ou à long terme (effets chroniques), leur caractère persistant et leur aptitude à former des combinaisons toxiques avec d’autres composés chimiques (IARC, 1987)
.
Les troubles observés dans le cas d’un effet aigu concernent surtout la peau et les muqueuses. De nombreuses études sur la toxicité chronique des pesticides pour l’homme ont démontré que ces composés peuvent causer des troubles d’ordre neurologique, perturber la croissance (Meyer et al, 2003), provoquer un disfonctionnement des systèmes immunitaires13 et de reproduction (Petrelli and Mantovani, 2002) et endocriniens (Sanchez-Pena et al, 2004). Le cancer est aussi répertorié parmi les maladies pouvant être causées par les pesticides (Keetles et al, 1997).
Depuis près de cinquante ans, les pesticides ont été mis en évidence dans tous les compartiments environnementaux. Si les pesticides présents dans l’environnement peuvent avoir des impacts sur la santé humaine, ces composés peuvent également avoir un effet non négligeable sur les écosystèmes.
b.Impact environnemental
Afin d’apprécier les mécanismes de contamination par les pesticides des écosystèmes aquatiques, il est important de bien comprendre leur mode de dispersion et la dynamique de ces composés dans les différents compartiments environnementaux.
Après leur épandage sur les cultures, les pesticides peuvent se volatiliser vers l’atmosphère, se fixer dans le sol, être entraînés par l’eau dans des couches plus profondes, ou encore se retrouver dans les eaux de ruissellement superficielles (Figure 4).
Lors de l’application des produits phytosanitaires sur les cultures, ces produits peuvent s’échapper dans l’atmosphère avant même que le produit n’atteigne le sol. Ce phénomène est observé lors des traitements par pulvérisation, et est accentué par les mouvements des masses d’air (dérive). Après épandage, les produits phytosanitaires peuvent être transportés vers l’atmosphère par volatilisation à partir du sol ou via l’érosion éolienne.
Dans l’atmosphère, les pesticides peuvent être retrouvés dans la phase gazeuse, dans la phase dissoute et adsorbés sur les particules en suspension (Wong et al, 2009 ; Yao et al, 2008). Pendant le transport de ces composés par les masses d’air, les pesticides peuvent subir des transformations sous l’effet de la lumière, d’agents oxydants et/ou des radicaux, pouvant conduire à l’élimination des pesticides, ou à la formation de sous-produits de dégradation, parfois plus toxiques que les composés de départ (Lanyi and Dinya, 2005).
Figure 4 : Interactions et transfert des pesticides dans les différents compartiments environnementaux (INRA, 2005).
Plusieurs pesticides ont fréquemment été observés dans l’eau de pluie, la neige et les brouillards (Atkinson et al, 2003). Des études réalisées sur les eaux de pluies ont notamment montré de façon épisodique et irrégulière, la présence d’un certain nombre d’herbicides et de leurs métabolites (atrazine, simazine, alachlore, métolachlore, dinoterbe, déséthylatrazine, déisopropylatrazine). Certains ont également été retrouvés dans les phases gazeuse et