Le rôle des métabolites dérivés de la diète sur la santé
cardiométabolique :
la contribution des acides aminés
à chaîne ramifiée et des polyphénols
Mémoire
Michèle Rousseau
Maîtrise en nutrition - avec mémoire
Maître ès sciences (M. Sc.)
Le rôle des métabolites dérivés de la diète sur la santé
cardiométabolique :
La contribution des acides aminés à chaîne ramifiée et des
polyphénols
Mémoire
Michèle Rousseau
Sous la direction de :
Résumé
Le syndrome métabolique (SM), précurseur du diabète de type 2 et des maladies cardiovasculaires, est un fléau majeur alourdissant le système de santé dans les pays industrialisés. Ces maladies ont en commun le stress oxydatif, qui contribuerait à leur développement. De plus, leur progression peut être modulée par l’alimentation, qui est source d’aliments aux propriétés pro- ou antioxydantes. Les études longitudinales décrivent depuis longtemps la consommation de viande comme étant plutôt néfaste pour la santé, alors que celle de fruits y serait favorable. La viande est entre-autres la source alimentaire principale d’acides aminés à chaîne ramifiée (AACR), métabolites dont les niveaux plasmatiques seraient élevés chez les personnes résistantes à l’insuline ou présentant le SM. Les données de 197 individus d’adiposité variée et présentant ou non le SM de la cohorte INFOGENE ont été utilisées afin de vérifier si la consommation de protéines d’origine animale ou végétale ou celle de viande rouge et des autres principaux aliments source de protéines était associée aux niveaux plasmatiques d’AACR. La relation entre ces aliments et les sous-produits du catabolisme des AACR, les acylcarnitines (AC) C3 et C5, fut par la suite investiguée. Alors qu’une forte association entre le statut d’embonpoint et la présence de SM et les niveaux plasmatiques d’AACR ou d’ACs C3 et C5 a été observée, les protéines d’origine animale et la consommation de viande rouge ne présentaient globalement qu’une modeste association avec les niveaux plasmatiques d’AACR. Ainsi, ces résultats suggèrent que l’apport en ces aliments ne serait pas le principal contributeur à l’augmentation des niveaux plasmatiques des AACR et des ACs C3 et C5. De leur côté, plusieurs études chez l’animal mettent de l’avant le potentiel du bleuet dans l’amélioration de la santé cardiométabolique. Son contenu élevé en polyphénols serait en cause. Un essai randomisé, contrôlé et à double insu fut conduit chez 49 adultes assignés à la consommation journalière de 50 g de poudre de bleuets (PB) ou placebo (PP) pour une durée de huit semaines afin d’observer si cette supplémentation affectait positivement la tension artérielle, le profil lipidique ou le degré de résistance à l’insuline des participants. En comparant les données recueillies au début, au milieu et à la fin de l’intervention et entre les groupes PB et PP, aucune amélioration dans ces paramètres ne fut observée. Ces résultats laissent suggérer que la consommation en poudre de l’équivalent de 2,3 tasses de bleuets n’aurait pas d’effet, à prime abord, sur la santé cardiométabolique d’individus à risque de développer le SM. Les bénéfices rapportés chez l’animal demeurent donc à étudier davantage chez l’humain.
Abstract
The metabolic syndrome (MS), precursor to the development of type 2 diabetes and cardiovascular diseases, is a major burden for the health system in developed countries. These diseases have in common that oxidative stress is believed to contribute to their development. Moreover, their progression can be modulated by diet, which is source of pro- and anti-oxidant foods. Longitudinal studies have for a long time considered meat consumption to be rather harmful for health, while that of fruits is thought to be beneficial. Meat is the main dietary source of branched-chain amino acids (BCAA), which plasma levels are reported to be elevated in insulin resistant individuals or ones presenting the MS. Data from 197 individuals with various adiposity values with or without MS from the INFOGENE cohort were examined to assess whether the consumption of animal or vegetal protein or that of red meat and other main protein food sources were correlates of plasma BCAA levels. The relationship between these food groups and by-products of BCAAs catabolism, the acylcarnitines (AC) C3 and C5, was subsequently investigated. While a strong association between overweight status and MS and plasma BCAA or C3 and C5 ACs was observed, dietary animal protein and red meat only had a modest association overall with plasma BCAA levels. Thus, these results suggest that intakes of these foods would not be the main contributor to the increase of plasma BCAAs and C3 and C5 ACs levels. For their part, several animal studies highlighted the potential of blueberries at improving cardiometabolic health. Their high antioxidant content would underlie these findings. A randomized, double-blind placebo-controlled clinical trial on 49 adults assigned to the daily consumption of 50 g of blueberry (BBP) or placebo powder (PP) for 8 weeks was conducted to test if this supplementation positively impacted blood pressure, lipid profile or insulin resistance of participants. Comparing data collected at baseline, 4 and 8 weeks and between BBP and PP groups, no improvement in these parameters was observed. These results suggest that the consumption of a powder equivalent to 2.3 cups of blueberries did not improve the cardiometabolic profile of individuals at risk of developing MS. The benefits reported in animal studies therefore remain to be further investigated in humans.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations, sigles, acronymes ... ix
Avant-propos ... xi
Introduction ... 1
Chapitre I : Problématique ... 3
1.1 Le syndrome métabolique ... 3
1.1.1. Description du syndrome métabolique ... 3
1.1.2 Développement du SM ... 4
1.1.3 Diagnostic précoce du SM ... 5
1.1.4 Facteurs de risques du SM ... 8
1.2 Le stress oxydatif ... 12
1.2.1 Description et développement du stress oxydatif ... 12
1.2.2 Impacts du stress oxydatif sur la santé cardiométabolique ... 12
1.2.3 Moyens de défense contre le stress oxydatif ... 15
1.3 Alimentation Nord-Américaine ... 18
1.3.1 Composition ... 18
1.3.2 Viande rouge et charcuteries ... 18
1.3.3 Petits fruits et bleuets ... 21
1.4 Objectifs ... 28 1.4.1 Objectif général ... 28 1.4.2. Objectifs spécifiques ... 28 1.5 Hypothèses ... 29 1.5.1. Hypothèse générale ... 29 1.5.2. Hypothèses spécifiques ... 29
Chapitre II : Associations entre les sources alimentaires de protéines, les taux plasmatiques d’AACR et les niveaux d’acylcarnitines à chaîne courte chez l’adulte ... 30
1. Introduction ... 32
2. Materials and Methods ... 33
2.1. Study Population ... 33
2.2. Dietary Assessment and Food Grouping ... 33
2.3. Anthropometric Measurements ... 34 2.4. Biochemical Parameters ... 34 2.5. Metabolite Profiling ... 35 2.6. Statistical Analyses ... 35 3. Results ... 35 3.1. Study Population ... 35 3.2. Dietary Intakes ... 36
3.3. Plasma BCAAs and Protein Intakes ... 36
3.4. Acylcarnitines ... 37 4. Discussion ... 38 5. Conclusions ... 42 References ... 43 Tables ... 48 Figures ... 54
Chapitre III : Effets d’une supplémentation de huit semaines en poudre de bleuet sur la santé cardiométabolique : Un essai randomisé, contrôlé et à double insu ... 55
3.1 Résumé ... 56
3.2 Abstract ... 56
1. Introduction ... 57
2. Materials and methods ... 58
2.1. Study population ... 58
2.2 Intervention ... 58
2.3 Study protocol and intervention ... 59
2.4 Anthropometric measurements. ... 59
2.5 Biological samples ... 59
2.6 Dietary assessment and questionnaires ... 60
2.7 Statistical analysis ... 60
3. Results ... 61
3.2 Dietary intakes ... 61
3.3. Time and treatment effects on metabolic markers ... 61
3.4. OGTT-derived measurements of insulin resistance and sensitivity ... 62
4. Discussion ... 62
5. Conclusion ... 65
References ... 66
Figures ... 71
Tables ... 73
Discussion générale et conclusion ... 78
Liste des tableaux
Chapitre I
Tableau 1. Conditions menant au diagnostic du syndrome métabolique………..………..3
Tableau 2. Description sommaire des principaux antioxydants endogènes et exogènes………..…………16
Tableau 3. Résumé des essais randomisés contrôlés ayant étudié l’effet d’une supplémentation en bleuet sur la santé cardiométabolique et/ou différents marqueurs inflammatoires ...……….24
Chapitre II Table 1. Characteristics of participants………...…48
Table 2. Daily dietary energy and macronutrients intakes of participants……….49
Table 3: Mean intakes (standard portions/day) of the principal food groups contributing to protein intakes…..50
Table 4. Associations between all 12 principal protein sources and plasma BCAA levels in subgroups based on OW and MS status without and with adjustments for confounders………..51
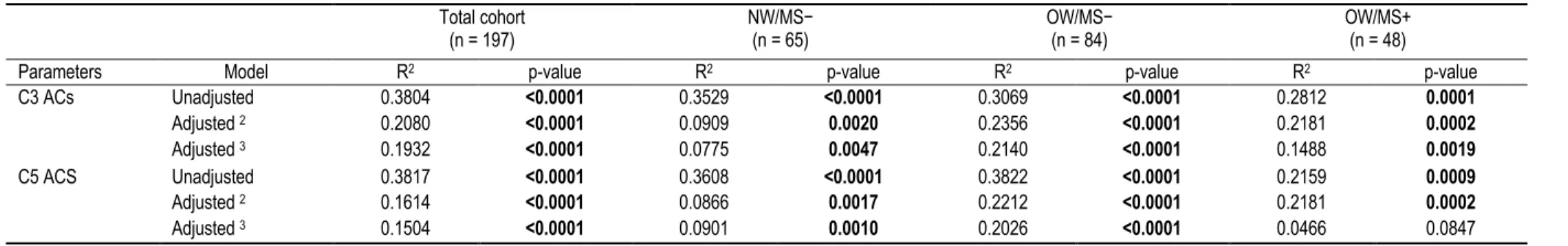
Table 5. Associations between plasma BCAA and C3 and C5 ACs plasma levels in the whole cohort and by subgroups based on OW and MS status without and with adjustments for confounders...…………...52
Supplementary Table 1. Food grouping used in the dietary pattern analysis………...………...53
Chapitre III Table 1. Characteristics of participants completing the 8-week supplementation period…………..………...73
Table 2. Effects of treatment and/or time on energy and macronutrients intakes………..74
Table 3. Effects of treatment and/or time on measures of cardiometabolic health……….75
Table 4. Effect of treatment on changes in metabolic variables of interest………..…76
Table 5. Effects of treatment and/or time on insulin resistance (HOMA-IR) and insulin sensitivity (Matsuda index), without and with adjustments for sex, age and BMI……….77
Liste des figures
Chapitre I
Figure 1. Métabolisme simplifié des acides aminés à chaîne ramifiée………..………..6
Chapitre II
Figure 1. Mean plasma and dietary BCAA levels between subgroups of NW/OW individuals with or without MS……….54 Figure 2. Mean plasma concentrations of C3 and C5 ACs in relation with mean plasma BCAA levels between
subgroups of NW/OW individual with or without MS………….………54
Chapitre III
Figure 1. Graphical representation of the study protocol.………..………71 Figure 2. Flow chart of participants form recruitment to analysis………72
Liste des abréviations, sigles, acronymes
AACR : Acides aminés à chaîne ramifiée AC : Acylcarnitines
ATP : Adénosine triphosphate BBP : Blueberry powder
BCAA : Branched-chain amino acid BCAT : Aminotransférase à chaine ramifiée
BCKD : Déshydrogénase de l’acide alpha-cétonique à chaine ramifiée DBT2 : Diabète de type 2
ENO : Espèces réactives de l’azote ERO : Espèces réactives de l’oxygène FRAP : Ferric reducing ability of plasma HbA1c : Hémoglobine glyquée
HDL : Lipoprotéines de haute densité ICAM-1 : Intervascular cell adhesion molecule-1 IMC : Indice de masse corporelle
LDL : Lipoprotéines de faible densité MBI : Microbiote intestinal
MCV : Maladies cardiovasculaires MS : Metabolic syndrome
mTORC1 : Mammalian target of rapamycine 1 PB : Poudre de bleuets
PFGA : Produits finaux de glycation avancée PP : Poudre placebo/Placebo Powder
RI : Résistance à l’insuline
RL : Radicaux libres
SM : Syndrome métabolique
TG : Triglycérides
TNF-alpha : Facteur de nécrose tumorale TMAO : Triméthlamine-N-oxyde
VCAM : Vascular cell adhesion molecule-1 VLDL : Lipoprotéines de très faible densité yBB : y-butyrobétaine
Avant-propos
Dès le début de mon parcours en nutrition à l’Université Laval, j’avais en tête de poursuivre mes études après l’obtention de mon baccalauréat. Ce désir a été confirmé suite à un été passé à travailler dans le laboratoire du Dr Alain Veilleux à l’Institut sur la nutrition et les aliments fonctionnels (INAF), dont les intérêts de recherche s’articulent autour du SM et du rôle de l’intestin sur la santé. Cette expérience a orienté mes intérêts vers une maîtrise qui porterait sur le sujet des maladies chroniques, mais qui toucherait davantage à la nutrition et serait de nature moins fondamentale. Ainsi, le profil de recherche de Marie-Claude Vohl correspondait parfaitement à ce que je cherchais. Je fus donc enchantée d’apprendre qu’elle cherchait une étudiante pour travailler sur les données du projet BLEUET, pour lequel la phase de recrutement des participants venait tout juste de débuter. Initialement, mon projet de maîtrise ne devait s’articuler qu’autour de l’étude BLEUET, évaluant l’impact d’une supplémentation en poudre de bleuets sur la santé cardiométabolique. Cependant, étant donné la difficulté à recruter rapidement le nombre requis de participants pour cette étude d’intervention, ce projet est plutôt devenu le second mandat de ma maîtrise. En fait, ce délai imprévu de trois sessions m’a laissé l’opportunité de m’intéresser au rôle de l’alimentation sur les concentrations plasmatiques d’un biomarqueur sanguin considéré comme prédicteur précoce des maladies cardiométabolique. Ainsi, mes efforts se sont portés sur deux fronts à la fois, me permettant de réaliser un vaste projet de maîtrise sur le thème du SM.
Le premier article présenté s’intitule Associations Between Dietary Protein Sources, Plasma BCAA and
Short-Chain Acylcarnitines Levels in Adults et a été publié en janvier 2019 dans le journal Nutrients. En tant que
première auteure, mon implication a été d’analyser et d’interpréter les données en plus d’avoir rédigé la première version de l’article. L’implication des coauteurs est la suivante : conceptualisation et conception du projet : Louis Pérusse, Simone Lemieux et Marie-Claude Vohl; analyse des données : Frédéric Guénard, Bénédicte Allam-Ndoul et Véronique Garneau; Supervision : Marie-Claude Vohl; et révision du manuscrit : tous les auteurs. Le second article est actuellement en cours de révision par le U.S. Highbush Blueberry Council. Il a pour titre Effect
of an 8-week freeze-dried blueberry powder supplementation on markers of cardiometabolic health: A randomized, double-blind placebo-controlled clinical trial. J’ai d’abord contribué au projet en participant au
recrutement des participants et à la saisie des données. J’ai par la suite analysé et interprété les données et rédigé la première version de l’article. Les coauteurs ont contribué ainsi : conceptualisation et conception du projet : Véronique Garneau, Charles Couillard, Patrick Couture, Denis Roy, André Marette et Marie-Claude Vohl; supervision clinique : Patrick Couture, Valérie Guay, Véronique Garneau et Michèle Kearney; analyse des données : Frédéric Guénard, supervision : Marie-Claude Vohl; et révision du manuscrit : tous les co-auteurs. Ce mémoire est donc la conclusion des six dernières sessions passées à investiguer comment l’alimentation peut influencer la santé cardiométabolique. La réalisation de ces travaux n’aurait toutefois pas été possible sans
la contribution de nombreuses personnes qu’il m’est essentiel de remercier. D’abord, ma directrice de recherche Marie-Claude, qui était toujours présente pour me guider et écouter mes doutes tout au long de ce processus. Joignable même la fin de semaine et tard le soir, je savais pouvoir compter sur son soutien qu’elle qu’en soit la cause. Ensuite, merci à Frédéric pour sa patience, son calme et ses conseils toujours réfléchis et sages. Son aide, particulièrement nécessaire en période d’analyses des données sur SAS, était fondamentale à la réalisation de mes projets. Mes remerciements vont ensuite aux autres « Vohl » : Bastien, qui fut présent pour m’aider avant même le début officiel de ma maîtrise en m’accompagnant dans la préparation des demandes de bourses; Bénédicte, dont les judicieux conseils étaient toujours empreints de toute l’expérience qu’elle a acquise; Juan, la meilleure ressource pour réaliser de beaux tableaux et visuels; Maximilien Franck, source intarissable de savoir avec qui une simple discussion aurait pu durer des heures; et Michèle, Véronique et Valérie, qui avaient la responsabilité du recrutement et du bon déroulement du projet BLEUET. Quelques remerciements supplémentaires aux membres de l’unité clinique de l’INAF, aux co-auteurs de ces deux papiers et aux autres professeurs m’ayant aidé dans ce processus. J’aimerais également souligner les autres membres de l’INAF avec qui j’ai eu l’occasion de travailler et d’échanger. On dit que l’INAF est un milieu particulièrement vivant et chaleureux, et ce ne peut être que grâce à vous. J’exprime aussi ma reconnaissance à la Fondation Initia pour m’avoir octroyé une bourse d’étude dans le cadre de l’étude BLEUET. Finalement, je ne peux oublier ma famille en commençant par mes parents et mes sœurs, dont l’appui est inconditionnel. Enfin, mon amoureux qui, travaillant dans un autre pavillon de l’Université, prenait plaisir à venir « hanter » les corridors souterrains de l’INAF sur l’heure du midi, me sortant de ma bulle de travail le temps d’un petit rendez-vous improvisé.
Introduction
Le fardeau économique associé aux maladies découlant du syndrome métabolique (SM) est un enjeu de société dans les pays en développement et dans les pays développés. Regroupant obésité, résistance à l’insuline (RI), hypertension et dyslipidémie, un individu qui souffre du SM coutera en moyenne 1,6 fois plus cher en soins de santé qu’une personne n’ayant pas ce problème de santé (1). D’ailleurs, les coûts associés à l’obésité seule s’élevaient à 4,61 milliards de dollars par an au Canada en 2008, soit une augmentation de 28% en huit ans seulement (2). Bien que les divers désordres métaboliques composant le SM ne touchent pas directement les mêmes tissus ou organes du corps humain, ils possèdent tous un point commun : le stress oxydatif serait contributoire à leur progression (3). Celui-ci se développe lorsque les défenses antioxydantes du corps n’arrivent plus à pallier la production de molécules aux propriétés oxydantes, générant ainsi un état de stress chronique nocif pour les cellules en modifiant leur structure et leurs fonctions (4).
Un bon nombre de facteurs de risques influençant le SM sont modifiables et contrôlables par l’individu. Dans cette optique, l’alimentation s’avère un outil au potentiel particulièrement intéressant autant en prévention que pour le traitement et la gestion du SM et des maladies qui y sont associées. En effet, les choix alimentaires contribuent à la gestion du poids, considéré comme le plus important facteur de risque du SM (5), mais peuvent aussi influencer la tension artérielle (6), les niveaux plasmatiques de lipides (7) et ceux de glucose (8). De surcroit, certains aliments sont riches en composés aux propriétés antioxydantes, tel que les fruits (9), tandis que d’autres comme les viandes contiennent des composés au potentiel plutôt néfaste sur la santé (10,11). En fait, de nombreuses études prospectives associent la consommation de fruits à une meilleure santé cardiométabolique (12). À l’inverse, des apports élevés en viande rouge et en charcuteries semblent favorables à l’augmentation des risques de mortalité et de morbidité (13–15), bien que ceci soit actuellement un sujet controversé (16). Avec des dépenses en santé de 183,1 milliards de dollars dont 27,6 milliards pour les médicaments d’ordonnance en 2010 au Canada (17), est-il possible d’espérer que les aliments puissent agir à titre de médicaments? Dans cette optique, il est d’intérêt d’étudier plus en profondeur ces deux catégories d’aliments afin d’explorer leur rôle dans l’amélioration, le maintien ou la détérioration de la santé.
Les travaux décrits dans ce mémoire ont pour objectif d’évaluer comment les consommations de protéines d’origine animale dont principalement la viande rouge, et celle de bleuets, influencent la santé métabolique d’individus à risque ou présentant le SM. D’abord, la première section du chapitre initial vise à définir et expliquer les composantes du SM en plus d’identifier ses principaux facteurs de risque. La seconde section est dédiée au rôle du stress oxydatif dans le développement de ce syndrome. Quant à elle, la troisième section aborde l’influence que possède l’alimentation sur la santé, en mettant l’accent sur les viandes et les petits fruits.
La détection précoce des maladies chroniques est une composante essentielle de leur gestion efficace. Parmi les biomarqueurs potentiels, les niveaux plasmatiques d’acides aminés à chaîne ramifiés (AACR) sont reconnus comme prédicteurs fiables du développement de la RI (18) et même des maladies cardiovasculaires (MCV) (19). Bien que plusieurs études aient démontré le lien entre les concentrations plasmatiques d’AACR et la présence ou le développement de maladies chroniques, les mécanismes d’action sous-jacents à cette augmentation sont encore méconnus bien que quelques hypothèses aient été formulées. Sachant que la viande est la principale source de ces acides aminés, le premier article présenté dans ce mémoire vise à vérifier l’association entre la consommation de protéines d’origine animale et végétale et les niveaux plasmatiques d’AACR dans une cohorte incluant des individus sains ou au profil métabolique détérioré.
De tous les fruits, les baies et tout particulièrement les bleuets sont parmi les aliments les plus riches en composés antioxydants (20). De nombreuses études chez l’animal ont préalablement démontré le potentiel de ce petit fruit à améliorer divers paramètres de la santé cardiométabolique (21–23). Malgré tout, les études chez l’humain demeurent équivoques (24,25). Le second article présenté rapporte donc les résultats d’un essai randomisé contrôlé à double insu investiguant l’effet d’une supplémentation de huit semaines en poudre de bleuets (PB) sur divers paramètres relatifs à la santé cardiométabolique, et ce chez des individus à risque de souffrir du SM.
Chapitre I : Problématique
1.1 Le syndrome métabolique
1.1.1. Description du syndrome métabolique
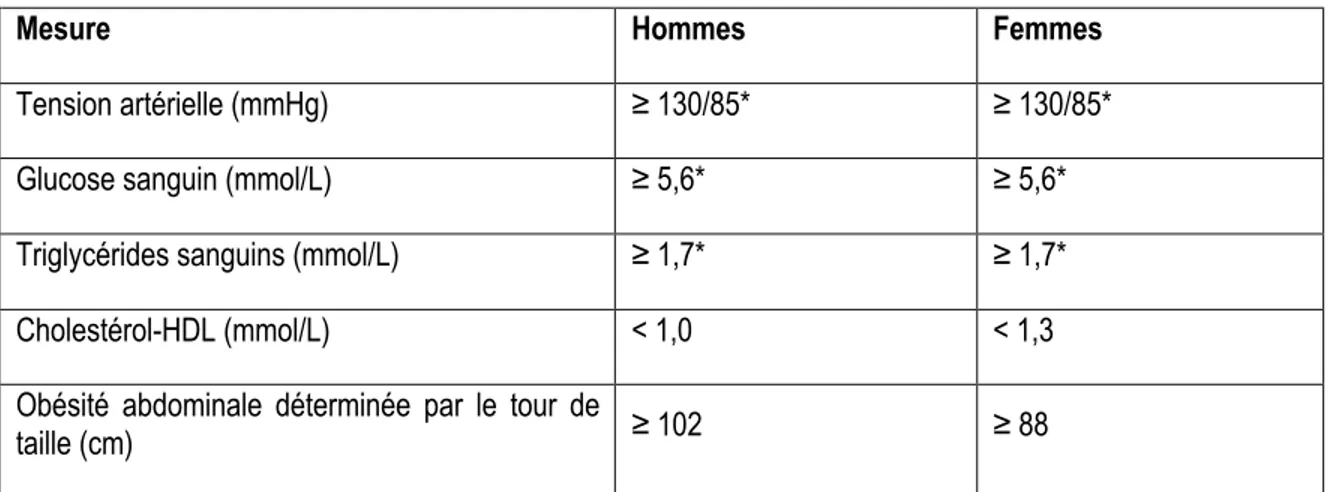
Le SM n’est pas une maladie en soi. Il s’agit plutôt d’un ensemble de facteurs de risque prédisposant au développement de maladies cardiovasculaires et métaboliques. Comme leur progression est asymptomatique, le diagnostic du SM chez un individu s’avère un outil pratique permettant d’initier certains traitements visant à ralentir la progression de pathologies pour la plupart irréversibles. Plus précisément, selon l’American Heart Association, un individu souffre du SM lorsqu’il possède trois des cinq critères présentés au Tableau 1 (26). Ces critères incluent des mesures physiques et biochimiques facilement accessibles dans un contexte clinique. Les données de 2007-2009 de la Canadian Health Measures Survey révélaient que 19,1% des adultes Canadiens répondaient aux critères du SM, la prévalence étant plus importante chez les femmes (20,5%) que chez les hommes (17,8%) (27). Toutefois, comme l’obésité est reconnue comme un facteur de risque majeur, une valeur de référence plus faible pour le critère du tour de taille a aussi été proposée. Ce seuil plus strict est de ≥ 94 cm pour les hommes et ≥ 80 cm pour les femmes. À ce moment, ce serait alors plutôt 23,2% des adultes (23,4% des hommes et 22,9% des femmes), qui souffriraient du SM. Les prévalences augmentent généralement avec l’âge et sont plus élevées chez les individus moins éduqués (27). La prévalence est plus élevée aux États-Unis, où 34,7% des adultes de 20 ans et plus (32,8% des hommes et 36,6% des femmes), satisfont les critères les plus conservateurs (28).
Tableau 1. Conditions menant au diagnostic du syndrome métabolique
Mesure Hommes Femmes
Tension artérielle (mmHg) ≥ 130/85* ≥ 130/85*
Glucose sanguin (mmol/L) ≥ 5,6* ≥ 5,6*
Triglycérides sanguins (mmol/L) ≥ 1,7* ≥ 1,7*
Cholestérol-HDL (mmol/L) < 1,0 < 1,3
Obésité abdominale déterminée par le tour de
taille (cm) ≥ 102 ≥ 88
* Ou prise de médication abaissant ces valeurs. Abréviations : mmHg : millimètres de mercure; HDL : lipoprotéines de densité élevée.
1.1.2 Développement du SM
La RI et l’obésité abdominale sont reconnues comme des composantes clés du SM. En fait, la RI est souvent mise de l’avant comme étant précurseur aux autres dérèglements métaboliques caractéristiques du SM. La RI survient lorsque l’organisme ne répond plus à une sécrétion normale d’insuline alors que les niveaux de glucose sanguins s’élèvent, comme c’est le cas en période postprandiale. L’organisme réagit alors en produisant une plus grande quantité d’insuline. Cette hyperinsulinémie compensatoire permet une gestion presque normale des réserves de glucose, ainsi, le patient n’en ressentira aucun symptôme (29,30). Or, après un certain temps, les cellules bêta du pancréas ne sont plus en mesure de poursuivre à ce rythme de production effréné, si bien que les niveaux plasmatiques de glucose demeurent élevés en permanence. L’individu est alors intolérant au glucose, le dernier stade avant le diabète de type 2 (DBT2) franc. Le pré-diabète, comprenant la RI et l’intolérance au glucose, est fréquemment rencontré de façon concomitante avec l’hypertension et les dyslipidémies étant donné le rôle de l’insuline dans ces pathologies (31).
L’insuline est une hormone anabolique : normalement, sa sécrétion entraine la mise en réserve du glucose sous forme de glycogène (glycogénèse) dans les tissus sensibles à l’insuline, principalement le foie, le tissu adipeux et les muscles squelettiques (29,32). Elle inhibe également la lipolyse au niveau du foie et du tissu adipeux et stimule la lipoprotéine lipase, une enzyme permettant la libération des triglycérides (TG) des lipoprotéines et leur stockage (32,33). Comme la RI implique que l’insuline est moins efficace et/ou présente en plus faible concentration, son action anabolique sera affaiblie, résultant en une augmentation de la lipolyse et du flux d’acides gras libres en circulation (29,33). Les acides gras libres pourront en retour modifier les voies de signalisation métaboliques, inhiber la capture de glucose par le muscle squelettique et, dans le foie, augmenter la synthèse de glucose, de TG et conséquemment, de lipoprotéines de très faible densité (VLDL). Ceci encourage d’autant plus la RI (29). En parallèle, des niveaux réduits de lipoprotéines de densité élevée (HDL) et une prédominance de lipoprotéines de faible densité (LDL) petites et denses (plus athérogènes que celles de grande taille), sont souvent observés (33). Mais encore, l’insuline est impliquée dans quatre aspects majeurs de la fonction vasculaire. D’abord, un état hyper-insulinique stimule la réabsorption de sodium en activant la pompe à cations au niveau des tubules rénaux, résultant en l’augmentation du volume plasmatique (34). Ensuite, l’insuline augmente la sécrétion d’endothéline-1 et active le système nerveux sympathique, tous deux ayant un effet vasoconstricteur (34). Finalement et non le moindre, l’insuline régule la tension artérielle en induisant la libération d’oxyde nitrique, un vasodilatateur et antiagrégant au niveau de l’endothélium vasculaire (34). Or, cette fonction est fortement perturbée en présence de RI. Pour terminer, au niveau du muscle, le principal site d’entreposage du glucose en période postprandiale, la RI compromet la dilatation et le recrutement des petits capillaires, y réduisant donc le flux sanguin ce qui nuit à l’entreposage du glucose, perpétuant l’état hyperglycémique (35,36).
1.1.3 Diagnostic précoce du SM
Tel que mentionné plus haut, le développement du SM se fait de façon insidieuse. Comme ils sont asymptomatiques, des taux anormaux de lipides et de glucose sanguins et une tension artérielle élevée ne sont détectables qu’en clinique. En conséquent, à moins d’être suivi régulièrement par un médecin, plusieurs années peuvent s’écouler avant que le SM ne soit diagnostiqué. Parfois, les dommages sont déjà faits et l’individu se présente à l’hôpital avec un diabète franc ou une MCV. À ce moment, l’état pathologique est donc bien installé et n’est souvent plus réversible. Le seul critère visible permettant de suspecter le SM est donc le tour de taille. Comme il reflète mieux la quantité de gras intra-abdominal que l’indice de masse corporel (IMC), il s’agit d’un important prédicteur du risque de DBT2 et de MCV, et ce autant pour les hommes que les femmes, peu importe leur âge et leur ethnicité (37). D’ailleurs le tour de taille corrèle avec le risque de DBT2 et ce, indépendamment de l’IMC (37).
Toutefois, il s’avère que les individus en surpoids ou obèses puissent être métaboliquement sains (38,39). Il est donc d’intérêt de s’attarder à l’utilisation d’autres biomarqueurs permettant de prédire l’apparition du SM de façon plus précise. Parmi ceux-ci, la concentration plasmatique d’acides aminés à chaîne ramifiée (AACR), incluant la leucine, la valine et l’isoleucine (40), est rapportée dans la littérature comme étant un indicateur précoce de la RI et du risque cardiométabolique (41,42).
L’élévation des niveaux plasmatiques d’AACR se voit de façon concomitante avec la présence d’obésité ainsi qu’avec plusieurs facteurs de risque cardiovasculaire et de DBT2 (19,43–49) tels un tour de taille ou un IMC élevés, des valeurs plasmatiques élevées de glucose à jeun, d’hémoglobine glyquée (HbA1c), de TG ou d’acide urique, et des valeurs plasmatiques diminuées de cholestérol-HDL (50). Les niveaux d’AACR augmenteraient aussi en parallèle avec la quantité de facteurs de risque du SM présents, tels que décrits dans le Tableau 1 (50). En procédant par analyse de composante principale, certains auteurs ont également mis en lumière des grappes de métabolites associés à une santé cardiométabolique détériorée (46,51). Parmi ceux-ci, deux facteurs respectivement composés des AACR et de leurs métabolites et d’acylcarnitines (AC) à chaine courte dont C3 et C5, étaient significativement différents entre les individus selon qu’ils soient en santé ou présentant un profil métabolique détérioré, ceci indépendamment de leur IMC (46). Cette différence était plus prononcée dans le sous-groupe d’individus obèses, mais elle met tout de même en lumière la limite de l’IMC comme prédicteur du SM (46).
À ce jour, les mécanismes sous-jacents à l’élévation des taux plasmatiques d’AACR demeurent méconnus. D’autre part, il est incertain si cette élévation est la conséquence d’une détérioration métabolique ou si elle en est la cause, que ce soit en tout ou en partie. Des hypothèses ont toutefois été énoncées. Pour commencer, l’expansion du tissus adipeux, l’état inflammatoire qui l’accompagne et l’effet de ce dernier sur les tissus sensibles à l’insuline pourraient être les premiers événements menant à l’augmentation des niveaux d’AACR (42). Le catabolisme des AACR débute par leur transamination par l’aminotransférase à chaine ramifiée (BCAT), une étape réversible se déroulant dans les tissus périphériques (Figure 1) (52). Ceci génère un acide alpha-cétonique à chaine ramifiée, qui sera par la suite décarboxylé de façon oxydative et définitive par le complexe déshydrogénase de l’acide alpha-cétonique à chaine ramifiée (BCKD) (40,53). Les sous-produits suivants pourront dès lors être utilisés par le cycle de Krebs (53,54).
Les AACR ont comme autres sous-produits de métabolisme les acylcarnitines C3 et C5, dont les niveaux plasmatiques ont également été rapportés comme étant plus élevés conjointement avec la présence de DBT2 ou de facteurs de risque cardiovasculaire (43). Chez l’humain, bien que l’activité de l’enzyme BCAT serait supérieure dans les muscles et le foie, elle serait tout de même présente dans le tissus adipeux (55). Comme cette masse occupe une certaine surface corporelle chez les individus obèses, sa contribution n’est pas à négliger. De ce fait, certaines études chez l’animal ont mis en évidence la réduction de l’expression d’enzymes impliquées dans l’oxydation des AACR dans le tissu adipeux de souris résistantes à l’insuline (56). Une réduction de l‘oxydation des AACR en présence de facteurs inflammatoires pourrait aussi être en cause (57). Chez l’humain, des résultats comparables ont été rapportés dans un groupe d’individus obèses avec ou sans diabète, qui présentaient une diminution de l’expression de la protéine BCKD, bien que ceci n’était vrai que chez les hommes (58). Finalement, dans une étude réalisée chez des femmes uniquement, cette diminution des enzymes fut principalement observée au niveau du gras viscéral et non sous-cutané, dont la masse était associée aux niveaux d’AACR (48).
Selon une autre hypothèse, l’augmentation dans la disponibilité plasmatique des AACR pourrait induire la RI dans les tissus périphériques. Les AACR, et particulièrement la leucine, peuvent activer la voie anabolique du
mammalian target of rapamycin complex 1 (mTORC1) (59). L’activation de cette voie induit la phosphorylation
de la protéine S6 kinase 1, qui phosphoryle à son tour le substrat 1 du récepteur à l’insuline, l’inhibant et induisant sa dégradation (9,60). La liaison de l’insuline est dès lors compromise, favorisant l’apparition d’un état de RI par la réduction de la capture du glucose en circulation et de sa mise en réserve (59–64).
Dans l’analyse des facteurs causaux potentiels sous-jacents à l’augmentation des niveaux d’AACR, il faut considérer que ces acides aminés sont essentiels, et donc qu’ils doivent provenir de l’alimentation. En effet, 11 des 21 acides aminés nécessaires chez l’humain ne peuvent pas être synthétisés par le corps ou l’être en quantité suffisante (65). Une diète excluant l’un d’entre eux n’est donc pas viable (65). Les principales sources d’AACR dans les pays industrialisés sont la viande rouge, la volaille, le poisson et le lait entier aux États-Unis (66) et au Royaume-Uni (67), et la viande rouge, la volaille, le pain, le riz et les légumineuses au Brésil (68). Dans ces populations, une association positive entre les niveaux plasmatiques d’AACR et la présence de RI fut rapportée. À l’opposé, une association inverse entre les niveaux d’AACR et la RI fut observée chez les femmes d’une cohorte japonaise dont les apports en AACR provenaient d’aliments principalement végétaux, soit les céréales, les pommes de terre et l’amidon, suivis des poissons et fruits de mer puis des viandes (69). De surcroit, une étude a identifié un patron alimentaire corrélant avec les concentrations plasmatiques d’AACR et expliquant 32,5% de leur variation. Ce patron, basé sur l’alimentation des quatre dernières semaines, corrélait positivement avec la consommation de viandes, saucisses, sauces, œufs et crème glacée, mais négativement avec celle de noix, céréales, champignons et légumineuses (70). Ainsi, le type d’aliment desquels proviennent ces acides
aminés pourrait influencer la façon dont ils sont métabolisés. Ceci va de pair avec les nombreuses études démontrant l’augmentation des risques de mortalité ou de souffrir de maladies métaboliques avec une plus grande consommation de protéines totales ou de protéines d’origine animale (71–73) ou d’AACR (66,67,74– 76). Dans cet ordre d’idées, des études suggèrent qu’une réduction de la consommation d’AACR permettait d’améliorer la santé métabolique chez la souris (77,78) et l’humain (66).
1.1.4 Facteurs de risques du SM
Nombreux sont les facteurs pouvant influencer le risque de développer le SM. Ceux-ci peuvent être contrôlables ou non et n’ont pas tous la même importance pour chacune des conditions entrant dans la définition du SM.
1.1.4.1 Surplus pondéral
De multiples facteurs dont la génétique, le stress et la prise de médication peuvent contribuer au surplus de poids. Il est cependant clair que les habitudes de vie y participent grandement. L’obésité, résultant d’un apport calorique accru, de choix alimentaires sous-optimaux et d’une dépense énergétique insuffisante, serait à la base du développement de la RI et serait le principal prédicteur du développement du SM (5). L’inactivité physique et la prise de poids sont d’ailleurs associées au risque de SM (79). Plus particulièrement, l’adiposité abdominale génère un stress métabolique important déréglant le métabolisme des nutriments et entrainant, à plus ou moins long terme, un état de stress oxydatif perpétuant l’état pathologique qui se développe (31). Le rôle de l’obésité dans le développement du SM sera discuté plus en profondeur à la section 1.2.2.2.
1.1.4.2 Age, sexe et ethnicité
L’âge est un des principaux facteurs de risque du SM. Par exemple, la prévalence du SM de la cohorte de la
Third National Health and Nutrition Examination Survey (NHANES) était de 6,7% chez les participants de 20 à
29 ans tandis qu’elle passait à 43,5% pour ceux de 60 à 69 ans (80). Dans cet article, la prévalence n’était pas significativement différente entre les hommes et les femmes. Toutefois, Carthenon et coll. et Ford et coll. ont respectivement observé une prévalence accrue chez les femmes noires (79) et celles d’origine africaine ou mexicaine (80), respectivement. En fait, il semble que les hommes aient un risque légèrement plus élevé d’en souffrir que les femmes avant 50 ans, mais que cette observation serait renversée après cet âge (81). L’effet des changements hormonaux lors de la ménopause sur la RI, l’obésité androïde et les niveaux de cholestérol-HDL expliquerait l’augmentation de la prévalence de SM chez les femmes après cette période (81).
1.1.4.3 Tabagisme
augmentent le stress oxydatif au niveau des cellules endothéliales du fumeur, affectant leur intégrité (82). La santé vasculaire étant une composante du SM évaluée par la mesure de la tension artérielle, il est justifié de considérer le tabagisme comme un facteur de risque de ce syndrome. Dans leur étude réalisée en Taiwan, Chen et coll. ont rapporté que comparativement aux anciens fumeurs et aux non-fumeurs, une plus grande proportion de fumeurs présentait des niveaux de TG élevés et de cholestérol-HDL bas (83). Les anciens fumeurs étaient aussi plus nombreux à faire de la haute tension, et le SM était plus prévalant chez les fumeurs que chez les deux autres groupes. Finalement, ces associations montraient une relation dose-dépendante avec la quantité de cigarettes fumées (83). Par contre, selon le modèle multi-ajusté de Monsanto et coll., la relation entre le tabagisme et le SM serait influencée par d’autres facteurs de risque, limitant la probabilité d’une association directe (84). Tout de même, une méta-analyse regroupant plus de 50 000 individus de trois continents différents a décrit un risque relatif augmenté de 26% en comparant les fumeurs actuels à ceux ne fumant pas (85).
1.1.4.4 Statut socio-économique
Deux grandes études de cohorte américaines ont rapporté une augmentation du risque de souffrir du SM chez les individus ayant le plus faible niveau de scolarité (secondaire ou moins) (79,86). Ceci pourrait être relié au statut socioéconomique généralement plus faible de ces individus, augmentant leur stress et limitant leur accès aux soins de santé. D’ailleurs, Montano et coll. ont rapporté une association entre l’anxiété ou la dépression et le risque de SM (84). L’association entre le statut-socioéconomique et le SM pourrait aussi dépendre de la présence d’autres facteurs de risque notamment reliés aux habitudes de vie et à l’origine ethnique (79). Montano et coll. ont tenté de contrer ce problème par leurs analyses utilisant deux modèles de régression incluant ou non certaines habitudes reliées à la santé comme médiateurs du risque. Conformément aux autres études citées dans ce paragraphe, ils ont observé qu’un niveau socio-économique plus élevé, un revenu également plus élevé, le statut professionnel et la présence d’un partenaire de vie étaient associés à une prévalence réduite du SM. Dans le modèle ajusté pour les facteurs confondants reliés à la santé, ces effets étaient réduits bien qu’un niveau d’éducation supérieur et la présence d’un partenaire de vie persistaient comme de plus forts protecteurs envers le SM (84).
1.1.4.5 Génétique et histoire familiale
Les résultats d’études d’associations pangénomiques portent à croire que le SM possède une composante héréditaire. Il est estimé que le SM serait héritable de 24 à 30%, ce pourcentage variant selon la population étudiée (87). L’hérédité aurait une responsabilité différente sur chacune des caractéristiques du SM, allant de 15% pour la tension systolique à 60% pour les niveaux de cholestérol-HDL dans une cohorte hispanique (88). Plusieurs loci d’intérêt se trouveraient sur des gènes associés au métabolisme des lipides ou associés aux
niveaux sanguins de lipides. De plus, des changements épigénétiques tel que la méthylation de l’ADN pourraient aussi avoir une influence sur l’expression de gènes impliqués dans la pathologie du SM (87). D’autres études ont mis de l’avant l’histoire familiale comme facteur de risque du SM. Lipinska et coll. ont observé des niveaux de cholestérol-total et -LDL plus élevés chez les enfants adultes d’individus présentant le SM de ceux d’individus sans SM (89). D’autre part, les prévalences d’obésité et de tabagisme (actuel ou antérieur), étaient aussi augmentées chez les individus ayant une histoire familiale de diabète et/ou de MCV dans la population NHANES III (90). Les prévalences d’hypertension, de diabète et de MCV étaient aussi plus élevées chez ces individus, les prédisposant alors à souffrir plus tard du SM (90).
1.1.4.6 Activité physique
L’activité physique est une importante composante associée à la santé et aux maladies chroniques. En effet, la majorité des études concluent en une association inverse entre la pratique d’activité physique ou sportive et le risque de DBT2. Une méta-analyse a d’ailleurs rapporté une diminution significative du risque de 35% en comparant les individus les plus actifs à ceux les moins actifs (91). Même des activités de plus faible intensité telles que la marche ou les activités de la vie quotidienne s’avéraient bénéfiques sur le risque de DBT2 (91). Cette diminution ne serait pas linéaire, avec une plus forte pente à un niveau d’activité faible, qui tend à s’adoucir plus le niveau d’activité augmente (91). Pour sa part, la relation inverse entre le temps consacré à l’activité physique et le risque de SM semblait plutôt linéaire dans une autre méta-analyse (92). Des résultats comparables à ceux d’Aune et coll. ont aussi été rapportés dans une méta-analyse par Wahid et coll. selon laquelle passer d’un état d’inactivité physique à un niveau d’activité correspondant à la recommandation de 150 minutes par semaine d’activités aérobiques d’intensité modérée réduisait les risques de MCV de 17%, ceux de mortalité par MCV de 23% et ceux de DBT2 de 26% (93). La réduction du risque sans ajustement pour le poids corporel n’étant que légèrement plus élevée, les effets bénéfiques du sport sur les composantes du SM seraient donc en majeure partie indépendants du poids (93). Finalement, en utilisant les données de la phase 2003-2006 de NHANES, Dankel et coll. ont décrit que les individus respectant les recommandations d’activité physique (tel que décrites plus haut), et d’activités de renforcement musculaire (au moins deux sessions par semaine), avaient un risque de souffrir du SM respectivement de 61 et 25% plus faible que ceux n’atteignant pas ces recommandations (94). En combinant les deux types d’activités, c’est plutôt une diminution 70% des risques qui fut énoncée (94).
1.1.4.7 Alimentation
Tel que mentionné au début de cette sous-section, le surplus de poids est un facteur de risque important pouvant être influencé par l’adoption d’habitudes alimentaires saines. D’abord, quelques patrons alimentaires ont
découlant. Parmi ceux-ci, la diète méditerranéenne est probablement la plus connue et parmi les plus recommandées par les professionnels de la santé. Ses effets sur la gestion du poids, de la glycémie, de la tension artérielle et des lipides sanguins seraient principalement dus à sa richesse en aliments aux propriétés antioxydantes et antiinflammatoires (95–97). D’autres types de diètes similaires dites « prudentes » semblent démontrer un effet protecteur sur le risque de SM comparativement aux diètes « western », bien que l’effet ne serait pas aussi fort dans les études de cohorte que celles transversales (98). Brièvement, une diète « prudente » comprend davantage de légumes, fruits, grains entiers, poissons et fruits de mer, volaille, légumineuses, huile, noix, graines et produits laitiers faibles en gras, alors que celle « western » est caractérisée par la présence accrue de viandes, charcuteries, céréales raffinées, sucreries, desserts, fast-food, collations et boissons sucrées (98). Certaines diètes (réduites en énergie, basées sur l’index glycémique, végétarienne, Nordique ou DASH), peuvent également être recommandées tandis que d’autres (riche en acides gras omega-3, modérée à riche en protéines, à haute fréquence de repas (high meal frequency) ou faibles en glucides), doivent encore faire leurs preuves (99,100).
D’un autre côté, certaines études se sont penchées sur la consommation d’aliments ou de groupes d’aliments précis. Notamment, Kim et coll. ont rapporté que la consommation de produits laitiers (tous types confondus), réduisait le risque de SM d’environ 15% en comparant le plus haut versus le plus bas niveau de consommation (101). Également en comparant ces deux niveaux de consommation, Tian et coll. ont quant à eux rapporté une diminution du risque de SM de 13%, 15% et 24% respectivement pour la consommation de fruits, légumes et fruits et légumes combinés (12). La consommation d’alcool (tous types confondus), n’a quant à elle révélé aucun changement dans le risque global de développer le SM (102). Toutefois, les très petits buveurs (0.1-5 g d’éthanol par jour) présentaient un risque diminué (RR 0.86, 95% IC : 0.75-0.99) et les très grands buveurs (>35 g/jour) présentaient un risque augmenté (1.84, 95% IC :1.34-2.52). Stratifié selon le sexe, ces différences étaient statistiquement significatives seulement chez les hommes (102). Une précédente méta-analyse sur le sujet avait plutôt identifié que les hommes et les femmes consommant de façon modérée (respectivement 0.1-39.9 g d’éthanol/jour et 0.1-19.9 g d’éthanol/jour), avaient un risque réduit de souffrir du SM versus les non-buveurs (103). Ainsi, il semblerait qu’une consommation légère d’alcool soit protectrice mais qu’une consommation plus grande puisse être associée à un risque augmenté de SM. Finalement, Micha et coll. ont conclu à une forte association entre la consommation de viandes transformées et le risque de MCV et de DBT2 (104). Les évidences étaient moins fortes quant aux viandes rouges non transformées (104).
1.2 Le stress oxydatif
1.2.1 Description et développement du stress oxydatif
Les molécules ne sont pas immuables. Dans le corps, elles sont sujettes à diverses altérations faisant ou non partie de leur métabolisme normal. Notamment, le métabolisme cellulaire génère une quantité importante de molécules au fort pouvoir oxydant. Il s’agit des RL et autres espèces réactives de l’oxygène (ERO) ou de l’azote (ERN) (4). Les RL sont des molécules ayant perdu un électron sur leur dernière orbitale atomique, ce qui leur confère un haut niveau d’instabilité. Pour tenter de retrouver leur état initial, les RL auront tendance à capter ou donner un électron à une autre molécule (4,105). Le radical hydroxyle est parmi les plus connus étant donné sa très haute réactivité (4,105). Bien que les termes « radical libre » et « espèce réactive de l’oxygène » soient souvent confondus, ils ne sont pas tout à fait synonymes. En effet, les ERO et ERN contiennent respectivement un groupement oxygène ou azoté hautement réactif, sans nécessairement être des molécules radicalaires (106). Il s’agit par exemple de l’anion superoxyde et du peroxyde d’hydrogène (4,105). Les RL et les ERO/ERN peuvent s’attaquer à divers types de molécules, dont les protéines, les lipides, le matériel génétique (ADN) et l’ARN (106). Des attaques radicalaires sur les molécules présentes dans une cellule peuvent engendrer divers dommages à leur structure et leurs fonctions, modifiant alors leurs processus biologiques ou pouvant causer leur apoptose. Ainsi, les RL seraient particulièrement impliqués dans l’initiation de dommages cellulaires associés au développement de diverses maladies chroniques (106).
Le corps possède plusieurs moyens de défense afin de contrer la production d’EROs. Ceux-ci seront couverts dans la section 1.2.3. Tout de même, il faut préciser que les EROs n’entrainent pas nécessairement des perturbations néfastes aux processus biologiques du corps humain. En fait, ces molécules jouent plusieurs rôles physiologiques importants en étant impliquées dans la synthèse de composantes cellulaires, la défense contre les pathogènes et dans diverses voies de signalisation cellulaire (3). Ceci étant dit, il arrive que la production de RL soit telle que le corps n’arrive plus à les neutraliser. Il se peut aussi que ce soit plutôt les défenses antioxydantes (i.e. molécules qui neutralisent ou amoindrissent l’activité des ROS), qui soient trop peu nombreuses ou efficaces pour gérer adéquatement les EROs. Dans les deux cas, ce déséquilibre oxydant-antioxydant entraînera ce qu’on appelle un état de stress oxydatif. Mais, pour réellement parler de stress oxydatif, ce déséquilibre en faveur des oxydants doit aussi être accompagné d’une perturbation dans les voies de signalisation cellulaires et/ou de dommages aux molécules (107).
1.2.2 Impacts du stress oxydatif sur la santé cardiométabolique
Le stress oxydatif contribuerait à la survenue et à l’entretient de nombreuses maladies chroniques. En plus d’être associé au cancer, à la maladie de Parkinson, à la dépression, aux maladies rénales et à celles
pulmonaires, il est impliqué dans trois conditions particulières au SM dont il fut question plus haut: l’athérosclérose, l’obésité et la RI (3,108,109).
1.2.2.1 Athérosclérose
L’athérosclérose, intimement associée aux MCV, est considérée comme une maladie chronique inflammatoire des vaisseaux sanguins (110). Celle-ci se développerait graduellement avec l’accumulation de lipides et de cellules inflammatoires dans la paroi des vaisseaux sanguins (110,111). Le processus athérosclérotique est initié par l’apparition de lésions appelées stries lipidiques au niveau de l’endothélium, le rendent perméable au passage de diverses molécules dans la paroi vasculaire. Ces lésions sont appelées « stries lipidiques » puisqu’elles seront infiltrées par les LDL, qui se logeront dans l’intima (110,111). Les LDL, de par leur contenu élevé en lipides, sont particulièrement sujettes à l’oxydation suivant une attaque enzymatique ou radicalaire (110). Les individus en situation de stress oxydatif y sont donc spécialement sensibles. Une fois oxydées, les dénommées LDL-Ox pourront alors produire ou favoriser l’expression de chimiokines et de molécules d’adhésions telles que la VCAM-1 (Vascular cell adhesion molecule-1) et les P- et E-sélectines à la surface de l’endothélium (110,111). Les chimiokines ont la capacité d’attirer les leucocytes telles que les lymphocytes-T et les monocytes. Les monocytes peuvent ensuite migrer dans l’intima où ils se différencieront en macrophages qui goberont les LDL-ox, devenant des cellules spumeuses gorgées de cholestérol, elles-mêmes sécrétant diverses cytokines inflammatoires impliquées dans la progression de la plaque athéromateuse de par leur production d’EROs (111,112). De leur côté, les lymphocytes-T peuvent produire des médiateurs de l’inflammation favorables à la progression de la plaque d’athérosclérose (110). Au fur et à mesure de son expansion, la lumière vasculaire rétrécit, impactant le flux sanguin. À ce moment, certains signes cliniques peuvent être mesurés tels qu’une tension artérielle plus élevée. Les lipides et les cellules inflammatoires contenus dans la lésion athéromateuse sont bien emprisonnés dans l’intima et séparés de la lumière vasculaire par une chape fibreuse principalement composée de matrice extracellulaire et de cellules musculaires lisses (113). La plaque peut toutefois se rompre, surtout si elle est riche en lipides, en médiateurs de l’inflammation et que sa chape fibreuse est mince (113). Au moment de sa fracture, le contenu de la plaque se déverse dans le sang, ce contact entrainant la formation d’un caillot. S’il se détache et est d’une certaine taille, il suivra le flot sanguin et terminera sa route au milieu d’un vaisseau ou une artère de plus faible calibre, bloquant la circulation et entrainant un infarctus thrombotique (112). Bien qu’une plaque rompue puisse se réparer par la prolifération des cellules musculaires lisses là où les lipides et les cellules inflammatoires étaient emprisonnées, la lumière vasculaire demeurera réduite et l’intima sera fibreuse et peu élastique (112).
Ainsi, de nombreux facteurs inflammatoires sont présents dès la formation d’une strie lipidique. Il faut aussi considérer que les cellules endothéliales contiennent des systèmes enzymatiques pouvant générer des RL, des
ERO ou des ERN. Il s’agit notamment de la NADPH oxydase, de la xanthine oxydase, de la chaine respiratoire mitochondriale et de l’oxyde nitrique synthase, dont le métabolisme est source d’anion superoxyde et/ou de peroxyde d’hydrogène (113,114).
1.2.2.2 Obésité et résistance à l’insuline
Le tissu adipeux est d’abord composé d’adipocytes, mais aussi d’autres cellules au potentiel inflammatoire pouvant être source de stress oxydatif (115). En fait, les adipocytes matures possèdent des propriétés métaboliques de synthèse et de sécrétion de médiateurs biochimiques ce qui permet de considérer le tissu adipeux comme un organe aux propriétés paracrines et endocrines (29,116,117). Il est notamment peuplé de macrophages, le principal type de cellule immunitaire dans ce tissus (115). Ces derniers s’activeraient en réponse à un excès en nutriments et contribueraient à l’hypertrophie et à la multiplication des adipocytes en résultant (115,118). Ce processus libère davantage de macrophages et de cytokines pro-inflammatoires telles que l’interleukine-6, le facteur de nécrose tumorale (TNF-alpha) et les adipokines (29,116,119), perpétuant l’état d’inflammation. En outre, la croissance du tissus adipeux peut outrepasser la capacité de la vascularisation déjà présente à irriguer adéquatement ce tissu, générant un état d’hypoxie fortement inflammatoire (29,115,118,119). Aussi, les cytokines produites par les macrophages induiraient l’expression de molécules d’adhésion initiant le processus d’athérosclérose (101). De plus, elles contribueraient au développement de la RI par leur effet inflammatoire et, plus précisément, la TNF-alpha agirait en empêchant la phosphorylation du récepteur à l’insuline, nuisant à la capture du glucose en circulation pour fins de mise en réserve (120,121). Un lien semble aussi se tisser entre différentes kinases impliquées dans la phosphorylation du récepteur à l’insuline et la surproduction d’EROs provenant de mitochondries dysfonctionnelles, la mitochondrie étant l’un des plus grands générateurs de EROs dans le corps (122). En fait, jusqu’à 2% (106) des électrons s’échapperaient de la chaine de transport des électrons, principalement au niveau des complexes I et III (113), se transformant en ions superoxydes. Ces RL peuvent être métabolisés par la superoxyde dismutase en peroxyde d’hydrogène, puis réagir avec le l’ion ferreux afin de former le radical hydroxyle par la réaction de Fenton (105,123). Le peroxyde d’hydrogène serait capable de moduler la voie de signalisation de l’insuline tandis que le radical hydroxyde, hautement réactif, peut causer des dommages irréversibles aux macromolécules (123). Étant donné la disponibilité accrue de nutriments en circulation en présence de RI, les mitochondries devront augmenter leur activité, générant de façon proportionnelle davantage de ces EROs (122–124). Ce stress oxydatif supplémentaire sur les mitochondries résultera en une diminution de leur efficacité à oxyder les substrats du cycle de Krebs en adénosine triphosphate (ATP) (123,124). Finalement, les cellules bêta du pancréas sont sensibles à l’inflammation, si bien qu’un état de stress oxydatif peut également contribuer à leur difficulté à sécréter suffisamment d’insuline lorsque les tissus périphériques y deviennent résistants (124).
1.2.3 Moyens de défense contre le stress oxydatif
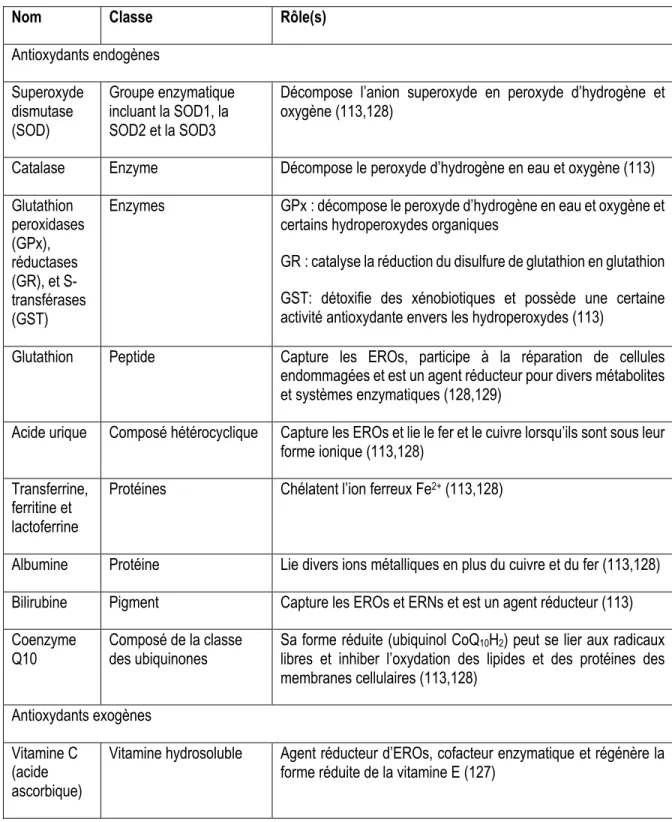
Différentes situations peuvent être source de RL et donc potentiellement entrainer un état de stress oxydatif. L’alimentation, la médication, le tabagisme, l’activité physique, les polluants, les radiations et les pesticides sont autant de facteurs comportementaux et environnementaux susceptibles d’y contribuer (4,105,106). Ces derniers ont l’avantage d’être contrôlables, du moins à un certain degré, par l’individu. Ainsi, la gestion de ces facteurs de risque s’avère importante dans la prévention de plusieurs pathologies liées au stress oxydatif. D’un autre côté, tel que discuté plus haut, les EROs sont des sous-produits normaux de nombreux processus biologiques. La maladie, le stress et diverses conditions aigues telle une ischémie ou un traumatisme sont aussi génératrices d’EROs (106). Fort heureusement, un peu comme les EROs peuvent être produites par le corps ou apportées par l’environnement, le corps humain possède un système d’antioxydants endogènes couplé à celui exogène, modulable par l’alimentation. Brièvement, un antioxydant se veut une molécule ayant la capacité de donner un de ses électrons à un RL, diminuant ainsi son niveau de réactivité sans toutefois devenir hautement réactif à son tour (4). Il peut aussi s’agir d’une enzyme catalysant une réaction visant la neutralisation de l’ERO (4). Les antioxydants endogènes sont synthétisés par l’organisme. Dans les cellules, l’élévation des niveaux d’EROs entrainera l’augmentation de l’expression de gènes possédant une activité antioxydante ou l’expression d’enzymes antioxydantes directement (125). Ces derniers incluent notamment la superoxyde dismutase, la catalase et la glutathion réductase, peroxydase et transférase. Quant aux autres molécules au pouvoir antioxydant, nommons le glutathion, l’acide urique, la transferrine, l’albumine, la bilirubine et la coenzyme Q10. Elles sont décrites plus en détail dans le Tableau 2.
Pour leur part, les antioxydants exogènes se retrouvent dans l’organisme par l’alimentation ou la supplémentation. Du côté des vitamines ayant démontré une capacité antioxydante se trouvent les vitamines C, E (principalement sous la forme alpha-tocophérol) et A (principalement sous la forme bêta-carotène). Les polyphénols, incluant les flavonoïdes et les anthocyanes, sont une autre importante sous-classe d’antioxydants. Ces antioxydants sont en fait des molécules naturellement produites par les plantes pour se protéger des fluctuations environnementales, du rayonnement ultra-violet et des parasites (126).
Autant les antioxydants endogènes qu’exogènes sont nécessaires à la défense contre les RL. En première ligne de défense se trouvent ceux qui inhibent la production de RL. Ils agissent en neutralisant les molécules ayant le potentiel de perdre un électron et donc de devenir hautement réactives (4). Les enzymes glutathion peroxydase et transférase en font partie. En deuxième ligne de défense se trouvent les molécules pouvant neutraliser les RL telles que les vitamines et l’acide urique, alors que la troisième et dernière ligne implique les molécules capables de réparer ou de régénérer les biomolécules ou les autres antioxydants (4). C’est le cas par exemple de la vitamine C, qui régénère la vitamine E. Toutefois, la vitamine C possède aussi une activité
antioxydante en donnant un de ses électrons à un RL (127). Ainsi, les antioxydants agissent de façon à la fois spécifique et complémentaire en plus d’être utiles à divers niveaux de défense et dans différents tissus. Les principales molécules antioxydantes sont décrites dans le Tableau 2.
Tableau 2. Description sommaire des principaux antioxydants endogènes et exogènes
Nom Classe Rôle(s)
Antioxydants endogènes Superoxyde dismutase (SOD) Groupe enzymatique incluant la SOD1, la SOD2 et la SOD3
Décompose l’anion superoxyde en peroxyde d’hydrogène et oxygène (113,128)
Catalase Enzyme Décompose le peroxyde d’hydrogène en eau et oxygène (113) Glutathion peroxidases (GPx), réductases (GR), et S-transférases (GST)
Enzymes GPx : décompose le peroxyde d’hydrogène en eau et oxygène et certains hydroperoxydes organiques
GR : catalyse la réduction du disulfure de glutathion en glutathion GST: détoxifie des xénobiotiques et possède une certaine activité antioxydante envers les hydroperoxydes (113)
Glutathion Peptide Capture les EROs, participe à la réparation de cellules endommagées et est un agent réducteur pour divers métabolites et systèmes enzymatiques (128,129)
Acide urique Composé hétérocyclique Capture les EROs et lie le fer et le cuivre lorsqu’ils sont sous leur forme ionique (113,128)
Transferrine, ferritine et lactoferrine
Protéines Chélatent l’ion ferreux Fe2+ (113,128)
Albumine Protéine Lie divers ions métalliques en plus du cuivre et du fer (113,128) Bilirubine Pigment Capture les EROs et ERNs et est un agent réducteur (113) Coenzyme
Q10 Composé de la classe des ubiquinones Sa forme réduite (ubiquinol CoQlibres et inhiber l’oxydation des lipides et des protéines des 10H2) peut se lier aux radicaux membranes cellulaires (113,128)
Antioxydants exogènes Vitamine C
(acide ascorbique)
Vitamine hydrosoluble Agent réducteur d’EROs, cofacteur enzymatique et régénère la forme réduite de la vitamine E (127)
Vitamine E (alpha-tocophérol)
Vitamine liposoluble Capture les radicaux peroxydes produit par la peroxydation lipidique (127)
Caroténoïdes (beta-carotène)
Pigment liposoluble Capturent les EROs et principalement de l’oxygène singulet (109,130) et les radicaux peroxyde (130)
Polyphénols Composés phénoliques
de différentes classes Capturent les EROs/ERNs et/ou inhibent leur formation et chélatent certains métaux (131)
L’humain peut accéder à une vaste gamme d’antioxydants de par ses choix alimentaires. Tel que mentionné plus haut, les aliments d’origine végétale en sont la principale source bien que ceux d’origine animale en contiennent, mais en quantité généralement inférieure (111,126). Le contenu en antioxydants d’un très large éventail de produits fut analysé par Carlsen et coll. En excluant les suppléments de vitamines et minéraux (teneur moyenne en antioxydants: 98,58 mmol/100g) et les plantes utilisées en médecine traditionnelle (91,72 mmol/100g), les catégories d’aliments fournissant le plus d’antioxydants selon la méthode FRAP
(Ferric-reducing ability of plasma) étaient les épices et les herbes (29,02 mmol/100g), suivies des baies et de leurs
sous-produits (9,86 mmol/100g) et des breuvages (8,30 mmol/100g), catégorie incluant notamment le vin, le café et le thé (9). En comparaison, les viandes et les produits de la mer n’en contenaient que de 0,11 à 0,31 mmol/100g. Une étude finlandaise ayant analysé le contenu en polyphénols de 143 aliments a identifié que 16 variétés de baies se classaient parmi les 20 aliments les plus riches en polyphénols (20). Il est toutefois essentiel de noter l’importante variabilité entre les aliments d’une même catégorie, mais aussi entre les différents échantillons d’un même produit selon sa variété, sa provenance et les transformations qu’il a subi. De plus, le contenu en antioxydants d’un aliment n’est pas gage de sa biodisponibilité dans le corps (9). Tout de même, on présume qu’un individu peut bonifier ses défenses antioxydantes en choisissant chaque jour d’ingérer des aliments qui en sont riches.
1.3 Alimentation Nord-Américaine
1.3.1 Composition
Il est bien reconnu que l’alimentation des résidents des pays développés tels que le Canada et les États-Unis s’est modifiée au cours des derniers siècles. La consommation d’aliments transformés et de piètre qualité nutritionnelle s’est accrue, au détriment de la santé des habitants. Certaines tendances se dressent au sein des classes sociales, des âges et du sexe. Utilisant le score HEI (Healthy Eating Index) pour évaluer la qualité de l’alimentation des participants de la vague 2003-2004 de NHANES, Hiza et coll. ont rapporté que globalement, les adultes atteignaient un score de 56 sur une possibilité de 100 points (132). Quant à eux, les adultes les plus âgés obtenaient 65 points. Les femmes présentaient un score plus élevé que les hommes, tout comme les blancs avaient un meilleur score que les hispaniques et les personnes de race noire. Finalement, avoir un revenu et/ou un niveau d’éducation dans la catégorie la plus élevée était favorable à l’obtention d’un score significativement supérieur à celui de la catégorie la plus basse. Chez les adultes, les scores moyens associés à la consommation de fruits totaux, de légumes totaux et de grains entiers étaient respectivement de 51, 68 et 17. Pour ce qui est des viandes et des légumineuses, le score moyen était de 81, indiquant une consommation adéquate en quantité mais ne donnant toutefois aucun indice sur la qualité des sources protéiques consommées (132). En somme, cette étude populationnelle permet de constater un écart entre les recommandations en matière de saine alimentation et l’apport alimentaire réel des individus en Amérique du Nord. Les deux prochains sous-chapitres traiteront de deux catégories d’aliments présents dans la diète Nord-Américaine et dont la consommation est respectivement associée à l’augmentation et à la réduction des risques de maladies cardiométaboliques.
1.3.2 Viande rouge et charcuteries
La surconsommation de viande est maintenant reconnue comme un facteur de risque de mortalité et de maladies, en plus d’être néfaste pour l’environnement (133,134). Depuis 1980 au Canada, la consommation de poulet et celle d’agneau ou de mouton a augmenté, passant respectivement de 11,39 à 20,84 et de 0,52 à 0,70 kg/personne/an (135). Celle de dindon s’est maintenue (3,30 à 3,38 kg/personne/an). À l’inverse, la consommation de bœuf (27,09 à 16,18 kg/personne/an), de porc (22,87 à 15,86 kg/personne/an) et de veau (0,95 à 0,64 kg/personne/an) ont diminué (135). Selon les données de 2007 à 2011 de l’Enquête canadienne sur les mesures de la santé, les canadiens de six ans et plus mangent en moyenne 1,62 portions de viandes et substituts chaque jour (136). Parmi les adultes, ce serait les femmes de 19-30 ans qui en consommeraient le moins (1,44 [1,30-1,58]) alors que les hommes du même groupe d’âge avaient les apports les plus élevés (1,92 [1,65-2,20]) (136). Une récente étude révélait quant à elle que les adultes québécois de langue française mangeaient en moyenne 2,4 portions de viandes et substituts par jour (IC : 2,4-2,5) (137). La viande rouge