Développement à visée clinique d’une prothèse vasculaire
décellularisée de faible diamètre produite par génie
tissulaire
Thèse
Maxime Tondreau
Doctorat en biologie cellulaire et moléculaire
Philosophiae Doctor (Ph.D.)
Québec, Canada
© Maxime Tondreau, 2015
iii
RÉSUMÉ
Il existe un besoin clinique pour les prothèses vasculaires de faible diamètre (< 6 mm), notamment pour effectuer des pontages vasculaires. Les prothèses synthétiques de faible diamètre, n’ayant pas d’endothélium, sont sujettes à la thrombose. Ainsi les chirurgiens préfèrent utiliser les vaisseaux autologues des patients. Pour cela, la veine saphène est de loin la plus utilisée. Cependant, de nombreux patients n’ont pas de vaisseaux adéquats, soit parce qu’ils ont déjà été utilisés, soit parce qu’ils sont malades. Pour pallier ce manque, le LOEX a développé un substitut vasculaire reconstruit en laboratoire par la méthode d’auto-assemblage du génie tissulaire. Ces substituts, faits à partir de cellules humaines, ont une longue période de production et ne peuvent être faits à l’avance ni préservés. L’objectif principal de cette thèse est le développement d’une prothèse vasculaire de faible diamètre facilitant le transfert du laboratoire vers la clinique. S’inspirant de travaux antérieurs, les travaux focalisent sur des prothèses obtenues à partir de fibroblastes dermiques humains puis décellularisés. Comme la réponse immunitaire se fait principalement contre les cellules et non pas contre la matrice extracellulaire, la décellularisation permet de gagner une compatibilité immunitaire inter-individu, voire inter-espèce. Ainsi, des prothèses ont été implantées dans six rats pendant six mois sans immunosuppression avec un taux de succès de 83%. Les explants présentaient une infiltration cellulaire suggérant la formation d’une nouvelle media recouverte d’un endothélium. Par ailleurs, nous avons démontré qu’il était également possible de produire des prothèses de grandeur et diamètre adéquats pour une utilisation clinique. Ces prothèses ont été préservées durant trois mois sans altérer leurs propriétés mécaniques. Nous avons également endothélialisé des vaisseaux qui ont ensuite été conditionnés en bioréacteur durant une semaine. Le processus entraînait une compaction de la matrice extracellulaire et un gain dans la résistance à la traction du matériau. En conclusion, les prothèses vasculaires décellularisées offrent deux avantages majeurs facilitant ainsi les essais précliniques et accélérant leur transfert du laboratoire vers les patients.
v
ABSTRACT
There is a clinical need for small-diameter vascular prostheses (< 6 mm), particularly for coronary and femoro-popliteal bypasses. Small-diameter synthetic vascular prostheses, comprising no endothelium, present an unacceptable risk of thrombotic occlusion. For this reason, it is preferable to use autologous vessels from the patients. The saphenous vein is the gold standard for most bypasses. However, many patients have diseased vessels or vessels that have already been used. For these reasons, the LOEX has developed a tissue-engineered blood vessel using the method of self-assembly. Such vessels have a long period of production and cannot be made in advance and stored. Moreover, obstacles slow down the realization of preclinical studies; indeed, given the use of human cells, either new autologous animal models must be developed or experimental animals must be immunosuppressed. The main objective of this thesis is to optimize a small-diameter tissue-engineered blood vessel in order to accelerate the translation from the laboratory to a clinical setting. Inspired by previous work, the studies presented in this thesis have focused on vessels produced from human dermal fibroblasts which were then decellularized. Since the immune response is mostly directed against cells and not against the extracellular matrix, the decellularization allows inter-individual and inter-species immunological compatibility. We have successfully implanted five out of six non-immunosuppressed rats for a period of 6 months. Explants presented cellular infiltrations suggesting the formation of a new media covered by a confluent endothelium. We have thereby shown that vessels of an appropriate length and diameter could be produced for clinical applications. These vessels were preserved for up to three months without showing any sign of mechanical degradation. We have also endothelialized such vessels that were conditioned for one week in a bioreactor. The process led to a compaction of the extracellular matrix and an increase in the ultimate tensile strength. In conclusion, the possibility of making the decellularized vessels in advance and to use them in various preclinical animal models could greatly accelerate the clinical translation from the laboratory to patients.
vii
TABLE DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... v
TABLE DES MATIÈRES ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xix
REMERCIEMENTS ... xxiii
AVANT-PROPOS ... xxv
Chapitre 1. Introduction ... 1
1.1. Mise en contexte et problématique... 1
1.2. Les tissus conjonctifs ... 5
1.2.1. La matrice extracellulaire et ses composantes ... 5
1.2.2. Introduction au génie tissulaire ... 9
1.3. La physiologie des vaisseaux sanguins natifs ... 12
1.3.1. Le système cardiovasculaire ... 12
1.3.2. La pression sanguine et les échanges gazeux ... 14
1.3.3. Les trois tuniques vasculaires ... 15
1.3.4. Les types cellulaires vasculaires ... 17
1.3.5. Différences cellulaires entre les veines et artères ... 19
1.3.6. Les forces hémodynamiques ... 20
1.3.7. La mécanotransduction dans les cellules vasculaires ... 23
1.3.8. Le maintien de l’homéostasie vasculaire ... 25
1.3.9. Le remodelage vasculaire ... 26
1.4. Les besoins cliniques ... 29
1.4.1. L’athérosclérose ... 29
1.4.2. Les cibles de l’athérosclérose ... 30
1.4.3. Le traitement de la sténose vasculaire et les pontages vasculaires ... 31
1.4.4. L’accès vasculaire pour l’hémodialyse ... 35
1.5. Le génie tissulaire vasculaire ... 37
viii
1.5.2. Les premières approches de prothèses vasculaires ... 40
1.5.3. Les tests mécaniques pour les vaisseaux sanguins reconstruits ... 41
1.5.4. Les différentes approches et techniques de génie tissulaire vasculaire ... 43
1.5.5. Les vasa-vasorum ... 47
1.5.6. La fonctionnalité des vaisseaux sanguins produits par génie tissulaire ... 47
1.5.7. Le remodelage in vitro ... 49
1.6. La décellularisation de vaisseaux sanguins et les modèles animaux ... 51
1.6.1. Le remodelage de vaisseaux décellularisés ... 52
1.6.2. La recellularisation pré-implantation ... 53
1.6.3. Les modèles animaux ... 54
1.7. Propriétés recherchées des prothèses vasculaires à visée clinique ... 57
1.8. Objectifs de la thèse ... 58
Chapitre 2. Remodelage in vivo d’échafaudages vasculaires faits à partir de fibroblastes et implantés 6 mois chez le rat ... 61
2.1. Introduction ... 66
2.2. Methods ... 68
2.2.1 Dermal fibroblasts isolation and culture ... 68
2.2.2 Production of tissue-engineered vascular scaffolds ... 68
2.2.3 Vascular scaffold implantation as aortic interpositional grafts in rats ... 69
2.2.4 Blood panel analysis ... 69
2.2.5 Doppler imagery and radiography ... 69
2.2.6 Histology ... 69
2.2.7 Immunofluorescence ... 70
2.2.8 Uniaxial tensile testing, thickness and water permeability... 70
2.2.9 Statistical analysis... 71
2.3 Results ... 72
2.3.1 Pre-implantation morphology of 1.6-mm scaffolds ... 72
2.3.2 Implantation study ... 74
2.3.3 Microscopic aspects of explanted grafts ... 74
2.3.4 Mechanical properties of the explants ... 77
ix
2.3.6 Preservability of 4.6-mm-ID FDVSes ... 82
2.4 Discussion ... 84
2.5 Conclusion ... 87
Chapitre 3. Les propriétés mécaniques d’échafaudages vasculaires faits à partir de fibroblastes stimulés avec un flux pulsatile ... 89
3.1. Introduction ... 93
3.2. Materials & methods ... 95
3.2.1 Dermal fibroblasts and endothelial cells isolation and culture ... 95
3.2.2 Production of tissue-engineered vessels ... 95
3.2.3 Tissue decellularization ... 95
3.2.4 Endothelial cells seeding and bioreactor conditioning ... 95
3.2.5 Mechanical testing ... 96
3.2.5.1 Burst pressure, compliance and thickness ... 96
3.2.5.2 Suture retention strength ... 97
3.2.5.3 Uniaxial traction testing... 97
3.2.6 Histology ... 98
3.2.7 Immunofluorescence ... 98
3.2.8 DNA assay ... 98
3.2.9 Statistical analysis... 99
3.3. Results ... 101
3.3.1 Production of the fibroblast-derived vascular scaffold and endothelialization ... 101
3.3.2 Burst pressure and compliance ... 101
3.3.3 Histology ... 102
3.3.4 Uniaxial rings testing, thickness measurements, and suture strength ... 102
3.3.5 Preservation study... 105
3.3.6 Immunofluorescence ... 106
3.3.7 DNA assays ... 107
3.4. Discussion ... 109
3.5. Conclusion ... 114
Chapitre 4. Échafaudages vasculaires dérivés de fibroblastes et ensemencés avec des cellules musculaires lisses ... 117
x
4.1.1 Isolement des cellules musculaires lisses et des cellules endothéliales ... 119
4.1.2 Production des échafaudages vasculaires dérivés de fibroblastes (EVDF) ... 119
4.1.3 Ensemencement des EVDF et conditionnement en bioréacteur ... 119
4.1.4 Histologie... 120 4.1.5 Immunofluorescence ... 120 4.1.6 Vasoréactivité ... 121 4.1.7 Tests mécaniques ... 121 4.1.8 Statistiques ... 122 4.2 Résultats ... 122
4.2.1 Ensemencement des EVDF ... 122
4.2.3 Histologie et vasocontractilité des EVDF ensemencés ... 123
4.2.4 Les propriétés mécaniques des EVDF ensemencés ... 126
4.3. Discussion ... 126
Chapitre 5. Discussion générale, conclusions et perspectives ... 129
5.1. Les avantages des EVDF ... 129
5.2. Maturation des prothèses vasculaires avant la décellularisation ... 130
5.3. Amélioration des propriétés mécaniques et de l’homogénéité des prothèses ... 131
5.4. Conditionnement en bioréacteur ... 132
5.5. Préservation des EVDF ... 134
5.6. Critères mécaniques ... 135
5.7. Intégration et remodelage in vivo ... 135
5.8. Transfert vers le milieu clinique ... 135
5.9. Conclusions ... 136
5.10. Perspectives ... 137
Références ... 141
Annexe 1: L’émergence de vaisseaux sanguins humains reconstruits par génie tissulaire comme modèles vasculaires ... 157
xi
Liste des tableaux
Tableau 1-1. Les différents paramètres physiologiques de divers vaisseaux sanguins natifs. Tableau tiré de [75]. * Le nombre de Reynolds permet de déterminer si l’écoulement est laminaire ou turbulent. Ce nombre, sans unité, tient compte du flux, de la densité et de la viscosité du fluide. Les nombres plus élevés que 2000 correspondent généralement à un flot turbulent tandis qu’en bas de 2000, le flot est laminaire. ** Le calcul n’est pas applicable puisque le régime de l’écoulement relève de la capillarité et que le sang n’est plus considéré comme un continuum à cette échelle. *** Les dynes par cm2 peuvent s’obtenir en multipliant par 10 les newtons (N) par m2. ... 20 Tableau 2-1. Blood panel and high-sensitivity C-reactive protein analysis. ... 75
xiii
Liste des figures
Figure 1-1. Mortalité annuelle causée par les maladies cardiovasculaires aux États-Unis. Figure adaptée de [4]. ... 1 Figure 1-2. Fibres de collagène de type I vues par microscopie électronique à transmission. Périodicité de 680 ångström... 7 Figure 1-3. La circulation pulmonaire et la circulation systémique. Tirée de [23]. ... 12 Figure 1-4. Schéma des différentes artères et veines des jambes. Adaptée de [59]. ... 13 Figure 1-5. Représentation schématisée des trois tuniques d'un vaisseau sanguin ainsi que des limitantes élastiques. Adaptée de [59]. ... 15 Figure 1-6. Schéma représentant les forces de cisaillement. ... 21 Figure 1-7. Schéma représentant la présence d’un athérome sur une artère malade et le risque accru de thrombose. Adaptée de [59]. ... 29 Figure 1-8. Répartition des maladies cardiovasculaires. Figure adaptée de [4]. ... 30 Figure 1-9. Types de pontages coronariens selon le nombre d'artères pontées. Figure adaptée provenant de [59]. ... 32 Figure 1-10. Insertion percutanée d'un tuteur endovasculaire (A) et procédure d'endartériectomie (B). Adaptée de [59] ... 33 Figure 1-11. Greffon artérioveineux pour l'accès à l'hémodialyse. Figure adaptée de [59]. ... 36 Figure 1-12. À gauche, Arthur B. Voorhees. À droite, en haut : la prothèse en Vinyon-N. À droite, en bas, le même type de prothèse huit ans après l’implantation. Images provenant de [127]. ... 40 Figure 1-13. Représentation d'un test de traction uniaxiale. Figure tirée de [170]. ... 42
xiv
Figure 1-14. Vaisseau sanguin reconstruit par la méthode d'auto-assemblage. Tirée de L’Heureux et al., 1998 [44]. ... 44 Figure 1-15. Figure adaptée tirée de [187]. Les différentes techniques de génie tissulaire présentées dans cette section y sont regroupées en trois catégories: in vitro, in vivo et in situ. ... 46 Figure 2-1. The human fibroblast-derived vascular scaffold (FDVS). (A) The FDVS on a stainless steel mandrel with an inner diameter of 1.6 mm. (B) One-cm segment from the scaffold off the mandrel and placed in deionized water. (C) Masson’s trichrome stained histological cross-section. The extracellular matrix presented a dense collagen structure (blue). ... 72 Figure 2-2. Implantation and in vivo imaging of the graft. Picture of a same scaffold immediately post implantation (A) and six months later (B), showing integration of the graft. The white arrows point to the anastomotic sites. (C) In vivo ultrasound before sacrifice six months after implantation confirming aortic blood flow. ... 73 Figure 2-3. Comparative histology of fibroblast-derived vascular scaffold before and after implantation, and native rat aortas. A-C and G-I: Masson’s trichrome. D-F: Hematoxylin & eosin. Representative scaffold’s wall before implantation, showing a dense collagenous content in blue (A) and light pink (D). (B,E) The explanted scaffold six months after implantation, showing the presence of cells on the luminal and abluminal sides. Native rat aorta, presenting a sparse collagenous content in blue (adventitia; C) or very pale pink (F) and a dense layer with many cell nuclei and a reddish tint (media). (G,H,I) Longitudinal cross-sections taken at the site of anastomosis. Cells appeared to have proliferated passed the inner elastic lamella (black arrows) of native aortas (I), and onto the luminal side of the graft at the anastomotic site (H) and beyond (G). Scale bars: 100 µm. ... 76 Figure 2-4. Comparative immunofluorescence of fibroblast-derived vascular scaffold before and after implantation, and native rat aortas. Scaffolds and native rat aortas were stained for alpha smooth muscle actin (A-C), calponin (D-F), Von Willebrand Factor (vWF; G-I), and elastin (J-L) and counterstained with Hoechst. In all cases, the staining of unimplanted scaffolds was negative (A, D, G, J). Following 6 months of implantation, grafts stained positively for alpha smooth muscle actin and calponin (B, E), vWF (H) and elastin (K). White arrows (K) point a continuous
xv and thin elastin staining on the lumen side of the explants that was not found in unimplanted controls (J). As expected, observations regarding native rat aortas confirmed the efficacy of the staining. Scale bars: 50 µm. *: Luminal side. ... 78 Figure 2-5. Scatterplots obtained from uniaxial tensile tests of rings from scaffolds before implantation (n=3; FDVS), explants (n=2) and native rat aortas (n=2). (A) Failure load per unit length, (B) ultimate strain and (C) inner diameter were calculated from the testing of a minimum of two rings per sample. Small length of the grafts, imperfect success rate (83%) and priority given to histological analyses prevented a higher sample size. ... 79 Figure 2-6. Mechanical properties of FDVS to evaluate homogeneity (A-D) and simulation of a quality control test (E-F). To evaluate the homogeneity along the length of the scaffolds, three scaffolds were cut in three 5-cm-long segments each and for every segment, three rings were cut and tested for their estimated burst pressure (A), suture retention strength (B), ultimate tensile strength (C) and thickness (D). The scatterplots present the results for the nine rings tested for each scaffold in order to present the results variability except for the thickness for which the results present the average measurement from 6 different positions on each third of the scaffold. To simulate a quality control test, a 1.5 cm-long segments (extremity) was removed from one extremity of three long vessels, measured for thickness (E), and three tissular rings from the segment were mechanically tested in order to estimate the burst pressure (F). A 10 cm long segment from the rest of the vessel (FDVS) underwent a real burst pressure assay (F) after measuring its thickness (E). Student’s paired t-tests were then performed and no statistical differences between measures from the extremity and measures from the rest of the FDVS were found. (G) Macroscopic picture featuring the removal of half a centimeter from each extremity due to a high level of variation at the extremities as a consequence of the rolling process. These extremities were removed systematically on all vessels before testing. Results on histograms are expressed as mean ± SD, n=3 scaffolds. ... 81 Figure 2-7. Mechanical properties of FDVS tested immediately following decellularization (0 months) and after three months of preservation in PBS supplemented with 10% FCS. For each condition, three long vessels were each cut in three segments that were tested in triplicates, bringing the total number of rings tested per condition to 27. The average length of vessels
xvi
before cutting was 16.9 cm. The UTS (A), thickness (B), inner diameter (C), ultimate strain (D), estimated BP (E), elastic modulus (F) and suture retention strength (G) did not show any significant difference over time. Masson’s trichrome staining of histological cross-sections (H) showed that the structure of the collagen-rich FDVS remained similar after three months of preservation. Results are expressed as mean ± SD; n=3 Scale bars: 100 µm. ... 83 Figure 3-1. Schematic view of the process used to create allogeneic decellularized tissue-engineered scaffolds that can be endothelialized for clinical applications. (A) The offline stage (top) represents the sequential steps for the production of the acellular scaffold. (B) The online stage (bottom) starts following a superficial vein biopsy from a patient, for the isolation and expansion of endothelial cells, and ends with the endothelialization and conditioning of the TEBV in a bioreactor. The online stage lasts approximately 4 weeks. (C) Timeline of the experiment summarizing the production stages. ... 100 Figure 3-2. Mechanical properties and histology of the constructs. (A) Burst pressure of vessels prior to decellularization (Pre-decell.) (n=8), following decellularization (Decell.) (n=6), following endothelialization and stimulated 1 week in the bioreactor ... 102 Figure 3-3. Thickness measurements, uniaxial ring testing and suture retention strength tests were performed at various stages of production, allowing the calculation of UTS, estimated burst pressure, inner diameter, ultimate strain and suture strength. (A) Endothelialized scaffolds perfused for 1 week (n=3) showed an increase in UTS when compared with decellularized constructs (n=5). This increase in UTS was correlated by a decrease in thickness of those endothelialized scaffolds that were perfused when compared to the decellularized vessels (C). However, pre-decellularized (n=5), decellularized (n=5), and constructs perfused for 1 week with (n=3) or without (n=3) pre-seeded endothelial cells did not show any significant differences for the estimated burst pressure (B), inner diameter (D), ultimate strain (E), and suture retention strength (F). * p < 0.05, ** p < 0.01. ... 104 Figure 3-4. Tissue-engineered fibroblast-derived vascular scaffolds (FDVS) were tested after 1 month and 3 months of preservation in deionized water at 4 °C (n=3 each). Mechanical data were compared to FDVS right after decellularization (set at 100%). The UTS (A), the inner diameter (D), and the ultimate strain (E) did not show any significant difference over time. The estimated
xvii burst pressure (B), thickness (C) and suture retention strength (F) did not show a significant difference after 1 month of decellularization. However, those properties declined by 24% after 3 months. (G) Masson’s trichrome histological of tissular rings cross-sections showed that the structure of the collagen-rich FDVS remains similar despite a decrease in thickness after 3 months of preservation. Scale bars: 100 µm. * p < 0.05, ** p < 0.01. ... 105 Figure 3-5. Immunofluorescence analyses of the vascular constructs at the different stages of production. Ten-µm thick cross-sections were stained for DNA (Hoechst; A, D, G, J), F-actin (Phalloidin; B, E, H, K), collagen 1 (C, F, I, L) and vWF (H inset). For one given staining, all photographs were taken with the same exposure. DNA staining was visible in pre-decellularization constructs (A) and the signal appeared to be more diffuse following decellularization (D). In perfused constructs, DNA was only found at the location of endothelial cells (G, J). F-actin was found to be sparsely present in all constructs (B, E, H, K) with the highest signal found at the location of endothelial cells (H). Staining for vWF was found on the lumen side of endothelialized grafts, confirming the phenotype of the endothelial cells (H insert). As expected, high amounts of collagen I were observed in all constructs (C, F, I, L). ... 107 Figure 3-6. DNA assay of the vascular constructs at the different stages of production (n=3 each). Both decellularization and perfusion led to a decrease in DNA content. ****: p < 0.0001. ... 108 Figure 4-1. Immunofluorescence des EVDF ensemencés avec des cellules. Des EVDF ont été ensemencés sur leur côté extérieur avec des CML (A) ou des FD (B), rincés, puis cultivés dans des plats de Pétri pendant deux semaines. F-actine, un marqueur intracellulaire ubiquitaire, est marqué en rouge tandis que la collagène I est marqué en vert. *Côté luminal. Barres : 50 µm. 122 Figure 4-2. Histologie et vasocontractilité des EVDF ensemencés. En A et B, des coupes transversales colorées au Trichrome de Masson représentant des EVDF (A) et des EVDF ensemencés par des CML (B). Les EVDF présentaient une matrice extracellulaire dense dénuée de noyaux cellulaires. En contrepartie, la région luminale des EVDF ensemencés était mince et pourvue d’une haute densité de noyaux cellulaires (barres : 50 µm.) Afin de vérifier la contractilité des EVDF, deux anneaux par vaisseau, provenant de 6 vaisseaux, ont été montés dans un myographe et soumis à des doses croissantes d’endothéline-1 (C) et d’histamine (D).
xviii
Trois des 12 anneaux testés n’ont pas répondu à la stimulation. Ces données ne sont pas présentées sur la représentation graphique. Les résultats sont des moyennes ± SD, n=6. ... 124 Figure 4-3. Propriétés mécaniques des EVDF avant et après l'ensemencement des cellules musculaires lisses et endothéliales. L’épaisseur (A), le diamètre interne (B), la pression d’éclatement estimée (C), la force ultime à la rupture (D), l’étirement ultime à la rupture (E) et le module élastique (F) ont tous été significativement affectés par le processus d’ensemencement des cellules et de conditionnement en bioréacteur. Les résultats sont exprimés sous la forme de la moyenne ± SD, n=6 vaisseaux par condition. * p < 0.05; ** p < 0.01, *** p < 0.001. ... 125
xix
Liste des abréviations
ADN : Acide désoxyribonucléique
ALK2 : Kinase-2 semblable à l’activine (Activin-like kinase-2) CE : Cellule endothéliale
CML : Cellule musculaire lisses
DMEM : Milieu de Eagle modifié par Dulbecco (Dulbecco’s modified Eagle’s medium) DMEM-F12 : DMEM supplémenté avec le supplément F12
EGM-2 : Milieu 2 de croissance de cellules endothéliales (Endothelial Growth Medium-2) EGM-2 MV : EGM-2 pour cellules microvasculaires
EphB4 : Récepteur 4 de l’éphrine type B (Ephrin type-B receptor 4) EVDF : Échafaudage vasculaire dérivé de fibroblastes
FD : Fibroblastes dermiques
FDA : Food and Drug Administration
FDVS: Équivalent anglophone de EVDF (Fibroblast-derived vascular scaffold) GAG : Glycoaminoglycanes
gf : Gramme-force; unité représentant la force subie par une masse de 1 gramme dans un champ gravitationnel de 9,80665 m/s2
GFP : Protéine fluorescente verte (Green fluorescent protein)
HUVEC : Cellules endothéliales de cordon ombilical humain (Human umbilical vein endothelial cell)
ID : Diamètre interne (Inner diameter)
LOEX : Laboratoire d’organogénèse expérimentale
MCP1 : Protéine chimioattractante de monocytes 1 (Monocytes chemoattractant protein 1) MEC : Matrice extracellulaire
MMP : Métalloprotéinase de la matrice (Matrix metalloproteinase) NIDDK : National Institute of Diabetes and Digestive and Kidney NO : Oxyde nitrique (Nitric oxide)
OCT : Température optimale de coupe (Optimal cutting temperature) PCL : Polycaprolactone
PDGF : Facteur de croissance dérivé des plaquettes (Platelet derived growth factor) PEG-DA : Poly-éthylène-glycol-diacrylate
PGA : Acide polyglycolique (Polyglycolic acid) PLA : Acide polylactique (Polylactic acid)
PLG : Copolymère d’acide lactique et glycolique (Poly(lactic-co-glycolic acid)) PGI1 et PGI2 : Prostaglandine I1 et I2
PTFE : Polytétrafluoroéthylène ou téflon
PVA : Alcool polyvinylique (Polyvinyl alcohol)
TEBV : Vaisseau sanguin reconstruit par génie tissulaire (Tissue-engineered blood vessel) TGF-β : facteur de croissance transformant bêta (Transforming growth factor beta)
TIMP : Inhibiteurs tissulaires des MMP (Tissue inhibitor of metalloproteinases) TNF-α : Facteur de nécrose tumorale alpha (Tumor necrosis factor alpha) t-PA : Activateur tissulaire du plasminogène (Tissue plasminogen activator)
xxi
« Pour les uns, qui voyagent, les étoiles sont des guides. Pour d'autres elles ne sont rien que de petites lumières. Pour d'autres qui sont savants elles sont des problèmes.» -Antoine de Saint-Exupéry (Le petit Prince)
xxiii
REMERCIEMENTS
Ces travaux ont été réalisés au Laboratoire d’organogénèse expérimentale (LOEX) de l’Hôpital de l’Enfant-Jésus à Québec, sous la direction du Dr François A. Auger et la codirection du Dr Stéphane Bolduc. Le LOEX est un Centre de recherche des Fonds de recherche du Québec en santé.
Je tiens tout d’abord à exprimer ma gratitude envers mon directeur de recherche et directeur du LOEX, le Dr François A. Auger, pour m’avoir accueilli dans son laboratoire. Sans lui, la création du Laboratoire d’organogénèse expérimentale, véritable chef de file international dans le domaine prometteur de la médecine régénératrice, n’aurait pas été possible. De plus, son travail acharné de plus d’une décennie, assisté de plusieurs employés du LOEX, est directement responsable de la création de locaux accueillant et d’une vaste superficie uniquement dédié à la recherche ainsi qu’une zone de laboratoire répondant aux besoins les plus pointus des agences gouvernementales et digne de l’industrie biomédicale. L’inauguration de ces locaux en 2010 n’auraient pas été possibles sans la contribution des Fonds Canadiens de l’Innovation. Je remercie également le Dr Stéphane Bolduc pour son soutien au cours de mes études. Je tiens également à remercier la Dre Lucie Germain, co-fondatrice du LOEX, pour sa contribution régulière à mon équipe de travail, l’équipe vasculaire. Je remercie également tout le personnel qui permet au LOEX d’être un centre de recherche hors pair.
J’ai un souvenir mémorable de mes collègues de travail membres étudiants et techniques de l’équipe vasculaire : Jean-Michel Bourget, Todd Galbraith, Véronique Laterreur, Cindy Perron, Giridhar Raghunathan, Catherine Tremblay et Karine Vallières. Le support régulier de Dan Lacroix, directeur de projet, a été un atout indispensable à ma réussite. Merci à tous les autres membres du LOEX.
J’aimerais également remercier Alexandre et René pour leur bon travail et plus particulièrement pour la stérilisation régulière du gros bioréacteur. Un merci particulier à Rina Guignard, dont la formation intense en culture cellulaire a été une bonne lancée pour mes travaux.
Faire une thèse sur la reconstruction de vaisseaux sanguins par génie tissulaire a été une expérience d’une immense valeur. Les difficultés et les moments de réussites que j’ai vécus ont contribués significativement à mon développement personnel et professionnel. Le génie
xxiv
tissulaire est un domaine complexe dans lequel une navigation allègre requiert l’acquisition d’une vaste quantité de concepts et de méthodologies provenant de disciplines variées. Vivre la recherche interdisciplinaire est une expérience très enrichissante car le contact journalier avec des acolytes de domaines divers est une opportunité d’aller au-delà de nos propres limites.
Ces travaux n’auraient pas été possibles sans l’aide financière des Instituts de recherche en santé du Canada et de la Fondation de recherche du Québec – Santé.
Je remercie mes parents, Lise et Benoit, ainsi que mon frère, Cédric, qui m’ont fournis du support durant toute ma vie.
J’ai évidemment une pensée toute particulière pour mon amour, Madeline, qui est tous les jours une source de motivation.
xxv
AVANT-PROPOS
Cette thèse comprend deux manuscrits dont je suis l’auteur principal et qui ont été soumis pour être publiés dans des journaux scientifiques. Le premier est présenté au chapitre 2 sera soumis prochainement à un journal scientifique pour évaluation par les pairs. J’ai effectué la majorité des travaux présentés dans cet article au LOEX. Les vaisseaux ont été implantés chez le rat par la technicienne en santé animale du LOEX, Anne-Marie Moisan. J’ai assisté Véronique Laterreur qui a effectué, sous la supervision des Drs Jean Ruel et Lucie Germain, les tests mécaniques et fait les calculs menant à la mesure des propriétés mécaniques. J’ai conçu les expériences en collaboration avec Karine Vallières, Jean-Michel Bourget, Catherine Tremblay et Dan Lacroix. J’ai rédigé le manuscrit sous la supervision du Dr François Auger, responsable du projet, ainsi qu’avec l’aide précieuse de Karine Vallières et l’assistance de Dan Lacroix. Tous les auteurs ont participé à la révision du manuscrit qui a également été revu de façon indépendante par deux chercheurs du LOEX, Robert Gauvin et Stéphane Bolduc.
Le deuxième, présenté au chapitre 3, a été publié par la revue Acta Biomaterialia le 18 mai 2015. J’ai effectué la majorité des travaux présentés dans cet article au LOEX. J’ai assisté Véronique Laterreur qui a effectué, sous la supervision des Drs Jean Ruel et Lucie Germain, les tests mécaniques et fait les calculs menant à la mesure des propriétés mécaniques. J’ai conçu les expériences en collaboration avec Karine Vallières, Jean-Michel Bourget, Catherine Tremblay et Dan Lacroix. J’ai rédigé le manuscrit sous la supervision du Dr François Auger avec l’aide importante de Robert Gauvin ainsi que l’assistance de Karine Vallières, Jean-Michel Bourget et Dan Lacroix. Tous les auteurs ont participés à la révision du manuscrit.
Une courte revue de littérature, portant sur l’utilisation des vaisseaux sanguins reconstruits par auto-assemblage comme alternative aux modèles animaux, a été placée en annexe. Elle a été publiée en août 2011 dans la revue ALTEX dans les Proceedings du 8th World Congress on
Alternatives and Animal Use in the Life Sciences. J’ai rédigé l’entièreté de l’article sous la
1
Chapitre 1. Introduction
1.1. Mise en contexte et problématique
Les vaisseaux sanguins peuvent sembler être de simples tuyaux lorsqu’on les compare aux organes complexes tels le poumon, l’œil ou le cerveau. Ce sont cependant des composantes dynamiques du corps qui doivent réagir à de nombreux stimuli mécaniques et biochimiques afin de répondre aux besoins en oxygène et nutriments de tout notre corps. Les maladies cardiovasculaires, responsables de 29% de tous les décès canadiens, sont la seconde cause de mortalité au Canada, tout juste après le cancer à 35% [1]. Aux États-Unis et à l’échelle mondiale, les maladies cardiovasculaires demeurent la première cause de décès (Figure 1-1) [2]. La maladie cardiovasculaire la plus fréquente est la maladie coronarienne [3]. À elle-seule, elle a causé la mort de près d’un Américain sur six en 2010.
Figure 1-1. Mortalité annuelle causée par les maladies cardiovasculaires aux États-Unis. Figure adaptée de [4].
Le nombre total d’opérations et procédures cardiovasculaires aux États-Unis a augmenté de 5 939 000 en 2000 à 7 588 000 en 2010 [5]. Le pontage coronarien est l’une des chirurgies les plus fréquentes et, bien qu’en déclin au Canada et aux États-Unis, il y a eu plus de 20
2
000 pontages faits au Canada et 350 000 opérations de ce type aux États-Unis chaque année au cours de la dernière décennie [6, 7]. Les pontages coronariens ne sont évidemment pas seulement une réalité nord-américaine, puisqu’au Japon, en 2005, 18 000 pontages ont été effectués[8]. Le vaisseau sanguin autologue le plus utilisé pour les pontages coronariens et fémoro-poplités est la veine saphène. Lorsque possible, l’artère mammaire interne (aussi appelée artère thoracique interne) est aussi utilisée pour certains pontages coronariens [9]. Or, les greffons autologues sont souvent dans un état pathologique ou d’une taille inadéquate [10]. Les prothèses synthétiques sont dénués d’endothélium et leur composition chimique entraîne des thromboses lorsqu’utilisées dans des situations de faible débit sanguin comme au niveau de l’artère coronaire [11, 12]. Cependant, des stratégies d’endothélialisation ont été développées, par exemple pour le polytetrafluoroéthylène (PTFE) [13, 14]. Malgré des résultats prometteurs lorsqu’utilisées comme pontages coronariens [15], les prothèses de PTFE ont plusieurs désavantages. Ceux-ci sont des risques d’hyperplasie intimale, des risques d’infection, et une réaction naturelle à un corps étranger [16].
Pour ces raisons, l’un des défis du génie tissulaire demeure la production de prothèses vasculaires de faible diamètre pour utilisation clinique [17-19]. Il est difficile de décrire avec précision le domaine du génie tissulaire, puisqu’il s’agit vraiment d’un domaine multidisciplinaire. Selon Langer et Vacanti, il s’agit d’un domaine qui applique les principes de l’ingénierie aux sciences de la vie pour le développement de substituts biologiques qui restaurent, maintiennent ou amélioration la fonction de tissus ou d’organes [20]. Le LOEX a développé une approche novatrice de génie tissulaire : l’auto-assemblage. Cette approche permet de produire des tissus entièrement biologiques et dénués de tout matériel exogène. En cultivant des cellules en présence de l’ion ascorbate, celles-ci sécrètent et assemblent du collagène et d’autres protéines de la matrice extracellulaire (MEC). Après une période de quelques semaines, on obtient des feuillets cellulaires vivants, comprenant à la fois les cellules et leur MEC. Ces feuillets peuvent alors être assemblés, manuellement où à l’aide de guides, en structures plus ou moins complexes, soit par empilement, roulage ou à l’aide de gabarits [21].
3 Cependant, l’un des désavantages de l’auto-assemblage est la durée de production des feuillets et la durée de la maturation des tissus plus complexes. Ces périodes se comptent en semaines et en mois. De plus, la variabilité des vaisseaux produits à partir de différentes populations de cellules est plus grande que si l’on utilisait constamment la même population de cellules. En outre, des difficultés sont rencontrées lors des études précliniques. D’abord, on ne peut tester le modèle humain de vaisseaux dans un animal sans immunosuppression à cause du rejet immunitaire des cellules humaines. De plus, l’immunosuppression est inappropriée à moyen et long terme. Ensuite, la mise au point de modèles équivalents à partir de cellules animales autologues afin de permettre des études précliniques sans immunosuppression est fastidieuse et coûteuse. D’ autre part, cela implique que les vaisseaux testés ne sont pas parfaitement représentatif du modèle humain que nous souhaitons appliquer en clinique.
La décellularisation de structures vasculaires cultivées permet d’éviter plusieurs de ces difficultés, ainsi que de produire des tissus d’avance. De tels échafaudages des vaisseaux sanguins guident la croissance des cellules afin de créer une structure tubulaire à l’intérieur de laquelle le sang peut circuler librement.
L’objectif de cette thèse est d’améliorer l’applicabilité clinique d’une prothèse vasculaire construite par génie tissulaire. La décellularisation de cette prothèse procure des avantages généralement associées avec les prothèses synthétiques. Par exemple, elle permet de fabriquer la prothèse d’avance et de l’entreposer. Ainsi, le temps nécessaire pour obtenir une prothèse prête à l’implantation est raccourci. Elle permet aussi d’utiliser la prothèse de façon allogénique1, voire xénogénique2, grâce à un gain en immunocompatibilité. La variation inter-prothèse est d’ailleurs diminuée étant donnée la possibilité de les fabriquer d’avance, par lots provenant d’une même population cellulaire. Ainsi, la décellularisation permet de faciliter la transition d’une prothèse vasculaire construite par génie tissulaire des expériences in vitro vers des études précliniques.
1 D’un individu d’une espèce à un autre de la même espèce. 2 D’une espèce à une autre.
4
Afin de faciliter la compréhension des travaux, cette thèse propose d’abord une introduction générale sur la physiologie de la matrice extracellulaire et plus détaillée sur l’anatomie des vaisseaux sanguins natifs, de leur environnement mécanique et du phénomène de remodelage. Elle traitera ensuite du génie tissulaire vasculaire et des besoins cliniques propres au domaine. Finalement, il sera question de l’approche de décellularisation et des modèles animaux.
5
1.2. Les tissus conjonctifs
Les tissus conjonctifs forment les structures de support du corps. Ils sont parfois classifiés dans un éventail allant de tissus lâches (l’adventice des vaisseaux sanguins, le tissu adipeux) à denses (les tendons, le cartilage, les os) [22, 23]. Bref, ce sont tous les tissus sauf les épithéliums, les muscles et le tissu nerveux.
Le collagène est le principal composant des tissus conjonctifs ainsi que la protéine la plus abondante chez les mammifères, représentant de 25 à 35% du contenu total en protéines du corps. Il est présent exclusivement chez les animaux. Le collagène se retrouve principalement dans les tendons, les ligaments et la peau, mais se retrouve aussi dans la cornée, le cartilage, les os, les vaisseaux sanguins, l’intestin et les disques intervertébraux [23].
1.2.1. La matrice extracellulaire et ses composantes
La MEC est un réseau complexe englobant des combinaisons diverses de collagène, d’élastine, de laminine, de fibronectine, les composantes de la substance fondamentale et bien d’autres protéines, incluant des enzymes protéolytiques impliquées dans la dégradation et le remodelage de la MEC. Guidant la migration cellulaire et modulant la réponse cellulaire, la MEC joue un rôle clé dans la stimulation de la prolifération et différenciation cellulaire [24].
La protéine fibreuse qu’est le collagène peut être assemblée en fibres. Il en existe une vingtaine de types différents qui forment des filaments ou des réseaux. Les molécules de collagène de type I sont d’abord synthétisées dans la cellule sous la forme d’un monomère, le procollagène. Une fois sécrété dans le liquide interstitiel, le procollagène se polymérise spontanément par formation de liaisons covalentes croisées entre les monomères. Les fibrilles ainsi formées s’associent à leur tour en faisceaux de fibrilles; ces derniers constituent les fibres de collagène visibles au microscope optique. Les fibres de collagènes sont extrêmement robustes et confèrent à la matrice une grande résistance à la traction (force longitudinale provoquant l’extension). Des essais ont en effet démontré que les fibres collagènes sont plus résistantes que des fibres d’acier de même calibre. À l’état frais,
6
les fibres collagènes sont blanches et luisantes, c’est pourquoi on les appelle aussi fibres blanches [23].
1.2.1.1. La substance fondamentale
La substance fondamentale est un matériau sans forme définie qui comble les espaces entre les cellules et qui retient les fibres. Elle est composée entre autres de liquide interstitiel, de protéines d’adhérence et de protéoglycanes. Les protéines d’adhérence (fibronectine, laminine et autres) jouent le rôle d’une colle qui permet aux cellules du tissu conjonctif de se fixer aux éléments de la matrice. On appelle protéines matricellulaires les protéines qui font partie de la MEC sans toutefois faire partie de sa structure elle-même [25]. Elles peuvent non seulement posséder des sites d’interaction avec les cellules, mais aussi séquestrer des facteurs de croissance et moduler leur biodisponibilité. Par exemple, les thrombospondines sont une famille de cinq protéines qui joueraient un rôle dans l’inhibition de la formation de capillaires. La thrombospondine-2 serait aussi en mesure d’influencer la fibrillogenèse et d’améliorer la stabilité de la MEC sans toutefois intégrer les fibrilles de collagène eux-mêmes [25]. Ceci dit, son activité exacte est toujours incomprise.
Les protéoglycanes sont constitués d’une protéine centrale à laquelle sont greffés de très grosses molécules glucidiques, les glycosaminoglycanes (GAG). Un grand nombre de protéoglycanes se retrouvent par exemple liés à l’acide hyaluronique, un GAG, afin de former des agrégats qui retiennent l’eau dans la MEC. D’autres GAGs sont des sulfates. Par exemple, le sulfate de chondroïtine se retrouve dans les cartilages et les os, le sulfate de kératine dans le cartilage, les os, la cornée et les disques intervertébraux, le sulfate de dermatane dans le derme, les vaisseaux sanguins et les valves cardiaques, et le sulfate d’héparine se retrouve dans la membrane basale, dans le poumon et le foie [22].
Les glycoprotéines sont également des protéines associées à des glucides, mais contrairement aux protéoglycanes, la fraction glucidique est beaucoup plus petite. Par exemple, la fibronectine est une glycoprotéine qui joue un rôle clé dans l’adhésion des cellules à la MEC. La laminine est une glycoprotéine qui se trouvent, comme son nom l’indique, dans les lames basales, aussi appelée membranes basales. D’autres exemples
7 sont la chondronectine du cartilage, et les glycoprotéines osseuses que sont l’ostéocalcine, l’ostéopontine et la sialoprotéine.
1.2.1.2. La synthèse du collagène
Les protéines de la famille du collagène sont d’abord synthétisées, dans le réticulum endoplasmique, sous forme de préprocollagène, qui est constitué de trois chaînes polypeptidiques enroulées en hélice. Les résidus proline et lysine sont ensuite hydroxylés par la peptidyl proline hydroxylase et la peptidyl lysine hydroxylase. Ces enzymes requièrent toutes les deux la présence de la vitamine C comme donneur d’électrons. L’hydrolysine est par la suite glycosylée, ce qui favorise la conformation structurelle en triple hélice du procollagène, toujours dans le réticulum endoplasmique. Des glucides y sont ensuite ajoutés dans l’appareil de Golgi, ce qui le mène à la structure final du procollagène qui est ensuite sécrété en dehors de la cellule [22].
Le procollagène est ensuite clivé par des peptidases extracellulaires afin de former le tropocollagène. Ce dernier s’assemble de lui-même en fibrilles avec une périodicité de 67 nm. L’enzyme lysyl oxydase, qui utilise le cuivre comme cofacteur, provoque la réticulation des molécules de tropocollagène adjacentes [22]. Le résultat final, un polymère de tropocollagène, est nommé fibrille de collagène. Les fibrilles s’assemblent ensuite spontanément en fibres de collagène (Figure 1-2).
Figure 1-2. Fibres de collagène de type I vues par microscopie électronique à transmission. Périodicité de 680 ångström.
8
1.2.1.3. Les types de collagène
Le collagène est la famille de protéines la plus abondante du corps humain (25 à 35% des protéines du corps). Jusqu’à maintenant, 29 types de collagènes ont été identifiés et décrits mais plus de 90% du collagène humain est de type I. Le type I est présent dans les tendons, la peau, les parois artérielles, l’endomysium des myofibrilles, le fibrocartilage, les parties organiques des os et des dents et les cicatrices. Le type II compose 50% du cartilage. Le type III se retrouve dans les tissus granuleux et est produit par les jeunes fibroblastes avant que le type I soit synthétisé. Il se retrouve dans les parois artérielles, la peau, l’intestin et l’utérus. Le collagène IV se retrouve dans les lames basales et dans le cristallin de l’œil [22, 23].
1.2.1.4. Les fibres élastiques
Les fibres élastiques sont de longs filaments minces qui forment des réseaux ramifiés dans la matrice extracellulaire. Elles contiennent une protéine fibreuse, l’élastine, qui leur permet de s’étirer et de reprendre leur forme à la manière d’un élastique. Quand le tissu conjonctif atteint un certain degré d’étirement, les épaisses fibres collagènes qui accompagnent toujours les fibres élastiques deviennent rigides. Puis, lorsque la tension se relâche, les fibres élastiques reprennent leur position d’origine et redonnent au tissu conjonctif sa longueur et sa forme initiales. On trouve des fibres élastiques dans les endroits où l’élasticité est essentielle, en particulier dans la peau, les poumons et la paroi des vaisseaux sanguins. Comme les fibres élastiques sont jaunâtres, on les appelle parfois fibres jaunes [23].
L’élastine mature est une protéine insoluble et hydrophobe formé par la réticulation de son précurseur, la tropoélastine. Ce précurseur est relâché dans l’espace extracellulaire où la présence de lysyl oxydase et des glycoprotéines fibuline-4 ou 5 participent à sa réticulation [26]. En situation normale, l’élastogenèse est restreinte principalement au stade fœtal et en enfance, et les fibres élastiques matures durent toute la vie. La demi-vie des fibres élastiques étant de 40 ans, elles sont considérées comme l’élément le plus durable de la MEC [26].
9 1.2.1.5. Les métalloprotéinases
Les métalloprotéinases de la matrice (MMP) constituent une famille d’au moins 18 enzymes apparentées par leur structure. Elles peuvent être définies par plusieurs caractéristiques communes : un mécanisme catalytique dépendant du zinc, une sécrétion en tant que zymogènes, une séquence d’ADN démontrant toujours une homologie à celle de la collagénase interstitielle (MMP-1) et une activité enzymatique servant à cliver un ou plusieurs éléments de la matrice. Ces protéinases peuvent être divisées en collagénases, gélatinases, stromélysines, ou en MMP membranaires [27].
Évidemment, l’activité des MMP doit être étroitement contrôlée puisque cette famille peut dégrader tous les constituants de la MEC. Les MMP semblent exister en équilibre avec les inhibiteurs tissulaires de MMP (TIMP). Certains phénomènes déplacent l’équilibre vers les MMP, provoquant ainsi une certaine dégradation de la MEC. Elles jouent donc un rôle clé dans le remodelage des tissus. De plus, elles sont également impliquées dans le clivage de certaines formes de précurseurs de molécules actives comme le TNF-α, des facteurs de croissance et l’endothéline [27].
1.2.2. Introduction au génie tissulaire
Le génie tissulaire est un domaine interdisciplinaire qui applique des principes de l’ingénierie et des sciences de la vie afin de développer des substituts biologiques qui restaurent, maintiennent ou améliorent les fonctions des tissus [28]. Il s’agit fréquemment de la combinaison de cellules avec des matériaux synthétiques ou naturels afin d’améliorer ou de remplacer des fonctions biologiques dans un effort de faire progresser la médecine. De tels matériaux peuvent alors remplacer la MEC lors de la reconstruction de tissu en laboratoire.
Il existe une foule de biomatériaux synthétiques provenant de la chimie des polymères. Pour en nommer quelques-uns, citons l’acide polylactique (PLA), l’acide polyglycolique (PGA) ou le polyvinyl alcool (PVA) [29]. Le silicone peut également être utilisé comme biomatériaux [30]. D’autres biomatériaux sont extraits de la nature; par exemple, des composites d’alginate peuvent servir à reconstruire du tissu osseux [26]. Ces biomatériaux peuvent être ensemencés avec des cellules qui peuvent produire de la MEC. En effet,
10
certains types cellulaires comme les fibroblastes, les ostéoblastes, les chondroblastes et les cellules musculaires lisse (CML) ont la capacité de sécréter du collagène et d’autres protéines de la MEC lorsque cultivés en présence d’ion ascorbate. L’acide ascorbique, mieux connu sous le nom de vitamine C, est un élément essentiel pour la synthèse cellulaire de collagène [31].
Il est également possible d’utiliser la capacité de synthèse de MEC afin d’éviter l’utilisation de biomatériaux. Ainsi, l’auto-assemblage réfère à la capacité des cellules cultivées sur la surface bidimensionnelle d’un flacon de culture à produire leur propre MEC en quelques semaines puis à évoluer dans cet environnement tridimensionnel [32]. Cet ensemble comprenant les cellules et leur MEC est appelé feuillet cellulaire. Plusieurs chercheurs, dont ceux du Laboratoire d’organogénèse expérimentale (LOEX) parlent de
technologies basées sur les feuillets cellulaires [33-35]. Ces feuillets peuvent être
assemblés de plusieurs façons afin de former des tissus plus complexes. Par exemple, les feuillets peuvent être empilés pour former des tissus plus épais menant à de la peau [36-38] et des cornées [39]. Ces tissus plus épais peuvent aussi être moulés dans des gabarits afin de produire des formes plus ou moins complexes allant des vessies [40-42] aux valves cardiaques [43]. Alternativement, les feuillets cellulaires peuvent être roulés autour de mandrins afin de former des vaisseaux sanguins [44, 45], des urètres [46-48] et du tissu pour la réparation de la tunique albuginée du pénis [49].
La MEC provenant de donneurs animaux ou de cadavres humains peut également servir de biomatériau naturel et être recellularisée ou non [50]. En produisant un échafaudage directement à partir d’un organe prélevé, il est possible d’obtenir des structures complexes qu’on ne pourrait produire par auto-assemblage ou avec des biomatériaux synthétiques. Cependant, bien souvent, des tissus sont prélevés afin de servir à d’autres fonctions. Par exemple, la sous-muqueuse de l’intestin grêle porcin peut servir à réparer la vessie [51]. Elle peut également servir à favoriser la guérison des plaies chroniques [52, 53]. Le collagène de derme porcin est aussi à l’étude pour la réparation des hernies hiatale [54]. La quête de nouvelles sources de MEC, tel le foie de porc, est constante [55].
11 La MEC peut également être reconstituée in vitro sous formes de gels obtenus à partir de collagène extrait de tissu animal tel que les tendons de rat [56, 57]. Cependant, les propriétés mécaniques des tissus fabriqués à partir de gels de collagène sont typiquement décevantes, voire insuffisantes pour l’implantation, puisque le collagène reconstitué ne présente pas la même complexité de réticulation que l’on retrouve dans les tissus natifs [58].
12
1.3. La physiologie des vaisseaux sanguins natifs
1.3.1. Le système cardiovasculaire
Afin de mettre les vaisseaux sanguins en contexte, nous parlerons d’abord du système cardiovasculaire.
Figure 1-3. La circulation pulmonaire et la circulation systémique. Tirée de [23].
Le cœur agit comme une double pompe puisqu’il dessert deux circulations (Figure 1-3). Du côté droit, il dessert la circulation pulmonaire qui va oxygéner le sang au niveau des poumons avant que le sang ne revienne au côté gauche du cœur. Le côté gauche envoie ensuite le sang vers tous les tissus de l’organisme ; puis le sang revient alors au côté droit du cœur pour être oxygéner de nouveau par la circulation pulmonaire [23].
La circulation coronarienne est particulière puisqu’elle apporte le sang afin de nourrir le muscle cardiaque lui-même, le myocarde. Deux artères coronaires, la droite et la gauche, naissent de l’aorte thoracique ascendante puis se ramifient autour de la paroi cardiaque externe afin de nourrir le tissu cardiaque en oxygène et nutriments. Cependant, chez près
13 de 15% de la population, seule l’artère coronaire gauche et se ramifient et, chez 4% de la population, il n’y a qu’une seule artère coronaire [23].
Tous les vaisseaux qui transportent le sang sortant des ventricules du cœur sont appelés artères. Ces artères peuvent être élastiques ou musculaires, ou être des artérioles. Les artères élastiques, telles l’aorte et ses principales ramifications, servent surtout au transport du sang sans une régulation fine comme le font les artères musculaires. Elles sont particulièrement riches en élastine. Elles se dilatent quand le sang arrive sous pression puis reviennent à leur degré d’étirement initial, ce qui contribue à la continuité de la circulation du sang entre les battements du cœur. D’un point de vue fonctionnel, elles sont essentiellement des tubes élastiques. Les artères musculaires pour leur part apportent le sang aux divers organes et ont un diamètre allant de 0,3 à 10 mm. Ces artères sont présentes notamment dans les jambes (Figure 1-4). Elles contiennent beaucoup plus de muscle lisse mais moins d’élastine que les artères élastiques. C’est davantage sur ce type de vaisseau que se penchera cette thèse. Finalement, les artérioles ont un calibre se situant entre 0,3 mm et 10 µm et rejoignent les lits capillaires [23].
14
Les capillaires sont les plus petits vaisseaux sanguins et leur paroi n’est formée généralement que d’une seule épaisseur de cellules endothéliales (CE) , voire une seule CE qui fait toute la circonférence [23]. Ils ont parfois une couche de cellules contractiles sur le côté extérieur nommées péricytes [60]. Les capillaires ont un diamètre moyen de 6 à 8 µm, et une épaisseur d’environ 1 µm. La capacité de se contracter des capillaires et des artérioles permet à l’organisme de contrôler l’apport sanguin aux lits de capillaires et donc aux organes desservis [23].
1.3.2. La pression sanguine et les échanges gazeux
La première phase du cycle cardiaque est dite systolique et permet au sang de quitter les ventricules par les artères. La pression dans l’aorte et les artères qui en découlent est alors d’environ 120 mmHg. La seconde phase est dite diastolique et dépend alors de l’élasticité des grandes artères pour continuer la conduction du sang en aval. Durant cette phase, toutes les parties du cœur sont en relaxation, ce qui permet le remplissage passif des ventricules. La pression artérielle au cours de cette phase, nommée diastole, est alors de seulement 70 à 80 mmHg. Le cœur, en situation normale, passe un tiers du temps en systole et deux tiers du temps en diastole.
La pression diminue au fur et à mesure qu’on se rapproche des capillaires étant donné la perte d’énergie causée par la résistance périphérique tout au long du trajet vasculaire. Cette perte est particulièrement marquée dans les artérioles, tout juste avant les capillaires, puisque la résistance augmente à la quatrième puissance du rayon du vaisseau (équation de Hagen-Poiseuille)[23]. Ainsi, dans les lits de capillaires, la pression passe d’environ 40 à 20 mmHg.
Ensuite, le sang revient au cœur par le circuit veineux. La pression continue de diminuer dans les veines et dépend de la respiration et des contractions musculaires, en association avec le système de valvules anti-retour dans les grosses veines, pour retourner le sang jusqu’au cœur. Les veinules, d’un diamètre de 8 à 100 µm, sont très peu différentes des capillaires à l’exception d’une petite paroi externe. D’un point de vue anatomique, les veines sont très semblables aux artères mais leur paroi est plus mince. Elles contiennent peu de muscle lisse et d’élastine. Contrairement aux artères, la tunique externe des veines,
15 l’adventice, est la plus robuste et est bien plus épaisse que la tunique moyenne, la media. Les plus grosses veines ont cependant davantage de muscle lisse. Une distinction majeure avec les artères est la présence de valvules veineuses, particulièrement abondantes dans les veines des membres. Ces valvules sont des replis de la tunique interne qui empêchent le reflux du sang vers les extrémités [23].
Le rôle de la circulation sanguine est évidemment d’être le convoyeur systémique de diverses substances. Les nutriments (acides aminés, glucose, lipides, etc.), l’oxygène, le gaz carbonique et les déchets métaboliques transigent entre la circulation et les tissus principalement par diffusion, simplement en suivant le gradient de concentration [23].
1.3.3. Les trois tuniques vasculaires
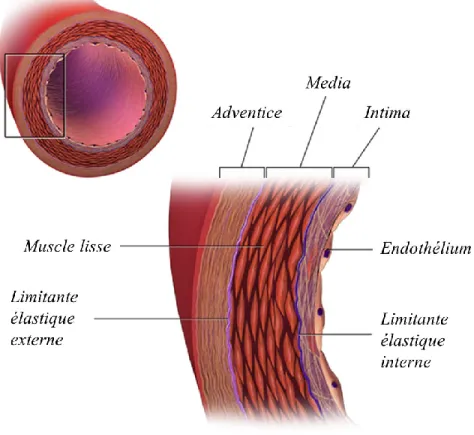
Figure 1-5. Représentation schématisée des trois tuniques d'un vaisseau sanguin ainsi que des limitantes élastiques. Adaptée de [59].
La tunique externe, l’adventice, est constituée de collagène, principalement de type I, de quelques fibres élastiques et de fibroblastes (voir Figure 1-5) [22]. L’adventice protège les
16
vaisseaux en limitant leur dilatation et les ancrent aux structures environnantes. Par exemple, l’adventice coronarienne est profondément enracinée dans le myocarde, elle-même muni d’une importante vascularisation appelée vasa-vasorum puisqu’elle nécessite un apport sanguin exceptionnel. Les vasa-vasorum coronariens sont beaucoup plus denses et petits que ceux des artères périphériques [61, 62].
Les vasa-vasorum consistent en de petites artères qui pénètrent la paroi vasculaire à partir de la surface abluminale3 et forme une arborescence jusqu’à la media externe. Chez les humains, les vaisseaux avec des parois de moins de 29 cellules d’épaisseur n’ont normalement pas de vasa-vasorum ainsi que, en général, les vaisseaux avec une lumière de moins de 0.5 mm [23].
La tunique moyenne est la media. Elle renferme des cellules musculaires lisses (CML) et est structurée principalement par du collagène de type III, ainsi que par des fibres élastiques dont une couche épaisse forme la limitante élastique externe [22]. Les CML sont disposées en anneaux concentriques, séparés de feuillets d’élastine continus. Elles peuvent être dans des muscles lisses composés d’une seule unité où les cellules contractent et relaxent simultanément, tel qu’au sein du tractus gastro-intestinal et urogénital. Elles peuvent aussi être dans muscles lisses composés de multiples unités, par exemple dans la paroi des voies respiratoires et des vaisseaux sanguins. La contraction ou dilatation de la media peut directement influencer le diamètre interne des vaisseaux sanguins [23].
La tunique interne est l’intima. L’intima comprend un endothélium, une membrane basale, du tissu conjonctif lâche et une limitante élastique interne [22]. L’endothélium est composé de cellules pavimenteuses confluentes, les CE, présentant des jonctions serrées. Les CE sont ancrés sur la membrane basale, une fine structure en feuillet qui contient notamment de la laminine et du collagène de type IV, mais aussi du nidogène, du perlecan, des collagènes de type XV et XVIII, de la fibronectine et du sulfate d’héparane. Outre leur rôle structurel, ces molécules de la membrane participent notamment à l’adhésion des CE. En sécrétant divers facteurs, l’endothélium empêche la coagulation du sang et agit de façon
17 paracrine sur la media afin de contrôler le tonus musculaire. Il s’agit également d’une barrière sélective qui permet de contenir le sang dans les vaisseaux.
1.3.4. Les types cellulaires vasculaires
Les fibroblastes sont des cellules mésenchymateuses formant l’infrastructure des tissus. Il s’agit du type cellulaire le plus abondant dans les tissus conjonctifs animaux. Leur rôle principal est la sécrétion et maintenance du collagène.
Les CML ont la propriété d’être fortement étirables. Ainsi, les tissus présentant des CML sont généralement plus élastiques et fonctionnent sur une plus grande amplitude de tension, contrairement à un muscle strié qui perd largement sa capacité de contracter lorsqu’étirée. Les CML sont donc présentes dans les tissus comme les vaisseaux sanguins, les intestins et la vessie [23]. Une partie importante du volume cytoplasmique d’une CML est occupée par la myosine et l’actine, qui ensemble ont la capacité de contracter. L’alpha-actine est l’isoforme prédominant d’actine dans les muscles lisses, contrairement aux muscles cardiaques et squelettiques qui ont leurs propres isoformes.
La calmoduline, la caldesmone et la calponine sont des protéines importantes pour le bon fonctionnement des CML. La calmoduline a un rôle semblable à la troponine des muscles cardiaques et squelettiques et régule la contraction. Lorsqu’elle se lie au calcium, elle cesse d’être active et permet à la contraction d’avoir lieu. Ainsi, une élévation du calcium cytoplasmique entraîne la contraction. La calponine n’a pas un rôle clair; elle est présente en quantité semblable à l’actine et contribuerait à soutenir le cytosquelette. La caldesmone servirait d’ancrage pour l’actine, la myosine et la tropomyosine, augmentant ainsi la capacité des CML à maintenir la tension. Une autre protéine importante, la smootheline, fait partie du cytosquelette des CML et n’est exprimée que dans les CML pleinement différenciées. Les cellules avec des caractéristiques des CML, comme les myofibroblastes et les autres cellules musculaires, ne contiennent pas de smootheline.
Les CML de la media des artères coronaires sont orientées de façon circonférentielle [63, 64]. La media y est très épaisse puisque les artères coronaires sont très vasoréactives. Chaque couche de CML de la media possède une orientation relative d’environ 12 degrés par rapport aux couches voisines [65]. Les CML des vaisseaux auront une orientation
18
relative différente selon le type de vaisseaux et l’espèce; néanmoins, cette structure en diagonale croisée mène à de meilleures propriétés mécaniques des vaisseaux [66].
Dans les vaisseaux sanguins, la tropoélastine est généralement produite par les CML de la media ou les fibroblastes de l’adventice [26]. La présence de l’élastine s’étend principalement de la limitante élastique interne à la limitante élastique externe. Dans la paroi d’une artère, l’élastine peut représenter 50% du poids sec. L’élasticité des artères est une fonction critique, puisque cela permet la continuation de la circulation sanguine pendant la diastole, c’est-à-dire la phase où l’éjection cardiaque cesse. Dans la media, les fibres élastiques sont présentes en lamelles fenestrées concentriques. Ces lamelles se présentent en alternance avec des couches de CML, formant ce qu’on appelle l’unité lamellaire.
Les CE, formant l’endothélium, ont plusieurs fonctions. Elles sont une barrière sélective contrôlant le passage de nutriments et de cellules lymphatiques [67]. Elles sécrètent de nombreuses molécules qui participent afin, d’une part, de moduler la coagulation du sang et, d’autre part, de contrôler le tonus vasculaire en agissant sur la media. Par exemple, les CE sécrètent la prostacycline (PGI2), l’oxyde nitrique (NO) et l’activateur tissulaire du plasminogène (t-PA) qui sont tous anti-thrombotiques. Elles peuvent par contre aussi sécréter le facteur von Willebrand (qui est entreposé dans les granules Weibel-Palade), dont le rôle est essentiel pour favoriser la coagulation du sang. Finalement, elles sécrètent aussi des molécules comme l’endothéline-1 qui provoque une contraction chez les CML vasculaires. L’endothélium est aussi responsable de certaines conversions moléculaires : il convertit l’angiotensine I en angiotensine II; il forme les composés inertes de la bradykinine, de la sérotonine, de la norépinéphrine, des prostaglandines et de la thrombine. Il peut aussi dégrader les lipoprotéines en triglycérides et cholestérol [22]. Les CE peuvent également bourgeonner et participer à l’angiogénèse, c’est-à-dire la formation de nouveaux vaisseaux à partir de vaisseaux existants. Ce processus est à ne pas confondre avec la vasculogénèse qui concerne principalement la formation de nouveaux vaisseaux durant l’embryogénèse.
Les CE forment le réseau de capillaire dans l’adventice des vaisseaux sanguins : les vasa-vasorum. Isolé d’aortes porcines, ces capillaires répondent aux vasodilatateurs – comme la


![Figure 1-3. La circulation pulmonaire et la circulation systémique. Tirée de [23].](https://thumb-eu.123doks.com/thumbv2/123doknet/6351648.167547/38.918.252.619.267.715/figure-circulation-pulmonaire-circulation-systémique-tirée.webp)
![Figure 1-4. Schéma des différentes artères et veines des jambes. Adaptée de [59].](https://thumb-eu.123doks.com/thumbv2/123doknet/6351648.167547/39.918.223.719.599.975/figure-schéma-artères-veines-jambes-adaptée.webp)



![Figure 1-8. Répartition des maladies cardiovasculaires. Figure adaptée de [4].](https://thumb-eu.123doks.com/thumbv2/123doknet/6351648.167547/56.918.118.769.526.854/figure-répartition-maladies-cardiovasculaires-figure-adaptée.webp)
