L’utilisation du recalage déformable d’images CT sur
CBCT dans le but de générer des contours du jour et
d’améliorer le cumul de dose avec image du jour
MémoireOlivier Fillion
Maîtrise en physique – physique médicale Maître ès sciences (M.Sc.)
Québec, Canada
L’utilisation du recalage déformable d’images CT sur
CBCT dans le but de générer des contours du jour et
d’améliorer le cumul de dose avec image du jour
MémoireOlivier Fillion
Sous la direction de:
Résumé
Ce projet de maitrise concerne l’utilisation du recalage déformable pour la déformation des contours et la déformation des distributions de dose. Son but est d’étudier la possibilité de générer automatique-ment des contours du jour par recalage déformable et de proposer une nouvelle méthode pour cumuler les doses sur l’ensemble d’un traitement de radiothérapie. La méthode consiste à recaler l’image CT, qui permet de faire des calculs de dose, sur l’image CBCT, qui montre l’anatomie du jour, dans le but d’améliorer les suivis de patients. Pour évaluer la possibilité d’utiliser cette méthode, le projet est divisé en trois parties, centrées autour de cas de cancer de la prostate. Premièrement, on caractérise les recalages déformables provenant du logiciel Elastix en utilisant les images d’un fantôme anthro-pomorphique. Les calculs de dose sur ces images montrent que la méthode permettrait de calculer précisément des doses sur image du jour. Deuxièmement, on quantifie la précision de la déformation de contours avec le logiciel OnQ rts. La précision est évaluée en comparant les contours recalés aux contours tracés manuellement à l’aide de métriques de similarité. Cette étude montre que les contours produits par recalage déformable doivent être corrigés par la suite pour améliorer leur précision. De plus, la combinaison de l’indice d’inclusivité et des contours comme la prostate et le contour externe du corps permettent d’évaluer avec le plus de précision les déformations anatomiques. Troisièmement, on démontre la faisabilité de déformer les doses du jour de manière à les cumuler à l’aide du logiciel Elastix. Le principal défi pour bien déterminer les écarts de dose en clinique serait de bien caracté-riser la précision des recalages des organes à risque, puisqu’ils sont situés près des régions de haut gradient de dose. Dans le futur, cette technique pourrait être utilisée si la qualité des recalages est bien contrôlée.
Table des matières
Résumé iii
Table des matières iv
Liste des tableaux vi
Liste des figures vii
Remerciements xiii
Avant-propos xiv
Introduction 1
1 Matériel et Méthodes 14
1.1 Banques d’image . . . 14
1.2 Caractérisation des recalages déformables à l’aide du logiciel Elastix . . . 18
1.3 Caractérisation de la déformation de contours à l’aide du logiciel OnQ rts . . . . 25
1.4 Évaluation du cumul de dose par recalage déformable . . . 28
2 Caractérisation des recalages du logiciel Elastix à l’aide d’un fantôme anthropo-morphique 34 2.1 Mise en contexte . . . 34
2.2 Méthode . . . 34
2.3 Optimisation des paramètres de recalage . . . 35
2.4 Calcul de dose sur image avec fantôme. . . 46
2.5 Utilisation du recalage déformable sur image patient . . . 51
3 Deformable image registration and automatic contouring using cone-beam CT : A study of similarity indices 55 3.1 Résumé . . . 55
3.2 Abstract . . . 56
3.3 Introduction . . . 57
3.4 Materials and Methods . . . 58
3.5 Results. . . 60
3.6 Discussion. . . 66
3.7 Conclusions . . . 68
4.1 Méthode . . . 70
4.2 Calcul de dose par fraction . . . 72
4.3 Accumulation de dose. . . 76
4.4 Intérêt des doses du jour et cumulatives pour une utilisation éventuelle en clinique 80
Conclusion 81
A Exemple d’un fichier de paramètres fourni à Elastix pour le recalage déformable
d’une image CT sur une image CBCT 84
Liste des tableaux
0.1 Incertitudes sur des traitements du cancer de la prostate représentées par l’écart type
des translations dans chaque direction . . . 6
1.1 Nombres HU moyens des organes du fantôme anthropomorphique de la région
pel-vienne masculine et les valeurs typiques pour des organes humains . . . 14
3.1 Mean volume of the contoured organs on the planning CT of each patient . . . 59
3.2 Dice indices between the unregistered CT or the registered CT and a replanning CT for cases of lungs (N=4) cancers with the Adaptive Plan contouring method. The p-value of the paired-sample t-test between the two distributions is written in the last
column. . . 61
3.3 Mean Dice indices between the unregistered CT or the registered CT and a replanning CT for cases of head and neck (N=6) cancers with the Adaptive Plan contouring me-thod. The p-value of the paired-sample t-test between the two distributions is written
in the last column.. . . 61
4.1 Variations moyennes en cGy par fraction de 200 cGy entre les doses planifiées et déformées minimales, moyennes et maximales reçues par 3 des organes à l’étude pour 4 patients étudiés. Les doses déformées sont dans le même référentiel que l’image CT
de planification . . . 74
4.2 Variations cumulatives en cGy entre les doses planifiées et déformées minimales, moyennes et maximales reçues par 3 des organes à l’étude pour 4 patients étudiés (180 cGy/fractions, 25 fractions). Les incertitudes représentent l’écart type de tous les
Liste des figures
0.1 Schématisation de volumes pris en compte lors de la planification d’un traitement. À
noter que les marges ne sont pas nécessairement uniformes autour du GTV. . . 5
0.2 Tomodensitomètre utilisé au département de radio-oncologie de L’Hôtel-Dieu de Québec 7
0.3 Tomodensitomètre à faisceau conique (identifié par des flèches : source à gauche et imageur à droite) embarqué sur un accélérateur linéaire au département de
radio-oncologie de L’Hôtel-Dieu de Québec . . . 9
1.1 Fantôme anthropomorphique de la région pelvienne masculine, représenté dans une cuve d’eau. Les images à gauche (A, D) sont les images CT montrant deux anatomies où la prostate a été déplacée de 2 cm et les images à droite (B, C) montrent les mêmes anatomies prises par CBCT. Les organes simulés sont la prostate, le rectum, la vessie
et les têtes fémorales. . . 15
1.2 Méthode employée pour valider la méthode d’amélioration des images par utilisation du recalage déformable. L’image CT avec l’anatomie de référence (A) est déformée sur l’image CBCT avec anatomie déformée (C) à l’aide du logiciel Elastix pour être ensuite comparée à l’image CT avec l’anatomie déformée (D) en calculant la dose sur
ces deux images. . . 16
1.3 Exemple des images utilisées pour un patient : à gauche l’image CT de planification et à droite une image CBCT prise avant l’une des fractions du traitement. À l’exception du contour externe et de l’expansion autour du corps, toutes les structures visibles ont
été contourées par une résidente en radio-oncologie. . . 17
1.4 Image CBCT du patient P9 dont les densités ont été regroupées en 4 catégories : air,
tissus peu dense, tissus dense et os . . . 17
1.5 Schématisation du processus de recalage déformable dans le logiciel Elastix . . . 20
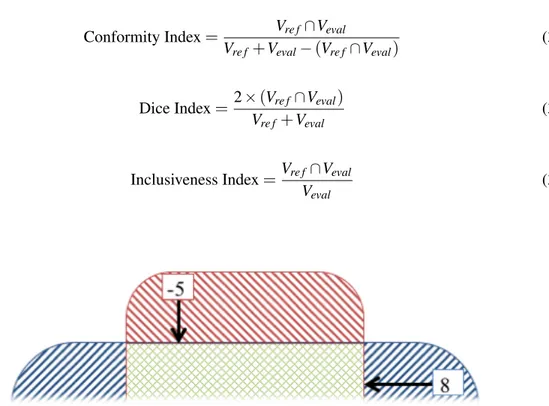
1.6 Schéma montrant l’effet du volume des organes sur l’indice de superposition. Des organes dont la surface qui ne se superpose pas (//) est la moitié de la surface qui se superpose (||) donne un ratio de superposition de 2/3. Des organes plus gros dont la
1.7 Protocole élaboré pour une éventuelle application clinique du recalage déformable. Dose plan représente la planification du traitement, qui permet d’extraire la dose cu-mulée du traitement (Cumul) et l’image CT de planification (CT planif). Durant le traitement, un CBCT du jour est pris (CBCT jour), ce qui permet de faire un reca-lage déformable sur ces deux images pour créer l’image CT recalée (CT déform) et ses contours recalés. Ces contours permettent d’évaluer les déformations anatomiques qu’a subit le patient depuis l’image CT de planification (Éval déform) et ainsi décider si le traitement planifié devrait se poursuivre ou être modifié. À la case Éval dose, on effectue un calcul de dose sur l’image CT recalée pour aider à la décision égale-ment. À la case CT planif, on effectue un recalage inverse de l’image CT recalée sur l’image CT de planification afin d’obtenir les paramètres pour recaler la dose calculée à Éval dose dans le référentiel de l’image de planification (Dose déform). Toutes les doses déformées sont ensuite cumulées pour connaître la véritable dose cumulée et la
comparer au cumul de planification. . . 30
1.8 Méthode pour l’évaluation de la dose du jour aux organes et leur accumulation pour
toutes les fractions d’un patient . . . 31
2.1 Effet du paramètre B-Spline Interpolation Order sur le recalage de l’image CT (haut, droite) sur l’image CBCT. Les images recalées sont illustrées en haut à gauche et au milieu pour différentes valeurs du paramètres et leurs différences avec l’image CBCT sont illustrées en-dessous. Les valeurs d’écart moyen et maximal de ton de gris à l’intérieur d’une région d’intérêt rectangulaire centrée autour de la prostate, la valeur de la métrique d’information mutuelle et le temps de calcul sont inscrits sous
les images de différences. . . 36
2.2 Valeur de la métrique de similarité et temps de calcul en fonction de la valeur du
paramètre B-Spline Interpolation Order pour le recalage de l’image fantôme . . . 36
2.3 Effet du paramètre Final Grid Spacing In Physical Units sur le recalage de l’image CT (haut, droite) sur l’image CBCT. Les images recalées sont illustrées en haut à gauche et au milieu pour différentes valeurs du paramètres et leurs différences avec l’image CBCT sont illustrées en-dessous. Les valeurs d’écart moyen et maximal de ton de gris à l’intérieur d’une région d’intérêt rectangulaire centrée autour de la prostate, la valeur de la métrique d’information mutuelle et le temps de calcul sont inscrits sous
les images de différences. . . 38
2.4 Valeur de la métrique de similarité et temps de calcul en fonction de la valeur du
paramètre Final Grid Spacing In Physical Units pour le recalage de l’image fantôme 39
2.5 Effet du paramètre Number Of Histogram Bins sur le recalage de l’image CT (haut, droite) sur l’image CBCT. Les images recalées sont illustrées en haut à gauche et au milieu pour différentes valeurs du paramètres et leurs différences avec l’image CBCT sont illustrées en-dessous. Les valeurs d’écart moyen et maximal de ton de gris à l’intérieur d’une région d’intérêt rectangulaire centrée autour de la prostate, la valeur de la métrique d’information mutuelle et le temps de calcul sont inscrits sous
les images de différences. . . 39
2.6 Valeur de la métrique de similarité et temps de calcul en fonction de la valeur du
2.7 Effet du paramètre Number Of Spatial Samples sur le recalage de l’image CT (haut, droite) sur l’image CBCT. Les images recalées sont illustrées en haut à gauche et au milieu pour différentes valeurs du paramètres et leurs différences avec l’image CBCT sont illustrées en-dessous. Les valeurs d’écart moyen et maximal de ton de gris à l’intérieur d’une région d’intérêt rectangulaire centrée autour de la prostate, la valeur de la métrique d’information mutuelle et le temps de calcul sont inscrits sous
les images de différences. . . 41
2.8 Valeur de la métrique de similarité et temps de calcul en fonction de la valeur du
paramètre Number Of Spatial Samples pour le recalage de l’image fantôme . . . 41
2.9 Effet du paramètre Maximum Number Of Iterations sur le recalage de l’image CT (haut, droite) sur l’image CBCT. Les images recalées sont illustrées en haut à gauche et au milieu pour différentes valeurs du paramètres et leurs différences avec l’image CBCT sont illustrées en-dessous. Les valeurs d’écart moyen et maximal de ton de gris à l’intérieur d’une région d’intérêt rectangulaire centrée autour de la prostate, la valeur de la métrique d’information mutuelle et le temps de calcul sont inscrits sous
les images de différences. . . 42
2.10 Valeur de la métrique de similarité et temps de calcul en fonction de la valeur du
paramètre Maximum Number Of Iterations pour le recalage de l’image fantôme . . . 43
2.11 Effet du paramètre Number Of Resolutions sur le recalage de l’image CT (haut, droite) sur l’image CBCT. Les images recalées sont illustrées en haut à gauche et au milieu pour différentes valeurs du paramètres et leurs différences avec l’image CBCT sont illustrées en-dessous. Les valeurs d’écart moyen et maximal de ton de gris à l’inté-rieur d’une région d’intérêt rectangulaire centrée autour de la prostate, la valeur de la métrique d’information mutuelle et le temps de calcul sont inscrits sous les images de
différences. . . 44
2.12 Valeur de la métrique de similarité et temps de calcul en fonction de la valeur du
paramètre Number Of Resolutions pour le recalage de l’image fantôme . . . 45
2.13 Histogramme dose-volume de la prostate pour un calcul de dose sur l’image CT de contrôle (vérité), l’image CBCT avec anatomie déformée et l’image CT recalée pour
une translation de la prostate de 0,5 cm. . . 48
2.14 Illustration de la position du centre de la distribution de la dose calculée (trait bleu : isodose 95 %) par rapport à la prostate (contour rouge) sur l’image CT de contrôle
(A), CBCT (B) et CT recalée (C). . . 48
2.15 Histogramme dose-volume du rectum pour un calcul de dose sur l’image CT de contrôle (vérité), l’image CBCT avec anatomie déformée et l’image CT recalée pour une
trans-lation de la prostate de 0,5 cm . . . 49
2.16 Histogramme dose-volume de la prostate (droite) et du rectum (gauche) pour un calcul de dose sur l’image CT de contrôle (vérité), l’image CBCT avec anatomie déformée
et l’image CT recalée pour une translation de la prostate de 1 cm . . . 50
2.17 Images CT, CT recalée et CBCT utilisées pour le calcul de dose d’un plan de
radio-thérapie conformationnelle sur une image patient . . . 52
2.18 Histogramme dose-volume de la prostate (droite) et du rectum (gauche) pour un cal-cul de dose sur l’image CT de planification, l’image CBCT, l’image CT recalée et l’image CBCT segmentée avec 4 groupes de densités pour un déplacement typique de
3.1 The red contour (\\) is the reference volume, the blue contour (//) represents the au-tomatically generated volume and the green surface is the intersection of the two vo-lumes, on a single slice of the image. The mean distance to conformity is the average of the sum of the distances between each pixel of the automatic contour and the
refe-rence contour. . . 60
3.2 The reference index is obtained by comparing the CBCT contours to the planning CT contours. The automatic indices are calculated for each of the contours propagation
method used. . . 61
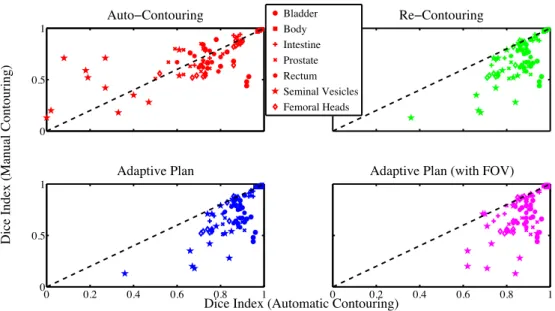
3.3 Dice indices for the automatically generated contours with respect to their Dice index
with the manual contours. For clarity, only 1 on 4 points are shown. . . 62
3.4 Ratio of conformity indices for the automatically and manually generated contours with respect to the mean distance to conformity on the manual contours for the target and 3 OARs. The dashed line at a ratio of 1 represent a perfect automatic contouring. The full line is a linear fit of all the points for each organ, with its equation and its
coefficient of determination. . . 64
3.5 Discrepancy between the automatic and manual contour inclusiveness indices with respect to the automatic inclusiveness index for the bladder, prostate, rectum and semi-nal vesicles contours. The inclusiveness value obtained with automatic (i.e. using DIR) method are sorted in 5 bins with central values between 0.1 and 0.9. Each bin repre-sents the distribution of contours within index ±0.05 of the central value. The boxes are drawn for each of the 4 methods : A) Auto-Contouring (red), B) Re-Contouring (green), C) Adaptive Plan (blue) and D) Adaptive Plan with FOV (purple). The middle line of each box represents the median, the top and bottom of the box are the 25th and the 75th percentiles and the whiskers comprise the values up to 1.5 times the inter-quartile range above or below the box, beyond which the outliers are represented by + signs. The notch on the side of every box indicates the variability of the median value with respect to that of the other boxes : the width is computed so that, when the notches of two boxes do not overlap, the medians of these boxes are different at the
5% significance level. . . 65
3.6 Joint probability P(Indexman=x± y|Indexauto=x± y)as a function of the automatic contours index for four indices : Conformity Index, Mean Distance to Conformity, Dice Index and Inclusiveness Index. The automatic contours used were generated with
the Auto-Contouring method. . . 66
4.1 Histogramme dose-volume pour l’évaluation de la distribution de la dose du jour sur image CT recalée pour le patient P5. Les courbes rouges, vertes et bleues sont les distributions de dose à la prostate, à la vessie et au rectum, respectivement. Les courbes pleines représentent le calcul de dose sur l’image CT de planification et les courbes
pointillées sont tirées du calcul du plan de traitement sur les images CT recalées. . . 73
4.2 Exemple de la distribution de la dose pour une fraction du traitement planifié sur l’image CT de planification et l’image CT recalée sur l’image CBCT de la fraction pour le patient P9. La structure rouge représente le contours de la prostate. La diffé-rence d’échelle entre le CT planif et le CT recalé représente une des transformations
géométriques qui ont été appliquées sur l’image lors du recalage. . . 75
4.3 Coupe au centre de la prostate montrant l’accumulation de la dose planifiée et reca-lée pour le patient P9 sur 9 fractions du traitement de 25 fractions (1,8 Gy/fraction, Dmax, 25 f ract=61, 73 Gy). Afin d’améliorer la comparaison, les deux images affichées
4.4 Différence entre les doses cumulatives planifiée et déformée sur l’image CT pour le patient P9. L’image A est centrée sur la prostate, B montre les plus grandes différences de dose autour de la prostate et les images C et D sont situées beaucoup plus haut (11,5
Remerciements
Je désire premièrement remercier Louis Archambault de m’avoir offert l’opportunité de participer à ce projet sous sa supervision. Ce projet était une chance unique pour moi de suivre ma passion en physique médicale et d’en apprendre davantage sur l’aspect clinique de la radiothérapie. Tout au long du projet, ses recommandations et sa motivation m’ont toujours montré la voie à suivre. De plus, tout le support qu’il m’a offert a été essentiel pour me permettre d’avancer tout au long de mes études. Je voudrais aussi remercier Luc Gingras pour toute l’aide qu’il m’a apportée. Malgré ses nombreuses tâches, il a toujours su trouver le temps de m’expliquer différents concepts en ce qui concerne les bases de la radiothérapie. Ses grandes forces résident dans ses connaissances et son instinct de la physique médicale. À chacun de nos échanges, je tâchais de profiter du maximum de son savoir.
Je remercie également Luc Beaulieu de m’avoir accueilli dans son programme d’études graduées et je suis content d’avoir pu apprendre de lui à plusieurs reprises, comme dans le cadre du cours de travaux pratiques en génie biomédical. Les aspects de la recherche académique n’ont pas de secrets pour lui et il peut voir le potentiel des étudiants avec lesquels il travaille, ce qui permet de tirer le maximum de nous-mêmes.
Un merci également aux étudiantes qui m’ont introduit au recalage déformable au début de ma mai-trise : Audrey Cantin et Sharlie D Vincent. En tant que débutant, elles m’ont aidé à démystifier les aspects les plus obscurs des logiciels comme Elastix et Pinnacle et elles ont pu me transmettre leur passion pour leurs projets à chacune de nos discussions.
Je dois aussi remercier le Groupe de recherche en physique médical dans son ensemble. J’y ai été accueilli depuis mon stage à l’été 2011 et je n’ai pas ainsi seulement gagné des collègues, mais aussi des amis. Un merci spécial aux étudiants qui m’ont aidé à traverser les épreuves des cours de maitrise : Patricia DD, Marie-Ève et Cédric. De plus, j’aimerais remercier les étudiants qui ont partagé mon quotidien dans le bureau des étudiants au quatrième étage du Couillard au cours des années : Émilie, Marie-Chantal, Ophélie, Daniel, Angélika et Paul. Finalement, je veux remercier Jean-François et Jonathan pour leur amitié, leur générosité et les bons moments que j’ai pu partager en leur compagnie. Finalement, un remerciement tout spécial à Patricia qui a contribué à d’innombrables occasions à améliorer mon séjour à la maitrise en physique médicale.
Avant-propos
Le chapitre3est un article qui a été inclus dans ce mémoire et qui porte le titre : Deformable image registration and automatic contouring using cone-beam CT : A study of similarity indices. L’article a été soumis le 7 septembre 2016 au journal Journal of Applied Clinical Medical Physics. Au mo-ment du dépôt du mémoire, le manuscrit est en processus de correction et d’amélioration à l’aide des commentaires qui ont été remis aux coauteurs après avoir terminé une première phase du processus d’évaluation par les pairs. L’état d’acceptation du manuscrit sera dépendant de l’évaluation suivant la remise de la deuxième version de l’article. Suite à l’évaluation, la version qui sera publiée pourrait être davantage modifiée par rapport à celle qui a été soumise, et donc pourrait différer de celle retrouvée dans ce mémoire de maîtrise.
L’article a été écrit par trois coauteurs : Louis Archambault, Luc Gingras et moi-même. Pour ma part, je suis l’auteur de correspondance pour ces travaux. Louis Archambault est mon directeur de maîtrise. Il est physicien médical au Département de radio-oncologie du CHU de Québec - Université Laval et professeur au Département de physique, de génie physique et d’optique à la Faculté des sciences et de génie de l’Université Laval. Luc Gingras est collaborateur au projet. Il est également physicien médical au Département de radio-oncologie du CHU de Québec - Université Laval et professeur associé au Département de physique, de génie physique et d’optique à la Faculté des sciences et de génie de l’Université Laval.
Mon rôle dans cet article a été de mettre sur pied la méthodologie et d’effectuer les manipulations ayant conduit aux résultats présentés. L’analyse de ces résultats a été faite conjointement avec Louis Archambault et Luc Gingras, suite à des discussions sur la signification des résultats obtenus. La rédaction de l’article a été effectuée dans un premier temps par moi, pour la première version. Ensuite, toutes les sections de l’article ont été révisées par Louis Archambault et Luc Gingras pour des fins d’améliorations et de corrections. Ces corrections ont été vérifiées ou appliquées par moi-même afin de produire le manuscrit qui a été soumis au journal.
Introduction
Radiothérapie guidée par imagerie
Description de la technique
L’utilisation croissante de l’imagerie en radiothérapie a permis d’améliorer avec le temps la délivrance des traitements en radio-oncologie par une meilleure délimitation des régions à traiter pour la guérison du cancer. Le principe de la radiothérapie guidée par imagerie, maintenant répandue dans un dépar-tement de radio-oncologie comme celui de L’Hôtel-Dieu de Québec, est d’acquérir des images avant le début des traitements et avant certaines fractions. La première séquence d’images sert à planifier le traitement et les images subséquentes visent à positionner le patient afin de centrer la région à traiter sur l’isocentre de l’accélérateur linéaire, soit l’intersection entre son axe de rotation et l’axe du fais-ceau de radiation [1]. Cette méthode, combinée avec des marqueurs sur la peau ou radio-opaques aux images de positionnement, est utile pour cibler plus précisément les tissus tumoraux [2]. L’alignement du patient par imagerie peut être effectué de différentes manières : l’imagerie portale par l’acquisition de la dose de faisceaux mégavoltages à la sortie du patient ou l’imageur kilovoltage embarqué sur les appareils de traitement. Dans le cadre de ce projet, seule l’imagerie kilovoltage est abordée et plus par-ticulièrement la tomodensitométrie à faisceau conique (CBCT, Cone Beam Computed Tomography), expliquée plus en détail à la sectionModalités d’imagerie.
L’alignement des images prises avant le début de chaque fraction du traitement et celle utilisée pour la planification du traitement se fait par fusion. Cette fusion est un recalage rigide manuel qui vise à aligner les images en se basant sur les os, sur des marqueurs ou sur des tissus mous. L’alignement avec les os est généralement utilisé parce que les os sont bien visibles sur des images kilovoltages grâce au bon contraste par rapport aux tissus mous. En effet, les images en tomodensitométrie sont formées par l’interaction du faisceau de radiation avec les différents tissus. Le ton de gris dans l’image indique le coefficient d’absorption des tissus à l’énergie du faisceau employée, coefficient qui est fonction de la densité et du numéro atomique effectif des tissus traversés. Ainsi, le contraste est grand puisque les os possèdent une grande concentration de calcium et de phosphore et donc leur numéro atomique effectif se situe près de 13, soit passablement plus élevé que celui des tissus mous, qui est autour de 7 [3]. La technique d’alignement du patient avec les os est appelée en ligne, parce qu’elle utilise des images produites au moment du traitement. Elle apporte une plus grande précision de positionnement, mais
administre une plus grande dose de radiation au patient due à l’imagerie de positionnement [4]. Par exemple, des images orthogonales de positionnement par recalage osseux pour un examen de la région pelvienne peut occasionner une dose de l’ordre de 0,1 cGy à 50% du volume de la vessie et cela peut monter à 2 cGy pour un examen par tomodensitométrie à faisceau conique [5]. Par contre, pour les tissus peu ou non liés aux os, cette technique est moins précise parce que la position de la région à traiter n’est pas nécessairement reliée à celle des os.
Les techniques hors ligne, comme celle abordée dans ces travaux de recherche, sont des méthodes qui s’effectuent entre les fractions d’un traitement. Dans le cas présent, la méthode consiste à acquérir des images CBCT de la région pelvienne de manière régulière durant le traitement de radiothérapie externe de la prostate, comme la méthode en ligne. Par contre, la méthode hors ligne requiert de faire des vérifications à l’aide de l’imagerie afin que la planification soit respectée. Pour ce faire, l’image CBCT du jour peut être fusionnée à l’image en tomodensitométrie de planification (CT, Computed Tomography) afin de vérifier qu’il n’y a pas des déformations anatomiques qui surviennent plus fré-quemment. Il est également possible de calculer la dose sur l’image CBCT en appliquant une densité homogène dans toute l’image (celle de l’eau) et de faire une approximation des doses du jour aux organes. L’avantage de cette approximation est de vérifier l’impact d’une grande déformation, comme la perte significative de poids du patient. L’avantage de ces techniques est de mener à une détection d’erreurs rapide et d’améliorer la qualité générale des traitements [4].
Identification des structures et planification
Suite au diagnostic de cancer et à la rencontre entre le radio-oncologue et le patient, ce dernier passe un examen en tomodensitométrie. L’acquisition de cette image a deux fonctions, la première étant d’identifier et tracer le contour des tissus et la seconde étant d’aider au calcul des doses administrées durant le traitement.
La première étape de la planification est l’identification par le radio-oncologue des tissus importants dans l’image. Il trace le contour de toute l’extension de la maladie ainsi que des possibles métastases. Par la suite, la segmentation des contours des organes à risque environnants est effectuée, de manière à ce que la planification du traitement évite ces tissus sains. Les contours qui s’ajoutent à ceux-ci par la suite ont pour but de bien contrôler la distribution de la dose autour de ces structures anatomiques. Entre autres, des marges, expliquées plus en détail à la sectionMarges de planification, sont utilisées pour former la région cible qui sera traitée. Cette région est plus grande que le volume visible ou invi-sible de la maladie, afin que les variations anatomiques du patient n’affectent pas la dose administrée à la tumeur.
Il existe toutefois une incertitude reliée à l’étape de délinéation des tissus par les médecins. En effet, même s’ils suivent les mêmes indications, il existe une incertitude sur l’interprétation des tons de gris des images diagnostiques et donc une variabilité sur les contours des médecins. La variabilité existe à la fois entre les contours d’un même médecin (intraobservateur) et entre les contours de plusieurs
médecins (interobservateur). Par exemple, il a été montré que le contour de la prostate sur image CT peut varier entre 10 et 15 % entre des médecins. De plus, pour les vésicules séminales, un organe plus petit et dont le contraste avec les tissus environnants est faible également, la variabilité est plus haute : entre 14 et 18 % [6,7]. Que ce soit une erreur de volume de la cible ou de sa forme, une erreur à cette étape peut mener à des écarts de dose entre ce qui est planifié et ce qui est délivré à chaque fraction du traitement [8]. Cette incertitude sur les contours est encore plus prononcée lorsque des images de faible qualité sont utilisées. Par exemple, les contours tracés sur des images échographiques transrectales de la prostate indiquent une variabilité interobservateur de 21,9 %, mais également une variabilité intraobservateur de 15,5 % [9]. Ainsi, comme l’appuie l’étude de Lütgendorf-Caucig et coll. [10], les contours sur des images possédant davantage d’artéfacts, comme en tomodensitométrie à faisceau conique tel qu’il est abordé dans ce projet, sont aussi dépendants du médecin qui les produit et de son interprétation de l’étendue de la maladie. Ainsi, les contours tracés par les médecins possèdent une incertitude intrinsèque dont il est nécessaire d’être conscient. Par exemple, des contours d’organes tracés sur images CT et CBCT par une radio-oncologue ont été utilisés dans le cadre de cette étude, donc les conclusions sur la comparaison de contours qu’il est permis de tirer sont limitées par ces incertitudes de plusieurs pourcents.
Le traitement est ensuite planifié, étape lors de laquelle le type de faisceau, son énergie et les diffé-rentes incidences sont choisis. Ces considérations ont pour but de limiter la dose aux tissus sains et maximiser la dose à la tumeur. Par exemple, dans le cadre de ce projet, la planification utilisée est une planification typique d’un traitement de radiothérapie du cancer de la prostate. Les plans de traite-ment des patients étudiés utilisent des faisceaux de photons de 6 MV. Ces faisceaux sont produits par l’interaction d’un faisceau d’électrons avec une cible après avoir été accéléré dans un champ électro-magnétique jusqu’à une énergie de 6 MeV. Sept incidences de faisceau sont employées de manière à éviter les tissus les plus sensibles. Dans le cas du cancer de la prostate, on tente d’éviter le rectum, la vessie, l’intestin grêle, les amas nerveux et les têtes fémorales. La dose prescrite à la cible est de 1,8 Gy par fraction, pour un traitement de 25 fractions et cela dans le but de diminuer la toxicité du trai-tement pour les tissus sains, comme il est discuté à la sectionRadiothérapie adaptative. Il est à noter que cette planification n’est qu’une partie d’un traitement conventionnel pour le cancer de la prostate. Habituellement, 10 fractions supplémentaires s’ajoutent à ces 25 fractions afin d’augmenter la dose à la prostate uniquement et non plus également aux organes environnants susceptibles de posséder des cellules tumorales.
Variations anatomiques interfractions
La planification est basée sur une séquence d’images CT qui est un cliché de l’anatomie du patient avant le début des traitements. Un contour peut, à une fraction donnée, ne plus représenter adéquate-ment l’organe prévu lors de la planification [11]. En effet, l’anatomie interne comme externe du patient va varier dans le temps, autant pendant une fraction qu’entre les fractions [12,13]. Par exemple, la res-piration du patient ou les mouvements intestinaux peuvent provoquer de la pression et un mouvement
des autres organes du corps. De plus, deux semaines peuvent s’écouler entre l’acquisition de l’image CT et le début des traitements. Durant ce délai, la maladie peut évoluer et continuer à augmenter en volume. D’ailleurs, durant les semaines que peuvent durer les traitements, le patient peut perdre du poids, les tissus de l’anatomie interne peuvent se déplacer et changer de forme.
Dans le cas abordé pour cette étude, soit le cancer de la prostate, le volume du rectum peut changer selon qu’il y a présence d’air ou non. De plus, le remplissage de la vessie peut faire varier la position des tissus autour de la prostate [14,15,16]. En plus de la position, la forme et l’orientation de la pros-tate peuvent varier légèrement [17,18]. Ainsi, la délinéation des contours faite lors de la planification comporte une incertitude due surtout aux mouvements aléatoires des organes à chacune des fractions. Cette incertitude sur les mouvements des organes est toutefois prise en considération lors de la déli-néation des tissus. Ceci est particulièrement vrai pour la région traitée, dont le volume est plus grand que la pathologie elle-même afin d’inclure, entre autres, les incertitudes du mouvement, du volume et de la forme du tissu tumoral dans le temps [19]. Ces variations anatomiques sont également abordées à la sectionMarges de planification.
Marges de planification
Pour tenir compte des divers aléas qui peuvent survenir tout au long d’un traitement, il est nécessaire d’employer des marges lors de la planification. Ces marges ont pour but de cibler les tissus cancéreux à chaque fraction et ainsi respecter la planification du traitement indépendamment des erreurs de po-sitionnement aléatoires et de certaines erreurs systématiques, comme un popo-sitionnement non adéquat dû à un système d’immobilisation trop complexe, les mouvements indépendants des marques sur la peau par rapport à l’anatomie interne ou même les erreurs de délinéation des structures lors de la planification [20,21].
Les premières définitions des volumes et de ces marges sont tirées de rapports de l’International Commission on Radiation Units and Measurements [22]. Ces rapports définissent la nomenclature utilisée pour uniformiser la pratique. Ainsi, les contours les plus utilisés en radiothérapie sont illustrés à la figure0.1.
Le GTV (Gross Tumor Volume) est le volume tumoral macroscopique. Il s’agit de l’étendue de la tumeur visible à l’imagerie. Le CTV (Clinical Target Volume) est le volume cible clinique qui com-prend à la fois le GTV ainsi que toute extension des cellules cancéreuses invisibles à l’imagerie et qui doit être traitée. Cette première marge autour de la tumeur est définie grâce à l’expérience du méde-cin et elle comprend les structures avoisinantes les plus à risque de contenir des cellules cancéreuses. Le PTV (Planning Target Volume) est le volume cible prévisionnel. Il inclut le CTV ainsi que deux marges : une marge interne pour prendre en compte les variations anatomiques qui peuvent survenir au cours du traitement et une marge d’incertitude reliée au traitement. Les variations anatomiques qui peuvent déplacer la prostate tout au long du traitement peuvent être le péristaltisme, la perte de poids et le remplissage de la vessie et du rectum [23]. Dans les incertitudes reliées au traitement entrent
FIGURE0.1 – Schématisation de volumes pris en compte lors de la planification d’un traitement. À noter que les marges ne sont pas nécessairement uniformes autour du GTV.
en compte : le positionnement du patient à chaque fraction du traitement, les petits mouvements qui pourraient se produire lors du traitement ainsi que les incertitudes sur la délivrance du traitement par les appareils. Ainsi, le PTV, qui est davantage un concept géométrique que biologique, est un volume de planification qui permet de s’assurer que le traitement sera bien délivré à chaque fraction [19]. Toutes ces incertitudes de positionnement qui mènent à l’application de marges peuvent être systéma-tiques ou aléatoires. Les erreurs systémasystéma-tiques sont des erreurs constantes qui s’appliquent pour tout le traitement, tandis que les erreurs aléatoires peuvent être différentes entre chacune des fractions. De grandes erreurs aléatoires sur une population de patients va entraîner un sous-dosage modéré de la cible pour une grande proportion des patients, tandis qu’une même erreur systématique entraî-nera un plus grand sous-dosage, mais pour un nombre de patients plus faible. Une marge de sécurité recommandée consiste à additionner en quadrature les erreurs aléatoires et systématiques, qui sont eux-mêmes multipliés par des coefficients, pour former le PTV. L’utilisation de deux coefficients pour ces erreurs vise à compenser l’erreur systématique de préparation et l’étalement de la dose cumulative lors de l’exécution du traitement à chaque séance en produisant une marge qui permettra, avec une certaine probabilité, de couvrir adéquatement la cible. Ces coefficients, qui représentent le poids de chaque type d’erreur, sont obtenus en déterminant le ratio σ/Σ entre les erreurs aléatoires (σ) et les erreurs systématiques (Σ). Un résumé de ces différentes incertitudes en ce qui a trait au traitement du cancer de la prostate est donné au tableau0.1[24].
Une étude montre que les erreurs aléatoires maximales causées par le déplacement de la prostate et par le positionnement du patient peuvent atteindre, par exemple, jusqu’à 2,7 mm en antéro-postérieur et 2 mm en latéral, respectivement [25]. De plus, il faut ajouter une erreur systématique reliée à la délinéation des contours qui atteint 1,7, 2 et 2 mm en latéral, supéro-inférieur et antéro-postérieur, respectivement. D’autres études sur des cas cliniques indiquent que les mouvements de la prostate sont
TABLE0.1 – Incertitudes sur des traitements du cancer de la prostate représentées par l’écart type des translations dans chaque direction
Erreurs sur l’exécution Erreurs sur la préparation (aléatoires) (systématiques)
[mm] [mm]
Lat Sup-Inf AP Lat Sup-Inf AP
Délinéation de la cible 1,7 2 - 3,5 2,0
Mouvement de l’organe 0,9 1,7 2,7 0,9 1,7 2,7 Erreur de positionnement 2,0 1,8 1,7 2,6 2,4 2,4 Somme quadratique des écarts types 2,2 2,5 3,2 3,2 3,6 - 4,5 4,1 Lat : Latéral
Sup-Inf : Supéro-Inférieur AP : Antéro-Postérieur
plus prononcés dans la direction antéro-postérieure et supéro-inférieure [26,27,28]. Ces déplacements systématiques dans ces directions étaient de 1,4 et 1 mm, respectivement [26]. Une autre étude indique des déplacements qui peuvent en atteindre jusqu’à 16 mm entre les fractions [29]. Ainsi, les marges à employer pour prendre en compte les erreurs de positionnement et de déplacement des organes dépendent du pourcentage minimum des patients pour lesquels on veut couvrir une proportion du volume cible avec une fraction de la dose de prescription. Toutefois, on s’assure qu’il y ait une fraction du volume cible qui soit couvert par la dose de prescription. Ces marges sont toutefois de grande importance pour augmenter la probabilité de disparition de la maladie.
Modalités d’imagerie
À la base d’un traitement de radiothérapie guidé par l’image se trouve l’imagerie médicale. Il s’agit de méthodes non invasives qui visent à visualiser différentes caractéristiques de l’anatomie interne du patient. Les différentes modalités d’imagerie présentent des avantages selon l’intervention choisie. Dans le cadre de traitements de radiothérapie, la modalité la plus conventionnelle est la tomodensito-métrie. Elle consiste à imager le patient à l’aide d’un faisceau de photons kilovoltage (ou mégavoltage dans le cadre des MV CBCT) et ceci peut être effectué à l’aide d’un tomodensitomètre conventionnel (CT) ou d’un tomodensitomètre à faisceau conique (CBCT). Les pixels dans ces images ont chacun une valeur de ton de gris et cette information est appelée nombre CT ou nombre Hounsfield (ou HU pour Hounsfield Unit en anglais). Ces intensités des pixels sont des valeurs qui permettent de relier chaque région de l’image à sa densité électronique, information essentielle pour simuler un traitement de radiothérapie et calculer les doses de radiation déposées dans les tissus. Les nombres CT sont un rapport de la densité des tissus sur celle de l’eau et s’étendent d’environ -1000 pour l’air jusqu’à 3000 et plus pour les métaux. Ils sont définis par l’équation1[3].
HU(x, y, z) =1000(µ(x, y, z)− µw) µw
(1)
Où µ(x, y, z)est le coefficient d’atténuation linéaire mesuré à chaque pixel et µw est le coefficient
d’atténuation linéaire de l’eau.
Tomodensitométrie (CT)
Un tomodensitomètre comme celui illustré à la figure0.2emploie un faisceau de radiation pour pro-duire une image de l’anatomie. L’image tridimensionnelle de haute résolution du corps est produite par la reconstruction d’un grand nombre de projections prises à plusieurs angles autour du patient [3]. La géométrie du CT est circulaire, ce qui rend l’acquisition d’images à plusieurs angles possible. En effet, la source de radiation kilovoltage tourne autour du patient et émet son faisceau en éventail vers des barrettes de détecteurs de l’autre côté du patient. En avançant la table sur laquelle le patient est couché, le mouvement du faisceau en éventail devient hélicoïdal et une section du corps plus large peut être acquise.
FIGURE0.2 – Tomodensitomètre utilisé au département de radio-oncologie de L’Hôtel-Dieu de Qué-bec
Aux énergies kilovoltages, le faisceau de radiation interagit principalement par effet photoélectrique ou par effet Compton dans les tissus du patient [30]. À chacune de ces interactions, l’intensité du faisceau diminue, et plus les interactions sont nombreuses, plus l’atténuation du faisceau est grande. Ainsi, la réponse de chaque élément du détecteur indique l’atténuation linéaire des tissus, pondéré sur le parcours du faisceau entre le point focal de la source de radiation et cet élément. Cette atténuation est reliée à la densité électronique des tissus traversés, ce qui rend l’image CT pratique pour la pla-nification des traitements en radiothérapie. Les nombreuses projections du corps du patient, obtenues lorsque la source tourne autour de celui-ci et que la table est déplacée, permettent une reconstruction tridimensionnelle par rétroprojection filtrée [3], également utile pour la planification.
Tomodensitométrie à faisceau conique (CBCT)
La physique derrière le fonctionnement du CBCT est la même que pour le CT. L’image obtenue est tirée de l’atténuation linéaire du faisceau de radiation kilovoltage traversant le patient et détecté par des détecteurs. Toutefois, la plus grande différence est la forme conique du faisceau. Au lieu d’un faisceau en éventail très étroit capté par des barrettes de détecteurs, le faisceau est mesuré par un large détecteur plat et peut atteindre jusqu’à près de 20° d’angle de cône et une dimension jusqu’à 40 cm de côté (figure 0.3). De cette manière, un déplacement de table n’est pas nécessaire pour obtenir une image d’une plus grande section du patient. Il ne suffit que d’effectuer une rotation de l’appareil de traitement pour obtenir plusieurs images projetées, à la manière du CT. Par contre, la vitesse de rotation de l’appareil de traitement est beaucoup plus faible que la source d’un CT. Ainsi, des artéfacts de mouvement peuvent apparaitre si le patient bouge ou respire et des sections de l’anatomie peuvent se retrouver dédoublées. De plus, étant donné que moins d’acquisitions sont prises durant la séance d’imagerie, un sous-échantillonnage peut se produire, ce qui diminue sa résolution.
Un aspect négatif de cette modalité est que la largeur du faisceau augmente la probabilité que la radiation diffusée par des interactions dans le corps atteigne des détecteurs qui ne sont pas directement sur son trajet [3]. Ceci augmente le bruit à chaque image et cela diminue la qualité de l’image acquise. La relation entre les nombres CT et les densités électroniques n’est plus linéaire, ce qui rend cette image impropre au calcul de la dose pour la planification. Par exemple, un calcul de dose sur image CBCT, avec étalonnage des nombres HU, pour une planification de radiothérapie conformationelle avec un faisceau de photons 6 MV peut montrer un écart de dose jusqu’à 3,3% avec un calcul sur image CT, tandis qu’un traitement en radiothérapie à intensité modulée (IMRT, Intensity Modulated Radiation Therapy) donne un écart de dose jusqu’à 2,5% [31]. Une autre étude indique que lorsque l’on emploie plutôt une courbe de nombres HU d’un CT pour faire un calcul de dose d’un plan d’IMRT sur image CBCT, on peut obtenir un écart de dose de 8, 0% ± 5, 7% dans le cadre de cas de cancer de la prostate [32].
Les autres désavantages proviennent des artéfacts qui peuvent survenir sur les images CBCT [33,
34]. Parmi celles-ci, on retrouve l’artéfact de rebord ou l’artéfact de durcissement. Il se produit près d’un haut gradient d’intensité et il se caractérise par la formation de lignes très sombres derrière ces structures dans la direction du faisceau. De plus, le sous-échantillonnage du patient, qui est dû à la divergence conique du faisceau peut également produire un patron de Moire, soit des lignes qui divergent du centre vers la périphérie de l’image. Finalement, l’artéfact de mouvement est un artéfact propre au CBCT, car l’acquisition de l’image est beaucoup plus longue qu’une coupe d’une image CT. En effet, durant les 6 à 20 secondes que dure l’acquisition de l’image CBCT, le patient peut bouger légèrement et les tissus internes peuvent se déplacer, comme lors de la respiration par exemple. Ceci produit un dédoublement des organes sur l’image CBCT, ce qui la rend moins idéale en comparaison à l’image CT.
FIGURE 0.3 – Tomodensitomètre à faisceau conique (identifié par des flèches : source à gauche et imageur à droite) embarqué sur un accélérateur linéaire au département de radio-oncologie de L’Hôtel-Dieu de Québec
[35]. En effet, puisqu’il s’agit d’une modalité utilisée pour le positionnement, la qualité de l’image n’est pas aussi importante qu’au CT. Comme il est expliqué plus haut, étant donné que l’intensité du signal est plus faible, cela diminue le rapport signal sur bruit de l’image. Un deuxième avantage est que le système d’imagerie est installé sur les appareils de traitement, comme le montre la figure0.3. Le fait qu’il ne s’agit pas d’un appareil situé dans une autre salle rend la planification des séances d’imagerie régulières plus simple. Les images sont acquises au début et/ou à la fin d’une fraction, une procédure qui n’augmente pas beaucoup la charge de travail en clinique en comparaison à une séance d’imagerie au CT qui exigerait de repositionner le patient dans cette salle. Comme sa qualité est moindre que celle du CT, la planification du traitement n’est pas faite sur ces images. Elles servent surtout à replacer le patient au début de ses fractions pour complémenter les marqueurs à la peau [36]. Il est aussi possible de vérifier l’anatomie du patient et effectuer au besoin des calculs de dose simplifiés lors du suivi d’un cas.
Radiothérapie adaptative
Le besoin d’adapter et de modifier les traitements de radiothérapie dans le temps provient du fait que ces traitements sont généralement divisés en séances, appelées fractions. Cet étalement du traitement en plusieurs fractions est utilisé dans la plupart des cas de radiothérapie externe, car cela produit un meilleur contrôle tumoral pour un niveau de toxicité donné, en comparaison à une dose de radiation unique. En effet, en comparaison aux tissus sains, les cellules tumorales sont un type de cellule qui présente peu de réparation aux dommages sublétaux occasionnés par les bris dans l’ADN de la cellule dû à la radiation. Par contre, la répartition de la dose pour le traitement de la prostate est particulier parce que la tumeur se prolifère plus lentement que les tissus sains de la prostate. La dose de 1,8 Gy par fraction, et non plus, vise à obtenir le meilleur effet biologique pour une certaine dose totale. Ainsi,
en espaçant les séances du traitement, il est donc possible de favoriser la réparation des cellules saines au détriment des cellules cancéreuses et ainsi atteindre le contrôle tumoral désiré en maximisant la survie des tissus sains.
Ainsi, l’un des défis de la radiothérapie est de s’assurer de bien traiter les tissus tumoraux et d’éviter les tissus sains, et ce, sur une période de plusieurs semaines. Bien que l’ajout de plus grandes marges, telles qu’expliquées plus haut, permet de traiter adéquatement la cible dans l’éventualité où celle-ci se déplace ou change de forme entre les fractions du traitement, cela ne permet pas de réduire la dose aux tissus sains. Pour atteindre un tel but, il est nécessaire d’effectuer des vérifications et, au besoin, des ajustements qui reflètent les changements dans l’anatomie du patient. Ces modifications au cours d’un traitement font partie de méthodes de radiothérapie adaptative. Il existe des techniques adaptatives en ligne et hors ligne, c’est-à-dire lors des fractions et entre les fractions.
Radiothérapie adaptative en ligne
Les méthodes d’adaptation du traitement en ligne sont des méthodes précises qui se basent sur l’ima-gerie du jour pour s’assurer d’atteindre les objectifs du traitement tel qu’il a été planifié. Parmi celles-ci notons l’optimisation de la position des lames du collimateur multilames au moment du traitement afin de suivre la prostate tout au long des traitements et augmenter la similarité entre la distribution de dose lors du traitement et lors de la planification [37]. De plus, une autre méthode proposée consiste à ima-ger le patient au début des fractions, de manière à planifier avec une image CT du jour. Cette méthode a l’avantage de diminuer grandement les erreurs au cours du traitement, mais elle peut être coûteuse en temps puisque les organes doivent être contourés avant de commencer la fraction [38]. De plus, si la durée du processus en ligne est trop longue, la précision peut diminuer à cause des mouvements internes des organes entre la séance d’imagerie et le début de la séance de traitement. Pour pallier ces problèmes, la technique de recalage déformable d’images décrite à la sectionRecalage d’images pour-rait être appliquée aux contours tracés lors de la planification afin de déformer les contours existants sur les nouvelles images. Bien que le radio-oncologue doive vérifier tous les contours issus du reca-lage, cette technique aurait l’avantage de prendre moins de temps avant de délivrer le traitement. Une dernière méthode développée à L’Hôtel-Dieu de Québec, considérée comme hybride, est l’adaptation au jour du traitement de plans préparés hors ligne. Elle consiste à sélectionner, à chaque fraction, un plan parmi une banque de plans déjà préparés selon l’anatomie qui est la plus semblable à celle du jour. Le plan est sélectionné en trouvant celui dont la distance entre le recalage osseux et le recalage sur grains d’or dans la prostate est le plus similaire à ce qui est mesuré au jour du traitement. De plus, l’image CBCT produite à cette fraction vient enrichir la base d’images du patient sur lesquelles un plan est optimisé entre les fractions.
Radiothérapie adaptative hors ligne
Par contrainte de temps et de ressources au moment du traitement, les techniques adaptatives les plus conventionnelles proposent d’effectuer des étapes de vérification hors ligne, c’est-à-dire entre les
fractions tout au long du traitement [39, 40]. Par exemple, l’une des méthodes hors ligne revient à déterminer une position moyenne de la prostate et la forme du rectum en se basant sur la moyenne sur 4 images CT afin de réduire l’erreur systématique de positionnement [41]. Il est également possible d’adapter le plan de traitement entre les fractions en se basant sur des images tomodensitométriques prises au cours des traitements [42, 43]. Le but de cette méthode qui prend davantage de temps, mais qui permet de faire de la compensation de dose, est d’effectuer une réoptimisation du traitement ainsi que des paramètres des faisceaux, tel qu’il est fait lors de la planification. De plus, lorsque des variations anatomiques sont détectées, un suivi du patient peut être effectué en planifiant d’autres acquisitions d’images dans le futur et en effectuant davantage de modifications au plan de traitement. Par exemple, des travaux effectués à l’Hôtel-Dieu de Québec ont étudié l’utilisation de l’imagerie CBCT pour déterminer la variabilité du volume tumoral dans le temps pour des cas de cancer du poumon [44] et pour effectuer des recalages osseux et sur grains d’or pour la diminution des marges pour des cas de cancer de la prostate [45]. Dans le cadre de cette dernière étude, trois méthodes de radiothérapie adaptative pour des cas de cancer de la prostate ont été utilisées. Le traitement était divisé en 2 phases, soit 25 fractions pour traiter la prostate et les ganglions et 10 fractions avec recalage sur grains d’or de 2,2 Gy pour la prostate seule. Les trois méthodes ne sont étudiées que sur la première phase. Pour la première méthode, le recalage osseux a été utilisé pour traiter le bassin et la prostate avec 1,8 Gy par fraction puis en complétant la dose à la prostate avec 0,4 Gy en utilisant le recalage avec grains d’or. La seconde méthode était une variante de la première méthode, mais où un faible gradient de dose a été appliqué entre les deux régions traitées de manière à ce que le complément de dose au centre de la prostate soit de plus de 0,4 Gy. La troisième méthode consistait à sélectionner un plan précalculé basé sur la position du centre de masse de la prostate sur l’imagerie CBCT du jour à l’aide d’un recalage sur l’anatomie osseuse. Ces trois méthodes ont le potentiel d’améliorer la couverture du CTV et de réduire les marges, mais les deux premières méthodes par recalage ont le potentiel d’être aisément applicables en clinique.
Autrement, dans le cas de grandes déformations où le traitement ne peut pas être légèrement mo-difié, comme une grande perte de poids, le traitement peut être replanifié. Ces nouvelles étapes de segmentation et de calcul de la dose sont donc effectuées hors ligne. De cette manière, une meilleure optimisation du traitement peut être faite et des outils peuvent être mis en place pour évaluer les erreurs sur le traitement [46]. Toutefois, dans le cas d’une replanification complète, d’autres facteurs peuvent entrer en ligne de compte et qui peuvent affecter le succès du traitement. Entre autres, un délai au cours d’un traitement pourrait venir modifier l’effet biologique effectif du traitement en permettant davan-tage de repopulation des cellules tumorales durant la replanification. Cela ferait en sorte de diminuer le succès du traitement si la dose par fraction n’est pas ajustée. Il faut donc non seulement prendre en compte les erreurs liées aux variations interfractions, mais également les délais qu’occasionneraient la replanification dans le parcours du patient.
Recalage d’images
Le recalage d’images est une technique de fusion des informations contenues dans deux images d’un même patient prises à l’aide de la même ou de différentes modalités d’imagerie et espacées dans le temps. Le concept du recalage est d’aligner les caractéristiques d’une image dite mobile ou secondaire sur une image dite fixe, ou de référence. Deux méthodes sont possibles pour aligner l’image mobile sur l’image fixe : le recalage rigide et le recalage déformable [47].
Recalage rigide
Le recalage rigide consiste à déplacer l’image mobile de manière à ce qu’elle soit placée dans le même système de coordonnées que l’image de référence. Ainsi, les transformations permises par le recalage rigide sont des translations et des rotations, pour un total de 6 degrés de liberté. De plus, pour le recalage rigide, la transformation est appliquée de manière globale sur tous les pixels de l’image. À L’Hôtel-Dieu de Québec, le recalage rigide est une étape qui est effectuée manuellement à chaque fraction du traitement. Elle sert à aligner le patient avec les images qui ont été prises avant le début du traitement en effectuant des translations de la table de traitement sur laquelle le patient est installé. Dans le cadre d’un processus automatisé, en plus de la transformation rigide, l’algorithme emploie une métrique et un optimiseur, tel qu’expliqué à la section1.2.1. La métrique calcule la similarité entre les deux images et l’optimiseur détermine la transformation à effectuer pour maximiser la métrique [48]. L’utilité du recalage rigide dans le cadre de ce projet est principalement de fusionner une image sur une autre de manière à superposer grossièrement leurs caractéristiques. Il s’agit d’une étape importante pour effectuer un bon recalage déformable.
Recalage déformable
Le principe du recalage déformable est similaire au recalage rigide, en ce sens que des transformations géométriques sont appliquées à l’image mobile de manière à augmenter la similarité entre les images. La distinction est que, durant le recalage déformable, les transformations varient localement, ce qui crée une déformation de l’image plutôt qu’une transformation globale. Cette méthode est particulière-ment utile lorsqu’il est nécessaire de faire correspondre deux anatomies différentes, où les tissus n’ont pas la même forme ou la même taille.
De plus, comme le recalage rigide, l’algorithme utilise une métrique et un optimiseur. La différence avec le recalage rigide étant le nombre de degrés de liberté de la transformation, pouvant théorique-ment aller jusqu’à N3, soit le nombre de pixels dans l’image au cube. En effet, bien qu’il serait difficile de garder la forme des organes, un recalage déformable pourrait déplacer chaque pixel individuelle-ment et libreindividuelle-ment dans les trois dimensions de l’image. Les algorithmes des logiciels utilisés pour ce projet sont décrits plus en détail aux sections 1.2.1et 1.3.1. Également, le recalage déformable appliqué sur des contours et des distributions de dose sera abordé aux chapitres3et4, respectivement.
Présentation du projet de recherche
Ce projet de recherche se découpe en trois parties. La première partie vise à employer le logiciel Elas-tix pour caractériser les recalages déformables possibles. La motivation à utiliser ce logiciel provient du fait qu’il est libre et utilisable sur plusieurs plateformes. Il s’agit d’avantages importants lorsqu’il est question de développer et ultimement intégrer une technique de recalage déformable qui serait adaptée aux besoins en cliniques à L’Hôtel-Dieu de Québec. Les premiers tests emploient des images d’un fantôme anthropomorphique de la région pelvienne masculine. L’utilisation d’un fantôme per-met de connaitre l’image déformée attendue et ainsi optimiser les valeurs des paramètres de recalage donnés au logiciel sous la forme d’un fichier. Ce fichier de paramètres optimisés est ensuite utilisé pour recaler des images d’un patient. Les calculs de dose et les analyses d’intensités et de similarités sont utilisés aux différentes étapes du chapitre2pour quantifier la qualité des recalages.
La seconde partie au chapitre 3 est une étude sur la qualité des contours générés par le recalage déformable provenant du logiciel OnQ rts. Le but est de vérifier si la déformation des contours de l’image CT permet de produire automatiquement des contours du jour adéquats. Cette section a une visée plus clinique, car on tente d’évaluer la combinaison de l’organe, la méthode et la métrique qui permettrait d’évaluer quantitativement et de manière précise les déformations anatomiques entre les organes sur image CT et ceux sur image CBCT. De plus, l’avantage d’utiliser ce logiciel à cette étape est qu’il possède de nombreux outils d’analyse géométrique des contours et que différentes méthodes de recalage déformable sont également offertes par le logiciel. La méthode utilisée a pour but de déterminer si le recalage déformable, utilisé en clinique, permettrait de sauver du temps sur la délinéation des organes sur les images du jour. Pour tester les algorithmes du logiciel, on utilise des images CT et CBCT de patients dont les contours ont été dessinés sur chaque image. Ces contours comportent une incertitude due à l’interprétation des organes sur chacune des images, mais ce sont les contours que l’on s’attend à obtenir du logiciel en ce sens que l’on désire obtenir des contours similaires à ce qui est fait manuellement.
La troisième partie est une preuve de concept. Les résultats du chapitre4visent à démontrer l’appli-cation d’une nouvelle méthode de déformation des doses pour un cumul qui représente mieux l’effet des déformations anatomiques sur les distributions de dose. Les mêmes images patients ont été uti-lisées conjointement avec l’algorithme de recalage du logiciel Elastix. Après le calcul des doses sur les images recalées provenant du logiciel OnQ de la précédente section, le logiciel Elastix est utilisé pour obtenir la transformation inverse de celle obtenue par OnQ : un recalage de l’image CT recalée sur l’image CT de planification. Ces paramètres de déformation sont appliqués aux cartes de dose du jour et ces dernières sont cumulées. Le cumul des doses déformées et le cumul de dose planifié sont ensuite comparés pour montrer les différences de distribution de dose sur plusieurs fractions pour ces patients.
Chapitre 1
Matériel et Méthodes
1.1
Banques d’image
Les images utilisées lors de ce travail de maitrise proviennent de deux banques. La première banque consiste en des images CT et CBCT d’un fantôme utilisé pour des fins de caractérisation. Cette banque est progressivement mise de côté alors que la méthode de recalage déformable est étendue à une banque d’images CT et CBCT de patients, dont tous les contours d’organes sont tracés par un expert.
1.1.1 Fantôme anthropomorphique
Premièrement, les images employées pour la caractérisation du logiciel au chapitre2 sont tirées du projet de maitrise de Sharlie D. Vincent [49]. Ce sont des images CT et CBCT d’un fantôme an-thropomorphique de la région pelvienne masculine. Le fantôme est une cuve remplie d’eau où sont suspendus, par un système de filaments et de tige, des objets simulant des organes. Les organes re-produits dans le fantôme sont la prostate, la vessie, le rectum et les têtes fémorales. Ils sont faits de plusieurs matériaux, comme un respirateur pédiatrique rempli de liquide avec agent de contraste pour la vessie, du plâtre pour les têtes fémorales, des billes de plastique pour le rectum et de la pâte à modeler pour la prostate. Les nombres HU des organes du fantôme sont donnés au tableau1.1. TABLE1.1 – Nombres HU moyens des organes du fantôme anthropomorphique de la région pelvienne masculine et les valeurs typiques pour des organes humains
Organe Humain Fantôme Prostate 400 40
Vessie 40 -10
Rectum -500 -250 Têtes fémorales 950 1000
L’écart maximal absolu entre les nombres HU du fantôme et ceux d’un humain se retrouve dans la prostate et il est de 360. En moyenne, cet écart pour tous les organes est de 178. Les recherches de Sharlie D. Vincent ont montré que ces écarts n’engendrent pas d’erreur significative pour le recalage
déformable et que ce fantôme pouvait être employé pour la caractérisation d’algorithmes. Un exemple de ces images de fantôme est illustré à la figure1.1.
CT
référenceCT
anatomie déforméeCBCT
anatomie déforméeCBCT
référenceA
B
C
D
FIGURE 1.1 – Fantôme anthropomorphique de la région pelvienne masculine, représenté dans une cuve d’eau. Les images à gauche (A, D) sont les images CT montrant deux anatomies où la prostate a été déplacée de 2 cm et les images à droite (B, C) montrent les mêmes anatomies prises par CBCT. Les organes simulés sont la prostate, le rectum, la vessie et les têtes fémorales.
L’avantage d’utiliser ces images vient du fait que des déformations physiques connues ont pu être apportées au fantôme. Ainsi, différentes translations de la prostate ont pu être étudiées pour caracté-riser le logiciel Elastix. Pour chacune des images, les contours d’organes ont pu être tracés et cela a surtout permis d’obtenir les contours manuels attendus sur les images CT, soit les contours de réfé-rence. Par la suite, la méthode employée pour le recalage est similaire à celle utilisée par Sharlie D. Vincent. Cette méthodologie, illustrée à la figure1.2, montre qu’un ensemble de 4 images a été utilisé. Premièrement, le fantôme avait été imagé au CT avec une anatomie de référence (A), puis déplacé à l’accélérateur linéaire pour obtenir une image CBCT de la même anatomie (B). Après avoir subi une transformation physique, le fantôme était imagé au CBCT (C), puis au CT (D). Comme il est expliqué plus bas, le recalage était effectué entre l’image CT avec l’anatomie de référence et l’image CBCT avec l’anatomie déformée. Cette image recalée résultante (E) pouvait alors être comparée à la vérité attendue, soit l’image CT avec l’anatomie déformée.
1.1.2 Patients
Deuxièmement, les images de patients de cas de cancer de la prostate ont été utilisées pour évaluer les différents algorithmes de recalages (figure1.3). Il s’agit de 5 des patients qui ont été utilisés lors d’une précédente étude sur les marges employées en radiothérapie à l’Hôtel-Dieu de Québec. Ces 5 patients ont par la suite été utilisés dans le cadre du projet de maitrise d’Audrey Cantin sur des stra-tégies de radiothérapie adaptative et qui utilisait également le logiciel de recalage déformable Elastix [50]. À l’opposé des images fantômes, la particularité de ces images réside dans le fait qu’elles n’ont pas d’image correspondant à l’image CT de l’anatomie déformée, soit la vraie déformation attendue.
CTréférence (à la fract. 0) CBCTréférence (à la fract. 0) Recalage VS Contrôle CTrecalé CTanatomie déformée (à la fract. n) CBCTanatomie déformée (à la fract. n)
A
B
C
D
E
FIGURE1.2 – Méthode employée pour valider la méthode d’amélioration des images par utilisation du
recalage déformable. L’image CT avec l’anatomie de référence (A) est déformée sur l’image CBCT avec anatomie déformée (C) à l’aide du logiciel Elastix pour être ensuite comparée à l’image CT avec l’anatomie déformée (D) en calculant la dose sur ces deux images.
Étant donné que la procédure pour la déformation des structures à partir du logiciel Elastix n’a pas été mise sur pied au cours de ce projet, il n’était pas possible d’utiliser les structures déformées et tracées manuellement pour valider la qualité des recalages des images patients. À la place, au chapitre
2, l’image CBCT a été modifiée de manière à corriger les densités électroniques dans l’image. Cette stratégie a pour but de corriger les artéfacts dans l’image CBCT qui créent, premièrement, des varia-tions ponctuelles des densité électroniques et, deuxièmement, des densités électroniques trop élevées ou trop faibles pour les tissus très ou peu denses. Ainsi, on uniformise les densités électroniques en simulant ceux d’une image CT. Il s’agit d’une méthode de correction similaire à celle employée par le logiciel Raystation (RaySearch Laboratories, Stockholm, Suède) [51]. Cette modification consiste à regrouper les densités présentes dans l’image en 4 catégories : l’air (entre -1000 et -500), les tissus mous peu denses (entre -500 et 0), les tissus mous denses (entre 0 et 300) et les os (entre 300 et 3000). Une image résultante de ce seuillage est illustrée à la figure1.4.
Pour les 5 patients utilisés pour l’étude, chacun a une image CT de planification et de 6 à 13 images CBCT prises régulièrement durant le cours du traitement. Pour toutes ces images, 7 organes ont été analysés : la prostate, la vessie, le rectum, les vésicules séminales, les têtes fémorales, l’intestin et le contour externe du corps. Tous les contours à l’exception des têtes fémorales et du contour externe du corps ont été tracés par une résidente en radio-oncologie lors des travaux d’Audrey Cantin. Pour ces deux exceptions, le logiciel OnQ rts a été utilisé pour obtenir un premier contour préliminaire à partir d’un atlas de contours. Le contour final a été obtenu après avoir peaufiné manuellement les volumes préliminaires. Finalement, les contours sur les images CBCT ont été considérés comme la
ication
CT planif CBCT fraction x
FIGURE1.3 – Exemple des images utilisées pour un patient : à gauche l’image CT de planification et à droite une image CBCT prise avant l’une des fractions du traitement. À l’exception du contour externe et de l’expansion autour du corps, toutes les structures visibles ont été contourées par une résidente en radio-oncologie.
FIGURE1.4 – Image CBCT du patient P9 dont les densités ont été regroupées en 4 catégories : air, tissus peu dense, tissus dense et os
vérité absolue, c’est-à-dire les contours attendus après les recalages, aux chapitres2et3.
En plus des images de patients de cas de la prostate, des patients de cas de cancer du poumon et de cancer de la tête et du cou ont été utilisés au chapitre 3. Il s’agissait d’une première étape de caractérisation des recalages avec le logiciel OnQ rts. Ces cas ont été choisis parce qu’il s’agit de cas possédant deux images CT prises durant le traitement, contrairement aux cas de cancer de la prostate qui n’avaient qu’une image CT. Il était donc possible de faire des recalages CT sur CT. Ces recalages à une seule modalité avec des images de bonne qualité permettaient d’obtenir un indicateur de la qualité des recalages avec ce logiciel dans la meilleure des situations. Quatre patients de cancer du poumon et six patients de cancer de tête et cou ont été sélectionnés et pour chaque site, 6 structures ont été utilisées pour l’analyse : corps, carène, moelle épinière, coeur, poumons, oesophage pour les cas de