Réponse des communautés végétales des tourbières à
l’arrêt du broutement par le cerf de Virginie
à l’île d’Anticosti
Mémoire
Milène Courchesne
Maîtrise en biologie végétale
Maître ès sciences (M. Sc.)
Québec, Canada
Réponse des communautés végétales des tourbières à
l’arrêt du broutement par le cerf de Virginie
à l’île d’Anticosti
Mémoire
Milène Courchesne
Sous la direction de :
Monique Poulin, directrice de recherche
Stéphanie Pellerin, codirectrice de recherche
III
RÉSUMÉ
Les cerfs de Virginie (Odocoileus virginianus) utilisent abondamment les tourbières sur l’île d’Anticosti. En effet, dans un contexte de densité élevée et d’absence de prédateurs, les tourbières représentent des aires d’alimentation alternatives. Or, cette utilisation peut entraîner des changements dans leurs communautés floristiques en raison du broutement sélectif et du piétinement. Ce projet vise à déterminer les effets du retrait du cerf sur les communautés végétales de différents types de tourbières : 1) ombrotrophes (bogs) et 2) minérotrophes (fens ouverts et arbustifs) ainsi que 3) leurs bordures (laggs). Un dispositif comprenant 53 exclos appariés à une parcelle avec cerfs a été mis en place en 2007 et a été suivi quatre fois sur huit ans par des inventaires floristiques. Ce suivi a d’abord permis de caractériser la flore des tourbières après l’exclusion des cerfs, d’analyser le rétablissement dans le temps des communautés végétales des différents types de tourbières après l’exclusion des cerfs puis de comparer les réponses à l’exclusion selon la productivité des sites
.
Les résultats ont montré que les laggs étaient des habitats riches en espèces qui possédaient une flore unique. Dans les laggs et les fens arbustifs, la composition végétale des exclos s’est différenciée de celle des parcelles avec cerfs au fil des années, favorisant certaines espèces broutées par le cerf, notammentSanguisorba canadensis et Betula pumila tandis que des espèces tolérantes au broutement comme Trichophorum cespitosum et Dasiphora fruticosa ont bénéficié de la présence des cerfs. La diversité bêta était
plus élevée dans les exclos que dans les parcelles soumises au broutement dans les tourbières à pH élevé, suggérant que les cerfs mènent à l’homogénéisation dans les tourbières les plus productives. Les plans de conservation de la diversité végétale des tourbières de l’île d’Anticosti devront tenir compte que la réponse de la végétation à l’arrêt du broutement par les cerfs varie selon le type d’habitats et selon la productivité.
IV
ABSTRACT
White-tailed deer (Odocoileus virginianus) are regular users of peatlands on Anticosti Island. In a context of high density of herbivores and absence of predators, peatlands may become new feeding areas. Intensive use of peatlands by deer may lead to changes in these plant communities by trampling and selective browsing. This project aims to determine the impacts over several years of deer browsing on plant communities in peatlands by comparing different types of peatlands: ombrotrophic (bogs) and minerotrophic (open and shrub fens) and their edges (laggs). A total of 53 exclosures paired with a browsed plot were installed in 2007 and surveyed four times over eight years by floristic surveys. This survey describes the flora of the island’s peatlands after deer exclusion. It also assesses the recovery over time of peatland vegetation communities after deer exclusion and compares the responses among habitat type and site productivity. Results showed that laggs are species rich habitats with a unique flora. In laggs and shrub fens, vegetation composition of exclosures changed over time compared to browsed plots, promoting growth of palatable species such as
Sanguisorba canadensis and Betula pumila, while deer-tolerant species like Trichophorum cespitosum and Dasiphora fruticosa benefited from browsing. Beta diversity was higher in exclosures than in browsed plots for
peatlands with high pH, which suggests that deer browsing leads to biotic homogenization of more productive peatlands. Conservation plans targeting plant diversity in peatlands of Anticosti Island should consider that vegetation response varies according to habitat type and site productivity.
V
TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ... IV LISTE DES TABLEAUX ... VII LISTE DES FIGURES ... VIII LISTE DES ANNEXES ... IX REMERCIEMENTS ... X AVANT-PROPOS ... XII
CHAPITRE 1 ... 1
INTRODUCTION GÉNÉRALE ... 1
La perturbation écologique et comment la mesurer ... 2
Résilience et résistance ... 2
Mesures de composition et de diversité végétale ... 3
Les grands herbivores : une perturbation chronique menant à des changements de composition et de diversité forestière ... 3
Les grands herbivores et la composition végétale ... 5
Les grands herbivores et la diversité végétale ... 5
Le cas de l’île d’Anticosti ... 6
Les tourbières : une aire d’alimentation alternative pour les cerfs de Virginie ... 7
Les tourbières : une vue d’ensemble ... 8
Définition et processus de formation des tourbières ... 8
Types de tourbières et succession végétale ... 8
Gradients de végétation ... 10
Les différents types de tourbières et leur utilisation par les herbivores ... 11
Les impacts des grands herbivores sur les tourbières ... 11
Objectifs et hypothèses de recherche ... 13
CHAPITRE 2 ... 15
PORTRAIT DE LA FLORE DES TOURBIÈRES DE L’ILE D’ANTICOSTI APRÈS L’EXCLUSION DES CERFS DE VIRGINIE ... 15
Résumé ... 16
Introduction ... 16
Méthodes ... 17
Aire d’étude ... 17
Design expérimental et inventaires de végétation ... 18
Conditions environnementales ... 19
VI
Résultats ... 22
Diversité ... 22
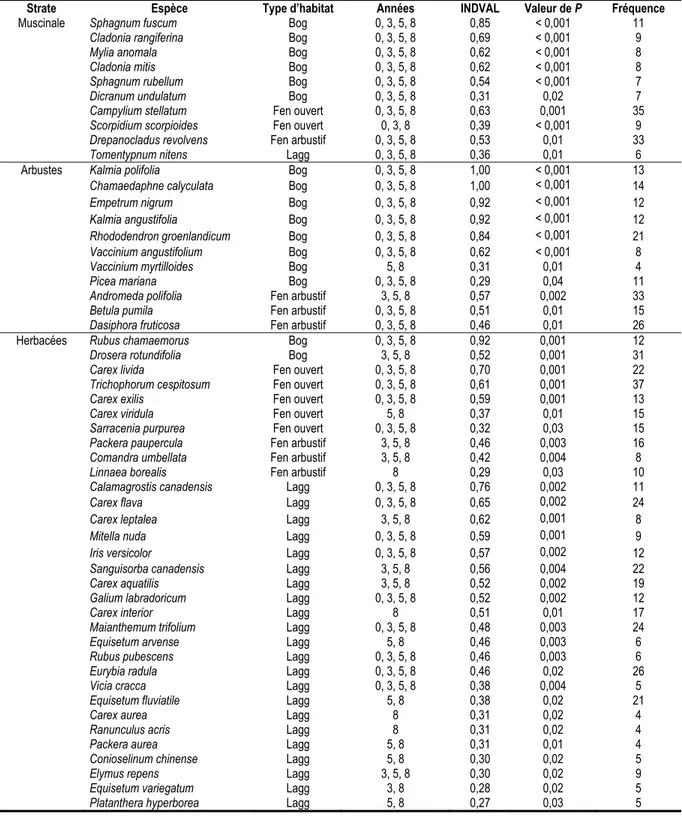
Espèces indicatrices et composition en espèces ... 24
Changement de couvert végétal depuis l’installation des exclos ... 27
Conditions environnementales ... 28
Relation entre la végétation et les variables environnementales ... 31
Discussion ... 31
Diversité de la flore des tourbières à la suite de l’exclusion des cerfs ... 31
Espèces ayant répondu à l’exclusion des cerfs ... 33
Conditions environnementales expliquant la diversité végétale ... 33
Conclusion ... 34
CHAPITRE 3 ... 35
CHRONIC DEER BROWSING LEADS TO BIOTIC HOMOGENIZATION OF PRODUCTIVE PEATLANDS ... 35
Résumé ... 36 Abstract ... 36 Introduction ... 37 Methodology ... 39 Study area ... 39 Experimental design ... 40 Sampling ... 40 Data analyses ... 41 Results ... 42
Changes in vegetation composition over time ... 42
Structure and vegetation cover ... 45
Beta diversity ... 46
Discussion ... 47
Changes in vegetation composition and structure in shrub fens and laggs ... 47
Biotic homogenization of vegetation in more productive habitats ... 49
CHAPITRE 4 ... 51
CONCLUSION GÉNÉRALE ... 51
Apports de l’étude ... 52
Limites de l’étude ... 53
Implications pour la conservation ... 54
RÉFÉRENCES ... 56
VII
LISTE DES TABLEAUX
Tableau 1.1 Définitions des différents types d’habitats tourbeux étudiés ... 9 Tableau 2.1 Richesse totale des plantes dans chacun des quatre types d’habitats de tourbières pour l’année 2007 et 2015 de l’île d’Anticosti. ... 22 Tableau 2.2 Les valeurs indicatrices des espèces selon les strates de végétation de chacun des types d’habitats tourbeux de l’île d’Anticosti. ... 25 Tableau 2.3 Nombre d’espèces indicatrices selon les années pour chacun des types d’habitats tourbeux de l’île d’Anticosti et pour chacune des strates de végétation. ... 26
VIII
LISTE DES FIGURES
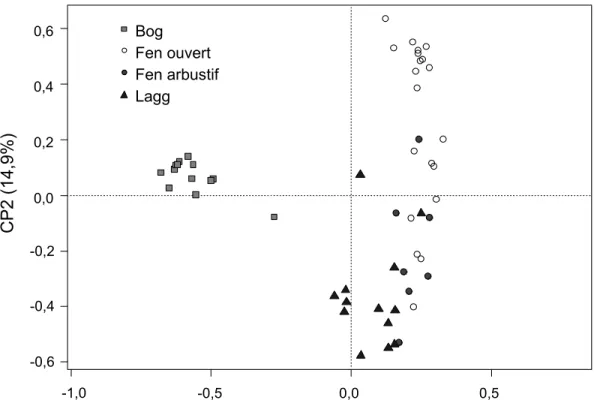
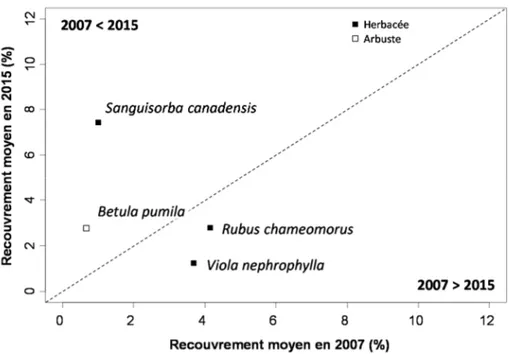
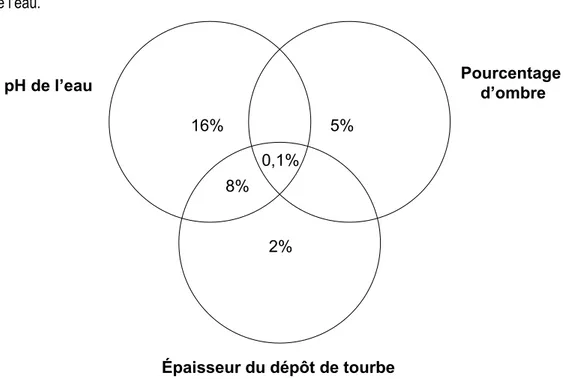
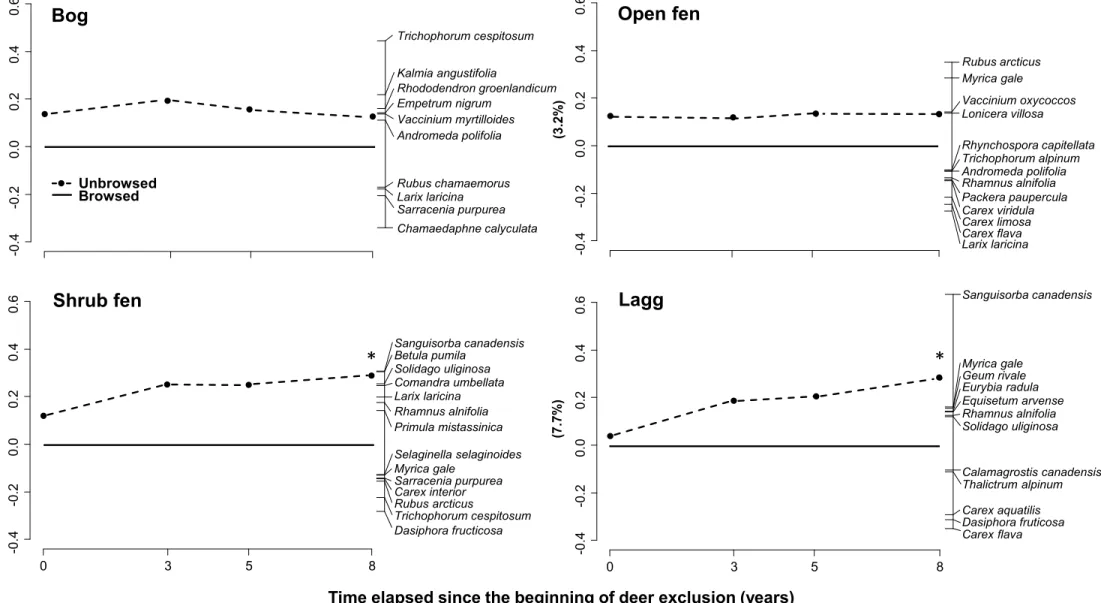
Figure 2.1 Localisation des 53 exclos situés dans les différents types d’habitats des tourbières dans la partie ouest de l’île d’Anticosti (Québec, Canada). ... 19 Figure 2.2 A) Richesse en espèces B) Indice de Shannon et C) Indice de Simpson dans les différents types d’habitats de tourbières de l’île d’Anticosti huit ans après l’installation d’exclos. ... 23 Figure 2.3 Analyse en composantes principales représentant 53 exclos dans différents types de tourbières de l’île d’Anticosti selon leur similarité en espèces. ... 27 Figure 2.4 Recouvrement moyen des espèces avant l’installation des exclos en 2007 par rapport à celui en 2015 (n = 53 sites) dans des tourbières de l’île d’Anticosti. ... 28 Figure 2.5 Distribution des variables environnementales dans les quatre types d’habitats tourbeux étudiés sur l’île d’Anticosti. A) pH de l’eau B) conductivité électrique C) profondeur de la nappe phréatique D) Épaisseur du dépôt de tourbe E) Concentration en ions magnésium dans l’eau F) ions calcium et G) ions potassium.. ... 30 Figure 2.6 Partition de la variance à l’aide d’un diagramme de Venn entre les variables environnementales explicatives de la répartition des espèces huit ans après l’installation des exclos dans des tourbières de l’île d’Anticosti.. ... 31 Figure 3.1 Principal response curves representing changes in plant composition between unbrowsed and browsed plots by white-tailed deer over time for all types of habitat (bog (n = 13), open fen (n = 20), shrub fen (n = 7) and lagg (n = 13)) in peatlands of Anticosti Island. ... 44 Figure 3.2 Average shrub height in the four types of peatland habitat of Anticosti Island, all years combined. ... 45 Figure 3.3 Herbaceous cover in the four types of peatland habitat of Anticosti Island, all years combined. ... 46 Figure 3.4 Influence of browsing and pH of water on the multivariate dispersion (percentage difference) of species composition in peatlands of Anticosti Island. ... 47
IX
LISTE DES ANNEXES
Annexe 1 Les équations des indices de diversité alpha utilisées pour calculer la diversité alpha des différents types d’habitats dans les tourbières de l’île d’Anticosti ... 67 Annexe 2 Espèces de plantes rares répertoriées dans les exclos des différents types d’habitats des tourbières de l’île d’Anticosti entre 2007 et 2015. ... 68 Annexe 3 Analyse en composantes principales représentant les espèces qui sont associées aux 53 exclos des différents types de tourbières de l’île d’Anticosti représentés par différents symboles. ... 69 Annexe 4 Corrélation de Pearson entre les différentes variables environnementales mesurées dans les tourbières de l’île d’Anticosti. Les corrélations les plus fortes sont en gras. ... 70 Annexe 5 Environmental variables (pH and electrical conductivity) for the four types of peatland habitats on Anticosti Island ... 71 Annexe 6 Survey years for all variables in the peatlands of Anticosti Island ... 72 Annexe 7 Number of each habitat type of peatlands of Anticosti Island found in each group of pH ... 73 Annexe 8 Principal response curves representing changes in bryophyte composition between unbrowsed and browsed plots over time for all types of habitats (bog (n = 13), open fen (n = 20), shrub fen (n = 7), and laggs (n = 13)) in peatlands of Anticosti Island. ... 74 Annexe 9 Bryophyte cover in four types of peatland habitat of Anticosti Island for all years combined. ... 75 Annexe 10 Liste des espèces végétales présentes dans les inventaires dans les tourbières de l’île d’Anticosti ... 76
X
REMERCIEMENTS
J’ai tellement de gens à remercier que j’espère ne pas en oublier! Tout d’abord, je voudrais remercier mes deux directrices pour leurs judicieux conseils qui ont su guider ma réflexion tout au long du projet. Merci de m’avoir confié ce projet. C’était le projet parfait pour moi qui combinait mes intérêts pour les tourbières et les relations plantes-herbivores. Monique, un gros merci pour ta confiance, ta compréhension, ta disponibilité, ton appui et tes encouragements à toutes les étapes du projet. Stéphanie, merci pour tes idées, ton efficacité et tes bons conseils. J’ai toujours apprécié nos rencontres à trois très efficaces et la vitesse impressionnante de votre correction!
J’aimerais grandement remercier Marianne d'avoir fait avancer le projet lors de son doctorat, mais aussi d’avoir toujours été là pour m’encourager et me soutenir dans le projet. Merci de m’avoir laissée m’approprier le projet et d’avoir pris de ton temps pour venir partager ton savoir sur le terrain. Tes conseils ont été appréciés pour la rédaction.
Merci à Steeve de m’avoir fait sentir intégrée dans ton labo comme une de tes propres étudiantes et pour tous tes commentaires constructifs sur mon projet. Merci à Jean-Pierre de m’avoir donné la chance de participer pour une première fois à un projet de recherche et pour tous tes conseils sur mon projet et sur mon mémoire. Un gros merci à Sonia, professionnelle de recherche à la Chaire Anticosti, qui était toujours là pour répondre à mes questions. Merci aussi à Julien et à Caro. Merci également à Nelson Thiffault pour ses précieux commentaires sur mon mémoire.
Merci beaucoup à Emilie de m’avoir acceptée dans son équipe de terrain à l’île d’Anticosti à l’été 2013. J’ai passé de bons moments sur le terrain et j’ai beaucoup appris en travaillant avec toi. J’avais parlé à Emilie que j’étais intéressée par le projet des tourbières à l’île d’Anticosti déjà lors de cet été et finalement, je me suis retrouvée avec ce projet pour la maîtrise!
Merci Aimée de m’avoir fait découvrir l’île et d’avoir vérifié et réparer les exclos de si nombreuses fois! Mes trois passages à l’île n’auraient pas été les mêmes sans le « social » sur l’île! Merci à l’aide sur l’île, en particulier Gaétan, Danièle et Joël. Un merci à l’équipe de 2007 qui ont installé le dispositif : Monique, Gilles Ayotte et Sylvain Ménard. Merci à tous les assistants de terrain qui ont contribué à la récolte de données depuis le début du projet. Un merci particulier à Sabrina et Jessica, deux filles super motivées avec qui mon
XI
terrain n’aurait jamais été aussi drôle et aussi efficace! Merci aussi à Maxime et à Evelyne qui ont partagé avec nous les joies du terrain!
Merci au CRSNG, au FRQNT et à la Chaire Anticosti pour le soutien financier. Je remercie également le CSBQ qui m’a permis d’aller présenter mes résultats au congrès ÉCOVEG12 à Brest en France.
Merci à Gaétan Daigle et à Pierre Legendre pour leurs précieux conseils statistiques. Merci à Gilles Ayotte et à Denis Bastien pour leurs aides botaniques. Merci aussi à Karen Grislis pour la révision de l’anglais.
Grâce à mon projet de maîtrise, j’ai eu la chance d’appartenir à plusieurs labos en même temps. Merci à toute la gang du Labo Côté-Tremblay pour leur dynamisme et leurs idées lors des rencontres de labo ainsi que leur soutien lors de mes présentations, en particulier : Maxime, Emilie, Michaël, Nico, Amélie, Julien, Sab, Maël, Barbara, Pascale, Jérémie, Dalie, Clara, Béa et Édouard pour m’avoir aidée de près ou de loin durant ma maîtrise. Sans oublier les gens du GRET pour les pratiques de présentations, pour le prêt de matériel et pour m’avoir acceptée dans leur grande famille, même si je n’en faisais pas officiellement partie. Merci aux étudiants du labo de Monique : Bérenger qui m’a également aidée pour les statistiques, Jérôme, Laurent, Maxime, Alexandre, Léo Janne et Daniel. Tous ces gens que j’ai côtoyés au cours de mes deux années m’ont toujours impressionnée par leurs connaissances et par leurs ambitions et je suis certaine qu’ils iront loin dans leurs parcours professionnels.
Merci à Guillaume et à ma petite boule de poil Navi pour leur grand soutien moral. Merci aussi à tous mes amis qui ont été là pour me supporter et qui ont su me changer les idées quand c’était le temps!
Merci à toute ma famille, à ma mère Francine, à ma sœur Élodie de m’avoir encouragée pendant toutes mes années d’études. Un merci particulier à mon père, Yvon. Merci papa de m’avoir transmis ta passion!
XII
AVANT-PROPOS
Ce mémoire de maîtrise vise à déterminer la réponse des communautés végétales des tourbières à l’arrêt du broutement par le cerf de Virginie à l’île d’Anticosti (Québec, Canada) et s’inscrit dans le contexte des projets de recherche de la Chaire de recherche industrielle CRSNG en aménagement intégré des ressources de l’île d’Anticosti (Chaire Anticosti). En 2007, le projet a été amorcé par la Chaire Anticosti. Un premier inventaire a été réalisé immédiatement après l’installation des exclos à l’été 2007 par Monique Poulin, Sylvain Ménard et Gilles Ayotte. Les inventaires de végétation en 2008, en 2010 et en 2012 ont été réalisés par Marianne Bachand alors qu’elle était étudiante au doctorat à la Chaire Anticosti.
Ce mémoire comprend quatre chapitres, soit une introduction générale, suivie de deux chapitres sous forme d’article scientifique, une conclusion générale et des annexes. Le premier article est rédigé en français et sera soumis au Naturaliste canadien. Le second est rédigé en anglais et sera soumis à une revue scientifique internationale (Plant Ecology). En tant que première auteure, je fus responsable du développement des hypothèses de recherches et des prédictions, de l’élaboration du protocole d’échantillonnage en 2015, de la récolte de données sur le terrain en 2015, des manipulations en laboratoire, de la compilation et de l’analyse des données ainsi que de la rédaction des chapitres. Les coauteurs ont participé à ces chapitres par la planification du projet et en apportant leurs conseils et leurs commentaires durant le processus de rédaction, durant l’analyse des données ainsi que l’interprétation des résultats.
Les chercheurs qui seront coauteurs des deux articles sont :
Monique Poulin, directrice de maîtrise, professeur titulaire au département de phytologie de l’Université Laval
Stéphanie Pellerin, codirectrice de maîtrise, chercheur au Jardin botanique de Montréal et professeur associé au département de phytologie de l’Université Laval
Steeve D. Côté, collaborateur, professeur titulaire au département de biologie de l’Université Laval et titulaire de la Chaire de recherche industrielle-CRSNG en aménagement intégré des ressources de l’île d’Anticosti.
Marianne Bachand, scientifique chez Environnement Canada et Changement climatique / Gouvernement du Canada
1
CHAPITRE 1
2
La surabondance de grands herbivores a fortement perturbé les écosystèmes à travers le monde en modifiant la composition et les processus écologiques de ceux-ci (Hobbs 1996). L’île d’Anticosti constitue un bon exemple de l’impact des cervidés sur les écosystèmes où les fortes densités de cerfs de Virginie (Odocoileus
virginianus Zimmermann) ont complètement changé la composition forestière qui est passée de grandes forêts
de sapins et de bouleaux blancs à des forêts dominées par l’épinette blanche, une espèce moins appréciée des cerfs (Potvin et al. 2003, Barrette et al. 2010). Dans ce contexte de densités élevées et d’absence de prédateurs, les cerfs utilisent des sites alternatifs pour se nourrir comme les tourbières (Massé & Côté 2009). Pour l’instant, ce phénomène est restreint à l’île d’Anticosti, mais le contexte d’augmentation des populations de cervidés en Amérique du Nord (Côté et al. 2004) pourrait mener à l’augmentation de leur utilisation à la suite de la diminution des ressources forestières. L’intérêt d’étudier les tourbières réside dans le fait que ce sont des systèmes fragiles aux perturbations et qui remplissent des rôles écologiques importants, notamment la captation de carbone. La présente étude vise à déterminer la réponse de la végétation (composition et diversité) des tourbières à la suite du retrait des cerfs sur plusieurs années afin de mieux comprendre l’impact du broutement des cerfs sur ces écosystèmes. Les sections suivantes traiteront du concept de perturbations, des impacts des grands herbivores sur les écosystèmes forestiers, du cas de l’île d’Anticosti, des tourbières et des impacts des grands herbivores sur les celles-ci.
La perturbation écologique et comment la mesurer
Une perturbation correspond à un évènement ponctuel ou continu qui modifie la structure et la fonction des communautés et qui provoque parfois une perte d’organismes dans les écosystèmes touchés (White & Jentsch 2001). Les perturbations peuvent être d’origine naturelle comme le feu, les épidémies d’insectes ou le verglas mais aussi d’origine anthropique comme l’urbanisation, la fragmentation ou les changements climatiques récents. Les grands herbivores, notamment les cervidés, peuvent être parfois considérés comme des agents de stress pour l’écosystème, mais également de plus en plus comme des agents perturbateurs des écosystèmes puisqu’ils affectent les propriétés à long terme de ceux-ci (Hobbs 1996, Royo & Carson 2006, Frelich & Reich 2010), ce qui sera discuté dans la prochaine section.
Résilience et résistance
La réponse des milieux naturels aux perturbations dépend de plusieurs facteurs comme l’étendue, l’intensité, la sévérité, la durée et la fréquence des perturbations (Coffin & Lauenroth 1988), mais aussi des espèces présentes et leurs attributs fonctionnels. Une perturbation peut entrainer trois types de réponses : 1) aucun changement à long terme ou des changements mineurs, 2) des changements graduels et 3) des changements majeurs et survenant de façon abrupte. Ce type de réponse peut dépendre de la résilience et de la résistance de l’écosystème face à la perturbation, deux composantes fondamentales pour la stabilité de l’écosystème (Carpenter et al. 2001). La résilience d’un écosystème se définit comme la capacité d’un écosystème à
3
absorber une perturbation sans modifier sa composition initiale, sa structure, ses fonctions et ses mécanismes de régulation (Holling 1973, Walker et al. 2004). Selon cette définition, un écosystème peut avoir plusieurs points d’équilibre et un écosystème est résilient lorsqu’il peut absorber plusieurs perturbations ou une forte perturbation sans changer d’état qu’équilibre (Holling 1973). La résistance est une mesure de la sensibilité d’un écosystème aux modifications de son environnement biotique et abiotique après une perturbation (Westman 1978, Walker et al. 2004). Un écosystème est donc résistant lorsque la perturbation ne change pas sa composition (Sutherland 1990). Un écosystème stable est ainsi un écosystème résilient ou résistant aux perturbations.
Mesures de composition et de diversité végétale
Afin de déterminer l’impact d’une perturbation sur un écosystème donné et d’identifier les espèces favorisées ou affectées par celle-ci, la composition en espèces et la diversité végétale peuvent être mesurées. La composition en espèces correspond à l’inventaire de l’ensemble des espèces selon leur abondance ou leur fréquence relatives à différents habitats. La diversité taxonomique se décompose en trois composantes : la diversité alpha, bêta et gamma. La diversité alpha se définit dans son sens strict comme le nombre d’espèces présentes dans le même site et leur abondance respective (Whittaker 1972). Parmi les indices de diversité alpha, l’indice de Simpson (Simpson 1949) prend en compte la dominance des espèces tandis que l’indice de Shannon-Wiener calcule l’uniformité relative de toutes les espèces, donnant davantage de poids aux espèces rares (Shannon & Weaver 1963). La diversité bêta est la variation de la composition en espèces entre les sites et peut être étudiée le long de gradients spatiaux ou temporels (Whittaker 1972). La diversité totale d’un paysage ou d’une région géographique composée d’une multitude d’habitats correspond à la diversité gamma (Whittaker 1972).
Les grands herbivores : une perturbation chronique menant à des
changements de composition et de diversité forestière
La surabondance des grands herbivores et son impact sur les écosystèmes forestiers ont été abondamment étudiés (Russell et al. 2001, Rooney & Waller 2003, Côté et al. 2004). Depuis quelques années, les populations de cervidés ont augmenté dans la plupart des milieux tempérés de l’Amérique du Nord et de l’Europe dû à l’accroissement de la quantité de fourrage et à la réduction de la pression de chasse et des populations de prédateurs naturels (Côté et al. 2004). Les cervidés représentent des éléments clés des écosystèmes puisqu’ils en modifient la composition végétale et les processus écologiques (Hobbs 1996, Rooney & Waller 2003). En effet, les cervidés consomment les feuilles, les fleurs et les fruits, ce qui affecte directement la survie et la croissance des plantes (Côté et al., 2004). Par exemple, les cervidés peuvent réduire l’abondance des herbacées préférées de sous-bois comme le trille blanc (Trilium grandiflorum Schreb.) ou le maïanthème du Canada (Maianthemum canadense Desfontaines) (Augustine & Frelich 1998, Royo et al.
4
2010). Les cervidés peuvent de même affecter indirectement d’autres populations végétales et animales en augmentant la présence de la lumière par l’élimination de certaines espèces ou strates végétales ainsi qu’en consommant les plantes qui sont utilisées par d’autres animaux (Rooney & Waller 2003). Ils peuvent également affecter indirectement les écosystèmes en altérant les processus écologiques comme les cycles des nutriments. Par exemple, les fèces et l’urine des herbivores ont un impact important sur les cycles de l’azote puisqu’une partie de l’azote consommée est par la suite retournée dans le sol (Hobbs 1996).
Les changements de la composition, la structure et la fonction des écosystèmes peuvent entraîner la perte de la résilience de ceux-ci selon le degré d’altération (Côté et al. 2004, Walker et al. 2004) et ultimement mener à des écosystèmes alternatifs (Connell & Slatyer 1977, Tremblay 2005). Ces états alternatifs sont composés d’espèces et de fonctions différentes de l’écosystème initial et peuvent être soit réversibles ou irréversibles, ce qui dépend de la résilience des écosystèmes (Scheffer & Carpenter 2003). Les écosystèmes qui sont soumis au broutement depuis peu et qui ont une grande productivité sont plus à risque de perdre leur résilience et changer d’état (Cingolani et al. 2005). Ces écosystèmes sont plus susceptibles à la perte de résilience puisque les plantes qui s’y trouvent ont investi plus dans la croissance due à la compétition pour la lumière que dans la reproduction et leur rétablissement après une perturbation (Cingolani et al. 2005). Même lorsque l’effet du broutement est considérable dans un écosystème, les réserves de graines peuvent permettre de supporter la résilience de l’écosystème et ainsi empêcher la mise en place d’un état stable alternatif (Augustine & Frelich 1998, Rooney et al. 2002).
Afin d’étudier l’effet du broutement intensif des cerfs sur les écosystèmes, plusieurs études ont utilisé des exclos (Augustine & Frelich 1998, Tremblay et al. 2007, Rooney 2009). L’utilisation d’exclos permet de mettre en évidence, visuellement et expérimentalement, le retour de la végétation dans les écosystèmes qui ont été sujets au broutement des cerfs pendant de longues périodes (Bergström & Edenius 2003, Côté et al. 2004). Les exclos ne permettent donc pas de montrer les communautés végétales présentes en absence des cervidés puisque certaines espèces ont pu être complétement extirpées par le broutement, mais bien de déterminer celles qui se rétablissent après l’arrêt du broutement. La plupart des études utilisent un seul niveau de broutement (densité naturelle) comparé aux endroits où les cerfs ont été exclus alors qu’un nombre plus restreint se base sur des exclos à densités variables (Tremblay et al. 2007, Royo et al. 2010, Bachand et al. 2015). Les études à un seul niveau de broutement sont souvent critiquées puisqu’elles ne sont pas représentatives de régimes naturels de broutement (Royo et al. 2010), ce qui rend l’application de ces études limitée (Bergström & Edenius 2003). Les études à densités variables permettent de déterminer un niveau optimal de broutement pour maintenir la résilience des écosystèmes (Bachand et al. 2015). Par contre, ces dernières représentent des coûts importants dus à la construction de grands enclos et la gestion des densités.
5
Les grands herbivores et la composition végétale
Face au broutement des herbivores, certaines plantes peuvent se maintenir en place par des mécanismes de résistance ou de tolérance. Les plantes résistantes ont généralement des traits leur conférant un avantage comme la présence de défenses chimiques ou morphologiques qui leurs permettent de réduire leur probabilité d’être consommées tandis que les plantes tolérantes sont broutées sans impact sur leur croissance, leur reproduction et leur survie puisqu’elles ont notamment la capacité de compenser les pertes subies par le broutement (Belsky et al. 1993). Par exemple, les chardons (Cirsium spp.) sont résistants au broutement en raison de la présence d’épines tandis que les graminées sont tolérantes puisque leur méristème se trouve à leur base ce qui évite leur consommation et permet une régénération rapide après le broutement des parties supérieures (Ferraro & Oesterheld 2002). Ainsi, l’abondance et le recouvrement de plantes résistantes et tolérantes augmentent généralement en présence de densité élevée d’herbivores (Diaz et al. 2007). Le mécanisme par lequel les plantes tolérantes remplacent les tissus endommagés par le broutement est appelé la compensation (Belsky 1986). Certaines plantes peuvent même augmenter en biomasse en présence des cerfs, on parle alors de surcompensation (McNaughton 1986, Paige & Whitham 1987, Edenius et al. 1993). En effet, les cerfs affectent la croissance de ces plantes en prélevant la tige terminale, ce qui peut causer l’apparition de plusieurs tiges latérales.
Les grands herbivores, notamment les cervidés, induisent de nombre impacts directs et indirects sur la végétation tel un déclin dans l’abondance des espèces préférées en favorisant les espèces résistantes et tolérantes (Augustine & Frelich 1998, Rooney & Waller 2003, Rooney 2009). Par exemple, les communautés végétales de l’île d’Anticosti ont été comparées à celle de l’archipel des îles Mingan (sans cerf) et certaines espèces résistantes au cerf comme le chardon (Cirsium arvense L. Scopoli) n’ont été trouvées qu’à Anticosti, ce qui suggère que le cerf influence la composition des communautés végétales et modifie la succession naturelle (Viera 2003). Les cervidés amènent des changements dans la composition des communautés forestières surtout celles préférablement soumises au broutement (Perea et al. 2014). Par exemple, les plantes des premiers stades de succession telles les Labiées et les Cistacées ne sont généralement pas les préférées des cerfs et par conséquent, les cerfs favorisent dans ce cas le retour des écosystèmes à des stades pionniers de succession (Perea et al. 2014). Ainsi, le cerf de Virginie change les chênaies en prairie, les prûcheraies en érablières et empêche la régénération du thuya occidental (Thuja occidentalis L.) (Alverson & Waller 1997, Côté et al. 2004, Larouche & Ruel 2015).
Les grands herbivores et la diversité végétale
Plusieurs études ont rapporté que la diversité végétale dans les écosystèmes forestiers peut être favorisée par une faible densité de cerfs et fortement diminuée à densités élevées (Rooney & Waller 2003, Côté et al.
6
2004). Selon l’hypothèse de perturbation intermédiaire, des niveaux intermédiaires de densités de cervidés permettent de favoriser la diversité interspécifique (Connell & Slatyer 1977). En effet, à de faibles densités jusqu’à des densités intermédiaires, la consommation des espèces dominantes laisse l’opportunité aux espèces végétales ayant besoin de lumière de s’installer (Schütz et al. 2003). Par contre, à forte densité, les impacts directs et indirects des cervidés amènent une diminution de la diversité des communautés végétales (Augustine & Frelich 1998, Rooney & Waller 2003). Comme le broutement des cerfs est sélectif, celui-ci peut affecter la diversité spécifique et provoquer des changements dans les communautés végétales dominantes (Russell et al. 2001). À titre d’exemple, les communautés végétales de sous-étages des forêts de l’est des États-Unis ont été modifiées par le cerf de Virginie passant de buissons et d’herbacées latifoliées à des communautés dominées par les graminées et les ptéridophytes, espèces tolérantes au broutement (Horsley & Marquis 1983). Ce changement de composition végétale peut mener à la simplification des communautés végétales et ultimement à l’homogénéisation des communautés végétales. D’ailleurs, Rooney (2009) a montré que dans les forêts du nord du Wisconsin, les cerfs peuvent mener à l’homogénéisation biotique à l’échelle du peuplement, c’est-à-dire que la composition en espèces était plus similaire entre les parcelles témoins soumises au broutement qu’entre les exclos. En présence de cerfs, la végétation s’est simplifiée en quelques espèces tolérantes au broutement comme la végétation graminoïde qui est passée d’un couvert de 10 % à 83 % en seulement 16 ans de densités élevées (Rooney 2009). Dans le maquis méditerranéen, les cervidés ont également mené à l’homogénéisation biotique en causant la diminution de 30% de la richesse spécifique des plantes ligneuses due au manque de régénération des espèces préférées (Perea et al. 2014). Sur l’archipel des îles Haida Gwaii dans l’ouest canadien, Martin et al. (2010) ont montré que les cerfs à queue noire (Odocoileus hemionus Rafinesque) peuvent simplifier la végétation dans les îles où ils étaient présents depuis plus de 50 ans. Le résultat est un assemblage de quelques espèces tolérantes au broutement, soit deux espèces de conifères, la végétation de sous-bois étant presque complètement disparue (Martin et al. 2010). Bref, en présence de grandes densités de cerfs, le broutement amène un changement de composition forestière et peut même occasionner une perte de diversité végétale dans ces écosystèmes.
Le cas de l’île d’Anticosti
À l’île d’Anticosti, les grandes densités de cerfs offrent une opportunité d’étudier les impacts des cervidés sur les écosystèmes. Au 19e siècle, 220 individus ont été introduits sur cette île située dans le golfe du St-Laurent
pour la pratique de la chasse. En absence de prédateurs naturels, cette population a pris de l’expansion pour atteindre rapidement une densité de cerfs de plus de 20 cerfs/km2 (Rochette & Gingras 2007) et même jusqu’à
56 cerfs/km2 par endroits (Tremblay et al. 2006). Les fortes densités ont nettement perturbé les forêts
présentes de sorte que plusieurs espèces ligneuses ont vu leur abondance diminuer comme le bouleau à papier (Betula papyrifera Marsh.), le peuplier faux-tremble (Populus tremuloides Michx.), le sorbier d’Amérique
7
(Sorbus americana Marsh.), le cerisier de Pennsylvanie (Prunus pensylvanica L. f.) et le noisetier à long bec (Corylus cornuta Marsh.) (Pimlott 1965). D’autres espèces qui étaient autrefois abondantes sur l’île comme l’épilobe à feuilles étroites (Chamerion angustifolium (L.) Scopoli), le framboisier (Rubus idaeus L.) et la clintonie boréale (Clintonia borealis (Ait.) Rafinesque) ne sont presque plus présentes dans les environnements non aménagés (Potvin et al. 2003). Un des changements les plus marqués à la suite de l’introduction des cerfs de Virginie est le remplacement des peuplements de sapins baumiers (Abies balsamea (L.) Miller), qui représentent environ 72 % de l’alimentation hivernale du cerf de Virginie (Lefort et al. 2007), par des pessières à épinettes blanches (Picea glauca (Moench) Voss), une espèce peu appréciée par le cerf (Potvin et al. 2003, Barrette et al. 2010).
Afin d’aider les travaux de restauration de la sapinière à bouleau blanc et de mieux comprendre l’impact des cerfs sur celle-ci, des enclos à densités variables ont été installés pour déterminer une densité limite de cerfs qui permet de conserver les processus écosystémiques. Ces enclos sont aménagés après une coupe forestière et la population de cerfs y est diminuée par l’attribution de permis de chasse à l’intérieur des enclos (Beaupré et al. 2004). En étudiant le retour de la végétation selon différentes densités de cerfs (0, 7,5, 15 cerfs/km2 et densité naturelle), Tremblay et al. (2007) ont trouvé que des densités de cerfs de moins de 15
cerfs/km2 atteintes en moins de 3 ans après une coupe seraient compatibles avec le maintien de la
régénération. Bachand et al. (2015) suggèrent une plus grande réduction de densités de cerfs, soit moins de 7,5 cerfs/km2 afin de permettre la restauration des fonctions spécifiques des peuplements de sapins. Après 3
ans à une densité de 7,5 cerfs/km2, le rétablissement d’espèces préférées par les cerfs était possible comme
l’épilobe à feuilles étroites qui a été désignée comme indicatrice de faible densité de cerf (Tremblay et al. 2006). La gestion par exclos permet donc de déterminer les densités optimales de cerfs de Virginie pour la régénération de la forêt et d’identifier les espèces qui sont le plus affectées par le broutement.
Les tourbières : une aire d’alimentation alternative pour les cerfs de Virginie
Les changements de composition forestière et la presque disparition de plusieurs espèces arbustives et herbacées à l’île d’Anticosti ont amené les cerfs à se trouver d’autres alternatives pour se nourrir en période estivale. Dans le contexte de densité élevée d’herbivores, la disponibilité des ressources par individus diminuent dans les endroits préférées et sont donc souvent délaissés par les herbivores pour des endroits moins préférés (Pérez-Barbería et al. 2013). Ainsi, les tourbières et leurs pourtours peuvent représenter des aires d’alimentation alternatives selon les dernières études de sélection d’habitats menées à l’île d’Anticosti (Massé & Côté 2009). En l’absence de prédation, la sélection de l’habitat à fine échelle est déterminée par la quantité de nourriture plutôt que le couvert pour la protection (Massé & Côté 2009). Les tourbières possèdent davantage de ressources que les milieux forestiers en été et sont donc utilisées pour l’alimentation des cerfs (Massé & Côté 2012). L’étude de Massé & Côté (2009) a permis de montrer que les milieux ouverts
8
(tourbières et coupes) sont grandement utilisés pour l’alimentation en comparaison aux habitats forestiers en raison de l’abondance d’herbacées et d’arbustes qui s’y trouvent en été. Plus précisément, dans cette même étude, les cerfs ont utilisé 60% des coupes, 29% du couvert forestier et 50% des tourbières disponibles. Une augmentation de 10 % en herbacées et en arbustes décidus dans un milieu donné est associée à une augmentation de 12 % de la probabilité d’utilisation par le cerf de ce milieu (Massé & Côté 2009).
Les tourbières : une vue d’ensemble
Définition et processus de formation des tourbières
Les tourbières sont des milieux humides où le processus d’accumulation est supérieur au processus de décomposition entrainant ainsi une accumulation de la matière organique sur au moins 30 cm (Payette & Rochefort 2001). Il existe deux processus de formation des tourbières : la paludification et le comblement. Le plus commun est la paludification qui se définit comme l’entourbement d’un site terrestre mal drainé dû à l’influence du climat, de la géomorphologie ou de la géologie (Rydin et al. 2013). Une tourbière peut également se former par le comblement d’un lac ou d’un petit plan d’eau. L’accumulation de matière organique commence par les bords et le fond du plan d’eau jusqu’à le combler complètement (Rydin et al. 2013). Les deux modes de formation peuvent intervenir en même temps sur un même site.
Types de tourbières et succession végétale
Les tourbières se divisent généralement entre les tourbières ombrotrophes (les bogs) et les tourbières minérotrophes (les fens) qui se distinguent selon leurs sources d’alimentation en eau et en éléments minéraux qui induisent à leur tour des distinctions dans leur composition chimique et floristique ainsi que dans leur hydrologie (Tableau 1.1). Les bogs sont généralement plus acides (pH < 5.5) et ont une plus faible conductivité électrique de l’eau de surface (conductivité corrigée < que 80 µS/cm) et de plus faibles concentrations en cations de base (calcium, sodium) que les fens (Vitt et al. 1995, Andersen et al. 2011).
9
Tableau 1.1 Définitions des différents types d’habitats tourbeux étudiés
Type d’habitats Définitions*
Bog
Tourbière ombrotrophe dont l’apport principal en éléments minéraux et en eau provient du vent et des précipitations. Dominance de sphaignes et d’éricacées.
pH de l’eau de 2,8 à 5,4
Fen ouvert
Tourbière minérotrophe recevant une quantité variable d’eau, à la fois des précipitations et des eaux de drainage qui enrichissent en éléments minéraux le sol humide. Dominance de cypéracées et de mousses brunes. pH de l’eau 3,8 à 7,5
Fen arbustif Idem que fen ouvert, mais on note la présence de plus de 25 % d’arbustes et de petits arbres. pH de l’eau 3,8 à 7,5
Lagg
Zone tourbeuse minérotrophe (± 30 cm de dépôt organique) en périphérie des tourbières qui fait la transition entre la tourbière et le milieu forestier et qui est parfois caractérisée par la présence d’espèces écotonales. Dominance d’herbacées, arbres et arbustes.
pH, conductivité et nappe phréatique plus élevés que la tourbière.
*Définitions adaptées de Harris et al. (1996), Payette & Rochefort (2001), Andersen et al. (2011), Langlois et
al. (2015) et Paradis et al. (2015)
Au début de la formation d’une tourbière, peu importe le processus de formation, la tourbière correspond en général au type minérotrophe (Rydin et al. 2013). Les tourbières minérotrophes sont alimentées à la fois par l’eau des précipitations et par les eaux de ruissellement de surface ou souterraines, ce qui apporte des éléments minéraux et nutritifs aux plantes (Payette 2001). Après un certain temps, l’accumulation progressive de tourbe déconnecte la surface des sols minéraux sous-jacents de sorte que les seuls minéraux disponibles pour les plantes proviennent des précipitations, ce qu’on appelle l’ombrotrophisation (Rydin et al. 2013). Comme l’apport des minéraux y est plus faible, la végétation devient acidophile et elle s’appauvrit en plantes vasculaires (Payette 2001). Toutefois, l’ombrotrophisation peut être arrêtée et même inversée par un apport en minéraux et en nutriments provenant d’eaux de drainage, passant alors d’une tourbière ombrotrophe à une tourbière minérotrophe. Dans une séquence temporelle de succession, une tourbière minérotrophe ou ombrotrophe peut passer de ouverte (fen ou bog ouvert) à boisée (fen ou bog arbustif) jusqu’au stade arborescent (ou forestier) et même passer de minérotrophe à ombrotrophe ou inversement (Harris et al. 1996, Rydin et al. 2013).
Les tourbières ombrotrophes sont généralement considérées comme des écosystèmes pauvres en espèces (Damman 1986), et sont donc reconnues comme des milieux peu productifs qui évoluent très lentement (Maitland & Morgan 1997). En effet, les tourbières ombrotrophes sont généralement moins diversifiées que les
10
tourbières minérotrophes (Payette 2001). Les sphaignes qui dominent dans les tourbières ombrotrophes créent des conditions acides, pauvres en éléments minéraux et anoxiques, ce qui rend l’environnement défavorable pour les plantes vasculaires (Van Breemen 1995). Les tourbières minérotrophes se forment dans les dépressions et les pentes, une topographique qui permet l’arrivée de l’eau provenant des milieux minéraux adjacents, ce qui favorise l’apport de minéraux (Payette 2001) et rend ces tourbières plus riches en espèces que les tourbières ombrotrophes.
Les tourbières minérotrophes se divisent généralement en deux types selon leurs conditions chimiques : les tourbières minérotrophes pauvres et les tourbières minérotrophes riches (Du Rietz 1949, Payette 2001). Le pH des tourbières minérotrophes pauvres se situe entre 3.8 et 6.5 tandis que celui des tourbières minérotrophes riches est supérieur à 5.5 jusqu’à atteindre plus de 7.5 (Gorham & Janssens 1992). Les tourbières minérotrophes présentent donc un grand gradient de minérotrophie associé à leur pH.
Les bordures des tourbières, les laggs, ont été peu étudiées, mais elles sont généralement considérées comme plus riches en espèces que la tourbière puisqu’elles sont enrichies en minéraux par l’eau provenant des sols minéraux sous-jacents et adjacents (Dimitrov et al. 2014, Langlois et al. 2015). Les laggs constituent des écotones qui se distinguent des milieux environnants, soit du milieu minéral et de la tourbière, par une structure de végétation différente, c’est-à-dire un couvert plus abondant d’arbustes, par une concentration plus élevée en azote et phosphore dans les sols ainsi que par un niveau d’eau plus élevé et fluctuant (Paradis et al. 2015). Paradis et al. (2015) ont montré que les laggs en bordure de bogs au Nouveau-Brunswick, dans l’Est du Canada peuvent être caractérisés par 1) une transition abrupte sans montrer de communautés écotonales, 2) une transition rapide avec une communauté écotonale de lagg marécageux, 3) une transition rapide avec deux communautés écotonales soit une de lagg-fen et une autre de lagg marécageux et finalement 4) une longue transition avec un milieu humide élargi en périphérie du bog, le deuxième type étant le plus commun dans cette région (Paradis et al. 2015). Les laggs sont donc des habitats très variables, mais généralement d’une richesse plus importante que la tourbière attenante.
Gradients de végétation
Les tourbières présentent des patrons de végétation apparents, c’est-à-dire des changements dans la composition et l’abondance des espèces, qui peuvent être expliqués par différents gradients environnementaux et spatiaux (Sjörs 1948). Le premier est le gradient de topographie entre les buttes et les dépressions qui a été surtout décrit pour les bryophytes, selon lequel les espèces de sphaignes varient avec la position relative à la nappe phréatique (Clymo & Hayward 1982). Ensuite, un gradient entre le centre d’une
11
tourbière et ses bordures a également été étudié. Les espèces indicatrices de minérotrophie augmentent en nombre du centre vers les bordures des tourbières (Damman & Dowhan 1981) de même que le nombre et la taille des arbres et la richesse en espèces (Campbell & Rochefort 2001). Le troisième gradient est le gradient de pauvre à riche en espèces indicatrices de minérotrophie, qui mène surtout à la distinction entre les tourbières ombrotrophes et minérotrophes (Du Rietz 1949). Ce gradient est souvent associé au pH de l’eau et à la présence d’éléments minéraux et nutritifs (Vitt & Chee 1990, Wheeler & Proctor 2000). Enfin, le dernier gradient est causé par les conditions climatiques entre les régions biogéographiques, comme la distance depuis la mer, où se trouvent les tourbières ombrotrophes (Malmer 1986). Par exemple, la croissance des arbres dans les tourbières continentales est due à la période prolongée d’une nappe phréatique profonde en raison des faibles précipitations dans ces régions (Malmer 1986). L’intérêt d’étudier ces gradients est de mieux comprendre la répartition des espèces végétales dans les tourbières.
Les différents types de tourbières et leur utilisation par les herbivores
En Europe, les tourbières sont souvent utilisées comme pâturage pour les grands herbivores domestiques (moutons et vaches). Par contre, les tourbières sont normalement moins productives que les écosystèmes forestiers et les cervidés préfèrent donc les habitats forestiers (Telfer 1970). Étant donné que les tourbières n’étaient pas reconnues comme des milieux fréquentés par les cervidés, elles ont souvent été ignorées dans les études sur le broutement par le cerf. L’étude de Massé & Côté (2009) a permis de montrer qu’à l’île d’Anticosti les cerfs utilisent les tourbières et cette utilisation varie selon le type d’habitat. Ainsi, les laggs et les fens sont les habitats de tourbières les plus intéressants pour le cerf puisqu’ils présentent un couvert d’arbustes décidus de 35 % plus grand que tous les autres habitats (bogs, coupes, forêts) (Massé & Côté 2009). En effet, les cerfs utilisent 3 fois plus les laggs que les bogs et 2 fois plus les fens que les bogs (Massé & Côté 2009). Ceci est cohérent avec l’étude de Pellerin et al. (2006) qui a montré que l’impact du broutement était plus élevé dans les fens que dans les bogs. Par contre, cette étude était restreinte au centre des tourbières et le lagg n’avait pas été échantillonné alors que cet habitat est susceptible d’être plus utilisé par les cerfs. D’ailleurs, dans un bog au nord de l’Angleterre, certaines espèces typiques des tourbières comme la bruyère commune (Calluna vulgaris (L.) Hull) étaient favorisées par l’arrêt du broutement des moutons et cette différence était supérieure dans les bordures que dans le centre du bog étudié, ce qui peut suggérer que l’impact des herbivores peut varier selon la minérotrophie des sites (Smith et al. 2003).
Les impacts des grands herbivores sur les tourbières
Plusieurs études européennes ont porté sur l’impact des animaux domestiques, plus particulièrement les moutons (Ovis aries L.), dans les tourbières (Grant et al. 1985, Tallis 1998, Hulme et al. 2002, Smith et al. 2003). Ces études peuvent être comparables à la présente étude, puisque les cerfs et les moutons sont des herbivores de types sélectifs et de taille similaire (Rawes & Hobbs 1979, Birnie & Hulme 1990, Côté et al.
12
2004). Les cerfs comme les moutons ne consomment que de petites parties des plantes contrairement aux vaches qui utilisent leurs langues pour arracher les plantes (Tallis 1998). Les auteurs européens étudiant le broutement dans les tourbières font les mêmes constats que les auteurs qui étudient le broutement en milieux forestiers pour ce qui est de la diversité. En effet, à faible densité d’herbivores, le broutement dans les tourbières pourrait augmenter la diversité végétale en diminuant le couvert en arbustes et en éliminant la compétition, pour ainsi permettre aux plantes de lumière de s’installer (Ausden et al. 2005, Sundberg 2012). Par contre, un broutement élevé contribue à un changement de composition végétale et à la diminution de certaines éricacées comme la bruyère commune (Calluna vulgaris (L.) Hull) au profit d’espèces graminoïdes comme la linaigrette à large graine (Eriophorum vaginatum L.) (Rawes & Hobbs 1979). De plus, la biomasse végétale dans un bog en Écosse était réduite de 20 à 50% à de fortes densités d’herbivores (2,2 moutons/ha) comparativement à de faibles densités (0,4 moutons/ha) sur neuf ans (Grant et al. 1985). À titre comparatif, la densité moyenne de cerfs de l’île d’Anticosti équivaut à 0,2 cerf/ha (i.e. 20 cerf/km2; Rochette & Gingras 2007).
Les herbivores causent aussi de l’érosion dans les tourbières. En Écosse, une étude faite à l’aide de photos aériennes a montré que 17 % de la surface des tourbières étudiées ne présentaient aucune végétation (Birnie & Hulme 1990). En effet, la tourbe à nu augmente rapidement avec un broutement intensif (Rawes & Hobbs 1979). Cette érosion est causée par le piétinement des animaux qui laisse des marques dans le sol mou des tourbières et compacte le sol (Arnesen 1999). D’ailleurs, plusieurs études mentionnent que le broutement contribue grandement à la diminution des lichens et des bryophytes qui sont également sensibles au piétinement (Rawes & Hobbs 1979, Welch & Scott 1995, Pellerin et al. 2006). Certaines espèces peuvent être favorisées par le piétinement comme le gaillet des fanges (Galium uliginosum L.) et la violette des marais (Viola palustris L.) qui ont augmenté en couvert après une simulation d’empreintes d’ongulés (Stammel & Kiehl 2004) et la droséra à feuilles rondes (Drosera rotundifolia L.) qui peut se trouver en plus grande concentration dans les tourbières avec un grand pourcentage de tourbe à nu (Pellerin et al. 2006). De plus, certaines espèces sont tolérantes au piétinement par les cerfs, notamment les plantes graminoïdes dues à leur forme et à la protection de leur méristème (Arnesen 1999).
Plusieurs études ont approfondi l’impact du broutement et du piétinement des herbivores domestiques dans les tourbières, mais peu d’études ont porté sur le broutement des herbivores sauvages comme le cerf de Virginie dans les tourbières. En comparant les communautés végétales des tourbières entre l’île d’Anticosti habitée par les cerfs et les îles Mingan non habitées par les cerfs, une différence de 33 % plus de couvert de lichens entre les tourbières de Mingan et Anticosti a été trouvée (Viera 2003). Dans une étude similaire, Pellerin et al. (2006) ont trouvé que la diversité végétale était supérieure dans les fens non broutés que dans les fens broutés, plus particulièrement pour ce qui est des arbustes, des carex et des hépatiques (Pellerin et
13
al. 2006). Dans les tourbières d’Anticosti, les cerfs de Virginie préfèrent le bouleau nain (Betula pumila L.) et le
myrique baumier (Myrica gale L.) (Viera 2003, Pellerin et al. 2006). De plus, dans ce contexte de surabondance, les cerfs vont jusqu’à brouter le kalmia à feuilles d’andromède (Kalmia polifolia Wangenheim), une espèce pourtant toxique (Pellerin et al. 2006). Pellerin et al. (2006) ont aussi trouvé que la surface foliaire du bouleau nain était significativement plus faible dans les tourbières de l’île d’Anticosti que dans celles sur les îles Mingan. Le nombre de feuilles chez la chicouté (Rubus chamaeomorus L.) est également plus faible lorsqu’il y a présence de cerfs et la proportion de chicouté ayant seulement une feuille à Anticosti (80 %) est plus élevée que sur les îles Mingan (58 %)(Pellerin et al. 2006). Dans un fen dans l’état de New York, Johnson & Leopold (1998) ont montré que le broutement par les mammifères réduisait la hauteur des arbustes. En effet, la hauteur des arbustes a augmenté de plus de 20 cm dans tous les traitements clôturés après deux ans (Johnson & Leopold 1998). Bref, les herbivores peuvent avoir un impact sur les communautés végétales des tourbières, mais il reste à déterminer comment cet impact peut varier selon les types de tourbières et selon leur productivité.
Objectifs et hypothèses de recherche
Ce projet vise à comprendre l’impact du broutement des cerfs sur la végétation des tourbières. Dans un premier temps, ce projet permettra de dresser un portrait de la flore des tourbières de l’île d’Anticosti dans un contexte d’exclusion de cerfs et dans un deuxième temps, à évaluer la réponse de la végétation des tourbières à l’arrêt du broutement par les cerfs en regardant l’évolution de la composition, la structure et la diversité végétale à la suite du retrait des cerfs. Quatre types d’habitats tourbeux seront comparés : les bogs, les fens ouverts, les fens arbustifs et les laggs.
Pour le portrait de la flore des tourbières, nous émettons comme hypothèse que les tourbières supportent une diversité végétale qui n’est pas totalement exprimée à cause de la présence des cerfs. Ainsi, nous prédisons le retour de plusieurs espèces et l’augmentation de la diversité dans les différents types de tourbières au fil du temps suite à l’établissement des exclos. Cette hypothèse est explorée dans le chapitre 2.
Concernant le deuxième objectif, nous formulons comme première hypothèse que la réponse de la végétation des tourbières sera déterminée par la composition initiale du type d’habitat, et sera donc plus élevée dans les habitats composés d’espèces fortement utilisées par les cerfs et non-résistantes au broutement. Ainsi, la différence entre l’exclos et la parcelle avec cerfs s’accentuera le long de cette séquence d’habitats : bogs, fens ouverts, fens arbustifs et laggs. Nous prédisons une différenciation de composition végétale dans le temps, soit un recouvrement supérieur en espèces préférées par les cerfs ou non-résistantes au broutement (par exemple Betula pumila et Myrica gale) dans les exclos et en espèces résistantes comme le Kalmia ou
14
tolérantes au broutement comme les plantes graminoïdes dans les parcelles avec cerfs. Nous prédisons aussi une augmentation de la hauteur moyenne des arbustes, du recouvrement en herbacées et en arbustes dans les exclos comparativement aux parcelles avec cerfs. Nous formulons comme deuxième hypothèse qu’à fortes densités de cerfs, le broutement mène à l’homogénéisation de la végétation dans les tourbières et cette différence augmentera selon la productivité des sites, ce qui se traduirait par une plus grande similarité en espèces entre les parcelles soumises au broutement qu’entre les exclos dans les sites les plus productifs. Ces hypothèses sont testées dans le chapitre 3.
15
CHAPITRE 2
P
ORTRAIT DE LA FLORE DES TOURBIÈRES DE L
’
ILE D
’A
NTICOSTI
APRÈS L
’
EXCLUSION DES CERFS DE
V
IRGINIE
16
Résumé
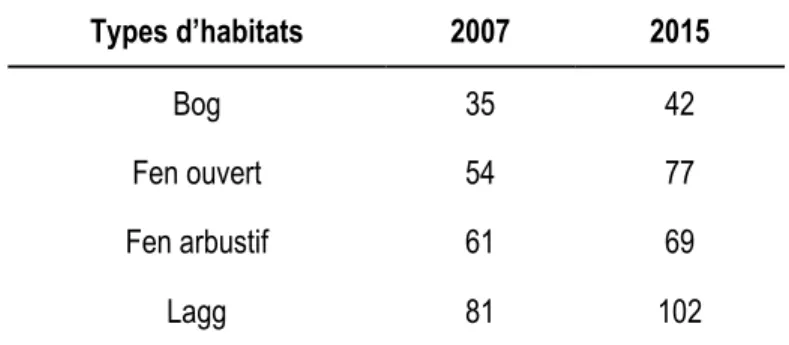
Depuis leur introduction il y a plus d’une centaine d’années, les cerfs de Virginie ont fortement perturbé les communautés végétales de l’île d’Anticosti. En raison de leur densité élevée et de l’absence de prédateurs, les cerfs exploitent de plus en plus de nouvelles aires d’alimentation, comme les tourbières, normalement peu utilisées. Quelle est la diversité végétale des tourbières après le retrait du cerf à la suite d’une présence de plus de 100 ans? Pour répondre à cette question, un dispositif permettant d’exclure les cerfs a été mis en place pendant huit ans dans 53 tourbières se regroupant selon quatre types d’habitats: les bogs, les fens ouverts, les fens arbustifs et les laggs (écotone entre la tourbière et la forêt). Au total, nous avons inventorié 125 espèces végétales au moment de l’instauration des exclos (2007) et 158 espèces après huit ans d’exclusion du cerf. La richesse spécifique était deux fois plus élevée dans les laggs que dans les bogs et le nombre d’espèces herbacées indicatrices était 4 à 10 fois plus élevée dans les laggs que dans les autres types d’habitats. De plus, après huit ans d’exclusion du cerf, le couvert végétal des espèces fortement broutées par le cerf a grandement augmenté, notamment celui de Betula pumila L. et Sanguisorba canadensis L. (2 et 8 fois plus respectivement). En somme, les tourbières de l’île d’Anticosti possèdent un potentiel de richesse végétale qui est favorisé par l’arrêt du broutement du cerf de Virginie sur ces écosystèmes tourbeux.
Introduction
Les grands herbivores représentent souvent des agents perturbateurs des écosystèmes puisqu’ils en modifient la composition végétale et les processus écologiques (Hobbs 1996, Rooney & Waller 2003, Côté et
al. 2004). En effet, ils affectent directement les plantes en consommant les feuilles, les fleurs et les fruits et
indirectement en altérant les relations interspécifiques ainsi que les cycles du carbone et des autres nutriments (Côté et al. 2004). En surabondance, les grands herbivores peuvent grandement affecter les écosystèmes et l’île d’Anticosti en est un exemple frappant. Au 19e siècle, environ 220 cerfs de Virginie
(Odocoileus virginianus Zimmermann) ont été introduits sur l’île pour la pratique de la chasse sportive. En l’absence de prédateurs, la population de cerf a vite augmenté pour atteindre aujourd’hui des densités supérieures à 20 cerfs/km2 (Rochette & Gingras 2007). Le broutement intensif par le cerf de Virginie a
profondément modifié la composition forestière de l’île et a contribué à la disparition locale d’espèces qui étaient autrefois abondantes comme Acer spicatum Lam., Corylus cornuta Marsh., Cornus stolonifera L.,
Chamerion angustifolium L., Rubus idaeus L. et Clintonia borealis Ait. qui ont été remplacées par des espèces
résistantes au broutement telles Cirsium arvense (L.) Scopoli et les graminées (Pimlott 1965, Viera 2003, Tremblay 2005). D’autre part, les peuplements d’Abies balsamea (L.) Mil., espèce qui représente environ 72% de l’alimentation hivernale du cerf (Lefort et al. 2007), se font de plus en plus rares et laissent place à des pessières blanches et des landes forestières (Potvin et al. 2003). Dans le contexte de densités élevées de
17
cerfs résultant en un manque de ressources forestières dû au broutement intensif des cerfs et de l’absence de prédateurs, les tourbières et particulièrement leurs pourtours sont devenues des aires d’alimentation alternatives en été (Massé & Côté 2009). Or, les tourbières de l’île d’Anticosti représentent un intérêt particulier pour la biodiversité en raison de leur flore diversifiée et rare dans le paysage canadien (Dignard et
al. 2009). En effet, contrairement à la majorité des tourbières des régions boréales, celles de l’île d’Anticosti
bénéficient d’un climat maritime et reposent sur des sols calcaires favorisant la présence d’espèces calciphiles ou rares au Québec (Sabourin & Morin 2009).
En été, les cerfs de Virginie utilisent davantage les tourbières de l’île d’Anticosti, qui constituent 25% de la surface de l’île, que les milieux forestiers (Massé & Côté 2009). Cette forte utilisation des tourbières par les cerfs peut avoir entraîné des changements dans leurs communautés floristiques en raison du broutement sélectif et du piétinement. Par exemple, une étude précédente a montré que les tourbières minérotrophes de l’île d’Anticosti étaient plus pauvres en espèces d’arbustes, de cypéracées et d’hépatiques que celles des îles de Mingan situées à proximité (<50 km à vol d’oiseau) et où le cerf est absent (Pellerin et al. 2006). Les tourbières de l’île d’Anticosti se répartissent selon un gradient de minérotrophie passant des tourbières ombrotrophes (les bogs) à pH acide (généralement pH < 5.5) aux laggs et tourbières minérotrophes (les fens) à pH plus élevé (pH entre 3.8 et 6.9, Andersen et al. 2011). Les laggs sont des habitats minérotrophes qui constituent l’écotone en bordure de la tourbière. Les cerfs de l’Île d’Anticosti fréquentent trois fois plus les laggs que les bogs et deux fois plus que les fens en raison de l’abondance des herbacées et des arbustes comestibles (Massé & Côté 2009).
Dans le but d’étudier la réponse des communautés végétales au retrait des cerfs de Virginie des tourbières de l’île d’Anticosti, des exclos ont été installés dans des tourbières de la portion ouest de l’île en 2007. Ces tourbières étaient caractérisées par des niveaux variés de minérotrophie. En se basant sur ce dispositif expérimental, notre objectif était de dresser un portrait du potentiel végétal des tourbières de l’ouest de l’île d’Anticosti dans un contexte d’exclusion des cerfs. Plus spécifiquement, nous avons caractérisé les communautés végétales et certaines conditions environnementales expliquant leur diversité huit ans après l’installation des exclos dans quatre types d’habitats tourbeux, soit les bogs, les fens ouverts, les fens arbustifs et les laggs. De plus, afin de déterminer quelles espèces ont le plus bénéficié du retrait des cerfs, nous avons étudié les changements de couvert pour les espèces herbacées et arbustivesentre 2007 et 2015.
Méthodes
Aire d’étude
Située dans le golfe du Saint-Laurent, l’île d’Anticosti s’étend sur une superficie de 7943 km2. Elle se trouve
18
climat est maritime, avec des précipitations annuelles de 917 mm et des températures moyennes variant d’un minimum de -12 °C en février à un maximum de 16 °C en juillet (Environnement Canada 2006). Les espèces arborescentes historiquement abondantes sont Abies balsamea (L.) Mil., Betula papyrifera Marsh., Picea
glauca (Moench) Voss et Picea mariana (Miller) B.S.P. (Lavoie & Fillion 2001). Selon le dernier inventaire
aérien de 2006, la densité moyenne de cerfs sur l’île s’élèverait à plus de 20 cerfs/km2 (Rochette & Gingras
2007), quoiqu’elle puisse atteindre ≥ 56 cerfs/km2 par endroit et par moment (Tremblay et al. 2006).
Les tourbières de l’île d’Anticosti se sont mises en place à la suite du retrait de la mer de Goldwaith il y a environ 8500 ans cal B.P. (Lavoie & Fillion 2001). Ces tourbières n’ont jamais été exploitées ni drainées de sorte que l’effet du broutement des cerfs ne peut être masqué par des perturbations d’origine anthropique. Les bogs sont surtout dominés par les sphaignes et les éricacées tandis que les fens sont dominés par les Carex et les arbustes tels que Dasiphora fruticosa (L.) Rydb. et Myrica gale L. (Viera 2003). Les espèces arborescentes sont pratiquement absentes de ces deux habitats. Pour cette étude, nous avons divisé les fens en fens ouverts et en fens arbustifs selon un seuil de 25% de recouvrement d’arbustes (Harris et al. 1996). Les laggs se caractérisent généralement par la présence de plantes graminoïdes et par un couvert variable d’espèces arbustives et arborescentes (Larix laricina Du Roi K. Koch et P. mariana). Ils ont un pH élevé, un niveau de la nappe phréatique élevé et fluctuant, une topographie généralement plus basse que la tourbière, une structure végétale différente par la présence d’arbustes et d'un couvert arborescent et une concentration plus élevée en azote et phosphore (Langlois et al. 2015, Paradis et al. 2015).
Design expérimental et inventaires de végétation
En 2007, un dispositif expérimental de 53 exclos carrés de 4 m2 et d’une hauteur de 1,22 m a été installé dans
13 bogs, 20 fens ouverts, 7 fens arbustifs et 13 laggs (Figure 2.1). Les quadrats échantillonnés étaient de 1 m2
et positionnés au centre des exclos. Les arbres de grande taille n’ont pas été inclus dans les exclos lors de leur installation, la méthode d’échantillonnage n’étant ici pas appropriée pour l’estimation du couvert des espèces arborescentes de grande taille. Les sentiers de cerfs de Virginie ont été évités lors de la mise en place du dispositif.
La végétation a été inventoriée une première fois juste après l’installation des exclos en juillet 2007, en 2010, en 2012 puis huit ans après l’exclusion des cerfs en juillet 2015. Pour cette étude, nous avons comparé la diversité végétale de l’année de l’installation des exclos et la huitième année (sauf pour les analyses d’espèces indicatrices pour lesquelles nous avons utilisé toutes les données d’inventaires). L’analyse de toute la séquence temporelle fait l’objet d’une autre étude (Voir chapitre 3). Le recouvrement de toutes les espèces végétales a été évalué visuellement en pourcentage de recouvrement au sol (<1, au 1 % près entre 1 et 10 %, au 5 % près entre 15 et 90 % au et au 1 % près entre 90 et 100 %).
19
Figure 2.1 Localisation des 53 exclos situés dans les différents types d’habitats des tourbières dans la partie ouest de l’île d’Anticosti (Québec, Canada).
Conditions environnementales
À l’été 2015, un ensemble de variables environnementales a été mesuré dans chaque tourbière. Les mesures ont été prises à un seul point à proximité de l’exclos (< 5 m). Des échantillons d’eau de surface ont été prélevés afin de mesurer le pH, la conductivité électrique ainsi que la composition en cations de base, des variables permettant de caractériser les tourbières (Andersen et al. 2011). Le pH et la conductivité électrique ont été mesurés directement sur le terrain dans l’eau de surface à l’aide d’un pHmètre/conductivimètre (HI98129, Testeur de pH/Conductivité/TDS, Hannah Instrument, Modèle #98129). Le protocole de calibration du fabricant a été appliqué et la conductivité a été corrigée pour les concentrations en ions H+ selon la formule
de Sjörs (1950) adaptée aux tourbières (conductivité -(10-pH x 325 000) à 20°C). Les échantillons d’eau pour
l’analyse des cations de base (Ca2+, Mg2+, K+) ont été récoltés dans des bouteilles de polyéthylène et ils ont
été conservés congelés jusqu’à l’analyse chimique à l’aide d’un ICP (Perkin-ElmerP40) au département de foresterie de l’Université Laval (Québec, Québec, Canada). La profondeur de la nappe phréatique a été mesurée dans un trou creusé directement dans la tourbière alors que l’épaisseur du dépôt de tourbe a été mesurée à l’aide de tiges de fibre de verre. Enfin, le pourcentage d’ombre des arbres, qui correspond à la