Élaboration d’une stratégie analytique de dissolution du
Hg et du Pb dans les aliments sur le terrain
Mémoire
Audrey Laberge-Carignan
Maîtrise en chimie - avec mémoire
Maître ès sciences (M. Sc.)
Élaboration d’une stratégie analytique de
dissolution du Hg et du Pb dans les aliments sur le
terrain
Mémoire
Audrey Laberge-Carignan
Sous la direction de :
Dominic Larivière, directeur de recherche
Résumé
La nourriture issue de la chasse ou de la pêche comporte plusieurs nutriments essentiels à une bonne santé. Toutefois ces aliments peuvent aussi contenir des concentrations importantes en contaminants tel que le mercure et le plomb, qui posent un risque pour la santé.
Pour guider les communautés qui basent leur alimentation sur la chasse ou la pêche, l’objectif global du projet est de développer une plateforme analytique permettant le suivi de la qualité alimentaire dans les environnements nordiques. Pour ce faire, une stratégie analytique de dissolution de la chair animale pouvant être employée à l’extérieur d’un laboratoire par des non scientifiques a été mise en place.
Cette stratégie comporte l’échantillonnage, la mise en solution de la chair et la séparation des analytes pour effectuer leur analyse ainsi que le changement de matrice, en plus de la détection et de la quantification des analytes par fluorimétrie. Toutefois, puisque les systèmes de détection visés pour la plateforme sont en développement, une méthode de quantification du plomb et du mercure par ICP-MS/MS a aussi été développée. Cette stratégie analytique a été élaborée pour l’analyse de l’omble chevalier, un poisson consommé à l’année dans certaines communautés nordiques dans lequel les concentrations en contaminants sont très variables.
Le processus analytique, de l’échantillonnage à l’obtention d’une solution mono élémentaire en passant par l’analyse ICP-MS/MS et la dissolution de la chair d’omble chevalier, sera décrit dans ce mémoire.
Abstract
Fish and game meat contain different essential nutriments for a good health. However, it can also contain contaminants, such as mercury and lead, that pose a health risk.
To guide the communities that base their diet on hunting or fishing, the main objective of the project is to develop a portable analytical platform that allows the monitoring of contamination by heavy metals of country food on the field. To this end, an analytical strategy for the dissolution of food flesh that can be deployed outside of the laboratory and used by non-scientists has been established.
This strategy includes sampling, flesh dissolution, analyte separation and matrix exchange for the analysis in addition to fluorimetric detection and quantitation of the analytes. Since the quantification system for this platform is still under development, we therefore developed an ICP-MS/MS method to quantify lead and mercury in our food extracts. This method was developed to analyze arctic char, a fish consumed all year long in some northern communities and in which the contamination level can vary significantly.
The analytical process from sampling to monoelemental analysis by ICP-MS/MS will be discussed in this document.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... v
Liste des tableaux ... vii
Liste des abréviations ... ix
Remerciements ... x
Introduction ... 1
Chapitre 1 Théorie ... 15
Chapitre 2 Plan d’expérience ... 36
Chapitre 3 Échantillonnage ... 42
Chapitre 4 Analyse ... 52
Chapitre 5 Dissolution ... 70
Chapitre 6 Séparation ... 84
Chapitre 7 Changement de matrice ... 98
Conclusion ... 108
Bibliographie ... 110
Annexe A Notions statistiques ... 116
Annexe B Évaluation de différentes méthodes d’analyse du mercure dans la chair de poisson ... 118
Liste des figures
Figure 1 : Communautés inuites du Nord canadien ... 1
Figure 2 : Émissions de plomb dans l'atmosphère au Canada ... 4
Figure 3 : Proportion de l'émission globale anthropique du mercure dans l'air en 2005 pour différents secteurs d’activités dans le monde. ... 7
Figure 4 : Sources globales de mercure dans l'Arctique par les courants océaniques (bleu) et les transports atmosphériques (blanc). ... 8
Figure 5 : Cycle biogéochimique du mercure dans les environnements nordiques ... 9
Figure 6 : Effet des ultrasons sur les microbulles ... 22
Figure 7 : 4,4’(5’)-di-t-butylcyclohexano-18-couronne-6 (DtBuCH18C6) ... 27
Figure 8 : Facteur de capacité (k') pour la résine Sr en fonction de la concentration d'acide nitrique pour différents ions à 23-25°C ... 28
Figure 9 : Le facteur de capacité (k’) pour Hg, Pb, Sn en fonction de la concentration en HCl pour la résine Pb après une période de stabilisation de 3h ... 29
Figure 10 : Complexation entre la résine Ambersep GT74 et le Hg2+ ... 31
Figure 11 : Capacité de la résine Ambersep GT74 pour différents cations ... 32
Figure 12 : Torche pour le plasma ICP et la distribution de température dans le plasma .... 33
Figure 13 : Schéma d’un filtre de masse à quadupôle ... 34
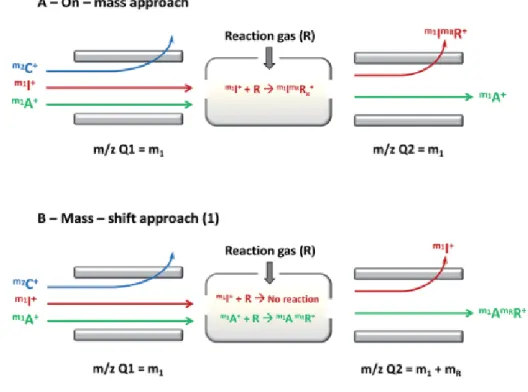
Figure 14 : Différentes approches pour éliminer les interférences par ICP-MS/MS. ... 35
Figure 15 : Représentation d'un domaine d'étude à deux facteurs... 38
Figure 16 : Surface de réponse formée par la modélisation de l'ensemble des points expérimentaux du domaine d'étude ... 39
Figure 17 : Domaine d'étude avec point central ... 40
Figure 18 : Utilisation du poinçon à biopsie... 43
Figure 19 : Poinçon à vis (a) sans et (b) avec embout et (c) poussoir. ... 44
Figure 20 : Mercaptoéthanol (ME) ... 57
Figure 21 : Signal d’une injection de 5 ng g-1 de Hg dans l'eau en présence et en absence de ME ... 57
Figure 22 : Cystéine (Cys) ... 58
Figure 23 : Effet de la présence d’hélium dans la cellule de réaction de l’ICP-MS/MS sur la sensibilité instrumentale pour divers isotopes de mercure (200, 201 et 202)... 60
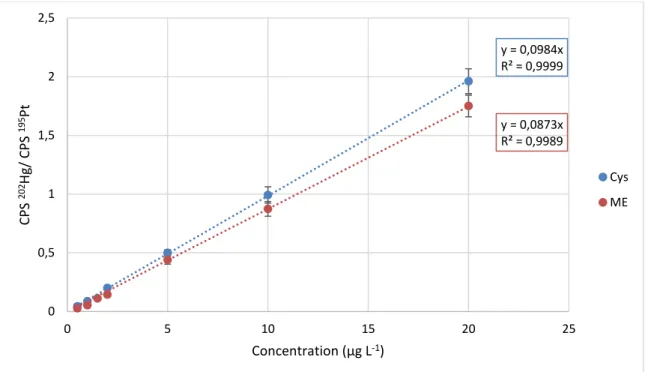
Figure 24 : Effet de la présence d’hélium dans la cellule de réaction de l’ICP-MS/MS sur la sensibilité instrumentale pour divers isotopes de plomb (206 et 208). ... 60 Figure 25 : Étalonnage du mercure par ICP-MS/MS en présence de cystéine (Cys) et
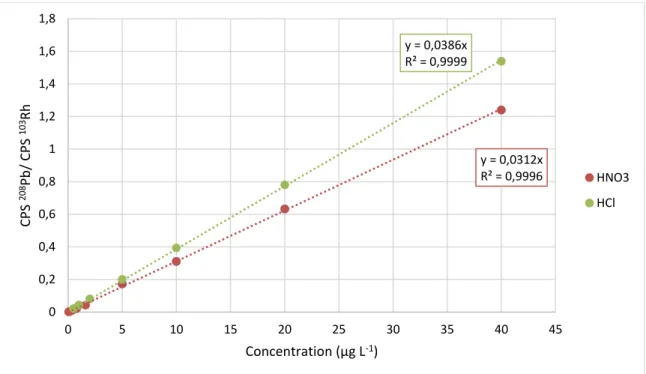
Figure 30 : Étalonnage du Pb par ICP-MS/MS en milieu HNO3 et HCl. ... 67
Figure 31 : Étalonnage du Hg et du Pb à faible concentration ... 68
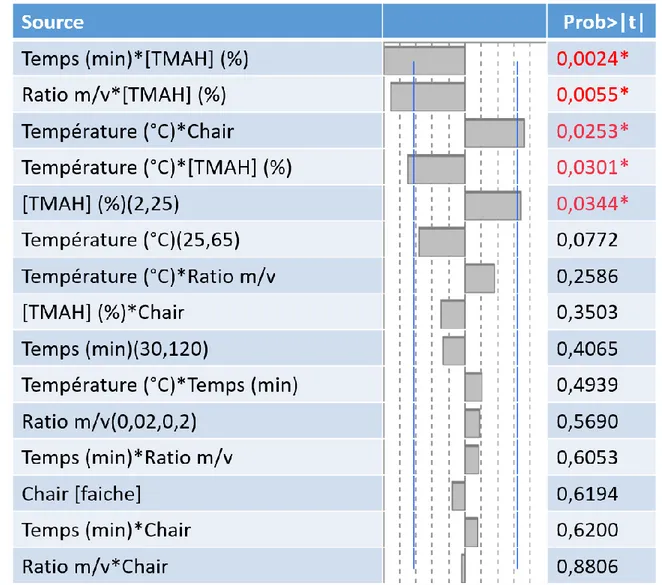
Figure 32 : Influence des paramètres du FFD 1 ... 74
Figure 33 : Réponse de l'optimisation du Pb avec le FFD 1 ... 75
Figure 34 : Influence des paramètres du FFD2 ... 76
Figure 35 : Réponse de la récupération du Pb avec le FFD2 ... 76
Figure 36 : Profil de récupération du Hg et Pb lors de la dissolution dans le TMAH en présence d’ultrasons ... 78
Figure 37 : Système à ultrasons. ... 80
Figure 38 : Interface d'utilisation du système à ultrasons ... 80
Figure 39 : Réponse de l'optimisation de la dissolution avec la sonde à ultrasons ... 82
Figure 40 : Étapes de la séparation sur résine Sr ... 86
Figure 41 : Récupération du Pb et du Hg pour les différentes étapes de la séparation sur résine Sr ... 86
Figure 42 : Récupération du Hg et du Pb lors de l’élution à la Cys et au CA sur résine Sr . 88 Figure 43 : Récupération du Hg et du Pb lors de l’élution à la ME et au CA sur résine Sr . 88 Figure 44 : Séparation de Hg et du Pb dans HCl 3 M sur résine Sr ... 89
Figure 45 : Libération du Hg par différentes solutions de rinçage ... 90
Figure 46 : Protocole d’évaluation de la préconcentration de la résine Sr. ... 91
Figure 47 : Évaluation de la préconcentration de la résine Sr ... 92
Figure 48 : Récupération du Pb avec différentes concentrations de CA ... 93
Figure 49 : Récupération du Hg avec différentes concentrations de Cys ... 94
Figure 50 : Cinétique de récupération du Hg lors de l’élution avec la cystéine 0,05 mM ... 95
Figure 51 : Séparation d’un échantillon de Hg et de Pb dans l’HNO3 0,1 M et le TMAH sur résine Sr ... 96
Figure 52 : Élution du Hg et du Pb de la résine Ambersep GT74 à différentes concentrations d’HCl ... 100
Figure 53 : Séparation du Hg et du Pb dans du TMAH 10% sur la résine Ambersep GT74 ... 101
Figure 54 : Différentes colonnes pour la résine Ambersep GT74 ... 102
Figure 55 : Comparaison de la taille de la colonne sur la récupération du Pb et du Hg... 102
Figure 56 : Séparation du Hg et du Pb d’une matrice de TMAH 20 % sur la résine Ambersep GT74 ... 103
Figure 57 : Séparation Hg, Pb sur la résine Ambersep GT74 avec des rinçages au NaOH 2,74 M ... 104
Figure 58 : Séparation d’un échantillon de dissolution de chair de poisson sur la résine Ambersep GT74 ... 105
Figure 59 : Séparation d’un mL d’échantillon de dissolution de chair de poisson de résine Ambersep GT74 ... 106
Figure 60 : Séparation d’un échantillon de dissolution de chair de poisson sur une résine Ambersep GT74 de 5,3 mL ... 107
Liste des tableaux
Tableau 1 : Abondance isotopique du plomb ... 3
Tableau 2 : Concentration de plomb (Pb) dans le sang maternel ... 6
Tableau 3 : Abondance isotopique moyenne du mercure... 7
Tableau 4 : Concentration en mercure (Hg) dans le sang maternel... 11
Tableau 5 : Comparaison des différentes techniques de mise en solution de la chair de poisson commercialement disponibles. ... 16
Tableau 6 : Différentes méthodes de dissolution alcaline ... 20
Tableau 7 : Rayon ionique du Sr, Pb et Hg pour différentes coordinations (Å) ... 27
Tableau 8 : Rétention du Pb sur la résine Sr suite à l’élution avec différents agents complexants ... 30
Tableau 9 : Masse de chair d'omble chevalier prélevée avec les différents poinçons ... 45
Tableau 10 : Masse (g) des échantillons d’omble chevalier prélevés par différentes personnes avec les différents poinçons ... 47
Tableau 11 : Masse (g) des échantillons frais ou surgelés prélevés avec les différents poinçons ... 49
Tableau 12 : Masses (g) des échantillons prélevés dans différentes espèces de poissons avec le poinçon EMS de 7 mm ... 50
Tableau 13 : Potentiels d'ionisation de certains éléments ... 54
Tableau 14 : Paramètres instrumentaux: ICP-MS/MS 8900 ... 55
Tableau 15 : Sensibilité pour chacun des isotopes par ICP-MS/MS ... 61
Tableau 16 : Comparaison des performances analytiques des différentes méthodes d’analyse du Hg par ICP-MS/MS ... 68
Tableau 17 : Comparaison des performances analytiques des différentes méthodes d’analyse du Pb par ICP-MS/MS ... 69
Tableau 18 : Paramètres à optimiser pour la dissolution de la chair d’omble chevalier ... 72
Tableau 19 : Récupération du plomb dans le plan factoriel complet 1 ... 73
Tableau 20 : Paramètres à optimiser pour maximiser la récupération en Pb lors de la dissolution assistée par ultrasons ... 75
Tableau 21 : Paramètres à optimiser pour maximiser la récupération en Pb et Hg lors de la dissolution assistée par ultrasons ... 77
Tableau 22 : Comparaison des différentes sources d'ultrasons sur la récupération ... 81
Tableau 23 : Paramètres à optimiser pour maximiser la récupération en Pb et Hg lors de la dissolution avec la sonde à ultrasons ... 82
Tableau 29 : Étapes de séparation du Hg dans HCl 3 M sur la résine Sr. ... 94
Tableau 30 : Étape pour la cinétique d’élution du Hg par Cys 0,05 mM ... 95
Tableau 31 : Étapes d’élution du Hg et du Pb sur la résine Ambersep GT74. ... 99
Tableau 32 : Étapes d’élution du Hg et du Pb sur la résine Ambersep GT74. ... 100
Tableau 33 : Séparation d’échantillon de dissolution de poisson dans TMAH 20 % sur résine Ambersep GT74 ... 104
Tableau 34 : Séparation d’échantillon de dissolution de poisson dans TMAH 20 % sur résine Ambersep GT74 ... 106
Liste des abréviations
µ Moyenne
CA Citrate d'ammonium dibasique
CV Coefficient de variation ou coefficient de variance
Cys L-cystéine
EC Éther-couronne
f Degrés de liberté
FAO Organisation des Nations Unies pour l'alimentation et l'agriculture (Food and Agriculture Organisation of the United Nations)
Fmax Valeur de Hartley
Fmax0 Valeur de Hartley critique
H2 Hydrogène gazeux
HCl Acide chlorhydrique
Hg(0)g Mercure gazeux
HNO3 Acide nitrique
ICP-MS Spectromètre de masse à couplage inductif
ICP-MS/MS Spectromètre de masse à couplage inductif avec triple quadrupôle
k Nombre de série utilisé dans un test d’Hartley
m/z Ratio masse sur charge
ME 2-Mercaptoéthanol
MeHg Méthylmercure
NH3 Ammonique gazeux
NRC Centre de recherche du Nunavik
O2 Oxygène gazeux
OMS Organisation Mondiale de la Santé
ppb Partie par milliard (μg L-1)
ppm Partie par million (mg L-1)
PTWI
Apport tolérable hebdomadaire provisionnel (Provisional tolerable weekly intake)
SDmax Écart-type maximal
SDmin Écart-type minimal
SN Sentinelle Nord
t Valeur de Student
tcrit Valeur de Student critique
TMAH Hydroxyde de tétraméthylammonium
Remerciements
Dans un premier temps, j’aimerais remercier mon directeur, Dominic Larivière, pour son temps, ses conseils et ses encouragements sans lesquels ce projet n’aurait jamais pu venir à terme. Ton aide a permis de porter ce projet beaucoup plus loin que ce que j’imaginais et de solutionner les problèmes que je pensais sans réponse. Merci pour toutes les opportunités de présentation, de formation et d'avancement que tu m'as offertes. Je n’aurais pas pu imaginer un meilleur directeur.
Merci à mon co-directeur, Pierre Ayotte, qui a permis de mieux comprendre l’impact des contaminants dans la nourriture traditionnelle sur les communautés.
Au cours de ma maitrise, j’ai eu l’occasion d’effectuer un stage à l’IPRE M où j’ai pu en apprendre beaucoup sur l’analyse du mercure dans des matrices environnementales, permettant de résoudre certains soucis de quantification. J’aimerais donc remercier Olivier Donard de m’avoir offert ce stage, Sylvain Berail de m’avoir accueillie et de m’avoir appris les méthodes d’analyse isotopique. Merci à Emmanuel Tessier pour son aide avec les procédures de laboratoire et les techniques de spéciation. Et bien sûr Emmanuelle Maria, Mathieu Martinez, Éline Barret, Bastien Duval et Robien Cellier, merci de votre accueil. Un merci tout spécial aux membres du groupe Larivière qui ont rendu mon expérience à la maitrise dynamique, divertissante et amusante. Merci à Claire Dalencourt qui a toujours été présente pour m’aider à rédiger les courriels que je ne savais pas comment formuler et qui avait toujours des solutions à mes problèmes. Merci d’avoir rendu le laboratoire si dynamique. Merci à Samantha Salou qui a toujours les mots pour nous remonter le moral. Merci, Mélodie, pour les discussions qui ont permis de résoudre tellement de problèmes. Merci à Audrey Picard-Lafond qui m’a aidée à faire évoluer ce projet. Merci à Elizabeth Drouin, Guillaume Blanchet-Chouinard, Maxime Gagnon, Julie Rochette et Alexa Leblanc pour votre aide au laboratoire. Merci à Gabrielle Cantin et Laurence Whitty-Léveillé qui m’ont inspirée et m’ont permis de découvrir le plaisir de la recherche, sans vous je n’aurais jamais commencé cette maitrise.
Merci aux collaborateurs sur ce projet, l’équipe des professeurs Jean Ruel et André Bégin-Drolet qui ont créé les instruments nécessaires à la réalisation de ce projet. Ce mémoire n’aurait jamais pu être rédigé sans l’aide de Justine Basque qui a été une super stagiaire en étant très autonome et efficace dans son travail de laboratoire, ce qui a permis de faciliter largement ma rédaction. Merci à Vincent Boutet pour le travail effectué lors de son stage dans le laboratoire.
Finalement, merci à ma famille et mes ami(e)s pour leur support moral et leurs encouragements.
Introduction
i.
Problématique Nordique
Le Nord canadien est un vaste territoire qui abrite une faune et une flore uniques. On retrouve dans cette région plusieurs petites communautés, majoritairement inuites. Ces communautés ne sont pas reliées par des routes et ne sont accessibles que par avion ou par bateau, lorsque les conditions climatiques le permettent[1]. L’environnement nordique impose donc à ces communautés un mode de vie différent de celui des occidentaux.
Figure 1 : Communautés inuites du Nord canadien [1]
Malgré la présence de supermarchés où on trouve de le nourriture occidentale, les habitudes alimentaires des communautés nordiques sont bien différentes de celles du sud.[2] L’approvisionnement des supermarchés en produits frais est très difficile. La majorité des aliments qu'on y retrouve sont transformés et contiennent des quantités importantes de sel, de sucre et de gras.[2] On y retrouve surtout des boissons gazeuses, des friandises, des croustilles, des viandes transformées comme le saucisson de Bologne, du pain et des œufs.
l'obésité, le diabète, l'anémie et les problèmes cardiovasculaires.[2] Les autorités locales encouragent donc les populations à consommer plus de nourriture traditionnelle, telle que les produits de la chasse, de la pêche, du trappage ou de la cueillette.[4]
L’alimentation traditionnelle est importante pour les communautés. En plus de permettre de subvenir aux besoins alimentaires, elle bâtit l'identité culturelle et la cohésion de la communauté par la coopération, le partage et l'échange de connaissances.[2], [5], [6] Elle est entre autres constituée de bélouga, de phoque, de caribou, de baleine, de petits fruits, de différentes espèces d’oiseaux et de poissons. Les aliments traditionnels sont associés à une bonne santé mentale, physique et spirituelle[7]. Ils contiennent plusieurs nutriments essentiels tels que des vitamines, des minéraux, des acides gras polyinsaturés oméga-3 et des protéines animales.[2]
Toutefois, la nourriture traditionnelle peut contenir des concentrations importantes de contaminants, tels que le plomb (Pb) et le mercure (Hg), ce dernier principalement sous forme méthylmercure (MeHg).[1],[8]
Ces contaminants, bien que présents naturellement dans l’environnement, sont retrouvés en concentrations importantes dans la chair de certaines espèces animales, principalement les poissons et mammifères marins situés au sommet de la chaîne alimentaire suite à la bioaccumulation et la bioamplification des contaminants. La bioaccumulation est l’accumulation d’une substance dans un organisme suite à son assimilation, ce qui implique que le contaminant ingéré par l’individu va s’accumuler et donc se concentrer dans son corps au cours de sa vie.[9], [10] La bioamplification est définie comme une suite de transferts qui mène a de plus fortes concentrations en contaminant dans un organisme que dans sa nourriture.[9] Il a donc une augmentation de la concentration en contaminant au fur et à mesure que montent les mailles de la chaîne trophique. Le contaminant est transféré de la proie au prédateur.
ii.
Plomb
Le plomb (Pb) est l’un des métaux les plus présents dans la croûte terrestre.[11], [12] Il a une masse molaire de 207,2 g mol-1 et le numéro atomique 82 du tableau périodique avec une configuration atomique [Xe] 6S2 4f14 5d10 6p2.[11] Il est dense, résistant à l'oxydation et malléable. Ces propriétés expliquent sa présence dans plusieurs alliages.[12], [13] Comme la plupart des métaux, le Pb se retrouve sous forme organique ou inorganique dans l’environnement selon le milieu. Les formes tétraéthylée et tétraméthylée sont les formes organiques les plus courantes. Certains complexes de plomb organiques sont transformés en plomb inorganique par photolyse et autres procédés physico-chimiques, faisant de la forme inorganique la plus courante.[13] Le Pb possède trois niveaux d'oxydation 0, II et IV. Le Pb (II) est le plus commun, il est entre autres retrouvé sous cette forme ionique dans les milieux aquatiques. Le plomb a un temps de résidence atmosphérique de 7 à 10 jours.[14] Il se retrouve dans les milieux aquatiques par déposition atmosphérique ou par érosion des sols. Sa concentration dépend de plusieurs paramètres, tels que le pH, la conductivité, la température, la salinité et la concentration en carbone organique dissout.[13],[15] En milieu alcalin, il précipite sous la forme PbCO3, alors qu'on le retrouve principalement sous la forme
PbSO4 ou PbCl2 dans les milieux plus acides. Le plomb a 4 isotopes naturellement présents
(Tableau 1).[16]
Tableau 1 :
Abondance isotopique du plomb[16]
Masse Abondance
204 1,4 %
206 24,1 %
207 22,1 %
208 52,4 %
Historiquement utilisé comme pigment dans la peinture, comme matériaux pour la plomberie ou comme additif dans l'essence, le plomb est présentement utilisé dans les batteries des
La toxicité du plomb étant connue depuis des décennies, il a donc été retiré ou interdit dans certains produits. En 1975, il est retiré de la peinture.[17] En 1990, les gouvernements ont interdit son utilisation dans l'essence, entrainant une diminution des émissions dans l'atmosphère de près de 90 % (Figure 2).[12], [17] Puisque le plomb est persistant, on le retrouve encore en grande concentration dans l'environnement suite aux utilisations passées.[17]
Figure 2 : Émissions de plomb dans l'atmosphère au Canada[12]
Le plomb est reconnu par l’Organisation Mondiale de la Santé comme l’un des métaux les plus dangereux pour la santé.[18] Les principales sources d'empoisonnement au Pb sont par l'alimentation ou par l'air.[15] Une fois ingéré, le Pb entre par l'intestin dans le sang d'où il peut atteindre les autres organes.[15] Il s'accumule principalement dans les os, les reins, le foie et puisque la barrière hématoencéphalique est vulnérable au Pb, il atteint également le cerveau. Son temps de demi-vie dans les tissus mous est de 30 à 40 jours alors qu'il est de 20 à 30 ans dans les os.[15], [19] Les os sont un réservoir actif de Pb, ce qui implique qu’il est continuellement absorbé et relargué dans l’organisme. Environ 90 % du plomb présent dans un adulte se retrouve dans les os alors que chez les enfants les os accumulent 70 % de la quantité présente dans l'organisme.[12] Le Pb est remis en circulation par différents processus, entre autres lors de libération de calcium osseux. La libération du Pb osseux chez la mère est la principale voie d'exposition du fœtus.[12] Les carences en fer ou en calcium augmentent son absorption dans l'organisme et les risque associés.[12], [13]
L’exposition au Pb entraine des risques de problèmes cardiovasculaires, rénaux, endocriniens et neurologiques, et ce même lors d'expositions à de faibles concentrations.[20] Une concentration sanguine en Pb inférieure à 5 µg dL-1 a des effets nocifs pour la santé, telle qu’une augmentation des problèmes d'attention, de l'agressivité et des comportements délinquants ou antisociaux, en plus d’entrainer une diminution du QI et des dégénérescences neurologiques.[12], [15], [20], [21] La présence de Pb dans le sang entraine une augmentation de la pression artérielle, donc augmente les risques de problèmes cardiovasculaires tels que les infarctus. Le Pb bloque également l'activité de certaines enzymes en se liant au groupement thiol, mais peut aussi activer certaines fonctions cellulaires en imitant les ions calcium. L'agence internationale de recherche sur le cancer (IARC) considère depuis 2006 le plomb comme un composé probablement cancérigène pour l'humain (classe 2A).[22]
Tout comme chez l'humain, le plomb s'accumule dans les os des animaux. Dans les poissons, il est principalement retrouvé dans les branchies, les reins, le foie et les os. La concentration en Pb dans les animaux aquatiques dépend de son milieu de vie et est reliée à son absorption via l'eau du milieu et par l'ingestion de particules de sol.[12] L’Organisation des Nations Unies pour l’alimentation et l’agriculture a établi la limite maximale à 300 µg de Pb par kg de chair de poisson.[23]
L'utilisation de grenaille de Pb ou d'autres munitions contenant du plomb représente un risque important de contamination de la viande. Puisque ces munitions sont largement utilisées dans le Nord québécois pour la chasse aux petits gibiers comme les oiseaux, le risque de contamination de la chair est non négligeable.[24] La concentration présente dans le sang maternel des femmes Inuit du Nunavik est plus importante que celle retrouvée dans le sang maternel de femmes non Inuit du sud du Québec (Tableau 2). L’analyse isotopique du Pb montre que cette différence de concentration est probablement due aux munitions utilisées pour la chasse et la consommation de nourriture traditionnelle.[25], [26]
Tableau 2 :
Concentration de plomb (Pb) dans le sang maternel[25] Non Inuit du sud du Québec (n = 134) Inuit Nunavik (n = 162) µg L-1 µg L-1 Minimum 2,1 5,2 Maximum 58 259 Moyenne 21,2 50
Un outil de suivi de la qualité alimentaire dans les milieux nordiques permettrait aux communautés de faire des choix plus éclairés, ce qui permettrait de réduire les concentrations en plomb retrouvées dans le sang des Inuit.
iii. Mercure
Le mercure est le seul métal du tableau périodique à être liquide dans des conditions de température et de pression normales; son point de fusion est de -38,8 °Cet sa température d'ébullition de 356,58 °C.[27], [11] Avec le numéro atomique 80 et une configuration électronique [Xe] 4f14 5d10 6s2, le mercure a une masse molaire de 200,59 g mol-1.[11] Il possède plusieurs niveaux d'oxydation (0), (I) et (II). Le Hg(0) est la forme métallique, mais sa pression de vapeur de 0,18 Pa fait qu'il se trouve aussi sous forme gazeuse.[15] À part les gaz nobles, le mercure est le seul gaz monoatomique stable.[8], [28] Le niveau d’oxydation (I) est le plus rare dans l'environnement, il est principalement retrouvé sous forme Hg22+.[8],
[28] Le Hg(II) est la forme ionique retrouvée entre autres dans les milieux aquatiques. Le Hg est naturellement présent dans l'environnement. Dans le sol, il est retrouvé sous forme de minerais, le plus abondant étant le cinabre, HgS.[29] Dans l'atmosphère, il est principalement retrouvé en gaz monoatomique, Hg(0)g, qui provient naturellement
d’éruptions volcaniques ou de la volatilisation en provenance des eaux de surface. Dans l’eau douce, plus de 70 % du mercure est sous forme de Hg(II).[30] Le mercure possède 7 isotopes stables (Tableau 3).
Tableau 3 :
Abondance isotopique moyenne du mercure[16]
Masse Abondance 196 0,2 % 198 10,1 % 199 16,9 % 200 23,1 % 201 13,2 % 202 29,7 % 204 6,8 %
La libération de mercure atmosphérique a grandement augmenté pendant l’industrialisation, la principale source étant l’utilisation de combustibles fossiles comme le charbon pour produire de l’énergie (Figure 3).[15], [30]
Puisqu'il est stable sous plusieurs formes, le mercure est présent dans tous les compartiments environnementaux (atmosphère, lithosphère, biosphère, hydrosphère) à des concentrations s’échelonnant sur plusieurs ordres de grandeur. Le Hg(0)g a un long temps de résidence
atmosphérique allant de six à dix-huit mois.[31] Il peut donc être retrouvé dans des zones très éloignées des lieux d'émission et a tendance à s'accumuler aux plus hautes latitudes via les courants océaniques et la circulation atmosphérique, faisant de ce dernier un contaminant global (Figure 4).[24], [32]
Figure 4 : Sources globales de mercure dans l'Arctique par les courants océaniques (bleu) et les transports atmosphériques (blanc). [30]
Le Hg(0)g peut être oxydé par des radicaux brome ou d’autres espèces oxydantes présentes
dans l’atmosphère, entrainant sa transformation en espèces moins stables et sa déposition. Sur la banquise, le mercure peut être réduit par des réactions photochimiques et retourner dans l'atmosphère ou s’incorporer au sol et aux eaux sous forme ionique.[8] Puisqu'il se dépose et se remobilise facilement, le mercure a un cycle biogéochimique dynamique qui rend sa modélisation dans l'environnement difficile.[30]
Figure 5 : Cycle biogéochimique du mercure dans les environnements nordiques [8] Le Hg (II) peut être transformé en organomercuriel par des microorganismes tels que les bactéries sulfato-réductrices.[30], [33] Le méthylmercure (MeHg) est la forme de mercure représentant le plus grand risque pour la santé.[34] Il s’accumule dans la chair, entrainant de la bioaccumulation et de la bioamplification. Le MeHg est donc présent en plus grande concentration dans la chair des animaux qui se situent au sommet de la chaîne trophique. Les prédateurs sont donc plus à risque d'un empoisonnement au MeHg que les proies qu'ils consomment. Le MeHg a une grande affinité pour les ligands thiol des protéines et a un caractère lipophile,[35] ce qui explique que plus de 90 % du mercure présent dans la chair de poisson est sous forme méthylée. Dans certaines espèces telles que l’omble chevalier, le MeHg constitue entre 97 et 100% du mercure présent dans la chair.[7] Les concentrations en Hg et en MeHg dépendent de différents facteurs : la taille de l'animal, son âge, son habitat,
La recherche sur les impacts du Hg et du MeHg sur l'humain a grandement augmenté depuis 1958 après l'incident de Minamata au Japon, où du mercure avait été relargué dans les cours d’eau par une industrie locale. Les microorganismes du milieu ont méthylé ce mercure créant du MeHg qui s’est bioaccumulé dans les poissons que consommait la population, créant plusieurs problèmes de santé allant de la perte de mémoire à la mort.[36]
Une fois ingéré, entre 90 et 95 % du MeHg atteint la circulation sanguine par voie gastro-intestinale. Il se lie aux globules rouges pour être transporté dans tout l'organisme. Le MeHg peut passer la barrière hématoencéphalique en se liant à la cystéine pour emprunter le transporteur de la méthionine. Le cerveau et le système nerveux sont donc affectés par ce dernier.[15] Au niveau moléculaire, le MeHg inhibe la production de certaines protéines et augmente la concentration intracellulaire de Ca2+ et interfère avec certains
neurotransmetteurs.[15] Il bloque aussi certaines enzymes, cofacteurs et hormones,[15] ce qui crée des pertes de vision, d'audition, des difficultés de contrôle moteur et des tremblements. Les enfants sont particulièrement à risque et peuvent avoir des problèmes d'attention, de mémoire et un risque accru de déficience intellectuelle.[32], [37] Chez les adultes, le MeHg est aussi soupçonné d'affecter les systèmes cardiovasculaire et immunitaire.[37], [38] Puisqu’il peut aussi traverser la barrière placentaire, la concentration en MeHg peut être jusqu'à 1,5 fois plus importante dans le sang du foetus que dans le sang de la mère.[32], [38] L’exposition au MeHg in utero a des conséquences importantes pouvant aller de retards de développement jusqu’à la mort de l'enfant à naitre.[8], [38]
Dans les produits commerciaux, la concentration maximale permise est de 0,5 µg de mercure par kg de poisson frais. Pour les populations qui basent leurs alimentations sur le poisson, cette limite est moindre à 0,2 μg kg-1.[8], [30] Le comité mixte FAO/OMS composé d'experts des additifs alimentaires a calculé l’apport tolérable hebdomadaire provisionnel (“provisional tolerable weekly intake” (PTWI)) pour le mercure à 4 μg kg-1 de masse corporelle par
semaine sous forme inorganique et 1,6 μg kg-1 de masse corporelle par semaine pour la forme méthylée.[39], [40], [41] Dans une étude effectuée entre 1996 à 2000 auprès de jeunes du
Nunavik, la concentration moyenne de Hg dans le sang des enfants était supérieur à 18 µg L-1, ce qui est près de 20 fois plus élevé que les concentrations retrouvées dans le sang des enfants échantillonnés au sud du Québec[42], [43]sachant que la limite provisoire est de
8 µg L-1 en Hgt .[7]Une comparaison similaire a été effectuée avec le sang maternel et les
femmes Inuit du Nunavik ont des concentrations de mercure total beaucoup plus élevées que dans le sang de non Inuit vivant au sud du Québec (Tableau 4).
Tableau 4 :
Concentration en mercure (Hg) dans le sang maternel[25] Non Inuit vivant au sud du Québec (n = 134) Inuit Nunavik (n = 162) µg L-1 µg L-1 Minimum 0 2,6 Maximum 3,6 44 Moyenne 0,9 10,4
Sa propagation atmosphérique sur de longues distances, sa capacité de bioaccumulation, sa persistance dans l’environnement et son impact sur la santé humaine font du mercure un contaminant préoccupant à l’échelle mondiale. Le Programme des Nations Unies pour l’environnement a adopté la convention de Minamata le 16 août 2017.[44] Cet accord environnemental mondial a pour but de protéger la santé humaine et l’environnement contre l’émission et les rejets anthropiques de mercure et de ses composés en prévoyant une série de mesures à cette fin.[44] Les obligations de cette convention devraient diminuer la concentration en mercure dans l’environnement avec le temps et avoir un effet positif sur l’environnement nordique et la santé humaine.[30], [44]
La mise au point d’un appareil de suivi alimentaire dans les milieux nordiques va permettre de rassurer les populations sur la qualité de la nourriture et à plus long terme pourrait aussi permettre de voir les impacts réels de la convention de Minamata sur l’environnement nordique.
iv. Présentation du projet
Dans le cadre de la stratégie Sentinelle Nord, l’objectif du projet 3,4 est de mettre au point une plateforme analytique pour effectuer le suivi de la qualité alimentaire dans les environnements nordiques. Un appareil permettant d’obtenir localement et facilement de l’information sur la qualité alimentaire augmenterait l’autonomie des Inuit face à leurs choix alimentaires et leur confiance dans la nourriture traditionnelle. Vue la grandeur du territoire, faire une étude des contaminants dans la chair animale représente un défi important. Le développement d’une plateforme analytique évaluant la présence d’espèces chimiques sentinelles telles que le plomb et le mercure dans la nourriture traditionnelle nordique aiderait les communautés et les chercheurs. Cet appareil permettrait aux populations de savoir rapidement si la viande qu'ils vont consommer est sûre, passable ou risquée. Cette plateforme analytique effectuerait automatiquement la préparation, la mesure et l’analyse du Hg et du Pb dans l’échantillon, permettant son utilisation par des personnes n’ayant aucune formation scientifique. La plateforme transmettra les informations au Centre de Recherche du Nunavik (NRC), pour qui la connaissance de la qualité alimentaire est essentielle pour effectuer des interventions de santé publique efficaces.
Le développement de cette plateforme demande la collaboration de plusieurs étudiants de différents laboratoires. Pour permettre l’utilisation de l’appareil par de non scientifique, cette plateforme va inclure un système de pompe pour permettre d’ajouter les bons volumes de solution automatiquement.
La quantification du Hg et du Pb sera effectué à l’aide d’un système de détection optique. Ce système optique sera constitué de nanoparticules fonctionnalisées avec des capteurs moléculaires spécifiques à l’élément recherché. Ces capteurs ont la caractéristique de changer de conformation une fois liée aux métaux recherchés, changeant la longueur d’onde d’émission des nanoparticules, permettant ainsi la quantification. Le centre métallique de ces particules permet d’améliorer leur capacité de luminescence. Ce système optique est en cours de développement et pourrait permettre une quantification efficace par d’un système compact. Toutefois, les capteurs moléculaires qui constitue ce système sont sensible à leurs milieux, il est donc nécessaire d’utiliser ce système de détection à des pH entre 6 et 8 sans présence de chlorure.
Dans cette optique, il faut dans un premier temps effectuer la dissolution de la matrice; ce sur quoi se concentrent ces travaux de maîtrise.
La dissolution d'échantillons biologiques peut être effectuée de différentes façons. Les méthodes micro-ondes ou par chauffage acide sont les plus populaires, mais demandent la manipulation d'acide concentré, des appareils dispendieux et volumineux ainsi que la présence de personnel qualifié.[45] Ces méthodes ne s’appliquent donc pas dans le cadre de ce projet. La dissolution alcaline à l'aide d'hydroxyde de tétraméthylammonium et d'ultrasons permet de mettre la chair en solution avec une récupération quantitative des analytes d'intérêt en peu de temps.[45], [46] Cette méthode de dissolution sera détaillée dans ce mémoire.
v. Objectifs du mémoire
L’objectif de ce mémoire est de développer une méthode de dissolution de la chair d’omble chevalier puis de séparation du Hg et du Pb pouvant être effectuée sur le terrain par des non scientifiques. L’omble chevalier (Salvelinus alpinus) est un poisson qui peut se retrouver dans l’eau douce ou salée et qui est consommé tout au long de l’année par les communautés nordiques.
Pour être en mesure d’effectuer la dissolution de la chair, il faut dans un premier temps la prélever. Il faut donc élaborer une méthode de prélèvement des échantillons qui soit simple, rapide et reproductible. Pour ce faire, différents types de poinçons ont été testés et sont présenté dans le chapitre 3.
Puisque le système de détection optique est en développement, la quantification est effectuée à l’aide d’un spectromètre de masse à plasma à couplage inductif (ICP-MS/MS). Les méthodes développées pour l’analyse du Hg et du Pb sont présentées dans le chapitre 4.
permettre la plus grande récupération des analytes : le temps, la température, la concentration de TMAH, le ratio masse/volume et l’intensité des ultrasons.
Afin de réduire les interférents possibles lors de la quantification il faut séparer les analytes de la matrice et les séparer les uns des autres. Pour ce faire, une méthode a été développée à l’aide de la résine Sr commercialement disponible et est décrite dans le chapitre 6.
Les résines ont une efficacité variable selon le milieu et malheureusement la résine Sr ne fonctionne pas en milieu basique. Le chapitre 7 porte donc sur l’élaboration d’un processus permettant de changer la matrice de l’échantillon dissout pour transférer les analytes d’une matrice basique à une matrice acide.
Chapitre 1 Théorie
1.1. Mise en solution
1.1.1. Méthodes de mise en solution
La plupart des méthodes d’analyse nécessitent l’utilisation d’échantillons sous forme dissoute. Cependant, une grande proportion des matrices environnementales étant solides, il est donc important d’effectuer leur mise en solution efficacement. L’un des objectifs de ce mémoire est d’être en mesure de dissoudre le Pb et le Hg , en peu de temps et de façon reproductible. Certaines matrices peuvent représenter un véritable défi de solubilisation et nécessitent l’utilisation de techniques employant des réactifs chimiques passablement agressifs. Choisir la bonne technique de dissolution ainsi que les bons réactifs est critique au succès de l’analyse.[47] L’utilisation d’une méthode non adaptée aux analytes d’intérêt peut entrainer leur volatilisation, leur précipitation ou encore la formation d’espèces encore plus réfractaires. Plusieurs méthodes de dissolution sont commercialement disponibles et sont décrites sommairement (Tableau 5).
Les méthodes de digestion à l’aide d’un bain de sable ou d’une plaque chauffante sont les plus anciennes. La chaleur produite par ces sources est transmise au contenant dans lequel se trouve l’échantillon avant d’atteindre ce dernier. Puisque la chaleur doit diffuser vers l’échantillon, ce type de chauffage est peu homogène. La mise en solution demande donc l’utilisation de réactif concentré combinée à de longs temps de réaction.[47] Le système de digestion Digiprep (SCP Science) est semblable, en termes de concept, au bain de sable, mais offre un contrôle plus reproductible des étapes de chauffage, mais également des températures plus uniformes et précises.
Tableau 5 :
Comparaison des différentes techniques de mise en solution de la chair de poisson commercialement disponibles.
Température (°C) Temps (min) Pression (bar) Réactif Volume de réactif ( mL) Masse d'échantillon (g) Récupération Source Hg (%) Pb (%) Digestion acidei 80 180 1 HNO3 70% (v/v) H2SO4 98% (v/v) 3,5 1,0 103 102 [48], [49] Micro-onde semi-ouvertii 75 4 1 TMAH 25% (m/v) 5 0,2 97 ND [50] Micro-onde pressuriséiii 200 30 55 HNO3 65% (v/v) H2O2 30% (v/v) 6 2 1,0 97 98 [51] Minéralisateur haute pressioniv 260 60 40 HNO3 65% (v/v) H2O 6 2 0,5 98 - [52]
i: DigiPREPjr de SCP Science (Québec, Qc, CANADA) ii : Discover de CE M corporation (Orsay, France) iii : Mars5 de CE M Corporation (Matthews, NC, USA) iv : Multiwave 7000 de AntonPaar (Les Ulis, France)
La méthode de digestion par micro-ondes est couramment utilisée pour la dissolution de matériaux biologiques. Les micro-ondes vont produire de la chaleur via deux processus : la rotation des dipôles et la conduction ionique. L’interaction des molécules dipolaires, par exemple: l’eau, avec le champ électrique du micro-ondes qui est en oscillation constante entraine des rotations moléculaires et ainsi une augmentation de la température.[53] Lorsque les digestions sont effectuées dans des contenants en quartz ou en téflon qui n’absorbent pas ce type de rayonnement, l’énergie est transférée directement, sans perte, à la solution, permettant ainsi à l’échantillon d’atteindre rapidement des températures élevées et uniformes.[47] Cette méthode peut être effectuée en système semi-ouvert ou pressurisé. La digestion micro-ondes en système pressurisé consiste à placer l’échantillon et une dizaine de millilitres d’acide concentré dans un récipient fermé (une bombe) en téflon ou en quartz. Puisque la digestion est effectuée en milieu fermé, il n’y a pas de perte de vapeur et les espèces volatiles sont conservées.[47] Ce système permet donc d’atteindre des températures plus élevées de par sa capacité à maintenir la dissolution sous pression.
En système ouvert, les températures maximales atteignables sont moins élevées. Cette technique de digestion est donc privilégiée pour la préparation d’échantillons à des fins d’analyse de spéciation où la température est critique. Cette méthode permet de faire la dissolution de la matière organique sans dénaturer les espèces chimiques présentes.
Le système de digestion infrarouge permet un chauffage efficace. Les infrarouges sont des radiations de plus haute énergie que les micro-ondes. L’appareil de digestion infrarouge disponible dans le laboratoire permet de mettre des échantillons en solution dans des tubes en quartz qui focalise les radiations sur une petite zone. Les radiations infrarouges vont interagir avec la surface des particules accélérant ainsi leur dissolution et réduisant les pertes dans le milieu.
plus réfractaires. Ces réactifs permettent la dissolution de la majorité des matrices environnementales.[54]
Les différentes techniques présentées précédemment doivent être effectuées dans des laboratoires par du personnel qualifié et sont donc peu adaptées pour une utilisation en milieu nordique par les membres de ces communautés. En conséquence, il est nécessaire dans le cadre de ce projet d’explorer de nouvelles avenues pour effectuer la mise en solution adaptée aux aliments nordiques. Pour cela, la méthode de dissolution de la chair de poisson doit être : 1) rapide, 2) ne pas nécessiter des températures ou des pressions élevées, 3) ne représenter que peu de danger d’utilisation, 4) produire un minimum de déchets, 5) être facile à déplacer et 6) être réalisable sans connaissance exhaustive de la méthode.
Compte tenu de ces critères, une dissolution non pas en milieu acide, mais plutôt en milieu alcalin apparait comme une technique prometteuse.
1.1.2. La dissolution alcaline
Différents réactifs alcalins peuvent être utilisés pour la solubilisation. L'hydroxyde de sodium (NaOH) est une base inorganique qui facilite la solubilisation de certains éléments en entrainant la déprotonation ou encore la formation d’hydroxocomplexes. Des solutions d’éthylène diamine tétraacétique (EDTA) à des pH supérieurs à 10 permettent également la mise en solution de certains éléments comme le Zn, Mn, Mg, Ca, Cd, Fe et le Pb.[45] Certaines bases organiques solubles en milieux aqueux peuvent être utilisées telles que des amines tertiaires ou de l’hydroxyde de tétraméthylammonium (TMAH)[45].
L’hydroxyde de tétraméthylammonium (TMAH) est une base organique avec un pH se situant entre 13,4 et 14,7 pour des concentrations supérieures à 1 % (v/v), dont la formule chimique est (CH3)4NOH.[45] Il est soluble dans l’eau et dans des solvants organiques tels
que le méthanol. Le TMAH est disponible commercialement sous forme solide, en solution aqueuse ou en solution dans le méthanol à différentes concentrations.
En 1973, Murthy et ses collaborateurs ont été les premiers à utiliser la dissolution alcaline à l’aide de TMAH pour dissoudre de la chair animale dans laquelle ils voulaient déterminer la concentration en Zn, Cu, Cd et Pb.[55] Depuis, plusieurs chercheurs ont utilisé la dissolution
alcaline pour dissoudre les métaux contenus dans des cheveux, des ongles, des plumes, du sang et de la chair animale.[45]
Les solutions de TMAH sont stables à température ambiante. Campos et coll. ont montré que le TMAH agit sur les protéines, les acides aminés et les lipides, en comparant par analyses Raman des échantillons de poulet avant et après dissolution alcaline.[45], [56] Le TMAH crée l’hydrolyse et la méthylation des esters, des amines et certains éthers, en plus de briser les ponts disulfure dans les protéines.[57] Considérant que le TMAH est une base organique, sa capacité de pénétration dans la chair est plus importante que les bases inorganiques dû à son caractère plus lipophile, augmentant ainsi son efficacité de dissolution.
Lors de la mise en solution, il faut aussi porter attention à la volatilisation des espèces, particulièrement pour le mercure qui peut être réduit et se volatiliser.[53] La dissolution à l’aide de TMAH ne demande pas de température ou de pression élevée, il est donc plus facile de récupérer les éléments plus volatils.[58], [59]
Le TMAH est connu pour ne pas dénaturer les différentes espèces de mercure présentes dans les échantillons. Il est entre autres utilisé pour faire des analyses de spéciation. Pour quantifier le mercure total après une dissolution alcaline, il est nécessaire d’oxyder les espèces organométalliques. Cette oxydation permet d’obtenir la totalité du mercure présent dans l’échantillon sous forme Hg2+. Cette réaction peut être effectuée à l’aide de permanganate de
potassium (KMnO4) ou de tétrahydruroborate de sodium (NaBH4).[59]
Le TMAH permet la dissolution de la chair de poisson à température ambiante en environ 24 h.[59] La littérature fait état de plusieurs méthodes de dissolution alcaline qui ont été développées pour différentes matrices. Afin d’accélérer le processus, certains échantillons sont solubilisés à l’aide de système micro-onde ouvert, de plaques agitatrices ou encore d’ultrasons (Tableau 6)
Tableau 6 :
Différentes méthodes de dissolution alcaline Type de matrice biologique Analyte [TMAH] (%) Température (°C) Temps
(min) Assisté Volume ( mL)
Masse (mg)
Rendement
(%) Source
1 Fruit de mer Hg total 25 20 1440 S.A. 5 250 96 [60]
2 Lait en poudre Sn 12,5 80 30 A.M. 2 350 100 [58]
3 Poisson Pb 25 20 1080 S.A. 4 250 92 [61]
4 Poisson Hg 2 25 7 U.S. 8 200 99 [62]
5 Cheveux Pb 2 150 270 M.O. 2 300 95 [63]
6 Huitres MeHg+ 25 70 46 M.O. 4 100 92 [64]
7 Cœur de poulet Pb 25 200 480 S.A. 1,75 250 95 [56]
Les sources d’ultrasons sont petites et pourraient être faciles à implanter sur une plateforme analytique portative.[65] Contrairement à l’agitation magnétique, les ultrasons peuvent interagir avec le médium de dissolution ainsi que l’échantillon sans l'ajout d’un objet, évitant les problèmes de contamination croisée. Les ultrasons semblent être la meilleure option pour permettre la dissolution de chair animale de façon simple et portative.
1.1.3. Ultrasons
L’utilisation des ultrasons en chimie, nommée sonochimie, est grandissante puisqu’elle est sécuritaire, demande peu d’énergie, s’utilise à température ambiante et produit peu de déchets.[66]
Comparativement aux ondes électromagnétiques (ex. : les micro-ondes) qui peuvent traverser la matière sans perdre d’énergie, les ondes sonores ont besoin d’un milieu pour se propager; ainsi la distance qu’elles vont parcourir variera selon le milieu de propagation.[67] Les sons sont des ondes de pression qui se propagent dans un milieu par compression et expansion.[66] Les ultrasons sont des ondes mécaniques dont les fréquences sont supérieures à celles perceptibles par l’humain, soit à des fréquences de 20 kHz à plusieurs MHz dépendant de la source.[68]
Elles créent des cycles de compression et d’expansion de microbulles présentes dans l’échantillon jusqu’au point où ces dernières implosent. Ce phénomène appelé cavitation se produit rapidement soit en environ 400 µs. Il génère des températures locales estimées à 5000 °C et des pressions supérieures à 1000 atm.[69]–[71] Le phénomène de cavitation se produit dans un très petit volume et l’énergie émise est rapidement dispersée dans le reste de l’échantillon.[69]
Figure 6 : Effet des ultrasons sur les microbulles[71]
Lorsque des ultrasons sont propagés dans une solution hétérogène, les effets de cavitation sont plus importants, l’interface entre la solution et un solide créant une déformation des microbulles passant d’une forme sphérique à une forme ovale. L’implosion de ces bulles asymétriques produit un jet de liquide de grande vitesse environnant les 400 km h-1. Ces implosions dégagent une grande quantité d’énergie localisée qui altère la surface de l’échantillon, accélérant sa dissolution et entrainant la formation de radicaux libres (ex. OH.)
et d’espèces oxydantes (H2O2) favorisant les processus d’oxydation.[68], [72]
Il existe différentes sources d’ultrasons commercialement disponibles tels que les bains et les sondes.[73] Les bains sont les plus couramment utilisés en laboratoire puisqu’ils sont peu dispendieux. Ils produisent des ultrasons de faible intensité à des fréquences de l’ordre de 40 kHz.[71] Toutefois, ces ultrasons ne sont pas propagés directement dans l’échantillon, ils doivent au préalable se diffuser dans l’eau du bain. La propagation des ondes dans le milieu dépendant de la densité de ce dernier, comme les ultrasons entrainent une augmentation de la température, la densité et donc la propagation des ondes varient. Cela amène deux désavantages importants pour l’extraction soit : le manque d’uniformité des ultrasons à l’intérieur du bain et la diminution de l’énergie transférée à l’échantillon en fonction du
Formation de bulles Croissance des bulles en cycles successifs Bulles atteignent une taille instable Éclatent violemment Ra y o n des bul les (micro ns ) Temps (µs) Croissance Point chaud
temps.[69] Les sondes à ultrasons, quant à elles, sont insérées directement dans l’échantillon ce qui permet d’éviter les pertes dans le milieu en focalisant les ultrasons sur une zone précise. Elles sont généralement opérées à des fréquences d’environ 20 kHz. Toutefois, les performances de ces sondes peuvent être altérées par la formation de précipités sur l’embout, diminuant ainsi ses performances. En plus, considérant que la sonde est en contact direct avec l’échantillon, les risques de contamination croisée ou de contamination des échantillons par les constituants de la sonde, par exemple le titane, ne sont pas négligeables.
Plusieurs paramètres influencent l’efficacité du phénomène de cavitation dans l’échantillon. La viscosité du milieu a un impact sur la cavitation; plus le milieu est visqueux, plus la pression nécessaire pour débuter la cavitation sera grande.[66] Un solvant ayant une pression de vapeur élevée va favoriser la formation des microbulles; toutefois la pression générée par cavitation sera diminuée. La température favorise également le processus de cavitation; celui-ci diminue toutefois fortement avec l’augmentation de la température.[66]
Les méthodes de dissolution à l’aide d’ultrasons sont plus rapides et simples que les méthodes conventionnelles (i.e. micro-ondes, agitations, plaques chauffantes) puisqu’elles ne demandent pas de temps de chauffage ou de refroidissement à la température ambiante. De plus, les ultrasons ne nécessitent pas de vaisselle spécifique ou de réactifs particuliers, contrairement aux micro-ondes qui nécessitent de la vaisselle en quartz ou en téflon et un échantillon qui contient des espèces dipolaires.[68] Ils permettent finalement une bonne homogénéisation de l’échantillon et la création d’émulsion.[68]
La possibilité de combiner l’efficacité de la dissolution à l’aide du TMAH et la puissance des ultrasons dans une méthode de mise en solution de la chair de poisson semble une avenue très prometteuse pour ce projet et sera discutée en profondeur dans le chapitre 6.
trouble ou par séparation chromatographique. L’objectif est d'isoler l'analyte dans une phase différente de la matrice. Pour préconcentrer l’analyte, la phase dans laquelle il sera isolé doit être d’un volume inférieur au volume de l’échantillon initial. Si par exemple 100 µg de Pb dans 100 mL de matrice sont isolés dans 10 mL d’une autre phase non miscible, la concentration de Pb est maintenant de 100 µg dans 10 mL, ce qui représente un facteur de préconcentration de 10 (1 à 10 mg L-1).
La coprécipitation consiste à séparer les composés en effectuant une précipitation sélective. Puisque cette méthode de séparation est basée sur la différence de solubilité des éléments dans différentes conditions, l’analyte d’intérêt et les interférents devront présenter des solubilités distinctes. La précipitation peut être effectuée en modifiant le pH ou en ajoutant des sels comme des sels de sulfures, de chlorures ou de sulfates.[47] Cette méthode de séparation est simple; toutefois, l’analyte précipité peut facilement être contaminé par plusieurs autres composantes de la matrice précipitant dans les mêmes conditions que ce dernier. La méthode doit donc être effectuée à plusieurs reprises sur un même échantillon pour avoir une bonne séparation.[74] En présence de faibles concentrations, la précipitation peut être longue et le précipité peut être difficile à isoler sans l’ajout d’un co-précipitant.[47] L’extraction liquide-liquide consiste à transférer l’analyte dans une phase différente non-miscible; pour la plupart des métaux, l’utilisation de ligands spécifiques est nécessaire.[75] Prenons ici l’exemple d’un analyte en phase aqueuse et d’un ligand dissout dans une phase organique. La liaison ligand-analyte s’effectuera à l’interface entre les deux phases. Une fois lié, le complexe ligand-analyte est neutre et hydrophobe, ce qui permettra à l’analyte de migrer d’une phase aqueuse à une phase organique. Les différentes phases peuvent ensuite être séparées et analysées. Bien que cette méthode soit grandement utilisée, elle nécessite l’utilisation de grande quantité de solvants organiques qui peuvent être néfastes pour l’environnement et la santé en plus de ne pas permettre une grande préconcentration des analytes.[74]
L’extraction au point trouble consiste à déplacer l’analyte de la matrice vers une micelle à l’aide d’un ligand spécifique. L’extraction par point trouble est similaire à l’extraction liquide-liquide. Toutefois dans cette technique, les ligands se concentrent dans des micelles de surfactant qui ont la caractéristique de précipiter lorsqu’elles sont au-delà la température
de point trouble, permettant une séparation facile des phases. L’extraction par point trouble permet de récupérer l’analyte dans un très petit volume, donc d’obtenir un grand facteur de préconcentration.[76]
La séparation chromatographique sur résine consiste à mettre en contact la phase mobile contenant les analytes d’intérêt avec une phase stationnaire. Les éléments ayant une affinité plus grande pour la phase stationnaire que la matrice seront retenus, permettant de retenir les éléments voulus en laissant passer les autres composantes de la matrice.[47] La phase stationnaire est régulièrement préparée sous forme de colonne chromatographique. Les métaux retenus sur la colonne peuvent être ensuite élués de différentes façons permettant la réutilisation de la colonne pour effectuer plusieurs analyses. En plus de permettre la séparation des analytes, les colonnes chromatographiques permettent leur préconcentration. En effet, une fois sur la colonne les éléments d'intérêt peuvent être élués avec un volume moindre que celui de la solution initiale. Différents types de résines sont commercialement disponibles : les résines ioniques et les résines chélatantes.
Les résines ioniques effectuent un échange ionique entre la phase stationnaire et la phase mobile permettant une séparation des éléments selon leur charge (Équation 1). Ces résines sont constituées de polymères contenant plusieurs fonctions ioniques hydrophobes. Ces résines peuvent être divisées en deux types : cationique ou anionique dépendant de la charge positive ou négative de leur contre-ion. Les résines anioniques peuvent entre autres contenir des fonctions acides sulfoniques (RSO3-H+) ou acides carboxyliques (RCOOH). Les résines
cationiques peuvent contenir des amines quaternaires (RN(CH3)3+ OH-). Ce type de résines
est particulièrement intéressant lorsque les espèces à séparer sont de charge opposée, par exemple la séparation d’ions phosphate (PO43-) et d’ions baryum (Ba2+). Cependant, elles
demandent un contrôle précis du pH et peuvent être dégradées par la présence d’acides à des concentrations élevées.
agents chélatants sont des acides faibles organiques qui forment des complexes non chargés avec les ions métalliques, donnant ainsi aux ions une grande affinité pour les solvants organiques imprégnés sur la phase stationnaire.[47] Ces colonnes vont permettre une séparation des analytes en fonction de leur affinité pour le ligand présent dans la résine. La formation de complexe chélatant-ion est influencée par différents facteurs tels que la concentration de ligand, la concentration d’ion, le pH et les contre-ions[47]. Une fois l’analyte retenu sur la résine, il est possible de l’éluer avec une solution pour laquelle l’affinité de l’analyte est supérieure à celle de la résine. L’élution peut aussi être causée par une déstabilisation du complexe chélatant-ion, par exemple via la protonation résultant d’un changement de pH ou d’augmentation de la concentration d’un contre-ion.
En considérant la facilité d’exécution associée à la séparation, les hauts degrés de sélectivité observés, la grande disponibilité commerciale de ces produits et la possibilité de préconcentration de l’analyte, la séparation sur colonne a été la méthode retenue dans le cadre de ce mémoire. La résine commerciale de Eichrom Sr est connue pour permettre une bonne séparation du plomb.
1.2.1. Résine Sr
Différentes résines sont commercialement disponibles pour retenir le plomb, comme la résine Pb de Eichrom. Elle est imprégnée de l’éther-couronne 4,4’(5’)-di-t-butylcyclohexano-18-couronne-6 (DtBuCH18C6) (Figure 7) dans de l’alcool.[77] La résine Sr de Eichrom est imprégnée du même éther-couronne que la résine Pb, mais cette fois dans l’octanol. Toutefois, la concentration d’éther-couronne est plus grande dans la résine Sr que dans la résine Pb, ce qui permet la rétention du Pb d’une plus large plage de concentration et permet d’éviter la lixiviation précoce de ce dernier lors de l’utilisation de grands volumes de phase mobiles élevés. La cavité de cet éther-couronne a un diamètre entre 2,6 et 3,2 Å.[78] Bien que cette résine ait été commercialisée pour la séparation du strontium (Sr) , elle retient aussi plusieurs autres métaux ayant des rayons ioniques s’approchant de celui du Sr (Figure 7).[79]
Figure 7 : 4,4’(5’)-di-t-butylcyclohexano-18-couronne-6 (DtBuCH18C6)[78] Tableau 7 :
Rayon ionique du Sr, Pb et Hg pour différentes coordinations (Å)[80]
Coordination Sr 2+ Pb2+ Hg2+
4 - - 0,96
6 1,18 1,19 1,02
8 1,26 1,29 1,14
L’affinité du plomb pour cette résine dans l’acide nitrique (HNO3) est même plus grande que
celle du Sr. L’affinité d’un élément pour la résine est exprimée par le facteur de capacité (k’). 𝑘′= 𝐶𝑠𝑉𝑠
𝐶𝑚𝑉𝑚 Équation 2
où Cs est la concentration d’analyte sur la phase stationnaire
où Vs est le volume de la phase stationnaire
où CM est la concentration d’analyte sur la phase mobile
où V M est le volume de la phase mobile
Plus le facteur de capacité est élevé, plus l’analyte sera immobilisé sur la résine et sera séparé facilement de la matrice. Le Pb a des facteurs de capacité supérieurs à 102 pour des concentrations en HNO3 variant entre 10-2 à 101 M (Figure 8)[74]. Il est retenu sous forme
d’ion Pb2+ étant complexé par les oxygènes constituant le cœur de l’éther-couronne avec sa
charge balancée par un contre-ion (Cl-, NO
Figure 8 : Facteur de capacité (k') pour la résine Sr en fonction de la concentration d'acide nitrique pour différents ions à 23-25°C[74], [78]
Bien que la résine Sr ait été documentée pour l’extraction de plusieurs métaux, la littérature contient très peu d’information sur sa capacité à retenir le Hg. Quelques articles rapportent des capacités de séparation de la résine Pb. Despotopulos et coll. ont observé que la rétention du mercure sur la résine Pb est effectuée entre 2 éthers couronne (EC) différents selon l’équation suivante[82] :
HgCl2(aq) + 2EC(org) ↔ [HgCl2⸳2EC](org) Équation 3
Ce qui implique que la rétention du Hg serait dépendante de la concentration en contre-ion (Cl-) et que des concentrations importantes en Cl- entraineraient la formation de
chlorocomplexes tels que HgCl3- et de HgCl42-, réduisant du même coup le facteur de capacité
Figure 9 : Le facteur de capacité (k’) pour Hg, Pb, Sn en fonction de la concentration en HCl pour la résine Pb après une période de stabilisation de 3h.[82]
Une fois retenus sur la résine, les analytes peuvent être élués à l’aide de différentes solutions qui vont modifier l’affinité de l’analyte pour la résine. Le Pb peut être élué facilement à l’aide de différents agents complexants (Tableau 8).
Tableau 8 :
Rétention du Pb sur la résine Sr suite à l’élution avec différents agents complexants [74]
Agent complexant Concentration (M) pH k’pb
Acide sulfurique (H2SO4) 0,1 - 4,4 Acide acétique (CH3COOH) 0,1 - 48 Acide chlorhydrique (HCl) 0,2 - 163 Acétate d’ammonium (C2H7NO2) 0,1 7 - Tartrate d’ammonium ((NH4)2O6C4H4) 0,1 6,7 0,55
Citrate d’ammonium dibasique
(C6H14N2O7) 0,1 5,1 1,05
Oxalate d’ammonium
((NH4)2C2O4) 0,1 6,4 1,5
Puisque le mercure est un acide dit de type mou selon le concept acide-base de Pearson, il possède une affinité particulière pour des bases molles telles que le soufre (S). Différentes molécules contenant des atomes de soufre pouvant interagir avec le Hg (cystéine, mercaptoéthanol) ont été envisagées pour l'élution de ce dernier et seront discutées plus en détail dans le chapitre 6 de ce mémoire.
1.2.2. Résine Amsersep GT74
La résine Ambersep GT74 est une résine échangeuse d’ion constituée de groupements thiol (Figure 10) qui ont une grande affinité pour différent métaux : Hg > Ag > Cu > Pb > Cd > Ni > Co > Fe > Ca > Na.[83] Cette résine peut retenir jusqu’à 60 g de Hg par litre de résine,[84] permettant la liaison de différentes formes de Hg (Hg2+, CH
3Hg+, C2H5Hg+,
C6H5Hg+) (Figure 10).[85], [86] La résine Ambersep GT74 est commercialisée pour le
Figure 10 : Complexation entre la résine Ambersep GT74 et le Hg2+
Contrairement à la résine Sr, la résine Ambersep GT74 est stable à des pH acides et basiques[83]. Pelcova et coll. ont monté la capacité de la résine à retenir le mercure à des pH entre 2 et 10 avec de meilleures capacités à des pH entre 4 et 8, [87] ce qui pourrait permettre le chargement de notre échantillon dissout dans le TMAH sans changement de matrice. Toutefois, le Hg peut seulement être élué à l’aide d’acide chlorhydrique concentré, ce qui risque de complexifier la quantification des analytes à l’aide du capteur fluorescent en développement.
Les capacités d’extraction des résines cationiques peuvent être présentées sous forme d’équivalent. L’équivalent (eq) est une unité qui prend en considération la valence de l’élément étudié. Un mmol de Na+ équivaut à un mEq alors qu’un mmol de Ca2+ équivaut à
2 mEq.
n x v = eq Équation 4
Où n est le nombre de moles d’élément Où v est la valence de l’élément
Où eq est un équivalent
Comme le montre la Figure 11, la résine a une très bonne capacité pour le Hg à des pH peu acides, laissant penser qu’elle pourrait permettre la séparation du Hg et possiblement du plomb en milieux basique.
Figure 11 : Capacité de la résine Ambersep GT74 pour différents cations. [83]
1.3. Analyse
Suite à la mise en solution, la séparation et la préconcentration, l’analyse peut être effectuée. Dans le cadre de ce mémoire, les analyses ont été effectuées à l’aide d’un spectromètre de masse à plasma à couplage inductif (ICP-MS/MS) (Agilent, 8900 triple quadrupôle ICP-MS). Cet appareil permet l’analyse élémentaire des échantillons. Il discrimine chacun des atomes selon leur ratio masse sur charge, permettant ainsi de quantifier les éléments à l’aide de leurs isotopes.
L’appareil combine une source d’ionisation et un spectromètre de masse. Les échantillons liquides sont introduits à l’aide d’un nébuliseur qui permet la formation de gouttelettes qui seront désolvatées avant que la matrice soit décomposée et que les atomes puissent être ionisés.[88] La source d’ionisation dans le cas présent est un plasma à couplage inductif. Ce plasma est formé par une entrée d’argon (Ar) dans une torche en quartz avec un anneau de platine (Pt) qui ajoute des électrons au gaz.[88] La torche est dans une bobine de cuivre sur laquelle est appliquée une énergie radiofréquence, créant u champ magnétique qui accélère les électrons (Figure 12). Les électrons et les atomes neutres d’argon entrent en collision,
Cap ac ité d ’é q u ili b re m e q /L
![Figure 11 : Capacité de la résine Ambersep GT74 pour différents cations. [83]](https://thumb-eu.123doks.com/thumbv2/123doknet/3149803.89708/43.918.135.738.129.463/figure-capacité-résine-ambersep-gt-cations.webp)
![Figure 16 : Surface de réponse formée par la modélisation de l'ensemble des points expérimentaux du domaine d'étude[94]](https://thumb-eu.123doks.com/thumbv2/123doknet/3149803.89708/50.918.273.651.427.759/figure-surface-réponse-formée-modélisation-points-expérimentaux-domaine.webp)