Colonisation, par les insectes xylophages, du sapin
baumier défolié par la tordeuse des bourgeons de
l'épinette
Mémoire
Maud Régnier
Maîtrise en sciences forestières - avec mémoire
Maître ès sciences (M. Sc.)
Colonisation, par les insectes xylophages, du sapin
baumier défolié par la tordeuse des bourgeons de
l’épinette
Mémoire
Maud Régnier
Sous la direction de :
Éric Bauce, directeur de recherche
Christian Hébert, codirecteur de recherche
Résumé
Les objectifs de cette étude étaient d’établir la succession d’espèces saproxyliques chez le sapin baumier (Abies balsamea [L.] Mill.), défolié par la tordeuse des bourgeons de l’épinette (Choristoneura
fumiferana [Clemens]) et de déterminer le niveau seuil au-dessus duquel la colonisation survient
massivement. Nous avons également déterminé l’influence du niveau de défoliation sur la préférence et la réussite de ponte du longicorne noir (Monochamus scutellatus [Say]), espèce connue pour causer des dommages considérables dans le bois. Les niveaux de défoliation étudiés étaient léger, modéré, sévère et totale. Afin de caractériser la communauté d’insectes visitant les arbres sélectionnés, des pièges à interception fixés au tronc ont été utilisés. Une quarantaine d’espèces ont visité davantage les arbres présentant une défoliation sévère et totale comparativement aux autres niveaux. Par les procédés d’écorçage et la mise en élevage, de sections de tronc, on a mis en évidence une succession d’espèces qui ont colonisé les arbres affaiblis, soit Serropalpus substriatus, Pityokteines sparsus,
Monochamus scutellatus et Pissodes substriatus et les arbres morts, soit Sirex cyaneus et Trypodendron lineatum. Cette communauté d’insectes est connue pour former des galeries et
transporter des champignons qui peuvent accélérer la dégradation du bois. Par conséquent, il était nécessaire de déterminer le niveau de défoliation auquel les insectes répondaient le plus. Nous avons déterminé qu’à partir de 90 % de défoliation globale de l’arbre, les insectes secondaires colonisaient massivement les sapins. Nous n’avons pas établi de lien entre la présence des insectes et les concentrations de monoterpènes contenu dans l’écorce des sapins. Des tests de choix ont révélé une préférence d’oviposition, par les femelles de longicorne noir, pour les arbres sévèrement défoliés, mais les cicatrices d’oviposition ont été retrouvées sur tous les niveaux de défoliation avec un nombre plus élevé sur les arbres de défoliation légère. L’installation de pièges à interception semble être un outil efficace afin de prédire les dommages au bois et ainsi fournir des recommandations pour les plans spéciaux de récupération.
Table des matières
Résumé ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations ... viii
Remerciements ... x
Avant-propos ... xi
Introduction générale ... 1
Chapitre 1 Réponse des insectes secondaires aux sapins défoliés par la tordeuse des bourgeons de l’épinette, Choristoneura fumiferana ... 6
1.1 Résumé ... 6
1.2 Introduction ... 7
1.3 Matériels et méthodes ... 10
1.3.1 Secteur d’étude ... 10
1.3.2 Sélection du peuplement et estimation de la défoliation ... 10
1.3.3 Échantillonnage des insectes secondaires ... 11
1.3.4 Description de l’environnement immédiat des arbres étudiés ... 12
1.3.5 Analyse des monoterpènes de l’écorce ... 12
1.3.6 Analyses statistiques ... 13 1.4 Résultats ... 15 1.4.1 Taux de visite ... 15 1.4.2 Taux de colonisation ... 16 1.4.3 Seuil de défoliation ... 16 1.5 Discussion... 18 Remerciements ... 22 Références citées ... 23 Tableaux ... 28 Figures ... 31
Chapitre 2 Influence de la défoliation du sapin baumier par la tordeuse des bourgeons de l’épinette,
sur la préférence et la convenance de l’hôte du longicorne noir, Monochamus scutellatus ... 35
2.1 Résumé ... 35
2.2 Introduction ... 36
2.3 Matériels et méthodes ... 39
2.3.1 Sélection des arbres ... 39
2.3.2 Capture des femelles du longicorne noir ... 39
2.3.3 Tests de préférence et évaluation de la convenance de l’hôte ... 40
2.3.4 Analyses statistiques ... 41
2.4 Résultats ... 42
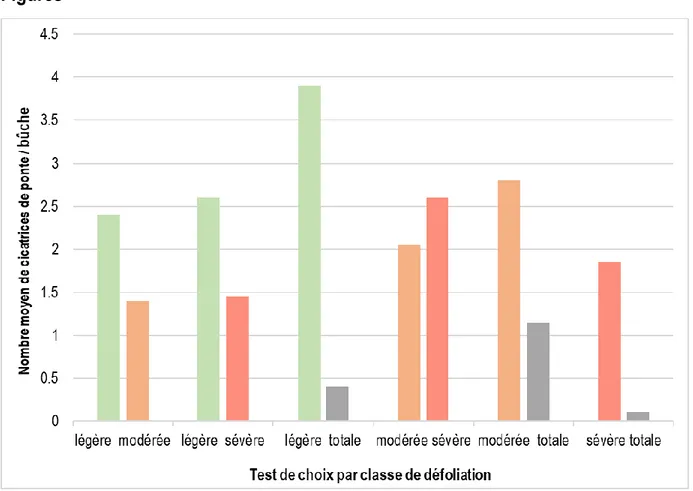
2.4.1 Cicatrices potentielles de ponte... 42
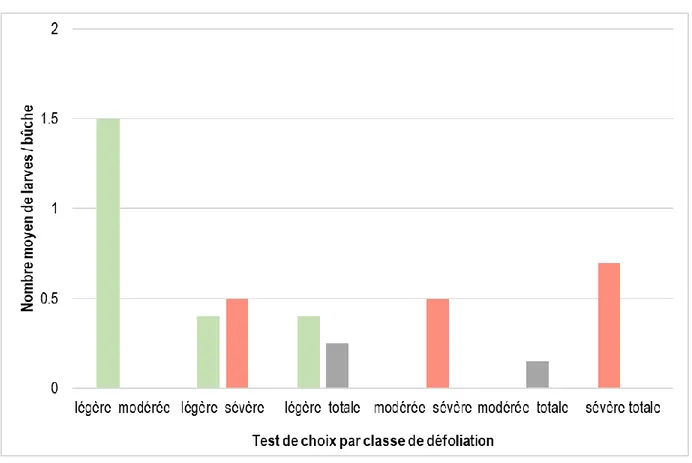
2.4.2 Préférence d’oviposition (abondance des larves) ... 42
2.5 Discussion... 43 Remerciements ... 45 Références citées ... 46 Tableaux ... 49 Figures ... 51 Conclusion générale ... 53
Les impacts économiques potentiels des espèces rencontrées ... 54
Bibliographie ... 57
Annexes ... 65
Annexe A. Pièges à interception fixés au tronc. ... 65
Annexe B. Prélèvement du disque d’écorce pour l’analyse des composés volatils (monoterpènes). ... 66
Annexe C. Peuplement d’étude (Côte-Nord) comprenant un gradient de défoliation, allant de léger à total, de la tordeuse des bourgeons de l’épinette. ... 67
Annexe D. Critères morphologiques pour distinguer mâle et femelle du longicorne noir, Monochamus scutellatus ... 68
Annexe E. Liste et abondance des insectes capturés à l’aide des pièges à interception selon le niveau de défoliation. ... 69
Liste des tableaux
Tableau 1.1 Abondance totale des insectes secondaires dominants capturés dans les pièges à
interception selon le niveau de défoliation des sapins baumiers.
Tableau 1.2 Abondance totale des espèces secondaires colonisant le sapin baumier défolié par la
TBE selon le niveau de défoliation.
Tableau 1.3 Concentration moyenne des monoterpènes selon le niveau de défoliation des sapins
baumiers
Tableau 2.1 Comparaison de l’abondance moyenne des cicatrices potentielles de ponte des femelles
de Monochamus scutellatus lorsqu’exposées pendant 48 heures à un choix entre deux bûches de sapin baumier provenant d’arbres défoliés par la TBE et comparaison de l’effet du traitement à l’aide d’un test t de Student apparié (α = 0.05).
Tableau 2.2 Comparaison de l’abondance moyenne des larves de Monochamus scutellatus dans des
bûches de sapin baumier lorsqu’exposées pendant 48 heures à un choix entre deux bûches de sapin baumier provenant d’arbres défoliés par la TBE et comparaison de l’effet du traitement à l’aide d’un test t de Student apparié (α = 0.05).
Liste des figures
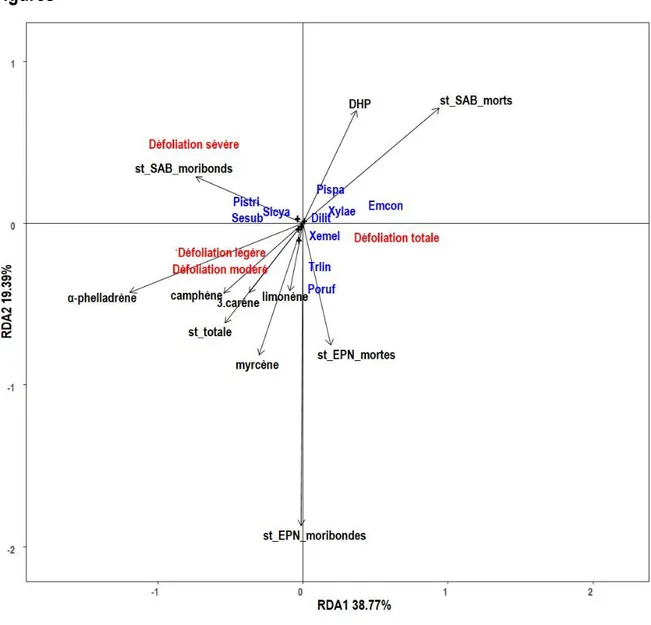
Figure 1.1 Analyse canonique de redondance (RDA) (échelle =2) sur les assemblages d’insectes
secondaires capturés à l’aide de pièges à interception dans le peuplement de sapins baumiers défolié par la tordeuse des bourgeons de l’épinette et les variables environnementales. Les espèces de coléoptères ayant un score < 0,1 sont marquées d’un symbole + et les espèces ayant un score > 0,1 sont identifiées sur leurs coordonnées de score par un code d’espèce. Les codes sont les suivants : Dilit (Diluta liturata), Emcon (Emmesa connectens), Poruf (Polygraphus rufipennis), Pispa (Pityokteines
sparsus), Pistri (Pissodes striatulus), Sesub (Serropalpus substriatus), Sicya (Sirex cyaneus), Trlin
(Trypodendron lineatum), Xemel (Xeris melancholicus), Xylae (Xylita laevigata). Les vecteurs fléchés représentent les variables explicatives continues : DHP (diamètre hauteur de poitrine), st_EPN_moribondes (surface terrière d’épinettes noires moribondes), st_EPN_mortes (surface terrière d’épinettes noires mortes), st_SAB_morts (surface terrière de sapins baumiers morts), st_SAB_moribonds (surface terrière de sapins baumiers moribonds), st_totale (surface terrière totale en mètre carré par hectare). Les autres nominations sont les monoterpènes : α.phelladrène, camphène, 3.carène, limonène et myrcène.
Figure 1.2 Analyse canonique de redondance (RDA) (échelle =2) sur les assemblages d’insectes
secondaires issus des écorçages et de l’émergence des bûches de sapins baumiers défoliés par la tordeuse des bourgeons de l’épinette et les variables environnementales. Les espèces de coléoptères ayant un score < 0,1 sont marquées d’un symbole + et les espèces ayant un score > 0,1 sont identifiées sur leurs coordonnées de score par un code d’espèce. Les codes sont les suivants : Moscu (Monochamus scutellatus), Pispa (Pityokteines sparsus), Pistri (Pissodes striatulus), Sesub (Serropalpus substriatus), Trlin (Trypodendron lineatum). Les vecteurs fléchés représentent les variables explicatives continues : DHP (diamètre hauteur de poitrine), st_EPN_moribondes (surface terrière d’épinettes noires moribondes), st_EPN_mortes (surface terrière d’épinettes noires mortes), st_SAB_morts (surface terrière de sapins baumiers morts), st_SAB_moribonds (surface terrière de sapins baumiers moribonds), st_totale (surface terrière totale en mètre carré par hectare). Les autres nominations sont les monoterpènes : α.phelladrène, camphène, 3.carène, limonène et myrcène.
Figure 1.3 Abondance des différents insectes secondaires dans les écorçages et les cages
d’émergences en fonction de la défoliation globale de la couronne supérieure (régressions binomiales(GLMM)).
Figure 1.4 Abondance des différents insectes secondaires dans les pièges à interception en fonction
de la défoliation globale de la couronne supérieure (régressions binomiales(GLMM)).
Figure 2.1 Nombre moyen par bûche des cicatrices potentielles de ponte des femelles de
Monochamus scutellatus lorsqu’exposées pendant 48 heures à un choix entre deux bûches de sapin baumier provenant d’arbres défoliés par la TBE.
Figure 2.2 Nombre moyen par bûche des larves de femelles de Monochamus scutellatus
lorsqu’exposées pendant 48 heures à un choix entre deux bûches de sapin baumier provenant d’arbres défoliés par la TBE.
Liste des abréviations
CFL : Centre de foresterie des LaurentidesDHP : Diamètre à Hauteur de Poitrine (1,3 m de la plus haute racine) iFor : Consortium de recherche sur les insectes forestiers
MFFP : Ministère des Forêts, de la Faune et des Parcs du Québec MRN : Ministère des Ressources naturelles
RNCan : Ressources Naturelles Canada SCF : Service canadien des forêts
SOPFIM : Société de Protection des Forêts contre les Insectes et Maladies TBE : Tordeuse des bourgeons de l’épinette
« Le désir d’apprendre est capable de tout »
Jean-Henri Fabre Scène de la vie des insectes (1933)
Remerciements
Merci Christian de m’avoir ouvert, de nouveau, les portes de la recherche en entomologie forestière, de m’avoir donné la possibilité de m’épanouir au long de ces deux années dans un domaine qui me tient tant à cœur et de m’avoir soutenue, à ta manière, jusqu’au bout du processus qu’est la maîtrise. Il y a quelques années, tu m’avais donné l’occasion de finaliser mes études au sein de ton laboratoire. Six mois de découvertes, d’émerveillements et de générosités se sont écoulés et comme les Québécois le disent si bien « je suis tombée en amour ». Et oui, quelques années plus tard, je suis revenu vers toi, non loin d’imaginer reprendre mes études, j’ai accepté cette maîtrise, voyant pour moi une réelle chance de travailler de manière plus concrète dans la recherche. Finalement, cette opportunité m’a offert bien plus qu’un diplôme. Ma vie est dorénavant ici et c’est avec fierté que je termine ma maîtrise en cette fin d’année 2019. J’ai hâte de voir ce que l’avenir me réserve. C’est avec le sourire que je relirai ce mémoire me remémorant les bons souvenirs en tant qu’étudiante. Merci encore Christian.
Olivier, il y a cinq ans à peine, je quittais le Québec en te souhaitant de tout cœur d’intégrer de manière permanente le Centre de Foresterie des Laurentides et dorénavant c’est avec un immense respect et un amour sincère que je t’épaule au quotidien. Cette maîtrise, je ne l’ai pas réalisée seule. Tu as été, pour moi, un soutien permanent et une écoute indispensable. Tes encouragements et tes conseils m’ont rendue forte et je suis fière du chemin que nous avons mené à deux. Merci d’être là pour moi.
Rien de cela n’aurait été possible sans les soutiens et les encouragements quotidiens de ma famille. Merci mes parents, pour tout ce que vous m’avez apporté et donné. Je ne serais certainement pas là aujourd’hui sans vous. Je n’ai pas de mots assez forts pour décrire ma gratitude que j’ai à votre égard, merci infiniment. Merci ma sœur, pour les petits messages chaleureux qui m’ont donné du baume au cœur durant ces deux années. Merci sincèrement belle-famille, pour votre réconfort et votre appui, vous comptez beaucoup pour moi.
Bien entendu, merci chers collègues, Jean Michel, Olivier, Anne, Fanny. On sait tous qu’une bonne ambiance de travail est nécessaire afin d’avancer dans la bonne voie et c’est vraiment agréable de vous côtoyer au quotidien et de pouvoir compter sur vous. Merci Alain et toute ton équipe et Sébastien pour votre écoute et votre efficacité de réactions face aux aléas. Merci Richard, pour ton jugement et l’amélioration sur la rédaction de ce mémoire. Merci aux étudiants de l’Université Laval, Ioan, Sandrine, Jonathan et Raphaël pour votre aide indispensable de terrain. Merci Morgane et Pierrick, mes deux acolytes, pour votre bonne humeur et votre soutien continu.
Je voudrais terminer ces remerciements pour mon directeur de recherche, Éric, de m’avoir apporté une aide financière durant ma maîtrise et une liberté appréciée.
Avant-propos
Ce mémoire de maîtrise est constitué de deux chapitres, « Réponse des insectes secondaires aux sapins défoliés par la tordeuse des bourgeons de l’épinette, Choristoneura fumiferana » et « Influence de la défoliation du sapin baumier par la tordeuse des bourgeons de l’épinette, sur la préférence et la convenance de l’hôte du longicorne noir, Monochamus scutellatus ». Ces deux chapitres rédigés en français et sous la forme d’articles scientifiques sont destinés à être publiés dans des journaux scientifiques pour l’année 2020. L’étudiante a le statut de premier auteur des articles et le directeur de recherche, le codirecteur de recherche ainsi que les intervenants actifs dans la maîtrise de l’étudiante ont le statut de coauteurs. Le corps du mémoire comprend une introduction, deux chapitres et une conclusion. L’entièreté de l’installation des dispositifs d’échantillonnage, les mesures de l’ensemble des variables environnementales et la partie laboratoire comme l’évaluation du niveau de défoliation des arbres, l’analyse des monoterpènes, la description de l’environnement autour de chaque arbre, l’écorçage des bûches, la détermination des spécimens à l’espèce ont été établis et mis en place par l’étudiante ou sous sa supervision. Une aide a été apportée par l’embauche d’auxiliaires de recherche, le personnel du CFL et le personnel de la SOPFIM. Les deux chapitres ont été écrits entièrement par l’étudiante encadrée et soutenue par les coauteurs. Cette étude a été financée par le consortium de recherche sur les insectes forestiers (iFor) sous des contributions du Conseil de Recherches en Sciences naturelles et Génie du Canada (CRSNG), du Service Canadien des Forêts (SCF-RNCan) et de la Société de Protection des Forêts contre les Insectes et Maladies (SOPFIM) et des compagnies Résolu, Arbec et Cedrico.
Introduction générale
Les forêts et le principe de gestion durable
Le territoire forestier canadien joue un rôle de premier plan dans le fragile équilibre planétaire comptant pour environ 10 % des forêts du globe et renfermant près de 20 % de l’eau douce de la planète (RNCan, 2018). Les forêts canadiennes jouent un rôle primordial d’un point de vue écologique, culturel et économique. Elles représentent 35 % du territoire canadien, soit 347 millions d’hectares et sont essentielles pour le stockage du carbone, la purification de l’air et la régularisation du climat (RNCan, 2018). En plus des avantages écologiques, les forêts du Canada créent des possibilités de développement économique. Si le bois d’œuvre représente une part importante des ressources économiques du pays, les produits forestiers non ligneux (sirop d’érable, bleuets, gibiers, etc.) constituent également un apport important dans l’économie (RNCan, 2018). Afin de préserver tous les bénéfices tirés des forêts, le Canada s’est engagé sur le plan forestier en devenant membre du Processus de Montréal en 1994 à la suite de l’adoption à Rio des Principes relatifs aux forêts. Les pays membres du Processus de Montréal ont recours à un ensemble de critères communs et d’indicateurs basés sur la science pour mesurer le progrès effectué vers la conservation et l’aménagement durable des forêts boréales et tempérées de la planète (RNCan, 2018). Avec l’adoption de la Commission d’étude sur la gestion de la forêt publique québécoise (Commission Coulombe), le concept de l’aménagement écosystémique a été développé en réponse aux préoccupations sur la gestion environnementale des forêts et d’assurer le maintien de la biodiversité et la viabilité/pérennité des écosystèmes (Grenon et al., 2010). L’aménagement écosystémique est devenu un outil efficace pour concilier la vaste gamme des valeurs associées aux forêts.
Perturbation naturelle : les épidémies de la tordeuse des bourgeons de l’épinette
Le principe d’aménagement écosystémique est une démarche inspirée de la dynamique des forêts naturelles tout en conciliant les activités économiques comme la récolte et la production de bois. Afin d’établir des mesures d’aménagement durable adéquates, il est essentiel de comprendre les différentes perturbations qui régulent la dynamique des forêts. Le feu est considéré comme la perturbation naturelle dominante en Amérique du Nord (Flannigan et al., 2005, Gauthier et Vaillancourt, 2008, Nappi et al., 2010) hormis dans l’est où les épidémies d’insectes sont les moteurs de la dynamique de la forêt boréale (MacLean, 1980). L’humidité étant plus élevée dans cette région,
l’intervalle entre les feux est supérieur à la longévité des arbres (Kneeshaw et Gauthier, 2003). Le sapin baumier, une essence adaptée aux régions où les feux sont beaucoup moins fréquents, y est relativement abondant. Cependant, le sapin baumier fait face à un ennemi naturel ; la tordeuse des bourgeons de l’épinette (TBE) (Blais, 1983). La prédominance du sapin, à l’échelle du paysage, a engendré des épisodes épidémiques importants. À noter que les zones touchées au Canada par des insectes forestiers, en 2016, étaient plus nombreuses, représentant 4.5 % soit 15 millions d’hectares, que les feux de forêt avec 3 millions d’hectares (RNCan, 2018). Les épidémies de TBE se produisent de façon périodique à tous les 25 à 40 ans (Royama et al., 2005). Les chenilles de ce lépidoptère indigène en Amérique du Nord (Miller, 1977), causent des dommages par défoliation en s’alimentant du jeune feuillage annuel. Une défoliation grave et répétée entraîne la mortalité de la quasi-totalité des arbres (MacLean, 1980). Ces épidémies façonnent la composition, la structure d’âge et l’organisation spatiale du paysage. L’arrangement de ces attributs conditionne, à son tour, l’habitat des diverses espèces fauniques, floristiques et autres qui occupent le territoire forestier (MFFP, 2014). Elles participent également au rajeunissement de la forêt, la remise en circulation des éléments nutritifs et la régénération de certaines essences ligneuses (Coulombe et al., 2004). Malgré les bénéfices écologiques de ces épidémies, les impacts économiques dus à la perte de la matière ligneuse sont considérables et le taux de mortalité observé peut exiger une intervention. Le Ministère des Forêts, de la Faune et des Parcs (MFFP) met donc en place des plans spéciaux d’aménagement. Le Baccillus Thurigiensis var kurstaki (Btk), un insecticide biologique, est utilisé par pulvérisation aérienne afin de
limiter les pertes ligneuses de sapins baumiers et de garder les arbres vivants jusqu’à la fin de l’épidémie. Cependant, des plans de récupération sont nécessaires dès lors que la proportion du volume à récolter, constitué d’arbres morts, commence à être significative (de l’ordre de 10 %) (Hébert et Bélanger, 2014). Selon le Règlement sur les normes d’intervention dans les forêts du domaine de l’État (RNI), une coupe de récupération conduit à l’abattage ou la récolte des tiges d’un peuplement d’arbres détériorés à la suite de désastres naturels telle qu’une épidémie d’insectes (MFFP, 2014). D’après un extrait de la Loi sur l’aménagement durable du territoire forestier de l’article 60:
« En cas de perturbations d’origine naturelle ou anthropique causant une destruction importante de massifs forestiers dans une aire forestière […], le ministre peut […] préparer un plan d’aménagement spécial en vue d’assurer la récupération des bois et la réalisation des traitements sylvicoles appropriés et appliquer ce plan, pour la période et aux conditions qui y sont prévues ».
Les interventions du Ministère, en matière de protection des forêts, contre les perturbations naturelles visent à protéger les volumes ligneux attribués aux entreprises de transformation du bois. Cette démarche constitue donc une étape vers un modèle de développement durable en conciliant l’aspect environnemental que représente l’utilité du bois mort et/ou moribond au sein des peuplements défoliés ainsi que l’aspect économique dû aux pertes de la matière ligneuse. Après l’épidémie de 1910 à 1920, plus de 720 millions de m3 de sapin baumier et d’épinettes, soit 40 à 50 % du volume des arbres hôtes
présents, avaient été tués dans l’est du Canada (Swaine et al., 1924).
Rôle écologique du bois mort
Les superficies touchées par la TBE varient annuellement, mais représentent toujours une contribution majeure à la disponibilité du bois mort. La présence de bois mort dans les forêts aménagées était, autrefois, considérée comme un gage de mauvaise gestion, comme un gaspillage de ressources. Aujourd’hui, sa valeur écologique au sein des écosystèmes forestiers n’est plus à démontrer (Angers, 2009). Les premiers travaux concernant le bois mort, sa dynamique et ses fonctions ont essentiellement été réalisés dans le Nord-Ouest américain et en Scandinavie. Le bois mort constitue un habitat, un abri ou une source d’alimentation nécessaire à la survie d’une multitude d’organismes (Angers, 2009). Au Québec, on compte plus de 62 espèces de vertébrés, utilisatrices de bois mort (Darveau et Desrochers, 2001). De nombreux oiseaux, tels que les pics, creusent des cavités dans les arbres morts (Fan et al., 2003) qui sont utilisées par la suite par de nombreuses espèces telles que des mammifères ou d’autres oiseaux (Darveau et Desrochers, 2001). La plupart des insectes saproxyliques sont dépendants des arbres moribonds ou morts dans leur cycle de développement (Speight, 1989). Ces insectes servent également de ressources alimentaires pour de nombreuses espèces. Plusieurs vertébrés tirent avantage des débris ligneux au sol, soit comme couvert pour déjouer les prédateurs (Loeb, 1999) soit pour se nourrir d’insectes ou de végétaux qui s’y trouvent. On dénombre de nombreux autres groupes d’espèces utilisatrices du bois mort comme les amphibiens (Darveau et Desrochers, 2001), la flore (Miller et al., 2002) et les champignons (Komonen, 2003). Il est particulièrement important de noter que chaque utilisateur de bois mort est associé à des caractéristiques qui lui sont propres (espèce, statut, stade de décomposition et taille) (Jonsson et al., 2005, Saint‐Germain et al., 2007). Au fur et à mesure de leur décomposition, les caractéristiques des débris ligneux évoluent. Éventuellement, ils finissent par s’incorporer avec la matière organique du sol où ils contribuent à la rétention en eau et en nutriments via leur propre capacité à absorber l’eau et
leur rôle dans le développement et le maintien de la structure du sol (Crête, 2004). Une étude a montré une relation significative entre la quantité de bois mort enfoui et la capacité du sol à retenir les nutriments (Brais et al., 2002). Le bois mort représente, également, un substrat qui permet la fixation de l’azote et le stockage de grandes quantités d’eau (Angers, 2009). Par l’entremise de la photosynthèse, les arbres captent le CO² de l’atmosphère et en accumulent une fraction, sous forme de carbone, dans leurs diverses structures (Waring et Schlesinger, 1985). Ces structures, qui forment le réservoir de carbone de la biomasse vivante, alimentent directement le réservoir de carbone du bois mort. La décomposition de celui-ci entraîne l’émission d’une fraction importante du carbone qu’il contient vers l’atmosphère alors que le reste est transféré dans les réservoirs de carbone des sols organiques et minéraux (Kurz et al., 1993).
Les insectes saproxyliques et les épidémies de la TBE
Au sein d’un peuplement perturbé par la TBE, il existe un patron de mortalité d’arbres caractérisé par leur taille, leur statut et leur degré de décomposition divers (Angers, 2009). Ces patrons de mortalité engendrent des conditions favorables à une colonisation par les espèces saproxyliques. Les insectes saproxyliques sont les premiers à profiter de cette abondance de ressources, particulièrement pour ceux qui captent rapidement les composés volatils émis par les arbres dus aux stress de la défoliation de la TBE et ceux qui possèdent une capacité de déplacement sur de longues distances. Par définition, les espèces saproxyliques dites secondaires utilisent le bois moribond ou mort pendant au moins une partie de leur cycle vital ou d’autres organismes saproxyliques présents dans le bois comme les champignons ou les bactéries (Speight, 1989). Les études portant sur les espèces saproxyliques colonisant le bois mort dans d’autres perturbations telles que les feux de forêt (Saint-Germain et al., 2004, Boucher et al., 2012, Bélanger et al., 2013) et les épidémies de l’arpenteuse de la pruche (Béland et al., 2019) ont mis en lumière la présence d’une succession d’espèces colonisant de manière différente le bois mort selon les conditions de mortalité des arbres. Par conséquent, les communautés d’espèces observées selon la perturbation ne sont donc pas les mêmes. En contexte d’épidémie de TBE, ces informations sont nécessaires afin d’optimiser les coupes de récupération et ainsi prévoir les dommages potentiels des espèces saproxyliques. En effet, certaines espèces sont caractérisées comme étant problématiques par les galeries qu’elles forment et le cortège de champignons qu’elles transportent dans le bois. Le longicorne noir, Monochamus scutellatus, est connu pour coloniser les arbres affaiblis, moribonds ou récemment morts (Wilson, 1962, Martineau, 1985). Cet insecte est
devenu une espèce nuisible dans la forêt boréale de l’est de l’Amérique du Nord principalement après les feux de forêt (Gardiner, 1957, Safranyik et Raske, 1970, Raske, 1972) où son abondance peut atteindre des niveaux importants. À l’état larvaire, le longicorne noir creuse des galeries dans le bois moribond ou mort et diminue considérablement la qualité de la matière ligneuse. De plus, il peut favoriser la contamination des arbres par des champignons responsables de la dégradation du bois. Par conséquent, l’objectif principal de cette étude est d’améliorer les connaissances des mécanismes de colonisation par les insectes saproxyliques du sapin baumier au sein d’un peuplement défolié par la TBE afin d’optimiser les plans de récupération. Des études antérieures ont révélé la présence d’insectes saproxyliques colonisant les arbres affaiblis et morts par la TBE (Swaine et al., 1924, Belyea, 1952). Cependant, aucune étude n’a révélé l’impact de la défoliation de la TBE et la succession d’espèce colonisant le sapin baumier défolié. Les objectifs de cette étude sont donc les suivants : Objectif 1 : établir la succession d’espèces saproxyliques chez le sapin baumier défolié et déterminer le niveau de défoliation seuil au-dessus duquel la colonisation survient massivement.
Objectif 2 : de déterminer l’influence du niveau de défoliation sur la préférence et la réussite de ponte du longicorne noir Monochamus scutellatus
Chapitre 1 Réponse des insectes secondaires aux
sapins défoliés par la tordeuse des bourgeons de
l’épinette, Choristoneura fumiferana
Maud Régnier1, Éric Bauce1 et Christian Hébert2
1Université Laval, Faculté de foresterie, de géographie et de géomatique, Pavillon Abitibi — Price,
Québec, Québec, G1K 7P4, Canada
2Ressources naturelles Canada, Service Canadien des Forêts, Centre de foresterie des Laurentides,
1055 rue du P.E.P.S., C.P. 10380, Stn. Sainte-Foy, Québec, Québec, G1V 4C7, Canada
1.1 Résumé
Les défoliations répétées de la tordeuse des bourgeons de l’épinette (TBE) sur le sapin baumier entraînent une lente détérioration de l’arbre qui se termine, après quelques années, par sa mort. Une colonisation par les insectes secondaires est alors observée, mais ce processus est encore peu documenté. Il s’agit pourtant d’une information cruciale pour optimiser les plans de récupération. Six espèces ont été détectées en abondance colonisant les arbres de défoliation sévère et totale,
Pityokteines sparsus, Serropalpus substriatus, Sirex cyaneus, Monochamus scutellatus, Trypodendron lineatum et Pissodes striatulus. Ces espèces entraînent une dégradation du bois par la formation de
galeries et la propagation de champignons, mais elles peuvent être détectées par l’installation de pièges à interception fixés au tronc d’arbres défoliés. L’abondance de ces insectes est liée à une colonisation active des tissus ligneux et exprime une succession d’espèces associées à l’état de dégradation des arbres. Les pièges à interception constituent donc un outil additionnel pour mieux prédire les dommages au bois et aider les aménagistes dans l’élaboration des plans spéciaux de récupération.
Mots-clés : épidémie de la tordeuse des bourgeons de l’épinette, défoliation, sapin baumier, insectes
1.2 Introduction
En Amérique du Nord, la forêt boréale est affectée par plusieurs perturbations naturelles majeures. Les feux de forêt prédominent dans l’ouest du territoire (Payette, 1992, Stocks et al., 2002, Flannigan et al., 2005) alors que dans l’est, ce sont les épidémies d’insectes et les chablis qui sont les moteurs de la dynamique forestière (Batzer, 1973, Baskerville et MacLean, 1979, MacLean, 1984, Piene, 1989, Gauthier et al., 2010). Le climat plus humide de l’est diminue l’inflammabilité et favorise la présence
du sapin baumier, essence commune dans les régions où les feux sont moins fréquents (Kneeshaw et Gauthier, 2003, Coulombe et al., 2004). Le paysage forestier de l’est est d’ailleurs dominé par des peuplements de sapins dans ce qui constitue le domaine de la sapinière à bouleau blanc. Le sapin baumier est principalement régulé par les infestations de la tordeuse des bourgeons de l’épinette (Choristoneura fumiferana (Clemens)) (Blais, 1983).
Cet insecte, indigène en Amérique du Nord, cause des dommages par défoliation aux sapins et épinettes en s’alimentant de bourgeons, de fleurs et de pousses annuelles (Miller, 1977). Ses populations augmentent graduellement pour atteindre un niveau épidémique tous les 30 ans ; les pullulations durent généralement de 15 à 20 ans à l’échelle régionale (Royama, 1984, Jardon et al., 2003). Trois importantes infestations de la TBE se sont produites en Amérique du Nord au cours du XXe siècle, soit vers 1910, 1940 et 1970 (Blais, 1983). Après l’épidémie de 1910 à 1920, plus de 720 millions de m3 de sapin baumier et d’épinette, soit 40 à 50 % du volume des arbres hôtes présents,
avaient été tués dans l’est du Canada (Swaine et Craighead, 1924).Au Québec, la dernière épidémie (1967-1992) a affecté 35 millions d’hectares de forêts et aurait entraîné des pertes par mortalité estimées entre 139 et 238 millions de mètres cubes d’épinettes et de sapins (Boulet et al., 1996). L’épidémie actuellement en cours sur la Côte-Nord a commencé en 2006 et elle s’est étendue dans plusieurs autres régions de l’est du Québec (MFFP, 2019).
En période épidémique, une récurrence de la défoliation du feuillage de l’année courante peut entraîner la mortalité des arbres hôtes (MacLean et Ostaff, 1989). En général, la mortalité du sapin baumier débute après quatre à cinq années de défoliation sévère. Cependant, une épidémie de TBE n’entraîne pas nécessairement une mortalité complète des arbres. Les individus partiellement défoliés survivent à l’épidémie, mais subissent une diminution de croissance (MacLean, 1984). Les épidémies de TBE génèrent donc, dans un même peuplement, d’énormes quantités de bois morts ainsi que des arbres moribonds (MacLean, 1980, Morin, 1994). Les superficies touchées par la TBE au Québec atteignent
9 608 488 ha et dans la région de la Côte-Nord, les superficies touchées ont augmenté de 14 % en 2019 (MFFP, 2019). La défoliation sévère réduit l’augmentation annuelle de volume de bois de 20 % après un an de défoliation (Piene, 1980) et de 25 à 50 % après deux ans de défoliation (Batzer, 1973, Baskerville et MacLean, 1979, Piene, 1980). Les coupes de récupération sont donc importantes et souvent accélérées dans les aires dévastées par cet insecte (Lindenmayer et al., 2012). De plus, les sapinières à bouleau blanc sont parmi les plus productives dans la province de Québec (MRNF, 1994). Cependant, les arbres moribonds et morts doivent être récupérés rapidement avant qu’ils ne soient attaqués par les insectes xylophages pouvant causer des dommages structuraux au bois réduisant considérablement sa valeur marchande (Raske, 1972, Fettig et al., 2007).
En effet, cette ressource est l’habitat convoité par les espèces phloéophages et xylophages. En Europe, la foresterie industrielle a entraîné un déclin important de la diversité des espèces xylophages et la disparition de certaines espèces (Heliövaara et Väisänen, 1984). Au Canada, la recherche sur les insectes saproxyliques [c.-à-d. ceux qui dépendent, pendant au moins une partie de leur cycle de vie, du bois mort ou mourant des arbres moribonds ou morts (Speight, 1989)] a fourni des connaissances utiles sur les réponses des assemblages d’espèces aux variations des facteurs environnementaux résultant des perturbations naturelles et anthropiques (Langor et al., 2008).
Les insectes colonisant les arbres défoliés par la TBE sont étudiés depuis des décennies. L’étude de Swaine et al. (1924) rapporte les espèces d’importances majeures et mineures et leur impact sur le bois défolié par la TBE. Malgré l’ancienneté de cette étude, les espèces décrites et les informations détaillées sur leur caractéristique sont toujours valides. Par la suite, Belyea (1952) a étudié la colonisation d’espèces secondaires du sapin baumier défolié par la TBE en Ontario. Les résultats indiquent qu’une dizaine espèces d’insectes vivant dans l’écorce et le bois ont été trouvées dans les sapins baumiers sévèrement défoliés et récemment morts. De ce nombre, seulement deux espèces ont été abondantes, Monochamus scutellatus (Coleoptera : Cerambycidae) et Pityokteines sparsus (Coleoptera : Curculionidae), mais elles n’auraient eu aucun impact sur la mortalité des arbres. Plus récemment, l’étude de Barnouin (2005) a étudié les communautés de coléoptères saproxyliques d’une sapinière perturbée par la TBE exempte de récupération avec celles d’une sapinière ancienne et d’une coupe de récupération. Il a rapporté que la communauté d’espèces dans les sapinières défoliées par la TBE avec absence de traitement sylvicole et les sapinières anciennes étaient similaires. Ces différentes études apportent des éléments pertinents sur la diversité des espèces colonisant le sapin baumier défolié par la TBE, cependant, aucune d’entre elles ne précise le niveau de défoliation requis
pour déclencher la colonisation et l’influence de la défoliation sur la colonisation par les insectes secondaires.
La présente étude vise à améliorer notre connaissance des processus de colonisation par les insectes secondaires d’arbres affectés par les défoliations de la TBE, pour mieux cibler les peuplements devant faire l’objet d’opérations de récupération et réduire les pertes économiques qui en résultent. Les objectifs sont les suivants : 1) mesurer la réponse des insectes secondaires visitant les arbres, à l’aide de pièges à interception, dans un peuplement défolié par la TBE, 2) déterminer s’il existe une succession d’espèces d’insectes secondaires associés à l’état de dégradation du sapin baumier défolié par la TBE et 3) déterminer le seuil de défoliation qui déclenche la colonisation par ces insectes.
1.3 Matériels et méthodes
1.3.1 Secteur d’étude
Le secteur d’étude se situe dans la région de la Côte-Nord au Québec, Canada à proximité de la ville de Baie-Comeau (49°17'14'' N, 68°09'10'' W). Ce secteur appartient au domaine bioclimatique de la sapinière à bouleau blanc de l’Est dans la sous-zone de la forêt boréale continue (Thibault, 1985). Le paysage forestier est largement dominé par des peuplements conifériens de sapin baumier, Abies
balsamea (L.) Mill., où le bouleau à papier Betula papyrifera Marsh, est la principale espèce compagne.
L’épinette blanche, Picea glauca (Moench) Voss., et l’épinette noire, Picea mariana (Mill.) sont également bien représentées. Les espèces résineuses sont hautement susceptibles à la défoliation de la tordeuse des bourgeons de l’épinette (TBE) (MacLean, 1980, Bergeron et al., 1995, MacLean et Ostaff, 1989). L’épidémie a débuté en 2006 dans la région de la Côte-Nord et elle s’étend sur une superficie de 3,6 M ha de forêts résineuses (MFFP, 2019).
1.3.2 Sélection du peuplement et estimation de la défoliation
Le peuplement étudié a été choisi lors d’une visite terrain au début de juin 2018. Il comportait une densité élevée de sapins baumiers affectés par la TBE, la défoliation globale des arbres variant entre 20 et 100 %. Les arbres retenus devaient posséder un diamètre à hauteur de poitrine (DHP, mesuré à 1,3 m de hauteur) supérieur à 9 cm (taille commerciale au Québec) et être espacés d’au moins 12 m afin d’éviter un chevauchement dans la description forestière autour des arbres étudiés. Au total, 100 sapins baumiers, répartis selon 4 classes de défoliation, ont été sélectionnés sur l’ensemble du peuplement pour l’échantillonnage des insectes secondaires. La défoliation globale des arbres a été estimée aux jumelles par deux observateurs en juin 2018. Les sapins sélectionnés appartenaient aux classes de défoliation suivantes : 1) défoliation légère (20 sapins <35 %) ; 2) défoliation modérée (20 sapins entre 35 et 69 %) ; 3) défoliation sévère (20 sapins entre 70 et 99 %) et 4) une défoliation totale qui correspondait à 100 % du feuillage (40 sapins). Les classes de défoliation correspondent à la perte de feuillage dans le houppier des arbres, causée par l’activité récurrente de la TBE sur plusieurs années (MFFP, 2019). La défoliation globale a été réestimée à l’automne 2018 en utilisant la méthode d’estimation de la couronne supérieure (Béland, 2017). Chaque arbre échantillonné a alors été classé individuellement comme défolié de 0 à 100 %, selon dix classes de défoliation de 10 %.
1.3.3 Échantillonnage des insectes secondaires
Les taux de visite des insectes secondaires aux arbres sélectionnés ont été déterminés à l’aide de pièges à interception fixés au tronc appelé « Trunk Window Trap » (TWT) (Kaila, 1993). Les pièges étaient constitués d’un panneau rectangulaire en plexiglas® (15 x 40 cm) vissé perpendiculairement le long du tronc. Un entonnoir de 15 cm a été vissé sous le panneau avec l’aide de supports métalliques. Un bocal collecteur (500 mL), muni d’une ouverture recouverte d’une mousseline (trop-plein), a été fixé sous l’entonnoir et rempli de 250 mL de propylène glycol à 80 %. Deux pièges à interception ont été installés à la hauteur du DHP sur chaque arbre et positionnés respectivement des côtés est et ouest de l’arbre (Annexe 1). L’installation a été effectuée durant la deuxième semaine de juin et la récolte des échantillons a débuté la semaine suivante. Les échantillons ont été récupérés chaque semaine entre le 14 juin et le 23 août 2018 et ont été entreposés dans une chambre froide (4°C) au Centre de foresterie des Laurentides (CFL) du Service Canadien des forêts de Ressources naturelles Canada (SCF-RNCan) à Québec, jusqu’au moment du tri. À l’issue du tri, les spécimens ont été identifiés à l’espèce, certains individus ont été montés pour la collection de référence et les autres conservés dans de l’alcool éthylique à 70 %. Les familles d’insectes associées au sapin baumier défolié par la TBE dans les travaux de Belyea (1952) ont été privilégiées pour l’étude : les Curculionidae, les Melandryidae, les Cerambycidae et les Siricidae. Les 29 et 30 octobre 2018, un poinçon de 10 mm de diamètre (n° 149 Arch 1025 ; CS Osborne & Co., Harrison, NJ) a été utilisé pour retirer un disque d’écorce à la hauteur du DHP, au même emplacement que l’entonnoir du piège à interception (Annexe 2). Chaque disque d’écorce a été emballé dans une pochette plastique étiquetée individuellement et immédiatement placée dans un congélateur à -40 °C localisés dans un bâtiment de la SOPFIM à proximité. Les échantillons ont ensuite été transportés jusqu’au CFL à Québec et placés dans un autre congélateur à -40 °C. Après le prélèvement de disques d’écorce, les arbres ont été abattus et deux bûches de 40 cm de long ont été prélevées une au-dessus et l’autre en dessous du DHP pour chaque arbre afin de mesurer la colonisation des arbres. Les pièges à interception fournissent une estimation du taux de visites des insectes sur les arbres étudiés, mais ils ne permettent pas de mesurer la colonisation des arbres (Béland et al., 2019). Les bûches situées en dessous du DHP ont été écorcées durant l’hiver 2018 à l’aide d’un ciseau à bois et d’un maillet. Les larves et les adultes d’insectes ont été récoltés et mis dans des fioles contenant de l’alcool éthylique à 70% jusqu’à l’identification en laboratoire. Le dénombrement des trous des insectes secondaires et de prédations (pics) ainsi que le recouvrement de galeries ont également été mesurés. Les secondes bûches, prélevées au-dessus du
DHP, ont été placées en élevage dans des cages d’émergence dans la bûcheraie du CFL. Ce bâtiment reproduit les conditions environnementales de terrain et permet un suivi rapide de l’émergence des insectes puisqu’à proximité du laboratoire de recherche où sont triés et identifiés les spécimens. Chaque bûche a été placée dans une cage ventilée en novembre 2018. Les cages d’émergence se composent de seaux en plastique de 20 L, dans lesquels les bûches sont suspendues pour essayer de maintenir leur position naturelle. À l’extrémité inférieure du seau, un flacon collecteur a été rempli de propylène glycol à 80 %. Le flacon collecteur a été vidé une fois par semaine, à partir de l’émergence des spécimens, tout au long de l’été. Chaque insecte a été identifié à l’espèce et conservé dans de l’alcool éthylique à 70% ou monté pour la collection de référence. Au mois d’octobre 2019, les bûches ont été écorcées comme décrit précédemment afin de recueillir les insectes qui possèdent un cycle de 2 ans comme les espèces de Monochamus et dénombrer les trous d’émergence passée ou les galeries d’insectes ayant déjà complété leur développement au moment de la mise en élevage (Peddle et al., 2002, Boucher et al., 2012, Bélanger et al., 2013). L’écorçage et la mise en élevage permettent de lier directement les insectes à l’habitat qu’est la bûche (Wikars et al., 2005, Toivanen et Kotiaho, 2010, Azeria et al., 2012, Boucher et al., 2012, Boulanger et al., 2013).
1.3.4 Description de l’environnement immédiat des arbres étudiés
Une placette de 5 m de rayon a été décrite autour de chaque arbre étudié afin de caractériser l’environnement forestier immédiat. L’essence, le DHP, l’état de l’arbre (Hunter, 1999) et la classe de défoliation (MFFP, 2019) ont été enregistrés pour chaque arbre de dimension commerciale. Cela a permis de calculer la surface terrière (Monk et al., 1970) et la densité des arbres autour de l’arbre étudié. L’état de dégradation (vivants, moribonds ou morts) de chaque essence a également été évalué.
1.3.5 Analyse des monoterpènes de l’écorce
Les disques, prélevés sur chaque arbre, ont été trempés dans de l’azote liquide et broyés finement avec un broyeur (IKA® A 11, Imlab). La poudre d’écorce a été placée dans des fioles avec le numéro de l’échantillon et placée dans un congélateur à -80 °C. Dans un tube à essai en plastique (13 mL), 100 mg de poudre d’écorce d’un échantillon a été mélangé avec 1 mL d’eau distillée, 3 mL d’hexane, 2 mL de méthanol et 75 uL de tétradécane (standard interne) puis placé dans un bain de glace pendant 20 minutes. Les tubes à essai ont ensuite été placés dans une centrifugeuse programmée à 4 °C à une vitesse de 3000 tours par minute pendant 7 minutes puis replacés dans un bac de glace pour
ensuite procéder à l’extraction de la phase non polaire contenant les monoterpènes. Une infime quantité de sulfates de magnésium anhydre est insérée dans une seringue munie d’une cartouche filtrante et à l’aide d’une pipette Pasteur, la phase non polaire contenant les monoterpènes est récupérée des tubes à essai et insérée dans la seringue. Le contenu de la seringue est ensuite placé dans des fioles à injection de 1 mL et placé immédiatement au congélateur à -80 °C. Les fioles contenant les composés phénoliques ont ensuite été analysées avec un chromatographe en phase gazeuse (Varian GC3900). Les résultats des concentrations de monoterpènes ont été extraits et compilés dans un fichier Excel.
1.3.6 Analyses statistiques
Des analyses canoniques de redondance (RDA) ont été utilisées pour explorer les liens entre les insectes secondaires et les facteurs environnementaux associés à l’épidémie de TBE. Pour chaque dispositif (pièges à interception et cages d’émergence), une RDA a été réalisée en utilisant des variables explicatives différentes pour chaque jeu de données. En effet, selon la méthode d’échantillonnage (capture par piège, écorçage et émergence), les variables mesurées et les données générées ne sont pas identiques. Seules les espèces significatives ont été représentées, la présence d’espèces rares pouvant difficilement être associée à des variables explicatives. Les centroïdes des différentes classes de défoliation ont été illustrés sur les ordinations. Les RDA ont été effectuées sur des données transformées par la méthode de Hellinger (Legendre et Gallagher, 2001) à l’aide de la fonction decostand du paquet vegan (Oksanen et al., 2015). Cette méthode permet de minimiser l’importance des zéros et est généralement utilisée pour les données d’abondance d’espèces (Legendre et Gallagher, 2001). Des tests de permutation (1000 permutations) ont été effectués pour valider la signification statistique du modèle et de chaque axe canonique (Legendre et Legendre, 2012) avec la fonction anova.cca. Les facteurs d’inflation de variable pour chaque contrainte ont été testés avec la fonction vif.cca du paquet vegan (Oksanen et al., 2015). Des diagrammes à trois corrélations (type d’échelle 2) ont été réalisés à l’aide de la fonction ggplot du paquet ggplot2 (Wickham, 2016) pour tracer les ordinations.
Afin d’évaluer la réponse numérique des espèces abondantes à la défoliation de la tordeuse des bourgeons de l’épinette, des modèles linéaires généralisés (GLM) ont été utilisés. La défoliation établie par la méthode d’estimation de la couronne supérieure a été utilisée pour réaliser les régressions. Les données similaires de certaines espèces (ex : larves de Monochamus scutellatus provenant des écorçages des deux bûches) ont été compilées et une série de GLM a été produite. Les suppositions
(indépendance des données, distribution des résidus, structure de variance et présence de valeurs extrêmes) ont d’abord été testées en utilisant la fonction glm (Core et Team, 2014). La fonction c_hat du paquet AICcmodavg (Mazerolle, 2015) a été utilisée afin de vérifier la surdispersion des modèles, auquel cas nous avons utilisé la distribution binomiale négative avec la fonction glm.nb du paquet MASS (Ripley, 2002). La fonction ggplot du paquet ggplot2 (Wickham, 2016) a été utilisée pour les représentations graphiques des RDA et des régressions. Les analyses statistiques ont été effectuées avec le logiciel R (R.3.6.1).
1.4 Résultats
1.4.1 Taux de visite
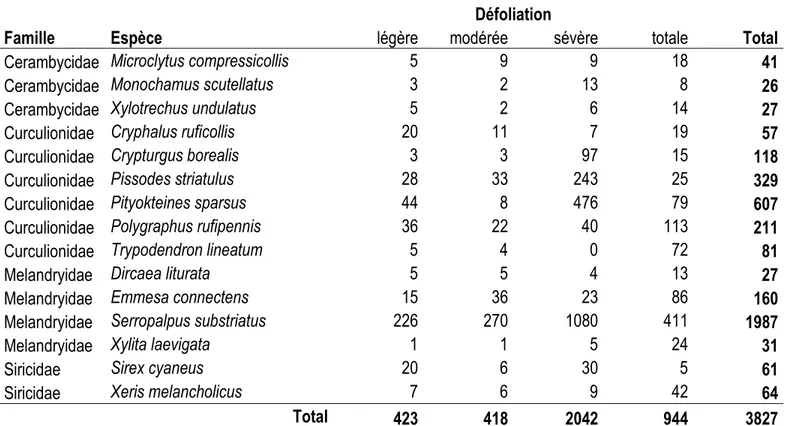
Un total de 3966 spécimens adultes des quatre familles retenues a été capturé et identifié à l’espèce. La richesse spécifique totale est de 41 espèces, dont 13 espèces de Cerambycidae, 20 espèces de Curculionidae, 6 espèces de Melandryidae et 2 espèces de Siricidae. L’espèce la plus abondante était un Melandryidae Serropalpus substriatus avec 1987 spécimens suivi par un scolyte Pityokteines
sparsus avec 607 individus et un charançon Pissodes striatulus avec 329 individus. Trois autres
espèces de scolytes, Polygraphus rufipennis, Crypturgus borealis, Trypodendron lineatum, une espèce de Melandryidae, Emmesa connectens et une espèce de sirex, Xeris melancholicus, suivent avec respectivement 211, 118, 81, 160 et 64 spécimens (Tableau 1.1). La RDA mettant en relation les insectes capturés dans les pièges à interception et les variables environnementales était statistiquement significative (F = 1,9864, df = 14, P = 0,001). Les variables environnementales expliquent 24.65 % de la variance de la communauté d’insectes. Les deux premiers axes de la RDA expliquent respectivement 38.77 % et 19.39 % (Figure 1.1).
Dans le diagramme à trois corrélations (triplot), l’ensemble des pièges placés sur des arbres vivants défoliés légèrement, modérément et sévèrement se situent du côté gauche de l’axe RDA1. Les arbres de défoliation légère et modérée sont liés positivement à l’ensemble des monoterpènes ainsi qu’à la surface terrière totale. Les arbres de défoliation sévère sont liés positivement à la surface terrière de sapins baumiers moribonds. Les pièges placés sur des arbres de défoliation totale et vraisemblablement morts se situent du côté droit de l’axe RDA1. Certaines espèces présentent des scores assez faibles et sont proches de l’origine, mais se répartissent le long de l’axe RDA2. Les scolytes Polygraphus rufipennis et Trypodendron lineatum ainsi que le Siricidae Xeris melancholicus sont fortement corrélés positivement à la surface terrière d’épinettes noires moribondes et mortes. L’ensemble des espèces suivantes : Pityokteines sparsus, Emmesa connectens, Xylita laevigata et
Dircea liturata sont fortement corrélées positivement avec la surface terrière de sapins baumiers morts
et le DHP des arbres. Deux des trois espèces les plus abondantes, Pissodes striatulus et Serropalpus
substriatus ainsi que Sirex cyaneus sont fortement corrélés à la surface terrière de sapins baumiers
moribonds et sont liés positivement avec les arbres de défoliation sévère soit des arbres moribonds. Aucun monoterpène ne semble expliquer la colonisation des insectes secondaires sur les arbres relativement affaiblis et morts.
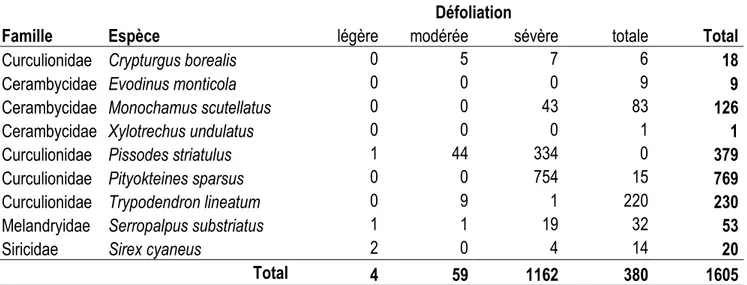
1.4.2 Taux de colonisation
Par le biais des écorçages et des cages à émergences, neuf espèces ont pu être identifiées. Comme les résultats des pièges à interception, le scolyte Pityokteines sparsus et le charançon Pissodes
striatulus sont les espèces les plus abondantes avec respectivement 769 larves/adultes et 379
larves/adultes. Un total de 126 trous d’entrée du longicorne Monochamus scutellatus ont été trouvés ainsi que 230 trous de sorties du scolyte Trypodendron lineatum. Une cinquantaine de Serropalpus
substriatus et une vingtaine de Sirex cyaneus ont émergé des bûches. Les autres espèces, Crypturgus borealis (18 adultes), Xylotrechus undulatus (1 adulte) et Evodinus monticola (5 larves) ont été trouvés
en faible abondance (Tableau 1.2). Un nombre de 17 larves de longicornes de la sous-famille de Cerambycinae et une larve de Buprestidae ont été trouvés, mais elles n’ont pas pu être déterminées à l’espèce.
La RDA était statistiquement significative (F = 2.2302, df = 14, P = 0,001). Les variables environnementales expliquent 26.86 % de la variance de la communauté d’insectes. Les deux premiers axes de la RDA expliquent respectivement 48.09 % et 27.94 % (Figure 1.2).
Dans le diagramme à trois corrélations (triplot), l’ensemble des pièges placés sur les arbres les moins défoliés par la TBE (légère et modéré) se situent du côté gauche de l’axe RDA1 et sont liés positivement à l’ensemble des monoterpènes ainsi qu’à la surface terrière totale. Les pièges placés sur des arbres de défoliation sévère et totale soit des arbres relativement affaiblis et vraisemblablement morts se situent du côté droit de l’axe RDA1. Les espèces, Pityokteines sparsus, Serropalpus
substriatus, Pissodes striatulus et Monochamus scutellatus, sont fortement liées aux arbres de
défoliation sévère. Le scolyte Trypodendron lineatum et le siricidae Sirex cyaneus sont fortement liés aux arbres de défoliation totale et corrélée fortement à la surface terrière de sapins baumiers morts ainsi qu’à la surface terrière d’épinettes moribondes et mortes. Aucun monoterpène ne semble expliquer la colonisation des insectes secondaires sur les arbres affaiblis et morts.
1.4.3 Seuil de défoliation
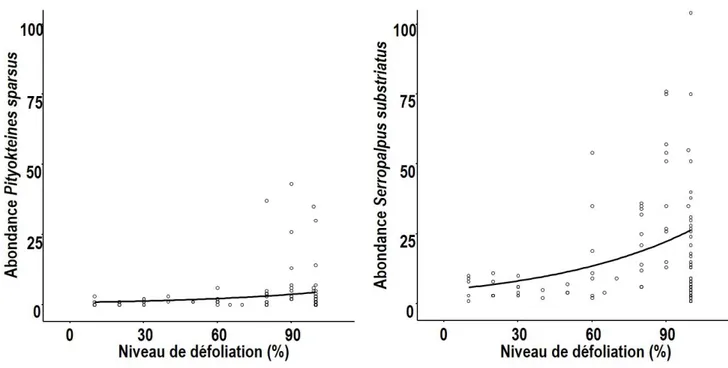
Le seuil de défoliation, qui déclenche la colonisation par les insectes secondaires, a été déterminé à partir de la relation entre l’abondance des espèces présentes dans les bûches et la défoliation. Les relations pour les espèce Pissodes striatulus et Pityokteines sparsus n’étaient pas significatives. Pour
abondance a augmenté de façon significative en fonction de la défoliation (P ≤ 0.001). La figure 1.3 montre que les insectes secondaires colonisent massivement les arbres à partir de 90 % de défoliation globale et ne cesse de s’accroitre avec la défoliation des arbres.
Afin d’estimer le pouvoir prévisionnel des pièges à interception et permettre de mieux préciser la fenêtre critique pour procéder à la récupération, la relation entre l’abondance des espèces capturées dans les pièges à interception et la défoliation a été testée. Seules les espèces Pityokteines sparsus et Serropalpus substriatus étaient significatives. Les résultats sont cependant marginaux pour le scolyte Pityokteines sparsus (Figure 1.4). Pour le mélandryide Serropalpus substriatus, les visites exploratoires ont été effectuées sur l’ensemble des arbres défoliés avec une légère augmentation vers les arbres morts. Il n’est cependant pas possible d’établir un pourcentage précis de défoliation où la fenêtre de colonisation est effectuée par cette espèce (Figure 1.4).
1.5 Discussion
Les résultats indiquent clairement qu’il existe un assemblage d’insectes secondaires visitant abondamment le sapin baumier défolié par la TBE. Les arbres de défoliation sévère et totale ont été largement visités par une quarantaine d’espèces et neuf ont colonisé, de façon certaine, les arbres sévèrement et totalement défoliés. Ce résultat a été confirmé par les données de colonisation (Tableau 1.2, Figure 1.2) où les arbres fortement affaiblis ou présumés morts ont été colonisés par les insectes secondaires. Parmi les neuf espèces, six ont colonisé massivement les sapins et ont représenté 99 % de l’abondance des espèces retrouvées. Quatre espèces ont été trouvées dans des arbres de défoliation sévère, Pissodes striatulus, Pityokteines sparsus, Serropalpus substriatus et
Monochamus scutellatus. Ces espèces sont donc capables de s’attaquer et se développer dans des
arbres encore vivants. Les deux autres espèces, Trypodendron lineatum et Sirex cyaneus ont été trouvés dans des arbres de défoliation totale, présumés morts. L’ensemble de ces espèces a été capturé à l’aide des pièges à interception. Par conséquent, l’installation d’un dispositif de capture par pièges permettra de confirmer leur présence et ainsi d’être un indicateur des dommages à venir dans les arbres défoliés.
Les arbres vivants, mais sévèrement défoliés au début de l’échantillonnage avaient pour la plupart succombé à la fin de l’été. D’ailleurs, le cambium avait déjà commencé à se décolorer lorsque les premières larves ont été extraites, au moment de l’écorçage, suggérant que les arbres étaient manifestement morts pendant le développement larvaire. Cela suggère que les conditions deviennent propices à la colonisation pour une période courte puisque la mortalité des arbres sévèrement défoliés (moribonds) surviendrait rapidement. Les changements progressifs de l’attaque de la TBE sur le sapin baumier engendrent des modifications d’habitat auquel les insectes secondaires réagissent rapidement et fortement (Raffa et Berryman, 1980). À la suite d’événements perturbateurs, des composés chimiques secondaires sont émis par les arbres blessés ou affaiblis ce qui peut attirer des insectes qui se dispersent dans le peuplement (Trapp et Croteau, 2001, Allison et al., 2004). Cela semble être le cas du polygraphe de l’épinette Polygraphus rufipennis, qui a été capturé en abondance dans les pièges à interception. Les hôtes colonisés par cette espèce sont le mélèze et à toutes les espèces d’épinettes (Swaine et al., 1924). Les visites exploratoires sur le sapin indiquent une corrélation étroite avec la surface terrière d’épinettes moribondes et mortes. L’épinette noire était omniprésente à certains endroits du peuplement étudiés, mais le nombre d’épinettes défoliées par la TBE était relativement bas. Dans le cas où des épinettes étaient sévèrement ou totalement défoliées,
les sapins présents étaient morts depuis plusieurs années (tête cassée, perte d’écorce et bois sec). Le polygraphe de l’épinette a également été retrouvé en abondance dans les épinettes noires brûlées (Saint-Germain et al., 2004) confirmant l’association avec cette essence. D’autres espèces xylophages ont également visitées les sapins baumiers défoliés soit Xylita laevigata, Emmesa connectens et
Dircaea liturata. La présence de ces espèces a été mentionnée dans des peuplements affectés
plusieurs années plus tôt par la TBE (Barnouin, 2005, Norvez et al., 2013). Cependant, elles ont été capturées en faible abondance tout comme dans notre étude. Une espèce de Siricidae, Xeris
melancholicus, a également été capturée, mais aucune mention n’a confirmé la présence de cette
espèce dans une épidémie d’insectes. Les observations sur leurs activités dans le peuplement étant limitées, il est difficile d’élaborer davantage.
L’abondance massive de Pityokteines sparsus, Serropalpus substriatus, Sirex cyaneus, Monochamus
scutellatus, Trypodendron lineatum et Pissodes striatulus et les dommages observés dans les bûches
de sapins défoliés par la TBE rendent ces espèces problématiques pour les coupes de récupération. Cet assemblage d’espèces a été rencontré, en Ontario au Lac Nipigon, dans des sapins baumiers sévèrement affaiblis ou nouvellement morts causés par la défoliation par la TBE (Belyea, 1952). Trois de ces espèces, associées à des arbres de défoliation sévère, Pissodes striatulus, Monochamus
scutellatus et Pityokteines sparsus sont connus pour attaquer des arbres avant que la mort ne soit
évidente (Belyea, 1952). De nombreuses larves de Pissodes striatulus et de Monochamus scutellatus ont été retrouvées en présence d’adultes et de larves de Pityokteines sparsus. Il a été suggéré que les changements dans les pressions osmotiques dans la tige et l’écorce de l’arbre résultant des dommages causés par d’autres insectes peuvent produire des conditions attrayantes pour Pityokteines sparsus dans le sapin baumier (Kraemer, 1949). Ceci suggère que ces espèces ont des critères de colonisation similaires. Belyea (1952) mentionne que Monochamus scutellatus avait presque toujours colonisé les arbres infestés durant la même saison par Pityokteines sparsus sur des arbres apparemment vivants. La prédominance de sapin baumier affaibli aurait donc largement contribué à une abondance massive de ces insectes qui peuvent être qualifiés comme étant particulièrement agressifs. Béland et al. (2019) confirme également une augmentation de la colonisation de Pissodes striatulus dans les arbres fortement défoliés par l’arpenteuse de la pruche. Monochamus scutellatus est connu pour être une espèce opportuniste puisqu’elle colonise les arbres récemment tués par des perturbations telles que des épidémies d’insectes ou des chablis (Gardiner, 1975, Basham, 1986) et présente en abondance dans les brûlis (Saint-Germain et al., 2004). Quant à Pityokteines sparsus, il est connu pour ne
s’attaquer qu’au sapin baumier (Swaine et al., 1924). Par conséquent, une épidémie de TBE génère des conditions de colonisation propices à ces trois espèces.
Le Melandryidae Serropalpus substriatus retrouvé davantage dans les arbres de défoliation sévère et le Siricidae Sirex cyaneus dans les arbres de défoliation totale seraient deux espèces intimement liés par mutualisme (Bittner et al., 2016). Le genre Serropalpus est associé au bois infesté par le champignon responsable de la pourriture blanche, Amylostereum chailletii (Talbot, 1977, Lawrence, 1991) porté par Sirex cyaneus (Stillwell, 1966, Tabata et al., 2000). La gamme d’hôtes de Sirex
cyaneus est limitée aux espèces d’Abies principalement le sapin baumier (Schiff et al., 2012) où Serropalpus substriatus émerge généralement d’arbres infestés par cette espèce (Bittner et al., 2016).
Schiff et al (2012) ont confirmés que les femelles Sirex déposent leur œuf dans des sapins morts, mais également dans les arbres moribonds. En effet, les spores asexuées du champignon sont transportées près de l’ovipositeur chez les guêpes femelles d’où elles sont inoculées dans le bois pendant la ponte (Coutts, 1969, Coutts et Dolezal, 1965, Madden, 1981), mais elles peuvent également être insérées pendant le sondage exploratoire des arbres hôtes potentiels (Coutts et Dolezal, 1969). Cela pourrait expliquer la présence de Serropalpus substriatus dans des arbres qui ne semblent pas avoir été colonisés par Sirex cyaneus. Toutefois, des analyses approfondies devront être réalisées afin de confirmer la présence de ce champignon dans les bûches.
La plupart des scolytes sont les premiers à coloniser les arbres fortement affaiblis ou morts (Trapp et Croteau, 2001). Il n’est donc pas surprenant d’observer une abondance marquée de trous de sortie du scolyte birayé, Trypodendron lineatum, dans les sapins baumiers morts. L’activité de cette espèce s’est déroulée à la fin de l’été, moment où les captures ont eu lieu dans les pièges à interception, ce qui indique que ces individus venaient hiverner dans le peuplement. Cet insecte est connu pour coloniser les rémanents, les souches et les tas de bois dans les zones de récupération et s’envole vers les peuplements forestiers les plus proches pour hiverner (Kinghorn et Chapman, 1959, Dyer et Kinghorn, 1961). L’étude de Béland et al (2019) a révélé que cette espèce était essentiellement la seule à coloniser massivement les sapins baumiers tués par l’arpenteuse de la pruche. Cependant, les auteurs suggèrent qu’il pourrait ne pas coloniser les arbres potentiellement tués par d’autres saproxyliques. La présence de trous et non d’adultes suggère que la colonisation a été précoce et effectuée avant la plupart des espèces secondaires discutées précédemment. La seule trace du passage de cette espèce a été identifiée par des trous de sorties et aucun individu n’a été retrouvé émergeant des bûches. Ce
scolyte pourrait être une espèce indicatrice de la mortalité du sapin baumier et pourrait ouvrir la porte à d’autres espèces xylophages.
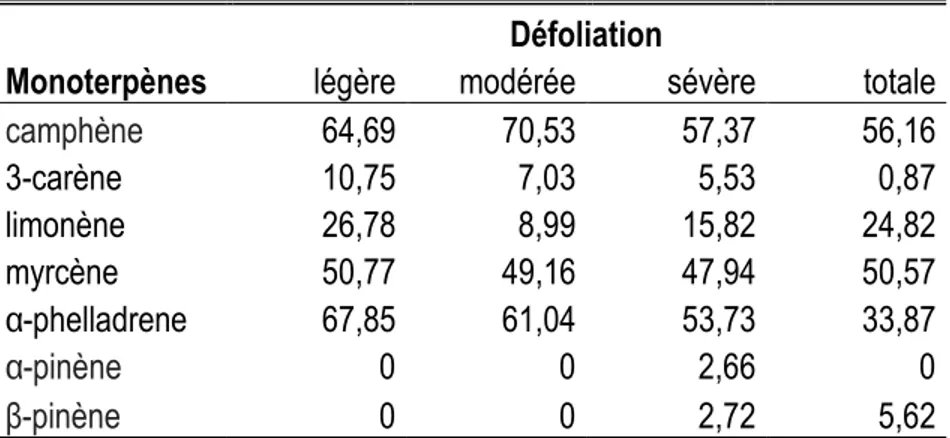
Le retrait des aiguilles par la TBE cause un stress et provoque des changements dans les profils qualitatifs et quantitatifs des monoterpènes qui affectent les émissions volatiles dans les tissus foliaires et sous-corticaux (Wallin et Raffa, 1999, Caron et al., 2013). Wallin et Raffa (1999) suggèrent que ces changements interagissent avec l’attrait des arbres et leur sensibilité à la colonisation par les espèces saproxyliques. Les arbres de défoliation légère et modérée sont associés à l’ensemble des monoterpènes et émis en plus grande quantité que les arbres de défoliation sévère et totale (Tableau 1.3). Ce résultat semble cohérent puisque les arbres de défoliation légère et modérée sont des arbres sains et en mesure de se défendre contre la défoliation de la TBE en émettant plus de composés volatils. Cependant, aucune des espèces retrouvées ne semble avoir de liens avec les concentrations de monoterpènes sous corticaux.
Les six espèces trouvées en abondance dans les sapins moribonds et morts des suites des défoliations par la TBE forment de nombreuses galeries et sont porteurs de champignons pouvant accélérer la décomposition du bois. Ces espèces sont donc considérées problématiques pour les coupes de récupération. Elles peuvent, cependant, être détectées facilement grâce à l’installation de pièges à interception. Si une espèce est capturée en nombre élevé, il est probable que la colonisation soit en cours. Par conséquent, il sera possible de prédire les dommages potentiels dans le peuplement. La mort d’un arbre n’est pas un événement bien défini et il est difficile d’établir le moment précis où elle se produit. Bien qu’il soit facile de distinguer un sapin vivant d’un sapin manifestement mort, des méthodes devront être investiguées afin de définir clairement cet événement. Le moment de mortalité de l’arbre peut avoir un impact considérable sur la colonisation des espèces. En effet, un dessèchement du bois peut survenir pendant l’hiver et rendre la colonisation non propice à un grand nombre d’espèces secondaires. De plus, des analyses de bois seraient pertinentes afin de déterminer la présence de champignons ou autres organismes xylophages pouvant contribuer à la dégradation accélérée du bois. Il est important de noter que cette étude a été menée dans un seul peuplement et qu’il reste à confirmer la présence de ces espèces dans d’autres peuplements défoliés par la TBE.
Remerciements
Je remercie Ioan Nicolae, Sandrine Corriveau, Jonathan Poirier et Raphaël Sanche Hébert du Consortium de recherches sur les insectes forestiers (iFor) pour le soutien technique et la collecte de données sur le terrain et en laboratoire. Je remercie Alain Dupont ainsi que Caroline Morin et André Perreault de la Société de protection des forêts contre les insectes et maladies pour leur disponibilité ainsi que leur aide technique et logistique. Je remercie également Olivier Jeffrey, Jean-Michel Béland et Sébastien Dagnault pour l’aide technique sur le terrain et pour l’analyse des données. Ces travaux ont été financés par le consortium de recherche sur les insectes forestiers (iFor) sous des contributions du Conseil de Recherches en Sciences naturelles et Génie du Canada (CRSNG), du Service Canadien des Forêts (SCF-RNCan) et de la Société de Protection des Forêts contre les Insectes et Maladies (SOPFIM) et des compagnies Résolu, Arbec et Cedrico.