MONA EFFENDI
ÉTUDE PROSPECTIVE SUR LA CORRÉLATION
ENTRE LE VOLUME PLACENTAIRE AU 1
ERTRIMESTRE ET LE POIDS DU NOUVEAU-NÉ
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de Maîtrise en Médecine Expérimentale
pour l’obtention du grade de Maître ès sciences (M.Sc.)
DÉPARTEMENT DE MÉDECINE UNIVERSITÉ LAVAL
QUÉBEC
2013
Résumé
Objectifs : Vérifier s'il existe une corrélation entre le volume placentaire, évalué par
échographie tridimensionnelle au 1er trimestre de la grossesse et le poids de naissance.
Méthodologie : Une étude de cohorte prospective de 543 femmes enceintes recrutées
entre 11 et 13 semaines de grossesse. Nous avons évalué l’association entre le volume placentaire mesuré par échographie tridimensionnelle (rapportée en multiple de la médiane pour l’âge gestationnel) et le poids du nouveau-né à la naissance (rapporté en percentile). Nous avons utilisé des analyses non paramétriques (test de corrélation de Spearman, Mann-Whitney, et Kruskal-Wallis) avec une valeur de p significative si inférieure à 0.05.
Résultats : Parmi 554 femmes recrutées et admissibles, nous avons observé une
corrélation significative entre le volume placentaire au 1er trimestre et le poids de naissance (Coefficient corrélation(CC): 0,15; p<0.0001). Le volume placentaire n’était pas associé au risque de prééclampsie. Conclusion : Il existe une corrélation significative entre le volume placentaire évalué au 1er trimestre de la grossesse et le poids de naissance, mais aucune corrélation ne fut observée avec le développement d’une prééclampsie au cours de la grossesse.
Abstract
Objectives: To assess the correlation between placental volume, measured by three
dimensional ultrasound in the first trimester of pregnancy and birth weight. Methodology: A prospective cohort recruiting 543 women between 11 and 13 weeks gestation was conducted. We evaluated the correlation between placental volume measured by three- dimensional ultrasound (reported as multiple of t h e median for gestational age), and birth weight (reported in percentile). Data were analyzed using non-parametric tests (Spearman, Mann-Whitney, Kruskal- Wallis), with a significant p value under 0,05.
Results: A total of 554 women were recruited. The placental volume showed significant
correlation with birth weight (Correlation coefficient (CC); 0,15; p<0.0001). The placental volume was not associated with preeclampsia. Conclusion: There is a significant correlation between placental volume and birth weight. In this study, no correlation was found between placental volume and preeclampsia.
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche, le Dr Emmanuel Bujold, pour m’avoir permis d’intégrer son équipe et m’avoir donné sa confiance. Je suis encore plus reconnaissante qu’il m’a supervisée de près tout au long de mon travail, d’avoir encadré mes efforts avec excellence, exactitude et loyauté. Ses expériences, ses multiples compétences m’ont permis de poursuivre mon apprentissage dans le domaine.
Je tiens à remercier Amélie Têtu, assistante de recherche, qui m’a aidée à mon intégration dans le domaine de la recherche et à la finalisation de la banque des données de mon projet. Stéphanie Roberge a eu la gentillesse d’être d’un soutien extraordinaire m’a aidé dans la structure et la recherche des articles pour ma revue de littérature. Au tout début, me lancer dans l’aventure de la maîtrise m’effrayait, mais celles- ci m’ont permis de me guider et de garder la tête haute. Leur sourire, leur soutien, leur amitié furent une partie très intégrante de mon cheminement.
Je tiens à remercier la Chaire de recherche Jeanne et Jean-Louis Lévesque à l’Université Laval qui a financé mon projet et la Fondation de recherche de santé du Québec pour m’avoir octroyé la bourse de maîtrise qui m’a été d’un excellent soutien financier.
Finalement, je désire offrir mes plus sincères remerciements à mes parents, Zakaria et Samar Effendi, et à ma sœur Nadia, dont je dédie ce mémoire. Ceux-ci m’ont été d’un soutien inoubliable, durant ces années. Malgré les obstacles sur mon chemin, ils m’ont permis de croire en moi-même et de garder la force. Ils sont pour moi mes anges gardiens, et ce mémoire ne serait pas ce qu’il serait ce jour sans leur place dans ma vie et dans mon cœur. Je leur dois mon succès, ma réussite, mes rêves et encore plus, ma vie.
Ce mémoire est le résultat d’un travail d’équipe exemplaire, d’un support inconditionnel et d’une passion éternelle. Grâce à cette expérience, ceci me permettra de poursuivre mes rêves dans la recherche.
Table des matières
Page
RESUME ... II ABSTRACT ... III REMERCIEMENTS ... IV TABLE DES MATIERES ... V LISTE DES ABREVIATIONS ... VII TABLEAUX ... VIII TABLES ... VIII LISTE DES FIGURES ... IX
INTRODUCTION ... 1
CHAPITRE 1 – ÉTAT DES CONNAISSANCES ... 3
1.1. DEVELOPPEMENT PLACENTAIRE ... 3
1.1.1. Histologie placentaire ... 3
1.1.2. Échanges fœto-placentaires ... 4
1.2. INSUFFISANCE PLACENTAIRE ... 5
1.2.1. Pathologies associées à l’insuffisance placentaire ... 5
1.2.2. Facteurs de risque de l'insuffisance placentaire ... 6
1.2.3. Mécanismes d'adaptation fœtale à l'insuffisance utéro-placentaire ... 7
1.2.4. Manifestations de l'insuffisance placentaire... 7
1.2.5 Diagnostic échographiques de l’insuffisance placentaire ... 8
1.2.6. Classification de la sévérité de l'insuffisance placentaire ... 9
1.3. LA RESTRICTION DE CROISSANCE INTRA-UTERINE (RCIU) ET LA PREECLAMPSIE (PE) 11 1.3.1. La RCIU ... 11
1.3.2 La prééclampsie ... 14
1.3.3 Prédiction de la RCIU et de la prééclampsie ... 15
1.4. LE VOLUME PLACENTAIRE ... 16
1.4.1. Historique ... 16
1.4.2. Techniques de mesure du volume placentaire ... 16
1.4.3. Association entre le volume placentaire, le poids de naissance et la prééclampsie ... 18
1.5. HYPOTHESE DE RECHERCHE ET OBJECTIFS ... 20
vi
1.5.2. OBJECTIFS : ... 20
CHAPITRE 2 ... 21
ASSOCIATION BETWEEN FIRST-TRIMESTER PLACENTAL VOLUME AND BIRTH WEIGHT ... 21 ABSTRACT ... 22 INTRODUCTION ... 23 METHODS ... 23 RESULTS ... 26 DISCUSSION ... 31 ACKNOWLEDGEMENTS ... 33 CHAPITRE 3- DISCUSSION/CONCLUSION ... 34 BIBLIOGRAPHIE... 36
ANNEXE 1. APPROBATIONS DES COMITES D’ETHIQUES A LA RECHERCHE ... 40
ANNEXE 2. FORMULAIRE DE CONSENTEMENT ... 42
Liste des abréviations
BHCG: B- Human Chorionic Gonadotrophin CA: Circonférence abdominale
HTA: Hypertension artérielle IP: Index de pulsatilité
IR: Index de résistance/pourcelot IUGR: Intra-uterine growth restriction LCC: Longueur céphalo-caudale
OMS: Organisation Mondial de la Santé PAG : Petit pour l’âge gestationnel PE: Prééclampsie
RCIU: Restriction de croissance intra-utérine
SOGC: Société des obstétriciens et gynécologues du Canada TEV: Cytrophoblaste extravilleux
VOCAL: Virtual Organ Computer-aided Analysis VPE: Volume placentaire estimé
WHO: World health organization 3D: Tridimensionnelle
viii
Tableaux
Tableau 1. Facteurs de risque de la PE et RCIU ...6 Tableau 2. Classification de l'insuffisance placentaire, adaptée selon Gudmundsson et al. ... 10 Tableau 3.Revue de littérature sur le volume placentaire mesuré en période anténatale. ... 18
Tables
Table 1. Characteristics of eligible women. ... 27 Table 2. First-trimester placental vascularization indices according to pregnancy outcomes ... 31
Liste des figures
Figure 1. Doppler de l'artère utérine droite, notez l'incisure proto-diastolique ...8 Figure 2. Doppler de l'artère ombilicale anormal (un flot rétrograde est présent) ...9 Figure 3. Placental volume measured by 3D Doppler ultrasound according to crown-rump length at
11-13 weeks’ gestation ... 28
Figure 4. First-trimester placental volume at 11-13 weeks’ gestation in AGA, SGA and LGA
neonates. ... 29
Figure 5. First-trimester log-transformed placental volume at 11-13 weeks’ gestation in women
Introduction
La restriction de croissance intra-utérine (RCIU) et la prééclampsie (PE) sont deux complications de la grossesse qui sont souvent intimement liées à la fonction placentaire.
Avec l’accouchement prématuré, ils comptent parmi les pires complications obstétricales pouvant entraîner des effets néfastes sur l’enfant, sur sa croissance et sur sa condition neurologique et intellectuelle à long terme. Selon l’Organisation Mondiale de la Santé (OMS), près de 2,6 millions d’enfants sont mort-nés en 2009 et la PE et la RCIU comptaient parmi les causes principales.1 La PE, définie par une hypertension artérielle gestationnelle combinée à une protéinurie, touche environ 2-8% des grossesses : les taux les plus élevés se retrouvant dans les pays en voie de développement. La RCIU est en général définie par un poids de naissance inférieur au 10e percentile pour l’âge
gestationnel.2
Une quantité croissante d’évidences suggèrent que la dysfonction placentaire associée à la PE et à la RCIU débute souvent dès le premier trimestre de la grossesse. Il a été observé que les patientes avec un niveau sanguin diminué en PAPP-A (Pregnancy Associated Plasma Protein A) au 1er trimestre et un volume placentaire réduit au 2ième trimestre étaient plus à risque d'une RCIU sévère, d'accouchement prématuré et de mort néonatale.3 Law et al. en 2009, ont observé que le volume placentaire mesuré au 1er trimestre était associé au risque de développer une RCIU.4 Il a même été proposé que la combinaison de marqueurs biologiques (biochimiques et échographiques) puisse permettre de prédire suffisamment le risque de la PE et de la RCIU dès la fin du 1er trimestre pour espérer une utilisation clinique. Un intérêt croissant pour ces recherches a été favorisé par la publication de méta- analyses ayant démontré que l’utilisation de l’aspirine à faible dose, débutée au premier trimestre de la grossesse pouvait être efficace pour prévenir la PE et la RCIU.5
La reproductibilité de l'évaluation tridimensionnelle de la vascularisation et du volume placentaire menée au cours du 1er trimestre est excellente, tant chez l’humain que chez l’animal.6, 7 Ces résultats suggèrent que l’évaluation tridimensionnelle du placenta pourrait identifier les femmes à risques élevés de dysfonction placentaire, de RCIU et de prééclampsie tôt en grossesse pour leur proposer des mesures préventives.
Le premier chapitre de ce mémoire présente une revue de littérature sur l’insuffisance placentaire, la prééclampsie, la restriction de croissance intra-utérine, et le volume placentaire. Dans le deuxième chapitre, nous présentons une étude de cohorte prospective ayant pour but d’étudier la relation entre le volume placentaire mesuré au 1er trimestre et le poids à la naissance, ainsi que le risque de PE.
CHAPITRE 1 – ÉTAT DES CONNAISSANCES
1.1. Développement placentaire
Le développement placentaire est un processus qui débute avec l'implantation du blastocyste ou morula, formée de 50 à 60 cellules embryonnaires indifférenciées, au 4e jour de la fécondation. Une différenciation va ensuite entraîner la formation d’un pôle embryonnaire à partir duquel se développera l’embryon et d’un pôle trophoblastique à partir duquel se développera le placenta.
1.1.1. Histologie placentaire
La placentation débute avec l’implantation du blastocyste sous l’épithélium utérin et sa différenciation en tissus embryogéniques et extra-embryogéniques. Son pôle externe, soit le pôle trophoblastique, sera formé du trophoblaste qui lui-même est divisé en deux couches : le cytotrophoblaste et le syncytiotrophoblaste.8, 9
Ils mèneront au chorion (villosités choriales et membrane chorionique) et au placenta qui sera responsable des échanges fœto-maternels. Ces échanges se feront grâce aux villosités choriales qui apparaîtront dès le 12e jour post-fécondation.
Plus spécifiquement, les cellules cytrophoblastiques se développeront et se différencieront en cellules endovasculaires et interstitiels qui formeront le trophoblaste extra-villeux (TEV). La portion endovasculaire du TEV crée une occlusion des artérioles spiralées utérines au site de l'implantation pour prévenir le sang maternel de pénétrer dans les villosités placentaires. La portion interstitielle du TEV quant à elle sera responsable dès la 8e semaine de grossesse de l'envahissement, de l'érosion anatomique des artérioles spiralées distales et de la sécrétion des facteurs angiogéniques et vasodilatateurs pour améliorer le flot utérin au premier trimestre et de façon plus importante au second trimestre.
1.1.2. Échanges fœto-placentaires
La circulation fœtale est une circulation artérioveineuse fondamentalement très différente de celle de l’adulte.10-12 Elle assure le bien-être du fœtus. Les nutriments essentiels pour la croissance fœtale, sa maturation et son développement sont distribués au fœtus par le placenta, et ce, au travers de la veine ombilicale à l’intérieur du cordon ombilical qui relie le fœtus au placenta. La veine ombilicale est unique et celle-ci véhicule le sang oxygéné à une concentration de 90 % d'O2. Le sang appauvri en oxygène (O2=60%) retourne au
placenta par les deux artères hypogastriques dérivées des artères iliaques internes et ce, jusqu'aux deux artères ombilicales qui font également partie du cordon ombilical.
1.2. Insuffisance placentaire
Le processus d'implantation du placenta requiert un ensemble de fonctions précises et importantes qui doivent être coordonnées pour assurer la bonne formation et le bon fonctionnement du placenta. Ceci inclut la production d’hormone pléthorique (hormone qui augmente la vascularisation), de facteurs de croissance, de facteurs de transcription, etc. L'altération de l'expression de l'un ou plusieurs de ces facteurs peut causer une insuffisance des fonctions placentaires et ainsi entraîner une RCIU communément appelée d'origine vasculaire ou d’autres pathologies comme la prééclampsie, la mort fœtale ou le décollement du placenta.
1.2.1. Pathologies associées à l’insuffisance placentaire
De nombreuses pathologies placentaires peuvent mener à l’insuffisance placentaire, incluant l’insuffisance de la pénétration du TEV au niveau de la région interstitielle, les pathologies des artères souches, les anomalies du développement des villosités chorioniques et la thrombose occlusive, parmi les plus fréquentes.8 , 1 3 , 1 4 On retrouve des anomalies de l’invasion interstitielle du TEV dans plus de la moitié des grossesses compliquées par une PE et/ou une RCIU. La biopsie du lit placentaire est la technique utilisée pour mettre en évidence l’insuffisance de la pénétration du TEV dans le segment myométrial (média muscularis) des artères spiralées, communément appelé anomalie de transformation des artères spiralées.15 Mais l’évaluation du flot au niveau des artères utérines par échographie Doppler est une technique moins invasive qui permet d’estimer le niveau de transformation des artères spiralées au niveau du lit placentaire.15 Normalement l'invasion trophoblastique au niveau du segment myométrial se situe à environ 3-5mm de profondeur. Chez les grossesses compliquées de prééclampsie cette invasion n’est que d’environ 2mm.8
1.2.2. Facteurs de risque de l'insuffisance placentaire
En raison de sa complexité et de sa définition large, il est difficile d’établir des facteurs de risque spécifique de l’insuffisance placentaire. Le tableau 1 rapporte les facteurs de risque de PE et de RCIU.16
Tableau 1. Facteurs de risque de la PE et RCIU
Facteurs de risques Risque relatif pour PE et RCIU
Hypertension artérielle chronique17 PE : RR 1.38-2.37 RCIU : RR= 0.48
Antécédent de maladies placentaires (thrombose, insuffisance, décollement placentaire etc.)
Antécédent de RCIU18
PE : RR 7.19, 95% CI 5.85-8.83
RCIU : RR 9.7, 3.3-18.3
Age > 35 ans
Jeune âge (<30ans)18
PE : RR1.96, 95% CI 1.34-2.87 pour les
multipares et RR 1.68, 95% CI 1.23-2.29 pour les primipares
RCIU : RR 0.8 (0.7-0.9) Maladie chroniques17 Anémie de grossesse18 Épilepsie19 PE : RR 3.56, 95% CI 2.54-4.99 RCIU : RR 2.7 (1.3-5.4) RCIU: RR 1.9, (1.2-3.3)
1.2.3. Mécanismes d'adaptation fœtale à l'insuffisance utéro-placentaire
La transformation des artères spiralées est un processus évolutif au cours de la grossesse et une proportion variable des artères spiralées du lit placentaire demeure « non-transformée » même chez les grossesses normales.15 D’ailleurs, la majorité des grossesses avec une augmentation de la résistance des artères utérines évaluée par Doppler ne développeront pas de RCIU ou de PE.8 Au niveau hématologique, la réponse du fœtus consiste initialement à une augmentation compensatoire d'érythropoïétine qui entraîne ainsi une augmentation de globules rouges. Ce mécanisme compensatoire peut être bénéfique de façon transitoire. Par ailleurs, les villosités chorioniques du placenta s'adaptent à cette réduction de sang d'origine maternelle en augmentant leur surface d'échange et ainsi la fraction d'oxygène fourni. Il peut y avoir épaississement jusqu’à 4 cm du placenta et une augmentation des villosités terminales.8 Il a été observé qu’un petit lit placentaire accompagné d’un placenta épaissi soit un facteur de risque pour la prééclampsie.201.2.4. Manifestations de l'insuffisance placentaire
L’insuffisance placentaire peut se manifester soit au niveau maternel, placentaire ou fœtal. Les principales manifestations les plus souvent rapportées sont les suivantes 8, 21:
Manifestation maternelle :
1. Prééclampsie
Manifestations placentaires :
1. Diminution du volume placentaire (traité plus loin) 2. Thrombose/calcification placentaire14
3. Décollement placentaire
Manifestations fœtales et conséquences à long terme.
1. Diminution de la croissance fœtale 2. Changement hémodynamique fœtal
(cerveau, surrénales, cœur) au dépend de d’autres organes (intestins, reins) avec les conséquences potentielles lors de la vie adulte
4. Augmentation du risque de la mort fœtale in-utero
5. Augmentation du risque de maladies adultes chroniques (obésité, diabète, hypertension)
1.2.5 Diagnostic échographiques de l’insuffisance placentaire
En présence de RCIU et de PE, on peut faire une évaluation du Doppler des artères utérines et des artères ombilicales 21, 22. Le Doppler des artères utérines peut être réalisé dès la 11e semaine de la grossesse et le résultat est habituellement rapporté en termes d'index de pulsatilité (IP) (>95e percentile) ou de l'index de résistance/Pourcelot (IR). On peut également observer des incisures proto-diastoliques, communément appelés « notches » qui peuvent être unilatérales ou bilatérales. La présence d’incisures proto-diastoliques et des IP ou IR élevés sont associés à une plus grande proportion d’artères spiralées non- transformées et à un risque plus élevé de PE et de RCIU 15, 23.
Figure 1. Doppler de l'artère utérine droite, notez l'incisure proto-diastolique
Au niveau des artères ombilicales, la diminution du flot, l'absence du flot et même un flot
endommagées. Cette mesure par échographie Doppler permet d’évaluer la réponse fœtale à l’insuffisance placentaire au 2e et 3e trimestre de la grossesse : elle est particulièrement utile pour l’évaluation du risque fœtal en présence de RCIU ou de PE, mais les changements anormaux apparaissent tardivement dans le processus de la maladie placentaire et ne permettent pas une prédiction précoce de la RCIU ou de la PE.
Figure 2. Doppler de l'artère ombilicale anormal (un flot rétrograde est présent)
1.2.6. Classification de la sévérité de l'insuffisance placentaire
Le tableau 2 présente une classification de l'insuffisance placentaire associée à une RCIU selon la vélocité du Doppler des artères utérines et ombilicales proposée par Gudmundsson et al 2003.24
Tableau 2. Classification de l'insuffisance placentaire, adaptée selon Gudmundsson et al.
Flot sanguin de l’artère ombilicale 0
1 2 3
Flot de l'artère ombilicale normale et ondes de flot normales. Index de pulsatilité entre 2-3 écart-types au-dessus de la moyenne. IP >3 écart-type et flot diastolique antérograde
Absence de flot ou flot rétrograde de l'artère ombilicale. Flot sanguin de l’artère utérine
0 1 2 3 4
Vélocité et flot normal dans les 2 artères Un paramètre anormal présent (IP ou incisure) Deux paramètres anormaux présents
Trois paramètres anormaux présents
Quatre paramètres anormaux présents (IP augmenté et incisures dans les 2 artères)
Insuffisance placentaire= artère ombilicale + artère utérine
Classification de l’insuffisance placentaire 0 1-3 4-5 6-7 Normale Atteinte légère Atteinte moyenne Atteinte sévère
1.3. La restriction de croissance intra-utérine (RCIU) et la
prééclampsie (PE)
La RCIU et la PE sont les deux manifestations cliniques les plus communes de l’insuffisance placentaire.25-27
1.3.1. La RCIU
La définition du RCIU habituellement utilisée est: « un poids estimé par échographie inférieur au 10e percentile pour l’âge gestationnel ». Cette définition est cependant très controversée, car elle ne distingue pas entre les fœtus constitutionnellement petits de ceux avec une RCIU réelle.
La RCIU implique que la croissance fœtale est limitée par un ou plusieurs processus pathologiques.
1.3.1.1 Croissance fœtale normale
Le processus de la croissance fœtale peut se diviser en 3 phases qui s’entrecoupent: 1. Hyperplasie cellulaire durant les 16 premières semaines de grossesse.
2. Hyperplasie et hypertrophie cellulaire concomitante entre la 16e et 32e semaine de grossesse.
3. Hypertrophie cellulaire entre la 32e semaine et le terme de la grossesse.
Normalement, le fœtus augmente en poids d'environ 5g/jour entre la 14e et 15e semaine de grossesse, 10g/jour à 20 semaines de grossesse et 30-35g/jour entre 32 et 40 semaines de grossesse.
1.3.1.2 RCIU symétrique et asymétrique
La RCIU se divise en deux catégories ;
Symétrique:
Atteint de 20 à 30 % des fœtus avec une RCIU.
Tous les organes sont atteints de façon proportionnelle en raison d'une atteinte de l'hyperplasie cellulaire en début de grossesse.
Causes: anomalies chromosomiques, infection congénitale, euploïdie, désordre génétique et l’insuffisance utéro-placentaire (le flot des artères utérines et de la veine ombilicale est anormal).
S'établit tôt en grossesse et plus rare.
Asymétrique:
Atteint de 70 à 80 % des fœtus avec une RCIU.
Diminution du volume abdominal (foie, graisse sous-cutanée). L'asymétrie est secondaire à la capacité du fœtus à s'adapter à
l'environnement en redistribuant le sang aux organes vitaux (cerveau et cœur).
Secondaire en général à une insuffisance utéro-placentaire compensée à son début.
S'établit plus tard en grossesse.
1.3.1.3. Causes d’une RCIU26-28
Facteurs fœtaux et placentaires
L’insuffisance placentaire : telle que traité plus haut
Infection: 5 % des cas, les virus et parasites peuvent gagner l'accès à la barrière, le cytomégalovirus (CMV) le plus fréquent.
Grossesse multiple Anomalie congénitale Facteurs génétiques:
Contribue à 30-50 % du poids fœtal (plus d'influence maternelle que paternelle). Les femmes de petit poids et de petite taille
Antécédent de RCIU fœtal.
Anomalie du caryotype (aneuploïdie, trisomie, mutation, etc. )
Facteurs Maternels
Les pathologies suivantes peuvent causer une réduction dans le flot utéro- placentaire :
o Pathologies maternelles (HTA, insuffisance rénale, diabète, collagène, lupus, etc.)
o Pathologie entraînant l'hypoxie: pathologies pulmonaires, anomalies cardiaques cyanotiques, anémie, résidents en haute altitude.
o Diminution de l'apport calorique.
Autres facteurs
Désordres immunologiques et hématologiques (auto-immun, anémie falciforme, cigarette, toxines), malformations utérines.
1.3.1.4. Diagnostic échographique de la RCIU
De nombreux paramètres échographiques sont utilisés pour identifier la RCIU :
1. Poids fœtal estimé <10e percentile (RCIU) 2. Circonférence abdominale <5e percentile
3. Ratio périmètre crânien/circonférence abdominale <10e percentile 4. Longueur du fémur/circonférence abdominale ratio > 23,5
5. Vélocité de la croissance circonférence abdominale <11mm dans 14 jours 6. Diminution de l’index de l'artère cérébrale
1.3.2 La prééclampsie
La prééclampsie est une hypertension artérielle accompagnée de protéinurie après la 20e semaine de grossesse chez une femme originalement normotensive. L'éclampsie est le développement de convulsion (épilepsie) de type grand mal chez une patiente souffrant de prééclampsie.16, 29, 30
1.3.2.1. Incidence
Les pathologies hypertensives compliquent environ 5 à 10% des grossesses. La prééclampsie atteint 3-8% de toutes les grossesses sur une échelle mondiale, 5-8% de toutes les grossesses aux États-Unis et environ 2 à 4% des grossesses au Canada.
1.3.2.2. Classification
Légère: Tension artérielle ≥ 140/90 mmHg, Protéinurie ≥ 300mg/24h ou 30mg/dl Sévère: Tension artérielle ≥ 160/110 mmHg et un facteur défavorable parmi les
suivants : protéinurie ≥ 3g/24h, créatinine ≥ 1,2 mg/dl, thrombocytopénie ≤ 100000, signes d'hémolyse (LDH ↑), lésions hépatocellulaires (↑ALT ou AST), symptômes visuels (scotomes) ou cérébraux (céphalée), douleur épigastrique, oedème cérébral, hémorragie cérébrale.
1.3.2.3. Facteurs de risques16
Antécédent personnel de prééclampsie Première grossesse (nulliparité) Antécédent familial de prééclampsie Diabète gestationnel ou pré-grossesse Grossesse multiple
Obésité
Hypertension et/ou pathologie rénale préexistante Syndrome anti-phospholipide
Intervalle prolongé ou raccourcit entre les grossesses, < 2ans ou > 10 ans.
1.3.2.4. Signes et symptômes
Les manifestations cliniques sont en général expliquées par la réponse maternelle à la dysfonction endothéliale généralisée et par l’insuffisance placentaire associée.
Symptômes Céphalée Scotomes Douleurs épigastriques Irritabilité Signes
Maternelle : voir classification pour les signes cliniques. Fœtal:
o RCIU
o Naissance prématurée o Mort néonatale
1.3.3 Prédiction de la RCIU et de la prééclampsie
On tente de prédire tôt en grossesse la RCIU et la PE depuis de nombreuses années. Plusieurs marqueurs ont été rapportés dans de nombreuses études.31-33 Ces facteurs incluent des marqueurs biophysiques, angiogéniques et des marqueurs échographiques comme le Doppler des artères utérines discutés plus haut. Un nombre croissant d’évidences suggère que la combinaison de marqueurs puisse permettre de prédire une proportion importante de ces pathologies34-37.
1.4. Le Volume placentaire
1.4.1. Historique
Comme il existe une association entre le volume ou le poids du placenta à la naissance et la présence de RCIU, il y a donc un intérêt scientifique pour la mesure du volume placentaire par échographie tôt en grossesse depuis plusieurs années. Le volume placentaire a été mesuré à l’aide de nombreuses techniques incluant l’échographie bidimensionnelle, l’échographie tridimensionnelle et la résonance magnétique. En 2001, Tham et al. ont déterminé que le volume placentaire au 2e trimestre évalué par méthode bidimensionnelle était associé à un petit poids à la naissance, p = 0.0338. Duncan et al. en 2001 ont également prouvé la faisabilité de mesurer le volume placentaire entre 20 semaines de grossesse jusqu’à terme en utilisant l’échographie planaire en résonnance magnétique.39L’échographie tridimensionnelle s’étant grandement améliorée au cours de la dernière décennie, celle-ci devient un outil de plus en plus intéressant pour la mesure du volume placentaire.
1.4.2. Techniques de mesure du volume placentaire
1.4.2.1 La méthode échographique bidimensionnelle
La méthode bidimensionnelle permet d’effectuer une estimation du volume placentaire. En 1987, Wolf et al. démontrent la faisabilité de l’estimation de la mesure du volume placentaire au 2e trimestre avec l'échographie bidimensionnelle.3, 40-43
Tout d’abord, un premier cliché est effectué de façon latérale au placenta pour en évaluer l’épaisseur. Ensuite, la longueur et la largeur maximum sont ensuite évaluées à partir d’un même cliché. Le volume est ensuite estimé (VPE) au moyen de la formule suivante : V = (πT/6)*[4H(W-T) + W(W-4T) + 4T2], V= volume, T= Épaisseur du placenta, H= hauteur du placenta. Selon Azpurua et al.43 en 2010, cette méthode a une excellente reproductibilité intra-observateur (Coefficient corrélation : 0.99) et une excellente corrélation entre le VPE
(estimé peu de temps avant l’accouchement) et le poids placentaire réel (mesuré à la naissance). En 2012, Rosner et al.44 ont démontré une bonne corrélation entre la technique d’échographie bidimensionnelle et celle tridimensionnelle au 1er trimestre (71cm3 vs 64cm3, ICC 0.65m 95% CI 0.51-0.75). La limite principale de la méthode bidimensionnelle est la durée de la procédure et le fait qu’elle ne permet pas d’évaluer la vascularisation placentaire.
1.4.2.2 La méthode échographique tridimensionnelle (3D)
La méthode de mesure inclut un balayage entier tridimensionnel du placenta autour d’un axe fixe qui entraîne simultanément la production d’une séquence de 6 à 12 images parallèles et planaires.45 À partir de ces images, il est possible d’identifier le contour du placenta pour chacune de celle-ci. Le programme informatique habituellement utilisé, VOCAL (Virtual Organ Computer-aided AnaLysis), permet d’intégrer les mesures des contours du placenta en un « volume » rapporté en cm3. Par la suite, il est possible de comparer le volume obtenu à des chartes établies selon l’âge gestationnel.46, 47 L’excellente reproductibilité de la mesure du volume placentaire a été démontrée pour les mesures réalisées entre 11 et 18 semaines de grossesse par Deurloo et al48, et entre 11-13 semaines de grossesse par Burstein et al.49
Un avantage important de l’échographie tridimensionnel est la possibilité d’ajouter une mesure de la vascularisation intra-placentaire grâce aux techniques d’angiographie échographique.45, 48, 50-52 Les mesures de vascularisation évaluées sont les suivantes:
Index de vascularisation (VI) : Cet index permet d’estimer la proportion du volume
placentaire constitué de liquide (sang) en circulation. Il représente donc la proportion de vaisseaux sanguins à l’intérieur du placenta.
Index du Flot (FI) : Cet index est proportionnel au flot des globules rouges en circulation
à l’intérieur du volume évalué.
Index du flot de la vascularisation (VFI) : Cet index est calculé à partir de la
combinaison du VI et FI. Il est proportionnel au volume de globules rouges circulant dans le volume placentaire étudié par unité de temps.
1.4.3. Association entre le volume placentaire, le poids de naissance et la
prééclampsie
Nous avons retrouvé plus de 1000 références à partir du site de recherche Medline et Embase (1999- 2011, études humaines) en utilisant les mots-clés suivants: placenta* et (three-dimension* ou 3D ou volume* ou size). Je vous résume dans le tableau 4 les principaux résultats.
Tableau 3.Revue de littérature sur le volume placentaire mesuré en période anténatale. Auteurs
(année) N gest. Âge placentaire Evaluation Résultats
1
Burstein et al. (2009)49
20 11-13.0 Échographie 3D Reproductibilité du volume placentaire moyen a été confirmée. Kappa= 0.8
2 De Paula et al. (2008)47 295 12-40 Échographie 3D Tables de références du volume placentaire reporté en cm3 selon l’âge
gestationnel.
3
Deurloo et al. (2007)48
34 11-18.0 Échographie 3D Reproductibilité du volume placentaire entre 11-18 semaines. Coefficient corrélation intra et interobservateur (0.99, 0.97). 4 Duncan et al. (2001)39 55 19-40 Echo-planaire/ Résonance magnétique Confirmation de faisabilité de l’échographie planaire utilisant la résonance magnétique
5 Hafner et al. (2006)51 2489 11-13.0 Échographie 3D
Le quotient placentaire (volume placentaire/LCC) ≤ 10e percentile est associé au PAG et à la PE.
6 Hafner et al. (2001)50 1060 11-13.0 Échographie 3D
Corrélation entre le volume placentaire au 1er trimestre et le Doppler de l’artère utérine au 2e trimestre.
7 Law et al. (2009)4 619 18-22 Scanner 4-8 Mhz 4D transducer
Le volume placentaire et le Doppler des artères utérines sont des
prédicteurs indépendants pour les PAG.
8
Metzenbauer et al. (2002)53
1476 - Quotient placentaire (volume placentaire /LCC)
Association significative entre quotient placentaire et poids à la naissance.
9 Metzenbauer et al. (2001)54
1462 End of 1 st Échographie 3D
La corrélation a été établie entre le volume placentaire et la PAPP-A et f-β-hCG (r=0.28, p< 0.001; et: r=0.10, p< 0.001). 10 Metzenbauer et al. (2002)55 2863 10-13.0 Échographie 3D
Le quotient placentaire est plus faible chez les fœtus porteur d’une anomalie
chromosomique (0.67 vs 0.98, p<0.05)
N= nombre de patientes, Age gest.= âge gestationnel en semaines de grossesse
La mesure tridimensionnelle du volume placentaire peut être utilisée au courant du premier trimestre mais il est important de considérer la croissance placentaire importante au cours de cette période. La moyenne du volume placentaire à été évalué par Burstein et al.
Auteurs (année) N Âge gest. Evaluation placentaire Résultats
11 Nowak et al. (2008)56 37 1 trim st VOCAL methods Multiplanar and
Le volume placentaire augmente avec l’âge gestationnel au 1er trimestre (r=0.791 pour VOCAL 12 degrés, r=0.801 pour 30 degrés et r=0.783 pour la méthode multiplanaire).
12 Odibo et al. (2011)57 388 11-14 Échographie 3D
Absence d’association entre volume placentaire et PE. PE est plutôt associée à une diminution des indices de vascularisation
13
Plasencia et al. (2011)58
3104 11-13 Échographie 3D Le volume placentaire est réduit chez les RCIU. (0.88 MoM, p<0.0001)
14 Proctor et al. (2009)3 90 18-23.6 Échographie 2D
PAPP-A bas et longueur placentaire <10 cm combinés sont associés à la RCIU,
l’accouchement prématuré et la
mortinaissance. (RR, 3.96; 95% CI, 2.21- 5.98; RR, 3.96; 95% CI, 2.21-5.98; et RR, 6.44, 95% CI, 2.74-14.54, respectivement).
15 Rizzo et al. (2009)59 80 11-13.6 Échographie 3D
Les indices de vascularisation sont significativement reliées au poids de
naissance (VI r = 0.563, FI r = 0.580, VFI r = 0.601; p < .001).
16 Rizzo et al. (2008)60 348 11-14.0
Doppler artérielle et Échographie 3D
Le volume placentaire est plus bas chez les grossesses qui ont développé une
prééclampsie (t=4.636, p<0.003), particulièrement les PE <32 semaines (t=9.704, p<0.0002).
17 Thame et al. (2001)38 712 14,17,2 0 Échographie 2D Association significative entre le volume placentaire et le poids de naissance.
18
Zalud et al.
(2007)61 199 14-25 Échographie 3D On définit un volume placentaire normal et volume artériel et échelle de gris normal dans le second trimestre utilisant
l’échographie 3D.
19 Schuchter et al.
(2001)62
356 15-17.0
Échographie 3D
Les quotients du poids fœtal et volume placentaire peuvent assister au diagnostic de grossesses à risques élevés et de gros foetus avec un petit placenta.
A environ 67.5 +/- 26.7 mL.49 De Paula et al. ont mis en place une échelle de référence du volume placentaire par rapport à l'âge gestationnel et le poids fœtal estimé47. Ils ont rapporté un volume placentaire moyen allant de 83cm3 à 12 semaines de grossesse jusqu’à 428 cm3 à 40 semaines. Bien qu’une corrélation importante semble exister entre le volume placentaire et le poids de naissance, très peu d’études ont évalué la valeur prédictive du volume placentaire au 1er trimestre pour les issues de grossesse et les résultats demeurent controversés, surtout en ce qui concerne la prédiction de la prééclampsie.57, 60
1.5. Hypothèse de recherche et objectifs
1.5.1. Hypothèse :
Il existe une corrélation directe entre le volume placentaire évalué par échographie tridimensionnelle au 1er trimestre de la grossesse et le poids à la naissance
1.5.2. Objectifs
:1.5.2.1 Principal : Évaluer la corrélation entre le volume placentaire, évalué par
échographie tridimensionnel au 1er trimestre de la grossesse et le poids de naissance (mesuré en percentile);
1.5.2.1 Secondaire : Évaluer l’association entre le volume placentaire tridimensionnelle au
CHAPITRE 2
Association between first-trimester placental volume and
birth weight
Mona Effendi, MD, MSc, Yves Giguère, MD, PhD, Jean-Claude Forest, MD, PhD, Normand Brassard, MD, MBa, Mario Girard, RT, Katy Gouin, MD,
Diane Tessier RT, Emmanuel Bujold, MD, MSc.
Department of Obstetrics & Gynaecology, Faculty of medicine, Centre Hospitalier
Universitaire de Québec, Université Laval, Québec, QC, Canada Department of Social and Preventive Medicine, Faculty of medicine,
Association between first-trimester placental volume and birth
weight
Abstract
OBJECTIVE: To estimate the correlation between first-trimester placental volume and
birth weight, small-for-gestational-age (SGA), and preeclampsia. METHODOLOGY: A prospective study of women with singleton pregnancy recruited at 11-13 weeks of gestation was conducted. Placental volume was measured using three-dimensional ultrasound and reported as multiple of median (MoM) for gestational age. Participants were followed until delivery. Birth weight was collected and reported in percentile for gestational age. Pearson’s correlation test and Mann-Whitney test were used. RESULTS: We reached a complete follow- up for 543 eligible women. A significant correlation between placental volume and birth weight (correlation coefficient: 0,15; p<0.0001) was found. Neonates small-for-gestational-age <10th percentile had a smaller placenta volume (median MoM:
0,67; interquartile range: 0,38-1,00) and neonates large-for-gestational-age (>90th percentile) had a larger placental volume (median MoM: 0,98; 0,64-1,56) than neonates between the 10th and 90th percentile (median MoM: 0,38-1,00) (p<0.0001). First-trimester placental volume was not associated with the risk of preeclampsia (p=0.87).
CONCLUSION: There is an excellent correlation between first trimester placental
volume and birth weight. No correlation was found between placental volume and the risk of preeclampsia.
Introduction
Intra-uterine growth restriction (IUGR) is a complication of pregnancy commonly related to placental insufficiency and small placenta weight.28 Small placental size or volume at mid-trimester ultrasound can identify women at high-risk of IUGR.3, 38, 40, 53, 54 Measurement of placental volume as early as the first-trimester could also predict IUGR and preeclampsia, but such associations have been disputed.57, 58, 60 Plasencia et al. reported a strong correlation between first-trimester placental volume and birth weight in a cohort of3,104 singleton pregnancies.58 However, they did not report whether or not the placental volume was associated with the risk of preeclampsia.
There has been a growing interest in the early prediction of IUGR and preeclampsia after the publication of some meta-analyses suggesting that most cases of IUGR and preeclampsia, and mainly the severe and early forms of preeclampsia, can be prevented using aspirin initiated in early pregnancy.5, 63, 64 Several combinations of biophysical, biochemical, and ultrasonography markers have been proposed to predict those diseases with heterogeneous results.34-37, 65 In the current study, we aimed to evaluate the value of first-trimester placental volume using 3D Doppler ultrasound for the prediction of IUGR and preeclampsia.
Methods
We performed a prospective cohort study of pregnant women from March 2010 to January 2011 after approval from the Scientific and Ethic Committee of the CHU de Québec.
Singleton pregnancies were recruited before 14 weeks of gestation. Multiple pregnancies, fetus with suspected lethal malformation or chromosomal anomalies (verified at posteriori) and pregnancies that ended by a spontaneous abortion before 20 weeks, were excluded. After written consent had been obtained, each woman filled a medical and obstetrical
questionnaire. An ultrasound was scheduled and performed between 11 weeks + 0 days and 13 weeks + 6 days where crown- lump length (CRL) was measured and three-dimensional sweeps of the entire placenta was acquired using Voluson 730 Expert ultrasound machines (GE Medical Systems, Milwaukee, WI, USA) equipped with a 4-8 MHz transducer. The participants were followed until delivery and medical records were reviewed for perinatal data including birth weight, placental weight, gestational age, and the presence of preeclampsia. The definition of preeclampsia was that of the International Society for the Study of Hypertension in Pregnancy.66 The systolic blood
pressure should be 140 mm Hg or more and/or the diastolic blood pressure should be 90 mm Hg or more on at least two occasions 4 h apart after 20 weeks of gestation in previously normotensive women, and there should be proteinuria (300 mg or more in 24 h) or two readings of at least ++ on dipstick analysis of midstream or catheter urine specimens if no 24-hour collection was available. In preeclampsia superimposed on chronic hypertension, significant proteinuria (as defined above) should develop after 20 weeks of gestation in women with known chronic hypertension (history of hypertension before conception or the presence of hypertension at the booking visit before 20 weeks of gestation in the absence of trophoblastic disease). The medical record of each case with suspicion of hypertensive disorder was reviewed by a medical doctor. The definition of small for gestational age (SGA) was birth weight below the 10th percentile according to gestational age and sex of a standard birth weight curve used in our population.67 The
definition of large for gestational age (LGA) was birth weight greater the 90th percentile. Birth weight between the 10th and the 90th percentile was reported as adequate for gestational age (AGA).
Placental weight was also reported as MoM for gestational age after calculation of the median for each gestational age subgroup at birth (28-31 weeks; 32-36 weeks; >36 weeks).
First-trimester placental volume was measured for each participant by a single medical doctor (M.E.) who had been previously trained to measure placental volume with excellent reproducibility and who was blinded to all clinical data. We used a technique similar to those previously published.57, 58, 60 The VOCAL (Virtual Organ Computer-aided Analysis) technique was used to obtain a sequence of 6 sections of the placenta, each after a 30 ° rotation from the previous one. In each of the 6 planes, the contour of the placenta was drawn manually, taking care to exclude the uterine wall. Placental volume was automatically calculated by the built-in scanner software from the areas highlighted in each of the 6 planes. When the calculation was finished, the computed reconstruction of the organ was displayed together with the volume. The distribution of placental volume was made Gaussian after logarithmic transformation. The median log10 placental volume was
then calculated according to CRL categorized into four subgroups: 45-54 mm; 55-64 mm; 65-74 mm; and 75-84 mm. Then, each participant’s log10 placental volume was
divided by the median volume of the corresponding CRL’s subgroup; which was reported as the log10 placental volume multiple of median (MoM).
Non parametric test were used to evaluate the correlation between placental volume and perinatal outcomes, birth weight and placental weight, including Spearman correlation test, Mann-Whitney U test, and chi-squared test. Receiver operating characteristic (ROC) curves analysis was used to evaluate the optimal performance of screening for SGA using placental volume measurement. SPSS 20.0 (SPSS Inc., Chicago, Ill., USA) was used to compute the data. P values below 0.05 were considered significant.
Results
A total of 607 women were recruited at a mean gestational age of 12 weeks and 6 days. Of them, 64 women were excluded of the analyses: 47 were not eligible at the time of the 11-13 weeks ultrasound (multiple pregnancy, miscarriage, inadequate CRL); 5 women had an interruptions of pregnancy for fetal anomalies; there were 3 cases of fetal miscarriage after recruitment; 7 cases loss to follow-up; and 2 cases who did not have adequate placental tridimensional ultrasound. From the 543 women included in the analyses, 12 (2.2%) developed preeclampsia and 31 (5.7%) delivered a SGA neonate, including 4 women who had combined both preeclampsia and SGA. There was no case of early-onset (<34 weeks) preeclampsia. Table 1 reports the characteristics of each group. Of note, we observed that women with SGA neonates without PE were younger, more likely to be smokers, and had a smaller placental weight at birth.
Table 1. Characteristics of eligible women.
Continuous variables are reported in median with their interquartile range. *p<0.05
No PE / no SGA
(reference group)
SGA / no PE PE / no SGA SGA and PE
N = 504 N = 27 N = 8 N = 4
Maternal age (years)
30 (27 – 32) 27 (26 – 33) 31 (28 – 35) 29 (27 – 34)
Body mass index
(kg/m2) 23 (21 – 26) 23 (20 – 26) 27 (21 – 36) 23 (20 – 26) Nulliparous (n) 249 (50%) 16 (59%) 6 (75%) 0 Smoker (n) 39 (7.7%) 6 (22%)* 0 0 Crown-rump length (mm) 62 (56 – 68) 64 (51 – 69) 60 (58 – 64) 60 (58 – 67) Gestational age at delivery (weeks) 40 (39 – 40) 39 (39 – 40) 38 (35 – 38)* 38 (37 – 39) Birth weight (grams) 3407 (3120 – 3730) 2602 (2395 – 2766)* 2953 (2398 – 3793) 2398 (1927 – 2650)* Placental weight (grams) 511 (446 – 577) 381 (354 – 453)* 463 (405 – 619) 426 (290 – 534)
Using Spearman’s test, we found that placental volume was significantly associated with CRL (p<0.001), but not with maternal age (p=0.22), maternal BMI (p=0.90) or parity (p=0.99). Figure 3 shows the distribution of placental volume according to CRL: the median placental volume increases with advancing CRL from 34 ml at CRL of 45-54 mm, to 37 ml at CRL of 55-64 mm, 47 ml at CRL of 65-74 mm and 56 ml at CRL of 75-84 mm.
Figure 3. Placental volume measured by 3D Doppler ultrasound according to crown-rump
length at 11-13 weeks’ gestation
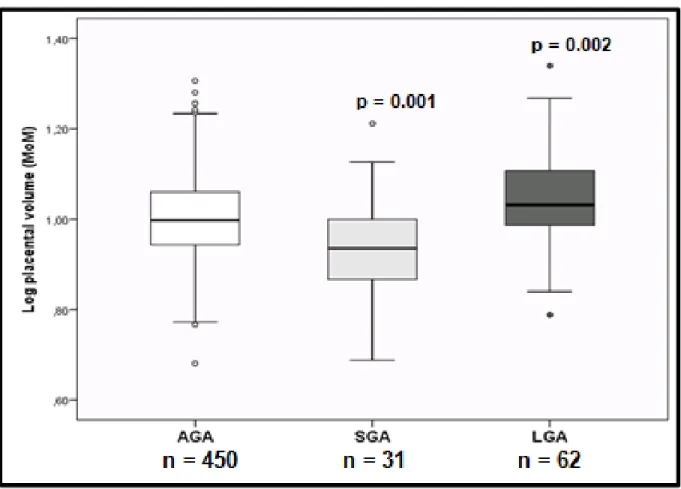
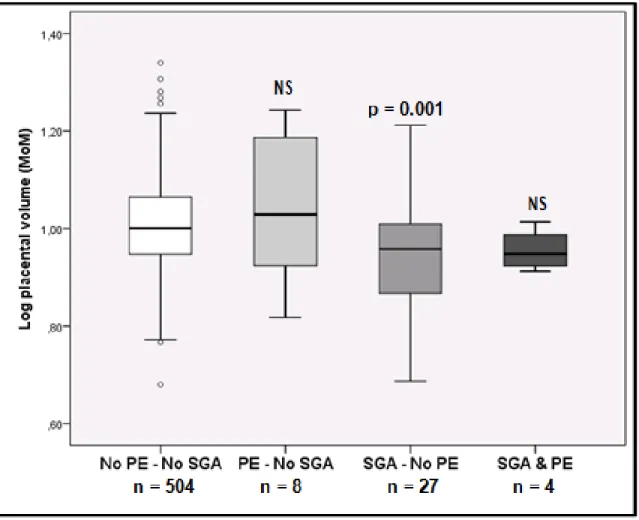
First-trimester log transformed placental volume MoM was strongly associated with birth weight (correlation coefficient (cc): 0.18; p<0.001), birth weight percentile (cc: 0.17; p<0.001); placental weight at birth (cc: 0.21; p<0.001); and placental weight MoM adjusted for gestational age (cc: 0.22; p<0.001). SGA neonates were associated with a smaller first-trimester placental volume and LGA neonates were associated with larger placental volume than AGA neonates (figure 4). On the other hand, women who developed preeclampsia without SGA had a similar first-trimester placental volume when compared to women without preeclampsia or SGA (figure 5).
Figure 4. First-trimester placental volume at 11-13 weeks’ gestation in AGA, SGA and
LGA neonates.
Placental volumes are expressed in MoM adjusted for gestational age and reported as median, interquartile range (box) and range (whisker plots) for each subgroup.
Figure 5. First-trimester log-transformed placental volume at 11-13 weeks’ gestation in
women with or without preeclampsia and SGA neonates.
Log10 transformed placental volumes are expressed in MoM adjusted for gestational age and reported as median, interquartile range (box) and range (whisker plots) for each subgroup.
Looking at placental vascularization indices, we found that VI, FI and VFI correlated with maternal BMI (p<0.001) and parity (p<0.001), but not with CRL or maternal age. After log10 transformation and adjustment for maternal BMI and parity, we found that placental
VI and FI MoM were lower in women who subsequently developed preeclampsia or had a SGA neonate compared to the reference group (table 2).
Table 2. First-trimester placental vascularization indices according to pregnancy outcomes.
The indices are log transformed, adjusted for maternal BMI and reported in MoM with their interquartile range. *p<0.05
No PE or SGA
(reference) PE – No SGA SGA – No PE SGA & PE
Log10 VI 1.01 (0.77 – 1.21) 0.64 (0.23 – 1.05)* 0.81 (0.67 – 1.16)* 0.76 (0.49 – 1.17)
Log10 FI 1.00 (0.97 – 1.02) 0.99 (0.93 – 1.01) 0.99 (0.95 – 1.02) 0.98 (0.97 – 1.02)
Log10 VFI 1.02 (0.68 – 1.31) 0.52 (-0.08 – 1.14)* 0.76 (0.51 – 1.20) 0.68 (0.31 – 1.26)
Discussion
We found that first-trimester placental volume as measured by 3D Doppler ultrasound is smaller in women who will deliver a SGA neonate and larger in women who will deliver a LGA neonate. Women who subsequently developed preeclampsia had smaller values of first-trimester placental VI and VFI but similar placental volume when compared to the reference group.
Our data are in agreement with those of Plasencia et al. who previously demonstrated the positive correlation between first-trimester placental volume and birth weight.58 They are
also in agreement with those of Odibo et al. who found lower 3D power Doppler vascular flow indices in pregnancies that develop PE.57 However, similarly to Odibo et al., we did not confirm the findings of Rizzo et al. who suggest that small first-trimester placental volume was a strong predictor of preeclampsia.60 Such differences can potentially be explained by the fact that our studied population had a low risk of preeclampsia (2.1% compared to 4.5% in the Rizzo’s study) and much less severe cases (we observed no case of preeclampsia before 32 weeks’ compared to 6 (38%) out of 16 cases in the Rizzo’s study). Early-onset preeclampsias are more related to placental disorders than term preeclampsia.68
Our study is definitively limited by the fact that we observed only a small number of preeclampsia and no case of early-onset preeclampsia: we cannot speculate on the predictive value of first-trimester placental volume for early-onset preeclampsia. However, our study has several strengths: its prospective design; the measurement of placental volume was performed blinded to clinical data; placental volume and vascularization indices were adjusted for potential confounding factors including gestational age, maternal BMI and parity; and the low rate of participants lost to follow-up.
Our study did not aim to evaluate the predictive values of placental volume or vascularization indices for preeclampsia or SGA. However, our results suggest that their discriminatory ability would be modest. Added to the fact that an adequate equipment and expertise are mandatory to obtain reliable data, we believe that such biomarkers are not likely to become useful clinically at this time. Nevertheless, our results suggest that the different pathological processes that will lead to different placental pathologies that have been observed in cases of preeclampsia and SGA after birth are probably already initiated in the first-trimester of pregnancy.
In conclusion, our study suggests that pregnancies complicated by SGA and/or PE can show differences in terms of placental volume and placental vascularization indices using 3D ultrasound at 11-13 weeks of gestation.
Acknowledgements
Dr Emmanuel Bujold holds a Clinician Scientist Award from the Canadian Institute for
Health Research and the Jeanne et Jean-Louis Lévesque Perinatal Research Chair at Université Laval who funded the current study.
Yves Giguère is a senior clinical research scholar from the FRQ-S (Fonds de la recherche
CHAPITRE 3- DISCUSSION/CONCLUSION
Dans notre étude, nous avons constaté que le volume placentaire mesuré par échographie tridimensionnel au 1er trimestre de grossesse était corrélé de façon significative avec le percentile du poids de naissance. Nous n’avons noté aucune corrélation entre le volume du placenta et la PE. Néanmoins, nous avons constaté que les indices de vascularisation VI et VFI, mesuré à l’aide de l’échographie 3D combiné au Doppler de puissance, était diminués chez les femmes qui allaient développer une PE.
Notre étude suggère donc que les processus pathologiques placentaires liés au petit poids de naissance et à la PE sont différents, et ce, dès le 1er trimestre de la grossesse. Cette observation est en accord avec de nombreuses études ayant évalué les pathologies placentaires après la naissance.57, 68
Nous avons démontré que le volume placentaire est plus réduit chez les patientes dont le fœtus développera une RCIU. Par ailleurs, les patientes avec des bébés plus gros pour l’âge gestationnel (GAG) avaient un volume placentaire plus élevé.
Notre étude est en accord avec Plasencia et al, qui ont également démontré une corrélation positive entre le volume placentaire au premier trimestre et le poids du nouveau-né.58 Nos données sont également en accord avec celles d’Odibo et al,57 qui ont trouvé que les indices de vascularisation (évalués par Power Doppler) sont réduits chez les patientes atteintes de prééclampsie. Cependant, contrairement à Odibo et al, nous n’avons pas confirmé les observations de Rizzo et al, qui ont suggéré qu’un volume placentaire réduit au premier trimestre était un fort prédicteur de la prééclampsie.60 Cette différence peut être probablement expliquée par le fait que notre population avait un faible taux de prééclampsie (2.1% comparativement à 4.5% pour l’étude de Rizzo) dont beaucoup moins de cas de prééclampsie sévère (aucun cas de prééclampsie avant 32 semaines de grossesse comparativement à 6 cas (38%) sur 16 dans l’étude de Rizzo). Les prééclampsies qui se manifestent précocement en grossesse sont probablement plus reliées aux anomalies placentaires que les prééclampsies se manifestant à terme.
Notre étude à définitivement été limité par le fait que nous n’avions observé qu’un petit nombre de cas de prééclampsie et aucun cas de prééclampsie précoce; ainsi, nous ne pouvons nous prononcer sur la valeur prédictive du volume placentaire au premier trimestre pour les prééclampsies précoces. Cependant, notre étude a de nombreux points forts; une structure appropriée, les mesures du volume placentaire ont tous été effectués en double aveugle, le volume placentaire et les indices de vascularisation ont tous été ajustés pour des facteurs potentiels de confusion incluant l’âge gestationnel, l’indice de masse corporelle maternel et la parité ; et finalement un nombre très faible de participantes perdues au suivi.
Notre étude n’avait pas pour but d’évaluer la valeur prédictive du volume placentaire ou des indices de vascularisation de la prééclampsie et de la RCIU. Cependant, nos résultats suggèrent que leur capacité discriminatoire est modeste. En plus de nécessiter d’un équipement adéquat et d’une expertise spécialisée pour obtenir des données fiables, nous croyons que ces biomarqueurs ont peu de chances de devenir cliniquement utiles dans les prochaines années.
En conclusion, notre étude suggère que les grossesses compliquées par la RCIU et/ou la PE, évaluées par échographie 3D entre 11 et 13 semaines de grossesse, présentent des différences en terme de volume placentaire et indices de vascularisation. De plus, nos résultats suggèrent que les différents processus pathologiques qui mèneront aux pathologies placentaires observées dans les cas de prééclampsie et de RCIU après la naissance sont probablement déjà amorcés au premier trimestre de grossesse, mais l’utilité clnique de ces marqueurs reste à démontrer.
Bibliographie
1. WHO. Risking death to give life. 2005
2. Dolea C AC. Global burden of hypertensive disorders of pregnancy in the year 2000. Evidence and information for policy (eip). 2003
3. Proctor LK, Toal M, Keating S, Chitayat D, Okun N, Windrim RC, Smith GC, Kingdom JC. Placental size and the prediction of severe early-onset intrauterine growth restriction in women with low pregnancy-associated plasma protein-a. Ultrasound Obstet Gynecol. 2009;34:274-282
4. Law LW LT, Sahota DS, Chan LW, Fung TY, Lau TK. Which ultrasound or biochemical markers are independent predictors of small-for-gestational age? . Ultrasound Obstet Gynecol. 2009;34:283-287
5. Bujold E, Roberge S, Lacasse Y, Bureau M, Audibert F, Marcoux S, Forest JC, Giguere Y. Prevention of preeclampsia and intrauterine growth restriction with aspirin started in early pregnancy: A meta-analysis. Obstet Gynecol. 2010;116:402-414
6. Bujold E, Effendi M, Girard M, Gouin K, Forest JC, Couturier B, Giguere Y. Reproducibility of first trimester three-dimensional placental measurements in the evaluation of early placental insufficiency. J Obstet Gynaecol Can. 2009;31:1144-1148 7. Morel O, Pachy F, Chavatte-Palmer P, Bonneau M, Gayat E, Laigre P, Evain-Brion D,
Tsatsaris V. Correlation between uteroplacental three-dimensional power doppler indices and true uterine blood flow: Evaluation in a pregnant sheep model. Ultrasound Obstet Gynecol. 2010;36:635-640
8. Chaddha V, Viero S, Huppertz B, Kingdom J. Developmental biology of the placenta and the origins of placental insufficiency. Semin Fetal Neonatal Med. 2004;9:357-369
9. De Falco S. The discovery of placenta growth factor and its biological activity. Exp Mol Med. 2012;44:1-9
10. Kiserud T. Physiology of the fetal circulation. Semin Fetal Neonatal Med. 2005;10:493-503 11. Kiserud T, Acharya G. The fetal circulation. Prenat Diagn. 2004;24:1049-1059
12. Struijk PC, Mathews VJ, Loupas T, Stewart PA, Clark EB, Steegers EA, Wladimiroff JW. Blood pressure estimation in the human fetal descending aorta. Ultrasound Obstet Gynecol. 2008;32:673-681
13. Hirano H, Imai Y, Ito H. Spiral artery of placenta: Development and pathology-immunohistochemical, microscopical, and electron-microscopic study. Kobe J Med Sci. 2002;48:13-23
14. Fox H. The histopathology of placental insufficiency. J Clin Pathol Suppl (R Coll Pathol). 1976;10:1-8
15. Espinoza J, Romero R, Mee Kim Y, Kusanovic JP, Hassan S, Erez O, Gotsch F, Than NG, Papp Z, Jai Kim C. Normal and abnormal transformation of the spiral arteries during pregnancy. J Perinat Med. 2006;34:447-458
16. August PM, Baha Sabai, MD. Clinical features, diagnosis and long term prognosis of preeclampsia. 2009
17. August PM, Baha Sabai, MD. Preeclampsia: Clinical features and diagnosis. 2012
18. Muhammad T, Khattak AA, Shafiq ur R, Khan MA, Khan A, Khan MA. Maternal factors associated with intrauterine growth restriction. Journal of Ayub Medical College,
Abbottabad : JAMC. 2010;22:64-69
19. Kelly VM, Nelson LM, Chakravarty EF. Obstetric outcomes in women with multiple sclerosis and epilepsy. Neurology. 2009;73:1831-1836
20. Kajantie E, Thornburg KL, Eriksson JG, Osmond C, Barker DJ. In preeclampsia, the placenta grows slowly along its minor axis. The International journal of developmental biology. 2010;54:469-473
21. Carbillon L, Largilliere C, Perrot N, Tigaizin A, Cynober E, Uzan M. [uteroplacental haemodynamics and uterine artery doppler practice at 12 weeks gestation]. Gynecol Obstet Fertil. 2003;31:378-381
22. Mari G, Hanif F. Fetal doppler: Umbilical artery, middle cerebral artery, and venous system. Semin Perinatol. 2008;32:253-257
23. Cnossen JS, Morris RK, ter Riet G, Mol BW, van der Post JA, Coomarasamy A, Zwinderman AH, Robson SC, Bindels PJ, Kleijnen J, Khan KS. Use of uterine artery doppler ultrasonography to predict pre-eclampsia and intrauterine growth restriction: A systematic review and bivariable meta-analysis. CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne. 2008;178:701-711
24. Gudmundsson S, Korszun P, Olofsson P, Dubiel M. New score indicating placental vascular resistance. Acta Obstet Gynecol Scand. 2003;82:807-812
25. Miller J, Turan S, Baschat AA. Fetal growth restriction. Semin Perinatol. 2008;32:274-280 26. Divon MYMFAM. Diagnosis of fetal growth restriction and overview of causes and risk
factors for fetal growth restriction. 2009
27. Turan OM, Turan S, Gungor S, Berg C, Moyano D, Gembruch U, Nicolaides KH, Harman CR, Baschat AA. Progression of doppler abnormalities in intrauterine growth restriction. Ultrasound Obstet Gynecol. 2008;32:160-167
28. Baschat AA, Hecher K. Fetal growth restriction due to placental disease. Semin Perinatol. 2004;28:67-80
29. Egbor M, Ansari T, Morris N, Green CJ, Sibbons PD. Morphometric placental villous and vascular abnormalities in early- and late-onset pre-eclampsia with and without fetal growth restriction. BJOG. 2006;113:580-589
30. Norwitz EM, Repke John T, MD. Preeclampsia: Management and prognosis. 2009 31. Errol R Norwitz M, PhD. Prediction of preeclampsia. 2012
32. Duckitt K, Harrington D. Risk factors for pre-eclampsia at antenatal booking: Systematic review of controlled studies. BMJ. 2005;330:565
33. Kuc S, Wortelboer EJ, van Rijn BB, Franx A, Visser GH, Schielen PC. Evaluation of 7 serum biomarkers and uterine artery doppler ultrasound for first-trimester prediction of preeclampsia: A systematic review. Obstet Gynecol Surv. 2011;66:225-239
34. Akolekar R, Syngelaki A, Poon L, Wright D, Nicolaides KH. Competing risks model in early screening for preeclampsia by biophysical and biochemical markers. Fetal Diagn Ther. 2012
35. Giguere Y, Charland M, Bujold E, Bernard N, Grenier S, Rousseau F, Lafond J, Legare F, Forest JC. Combining biochemical and ultrasonographic markers in predicting preeclampsia: A systematic review. Clin Chem. 2010;56:361-375
36. Audibert F, Boucoiran I, An N, Aleksandrov N, Delvin E, Bujold E, Rey E. Screening for preeclampsia using first-trimester serum markers and uterine artery doppler in nulliparous women. Am J Obstet Gynecol. 2010;203:383 e381-388
37. Forest JC, Charland M, Masse J, Bujold E, Rousseau F, Lafond J, Giguere Y. Candidate biochemical markers for screening of pre-eclampsia in early pregnancy. Clinical chemistry