MARC-OLIVIER BOUCHARD
NOUVELLE APPROCHE POUR LA MESURE DE LA
SOLUBILITÉ DE L’HYDROGÈNE DANS
L’ALUMINIUM LIQUIDE
Mémoire présentée
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de maîtrise en génie des matériaux et de la
métallurgie
pour l’obtention du grade de Maître ès sciences (M.Sc.)
DÉPARTEMENT DE GÉNIE DES MINES, DES MATÉRIAUX ET DE LA MÉTALLURGIE
FACULTÉ DES SCIENCES ET DE GÉNIE UNIVERSITÉ LAVAL
QUÉBEC
2014
Résumé
La présence d’hydrogène en solution dans l’aluminium liquide entraîne la formation de porosités une fois celui-ci solidifié. C’est pourquoi il est important de bien mesurer la quantité de gaz dissous dans le métal. La méthode de Sieverts, utilisée par d’autres expérimentateurs dans le passé, montre certaines faiblesses et une nouvelle méthode plus fiable et versatile est proposée afin de valider les résultats obtenus précédemment. Après plusieurs tests et améliorations au montage et à la méthodologie, des résultats prometteurs ont été obtenus. En fait, un phénomène attribuable à la dissolution de l’hydrogène dans l’aluminium a été observé. En faisant quelques hypothèses, ces résultats ont permis de valider le modèle mathématique en obtenant une valeur de la solubilité de l’hydrogène dans l’aluminium près de celle des autres expérimentateurs. Suite à ces essais, de nouvelles améliorations ont été apportées au montage et une nouvelle méthodologie de mesure est proposée pour les expérimentations futures.
Abstract
The presence of hydrogen in solution in liquid aluminium leads to the formation of porosities after the solidification. For this reason, a good measurement of the quantity of gas dissolve in the molten metal should be made. The Sieverts’ method, used by the precedents experimenters, shows some weaknesses and a new method more reliable and versatile is proposed to validate the results formerly obtained. After several tests and ameliorations to the measurement system, some promising results were obtained. A phenomenon that can be attributed to the dissolution of hydrogen in liquid aluminium was observed. By making some assumptions, these results were used to validate the mathematical model by obtaining a value of the solubility of hydrogen in aluminum near the other experimenters. Following that, new ameliorations were made to the system and that a new measurement methodology is proposed for the future experimentations.
Avant-Propos
Je tiens d’abord à remercier Daniel Larouche qui m’a permis de travailler sur ce sujet à la fois passionnant et rempli de défis et aussi pour toute son aide et son soutien apportés tout au long des différentes étapes du projet. Je tiens également à remercier l’équipe de professeur du département GML de l’Université Laval.
Je veux aussi à remercier Patrice Chartrand ainsi que toute l’équipe de professeurs, spécialistes de recherche et étudiants gradués du CRCT pour m’avoir accueilli durant les derniers mois de ma maîtrise et pour m’avoir fait connaître ce qu’est le travail dans un centre de recherche de renommée mondiale.
Tout ce travail n’aurait pas pu être réalisé sans l’apport important d’Israël Reix, stagiaire qui a su faire des modifications importantes au montage et effectuer plusieurs tests expérimentaux. De même, qu’Honoré Kamaga qui, suite à mes travaux, a réussi à amener la qualité du montage et de la méthode expérimentale à un niveau supérieur permettant ainsi l’obtention de résultats prometteurs.
L’aide de Daniel Marcotte et Marie-Josée Bouchard, techniciens au département GMN-GML, a été indispensable dans la réalisation de différentes pièces du montage et pour la caractérisation des matériaux utilisés. L’aide de l’équipe de l’atelier d’usinage du département de Physique et de Génie Physique de l’Université Laval a également été grandement appréciée de même que le support de plusieurs fournisseurs. De plus, le support de l’équipe d’étudiants gradués de l’Université Laval a aussi été très apprécié.
L’aide financière du REGAL via le fonds pour les étudiants et du CQRDA via le PARU a été bénéfique à réalisation du projet. Je tiens aussi à remercier le REGAL pour l’organisation des Journées des Étudiants du REGAL qui sont une expérience très enrichissante.
Finalement, je remercie ma conjointe Camille et mes parents Marc et Véronique pour tout le support et l’écoute apportées au long de mon cheminement.
Table des matières
Résumé ... i
Abstract ... ii
Avant-Propos ... iii
Table des matières ... iv
Liste des tableaux ... vii
Liste des figures ... viii
Introduction ... 1
1-Revue de littérature ... 3
1.1-Solubilité de l’hydrogène dans l’aluminium ... 3
1.1.1-Interaction entre l’hydrogène et l’aluminium ... 4
1.1.2-Origine de l’hydrogène ... 5
1.1.3-Formation et dissolution de l’hydrogène ... 6
1.1.3.1-Réaction d’oxydation ... 6
1.1.3.2-Réaction de dissolution ... 6
1.1.3.3-Taux de dissolution et effet de la couche d’alumine ... 7
1.1.3.4-Recombinaison gazeuse lors de la solidification ... 8
1.1.4-Traitement thermodynamique et mathématique de la dissolution de l’hydrogène ... 8
1.1.4.1-Isotherme de Sieverts ... 8
1.1.4.2-Isobares de Van’t Hoff ... 9
1.1.4.3-Traitement simplifié ... 12
1.1.5-Effets des éléments d’alliage sur la solubilité ... 13
1.2-Méthodes de mesure de l’hydrogène en solution ... 15
1.2.1-Méthode de Sieverts ... 15
1.2.1.1-Montage et expériences avec la méthode de Sieverts ... 15
1.2.1.2-Facteurs influençant la qualité des résultats ... 17
1.2.1.3-Méthode de Sieverts modifiée ... 20
1.2.2-Méthode d’extraction d’hydrogène à l’état solide ... 21
1.2.3- Méthode d’extraction par fusion sous azote ... 23
1.2.4-Méthode de recirculation en boucle fermée (Telegas, AlScan) ... 23
1.2.4.1-Principe général ... 24
1.2.4.2-Telegas ... 24
1.2.4.3-Catharomètre ... 26
1.2.4.4-AlScan ... 26
1.2.4.5-Traitement thermodynamique et mathématique des mesures ... 28
1.2.5-Méthode CHAPEL... 29
1.2.6-Méthodes qualitatives ... 29
1.2.6.1-Méthode de la première bulle ... 29
1.2.6.2-Méthode de solidification sous vide partiel ... 30
1.3-Analyse et classement des mesures de la solubilité ... 31
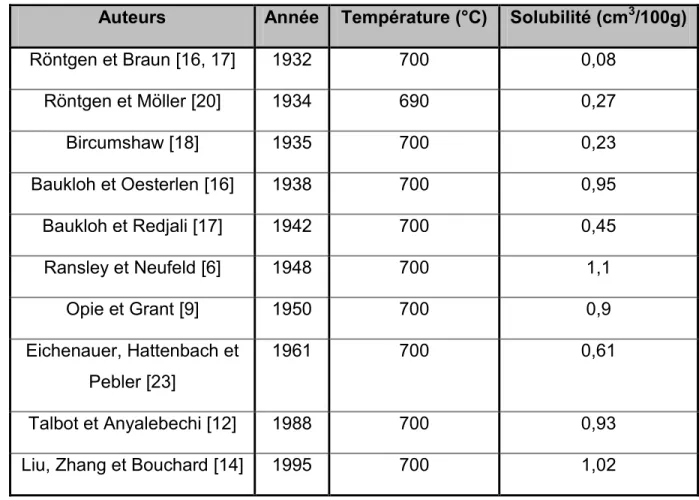
1.3.1-Résultats obtenus précédemment ... 31
1.3.2-Étude des résultats pour la modélisation thermodynamique du système Al-H ... 33
1.4.1-Point de vue d’expérimentateurs ... 37
1.4.2-Analyse des causes d’erreurs ... 38
1.4.2.1-Diffusion et absorption de l’hydrogène dans le verre et les joints ... 38
1.4.2.2-Colonne barométrique au mercure ... 39
1.4.2.3-Gaz inerte utilisé ... 40
1.4.2.4-Composition du creuset ... 40
1.4.2.5-Petites masses de métal utilisées ... 41
1.4.2.6-Atteinte de l’équilibre ... 41
1.4.3.7-Manque d’information sur l’interaction du gaz avec le montage ... 42
1.4.3-Analyse des travaux réalisés ... 43
1.4.3.1-Étude de Ransley et Neufeld ... 43
1.4.3.2-Étude d’Opie et Grant ... 47
1.4.3.3-Étude de Talbot et Anyalebechi... 49
1.4.3.4-Étude de Liu, Zhang et Bouchard ... 50
1.4.3.5-Sommaire des études ... 53
1.4.4-Conclusion de la discussion ... 54
2-Méthode de mesure ... 55
2.1-Nouveauté de la méthode ... 55
2.1.1-Lien avec la méthode de Sieverts ... 55
2.1.2-Nouvelle méthode proposée ... 56
2.2-Montage expérimental ... 57
2.2.1-Chambre de mesure ... 57
2.2.2-Instruments de mesure ... 64
2.2.2.1-Température ... 64
2.2.2.2-Pression ... 64
2.2.2.3-Concentration en hydrogène dans la chambre : H2scan ... 64
2.2.2.4-Concentration en hydrogène dans l’aluminium : AlScan ... 66
2.2.3-Acheminement des gaz et pompes ... 67
2.2.3.1-Contrôleurs de débit massique des gaz ... 67
2.2.3.2-Pompe à vide ... 67
2.2.3.3-Pompe de recirculation ... 67
2.2.3.4-Pompe de bullage ... 68
2.2.4-Assemblage des différentes composantes ... 69
2.3-Procédure expérimentale ... 73
2.3.1-Assemblage du montage expérimental ... 74
2.3.2-Déroulement des expériences ... 77
2.3.3-Historique du développement de la méthode expérimentale et proposition d’une nouvelle méthode ... 84
2.3.3.1-Méthode avec ajout de granules ... 84
2.3.3.2-Méthode de fusion d’une masse d’aluminium ... 86
2.3.3.3-Méthode de bullage d’un mélange H2-N2 dans l’aluminium ... 87
2.3.3.3-Méthode proposée par ajout d’un volume d’H2 pur au N2 et Al ... 89
2.4-Bilan de matière et calcul de la solubilité ... 91
2.4.1-Calcul du volume inerte de la chambre ... 91
2.4.2-Modèle du calcul de la solubilité ... 94 2.4.2.1-Bilan sur le nombre de moles d’hydrogène diatomique dans le gaz96
2.4.2.2-Bilan sur le nombre de moles d’hydrogène monoatomique en
solution ... 97
2.4.2.3-Bilan sur le nombre de moles d’hydrogène diatomique capté par l’acier inoxydable ... 99
2.4.2.4-Bilan global ... 102
3-Résultats ... 104
3.1-Exemples de test préliminaire ... 104
3.1.1-745°C - 6% H2 avant réusinage de la chambre ... 104
3.1.2-760°C - 6% H2 à vide après réusinage de la chambre ... 107
3.1.3-700°C - 6% H2 avec Al après réusinage de la chambre ... 108
3.1.4-750°C - 8,35 %H2 à vide après améliorations majeures ... 110
3.1.5-595°C et 695°C - 12%H2 avec Al après améliorations majeures ... 111
3.2-Exemple d’application du modèle de la solubilité ... 113
3.3-Discussion des résultats ... 118
3.3.1-Effets de l’étanchéité et des fuites ... 118
3.3.2-Effets de l’acier inoxydable ... 120
3.3.3-Effets de la pompe de bullage ... 121
3.3.4-Effets du gradient thermique ... 122
3.3.5-Effets du gaz de dilution ... 123
3.3.6-Effets de l’utilisation d’un creuset en graphite ... 124
3.3.7-Conclusion de la discussion ... 126
Conclusion ... 127
Bibliographie ... 130
Annexe A : Procédure expérimentale technique ... 133
Annexe B : Résultats des mesures du volume et du gradient thermique de la chambre ... 136
Liste des tableaux
Tableau 1 : Valeurs de la solubilité de l'hydrogène dans l'aluminium liquide à 700°C et 1 atm ... 32 Tableau 2 : Sommaire des expériences sur la solubilité de l'hydrogène dans
Liste des figures
Figure 1 : Solubilité de l’hydrogène dans l’aluminium pur en fonction de la
température [2] ... 3 Figure 2 : a) Effet du contenu en hydrogène dans l'aluminium et du taux de
refroidissement sur le pourcentage de porosités d’une pièce [2] ; b) Effet du pourcentage de porosités et de l'hydrogène en solution sur la résistance à la traction et sur la limite d'élasticité d’une pièce [2] ... 4 Figure 3 : Effet de différents éléments d’alliage sur la solubilité de l’hydrogène dans
l’aluminium en fonction de la température : a) Effet du cuivre [1] ; b) Effet du silicium [1] ; c) Effet du lithium [1] ... 14 Figure 4 : Schéma de la méthode de Sieverts et légende des composantes [1] ... 16 Figure 5 : Schéma de la méthode d’extraction pour l’aluminium liquide [22] ... 21 Figure 6 : a) Schéma de fonctionnement du Telegas [24] ; b) Schéma de la sonde
du Telegas [24] ... 25 Figure 7 : a) Appareil AlScan [28] ; b) sonde AlScan [28] ; c) Schéma du
fonctionnement de l’AlScan [28] ... 27 Figure 8 : Charte standard utilisée pour le test de solidification sous vide partiel [4]
... 30 Figure 9 : Isobares de Van’t Hoff représentant la solubilité de l’hydrogène en
fonction de la température telle que mesurée par différents auteurs [1] ... 33 Figure 10 : Perméabilité à l'humidité de différents matériaux [37] ... 58 Figure 11 : a) Photo d’une bride à couteaux [38] ; b) Schéma de la fermeture d’une bride à couteaux avec un joint torique [39]... 59 Figure 12 : Image de la partie inférieure de l'agitateur de graphite ... 60 Figure 13 : Images de la chambre de mesure : a) Extérieur de la chambre ; b)
Double paroi ; c) Pièces inertes en acier inoxydable; d) Creuset de graphite 61 Figure 14 : Schéma complet de la chambre de mesure ... 62 Figure 15 : Schéma des composantes internes de la chambre ... 63 Figure 16 : a) et b) Schématisation du capteur du H2scan ; c) Relation entre la
variation de la résistance du capteur et la concentration en hydrogène ; d) Relation entre la vairation de la densité de charge du capteur et la
concentration en hydrogène ... 66 Figure 17 : Montage expérimental complet ... 69 Figure 18 : Illustrations des différentes étapes des expériences : a) Vide complet ;
b) Fusion ; c) Entrée de l’agitateur et vide partiel ; d) Entrée d’azote ; e)
Dégazage ; f) Mesure AlScan ... 82 Figure 19 : Illustrations des différentes étapes des expériences pour l’idée originale
: a) État initial de la chambre ; b) Ajout de la première masse de granules et vide ; c) Entrée du gaz ; d) Fusion, branchement de l’H2scan et atteinte du premier équilibre ; e) Ajout de la deuxième masse de granules ; f) Fusion et deuxième équilibre ... 88 Figure 20 : Montage expérimental complet après amélioration ... 91 Figure 21 : Évolution de la concentration en hydrogène pour le test à 745°C et 6%
H2 ... 105
Figure 23 : Évolution de la température pour le test à 745°C et 6% H2 ... 107
Figure 24 : Évolution de la concentration en hydrogène, de la pression et de la température pour le test à vide à 760°C et 6% H2 ... 108
Figure 25 : Évolution de la concentration en hydrogène, de la pression et de la température pour le test avec Al à 700°C et 6% H2 ... 109
Figure 26 : Évolution de la concentration en hydrogène et de la pression et pour le test à vide à 750°C et 8,35% H2 ... 110
Figure 27 : Évolution de la concentration en hydrogène, de la pression et de la température pour le test avec Al à 595°C et 12% H2 ... 111
Figure 28 : Évolution de la concentration en hydrogène, de la pression et de la température pour le test avec Al à 695°C et 12% H2 ... 112
Figure 29 : Valeurs importantes recueillies lors du test avec Al à 695°C et 12% H2
Introduction
L’aluminium est un métal de plus en plus en demande en raison de ses bonnes propriétés mécaniques et de sa faible masse volumique. Les domaines technologiques de pointe tels que le secteur de l’automobile et de l’aérospatial privilégient son utilisation pour la fabrication de nombreuses composantes critiques. Ainsi, l’aluminium utilisé doit être d’une qualité supérieure et présenter un nombre minimal de défauts. Les porosités en sont un des plus indésirables puisqu’elles réduisent grandement les propriétés mécaniques du métal. Dans l’aluminium, elles sont en partie causées par une trop grande proportion d’hydrogène dissous dans le métal liquide avant la coulée. Celui-ci est soluble dans le liquide et insoluble dans le solide. Alors, il se recombine sous forme gazeuse lors de la solidification et entraîne la formation de vides. Pour éviter ce phénomène, la solubilité de l’hydrogène dans l’aluminium liquide doit être bien connue et des mesures précises de sa valeur doivent être faites. Ainsi, la qualité des appareils mesurant la quantité d’hydrogène en solution dans l’aluminium lors de la coulée pourra être améliorée. C’est donc pourquoi, le but de ce projet de maîtrise est d’obtenir des mesures fiables et valables de la solubilité de l’hydrogène dans l’aluminium liquide à l’aide d’une nouvelle approche expérimentale.
Suite à plusieurs travaux basés sur l’utilisation de la méthode de Sieverts, différentes valeurs de la solubilité de l’hydrogène dans l’aluminium ont été obtenues. Cette méthode consiste à fusionner de l’aluminium dans un système étanche en verre dont le volume a été mesuré avec un gaz de référence. Ensuite, le métal est mis en contact avec de l’hydrogène et la différence de volume est mesurée pour déduire la quantité d’hydrogène qui est entrée en solution dans l’aluminium. Bien que cette méthode semble relativement fiable, on observe de la discordance entre la majorité des valeurs qui ont été mesurées. À la lumière d’une tentative de mesure effectuée récemment et suite à une analyse approfondie des causes d’erreur possibles de cette méthode, une nouvelle procédure expérimentale pour mesurer la solubilité de l’hydrogène dans l’aluminium s’impose.
Cette nouvelle méthode a été conçue en se basant sur les faiblesses de celle de Sieverts et autant le montage expérimental que la procédure sont entièrement nouveaux. Tout d’abord, cette dernière consiste à fusionner une masse d’aluminium dans une chambre étanche d’acier inoxydable remplie d’azote. Une fois la stabilité atteinte, le métal est mis en contact avec un volume connu d’hydrogène dilué dans l’azote. De plus, le montage expérimental permet de buller le mélange de gaz directement dans le métal liquide et ainsi d’augmenter grandement la cinétique de la réaction de dissolution. Plusieurs variables peuvent être mesurées en continu lors des tests, soient la température du métal liquide, la pression et la concentration en hydrogène dans l’atmosphère de la chambre. Ainsi, lorsque de l’hydrogène entre dans l’aluminium liquide, des variations de la concentration et de la pression seront détectées. Elles pourront par la suite être reliées à la solubilité de l’hydrogène grâce à un bilan massique fait sur le système de mesure en entier. Donc, cette nouvelle méthode permet d’obtenir des valeurs de la solubilité de l’hydrogène en offrant la possibilité de procéder aux expériences sans briser l’équilibre de la chambre et en enregistrant en continu toute les variables nécessaires au calcul de la solubilité de l’hydrogène dans l’aluminium.
Pour bien comprendre la problématique, une revue de littérature complète présentera la théorie ainsi que le traitement thermodynamique lié à la solubilité de l’hydrogène dans l’aluminium. Ensuite, quelques méthodes de mesures seront expliquées, incluant la méthode de Sieverts et les appareils de mesures industriels. Les résultats obtenus par tous les expérimentateurs ayant tentés de mesurer la solubilité de l’hydrogène dans l’aluminium seront présentés et discutés. Par la suite, une discussion critique de la méthode de Sieverts permettra de mieux comprendre la nécessité d’introduire une nouvelle méthode de mesure. Cette dernière sera ensuite expliquée dans le détail tant au niveau des différents composantes du montage expérimental, des appareils de mesures, de la procédure suivie lors des tests et du bilan de matière nécessaire à l’obtention de la valeur de la solubilité. Finalement, les résultats obtenus jusqu’à maintenant seront présentés ainsi qu’un exemple de calcul et qu’une discussion de la méthode actuelle.
1-Revue de littérature
1.1-Solubilité de l’hydrogène dans l’aluminium
L’hydrogène est le principal responsable de la formation de porosités dans les alliages d’aluminium. En raison de son petit rayon atomique, il est le seul gaz soluble dans ce métal. [1] Par contre, sa solubilité est beaucoup plus élevée dans le liquide que dans le solide, comme on peut le voir à la Figure 1. Ainsi, lors de la solidification, l’hydrogène entré en solution dans le liquide redevient gazeux en raison de la diminution de solubilité. Ce gaz peut nucléer et former des pores qui sont très dommageables pour les propriétés des pièces moulées. Comme illustré à la Figure 2 a), plus il y a d’hydrogène en solution dans le liquide, plus il y a de porosités dans le métal solidifié. On voit aussi qu’un taux de refroidissement plus lent entraîne un volume de pores plus important puisque le gaz a moins le temps de s’échapper du métal et qu’il demeure emprisonné dans la pièce. De plus, la Figure 2 b) montre que les propriétés mécaniques d’une pièce diminuent grandement avec le nombre de pores présents. Il est donc très important de comprendre en profondeur les principes de mise en solution de l’hydrogène dans l’aluminium tant du côté théorique que du côté expérimental pour bien prévenir et contrôler la formation de porosités dans les pièces finales.
Figure 2 : a) Effet du contenu en hydrogène dans l'aluminium et du taux de refroidissement sur le pourcentage de porosités d’une pièce [2] ; b) Effet du pourcentage de porosités et de l'hydrogène en solution sur la résistance à la traction et sur la limite d'élasticité d’une pièce
[2]
1.1.1-Interaction entre l’hydrogène et l’aluminium
Tout d’abord, l’hydrogène est le seul gaz soluble dans l’aluminium en raison du faible rayon interatomique de la maille cubique face centrée de ce métal. En fait, dans le solide, l’espace interatomique des interstices octaédriques est de 0,059 nm. Pour le liquide, en raison de la variation volumique lors du changement de phase, le rayon interatomique est d’environ 4% plus grand que dans le solide soit de 0,061 nm. Les interstices octaédriques sont les sites où l’hydrogène a le plus de chance de se retrouver lorsqu’il est en solution dans le solide. Comme il n’y a pas de réseau cristallin dans le liquide, l’hydrogène peut se retrouver dans n’importe quel espace interatomique mais ceux-ci ne sont pas beaucoup plus volumineux que dans le solide. [1]
L’hydrogène monoatomique a un rayon de Bohr de 0,053 nm. [1] Cette variable est en fait la longueur caractéristique entre le proton et l’électron pour l’atome d’hydrogène. De son côté, la molécule diatomique d’hydrogène a une distance internucléaire de 0,074 nm. Ainsi, seul l’atome d’hydrogène peut entrer
dans les sites octaédriques du réseau CFC de l’aluminium. Donc, le gaz doit se dissocier pour entrer en solution. [1]
1.1.2-Origine de l’hydrogène
Pour que de l’hydrogène se retrouve en solution dans le métal, il faut bien entendu qu’il y ait une source présente. Dans le cas de ce gaz, il provient presqu’exclusivement de la réaction entre l’aluminium et l’humidité présente dans l’atmosphère du four de fusion qui mène à la production d’alumine et d’hydrogène.
L’humidité quant à elle provient de plusieurs sources. Premièrement, de la vapeur d’eau est présente dans l’atmosphère de manière naturelle. Il a d’ailleurs été observé que dans les régions au climat tempéré, les effets de l’hydrogène sont différents selon les saisons et le taux d’humidité atmosphérique. De plus, lorsqu’un four à combustion est utilisé pour chauffer le métal, une quantité très importante de vapeur d’eau est formée lors de la réaction chimique entre les hydrocarbures et l’oxygène. L’humidité peut aussi se retrouver à la surface des matériaux à fondre. Ensuite, une couche d’alumine est inévitablement présente à la surface de l’aluminium. Cette dernière est souvent hydratée et lorsqu’elle est chauffée elle relâche de l’eau. De plus, les résidus de lubrifiant et de traitement de surface qui peuvent être présent sur l’aluminium recyclé, tel le revêtement polymérique sur les canettes, sont aussi une source d’humidité et d’hydrogène. Finalement, tous les matériaux qui entrent en contact avec l’aluminium et qui ne sont pas parfaitement secs sont une source importante d’eau. Il peut s’agir de métal solide et d’éléments d’alliage ajoutés dans le four, des murs du four après un arrêt, des dalots de coulés, des agitateurs et de pâte réfractaire qui n’a pas suffisamment séchée avant son contact avec l’aluminium. De plus, certaines études ont prouvées que lorsque l’aluminium est refondu, l’hydrogène déjà présent dans le métal solide a un effet considérable sur la quantité d’hydrogène dans la pièce finale. Ce processus est parfois comparé à l’hérédité génétique. [3] Donc, tous ces phénomènes agissent comme une source potentielle d’humidité et d’hydrogène. Il faut donc bien les contrôler si on veut limiter au maximum la mise en solution du gaz et la formation de porosités. [1, 4]
1.1.3-Formation et dissolution de l’hydrogène
1.1.3.1-Réaction d’oxydation
L’humidité est la principale source d’hydrogène pour la réaction de dissolution de ce gaz dans l’aluminium liquide. [1, 4, 5] En fait, l’eau réagit avec le métal et devient une source importante d’hydrogène en se décomposant. Plus précisément, l’aluminium et l’oxygène présent dans l’eau réagissent pour former de l’alumine libérant ainsi de l’hydrogène selon la réaction chimique suivante (1) :
2Al(s,l)+3H2O(g) Al2O3(s)+ H2(g) (1)
L’énergie libre de Gibbs standard en joule de cette réaction est respectivement pour le solide (2) et le liquide (3) [1] :
Gs0 -958387-72,87TlogT+394,5T (2) Gl0 -979098-71,91TlogT+413,6T (3)
À température ambiante pour le solide (4) et à 700°C, une température standard de coulée, pour le liquide (5) :
Gs0(298,15K) -894,53 kJ (4) Gl0(973,15K) -785,71 kJ (5)
Avec une énergie libre de Gibbs standard aussi négative, la réaction d’oxydation de l’aluminium par l’eau est grandement favorisée en présence d’humidité. Donc, le métal est immanquablement en contact avec de l’hydrogène qui peut potentiellement entrer en solution.
1.1.3.2-Réaction de dissolution
Ensuite, comme seul l’hydrogène monoatomique peut se loger dans le métal, le gaz doit se dissocier pour pourvoir entrer en solution (6) :
Comme la réaction chimique pour la formation de l’hydrogène gazeux est rapide, c’est la cinétique des réactions de dissolution qui contrôle le taux de mise en solution de l’hydrogène. Elle dépend de la cinétique à l’interface entre l’aluminium et l’atmosphère, de la vitesse de diffusion de l’hydrogène dans l’aluminium ainsi que de la capacité de l’aluminium à absorber les gaz. [1]
1.1.3.3-Taux de dissolution et effet de la couche d’alumine
Une fois l’équilibre atteint à l’interface entre le liquide et le gaz, il y a alors concurrence entre la dissolution de l’hydrogène (7) dans l’aluminium et entre sa recombinaison sous forme de gaz (8) :
2Al(l)+3H2O(g) Al2O3(s)+6H(sol) (7) 6H(sol) 3H2(g) (8)
Ainsi, une fois l’équilibre atteint, ces deux réactions se produisent à la même vitesse et l’hydrogène entre et sort de l’aluminium liquide tout en demeurant à concentration constante à l’intérieur.
La réaction chimique d’oxydation de l’aluminium par l’eau produit aussi de l’alumine en plus du gaz. Cette couche d’oxyde solide se forme sur les parois du solide ou flotte à la surface du métal liquide. Dans ce dernier cas, l’alumine forme une barrière importante entre l’aluminium et l’atmosphère extérieure. Alors, une fois que la couche d’oxyde est formée, les composés pouvant réagir avec l’aluminium doivent diffuser à travers cette barrière pour atteindre le métal liquide. [1] Donc, l’aluminium n’absorbe l’hydrogène directement que durant une période de temps très restreinte. Par la suite, le gaz doit diffuser dans l’alumine avant d’atteindre le liquide et la vitesse de la réaction de solubilisation est beaucoup réduite et les réactions d’équilibre ne se produisent plus aussi facilement. Dans ces conditions, la vitesse de diffusion à travers la couche d’Al2O3 joue un rôle très
important dans le contrôle du taux de dissolution de l’hydrogène dans le métal liquide. [6]
1.1.3.4-Recombinaison gazeuse lors de la solidification
Donc, une fois que l’hydrogène est entré en solution dans le métal liquide, ce qui est pratiquement inévitable pour des pièces coulées sous atmosphère normale, le danger de former des porosités est présent. En raison de la très grande différence de solubilité entre le liquide et le solide, l’hydrogène est environ 20 fois moins soluble dans ce dernier, l’équilibre entre les réactions chimiques est brisé et une grande quantité d’hydrogène en solution se recombine sous forme gazeuse. Ce gaz peut s’échapper du métal si le temps de solidification est adéquat mais dans la majorité des cas, il se forme des porosités et l’intégrité de la pièce est atteinte.
1.1.4-Traitement thermodynamique et mathématique de la
dissolution de l’hydrogène
1.1.4.1-Isotherme de Sieverts
Pour obtenir des équations décrivant la solubilité de l’hydrogène dans l’aluminium il est indispensable de décrire de manière thermodynamique la relation de solubilisation de l’hydrogène (9) :
H2(g) 2H(sol) (9) Pour cette réaction la constante d’équilibre K (10) est :
K (aH)
2
aH2 (10)
Où aH2 est l’activité de l’hydrogène gazeux au-dessus de l’aluminium et aH l’activité
de l’hydrogène monoatomique dans l’aluminium.
Comme le gaz peut être considéré comme idéal aux températures étudiées, l’activité peut être supposée proportionnelle à la pression au lieu d’à la fugacité (11) :
aH2
PH2 PH02
Où PH2 est la pression partielle d’hydrogène au-dessus de métal liquide. L’état
standard qui décrit l’hydrogène est le gaz pur à pression standard PH02, dans la
plupart des cas 1 atm, et à la même température que le gaz étudié. [7]
Pour ce qui est de l’hydrogène monoatomique en solution, il n’existe pas d’état standard décrivant le gaz pur en solution. Donc, il y a deux manières de décrire l’activité de ce dernier. La première (12) est en utilisant un état standard lié à la molalité qui est en fait la quantité de soluté, en moles, contenue dans 1 kg de solvant [8] :
aH
mH
mH0 (12)
Dans cette équation, mH est la molalité de l’hydrogène dans l’aluminium et mH0 est la valeur standard de molalité souvent établie comme unitaire. La deuxième manière de décrire le soluté (13) est de considérer que l’hydrogène en solution suit la loi de Raoult qui stipule que pour un soluté en très faible quantité dans un solvant, l’activité de l’élément en solution peut être approximé par sa fraction molaire. [7] En raison de la faible solubilité de l’hydrogène dans l’aluminium, on peut considérer que H 0 et qu’alors :
aH H (13)
En choisissant PH02 et mH0 comme états standards et en remplaçant les valeurs de
l’activité dans l’équation (10), on obtient l’équation de l’isotherme de Sieverts [1, 4, 5] (14) :
mH
mH0 √K
PH2
PH02 (14) 1.1.4.2-Isobares de Van’t Hoff
Il est aussi possible de développer des équations en se basant sur la variation de l’énergie libre de Gibbs G [1] (6) :
dG ∑ Vdp- ∑ SdT+ ∑ dn (15)
Où V est le volume, P la pression, S l’entropie, T la température, le potentiel chimique et n le nombre de mole de l’espèce étudiée.
Le cas étudié correspond en fait au transfert de dnH2 moles d’hydrogène
diatomique à 2dnH moles d’hydrogène monoatomique en solution. De plus, on n’observe aucune variation de pression ni de température durant cette réaction. Alors dp 0 et dT 0 et l’équation (15) devient (16) et (17) :
dG HdnH- H
2dnH2 (16)
dG 2 HdnH2-
H2dnH2 (17)
Selon la définition des potentiels chimiques l’équation (17) devient (18) : dG 2( H0+RTlna
H)dnH2-( H02+RTlnaH2)dnH2 (18)
Dans cette équation, H0 et H2
0 sont les potentiels chimiques du soluté et du gaz à
leur état standard. Ensuite, comme la réaction se produit à l’équilibre, dG 0 l’équation (18) devient (19) :
2( H0+RTlna
H)-( H02+RTlnaH2) 0 (19)
En réarrangeant cette équation elle devient (20) :
lnaH2-2lnaH (2 H0- H 2 0 ) RT (20) Comme (21) : G0 2 H0- H 2 0 (21) Et que (22) :
G0 H0-T S0 (22)
Où H0 l’enthalpie de la solution dans son état standard et S0 son entropie à l’état standard. L’équation (20) peut être réécrite comme suit (23) :
lnaH2-2lnaH H
0
RT S0
R (23)
En choisissant la molalité et la pression comme état standard et en remplaçant les activités selon les équations (11) et (12), on obtient (24) :
ln(PH2 PH02) -2ln ( mH mH0) H0 RT S0 R (24)
Dans la majorité des cas, cette équation est écrite sous forme de logarithme en base 10 au lieu d’en logarithme naturel pour faciliter la mise en graphique. De plus, le facteur deux est placé sous forme de demi devant la pression pour montrer l’effet de la dissociation de l’hydrogène. Sous la forme suivante (25), cette équation correspond à l’isobare de Van’t Hoff selon la molalité du soluté :
log(mH mH0) - log ( PH2 PH02 ) - H 0 2,303*2RT+ S0 2,303*2R (25)
Le même développement peut être fait en choisissant la fraction molaire du soluté infiniment dilué comme état standard. Ainsi, en remplaçant les activités selon les équations (11) et (13) l’équation (23) devient (26) :
ln(PH2 PH02 ) -2ln( H) H H 0 RT S0H R (26) Et sous la notation courante de l’isobare de Van’t Hoff (27) :
log( H)- log (PH2 PH02) H0H 2,303*2RT+ S0H 2,303*2R (27)
Où H0H et S0H réfère aux états standards hypothétiques du soluté et sont purement théorique et ne sont reliés à aucun concept physique. [1, 4, 5]
1.1.4.3-Traitement simplifié
Donc, ces équations montrent la relation qu’ont la fraction molaire ou la molalité avec la pression et la température. Par contre, elles sont difficilement utilisables hors du contexte théorique et une notion de solubilité qui décrit la quantité en hydrogène dans le métal de manière plus concrète doit être développée pour le milieu industriel. Ainsi, la valeur de la solubilité S a été instaurée pour pouvoir être utilisée en industrie pour fixer des limites de quantité de gaz en solution ou pour quantifier l’effet du dégazage sur le métal. Cette valeur correspond au volume de gaz diatomique à 273,15 K et 1 atm qui est contenu dans 100 g de métal. [1] Donc, les unités habituellement utilisés pour quantifier la solubilité de l’hydrogène dans l’aluminium liquide sont les cm3/100g.
Selon le traitement fait par plusieurs auteurs, on peut substituer S à mH⁄mH0. De plus, comme les isobares de Van’t Hoff sont difficilement calculables, des mesures sont nécessaires pour connaître la quantité d’hydrogène entrée en solution dans le métal. Les valeurs mesurées sont la température et la pression. Donc, il est possible de considérer les termes enthalpiques et entropiques comme constants et de trouver la valeur de ces constantes en effectuant des mesures à différentes températures et pressions. De plus comme ces termes sont considérés constants, l’effet de la substitution de mH⁄mH0 par S se retrouve inclue dans
ceux-ci. Ainsi, les équations (25) et (27) deviennent (28) :
log(S)- log(PH2
PH02) -A
T+B (28)
Ainsi, la majorité des auteurs présentent les résultats obtenus lors des expérimentations sous la forme de l’équation (28).
Il est aussi important de faire le lien théorique entre la solubilité exprimée en cm3/100g et les variables utilisées dans les équations soit mH⁄mH0 et H même si
les termes de droite sont considérés constants et que ce lien n’est pas nécessairement tenu en compte lors des calculs pratiques. Donc, selon Talbot [1] (29) : mH mH0 2( S Vm) *10 20 ( S 22400) 8,93*10 -4*S (29)
Où Vm est le volume molaire de l’hydrogène diatomique à 273,15 K et 1 atm et est
égal à 22400 cm3/mole. Le facteur 2 est présent puisque la solubilité S est exprimée en fonction de l’hydrogène diatomique alors que la molalité l’est en fonction de l’hydrogène monoatomique. Le facteur 10 est quant à lui présent puisque la molalité est exprimé pour 1 kg de solvant alors que la solubilité l’est pour 100 g.
Le même lien est fait pour la fraction molaire du soluté infiniment dilué (30) :
H nH nAl MAl Vm*0,1*2S 0,027 22400*0,1*2*S 2,41*10 -5 *S (30)
Où nH et nAl sont les nombres de moles d’hydrogène et d’aluminium. Comme
l’hydrogène est très dilué dans l’aluminium, on peut négliger le nH qui devrait
habituellement se retrouver au dénominateur ( H nH nAl+nH
nH
nAl) Ensuite, MAl est la
masse molaire de l’aluminium et est égale à 0,027 kg/mole. Le facteur 2 est présent pour la même raison et le facteur 0,1 est présent puisque la masse molaire est exprimée pour 1 kg alors que la solubilité l’est pour 100g. [1]
1.1.5-Effets des éléments d’alliage sur la solubilité
Les éléments d’alliage peuvent avoir un effet sur la quantité d’hydrogène qui entre en solution dans le métal. [1, 4, 5, 9, 10] Des études approfondies ont été réalisées pour quelques éléments courants pour l’aluminium, soit le cuivre, le silicium et le lithium. Il a été observé que le cuivre diminue la solubilité de l’hydrogène dans l’aluminium, comme on peut le voir à Figure 3 a). Cela est causé par le fait que ces deux métaux interagissent fortement ensemble et que les atomes de cuivre entourent ceux d’aluminium réduisant ainsi les interactions possibles entre l’hydrogène et ce dernier. [9] Le même phénomène se produit avec
le silicium, comme illustré à la Figure 3 b). Ce métal présente un comportement presque qu’idéal avec l’Al. Par contre, l’effet de cet élément est moins marqué que celui du cuivre. Il a aussi été observé que plus la fraction molaire de l’élément d’alliage est grande, plus la diminution de la solubilité est marquée.
Figure 3 : Effet de différents éléments d’alliage sur la solubilité de l’hydrogène dans l’aluminium en fonction de la température : a) Effet du cuivre [1] ; b) Effet du silicium [1] ; c)
Effet du lithium [1]
Le lithium (voir la Figure 3 c)) et le magnésium quant à eux produisent l’effet contraire en augmentant la solubilité de l’hydrogène dans l’aluminium. Premièrement, ces deux éléments s’oxydent plus facilement que l’aluminium. [1] Ainsi, il se forme de nouvelles phases qui peuvent avoir un effet sur la dissolution de l’hydrogène dans l’aluminium. Le fait d’ajouter du lithium au système amène une diminution de l’énergie libre de Gibbs de dissolution de l’hydrogène. [10] Aussi, plus de sites sont possibles pour l’hydrogène étant donné que l’hydrogène
a) b)
forme un hydrure, LiH, avec le lithium. Donc, dans ces alliages, l’hydrogène se retrouve sous forme de solution dans l’aluminium en plus d’être lié chimiquement avec le lithium dans les cas où l’hydrure est formé.
1.2-Méthodes de mesure de l’hydrogène en solution
Au fil du temps, plusieurs méthodes ont été développées pour mesurer la solubilité de l’hydrogène dans l’aluminium. Elles peuvent être séparées en deux types. Premièrement, les méthodes directes qui permettent d’obtenir une valeur absolue et directe de la quantité d’hydrogène en solution. Ces dernières sont des méthodes expérimentales difficiles d’utilisation. Elles regroupent la méthode de Sieverts, celle d’extraction d’hydrogène à l’état solide et celle d’extraction sous azote. Ensuite, les méthodes indirectes permettent de connaître la quantité d’hydrogène en solution de manière relative et l’utilisation de relations mathématiques est nécessaire pour obtenir cette valeur à partir des mesures effectuées. Ces dernières sont plus simples d’utilisation et se retrouvent souvent en industrie. Elles regroupent la méthode de boucle de recirculation à la base des appareils Telegas et AlScan, la méthode CHAPEL, celle de la première bulle et celle de solidification sous vide partiel. Dans la majorité des cas, les valeurs obtenues grâce à une méthode directe servent à établir les relations mathématiques qui lient les données recueillies par les méthodes indirectes à la solubilité de l’hydrogène. Dans les sections suivantes, ces méthodes seront détaillées en débutant par celles directes.
1.2.1-Méthode de Sieverts
1.2.1.1-Montage et expériences avec la méthode de Sieverts
La méthode de mesure absolue de la solubilité de l’hydrogène dans l’aluminium la plus utilisée et acceptée à ce jour est la méthode de Sieverts. [1, 4-6, 9, 11-15] Plusieurs auteurs [4-6, 9, 10, 12, 14, 16-20] ont effectué leurs expérimentations avec ce système développé par Sieverts au début du XXe siècle [13]. Celui-ci peut être utilisé pour mesurer la solubilité des gaz dans différents métaux liquides pour lesquels la cinétique d’absorption est rapide. Cette méthode est donc bien conçue pour la mesure de la solubilité de l’hydrogène dans
l’aluminium. Dans ce cas particulier, elle consiste à exposer une masse connue d’aluminium à un volume connu d’hydrogène le tout à température et à pression constante. En observant la variation de volume de l’hydrogène et en la comparant au volume d’un gaz de référence, il est possible de connaître la quantité d’hydrogène qui est entré en solution dans l’aluminium. Les valeurs obtenues sont en cm3/100g étant donné qu’on mesure directement le volume et qu’on connaît la masse d’aluminium exposée au gaz.
Plus précisément, le montage expérimental de la méthode de Sieverts consiste en un système en verre totalement étanche relié à une pompe à vide et à un système d’entrée de gaz. Celui-ci est illustré à la Figure 4. L’élément central du montage est la chambre d’absorption qui contient le creuset réfractaire destiné à contenir l’échantillon d’aluminium liquide. Celle-ci doit être placée dans un four pour lui permettre d’atteindre la température d’expérimentation située au-dessus du point de fusion de l’aluminium. Le reste du système est à température ambiante. Un thermocouple permet de mesurer la température dans le montage et une colonne barométrique de mercure permet de mesurer les variations de volume de gaz qui sont à la base de la méthode.
Figure 4 : Schéma de la méthode de Sieverts et légende des composantes [1]
A : Chambre d’absorption (b) B : Burette de gaz
C : Colonne barométrique D : Réservoir de mercure E : Thermocouple
F : Valve vers l’atmosphère G : Valve vers la pompe à vide H : Échantillon
J : Creuset d’alumine
K : Coquille de silice externe L : Coquille de silice interne M : Sceau
N : Thermocouple T : Valves
Le déroulement des expériences est relativement simple. Tout d’abord, le vide est fait dans le montage et l’aluminium est fusionné tout en continuant à faire le vide durant une période assez longue pour éliminer tous les contaminants. Ensuite, une fois que l’aluminium est liquide et que le vide est adéquat, une quantité de gaz de référence est entrée dans le système. La valeur du volume est lue sur la burette graduée de la colonne barométrique et elle est utilisée comme valeur de référence pour un gaz insoluble dans le métal. Cette dernière est en fait la valeur du volume inerte de gaz contenu dans le système en verre du montage. Le vide est alors fait une nouvelle fois pour évacuer le gaz de référence. Lorsque ce dernier est satisfaisant, l’étape la plus importante est maintenant de faire entrer l’hydrogène dans le montage en procédant de la même manière que pour le gaz de référence. Une fois que l’équilibre semble atteint et que la valeur de volume indiquée par la colonne barométrique est stable, on peut considérer celle-ci comme finale. Ainsi, en comparant la mesure finale à celle de référence, il est possible de constater que la première est inférieure à la seconde. Cette différence est causée par l’hydrogène qui est entré en solution dans l’aluminium liquide et elle est directement reliée à la solubilité en cm3 d’hydrogène par 100 g d’aluminium.
Il y a deux méthodes possibles pour introduire les gaz dans le système. [15] La première est à pression fixe pour laquelle l’hydrogène est entré dans la chambre jusqu’à ce que la pression soit stable, ce phénomène correspondant à l’équilibre thermodynamique du système. Alors, le volume total d’hydrogène est noté et il peut être comparé avec celui du gaz de référence pour obtenir la valeur de la solubilité. [6, 9] La seconde est à volume ou nombre de moles fixe et elle consiste à faire entrer dans le système le même nombre de moles d’hydrogène que de gaz de référence. En recueillant la valeur de la pression obtenue pour chaque type de gaz, il est possible d’obtenir la solubilité de l’hydrogène dans l’aluminium liquide par régression linéaire. [14]
1.2.1.2-Facteurs influençant la qualité des résultats
Plusieurs facteurs influencent la qualité des mesures obtenues. Premièrement, le gaz de référence utilisé est très important. Celui-ci doit avoir des
propriétés thermiques similaires à l’hydrogène pour éviter tout biais causé par une expansion différente ou un gradient thermique différent qui auraient un effet sur la lecture du volume. De plus, ce gaz doit être totalement insoluble dans l’aluminium pour que la mesure de volume soit assurément celle du volume inerte du système. Ainsi, selon quelques auteurs [9, 12], le gaz idéal est l’hélium surtout en raison de ses propriétés caractéristiques très semblables à l’hydrogène. Par contre, d’autres auteurs ont utilisé le néon [6] ou l’argon [14, 16] et certains ont même soulevé une inquiétude face à la solubilité de l’hélium dans l’aluminium [14]. Celui-ci est tout de même généralement accepté comme le meilleur gaz pour les mesures.
Un autre facteur important est la valeur du volume inerte du montage. Ce dernier est constitué du volume de gaz contenu dans le système en verre situé au-dessus de l’aluminium. Étant donné que l’hydrogène est très peu soluble dans l’aluminium, la variation de volume qu’on tente d’observer dans le montage de Sieverts est très faible. La quantité de gaz qui entre en solution n’est pas fonction du volume de gaz présent dans le montage. Donc, peu importe le volume inerte de la chambre de mesure, la même quantité de gaz entrera en solution. Ainsi, la mesure de la variation doit se faire sur un volume de gaz le plus petit possible pour qu’elle soit la plus grande possible par rapport au volume inerte et alors plus facilement détectable.
De plus, une attention très importante doit être portée à la qualité du vide. Ainsi, le type de verre utilisé pour fabriquer le montage est important puisqu’à haute température, plusieurs sont perméables à l’hydrogène à différents degrés et peuvent ainsi créer une fuite de gaz vers l’extérieur. De plus, tous les joints doivent être parfaitement étanches pour empêcher toute fuite ou toute contamination des gaz de mesure. Pour limiter la perte d’hydrogène vers l’extérieur du montage, Ransley et Neufeld [6] ont proposé d’entourer le système d’une atmosphère d’hydrogène. Ainsi, il n’y a plus de gradient chimique entre l’intérieur et l’extérieur du montage et la force motrice pour la diffusion de l’hydrogène dans le verre est alors éliminée. De plus, il est possible de refroidir les parois de verre pour limiter la diffusion étant donné que ce phénomène est grandement dépendant de la
température. Par contre, la méthode la plus acceptée pour contrer cette source d’erreur est d’utiliser un four à induction qui augmente la rapidité de chauffage.
Le matériel avec lequel est fabriqué le creuset qui contient l’aluminium est aussi un facteur très important. Il doit être bien choisi pour éviter toute contamination du métal ou du gaz causée par une réaction chimique potentielle entre ces éléments et le creuset. Le matériel le plus utilisé est l’alumine en raison de sa très grande stabilité chimique.
La méthode d’entrée des gaz peut aussi avoir un effet important sur les résultats. La technique à nombre de moles ou volume fixe élimine les corrections liées aux erreurs de manipulations. En ayant un nombre de moles déjà fixé avant les expériences, il est impossible de dépasser la quantité de gaz à introduire dans la chambre alors que le risque est présent avec la méthode à pression fixe. Dans le cas où une erreur se produit avec cette dernière méthode, l’expérimentateur doit évacuer une partie du gaz durant les mesures pour obtenir la pression désirée. Cette manipulation peut fausser les résultats en faisant sortir du système des composés importants ou en y faisant entrer des contaminants. Par contre, la méthode à pression fixe présente un avantage majeur par rapport à la méthode à nombre de moles ou volume fixe puisque le nombre de moles de gaz présent au dessus du métal est toujours le même indépendamment du gaz en présence. Ainsi, si le gaz de référence a des propriétés physiques et thermiques similaires à l’hydrogène, le gradient thermique dans la phase gazeuse est toujours le même ce qui annule les erreurs de mesures causées par les variations de température. [15]
Le temps nécessaire pour atteindre l’équilibre thermodynamique entre la phase liquide et gazeuse est aussi très important. Plus l’équilibre est atteint rapidement, plus l’expérience est courte. Ainsi, les effets des erreurs qui peuvent être causées par le facteur temps sont atténués. En fait, plus l’intervalle avant d’atteindre l’équilibre est long, plus d’autres phénomènes indésirables ont le temps de se produire et ainsi de biaiser les résultats. Le plus important d’entre eux est la diffusion de l’hydrogène à travers les parois du montage expérimental. Comme la diffusion est un processus qui évolue dans le temps, plus les expériences sont
longues, plus il y a de gaz qui peut s’échapper et fausser les données recueillies. De plus, la couche d’alumine qui se forme immanquablement à la surface de l’aluminium, même dans un environnement pratiquement sans oxygène, ralentit grandement la cinétique de la réaction de dissolution. Il est donc important de diminuer le temps nécessaire pour la réaction de dissolution le plus possible. Pour ce faire, plusieurs auteurs ont proposé d’utiliser un four à induction au lieu d’un four à convection. En plus d’être beaucoup plus rapide, ce dispositif permet de fondre et de maintenir l’aluminium à température sans chauffer directement les pièces de verre. La cinétique de diffusion de l’hydrogène à travers le verre est alors diminuée puisque sa température est moins élevée que dans un four conventionnel et que la chambre d’absorption est exposée moins longtemps à cette température. Donc, le transport du gaz à travers les parois en verre est moins important. De plus, un chauffage par induction produit des mouvements convectifs à l’intérieur de la masse d’aluminium. Cela permet de briser en continu la couche d’alumine qui se forme au-dessus de la masse et de toujours renouveler la surface de métal qui est exposée à l’hydrogène. Ainsi, en plus des effets sur le temps de chauffage et sur la diffusion de l’hydrogène à travers le verre, l’utilisation d’un four à induction améliore la cinétique de dissolution de l’hydrogène et les sources d’erreurs sont ainsi grandement atténuées.
1.2.1.3-Méthode de Sieverts modifiée
Dans le cas de la mesure de la solubilité de l’hydrogène dans les alliages d’aluminium-lithium et d’aluminium-magnésium, la technique de Sieverts a dû être modifiée par les chercheurs. [1, 10] Ces éléments d’alliage sont problématiques en raison des risques d’évaporation et d’interaction avec les éléments du montage. Pour éviter ces problèmes, les alliages préalablement fabriqués sont scellés dans des capsules d’acier perméables à l’hydrogène mais imperméables au gaz de référence utilisé. De plus, une attention particulière doit être apportée au matériau du creuset pour s’assurer qu’ils ne réagissent pas négativement avec les éléments d’alliage. Ainsi, il est possible d’effectuer les mesures de solubilité dans ces alliages en apportant ces modifications à la méthode traditionnelle.
1.2.2-Méthode d’extraction d’hydrogène à l’état solide
Cette méthode absolue a été développée par Ransley [6, 22, 24] et elle est souvent nommée « hot vacuum subfusion extraction » ou méthode de Ransley. [1, 4, 6, 15, 21-23] Elle peut être utilisée pour mesurer la solubilité de l’hydrogène dans l’aluminium liquide comme dans le solide tant au niveau industriel qu’expérimental. La méthode de Sieverts ne peut pas être utilisée pour le solide ni pour le domaine industriel en raison de la diffusion trop lente de l’hydrogène dans le solide qui rend les expériences trop longues et de l’impossibilité d’échantillonner un procédé industriel pour cette méthode.
Figure 5 : Schéma de la méthode d’extraction pour l’aluminium liquide [22]
Dans le cas du liquide, cette technique consiste à prendre un échantillon de l’aluminium et à le solidifier très rapidement dans un moule conçu pour ce type d’analyse. Une illustration de cette méthode est présentée à la Figure 5. Ainsi, le métal liquide est solidifié hors équilibre, ce qui fait en sorte que le solide résultant est sursaturé en hydrogène et que sa concentration représente celle du liquide juste avant sa solidification. Le métal liquide peut aussi bien provenir d’un four de fusion industriel que d’un montage expérimental dans lequel l’aluminium est maintenu à l’équilibre avec de l’hydrogène à une température donnée. Ensuite, cet échantillon est placé dans une chambre étanche et un vide poussé est fait tout en chauffant l’échantillon à une température près du solidus. Il se forme ainsi un
gradient de concentration entre le métal et le milieu qui l’entoure et la température active les processus de diffusion dans le métal. L’hydrogène contenu dans l’aluminium solide sursaturé tend alors à s’échapper et les gaz de sortie sont analysés pour connaître la concentration d’hydrogène du métal. Le temps de l’analyse est dicté par la vitesse de désorption de l’hydrogène qui est reliée aux processus de diffusion du gaz dans le métal. La quantité de gaz rejeté peut alors être reliée à la solubilité de l’hydrogène dans l’aluminium liquide à la température du liquide échantillonné.
Pour ce qui est de la mesure de la solubilité de l’hydrogène dans l’aluminium solide, l’échantillon doit d’abord être équilibré avec de l’hydrogène à la température désirée. Ainsi, l’aluminium absorbe de l’hydrogène selon sa solubilité et il est ensuite analysé de la même manière que pour les échantillons provenant d’aluminium liquide. C’est la méthode la plus acceptée pour faire des mesures avec l’aluminium solide.
Cette technique est plus facile d’utilisation que la méthode de Sieverts et elle est utilisée par plusieurs industries pour le contrôle de la production et la calibration d’appareils de mesure indirects. L’utilisation d’échantillons solides permet de faciliter grandement les expériences en évitant les complications causées par l’utilisation d’un creuset, comme le choix selon l’alliage et la contamination. De plus, toutes les considérations liées à l’atteinte de l’équilibre et à la diffusion de l’hydrogène à travers les parois du montage sont éliminées puisque tout l’hydrogène rejeté est directement acheminé vers les instruments d’analyse. Par contre, lorsque les mesures sont effectuées pour le liquide, les valeurs de solubilité obtenues avec la méthode d’extraction sont souvent inférieures à celles de la méthode de Sieverts. Cela est causé par le fait que même si le refroidissement de l’échantillon est très rapide, une certaine quantité d’hydrogène qui était dissous dans le liquide a le temps de diffuser à l’extérieur du métal solide. Ainsi, l’échantillon n’est plus représentatif du liquide puisqu’il a perdu une certaine quantité d’hydrogène lors de sa préparation. De plus, le contrôle des contaminants est très important puisque, dans le cas des échantillons pris en usine, ceux-ci
doivent être acheminés jusqu’au lieu d’analyse ce qui peut impliquer le contact avec de l’humidité ou des hydrocarbures qui sont une source d’hydrogène qui pourrait fausser les données. Finalement, dans le domaine industriel, cette technique pose un problème lorsqu’elle est utilisée pour un contrôle rapide de la production. Comme l’échantillon doit être analysé en laboratoire et que les tests sont relativement longs, il s’écoule beaucoup de temps entre le moment de l’échantillonnage et celui de l’arrivé des résultats. Étant donné que le temps est un facteur clé dans la production industrielle, cette méthode est souvent rejetée pour cette raison.
1.2.3- Méthode d’extraction par fusion sous azote
Cette méthode directe est très semblable à celle d’extraction à l’état solide. Ici aussi un échantillon solide est utilisé. Ce dernier peut provenir d’aluminium liquide ou d’un solide équilibré avec de l’hydrogène. Cet échantillon est alors chauffé dans une enceinte étanche jusqu’à la fusion complète. L’expérience se fait sous un courant continu d’azote dans lequel l’hydrogène se dilue et est acheminé vers les instruments de mesure. Le gaz cherche à sortir du métal en raison du gradient de concentration en hydrogène présent entre l’aluminium et l’azote. Donc, les mesures permettent de connaître la quantité d’hydrogène présent dans l’échantillon. Cette technique présente pratiquement les mêmes avantages et inconvénients que celle de Ransley sauf qu’elle est plus simple d’utilisation puisqu’il n’est pas nécessaire de faire le vide dans le montage ce qui favorise son utilisation dans le domaine industriel. [4, 15, 25]
1.2.4-Méthode de recirculation en boucle fermée (Telegas, AlScan)
Cette technique de mesure indirecte a été développée dans le but de fournir aux industries une manière facile et rapide de contrôler la quantité d’hydrogène dissous dans l’aluminium. Ainsi, avec la méthode de recirculation de gaz en boucle fermée, il est possible d’effectuer des mesures directement dans le bain de métal liquide sans avoir besoin d’échantillonner et d’attendre les résultats d’analyses faites en laboratoire. [1, 5, 15, 24, 26]
1.2.4.1-Principe général
Cette méthode consiste à créer un contact entre un gaz inerte et l’aluminium liquide. Lorsqu’il est en contact avec le métal, le gaz est en fait une atmosphère hors équilibre avec son environnement. Donc, pour rétablir celui-ci, l’hydrogène dissous dans l’aluminium diffuse dans le gaz et se recombine sous forme diatomique. Le gaz inerte contenant de l’hydrogène est ensuite récupéré et acheminé vers un appareil de mesure qui détermine la quantité d’hydrogène présente. Étant donné que l’équilibre est long à atteindre entre le métal et le gaz, ce dernier est recirculé plusieurs fois dans l’aluminium jusqu’à ce que la concentration d’hydrogène dans celui-ci se soit stabilisée et soit représentative de celle dans le métal. En fait, l’équilibre est atteint lorsque la pression partielle d’hydrogène dans le gaz inerte atteint une valeur pour laquelle l’activité de H2 dans
le gaz est la même que celle dans le liquide. Le gaz inerte utilisé peut être de l’argon ou de l’azote. Par contre, pour des raisons économiques, ce dernier est le plus souvent utilisé en industrie. Les valeurs mesurées par l’appareil demandent un traitement mathématique et thermodynamique impliquant un modèle semi-empirique pour être transformées en valeur de solubilité. C’est pourquoi cette méthode est qualifiée d’indirecte. Il existe deux types d’appareils basé sur ce principe de mesure. Soit le Telegas développé par la compagnie Alcoa et l’AlScan développé par Alcan et ABB Bomem. Ces deux appareils présentent une différence majeure au niveau de la sonde de bullage qui est insérée dans le métal liquide.
1.2.4.2-Telegas
La conception de ces appareils est tout de même simple. La Figure 6 a) présente un schéma complet des différentes composantes de l’appareil. La partie la plus importante est la sonde qu’on peut voir à la Figure 6 b). Pour ce qui est du Telegas, cette dernière est fabriquée de céramique d’alumine hautement frittée et elle compte trois parties déterminantes. Premièrement, un tube permet d’amener le gaz inerte du contenant jusqu’à l’aluminium et de le faire buller. Ainsi, dans cet appareil le contact entre le métal et le gaz inerte se fait à l’interface des bulles. Un deuxième tube situé directement à côté du premier permet de recueillir une bonne
partie des bulles formées et qui ont eu le temps de s’équilibrer avec le métal et de les conduire vers le système de mesure. Ensuite, un dôme surplombe ces tubes et permet de réacheminer les bulles restantes vers le tube de récupération. Par contre, étant donné que l’équilibre dans les bulles est long à atteindre, celles-ci doivent être réacheminées vers le métal. Cela est causé par le fait que la cinétique liée à la diffusion de l’hydrogène dissous dans les bulles est lente et que l’état d’équilibre n’a alors pas le temps d’être atteint avant la remonté des bulles vers le système de mesure. Ainsi, en recirculant le gaz jusqu’à la stabilité de la concentration, l’équilibre est atteint et la mesure est représentative de l’état du métal.
Figure 6 : a) Schéma de fonctionnement du Telegas [24] ; b) Schéma de la sonde du Telegas [24]
Le fait que le gaz est directement bullé dans l’aluminium peut amener une erreur sur les mesures. En fait, certaines bulles peuvent être perdues et entraînées par le métal lorsqu’il est en mouvement, ce qui peut fausser les lectures puisqu’une partie du gaz envoyé ne revient pas au capteur. De plus, des bulles de gaz inerte provenant d’une étape de dégazage peuvent se mélanger à celles créées par l’appareil et biaiser les mesures. Ensuite, comme la sonde est immobile, elle ne fait qu’analyser un faible volume stationnaire du métal liquide. Ainsi, il peut y avoir des disparités entre ce volume et l’ensemble du métal à
analyser. Finalement, il a été reporté que la sonde est très fragile et ne peut pas être utilisée en continu ni à plusieurs reprise.
1.2.4.3-Catharomètre
Le système de mesure est en fait un catharomètre. Ce dispositif permet de mesurer la conductivité thermique d’un gaz qui est inversement proportionnelle à la masse molaire de ce dernier [27]. Ainsi, dans le cas d’un mélange de gaz inerte et d’hydrogène, elle peut être reliée à la concentration en hydrogène puisqu’un changement de celle-ci entraîne inévitablement une variation de la masse molaire du mélange de gaz. Ainsi, des courbes de calibrations doivent être faites pour permettre de relier la mesure de la conductivité thermique à la concentration en hydrogène dans le gaz pour une température donnée. Donc, la valeur fournie par l’appareil est la pression partielle d’hydrogène en équilibre avec l’aluminium liquide et elle doit être transformée en valeur de solubilité.
1.2.4.4-AlScan
Pour ce qui est de l’AlScan, il a été développé ultérieurement au Telegas et la différence majeure entre les deux réside dans la conception de la sonde qui est plus simple, plus robuste et moins coûteuse que celle du Telegas. Une photographie de l’appareil est présentée à la Figure 7 a), une de la sonde à la Figure 7 b) et un schéma du fonctionnement du système entier à la Figure 7 c). Plutôt que de buller directement dans l’aluminium, la sonde de l’AlScan est fabriquée de céramique poreuse dans laquelle un gaz inerte circule en continu. Les pores sont assez fins pour ne pas laisser entrer de métal liquide dans la sonde tout en assurant un bon contact entre le gaz qu’elle contient et l’aluminium. Un premier tube achemine le gaz du réservoir jusqu’à la sonde et un second l’amène de la sonde au détecteur qui est ici aussi un catharomètre. L’hydrogène qui est dans le métal liquide tend à diffuser vers le gaz qui est dans la sonde poreuse en raison du gradient de concentration présent. Donc, la sonde de l’AlScan est basée sur le principe de diffusion à la surface de la céramique poreuse qui établi le contact entre le gaz inerte et le métal liquide.
Figure 7 : a) Appareil AlScan [28] ; b) sonde AlScan [28] ; c) Schéma du fonctionnement de l’AlScan [28]
En fait, pour l’AlScan, le contact entre l’aluminium et le gaz inerte se fait à l’interface du gaz contenu dans les pores de la céramique. Contrairement au Telegas, il n’y a pas de formation de bulles dans l’aluminium. Ainsi, les erreurs qui peuvent être causées par le fait que les bulles sont en contact direct avec l’aluminium sont nulles et les mesures sont plus stables et plus reproductibles. Par contre, la diffusion est plus lente que dans le cas où les bulles sont directement en contact avec le métal ce qui a pour incidence que l’équilibre est plus long à atteindre et que l’AlScan a un temps de mesure plus long que le Telegas. Pour diminuer cet effet, la sonde est agitée par un bras robotisé, ce qui permet d’accélérer les échanges entre le gaz inerte et le métal. De plus, ce mouvement
a) b)
permet de nettoyer l’interface de toute impureté et d’empêcher la formation d’une couche d’oxyde nuisible sur la sonde qui pourrait ralentir la diffusion de l’hydrogène.
1.2.4.5-Traitement thermodynamique et mathématique des mesures
Pour les deux appareils, les valeurs de pression partielle d’hydrogène doivent être transformées en valeurs de solubilité. Pour ce faire, un traitement thermodynamique et mathématique semblable à celui présenté à la section 1.1.4 doit être fait. Les concepteurs de l’AlScan fournissent le modèle semi empirique final utilisé pour faire le calcul de la solubilité (31) :
SH SH0*CF(T)*CF(A)*√PH2 (31)
Où : SH est la solubilité de l’hydrogène dans l’aluminium liquide analysé en
cm3/100g, SH0 est la valeur de référence de la solubilité de l’hydrogène dans
l’aluminium liquide à 700°C et 1 atm. Cette dernière doit être mesurée par des méthodes de mesure absolue telle la méthode de Sieverts pour pouvoir calibrer l’appareil. PH2 est la pression partielle d’hydrogène liée à la mesure de la
conductivité électrique du catharomètre. Finalement, CF(T) (32) et CF(A) (33) sont des facteurs de correction pour la température de mesure et pour les éléments d’alliage :
log[CF(T)] -2760
T +2,837 (32)
CF(A) 0,017(%Mg)-0,0269(%Cu)-0,0119(%Si) (33)
Où T est la température de mesure et %Mg, %Cu et %Si sont les concentrations massiques en élément d’alliage. La valeur de CF(T) est de 1 pour 700°C et celle de CF(A) est de 1 pour l’aluminium pur.
![Figure 1 : Solubilité de l’hydrogène dans l’aluminium pur en fonction de la température [2]](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/13.918.368.599.724.1047/figure-solubilité-l-hydrogène-aluminium-pur-fonction-température.webp)
![Figure 2 : a) Effet du contenu en hydrogène dans l'aluminium et du taux de refroidissement sur le pourcentage de porosités d’une pièce [2] ; b) Effet du pourcentage de porosités et de l'hydrogène en solution sur la résistance à la traction et sur la limi](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/14.918.173.792.107.466/hydrogène-refroidissement-pourcentage-porosités-pourcentage-porosités-hydrogène-résistance.webp)
![Figure 3 : Effet de différents éléments d’alliage sur la solubilité de l’hydrogène dans l’aluminium en fonction de la température : a) Effet du cuivre [1] ; b) Effet du silicium [1] ; c)](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/24.918.172.795.244.770/figure-éléments-solubilité-hydrogène-aluminium-fonction-température-silicium.webp)
![Figure 4 : Schéma de la méthode de Sieverts et légende des composantes [1]](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/26.918.204.795.670.1053/figure-schéma-méthode-sieverts-légende-composantes.webp)
![Figure 5 : Schéma de la méthode d’extraction pour l’aluminium liquide [22]](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/31.918.324.643.404.701/figure-schéma-méthode-extraction-l-aluminium-liquide.webp)
![Figure 6 : a) Schéma de fonctionnement du Telegas [24] ; b) Schéma de la sonde du Telegas [24]](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/35.918.189.771.435.745/figure-schéma-fonctionnement-telegas-schéma-sonde-telegas.webp)
![Figure 7 : a) Appareil AlScan [28] ; b) sonde AlScan [28] ; c) Schéma du fonctionnement de l’AlScan [28]](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/37.918.247.731.100.689/figure-appareil-alscan-sonde-alscan-schéma-fonctionnement-alscan.webp)
![Figure 8 : Charte standard utilisée pour le test de solidification sous vide partiel [4]](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/40.918.331.634.698.1038/figure-charte-standard-utilisée-test-solidification-vide-partiel.webp)
![Figure 9 : Isobares de Van’t Hoff représentant la solubilité de l’hydrogène en fonction de la température telle que mesurée par différents auteurs [1]](https://thumb-eu.123doks.com/thumbv2/123doknet/7004758.199775/43.918.274.695.102.430/figure-isobares-représentant-solubilité-hydrogène-fonction-température-mesurée.webp)