BIO-CONJUGAISON DE LA FIBRONECTINE SUR
SURFACE DE TÉFLON POUR APPLICATIONS DANS LE
DOMAINE VASCULAIRE
Mémoire
Michaël Byad
Maîtrise en génie des matériaux et de la métallurgie
Maître ès sciences (M.Sc.)
Québec, Canada
© Michaël Byad, 2016
BIO-CONJUGAISON DE LA FIBRONECTINE SUR
SURFACE DE TÉFLON POUR APPLICATIONS DANS LE
DOMAINE VASCULAIRE
Mémoire
Michaël Byad
Sous la direction de :
iii
Résumé
Depuis trente ans, des efforts ont été menés dans le domaine de l'ingénierie des matériaux afin de concevoir des appareils médicaux pouvant être en contact avec les tissus humains. Néanmoins l'interaction entre la surface du matériau et l'environnement physiologique entraine la plupart du temps des complications. Le laboratoire d'ingénierie des surfaces est spécialisé dans l'élaboration de surfaces biomimétiques capables d'interagir de manière proactive avec leur environnement.
Pour des applications cardiovasculaires, une des stratégies consiste à utiliser des protéines de la matrice extracellulaire, comme la fibronectine, connue pour la promotion de l'adhésion des cellules endothéliales. Dans ce contexte, parce que la bioactivité de la fibronectine est fortement liée à sa conformation, l'objectif est de comparer différentes stratégies d'immobilisation en caractérisant la quantité de fibronectine immobilisée ainsi que son activité biologique. Les précédentes études menées au laboratoire ont souligné le fait que la fibronectine immobilisée par les cystéines présente une meilleur bioactivité que lorsque celle-ci est immobilisée par les groupements lysines qu'elle contient. L'actuel projet porte sur l'étude de l'influence de l'utilisation d'un bras d'ancrage hydrophile ou hydrophobe entre la protéine et la surface sur la bioactivité de la protéine. Les résultats ont d'une part montré l'efficacité des bras d'ancrage dans l'immobilisation de la fibronectine et d'autre part les limites de leur utilisation pour une étude comparative portant sur la quantification et la bioactivité de la protéine.
iv
Table des matières
Résumé ... iii
Table des matières ... iv
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... x
Remerciements ... xii
Avant-Propos ... xiii
Introduction ... 1
1. CHAPITRE 1 : Revue de littérature et hypothèse ... 3
1.1. Historique des biomatériaux ... 3
1.2. Biocompatibilité des biomatériaux synthétiques ... 5
1.2.1. Réponses biologiques à l'implantation d'un biomatériau synthétique. ... 5
1.2.2. Rôle de l'eau dans la biocompatibilité ... 7
1.3. Stratégies pour améliorer la compatibilité au sang des matériaux synthétiques ... 7
1.3.1. Polymères en contact avec le sang ... 8
1.4. Modifications de surface des biomatériaux pour améliorer la compatibilité au sang 14 1.4.1. Endothélialisation des prothèses artérielles synthétiques ... 14
1.4.2. Immobilisation de biomolécule ... 17
1.5. Techniques de modification de surface ... 23
1.5.2. Traitement plasma ... 26
1.5.3. Revêtement ... 29
1.5.4. Auto-assemblage (SAMS) ... 29
v
1.6. Techniques de caractérisation ... 30
1.6.1. Méthode de spectroscopie ... 30
1.6.2. Immunofluorescence ... 32
1.6.3. Angle de contact ... 36
1.7. Hypothèses, défis et approches ... 37
1.7.1. Fonction d’adhésion cellulaire de la fibronectine ... 38
1.7.2. Conformation et bioactivité ... 39
1.7.3. NH-ester ... 40
1.7.4. Maléimide ... 41
1.7.5. Sélection des Bras d'ancrage d’ancrage ... 41
1.7.6. Amination du PTFE par traitement plasma ... 43
1.7.7. Choix de l’ELISA indirecte ... 43
1.7.8. Sélection des anticorps pour cibler la fibronectine ... 43
2. CHAPITRE 2: Matériels et méthodes expérimentales ... 46
2.1. Matériels ... 46
2.2. Méthodes ... 47
2.2.1. Techniques de modification de surface et préparation des échantillons 47 2.2.2. Techniques de caractérisation ... 48
3. CHAPITRE 3: Résultats et Discussion ... 51
3.1. Analyse XPS des différentes étapes de fonctionnalisation du PTFE ... 51
3.1.1. Étude de la fonctionnalisation du PTFE par plasma ... 51
3.1.2. Greffage de la fibronectine sur le PTFE par le Sulfo-KMUS ... 52
3.1.3. Greffage de la fibronectine sur le PTFE par le SM(PEG) 2 ... 57
3.2. Résultats angles de contact ... 60
vi
Conclusion ... 65
vii
Liste des tableaux
Tableau 1 : Médiateurs chimiques provenant du plasma sanguin et intervenant dans la réponse biologique ... 6 Tableau 2 : Tableau de résultats pour les analyses d'échantillon par la mesure
d'angle de contact ... 60
viii
Liste des figures
Figure 1 Structure d'une artère ... 15 Figure 2 Schéma représentant l'endothélisation d'une prothèse artérielle à base PTFE ... 16 Figure 3 schéma de fonctionnalisation de la surface d'un biomatériau par
l’intermédiaire d’un bras d’ancrage ... 24 Figure 4 Type de modification de surface par traitement plasma pour les polymères 27 Figure 5 : schéma représentant le dispositif instrumental pour effectuer un traitement plasma ... 29 Figure 6 Schéma représentant les étapes du fonctionnement d'un XPS ainsi que les différents types de donnée acquise à l'issue d'une analyse ... 31 Figure 7 Représentation schématique de la structure d'un anticorps ... 33 Figure 8: Schéma des différents types d'ELISA ... 36 Figure 9 Représentation des angles de contact par dépôt de liquide sur une surface solide lisse et homogène ... 36 Figure 10 Schéma de la structure de la fibronectine, de ces domaines destinés à l'adhésion cellulaire ou de biomolécules ... 39 Figure 11 Réaction entre le NHS ester et une amine primaire ... 41 Figure 12 Réaction entre le groupement maléimide et un groupement sulfhydryle ... 41 Figure 13 : Structure du Sulfo-KMUS ... 42 Figure 14 : Structure du SM(PEG)2 ... 42 Figure 15: Schéma réactionnel de la production de résorufine à partir de l'amplex red en présence de l'HRP et de H2O2 ... 44 Figure 16: Spectre d'émission et d'excitation de la résorufine ... 45 Figure 17 Spectre XPS de survol pour les échantillons de PTFE et de PTFE traité par plasma avant et après dérivation chimique ... 52 Figure 18 Spectres de survol obtenus pour les différentes étapes de
ix
Figure 19 Spectres haute résolution C1s a) échantillon de PTFE après traitement plasma b) échantillon PTFE avec le KMUS c) échantillon PTFE avec le Sulfo-KMUS et la fibronectine ... 56 Figure 20 Spectres haute résolution C1s a) échantillon de PTFE après traitement plasma b) échantillon PTFE avec le SM(PEG)2 c) échantillon PTFE avec le
SM(PEG)2 et la fibronectine ... 58 Figure 21: Domaine linéaire de la courbe de calibration ... 61 Figure 22: ELISA avec des anticorps primaires polyclonaux (FnA représente la
fibronectine adsorbée, FnG représente la fibronectine greffée) ... 62 Figure 23: ELISA avec des anticorps primaires monoclonaux (FnA représente la fibronectine adsorbée, FnG représente la fibronectine greffée) ... 63
x
Liste des abréviations
ARN : acide ribonucléïque ECM : matrice extra cellulaire
EGF : facteur de croissance épidermique
ELISA : méthode immuno-enzymatique sur support solide ePTFE : PTFE expansé
FGF : facteur de croissance des fibroblastes FN : fibronectine
FXIIA : facteur activé de Hageman GAG : Glycosaminoglycanes Ig : immunoglobuline
KNEED : séquence petidique Lys-Asn-Glu-Glu-Asp PDGF : facteur de croissance plaquettaire
PDMS : polydiméthylsiloxane PEG : polyéthylène glycol PES : polyéthersulfone
PET : polytéréphtalate d’éthylène PLA : acide polylactique
PMMA : polyméthacrylate de méthyle PP : polypropylène
PRTA-s : polymérisation radicalaire par transfert d’atome initié par la surface PS : polystyrène
PTFE : polytétrafluoroéthylène PU : polyuréthane
PVDF : Polyvinylidène fluoride PVP : Polyvinylpyrrolidone
xi
PHSRN : séquence peptidique Pro-His-Ser-Arg-Asn REDV : séquence peptidique Arg-Glu-Asp-Val RGD : séquence peptidique Arg-Gly-Asp SMC : cellule musculaire lisse
SM(PEG)2 : succinimidyl-[(N-maléimidopropionamido)-diéthylèneglycol] ester Sulfo-KMUS : N-κ-maléimidoundécanoyl-oxysulfosuccinimide ester
TGF : facteur de croissance transformant tPA : activateur du plasminogène
VEGF : facteur de croissance des cellules endothéliales vasculaires XPS : spectroscopie photoélectronique par rayons X
xii
Remerciements
Je souhaite en premier lieu remercier le professeur Gaétan Laroche de l’université Laval pour m’avoir proposé ce projet, ses conseils scientifiques ainsi que pour la liberté accordée pour conduire ce projet.
Je remercie aussi le professeur Lee de l’université Dalhousie pour son aide et sa supervision.
Je remercie les professionnelles de recherche Andrée Anne Guay Bégin et Pascale Chevallier pour leurs conseils scientifiques ainsi que leur contribution respective au niveau expérimental. Ce projet n’aurait pas pu être mené à terme sans leur aide. Je tiens à remercier Corinne Hoesli pour ses conseils concernant l’ELISA. Ainsi que tous les collègues étudiants que j’ai pu côtoyer pendant mon projet de maitrise.
Je remercie aussi le CRSNG pour son support financier via le NSERC CREATE Program on Regenerative Medicine.
xiii
Avant-Propos
L’auteur souhaite souligner la contribution des professionnels de recherche Andrée-Anne Guay-Bégin et Pascale Chevallier du centre hospitalier universitaire de Québec, Hôpital Saint François d’Assise, dans la réalisation de certaines étapes expérimentales de ce projet. En effet, la préparation et la fonctionnalisation des échantillons de PTFE destiné à être analysés en utilisant la méthode des ELISA ainsi que les tests ELISA ont été réalisés par leur intermédiaire. De plus, les tests XPS ont été conduits par ces professionnels. Les autres étapes expérimentales exposées dans ce mémoire de maîtrise ont été réalisées par l’auteur.
1
Introduction
L’objectif de ce projet de maîtrise est de proposer une amélioration de la compatibilité au sang des prothèses vasculaires à base de PTFE. Ces prothèses sont à l’heure actuelle utilisées avec succès pour remplacer les vaisseaux artériels de grand diamètre. Cependant le succès est relatif en ce qui concerne les prothèses de faible ou moyen diamètre car pour ce type de prothèse l’hydrophobicité inhérente à la surface du PTFE favorise la formation de thrombus artériel et réduit conséquemment leur efficacité. En effet, l'hydrophobicité de surface du PTFE induit une adsorption de protéines retrouvées dans le plasma sanguin. De nombreuses études portent actuellement sur la génération de tissus pouvant remplacer les artères endommagées. Même si ce domaine a connu de significatives avancées ces dernières années, les problématiques liées aux propriétés mécaniques ainsi qu’à la biocompatibilité de ces matériaux générés par ingénierie tissulaire constituent un frein à leur implantation chez le patient. Les matériaux synthétiques à base de PET ou de PTFE, de par leur faible coût et la facilité de les manipuler, représentent à ce jour l’alternative la plus efficace pour remplacer les vaisseaux sanguins derrière l’intervention de type autologue. Il existe différentes façons d'améliorer la compatibilité au sang des matériaux de type synthétique comme le PTFE faisant intervenir des modifications physico-chimiques et biologiques. Ces modifications de surface opérées sur les prothèses synthétiques comptent parmi les plus utilisées l’immobilisation d’anticoagulant tel que l’héparine [1] ainsi que le recouvrement par une monocouche de cellules endothéliales [2].
Le but est ici d’expérimenter de nouvelles directions concernant l’endothélialisation de la surface du polymère nécessaire à une bonne compatibilité du matériau en contact avec le sang par l’intermédiaire de l’immobilisation de protéine de la matrice extracellulaire. Les différentes stratégies élaborées par le laboratoire d’ingénierie des surfaces de l’Université Laval au cours des dernières années ont porté sur l’ancrage d’une protéine en particulier à savoir la fibronectine. Il a été notamment démontré que la nature chimique du type d’ancrage influence la qualité globale du procédé
2
d’endothélialisation. Cependant aucun travail à ce jour ne porte sur une étude comparative concernant l'influence de l'utilisation de bras d'ancrage possédant la même géométrie mais porteur d'une hydrophobicité différente a été réalisée. La plupart des travaux faisant intervenir notamment l'adsorption physique de protéines de la matrice extracellulaire. Le rôle de l’hydrophobicité de la surface est important dans la façon dont la configuration des protéines immobilisées et promouvant l’adhésion cellulaire va se présenter. Par conséquent ce paramètre va modifier la qualité de l’endothélialisation du matériau. Le projet vise à démontrer qu’en immobilisant la fibronectine sur PTFE par l’intermédiaire de deux types d’ancrage covalent faisant intervenir deux degrés d’hydrophobicité différents, la bioactivité de celle-ci va être modifiée. Ce mémoire de maîtrise s’organise sur trois chapitres principaux. Le premier chapitre comporte une revue de littérature sur les différentes stratégies existantes utilisées pour améliorer la compatibilité des matériaux synthétiques. Dans un second temps le matériel et méthode et la troisième partie sera consacré aux résultats ainsi qu’à la discussion.
3
1. CHAPITRE 1 : Revue de littérature et hypothèse
Dans cette revue de littérature, après avoir introduit et donné une définition des biomatériaux, nous étudierons les concepts de biocompatibilité au sang des matériaux de type polymère non dégradable ainsi que la relation entre la cellule et la surface des matériaux. Dans un second temps, nous présentons quelles sont les techniques permettant de promouvoir la compatibilité au sang de ces matériaux. Ce chapitre se focalise la plupart du temps sur les polymères, néanmoins plusieurs techniques présentées ici sont aussi utilisées pour améliorer d’autres matériaux qui sont amenés à être en contact avec le sang tels que les métaux (stents) et céramiques (verres bioactifs). Ensuite les techniques pour caractériser les modifications de surfaces associées au champ des biomatériaux seront présentées. Tout au long de ce chapitre, les stratégies employées lors de cette maitrise afin d’améliorer l’hémocompatibilité des prothèses de PTFE lors de ce seront décrites.
Il est à noter que les études portant sur l’ingénierie tissulaire malgré leur grand nombre, notamment en ce qui concerne l’utilisation de polymère dégradable ont été volontairement mises de côté pour l’écriture de cette revue de littérature.
1.1.
Historique des biomatériaux
Les premières traces retrouvées d'un matériau implanté dans un corps humain datent d'il y a 9000 ans à peu près. Les premières sutures ont été pratiquées pour la première fois il y a plusieurs milliers d'années. En 1829, les premières études sur la bioréactivité des matériaux ont été menées en implantant divers métaux dans le corps des chiens. Les conditions de corrosion et de dégradation de ces métaux ainsi que la réaction des divers tissus organiques ont, dès lors, été étudiées. Le développement des polymères à partir des années 40 vont amener les scientifiques à s'interroger sur les possibles réactions liées à leur implantation dans le corps humain. Les premières études ont lieux avec le nylon, le polyméthacrylate de méthyle (PMMA) et le polytétrafluoroéthylène (PTFE). La curiosité des médecins et
4
chirurgiens pour l'utilisation des matériaux s'est développée pendant les deux guerres mondiales. Lorsque la situation ne permet aucune alternative les chirurgiens héros font preuve d'inventivité dans leurs actes chirurgicaux. Cette période voit ainsi l'invention de nouveaux dispositifs médicaux. Cependant, l'encadrement par les agences de contrôle gouvernementales a mis peu à peu fin à cette période de grande créativité [3].
La première génération de biomatériaux s'est principalement focalisée sur la volonté de créer des biomatériaux synthétiques bio-inertes [4]. Cette génération de biomatériaux est à l'heure actuelle encore très utilisée. En effet, le PMMA est encore utilisé pour les lentilles de contact. Par ailleurs, le PTFE et le polytéréphtalate d’éthylène (PET) apparaissent encore comme la meilleure alternative dans le remplacement des vaisseaux artériels malades. L'avantage des matériaux polymères synthétiques étant leur faible coût de production ainsi que le peu de conditionnement nécessaire, une stabilité structurelle avant leur implantation ainsi qu'une relative facilité d'utilisation pour les chirurgiens lors des actes chirurgicaux.
La deuxième génération des biomatériaux est apparue après la découverte des verres bioactifs par Clarke en 1990. Cette découverte a mis en évidence l'importance de la structure du matériau dans le processus de régénération osseux. Ainsi le matériau par son mimétisme structural a vocation à être actif dans le processus de régénération d'un organe et non plus uniquement un matériau inerte physiologiquement. Une grande partie de ces nouveaux matériaux visent donc à l'intégration de fonction physiologique telle que l'ostéointégration ou l'adhésion cellulaire. Il est souvent nécessaire que ces structures soient favorables à l'intégration ou l'immobilisation d'agent physiologiques qui ont vocation soit de produire ou régénérer un nouveau matériau 'naturel' ou d'assimiler un matériau synthétique.
Tout un pan de la recherche sur l'amélioration des prothèses vasculaires vise le recrutement de cellules endothéliales sur la surface des biomatériaux déjà utilisés tels que le PTFE. De même le relargage d'agents chimiques diminuant l'influence de
5
la prolifération des cellules musculaires lisses est une voie de recherche très présente. La troisième génération de biomatériaux fait appel au génie tissulaire afin de régénérer des organes. La recherche se porte alors à produire des matériaux à base de matériaux biodégradables qui par leurs interactions avec des cellules prélevées chez le patient vont laisser place à des organes naturels. Néanmoins il existe des difficultés à régénérer des tissus/organes possédant les mêmes propriétés mécaniques.
Les avancées de la médecine tout au long du 20ème siècle ont été associées au progrès scientifique. Ainsi, l'imagerie médicale et les techniques telles que l'imagerie à résonnance magnétique ont permis de redéfinir la pratique même de diagnostic médical effectuée par les professionnels de santé. L'essor des nanotechnologies depuis les 15 dernières années offre de nouvelles perspectives dans le monde médical.
1.2.
Biocompatibilité des biomatériaux synthétiques
La définition de la biocompatibilité énumérée par Williams en 1987 est l'habilité d'un matériau à réagir de manière appropriée avec un environnement hôte et ce pour une application spécifique [5]. En effet, la plupart des biomatériaux sont implantés dans le corps et sont donc sujet à un contact prolongé avec l'environnement physiologique. Idéalement, l'implantation est définitive car le matériau est reconnu et interagit avec les éléments du corps humain comme le ferait un tissu normal. Ceci n'est que très rarement le cas et la majorité des biomatériaux implantés doivent être remplacés à partir d'une certaine durée. Les interventions chirurgicales sont de ce fait une nouvelle contrainte appliquée à l'utilisation de ces biomatériaux. Ainsi, les biomatériaux qui connaissent le meilleur succès en termes de biocompatibilité sont les matériaux qui ne sont pas en contact prolongé avec un environnement physiologique comme les lentilles oculaires.
6
Après l'implantation d'un matériau, dans le cadre d’un implant dans le système vasculaire, une réponse biologique se développe liée à l'interaction entre le sang et le matériau. Plusieurs revues de littérature ont, par le passé, décrit les différentes réactions et étapes de cette réponse biologique [6–8]. En effet, le contact avec le sang est responsable dans un premier temps de l'adsorption sur la surface de protéines contenues dans le plasma sanguin ainsi que le dépôt de facteur de coagulation et ce par un mécanisme combinant à la fois l'effet Vroman et un jeu d'interactions hydrophobes et électrostatiques entre le matériau et le sang [8]. L'adsorption sur la surface de protéines telles que les glycoprotéines IIb-IIa, fibrinogène, thrombine et le facteur de Von Willebrand favorise à la fois l'adhésion plaquettaire et l'activation du complément. Une fois le complément activé, la thrombose artérielle se propage par la libération d'éléments tels que la thromboxane B2 et la β-thromboglobuline par les plaquettes sanguines.
Tableau 1 : médiateurs chimiques provenant du plasma sanguin et intervenant dans la réponse biologique (6)
Médiateurs Exemples
Agents vasoactifs Histamine, sérotonine, adénosine, facteur relaxant dérivé endothélial, prostacycline, endothéline, thromboxane a2
Protéases plasmatiques - Système kinine - - Système complément - - Coagulation/système fibrinolytique Bradykinine, Kallikreine C3a, C5a, C3b, C5b-C9
Produits de la dégradation de la fibrine, facteur activé de Hageman (FXIIA), activateur du plasminogène tissulaire (tPA)
Leucotriènes Leucotriène B4 (LTB4), acide hydroxyeicosatetranoïque (HETE)
Protéases lysosomales Collagènase, élastase
Radicaux libres dérivé de
l’oxygène H
2O2, anion superoxyde, oxyde nitrique
Facteurs d’activation plaquettaire Lipides de la menbrane cellulaire
Cytokines Interleukine-1 (IL-1), TNF
Facteurs de croissance PDGF, facteur de croissance des fibroblastes (FGF), facteur de croissance transformant (TGF-α ou TGF-β), facteurs de croissance épidermique (EGF)
Par ailleurs, l'adsorption sur la surface produit des changements en ce qui concerne la composition biologique de cette interface dont le résultat est la mise en marche d'une réponse biologique spécifique à la nature de cette interface. Cette interface a été décrite comme une matrice de transition [9]. De même, des molécules permettant
7
l'adhésion cellulaire telles que la fibronectine et la thrombospondine sont retrouvées dans ce nouvel environnement. La formation de caillot sanguin est l'une des principales problématiques à résoudre pour améliorer la durée de vie des biomatériaux qui sont en contact avec le sang. Ce phénomène est dû à la fois aux réactions induites par l'agrégation des plaquettes sanguines mais aussi par la coagulation du sang.
1.2.2. Rôle de l'eau dans la biocompatibilité
L'eau est un solvant retrouvé dans la majorité des environnements biologiques. Le sang est composé de 45% en volume de molécules de sels et d'eau et contient 10% de protéines [10]. L'une des premières interactions lors de l'implantation d'un biomatériau a lieu avec les molécules d'eau [11].
Les matériaux ayant la meilleure résistance à l'adsorption protéique et de ce fait la meilleure biocompatibilité présentent des propriétés de surface d'hydrophilicité. Les molécules d'eau sont retenues ou liées sur la surface par des liaisons hydrogènes pour les matériaux présentant des groupements chimiques hydrophiles à leur surface ou par solvatation ionique pour les matériaux présentant des groupements chimiques zwittérioniques et constituent ainsi une barrière physique et énergétique empêchant l'adsorption protéique.
1.3.
Stratégies pour améliorer la compatibilité au sang des
matériaux synthétiques
Comme il est décrit dans 1.2.1, le contact avec le plasma sanguin lors de l’implantation d’un matériau synthétique est le phénomène déclencheur de la réponse biologique. Le plasma sanguin est composé d’une centaine de protéines différentes parmi lesquelles l'albumine, les immunoglobulines et la fibronectine constituent 50% des protéines contenues dans le plasma. Par ailleurs, le rôle d'une protéine comme la fibronectine dans le processus d'agrégation plaquettaire a été identifié depuis de nombreuses années [12]. L’adsorption des protéines issues du plasma sanguin sur la
8
surface du matériau va donc dans une certaine mesure réguler la formation de thrombose.
Par conséquent, les propriétés de surface des matériaux en contact avec le sang vont déterminer l’ampleur de la réponse biologique apportée par le plasma sanguin. Ces propriétés sont la nature chimique de la surface, l'énergie libre de surface, l'élasticité et la topographie. De plus, ces propriétés vont réguler et moduler l'interaction avec les cellules [9]. L’une des stratégies élémentaires employées afin d’améliorer la compatibilité au sang des biomatériaux synthétiques est de coordonner le choix du polymère avec les contraintes imposées (mécaniques ou physico-chimique) par l’environnement d’accueil. Cette partie présente donc les divers polymères utilisés pour fabriquer des matériaux destinés à être en contact avec le sang durant leur implantation ou utilisation.
1.3.1. Polymères en contact avec le sang
Historiquement, les biomatériaux fabriqués à partir de polymère sont les premiers à avoir présenté des résultats positifs en ce qui concerne l’implantation dans le corps humain. La maîtrise et le contrôle de la synthèse des polymères permettent une grande marge de manœuvre dans le contrôle des propriétés physico-chimiques et mécaniques du biomatériau désiré. La plupart des matériaux synthétiques utilisés pour des applications biomédicales sont sélectionnés pour leur neutralité chimique et biologique ainsi que pour leur stabilité mécanique. Leur nature physico chimique et leur stabilité structurale peuvent aussi servir à réaliser des modifications pour rendre leur surface bioactive [13].
1.3.1.1. Polyéthersulfone (PES)
Le PES est utilisé pour les membranes servant pour l'hémodialyse, la filtration et les bioréacteurs [14–16]. Il s'agit d'un polymère qui possède une bonne résistance chimique, stabilité thermique et hydrolytique et des bonnes propriétés mécaniques [17,18]. Néanmoins lorsque ce polymère est utilisé pour des applications qui
9
induisent un contact avec le sang, il est nécessaire de modifier sa surface afin d'éviter la coagulation sanguine [19].
1.3.1.2. Polyéthylène téréphtalate (PET)
Le PET est utilisé en tant que matériau pour la suture ainsi que pour les prothèses artérielles (DACRON®) et les prothèses ligamentaires dû à sa bonne biocompatibilité, son inertie chimique et ses propriétés mécaniques [20–22]. Il présente néanmoins une certaine hydrophobicité de surface qui lui empêche d’inhiber l’adsorption protéique, caractéristique que ce matériau partage avec le PTFE. Roll et al. ont, par ailleurs, publié une intéressante revue de littérature portant sur l’étude comparative entre le PTFE et le PET dans l'efficacité de l’implantation des pontages [23].
1.3.1.3. Polytétrafluoroéthylène (PTFE)
Le PTFE ou polytétrafluoroéthylène est aussi appelé TEFLON® dans sa dénomination commerciale. Il a été découvert en 1938 chez Dupont. Il s’agit d’un fluoropolymère semi-cristallin de formule (-CF2-)n possédant une basse température de transition
vitreuse (-70°C) Il est connu pour sa stabilité thermique avec un haut point de fusion ainsi que pour son hydrophobicité. La structure en hélice de sa chaîne principale confère au PTFE d’excellentes propriétés lubrifiantes [24]. La taille importante du rayon atomique des atomes de fluor rend difficile d’accès les liaisons carbonées par d’éventuel réactant [25]. Il possède donc une grande résistance aux solvants chimiques tels que les acides forts. Ce polymère est notamment très utilisé en tant que revêtement permettant d’éviter l’adhésion d’agent biologique que ce soit dans les outils de cuisine, les structures architecturales ainsi que les appareils biomédicaux. Ses propriétés mécaniques en font aussi un matériau très utilisé pour l’étanchéité des structures.
La version dite expansée (ePTFE), qui a été découverte en 1969, est utilisé pour les prothèses artérielles [26]. Sa production nécessite des conditions différentes au niveau de la phase d'extrusion du polymère. L'expansion du PTFE initiale est réalisée par l'intermédiaire de traction uniaxiale ou biaxiale. Cette version présente des
10
caractéristiques améliorées en ce qui concerne sa porosité permettant de lui conférer une meilleure imperméabilité envers les bactéries. De plus, il s'agit d'un matériau plus léger et ayant de meilleures propriétés de fluage par rapport au PTFE. Le PTFE est un polymère qui peut être utilisé aux côtés du PET pour fabriquer des prothèses artérielles. Néanmoins l'utilisation des prothèses artérielles à base de PTFE expansé reste moins efficace que les greffons de type autologue [27]. Sa structure microporeuse ainsi que sa grande flexibilité, sa résistance aux compressions en font un matériau adapté pour les sutures. Néanmoins la surface du matériau induit la formation de thrombose sur le long terme notamment en ce qui concerne les prothèses de faible diamètre [28]. En effet sa faible énergie de surface est responsable de son caractère hydrophobe ce qui est problématique dans son utilisation pour les prothèses artérielles car il n’empêche pas l’adsorption et l’attachement des protéines issues du plasma sanguin [29]. Plusieurs stratégies ont été développés sur le PTFE afin de promouvoir l'adhésion de cellule endothéliale sur sa surface et de réduire ainsi l'adsorption protéique et l'agrégation plaquettaire [30– 36].
11
1.3.1.4. Polydiméthylsiloxane (PDMS)
Parmi les polymères présentant des propriétés antiadhésives et élastiques, il y a le PDMS [37]. La structure du PDMS permet de modifier les propriétés mécaniques et structurales du matériau facilement en utilisant la synthèse de block copolymère et en alternant les unités molles et dures. Le PDMS possède des propriétés hydrophobes qui cependant ne permettent pas d'éviter l'adhésion des protéines sur sa surface [38]. De plus, la mobilité des chaines intrinsèques vers la surface fait du PDMS un matériau compliqué à modifier par traitement plasma. Des méthodes alternatives existent cependant comme les modifications par auto assemblage couche par couche ou l'étirement de la surface durant le traitement [39].
1.3.1.5. Polyvinylpyrrolidone (PVP)
Le PVP expose des propriétés hydrophiles, antiadhésives, une bonne solubilité dans l'eau, non toxique et biocompatible. Il est utilisé notamment en tant que substitut du plasma sanguin, cosmétique, additif, pour le revêtement des biomatériaux [40,41]. Depuis récemment, ce polymère est utilisé pour améliorer l'hémocompatibilité des membranes à base de PES [41].
1.3.1.6. Polyvinylidène fluoride (PVDF)
Comme le PTFE, il s'agit d'un fluoropolymère qui présente une bonne stabilité thermique, une bonne résistance chimique ainsi qu'une forte hydrophobicité [42]. Par ses propriétés intrinsèques, sa surface peut être fonctionnalisée par traitement plasma, chimique, par irradiation ou ozone [43].
1.3.1.7. Polystyrène
La modification du polystyrène pour améliorer sa compatibilité au sang peut être réalisée par un traitement plasma [44]. Le polystyrène est aussi utilisé en tant que substrat pour la culture cellulaire [45]. Tsai et al. ont utilisé ce polymère qui possède de très bonnes propriétés hydrophobes afin d’étudier le rôle de l’adsorption du
12
fibrinogène dans la médiation de l’adhésion plaquettaire provoquée par le contact avec le sang [46].
1.3.1.8. Polyéthylène glycol (PEG)
Le polyéthylèneglycol est un polymère qui est souvent utilisé pour ses facultés à interagir avec l'eau. Bien qu’il ne soit pas utilisé directement en tant que biomatériau pouvant se substituer à des organes ou à des tissus endommagés, il peut servir d’interface entre le matériau et des molécules biologiques. Il est ainsi soluble dans l'eau et peut être immobilisé sur la surface d'appareils biomédicaux car il possède une très faible énergie d'interface avec l'eau. Dès lors, la surface des polymères initialement hydrophobe devient hydrophile. Cette compatibilité avec l'eau est due notamment au fait que lors du mélange du PEG dans l'eau, l'entropie du mélange diminue. De plus, la structure du PEG et le positionnement de ses atomes d'oxygène dans sa structure cristalline possèdent une grande similarité avec la distance et l'organisation des atomes d'oxygène dans l'eau [47]. En condition aqueuse, le PEG forme un réseau intramoléculaire qui contient la molécule d'eau et rend ainsi complexe l'accès à la surface des protéines [13]. De ce fait, l'utilisation du PEG réduit considérablement l'adsorption protéique sur une surface [48] et améliorer la compatibilité au sang [49].
Ce polymère est aussi utilisé comme partie de molécules chimiques mono ou bifonctionnelles qui peuvent se lier à des protéines. On parle alors de conjugaison biologique [50]. La densité du PEG [51] ainsi que sa longueur de chaine, l'orientation et la conformation du polyéthylène glycol influencent grandement l'adsorption protéique [52]. Par ailleurs, il est difficile de réaliser un grand recouvrement de la surface car les premières molécules immobilisées constituent une gêne stérique pour l'accès d'autres molécules [53]. Baraymoglu et al ont démontré que l'activité des protéines ou enzymes immobilisées pouvait être favorisée par la conjugaison avec le PEG [54].
13
1.3.1.9. Polyuréthane
De par ses propriétés élastiques et dégradables qui peuvent être maitrisées, il s'agit d'un polymère qui est souvent utilisé pour la réalisation d'échafaudage en ingénierie tissulaire pour le remplacement des vaisseaux sanguins [55–57]. Son utilisation est très répandu dans les systèmes d'administration des médicaments [58] mais aussi pour les valves cardiaques artificiels [59]. Des nanofibres de polyuréthane peuvent être utilisées afin de créer des prothèses artérielles présentant des bonnes propriétés de biocompatibilité [60,61]. Ainsi suivant la composition chimique du polyuréthane, la durée de dégradation du polymère peut être contrôlée par la présence en plus ou moins grande quantité de liaisons ester. Ces liaisons étant susceptibles d'être hydrolysées. La présence de segments polyéther dans le polymère le rend sensible à la dégradation par oxydation alors que les associations entre polycarbonate et polyuréthane vont rendre le matériau sensible à la dégradation du type hydrolytique [56].
Certaines études visent à fabriquer des réseaux 3D poreux à base de polyuréthane pouvant par la suite relarguer des protéines de la matrice extracellulaire telle que la fibronectine [62]. Il possède une bonne biocompatibilité et ses propriétés mécaniques peuvent être aisément adaptées aux types d'utilisation recherchées. Néanmoins, le polyuréthane, lors d'un contact prolongé avec le sang, est susceptible de permettre le développement de thrombose artérielle [56]. De nombreuses études ont mis en avant pour l'amélioration de l'hémocompatibilité, la fonctionnalisation du polyuréthane par des groupements zwittérioniques [63].
1.3.1.10. Polypropylène
Le polypropylène est un polymère utilisé pour des applications biomédicales telles que les fils de sutures chirurgicaux, implants médicaux, interfaces bioréceptives dû à leur rigidité, flexibilité et leur résistance aux impacts. Sa chaîne principale carbonée est responsable de l'hydrophobicité du polypropylène [64]. Il est de plus utilisé en tant
14
que maillage pour la réparation de la zone pelvienne et la chirurgie abdominale [65– 68].
1.4.
Modifications de surface des biomatériaux pour améliorer
la compatibilité au sang
Une surface est définie comme étant la partie supérieure d'un matériau dont l'épaisseur ne dépasse pas la taille des atomes ou molécules qui se situent à cet endroit [11]. Plusieurs classifications des modifications de surfaces ont été présentées par le passé que ce soit par le type de technique employée ou le type d'interface biologique créée [13].
1.4.1. Endothélialisation des prothèses artérielles synthétiques
Le phénomène d'endothélialisation consiste en la création d'une monocouche de cellules endothéliales à la surface du matériau [36]. Les vaisseaux sanguins naturels sont constitués de plusieurs couches à savoir l'adventice, la media et l'intima. L'adventice est la couche la plus externe de la paroi artérielle alors que la média se situe sur la face interne des vaisseaux sanguins, cette face étant en contact direct avec le sang. Cette dernière couche est formée principalement par l'endothélium.
15
16
Plusieurs techniques sont utilisées à l'heure actuelle afin de favoriser l'endothélialisation d'un matériau [70]. Tout ceci dans l'objectif de limiter l'occlusion des vaisseaux sanguins lorsque ceux-ci sont propices au développement de thromboses artérielles. Les patients déjà atteint d'une maladie cardiovasculaire ou d'une thrombose vasculaire dans le passé sont considérés à risque lorsque l'on implante un greffon synthétique dans le système vasculaire [71].
17 1.4.2. Immobilisation de biomolécule
L’immobilisation de biomolécule sur le biomatériau synthétique présente deux objectifs principaux à savoir le recrutement de cellules endothéliales sur la surface et la régulation de l’environnement physiologique par les agents anticoagulants ou les inhibiteurs de la prolifération des cellules musculaires lisses.
1.4.2.1. Protéines de la matrice extracellulaire
Les cellules sont liées entre elles par l'intermédiaire de la matrice extracellulaire. La matrice extracellulaire de la paroi des vaisseaux sanguins est une structure hétérogène de protéines fibreuses, glycosaminoglycanes(GAG), protéoglycanes qui présente des signaux biochimiques ainsi que des sites d'adhésion cellulaire influençant et régulant les fonctions essentielles de la matrice extracellulaire [72]. Les constituants les plus importants de l'ECM sont le collagène, la fibronectine [73], vitronectine [74] et la laminine [75,76] pour leur rôle direct dans l'adhésion cellulaire [77].
Les constituants de cette matrice vont donc par leur rôle, organiser et structurer les cellules en tissus. De ce fait, ils font figure d'environnement et de support pour les cellules. La matrice extracellulaire va aussi guider la plupart des phénomènes physiologiques tels que le processus de cicatrisation. Son importance dans l'expression de fonctions cellulaires telles que la migration et l'adhésion est décisive dans le cheminement de ce processus. Son importance se situe aussi dans la régulation de la prolifération et de la différenciation des cellules des vaisseaux sanguins. Cette régulation des fonctions cellulaires par cet environnement est influencée par la pression exercée par le flux sanguin. La matrice extracellulaire avec ses constituants est ainsi un élément capital dans la relation entre la cellule et la surface d’un matériau.
Par conséquent, l’immobilisation de protéines de la matrice extracellulaire est une stratégie viable afin de favoriser un processus d’endothélialisation du matériau et
18
améliorer sa compatibilité au sang. En effet, l'immobilisation des protéines de la matrice extracellulaire a été utilisée par le passé pour améliorer la compatibilité au sang des prothèses artérielles synthétiques à base de PTFE et PET par le biais d'un traitement plasma [28].
Par ailleurs, l’isolement de ce type de protéine par rapport à leur environnement initial n’est pas sans risque. Cette matrice extracellulaire représente un environnement complexe où les stimulations mécaniques ont directement une influence sur la bioactivité des protéines. D’autre part, l’environnement direct de chaque protéine a un impact de type synergétique sur l’expression de leur bioactivité. Ainsi la plupart des protéines de la matrice extracellulaires lorsqu'elles sont immobilisées n'ont pas un pouvoir anticoagulant complet et ne peuvent empêcher la formation de thrombose [49].
1.4.2.1.1. Tropoélastine
La tropoélastine est un précurseur des fibres d'élastine qui est présent en grande proportion dans la paroi des vaisseaux sanguins. Elle est responsable de leur propriété mécanique telle que l'élasticité. Lorsqu'elle est immobilisée sur une surface, cette protéine permet de diminuer la thrombogénéicité du matériau tout en ne favorisant pas l'apparition de caillot sanguin [78].
1.4.2.1.2. Fibronectine
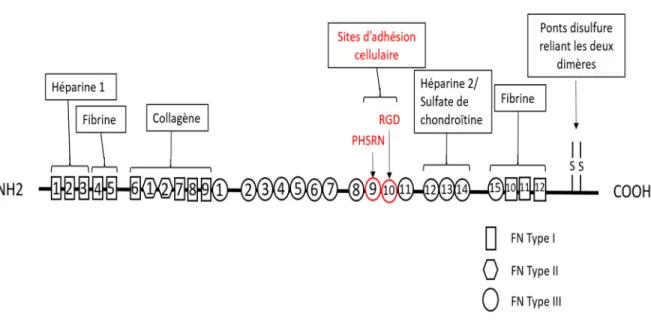
Parmi ces protéines de la matrice extracellulaire, la fibronectine constitue un élément essentiel du processus d'adhésion cellulaire. Il s’agit de la protéine d’adhésion cellulaire la plus présente dans le corps humain. Elle se retrouve dans la matrice extracellulaire sous forme fibrillaire et sous forme globulaire dans le sang.
Il s'agit d'une glycoprotéine composée de deux dimères dont le poids moléculaire total est de 440 kDa. Ses chaines polypeptidiques sont reliées entre elle par des ponts disulfures. La fibronectine est caractérisée à l'état fibrillaire principalement par
19
la répétition de trois domaines dit FN-I, FNII et FN III. Il y a ainsi 12 FN-I, 2-FN-II et 15 à 17 FN-III contenus dans chaque sous unités de fibronectine.
Par ailleurs, les fibronectines plasmatiques sont synthétisées principalement dans le foie par des hépatocytes. Les fibronectines cellulaires sont composées d'un grand nombre de fibronectine isoformes responsable de la spécificité envers les cellules. L'épissage des précurseurs ARN mitochondriaux conduit au fait qu'un seul de gène fibronectine conduit à produire un grand nombre de variation au niveau des propriétés de d'adhésion cellulaire et de solubilité. La fibronectine peut être un ligand pour une douzaine de récepteur issue de la famille des intégrines [79].
1.4.2.1.3. Laminine
L'immobilisation de la laminine a été réalisée sur une surface d’ePTFE par l'intermédiaire d'un bras d'ancrage hétérobifonctionnel afin de promouvoir l'endothélisation des prothèses vasculaires [75]. Cette protéine favorise aussi les mécanismes d'angiogenèse important dans la reconstruction des vaisseaux sanguins [80] et d'adhésion cellulaire [81].
1.4.2.2. Fragments et peptides
Les fragments de protéines peuvent être porteurs d'une fonction telle que l'adhésion cellulaire. De nombreuses études visent à se servir de ces fragments ou de séquences peptidiques responsables de l'adhésion cellulaire afin d'améliorer le recrutement de cellule sur une surface. En comparaison des protéines, la taille de ces fragments est beaucoup plus petite ce qui permet de tapisser la surface avec une densité plus élevée de fragment protéique dont la fonctionnalité est directement accessible à l'environnement physiologique. En 1984, la séquence peptide RGD (arginine, acide aspartique, glycine) a été mise en évidence comme étant une séquence promouvant l'adhésion cellulaire [12]. Ainsi depuis cette découverte, de nombreuses études ont porté sur l'incorporation de cette séquence peptidique dans le développement de biomatériaux à base de polymère, et ce dans le but de favoriser
20
leur endothélisation [82]. Cette endothélisation peut être favorisée en immobilisant le fragment recombinant rhFNIII7-10 porteur des motifs RGD et proline-histidine-serine-arginine-asparagine (PHSRN). Ce dernier site est une séquence d’activation appartenant au domaine III9 ayant un rôle synergétique avec le motif RGD dans la liaison avec l’intégrine [83].
Lei et Al. ont immobilisé différents fragments peptidiques servant pour l'adhésion cellulaire (RGD), au recrutement de cellules endothéliales (REDV et YIGSR) et la promotion de l'angiogénèse (SVVYGLR) sur une surface de PET. Lors de cette étude, l’immobilisation simultanée de plusieurs séquences peptidiques améliore l’endothélialisation du polymère [20]. Larsen et al. ont développé une technique pour améliorer l'endothélialisation des prothèses vasculaires à base de PTFE ou ePTFE avec laquelle le peptide d'adhésion cellulaire RGD est immobilisé par l'intermédiaire d'un fluoro-surfactant. Cette stratégie a permis d'améliorer la croissance des cellules qui se sont adsorbées sur la surface [36]. Chollet et al. ont souligné l'influence de la densité des peptides RGD immobilisés sur du PET sur la quantité de point focaux [21]. Ces peptides peuvent être immobilisés dans des polymères tels que le PTFE, PLA, PMMA, PS par mélanges, copolymérisation, traitements chimique ou physique. Kuwabara et al. utilisent un peptide CAG (cystéine-alanine-glycine) dérivé du collagène IV pour favoriser l'adhésion de cellules endothéliales sur des prothèses artérielles de faible diamètre [84]. Néanmoins cette stratégie permet de limiter la prolifération des cellules musculaires lisses par rapport à l'utilisation du peptide RGD qui présente une plus forte affinité pour les SMCs [85]. Par ailleurs, il a été démontré que l’immobilisation du fragment recombinant de fibrillin1 appelé PF8 permettait un meilleur attachement des cellules endothéliales que la fibronectine [31]. L'immobilisation des fragments N terminaux N10 et N18 de la tropoélastine permet de maintenir le même niveau de bioactivité et de réduire la thrombogénéicité du matériau mais présente l'avantage de diminuer la résistance à la dégradation par la protéase [86]. L'immobilisation couplée des peptides RGD et des fragments IKVAV et
21
YIGSR issus de la laminine sur du polyéthylène(glycol) monoacrylate a aussi été étudiée [87].
1.4.2.3. Facteur de croissance
Les facteurs de croissance sont des molécules chimiques solubles capables de provoquer une réponse cellulaire spécifique. Le type de réponse biologique peut être la migration, la prolifération, la différenciation ou l'adhésion cellulaire. La liaison spécifique du facteur de croissance à un récepteur transmembranaire de la cellule est responsable de la réponse engendrée. Par ailleurs, l’ECM joue un rôle dans la diffusion de ce type de molécule [88]. L'utilisation de facteur de croissance de l'endothélium vasculaire a été employée pour capturer des cellules endothéliales. Smith et Al.[89] ont montré que l'immobilisation de facteur de croissance de cellule endothéliale via une stratégie impliquant l'héparine pouvait capturer des cellules endothéliales dans le sang humain et ce sous contrainte de flux. Shin et Al.[90] ont démontré cependant que l'amélioration de l'adhésion cellulaire par l'immobilisation de facteur de croissance n'est pas forcément efficace suivant le type de type de stratégie utilisée. Les facteurs de croissance d'origine plaquettaire PDGF sont nécessaires à la vascularisation et peuvent être utilisés en ingénierie tissulaire pour favoriser l'angiogénèse. Il existe 4 types de PDGF: A,B,C et D, avec des formes homodimères et hétérodimères. Le PDGF-BB est par exemple impliqué dans la stabilisation des nouveaux vaisseaux sanguins [91]. Chow et al. ont souligné l'effet synergétique que pouvait avoir l'héparine sur les facteurs de croissance VEGF et FGF2 en agissant comme un cofacteur, stabilisant les récepteurs et protégeant ces molécules de la protéolyse ce qui eut pour finalité d'améliorer l'angiogenèse [92].
1.4.2.4. Agent anticoagulant
L'importance de l'héparine [93] en tant qu'anticoagulant a fait l'objet de nombreuses revues de littérature dans le passé [94,95] et notamment sur la relation avec l'antithrombine III [52]. L'héparine lorsqu'elle est immobilisée sur une surface permet de supprimer la formation de thrombose artérielle [93,96]. Néanmoins, cette protéine
22
ne peut être utilisée directement à cause de sa solubilité dans l'eau [17]. De plus, sa présence favorise la prolifération des cellules musculaires lisses [93]. Tang et al [97] ont démontré que l'immobilisation de l'héparine sur des membranes de polyéther sulfone permettait de diminuer l'adsorption de protéine, la suppression de l'adhésion plaquettaire et la diminution de la génération du complexe Thrombine-Antithrombine tout en gardant une bonne cytocompatibilité. Jin et al.[98] ont souligné l'importance de la densité des bras d'ancrage permettant d'attacher l'héparine sur une surface de propylène dans l'adsorption protéique. De même, le poids moléculaire des monomères utilisés pour produire le substrat va modifier l'adsorption. Pour remédier à la faible densité d'immobilisation de l'héparine, des études ont portées sur la structure de l'héparine et ses propriétés d'anticoagulant. De ce fait, plusieurs stratégies ont développées afin d'immobiliser des groupements chimiques tels que les sulfates, sulfamide ou les groupements carboxylates qui sont connus pour être responsable de ce pouvoir anticoagulant dans la structure de l'héparine. On parle alors de polymère Héparine-like [17,95]. Hoshi et al.[93] ont utilisé le poly(1,8-octanedio-co-citrate) qui est un polyester élastomérique afin d'immobiliser l'héparine sur une surface d'ePTFE. Le résultat de cette stratégie est la réduction de l'adhésion plaquettaire, la prolifération cellulaire et favorise la production d'oxyde nitrique.
L'acide citrique peut être utilisé en tant qu'anti coagulant dans le procédé de plasmaphérèse. L'acide citrique va réagir avec les cations Ca2+ du sang et va ainsi provoquer l'arrêt de la cascade la coagulation [99]. Xiang et al. ont ainsi combiné la synthèse et l'utilisation de copolymère zwittérioniques, apportant une résistance à l'adsorption protéique et des plaquettes sanguines et l'acide citrique pour ses qualités d'anticoagulant afin d'améliorer la compatibilité au sang d'un polysulfone. Le procédé utilisé étant une immobilisation covalente par chimie click [19,100]. Li et al. ont développé une méthode pour améliorer la compatibilité au sang des membranes pour l'hémodialyse de polyéthersulfone en immobilisant l'acide citrique. L'acide citrique greffé au polyuréthane est en ensuite mélangé au polyéthersulfone. Cette stratégie a démontré de bons résultats en ce qui concerne la cytocompatibilité ainsi que de
23
bonnes propriétés anticoagulantes [19]. De même, l'hirudine peut être utilisé en tant qu'agent anticoagulant [101].
Les oxydes nitriques peuvent servir aussi à supprimer l'activation des cellules sanguines. Yositomi et al. ont ainsi démontré qu'un polymère recouvert d'oxydes nitriques en contact avec le sang supprime la production de cytokines et d'espèce oxydées réactives qui sont le symptôme de l'activation des cellules sanguines [102].
La coagulation sanguine ainsi que le procédé d'activation peuvent être également inhibés et réduits par l'immobilisation de la benzamidine [101-104].
1.5.
Techniques de modification de surface
1.5.1.1. Adsorption physique et immobilisation covalente
L'adsorption physique due à sa simplicité à mettre en œuvre est la méthode qui est la plus utilisée. Elle peut être réalisée sur une grande diversité de support. Ainsi elle peut être mise en œuvre sur des implants métalliques [106]. Des études ont notamment porté sur l'adsorption des protéines du plasma sanguin et ont comparé les différents effets sur des substrats polymériques comme le PTFE, le PET et l'ePTFE [30]. Une des techniques majeures pour induire une immobilisation covalente de biomolécule est le traitement plasma [107]. Dans ce cas de figure, ce type de traitement est la première étape nécessaire pour fonctionnaliser la surface du matériau. Plusieurs études ont tenté de comparer les procédés d’immobilisation covalente à l’adsorption physique [108,109]. L’adsorption présente l’avantage de ne pas faire intervenir d’élément chimique pouvant dénaturer les protéines et leur conformation. Cependant, dans le cadre des prothèses vasculaires, les surfaces sont soumises de façon permanente à des contraintes mécaniques produites par le flux sanguins. L’immobilisation de protéine par l’intermédiaire d’une liaison covalente est donc plus durable dans le temps [110]. De plus, cette technique présente l’intérêt de cibler plus spécifiquement un type de conformation pour les protéines greffées.
24
1.5.1.2. Bras d'ancrage ou espaceur
L'utilisation de bras d’ancrage peut amener une modification de la stabilité de la biomolécules immobilisées [111]. Néanmoins, les bras d'ancrage permettent de diminuer l'encombrement stérique des protéines lorsque celles-ci sont liées via leur intermédiaire sur une surface. De ce fait, la protéine étant éloignée de la surface possède un plus grand degré de liberté dans sa mobilité. Il peut aussi protéger la protéine d'une dénaturation provoquée par l'hydrophobicité associée à la surface du polymère [13].
Figure 3 schéma de fonctionnalisation de la surface d'un biomatériau par l’intermédiaire d’un bras d’ancrage [12]
Plusieurs études ont été réalisées afin de trouver de nouveaux moyens d'immobiliser les protéines sur une surface de manière covalente [112]. Salchert et Al. [105] utilise des bras d'ancrage comme le PEG afin d'immobiliser un anticoagulant comme la benzamidine [113]. Biltresse et al. [114] ont démontré l'importance de la longueur des bras d'ancrage dans la réactivité des molécules immobilisés sur une surface de PET initialement fonctionnalisée avec des groupements hydroxyle par traitement chimique par voie humide.
1.5.1.3. Bioconjugaison [115]
La bioconjugaison est la liaison entre deux ou plusieurs molécules pour former un nouveau complexe dont les propriétés associées à chacune de ces molécules. Ces
25
molécules peuvent être d’origine naturelle ou synthétique. Une molécule peut être ainsi être ciblée en y attachant de façon covalente une molécule porteuse d’un signal fluorescent, radioactif ou biotine et ainsi faire office de marqueur pour l’imagerie médicale. Parmi les molécules intervenant on retrouve les ARN, glucides, les polysaccharides, les oligonucléotides, les lipides. Les molécules intervenant dans cette bioconjugaison sont appelées bras d'ancrage. Il existe différentes classes de bras d'ancrage suivant leur réactivité, leur nature et fonctions. Il y a ainsi des bras d'ancrage avec un seul site réactif, présentant deux mêmes fonctions réactives dites homobifonctionnels, ayant deux fonctions différentes dites hétérobifonctionnels. Certaines molécules trifonctionnelles ont été aussi développées. La longueur du bras d'ancrage peut être aussi modifiée. De même des propriétés spécifiques peuvent être introduites. Nous avons ainsi des bras d'ancrage n'introduisant pas d'espacement. Le procédé de bioconjugaison a notamment été utilisé pour la purification, la détection ou la localisation de domaine cellulaire spécifique impliqué dans le développement d'une maladie. Un certain type de réaction chimique est associé à la réaction de bioconjugaison. Ces réactions font intervenir les fonctions des bras d'ancrages ainsi que des groupements chimiques présents dans la structure des molécules.
La réactivité des protéines est caractérisée par les acides aminés portés par les diverses biomolécules ciblées. Au total 9 acides aminés possèdent un type de fonctionnalité spécifique sur leur chaine latérale. Ces acides aminés sont l'acide aspartique, l'acide glutamique, la lysine, l'arginine, la cystéine, l'histidine, la tyrosine, la méthionine et le triptophane. Les fonctions chimiques impliquées dans ces chaînes latérales sont des amines primaires, des imidazoles, carboxylates, disulfures, thioesters, groupements guanidyle, cycle phénol et indol. Ces fonctions sont néanmoins réactives suivant le pH du milieu dans lequel la protéine se trouve. En effet, suivant le pH ces fonctions vont être protonées ou déprotonées ce qui va favoriser ou non leur réactivité. L'utilisation de la bioconjugaison doit cependant préserver la bioactivité des protéines intervenant. De ce fait, les réactions ne doivent
26
pas impliquer des acides aminés proches des sites antigènes ou site d'adhésion et s’effectuer de préférence à la périphérie de la molécule.
La cystéine est l'unique acide aminé qui contient un groupement sulfhydryle. À pH physiologique, ce groupement est protoné et ne possède aucune charge. La réaction entre deux cystéines conduit à la formation d'un pont disulfure. Bien souvent ces ponts disulfures sont des éléments clés dans la conformation d'une protéine ou la stabilisation de sa structure. La plupart du temps, les cystéines sont présentes au centre de la conformation des protéines du fait de leur relative hydrophobicité.
1.5.2. Traitement plasma
Le plasma est le quatrième état de la matière et est composé de radicaux libres, d'espèces ioniques excitées, d’électrons, etc. Il existe deux types de plasma à savoir les plasmas chauds ou les espèces se trouvent en équilibre thermodynamique et les plasmas dits froids ou les espèces en présence sont hors équilibre thermodynamique. Les plasmas chauds sont très peu utilisés en laboratoire mais peuvent cependant servir à fondre certains matériaux. Ce type de plasma est représenté à l'état naturel par les vents solaires et les aurores boréales. Les plasmas chauds sont utilisés plus fréquemment dans les laboratoires. Au sein de ce type de plasma, les électrons possèdent une température différente en comparaison des autres espèces intervenantes. La densité de particule chargée plus faible de ce type de plasma permet de traiter la surface des matériaux tout en maintenant l'intégrité du matériau. La production de ces espèces réactives est effectuée par l'intermédiaire d'un gaz qui est excité par des ondes radio, des micro-ondes ou des électrons produits par une décharge sur filament chaud. Les espèces réactives dans le plasma vont réagir avec la surface des matériaux afin de les modifier chimiquement et physiquement. Parmi les avantages des techniques de modification de surface basées sur l'usage des plasmas figurent sa reproductibilité, son faible coût d'utilisation, la variété du type de changement appliqué sur la surface à savoir des modifications d'ordre chimique, physique, tribologique, électrique, optique, biologique
27
et mécanique. Cette technique peut être aisément transposée à l'échelle industrielle. Elle permet de traiter une grande diversité d'échantillon au niveau morphologique. De plus, des pochoirs peuvent être apposés sur la surface afin d'appliquer des motifs ou traiter sélectivement certaines régions du matériau.
Le traitement plasma peut être appliqué sur la surface des biomatériaux solides pour améliorer leur propriété de biocompatibilité [116]. La plupart des polymères possèdent une faible énergie de surface ce qui en font des matériaux problématiques pour attirer et attacher les cellules [117]. Ainsi, Carbone et al. ont utilisé le traitement plasma afin de diminuer l'hydrophobicité de surface du PTFE et de ce fait rendre l'adsorption protéique difficile. Une comparaison de deux types de traitement plasma à pression atmosphérique Ar et Ar/O2 [32]. L'implantation ionique par traitement plasma a été utilisée pour améliorer l'adhésion cellulaire sur des surfaces de PTFE et ePTFE [34]. Les changements chimiques néanmoins doivent intervenir uniquement sur la surface du polymère et ne doivent pas modifier ses propriétés intrinsèques [33]. De plus, l'introduction de groupement chimique sur la surface permet l'immobilisation covalente ultérieure de polymères ou molécules bioactives [118].
28
Plusieurs types de traitement ont été développés pour fonctionnaliser une surface et la rendre bioactive comme l'oxydation des surfaces par plasma, l'implantation ionique par plasma, la polymérisation par plasma permettant de créer un revêtement bioactif [119]. Le dépôt par plasma vapeur chimique permet d'immobiliser des biomolécules par un lien covalent. L'intérêt de cette méthode est quelle est sèche et peut être effectuée sur différent substrat sans que cela ne l'affecte [110]. Gomathi et al.[64] ont utilisé un traitement plasma azoté pour augmente l'énergie de surface, la mouillabilité et la compatibilité au sang du polypropylène. Cependant ce type de traitement provoque la perte de masse par le décapage de la surface. Il est important de trouver le bon compromis entre l'augmentation d'énergie de surface du polymère et sa perte de masse qui est responsable de sa rugosité.
1.5.2.1. Principe d'un plasma à décharge contrôlée par barrière électrique à pression atmosphérique
L'utilisation d'un plasma à décharge contrôlée par barrière électrique à pression atmosphérique présente les avantages d'être efficace, de traiter une large surface et d'être plus économique car généralement l'équipement utilisé a un peu faible coût que les instrumentations nécessitant d'effectuer les traitements sous vide. Néanmoins l'uniformité du traitement est plus difficile à obtenir à pression atmosphérique car les plasmas peuvent générer des arcs électriques. Dans ce cas de figure, les électrodes métalliques sont séparées par matériau isolant permettant de limiter la décharge électrique et de réduire la formation d'arc.
29
Figure 5 : schéma représentant le dispositif instrumental pour effectuer un traitement plasma [120]
1.5.3. Revêtement
En général, les groupements polaires appliqués en tant que revêtement (groupement hydroxyle ou amine) permettent d'augmenter l'hydrophilicité de la surface et ainsi de lui conférer des propriétés anti adsorption. En même temps, ces groupements peuvent servir de point d'attache pour d'éventuelle fonctionnalisation ultérieure [121]. L’immobilisation des facteurs de croissance peut être réalisée l’usage d’une couche de polydopamine. Ce procédé est inspiré par le recouvrement des moules. En effet, la dopamine est responsable du pouvoir adhérant des moules par la présence de groupement cathécol et d'amine primaire (lysine). De plus, le dépôt d'une couche de polydopamine est stable et permet la conjugaison ultérieure de biomolécule contenant des groupements thiols ou amine [90,92].
1.5.4. Auto-assemblage (SAMS)
Par cette méthode [122], les propriétés de surface peuvent être contrôlées au niveau moléculaire et définir l'ordre et l'orientation de la surface. Néanmoins, la plupart des études portent sur l'adsorption directe des protéines sur ce type de surface ou sur
30
l'adhésion cellulaire. De ce fait, la conformation des protéines absorbées sur la surface est difficilement contrôlable. La majorité des supports sur lesquels est appliqués cette technique est non polymérique [123].
1.5.5. Polymérisation radicalaire par transfert d'atome initié par la surface
L’amélioration de la compatibilité au sang ainsi que de l'endothélisation du polycaprolactone peut être effectuée par l’intermédiaire d’une polymérisation radicalaire par transfert d'atome initié par la surface [124]. Ce type de modification par le biais d'une polymérisation radicalaire par transfert d'atome initié par la surface (PRTA-s) permet de fonctionnaliser des membranes de PES par du PVP [125] et ainsi d'augmenter l'hydrophilicité de surface de la membrane. Ce procédé permet de former des chaînes polymères à la surface d’un matériau contenant des monomères initiateurs de cette polymérisation. Cette stratégie par rapport au coating permet d’avoir une plus grande densité ainsi qu’une meilleure résistance du revêtement au cours du temps. La structure en brosse des chaînes polymères formées à la surface du matériau inhibe l’adsorption protéique [126].
1.6.
Techniques de caractérisation
1.6.1. Méthode de spectroscopie1.6.1.1. Spectroscopie photoélectronique par rayons X (XPS)
La spectrométrie photoélectronique à rayon X (XPS) est généralement utilisée pour vérifier l'efficacité de divers types de modification effectuée sur la surface du matériau. Ainsi cet outil peut être utilisé après un traitement plasma ou l'immobilisation d'agent biologique [127].
L’origine de l’XPS en tant que technique d’analyse remonte à 1970 lorsque Kai Siegbahn et son équipe ont été capables de construire un instrument analysant les émissions photoélectronique. Cependant, les principes physiques ayant servi à son
31
élaboration ont été découverts sur plus d’un siècle avant. La production d’un photon est le résultat de l’éjection d’un électron initialement lié à un atome par l’intermédiaire d’un photon. Lorsque cette énergie est suffisante cela va conduire à l’émission d’un électron depuis l’atome. La rupture entre l'électron et le noyau atomique va consommer une portion d'énergie apportée par le photon. Les photons étant sans masse, l’interaction entre le photon et l’électron va produire un transfert d’énergie complet. La mesure de l’énergie cinétique (K.E.) issue de cette émission d’électron va permettre de quantifier l’énergie de liaison (B.E.) qui est spécifique d’un type d'élément atomique.
Figure 6 Schéma représentant les étapes du fonctionnement d'un XPS ainsi que les différents types de donnée acquise à l'issue d'une analyse [128]
A l’issue d’une analyse comme représentée par la Figure 6, l’énergie de distributions de chaque émission est rapportée à un ordre d’énergie prédéfinie et associé à un élément spécifique. De même, des informations issues d’une analyse XPS telles que la distribution spatiale spécifique aux émissions électroniques émises ainsi que leur distribution en profondeur.
La spectroscopie photoélectronique à rayon X est un outil pouvant être utilisé pour la détection des protéines adsorbées ou immobilisées sur une surface. De plus, elle
32
peut fournir des analyses quantitatives pour une épaisseur et une surface donnée [129]. En effet, l’XPS permet d’identifier la composition atomique d’une surface solide sur une épaisseur de 10 nm à la condition que ces éléments appartiennent à Li-U. L’exception étant pour les éléments H et He qui sont non détectables à cause de leur faible environnement photoélectronique [128]. Le succès de cette technique lors des 30 dernières années est en partie dû au fait que la préparation des échantillons est rapide et facile à mettre en œuvre. Les problèmes liés aux analyses XPS d'échantillon de polymère est la faible intensité du signal issu des sources monochromatiques, la faible résolution spatiale et les difficultés liées à la compensation de charge [130]. Excepté pour l'hydrogène, les analyses permettent de déterminer le pourcentage atomique de chaque atome. L'aire d'un pic de spectre XPS est proportionnelle au nombre d'atome de l'élément étudié.
1.6.2. Immunofluorescence
La conformation des protéines peut être analysée par différentes méthodes telles que les isotopes radioactifs, ELISA et FRET [131]. La méthode immuno-enzymatique ELISA peut permettre de quantifier la présence de fibronectine sur un tissue mou [132] ou immobilisée sur une surface [35].
1.6.2.1. ELISA
La méthode immuno-enzymatique ELISA est une méthode utilisée afin de quantifier la présence d'un anticorps ou antigène. Il existe différents protocoles d'application. Le principe de cette technique consiste à utiliser des anticorps qui de manière directe ou indirecte vont marquer une protéine cible ou un épitope particulier d'une protéine et par la suite être responsable de la production de fluorescence lorsque cet anticorps est porteur d'une enzyme prédestinée à cette action. L'usage d'une courbe de calibration en fonction de l'intensité du signal reçu permet de quantifier la protéine immobilisée sur une surface. Contrairement à la plupart des autres essais basés sur l'utilisation des anticorps, cette technique peut être quantitative. L'avantage de cette technique est sa relative rapidité et facilité d'exécution. Généralement, les anticorps
33
sont immobilisés sur une surface solide de manière non spécifique (par adsorption) ou spécifique (par bioconjugaison).
Les anticorps font partis du groupe des glycoprotéines parfois appelé immunoglobuline présent dans le sérum des espèces animales. Parmi le groupe des immunoglobulines, il existe 5 grandes classes: IgG, IgA, IgM, IgD et IgE.

![Figure 1 Structure d'une artère [69]](https://thumb-eu.123doks.com/thumbv2/123doknet/6360696.167948/28.918.172.679.131.664/figure-structure-d-une-artère.webp)

![Figure 3 schéma de fonctionnalisation de la surface d'un biomatériau par l’intermédiaire d’un bras d’ancrage [12]](https://thumb-eu.123doks.com/thumbv2/123doknet/6360696.167948/37.918.136.777.425.664/figure-schéma-fonctionnalisation-surface-biomatériau-intermédiaire-bras-ancrage.webp)
![Figure 4 : Type de modification de surface par traitement plasma pour les polymères[118]](https://thumb-eu.123doks.com/thumbv2/123doknet/6360696.167948/40.918.146.722.690.988/figure-type-modification-surface-traitement-plasma-pour-polymères.webp)
![Figure 5 : schéma représentant le dispositif instrumental pour effectuer un traitement plasma [120]](https://thumb-eu.123doks.com/thumbv2/123doknet/6360696.167948/42.918.204.674.142.488/figure-schéma-représentant-dispositif-instrumental-effectuer-traitement-plasma.webp)
![Figure 6 Schéma représentant les étapes du fonctionnement d'un XPS ainsi que les différents types de donnée acquise à l'issue d'une analyse [128]](https://thumb-eu.123doks.com/thumbv2/123doknet/6360696.167948/44.918.180.784.446.721/figure-schéma-représentant-étapes-fonctionnement-différents-acquise-analyse.webp)
![Figure 7 Représentation schématique de la structure d'un anticorps [133]](https://thumb-eu.123doks.com/thumbv2/123doknet/6360696.167948/46.918.179.761.341.950/figure-représentation-schématique-de-la-structure-un-anticorps.webp)
![Figure 9 Représentation des angles de contact par dépôt de liquide sur une surface solide lisse et homogène [135]](https://thumb-eu.123doks.com/thumbv2/123doknet/6360696.167948/49.918.128.787.716.937/figure-représentation-angles-contact-dépôt-liquide-surface-homogène.webp)