Implication de l’activité synaptique dans les déficits
cognitifs associés au vieillissement et à la maladie
d’Alzheimer
Thèse
Cyril Bories
Doctorat en neurobiologie
Philosophiae doctor (Ph.D.)
Québec, Canada
Résumé
Le déclin des fonctions cognitives associé au vieillissement et à la maladie d’Alzheimer est une préoccupation grandissante de santé publique. L’élaboration de stratégies thérapeutiques visant à maintenir les capacités cognitives repose sur l’étude des multiples déficits comportementaux associés au vieillissement dans des modèles animaux ou transgéniques de la maladie d’Alzheimer. Afin d'identifier les substrats de ces déclins cognitifs nous avons évalué les performances cognitives frontales dépendantes de rats âgés ainsi que de souris transgénique de la maladie d’Alzheimer. Notre analyse a révélé, dans une sous-population de rats âgés, l'émergence de comportements exploratoires stéréotypés, de déficits de mémoire en corrélation avec une perte d’épine dendritique « minces » concomitante à une augmentation de l’activité inhibitrice. À l’opposé les rats âgés résilients présentent une augmentation spécifique des entrées synaptiques excitatrices au niveau de la couche pyramidale 2/3 du cortex préfrontal. Ces changements semblent sous-tendus par un changement d’association de protéine trans-synaptique de la famille des Neuroligin.
Au-delà des troubles de la mémoire, la maladie d’Alzheimer se caractérise aussi par nombre de déficits comportementaux, tels que des troubles de l’humeur et des changements de la personnalité, anxiété ou agressivité. Nous démontrons l’existence de troubles du comportement social semblables à ceux observés chez l’être humain. De plus nos travaux démontrent l’existence d’un dimorphisme comportementale se reflétant au niveau synaptique. Nous avons ainsi pu révéler une association temporelle entre une hyperactivité synaptique et les phases de désinhibition sociale. Enfin et compte tenu de la similarité des changements sociaux observés avec ceux associés à certaines maladies neuropsychiatriques, nous avons réprimé l’activité de PAK (p21-activated kinase) une protéine impliquée dans la maturation synaptique. Nos résultats suggèrent un rôle de cette protéine dans les processus de phosphorylation de tau dans la maladie.
Nos résultats éclairent sous un nouveau jour les changements synaptiques associés aux déclins cognitifs lors au vieillissement et de la maladie d’Alzheimer.
Abstract
The cognitive decline associated with aging and Alzheimer's disease is a growing concern for public health. The development of therapeutic strategies to maintain cognitive abilities requires proper assessment of the multiple behavioral deficits associated with in animal models of aging as well as of transgenic model of Alzheimer's disease. To identify substrates of these cognitive declines we evaluated the frontal dependent cognitive performance of aged rats and of transgenic mice model of Alzheimer's disease. Our analysis revealed in a subpopulation of aged rats the emergence of abnormal stereotyped exploratory behavior and memory deficits both correlated with a loss of "thin" dendritic spine concomitant with an increase in the synaptic inhibitory tone. In contrast, aged rats resilient to such behavioral impairments exhibit a specific increase in excitatory synaptic inputs at the pyramidal layer 2/3 of the prefrontal cortex. These changes seem underpinned by a change of association of trans-synaptic protein of the Neuroligin family.
Beyond memory impairment, Alzheimer's disease is also characterized by many behavioral deficits, such as mood disorders and personality changes, anxiety, aggression, disinhibition. Here we report social behavior alterations similar to those observed in humans. Furthermore our work demonstrates the existence of a behavioral dimorphism reflected at the synaptic level. Indeed we were able to reveal a temporal association between background synaptic hyperactivity and phases of social disinhibition.
Finally given the significant synaptic changes observed in Alzheimer's disease, and given the similarity of the social changes observed in certain developmental and neuropsychiatric diseases, we genetically downregulated in a transgenic model of Alzheimer’s disease the activity of PAK (p21 activated kinase), a protein involved in actin reorganization and synaptic maturation. Our results suggest for the first time a role of this protein in the process of phosphorylation of tau in the disease. Our findings shed new light on synaptic changes associated with cognitive decline in aging and Alzheimer's disease.
Avant-Propos
La présente thèse est écrite sous forme d'insertion d'articles. Les résultats présentés dans les chapitres 2 à 5 sont composés de textes et figures de manuscrits soumis pour publication ou en préparation. La contribution de chacun des auteurs va comme suit :
Chapitre 2 : Differential changes in the balance of prefrontal synaptic activity in successful vs. unsuccessful cognitive aging. Cyril Bories, Zoé Husson, Matthieu J Guitton, Yves De Koninck
Pour cette étude, j'ai effectué toutes les analyses morphologiques et comportementales des animaux adultes et âgés. Zoé Husson a contribué aux expériences du groupe de jeunes animaux. Matthieu Guitton nous a conseillés sur le test de planche à trous. Enfin j'ai réalisé l’ensemble des figures et écris le texte en collaboration avec le Dr Yves De Koninck.
Chapitre 3 : A switch in Neuroligin proteins expression in successful aging. Cyril Bories, Zoé Husson, Matthieu J Guitton, Yves De Koninck
Pour cette étude, j’ai effectué toutes les analyses électrophysiologiques, morphologiques et comportementales des animaux adultes et âgés. Zoé Husson a contribué aux expériences du groupe de jeunes animaux. Matthieu Guitton nous a conseillés sur le test de planche à trous. De plus, j'ai réalisé l’ensemble des figures. Enfin le texte a été écrit en collaboration avec le Dr Yves De Koninck.
Chapitre 4: Sex-dependent alterations in social behavior and cortical synaptic activity coincide at different ages in a model of Alzheimer’s disease. Cyril Bories*, Matthieu J. Guitton*, Carl Julien, Cyntia Tremblay, Meriem Msaid, Yves De Koninck, Frédéric Calon.
comportementales ont été réalisées par Matthieu Guitton. Carl Julien, Cyntia Tremblay et Meriem Msaid ont contribué aux analyses moléculaires. De plus, j'ai réalisé l’ensemble des figures. Enfin le texte a été écrit en collaboration avec les Drs Frédéric Calon et Yves De Koninck.
Chapitre 5: In vivo inhibition of p21-activated kinase exacerbates synaptic and behavioral deficits in an animal model of Alzheimer’s disease. Cyril Bories, Dany Arsenault, Myriam Lemire, Carl Julien, Cyntia Tremblay, Susumu Tonegawa, Matthieu J. Guitton, Yves De Koninck, Frédéric Calon
Pour cette étude, j'ai effectué les analyses électrophysiologiques et morphologiques. Myriam Lemire a collaboré à l’analyse morphologique. Les analyses comportementales ont été réalisées par Matthieu Guitton. Dany Arsenault, Carl Julien et Cyntia Tremblay ont contribué aux analyses moléculaires. Le professeur Tonegawa a fourni la souche de souris dnPAK. De plus, j'ai réalisé l’ensemble des figures. Enfin le texte a été écrit en collaboration avec les Drs Frédéric Calon, Matthieu Guitton et Yves De Koninck.
Remerciements
Je voudrais tout d'abord remercier mon directeur de thèse, le Dr Yves De Koninck qui m’a donné l'opportunité de poursuivre mon doctorat au sein de son laboratoire. Je le remercie pour sa confiance et sa patience. Mes remerciements s'adressent aussi au Dr Frédéric Calon pour son aide dans l’écriture de mes articles.
Merci à mes compagnons d’aventures: Guillaume Lavertu pour m’avoir permis de m’échapper de mon ordinateur, qui fut aussi un bon “science partner ” et désormais un ami. Merci à Sylvain Côté pour les heures de débats inutiles et donc parfaitement indispensables et pour son soutien discret mais sans faille lors des mauvais moments
Merci au professeur Charalampos “Babis” Labrakakis qui coule des jours heureux en Grèce.
Merci pour les sourires de la “KéKé team”; Karine et Karen. Merci à mes stagiaires Myriam et Zoé qui auront accompli un travail remarquable en un temps record. Un grand merci aussi a tous les autres membres passés et présents du laboratoire : Sophie, Dominic, Yoan, Suzie, Louis-Etienne, Modesto, César, Annie, Harold, Gabrielle, Rob et un PDKiste Simon.
Un gros merci à Jacqueline et Sonya, pour m’avoir aidé à surmonter tous les tracas administratifs.
Une pensée pour les autres étudiants et pour ceux qui liront cette thèse : Lâchez pas !
À mes parents : Merci pour tout
À mon frère, Muriel et Morgane
Table des matières
Résumé ... i
Abstract ... iii
Avant-Propos ... v
Remerciements ... vii
Table des matières ... ix
Liste des Figures ... xi
Liste de tableaux ... xiii
Abbréviations ... xv
Chapitre 1 Introduction générale ... 1
Le vieillissement ... 3
Le cortex préfrontal ... 5
Changements fonctionnels au cours du vieillissement ... 21
La maladie d’Alzheimer ... 31
Généralités ... 31
État des connaissances cliniques actuelles ... 32
Objectifs de la thèse ... 50
Chapitre 2 Differential changes in the balance of prefrontal synaptic activity in successful vs. unsuccessful cognitive aging. ... 55
Abstract ... 59
Introduction ... 60
Material and Methods ... 61
Results ... 67
Discussion ... 73
Reference List ... 77
Figures ... 85
Chapitre 3 A switch in Neuroligin proteins expression in successful aging ... 97
Abstract ... 101
Introduction ... 102
Results ... 107
Discussion ... 110
Reference List ... 114
Figures ... 119
Chapitre 4 Sex-dependent alterations in social behavior and cortical synaptic activity coincide at different ages in a model of Alzheimer’s disease. ... 125
Abstract ... 127
Introduction ... 130
Material and Methods ... 131
Results ... 136
Discussion ... 139
Reference List ... 143
Figures ... 149
Table ... 153
Chapitre 5 In vivo inhibition of p21-activated kinase exacerbates synaptic and behavioral deficits in an animal model of Alzheimer’s disease. ... 157
Abstract ... 159
Introduction ... 162
Materials and methods ... 164
Results ... 170
Discussion ... 173
Reference List ... 178
Figures ... 187
Chapitre 6 Discussion générale ... 193
Récapitulatif ... 195
La synapse glutamatergique, un acteur de premier plan ... 196
La synapse inhibitrice, un second rôle ? ... 201
Inverser le vieillissement synaptique : perspectives ... 203
Conclusion ... 206
Liste des Figures
Figure 1: Le cortex préfrontal de 7 espèces. ... 6
Figure 2 Cartes cytoarchitectoniques et fonctionnelles du cerveau humain. ... 8
Figure 3 Carte cytoarchitectonique du cortex frontal de singe. ... 9
Figure 4 : Le cortex prefrontal du rat. Adapté de (Uylings et al., 2003) ... 10
Figure 5 :Innervation du cortex préfrontal. ... 11
Figure 6 Evaluation transversales (a) et longitudinales (b) de performances cognitives fronto-dependante au cours du vieillissement. ... 14
Figure 7 Évolution du poids du cerveau en fonction l’âge chez l’être humain. ... 15
Figure 8 Changements volumétriques de différentes aires corticales en fonction de l’âge chez l’être humain. ... 16
Figure 9 : Représentation schématique du microcircuit néocortical préfrontal. ... 18
Figure 10 : Modèle de la cellule pyramidale vieillissante. ... 20
Figure 11 Activités cérébrales enregistrées chez des jeunes adultes, adultes âgés avec déficits cognitifs et adultes âgés avec déficits cognitifs. ... 23
Figure 12 : Evolution de differentes sous unités GABA en fonction de l’âge. ... 29
Figure 13 : Conséquences neuro-anatomiques de la maladie d’Alzheimer. ... 34
Figure 14 :Histopathologie de la maladie d'Alzheimer. ... 35
Figure 15 Évolution des dépôts amyloïdes au cours de la maladie. ... 36
Figure 16 La protéine précurseur amyloïde (APP) et ses principaux dérivés. ... 38
Figure 17 : Evolution spatio-temporelle des enchevétrements intracellulaires. ... 39
Figure 18 Exemples de modèles transgéniques de la maladie d’Alzheimer. ... 42
Figure 19 Evolution du système glutamatergique au cours vieillisement.. ... 199
Figure 20 Evolution du système GABAergique au cours vieillisement. ... 201
Figure 21 Voie moléculaire impliquée dans la polymérisation de l’actine synaptique permettant la formation de nouvelle épines dendritiques ... 204
Liste des tableaux
Table 1 Quelques conséquences comportementales suite a une lésion du cortex préfrontal médian et orbito-frontal chez le rat. ... 12 Table 2 : Exemples d’alterations morphologiques associées au vieillissement dans le cortex préfrontal de primate. ... 21
Abbréviations
Aβ β amyloide
AMPA alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate cAMP adénosine monophosphate cyclique
ATP adénosine triphosphate
BAPTA 1,2-Bis(2-Aminophenoxy)ethane-N,N,N',N'-tetraacetic acid BDNF Brain Derived Neurotrophic Factor
dnPAK dominant negative of PAK
EGTA ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid EPSC courant excitateur postsynaptique
GABA acide y-aminobutyrique
GAD65 décarboxylase de l'acide glutamique 65 GAD67 décarboxylase de l'acide glutamique 67 GluR récepteur glutamatergique
GTP guanosine triphosphate Hz Hertz KA kaïnate KO knock-out LTD long-term depression LTP long-term potentiation MA Maladie d’Alzheimer
mEPSC courant excitateur postsynaptique miniature mIPSC courant inhibiteur postsynaptique miniature mGluR récepteur glutamatergique métabotrope MΩ Mega Ohm
NMDA N-méthyl-D-aspartate pA picoampère
PA potentiel d'action PAK p21 activated kinase PS1 Presenilin 1
PSD densité postsynaptique
sEPSC courant excitateur postsynaptique miniature sIPSC courant inhibiteur postsynaptique miniature SNC système nerveux central
µs microseconde
VGlut transporteur vésiculaire du glutamate VGAT transporteur vésiculaire du GABA
Chapitre 1
Le vieillissement
Le vieillissement biologique peut se définir comme un ralentissement progressif des processus physiologiques menant ultimement à la mort de l’organisme. Ce déclin peut résulter de dysfonctionnements métaboliques, de la mort massive de cellules ainsi que du non-remplacement de celles-ci (Aubert and Lansdorp, 2008). Le vieillissement est un processus physiologique, bien que celui-ci puisse être associé au développement de nombreuses pathologies. De plus ce processus présente une forte hétérogénéité aussi bien inter — qu’intra spécifiques, résultant ainsi en des durées de vie variable pour des individus appartenant à une même espèce.
Entendu qu’il existe une multitude de changements physiologiques concomitants au vieillissement, la présente introduction se veut non exhaustive et se borne à exposer les faits les plus saillants concernant le système nerveux sénescent afin de faciliter la mise en contexte des résultats exposés dans la présente thèse. Nous sommes toutefois parfaitement conscients que les différents concepts et données présentés subséquemment ne peuvent et ne doivent pas occulter les autres changements altérant le fonctionnement des différents organes.
Le système nerveux vieillissant.
Quand la plupart des gens se questionnent sur le déclin cognitif lors du vieillissement, la première idée qui vient à l'esprit est la maladie d'Alzheimer (MA). Toutefois le vieillissement « normal » du système nerveux peut aussi conduire à un déclin des fonctions cognitives ou non cognitives indépendamment de l’émergence de quelconque maladie neurodégénérative. Comme nous le verrons plus loin, le développement de ces altérations au cours du vieillissement semble peu dépendant d’un phénomène de mort cellulaire massive comme observé pour les maladies neurodégénératives. Toutefois et sachant que les maladies neurodégénératives, telles que les maladies d’Alzheimer ou de Parkinson, ont une incidence plus élevée dans la population âgée l’étude du processus de
vieillissement non-pathologique ou « normal », est un prérequis indispensable à l’interprétation des données passées, présentes et futures collectées lors d’études sur ces mêmes maladies. Comme nous le verrons dans les prochains paragraphes, les changements associés au vieillissement sont souvent subtils en comparaison des altérations observées chez les individus atteints de la maladie de Parkinson ou d’Alzheimer.
Les déficits de mémoire sont les symptômes parmi les plus visibles et les mieux reconnus lors du vieillissement, aussi bien par le grand public que par la communauté scientifique. De très nombreuses équipes se sont donc penchées sur l’étude d’une région clef de la mémoire déclarative et épisodique ; le lobe medio-temporal comprenant l’hippocampe, les cortex perirhinaux, entorhinaux et parahippocampiques. De fait, une abondante littérature rapporte de nombreux changements de plasticité neuronale, que ceux-ci soient fonctionnels ou structuraux. On note ainsi des altérations des capaceux-cités de potentialisation à long terme (potentialisation a long terme, PLT) à court terme (PCT), de changements d’excitabilité intrinsèque, de changements synaptiques fonctionnels (transmission synaptique, altération des propriétés des récepteurs postsynaptique) ou structuraux tels qu’une attrition synaptique, dendritique ou somatique [pour revue (Rosenzweig and Barnes, 2003;Disterhoft and Oh, 2007;Burke and Barnes, 2010)].
Toutefois, au-delà de ces troubles de la mémoire, d’autres bouleversements neuropsychologiques affectent la qualité de vie de nombre de personnes âgées. Ainsi les fonctions cognitives exécutives comprenant la flexibilité cognitive, l’attention et le langage représentent des domaines particulièrement affectés lors du vieillissement. Certaines études les considèrent comme les plus précocement altérées (Gallagher and Burwell, 1989;Gallagher and Rapp, 1997;Grady, 2008;Hara et al., 2011b). De plus on notera l’émergence d’épisodes de dépression chez les personnes âgées (Flint, 1999;Blazer, 2000). Pris dans leur ensemble, ces dysfonctionnements peuvent s’avérer particulièrement invalidants et nécessitent une prise en charge spécifique entraînant un coût humain et économique grandissant pour les sociétés modernes.
De ce fait il est d’un grand intérêt de rechercher les substrats neurobiologiques de ces déclins afin d’améliorer leur traitement et la prise en charge des patients. Pourtant ces déficits demeurent relativement peu étudiés en comparaison de ceux associés aux troubles de la mémoire déclarative (Hof and Morrison, 2004;Burke and Barnes, 2006). Toutefois un nombre grandissant d’équipes de recherche, dont la nôtre, s’est engagé dans la caractérisation et l’étude des mécanismes biologiques à l’origine de ces troubles. Pour cela une majorité de ces recherches a porté sur l’étude du cortex frontal, ce dernier jouant un rôle crucial dans la coordination et le maintien des fonctions exécutives. De plus de nombreuses études ont démontré chez le primate et le rongeur des altérations fonctionnelles et structurales peu ou prou similaires à celles observées au cours du vieillissement humain, nous permettant ainsi d’obtenir de précieuses données facilitant l’étude des corrélats neurobiologiques des troubles neuropsychologiques observés lors de la sénescence.
Une abondante littérature étant accessible sur les changements de propriétés du lobe medio-temporal lors du vieillissement, mais celle-ci s’avérant être plus limitée pour le cortex frontal, nous focaliserons dans un premier temps notre attention sur la synthèse des données existantes sur le cortex préfrontal lors du vieillissement non pathologique, et cela du réseau neuronal au neurotransmetteur. Nous présenterons enfin brièvement quelques notions clefs sur la maladie d’Alzheimer.
Le cortex préfrontal
Généralités
D’un point de vue fonctionnel, le cortex préfrontal joue un rôle prépondérant dans la genèse et le maintien des fonctions cognitives dites « hautes », permettant la planification et l’exécution d’acte complexes, l’élaboration du langage, la mémoire de travail (Fuster, 2000;Fuster, 2001;Fuster, 2002). Bien que le cortex préfrontal affiche un certain nombre de variations interspécifiques, notamment cyto-architectonique, de grandes similarités de connectivités cortico-corticales, cortico-thalamiques ainsi que fonctionnelles permettent
toutefois de rapprocher les résultats obtenus chez le rat de ceux obtenus chez les primates non humains et, in fine, chez l’être humain.
Dans un premier temps, nous présenterons dans leurs grandes lignes les différentes subdivisions et leurs fonctions respectives chez l’Homme, le primate et leurs équivalents chez le rongeur, et dans un deuxième temps, nous aborderons plus en détails la cytoarchitectonie du cortex préfrontal chez le rongeur. Enfin nous décrirons les changements associés au vieillissement observés dans le cortex préfrontal.
Fonctions et organisation.
Le cortex frontal et sa portion la plus rostrale, le cortex préfrontal, sont les structures phylogénétiquement et ontogénétiquement récentes. Le cortex préfrontal étant la structure la plus développée chez les mammifères, atteignant son développement maximal chez l’Homme et les primates non humains (Figure 1).
Figure 1: Le cortex préfrontal de 7 espèces. Adapté de (Fuster, 2002) Ra
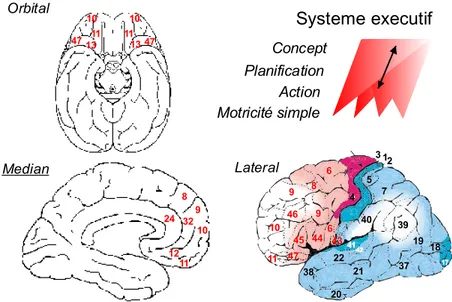
Chez l’être humain, le cortex préfrontal peut être subdivisé en trois grandes régions : orbitale, médiane et latérale (Figure 2). Différentes expériences de lésions ont permis de démontrer que les portions médianes et orbitales sont principalement impliquées dans le contrôle des comportements sociaux et émotionnels, alors que la portion latérale, notamment sa portion dorsale, la plus développée chez l’être humain, contribue au langage ainsi qu’à l’élaboration d’actes moteurs complexes, à la mémoire de travail et au raisonnement (Goldman-Rakic, 1996;Fuster, 2002;Uylings et al., 2003). Ces divisions anatomiques strictes découlant d’études sur les conséquences de lésions cérébrales, sont toutefois à nuancer à la lecture de nombreux travaux basés sur les nouvelles techniques d’imagerie par résonnance magnétique fonctionnelle (IRMf) ou par tomographie par émission de positron (PET-scan) démontrant ou rappelant la forte interdépendance de ces différentes structures dans la genèse des actes comportementaux susnommés (Fletcher et al., 1997). Chez l’être humain la région préfrontale 46 (aire 46 de Brodmann), plus précisément sa partie centrale et caudale, a aussi été associée à la mémoire de travail. Elle joue donc un rôle critique dans une gamme de tâches cognitives qui nécessitent de garder à l'esprit temporairement les informations nécessaires pour compléter des tâches avec plusieurs composants telles que suivre une route en suivant des indications ou pour réaliser une recette [pour revues, voir (Goldman-Rakic, 1996;Funahashi and Inoue, 2000;Fuster, 2000)]
Figure 2 Cartes cytoarchitectoniques et fonctionnelles du cerveau humain. Les différentes aires du cortex préfrontal humain et leur numérotation respective selon la classification de Brodmann (gauche). Organisation hiérarchique simplifiée des fonctions cognitives associées (droite). Les flèches indiquent les
interactions inter et intraréseaux. Adapté de (Fuster, 2000;Fuster, 2001).
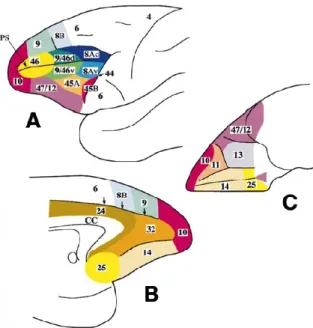
De nombreuses homologies peuvent être tracées avec les structures existantes chez le primate (Figure 3). De plus les expériences de lésions du cortex frontal chez le primate non humain ont permis de reproduire un grand nombre des déficits observés chez l’être humain confirmant les fortes analogies interspécifiques de cette structure, facilitant ainsi le rapprochement des résultats obtenus chez les primates non humain à ceux récoltés lors de travaux sur l’homme.
Median Orbital Lateral 8 9 10 32 24 12 11 10 11 10 11 47 47 13 13 9 9 6 6 46 45 44 47 11 10 8 4 5 12 3 43 40 39 19 18 17 37 21 42 41 22 38 20 7 Systeme executif Concept Planification Action Motricité simple
Figure 3 Carte cytoarchitectonique du cortex frontal de singe. (A) Vue latérale. (B) Vue médiane. (C) Vue inférieure. CC, corpus callosum, PS, principal sulcus (Fuster, 2001)
À l’opposé, l’existence chez le rongeur d’une structure anatomiquement ou fonctionnellement homologue au cortex préfrontal humain ou du primate a longtemps été un sujet de controverse (Uylings et al., 2003). D’un point de vue anatomique, une forte densité de fibres projetant du noyau du thalamus médiodorsal vers le cortex préfrontal médian est une des marques caractéristiques du cortex préfrontal chez l’Homme. Sur cette base, le cortex préfrontal médian chez le rat peut être anatomiquement subdivisé en 4 grandes zones (Figure 4), l’aire orbitale médiane (MO), Prelimbic (PrL), InfraLimbic (IL) et cingulaire (Cortex cingulaire Antérieur dorsal et ventral ; ACd et ACv). Toutefois Uylings (Uylings et al., 2003) prit le parti de réunir le cortex cingulaire, le cortex Prelimbic et InfraLimbic dans une même structure constituant ainsi, à leur sens, le cortex préfrontal médian auquel s’ajoutera le cortex orbito-frontal (OFC) pour composer l’ensemble du cortex préfrontal (Figure 4).
Figure 4 : Le cortex préfrontal du rat. Adapté de (Uylings et al., 2003)
Ces différentes zones du cortex préfrontal sont aussi en étroite relation avec d’autres noyaux cérébraux et notamment avec les ganglions de la base (Figure 5), ces derniers projetant vers le cortex pré-moteur mais exerçant aussi une forte influence sur le cortex préfrontal comme définit précédemment [Prelimbic (PrL), InfraLimbic (IL), Anterior cingulate (AC)]. Ainsi, comme chez le primate non humain (Middleton and Strick, 2001),
on a pu identifier chez le rat cinq circuits, un «moteur», un «oculomoteur », un « cingulaire antérieur/médial/orbito-frontal », un «orbito-frontal latérale », et un circuit «dorso-latéral », comme illustré pour la voie «cingulaire antérieur/médial/orbito-frontal» dans la Figure 4
(Uylings et al., 2003). En plus du noyau médiodorsal du thalamus le cortex préfrontal médian reçoit ainsi une forte innervation en provenance du noyau baso-latéral du complexe amygdalien ainsi que du noyau thalamique para-ventriculaire. On notera aussi une influence indirecte du compartiment dorso-médian de la substance noire réticulée (SNrdm).
Figure 5 :Innervation du cortex préfrontal. Illustration des principales voies impliquant le cortex préfrontal médian. Abréviations mPFC; medial prefrontal cortex, PL; prelimbic, IL; Infralimbic, MO; Medial optic, ACv;
Anterior Cingulate ventral, ACd Anterior cingulated dorsal, MDm adapté de (Uylings et al., 2003)
Néanmoins, chez le primate, d'autres domaines que le cortex préfrontal reçoivent aussi des projections provenant du noyau médiodorsal thalamique. Ainsi, la réception de telles projections thalamiques peut etre considéré comme critère nécessaire mais non suffisant pour désigner une zone corticale comme un strict homologue du cortex préfrontal des primates.
D’un point de vue fonctionnel, comme nous l’avons mentionné précédemment, le cortex préfrontal joue un rôle majeur dans l’élaboration de processus cognitifs complexes tels que le langage, l’élaboration de mouvements complexes, le contrôle exécutif incluant la mémoire de travail, la planification, le raisonnement déductif et la capacité de rediriger son attention. Sur la base de ces observations, Birrell et Brown (Birrell and Brown, 2000) ont pu adapter le test de Wisconsin (Wisconsin Card Sorting Test, ou WCST) pour établir, chez les rongeurs, une homologie stricte avec le cortex préfrontal des primates. Ainsi des animaux dont le PFC est lésé ou inactivé, montrent une moindre flexibilité dans l’utilisation de règles ou de concepts appris précédemment pour obtenir une récompense (Schoenbaum et al., 2006), se rapprochant ainsi de symptômes présentés par des patients âgés ayant des dysfonctionnements frontaux dépendants. Une diminution de l’activité cérébrale frontale est aussi observée chez les personnes dépressives. De telles observations ont aussi pu être
différents symptômes associés aux troubles neuropsychiatriques associés à ces désordres (Tabuchi et al., ;Covington, III et al., 2010).
Les lésions du cortex préfrontal médian et orbito-frontal chez le rat et la souris permettent d’établir différentes analogies avec le cortex frontal humain/primate. Les fonctions couvertes par le cortex préfrontal médian chez le rat semblent ainsi se rapprocher davantage des fonctions cognitives associées à l’aire 46 du cortex dorso-latéral humain.
Region Déficit comportemental
mPFC Mémoire de travail, visuelle
Habituation Attention
Accumulation compulsive de nourriture
Deficits au WSCT (Alternance Extradimensionnelle)
OFC Hyperactivité
Trouble du comportement social Mémoire de travail, olfactive Trouble de l’alimentation
Déficits au test de wisconsin (Inversion de règle et Alternance Intradimensionnelle)
Table 1 Quelques conséquences comportementales suite a une lésion du cortex préfrontal médian et orbito-frontal chez le rat. (Uylings et al., 2003)
Déficits cognitifs frontaux dépendants lors du vieillissement
Les tâches cognitives les plus complexes, c'est-à-dire celles touchant simultanément plusieurs fonctions, sont les plus sensibles et sont affectées plus rapidement par l'âge (Reitan, 1955; Jordan and Rabbitt, 1977). De plus il est bien admis que des altérations du fonctionnement du cortex préfrontal sous-tendent nombre de déficits cognitifs complexes liés à l’âge et qui accompagnent aussi la maladie d'Alzheimer, la maladie de Parkinson ainsi que nombre de maladies psychiatriques telles que la schizophrénie ou les maladies bipolaires (Cummings, 1995;Birrell and Brown, 2000;Brown and Bowman, 2002).
De récentes études épidémiologiques longitudinales ou transversales ont permis de révéler différentes trajectoires des performances cognitives au cours du vieillissement [pour revue (Hedden and Gabrieli, 2004)]. Ainsi un déclin linéaire en fonction de l'âge a pu être observé pour la vitesse de raisonnement, la mémoire épisodique, la capacité d’orientation (Figure 6). On peut constater grâce aux études longitudinales que ces changements sont subtils entre l'âge de 20 et 60 ans, tandis que les changements sont plus majeurs après l'âge de 60 ans. La stabilité relative de la mémoire sémantique jusqu'en fin de vie pourrait être indicatrice que les adultes plus âgés utilisent les connaissances et les expériences cumulées afin de formuler des stratégies plus efficaces lors de l'exécution de tâches complexes alors que les jeunes adultes s’appuieraient sur une capacité et une vitesse de traitement supérieure (Lorge et Helfant, 1953; Hedden and Gabrieli, 2004; Marschner et al., 2005). De là on peut distinguer une forme de connaissances consolidées (intelligence « cristallisée ») reflétant les apprentissages socio — culturels d'un individu, en opposition à une capacité d’apprentissage ou de « flexibilité » intellectuelle (intelligence « fluide »). C'est cette dernière forme d'intelligence qui apparaîtrait significativement affectée par le vieillissement cérébral (Chatelois and Renaseau-Leclerc, 1980).
Une accélération du déclin cognitif 3 à 6 ans avant la mort du sujet a aussi été reportée suggérant l’existence de pathologies sous-jacentes précipitant les changements liés au vieillissement cognitif, alors que le processus de vieillissement physiologique se caractérise par une perte progressive des fonctions cognitives.
Figure 6 Évaluation transversale (a) et longitudinale (b) de performances cognitives fronto-dependante au cours du vieillissement. (a) Les baisses sont évidentes dans tous les domaines, à l'exception des capacités
verbales et de calcul. (b) Une étude longitudinale a permis de révéler une dégradation marquée des performances après 55 ans.Adapté de (Hedden and Gabrieli, 2004)
Il est intéressant de noter que de nombreux déficits fronto-dépendants relevés chez l’être humain lors du vieillissement sont aussi observés dans une sous population d’animaux âgés (rongeur et primate non humain), en corrélation, ou non, avec l’apparition de troubles de la mémoire épisodique ou d’autres symptômes (Barense et al., 2002;Zhuo et al., 2007;Lasarge et al., 2007;Bizon et al., 2009;Bloss et al., 2010;Hara et al., 2010;Simon et al., 2010;Dumitriu et al., 2010b;Hara et al., 2011b).
Ainsi, une sous population de rongeurs ou de primates âgée présente des troubles de la mémoire de travail se caractérisant par des difficultés à retenir une information sur une longue période lors de taches ayant ou non une composante spatiale. On observe aussi une dégradation des performances pour des taches nécessitant l’apprentissage de règles ou un changement de règle impliquant le système exécutif (Rapp and Amaral, 1989;Frick et al., 1995;Barense et al., 2002;Luebke et al., 2004;Chang et al., 2005;Zhuo et al., 2007;Luebke et al., 2010a) et pour revue [(Luebke et al., 2010a ; Hara et al., 2011b)].
Changements macro- et microstructuraux lors du vieillissement
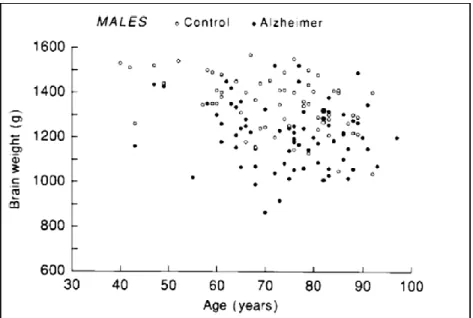
Les pertes de la flexibilité mentale chez les sujets âgés suggèrent la présence d'une certaine désorganisation des mécanismes frontaux de programmation et de régulation des activités intellectuelles complexes (Chatelois and Renaseau-Leclerc, 1980). L’observation de tels déficits cognitifs soulève la question de leur origine neurobiologique. La première approche fut de déterminer si la structure cérébrale et la morphologie neuronale sont affectées lors du vieillissement. Les travaux précurseurs de Brody (Brody, 1955) proposèrent qu’une mort neuronale massive (jusqu'à une perte de 50 %) sous-tendît les déficits cognitifs associés au vieillissement chez l’être humain. De fait à la naissance le cerveau pèse environ 350g atteint un maximum de près de 1375g vers l’âge de 20 ans suivit d’une diminution de poids de 10% jusqu'à la neuvième décennie. On note aussi un rétrécissement des circonvolutions et un élargissement des sillons résultant en une augmentation de l'espace entre le cerveau et ses méninges, on remarque aussi un élargissement des ventricules. Ces premières observations obtenues lors d’études post mortem ont pu être confirmées par des techniques d’imagerie modernes.
Alors que la maladie d'Alzheimer est associée à une forte réduction du poids du cerveau, on peut noter que le poids du cerveau semble être plus variable dans le groupe contrôle. Il a été démontré que certaines aires corticales sont toutefois peu sensibles au vieillissement normal comme le gyrus cingulaire antérieur et le cortex visuel primaire, alors que le cortex préfrontal dorso-latéral est significativement réduit et cela plus que toute autre région cérébrale [Figure 8 et (Raz et al., 1997;Rajah and D'Esposito, 2005)].De façon intéressante on notera que l’atrophie de l’aire 46 corrèle avec les déficits de mémoire de travail chez le singe (Shamy et al., 2011).
Figure 8 Changements volumétriques de différentes aires corticales mesurées imagerie par résonance magnétique en fonction de l’âge chez l’être humain. a/ Cortex prefrontal lateral b/ Cortex visuel c/
Hippocampe (Hedden and Gabrieli, 2004)
Toutefois l’amélioration des techniques stéréologiques (Peters et al., 1998) a permis de rejeter l’idée qu’une mort neuronale massive sous-tende les déclins cognitifs observés lors du vieillissement « normal ». Comme une diminution de la densité neuronale ne semble pas expliquer à elle seule la réduction cérébrale concomitante au vieillissement, des changements de la microstructure ou de la morphologie neuronale furent envisagés. Ainsi les travaux de Scheibel dans les années 70 suggérèrent qu’une attrition de l’arborisation dendritique combinée à une réduction des couches corticales dans de nombreuses régions soit à l’origine de la réduction de la surface cérébrale observée au cours du vieillissement
1976b;Cupp and Uemura, 1980). Pour exemple une réduction de la couche I corrèle aux déficits cognitifs observés lors du vieillissement les changements observés [pour revue (Hara et al., 2011b) ] et (table 2).
Pour rappel, le cortex préfrontal de rongeur se compose de 5 couches (Figure 9). Les cellules pyramidales constituent 80-90% des neurones du cortex, les 10-20 % restant étant composés d’une variété d’interneurones. Les neurones pyramidaux (PC) sont inhibés au niveau de leur axone par les cellules en chandelier, le soma est inhibé par les cellules en bouquet, alors que l'inhibition dendritique provient de cellule en double bouquet, de cellules bipolaires, de cellules neurogliales, des cellules de Martinotti et des cellules de Cajal-Retzius. De plus, les neurones pyramidaux projettent vers différentes régions du cerveau. Ainsi les cellules pyramidales de la couche V et VI sont les principales cellules de projection vers les régions sous-corticales, les ganglions de la base, et le thalamus (TH). Les cellules pyramidales de la couche VI projettent principalement vers le thalamus, alors que les neurones pyramidaux des couches superficielles II/III projettent vers d’autres zones corticales, telles que les colonnes corticales voisines et l'hémisphère controlatéral (CL). Comme présentés dans la figure 5, les interneurones sont repartis différemment entre les couches corticales, ainsi les cellules neurogliales et en double bouquet se situent préférentiellement dans les couches superficielles, alors que les cellules de Martinotti sont majoritairement présentes dans les couches profondes V et VI. Les cellules en bouquets représentent près de 50 % des interneurones et sont reparties entre les couches II et VI. De plus il est intéressant de noter que les interneurones peuvent agir localement (innervation intralaminaire) ou à distance de leur couche de résidence (innervation interlaminaire). Pour exemple, les cellules de Martinotti, dont le corps cellulaire se trouve au niveau des couches profondes V et VI ont une action inhibitrice dans la couche I, sur les dendrites distales des cellules pyramidales [pour revue (Defelipe and Fariñas, 1992;Grillner et al., 2005;Silberberg et al., 2005)].
Figure 9 : Représentation schématique du microcircuit néocortical préfrontal. Les neurones excitateurs sont en rouge et les neurones inhibiteurs en bleu, les synapses électriques sous forme d’un zigzag. Abréviations :
MC, Cellule de Martinotti; CHC, cellule chandelier; BP, cellule bipolaire, NGC, cellule neurogliale,
double-basket cell, BC, cellule en bouquet, CRC, cellule Cajal-Retzius, WM, matière blanche, Bs, tronc cérébral, CL
Cortex controlatéral, SC moelle épinière, TH, Thalamus. Bs : Tronc cérébral, BG : Ganglions de la base Adapté de (Grillner et al., 2005) B PC CRC DBC MC C CHC TH BG, Bs CL, SC 1 5 6 2/3 BP NGC WM
Des premières imprégnations selon la méthode de Golgi jusqu'à l’utilisation de techniques de fluorescence intracellulaire combinées au développement de nouvelles techniques d’analyses, un nombre grandissant de travaux a révélé l’existence de nombreux changements de la morphologie neuronale associés à la sénescence. Toutefois on note aussi la multiplication de résultats parfois diamétralement opposés. Ces apparentes contradictions reflètent bien souvent des différences de techniques de marquages, des variations interspécifiques et sont de plus dépendants de la zone, de la couche corticale ou d’âge. Ainsi ont été rapportées des réductions (Uylings and Brabander, ;Wong et al., 1998;Wong et al., 2000;Wong et al., 2006;Allard et al., 2010) ou des extensions (Cupp and Uemura, 1980;Bloss et al., 2010;Bloss et al., 2011) de l’arborisation dendritiques des cellules pyramidales chez l’homme, le singe ou le rongeur. Ces effets pouvant être différentiels entre l’arborisation basale et apicale et cela pour une même classe de cellule pyramidale (Bloss et al., 2010;Bloss et al., 2011). Toutefois un consensus semble se dégager à partir de ces études morphométriques : une perte majeure d’épines dendritique combinée ou non à des changements de l’arborisation dendritique semble être une marque caractéristique du neurone sénescent (Table 2 et
Figure 10 : Modèle de la cellule pyramidale vieillissante. Une diminution de la densité synaptique combinée ou non avec une attrition de l’arborisation dendritique résulte en réduction de l’activité glutamatergique.
On notera aussi une altération de la conduction axonale. Adapté de (Luebke et al., 2010b)
Pour résumer : le nombre d’épines dendritique, la principale porte d’entrée de l’activité excitatrice, diminue significativement au cours du vieillissement et s’avère être un corrélat des déficits comportementaux associés. La morphologie même de ces épines semble être affectée avec une diminution de la proportion d’épine dite « minces » combinée à une augmentation du volume de l’ensemble des épines (Dumitriu et al., 2010a;Dumitriu et al., 2010c) et pour revue (Luebke et al., 2010a;Hara et al., 2011b). Toutefois ces données collectées chez l’animal doivent être nuancées à la lecture d’études menées sur l’homme et démontrant un maintien de la densité synaptique dans le cortex frontal d’individu âgé (Scheff et al., 2001;Nelson et al., 2011).
Aire46 (dlPFC) Volume ↓ 10% DNMS (Shamy et al., 2011)
Aire46 couche I
Densité neuronale Non n.s
DNMS, DRST
(Peters et al., 1998); (Smith et al., 2004)
Lipofuscine ↑ - (Peters et al., 1994)
Épaisseur de couche ↓ DNMS (Peters et al., 1998)
Area 46 couche II/III
Densité épines dendritiques 30–60% DNMS (Peters et al., 1998) Synapse symétriques densité 30% DNMS (Peters et al., 2008)
Taille terminaison Axosomatique ↑ n.s (Soghomonian et al.,
2010)
Densité synapse asymétrique 30% DNMS (Peters et al., 2008); (Dumitriu et al., 2010a)
Volume épine dendritique 27% DNMS (Dumitriu et al., 2010a)
Aire 46 couche III Densité épine dendritique mince ↓46% DNMS (Dumitriu et al., 2010a) Taille et densité et épines
dendritiques « Champignon »
Non n.s (Dumitriu et al., 2010a)
Expression GluR2 ↓ - (Hof et al., 2002)
Densité Synaptique ↓ by 20% n.s (Peters et al., 2008);
Area 46 couche V Densité Synaptique ↓ by 20% n.s (Peters et al., 2008);
Table 2 : Exemples d’alterations morphologiques associées au vieillissement dans le cortex prefrontal de primate. Adapté de (Hara et al., 2011b)
Changements fonctionnels au cours du vieillissement
Activité cérébrale.
Comme mentionnées précédemment de nombreuses aptitudes cognitives tels que la mémoire épisodique, la vitesse de traitement de l’information et le raisonnement déclinent avec l'âge,. Le vieillissement est ainsi associé à des déficiences dans les tâches exécutives, toutefois les actes simples requérant une bonne mémoire de travail, telles que retenir une suite de chiffres semble moins sensible au vieillissement. En revanche, les participants plus
âgés obtiennent de plus mauvais résultats sur les tâches nécessitant la répression d’une consigne appris précédemment, démontrant de par le fait une perte de flexibilité cognitive.
Les progrès des enregistrements électroencéphalographiques combinés à ceux de l’imagerie médicale permettent désormais d’enregistrer in vivo et en temps réel l’activité cérébrale et de corréler celle-ci avec les performances cognitives de sujets âgés. Il a ainsi été montré que les personnes âgées présentent moins d'activité dans les lobes frontaux au cours des tâches exécutives requérantes la mémoire de travail. Il est toutefois intéressant de noter que certaines personnes âgées ont parfois une activité accrue dans des régions de PFC pas ou peu activées chez les jeunes adultes. Ces augmentations de l'activité de PFC se produisent souvent dans des zones controlatérales à celles activées chez les jeunes, on parle alors de réductions de l’asymétrie hémisphérique, ce qui indique que ces processus nécessitent le recrutement de zones cérébrales supplémentaires chez les personnes âgées. Ainsi lors de taches évaluant la mémoire de travail les adultes plus âgés présentaient une réduction de l’activation du cortex préfrontal dorsal concomitant avec une plus grande activation de la portion controlatérale pour les taches les plus exigeantes. Un tel recrutement de zones corticales supplémentaires pourrait signer l’utilisation de stratégies cognitives spécifiques aux personnes âgées (Hedden and Gabrieli, 2004).
Figure 11 Activités cérébrales enregistrées chez des jeunes adultes, adultes âgés sans déficits cognitifs et adultes âgés avec déficits cognitifs. Les individus âgés avec déficits cognitifs présentent un schéma d’activation hémisphérique semblable aux adultes jeunes, mais avec des maxima inférieurs à ceux des jeunes. Différemment, les individus âgés dépourvus de déficits cognitifs majeurs présentent une plus grande
activation bilatérale. RF, frontal droit ; LF, frontal gauche. Adapté de (Hedden and Gabrieli, 2004)
Excitabilité neuronale lors du vieillissement
Ici encore la question des substrats neurobiologiques de tels changements se pose. Comme nous venons de le voir la densité neuronale semble préservée au cours du vieillissement normal. Toutefois de subtils changements morphologiques de l’arborisation dendritique combinés à une réduction de la densité d’épines dendritique semblent prévaloir. De telles modifications des propriétés électrotoniques associées à des altérations des entrées synaptiques (Figure 10) sont à même de compromettre les performances intégratives des neurones (Rall, 1969;Grill and Riddle, 2002;Spruston, 2008;Kabaso et al., 2009) et conséquemment de perturber l’activité neuronale dans son ensemble.Quelques équipes de recherche se sont ainsi penchées sur une analyse systématique des propriétés électrophysiologiques des neurones du cortex préfrontal in vitro au cours du vieillissement normal. Les propriétés dites passives semblent préservées que cela soit le potentiel de membrane au repos ou la rhéobase [pour revue (Burke and Barnes, 2006)].
Une augmentation de la résistance d'entrée des cellules pyramidales chez les singes âgés, ainsi qu'une diminution du temps de l'amplitude du potentiel d’action n’ont pas ou n’ont pu être corrélés à la performance cognitive.
Une des caractéristiques des neurones pyramidaux du cortex préfrontal est de maintenir une activité de décharge soutenue et cela en l'absence de stimulation externe, constituant par la même un possible substrat du maintien d’information a plus ou moins long terme. De plus on constate une augmentation dramatique de la fréquence de décharge des neurones pyramidaux de la couche II/III de l’aire 46 du cortex préfrontal de singe in
vitro. Dans cette même étude le mode de décharge in vitro de ces neurones a pu être corrélé avec les performances cognitives individuelles de chaque animal (Luebke et al.,
afterhyperpolarization) dépendante du calcium a aussi été relevée dans les neurones pyramidaux de la couche III du cortex préfrontal de singe âgé. Cette augmentation a aussi pu être corrélée avec une dégradation des performances cognitives chez le singe (Luebke and Amatrudo, 2010). Dans la lignée de ces résultats une impressionnante étude chez le singe a pu démontrer, pour la première fois in vivo, une diminution liée à l'âge du taux de décharge moyen des neurones du cortex préfrontal et cela en lien avec une détérioration des performances cognitives dans une tache frontale dépendante (Wang et al., 2011).
Transmission synaptique
La transmission synaptique chimique, un élément crucial du fonctionnement neuronal, est altérée au cours du vieillissement. Un certain nombre de changements présynaptiques que cela soit lors de la synthèse ou de la relâche des neurotransmetteurs a été reporté. De plus de nombreuses altérations postsynaptiques semblent associées au vieillissement.
Nous porterons notre attention sur les deux principaux neurotransmetteurs à action dite rapide à savoir le glutamate et le GABA, respectivement associés aux fonctions excitatrices et inhibitrices chez l’adulte. Après quelques brefs rappels sur la physiologie de ces neurotransmetteurs nous nous intéresserons à leur devenir au cours du vieillissement, notamment dans le cortex préfrontal.
La transmission glutamatergique dans le cortex préfrontal au cours du vieillissement La grande diversité fonctionnelle des récepteurs du glutamate et leur important niveau d’expression dans l’ensemble des structures du système nerveux central (SNC) placent ces récepteurs au centre de nombreux processus aussi bien physiologiques que pathologiques. Le glutamate active deux grands groupes de récepteurs : ionotropiques et métabotropiques. Il existe trois types de récepteurs ionotropiques : AMPA, kaïnate et
NMDA se différenciant par leur affinité au glutamate ainsi que par leurs cinétiques d’activation/désactivation et leur perméabilité sélective à certains ions. [pour revue (Michaelis, 1998)].
Il a été démontré lors du vieillissement une diminution significative de 15-20 % de la quantité de glutamate dans le cortex frontal de rats (Dawson, Jr. et al., 1989;Wallace and Dawson, Jr., 1990;Segovia et al., 2001b). Il est intéressant de constater que des divergences semblent aussi exister entre les différentes subdivisions frontales. Par exemple, une diminution en glutamate a été rapportée dans le cortex préfrontal médian, mais pas dans le cortex préfrontal dorsal (Segovia et al., 2009). L’origine d’un tel déclin demeure floue mais une diminution de l’activité de la glutaminase, l’enzyme permettant la synthèse de glutamate à partir de la glutamine, a été reportée dans le cortex temporal, le striatum et l’hippocampe de rats âgés (Wallace and Dawson, Jr., 1992;Segovia et al., 2001a). Toutefois aucun lien clair n’a pu être établi entre une baisse de la quantité de glutamate observée dans certaines zones cérébrales et l’émergence de déficits cognitifs (Segovia et al., 2001a;Segovia et al., 2001b).
Récepteur NMDA
Les récepteurs NMDA se composent d'une sous-unité NR1 obligatoire qui en fonction de son association avec une ou plusieurs sous-unités NR2A, B, C ou D et auxiliaires NR3A-3B présentent des cinétiques d’activation/désactivation spécifiques pour revue (Cull-Candy et al., 2001;Kohr, 2006). L’activation du récepteur NMDA nécessite en plus de la liaison avec son ligand une dépolarisation membranaire. En effet, pour des potentiels hyperpolarisés, le canal du récepteur est bloqué par une fixation voltage — dépendante d’ions Mg2+ présents dans le milieu extracellulaire, lui conférant ainsi une propriété de détecteur de coïncidence de l’activité synaptique. Les récepteurs NMDA sont perméables aux ions monovalents et au calcium. L’influx de Ca2+ à l’intérieur de la cellule postsynaptique entraîne l’activation de cascades de signalisation intracellulaires. L’activité des récepteurs NMDA est cruciale pour l’induction de certaines formes de plasticités neuronales telles que la plasticité synaptique (LTP et LTD) et la plasticité de l’excitabilité.
Une diminution avec l'âge de la densité des récepteurs glutamatergique de type NMDA a été signalée. Une diminution (~30 %) de la densité des récepteurs NMDA a été décrite dans la plupart des aires corticales, du striatum et dans l'hippocampe [pour revue (Segovia et al., 1999;Segovia et al., 2001b)]. Plus spécifiquement on observe une réduction de l’expression de la sous unité NR2B dans le cortex préfrontal (Bai et al., 2004). Une baisse de l’affinité des récepteurs NMDA a aussi été reportée (Magnusson and Cotman, 1993b).Une telle diminution pourrait être mise en parallèle avec la diminution spécifique du nombre d’épines dites mince, celle-ci ayant une forte composante NMDA (Dumitriu et al., 2010a).
Récepteur AMPA.
Les sous-unités entrant dans la composition des récepteurs au glutamate de type AMPA (α-amino-3-hydroxy-5-methyl-4-isoxazolepropionate) sont synthétisées à partir de quatre gènes GluR1-4. Les récepteurs AMPA sont perméables aux cations monovalents, Na+ et K+. Leur perméabilité au calcium dépend grandement de l’incorporation d’une sous-unité de type GluR2 sous sa forme non éditée [pour revue voir (Greger et al., 2007)]. Dans les cellules pyramidales du cortex, les canaux AMPA ne sont que très peu perméables au calcium. Leur activation entraîne l’apparition d’un courant entrant d’ions Na+, et éventuellement d’ions Ca2+ (si absence de GluR2). Il est désormais bien établi que les récepteurs AMPA jouent un rôle prépondérant dans la potentialisation à long terme, et par extension dans le processus de mémorisation, (Bliss and Collingridge, 1993).
Une diminution de la densité ainsi que de l’affinité des récepteurs AMPA a été rapporté dans les cortex frontaux et pariétaux de souris (Magnusson and Cotman, 1993a). de manière plus précise une baisse significative de GluR2 a été reportée dans le cortex préfrontal de primate (Hof et al., 2002).
Récepteur Kaïnate
On distingue cinq types de sous-unités pouvant composer les récepteurs kaïnate. GluK1 à 3 (auparavant GluR5 à 7), peuvent constituer des récepteurs fonctionnels sous la
doivent s’associer avec GluK1-3 pour pouvoir former un hétérotétramère fonctionnel, GluK4 et 5 modulant alors l’affinité et les cinétiques d’activation/désactivation des récepteurs kaïnate (Ruiz, 2011).
Lors du vieillissement il a été reporté soit une baisse de la densité de récepteurs kaïnate (Magnusson and Cotman, 1993a) soit une préservation de celle-ci (Segovia et al., 2001b).
Comme nous venons de le voir les quelques études ayant porté sur les récepteurs au glutamate n’ont pas révélé d’altérations majeures de leurs compositions ou propriétés biophysiques. Toutefois ces changements subtils associés à l’atrophie dendritique et la réduction du nombre d’épines (Peters et al., 2008) observés lors du vieillissement entraînent une diminution de l’activité glutamatergique (Figure 10) constituant par là même un substrat potentiel des déficits cognitifs associés au vieillissement.
La transmission GABAergique dans le cortex préfrontal au cours du vieillissement
L’acide γ-aminobutyrique ou en abrégé GABA est le principal neurotransmetteur rapide inhibiteur du cerveau. Il est, de concert avec le glutamate, le principal régulateur de l’excitabilité et de la plasticité neuronale. Les actions postsynaptiques du GABA sont permises par deux types de récepteurs, A et B, respectivement responsables des formes rapides et lentes de l’inhibition. Il existe un troisième type de récepteur GABA, le récepteur GABAA-ρ (anciennement GABAC) il s’agit un récepteur ligand-dépendant dont l’activation résulte en une réponse lente et soutenue. Ce récepteur est principalement exprimé dans la rétine et les cellules bipolaires horizontales, nous restreindrons donc notre exposé aux seules formes retrouvées dans les cellules corticales et a leur devenir au cours du vieillissement [pour revue (Ben-Ari et al., 2007;Rissman et al., 2007b)].
GABAA
La majorité des récepteurs au GABA sont de types GABAA. Il s’agit de récepteurs pentamérique essentiellement perméables aux ions chlorure et, dans une moindre mesure, à d’autres anions, notamment les ions bicarbonates (HCO3-). À ce jour 20 différentes sous-unités ont pu être clonées (α1–6, β1–4, γ1–3, ρ1–3, δ, ε, π and θ). Dans les conditions physiologiques, l'activation du récepteur GABAA génère une hyperpolarisation membranaire et une réduction de la fréquence de décharge neuronale.
Les sous-unités α1, α2, α5, β2, β3, and γ2 sont fortement exprimées au niveau du cortex. Comme pour les récepteurs AMPA, la composition en sous-unités influence grandement la conductance ainsi que les cinétiques d’activation et désactivation. La majorité des récepteurs incorporent 2α, 2β et 1γ. Les différentes sous unités présentent des sites de liaison à de nombreux agents modulateurs tels que les barbituriques, les benzodiazépines ou les stéroïdes. Ces substances potentialisent ou diminuent l’effet du GABA. Pour exemple, les récepteurs contenant les sous-unités α1, β2/3 et γ2 sont les cibles de molécules sédatives ou anticonvulsives, tandis que les récepteurs contenant les sous-unités α2, β2/3, et γ2 sont les cibles des anxiolytiques. Enfin de nombreuses études pharmacologiques ont démontré que la sous-unité α5 est très abondante dans l'hippocampe et est une sous-unité clef des processus d'apprentissage et de mémorisation. Les récepteurs incluant cette sous-unité sont très sensibles au GABA, et génèrent une inhibition tonique ainsi que des potentiels inhibiteurs transitoires (Rissman et al., 2007b).
Des changements des niveaux d’expression des différentes sous-unités α, β, et γ ont été rapportés au cours du vieillissement. Encore une fois ces modifications apparaissent subtiles et très dépendantes de la région cérébrale investiguée comme illustré chez le rat (Yu et al., 2006;Rissman et al., 2007b) Le développement des techniques de puces à ADN et des PCR quantitatives ont permis d’étendre le champ d’investigation à plusieurs régions cérébrales chez l’homme ou le primate non humain (Fillman et al., 2010;Duncan et al., 2010). In fine les données actuelles démontrent une préservation ou une diminution d’expression des sous unités β2/3 et γ2 alors que celles d’α1 et α2 sont préservées ou
Figure 12 : Évolution de différentes sous-unités GABA en fonction de l’age. Les changements les plus importants ont lieu durant les 3 premiers mois de vie chez le rat. Le premier mois se caractérise par une
augmentation de l’expression des sous-unités α1, α2, α3, et γ2, puis une baisse de celle-ci jusqu'au deuxième mois. C’est seulement à l'âge de 3 mois que toutes les sous-unités du récepteur GABAA présentent
un niveau d’expression stable, et ce jusqu'à 18 mois. Seule la sous-unité α5 présente une lente réduction de son expression et cela dès les premières semaines postnatales, cette réduction est toutefois faible à partir
du 3e mois. (Yu et al., 2006)
Au-delà de ces changements d’expression unitaires, des changements de la stœchiométrie de ces sous-unités peuvent modifier profondément la physiologie neuronale et avoir des conséquences fonctionnelles et comportementales majeures. Ainsi
l’augmentation de la proportion de récepteurs exprimant la sous-unité α pourrait expliquer la plus grande sensibilité des personnes âgées aux antidépresseurs de type benzodiazépine.
Là encore les propriétés biophysiques des récepteurs GABAergique semblent peu affectées lors du vieillissement. Pourtant un nombre grandissant d’études rapporte des changements de l’efficacité de la transmission GABAergique (Luebke and Rosene, 2003;Luebke et al., 2004;Wong et al., 2006;Allard et al., 2010;Luebke et al., 2010a;Luebke et al., 2010b;Hara et al., 2011b) en lien ou non avec des déficits comportementaux. Ces observations pourraient être la conséquence d’un changement du nombre de boutons inhibiteurs combinés (Allard et al., 2010) ou non à des changements de l’excitabilité des neurones inhibiteurs. Enfin ces changements concomitants à ceux observés pour la transmission glutamatergique pourraient altérer profondément la balance synaptique (ces points seront discutés plus en détails dans le chapitre II et dans la discussion générale).
La maladie d’Alzheimer
Comme nous venons de le voir le vieillissement se traduit par des changements anatomofonctionnels subtils mais non négligeables au vu de leur portée sur l’intégrité intellectuelle des patients âgés. Toutefois les troubles les plus invalidants ne semblent affecter qu’un nombre réduit d’entre eux. A contrario les patients atteints par la maladie d’Alzheimer présentent, comme nous le verrons plus loin, un ensemble d’altérations anatomiques et cognitives identifiables et spécifiques.
Une abondante littérature sur la maladie d’Alzheimer étant accessible (plus de 80000 articles ou revues scientifiques accessibles via des sites de référencement tels que pubmed) et devant une telle profusion de données nous porterons notre attention sur les caractéristiques majeures de la maladie, symptômes cliniques, facteurs de risque et composante génétique de la maladie. Nous présenterons brièvement quelques modèles animaux ayant permis de récentes avancées dans la compréhension des mécanismes biologiques sous-jacents.
Généralités
La maladie d’Alzheimer, la plus fréquente cause de démence, est une maladie neurodégénérative se caractérisant notamment par l’attrition du système limbique et de noyaux sous-corticaux entraînant progressivement un déclin irréversible de la mémoire, du raisonnement, des capacités d'abstraction ainsi que du langage. La maladie a été souvent confondue avec d'autres syndromes de « démence sénile », eux-mêmes correspondant à un déclin cognitif progressif lors du vieillissement et cela indépendamment du développement de signes de neurodégénération. La description par le psychiatre bavarois, Alois Alzheimer, en 1907, de symptômes cliniques associés à une signature histopathologique claire a permis d’établir un phénotype neuropathologique permettant de diagnostiquer la maladie. Toutefois jusqu'à tout récemment seules les analyses post mortem permettaient de conclure avec certitude quant à la présence de la maladie.
On considère qu’un patient est atteint de la maladie d’Alzheimer s’il satisfait aux trois critères suivants et que nous détaillerons plus loin :
1. Une démence clinique (troubles cognitifs avec troubles de la mémoire qui ont une incidence sur les activités quotidiennes).
2. Un nombre substantiel d’enchevêtrements neurofibrillaires (NFT) visibles à l'autopsie.
3. Un nombre important de plaques amyloïdes.
État des connaissances cliniques actuelles
Symptômes cliniques
La durée moyenne de survie des patients atteints de la maladie d’Alzheimer est de cinq à huit ans après le diagnostic clinique. On distingue quatre phases majeures dans l’évolution de la maladie [pour revue (Forstl and Kurz, 1999)].
Phase prédémentielle
De subtils déclins cognitifs peuvent intervenir cinq ans avant que le diagnostic de la maladie soit avancé. Les patients éprouvent des difficultés à acquérir de nouvelles informations ainsi qu’à réaliser des taches complexes nécessitant une planification supérieure. À ce stade il peut être hasardeux de pronostiquer une forme immature de la maladie et non une condition réversible ou bénigne telle qu’un syndrome de démence ou des troubles de la mémoire non progressifs. Au stade prédémentiel de la maladie d’Alzheimer, les patients ne montrent pas une détérioration significative des activités de la vie quotidienne, bien que des épisodes de dépression puissent être rapportés.
Cette phase se caractérise par une dégradation des capacités de mémorisation ainsi qu’une désorientation dans le temps et l’espace suffisantes pour alerter l’entourage du patient. Toutefois la mémoire implicite ainsi que les souvenirs les plus anciens sont moins affectés. Les capacités de jugement et de planification sont de plus en plus réduites. On note aussi une réduction du vocabulaire, des difficultés à communiquer. Les épisodes dépressifs sont plus fréquents et de plus grande amplitude. Les patients avec une apathie sévère présentent une réduction de l’activité du cortex dorso-frontal Le patient demeure partiellement autonome mais une aide pour la réalisation de ses activités quotidiennes peut s’avérer nécessaire [pour revue (Forstl and Kurz, 1999)].
Phase de démence modérée
Le patient perd les souvenirs concernant son histoire personnelle, témoigne d’une incapacité grandissante à reconnaître amis et membres de la famille. On constate aussi un développement des troubles de l’humeur et des changements de la personnalité, anxiété, agressivité, désinhibition, répétition (Mega et al., 1996;Cummings and McPherson, 2001;McPherson et al., 2002;Teng et al., 2007). Près de 20% des patients développent des hallucinations visuelles. Les troubles de l’alimentation combinés à ceux de l’hygiène conduisent souvent à l’hospitalisation en fin d’assurer un suivi du patient.
Phase de démence sévère
Le patient perd jusqu'à ses plus anciens souvenirs. Le langage est réduit à des phrases simples de quelques mots. Les patients tentent malgré tout d’interpréter et de communiquer leurs émotions malgré leurs déficits cognitifs. On observe dans certains cas le développement d’actes moteurs stéréotypés. On note dans une faible proportion l’apparition de crises d’épilepsie. Les actes moteurs les plus simples tels que la mastication et la déglutition sont affectés. Les patients alités en fin de vie développent des infections multiples, les infections pulmonaires suivies d’infarctus du myocarde sont généralement fatales[pour revue (Forstl and Kurz, 1999)].