HAL Id: dumas-01824388
https://dumas.ccsd.cnrs.fr/dumas-01824388
Submitted on 27 Jun 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
Les activateurs des canaux potassiques : étude du
Nicorandil
Catherine Buaz
To cite this version:
Catherine Buaz. Les activateurs des canaux potassiques : étude du Nicorandil. Sciences pharmaceu-tiques. 1995. �dumas-01824388�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
11111111111111111111111111111
115 016846 5
UNIVERSITE Joseph FOURIER GRENOBLE 1 - Sciences Technologie Médecine
U.F.R. DE PHARMACIE
Domaine de la Merci - La Tronche
-Année 1994-95 N° D'ORDRE:
1-o
~~LES ACTIVATEURS DES CANAUX PO
êtude du
NICORANDIL
THESE
Présentée
à
l'université Joseph FOURIER GRENOBLE 1 pour obtenir le grade de DOCTEUR EN PHARMACIE. ParMlle BUAZ Catheriné
Cette thèse sera soutenue publiquement le Aç,ijuin 1995.
Devant M. le Professeur Demenge, Président du Jury
et
Remerciements
à:
- M. Demenge, Président du Jury,
- M. Ribuot, pharmacologue,
- Mme Bouchet, pharmacien,
- Mes parents,
- Ma soeur et Jérôme,
- Lino,
- Toute ma famille et mes amis.
i
SOMMAIRE
REMERCIEMENTS 2
SOMMAIRE 3
INTRODUCTION 8
Chapitre 1- LE POTASSIUM
101- GENERALITES ET RÔLE PHYSIOMOGIQUE
111-1-Les entrées 11
1-2-Les sorties 12
1-3-Rôle physiologique 12
1-3-1 Conséquences d'une hypokaliémie 12
1-3-2 Conséquences d'une hyperkaliémie 13
11- REPARTITION DU POTASSIUM DANS L'ORGANISME
1311-1-Le compartiment extracellulaire 13 11-2-Le compartiment intracellulaire 14 11-3-Le compartiment sanguin 14
111- TRANSFERTS DU POTASSIUM ENTRE MILIEU INTRA ET
EXTRACELLULAIRE
15111-1-Structure de la membrane cellulaire 15
Il 1-2-Electrophysiologie cellulaire 16
111-3-Protéines permettant le transport des ions à travers la membrane 19
111-3-1-2-1 Contôle direct des canaux ioniques par la
protéines G
22
111-3-1-2-2 Contrôle indirect des canaux ioniques par les
protéines G 23
111-3-2- Les protéines assurant le transport actif des ions 23
Chapitre 2- LES CANAUX POTASSIQUES: ETUDE DE
LEUR FONCTION, REGULATION ET PHARMACOLOGIE
251- INTRODUCTION ET DEFINITION
2611- CLASSIFICATION
27111- LES CANAUX POTASSIQUES SENSIBLES A L'ATP DITS
CANAUX POTASSIQUES ATP-DEPENDANTS
29111-1- Généralités 29
111-2- Mécanismes d'action pharmacologique 30
111-3-Rôle et fonctionnement des canaux potassiques ATP-dépendants
dans une cellule ~ pancréatique 33
111-3-1-Stimulation de la sécrétion d'insuline par le glucose 34 111-3-2- Rôle des canaux potassiques dans la sécrétion d'insuline
induite par le glucose
36
111-3-3- Action de certaines substances pharmacologiques et
, hormones sur les canaux potassiques A TP-dépendants 37 111-3-3-1 Action de certaines substances pharmacologiques 37
111-3-3-2 Action de certaines hormones 39
Chapitre 3- LES ACTIVATEURS DES CANAUX
POTASSIQUES: ETUDE DU NICORANDIL
4111- STRUCTURES CHIMIQUES
111- PHARMACOLOGIE
111-1- Mode d'action
111-1-1- Effets type ACP
111-1-1-1- L'eff/ux de potassium de la cellule 111-1-1-2- L'hyperpolarisation membranaire 111-1-1-3- Effets relaxants et anti-constracturants 111-1-2- Effets particuliers du Nicorandil
111-1-2-1- Action activatrice des canaux potassiques 111-1-2-2- Effets cellulaires liés au groupement-N02 111-1-2-3- Conclusion
111-2- Effets cardioprotecteurs des ACP
111-2-1- Qu'est-ce que la protection myocardique? 111-2-2- Cardioprotection des ACP
111-2-2-1- Action sur la cellule cardiaque 111-2-2-2- Effet cardioprotecteur des ACP 111-2-3- Effet cardioprotecteur du Nicorandil
111-2-3-1 En expérimentation
111-2-3-2- Chez l'homme: résultats d'une réalisée lors d' angioplasties
IV-
APPLICATIONS CLINIQUES
IV-1- Des ACP en général IV-1-1-Angine de poitrine IV-1-2- Hypertension artérielle IV-1-3-Asthme
IV-1-4- Appareil urinaire
IV-1-5- Maladie vasculaire périphérique IV-2- Cas particulier du Nicorandil
IV-2-1- Propriétés hémodynamiques
IV-2-1-1-Action du Nicorandil sur l'hémodynamique centrale
42
44
46
46
47 48 4850
51
52
52
55
55
56
56
56
58 5860
61
61
61
61
63 6364
64
64
gauche normale 65 IV-2-1-1-2- Patients coronariens avec insuffisance cardique 68 IV-2-1-1-3- Patients coronariens hypertendus 71 IV-2-1-2-Action du Nicorandil sur l'hémodynamique
coronarienne 72
IV-2-1-2-1- Effet du Nicorandil sur les gros troncs coronaires
épicardiques 72
IV-2-1-2-2- Effet du Nicorandil sur le spasme coronaire
7 4
IV-2-1-2-3- Effet du Nicorandil sur les artérioles coronaires 76 IV-2-2- Absence d'échappement thérapeutique: donnéeshémodynamiques 76
IV-2-3- Efficacité clinique 79
IV-2-3-1 Efficacité dans l'angor instable 80
IV-2-3-2- Efficacité dans l'angor stable 81
IV-2-3-2-1- Etude contre placebo 82 IV-2-3-2-2- Etude contre 13 bloquant 82 IV-2-3-2-3- Etude contre inhibiteurs calciques 83 IV-2-3-2-4- Etude contre dérivés nitrés et Molsidomine 85
V- PRINCIPALES CARACTERISTIQUES PHARMACOCINETIQUES
~DU NICORANDIL
86V-1-Absorption 87
V-2- Distribution 88
V-3- Métabolisation 88
V-4- Elimination 90
V-5- Etude des concentrations plasmatiques après administration en
dose unique et en dose répétées 91
V-6- Profil pharmacocinétique dans la population à risque 92
V-6-1- Chez le patient agé 92
V-6-2- Chez l'insuffisant hépatique 93
V-6-3- Chez l'insuffisant rénal 93
V-6-4- Autres facteurs susceptibles de modifier la pharmacocinétique 94
V-6-4-1- Influence de l'alimentation 94
V-6-4-2-1-Avec les inducteurs enzymatiques 95 V-6-4-2-2- Avec les inhibiteurs enzymatiques 96 V-6-4-2-3- Avec les anticoagulants oraux 96
VI-
TOLERANCE ET EFFETS INDESIRABLES DU NICORANDIL
97Vl-1- Tolérance générale 97
Vl-2- Tolérance cardiovasculaire 99
Vl-3- Tolérance comparée 1 OO
Vl-4- Tolérance lors d'associations 102
CONCLUSION 103
INTRODUCTION
Depuis la première description clinique, faite par W. Heberden en 1768 devant le Collège Royal des médecins de Londres, de ce qu'il proposait alors d'appeler "angine de poitrine", nos connaissances sur l'insuffisance coronaire et ses principales conséquences (angor et infarctus) ont fait des progrès considérables, aussi bien sur le plan épidémiologique que physiopathologique. Parmi ces progrès, la mise en évidence des facteurs de risque de la maladie coronarienne, a constitué un pas décisif: la lutte contre le tabagisme, la modification progressive des habitudes alimentaires, le traitement de l'hypertension artérielle ... sont autant de victoires.
De plus, la découverte des multiples mécanismes physiopathologiques de la cardiopathie ischémique (obstruction athéromateuse, spasme, thrombose) a permis de proposer des approches pharmacologiques plus affinées, combinant plusieurs molécules à activités complémentaires: ainsi, aux dérivés nitrés se sont ajoutés les
p
bloquants, puis plus récemment les inhibiteurs calciques. Tous ces médicaments ont prouvé leur efficacité clinique et sont quotidiennement utilisés.Enfin, il faut souligner que l'émergence de techniques nouvelles comme !'angioplastie transluminale, la thrombolyse et le pontage coronarien a permis d'enregistrer une diminution de la mortalité hospitalière par infarctus du myocarde.
Mais, malgré tous ces progrès, des enquêtes nationales récentes confirment que l'insuffisance coronarienne reste en France la première cause de mortalité et constitue un problème majeur de santé publique. Ainsi, les chiffres publiés en 1990, font état d'une fréquence annuelle de plus de 175000 épisodes aigus ou décès coronariens. C'est dire que le besoin thérapeutique persiste concernant, en particulier, le traitement prophylactique de l'angine de poitrine et la protection myocardique.
1994 pourrait cependant être une année déterminante dans le traitement de l'angor en marquant la naissance d'une nouvelle classe d'antiangineux répondant à cette double attente: les activateurs des canaux potassiques dont le Nicorandil est le premier représentant. Ces molécules, en provoquant l'ouverture des canaux potassiques ATP-dépendants, à la fois au niveau vasculaire et cardiaque, entrainent une vasodilatation périphérique et surtout coronaire et exercent une action cardioprotectrice au niveau du myocarde ischémique.
Nous développerons donc tout d'abord le rôle du potassium, ainsi que les conséquences d'une hypo et d'une hyperkaliémie, puis, nous étudierons plus particulièrement les canaux potassiques, lieux d'action de ces nouvelles molécules. Enfin, dans un troisième temps, nous nous attarderons plus longuement sur l'étude de ces dernières et surtout du Nicorandil qui se distingue des autres représentants de cette classe par son profil pharmacodynamique optimal et apparait ainsi comme un nouvel antiangineux puissant et maniable.
1- GENERALITES ET RÔLE PHYSIOLOGIQUE
Le potassium est quantitativement le cation intracellulaire le plus important de l'organisme humain. Il est essentiellement présent sous forme hydratée dans la phase fluide du corps, les liquides circulants et ceux qui remplissent l'intérieur des cellules. Il est étroitement lié à la vie cellulaire et, de ce fait, occupe une place privilégiée dans l'organisme. Sous forme ionisée, il joue un rôle fondamental dans le maintien de l'osmolarité du milieu intracellulaire et dans la fonction neuro-musculaire. De plus, il intervient dans de nombreuses réactions enzymatiques, en particulier dans l'anabolisme protidique et glucidique.
1-1- Les entrées
Les apports en potassium sont essentiellement alimentaires. On estime que les besoins quotidiens en potassium varient de 13 à 36 mmol et sont généralement couverts par l'alimentation, apportant 50 à 1 OO mmol par jour, sauf en cas de vomissements ou de diarrhées, ce qui représente une perte de 50 à 100 mmol par litre. (1)
Les aliments les plus riches en potassium sont: (en mmol pour 1 OOg) - abricots secs: 40
- légumes secs: 20 à 35 - fruits secs: 15 à 20
- champignons, épinards, pommes de terre: 12 - chocolat, bananes: 10
- viandes, abats: 4 à 8
- légumes et fruits frais: 5 à 7 - laitages, oeufs: 2.5
1-2- Les sorties:
Il s'agit essentiellement d'une élimination rénale. La capacité du rein à maintenir la balance potassique en équilibre dans une fourchette étroite, est très impressionnante. En effet, les apports en potassium peuvent varier d'un facteur de 1 OO sans entrainer de modifications significatives de la kaliémie.
Par contre, les réductions des apports en potassium au cours de périodes prolongées, entrainent des pertes potassiques urinaires importantes, la capacité du rein à protéger l'organisme contre des apports insuffisants étant moins bien développée que celle de le protéger contre des apports excessifs: (2)
L'élimination extra-rénale est accessoire et n'est pas régulée. Il s'agit des pertes fécales et de l'excrétion sudorale.
1-3- Rôle physiologique:
Le rôle du potassium est fondamental dans l'électrogénèse myocardique: en effet, il influence l'excitabilité et la contractilité du muscle cardiaque.
Il entre également en jeu dans la pathogénie de nombreux troubles du rythme: un manque ou un excès de potassium peuvent avoir de très graves répercussions sur l'organisme.
1-3-1- Conséquences d'une hypokaliémie:
Les conséquences d'une hypokaliémie sont essentiellement neuro-musculaires, atteignant le myocarde, les muscles lisses et striés.
L'atteinte myocardique est souvent limitée à des modifications électrocardio-graphiques.On peut observer parfois une hypotension orthostatique ou un souffle systolique. Dans les cas les plus sévères avec troubles du rythme (extra-systoles ventriculaires, tachycardie ventriculaire, torsades de pointes), des syncopes peuvent survenir avec fibrillation ventriculaire et arrêt circulatoire.
L'atteinte des muscles lisses peut être à l'origine d'une constipation ou d'un météorisme abdominal.
L'atteinte des muscles striés, elle, se traduit par une asthénie marquée. Pour des chiffres de kaliémie très bas (inférieurs à 2 mmol), de véritables paralysies peuvent survenir.
En plus du retentissement neuro-musculaire, l'hypokaliémie peut entrainer des désordres rénaux, ainsi que des pertes digestives ou rénales.
1-3-2- Conséquences d'une hyperkaliémie:
L'estimation du retentissement d'une hyperkaliémie est avant tout électrocardiographique. Dès que la kaliémie est supérieure à 7.5 mmol par litre, le pronostic vital est en jeu: un arrêt cardiaque peut survenir, dans la plupart des cas irréversible.
Aux troubles cardiaques peuvent être associées des manifestations neuro-musculaires (paresthésies diffuses, paralysie ascendante des membres).
11- REPARTITION DU POTASSIUM DANS
L'ORGANISME:
L'organisme d'un adulte normal de 70 Kg contient environ 3.5 moles de potassium soit 140 g, apprécié par des méthodes isotopiques; (3)
La répartition se fait à des concentrations très inégales dans trois secteurs différents.
11-1- Le compartiment extracellulaire:
-plasma: 0.4% du potassium total (la kaliémie est de 3.8 à 5.4 mmol par litre de plasma).
-liquides interstitiel et lymphatique: 1 % -os: 7.6%
-tissu conjonctif et cartilage: 0.4% -LCR et liquides digestifs: 0.6% Ce potassium est rapidement échangeable.
11-2- Le compartiment intracellulaire:
Ce compartiment est énorme et représente 90% du potassium total, soit 120 mEq par kilo de masse cellulaire. La majeure partie du potassium intracellulaire est intramusculaire. En effet, sa concentration cellulaire est variable d'un tissu à l'autre, mais elle est d'autant plus importante que l'activité métabolique du tissu est grande.
Sa répartition est la suivante:
-muscles striés, myocarde: 70% du potassium total -tissu adipeux: 20%
Le potassium cellulaire existe sous deux formes:
-une fraction libre ionisée osmotiquement active, en équilibre avec les anions tels que les phosphates et les sulfates.
-une fraction liée aux protéines et au glycogène. _
11-3- Le compartiment sanguin:
Ce troisième compartiment est très petit par rapport à la masse cellulaire: il s'agit des hématies. La richesse en potassium des globules rouges est importante mais il s'agit d'un potassium lentement échangeable.
111-TRANSFERTS
DU
POTASS
IUM
ENTRE
M
IL
IEU
INTRA
ET
EXTRACELLULA
IRE:
Des phénomènes actifs et passifs interfèrent dans le passage des électrolytesà
travers la membrane cellulaire, pour finalement expulser en permanance le sodium Na+ hors de lacellule, et pour maintenir lepotassium K+àl'intérieurde la cellule.
Avant d'essayer de comprendre ces mécanismes, un rappel de la structure de la membrane cellulaire et de l'électrophysiologiecellulaire s'impose.
111-1-Structure
de
la
membrane
ce
l
lu
la
ire
La membrane cellulaire est constituée d'une bicouche lipidique avec des têtes hydrophiles dirigées vers l'extérieuret des queues hydrophobes dirigées vers l'intérieur.
Dans cet ensemble, sont inclusesdes protéines, l'ensembleformant " la mosaîque fluide" (fig.1)(4).
Ot01t1 "'"i:iie-r 1-i:irt-e r1:Q'f.it t:..1 ~~ anc::.fH
ct.a:ris. Ilt11COU<Obt!' parJ~ ~ ~ llUl"I
~ ~ ;1ve.:.1y11 101 oct1y1chc11"HlttUtl·
- ~
*nfrat;:ftlh.n.ïl·rt oll:U.QC-•t!'-!!< il11. ~~ 1)3.rt:li!''$
~~ ~ iO".tCIJ·e$
1-e·1 l).tore·•11e ~
Fig. 1: La mosaîque fluide: les protéines transmembranaires et leslipidessont maintenus ensemble par des interactionsnon covalentes (ionique ou hydrophobes).
Ces protéines membranaires intégréessont solidement enfouies dans lescouches lipidiques. Certaines traversent complètement la double couche lipidique et sont dites protéines transmembranaires. D'autres sont inclusessoit dans lefeuilletexterne, soit dans lefeuillet interne. Les protéines périphériques intracellulairessont faiblement rattachées
à
la surface internede lamembrane.
Ainsi, la membrane plasmique n'est pas une simple barrière interposée entre les milieux intra et extracellulaires, mais permet, grâce aux protéines qu'elle renferme une régulation stricte du passage des ions et molécules entre les deux milieux. Ces mouvements d'ions se font en empruntant des canaux qui sont, en fait, ces diverses protéines.
11-2-E
lectrophys
io
log
ie
ce
l
lu
la
ire
Entre les deux faces de la membrane, il existe une différence de potentiel électrique: Vm
=
-50 mV appelé" potentiel membranaire de repos", la face externe de la membrane étant chargée positivement et la face interne négativement. C'est un état stationnaire où le flux ionique entrant sous l'effet du gradient de concentration électrochimique est équilibré par leflux sortant (fig. 2) (5)..... r·
~..
•40· ~ ~ .l
;.
-1or:
~
-JO -40 ~ •>QO .,., ~ Q. IQ ··?O ' ~ "''Fig. 2: Allure générale d'un potentiel d'action recueilli par un enregistrement intracellulaire.
L'activité électrique des cellules ou " potentiel d'action " consiste en une inversion temporaire de la polarisation de membrane telle que la face interne de la membrane devient positive et lafaceexterne négative: Vm > 0 mV.
A quoi ressemble un potentiel d'action? Hu1I ''1 E•: 1 ' 0 2
e
,.,
... ~~
CllJAllU• Na .. :_L 1'1U ~ Na• !(..•
c
e1:11au•d
(b
ûl'-K• ' l'.Y··· .
..
..~
I(•:•
,.a·i'·
',i" "(.: "9'"1!111\IlClrl'ilU•®•tf!$ Dlri.tmJt.1• m•mDrl-t'lt 40 20 ' 0 ' ' s,...,ll$!''"1ffi
,.,.Ui
Fig. 3: Schéma résumant lesdifférentes étapes mises en jeu lorsd'un potentiel d'action. A: Le diagramme montre comment varient le potentiel et le nombre de
canaux Na+ et K+ ouverts en fonction du temps lorsde l'émissiond'un potentiel d'action.
En B et C sont schématisées lesdifférentes conformations des canaux Na+ et K+ en fonction du temps.
Mesuré àl'intérieurde la cellule, il se présente sous la forme d'une onde où l'on peut distinguer trois phasesàpartir de lavaleur au repos Vm
=
-50 mV: (fig.3) (4)-la phase de montée est une dépolarisation qui atteint d'emblée, dans un temps très court souvent inférieuràla milliseconde, une amplitude maximale voisine de 1OO mV: alors Vm
=
35 mV.-la phase de descente du potentiel d'action est également rapide (1 à
2 ms), lepotentiel de membrane revenant alors vers son niveau initialde -50 mV.
A la phase de descente, le potentiel de membrane atteint souvent une valeur plus négative que le niveau de potentiel de repos. Le retouràla valeur de potentiel initialse faitalors selon un décours relativement lent.
Dès le début de la dépolarisation membranaire, la perméabilité au sodium augmente. Cette augmentation est très brève et entraine un flux important d'entrée de sodium dans la cellule. Ce flux d'entrée se fait sous l'influence du gradient de concentration et de la différence de potentiel.
Le flux entrant de sodium amène le potentiel d'action à une valeur proche du potentiel d'équilibre du sodium et ne se maintient pas. La perméabilité au sodium revient à sa valeur de repos: c'est le phénomène "d'inactivation sodée".
La perméabilité membranaire au potassium augmente aussi, mais cette augmentation ne débute que plus tard, alors que celle du sodium est déjà très augmentée. Cette élévation est longue et prolongée: c'est le phénomène de "rectification retardée normale". Ainsi, au moment où la perméabilité au sodium est redevenue faible, celle du potassium est très élevée. Cela provoque un flux sortant de potassium, ramenant le potentiel membranaire à sa valeur de repos: c'est la "phase de repolarisation".
Le décalage dans le temps entre les ouvertures des canaux sodique et potassique, et les différences de vitesse de passage, entrainent temporairement la présence d'un excès d'ions alcalins dans la cellule: le potentiel Vm, après le maximum, passe par un minimum, avant de revenir à la valeur de repos, lorsque la sortie d'une quantité suffisante de potassium a rétabli la polarisation.
Les quantités d'ions échangées lors d'action sur le potentiel sont faibles par rapport au contenu cellulaire.
Le potentiel d'action apparait donc comme le résultat de modifications de la perméabilité membranaire:
-modifications des quantités de sodium entrant dans la cellule pendant la dépolarisation
-modifications du potassium sortant de la cellule pendant la repolarisation.
Ainsi, à la fin du potentiel d'action, la cellule s'est enrichie en sodium et appauvrie en potassium.
La répétition de l'activité cellulaire pourrait entrainer de profondes modifications des concentrations ioniques si un transport actif d'ions contre le gradient de concentration ne rétablissait immédiatement les concentrations initiales. Ce transport actif, souvent appelé " pompe à sodium ", permet l'expulsion du sodium hors de la cellule et l'entrée du potassium dans la cellule.
111-3- Protéines permettant le transport des ions
à
travers la membrane
Les protéines jouant un rôle dans le transport des ions appartiennent à deux catégories:
-celles qui jouent un rôle dans le transport passif des ions -celles qui assurent le transport actif des ions.
111-3-1- Les protéines jouant un rôle dans le transport
passif: les protéines-canaux et les protéines liées aux
protéines G
Les protéines-canaux assurent directement le transport passif des ions. Les récepteurs liés aux protéines G modulent le transport passif des ions.
111-3-1-1- Les protéines-canaux appelées aussi canaux ioniques
Les canaux ioniques sont des protéines insérées dans la membrane des cellules. Elles présentent une structure tridimensionnelle qui délimite un pore aqueux au travers duquel passent sélectivement certains ions. Elles assurent elles-même le passage des
sont pas ouverts en permanance; en effet, ils existent sous différents états: des états où le pore aqueux est fermé, et des états où le pore est ouvert.
Le passage d'un état ouvert à un état fermé est étroitement régulé:
-soit par une modification de la polarité membranaire: ces canaux sont communément appelés les "canaux-voltage dépendants" , voltage étant le terme anglosaxon pour différence de potentiel ou VOC. C'est le cas des canaux potassiques dits " canaux potassiques voltage dépendants " qui jouent un rôle central dans tous les
phénomènes de repolarisation des potentiels d'action des cellules excitables. (fig. 4 et 5)(4).
C'est aussi le cas des canaux calciques dits "canaux calciques voltage dépendants" dont le rôle est très important dans la régulation de la sécrétion d'insuline au niveau de la cellule
p
du pancréas.Fig. 4: Les canaux ouverts par changement de potentiel transmembranaire ou canaux sensibles au voltage.
La configuration de la protéine-canal est principalement dépendante du champ électrique transmembranaire
Fig. 5: Canaux voltage-dépendants.
Le transport d'ions à travers la membrane crée des courants électriques. Ces courants sont le moyen de communication majeur entre la cellule et son environnement.
Les protéines-canaux sont habituellement perméables à un seul ion du fait de leur différence de structure et de leur spécialisation. Selon leur gradient électrochimique, les
ions entrent dans la cellule (sodium et calcium) ou en sortent (potassium}, si les canaux appropriés sont ouverts.
-soit par la fixation d'un neurotransmetteur sur son récepteur: ce sont "les canaux récepteurs dépendants" ou ROC.
Le canal ionique et le site de reconnaissance du ligand sont portés par la même molécule
L'interaction du neurotransmetteur avec son site de fixation entraine un changement de conformation qui laisse passer les ions dans le canal. (fig. 6 et 7)(4)
Fig. 6: Les canaux s'ouvrent lorsqu'un ligand est fixé sur le ou les sites récepteurs présents dans le domaine extracellulaire de la protéine. Le ligand
est par exemple un neurotransmetteur.
La configuration de la protéine-canal est principalement dépendante de la liaison du ligand.
Fig. 7: Canaux récepteurs-dépendants.
111-3-1-2- Les protéines réceptrices liées aux protéines G
Ce sont des protéines dont la structure tridimensionnelle ne délimite pas de pore aqueux. Elles ont pour rôle de moduler l'ouverture des canaux ioniques. Cette modulation se fait par l'intermédiaire d'une protéine G.
111-3-1-2-1-Contrôle direct des canaux ioniquespar laprotéine
G
La protéine G, une fois activée par lerécepteur, interagitdirectement avec lecanal ioniquesoit pour l'ouvrir,soit pour lefermer. (6)
Prenons comme exemple la liaisonde !'acétylcholineau récepteur muscarinique des fibres atriales cardiaques (fig. 8)(6)
Le muscle cardiaque reçoit une double innervation,sympathique et parasympathique.
La stimulation du nerf vague provoque un ralentissement et même un arrêt, selon l'intensitéde la stimulation, des battements cardiaques. Cela résulte d'une
hyperpolarisation de lamembrane, elle-même provoquée par une sortie d'ions K+. C'est toutrécemment que le mécanisme membranaire mis en jeulorsde l'activationde ce récepteur a été découvert: lerécepteur stimulé par !'acétylcholine provoque l'activationd'une protéine G spécifique, et qui module directement, sans l'interventiond'un second messager, l'activitédes canaux potassiques.
B
A: Trois protèines sont rnises en jeu.
A.. estlerécepteur al'Ach,les
canauxlonique.s11ont descanaux
K+, et une protéine G composée~
troi$sousunitésO'k, ii,,'Y· En absente d'Ach, la sous unité·<lk est
liée au GOP ..
s:L<1 présencede: l'Achprovoque
l'activationdurécepteur
m usearlni(lue,
cecientraîM ~ de 111
~ 6,~ !a $ous unité 11k
échangeleGOPçontredu GTP
C : C'est o1cGTP Qui rnoduleralt directement l'"ctlvitédes canaux
K*
Fig. 8: Schéma résumant lesdifférentes étapes mises en jeu lorsde l'activationpar l'acétylcholinedes récepteurs muscariniques des fibres cardiaques.
111-3-1-2-2-Contrôle indirectdes canaux ioniquespar les protéinesG
Le récepteur, une fois activé, interagitavec une protéine G qui elle-même active une enzyme qui produit un second messager.
Ce dernier peut, soit interagirdirectement avec lecanal, soit activer une protéine kinase qui phosphorylera directement le canal. (fig. 9)(4)
1. La liaison de neurotrar>smetteur
sur son site récepteur eritr11ine l'actlYatlon de la prot!!ine G
2.lasousunitdaliée au GTP
active une en;yme E(qui~ être ~ .ou .nonl(IUI
cataly3e la formation d'un second
~
3. Lé seconde message• soit
moduledirectement1es canaux ioniqtJes, soit actlve une ·protéine kinase spécifique IPKl. la ~
kinase~ phosphoryle dlreotement,oupar l'intermédiaire
d'àutresprotéines, les canaux ic>nlQues.
Fig. 9: L'activation de la protéine G entraîne la formation d'un second messager.
111-3-2-Les
pro
té
ines
assuran
t
le
transpor
t
ac
t
i
f
des
ions
:
la
pompe
Na+
-K+
ATPase
Cette pompe rétablit continuellement l'inégalitéde répartition des ionsNa+ et K+ de part et d'autre de la membrane. En effet, ces ionspassentàtravers lamembrane au niveau des différents canaux qui leursont perméables.
La pompeàsodium possède un mode d'action faisant intervenirun processus enzymatique: en effet, celui-ci permet lasortie de trois ionssodium et l'entréede deux ionspotassium, alors qu'une molécule d'ATP est hydrolysée, en présence de magnésium Mg2+, par une enzyme pour fournirl'énergienécessaire. (fig. 10) (7)
~
J
l
'm\$41.1 dH 1011$ ... mo,uw. ment j)H:5lt ~ MyiAtlP•ll'i"' Fig. 10: La pompe Na/K/ATPaseCette pompe, formée de deux sous-unités assemblées en un couple aB, transporte les ions Na+ et K+ dans le sens inversede leurgradient
Chapitre 2 .. LES CANAUX P
êtude de lleur· fonctiion'J
régulation 1t pharmacologie.,
1- INTRODUCTION ET DEFINITION
Décrits au niveau des cardiomyocytes, les canaux potassiques ont été identifiés au niveau des cellules
p
des ilôts de Langerhans, des cellules musculaires lisses des parois vasculaires, des bronches, de la vessie et de l'utérus, des cellules musculaires striées et des neurones.Ils y assurent différentes fonctions physiologiques, notamment la génèse des phénomènes électriques membranaires.
Leur ouverture augmente la perméabilité de la membrane pour l'ion potassium, provoquant sa sortie vers le milieu extérieur et dès lors une augmentation du potentiel de membrane. (8)
Cette hyperpolarisation entraine la fermeture des canaux calciques dépendant du potentiel de membrane. La diminution de la concentration intracellulaire du calcium permet une relaxation de la cellule musculaire et au niveau vasculaire, une vasodilatation.
Au contraire, la dépolarisation de la membrane nécessite la fermeture de ces canaux, permettant un déplacement du potentiel de membrane au-delà du potentiel d'équilibre défini par le gradient électrochimique du potassium.
Il existe plusieurs types de canaux potassiques différents les uns des autres quant à leurs caractéristiques et leurs fonctions physiologiques, mais aussi quant à leur répartition d'un tissu à l'autre ou d'un organe à un autre, ainsi que par l'utilisation d'antagonistes, pour certains très sélectifs de tel ou tel canal.
Certains dépendent de la différence de potentiel, d'autres sont calcium-dépendants, d'autres enfin sont mis en jeu par l'activation de récepteurs spécifiques ou de phénomènes métaboliques (comme les canaux ATP-dépendants).
La pathologie de ces canaux est peu connue. On sait seulement que tout retard à leur ouverture conduit à une dépolarisation membranaire qui, au niveau de la fibre musculaire lisse, peut provoquer une contracture (crise d'asthme, spasme coronaire).
Par contre, toute ouverture prolongée peut être responsable, par exemple, au niveau pancréatique, d'une hyperglycémie, et au niveau cardiaque, de troubles du rythme.
11- CLASSIFICATION
Une quinzaine de canaux potassiques sont actuellement connus et existent seuls ou en association, selon des combinaisons variables, au niveau de différents types de cellules, comme nous l'avons dit précédemment, pour produire des effets physiologiques donnés.
En dépit de leur hétérogénéité, les canaux potassiques peuvent être répartis en trois grandes catégories, elles-même probablement hétérogènes:
-les canaux dépendant du potentiel de membrane. -les canaux dépendant de l'ion calcium.
-les canaux contrôlés par la concentration en ATP établissant un lien entre l'état métabolique de la cellule et son excitabilité.
A côté de ces trois grandes classes, les pharmacologues distinguent également: -les canaux potassiques associés
à
certains récepteurs (muscariniques cholinergiques ... )-les canaux potassiques dépendant de seconds messagers intracellulaires (AMPc, inositol triphosphate ... ).
Cette spécificité de la localisation et de la fonction permet de rendre compte du profil d'activité des activateurs des canaux potassiques (ACP) selon leur aptitude
à
interagir avec tel ou tel type de canaux potassiques. (8) (9) (10)Parmi ces différentes classes de canaux potassiques, ce sont les canaux ATP-dépendants qui paraissent la cible privilégiée des médicaments de la classe des ACP utilisés ou proposés dans les différentes indications.
Mais, avant l'étudede ces derniers, donnons quelques rappels sommaires sur les canaux dépendants de l'ioncalcium.
Physiologiquement, le diamètre artériel dépend de la tonicité des cellules musculaires lisses disposées dans l'épaisseur de la paroi artérielle. L'état contractile de ces cellules est directement corréléà leur concentration intracellulaire en calcium. Ce dernier entre dans la cellule musculaire lisseà travers des canaux calciques qui s'ouvrent lorsquela membrane est dépolarisée, ces canaux sont voltage-dépendant (VOC).
Toutefois, ces cellules possèdent aussi dans leur membrane, un certain type de canaux potassiques qui s'ouvrent lorsque la concentration en calcium intracellulaire augmente: ces canaux sont dits calcium-dépendants.
Lorsqu'une cellule musculaire lisse vasculaire est dépolarisée en réponseà un stimulus exogène (activation d'un canal ligand-dépendant ou activation d'un canal par l'étirement), les canaux calciques voltage-dépendants s'ouvrent, participant au maintien de la dépolarisation.
Ces canaux potassiques, s'ouvrant du fait de l'augmentation de la concentration intracellulaire en calcium, tendent à hyperpolariser la membrane, ce qui éloigne les canaux calciques voltage-dépendant de leurpotentiel d'ouverture (fig. 11)(10) .
..·-:.
.. ·:\,, ~ d••vo.lfage .
·,·permettanH'oomblw..
~ ~ :.
'... ··:· ..
Fig. 11: Relation entre potentiel de membrane et ouverture des canaux calciques.
Ainsi, le degré de dépolarisation de la membrane et donc l'état contractile de la cellule musculaire lisse vasculaire, dépendà tout instant de l'influence compétitive des
courants calciques dépolarisants et des courants potassiques hyperpolarisants activés par le calcium.
A côté de ces canaux, il existe dans la membrane des cellules musculaires lisses vasculaires, d'autres canaux potassiques qui contribuent également à réguler la polarisation de la membrane et donc l'influx de calcium: ce sont les canaux potassiques ATP dépendants.
Ill- LES CANAUX POTASSIQUES SENSIBLES A
L'ATP DITS CANAUX POTASSIQUES ATP
DEPENDANTS
111-1- Généralités
Le canal potassique ATP-dépendant est de découverte récente: mis en évidence initialement dans le muscle cardiaque, il a été trouvé ensuite dans le pancréas, le muscle lisse et le système nerveux central (Noma, 1983) (12), (Petersen et Findlay, 1987) (11).
L'histoire moléculaire, cellulaire et physiopathologique du canal potassique ATP-dépendant n'aurait pu être décrite sans la constatation que ce canal était la cible des sulfonylurées susceptibles de se lier à lui avec une très haute affinité.
Ce sont ces canaux dont l'ouverture et la fermeture sont contrôlées par l'ATP intracellulaire qui constituent le site d'action spécifique des ACP, d'où leur appellation de canaux potassiques" ATP-dépendants "ou" K-ATP ".
En effet, ces canaux potassiques se ferment lorsque la concentration en ATP intracellulaire est augmentée (fig. 12)(12).
./.'"
ATP
·
Fig.12: Les canaux K+ ATP -dépendants se ferment lorsquela concentration en ATP intra-cellulaireest élevée.
111-2-Mécanisme d
'act
ion
pharmaco
log
ique
L'importance particulière de ces canaux tient au fait qu'ils mettent en adéquation le métabolisme cellulaire et l'étatcontractile.
Au cours de l'ischémie, la concentration intracellulaire en ATP des cellules musculaires lissesdiminue du faitde laréduction du métabolisme aérobie.
Les canaux potassiques ATP-dépendants s'ouvrent, hyperpolarisant la membrane. Cette hyperpolarisation prévient l'ouverturedes canaux calciques, d'où une relaxation du muscle lisse, et donc une vasodilatation locale créant ainsi les conditions hémodynamiques optimales pour permettre lasurvie du tissu ischémié(fig. 13 et 14)(13).
Potenlial . •.
~ ~
nN ~ :--..--- -.ro.~
K-~
--•.• \•~
!(• \'(* K+ I(+ I(• ,~
·O
..
Fig. 13: Ouverture des canaux potassiques: relaxation du muscle vasculaire lisse.
Ouverture des canaux K+
l
Augmentation flux K+ sortant
l
Hyperpolarisation membranaire
l
l
Inhibition entrée du Ca2+
l
Relaxation des fibres musculaires lisses
l
Fig. 14: Représentation schématique des conséquences de l'ouverture des canaux potassiques au niveau du muscle vasculaire.
Pour permettre l'ouverture de ces canaux ATP-dépendants, on utilise donc des agonistes potassiques qui vont diminuer la sensibilité de ces canaux
à
l'effet bloquant de l'ATP et faciliter leur ouverture.Deux conséquences fondamentales vont résulter de cette ouverture: d'une part, comme nous l'avons dit précédemment, la réduction de l'influx calcique, et d'autre part le raccourcissement du potentiel d'action des cellules excitables.
Ainsi, la réduction indirecte de l'entrée de calcium , va engendrer en plus de la vasodilatation précitée, une diminution de la contractilité myocardique et une épargne des réserves énergétiques de ces cellules (fig. 15)(14).
Agonistes P·otassiques
r;romsk.allnÎ Antagonistes pota_tïïsiques
~ · gllbelwlamtde · ditwWida lôlbulamlde ,'
©\
K+
,;tJL
ca••
·Flcletn Mtracellulal• : .ATPIADP; pH .. , .... canal calcAqM :11ntt·
'Ca++
ecnliiqueneM Rtfaudon du m.-Qletiue ~ Dilldnullon dt la i:ionttdon cardiaque l!lpar(lneênqétiqœdu ~ (ATP)Fig. 15: Régulation des canaux potassiques ATP-dépendants dans le coeur et les vaisseaux.
Lors d'une ischémie cardiaque, l'ouverture des canaux potassiques va donc freiner l'entrée des ions calcium dans les cellules myocardiques et limiter la libération de ces ions à partir de leurs sites de stockage intracellulaire: le réticulum sarcoplasmique.
L'augmentation transitoire du calcium cytosolique induite par les catécholamines sera également freinée, et tout cela concourt à protéger la cellule cardiaque contre les effets délétères de la" vague calcique" normalement constatée lors de la reperfusion du myocarde. Ce mécanisme fondamental est à la base de ce que l'on appelle la "
cardioprotection " des ACP dans laquelle les canaux potassiques ATP-dépendants sont spécifiquement impliqués (17).
En effet, au niveau des cellules cardiaques, les cibles moléculaires des ACP sont les canaux potassiques ATP-dépendants: en présence d'un ACP, ces canaux s'ouvrent pour des concentrations en ATP supérieures à celles nécessaires à leur activation en l'absence de l'ACP (fig. 16)(15)
Fig. 16: Renforcement par les activateurs des canaux potassiques du mécanisme cytoprotecteur naturel au cours de l'ischémie myocardique.
Nous reparlerons de cet effet cardioprotecteur des ACP dans le prochain chapitre.
111-3- Rôle et fonctionnement des canaux potassiques
ATP-dépendants dans une cellule
p
pancréatique
Le rôle de ces canaux potassiques ATP-dépendants a été particulièrement bien étudié au niveau de la cellule ~ pancréatique, où ils contrôlent la libération d'insuline.
Le glucose est l'initiateur de cette sécrétion, en dépolarisant la membrane cellulaire, permettant donc l'entrée de calcium par les canaux calciques voltage-dépendants.
Ces canaux sont d'un intérêt majeur du fait de leur rôle fondamental dans la génération et la modulation du potentiel de membrane et par conséquent dans le déclenchement et la régulation de la sécrétion d'insuline (16).
111-3-1- Stimulation de la sécrétion d'insuline par le
glucose
Il existe une relation étroite entre la concentration de glucose dans le milieu extracellulaire et le débit d'insuline sécrétée.
La sécrétion d'insuline en l'absence de glucose est très faible. L'action stimulante du glucose sur l'insulino-sécrétion commence à se manifester pour des concentrations se situant autour de 6 mM (1 mM=0.18 g par litre). A partir de cette concentration, la sécrétion d'insuline s'accroit rapidement: elle est linéairement reliée à la concentration de glucose jusqu'à 16.6 mM (17).
En présence d'une faible concentration de glucose, la cellule
p
pancréatique est électriquement silencieuse: elle est polarisée aux environs de -70mV, ce qui correspond au potentiel de repos. Celui-ci, proche du potentiel d'équilibre pour le potassium, est essentiellement déterminé par la perméabilité membranaire beaucoup plus grande pour le potassium que pour les autres ions (18).En effet, un certain nombre de canaux potassiques sont alors ouverts parmi lesquels les canaux potassiques ATP-dépendants (19).
En cas d'exposition de la cellule
p
pancréatique à une perfusion de glucose entre 10 et 25 mM, elle se dépolarise, cette dépolarisation entrainant l'apparition d'une activité électrique spontanée avec des potentiels d'action répétitifs (fig. 17)(19).....___.
1 min
Glucose {mM)
·.l!SmM
©
Fig. 17: Activité d'une cellule 13 après perfusion de glucose.
La cellule ~ pancréatique est devenue excitable et c'est cette activité électrique
spontanée provoquée par la perfusion de glucose qui entraine la sécrétion d'insuline. En même temps, cette activité électrique spontanée est liée
à
une diminution de l'efflux de potassium età
une entrée massive des ions calcium (fig. 18). En effet, au cours des phénomènes d'activité électrique, la dépolarisation de la membrane entraine l'ouverture de canaux calciques voltage-dépendant, ce qui permet l'entrée de calcium dans la cellule. L'augmentation de la concentration du calcium cytosolique va activer un système effecteur qui induit la sécrétion d'insuline(fig.18)(19).Sortie de 66Rb +
@
{%/min) 3o a
7 l025 Glucose (mM) Entrée de 45Ca 2+ .@
(pmol J fil.Il 5 min)15 ...
0 3 1 1Ci 25
Glucose {mM)
Fig. 18: Relation entre l'activité électrique, les flux ioniques K+ et Ca2+ et la sécrétion d'insuline par la cellule ~ des îlots de Langerhans isolés de souris.
Après un intervalle de temps, la cellule
p
pancréatique redeviendra silencieuse puis reprendra plus tard son activité électrique spontanée si la perfusion de glucose persiste (20).111-3-2- Rôle des canaux potassiques dans la sécrétion
d'insuline induite par le glucose
Comme nous l'avons dit précédemment, la membrane des cellules
p
possède des canaux sélectifs pour le potassium directement inhibés par l'ATP intracellulaire: ce sont les canaux potassiques ATP-dépendants (21).Ainsi l'ATP généré au cours du métabolisme du glucose, inhibe l'activité de ces canaux et représente donc un lieu essentiel entre ce métabolisme et la dépolarisation membranaire.
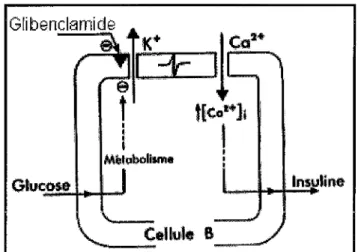
En résumé, la séquence d'évènements que déclenche le glucose pour aboutir à la sécrétion d'insuline peut être schématisée de la façon suivante: (fig.19)(21 ).
Cetlule B
__
,.,,..Fig. 19: Illustration schématique du mécanisme de la sécrétion d'insuline induite par le glucose.
Le métabolisme du glucose génère ia formation d'ATP qui inhibe les canaux potassiques ATP-dépendants. La dépolarisation qui en résulte provoque l'ouverture de canaux calciques voltage-dépendants, ce qui permet l'entrée du calcium dans la cellule.
Cette augmentation de la concentration cytosolique de calcium est considérée comme le signal intracellulaire déclenchant la sécrétion d'insuline (22).
Cette explication met en cause la variation de la concentration en ATP seul.
L'expérience montre que ce facteur intervient de façon différente s'il agit sur des canaux potassiques ATP-dépendants isolés ou inclus dans leurs structures cellulaires normales.
Le mécanisme, pour être vraisemblable, doit considérer les constituants présents à
côté de l'ATP, et se complique si ces derniers sont eux-même actifs.
Or, cela semble être le cas de l'ADP qui a une action inverse de celle de l'ATP, alors que l'AMP agit comme l'ATP.
Un canal isolé maintenu dans un milieu sans ATP, perd sa capacité d'action en quelques minutes: l'application d'ATP et de magnésium le réactive en le rendant de nouveau capable d'ouverture et de fermeture selon la concentration en ATP.
Il en est de même en traitant le canal inopérant par le GTP (guanosine triphosphate) ou GDP avec du magnésium.
Ainsi les canaux potassiques ATP-dépendants de la cellule
p
occupent une place essentielle dans les mécanismes de couplage entre la stimulation glucosée et la sécrétion d'insuline.111-3-3- Action de certaines substances
pharmacologiques et hormones sur les canaux
potassiques ATP-dépendants
111-3-3-1-Action de certaines substances pharmacologiques:
Agoniste et antagonistes des canaux potassiques ATP-dépendants
Agonistes potassiques
* Agonistes potassiques endogènes:
- Acétylcholine -Adénosine
* Agonistes potassiques de synthèse:
- Diazoxide (HYPERSTAT, PROGLICEM)
- Minoxidil (LONOTEN) - Pinacidil - Nicorandil (IKOREL) -Aprikalim - Cromakalim Antagonistes potassiques
* Sulfonylurées (antidiabétiques oraux):
- Glibenclamide (DAONIL, HEMIDAONIL, EUGLUCAN, MIGLUCAN)
- Tolbutamine (DOLJPOL)
*Autres antagonistes:
- Phentolamine (REGITINE)
- 5-hydroxydécanoate
- Antiarythmiques de classe Ill
Le rôle fondamental des canaux potassiques ATP-dépendants comme lieu d'action d'un certain nombre d'agents pharmacologiques aussi bien stimulant qu'inhibant la
sécrétion d'insuline est actuellement bien reconnu.
Parmi les stimulants de la sécrétion d'insuline, les sulfamides hypoglycémiants comme le glibenclamide, stimulent cette sécrétion en déclenchant, au niveau
membranaire des modifications électriques et ioniques similaires
à
celles produites par le glucose (fig.21)(22).. Insuline
En effet, ils induisent une réduction de la perméabilité membranaire potassique et donc une dépolarisation conduisant à l'ouverture de canaux calciques voltage-dépendants.
Cependant, au contraire du glucose qui doit être métabolisé pour être actif, ils agissent par un blocage direct du canal potassique. Des récepteurs de haute affinité aux sulfonylurées ont été caractérisés sur les membranes cellulaires de différentes lignées insulino-sécrétrices. Ce site de liaison est étroitement lié au canal potassique et permet d'en contrôler l'activité.
En ce qui concerne les inhibiteurs pharmacologiques de la sécrétion d'insuline, il est actuellement bien établi que le diazoxide hyperpolarise la membrane de la cellule
p
en augmentant la probabilité d'ouverture du canal potassique ATP-dépendant (23).Ainsi, le diazoxide inhibe la sécrétion d'insuline en déclenchant une série d'évènements membranaires, (ouverture du canal potassique ATP-dépendant, hyperpolarisation et inactivation des canaux calciques voltage-dépendants) point par point opposés à ceux que déclenchent le tolbutamide ou les autres sulfamides hypoglycémiants.
Dans la famille des activateurs des canaux potassiques, le diazoxide est parmi les plus puissants inhibiteurs de la sécrétion d'insuline.
D'autre part, le pinacidil et le cromakalim semblent avoir également des actions sur les cellules
p.
111-3-3-2- Action de certaines hormones
Un certain nombre d'hormones et neurotransmetteurs sont susceptibles de moduler la réponse de la cellule
p
au glucose en atténuant ou en amplifiant le signal insulino-sécréteur.Par exemple, la somatostatine est une hormone qui inhibe la sécrétion d'insuline par la cellule
p.
Soma
tos
ta
t
ine
GHbencJam
ide
~
i)e
HautATP
Fig. 22: Mécanisme d'action de lasomatostatine.
L'hormone se fixeàson récepteurspécifique, entrainant l'activationd'une protéine G qui se lieau récepteurspécifique. Cette liaisonentraine l'échangeGDP-GTP et lasous -unité
a
se sépare des sous-unitésp
ety.C'est lasous-unitéaliéeau GTP qui active alors lescanaux potassiques ATP-dépendants, entrainant leurouverture et donc une augmentation de l'affluxpotassique. Cette sortie de potassium engendre une hyperpolarisation membranaire et par suite réduira la probabilité d'ouverture des canaux calciques voltage-dépendants, voie d'entrée majeure du calcium nécessaireàlasécrétion d'insuline.
On retrouve lemême mode d'action par lagalanine, hormone hyperglycémiante de découverte récente.
En conclusion, nous pouvons dire que lescanaux potassiques jouentun rôle décisif non seulement au niveau cardiovasculaire mais également dans lecouplage stimulation-sécrétion de lacellule
p
pancréatique.Les canaux ATP-dépendants, qui sont lesplus nombreux et lesplus connus, représentent le lieuessentiel entre lemétabolisme du glucose et l'activitéélectrique membranaire.
Ils constituent ainsi une importantecible sur laquelleleglucose mais également certaines substances pharmacologiques peuvent agir.
Nous allons étudier dans leprochain chapitre, lesactivateurs des canaux potassiques.
Chapitre 3- LES CTll JEURS
.S CAN UX POTASSI
1ES:
1- INTRODUCTION
L'insuffisance coronarienne étant la première cause de mortalité en France, le nombre de molécules antiangineuses mises sur le marché ne cesse de s'accroitre.
Le traitement spécifique de l'angor est en général destiné
à
l'optimisation des déterminants de l'équilibre entre l'apport et la demande en oxygène myocardique.La plupart des antiangineux actuellement disponibles, agissent en réduisant la consommation d'oxygène par le myocarde soit par diminution de la fréquence cardiaque (13 bloquants, vérapamil, diltiazem) soit de la pression artérielle (p bloquants, inhibiteurs calciques) soit de la contractilité (p bloquants, vérapamil). De plus, les inhibiteurs calciques et les dérivés nitrés, y compris la molsidomine, améliorent les apports myocardiques en oxygène.
Cependant, l'utilisation de ces différentes molécules est restreinte du fait d'un certain nombre d'inconvénients: nombreuses contre-indications et effets indésirables. Une association entre les différentes classes pharmacologiques est souvent nécessaire afin d'agir sur l'ensemble des mécanismes impliqués dans l'ischémie myocardique. Enfin, récemment, l'importance des phénomènes de tachyphylaxie a été reconnue, limitant l'efficacité d'un traitement au long cours par les dérivés nitrés.
C'est ainsi qu'une nouvelle classe pharmacologique a fait son apparition: les activateurs des canaux potassiques dont le chef de file est représenté par le Nicorandil, au mode d'action original et que nous allons étudier dans cette troisième partie.
11- STRUCTURES CHIMIQUES
Cette classe des activateurs des canaux potassiques représente un groupe relativement hétérogène sur le plan des structures chimiques qui la constituent (fig .23)(25).
Ct-akà11tt1
llitl,.~
!1:1' ~~
0
~
Fig. 23: Structures chimiques des principaux agonistes des canaux potassiques.
On constate une assez grande variété des structures chimiques des ACP. Certaines d'entre elles possèdent un groupement cyano C=N comme le cromakalim, le pinacidil et leSR 44866.
Le Nicorandil ou (N-(2-hydroxy éthyl)-nicotinamide nitrate) est un nitro-ester de nicotinamide. La molécule est composée de deux parties possédant chacune une activité particulière et des propriétés spécifiques. La partie principale de la molécule est responsable de l'action activatrice des canaux potassiques tandis que la présence d'un groupement -N02 sur la chaine latérale explique les propriétés complémentaires que présente le Nicorandil. En effet, ce groupement confèreà la molécule des propriétés de type nitré,
à
savoir une vasodilatationà
prédominance veineuse. Il en résulte une diminution de la précharge se traduisant par une diminution de volume du ventriculecette propriété permet un effet préventif sur le spasme coronaire et une vasodilatation des gros vaisseaux coronaires.
111- PHARMACOLOGIE
Avant d'envisager de façon détaillée le mode d'action des ACP, il me semble utile de faire un rappel sur la régulation de la balance besoins/apports en oxygène du myocarde (26).
-Tout d'abord. rappelons quels sont les facteurs qui influencent les besoins en
oxvgène du mvocarde:
Parmi ces différents facteurs, trois apparaissent prépondérants:
- la fréquence cardiaque: les besoins en oxygène sont reliés de manière
linéaire à cette fréquence cardiaque.
- la tension pariétale intraventriculaire gauche: schématiquement, cette
tension dépend principalement de la précharge et de la postcharge ventriculaires gauches.
- la contractilité myocardique ou inotropisme: la contractilité reflète la
relation entre force et vitesse de contraction et longueur de l'élément contractile. Elle ïepïésente la pmpriété du muscle cardiaque de modifier sa performance sous l'influence d'agents hormonaux ou chimiques (fig. 24).
Précharge Fréquence Cardiaque
Apports d' 02 Débit coronaire
Toutes les circonstances physiologiques ou pathologiques qui augmentent l'un de ces trois facteurs (effort, hypertension artérielle, tachycardie, médicaments ... ) provoquent une augmentation des besoins en oxygène du myocarde.
- Voyons maintenant les moyens d'adaptation des apports d'oxygène au myocarde:
Seule une augmentation du débit coronaire peut permettre une augmentation de la quantité d'oxygène délivrée au niveau du myocarde, lors d'un accroissement des besoins en oxygène. C'est donc uniquement la vasodilatation coronaire qui assure une adéquation entre besoins et apports en oxygène.
Le débit coronaire est assuré par les artères épicardiques de gros calibre et par les artérioles coronaires intramyocardiques de petit calibre. Ces artérioles représentent environ 90% des résistances à l'écoulement du sang, chez le sujet normal.
L'adaptation des coronaires aux contraintes importantes qui leur sont imposés est assurée par une triple régulation:
- régulation métabolique - régulation nerveuse - régulation endothéliale
Chez le sujet normal, la vasomotricité coronaire permet une remarquable adaptation du débit sanguin lors d'une augmentation, même importante des besoins en oxygène du myocarde.
- Quel/es sont /es causes d'une rupture de /'équilibre appnrt.c::/bP..c:oins?
L'ischémie myocardique résulte d'une rupture de l'équilibre, soit, le plus fréquemment, lorsque l'augmentation des besoins en oxygène ne peut pas être compensée par une augmentation des apports, soit par une chute brutale des apports en oxygène (fig.25).
Angor spastiqÙa
'
Fig. 25: Cause d'une ischémie myocardique.
On observe:
- soit une augmentation des besoins en oxygène du myocarde sans augmentation parallèle des apports: c'est la conséquence d'une sténose fixe d'origine athéromateuse, responsable d'un angor d'effort.
- soit une chute brutale du débit coronaire sans augmentation des besoins en oxygène: l'ischémie apparait au repos et est la conséquence d'un spasme coronaire ou d'une thrombose.
Le but de la thérapeutique anti-angineuse est de rétablir l'équilibre apports/besoins en oxygène, soit par une réduction de la consommation d'oxygène, soit en agissant à des degrés divers sur les apports et les besoins.
111-1- Mode d'action
L'implication des canaux potassiques dans le maintien et dans les variations du potentiel membranaire de la cellule est une notion maintenant bien établie, comme nous l'avons vu précédemment.
Les ACP sont un groupe de molécules capables d'ouvrir ou de prolonger l'ouverture de certains canaux potassiques: les canaux potassiques ATP-dépendants situés dans la membrane cellulaire. Ces derniers semblent être plus particulièrement impliqués dans les phénomènes d'ischémie cellulaire, ce qui explique les propriétés des molécules les activant.
Le mécanisme d'action de ces molécules peut se résumer en trois étapes:
- une sortie passive du potassium de la cellule vers le milieu extracellulaire - une hyperpolarisation membranaire
- des effets relaxants et anti-contracturants.
111-1-1-1- L 'efflux de potassium de la cellule
L'ouverture de ces canaux par les ACP provoque une augmentation de l'efflux potassique de la cellule. Cet efflux est mesuré grâce à l'utilisation de rubidium marqué 86 Rb+, la parenté chimique du Rb et du potassium laissant supposer que le premier a le même comportement physiologique que le deuxième; ainsi la sortie de potassium est calculée par la mesure du flux sortant de 86 Rb+ (27).
D'une manière générale, l'augmentation de l'efflux potassique de la cellule va de paire avec l'activité hyperpolarisante et anti-contracturante: les deux phénomènes dépendent de la concentration en ACP.
Mais tous les ACP n'ont pas la même puissance d'action: le cromakalim est 3 à 4 fois plus puissant que le pinacidil, et le minoxidil, et 200 fois plus puissant que le
diazoxide, en ce qui concerne l'induction de l'efflux potassique. Il est en revanche 3 à 4 fois moins puissant que le SR 44866 (28)(29).
111-1-1-2- L'hyperpolarisation membranaire
Cet efflux d'ions positifs dont nous venons de parler va créer un courant électrique responsable d'une modification du potentiel de membrane. Selon l'état de la cellule à l'ouverture de ces canaux, il s'agira d'une hyperpolarisation ou d'une repolarisation: si la cellule était au repos, la sortie de potassium créera une hyperpolarisation membranaire rendant ainsi la cellule moins excitable puisque son potentiel s'éloignera du potentiel seuil. Si la cellule était dépolarisée, la sortie de potassium lui permettra de retourner plus rapidement à son potentiel de repos; la durée du potentiel d'action se trouvera ainsi raccourcie (fig.26)(29).
'
'
Fig. 26: Agonistes des canaux potassiques et excitabilité cellulaire. a) Dépolarisation rapide: entrée rapide de Na.
b) Repolarisation: efflux de k+ hors de la cellule.
Les agonistes des canaux potassiques raccourcissent la durée du potentiel d'action (1) en favorisant la repolarisation et hyperpolarisant la cellule (2) en prologeant l'efflux de K.
111-1-1-3- Effets relaxants et anti-contracturants
Comme nous venons de le voir, au niveau de la cellule musculaire lisse vasculaire, l'activation des canaux potassiques ATP-dépendants provoque une sortie de potassium de la cellule et une hyperpolarisation membranaire. Ce changement du potentiel de membrane va limiter la perméabilité des canaux calciques ddp-dépendants, c'est-à-dire sensibles
à
la différence de potentiel membranaire. En effet, il faut rappeler que le gradient de potassium dans la cellule excitable est opposé à celui du calcium, lorsque la concentration intracellulaire en potassium est de l'ordre de 150 nM et la concentrationextracellulaire de l'ordre de 4 à6 nM. En conséquence, l'ouverture des canaux potassiques va entrainer une baisse de charges positivesàl'intérieurde la cellule et donc une diminution des concentrations cytosoliques de calcium (30)(31)(fig.27).
@nyperpolartsatîon
·mem'branafN ca.++(
~
~
~
Fig. 271- L'activation d'un canal potassique ATP-dépendant, soit par un ligand extracellulaire (EDHF, nicorandil), soit consécutiveàla baisse de l'ATP intracellulaire, provoque une ouverture de ce canal.
2-La sortie de potassium qui en résulte hyperpolarise la membrane.
3-Cette hyperpolarisation bloque les canaux calciques voltage-dépendants et peut-être les canaux calciques récepteurs-dépendants de typeL.,
empêchant l'entréede calcium dans la cellule.
4- Ceci conduitàune baisse de la concentration de calcium libre
intracellulaiïe.
VOC= canal calcique voltage-dépendant. ROCL= canal calcique récepteur-dépendant de typeL.
Or de laconcentration intracellulaireen calcium dépend l'étatcontractile de la cellule: on observera donc une relaxation musculaire lisse(fig.28)(29).
Agonistes potassiques (nicorandil)
l
Ouverture des canaux potassiques sortie du potassium
i
Hyperpolarisation membranaire
l
Fermeture des canaux calciques voltage-dépendants
l
Diminution de la concentration intra-cellulaire
Inhibition du stockage et/ou du relargage du calcium au niveau du réticulum sarcoplasmique en calcium libre •<11---J
l
Relaxation vasculaireFig.28: Effets relaxants des ACP.
En outre, la concentration intracellulaire en calcium est probablement réduite par un mécanisme complémentaire: les ACP empêchent la formation d'inositol triphosphate, substance intracellulaire responsable du "relargage" du calcium par le réticulum sarcoplasmique.
111-1-2- Effets particuliers du Nicorandil
Comme nous !'avons vu au paragraphe !!, le Nicorandi! possède dans sa formule chimique deux parties distinctes: une exerçant l'activité activatrice des canaux potassiques, l'autre, le groupement -N02, responsable d'une vasodilatation. Du fait de ses propriétés ACP, le Nicorandil provoque une action relaxante qui prédomine sur les artérioles résistives, et un effet cytoprotecteur cardiaque.
De plus, par la présence du groupement nitré, on observe une stimulation de la guanylate cyclase et de la production de GMPc (guanosine monophosphate cyclique) par la cellule musculaire lisse vasculaire. Cette dualité de mécanisme d'action confère au Nicorandil un profil cardiovasculaire original mis à profit dans le traitement de la maladie coronarienne.
En fonction des modèles pharmacologiques utilisés, l'un ou l'autre mécanisme d'action prédomine, ces deux mécanismes étant indépendants.
Dans ce chapitre, nous allons donc faire la part des activités pharmacologiques du Nicorandil qui sont dûes à l'activation des canaux potassiques et de celles qui sont liées à la présence de la structure nitrée.
111-1-2-1-Action activatrice des canaux potassiques
Cette action est réalisée par la partie nicotinamide du Nicorandil. L'activation concerne bien les canaux potassiques ATP-dépendants puisqu'elle est antagonisée par des substances de la famille des sulfonylurées qui sont des antagonistes spécifiques de ce type de canal, ceci ayant été étudié dans la deuxième partie.
Au niveau de la cellule musculaire lisse, l'action activatrice des canaux potassiques du Nicorandil est superposable à celle décrite au paragraphe 111-1-1, c'est-à-dire que l'hyperpolarisation induite par l'ouverture des canaux potassiques ATP-dépendants va provoquer une baisse du calcium libre intracellulaire. Cette dernière entraine une relaxation de la cellule musculaire lisse et donc une vasodilatation, notamment au niveau artériel par diminution de la post-charge, la post-charge étant l'ensemble des forces qui s'opposent à l'éjection du ventricule gauche lors de la systole, et dépendant essentiellement des résistances vasculaires périphériques et, de manière inversement proportionnelle, de la compliance artérielle (32).
D'autre part, différents auteurs ont montré que les ACP modulent l'activité des canaux potassiques ATP-dépendants du muscle cardiaque en diminuant leur sensibilité à l'effet bloquant de l'ATP (33).
Lors de !'ischémie myocardique, la· concentration intracellulaire en fo,TP diminue
secondairement à l'arrêt du métabolisme aérobie. Dans ces conditions, une faible concentration de Nicorandil active les canaux potassiques ATP-dépendants du myocarde diminuant plus rapidement la contractilité dans la zone ischémiée et préservant au mieux les stocks énergétiques. Cet effet pharmacologique semble être