Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS École nationale supérieure d'ingénieurs (Poitiers) Institut de chimie des milieux et matériaux de Poitiers - IC2MP
(Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie et microbiologie de l'eau
Présentée par : Aude Audirac
Contribution à la mise en uvre du procédé d'ozonation catalytique à partir d'un catalyseur supporté
Directeur(s) de Thèse :
Nathalie Karpel vel Leitner, Florence Pontlevoy Soutenue le 12 décembre 2013 devant le jury Jury :
Président Bernard Legube Professeur des Universités, Université de Poitiers
Rapporteur Claude Descorme Chargé de recherche CNRS, Université de Lyon 1
Rapporteur Dominique Wolbert Professeur des Universités, Université de Rennes 1 Membre Nathalie Karpel vel Leitner Directrice de recherche CNRS, ENSIP
Membre Florence Pontlevoy Dirigeante Technavox-Serep, Poitiers
Membre Hervé Paillard Docteur, Véolia environnement, Paris
Pour citer cette thèse :
Aude Audirac. Contribution à la mise en uvre du procédé d'ozonation catalytique à partir d'un catalyseur supporté [En ligne]. Thèse Chimie et microbiologie de l'eau. Poitiers : Université de Poitiers, 2013. Disponible sur Internet <http://theses.univ-poitiers.fr>
L’UNIVERSITE DE POITIERS
ECOLE NATIONALE SUPERIEURE D’INGENIEURS DE POITIERS ECOLE DOCTORALE SCIENCES POUR L’ENVIRONNEMENT GAY LUSSAC
Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Diplôme national – Arrêté du 7 août 2006)
Spécialité : CHIMIE ET MICROBIOLOGIE DE L’EAU Par
Aude AUDIRAC
Ingénieur Génie des Procédés
Contribution à la mise en œuvre du procédé d'ozonation catalytique à partir d'un catalyseur supporté
Soutenue le 12 décembre 2013, devant la commission d’examen :
Rapporteurs
Dominique WOLBERT Professeur, ENSCR, Rennes
Claude DESCORME Chargé de Recherche, IRCELYON, Lyon
Examinateurs
Bernard LEGUBE Professeur, IC2MP, Poitiers (Président)
Hervé PAILLARD Docteur, VEOLIA EAU, Paris
Directrices de thèse
Nathalie KARPEL VEL LEITNER Directrice de Recherche, IC2MP, Poitiers
On a deux vies.
La deuxième commence le jour où
on réalise qu'on en a juste une
Confucius
La connaissance est une navigation
dans un océan d'incertitudes à
travers des archipels de certitudes
Remerciements
Mes remerciements vont en premier lieu à Sabine Petit, directrice de l’IC2MP pour m’avoir accueillie au sein de l’Institut de Chimie des Milieux et des Matériaux de Poitiers. Je souhaite ensuite remercier mes directrices de thèse, Nathalie Karpel Vel Leitner et Florence Pontlevoy pour leur soutien et la confiance qu’elles m’ont accordée au cours de ces trois ans de thèse. Nous avons pu avoir des conversations très intéressantes qui nous ont permis d’approfondir plusieurs points abordés au cours de ces travaux.
Je souhaite également remercier Monsieur Wolbert, professeur à l’Ecole Nationale Supérieure de Chimie de Rennes et Monsieur Descorme, chargé de recherche à l’IRCELYON d’avoir accepté de juger ce mémoire et d’en être rapporteurs.
Mes remerciements s’adressent aussi à Monsieur Paillard de Veolia Eau pour avoir accepté de participer à mon jury de thèse. Enfin, je remercie Monsieur Legube qui présidera ce jury. Je souhaite remercier tous les membres du laboratoire, en particulier, mes compagnons de bureau, Turki et Patrick, pour les discussions interculturelles, ainsi que Mélissa avec qui j’ai passé de bons moments au PLB. Merci également à Bertrand et Sahidou pour l’aide apportée à la plate-forme Eau.
Je tiens également à remercier Pascal pour toute l’aide qu’il a pu m’apporter d’un point de vue technique pour la réalisation des différents montages expérimentaux, bien qu’il ait fallu le plus souvent travailler dans l’urgence. Merci d’avoir toujours répondu présent pour m’aider dans toutes mes tâches de bricolage !
Et bien sûr, je remercie Mamouni, Louloutette et Doudounette, d’avoir toujours été là, de m’avoir soutenue et entourée.
Introduction Générale……….2
Chapitre I : Synthèse Bibliographique
I. L’ozonation ... 6I.1. Chimie de l’ozone ... 6
I.2. Réactivité de l’ozone ... 7
I.2.1. Activation par le peroxyde d’oxygène ... 7
I.2.2. Activation par les rayonnements UV ... 9
I.2.3. Mécanismes d’action de l’ozone ... 9
II. L’ozonation catalytique ... 11
II.1. L’ozonation catalytique homogène ... 11
II.2. L’ozonation catalytique hétérogène ... 12
II.2.1. Mécanismes de l’ozonation catalytique hétérogène ... 13
II.2.2. Consommation d’ozone ... 15
II.2.3. Pertes de métaux ... 15
II.2.4. Procédés industriels mettant en œuvre la catalyse hétérogène pourl’ozonation ... ... 15
II.2.5. Travaux sur l’ozonation catalytique hétérogène d’acides organiques ... 19
II.2.6. L’ozonation catalytique de l’acide succinique ... 21
II.2.7. Influence du pH ... 21
III. Modélisation des réacteurs ... 23
III.1. Réalisation de la stimulation en entrée ... 23
III.2. Distribution des Temps de Séjour ... 23
III.2.1. Les réacteurs idéaux, REP et ROPA ... 23
III.2.2. La courbe de DTS 24 III.2.3. Les écoulements dans les réacteurs réels ... 25
III.3. Détermination de la fonction de transfert d’un réacteur réel ... 26
III.4. La modélisation des réacteurs ... 27
IV. Transfert de matière ... 28
IV.1. Le transfert de matière dans un réacteur diphasique gaz-liquide ... 28
IV.1.1. Les modèles de transfert ... 28
IV.1.1.1. Modèle du film ... 28
IV.1.1.2. Modèle du double film ... 29
IV.1.1.3. Modèle de la pénétration ... 29
IV.1.1.4. Modèle du renouvellement de surface ... 30
IV.1.2. Détermination du coefficient volumique de transfert de matière, kLa ... 30
IV.1.3. Les types de contacteurs gaz-liquide 32 IV.1.3.1. Performances et limites des contacteurs en ozonation ... 33
IV.1.3.2. Contacteurs utilisés pour l’ozonation catalytique industrielle ... 34
IV.2. Couplage du transfert de matière et de la réaction chimique ... 36
IV.2.1. Les réactions diphasiques ... 36
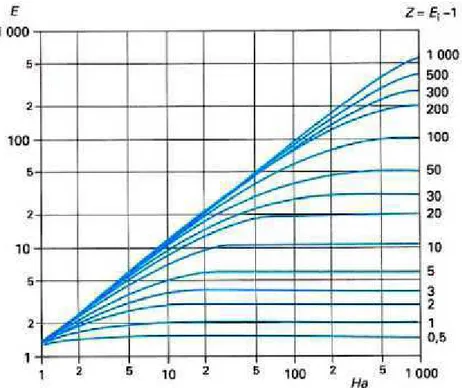
IV.2.1.1. Détermination du nombre de Hatta ... 36
IV.2.1.2. Les différents régimes réactionnels ... 39
IV.2.2. Les réactions triphasiques ... 39
Chapitre II : Protocoles et résultats préliminaires
I. Matériel et méthodes ... 55
I.1. Réacteurs utilisés ... 55
I.1.1. Réacteur 1L ... 55
I.1.2. Réacteur avec recirculation en mode batch, semi continu ou continu ... 56
I.2. Catalyseurs utilisés 59 I.2.1. Le catalyseur poudre ... 59
I.2.2. Le catalyseur supporté « bâtonnet » inox, C.1. ... 59
I.2.3. Le catalyseur supporté « disque » inox, C.2. ... 59
I.2.4. Le catalyseur supporté « disque » céramique, C.3. ... 60
I.3. Préparation des solutions ... 61
I.4. Méthodes analytiques ... 61
I.4.1. Quantification de l’acide succinique ... 61
I.4.2. Mesure du Carbone Organique Dissous (COD) ... 61
I.4.3. Protocole de mesure de l’ozone dissous ... 61
I.4.4. Protocole d’évaluation de l’efficacité de mélange et de la distribution des temps de séjour 62 II. Résultats préliminaires ... 64
II.1. Ozonation catalytique de l’acide succinique ... 64
II.1.1. Dégradation de l’acide succinique dans le réacteur 1 L avec le catalyseur poudre ... 65 II.1.1.1. Efficacité et sous-produits ... 65
II.1.1.2. Comparaison des catalyseurs sous forme de poudre et supportés ... 67
II.1.2. Efficacité du catalyseur supporté dans le réacteur R.1.A. pour l’ozonation de l’acide succinique ... 67
II.1.2.1. Influence de la concentration initiale en acide succinique ... 67
II.1.2.2. Influence de la masse de catalyseur ... 70
II.1.2.3. Comparaison des performances des trois catalyseurs supportés placés dans le réacteur ... 70
II.2. Influence du mode d’introduction de l’ozone gaz dans le réacteur ... 71
II.2.1. Efficacité de mélange 72 II.2.2. Transfert d’ozone en eau osmosée ... 72
II.2.3. Transfert d’ozone lors de la réaction d’ozonation catalytique ... 74
II.2.4. Consommation d’ozone ... 76
II.3. Influence de la dose d’ozone introduite ... 77
II.3.1. Débits massiques d’ozone de 6,5 et 12,3 g.h-1 ... 77
II.3.2. Débit massique d’ozone = 0 g.h-1 ... 79
II.4. Conclusions ... 80
Chapitre III : Modelling of Heterogeneous Catalytic
Ozonation of Succinic Acid on Metallic Foam
I. Introduction ... 86II. Material and Methods ... 87
III.1. Preliminary validation experiments ... 88
III.1.1. Mixing efficiency ... 88
III.1.2. Ozone concentration ... 90
III.2. Influence of the catalyst location ... 91
III.3. Catalytic ozonation kinetics ... 92
III.3.1. Catalyst weight influence 93 III.3.2. Influence of the initial succinic acid concentration ... 93
III.3.3. General kinetic expression ... 95
III.4. Continuous experiments ... 96
III.5. Mineralization experiments ... 97
IV. Conclusion ... 98
References: ... 99
Chapitre IV : Influence of Reaction Volume on a
Heterogeneous Catalytic Ozonation Process
I. Introduction ... 103II. Material and Methods ... 104
II.1. Material ... 104
II.2. Methods ... 106
III. Results and Discussion ... 106
III.1. Characteristics of initial configuration A ... 106
III.1.1. Residence Time Distribution (RTD) ... 107
III.1.2. Influence of recirculation flowrate on SA removal ... 108
III.2. Influence of Ozone introduction ... 108
III.3. Influence of Hydraulic Retention Time ... 110
III.3.1. Influence of inlet flow rate ... 110
III.3.2. Influence of reaction volume ... 111
III.3.3. Impact on one-through mode devices ... 112
IV. Conclusion ... 113
Chapitre V : Discussion
I. Principaux résultats de ces travaux ... 121I.1. Efficacité du catalyseur supporté par rapport au catalyseur poudre ... 121
I.2. Sous-produits ... 121
I.3. Localisation du catalyseur supporté ... 122
I.4. Modélisation de l’élimination de l’acide succinique ... 122
II. Discussion ... 126
II.1. Mécanisme d’ozonation catalytique hétérogène de l’acide succinique ... 126
II.2. Interprétation des courbes ... 126
II.3. Détermination des paramètres de dimensionnement ... 129
II.3.1. Consommation d’ozone ... 129
II.3.2. Recommandations pour le dimensionnement d’une installation ... 129
Chapitre I : Synthèse Bibliographique
Figure 1 : Structure de résonance de l'ozone (Peleg, 1976) ... 6
Figure 2 : Vitesse de décomposition de l'ozone en fonction de la concentration en H2O2 pour différentes valeurs de pH : Constantes de pseudo 1er ordre (d'après Staehelin et al. 1982)... 8
Figure 3 : Mécanisme de décomposition de l'ozone par le peroxyde d'hydrogène (Doré, 1989) ... 8
Figure 4 : Mécanisme complet de l'ozonation couplée aux UV (Legrini et al., 1993) ... 9
Figure 5 : Cyclo-addition 1,3 dipolaire sur une liaison éthylénique (Bailey, 1978) ... 9
Figure 6 : Substitution électrophile aromatique en série (Bailey, 1982)... 10
Figure 7 : Mécanisme d’oxydation des acides mono-carboxyliques d’après Fontanier et al. (2005) ... 17
Figure 8 : Représentation graphique des stimulations « Impulsion de Dirac » (gauche) et « Echelon de Heaviside » (droite) ... 23
Figure 9 : Réponse du REP à une stimulation « impulsion de Dirac » (gauche) et « Echelon de Heaviside » (droite)... 24
Figure 10 : Réponse du ROPA à une stimulation « impulsion de Dirac » (gauche) et « Echelon de Heaviside » (droite) ... 24
Figure 11 : Concentration en A en fonction de la distance à l’interface; modèle du film ... 29
Figure 12 : Concentration en A en fonction de la distance à l’interface; modèle du double-film ... 29
Figure 13 : Concentration à saturation de l’ozone dans l’eau en fonction de la concentration en phase gazeuse (pression de système = 1 atm) ... 32
Figure 14 : Exemples de mélangeurs statiques à garnissage (gauche, Kenics) et avec éléments hélicoïdaux (droite, Lighnin)... 34
Figure 15 : Représentation schématique de l’interface gaz-liquide selon la théorie du double-film ... 36
Figure 16 : Abaque de Van Krevelen et Hoftijzer (1948) pour une réaction d’ordre deux ... 38
Figure 17 : Facteur d’efficacité en fonction du module de Thiele (Thiele, 1939) ... 41
Chapitre II : Protocole et Résultats Préliminaires Figure 18 : Photographie du pilote 1 L ... 55
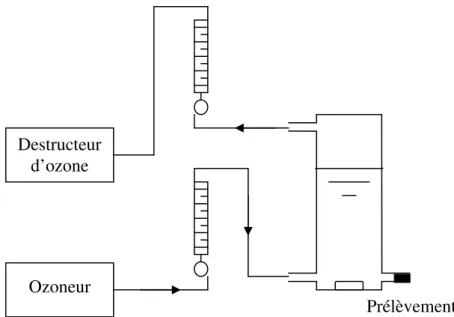
Figure 19 : Schéma du montage expérimental utilisé pour les expériences en ozonation catalytique de volume 1L ... 56
Figure 20 : Schéma du montage expérimental utilisé pour les expériences en ozonation catalytique sur le réacteur de 20 L ... 56
Figure 21 : Photographie du montage expérimental utilisé pour les expériences en ozonation catalytique (réacteur 20 L) ... 57
Figure 22 : Schéma détaillé et photographie du caisson ... 58
Figure 23 : Photographie des catalyseurs C.1. ... 59
Figure 24 : Photographie des catalyseurs C.2. ... 60
Figure 25 : Photographie des catalyseurs C.3. ... 60
Figure 26 : Représentation de la molécule d’acide succinique ... 61
Figure 27 : Réaction du Carmin Indigo avec l'ozone ... 62
Figure 28 : Ozonation seule de l’acide succinique en eau osmosée (pH = 3,6 ± 0,4 ; [O3]ge = 130g.m-3 ; QG =160 L.h-1) ... 64
Figure 30 : Evolution des rapports AS/AS0 (gauche) et COD/COD0 (droite) au cours du
temps, mcata = 1000 mg, [AS]0 = 1 mmol.L-1, qO3 = 1,1 ± 0,03 g.h-1... 65
Figure 31 : Mécanisme de minéralisation de l'acide succinique, d'après Fontanier et al. (2005) ... 66 Figure 32 : Sous-produits de dégradation de l'acide succinique au cours du temps ... 66 Figure 33 : Ozonation catalytique de 0,82 mmol.L-1 d'acide succinique en présence de 1000 mg.L-1 de poudre ou 640 ± 36 mg.L-1 de catalyseur supporté (qO3 = 2,4 g.h-1) ... 67
Figure 34 : Elimination de l’acide succinique au cours du temps pour des concentrations initiales de 0,2 à 50 mmol.L-1 avec le catalyseur C.1., mcata = 1750 mg, qO3 = 20,8 g.h-1... 68
Figure 35 : Elimination de l’acide succinique au cours du temps pour des concentrations initiales de 0,9 à 5,6 mmol.L-1 avec le catalyseur C.2., mcata = 1100 mg, qO3 = 20,8 g.h-1... 68
Figure 36 : Minéralisation de l'acide succinique pour différentes [AS]0 avec le catalyseur C.1.,
mcata = 1750 mg (gauche) et le catalyseur C.2., mcata = 1100 mg (droite), qO3 = 20,8 g.h-1... 69
Figure 37 : Elimination de l’acide succinique en fonction de la masse de catalyseur, C.1. à gauche et C.2. à droite [AS]0 = 4 mmol.L-1 avec qO3 = 20,8 g.h-1... 70
Figure 38 : Ozonation catalytique de l'acide succinique, [AS]0 = 1 mmol.L-1, mcata = 1015 et
1100 mg (C.1. et C.2. respectivement) (gauche) et [AS]0 = 2 mmol.L-1, mcata = 1100 et 1084
mg (C.2. et C.3. respectivment) (droite) ; qO3 = 20,8 g.h-1... 71
Figure 39 : Efficacité du mélange en mode semi-continu, réacteur R.1.A. (gauche) et R.2.B. (droite)... 72 Figure 40 : Concentrations en ozone dissous et gazeux, lors du transfert d’ozone dans le réacteur R.A., dans de l’eau osmosée, [O3]ge = 130g.m-3 et QG =160 L.h-1... 73
Figure 41 : Concentrations en ozone dissous et gazeux, lors du transfert d’ozone dans le réacteur R.B., dans de l’eau osmosée, [O3]ge= 130g.m-3 et QG =160 L.h-1... 74
Figure 42 : Concentrations en ozone dissous et gazeux dans le réacteur R.1.A. (gauche) et R.2.B. (droite) avec [O3]ge= 130g.m-3, QG =160 L.h-1, pHi = 3,9 ± 0,1 ; [AS]0 = 1,45 ± 0,05
mmol.L-1... 75 Figure 43 : Evolution de la concentration d'acide succinique au cours du temps, dans les réacteurs R.1.A. et R.2.B., avec [O3]ge= 130g.m-3, QG =160 L.h-1, pHi = 3,9 ± 0,1 ; [AS]0 =
1,45 ± 0,05 mmol.L-1, pH = 3,9... 75 Figure 44 : Concentrations en ozone dissous et gazeux, avec [O3]ge= 130g.m-3, QG =50 L.h-1 et
[AS]0 = 0,94 mmol.L-1... 77
Figure 45 : Rendement d’élimination de l’acide succinique en fonction du débit massique introduit en mode semi-continu en configuration R.2.B., [AS]0 = 1 mmol.L-1, [O3]Ge = 127 ± 3
g.Nm-3... 78 Figure 46 : Concentration en acide succinique au cours du temps avec [AS]0 = 4,1 mmol.L-1 et
mcata =1100 mg ... 79
Figure 47 : Concentration en ozone dissous, avec [AS]0 = 4,1 mmol.L-1 et mcata = 1100 mg . 80
Chapitre III : Modelling of Heterogeneous Catalytic Ozonation of Succinic Acid on Metallic Foam
Fig. 48: Experimental reactor system with the catalyst located directly in the reactor, or in the recirculation loop. Samples can be drawn from three sampling points and in the treated water tank. ... 87 Fig. 49 : Time-course variations in the dye concentration in the reactor and in the recirculation loop (gas flow rate: 0.16 Nm3 h-1, recirculation flow rate: 120 L h-1)... 89
L h . ... 90 Fig. 51: Catalytic ozonation of SA for different initial concentrations with [O3]g = 130 g Nm-3,
Qg = 160 L h-1. Full symbols: catalyst in the reactor, empty symbols: catalyst in the cartridge.
◊ [SA]0=0.9 mM; x [SA]0=1.3 mM; ∆ [SA]0=4 mM; [SA]0=5.6 mM; o [SA]0=7.7 mM.
Insert : [SA]0=4 mM; A : Qloop=120 L h-1, B : Qloop=120 L h-1, C : Qloop=60 L h-1, D :
Qloop=160 L h-1. ... 91
Fig. 52: Time-course variations in succinic acid volumes with [SA]0 = 1 mmol L-1. Insert:
Rate constant against the catalyst concentration with [SA]0 = 1 mmol L-1;(A = 360 mg L-1; B
= 180 mg L-1; C = 109 mg L-1; D = 98 mg L-1; E = 67 mg L-1 et F = 20 mg L-1). ... 93 Fig. 53: Pseudo zero order rate for SA removal by catalytic ozonation for different initial SA concentrations ([catalyst] = 64.7 and 20.3 mg L-1); Right scale: SA removed for 90 min reaction time... 94 Fig. 54: Experimental rate versus modelled rate of catalytic ozonation of succinic acid
[catalyst] = 20.3 and 64.7 mg L-1, [SA]0 = 1 to 10 mmol L-1... 96
Fig. 55: Comparison between succinic acid removal and mineralization during catalytic ozonation in continuous or semi-continuous mode ([catalyst] = 64.7 mg L-1) ... 97
Chapitre IV : Influence of Reaction Volume on a Heterogeneous Catalytic Ozonation Process
Figure 56 : Catalytic heterogeneous ozonation pilot with gaseous ozone introduced by the diffuser in the reactor (A) or upstream the cartridge (B) ... 104 Figure 57: Cartridge containing the catalyst disks (Bed volume = 19 mL) ... 105 Figure 58 : Residence Time Distribution, sampling points at outlet (5), after the cartridge (3) and in the reactor (2) (numbers are from Figure 56), operating conditions V=17 L, Qinlet = 10
L.h-1, Qloop = 120 or 10 L.h-1... 107
Figure 59 : SA removal according to the recirculation flow rate, [AS]0 = 3 mmol.L-1, QG =
0.16 Nm3.h-1, [O3]G = 130 g.Nm-3 [catalyst] = 64.7 mg.L-1. ... 108
Figure 60 : Dissolved ozone concentration after the cartridge, according the place where ozone gas was introduced ( Qloop = 120 L.h-1, QG = 0.16 Nm3.h-1, [O3]G = 130 g.Nm-3), t = 0
starting of O3 introduction... 109
Figure 61 : Rate for the different catalyst concentrations tested; [SA]0=1 mmol.L-1; inlet
flowrate : 10 L.h-1 = empty symbols; 20 L.h-1 = full symbols, QG = 0.16 Nm3.h-1, [O3]G = 130
g.Nm-3... 111 Figure 62 : SA removal in configuration B as a function of Volume ([SA]0 = 1mmol.L-1),
empty symbols : Qi = 10 L.h-1, full symbols : Qi = 20 L.h-1, QG = 0.16 Nm3.h-1, [O3]G = 130
g.Nm-3... 112 Chapitre V : Discussion
Figure 63 : Mécanismes d'ozonation catalytique ... 120 Figure 64 : Mécanisme classique de catalyse hétérogène ... 122 Figure 65 : Pourcentage d'élimination de l'acide succinique au cours du temps, réacteur
R.1.A., Q = 160 L.h-1, [O3] = 130 g.Nm-1, [cata] = 64,7 mg... 124
Figure 66 : Proposition de mécanisme d'ozonation catalytique hétérogène de l'acide
= 17 L ... 127 Figure 68 : Vitesse d'élimination de l'AS (µmol.min-1.L-1)/concentration en catalyseur (mg.L
-1) en fonction du volume de solution (L), mode continu, [AS]
0 = 1 mmol.L-1 (♦ : Qalim = 10
Introduction générale
L’augmentation de la sévérité des réglementations en matière de rejets industriels ou urbains dans l’environnement a conduit au développement de procédés de plus en plus performants en vue de dégrader les polluants présents dans ces effluents.
Ces procédés sont de plusieurs sortes, physiques (séparation par membranes, décantation, coagulation-floculation…), chimiques (traitements thermiques, oxydation…) ou biologiques (boues activées, digestion…). Parmi les procédés chimiques, les procédés d’oxydation occupent une place importante, que ce soit pour la désinfection ou l’élimination de molécules dissoutes. Les oxydants généralement utilisés sont le dioxyde de chlore, l’ozone, le permanganate de potassium, le peroxyde d’hydrogène…
En particulier l’ozone peut être utilisé pour la désinfection grâce à son fort pouvoir bactéricide, et pour l’oxydation grâce à son potentiel standard d’oxydo-réduction élevé. Il peut également être couplé à des espèces dissoutes ou solides qui jouent un rôle de catalyseur pour la dégradation d’espèces réfractaires. Il s’agit alors d’ozonation catalytique, procédé qui sera étudié dans la suite de ce travail.
A la suite d’essais réalisés dans un réacteur de laboratoire de volume 1 L, un brevet du CNRS est déposé sur l’utilisation d’un catalyseur sous forme de poudre pour l’ozonation des polluants en 2001. L’année suivante un pilote de 20 L muni d’une boucle de recirculation contenant une membrane pour séparer le catalyseur de l’effluent traité est mis en œuvre à la Plate-forme Eau du laboratoire de l’équipe Eau Géochimie Santé. Ce pilote semi-industriel, muni d’un diffuseur d’ozone non-optimisé (diamètre des bulles de plusieurs millimètres), d’une turbine, d’une cuve et d’une pompe d’alimentation, permet de traiter en continu des effluents réels.
En 2004, l’entreprise Technavox, bureau d’études-conception spécialisé en ozonation catalytique pour le traitement des eaux usées industrielles, est créée. Une unité mobile de traitement sur site (pilote 300 L) ainsi qu’une unité de traitement des saumures d’olives sont mises en œuvre. En 2007, SEREP, spécialiste du traitement des eaux usées industrielles entre au capital de Technavox qui installe l’année suivante une unité de traitement d’effluents cosmétiques.
Des travaux de recherche et développement sont ensuite effectués dans l’objectif de déposer le catalyseur poudre sur un support, fixe au sein du système, ce qui permettrait d’une part d’élargir la gamme d’effluents pouvant être traités par ce procédé (en termes de matières en suspension) et d’autre part de s’affranchir de l’étape de séparation par membrane.
C’est à ce stade qu’intervient cette thèse CIFRE, démarrée en 2011 avec pour objectif la mise en œuvre de ce catalyseur supporté nouvellement mis au point. Pour cela, trois étapes sont définies. L’efficacité du catalyseur supportée est tout d’abord évaluée en fonction des supports et par rapport au catalyseur poudre. Le pilote 20 L existant est ensuite modifié afin de permettre et d’optimiser l’utilisation du catalyseur supporté. Les expériences menées par la suite dans ce pilote auront pour but de modéliser l’élimination d’une molécule modèle, l’acide succinique, réfractaire à l’ozonation seule, par ozonation catalytique afin de prédire l’efficacité du procédé pour différentes conditions opératoires, en particulier, la concentration initiale d’acide succinique, la concentration de catalyseur et le débit à traiter. Ces données
permettront par la suite le dimensionnement d’un nouveau pilote adapté au catalyseur supporté, ce qui est l’objectif principal de cette thèse.
Une synthèse des connaissances sur l’ozonation catalytique en phase liquide, la modélisation des réacteurs et le transfert gaz-liquide sera présentée dans le premier chapitre. Les différents réacteurs utilisés au cours de ce travail ainsi que les protocoles d’analyses seront exposés dans une première partie du deuxième chapitre. La seconde partie de ce chapitre exposera les résultats préliminaires obtenus lors de l’étude de l’ozonation catalytique hétérogène de l’acide succinique dans les réacteurs 1 L et 20 L, l’identification des sous-produits de réaction, l’évaluation du transfert gaz-liquide et la mesure de la consommation d’ozone.
Les deux chapitres suivants correspondent à deux articles en langue anglaise. Le premier porte sur l’influence de la localisation du catalyseur dans le système et la modélisation de l’élimination de l’acide succinique. Le deuxième article est quant à lui dédié à l’influence du volume réactionnel sur l’efficacité de la réaction. Les résultats présentés dans cet article confirment d’une part ceux du premier article et d’autre part mettent en évidence l’existence d’un volume critique en dessous duquel l’efficacité de la réaction est affectée.
Le dernier chapitre est une discussion portant sur l’ensemble des résultats de la thèse. Un mécanisme complet de l’ozonation catalytique de l’acide succinique en trois étapes y est proposé et des recommandations pour le dimensionnement d’installations pilotes industrielles y sont faites.
CHAPITRE I
CHAPITRE I : Synthèse Bibliographique
I. L’ozonation
I.1. Chimie de l’ozone
L’ozone a été découvert en 1840 par C.F. Schobein et 23 ans plus tard sa structure a été proposée par Thomas Andrews. Il s’agit d’un allotrope triatomique d’oxygène, présent sous forme gazeuse à température et pression ambiante. Il est instable et se décompose en oxygène. En phase aqueuse, cette molécule peut être décrite comme un hybride de résonance entre les formes limite présentées en Figure 1.
Figure 1 : Structure de résonance de l'ozone (Peleg, 1976)
L’ozone en phase aqueuse peut réagir comme un dipôle, une espèce électrophile ou une espèce nucléophile, ce qui explique que sa demi-vie ne soit que de quelques secondes à quelques minutes en fonction du pH, de la température de l’eau, mais aussi de la concentration des autres composés (organiques et inorganiques). C’est un agent oxydant très puissant pouvant réagir avec les molécules dissoutes par de nombreux mécanismes réactionnels.
Tableau 1 : Caractéristiques de l'ozone
Caractéristiques Valeurs
Masse molaire 47,998 g.mol-1
Apparence Gaz bleu pâle
Masse volumique à 0°C et 1 atm 2,14 kgO3.m-3
Densité 1,7
Solubilité dans l’eau à 20 °C 570 mg.L-1
Température critique -12,1°C
Pression critique 54,6 bar
Point de fusion -197,2°C
Point d’ébullition -119,5°C
Potentiel standard d’oxydo-réduction 2,076 V
Limite de détection olfactive 0,01 à 0,05 ppm Enthalpie standard de formation 142,3 kJ.mol-1 Dose Létale médiane (souris) CL50 4 à 6 ppm
Dose entraînant un œdème pulmonaire 9 ppm
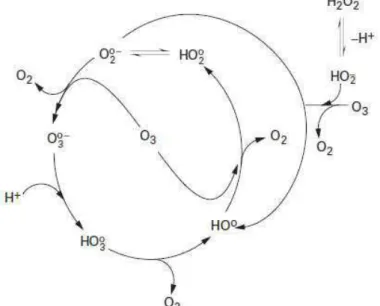
Dans l’eau pure, l’ozone se décompose en radicaux hydroxyles par une réaction en chaîne initiée par les ions hydroxyde dont les étapes et les constantes de vitesse sont les suivantes : Initiation :
− − → °+ ° + 2 2 3 HO HO O O k = 70 L.mol-1.s-1 + −+ ° ↔ ° O H HO2 2 pKa = 4,8 Propagation : 2 3 2 3 O O O O + °− → °−+ k = 1,6.109 L.mol-1.s-1 ° ↔ + °− + 3 3 H HO O k = 5,2.1010 L.mol-1.s-1 2 3 OH O HO °→ °+ k = 1,4.105 L.mol-1.s-1 ° → + ° O3 HO4 OH k = 2,0.109 L.mol-1.s-1 2 2 4 HO O HO °→ °+ k = 2,8.104 L.mol-1.s-1 Terminaison : 3 2 2 2 4 HO H O O O HO °+ °→ + + k = 1010 L.mol-1.s-1
Les réactions impliquées sont du premier ordre par rapport aux réactifs et les constantes de vitesse sont extraites de Staehelin et al. (1984).
Certains substrats présents dans les eaux réagissent avec les radicaux OH° et forment également des espèces radicalaires, mais dont la réactivité est faible. Ces substrats sont appelés pièges à radicaux et entraînent généralement la fin de l’étape de propagation. Ce sont en particulier, le tert-butanol, les alkyl-(R) et les (hydrogéno)carbonate (HCO3-/CO32-). Ces
substrats peuvent donc servir à des fins cinétiques pour inhiber la réaction de décomposition et stabiliser l’ozone.
I.2. Réactivité de l’ozone
En solution aqueuse, l’ozone peut réagir avec les espèces présentes selon deux voies. L’oxydation par l’ozone moléculaire constitue la voie directe alors que l’oxydation par les radicaux OH° issus de la décomposition de l’ozone est la voie indirecte. Ces radicaux ont des potentiels standards d’oxydoréduction plus élevés que l’ozone moléculaire et sont moins sélectifs.
L’oxydation par l’ozone moléculaire est la voie majoritaire à pH acide (inférieur à 3). C’est une réaction très sélective qui touche principalement les composés organiques insaturés, des composés inorganiques et certains composés aminés.
L’oxydation par les espèces issues de la décomposition de l’ozone, principalement les radicaux hydroxyles OH° (E° = + 2,7 V, Buxton et al., 1988) concerne les hydrocarbures aromatiques, les composés insaturés, les alcools aliphatiques et d’autres composés (Hoigné et Bader, 1976).
L’étape d’initiation présentée dans le paragraphe I.1.1. implique les ions hydroxyde, elle est donc d’autant plus importante que le pH de la solution est élevé. Néanmoins, il existe d’autres façons de promouvoir cette décomposition, notamment par la présence d’ions peroxyde issus du peroxyde d’hydrogène ou par la photolyse par rayonnement UV.
I.2.1. Activation par le peroxyde d’hydrogène
A partir de pH = 5, l’ajout dans la solution de peroxyde d’hydrogène accélère fortement la réaction de décomposition de l’ozone, comme le présente la Figure 2.
+ − + ↔ +H O HO H O O H2 2 2 2 3 pKa = 11,8 2 2 3 2 O O HO O
HO−+ → °− + °+ k = 2,8.106 L.mol-1.s-1 (Staehelin et al., 1982)
Par la suite, les anions radicaux O2°- décomposent l’ozone en radicaux hydroxyles par les
réactions suivantes : 2 3 3 2 O O O O °−+ → °− + ° ↔ + °− + 3 3 H HO O 2 3 OH O HO °→ °+
Figure 2 : Vitesse de décomposition de l'ozone en fonction de la concentration en H2O2 pour différentes
valeurs de pH : Constantes de pseudo 1er ordre (d'après Staehelin et al. 1982)
Le taux de décomposition de l’ozone en radicaux hydroxyles dépend à la fois de la concentration en peroxyde d’hydrogène, du pH, de la quantité d’anion radical superoxyde (O2°-) libérés par les promoteurs organiques oxydés par les radicaux hydroxyles et de la
quantité de pièges à radicaux présents.
Figure 3 : Mécanisme de décomposition de l'ozone par le peroxyde d'hydrogène (Doré, 1989) 0,0E+00 5,0E-03 1,0E-02 1,5E-02 0 2 H 4 6 2O2 (m M) kO H 2 ( s -1) pH = 5,0 pH = 5,3 pH = 5,6 pH = 6,0
I.2.2. Activation par les rayonnements UV
En solution aqueuse, le maximum d’absorbance des rayons UV par l’ozone est observé à 253,7 nm. La photolyse de l’ozone produit du peroxyde d’hydrogène selon la réaction suivante : 2 2 2 2 3 H O O H O O + →hν + ° → OH O
H2 2 2 photolyse directe du peroxyde d’hydrogène
2 2
3
2 O O OH O
HO−+ → °− + °+ réaction entre l’ozone et l’ion peroxyde
Figure 4 : Mécanisme complet de l'ozonation couplée aux UV (Legrini et al., 1993)
I.2.3. Mécanismes d’action de l’ozone
L’ozone étant un dipôle, il peut agir sur les doubles liaisons C=C par un mécanisme de cyclo-addition 1,3 dipolaire présenté sur la Figure 5 . Sur des composés aromatiques, cette cyclo-addition se traduit par une ouverture du cycle.
Figure 5 : Cyclo-addition 1,3 dipolaire sur une liaison éthylénique (Bailey, 1978)
Dans le cas des alcools, éthers et aldéhydes, le caractère dipolaire de l’ozone va permettre une insertion 1,3 dipolaire sur une liaison C–H en position α par rapport au groupement fonctionnel à effet électrodonneur. Les alcools primaires vont ainsi donner des aldéhydes par élimination d’oxygène ou des acides carboxyliques par élimination de peroxyde d’hydrogène. Les aldéhydes vont également former des acides carboxyliques par élimination d’oxygène. Il n’y a pas d’activation des liaisons C–H dans le cas des alcanes. Quant aux liaisons C–H en α
de groupements électroattracteurs de composés tels que les sulfones, cétones et acides carboxyliques, elles sont désactivées vis-à-vis de l’insertion 1,3 dipolaire, en conséquence les composés cités sont quasiment inertes à l’ozone.
Le caractère électrophile de l’ozone lui permet également de réagir avec des molécules possédant des sites à forte densité électronique telles que les composés aromatiques possédant un substituant électrodonneur (–OH, –NH2, –OCH3…), les amines et les mercaptans. Les
cycles aromatiques peuvent subir une substitution sur les atomes de carbone situés en ortho et para des substituants. (Figure 6)
Figure 6 : Substitution électrophile aromatique en série (Bailey, 1982)
Les sous-produits obtenus sont des composés hydroxylés très réactifs vis-à-vis d’une ozonation ultérieure pour donner, par ouverture du cycle aromatique des aldéhydes, des cétones et des acides carboxyliques.
II. L’ozonation catalytique
La réaction d’ozonation peut être améliorée par la présence d’un catalyseur. Il existe deux types de catalyseurs permettant d’améliorer ou d’accélérer l’oxydation des composés à dégrader par l’ozone, les catalyseurs homogènes, généralement des sels métalliques dissous dans la solution et les catalyseurs hétérogènes, sous forme solide. Ces deux types de catalyseurs seront présentés dans les deux paragraphes suivants.
II.1. L’ozonation catalytique homogène
De nombreux chercheurs se sont intéressés à l’influence de l’ajout d’ions métalliques lors de l’ozonation de solutions contenant des composés à éliminer. Plusieurs ions métalliques ont été étudiés, le manganèse, le cuivre, le nickel, le cobalt, le magnésium et le fer. De manière générale, l’ajout d’un ou plusieurs de ces ions dans une solution de molécules à ozoner, permet une élimination plus importante de ces molécules. L’augmentation de cette élimination suite à l’ajout de ces ions est variable et dépend de l’ion utilisé et de sa concentration, de la nature du composé à éliminer et de sa concentration, du pH, de la force ionique, etc.
Les ions Mn2+, Ti2+ et Co2+, sont généralement considérés comme les plus efficaces (Gracia et al., 1996, Cortès et al., 2000, Abd El-Raady et al., 2005 a,b, Trapido et al., 2005, Carbajo et al., 2006), bien que de bons résultats puissent aussi être obtenus avec du cuivre (Pi et al., 2003) ou du magnésium (Sui et al., 2010). Les molécules à éliminer peuvent être réfractaires à l’ozonation seule, comme l’acide oxalique ou dégradables mais faiblement minéralisables. L’élimination d’acide oxalique par ozonation catalytique homogène a été étudiée par Abd El-Raady et al. (2005) en présence de différents catalyseurs tels que le cobalt (Co2+) et le manganèse (Mn2+) qui permirent d’obtenir les meilleurs taux de minéralisation (100 et 80%). Les mécanismes proposés pour ces deux catalyseurs sont les suivants
+ + → 3 2 3 Mn Mn O
(
−)
+ − − + → +° + − 2 4 2 4 2 2 2 4 2 3 ( 1) O C n O C Mn O C Mn n Andreozzi et al. (1992) ° + + → + + ° − + OH O CO H O O C2 4 3 2 2 2 pH = 4,7 O H H CO CO H OH O C2 42− + °+2 + → 2+° 2 + 2Dans ce dernier mécanisme, la contribution de OH° et O2, les autres oxydants présents dans le
milieu, a été démontrée par le fait que la consommation d’ozone est inférieure à la stoechiométrie. Le catalyseur subit d’abord une réaction d’oxydoréduction avec l’ozone puis le complexe formé libère des radicaux oxalate (°C2O4-). Ces radicaux permettent la formation
de radicaux OH° peu sélectifs qui dégradent ensuite l’oxalate en CO2. Le manganèse quant à
lui revient à son état d’oxydation initial lors de la création des radicaux oxalate.
4 2 2 4 2 2 O CoC O C Co + + − ↔ − + + → + 3 2 4 3 4 2O O CoC O O CoC − + + → +° 4 2 2 4 2O Co C O
CoC Pines et Reckhow (2002)
− − + → + °C2O4 O3 2CO2 O3 pH = 6 − −+ °→ + °C2O4 OH 2CO2 OH − − + → + °C2O4 O2 2CO2 O2
Dans le cas du cobalt, le mécanisme proposé par Pines et Reckhow (2002) à pH = 6 débute par la formation d’un complexe entre le cobalt et l’oxalate qui se décompose en cobalt libre et radicaux oxalate sous l’action de l’ozone. Ces radicaux oxalate peuvent ensuite être dégradés en CO2 par les différents oxydants présents dans la solution, ozone moléculaire, radicaux
hydroxyles ou oxygène.
Dans le cas de la catalyse par le fer, c’est un autre mécanisme qui a été mis en évidence par Sauleda et Brillas (2001). Il n’y a pas formation de complexe avec la molécule à dégrader mais oxydation du fer par l’ozone pour créer des radicaux hydroxyles, qui seront alors responsables de l’élimination de la molécule cible.
2 2 3 2 O FeO O Fe + + → + + − + + + → + °+ OH OH Fe O H FeO2 2 3
Selon Gracia et al. (1996), l’ozonation catalytique d’acides humiques se ferait par un mécanisme identique à celui de l’ozonation seule (directe ou indirecte) car les mêmes sous-produits ont pu être détectés dans les deux cas. En revanche, la libération de radicaux hydroxyles par réaction entre l’ozone moléculaire et les ions métalliques (Mn2+) permet une minéralisation plus importante des sous-produits formés (majoritairement des acides carboxyliques, des hydrocarbures aromatiques, des aldéhydes, des cétones et des furane-acides carboxyliques).
Néanmoins, ces trois catalyseurs (manganèse, cobalt et fer) utilisés par d’autres groupes de chercheurs peuvent ne démontrer aucune ou uniquement une faible activité catalytique, rendant incertains ou incomplets les mécanismes cités ci-dessus.
II.2. L’ozonation catalytique hétérogène
Dans l’optique d’une utilisation à l’échelle industrielle, la catalyse homogène présente comme inconvénient que le catalyseur se trouve dissous dans la phase liquide, et ne peut donc être facilement récupéré à l’issue de la réaction.
La catalyse hétérogène permet de pallier à cet inconvénient en utilisant des catalyseurs solides. Ces catalyseurs peuvent être constitués des ions métalliques cités plus haut déposés sur des supports (alumines, zéolithes, gel de silice…), de métaux sous forme solide, de charbon actif, de perovskite, etc.
Différentes catégories de composés ont été soumises à l’ozonation catalytique hétérogène depuis la fin des années 1990, soit pour augmenter la vitesse de conversion, soit pour éliminer des composés réfractaires. Seuls certains points importants relatifs à l’ozonation catalytique seront présentés dans les paragraphes suivants.
De manière générale, et comme dans le cas de la catalyse homogène, l’addition d’un catalyseur solide dans le système permet d’améliorer les rendements d’élimination des molécules cibles, soit en augmentant la vitesse de dégradation pour des composés déjà oxydables par l’ozone seul, soit en dégradant des composés réfractaires à l’ozonation seule. L’ozonation catalytique peut aussi être utilisée pour améliorer la minéralisation de certains composés même si elle n’accélère pas leur vitesse de dégradation.
Les différentes équipes de recherche sur l’ozonation catalytique se sont penchées en particulier sur certains composés modèles comme l’acide oxalique (réfractaire à l’ozonation seule et sous-produit de nombreuses réactions d’oxydation), le diméthylphthalate (polluant industriel majeur), le phénol (composé CME non biodégradable), le nitrobenzène
(intermédiaire de la synthèse de pesticides, colorants et médicaments) et l’acide para-chlorobenzoïque (non biodégradable et bio-accumulable).
En termes de catalyseurs, des recherches récentes semblent s’orienter vers des matériaux structurés tels que les nanotubes de carbone, les MCM (Mobil Composition of Matter); les nids d’abeilles en céramiques ou même des membranes céramiques sur lesquelles des métaux ont été déposés. Cette nouvelle technique permet de limiter le colmatage membranaire par la matière organique en la dégradant par ozonation catalytique, ceci afin de conserver des flux de perméats constants au cours du temps (Corneal et al., 2011 et Zhu et al., 2011) ou d’oxyder certaines espèces en espèces plus facilement retenues par la membrane (Park et al., 2011). De manière générale, il ressort de ces différentes études que chaque famille de polluant peut être dégradée de manière optimale par certains types de catalyseur dans des conditions opératoires données et que les résultats obtenus, tant en termes de rendement d’élimination, de vitesse de réaction que de taux de minéralisation ne sont pas directement transposables à d’autres molécules. Les équipes de chercheurs se sont attachées à déterminer :
- les compositions optimales de catalyseur (en termes de types de métaux, de support, mais aussi de conditions de fabrication),
- les cinétiques réactionnelles en prenant en compte plusieurs paramètres, pH, part de réaction liée à l’ozone ou aux radicaux hydroxyles, part de réaction catalytique et non catalytique, part de réaction liée à la catalyse homogène et hétérogène, part de réaction liée à l’adsorption, concentration en ozone dissous, concentration en catalyseur,
- les mécanismes réactionnels spécifiques de l’ozonation catalytique en tachant de démontrer l’adsorption ou non de l’ozone, de la molécule à traiter, l’influence de la présence de piège à radicaux ou la stœchiométrie ou non du ratio molaire d’ozone consommé par molécule minéralisée,
- les sous-produits formés afin de déterminer s’ils sont plus toxiques que les polluants initiaux et si le mécanisme réactionnel est identique à celui en ozonation seule.
Néanmoins la diversité des conditions opératoires utilisées : type et quantité de catalyseur, type et concentration de molécules cibles, débit et concentration d’ozone gazeux et type de réacteur (cuve agitée, colonne à bulle, batch ou continu) rendent difficile des comparaisons entre ces différentes recherches issues de la littérature.
II.2.1. Mécanismes de l’ozonation catalytique hétérogène
Trois mécanismes ont été proposés dans la littérature pour expliquer le principe de l’ozonation catalytique, sans que l’un d’entre eux ne prédomine sur les autres. Ils sont présentés dans le tableau suivant.
Tableau 2 : Principaux mécanismes proposés pour la réaction d’ozonation catalytique
Mécanisme Référence P A Ox S Ox S Ox S Ox S O → + + → − − → + 3 (1)
Legube et al. (2002), Pines et Reckhow (2003), Park et al. (2004), Yang et al. (2009)
S P S P S P A S Ox S Ox S O + → − − → + − − → + 3 (2)
Ping et al. (2002), Baig et al. (2003), Pullabhotla et al. (2008)
S P S P S P S A S O S A S A S O S O + → − − → − + − − → + − → + 3 3 3 (3)
Logemann et Annee (1997), Gracia et al. (2000), Beltràn et al. (2002), Udrea et Bradu (2003), Beltràn et al. (2009)a
Avec Ox : radicaux hydroxyles, ions superoxyde, ion ozonide… A : un réactif
P : un produit
S : un site du catalyseur
Il s’agit en fait de déterminer si l’ajout d’un catalyseur lors de la réaction d’ozonation permet d’accélérer la décomposition de l’ozone en espèces plus réactives, dont notamment les radicaux hydroxyles qui, à leur tour vont dégrader les molécules à éliminer ou si les mécanismes mis en jeu lors de l’ozonation catalytique sont différents de ceux de l’ozonation seule. Dans le cas du mécanisme (1), l’ozone est transféré du gaz vers le liquide puis du liquide vers le catalyseur où sa décomposition est une réaction hétérogène liquide-solide. Les radicaux formés réagissent eux de manière homogène avec les molécules en solution. Dans les cas des mécanismes (2) et (3), la réaction est hétérogène puisqu’elle a lieu à la surface du catalyseur, que la molécule à traiter y soit fixée aussi ou non.
Il est relativement aisé de démontrer l’existence du premier mécanisme. En effet, dans ce cas, l’ajout de pièges à radicaux conduit à une forte diminution du rendement d’élimination, signe que les espèces oxydantes formées ne sont pas restées à la surface du catalyseur mais ont été libérées au sein du liquide. De même, ce type de mécanisme se caractérise par une diminution de la quantité d’ozone dissous et une augmentation de la consommation d’ozone (Park et al., 2004 et Yang et al., 2009). Dans le cas de l’ozonation de l’acide succinique en présence d’un catalyseur Ru-CeO2-TiO2, Legube et al. (2002) ont montré qu’en changeant les proportions de
ruthénium dans le catalyseur, l’efficacité du procédé était influencée. Le ruthénium réduit pouvant décomposer l’ozone en espèces oxydantes plus actives, ils en ont déduit que le ruthénium réduit présent à la surface du catalyseur en constituait les sites actifs. L’étude cinétique de la décomposition de l’ozone moléculaire a permis à Pines et Reckhow (2003) de démontrer que cette décomposition se faisait à la surface du catalyseur car la cinétique d’ordre zéro est généralement liée à une limitation par les sites actifs. La molécule modèle utilisée dans ce cas était l’acide para-chlorobenzoïque et le catalyseur du ruthénium réduit déposé sur une alumine.
Le mécanisme (2) se caractérise par l’adsorption de la molécule d’ozone sur le catalyseur pour former une espèce oxydante plus puissante qui oxydera la molécule à traiter à la surface du catalyseur. Les hypothèses en faveur de ce mécanisme sont proposées par Baig et al. (2003) et Ping et al. (2002). Les doses d’ozone requises pour éliminer la même quantité de polluant étant plus limitée en ozonation catalytique (Baig et al. 2003), ce n’est donc pas une génération de radicaux hydroxyles qui peut expliquer l’amélioration de l’efficacité du procédé. De plus, le fait qu’il faille la même quantité d’ozone pour abattre des composés très différents avec des vitesses de réaction très différentes témoigne en faveur d’un mécanisme en deux étapes. Pour Ping et al. (2002), l’ozonation catalytique de l’acide sulfosalicylique en présence de vanadium déposé sur un gel de silice doit se produire à la surface du catalyseur, soit par des radicaux hydroxyles soit par des liaisons oxygène de surface puisque l’ajout de pièges à radicaux ne produit pas de diminution de l’efficacité du système et l’acide sulfosalycilique ne montrant pas par ailleurs de capacités d’adsorption à la surface du catalyseur.
Enfin, le mécanisme (3) qui correspond à l’adsorption de l’ozone et de la molécule à traiter et à une réaction d’oxydation à la surface du catalyseur a été mis en évidence par Logemann et Annee (1997), Gracia et al. (2000) et Udrea et Bradu (2003). En faisant varier la température, le pH ou la concentration en pièges à radicaux, ils n’ont pas mis en évidence de différences sur l’efficacité de la réaction ce qui indique qu’il n’y a pas libération de radicaux hydroxyles ni de réaction au sein du liquide. De plus dans le cas de ces trois études, le catalyseur présentant des capacités d’adsorption de l’ozone ou des polluants, il a été conclu à une adsorption simultanée de l’ozone et des polluants.
En conclusion, il semble y avoir d’une part un mécanisme classique de procédé avancé d’oxydation qui consiste en une augmentation de quantité de radicaux hydroxyles libérés dans la solution. Ce mécanisme conduit à des intermédiaires réactionnels identiques à ceux observés en ozonation seule et peut être mis en évidence par une diminution de l’efficacité de la réaction en présence de pièges à radicaux. D’autre part, un deuxième mécanisme différent de celui de l’ozonation a été mis en évidence, mais les auteurs n’ont pas réussi à trancher quand à l’adsorption simultanée du polluant et de l’ozone. Ces différents mécanismes pourraient coexister et dépendre de la nature du catalyseur et des molécules cibles.
II.2.2. Consommation d’ozone
Un avantage de l’ozonation catalytique, qu’elle soit homogène ou hétérogène est qu’elle engendre souvent une diminution de la consommation d’ozone. Udrea et Bradu (2003) ont observé une diminution de 2 à 2,5 fois de la dose d’ozone introduite nécessaire pour obtenir un rendement donné lorsque qu’un catalyseur (Cu-Al2O3) est introduit dans le système
réactionnel. De même, l’ajout de Al2O3 lors de l’ozonation d’acides humiques permet de
diminuer la consommation d’ozone de 2,3 à 3,4 fois (Kasprzyk-Hordern et al. 2006). Une diminution de 45% de la consommation d’ozone a également été notée par Moussavi et al. (2012) lors de l’ozonation d’un colorant (RR-120) en présence de magnétite. Beltràn et al. (2009) ont noté une diminution de la consommation d’ozone lors de l’oxydation de sulfomethoxazole en présence de certains types de catalyseurs, commerciaux ou non.
En revanche, certaines conditions opératoires (type de catalyseur, type de susbstrat...) semblent provoquer une augmentation de la consommation d’ozone, comme l’indiquent Rivera-Utrilla et al. (2012) au cours de leurs recherches sur l’ozonation catalytique de sodium dodecylbenzenesulfonate avec des perovskites.
II.2.3. Pertes de métaux
Lors de la réaction d’ozonation catalytique hétérogène en présence d’oxydes métalliques, libres ou déposés sur des supports, il n’est pas rare, selon les conditions opératoires, de déceler une dissolution de ces métaux dans la phase liquide, ce qui engendre alors des pertes d’activité catalytique hétérogène, non compensées par une activité catalytique homogène de ces métaux dissous. Ces relargages, en proportions plus ou moins importantes ont été relevés par de nombreux auteurs tels que Shiraga et al. (2006), Rivas et al. (2006), Alvarez et al. (2007), Yalfani et al. (2011) et Bing et al. (2012).
II.2.4. Procédés industriels mettant en œuvre la catalyse hétérogène pour l’ozonation Il existe 5 procédés d’ozonation catalytique brevetés ou commercialisés en Europe, ils seront détaillés en fonction de leurs caractéristiques dans les parties suivantes. Ils sont rassemblés dans le tableau suivant :
Tableau 3 : Références des procédés commerciaux d’ozonation catalytique
Société Procédé Références
Degrémont
(France) TOCCATA
Brevet n° PCT/FR00/02955 (2000) Baig et Petitpain (2003)
Fontanier, Baig, Albet et Molinier (2004)
Fontanier, Farines, Albet, Baig et Molinier (2005) Fontanier, Farines, Albet, Baig et Molinier (2006) OTV
(France)
CATAZONE Allemane, Delouane, Paillard et Legube (1993) Brevet Français n° 94 13100 (1994)
Brevet Français n° 95 03383 (1995) Bigot, Luck, Paillard et Wagner (1995)* Djafer et Luck (1998)*
Brevet n° PCT/FR00/00019 (2000) Air Product
(Royaume Uni)
CHEMOX-Cat Barratt et Xiong (1995)
Barratt, Baumgartl, Hannay, Vetter et Xiong (1997) Brevet n° WO 97/14657 (1997)
Eco Purification System
(Pays-Bas)
ECOCLEAR Kaptijn, Plugge et Annee (1995) Logemann et Annee (1997) Kaptijn (1997)
Steensen (1997)
Technavox O.C. Brevet n° WO 03/064333 (2003)
Bui Quang (2009) Abdelli (2013) * Le nom « catazone » n’est pas cité dans le texte
Ces procédés commerciaux d’ozonation catalytique sont basés sur l’utilisation de catalyseurs différents, rassemblés dans le tableau suivant :
Tableau 4 : Catalyseurs utilisés dans les autres procédés
Procédé Catalyseur (%)
TOCCATA Poudre d’oxydes métalliques
composée de grains de 100 à 300 µm
CATAZONE TiO2 sous forme de pastilles
cylindriques de 2,8 mm sur 3,5 mm ou Cu déposé sur des alumines de types CK3S CHEMOX-Cat α et γ alumine sous forme de
« mousse monolithique »
ECOCLEAR Charbon Actif
O.C. Poudre d’oxydes métalliques
composée de grains de 2 à 100 µm
Un large panel de molécules modèles a été traité à l’aide de ces procédés d’ozonation catalytique.
L’étude la plus complète a concerné l’ozonation catalytique par le procédé TOCCATA de 30 molécules modèles, provenant de plusieurs classes chimiques :
- Acides carboxyliques : Acides acétique, propionique, butyrique, hexanoique, oxalique, succinique, dichloroacétique, chloroacétique, lactique, (p)-toluène sulfonique;
- Composés Phénolés : phénol, chlorophénol, guaiacol, trichlorophénol, syringaldéhyde, vaniline, catéchol;
- Amines : pyridine, glycine, triéthanolamine, EDTA, DTPA (Acide Diéthylène Triamine Penta-acétique)
- Carbohydrates : glucose, galactose, arabinose, xylose, mannose;
Pour toutes ces molécules modèles, une cinétique du premier ordre par rapport au COT a été observée. Seul le cas des acides carboxyliques, correspondants aux molécules traitées dans cette étude, sera détaillé. Sur les 10 acides testés (mentionnés ci-dessus), les 6 premiers sont réfractaires à l’ozonation et les 4 autres peu réactifs (5 % de COT éliminé en 2 heures pour l’acide chloroacétique, 1,4 % de DCO (0% de COT) éliminé en 2 heures pour l’acide lactique et 43 % de COT éliminés en 5 heures pour l’acide sulfonique-(p)-toluène). Deux mécanismes de minéralisation ont été proposés pour ces acides, selon qu’ils sont mono ou di-carboxylique. Dans le cas des acides mono-carboxyliques aliphatiques (acides acétique, propionique, butyrique, hexanoïque et lactique), la constante de vitesse d’élimination du COT est très proche pour les quatre derniers (entre 3,7 et 4,0.10-2 min-1) et deux fois moindre pour l’acide acétique (1,8.10-2 min-1), sachant que le seul sous-produit détecté pour les acides propionique, butyrique, hexanoïque et lactique est l’acide acétique. Le mécanisme proposé comprend la rupture de la liaison carbone-carbone finale pour former du dioxyde de carbone et l’aldéhyde correspondant avec un carbone en moins. Cet aldéhyde serait ensuite converti en acide carboxylique, dégradé de la même manière jusqu’à former l’acide acétique. De là, il y aurait formation de formaldéhyde et d’acide formique puis de dioxyde de carbone. Ces deux intermédiaires réactionnels (formaldéhyde et acide formique) ne seraient pas détectés en tant que sous produit d’ozonation catalytique, car ils sont très vite dégradés par ozonation seule.
(
)
2 3 2 1 2 3 1 2 3 2 2 3 ) ( ) ( CO COH H COOH C H CO COOH CH C H CHO CH C H CO COOH CH C H n n n ↓ − ↓ − ↓ − − − ↓ − − − ↓ − − − − ΜFigure 7 : Mécanisme d’oxydation des acides mono-carboxyliques d’après Fontanier et al. (2005)
Dans le cas des acides di-carboxyliques (acides oxalique et succinique), aucun intermédiaire réactionnel n’a été détecté et l’élimination du COT est concomitante à celle de l’acide oxalique, ce qui signifie qu’une seule étape est nécessaire pour la transformation de l’acide oxalique en dioxyde de carbone selon Fontanier et al. (2005) (qui serait un réarrangement moléculaire induit par l’oxyde du métal sans ajout de molécule d’oxygène). L’acide
succinique serait lui transformé successivement en acide malonique puis oxalique ce qui expliquerait une vitesse d’élimination du COT plus faible que dans le cas de l’acide oxalique (7,9 et 15,9.10-2 min-1 respectivement).
Les résultats d’études cinétiques menées sur les acides carboxyliques et les autres molécules traitées ont également permis de proposer un mécanisme d’action du catalyseur en deux étapes, une première étape d’adsorption de la molécule d’ozone à la surface du catalyseur puis une seconde de minéralisation à la surface du catalyseur (Fontanier et al. 2005).
Allemane et al. (1993) ont étudié l’ozonation d’albumine, de cellobiose et d’acide fulvique Cébron. Ils ont principalement mis en évidence une diminution importante de la consommation d’ozone lors de l’ozonation catalytique par rapport à l’ozonation seule et au procédé ozone/peroxyde d’hydrogène et l’impact d’un mécanisme catalytique différent d’une simple augmentation de la génération de radicaux hydroxyles, la présence de pièges à radicaux n’empêchant pas totalement la réaction de se produire. Ils ont de plus pu éliminer l’hypothèse d’une adsorption des molécules à traiter sur le matériau catalytique (TiO2,
procédé CATAZONE) en constatant que le carbone total restait stable au cours des expériences.
D’un point de vue expérimental, ils ont également montré que la localisation du catalyseur, dans la colonne à bulle de transfert d’ozone en mode lit fixe ou dans une cartouche dans une boucle de recirculation (V = 2,5 L et Qr = 65 L.h-1) ne changeait pas son efficacité.
Les autres procédés brevetés ont surtout été utilisés pour traiter des effluents complexes, tels que des lixiviats de décharge (TOCCATA, CATAZONE, CHEMOX-Cat et ECOCLEAR), des effluents issus de l’industrie (cosmétique, automobile, papetière, alimentaire, textile, pharmaceutique et chimique) (TOCCATA, CHEMOX-Cat et ECOCLEAR), des eaux de rinçage (ballasts, électronique) (CATAZONE, ECOCLEAR) et des eaux souterraines (ECOCLEAR).
Chacun de ces cinq procédés a donc été appliqué au traitement de lixiviats de décharge. Les résultats obtenus en termes de rendement d’élimination et de consommation d’ozone sont rassemblés dans le Tableau 5.
Tableau 5 : Performances des procédés commerciaux d’ozonation catalytique appliqués au traitement de lixiviats de décharge
Procédé
Concentrations initiales Abattements obtenus (gOConsommation d’ozone
3 consommé/gDCOéliminée)
TOCCATA [cata] = 66,7 g.L-1 DCO0 = 407 mg.L-1 COD0 = 162 mg.L-1 DCO : 90 % COD : 95 % O3 seule : 14,1 O3+catalyseur : 2,3
CATAZONE DCO0 = 1400 mg.L-1 DCO : 89 % O3+catalyseur : 2,68
CHEMOX-Cat DCO0 = 1015 mg.L-1 DCO : 50 % O3+catalyseur : 1,5
ECOCLEAR DCO0 = 350 à 1200 mg.L-1 DCO : 30 à
90 %
O3 seule : 1,2 à 2,2
O3+catalyseur : 0,8 à 1,8
O.C. DCO0 = 400 à 5400 mg.L-1 DCO0 : 75 à
95 % O3+catalyseur : 0,7 à 1,3 Ces procédés permettent d’améliorer significativement l’élimination de la DCO contenue dans les effluents à traiter. La consommation d’ozone par gramme de DCO éliminé est comprise entre 0,7 et 2,68 gO3 consommé/gDCOéliminée pour ces quatre procédés industriels.
D’autres auteurs (Friedrich et al., 1995 ; Monje-Ramirez et al., 2004 ; Bila et al., 2005 ; Goi et al., 2009 et Cortez et al., 2010) ayant ozoné sans catalyseurs, des lixiviats de décharges, obtiennent des valeurs de consommation d’ozone comprise entre 3 et 32 gO3consommé/gDCOéliminée, et généralement de l’ordre 3 à 4 gO3 consommé/gDCOéliminée.
II.2.5. Travaux sur l’ozonation catalytique hétérogène d’acides organiques
Le tableau suivant présente des résultats obtenus pour l’élimination d’acides organiques à l’aide de différents catalyseurs hétérogènes.
Tableau 6 : Ozonation catalytique hétérogène d’acides organiques
Référence Abattement en ozonation seule (%) Abattement en ozonation catalytique (%) Produit à éliminer / Catalyseur utilisé Ordre et constante de vitesse Andreozzi et al. (1996) et (1998) 0 % 0 % 47 % 74 % Acide pyruvique / MnO2 (0,2 g.L-1) Acide oxalique / MnO2 (0,1 g.L-1) Ordre 1 (AP) Ordre 1 (cata) 1,44.10-2 L.mmol-1.min-1 - Tong et al. (2003) 100 % (COT=21%) 11 % 100 % (COT=55%) 21 % Acide sulfosalycilique / β-MnO2 (3 g.L-1) Acide propionique / β-MnO2 (3 g.L-1) - - Beltràn et al. (2005) 1 % 72 % Acide oxalique / Fe2O3/Al2O3 (1,25 g.L-1) Ordre 1 (AO) 0,5 à 1,85.10-3 min-1 Fontanier et al. (2005) COT 0 % 0 % 0 % 0 % 0 % COT 56,5 % 77,3 % 75,5 % 80,2 % 73,3 % Toccata (- g.L-1) Acide acétique Acide propionique Acide butyrique Acide hexanoïque Acide oxalique Ordre 1 (acide) 1,8.10-2 min-1 3,8.10-2 min-1 3,7.10-2 min-1 3,9.10-2 min-1 15,9.10-2 min-1 Karpel Vel Leitner et Fu (2005) 17 % (COT = 6 %) 16 % (COT = 0 %) 89 % (COT = 88 %) 80 % (COT = 26 %) Ru/CeO2-TiO2 (0,8 g.L-1) Acide chloroacétique Acide pyruvique - Shiraga et al. (2006) 8 % 100 % Acide oxalique / Cu-Mg-Al (0,4 g.L-1) Ordre 1 (AO) 0,08 à 0,25 min -1 Rivas et al. (2006) 4 % 82 % (COT = 30 %) Acide pyruvique / Perovskite (1 g.L-1) - Alvarez et al. (2007) 9 % (COT = 6 %) 99 % (COT = 90 %) Acide pyruvique / Co/Al2O3 (0,4 g.L-1) - Liu et al. (2008) 0 % 100 % Acide oxalique / Nanotubes de carbone ( 0,1 g.L-1) -
Avramescu et al. (2008) 5 % 98 % Acide oxalique / Ni/Al2O3 (2 g.L-1) Ordre 1 (AO) Ordre 1 (O3) 158 à 540.10-3 L.mmol-1.min-1 Bui Quang (2009) 20 % 5 % 71 % 99 % 100 % 100 % Acide pyruvique TAO3 = 0,8 g.L-1 Acide acétique TAO3 = 0,8 g.L-1 Acide oxalique TAO3 = 0,8 g.L-1 Ordre 0,8 (AP) 0,14 min-1 Ordre 0,4 (AA) 0,93 min-1 Ordre 0,7 (AO) 0,16 min-1 Gonçalves et al. (2010) 5 % 0 % 100 % 70 % Acide oxalique / Nanotubes de Carbone (0,14 g.L-1) Acide oxamique / idem Ordre 0 (AO) 11,5 à 18,0.10-3 mmol.L-1.min-1 Tong et al. (2010) 3 % 50 % Acide oxalique / Fe3O4-CoO/Al2O3 ( 20 g.L-1) Ordre 1 (AO) Ordre 1 (O3) 237 L.mol -1.min-1 Sui et al.
(2010) 22 % 54 % Acide oxalique / FeOOH (2 g.L-1) - Orge et al. (2011) et (2012)a et b 42 % 10 % 10 % 100 % 100 % 70 % Acide oxalique / CeO2 (0,14 g.L-1) Mn + composites (0,35 g.L-1) Acide oxamique / CeO2 (0,5 g.L-1) - Li et al. (2011) et (2012) 15 % 100 % Acide pyruvique / PdO/CeO2 (0,3 g.L-1) - Zhang et al. (2011) et (2012) 4 % 4 % 41 % 98 % Acide oxalique / PdO/CeO (0,15 g.L-1) CuO/CeO2 (0,2 g.L-1) - Ordre 1 (AO) 1,3 à 25.10-4 min-1
La majorité des auteurs ont déterminé une cinétique du premier ordre par rapport à l’acide traité, en particulier l’acide oxalique. Certains ont aussi déterminé des ordres un par rapport à la concentration en ozone dissous et en catalyseur. Néanmoins, dans plusieurs cas, la constante tient compte à la fois de la réaction catalytique homogène et hétérogène (Avramescu et al., 2008, Tong et al., 2010) ou de l’adsorption sur le catalyseur et de la réaction (Beltràn et al., 2005).
Les constantes de vitesse de pseudo premier ordre (concentration en catalyseur et en ozone comprises dans la constante) sont de l’ordre de 10-2 à 10-4 min-1 et celles du second ordre (ordre un par rapport à l’ozone et ordre un par rapport à l’acide) sont comprises entre 11,5 et 540.10-3 L.mmol-1.min-1. Cette diversité des constantes vient du fait que les acides testés sont différents, mais surtout les catalyseurs utilisés et leur concentration sont très variés (de 0,1 à 20 g.L-1 pour les concentrations). Il s’agit de manière générale de réactions lentes.
II.2.6. L’ozonation catalytique de l’acide succinique
L’ozonation catalytique de l’acide succinique, qui sera utilisé dans la plupart des expériences menées au cours de cette étude, a été étudiée par trois équipes de chercheurs avec des catalyseurs différents. Il s’agit d’un composé réfractaire à l’ozonation seule (Takahashi, 1990). Les résultats qu’ils ont obtenus sont rassemblés dans le tableau suivant
Tableau 7 : Ozonation catalytique hétérogène de l’acide succinique
Référence Catalyseur utilisé Rendement Constante de vitesse Conditions Karpel Vel Leitner et al. (1998) Ru/CeO2 0,2 g.L-1 58 % en 3h 100% en 1h30 1,4.10-3 L2.mmol -0,24.mg -0,41.min-1 Réacteur semi-continu, qmO3 = 1250 mg.h-1, [AS]0 = 1 mmol.L-1, qmO3 = 1250 mg.h-1, [AS]0 = 0,5 mmol.L-1, Delanoë et al. (2001) Ru/CeO2 0,8 g.L-1 3,2 g.L-1 100 % en 1 h 100 % en 3 h - Réacteur semi-continu, qmO3 = 1250 mg.h-1, [AS]0 = 1 mmol.L-1, qmO3 = 1250 mg.h-1, [AS]0 = 5 mmol.L-1, Ernst et al. (2004) Al2O3 50 g.L-1 87,5 % (COD) en 30 min 90 % (COD) en 1h - Réacteur fermé, qmO3 = 10 mgO3, [AS]0 = 1,25 mmol.L-1, Réacteur semi-continu, qmO3 = 5g.h-1, [AS]0 = 1,25 mmol.L-1, Fontanier et al. (2005) Toccata - g.L-1 86,8 % (COD) en 4h 7,9.10-2 min-1 Réacteur semi-continu, qmO3 = 2 g.h-1 [AS]0 = 4,2 mmol.L-1 Karpel et Fu (2005) Ru-CeO2/TiO2 0,8 g.L-1 100 % (COD = 50 %) en 50 min - Réacteur semi-continu, qmO3 = 1,275 g.h-1 [AS]0 = 1 mmol.L-1
Au vu des résultats rassemblés dans le Tableau 7, l’ajout d’un catalyseur solide lors de l’ozonation de l’acide succinique, composé réfractaire à l’ozonation seule, permet de l’éliminer totalement avec un catalyseur de type RuCeCO2, et d’atteindre une minéralisation
de 90 % en 1 heure avec 50 g.L-1 de catalyseur Al2O3.
II.2.7. Influence du pH
Le pH de la solution peut influencer de plusieurs manières l’efficacité de la réaction d’ozonation catalytique.
En effet dans le cas de catalyseurs contenant des oxydes de métaux, le pH de la solution peut en modifier les propriétés de surface selon qu’il est inférieur ou supérieur au pHPZC (pH du
point de charge nulle) du catalyseur, ce qui peut provoquer les effets suivants :
- Selon le pHPZC du catalyseur, les espèces présentes la surface du catalyseur sont
différentes : − + + ↔ − + 2 OH Me H OH Me pH < pHPZC


![Figure 28 : Ozonation seule de l’acide succinique en eau osmosée (pH = 3,6 ± 0,4 ; [O 3 ] ge = 130g.m -3 ; Q G](https://thumb-eu.123doks.com/thumbv2/123doknet/7922913.265370/81.892.236.660.359.686/figure-ozonation-seule-acide-succinique-eau-osmosée-ph.webp)
![Figure 29 : Concentrations en ozone dissous au cours de l’ozonation catalytique d’acide succinique (réacteur 1L, [AS] 0 = 1mmol.L -1 )](https://thumb-eu.123doks.com/thumbv2/123doknet/7922913.265370/82.892.280.612.332.647/figure-concentrations-ozone-dissous-ozonation-catalytique-succinique-réacteur.webp)