UNIVERSITÉ MOHAMMED V – AGDAL
FACULTÉ DES SCIENCES
Rabat
N° d’ordre 2510THÈSE DE DOCTORAT
Présentée par
AMENZOUI Khadija
Discipline : Biologie
Spécialité : Ichtyologie
Variabilité des caractéristiques biologiques de la sardine, Sardina
pilchardus (Walbaum, 1792) exploitée au niveau des zones de Safi, Agadir
et Laâyoune (côtes atlantiques marocaines)
Soutenue le 13 novembre 2010 devant le jury
Président :
Mr. SADAK Abderrahim, Professeur à la Faculté des Sciences, Rabat
Examinateurs :
Mr. YAHYAOUI Ahmed, Professeur à la Faculté des Sciences, Rabat
Mr. JAZIRI Hassan, Professeur à la Faculté des Sciences, Rabat
Mr. MENIOUI Mohamed, Professeur à l’Institut Scientifique, Rabat
Mr. ZINE Nasser-Eddine, Professeur à la Faculté des Sciences, Meknès
Mr. MESFIOUI AbdelHakim, Chef du Centre Régional de Laâyoune, Institut
National de Recherche Halieutique
DEDICACE
A mes parents A mon mari, Mustapha
A mes fils bien aimés : Youssef et Omar A mes sœurs
AVANT-PROPOS
D'abord, je tiens à exprimer mes sincères remerciements à Mr. le Doyen de la Faculté des Sciences de Rabat, d’avoir accepté ma candidature.
Les travaux présentés dans cette thèse ont été effectués au laboratoire de zoologie et de Biologie Générale de la Faculté des Sciences de Rabat et laboratoire de Biologie et Ecologie du Département des Ressources Halieutiques de l'Institut National de Recherche Halieutique (INRH).
J'adresse mes sincères remerciements à Mr Ahmed Yahyaoui, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat et Responsable de l’UFR "Biodiversité et Aquaculture"d’avoir assuré la direction de cette thèse et qui par ses conseils et ses remarques judicieuses ont permis d'enrichir, de préciser et de compléter mon travail. Je voudrais qu'il trouve dans ces modestes mots, l'expression de ma profonde gratitude pour l'accueil qu'il m'a réservé au sein de son laboratoire. Il m'a fait profiter de son expérience et de ses connaissances sur la biologie des poissons.
Je tiens à remercier chaleureusement Mr. Abderrahim SADAK, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat, d'avoir bien accepté la présidence du jury.
Mes remerciements les plus sincères à Mr. Hassan JAZIRI, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat, pour avoir accepté d'être rapporteur de cette thèse et membre de son jury.
Mes remerciements les plus chaleureux à Mr. Mohamed Menioui, Professeur à l’Institut Scientifique de Rabat qui a accepté d’être rapporteur de ce travail. Sa présence dans son jury est un grand honneur pour moi.
Je tiens à exprimer ma plus grande gratitude à Mr. Nasser-Eddine ZINE, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Meknès qui m'a fait l’insigne honneur d’être rapporteur de ce travail et membre de son jury.
J'adresse mes remerciements à Mr. AbdelHakim Mesfioui, Chef du Centre Régional de Laâyoune, l'Institut National de Recherche Halietique, pour ses remarques constructives en tant que membre de jury.
Je tiens à remercier très vivement le Directeur Général de l’Institut National de Recherche Halieutique (INRH), Mr M. FAIK pour l’appui et l’aide encourageants qu’il accorde à la recherche scientifique.
J’adresse mes vifs remerciements à Mr. S. BENCHRIFI, Chef du Département des Ressources Halieutiques de l'INRH pour ses conseils.
Je tiens à remercier Mme. S. Kifani, Chef d'URD Suivi et Observation Directes des stocks pour ses qualités professionnelles dont elle ne réserve aucun effort pour en faire bénéficier les autres.
Un grand merci à Mr. K. Manchih, Chef du laboratoire de Biologie et Ecologie de l'INRH à Casablanca pour sa disponibilité et ses conseils.
Au laboratoire de Biologie et Ecologie de l'INRH à Casablanca, mes plus sincères remerciements vont à A. Moumni, S. Abdellaoui, F. H. Idrissi, H. Masski, A. Youssoufi et S. Semmoumy, pour leur soutien et leurs conseils.
Un sincère merci à mes collègues A. Lakhnigue, A. Marhoume et N. Charouki qui m’ont apporté une aide précieuse au cours de la thèse.
Un grand merci à mes collègues R. Sago, F. Bouthir et A. Bouhallaoui pour leur soutien et leur encouragement.
Tous mes remerciements aux chercheurs et personnels de l’INRH et plus particulièrement M. Barechedy, A. Boumaaz, A. Srairi et A. Ramzi.
Je suis très reconnaissante à mes parents pour leur affection, leur amour et leur soutien.
En fin j’adresse mes chaleureux remerciements à mon mari et mes enfants dont l’importance pour moi va bien au-delà des mots.
Résumé :
Les paramètres biologiques de la sardine ont été étudiés durant la période allant de 1999 à 2006 dans le but de vérifier l'hypothèse de l'homogénéité de la structure du stock sardinier de l'Atlantique central marocain. La connaissance des paramètres biologiques est indispensable pour une bonne analyse de la dynamique de populations et pour la gestion des stocks. Ces paramètres d’histoire de vie de la sardine varient d’une région à l’autre et dans le temps au sein d’une même région en raison de leur plasticité aux effets de l'évolution des conditions environnementales et de la pression élevée de la pêche dans l'écosystème atlantique marocain.
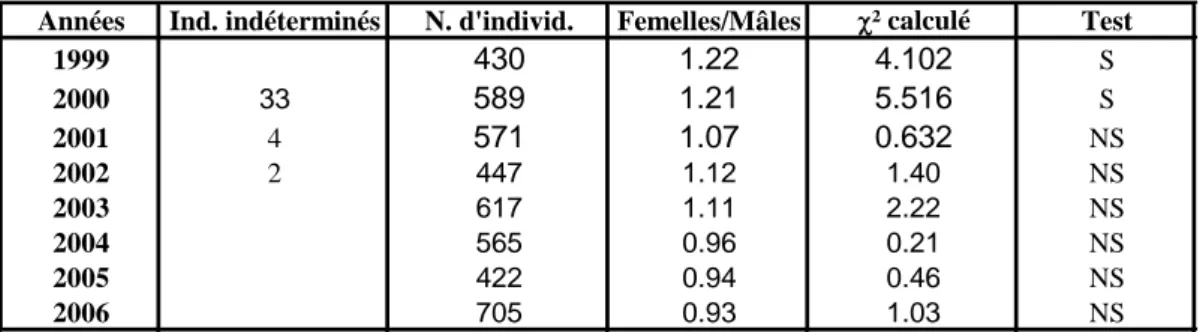
Le sex-ratio est à l'avantage des femelles dans la zone de Safi et d'Agadir et équilibré, entre les deux sexes, dans la région de Laâyoune.
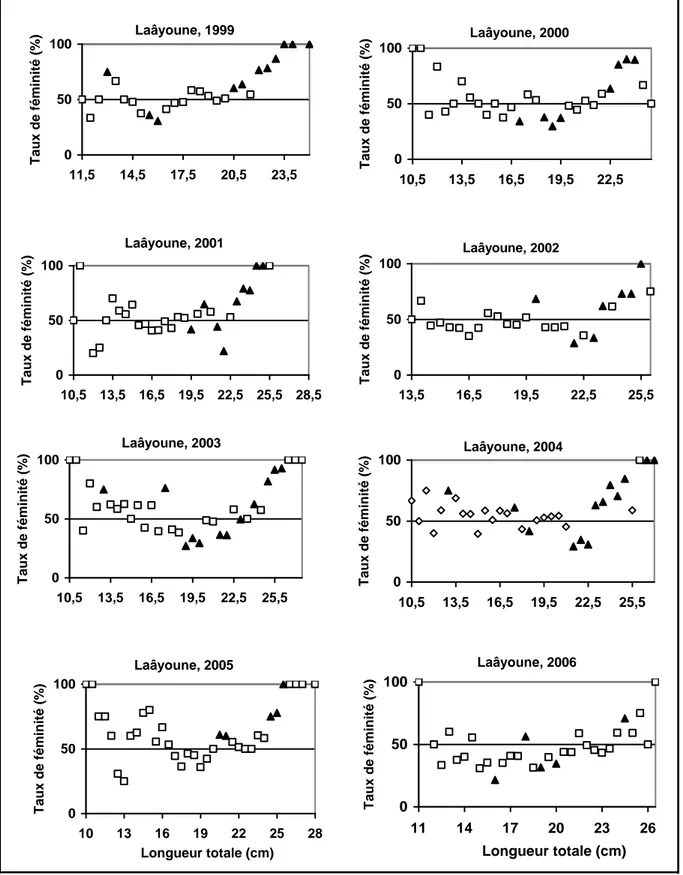
La taille de première maturité sexuelle est acquise au cours de la première année de vie de poisson dans les différentes zones étudiées. La taille de première maturité sexuelle est atteinte à 14,5 cm pour les deux sexes dans la zone de Safi, à 14,1 et 14,4 cm dans la zone d'Agadir et à 15,1 et 15,9 cm dans la zone de Laâyoune, respectivement pour les mâles et les femelles.
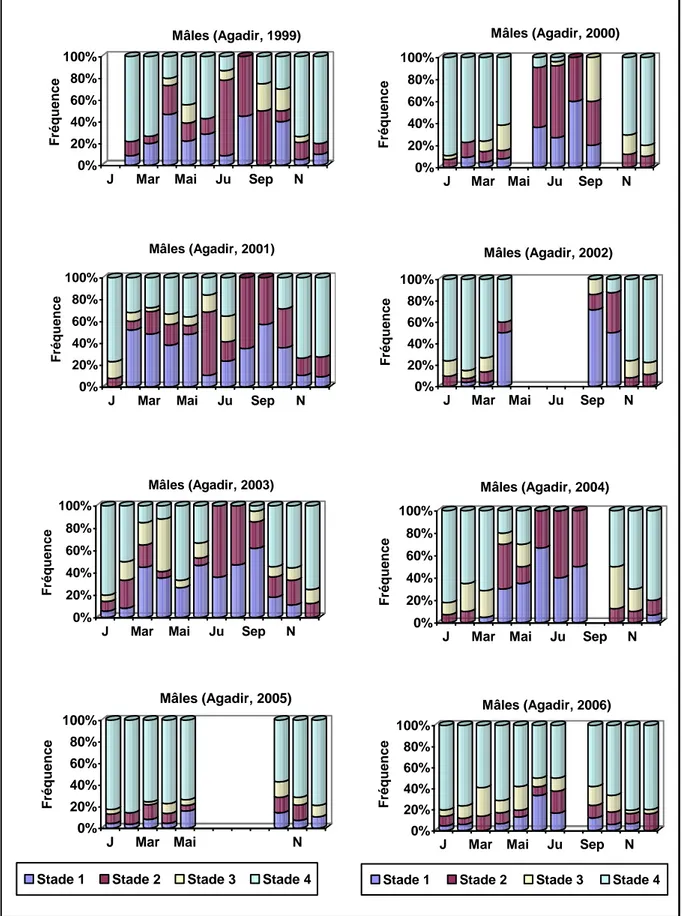
Les sardines se reproduisent entre janvier et mai dans la zone de Safi et continuent à se reproduire jusqu’au mois de juillet dans la zone d’Agadir. Tandis que, dans la région de Laâyoune, la saison de reproduction moyenne est étalée sur toute l’année. L'accumulation de réserves chez la sardine s'effectue durant la période qui précède le démarrage de la reproduction. L'étude histologique des ovaires a montré que la sardine se reproduit par émissions successives de plusieurs lots d’œufs durant une même saison de ponte et a permis de classer la sardine parmi les espèces à fécondité indéterminée. La fécondité moyenne par lot est estimée à 29445 ovocytes par femelle mature dans la zone de Laâyoune et de 41669 ovocytes par femelle mature dans le sud (entre 29° N et 24° N). Les relations taille-poids obtenues dans les différentes régions indiquent chez la sardine de l’Atlantique marocain soit une allométrie majorante (b étant supérieur à 3) soit une isométrie de croissance (b étant égal à 3).
Les sardines les plus exploitées étant de moyennes et grandes tailles. Les juvéniles sont absents dans les captures de Safi et faiblement représentés dans celles d’Agadir et Laâyoune. L'effort de pêche est orienté vers les adultes, ce sont surtout les jeunes adultes du groupe d'âge 2 et 3 ans qui subissent la mortalité la plus forte par pêche notamment dans la région de Laâyoune. La longévité est de 5 ans dans la zone de Safi, de 4 ans dans celle d'Agadir et de 6 ans dans la région de Laâyoune.
La sardine a une croissance en longueur et pondérale très importante durant sa première année de vie puis la vitesse diminue lorsque l'âge augmente et ceci quelle que soit la région étudiée. Les sardines de l’Atlantique marocain, peuvent être séparées en deux groupes en fonction de leur rythme de croissance en longueur et pondérale. Le premier groupe est constitué par les sardines des régions de Safi et d’Agadir et qui présente une croissance faible. L’autre groupe comprend les sardines provenant de la région de Laâyoune et ayant un rythme élevé de croissance.
Mots-clés : Atlantique central marocain, Sardina pilchardus, sex-ratio, période de ponte, stratégie de
Variability of sardine’s biological characteristics exploited in the areas of Safi, Agadir and Laâyoune (Moroccan Atlantic coast)
Abstract:
Biological parameters of sardine were studied during the period from 1999 to 2006 in order to verify the hypothesis of homogeneity stock structure of sardine in the Moroccan central Atlantic. Knowledge of biological parameters is essential for proper analysis of population dynamics and stock management. These life history parameters of sardine vary from one region to another and over time within the same region because of their plasticity to the effects of changing environmental conditions and high pressure fishing in the Moroccan Atlantic ecosystem.
The sex ratio is in favor of females in the area of Safi and Agadir, balanced between the sexes in the region of Laâyoune.
The size at first sexual maturity (L50) is acquired during the first year of fish life in different
studied areas. The size at first sexual maturity is reached at 14.5 cm for both sexes in the area of Safi, 14.1 and 14.4 cm in the area of Agadir and 15.1 and 15.9 cm in area of Laâyoune, respectively for males and females.
Sardines spawn between January and May in the area of Safi and continue to spawn until July in the area of Agadir. While in the region of Laâyoune, the average spawning season are spread throughout the year. The maximum of condition factor (K) corresponds to the month that precedes the starting of reproduction. This implies an accumulation of reserves by sardine before the reproduction period. Histological examination of ovaries showed that sardine reproduces by successive emissions of several batches of eggs during one spawning season and helped classify the sardine among species with indeterminate fecundity. The average batch fecundity was estimated at 29445 eggs per mature female in the area of Laâyoune and 41669 eggs per mature female in the south (between 29° N and 24° N).
The length-weight relationship obtained in the different regions is a majorant allometry (b > 3) or an isometric growth (b = 3).
The most exploited sardines have medium and large sizes. Juveniles are absent in the catches of Safi and poorly represented in those of Agadir and Laâyoune. The effort is geared toward adults; it is mainly young adults of age group 2 and 3 years who receive the highest mortality per fishing in the region of Laâyoune. Longevity is 5 years in the area of Safi, 4 years in Agadir and 6 years in the region of Laâyoune.
The sardine growth (length and weight) is so important in its first year of life and the growth speed decreases with age indifferent studied areas. The sardines of Moroccan Atlantic can be separated in two groups according to their rate of growth (length and weight). The first group consists of sardines from areas of Safi and Agadir and has a low growth. The other group consists of sardines from the region of Laâyoune and has a high rate of growth.
Keywords: Moroccan central Atlantic, Sardina pilchardus, sex ratio, spawning period, spawning strategy, fertility, condition factor (K), length-weight relationship, age, growth.
Le secteur de pêche et de l’aquaculture se caractérise ces dernières années par de profondes mutations à la fois à l’échelle mondiale et nationale. En effet, des changements structurels dans le marché des produits de la mer ont été enregistrés. C’est ainsi que nous avons assisté à un accroissement extraordinaire de la demande mondiale de poissons tirée notamment par les innovations techniques dans le domaine de pêche et de navigation et les changements des habitudes alimentaires et culinaires dans plusieurs régions du monde. Actuellement, les pêcheries mondiales font face à une nette dégradation en raison notamment de la situation de surexploitation des principaux stocks d’intérêt économique. C’est dans ce contexte que s’est développée l’aquaculture dans plusieurs pays à travers le monde, activité très vite apparue comme une alternative à la pêche et a permis de maintenir l’équilibre entre l’offre et la demande.
A son tour, le Maroc n’a pas échappé à ce processus de transformation des milieux naturels à travers le monde. En effet, le secteur de pêche maritime national fait face à des modifications qualitatives et quantitatives des ressources halieutiques et à des menaces d’épuisement des stocks halieutiques. Quant à l’aquaculture, malgré les initiatives individuelles et les nombreux projets mis en œuvre, elle n’a pu connaître un développement soutenu. De même, les industries de transformation des produits de la mer demeurent confrontées à une multitude d’entraves limitant leurs performances et leur compétitivité sur le marché international. Devant ces menaces qui pèsent sur la viabilité à long terme des pêches maritimes et face aux problèmes économiques et sociaux qui en découlent, le secteur halieutique marocain s'est récemment doté d'une stratégie ambitieuse et chiffrée appelée "halieutis". L’objectif global de cette stratégie est de garantir une pêche durable et compétitive valorisant le patrimoine halieutique marocain et de faire du secteur un véritable moteur de croissance de l'économie. Il s'agit aussi de renforcer et partager la connaissance scientifique. Cette stratégie a également pour objectif la mise en oeuvre du plan d’aménagement des petits pélagiques qui vise l’atteinte des objectifs suivants :
Exploiter durablement la ressource en définissant un TAC (Taux Admissible de Capture) par stock.
Valoriser l’ensemble des captures ainsi que le potentiel du stock Sud à travers le débarquement de toutes les captures au Maroc et leur valorisation notamment dans le cadre des pôles de compétitivité de Dakhla, Laâyoune et Agadir.
Dynamiser l’industrie à terre des petits pélagiques en approvisionnant les industries existantes et en développant de nouveaux produits à travers des projets de valorisation à terre.
Au Maroc, l’activité de pêche joue un rôle important dans la vie économique et sociale. C’est un véritable moteur de développement économique et social du pays. Elle contribue au PIB national, présente une source de devises et génère près de 600.000 emplois pour une population de 3 millions de personnes vivant directement ou indirectement de la pêche. Elle joue également un rôle important dans l’apport protéinique de la population.
Avec un littoral de 3500 km (Méditerranée et Atlantique) et une diversité importante de sa richesse marine, le Maroc possède un véritable potentiel halieutique concentré principalement en Atlantique centre et sud. Les petits poissons pélagiques, principalement les espèces de sardine, anchois, maquereau, chinchard et sardinelle, représentent sur le plan quantitatif, les principales ressources exploitées et totalisent presque 80% des captures. Leurs débarquements annuels (Figure 1) varient sous l’influence des fluctuations environnementales (Cury et Roy, 1987 ; Pezennec et al., 1993 ; Djagoua, 2003) et de l’effort de pêche. La sardine est l’espèce la plus importante en termes de captures (Figure 1) et de biomasse. Le Maroc est le premier producteur mondial de la sardine de qualité supérieure et leader sur le marché international de la sardine en conserve.
La richesse biologique des eaux marocaines, notamment atlantiques, est plus déterminée par la nature favorable du régime hydro-climatique qui y règne et par la configuration de la plate-forme continentale des côtes marocaines. C’est là deux facteurs d’une importance capitale qui vont régir la production du secteur halieutique du Maroc. Les upwellings constituent la principale source d’enrichissement des écosystèmes côtiers Nord ouest-africains et les petits poissons pélagiques y constituent la majeure partie de la biomasse. Leur dynamique est étroitement associée à celle des facteurs environnementaux tels que l'intensité et la variabilité saisonnière ou interannuelle des upwellings, les aspects de la production primaire ou secondaire ainsi que les caractéristiques hydrodynamiques du milieu.
0 200 400 600 800 1000 1200 1990 1992 1994 1996 1998 2000 2002 2004 2006 2008 C a p tu re s ( m il li e rs d e t o n n e s ) Sardine
Autres petits pélagiques
Figure 1 : Evolution des captures de sardine et autres petits pélagiques au niveau de la côte Atlantique marocaine.
Dans les régions Nord ouest africaines, ces espèces forment des stocks qui ne sont pas limités aux eaux territoriales d'un seul pays, mais s'étendent dans les eaux territoriales de deux ou plusieurs pays littoraux voisins (stocks communs). Par ailleurs, certains stocks migrent le long de la côte: il se peut qu'ils se trouvent dans les eaux côtières d'un pays pendant une partie de l'année et dans celles de pays voisins pendant le reste de l'année. Le caractère transfrontalier de ces ressources et la variabilité naturelle à laquelle elles sont soumises nécessitent une gestion spécifique et une coopération régionale pour une prise en compte de la ressource dans son contexte transfrontalier.
L'influence de l'environnement sur la biologie des petits pélagiques et les fluctuations de leur disponibilité et leur abondance ont été mises en évidence dans des nombreuses pêcheries du globe. L'évolution des pêcheries des petits pélagiques notamment celles des clupéiformes a montré que cette ressource peut être sujette à des fluctuations d’abondance très importantes, tels l’anchois du Pérou dont les captures ont chuté très brutalement à des quantités pratiquement nulles en 1984 et aussi la sardine californienne, la sardine japonaise et le hareng de la mer du nord. Le comportement grégaire de ces espèces et leur tendance à réduire leur zone de répartition plutôt que leur densité en cas de chute d’abondance, a été une des raisons invoquées pour expliquer ces effondrements (Saville,
1980). Cependant, il est maitenant reconnu que ces ressources présentent des fluctuations d’abondance même en l’absence de pêche, comme ont pu le démontrer Soutar et Isaac (1975) en étudiant les dépôts de sédiments en Californie, et que les changements hydro-climatiques jouent un rôle prépondérant dans ces fluctuations. Cependant, on s’accorde à penser que l’exploitation en réduisant la durée de vie des espèces réduit les capacités de celles-ci à traverser des périodes de faibles recrutemnts d’origine climatique (Troadec et al., 1980). Au Maroc depuis 1980, la pêcherie pélagique côtière a subi d'importantes fluctuations dont les répercussions ont été plus ou moins désastreuses sur l'activité en mer elle-même, sur l'industrie de transformation et même sur l'économie régionale. Les principaux ports traditionnels de pêche de sardine : Safi et Essaouira, où étaient basées la quasi-totalité de la flottille et l'infrastructure de transformation, étaient les premiers à souffrir de la fluctuation des ressources. Aussi, il faut rappeler la chute de biomasse enregistrée en 1997 dans la zone cap Boujdour-cap Blanc (Figure 2). Il convient donc d'être vigilant même si les stocks de sardine sont très abondants le long des côtes marocaines, afin de déceler des signes éventuels de modifications de la biologie de l’espèce, de l'abondance des stocks et de la structure des populations, qui menacent la pérennité de son exploitation.
Quatre pêcheries sardinières se sont développées chronologiquement du nord au sud de l’Atlantique marocain : la pêcherie Nord, la pêcherie traditionnelle de la région Safi-Agadir (zone A), la pêcherie cap Noun-cap Boujdour (zone B) et la pêcherie Sud, de cap Boujdour au cap Blanc (zone C). La gestion de ces pêcheries se base sur l’hypothèse de stocks séparés elle-même formulée sur la base des études morphométriques (Belvèze, 1984), biochimiques (Biaz, 1978) et biologiques (Belvèze, 1984). Selon cette hypothèse les sardines de l’Atlantique marocain peuvent se subdiviser en trois unités de stocks : stock nord, stock central (zone A et B) et le stock sud (zone C). Cependant, les résultats actuels de l’étude génétique ont montré l’existence de deux populations de sardine : une population au nord et une autre au sud (Chlaida, 2009).
En effet, la séparation des stocks de poissons est indispensable pour la gestion des pêches, pour la répartition des captures entre les pêcheries compétitives, l’identification et la protection des nourriceries et frayères, pour le développement de la pêche et de stratégie optimales de surveillance (Kutkuhn, 1981 ; Grimes et al., 1987 ; Smith et al.,1990).
Un stock de poissons peut être considéré comme un groupe qui se reproduit de façon aléatoire, avec l’intégrité temporelle ou spatiale pour les individus isolés reproductivement (Ihssen et al., 1981). Selon cette définition, un stock peut présenter des différences dans un ou plusieurs paramètres du cycle de vie par rapport à d’autres stocks de la même espèce.
Les paramètres du cycle de vie comprennent des caractéristiques telles que la reproduction, la croissance, la survie, le recrutement, la distribution et l’abondance (Ihssen et al., 1981 ; Pawson et Jennings, 1996). Ces caractéristiques sont utilisées pou distinguer les stocks de poissons parce qu’ils sont des expressions phénotypiques de l’interaction entre les influences génotypiques et environnementales. Des différences dans les paramètres d’histoire de vie sont considérées comme des preuves que les populations de poissons sont géographiquement et/ou reproductivement isolés (bien que le mélange peut se reproduire en saison) et forment donc des unités distinctes à des fins de gestion (Ihssen et al., 1981). Bien que, l’utilité des paramètres de l’histoire de vie pour l’identification des stocks puisse diminuer avec la complexité des stocks et l’histoire d’exploitation, leur applicabilité augmente avec le nombre de paramètres examinés (Ihssen et al., 1981).
C'est dans ce cadre qu'a été inscrit notre travail de thèse concernant la biologie de la sardine exploitée au niveau des zones de Safi (zone A), Agadir (zone A) et Laâyoune (zone B) et nous tentons de vérifier l’hypothèse de l’homogénéité du stock central de la sardine de l’Atlantique marocain.
Notre étude considère l'utilité de sex-ratio, la reproduction, fécondité, l’âge et la croissance comme des indicateurs de la structure des stocks tout en fournissant un exemple de l'approche holistique pour l’identification de stocks suggérée par Begg et Waldman,
1999. La stabilité temporelle et les tendances de ces paramètres sont également examinées
pour déterminer si les différences de caractéristiques entre les sardines de différentes zones sont maintenues au cours du temps.
Cette espèce a été choisie en raison de son importance socio-économique et de son abondance le long des côtes atlantiques marocaines. D'après les campagnes de prospection acoustiques effectuées en 2007 à bord du navire de recherche AL Amir Moulay Abdellah, la biomasse totale de la sardine a été estimée à 5881000 tonnes. 1338000 tonnes ont été
zone cap Boujadour-cap Blanc (zone C) (FAO, 2008). Parallèlement à ces résultats, d’autres évaluations sont effectuées par le navire de recherche norvigien Dr. Fridtjof Nansen entre 1995 et 2008 dans les régions situées entre cap Cantin-cap Boujadour et cap Boujadour-cap Blanc et ont montré une variabilité interannuelle considérable, et une chute en décembre 1997 notamment dans la zone cap Boujadour-cap Blanc (Figure 2). Les écarts de biomasse entre les deux zones sont accentués entre 1995 et 1996 et entre 2001 et 2008. De même, nous avons mis en évidence une forte fluctuation interannuelle entre 1994 et 2009 dans les débarquements de sardines effectués dans les régions de Safi, Agadir et Laâyoune (Figure 3). Les captures réalisées dans la zone de Laâyoune dépassent largement celles des zones de Safi et Agadir (Figure 3). L'évolution des captures indique des fluctuations importantes dues à la plus ou moins forte intensité des upwellings et de l'effort de pêche. Malgré ces fortes variations, la sardine reste le groupe trophique dominant en termes de biomasse et de production. Par conséquent, une variation de sa biomasse a des impacts trophiques significatifs. En effet, la sardine est une espèce qui contrôle à la fois les proies et les prédateurs. .
La capture est saisonnière et liée à la disponibilité des espèces ciblées et du schéma de migration dans la zone de pêche. Les flottilles impliquées sont hétérogènes et composées de barques, de senneurs traditionnels et de chalutiers pélagiques industriels.
Malgré l'abondance de cette espèce le long des côtes atlantiques marocaines, des lacunes notoires subsistent encore dans la connaissance de sa biologie en l’occurrence la maturité (par le suivi du rapport gonado-somatique), la fécondité, taille à la première maturité sexuelle et la stratégie de ponte. Donc à travers cette étude, nous fournissons des informations biologiques qui ont une double fonction, utilisées aussi bien à des fins de gestion que comme des descripteurs pour la comparaison des stocks de cette espèce.
0 1000 2000 3000 4000 5000 6000 7000 déc-9 5 déc-9 6 déc-9 7 déc-9 8 déc-9 9 déc-0 0 déc-0 1 déc-0 2 déc-0 3 dec0 4 déc-0 5 déc-0 6 déc-0 7 déc-0 8 Années B io m a s s e (m il le to n n e s )
Cap Cantin-cap Bojador Cap Bojador-cap Blanc
Figure 2 : Evolution de la biomasse de sardines entre 1995 et 2008 dans les zones situées entre cap Cantin-cap Bojador et cap Bojador-cap Blanc.
La sardine, comme la plupart d'autres petits clupéidés présentant une grande vulnérabilité aux variations des conditions du milieu, est une espèce qui réagit et s'adapte aux influences imposées par son environnement. Par conséquent, la variabilité intraspécifique peut être importante en raison de la plasticité phénotypique. Ainsi, nous avons choisi de faire une étude par région de sa biologie car elle permet de détecter l'influence de l'habitat sur les réponses biologiques de cette espèce et de déceler d'éventuelles adaptations génétiques comme l'ont suggéré Reagan (1916) in Kartas (1981) et Silva (2003) pour la sardine. Des études récentes ont montré que des différences génétiques pourraient exister entre deux formes provenant de régions proches mais qui serait isolées l’une de l’autre par des conditions hydrologiques (Chlaïda, 2009). Trois zones (Safi, Agadir et Laâyoune) ont été donc considérées le long de l'Atlantique marocain et qui diffèrent par leurs caractéristiques hydrologique et trophique (température de l'eau, salinité, nourriture disponible….) auxquelles sont sensibles les petits poissons pélagiques.
Sardina pilchardus 0 50 100 150 200 250 300 350 400 450 500 1994 1996 1998 2000 2002 2004 2006 2008 Années C a p tu re s (M il le to n n e s ) Safi Agadir Laâyoune
Figure 3 : Evolution des débarquements de sardines dans les régions de Safi, Agadir et Laâyoune entre 1994 et 2009.
Le document est structuré en quatre chapitres avec tout d’abord une synthèse des connaissances sur les principales caractéristiques climatiques, hydrologiques et trophiques de la zone d’étude. Ensuite, nous avons présenté la sardine en rappelant sa caractéristique biologique et écologique. Ce chapitre a fait l'objet d'une synthèse bibliographique. Le second chapitre est dédié au matériel et méthodes utilisés dans le manuscrit. Dans le troisième chapitre, les résultats obtenus durant cette thèse sont présentés. Ce chapitre a porté sur la biologie de reproduction, l'âge et croissance. La biologie de reproduction a été étudiée pour déterminer la proportion des sexes, la taille et l'âge de première maturité sexuelle. Cette étude a également permis de caractériser les différentes phases du cycle sexuel ainsi que les différents types histologiques correspondants. La stratégie de ponte et la nature de la fécondité ont été définies. La fécondité et l'intensité de l'atrésie ovocytaires ont été évaluées. L'étendu et le calendrier de ponte, suivant les différents groupes d'âge qui succèdent dans les pêcheries marocaines, ont été également déterminés. En ce qui concerne l'âge et la biologie de croissance, nous avons étudié le facteur de condition K et la relation taille-poids. Puis sont étudiées la structure démographique en taille, l’âge, la croissance
linéaire et pondérale ainsi que les taux de croissance correspondants. Dans le dernier chapitre, nous discutons les résultats présentés dans cette thèse et nous essayons de situer la sardine du stock central de l’Atlantique marocain par rapport à celles des autres secteurs méditerrannéen et atlantique. Enfin une conclusion générale ainsi que les perspectives sont proposées à notre travail.
CHAPITRE I :
ZONE D’ETUDE
I. Caractéristique générale de la côte atlantique marocaine
La structure hydrodynamique du littoral atlantique marocain se caractérise par la présence de plusieurs zones à upwelling (remontées d’eaux froides). On distingue globalement trois zones : la zone nord (région de Larache), la zone centrale (région d’Essaouira) et la zone sud (Tan-Tan, Dakhla). Les mécanismes de base qui conditionnent ces upwellings sont liés à la présence dans ces régions, en certaines périodes de l’année, de vents Nord-Est au Sud-Ouest (les alizés). Le cisaillement en surface dû à ces vents combiné à l’effet de Coriolis engendre dans ces zones, un transport global des masses d’eaux côtières vers le large (transport d’Ekman). Ces eaux sont aussitôt remplacées par des masses d’eaux froides et riches en éléments nutritifs, remontant du fond de l’océan. Ce phénomène d’upwelling permet un enrichissement permanant de nos côtes en éléments nutritifs, ce qui favorise la dynamique biologique de cet écosystème.
Différentes études ont été menées et ont confirmé que la dynamique des stocks des poissons pélagiques côtiers est étroitement associée à celle des facteurs environnementaux tels que l’intensité et la variabilité saisonnière et interannuelle des upwellings, les aspects de la production primaire ou secondaire ainsi que les caractéristiques hydrodynamiques. On peut citer les travaux de Furnestin (1953, 1957, 1959, 1970), Grall et al.(1974) , Minas et al.(1982), Belevèze (1983, 1984), Roy (1991) et Orbi et al. (1991).
La connaissance des conditions hydroclimatiques régnant sur le plateau continental de la région est indispensable à la compréhension de la répartition des espèces et de leurs déplacements saisonniers. Elle permet aussi d’expliquer la forte productivité biologique, donc la richesse et la diversité des ressources halieutiques dans cette zone.
Ainsi dans ce chapitre nous abordons les différents contextes, notamment physique météorologique, hydro-climatique et trophique de notre zone d’étude et l’importance de leur variabilité sur la production primaire et secondaire.
I. 1. Plateau continental
La côte atlantique marocaine est une côte à longs segments rectilignes s’étendant du cap Spartel (36°N) au cap Blanc (21°N) et présentant une succession de plages et de falaises, en grande partie couverte de dunes anciennes consolidées, donnant des alignements de crêtes et de sillons de même orientation générale que le littoral lui- même.
Les accidents marqués (embouchures des fleuves, promontoires rocheux et îles) y sont rares et n’arrivent pas à former d’abris le long de ce rivage partout exposé au vent et toujours battu par la grande houle du large. Les seules indentations qui le coupent de place en place sont les caps qui signalent des changements brusques de direction ; cap Spartel, cap Cantin, cap Sim, cap Ghir, cap Juby et cap Blanc (Figure 4).
Le plateau continental de l'Atlantique marocain a une extension variable, allant entre 50 et 150 km (Hagen, 2001). Il est caractérisé par une pente douce de moyenne toujours inférieure à 1‰ entre la côte et la profondeur de 130 à 160 m puis une brusque plongée en un talus dont l’inclinaison peut atteindre 25‰ jusqu’aux fonds de 250 à 300 m (Refk, 1985).
I. 2. Oscillations Nord Atlantique (NAO)
L’oscillation Nord Atlantique est le phénomène dominant dans la dynamique atmosphérique de l’Atlantique nord tout au long de l’année, mais il est plus prononcé pendant l’hiver et explique plus du tiers de la variabilité de la pression au niveau de la mer (Ottersen et al., 2001). L’impact de la NAO en hiver s’étend de la Floride au Groenland et du Nord Ouest Africain en passant par l’Europe jusqu’au Nord de l’Asie (Visbeck et al., 2001). Ainsi, dans le Nord Ouest Africain, il est observé que lorsque la NAO est positive, un fort gradient de pression se positionne jusqu’à la latitude de Nouadhibou (Mauritanie). Ce gradient est responsable de l’intensification des alizés et par conséquent il s’en suit un refroidissement des eaux.
Figure 4 : Caps de la côte atlantique marocaine.
Une dépression est observée sur la même latitude quand la NAO est négative ce qui favorise un affaiblissement des vents des alizés et donc un réchauffement des eaux le long du littoral nord ouest africain. L’oscillation consiste en un dipôle nord-sud d’anomalies standardisées. Le premier est localisé aux Açores (hautes pressions). Le second au-dessus de l’Islande (basse pression). Si on a une NAO positive (NAO+
) la pression atmosphérique augmente aux Açores et diminue en Islande. Cette situation est responsable du renforcement de l’anticyclone aux Açores et de la dépression en Islande (la pression diminue). En revanche, lorsque la NAO est négative (NAO-) le contraire se produit
accompagné d’un affaiblissement de l’anticyclone au niveau des Açores et de la dépression en Islande (la pression augmente) (Visbeck et al., 2001).
La NAO se manifeste principalement en hiver et sa relation avec le vent, la température et les champs de pression est forte à cette période. Cela suggère que des mécanismes écologiques ayant lieu en hiver sont les plus affectés par la NAO que ceux qui surviennent en été (Ottersen et al., 2001).
I. 3. Climat et courants
La côte atlantique marocaine est située sous l’emprise de l’anticyclone des Açores qui est variable en valeur absolue et en position géographique. Son évolution conditionne en grande partie la climatologie marocaine. Le déplacement saisonnier de l’anticyclone des Açores, de la dépression saharienne et de la zone intertropicale de convergence déterminent le balancement des alizés et donc la position et l’intensité des upwellings le long de la côte ouest africaine (Wooster et al., 1976).
En hiver, le système est décalé vers le sud. Le nord de la façade atlantique marocaine est atteint par les dépressions issues du front boréal. Elles amènent de la pluie de Gibraltar aux Canaries. Il n’y a pas de remontée d’eau au nord du cap Juby (28° N). Mais au sud de ce cap, la circulation superficielle dirigée vers le sud, accompagnée de résurgences, se fait sentir jusqu’au front des Bissagos (12 ° N) (Figure 5a).
En été, l’anticyclone des Açores exerce son influence sur tout le littoral marocain. La dérive superficielle (courant des canaries) se dirige vers le sud-ouest et les affleurements d’eaux profondes ont lieu du Maroc à la Mauritanie (35 à 20°N) (Figure 5b). Cette circulation superficielle au-dessus du plateau, largement dépendante du régime éolien (alizés), est généralement dirigée vers le sud, c’est le courant des canaries. De 20° à 25° N, les remontées d’eau sont permanentes, encadrées au nord par une zone où elles n’ont lieu qu’en été et au sud où elles n’ont lieu qu’en hiver (Binet, 1991).
Les upwellings côtiers sont liés au flux méridional. Tant que les alizés restent forts, le flux sud prévaut et il se produit des remontées d’eau (Mittelstaedt, 1983). L’inverse ne se produit que lorsque les alizés faiblissent.
Le long de la côte ouest africaine, il existe également un ensemble de courants dirigés vers le nord, à l’opposé de la dérive générale des alizés. Ce système est situé en sub-surface ou en profondeur, au-dessus du plateau ou du talus continental. Il atteint parfois la surface.
L’une des branches de ce sous-courant vient du fond du golfe de Guinée (Binet, 1991). Au nord, le système s’enfonce et s’éloigne de la côte. Devant la Mauritanie, le contre-courant subsuperficiel est encore situé sur la partie externe du plateau vers 60 m de profondeur tandis que le noyau du sous-courant profond est entre 100 et 200 m, à une centaine de kilomètre de la côte, au-delà du plateau continental (Mittelstaedt, 1982).
La probabilité de trouver un flux sub-superficiel nord, au large du plateau s’amenuise de 20 à 25° N. L’enfoncement du courant profond se poursuit au fur et à mesure qu’il se dirige vers le nord : 400 à 500 m vers 25° N et 500 à 1000 m vers 30 à 34° N.
Figure 5 : Circulation superficielle théorique : les flèches blanches indiquent
I. 4. Hydrologie
I. 4. 1. Température et salinité
Furnestin (1957) a étudié la dynamique spatio-temporelle de la température et de la salinité de surface de la zone côtière du Maroc entre cap Spartel et cap Juby. Il a constaté d’une manière générale que les isothermes et les isohalines sont parallèles au rivage. Les eaux ont une température ainsi qu’une salinité croissante de la côte vers le large et du Nord vers le Sud, ce-ci est presque pareil pour toutes les saisons de l’année. La caractéristique estivale se résume dans une augmentation de la salinité et de la température de la couche superficielle par rapport au printemps et ce-ci est dû à l’insolation. Au printemps, les eaux de la zone côtière sont à tous les niveaux nettement moins salées qu’en hiver. Cette chute de salinité est surtout attribuée à une forte montée des eaux profondes vers la surface tout le long de la côte. En automne, la salinité et la température de surface connaissent de fortes augmentations par rapport à l'été. Les eaux du large approchent toujours le rivage selon une orientation Nord-Est et se heurtent à la poussée au sens opposé des eaux côtières en retrait vers les couches profondes de 100m et de 200m.
Ces observations sont bien en accord avec celles de Chbani (1985) et Laroche et Idelhaj (1988) qui ont signalé que quelle que soit la saison (fin de l’hiver, printemps et automne), les isothermes de surface étaient plus ou moins parallèles à la côte et de température croissante de la côte vers le large. Des affleurements d’eaux froides du fond sont donc observés près de la côte aux trois saisons.
Des données plus récentes des campagnes océanographiques à bord du navire russe AtlantNiro, entamées le long de la côte atlantique marocaine de 1994 à 1998, ont montré une anomalie de température positive des eaux atlantiques marocaines de l’ordre de 2°C plus marquée durant les saisons hivernales qu’estivales, accompagnée d’une légère augmentation de la salinité. Les régions les plus affectées par cette variabilité ont concerné la zone cap Juby (Tarfaya)-cap Blanc (Lagouira), en particulier cap Juby-Dakhla (Berraho, 2007).
I. 4. 2. Upwelling
Une caractéristique essentielle des côtes atlantiques marocaines est la présence de remontées d’eaux froides profondes (upwelling), entraînant un enrichissement des eaux côtières en sels nutritifs et une forte productivité biologique.
Le phénomène d’upwelling est généralement attribué à l’influence de l’alizé du Nord-Est qui souffle parallèlement à la côte. Le courant des Canaries transporte des eaux de surface vers le Sud le long de la côte nord-ouest africaine. Dans cette zone, c’est donc la combinaison du courant des Canaries et des effets de dérive des eaux superficielles par les alizés qui provoque des remontées d’eaux profondes (Belvèze, 1984). Ces eaux sont ensuite entraînées vers le large, en dehors de la zone de remontée, par la dérive de surface (Roy, 1992). La zone d’upwelling est bien séparée des eaux chaudes du large par une zone frontale superficielle (Hagen, 2001).
I. 4. 3. Fluctuations spatio-temporelles des upwellings
Le long du courant des Canaries, les upwellings ne sont pas réguliers. Les remontées se produisent plus souvent en certains points du littoral, favorisées par la topographie et le régime des vents, notamment au voisinage de certains caps : du cap Sim (Safi) au cap Ghir (31°N) et du cap Corveiro (22°N) au cap Blanc, (Grall et al., 1974 ; Binet, 1988 ; Mittelstaedt, 1991 ; Longhurst, 1998).
D'autre part, la résurgence n'a pas lieu partout de la même façon. Jaques et Treguer (1986) estiment que sur la côte nord-ouest africaine, bordée par un plateau relativement large et peu profond, il existe une double cellule de remontée : l'une à la côte, l'autre aux Açores. Ce schéma évolue avec l'intensité du vent, la cellule du large prédomine par vent fort. Un changement dans la direction du vent déplace la zone de remontée ou la supprime même complètement. De même les alizés ne sont pas d'une régularité absolue et l'upwelling ne se déclenche pas immédiatement après le renforcement du vent. Au large du Sahara, l'affleurement des eaux ne se produit qu'après un jour de vent favorable (Jones et Halpern, 1981 ; Rébert, 1983).
Orbi et al. (1992) ont signalé que l'indice d'upwelling mensuel dans la zone comprise entre Safi et Sidi Ifni, se caractérise en moyenne de 1980 à 1990, par deux maxima : l'un est situé
en avril/ mai et l'autre en juillet/ août. Ce résultat fut prononcé en 1990 par rapport à la moyenne. Au sud entre Sidi Ifni et Laâyoune, le maximum de l'intensité de l'upwelling se situe entre mai et août. Par contre du cap Bojador (Boujdor) au cap Blanc (Lagouira), l'upwelling est relativement très fort par rapport aux autres zones et existe toute l'année avec un maximum en été. En outre, les travaux de Hughes et Barton (1974), Speth et Detlefsen (1982), Parrish et al. (1983), Laroche et Idelhaj (1988), Pelegri et al. (2005) ont décrit le déroulement saisonnier de l’upwelling dans les côtes sahariennes (21° à 26°N). Dans cette zone, l’upwelling est considéré comme quasi permanant durant l’année et particulièrement actif de mai à octobre avec un maximum d’intensité en été. Ces remontées sont localisées au niveau de deux zones : l’une entre le cap Boujdor et Dakhla (Makaoui, 2008) et l’autre entre cap Barbas et cap Blanc (Van Camp et al., 1991 ; Nykjaer et Van Camp, 1994 ; Barton et al., 1998 ; Hagen, 2001 ; Makaoui, 2008).
Au nord des côtes sahariennes, entre cap Cantin-cap Ghir (zone A) et cap Drâa-cap Juby (zone B), l’upwelling est saisonnier et se produit entre les mois de mars et août (Furnestin, 1948, 1956, 1959 ; Binet, 1988 ; Roy, 1991 ; Hilmi et al., 1998 ; Makaoui et al., 2005 ; Makaoui, 2008). Roy (1992) a analysé les variations inter-annuelles de l’intensité de l’upwelling au niveau de la zone située entre 25°N et 30°N. Il a constaté un accroissement continu de l’indice d’upwelling enregistré entre 1964 et 1988. De 16°N à 25°N, l’indice d’upwelling était maximal dans les années soixante-dix puis diminue jusqu’à la fin des années quatre-vingt.
I. 4. 4. Filaments
Les images par satellites dans les systèmes d’upwellings montrent l’expansion de filaments froids et riche en chlorophylle vers le large (Bernstein et al., 1977 ; Kostianoy et Zatsepin, 1996 ; Dvenport et al., 1999). L’upwelling exerce une influence «biologique » jusqu’à plusieurs centaines de kilomètres et dépasse de cette façon de 2,5 à 3,7 fois la zone « physiquement » déterminée dans la région du cap Blanc (Pastel, 1985). Au Maroc, ces filaments se développent sur plusieurs centaine de kilomètres devant cap Ghir, cap Juby et cap Blanc (Van Camp et al., 1991 ; Hernandez-Gherra et al., 1993 ; Nvarro-Perez et Barton, 1998). Ces filaments sont présents dans la majeure partie de l’année avec d’importantes variations inter-annuelles (Van Camp et al., 1991) et jouent un rôle important dans le transfert des masses d’eaux de la zone côtière vers le large (Kostianoy et Zatsepin, 1996).
I. 5. Production primaire et secondaire
Plancton végétal et animal sont, dans les réseaux trophiques, le relais entre le processus physico-chimique d'enrichissement et les petits poissons pélagiques. La production planctonique apporte l'énergie nécessaire à la croissance et à la reproduction des poissons adultes, au développement de leurs larves. Elle va donc, en partie, conditionner le succès d'une cohorte et son recrutement, mais aussi ces déplacements trophiques et sa disponibilité à la pêcherie.
I. 5. 1. Phytoplancton
L’upwelling conduit à un enrichissement des eaux superficielles en sels minéraux, et donc à une stimulation directe de la production primaire qui est à la base de toute la chaîne trophique. Jones et Halpern (1981), Grall et al. (1982) ont montré que des vents forts provoquent de puissantes remontées d’eau en surface, mais empêchent en même temps la production primaire de se développer rapidement en créant par un fort brassage une complète homogénéité verticale et une augmentation de la turbidité. Un fort indice d’upwelling ne conduit donc pas systématiquement à une productivité biologique optimale. Grall et al. (1974) ont distingué au niveau de cap Drâa, trois niveaux de production primaire :
le niveau superficiel pauvre en chlorophylle, la température y est très élevée et les sels nutritifs sont peu abondants,
le niveau intermédiaire coïncide avec les forts gradients en température et en sels nutritifs, caractérisé par une dizaine de mètres d’épaisseurs de fortes teneurs en chlorophylle et
le niveau inférieur, siège des phénomènes régénératifs, est riche en sels minéraux mais pauvres en oxygène et en pigments chlorophylliens.
Ces observations sont en accord avec ceux de Le Corre et Tréguer (1976) effectuées dans la zone située entre Sidi Ifni et cap Drâa.
I. 5. 2. Zooplancton
Le zooplancton est plus riche dans la zone néritique de la partie sud et c'est dans cette région que les variations saisonnières liées aux remontées d'eaux sont les plus marquées avec un maximum en automne et un minimum en été (Furnestin, 1957). En effet, l'auteur note un appauvrissement assez étonnant du zooplancton qui s'accentue et se généralise avec l'extension et l'épanouissement en surface des eaux ascendantes ; l’enrichissement ne se produit qu’au moment du mélange de ces eaux du large. Cet appauvrissement assez étonnant du zooplancton en saison de remontée d’eau, serait dû à des phénomènes d’eau rouge et d’exclusion animale. Quelques groupes ont été particulièrement étudiés : les Siphonophores, les Appendiculaires, les Salpes, les Cladocères et surtout les chaetognathes. Les résultats de Thiriot (1976) et de Somoue (2004) ne concordent pas avec ceux de Furnestin quant à la pauvreté du plancton estival. En janvier-mars, le zooplancton est pauvre et présente peu de différences d’un secteur à l’autre. En été, au contraire, les biomasses sont élevées et concentrées dans la région du cap Ghir. Le secteur sud, pourtant également riche en phytoplancton, est pauvre en zooplancton, cela est peut-être dû à une prolifération de Radiolaires du genre Aulacantha sp. Thiriot (1976) attribue ces différences observées à une exclusion animale due aux Salpes, celles-ci, nombreuses dans les prélèvements de Furnestin, étaient relativement rares dans les siens.
I. 5. 3. Transfert de la production primaire vers le zooplancton
Selon les latitudes, les régions et les climats, les maxima de phyto et zooplancton sont simultanés ou décalés dans le temps. On dit que les cycles de production sont, respectivement, équilibrés ou déséquilibrés.
Au large du Maroc, Furnestin (1957, 1976) a noté un décalage important entre, d’une part, la remise en circulation des sels nutritifs et le développement du phytoplancton dans l’upwelling, au printemps et en été, et d’autre part, le développement maximal des populations herbivores qui n’a lieu qu’à l’automne, lorsque l’intensité des résurgences diminue. Dans les régions où le vent fort se maintient longtemps, l’upwelling est intense et permanant. Les poussées phytoplanctoniques n’ont lieu que sur les franges du panache des eaux résurgentes (Grall et al., 1974 ; Dupouy et al., 1986). Le rapport des biomasses
auto+hétérotrophes/producteurs primaires montre que la meilleure utilisation du phytoplancton par le zooplancton se fait à une grande distance de la source de l’upwelling. Entre le cap Ghir et Agadir, cette distance est de l’ordre de 60 milles (Grall et al., 1974). Les plus fortes biomasses de zooplancton sont souvent rejetées au large (Hargreaves, 1978 ; Vives, 1974 ; Weikert, 1984 ; Olivar et al., 1985) contrairement à ce qu’en observe généralement. C’est également au-delà des Açores que les zooplanctontes de grande taille sont les plus nombreux (Blackburn, 1979). Le transfert de la production primaire en secondaire se fait mal, au dessus du plateau, à cause de la durée de développement des copépodes. Le schéma de deux cellules de résurgence au large du Sahara (Jacques et Tréguer, 1986), s’appuie sur la distinction des classes de taille du zooplancton établie par Blackburn (1979). Les espèces de petite taille sont au-dessus du plateau, elles n’utilisent qu’une partie de la production primaire. Le reste sédimente ou dérive au large avant d’être brouté par les espèces plus grandes (notamment des euphausiacés et des salpes). Entre les deux cellules, Schultz (1982) remarque, au nord du cap Blanc, de fortes concentrations d’Acartia clausi, entre 200 et 450 m. Il suppose qu’ils pourront revenir dans les régions productives, entraînés dans une remontée d’eau.
Le cap Blanc, sépare la région d’alternance nord et la région subtropicale (Berrit, 1973). C’est une limite faunistique pour les peuplements benthiques (Intès et Le Louff, 1982), planctoniques et ichtyoplanctoniques (Haman et al., 1981). On a attribué ce changement à la nature des eaux de résurgence : eaux centrales nord-atlantique au nord du cap Blanc, eaux centrales sud-atlantique au sud. En effet, cette frontière faunistique est bien due à un changement dans le système de courant (Schulz, 1982). Il n’y a plus presque de transport vers le nord, dans les eaux subsuperficielles, au nord du cap Blanc et le contre-courant s’enfonce trop profondément pour pouvoir alimenter les eaux côtières en espèces tropicales au nord de 22° N. Le front entre ces deux couches migre saisonnièrement et se localise en février au nord du cap Blanc et plus au sud de mars à mai (Ould Dedah, 1995).
II. Présentation de l’espèce
II. 1. Classification hiérarchique
Les espèces sont regroupées de façon hiérarchique en genre, les genres en familles, les familles en ordres, les ordres en classes, les classes en phylum et les phylums en règnes. Cette classification se veut le reflet du degré de parenté entre espèces. Les espèces du même genre sont plus apparentées que les espèces de la même famille. La place de la sardine dans cette classification est :
Règne Animal Phylum Chordés Super classe Poissons Classe Ostéichtyens
Sous-classe Actinoptérygiens Super ordre Téléostéens Ordre Clupéiformes. Famille Clupéidés Genre Sardina
Espèce Sardina pilchardus (Walbaum, 1792)
II. 2. Caractéristiques de Sardina pilchardus (Walbaum, 1792)
Cette espèce est caractérisée par une mâchoire légèrement saillante et une carène ventrale peu développée. Les opercules portent des cannelures radiaires. Sa nageoire dorsale est située en avant des pelviennes. La nageoire anale se caractérise par un allongement au niveau des deux derniers rayons. Le dos est d'une couleur bleu-vert, olive occasionnellement. Les flancs sont dorés et le ventre argenté. Une rangée de tâches sombres se trouve le long de chaque flanc. Les écailles sont grandes, argentées, fragiles et ne s'étendent pas jusqu'à la tête. La taille maximale de la sardine est de 25 cm en Atlantique et de 22 cm en Méditerranée. La taille commune est de 10 à 20 cm, (Holden et al., 1974).
II. 3. Différences avec les autres espèces les plus similaires
La sardine peut se distinguer des jeunes aloses par l'absence d'une fente médiane à la mâchoire supérieure et par la position de l'extrémité postérieure de la bouche. Chez la sardine, cette dernière est située en avant de la verticale qui passe par le centre de l'oeil.
Les deux espèces de sardinella, Sardinella aurita et Sardinella maderensis, diffèrent de Sardina pilchardus par l'absence de stries rayonnantes sur l'opercule et des points sombres sur les côtés du corps.
La sardine se différencie du hareng par son opercule strié tandis que celui du hareng est lisse et sans taches.
II. 4. Répartition géographique
La température est un facteur agissant sur la distribution de la sardine qui est une espèce sténotherme. L'isotherme 10°C marque, plus ou moins, la limite nord des populations de sardine et l'isotherme 20°C la limite sud (Furnestin, 1952).
La sardine, Sardina pilchardus est rencontrée le long des côtes atlantiques et méditerranéennes d'Europe et d'Afrique. En Méditerranée, elle est très commune dans le bassin occidental, rare dans le bassin oriental. Elle est totalement absente sur les côtes libyennes. Elle est abondante le long des côtes françaises de la Méditerranée, en particulier
dans le golfe de Lion. Dans l'océan Atlantique la sardine se répartit depuis Dogger Banc en mer du nord jusqu'au sud du cap Blanc (Lagouira) en Mauritanie et au Sénégal (Fréon et Stequert, 1978). La sardine se rencontre également dans les archipels des Açores, de Madère et des Canaries (Furnestin, 1952 ; Silva, 2003) (Figure 6). Sur la côte du nord-ouest de l’Afrique, l’aire d’extension des sardines est très liée à celle des upwellings côtiers. Au niveau des côtes atlantiques marocaines, la sardine se répartit du cap Spartel au cap Blanc (Figure 7) mais sa répartition est discontinue (Belvèze, 1984) :
Un premier groupement se situe entre cap Spartel et El Jadida. Un deuxième groupement se situe entre Safi et la baie d’Agadir. Un troisième groupement s’étend de Sidi Ifni à Laâyoune. Un quatrième groupement, au sud du cap Bojador.
La limite sud de sa répartition est conditionnée par la position du front thermique des eaux tropicales.
Figure 6 : Aire de répartition de la sardine (d'après Fisher et al., 1987)
Les fortes concentrations de sardines se rencontrent au-dessus des fonds compris entre 25 et 80 m (Furnestin, 1952). Elles sont surtout abondantes entre 15 et 40 m durant la nuit et à des profondeurs allant de 30 à 55 m pendant le jour (Holden et al., 1974). Dans la zone sud, la sardine peuple les eaux de profondeur allant jusqu'à 200 m et avec des températures en hiver variant de 13,8 à 18,2°C et en été de 16,7 à 18,7°C (INRH, 2002).
Les migrations saisonnières des sardines correspondent à des phénomènes saisonniers d’extension et de concentration de la population en relation avec le développement de l’upwelling entre cap Cantin et cap Ghir et non à une migration de la totalité de la population (Belvèze et Erzini, 1983). Lorsque les eaux commencent à se réchauffer pendant le printemps, la sardine de la zone nord (Tanger - El Jadida) et de la zone sud (Sidi Ifni – Boujdor) se déplacent vers la zone centrale (Agadir - Tarfaya) où se localise le centre de l’upwelling estival et où les conditions pour la croissance sont favorables. En Automne avec l’affaiblissement de l’upwelling dans la zone centrale, la sardine effectue une migration inverse pour des besoins de reproduction.
Le stock C de Sardina pilchardus effectue un mouvement de balancement entre le cap Bojador (26° N), en octobre-nombre et le cap Timiris (19° N), en mars (FAO, 1985). Ce qui correspond au déplacement saisonnier de l’upwelling (Binet, 1991).
Figure 7 : Zones de répartition et aires de ponte de la sardine au niveau des côtes atlantiques marocaines (source : INRH, 2002).
Les exigences écologiques se manifestent dans la répartition géographique comme dans les variations locales de disponibilité. La pêche des sardines était souvent meilleure là où la production primaire était la plus élevée (Nehring et Holzlöner, 1982 in Binet, 1996).
II. 5. Unités de stock au Maroc
Les sardines vivant le long des côtes marocaines ont été séparées en quarte unités de stocks distinctes (Furnestin, 1950 ; Furnestin et Furnestin, 1970; Belvèze, 1984) :
La sardine méditerranéenne forme une unité de stock séparée des autres par le détroit de Gibraltar.
Stock nord atlantique marocain, entre Larache et Casablanca.
Le stock central qui comprend les sardines de la région située entre Safi et Sidi Ifni (Zone A) et entre le sud de Sidi Ifni et Lâayoune (zone B).
Stock sud qui s’étend du Cap Bojador au Cap Blanc ou zone C (Figure 8).
Actuellement, le long de la côte atlantique marocaine deux stocks de sardines sont génétiquement identifiés quelque soit la saison d’étude. Un stock au nord du Maroc regroupant les sardines d’Agadir, de Safi, de Larache et de Sidi Ifni et un autre stock au sud du Maroc s’étalent de Tarfaya jusqu’à Dakhla (Chlaïda, 2009). La zone de transition entre les deux stocks se situe entre Sidi Ifni et Tarfaya, cette zone est occupée par le stock sud en hiver et par le stock nord en été. De ce fait, la limite entre les deux stocks se situe en hiver au niveau de Sidi Ifni et en été cette barrière se trouve au niveau de Tarfaya.
II. 6. Régime alimentaire
Les clupéidés sont en générale microphages filtreurs (zooplancton et/ou phytoplancton) (Longhrust, 1971). Ils occupent une position intermédiaire dans la chaîne alimentaire et subissent donc la prédation à tous les stades de leur développement aussi bien par des individus de la même espèce (aux stades larvaires) que par les thonidés, les scombridés, les mammifères marins et certains oiseaux.
Figure 8 : Unités de stock et zones de pêche (Pêcheries Nord, A, B et C) de la sardine le long de la côte atlantique marocaine. (FAO, 1997).
Les sardines sont planctophages, mais le type d'aliments ingérés varie en fonction de leur âge. Les larves se nourrissent essentiellement de phytoplancton (diatomées), Tandis que les juvéniles et les adultes ont un régime alimentaire beaucoup plus varié.
La place du phytoplancton (diatomées et péridiniens) est beaucoup moins importante, alors que, le zooplancton, et surtout les crustacés, sont largement prédominants. Ainsi, elles pourraient se nourrir presque exclusivement de phytoplancton pendant les saisons d'upwelling et de zooplancton entre ces périodes (Nieland, 1980 in Binet, 1988).
Par ailleurs, Cushing (1978), a remarqué que la longueur du tube digestif des sardines (1,5 fois la longueur du corps), est nettement plus importante que celle des clupéidés strictement zoophages (0,5 fois la longueur du corps). Cet allongement serait l'indice d'une certaine adaptation à un régime phytoplanctonique des sardines.
II. 7. Reproduction
Les zones de ponte et les nourriceries se situent dans des secteurs où la production est apte à satisfaire les besoins énergétiques des larves et où la dérive superficielle, n’entraîne pas de pertes excessives par advection.
Les oeufs de la sardine sont présents tout au long de la côte atlantique marocaine (Furnestin et Furnestin, 1959 ; Domanevsky et al., 1976 ; Ettahiri, 1996 ; Ettahiri et al., 2003 ; Berraho, 2007). Des concentrations sont rencontrées entre Larache et Casablanca, entre cap Cantin et cap Sim, entre cap Ghir et Sidi Ifni, entre cap Draa et cap Juby, entre cap Bojdor et la baie de Cintra et entre cap Barbas et cap Blanc (Figure 7). La ponte de la sardine a lieu durant toute l’année mais principalement en hiver et secondairement au printemps et en été (Ettahiri et al., 2003 ; Amenzoui et al., 2004 ; Amenzoui et al., 2005 ; Amenzoui et al., 2006 ; Berraho, 2007).
La température constitue le facteur extérieur le plus important pour la reproduction de la sardine. C'est à ses variations qu'on doit attribuer les différences saisonnières et géographiques constatées. La marge thermique dans laquelle s'inscrit la ponte est plutôt étroite, 15°5 à 20°C, l'optimum s'établissant entre 16 et 18°C. La ponte est faible et éparse si l'hiver est froid, elle est forte et d’étendue restreinte si l'hiver est chaud (Furnestin et Furnestin, 1959). En effet, la température n’a pas un effet direct sur la ponte de la sardine. Mais cette dernière développe une adaptation face aux conditions thermiques de son écosystème (Ettahiri, 1996 ; Berraho, 2007). Les températures d’émission des œufs de la sardine se localisent dans la fenêtre thermique entre 16° et 19°C en hiver et entre 18° et 20°C en été (Ettahiri, 1996 ; Ettahiri et al., 2003). En revanche, la salinité n’est pas un facteur déterminant pour la ponte de la sardine (Furnestin et furnestin, 1959 ; Berraho, 2007).
I. Echantillonnage
Nous avons utilisé un échantillonnage systématique au 1/10 et qui consiste à choisir au hasard un premier bateau parmi les dix premières unités et à échantillonner par la suite les unités débarquant à des pas de dix dans l'ordre d'entrée des bateaux (Belvèze, 1984). Un échantillon aléatoire d’environ 5 kg de poissons a été prélevé pour les mensurations de taille et l’étude des distributions des fréquences de taille.
Vu la taille de l'échantillon, il est impossible d'obtenir pour chaque poisson des informations concernant le poids individuel, le sexe, le poids des gonades, le stade de maturité sexuelle et l'âge. Il est donc nécessaire de procéder à une technique dite de double échantillonnage qui consiste à prélever un sous échantillon de cinq à dix individus par classe de taille de 0,5 cm inférieur de l’échantillon initial. Si l'échantillon contient un mélange d'espèces, celui ci est trié par espèce avant d’effectuer les mensurations biologiques.
Lors de l’opération d’échantillonnage, les informations collectées portent sur le poids de l’échantillon, le nom du port, du bateau, la zone et la date de pêche et le poids de la pêche.
II. Mesures et prélèvements
Les échantillons de sardines étudiées proviennent des débarquements commerciaux réalisés entre 1999 et 2006 (Annexe 1) dans les zones de Safi (32°21'16"N 9°17'16"W-32°14'31"N 9°15'44"W), Agadir (30°36'37"N 9°55'16"W-30°13'49"N 9°39'02"W) et Laâyoune (27°50'56"N 12°5'33"W-27°03'38"N 13°28'38"W), (Figure 9). D’autres échantillons ont été collectés à partir de la pêche expérimentale réalisée en hiver 2007 lors des compagnes hydro-acoustiques à bord du navire de recherche Al Amir Moulay Abdellah, et ont constitué du matériel pour l’étude de la fécondité.
La fréquence d’échantillonnage est mensuelle et en fonction de la disponibilité des sardines. En effet, les sardines effectuent des migrations, elles ne sont pas toujours disponibles dans les zones de pêches. De plus les conditions météorologiques ne sont pas toujours favorables à la pêche.
Figure 9 : Zone d'étude
Pour chaque individu échantillonné ont été notés :
- La longueur totale a été mesurée (à l’aide d’un ichtyomètre gradué au millimètre) de l’extrémité du museau à l’extrémité de la nageoire caudale et rapportée au ½ cm inférieur. - Le poids total, au dixième de gramme près.
- Le poids des gondes, au dixième de gramme près. - Le sexe et le stade macroscopique de maturité sexuelle.
Pour la détermination de l’âge de la sardine, cinq à dix paires d’otolithes par classe de taille de 0,5 cm inférieur ont été prélevées.
Des échantillons d’ovaires ont été prélevés pour fournir du matériel nécessaire à l’étude de la fécondité, de l’histologie ovarienne et de la distribution des fréquences des diamètres ovocytaires à chaque période de l’année. La méthode utilisée a été celle de Fontana (1969) et qui consiste à prélever un échantillon dans la partie médiane de l’ovaire.
En effet, l’homogénéité de la répartition des ovocytes, de point de vue nombre et état de maturation, dans différentes zones de l’ovaire de Sardina pilchardus a été testé (Pérez et al., 1992 ; Ganias et al., 2003 ; Amenzoui et al., 2006). Ces études ont confirmé qu’il n’existe pas de répartition différentielle entre les différentes parties de l’ovaire : les ovocytes de différents diamètres se répartissent au hasard au sein de l’ovaire. Cela nous a permis d’admettre que la distribution de fréquence d’un échantillon est représentative de celle de l’ensemble des ovocytes de l’ovaire.
Les échantillons d’ovaires destinés à l’étude histologique de l’ovogenèse ont été fixés au Bouin alcoolique (Annexe 2). Les pièces peuvent y séjourner une semaine. Après fixation, les échantillons ont été déshydratés en utilisant des bains d’éthanol de degré croissant. Puis, ils ont été placés dans des bains de toluène avant d’être inclus à la paraffine (Martoja et Martoja, 1967). Les échantillons ont été coupés à cinq ou six µm d’épaisseur au microtome. Pour la coloration des lames nous avons utilisé une coloration topographique (l’hématoxyline et l’éosine) susceptible de mettre en évidence les structures du noyau, du cytoplasme et des enveloppes folliculaires. Les résultats ont été exploités en microscope photonique. Alors que les échantillons réservés à l’étude de la fécondité et le suivi de la distribution des diamètres ovocytaires dans le temps ont été conservés dans le liquide de Gilson (Annexe 2) dont la formule due à Franz (1910) et modifiée par Simpson (1951). Le liquide de Gilson fixe et conserve les ovocytes tout en dissociant le tissu ovarien. Au bout de plusieurs mois. Les ovocytes sont libres, ils peuvent alors être comptés et mesurés.