Université d’Aix-Marseille – Faculté de Pharmacie – 27 bd Jean Moulin – CS 30064 - 13385 Marseille cedex 05 - France Tél. : +33 (0)4 91 83 55 00 - Fax : +33 (0)4 91 80 26 12
THESE
PRESENTEE ET PUBLIQUEMENT SOUTENUE DEVANT LA FACULTE DE PHARMACIE DE MARSEILLE
LE 19 DECEMBRE 2017 PAR
Mme BRUYERE LISE Née le 21/08/1992 à PERTUIS (84)
EN VUE D’OBTENIR
LE DIPLOME D’ETAT DE DOCTEUR EN PHARMACIE
TITRE : LES INHIBITEURS DE LA VOIE JAK : NOUVELLE
CLASSE PHARMACOLOGIQUE DANS LA PRISE EN CHARGE DE
LA POLYARTHRITE RHUMATOIDE
JURY :
Président : PICCERELLE Philippe Membres : LAMY Edouard BORNET Charleric
Mise à jour : 1/12/2015
27 Boulevard Jean Moulin – CS 30064 - 13385 MARSEILLE Cedex 05 Tel. : 04 91 83 55 00 – Fax : 04 91 80 26 12
ADMINISTRATION :
Doyen : Mme Françoise DIGNAT-GEORGE
Vice-Doyens : M. Jean-Paul BORG, M. Philippe CHARPIOT, M. Pascal RATHELOT Chargés de Mission : M. David BERGE-LEFRANC, M. François DEVRED, Mme Caroline
DUCROS, Mme Pascale BARBIER Conseiller du Doyen : M. Patrice VANELLE
Doyens honoraires : M. Jacques REYNAUD, M. Pierre TIMON-DAVID, M. Patrice VANELLE Professeurs émérites : M. José SAMPOL, M. Jean-Pierre REYNIER
Professeurs honoraires : M. Guy BALANSARD, M. Jacques BARBE, M. Yves BARRA, Mme Claudette BRIAND, M. Jacques CATALIN, Mme Andrée CREMIEUX, M. Aimé CREVAT, M. Bernard CRISTAU,
M. Gérard DUMENIL, M. Alain DURAND, Mme Danielle GARÇON, M. Maurice JALFRE, M. Joseph JOACHIM, M. Maurice LANZA, M. José MALDONADO, M. Patrick REGLI, M. Jean-Claude SARI Chef des Services Administratifs : Mme Florence GAUREL
Chef de Cabinet : Mme Sandrine NOURIAN Responsable de la Scolarité : Mme Myriam TORRE
DEPARTEMENT BIO-INGENIERIE PHARMACEUTIQUE
Responsable : Professeur Philippe PICCERELLE
PROFESSEURS
BIOPHYSIQUE M. Vincent PEYROT
M. Hervé KOVACIC
GENIE GENETIQUE ET BIOINGENIERIE M. Christophe DUBOIS
PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE,
Mise à jour : 1/12/2015 MAITRES DE CONFERENCES
BIOPHYSIQUE M. Robert GILLI
Mme Odile RIMET-GASPARINI Mme Pascale BARBIER M. François DEVRED Mme Manon CARRE M. Gilles BREUZARD Mme Alessandra PAGANO
GENIE GENETIQUE ET BIOTECHNOLOGIE M. Eric SEREE-PACHA
Mme Véronique REY-BOURGAREL PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE,
BIOPHARMACIE ET COSMETOLOGIE M. Pascal PRINDERRE M. Emmanuel CAUTURE Mme Véronique ANDRIEU Mme Marie-Pierre SAVELLI
NUTRITION ET DIETETIQUE M. Léopold TCHIAKPE
A.H.U.
CULTURE ET THERAPIE CELLULAIRE M. Jérémy MAGALON
ENSEIGNANTS CONTRACTUELS
ANGLAIS Mme Caroline MONTET
DEPARTEMENT BIOLOGIE PHARMACEUTIQUE
Responsable : Professeur Philippe CHARPIOT
PROFESSEURS
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE M. Philippe CHARPIOT
BIOLOGIE CELLULAIRE M. Jean-Paul BORG
HEMATOLOGIE ET IMMUNOLOGIE Mme Françoise DIGNAT-GEORGE
Mme Laurence CAMOIN
Mme Florence SABATIER-MALATERRE
MICROBIOLOGIE M. Jean-Marc ROLAIN
M. Philippe COLSON PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE ET
Mise à jour : 1/12/2015 MAITRES DE CONFERENCES
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE Mme Dominique JOURDHEUIL-RAHMANI M. Thierry AUGIER
M. Edouard LAMY
Mme Alexandrine BERTAUD Mme Claire CERINI
Mme Edwige TELLIER M. Stéphane POITEVIN
HEMATOLOGIE ET IMMUNOLOGIE Mme Nathalie BARDIN
Mme Dominique ARNOUX Mme Aurélie LEROYER M. Romaric LACROIX
MICROBIOLOGIE Mme Michèle LAGET
M. Michel DE MEO Mme Anne DAVIN-REGLI Mme Véronique ROUX M. Fadi BITTAR
Mme Isabelle PAGNIER Mme Sophie EDOUARD PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE ET
ZOOLOGIE Mme Carole DI GIORGIO M. Aurélien DUMETRE
Mme Magali CASANOVA Mme Anita COHEN
BIOLOGIE CELLULAIRE Mme Anne-Catherine LOUHMEAU
A.H.U.
HEMATOLOGIE ET IMMUNOLOGIE Mme Sylvie COINTE
DEPARTEMENT CHIMIE PHARMACEUTIQUE
Responsable : Professeur Patrice VANELLE
PROFESSEURS
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION M. Henri PORTUGAL Mme Catherine BADENS CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES M. Philippe GALLICE
CHIMIE MINERALE ET STRUCTURALE – CHIMIE THERAPEUTIQUE
M. Pascal RATHELOT M. Maxime CROZET
CHIMIE ORGANIQUE PHARMACEUTIQUE M. Patrice VANELLE
M. Thierry TERME PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE Mme Evelyne OLLIVIER
Mise à jour : 1/12/2015 PROFESSEURS ASSOCIES A TEMPS PARTIEL (P.A.S.T.)
GESTION PHARMACEUTIQUE, PHARMACOECONOMIE
ET ETHIQUE PHARMACEUTIQUE OFFICINALE M. Jean-Pierre CALISSI
MAITRES DE CONFERENCES
BOTANIQUE ET CRYPTOGAMIE, BIOLOGIE CELLULAIRE Mme Anne FAVEL
Mme Joëlle MOULIN-TRAFFORT
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Elisabeth SCHREIBER-DETURMENY Mme Catherine DEFOORT
M. Alain NICOLAY Mme Estelle WOLFF Mme Elise LOMBARD CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES M. David BERGE-LEFRANC M. Pierre REBOUILLON
CHIMIE THERAPEUTIQUE Mme Catherine DIANA
Mme Sandrine FRANCO-ALIBERT Mme Caroline DUCROS
M. Marc MONTANA CHIMIE ORGANIQUE PHARMACEUTIQUE
HYDROLOGIE
M. Armand GELLIS M. Christophe CURTI Mme Julie BROGGI M. Nicolas PRIMAS M. Cédric SPITZ M. Sébastien REDON PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE M. Riad ELIAS
Mme Valérie MAHIOU-LEDDET Mme Sok Siya BUN
Mme Béatrice BAGHDIKIAN
MAITRES DE CONFERENCE ASSOCIES A TEMPS PARTIEL (M.A.S.T.)
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Anne-Marie PENET-LOREC CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES
M. Thierry ATHUYT
DROIT ET ECONOMIE DE LA PHARMACIE M. Marc LAMBERT
DROIT ET COMMUNICATION PHARMACEUTIQUES A L’OFFICINE
ET GESTION DE LA PHARMAFAC M. Philippe BESSON
AHU
CHIMIE ORGANIQUE PHARMACEUTIQUE Mme Manon ROCHE
ATER
Mise à jour : 1/12/2015 DEPARTEMENT MEDICAMENT ET SECURITE SANITAIRE
Responsable : Professeur Benjamin GUILLET
PROFESSEURS
PHARMACIE CLINIQUE Mme Diane BRAGUER
PHARMACODYNAMIE M. Benjamin GUILLET
TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Athanassios ILIADIS
TOXICOLOGIE GENERALE M. Bruno LACARELLE
TOXICOLOGIE DE L’ENVIRONNEMENT Mme Frédérique GRIMALDI
MAITRES DE CONFERENCES
PHARMACODYNAMIE Mme Suzanne MOUTERDE-MONJANEL
PHYSIOLOGIE Mme Sylviane LORTET
Mme Emmanuelle MANOS-SAMPOL
TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Hot BUN
M. Joseph CICCOLINI
Mme Raphaëlle FANCIULLINO TOXICOLOGIE GENERALE ET PHARMACIE CLINIQUE M. Pierre-Henri VILLARD
M. Stéphane HONORÉ
Mme Caroline SOLAS-CHESNEAU Mme Marie-Anne ESTEVE
A.H.U.
PHARMACODYNAMIE M. Philippe GARRIGUE
ATER
PHARMACODYNAMIE M. Guillaume HACHE
Mise à jour : 1/12/2015 CHARGES D’ENSEIGNEMENT A LA FACULTE
Mme Nathalie AUSIAS, Pharmacien-Praticien hospitalier M. Pierre BERTAULT-PERES, Pharmacien-Praticien hospitalier Mme Martine BUES-CHARBIT, Pharmacien-Praticien hospitalier M. Gérard CARLES, Pharmacien-Praticien hospitalier
Mme Nicole FRANCOIS, Pharmacien-Praticien hospitalier Mme Sophie GENSOLLEN, Pharmacien-Praticien hospitalier Mme Christine PENOT-RAGON, Pharmacien-Praticien hospitalier M. Stéphane PICHON, Pharmacien titulaire
M. Alain RAGON, Pharmacien-Praticien hospitalier
M. Badr Eddine TEHHANI, Pharmacien – Praticien hospitalier
REMERCIEMENTS
Sept années passées à la faculté de Pharmacie de Marseille pour arriver aujourd’hui à la finalité de ce parcours long et parfois mouvementé.
A mon Président de Thèse
Monsieur le Professeur Philippe PICCERELLE
Je vous remercie de me faire l’honneur de présider ce jury aujourd’hui, et de me permettre de finaliser mes études de pharmacie.
A mon Jury de Thèse
Monsieur le Docteur Edouard LAMY
Merci d’avoir accepté d’être mon directeur de thèse.
Monsieur le Docteur Charleric BORNET
Je voudrais particulièrement remercier Charleric, pour m’avoir accompagné tout au long de mes études de pharmacienne et plus particulièrement ces derniers mois, dans ce projet de
thèse, pour le temps que vous y avez consacré et vos nombreux conseils. Merci également à Maud pour ses sourires et sa gentillesse, toujours.
Le parcours a parfois été compliqué mais j’ai toujours pu compter sur mes parents. Sans vous mon chemin n’aurait sûrement pas été le même.
Merci pour votre éducation, vos valeurs et votre amour. Je vous aime.
A mon oncle et parrain, qui a une place toute particulière dans mon cœur, pour être là toi aussi dans les moments durs, les voyages et la vie, tout simplement.
A ma sœur, mon neveu et à la famille en général, merci pour tous nos moments partagés, les anniversaires, les Noëls, ces souvenirs avec vous sont les plus beaux.
A Berthe et à nos soixante ans d’écart qui n’empêchent pas nos rires et nos prises de bec. A pépé, qui, je pense, serait fier de moi aujourd’hui.
A la famille Bogo-Eugé qui, comme l’a si justement dit Caroline, est ma presque-famille.
A ceux rencontrés dans les pires moments de la PACES : Anne, Antonin, Camille, Doriane. Je ne pensais pas vous trouvez à ce moment-là mais je sais maintenant que je peux compter
sur vous encore très longtemps.
Vous êtes inoubliables car mes souvenirs avec vous le sont aussi.
A la team pharma: Aurélie, Camille, Céline, Charlotte, Eve, Julie, Julia, Rebecca, Sophia. Ces années sans vous à mes côtés sur les bancs de la fac de pharma auraient été tellement moins
drôles. Merci pour les soirées, les carnavals, les week-ends, les rires.
Un remerciement tout particulier à Céline, pour les heures passées l’an dernier à me faire réciter. Peu l’auraient fait et je n’aurais pas pu rêver d’une meilleure aide.
Merci encore mille fois pour ta patience. Tu es la gentillesse incarnée, je te souhaite le meilleur …
A celui que j’aime, Flavien, pour tous les moments passés ensemble et aux nombreux à venir. Merci d’avoir été là pendant ces deux dernières années qui n’ont pas été les plus simples pour
« L’Université n’entend donner aucune approbation, ni
improbation aux opinions émises dans les thèses. Ces
opinions doivent être considérées comme propres à leurs
auteurs. »
LISTE DES ABREVIATIONS
JAK : Janus Kinase
PAR : Polyarthrite Rhumatoïde
AMM : Autorisation de Mise sur le Marché ACPA : Anticorps Anti-Peptides Citrullinés TNF : Tumor Necrosis Factor
IL : Interleukine
VS : Vitesse de Sédimentation CRP : Protéine C Réactive FR : Facteur Rhumatoïde
ACPA : Anticorps Anti-Peptides Citrullinés Ig : Immunoglobuline
ELISA : Enzyme-linked Immunosorbent Assay ACR : American College of Rheumathology EULAR : European League Against Rheumatism IRM : Imagerie par Résonnance Magnétique LED : Lupus Erythémateux Disséminé DAS 28 : Disease Activity Score 28 HAQ : Health Assessement Questionnaire HAS : Haute Autorité de Santé
EVA : Echelle Visuelle Analogique
AINS : Anti-Inflammatoires Non Stéroïdiens COX : Cyclo-Oxygénases
UGD : Ulcère Gastro-Duodénal Ly T : Lymphocyte T
DMARD(s) : Disease Modifying Anti-Rheumatic Drugs
csDMARD : conventional synthetic Disease Modifying Anti-Rheumatic Drugs bDMARD : biologic Disease Modifying Anti-Rheumatic Drugs.
tsDMARD : targeted synthetic Disease Modifying Anti-Rheumatic Drugs MTX : Méthotrexate
ANSM : Agence Nationale de Sécurité du Médicament et des produits de santé NFS : Numération Formule Sanguine
Ac : Anticorps
DCI : Dénomination Commune Internationale IDR : Intradermo Réaction
UI : Unité Internationale SMR : Service Médical Rendu
ASMR : Amélioration du Service Médical Rendu CT : Commission de Transparence
CHO : Cellules Ovariennes de Hamster Chinois RCP : Résumé des Caractéristiques du Produit PEG : Polyéthylène Glycol
STAT : Signal Transducer and Activator of Transcription SOCS : Suppressor Of Cytokine Signaling
MAP Kinase : Mitogen Activated Protein Kinase ERK : Kinases Régulatrices du signal Extracellulaire JNK : Kinases N-terminale
OMERACT : Outcome Measure in Rheumatoid Arthritis Clinical Trial OAT3 : transporteur d'anion organique de type 3
EMA : European Medecine Agency FDA : Food and Drug Administration
Table des matières
INTRODUCTION ... 1
PARTIE I : LA POLYARTHRITE RHUMATOÏDE ... 2
A. EPIDEMIOLOGIEET PHYSIOPATHOLOGIE DE LA MALADIE ...2
1. Physiopathologie ... 2
2. Diagnostic et formes de la maladie... 5
2.1. PAR débutante ... 5
2.2. Phase d’état de la maladie ... 8
3. Diagnostics différentiels ... 10
B. EVOLUTION DE LA MALADIE, SEVERITE ET COMPLICATIONS ... 11
1. Le HAQ ... 12
2. Le score composite DAS 28 ... 13
3. Suivi de la maladie et rémission ... 16
4. Complications rénales, cardiaques et handicap ... 18
PARTIE II : TRAITEMENTS ET PRISE EN CHARGE ... 19
A. LE TRAITEMENT D’ACTION IMMEDIATE ... 21
B. LES PREMIERS TRAITEMENTS DE FOND ... 23
C. LES BIOTHERAPIES ... 27
1. Les Anti-TNF alpha ... 33
2. Les autres biothérapies disponibles... 45
PARTIE III : LES INHIBITEURS DE LA VOIE JANUS KINASE ... 53
A. LES PRINCIPALES VOIES INTRACELLULAIRES IMPLIQUEES DANS LA POLYARTHRITE RHUMATOÏDE ... 53
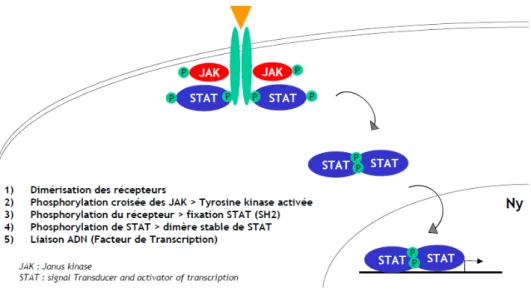
1. La voie intracellulaire JAK-STAT ... 53
3. La voie NIK/ IκBK/ NFκB ... 57
B. LA PLACE DES INHIBITEURS DE LA VOIE JAK DANS LES RECOMMANDATIONS OFFICIELLES ... 57
C. OLUMIANT®(BARICITINIB) ... 60
1. La petite révolution de l’Olumiant® ... 60
2. Les essais cliniques de phase III d’Olumiant® ... 61
2.1. L’étude RA-BEACON ... 62
2.2. RA-BUILD ... 63
2.3. RA-BEGIN ... 65
2.4. RA-BEAM ... 66
2.5. Conclusion sur les essais cliniques de phase III et impact sur la commercialisation ... 67
2.6. RA-BEYOND... 68
3. Stratégie thérapeutique ... 69
4. Prescription, Prix et Remboursement ... 70
5. Effets indésirables, précautions d’emplois ... 71
D. LE TOFACITINIB ... 76
1. Xeljanz®, un autre inhibiteur de la voie JAK ... 76
2. Les essais cliniques de phase III ... 77
2.1. ORAL START ... 77
2.2. ORAL SCAN, ORAL STANDARD, ORAL STRATEGY ... 78
2.3. ORAL SOLO et ORAL SYNC ... 80
2.4. ORAL STEP ... 80
2.5. Conclusion sur les essais cliniques de phase III et impact sur la commercialisation ... 81
3. Prescription, Prix et Remboursement ... 82
4. Effets indésirables et précautions d’emplois ... 82
E. LES MOLECULES EN COURS DE DEVELOPPEMENT ... 84
DISCUSSION ET CONCLUSION ... 86
BIBLIOGRAPHIE ... 90
1
INTRODUCTION
Le marché du médicament représente un enjeu économique majeur et de nombreux laboratoires se partagent ce marché où la concurrence est rude.
Aujourd’hui, les recherches sont orientées sur les maladies chroniques notamment, car ce sont elles qui concernent le plus grand nombre et que, pour beaucoup, la réponse médicamenteuse dont nous disposons aujourd’hui, est souvent insuffisante.
L’innovation, est donc au centre de cette recherche sur le traitement des maladies chroniques car c’est un des meilleurs moyens de gagner des parts de marché sur ses concurrents.
C’est ainsi, qu’une nouvelle classe thérapeutique dans le traitement de la polyarthrite rhumatoïde (PAR) est arrivée sur le marché du médicament cette année : les inhibiteurs de la voie JAK (Janus Kinase).
C’est par un mécanisme d’action innovant et agissant sur une voie originale que les laboratoires Lilly et Pfizer, ont développé deux nouvelles molécules, appartenant à cette nouvelle classe médicamenteuse, respectivement, Olumiant® (baricitinib) et Xeljanz® (tofacitinib).
L’apport de cette nouvelle classe en termes d’efficacité, de tolérance, et de qualité de vie pour les patients doit être évalué. Par ailleurs, devant la multiplicité des traitements déjà disponibles, on peut légitimement se demander si cette nouvelle classe va apporter une modification de la prise en charge de cette pathologie chronique rhumatismale. Les inhibiteurs de la voie JAK vont en effet devoir se faire une place sur un marché où les possibilités sont déjà relativement nombreuses pour les prescripteurs. De plus, l’arrivée des biosimilaires sur le marché, va entrainer une concurrence d’autant plus importante pour ces nouvelles molécules.
Les autorités de santé ont un rôle central et capital dans ce contexte, car ce sont elles qui détiennent les clés de la commercialisation des produits, via les autorisations de mise sur le marché (AMM), et déterminent les schémas de prise en charge qui servent de référence. Tout au long de cette réflexion, nous étudierons la prise en charge de la PAR dans sa globalité et la place potentielle des inhibiteurs de la voie JAK dans celle-ci.
2
PARTIE I : La Polyarthrite Rhumatoïde
A. Epidémiologie et physiopathologie de la maladie
La PAR est le rhumatisme inflammatoire chronique le plus fréquent dans le monde. Aujourd’hui, sa prévalence est estimée entre 0,3 et 0,8% de la population adulte, ce qui représente près de 300 000 personnes en France. [1]
Le plus souvent les premiers symptômes apparaissent vers 50 ans même si des formes plus précoces (15-30 ans) et plus tardives (après 70 ans) ont été observées.
Il est important de souligner que cette maladie touche plus particulièrement les femmes avant 60 ans avec un sex ratio de 3/1, même si par la suite cette différence s’atténue progressivement après 70 ans.
1. Physiopathologie
La polyarthrite rhumatoïde est une affection multifactorielle relevant de différents facteurs à la fois génétiques, environnementaux, immunologiques et hormonaux (probable influence des stéroïdes sexuels devant les améliorations transitoires de la maladie lors des grossesses).
Ce rhumatisme évolutif, à tendance destructrice, de cause inconnue, a donc des terrains génétiques favorisants. En effet, c’est une maladie polygénique dans laquelle plusieurs gènes de susceptibilité ont peut être identifiés et mis en cause dont notamment le HLA DRB1, le
HLA DR4 (antécédent familial de PAR), le PTN22 ou encore le STAT4.
Dans le cas de HLA DRB1, certains allèles prédisposent à la production d’anticorps dirigés contre les résidus citrullines de protéines endogènes : les ACPA (Anticorps anti-peptides citrullinés) dont font partie les anticorps antipeptides citrullinés cyclisés, que nous développerons plus loin, du fait de leur importance dans le diagnostic de la maladie. La
3 présence d’un allèle multiplie par trois le risque de survenue de la maladie, et par 20 pour 2 allèles. [2]
Du coté des facteurs environnementaux, le tabagisme joue un rôle très important. Une étude de 2001, menée sur 239 patients, a comparé la survenue de la maladie chez des patients avec des antécédents familiaux de PAR à celle de patients fumeurs (41 à 50 paquets années) sans antécédents familiaux de la maladie. L’étude a permis d’affirmer d’une part que le tabac est un facteur de risque important de développer une PAR et d’autre part que ce risque est même supérieur à celui lié au terrain génétique. [3]
En effet, il semblerait que le tabac favorise la citrullination (transformation de l’arginine en citrulline) de protéines endogènes, entrainant par la suite une stimulation antigénique par ces protéines citrullinées présentes dans la synoviale des articulations touchées.
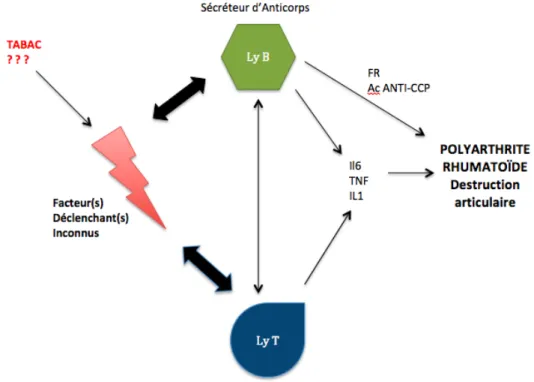
Malgré le fait que la cause de la maladie soit inconnue encore à ce jour, certains évoquent également le rôle possible d’une infection causée par un agent bactérien ou viral. Celui-ci serait alors responsable du phénomène initial entrainant une inflammation suivi par le recrutement de lymphocytes auto-réactifs (Figure 1). [4]
Dans l’environnement inflammatoire, ces lymphocytes sont ainsi activables par les auto-antigènes accessibles localement. Ils se différencient alors en cellules effectrices productrices de cytokines. C’est le cas des lymphocytes T de type TH1 qui libèrent des interféron-gamma et du TNF (Tumor Necrosis Factor) ou des lymphocytes B qui synthétisent eux, des auto-anticorps (facteurs rhumatoïdes, ACPA).
S’en suit alors une activation des macrophages par l’interféron-gamma et l’entretient des phénomènes inflammatoires locaux par la production des cytokines pro-inflammatoires de type [2] :
- TNF alpha qui agit sur les synoviocytes, les chondrocytes et les ostéoclastes
- L’IL-6 qui stimule la synthèse hépatique des protéines de l’inflammation et la différentions des lymphocytes T-Helpers en TH17
- L’IL-1 comme co-stimulateur des lymphocytes T
- L’IL17 amplifiée par l’IL-23, participe à l’inflammation et à la destruction ostéo-cartilagineuse.
4 La production de facteurs de croissance de type VEGF, PDGF, FGF, serait quant à elle, à l’origine du pannus synovial. Il s’agit d’une hyperplasie des cellules synoviales aboutissant à la formation d’un tissu synovial inflammatoire et prolifératif. Celui-ci tend alors à recouvrir le cartilage articulaire et serait impliqué à la fois dans la production d’enzymes, notamment des métalloprotéines et dans l’activation des ostéoclastes. Le tout étant responsable de la destruction du cartilage et de l’os, à l’origine des principaux symptômes de la PAR associé au phénomène inflammatoire majeur de la maladie.
5 2. Diagnostic et formes de la maladie
La polyarthrite rhumatoïde doit être diagnostiquée le plus précocement possible afin de débuter la prise en charge la plus adaptée et cela, avant la survenue de dégâts irréparables qui pourraient entraîner un handicap médico-social sur le long terme.
2.1. PAR débutante
Différentes manifestations vont pousser le patient à consulter dans un premier temps. Le plus fréquemment, il va le faire face à des douleurs articulaires qui vont apparaître en fin de nuit ou sur le matin avec une raideur matinale de l’articulation qui va durer au minimum 30 minutes. Il est également souvent observé une hydarthrose d’une ou de plusieurs articulations qui correspond au phénomène d’arthrite. C’est la résultante d’une hypertrophie des tissus mous ou d’un épanchement articulaire.
Dans la plupart des cas, ce sont le plus souvent les membres supérieurs qui sont touchés par ces deux phénomènes avec une prédilection pour les articulations du poignet, les os du carpe et les métacarpes. Progressivement les douleurs deviennent fixes, bilatérales et symétriques, ce qui contribue à orienter le diagnostic vers la polyarthrite rhumatoïde.
A noter que l’on peut observer des formes de polyarthrite aiguë fébrile, avec altération de l’état général et fièvre supérieure à 38,5° et cela dans environ 10 à 15% des cas. [5]
Devant ces symptômes, on réalisera un dosage biologique et immunologique pour rechercher à la fois un syndrome inflammatoire mais également des anticorps considérés comme des marqueurs de la polyarthrite rhumatoïde. [6]
Pour mettre en évidence un syndrome inflammatoire, il suffit de mesurer deux des protéines dites « protéines de l’inflammation ». Il y a d’une part, la Vitesse de Sédimentation (VS), qui correspond à la vitesse à laquelle les globules rouges se séparent du plasma et se déposent au fond d'un tube à essai posé verticalement. Elle se mesure au terme de 1 ou 2 heures, mais la mesure effectuée après 1h est déjà significative et suffisante dans la plupart des cas.
6 D’autre part, il y a la Protéine C Réactive (CRP) qui est une glycoprotéine du sang que le foie synthétise en réponse à un antigène. Elle augmente en cas d’inflammation et sa valeur normale est inférieure à 5 mg/L. [9][8]
Ces deux dosages permettent de mettre en évidence un syndrome inflammatoire, même s’ils sont non spécifiques de la polyarthrite rhumatoïde et qu’ils ne renseignent donc pas sur la cause de l’inflammation.
La PAR étant une maladie auto-immune, l’analyse immunologique est d’une grande importance et ce sont deux auto-anticorps (anticorps synthétisés par l’individu et dirigés contre ses propres cellules et tissus) que l’on va rechercher en première intention.
Tout d’abord, le Facteur Rhumatoïde (FR) qui est une immunoglobuline (Ig) de type IgM le plus souvent, ayant une activité anticorps dirigée contre les immunoglobulines G humaines ou animales. Il était classiquement recherché par la réaction de Waaler-Rose (globules rouges de mouton sensibilisés par du sérum de lapin antiglobules rouge de mouton, la réaction se faisant contre les immunoglobulines antiglobules rouges) ou le test au latex (particules de polyester recouvertes d’immunoglobulines humaines avec un seuil de positivité : 1/80° de dilution). Actuellement la détection du facteur rhumatoïde est réalisée par néphélémétrie laser qui à l’avantage d’être une technique automatisable et qui est exprimée en unités ou par une technique ELISA (Enzyme-linked immunosorbent assay) qui est la plus répandue et la plus sensible avec un seuil à 20 UI/mL.
La recherche du FR est positive dans 50-60% des cas de polyarthrite rhumatoïde débutante. Cependant sa positivité n’est pas suffisante pour affirmer une polyarthrite, ni indispensable car sa spécificité n’est que de 75 à 85% pour une sensibilité comprise entre 70 et 80%. [10]
Ensuite, les anticorps anti-peptides citrullinés qui sont des anticorps dirigés contre les résidus citrulline de protéines endogènes.
La titration de ces anticorps est une technique récente, réalisée par une méthode ELISA. À l’heure actuelle, ce sont les kits de deuxième génération (PCC2) qui sont utilisés en pratique professionnelle car ils ont permis d’augmenter la sensibilité du test.
Ce test s’intègre dans le faisceau d’arguments cliniques, biologiques et d’imagerie qui permet de poser le diagnostic et le pronostic de la PAR.
7 Ils peuvent permettre une prise en charge thérapeutique plus précoce et/ou plus agressive et ainsi limiter l’évolution de la maladie.
La sensibilité du test varie de 41 à 77 % et la spécificité de 94 à 98 %.
La grande variation de sensibilité peut s’expliquer par la différence de durée de présence des symptômes des patients inclus. [11]
On peut également faire une recherche des anticorps anti-nucléaires, qui sont des anticorps retrouvés dans environ 30 à 40% des maladies auto-immunes. Ils servent notamment au diagnostic différentiel avec le lupus érythémateux disséminé, avec notamment les anticorps anti-nucléaires de type anti-ADN natifs constamment négatifs dans la PAR et positif dans le lupus érythémateux disséminé.
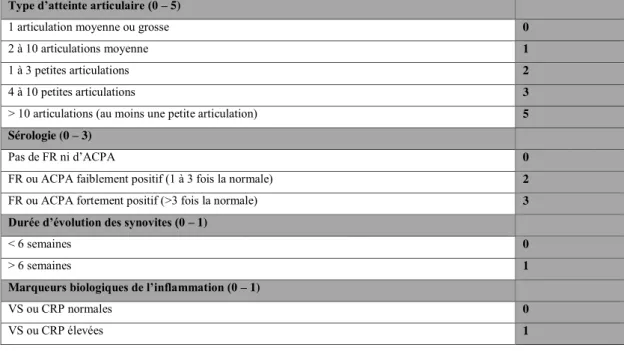
Afin de diagnostiquer au mieux la polyarthrite rhumatoïde, les médecins ont à leur disposition le SCORE ACR/EULAR (American College of Rheumatology/ European League Against Rheumatism), mis aux points par les associations de rhumatologues en 1987, mis à jour en 2010 et qui s’appuie sur les différents critères diagnostics évoqués plus haut (Tableau 1). Pour que le diagnostic de polyarthrite rhumatoïde soit validé, il faut un score > ou = 6. [12]
Type d’atteinte articulaire (0 – 5)
1 articulation moyenne ou grosse 0
2 à 10 articulations moyenne 1
1 à 3 petites articulations 2
4 à 10 petites articulations 3
> 10 articulations (au moins une petite articulation) 5
Sérologie (0 – 3)
Pas de FR ni d’ACPA 0
FR ou ACPA faiblement positif (1 à 3 fois la normale) 2
FR ou ACPA fortement positif (>3 fois la normale) 3
Durée d’évolution des synovites (0 – 1)
< 6 semaines 0
> 6 semaines 1
Marqueurs biologiques de l’inflammation (0 – 1)
VS ou CRP normales 0
VS ou CRP élevées 1
8 Le SCORE ACR/ EULAR, permet d’affirmer un diagnostic de PAR débutante. Il est important de souligner que pour établir ce diagnostic, le bilan d’imagerie n’est pas pris en compte. En effet, pour la PAR débutante, le plus souvent, les signes radiologiques sont absents.
Cependant, ce bilan d’imagerie lors de la phase débutante de la pathologie est important, même s’il ne sert pas au diagnostic. En effet, par la suite, il permet de suivre l’évolution de la maladie, sert au pronostic de la maladie et peut influer sur la décision thérapeutique (caractère érosif ou non de la maladie, rapidité de la dégradation radiologique etc.)
Le bilan d’imagerie, réalisé dès l’annonce de la PAR débutante, se compose de trois examens. L’examen radiologique est bilatéral et comparatif. Il recherche, notamment, les signes d’arthrite (déminéralisation épiphysaire « en bande », érosion, pincement diffus de l’interligne articulaire) qui sont le plus souvent normal au début de la maladie. Une échographie – doppler, très sensible pour la détection des synovites et des érosions. Il s’agit d’un examen très utile en cas de doute clinique. Et enfin, une Imagerie par Résonnance Magnétique (IRM) qui a son intérêt en cas de radios normales mais d’échographie douteuse. C’est l’examen le plus sensible pour le diagnostic précoce et le suivi de l’inflammation synoviale, de l’œdème osseux et des lésions érosives. [13]
2.2. Phase d’état de la maladie
Les manifestations articulaires
La polyarthrite rhumatoïde étant une maladie évoluant par poussée, il est fréquent qu’une fois installée, la maladie s’étende et s’aggrave. Des articulations jusqu’alors préservées sont alors atteintes. Cependant comme pour beaucoup de maladies évoluant par poussées, on connaît dans un premier temps, entre les phases actives de la maladie, des phases de rémissions et d’accalmies plus ou moins longues et relatives.
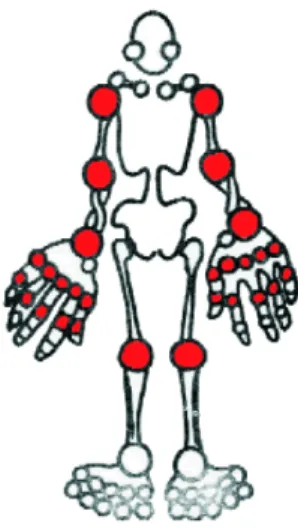
9 L’atteinte des mains est la plus caractéristique, même si grâce aux avancées thérapeutiques, on observe de moins en moins de cas de déformations, qui sont (Photo 1):
- la déformation cubitale des doigts en « coup de vent » - la déformation en « col de cygne »
- la déformation en boutonnière : fréquente de l’ordre de 50% chez les patients
Cependant l’atteinte des mains n’est pas isolée. En effet toutes les articulations synoviales peuvent être atteintes même s’il existe une prédominance pour les extrémités. C’est pour cela que l’on observe également une atteinte des poignets, qui participe à l’aggravation en « coup de vent ». Une atteinte des pieds qui est invalidante et qui survient dans 90 % des cas. Assez fréquemment on rencontre des atteintes de l’épaule ou encore même du coccyx (à rechercher systématiquement de part sa gravité) et du rachis cervical [14].
Photo 1 : cinquième doigt en boutonnière, poignet en dos de chameau et pouce en « z »
Les manifestations extra-articulaires
Ces manifestations traduisent le caractère systémique de la maladie rhumatoïde.
On observe fréquemment et c’est compréhensible, notamment lors des poussées évolutives de la maladie, une altération de l’état général pouvant se manifester par un fébricule, une asthénie pouvant être très marquée et un amaigrissement.
10 La maladie ayant une composante immunologique et inflammatoire importante, il n’est pas rare de retrouver des adénopathies et ce dans 20 – 30% des cas, qui doivent bien entendu être explorées pour écarter toutes pathologies malignes ou infectieuses notamment.
Souvent, des nodosités sous-cutanées ou nodules rhumatoïdes apparaissent. Ils sont rares au début de la maladie, mais sont ensuite retrouvés chez 10 – 20% des patients. Ce sont des nodules fermes, immobiles, indolores qui siègent au niveau des crêtes cubitales, des tendons extenseurs du doigt ou encore au niveau du tendon d’Achille (Photo 2). Ces nodules ne sont pas uniquement spécifiques de la maladie, même si c’est bien dans la polyarthrite rhumatoïde qu’on les rencontre le plus fréquemment.
Photo 2 : Nodules rhumatoïdes
3. Diagnostics différentiels
Tous les examens abordés précédemment sont indispensables au diagnostic et à la prise en charge rapide de la maladie, mais ils permettent aussi le diagnostic différentiel de la maladie. En effet, la polyarthrite rhumatoïde n’est pas la seule maladie auto-immune évoluant par poussée qui provoque des douleurs rhumatismales. Un mauvais diagnostic peut être très grave, puisqu’il peut entrainer un retard de diagnostic et donc un retard de prise en charge. Or, la rapidité du diagnostic dans la PAR est une condition importante pour une évolution
11 favorable de la maladie et une limitation de l’apparition de handicaps. Au début de la polyarthrite rhumatoïde, plusieurs diagnostics différentiels peuvent être évoqués :
Le syndrome de Gougerot-sjogren primitif : son diagnostic est difficile et il peut être
associé dans 30% des cas à la polyarthrite rhumatoïde. C’est une maladie auto-immune systémique qui se caractérise par une atteinte de certaines glandes, notamment lacrymales et salivaires, avec une diminution des sécrétions réalisant un syndrome sec, et de manifestations systémiques pouvant toucher différents organes.
La plus fréquente des manifestations extra-glandulaires systémiques est l’atteinte articulaire qui concerne environ 1 patient sur 2. Il peut s’agir de simples douleurs articulaires touchant surtout les articulations distales de la main. Plus rarement, on peut constater des gonflements de ces articulations, mais au contraire de la polyarthrite rhumatoïde, l’atteinte articulaire du syndrome de Gougerot-Sjögren primitif n’entraine jamais de dégâts articulaires. Cette maladie est également une des plus importante à écarter dans le diagnostic différentiel, puisque le FR est également positif dans ce syndrome. [15]
Le lupus érythémateux disséminé (LED) : Chez une femme jeune présentant une
polyarthrite aigüe, le LED doit être évoqué. Il s’agit d’une maladie auto-immune avec des atteintes cutanées et rénales et des similitudes avec la PAR par des atteintes articulaires et le FR positif. Cependant la présence des anticorps anti-ADN natifs, ainsi que les signes cutanés et parfois la leucopénie, permettent d’écarter une polyarthrite qui n’a souvent pour signes extra-articulaires que des adénopathies voire une splénomégalie. [16]
B. Evolution de la maladie, sévérité et complications
Les critères de gravité de la polyarthrite sont bien sur importants à prendre en compte pour l’évolution de la maladie. Ils doivent impérativement être recherchés.
En voici la liste :
- un début aigu polyarticulaire
- l’existence d’atteinte extra-articulaire - l’apparition précoce d’érosion radiologique
12 - l’existence d’un syndrome inflammatoire élevé (en particulier la CRP)
- la précocité de l’apparition du facteur rhumatoïde et surtout son titre élevé et la présence d’anti-CCP
- une mauvaise réponse au traitement de fond optimal (persistance de synovites à six mois sous traitement associant méthotrexate et biothérapie)
- un statut socio-économique défavorisé
- un score DAS 28 (Disease Activity Score) > 3,2
- un score HAQ (Health Assessement Questionnaire) > ou = 0,5. [17]
Pour traiter cette partie, il semble donc intéressant de se pencher sur les scores utilisés dans la prise en charge de la polyarthrite, et qui font référence notamment comme critère de gravité de la maladie. Ces scores permettent d’évaluer à la fois l’évolution de la maladie, mais également le ressenti des patients, notamment sur leur qualité de vie. Deux scores sont incontournables dans le traitement de la PAR, se sont le HAQ et le DAS 28.
1. Le HAQ
D’après la haute Autorité de Santé (HAS) : « Une PAR sévère se définit par l’existence d’un handicap fonctionnel mesuré par le HAQ (≥ 0,5), ou par l’existence ou la progression de lésions structurales en imagerie, ou par l’existence de manifestations systémiques. Un seul critère suffit. » [6]
Le HAQ est un score qui permet d’évaluer la qualité de vie du malade et non directement l’activité de la pathologie concernée. En effet, dans des maladies qui entraînent des situations de handicap comme la PAR, la qualité de vie des patients est bien souvent un reflet indirect de l’état du malade et de l’évolution de la maladie. « Le HAQ évalue huit domaines ou catégories d'activités quotidiennes sur vingt questions. Des activités comme, s'habiller, se lever, manger, marcher ou se laver sont évaluées par des questions qui permettent de définir le handicap fonctionnel d'un patient dans la vie quotidienne. Le score obtenu représente la somme de deux composantes, une première composante variable dépendante de l'inflammation et potentiellement corrigible par le traitement, et une deuxième composante
13 invariable résultante de l'atteinte structurelle. Ceci explique l'effet «plancher» parfois observé, en dépit d'un traitement hautement efficace sur les paramètres d'activité. » [18]
(Cf Annexe 1 : Questionnaire du score HAQ)
2. Le score composite DAS 28
Cet indice est défini sous la direction de la ligue Européenne contre le rhumatisme
(EULAR).En pratique, c’est un examen simplifié qui évalue 28 articulations douloureuses et
tuméfiées (10 métacarpophalangiennes, 8 interphalangiennes proximales des mains, 2
interphalangiennes du pouce, 2 poignets, 2 genoux, 2 coudes, 2 épaules) contre 54 pour le DAS (figure 2). Ce compromis permet une meilleure précision et reproductibilité.
Pour la HAS, le DAS 28 « prend en compte le nombre de synovites et d’articulations
douloureuses à la palpation (indice de Ritchie), le résultat de la vitesse de sédimentation et l’appréciation globale de la maladie évaluée par le patient sur une échelle visuelle analogique. » [6]
Dans un article de la revue médicale Suisse de 2005, il est dit que : « Le DAS28 est donc un indice composite d'activité de la PAR combinant de multiples paramètres en une mesure unique d'interprétation standardisée et qui est bien corrélé avec la sévérité de l'activité. Il est couramment utilisé dans les études cliniques, mais surtout sa simplicité en fait un outil d'évaluation extrêmement utile et facile à appliquer en pratique quotidienne. Il reflète en une valeur unique l'activité de la maladie à un moment donné ; il donne une sorte d'« instantané » de la maladie. » [18]
14 Figure 2 : Représentation schématique des 28 articulations évaluées dans le DAS 28
Le calcul du DAS 28 se fait selon la formule suivante :
𝐷𝐴𝑆28 = 0,56 × √𝑡28 + 0,28 × (𝑠𝑤28) + 0,70 × 𝐿𝑛(𝐸𝑆𝑅) + 0,014 × 𝐺𝐻
t28 = articulations douloureuses sw28 = articulations tuméfiées ESR = vitesse de sédimentation
15 Pour permettre aux praticiens de calculer le DAS28, différentes firmes pharmaceutiques offrent des calculettes dédiées. De plus, le site http://www.das-score.nl contient de nombreuses informations sur le DAS 28 et permet de télécharger une feuille Excel permettant le calcul sur son ordinateur. [19] (Cf Annexe 2 : DAS28 calcullator)
Définition du niveau d’activité avec le DAS 28 : - PAR de faible niveau d’activité : DAS 28 ≤ 3,2 ; - PAR active : DAS 28 > 3,2 ;
- PAR modérément active
Si le DAS28 est présenté comme une aide indispensable dans l’évaluation de la maladie, un article paru dans la revue The Lancet, en fait même un outil d’aide à la prescription.
En effet, en 2004, l’étude TIGORA a montré que l’utilisation rigoureuse du DAS28 améliorait la prise en charge des PAR. Pour réaliser cette étude, 110 patients ont été sélectionnés et randomisés dans deux groupes en simple aveugle. Les deux groupes de patients ont été traités par les traitements de fond des recommandations de l’époque. Cependant pour l’un des groupes, seul l’avis du rhumatologue a importé dans la décision d’intensifier le traitement, alors que pour le second groupe, cette décision a été prise automatiquement devant une activité modérée ou forte, selon le DAS calculé.
Les résultats font état de différences hautement significatives. En effet, pour les deux groupes on obtient des taux de rémission à deux ans selon les critères EULAR de 16% et 65% respectivement. [20]
Cette étude a donc permis de mettre en lumière l’importance de l’utilisation systématique du DAS28 avec un réel bénéfice pour les patients grâce à une évaluation chiffrée totalement objective et non influencée.
16 3. Suivi de la maladie et rémission
C’est ainsi qu’aujourd’hui, le DAS 28 fait parti des critères de suivi de la PAR. En effet, l’HAS considère que « l’objectif du suivi du patient est d’adapter rapidement la stratégie de prise en charge thérapeutique afin d’obtenir une rémission ou à défaut un faible niveau d’activité de la maladie, et prévenir l’atteinte structurale.
Le suivi est réalisé conjointement par le médecin spécialisé en rhumatologie et le médecin traitant.
Au cours du suivi, le médecin doit : - évaluer l’activité de la maladie
- rechercher la survenue de manifestations extra-articulaires - mesurer l’évolution structurale (progression radiologique)
- apprécier le degré de réponse au traitement et la tolérance du traitement.
Il est recommandé de réaliser dans le cadre du suivi de la première année de la PAR une évaluation mensuelle (à chaque consultation) jusqu’au contrôle de la maladie (rémission ou activité faible), puis tous les 3 mois (Figure 3):
- de l’activité de la maladie en évaluant les paramètres cliniques et biologiques permettant le calcul du score du DAS 28 : le nombre d’articulations gonflées, le nombre d’articulations douloureuses, l’échelle visuelle analogique (EVA) globale de l’activité de la maladie complétée par le patient, la raideur matinale, la VS, la CRP. - de la réponse au traitement
- du suivi de la tolérance du traitement prescrit, en adéquation avec les résumés des caractéristiques du produit et du contexte clinique du patient (incluant les comorbidités)
- de la recherche des manifestations extra-articulaires (ténosynovites, nodules rhumatoïdes, vascularite, syndrome sec, syndrome de Raynaud, etc.). » [6]
17 Évaluation de la réponse thérapeutique entre 2 mesures du DAS 28 :
Lorsque le score du DAS 28 final est ≤ 3,2 :
o une bonne réponse thérapeutique se définit par une amélioration du score du DAS 28 > 1,2 ;
o une réponse thérapeutique modérée se définit par une diminution du score du DAS 28 > 0,6 et ≤ 1,2 ;
o une non-réponse thérapeutique se définit par une diminution du score du DAS 28 ≤ 0,6.
Lorsque le score du DAS 28 final est ≤ 5,1 et > 3,2 :
o une réponse thérapeutique modérée se définit par une diminution du score du DAS 28 > 0,6 ;
o une non-réponse thérapeutique se définit par une diminution du score du DAS 28 ≤ 0,6.
Lorsque le score du DAS 28 final est > 5,1 :
o une réponse thérapeutique modérée se définit par une diminution du score du DAS 28 > 1,2 ;
o une non-réponse thérapeutique se définit par une diminution du score du DAS 28 ≤ 1,2.
18 4. Complications rénales, cardiaques et handicap
De nombreuses complications sont possibles dans cette pathologie.
Chez les patients atteints de PAR, les causes cardiovasculaires de décès sont prédominantes et doivent donc faire l’objet d’une prévention active pour éviter ces complications. En effet l’atteinte des trois tuniques cardiaques est possible avec notamment la possibilité de développer des péricardites.
Le rein est lui aussi un organe régulièrement touché dans l’évolution de la maladie avec l’apparition de signes rénaux, qui doivent toujours faire craindre l’apparition d’une amylose AA (amylose avec dépôt de protéine amyloïde sérique A (AA) dans les tissus) pouvant aboutir à une insuffisance rénale.
Les traitements, que nous développerons dans la partie suivante, sont également une cause iatrogène importante de complications. C’est le cas sur le rein avec les glomérulonéphrites interstitielles ou extramembraneuses, qui peuvent apparaître notamment sous biothérapie. Mais également les causes infectieuses, fréquentes chez les patients sous corticothérapie.
En plus de tous ces risques de complications, une situation de handicap s’installe souvent avec la progression de la maladie, nécessitant des aides à la rééducation et un accompagnement psychologique. La prise en charge de la PAR doit donc être globale et pluri-disciplinaire car de nombreux problèmes peuvent survenir pour le patient au cours de l’évolution de la maladie. C’est pour cela, que l’efficacité et la tolérance des médicaments utilisés dans le traitement de la PAR, sont des facteurs essentiels à prendre en compte.
19
PARTIE II : TRAITEMENTS ET PRISE EN CHARGE
La prise en charge de la PAR est complexe car les prescripteurs disposent d’un arsenal thérapeutique pour lutter, à plusieurs niveaux, contre cette pathologie. Faisons un point rapide sur les objectifs de cette prise en charge.
Tout d’abord, le premier défi est de soulager la douleur des malades. La restauration des capacités fonctionnelles et la préservation de la qualité de vie sont également essentielles.
Il est également important, et cela rejoint les premiers objectifs d’une certaine manière, d’obtenir une rémission clinique de la maladie. C’est à dire, un arrêt de l’évolution de la maladie. En effet, malgré toutes les molécules et les options thérapeutiques à notre disposition, on ne guérit pas, aujourd’hui, de la PAR. Dans le meilleur des cas, on ne sait que stopper ou ralentir son développement.
Ces objectifs à atteindre sont valables pour tous les patients. En effet, précisons que tous les patients atteints doivent être pris en charge au plus tôt, en adaptant au cas par cas le traitement, en raison de l’hétérogénéité de la maladie que nous avons développée dans la partie précédente.
C’est ainsi que l’on peut définir un arbre de décision dans la prise en charge de la maladie. Il nous guide afin d’atteindre les objectifs énoncés ci-dessus (Figure 4). [21]
Nous nous servirons de cet arbre comme référence, mais il est important de signaler qu’il est basé sur les recommandations 2007 de la HAS ([6]) qui sont, pour l’instant, suspendues.
20 Figure 4 : Arbre décisionnel de prise en charge de la PAR
Précisons que l’ensemble des molécules qui seront utilisées en traitement de fond de la PAR sont regroupés sous le terme : DMARDs (Disease Modifying Anti-Rheumatic Drugs) dans lequel on différencie :
- csDMARD : conventional synthetic Disease Modifying Anti-Rheumatic Drugs - bDMARD: biologic Disease Modifying Anti-Rheumatic Drugs
21 A. Le traitement d’action immédiate
Ce traitement qui est mis en place lors de la toute première prescription, a pour but d’agir sur la douleur ressentie par le patient et qui l’a poussé à consulter, le plus souvent.
Il n’y a pas de recommandations spécifiques à la PAR concernant la prise en charge de la douleur. Le traitement de la douleur (par antalgiques ou anti-inflammatoires non stéroïdiens) doit être instauré et adapté en fonction de son intensité.
Sont à notre disposition des antalgiques de palier 1 notamment, tel que le paracétamol qui présente peu d’effets indésirables et de contre-indications, sauf si le patient présente des troubles hépatiques puisque c’est un médicament hépatotoxique. Notons également qu’il s’agit de l’un des rares antalgiques qui n’est pas contre-indiqué en cas de grossesse ou d’allaitement. Le mécanisme d’action de cette molécule, qui est aujourd’hui la molécule phare de la première intention du traitement de la douleur, reste pour l’instant encore méconnu.
Il va également pouvoir être prescrit des anti-inflammatoires non stéroïdiens (AINS) qui vont agir de deux manières, puisqu’ils sont, à la fois antalgiques mais également anti-inflammatoires, or l’on sait maintenant l’importance de la part inflammatoire dans la maladie qui nous intéresse. Les AINS regroupent, entre autres, des molécules chefs de file comme l’ibuprofène ou le kétoprofène. Ces molécules agissent en inhibant des enzymes que l’on nomme cyclo-oxygénases (COX), qui ont un rôle dans la synthèse de molécules inflammatoires. Cependant, cette action sur l’inflammation est seulement symptomatique et ne guérit pas les causes de l’inflammation. [22]
Ces AINS ont, cependant, des effets indésirables et des contre-indications, qu’il est important de rappeler ici. C’est le cas du risque d’ulcère gastro-duodénal (UGD) dû à une action locale irritante et à une inhibition de la synthèse des molécules cytoprotectrices, aboutissant à une contre-indication absolue en cas d’antécédents d’ulcère.
De plus, on note également une action antiplaquettaire qui participe à l’aggravation du problème gastrique évoqué, en augmentant le risque d’hémorragie digestive. C’est à cause de cette toxicité digestive, mais aussi pour leur toxicité rénale et cardiovasculaire, qu’une surveillance sur le plan clinique et biologique avec, mesure de la tension artérielle, contrôle de la fonction rénale, est indispensable pour le suivi de ce traitement.
22 Il est également important de souligner l’interaction de ces AINS avec le méthotrexate, une des principales molécules du traitement de fond de la PAR. En effet, pour une dose supérieure à 15mg/semaine de méthotrexate, on note une augmentation de l’hématotoxicité du méthotrexate avec une diminution de la clairance rénale de cette molécule par les anti-inflammatoires. Pour ces doses hebdomadaires de méthotrexate, l’association avec les AINS est donc contre-indiquée. [23]
Toujours dans ces traitements d’action immédiate, abordons maintenant la corticothérapie. Le chef de file de cette classe est dans le cas qui nous intéresse la prednisone (Cortancyl®) que l’on va utiliser en première intention. Il s’agit d’une dose faible, que l’on va instaurer inférieure ou égale à 0,2 mg/kg/j (soit entre 5 à 10 mg par jour).
Cette molécule permet une amélioration rapide (en quelques jours) des symptômes de la maladie en freinant entre autre la dégradation des articulations atteintes et cela grâce à ses propriétés anti-inflammatoires et immunosuppressives. En effet ces molécules permettent une diminution de la libération d’IL-2 ayant pour effet de limiter la prolifération clonale des Ly T (lymphocytes T) et d’inhiber également la libération d’IL1 et d’IFN-γ.
Cependant la mise en route de cette corticothérapie doit quand même être associée à une évaluation du risque d’ostéoporose (si la prescription envisagée est supérieure à 3 mois), car c’est l’un des plus importants effets indésirables provoqué par ce traitement.
Cela passera par la correction d’une éventuelle carence en calcium et vitamine D, mais également par la prescription d’un biphosphonate en fonction du résultat des examens ostéodensitométriques chez l’homme et la femme non-ménopausée, et systématiquement chez cette dernière, si elle est ménopausée (avec ou sans antécédents de fracture pour fragilité osseuse). [24]
Précisons également que cette prise de prednisone se fera le matin, pour éviter un autre effet secondaire, l’insomnie. Cette prise ne s’accompagnera ni de régime sans sel, ni de la prise d’inhibiteurs de la pompe à proton, car la rétention hydro-sodée et le risque d’UGD ne sont pas à craindre pour les doses faibles administrées, bien que celles-ci soient quotidiennes. Par contre, un arrêt brutal de ce traitement est à proscrire. Celui-ci devra toujours être planifié, avec une diminution progressive des posologies, sur des intervalles d’au moins 15 jours, pour éviter une décompensation de l’arbre hypothalamo-hypophysaire.
Autre effet indésirable sérieux rencontré avec la prise au long court d’une corticothérapie (même à faible dose) : le risque infectieux. En effet, la prise de corticoïdes entraine une
23 diminution du nombre de lymphocytes T, aboutissant à une immunodépression et donc, un risque majoré de développer des troubles infectieux parfois graves. Le patient et l’équipe soignante doivent être particulièrement vigilants devant tout signe d’infection.
Tout ceci nous amène maintenant à aborder, les traitements de fond qui peuvent être mis en place dans la prise en charge de cette maladie.
B. Les premiers traitements de fond
Ces molécules du traitement de fond, sont regroupées sous l’acronyme anglais csDMARDs (conventional synthtic Disease-Modifying Anti-Rheumatic Drugs).
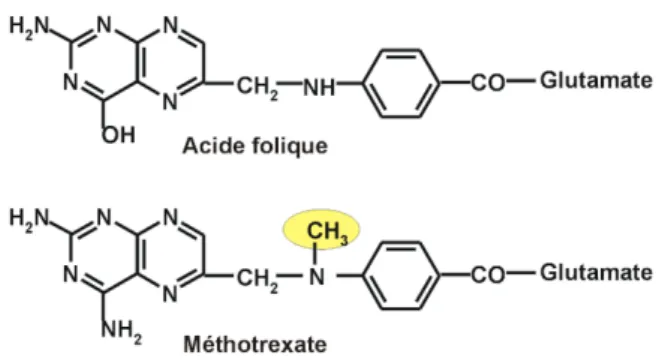
Intéressons-nous tout d’abord à la molécule prescrite en première intention. Il s’agit du méthotrexate (Figure 5).
Figure 5 : Structure chimique du méthotrexate et de l’acide folique
Le méthotrexate (MTX) administré hebdomadairement de façon orale ou sous-cutanée, a commencé à être utilisé dans les années 1970.
24 Cette spécialité est utilisée à faibles doses (7,5 à 15 mg une fois par semaine, en voie orale), avec augmentation par paliers de 2,5 à 5 mg par semaine jusqu’à un maximum de 25 mg par semaine. L’amélioration, quand elle apparaît, est rapide (1 à 2 mois) même si souvent, celle-ci disparaît s’il y a arrêt du traitement.
Son utilisation a montré un ralentissement de la progression de la maladie au niveau radiographique et a amélioré les résultats cliniques des patients atteint de PAR. Soulignons que pour un tiers des patients, une monothérapie par méthotrexate est suffisante pour obtenir la rémission de la maladie. [25][26]
De plus, son action est encore bien plus prononcée lorsqu’il est utilisé en combinaison avec un autre DMARD ou avec un agent biologique comme nous le verrons par la suite.
Il est important de noter que, malgré une bonne tolérance en général, une supplémentation en folate (vitamine B9) est systématiquement associée. On administre de l’acide folique per os (5 mg/semaine d’acide folique, 24 à 48 heures après la prise du méthotrexate) pour lutter contre l’effet indésirable le plus important de la molécule : l’hématotoxicité. En effet, le méthotrexate possède une importante toxicité hématologique qui est dose-dépendante et non cumulative, avec un nadir à J7-J10 entrainant leucopénie, thrombopénie voire pancytopénie (soit une atteinte possible des trois lignées cellulaires : blancs, rouges et plaquettes).
La surveillance clinique pour cette molécule est, par conséquent, très importante et rigoureuse, avec une surveillance clinique mais également biologique très stricte. Elle se compose, d’un bilan préalable avec hémogramme, d’un bilan rénal et hépatique, puis d’un hémogramme mensuel avec contrôle de la créatininémie et des transaminases régulièrement. [27]
Notons que le foie est également concerné, en raison de la toxicité hépatique cumulative du produit. Dans ce cas, une élévation des transaminases est observée dû à une possible fibrose hépatique voire, une cirrhose hépatique, d’où la surveillance hépatique associée à la surveillance hématologique. Cependant si le patient n’a pas d’autres facteurs de risque pour des dommages hépatiques, une atteinte par le méthotrexate de cet organe reste rare.
Une insuffisance rénale, ainsi que la grossesse et l’allaitement, sont également des contre-indications à l’utilisation de ce médicament.
25 Il est important d’insister sur le fait que les posologies du méthotrexate sont hebdomadaires et non quotidiennes. En effet, de nombreux cas de mésusages du médicament de ce type, ont été recensés. Ces erreurs ont entrainés des effets indésirables graves allant jusqu’au décès de certains patients. Ceci a abouti, en novembre 2016, à une lettre de l’Agence Nationale de sécurité du Médicament et des produits de santé (ANSM) aux professionnels de santé, faisant rappel des précautions à prendre lors de la prescription de cette spécialité (posologie en mg/semaine, indiqué le jour de prise sur l’ordonnance, s’assurer de la bonne compréhension du traitement par le patient etc.). [28]
Pour comprendre la toxicité de cette molécule, il nous suffit de se pencher sur son mécanisme d’action. En effet, le méthotrexate est un antimétabolite appartenant aux antifoliques. C’est donc un analogue de l’acide folique, agissant comme faux substrat en inhibant compétitivement la dihydrofolate-reductase et en bloquant ainsi la synthèse des bases puriques et pyrimidiques de l’ADN. Ceci explique son utilisation à la fois dans les protocoles anticancéreux, mais également pour le traitement des affections chroniques invalidantes comme la polyarthrite rhumatoïde. [27]
Précisons que son effet anti-inflammatoire dans notre cas pourrait être secondaire à l’induction d’une libération d’adénosine et à l’inhibition des polyamines.
En cas d’utilisation impossible du méthotrexate ou d’échec de cette molécule, deux autres DMARDs sont à notre disposition. Il s’agit du leflunomide et de la sulfasalazine.
Le leflunomide possède une action spécifique sur les lymphocytes en bloquant la synthèse des bases pyrimidiques de ces cellules. Il a donc une action antiproliférative sur les lymphocytes T activés, qui sont des acteurs de la polyarthrite rhumatoïde. Utilisé en monothérapie, il entraine des améliorations similaires à celles du méthotrexate que ce soit au niveau des résultats cliniques, ainsi qu’au niveau des scores radiographiques. Le plus souvent il est utilisé en combinaison avec des agents biologiques à la place du méthotrexate lorsque celui entraine trop d’effets indésirables chez le patient. [26]
Comme le méthotrexate, cette molécule est hépatotoxique. En effet, devant une élévation de 2 à 3 fois la normale des transaminases (enzymes hépatiques), on devra procéder à un arrêt immédiat du traitement.
26 Ceci impose un bilan préalable et une surveillance tous les quinze jours pendant six mois, puis tous les deux mois avec mesure de la tension artérielle, de la numération formule sanguine (NFS qui correspond au dosage des globules rouges, blancs et des plaquettes), du dosage des transaminases et d’une évaluation de la créatininémie.
Comme pour le méthotrexate, ce médicament est contre-indiqué en cas d’antécédents de pathologies hépatiques mais également de grossesse. Une contraception efficace est obligatoire pour les hommes comme pour les femmes en âge de procréer, devant le risque de malformations congénitales grave. Il est également contre-indiqué en cas d’infections actives et d’immunodéficience grave (ex : Syndrome d’Immunodéficience Acquise (SIDA)).
Si ces effets toxiques viennent à ce manifester, une procédure de wash-out est alors nécessaire en raison de la longue demi-vie du produit, mais également si l’on souhaite remplacer cette molécule par un autre traitement de fond de la maladie ou encore en cas de grossesse. Cette procédure consiste à administrer pendant environ 11 jours, soit de la cholestyramine (8g, trois fois par jour) soit du charbon activé (50g, quatre fois par jour).
La sulfasalazine est un autre « vieux » sDMARD qui a également montré des effets bénéfiques sur les patients atteints de PAR avec relativement peu de toxicité. Similaire au méthotrexate il agit à la fois sur une amélioration du signal de l’adénosine mais aurait également une action d’inhibition de la voie de l’acide arachidonique et des prostaglandines expliquant son action anti-inflammatoire mais également immunosuppressive.
Il est en général utilisé comme anti-inflammatoire colique dans les rectocoliques hémorragiques et la maladie de Crohn.
La posologie est de 2 grammes par jour, celle-ci est atteinte par palier, avec ajout de 500 mg toutes les semaines jusqu’à atteindre l’objectif.
Des études comparées avec des placebos ont montré une amélioration de la douleur dès quatre semaines de traitement avec la molécule. De plus, ce médicament a montré lui aussi un ralentissement de l’évolution radiographique de la maladie, même si le temps pour y arriver est plus long qu’avec les autres molécules et varie de un à trois ans de traitement. C’est ce qui explique qu’elle n’est pas la molécule utilisée en première intention. [26]
Notons que les effets indésirables gastriques et intestinaux sont les premiers effets indésirables rencontrés sous sulfasalazine, avec les réactions allergiques.
27 Soulignons également son hématotoxicité, avec le risque de développer une leucopénie sévère même si cela est rare durant la première année de traitement.
Une surveillance est donc là aussi nécessaire, avec un bilan biologique préalable puis un contrôle mensuel de la NFS et des urines, ainsi qu’une surveillance régulière de la créatininémie et des enzymes hépatiques, tout en assurant des apports hydriques importants (le médicament étant éliminé en majorité dans les urines).
Le traitement devra être interrompu définitivement en cas d’agranulocytose ou encore de réactions allergiques. Là encore, la femme enceinte ne peut être traitée par cette molécule. [29]
En l’absence de rémission avec les traitements de fond évoqués ci-dessus, on va devoir associer d’autres molécules entre elles afin d’obtenir cette rémission. Ces molécules sont, pour la plupart, des agents biologiques qui vont agir de manière ciblée, sur des acteurs de la polyarthrite rhumatoïde.
C. Les Biothérapies
L’identification du rôle de certaines cytokines pro-inflammatoires, notamment dans la polyarthrite rhumatoïde, a permis de proposer de nouvelles cibles thérapeutiques pour la prise en charge de cette pathologie. Ainsi depuis les années 2000, de nouveaux traitements ont vu le jour. Le premier d’entre eux étant l’infiximab, premier anticorps anti-TNFα commercialisé depuis 2000. Actuellement ce type de biothérapie ciblant les cytokines pro-inflammatoires connaît un développement important dans la prise en charge des pathologies inflammatoires chroniques comme la polyarthrite rhumatoïde. Ils sont regroupés sous le terme de bDMARD (biologic Disease-modifying Antirheumatic Drug).
Mais avant de développer plus en détail ces médicaments, rappelons tout d’abord la définition d’une biothérapie qui n’est autre qu’une « méthode thérapeutique basée sur l'utilisation de médicaments dérivés de molécules biologiques naturelles ».
Ce sont donc des médicaments, obtenus par des techniques permettant de modifier le patrimoine héréditaire d'une cellule par la manipulation de gènes in vitro, c’est le génie génétique.
28 Ces biothérapies sont donc des médicaments obtenus par l’utilisation de cellules qui vont être modifiées volontairement par l’homme dans le but de synthétiser des protéines de type anticorps dans le cas qui nous intéresse. Intéressons-nous de manière simplifiée aux différentes étapes qui permettent de produire ces biothérapies.
Les anticorps sont des molécules du système immunitaire chargées de se lier spécifiquement à un antigène particulier, avec une forte affinité et une bonne spécificité. Ils vont également recruter les autres acteurs du système immunitaire et éliminer les cibles.
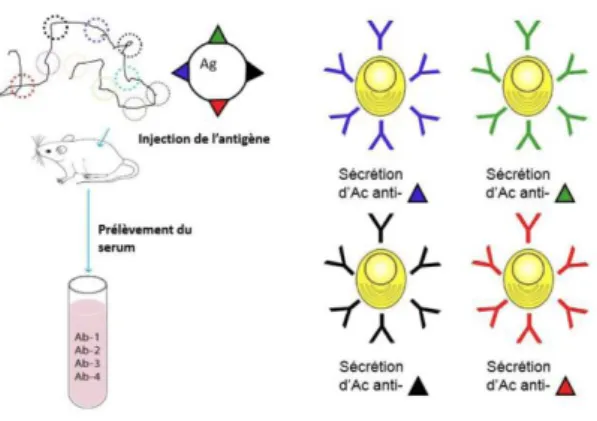
En thérapeutique, le but consiste à produire des anticorps contre des cibles déterminées. Pour cela, on injecte un antigène à un animal, ce qui provoque une immunisation. Le sérum que l’on obtiendra sera un « immun sérum ».
Si l’on injecte un antigène à plusieurs épitopes (partie d’un antigène reconnu par un anticorps), on obtient des anticorps polyclonaux, soit plusieurs anticorps reconnaissant des épitopes différents (Figure 6).
Figure 6 : La production d’anticorps polyclonaux
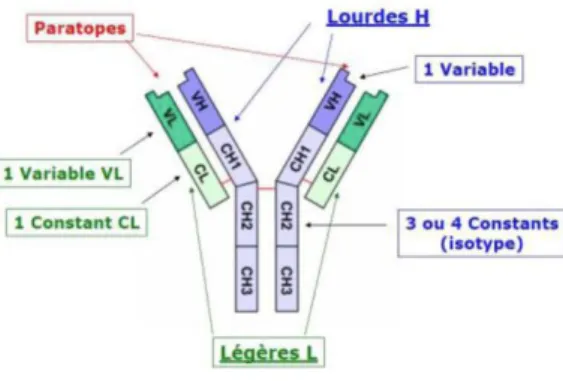
Pour comprendre tout cela, il est important de se pencher sur la structure des anticorps. Ce sont des glycoprotéines formées de deux catégories de chaines polypeptidiques : les chaînes légères (L) et les chaînes lourdes (H) (Figure 7).
Les chaînes légères sont formées de deux domaines : un domaine variable (VL) et un domaine constant (CL).
29 Les chaînes lourdes comportent elles, un domaine N-terminal variable (VH) et 3 ou 4 domaines constants (CH). Soulignons, que les domaines constants sont très proches d’un anticorps à l’autre et ne sont pas impliqués dans la reconnaissance vis à vis de l’antigène. Ce sont véritablement les domaines variables qui nous intéressent dans la biothérapie.
Les domaines variables sont au nombre de quatre et sont situés aux extrémités des deux bras. L'association d'un domaine variable de chaîne lourde (VH) et d'un domaine variable adjacent de chaîne légère (VL), constitue le site de reconnaissance (ou paratope) de l’antigène.
Figure 7 : Représentation des différentes chaines composant un anticorps
Une fois la cible déterminée, et l’identification du paratope spécifique de cette cible identifié, il va falloir synthétiser nos anticorps en grande quantité.
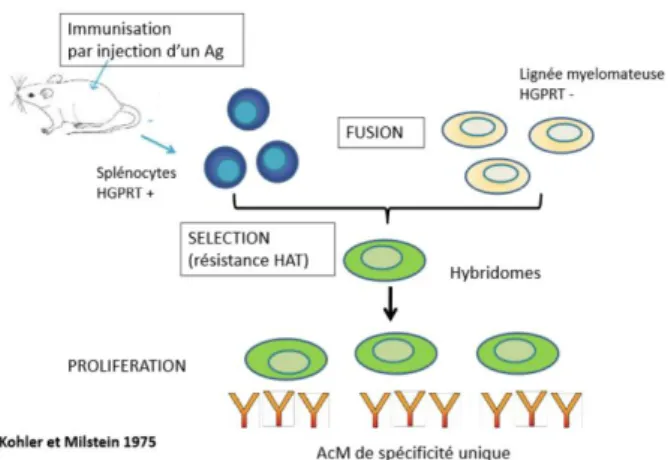
Pour cela, nous avons besoin d’hybridome. En 1975, Kohler et Milstein ont mis au point cette technique et leur travail a été récompensé par le Prix Nobel de Médecine en 1984. Cette technique, permet de produire une population homogène d’anticorps qui vont être monoclonaux et qui vont reconnaître le même épitope.
Pour obtenir un hybridome, le principe général est de fusionner un lymphocyte B qui sécrète des anticorps, mais qui ne se multiplie pas in vitro, avec des cellules de myélome lymphoïde qui ont la capacité de se multiplier rapidement et indéfiniment en culture. On obtient ainsi des cellules sécrétrices d’anticorps ayant une durée de vie indéterminée, et c’est bien là ce qui nous intéresse pour la production et la commercialisation à grande échelle de nos biothérapies (Figure 8).