Synthèse et caractérisation d’analogues de peptides
antimicrobiens riches en arginines
Mémoire
Nicolas Poulin
Maîtrise en chimie
Maître ès science (M. Sc.)
Québec, Canada
© Nicolas Poulin, 2017
II
Synthèse et caractérisation d’analogues de peptides
antimicrobiens riches en arginines
Mémoire
Nicolas Poulin
Sous la direction de :
Normand voyer, directeur de recherche
Michèle Auger, codirectrice de recherche
III
Résumé
La résistance antimicrobienne est un problème de santé publique de plus en plus inquiétant. En effet, si ce problème n’est pas contrôlé dès maintenant, dans les prochaines années, nous pourrions arriver dans une ère post-antibiotique où de simples infections pourraient recommencer à tuer. Afin d’éviter de tels enjeux, il est primordial que de nouveaux antibiotiques soient développés pour remplacer les médicaments contre lesquels les bactéries se sont adaptées. De toutes nouvelles classes de médicaments seraient nécessaires et l’une d’entre elles est la classe des peptides antimicrobiens. Ces segments protéiques sont retrouvés dans une impressionnante variété d’organismes et sont utilisés comme première ligne de défense contre les infections bactériennes. Le fonctionnement de ces molécules n’est pas entièrement compris, mais il est présumé qu’elles créent des pores dans les membranes bactériennes, causant ainsi la mort des cellules attaquées. Ces molécules ont un énorme potentiel, mais de nombreux problèmes empêchent leur utilisation clinique. Dans le laboratoire du Professeur Voyer, un peptide modèle, analogue des peptides antimicrobiens, a été synthétisé. Ce peptide composé de 10 leucines et de quatre phénylalanines modifiées par des éthers-couronnes a été modifié de façon systématique pour tenter de comprendre les déterminants de l’activité et de la sélectivité des peptides antimicrobiens. Dans ce mémoire, la synthèse et la caractérisation des analogues dans lesquels trois leucines ont été substituées par des acides aminés cationiques seront discutées. Ces peptides ont été caractérisés par des études biophysiques comme le dichroïsme circulaire, l’infrarouge à transformée de Fourier et le relargage de la calcéine par fluorescence. De plus, des tests d’activité biologique comme l’activité antimicrobienne et l’activité hémolytique ont aussi été réalisés et sont présentés dans le présent mémoire.
IV
Table des matières
Résumé ... II Table des matières ... IV Liste des tableaux ... VII Liste des figures ... VIII Liste des abréviations ... X Remerciements ... XII
Chapitre 1 – Introduction ... 1
1.1 - Antibiotiques ... 1
1.2 - Résistance aux antibiotiques ... 1
1.3 - Solutions envisageables ... 5
1.4 - Peptides antimicrobiens ... 7
1.4.1 - Classification... 8
1.4.2 - Peptides amphiphiles en hélice alpha ... 9
1.4.3 - Mécanisme d’action ... 10
1.4.4 - Potentiel comme médicament ... 11
1.4.5 - Peptides sur le marché ... 12
1.4.6 - Peptides antimicrobiens synthétiques ... 13
Chapitre 2 - Projet ... 14
2.1 - Antécédents au laboratoire ... 14
2.2 - Objectifs du projet... 17
Chapitre 3 - Synthèse et caractérisation ... 18
3.1 - Synthèse de l’acide aminé éther-couronne ... 18
3.2 - Synthèse peptidique sur support solide ... 20
3.3 - Purification et caractérisation ... 23
3.4 - Étude fluorimétrique du relargage de la calcéine ... 24
3.5 - Détermination de la structure secondaire par dichroïsme circulaire et dichroïsme circulaire orienté ... 26
3.6 - Détermination de la structure secondaire par spectroscopie infrarouge ... 27
3.7 - Test d’activité antibactérienne ... 29
3.8 - Test d’activité hémolytique ... 30
Chapitre 4 - Résultats et discussion ... 31
V
4.2 - Étude fluorimétrique du relargage de la calcéine ... 38
4.3 - Analyse de la structure secondaire par dichroïsme circulaire et dichroïsme circulaire orienté ... 42
4.3.1 - Dichroïsme circulaire ... 42
4.3.2 - Dichroïsme circulaire orienté ... 46
4.4 - Analyse de la structure secondaire par spectroscopie infrarouge à transformée de Fourier . 49 4.5 - Activité antibactérienne ... 51
4.6 - Activité hémolytique ... 58
4.7 - Protection des extrémités ... 62
Chapitre 5 – Conclusion et travaux futurs ... 67
5.1 - Conclusion ... 67
5.2 - Travaux futurs ... 69
Chapitre 6 - Partie expérimentale ... 71
6.1 - Remarques générales ... 71
6.2 - Synthèse de l’acide aminé éther-couronne ... 72
6.2.1 - Bromation de l’hexaéthylène glycol ... 72
6.2.2 - Estérification de la L-DOPA ... 73
6.2.3 - Protection de la L-DOPA méthylée avec le groupement BOC ... 74
6.2.4 – Macrocyclisation ... 75
6.2.5 - Saponification de l’éther-couronne ... 76
6.2.6 - Déprotection du BOC ... 77
6.2.7 - Protection de l’acide aminé éther-couronne par un groupement Fmoc ... 77
6.3 - Synthèse peptidique sur support solide ... 79
6.3.1 - Couplage du premier acide aminé ... 79
6.3.2 - Détermination du taux de substitution ... 80
6.3.3 - Acétylation des sites non-substitués ... 80
6.3.4 - Déprotection de la fonction amine du dernier acide aminé fixé ... 80
6.3.5 - Couplage de l'acide aminé suivant ... 81
6.3.6 - Test de Kaiser qualitatif ... 81
6.3.7 – Séparation et acétylation ... 81
6.3.8 - Clivage des analogues de la résine de Wang ... 81
6.4 - Purification HPLC ... 82
VI
6.6 - Étude fluorimétrique du relargage de la calcéine ... 83
6.6.1 - Préparation des vésicules ... 83
6.6.2 - Test de Bartlett ... 83
6.6.3 - Test de perméabilité membranaire ... 84
6.7 - Détermination de la structure secondaire par spectroscopie infrarouge ... 84
6.7.1 - Préparation des échantillons... 84
6.7.2 - Traitement des spectres ... 85
6.7.3 – Résultats ... 86
6.8 - Test d’activité antibactérienne ... 98
6.8.1 - Préparation des bactéries ... 98
6.8.2 - Préparation des solutions ... 98
6.8.3 - Test antimicrobien ... 98
6.9 - Test d’activité hémolytique ... 99
6.9.1- Préparation des plaques ... 99
6.9.2 - Préparation du sang chez Héma-Québec ... 99
6.9.3 – Test hémolytique ... 100
VII
Liste des tableaux
Tableau 1 – Structure secondaire et longueur d’onde associée ... 29
Tableau 2 – Rendement et caractérisation par HPLC et spectroscopie de masse des analogues non-acétylés ... 31
Tableau 3 – Rendement et caractérisation par HPLC et spectroscopie de masse des analogues acétylés ... 34
Tableau 4 – Structure secondaire majoritaire des séries R5R10 et R4R11 non-acétylés ... 49
Tableau 5 – Structure secondaire majoritaire des séries R5R10 et R4R11 acétylés ... 50
Tableau 6 – CMI de tous les 14-mère trisubstitués ... 52
Tableau 7 – CMI des peptides des séries R5R10 et R4R11 ... 54
Tableau 8 – Activité hémolytique des 14-mère trisubstitués ... 59
Tableau 9 – Activité hémolytique des peptides des séries R4R11 et R5R10 ... 61
Tableau 10 – Effet de la protection du N-terminal sur l’activité antimicrobienne et hémolytique ... 63
Tableau 11 – Effet de la protection du N-terminal sur la structure déterminée par FTIR ... 63
Tableau 12 - Rendement et caractérisation par HPLC et spectroscopie de masse des analogues protégés au C-terminal ... 64
Tableau 13 – Effet de la protection du C-terminal sur l’activité antimicrobienne et hémolytique ... 64
VIII
Liste des figures
Figure 1 - Modes d’action de différents antibiotiques ... 2
Figure 2 - Incidence des infections à Enterococcus résistant à la vancomycine pour 1 000 hospitalisations et pour 10 000 jours-patients12... 4
Figure 3 – Différents mécanismes de formation de pores des peptides antimicrobiens, adaptation de l’article de Brogden36 . ... 10
Figure 4 – Structure des différents peptides antimicrobiens disponibles sur le marché. ... 13
Figure 5 – Représentation schématique du 21-mère en hélice alpha 52 ... 14
Figure 6 – Relargage de la calcéine des analogues du 21-mère dans des vésicules de EYPC55. ... 15
Figure 7 – Structure du 14-mère ... 15
Figure 8 – Rétrosynthèse de l’acide aminé éther-couronne ... 18
Figure 9 – Préparation du dibromure d’hexaéthylène glycol ... 18
Figure 10 – Protection de la L-DOPA ... 19
Figure 11 - Macrocyclisation de l’éther couronne ... 19
Figure 12 – Préparation de la phénylalanine éther-couronne pour la synthèse peptidique ... 20
Figure 13 – Couplage du premier acide aminé sur la résine de Wang ... 21
Figure 14 – Déprotection de l’acide aminé ... 22
Figure 15 – Élongation du peptide ... 22
Figure 16 – Clivage du peptide de la résine ... 23
Figure 17 – Exemple de chromatogrammes MS et HPLC pour le peptide R3R12R14 ... 24
Figure 18 – Exemple de graphique de fluorescence obtenu pour le peptide R1R4R11 dans des vésicules de POPG ... 25
Figure 19 – Structure de POPC et POPG respectivement ... 25
Figure 20 – Schéma du fonctionnement du dichroïsme circulaire ... 26
Figure 21 – Schéma du fonctionnement du dichroïsme circulaire orienté ... 27
Figure 22 – Exemple de décomposition spectrale d’un spectre de FTIR67 ... 28
Figure 23 – Pourcentage de relargage de calcéine des vésicules de POPC par différents peptides non-acétylés ... 39
Figure 24 – Pourcentage de relargage de calcéine des vésicules de POPC par différents peptides acétylés ... 39
Figure 25 – Pourcentage de relargage de calcéine des vésicules de POPG par différents peptides non-acétylés ... 40
Figure 26 – Pourcentage de relargage de calcéine des vésicules de POPG par différents peptides acétylés ... 40
IX
Figure 27 – Représentation hélicoïdale du peptide 14-mère ... 42
Figure 28 – Spectres de dichroïsme circulaire dans des vésicules de POPC et POPG respectivement, des analogues trisubstitués des séries R4R11 et R5R10 ... 43
Figure 29 – Spectre de SR-CD du peptide R1R5R10 ... 44
Figure 30 – Spectre de SR-CD du peptide R4R10R11 ... 44
Figure 31 – Spectre de SR-CD du peptide AcR5R10R12 ... 45
Figure 32 – Spectre de SR-CD du peptide R1R4R11 ... 45
Figure 33 – Spectre de SR-OCD du peptide R1R5R10 ... 46
Figure 34 – Spectre de SR-OCD du peptide R4R10R11 ... 47
Figure 35 – Spectre de SR-OCD du peptide AcR5R10R12 ... 47
Figure 36 – Image des tests antimicrobiens pour S. epidermidis et E. coli, respectivement ... 56
Figure 37 – Structure du peptide R1R5R14 ... 57
Figure 38 – Structure du peptide AcR5R10R12 ... 57
Figure 39 – Spectre RMN 1H du Fmoc-21-C-7-L-Phe-OH ... 79
Figure 40 - Spectres infrarouge des séries R4R11 et R5R10 dans des vésicules de POPC ... 86
Figure 41 - Spectres infrarouge des séries R4R11 et R5R10 dans des vésicules de POPG ... 90
Figure 42 - Spectres infrarouge des analogues utilisés pour la protection des extrémités dans des vésicules de POPC ... 94
Figure 43 - Spectres infrarouge des peptides utilisés pour la protection des extrémités dans des vésicules de POPG ... 96
Figure 44 - Spectre infrarouge du peptide R1R5R14 et AcR1R5R14 dans les vésicules de POPG et POPC ... 97
X
Liste des abréviations
6Cl-HOBt : 1-hydroxy-6-chloro-benzotriazole
AcOH : Acide acétique
ATCC : « American Type Culture Collection »
Boc : tert-butoxycarbonyle
Boc2O : Carbonate de di-tert-butyl
BSA : Albumine de sérum bovin
CCM : Chromatographie sur couche mince
CMI : Concentration minimale inhibitrice
DBU : 1,8-diazabicyclo[5,4,0]undéc-7-ène DCM : Dichlorométhane DIC : Diisopropylcarbodiimide DIEA : Diisopropyléthylamine DMAP : Diméthylaminopyridine DMF : Diméthylformamide DMSO : Diméthylsulfoxide
EDTA : Acide éthylène diamine tétraacétique
ERV : Enterococcus résistant à la vancomycine
EYPC : « Egg Yolk Phosphatidyl Choline » Lécithine de jaunes d’oeufs
FDA : « Food and Drug Administration »
Fmoc : 9-fluorénylméthyloxycarbonyle
Fmoc-O-Su : N-(9-Fluorénylméthoxycarbonyloxy)succinimide
FTIR : Infrarouge à Transformé de Fourier
HCTU : O-(6-Chlorobenzotriazol-1-yl)-N,N,N′,N′-tétraméthyluroniumhexafluoro phosphate
HEPES : Acide 4-(2-hydroxyéthyl)-1-pipérazineéthanesulfonique
HOBt : Hydroxybenzotriazole
HPLC : Chromatographie liquide à haute pression
KIT : « Karlsruhe Institute of Technology »
LC : Chromatographie liquide
MHB : « Mueller Hinton Broth »
SM : Spectroscopie de masse
NMM : N-méthylmorpholine
OMS : Organisation mondiale de la santé
Pbf : Pentaméthyle-2,3-dihydrobenzofurane-5-sulfonyle
PBS : Tampon phosphate salin
PIB : Produit intérieur brut
POPC : 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine
POPG : 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-(1'-rac-glycerol)
REDOR : « Rotational-Echo, Double Resonance NMR »
RMN : Résonance magnétique nucléaire
RPM : Révolution par minute
XI
SN2 : Substitution nucléophile de type 2
SR-CD : Dichroïsme circulaire à radiation synchrotron
SR-OCD : Dichroïsme circulaire orienté à radiation synchrotron
TFA : Acide trifluoroacétique
THF : Tétrahydrofurane
TIS : Triisopropylsilane
XII
Remerciements
Les études présentées ici sont les plus récents développements d’un projet datant d’une quinzaine d’années. Ainsi, une quantité impressionnante de personnes y ont été impliquées. Bien que je ne puisse nommer tout le monde, je tiens à remercier tous ceux ayant travaillé sur ce projet avant moi.
D’abord, je voudrais remercier les gens ayant travaillé à la synthèse des peptides à l’étude dans ce mémoire; soit Rachelle Séguin et Laura-Lee Gosselin, deux stagiaires de premier cycle, ainsi que Romain Martiny, stagiaire français.
Je tiens à remercier Pierre-Alexandre Paquet-Côté qui a fait son projet de maîtrise sur d’autres analogues de notre peptide modèle. En plus de ses résultats qui ont beaucoup fait avancer notre étude des peptides antimicrobiens, Pierre-Alexandre a contribué à ma formation et sa connaissance du projet a toujours été pour moi un outil indispensable. Ensuite, je voudrais remercier François Otis, professionnel de recherche dans notre laboratoire. François trouve toujours une solution lorsqu’un problème surgit et se montre toujours disponible pour nous aider.
Je veux aussi remercier l’ensemble des étudiants de mon groupe, soit Christopher, Jean-Daniel, Gaëlle, Claudia, Sébastien et Corinne. Leur aide et leur soutien sont toujours appréciés. Je voulais aussi les remercier d’avoir fait de notre bureau et du laboratoire un endroit où il est agréable de travailler.
Je veux également remercier le professeur Normand Voyer qui m’a permis de travailler dans son laboratoire. Son enseignement et son encadrement m’ont fait grandir énormément tant sur les plans académique et professionnel que sur le plan personnel.
Finalement, je remercie les différents organismes subventionnaires; sans leur soutien financier, rien de tout ceci n’aurait été possible. Je remercie particulièrement PROTEO qui m’a accordé une bourse d’étude pour étudiant gradué.
1
Chapitre 1 – Introduction
1.1 - Antibiotiques
Depuis toujours, les infections bactériennes sont un véritable fléau pour la santé publique. Un nombre incalculable d’individus sont morts de ces infections, certaines semblant banales aujourd’hui. Ce qui a rendu ces infections si dangereuses était notre difficulté à les traiter de façon efficace. Heureusement, en 1929, Alexander Fleming fit la découverte fortuite de la pénicilline, le premier antibiotique, qui sera utilisé plus tard pour combattre les infections bactériennes causées par certaines bactéries des genres Staphylococcus et
Streptococcus1. Suite à la réalisation que de tels médicaments pourraient éliminer le problème des infections bactériennes, le nombre de classes d’antibiotiques sur le marché explosa. En effet, entre les années 1930 et 1960, plus de 20 nouvelles classes d’antibiotiques firent leur apparition sur les tablettes2,3
permettant ainsi de combattre et de contrôler plusieurs maladies et ainsi sauver d’innombrables vies.
Par contre, le développement d’antibiotiques a grandement ralenti depuis. En effet, depuis 1960, seulement deux nouvelles classes d’antibiotiques se sont ajoutées4,5. Il est devenu trop coûteux et trop compliqué pour les compagnies pharmaceutiques de développer de nouvelles classes d’antibiotiques6
. Pour tenter de stimuler la production de nouvelles classes d’antibiotiques, plusieurs mesures ont été suggérées, comme la simplification du procédé de mise en marché des antibiotiques par la FDA, l’homologue de Santé Canada aux États-Unis, ou de meilleures contrats d’exclusivité, mais aucune de ces mesures n’est en place en ce moment5.
1.2 - Résistance aux antibiotiques
La résistance aux antibiotiques est un mécanisme de défense que les bactéries développent en réponse à l’utilisation d’antibiotiques. Certaines bactéries sont intrinsèquement résistantes à un antibiotique donné, mais d’autres vont développer cette résistance soit par mutation ou par transfert horizontal de gènes7. Étant donné que les cibles des antibiotiques sont très variées, les mécanismes de résistance des bactéries sont tout aussi variés.
2
Figure 1 - Modes d’action de différents antibiotiques8
Comme démontré dans la figure 1, les antibiotiques attaquent une très grande variété de cibles importantes dans la cellule bactérienne. Par conséquent, plusieurs mécanismes sont nécessaires pour contrer l’action des différentes molécules antibiotiques. La première stratégie est d’empêcher que le médicament ne se rende à la cible. Pour ce faire, certaines cellules vont diminuer la perméabilité de leur membrane, empêchant ainsi la molécule d’entrer dans la cellule. D’autres bactéries peuvent synthétiser des pompes à efflux, qui sont des protéines de transport spécialisées pour éjecter un antibiotique à l’extérieur de la cellule. Une autre façon de générer la résistance consiste à modifier génétiquement la cible de l’antibiotique à l’aide de mutations pour empêcher que le médicament ne reconnaisse cette cible. La cible peut aussi être modifiée à l’aide d’enzymes pour obtenir le même résultat. Par exemple, une simple phosphorylation ou une méthylation bien placée peut modifier la structure de l’enzyme et empêcher l’action de l’antibiotique. Une troisième stratégie peut être utilisée pour générer de la résistance. Cette stratégie consiste à modifier directement l’antibiotique pour le rendre inactif. Ainsi, il est possible d’hydrolyser directement la molécule antibiotique à l’aide d’enzymes. Le transfert de différents groupements peut aussi suffire à inhiber l’activité. Si, par exemple, ce groupement vient protéger le site de liaison avec l’enzyme, un groupement aussi simple qu’un méthyle est suffisant7. En bref, il existe plusieurs modes d’action et les mécanismes de résistance peuvent être très variés, et ce, même pour un seul antibiotique.
3
La résistance aux antibiotiques, produit de l’évolution, est un phénomène naturel, mais notre utilisation des antibiotiques peut parfois accélérer la propagation de cette résistance. En effet, la prescription empirique d’antibiotiques par les médecins expose les bactéries de notre système au médicament, parfois sans qu’il n’y ait de besoin. Cette pratique peut donc induire de la résistance à des bactéries ne causant pas d’infection à l’instant, mais qui pourrait en causer éventuellement9,10. Ensuite, la mauvaise utilisation des antibiotiques par les patients peut aussi contribuer en réalisant une sélection des bactéries résistantes10. Par exemple, si le patient arrête de prendre ses médicaments avant la fin de son traitement, il est possible que la totalité des pathogènes responsables de l’infection ne soit pas éliminée. Ces bactéries résiduelles, ayant été exposées à l’antibiotique et ayant survécu, sont plus fortes et pourront ensuite croitre. Les prochaines générations de bactéries issues de ces individus seront plus fortes, plus enclines à la résistance aux antibiotiques11. Ce type de sélection est aussi causé par la quantité massive d’antibiotiques consommée par les animaux d’élevage. En effet, environ la moitié des antibiotiques de notre environnement proviendraient de la viande que l’on consomme11
.
La résistance aux antibiotiques, phénomène en croissance depuis quelques années12, est un problème très sérieux qui fut observé dès le début des premiers antibiotiques dans les années 19409. En effet, une bactérie devenue résistante peut causer des dommages considérables chez le patient et force l’utilisation d’antibiotiques différents ou à plus haute dose pour traiter l’infection. Comme on peut le voir à la figure 2, le nombre de cas d’infections reliées à Enterococcus résistant à la vancomycine (ERV) a augmenté de façon drastique dans les dix dernières années.
4
Figure 2 - Incidence des infections à Enterococcus résistant à la vancomycine pour 1 000 hospitalisations et pour 10 000 jours-patients12
L’ERV n’est pas la seule bactérie qui connait une telle augmentation. En effet, on voit une augmentation du taux d’infections par des bactéries résistantes chez les Canadiens pour une grande variété d’organismes. Par exemple, le Staphyloccocus aureus résistant à la méthyciline (SARM), le Streptococcus pneumoniae ou encore les bactéries résistantes du genre Salmonella. Par contre, il est à noter que le problème est connu des autorités gouvernementales depuis plusieurs années et que plusieurs actions de préventions ont été prises. Ces actions, pouvant s’étendre de la sensibilisation au dépistage systématique dans les hôpitaux, commencent à avoir un effet. Au Canada, on voit une légère baisse des infections aux bactéries résistantes pour plusieurs organismes depuis le début des années 201012. Ces mesures, bien qu’un pas dans la bonne direction, ne suffiront cependant pas à éradiquer ce problème majeur. Malgré les mesures prises pour ralentir ce phénomène, certaines études estiment que, d’ici quelques années, ce problème de santé seul pourrait coûter à chaque pays entre 3 et 10 % de leur PIB pour traiter les individus affectés13. Finalement, l’Organisation mondiale de la santé, l’OMS, a émis en 2014 le rapport intitulé « ANTIMICROBIAL RESISTANCE, Global Report on Surveillance ». Dans ce rapport, l’OMS étudie l’évolution de ce problème et en vient à la conclusion que, si des actions drastiques ne sont pas prises bientôt par l’ensemble de la planète, nous allons tomber dans
5
une ère post-antibiotique où les infections communes et les blessures mineures seront de nouveau mortelles14.
1.3 - Solutions envisageables
Pour tenter de contrôler l’évolution de la résistance aux antibiotiques, il faudra prendre des actions concrètes et immédiates. En effet, nous devons agir avant que ce problème déjà très grave ne prenne des proportions trop importantes. Pour ce faire, nous devrons premièrement changer nos pratiques actuelles et ensuite explorer de nouvelles méthodes de traitement.
La première étape pour ralentir l’évolution de la résistance aux antibiotiques est de sensibiliser la population. Cette solution est de loin la plus facile et aurait un impact significatif. En effet, si les gens prenaient leurs antibiotiques tel que prescrits, il serait possible d’enrayer plusieurs problèmes. Ensuite, beaucoup de médicaments sont prescrits par les médecins simplement pour rassurer les patients. Lorsqu’un patient se présente à l’hôpital avec des symptômes, il a souvent comme attente de sortir avec un médicament ou un traitement quelconque, et ce, même si aucun traitement n’est nécessaire. Ceci pourrait encourager certains médecins à prescrire des antibiotiques simplement pour rassurer leurs patients. Dans un tel cas, le patient peut se voir soulagé même si les antibiotiques n’étaient pas nécessaires grâce à l’effet placébo ou à l’évolution naturelle de la maladie. Pour tenter de régler ce problème, l’Association médicale canadienne à mis au point la campagne « Choisir avec soin » qui vise à aider les médecins et les patients à communiquer sur la nécessité des traitements et des examens15. Par le fait même, si l’on désire ralentir le développement de la résistance aux antibiotiques, les médecins doivent aussi être sensibilisés à ce problème. Les antibiotiques doivent être prescrits seulement lorsqu’ils sont vraiment nécessaires. L’Association médicale canadienne a émis un communiqué en mars 2016 confirmant le problème de surdiagnostic au Canada16. De plus, l’utilisation d’antibiotiques à spectre étroit peut aussi aider au problème en réduisant le nombre de bactéries touchées par le traitement17. Les médecins doivent comprendre que les impacts de leurs actions peuvent être très importants pour la lutte contre la résistance aux antibiotiques.
6
Une autre avenue à entreprendre serait de bannir l’utilisation d’antibiotiques comme facteur de croissance dans la nourriture des animaux de ferme. Cette mesure a déjà été adoptée par plusieurs pays d’Europe et il fut prouvé que, non seulement la prévalence des infections aux bactéries résistantes avait diminué, mais l’effet sur la croissance des animaux était insignifiante18. Cette mesure devrait donc être imposée partout sur la planète si nous voulons ralentir le développement de la résistance, mais l’aspect économique de telles décisions ralentit probablement son implantation.
Ensuite, il faudrait étudier les alternatives au traitement à l’aide d’antibiotiques. En effet, avant que les antibiotiques ne soient découverts, certaines maladies infectieuses étaient traitées à l’aide de bactériophages. Cette technique est appelé la phagothérapie19
. Les bactériophages sont des virus n’infectant que les bactéries et leur utilisation en médecine fut plus ou moins oubliée dans les années 1940, moment où les premiers antibiotiques prirent le relai. Cette technique, loin d’être parfaite, présentait plusieurs inconvénients. Mais le développement du génie génétique et de la médecine permettrait certainement le design de nouveaux phages plus facile à utiliser et ayant une activité accrue20. Par contre, de telles études demandent un investissement considérable, ce qui ralentit son développement par les compagnies pharmaceutiques.
Finalement, la dernière stratégie à explorer est le développement de nouveaux antibiotiques contre lesquels les bactéries ne sont pas résistantes. Pour obtenir de nouveaux antibiotiques, plusieurs approches peuvent être envisagées. En effet, l’approche à court terme consiste à modifier légèrement un antibiotique connu. Une telle modification peut être suffisante pour que le mécanisme de résistance de la bactérie cible ne reconnaisse plus l’antibiotique, ce qui vient régénérer l’activité de l’antibiotique. Cette méthode est peu coûteuse et demande peu de développement pour les compagnies pharmaceutiques21. Par contre, la résistance réapparaitra très rapidement après que ce nouvel antibiotique soit mis sur les tablettes, puisque le changement que devra faire la bactérie pour s’adapter est souvent minime4. Bien que cette technique soit efficace à très court terme, le problème ne sera jamais réglé de cette façon. La stratégie la plus durable serait de développer plusieurs nouvelles classes d’antibiotiques. Par contre, le développement de tels médicaments demande un investissement de temps et d’argent considérable et les résultats au terme du projet ne sont
7
jamais garantis22. Un nouveau candidat avec une activité prometteuse peut s’avérer avoir des effets secondaires majeurs empêchant l’utilisation chez l’humain. De plus, lorsqu’un nouvel antibiotique apparait sur le marché, les médecins ont tendance à le garder comme dernier recours pour le traitement d’infections par des bactéries résistantes. Cette technique, bien que très importante et pertinente pour le contrôle de la résistance, diminue les profits des compagnies pharmaceutiques, ce qui ne les motive pas à investir dans les antibiotiques3. Les antibiotiques ne sont pas non plus le marché le plus rentable. Comme ces molécules guérissent l’infection, leur utilisation est souvent restreinte à quelques jours, ce qui n’est pas très rentable pour les compagnies pharmaceutiques si on les compare aux médicaments contre les maladies chroniques où un patient consommera le médicament pour une très longue durée3,23. Pour ces raisons, les compagnies pharmaceutiques en général ne vont pas dans cette direction. Par contre, la mise en marché de nouvelles classes d’antibiotiques serait une méthode efficace pour contrer les bactéries multirésistantes. L’espoir pour le développement de telles classes de médicament retombe en ce moment sur le milieu académique et sur les petites compagnies en biotechnologie. En effet, beaucoup de recherche est faite dans ces milieux pour tenter de trouver de nouveaux antibiotiques21. Lorsque la viabilité d’une nouvelle molécule sera prouvée par le milieu académique, les compagnies pharmaceutiques pourront optimiser la molécule, compléter les nombreux tests nécessaires et mettre le nouveau médicament sur le marché. Ce procédé est très complexe et coûteux, mais lorsque la preuve de concept est réalisée par l’académique, ceci décuple les chances que la molécule se retrouve sur le marché. Un exemple de classe d’antibiotiques présentement très étudiée est les peptides antimicrobiens.
1.4 - Peptides antimicrobiens
Les peptides antimicrobiens sont de courts segments protéiques retrouvés dans virtuellement tout les organismes, responsables de la protection contre les bactéries24. L’humain aussi possède plusieurs peptides antimicrobiens, comme par exemple, l’histatine que l’on retrouve dans la salive humaine25
. Ces peptides d’une longueur d’environ 20 à 40 acides aminés sont souvent sélectifs envers les bactéries, mais ont un spectre d’action plutôt large25. Ces molécules seraient des candidats très intéressants pour le développement d’antibiotiques, car ils ont un mode d’action tout à fait unique. En effet, ces peptides
8
attaquent directement la membrane de la cellule, permettant ainsi un échange d’ions entre le milieu intracellulaire et extracellulaire amenant la cellule à l’apoptose. Ce mécanisme d’action est très intéressant puisque, en ayant une cible n’étant pas composée d’une seule molécule, il serait plus difficile pour la cellule victime de l’agression de développer de la résistance26.
1.4.1 - Classification
Il est possible de classifier les peptides antimicrobiens de plusieurs façons, mais en 1999 Richard M. Epand et Hans J. Vogel proposèrent de classifier les peptides antimicrobiens en fonction de leur structure. Cette méthode sépare les peptides antimicrobiens en six catégories : les peptides amphiphiles en hélice alpha, les peptides en feuillet bêta, les peptides ayant une composition en acide aminé inhabituelle, les peptides ayant des anneaux thioéther, les peptaïbols et les peptides macrocycliques ayant des nœuds disulfures27. La classe des peptides amphiphiles en hélice alpha contient la majorité des peptides antimicrobiens étudiés à ce jour. Ces peptides sont souvent chargés positivement et, comme le titre de la classe le suggère, ils forment des hélices alpha amphiphiles28. Cette classe contient plusieurs peptides connus comme la gramicidine A et la magainine. Les peptides en feuillets bêta ont une forte proportion de feuillet bêta et ont souvent tendance à adopter des structures cycliques liées par le squelette ou par des ponts disulfures27. La gramicidine S et la polymixine B sont deux exemples bien connus de cette catégorie. Les peptides ayant une composition en acide aminé inhabituelle ont une forte tendance à contenir plusieurs répétitions d’un acide aminé que l’on ne retrouve normalement pas si souvent dans un peptide, comme la proline, l’histidine ou le tryptophane 29
. Cette catégorie contient entre autre l’histatine, un peptique que l’on retrouve dans la salive des mammifères. Les peptides ayant des anneaux thioéther, aussi appelé « lantibiotiques », sont des peptides contenant les acides aminés non-protéinogène lanthionine (molécule 1) et β-méthyllanthionine30. Ces acides aminés viennent se cycliser pour former un anneau thioéther.
9
1
Cette catégorie inclut la nisine, un peptide utilisé comme agent de conservation. Les peptaïbols sont des peptides ayant souvent une conformation rigide en hélice alpha ou en hélice 310, contenant l’acide aminé acide α-amino-isobutyrique (molécule 2)31.
2
Finalement, les peptides macrocycliques ayant des nœuds disulfures sont des peptides dans lesquels on retrouve le motif du nœud disulfure. Un nœud disulfure est un entrelacement de plusieurs ponts disulfures qui forment un rotaxane, un anneau, autour d’un pont disulfure32. 1.4.2 - Peptides amphiphiles en hélice alpha
Nous regarderons maintenant plus en profondeur les peptides amphiphiles en hélices alpha, puisqu’ils sont les plus nombreux et les plus connus. Cette classe contient près de la moitié des peptides antimicrobiens et la majorité de ceux-ci possède une charge globale entre +1 et +6. Comme mentionné plus haut, les peptides de cette catégorie ont une longueur standard pour des peptides antimicrobiens, soit entre 20 et 50 acides aminées de long33. Plusieurs peptides ont leur extrémité C-terminale protégée par un amide. Cette simple protection vient remplir plusieurs fonctions; en plus d’augmenter la charge globale du peptide en masquant la charge négative du C-terminal, on vient aussi protéger le peptide de l’action des carboxypeptidases, des enzymes utilisant le C-terminal libre pour débuter l’hydrolyse du peptide34. Les peptides antimicrobiens amphiphiles en hélices alpha sont composés environ d’une moitié d’acides aminés non-polaires et d’une moitié d’acides aminés polaires organisés de façon à obtenir une face hydrophobe et une face hydrophile chargée positivement33. Cette caractéristique, que l’on désigne comme le caractère amphiphile d’un peptide, aide le peptide dans ses interactions avec les membranes procaryotes qui sont chargées globalement négativement.
10 1.4.3 - Mécanisme d’action
Le mécanisme exact par lequel les peptides antimicrobiens réussissent à tuer la cellule n’est pas entièrement connu, mais plusieurs hypothèses ont été soulevées au cours des années. En effet, il semble que tous les peptides antimicrobiens n’agissent pas de la même façon, bien qu’ils tentent tous d’induire des pores dans la membrane des cellules bactériennes35
. Quatre mécanismes principaux sont discutés aujourd’hui, soit la formation de pores toroïdaux, la formation de « barrel-staves », le « sinking-raft » et le « carpet-like ». La figure 3 présente ces différents mécanismes de façon schématisée.
Figure 3 – Différents mécanismes de formation de pores des peptides antimicrobiens, adaptation de l’article de Brogden36
.
La formation d’un pore toroïdal par un peptide antimicrobien requiert premièrement que les peptides se déposent parallèlement à la membrane, la face hydrophobe intercalée entre les têtes polaires des lipides, dans l’environnement hydrophobe de la membrane. Lorsque la concentration en peptides à un certain point de la membrane est assez élevée, les peptides vont venir progressivement induire une courbure dans les lipides jusqu’à en former un pore. Ce type de pore est particulier, puisque les lipides de la membrane font partie prenante du pore en ayant des têtes polaires intercalées entre les peptides, induisant la courbure de la
Barrel-stave
Pore toroïdal
Sinking-raft
Formation de pores
Carpet-like
11
membrane37. Pour le modèle de la formation de « barrel-staves », la formation de pores débute comme le modèle précédent, soit avec les peptides s’adsorbant à la membrane. Par la suite, les peptides formeront des agrégats qui viendront ensuite s’insérer dans la membrane pour former un tunnel transmembranaire. Dans ce mécanisme, les régions hydrophobes du peptide se retrouvent à l’extérieur, en contact avec les chaines lipidiques. Les régions hydrophiles se retrouvent à l’intérieur du tonneau, en contact avec l’eau38. Tout comme les deux autres mécanismes, le « sinking-raft » débute avec une accumulation de peptides parallèlement à la surface de la membrane. Pour la suite, ce mécanisme est très différent. Dans le « sinking-raft » les peptides resteront toujours parallèles à la membrane. Le pore est formé lorsque le peptide change de face de membrane. Ce pore temporaire sera induit grâce à la courbure de la membrane qu’induira le peptide pour « couler » dans la membrane39. Le dernier est le mécanisme de formation de pores « carpet-like ». Ce dernier requiert une concentration très grande de peptides qui resteront tous parallèles à la membrane. Les peptides vont ici faire un tapis de molécules qui va couvrir toute la membrane, la solubilisant ainsi en formant des micelles. Tout comme les autres mécanismes, cette technique requiert un peptide ayant une certaine amphiphilicité40.
1.4.4 - Potentiel comme médicament
Comme expliqué plus haut, les peptides antimicrobiens sont d’excellents candidats pour le développement de nouveaux antibiotiques. Ce sont des molécules naturelles très actives contre lesquelles les bactéries ont peu de mécanismes de défense. Par contre, plusieurs obstacles importants empêchent leur utilisation immédiate comme médicament. Premièrement, la toxicité envers l’hôte de certains peptides empêche leur utilisation41. En effet, leur activité hémolytique, pouvant être assez importante, limite les utilisations possibles de telles molécules. Comme ils lysent les globules rouges, les peptides ayant une activité hémolytique sont restreints à des utilisations topiques, où ils ne peuvent pas faire de dommages à l’organisme42, ce qui n’est pas très optimal pour un antibiotique. Deuxièmement, la synthèse et la purification de telles molécules peuvent être problématiques. En effet, la synthèse sur support solide est une méthode standard pour la production de peptides, mais elle peut être très coûteuse pour la production à grande échelle43. Ensuite, le peptide préparé par cette méthode nécessitera une purification pour
12
être utilisé comme antibiotique et celle-ci peut s’avérer extrêmement coûteuse dépendamment du peptide à purifier. La solution à ce problème serait l’utilisation de la biofermentation et des technologies de l’ADN recombinant pour générer les peptides d’intérêt par biosynthèse44
. Cette technique a par contre le problème que, par définition, les molécules synthétisées tueront les bactéries les synthétisant, apportant des problèmes de rendement et de rentabilité. Troisièmement, les peptides antimicrobiens, étant des protéines, tendent à être digérés lorsqu’utilisés de façon orale45
. Pour contourner ce problème, on peut soit modifier la molécule en espérant la rendre invisible aux protéases, tout en gardant son activité, soit l’utiliser de façon topique, où elle sera beaucoup moins exposée aux protéases. Cette problématique complique grandement le développement de peptides antimicrobiens et limite leur utilisation. Finalement, l’utilisation à long terme des peptides antimicrobiens d’origine autre qu’humaine pourrait causer des allergies26
. Cette conclusion fut tirée de l’étude des conséquences de l’utilisation de la polymixine B, un peptide antimicrobien déjà sur le marché46. Une option pour contrer ce problème serait de stimuler notre production naturelle de peptides antimicrobiens plutôt que d’en injecter de nouveaux. De cette façon, les peptides n’induiraient pas de réaction de l’organisme.
1.4.5 - Peptides sur le marché
L’étude des peptides antimicrobiens ne date pas d’hier. Pourtant, très peu de candidats se rendent jusqu’aux études cliniques et encore moins se rendent sur les tablettes. En effet, seulement une douzaine de peptides antimicrobiens sont actuellement dans le long processus des études cliniques47. Plusieurs centaines de peptides ont tentés de se rendre sur le marché, mais ont été interrompus pour une raison ou une autre42. On compte seulement une poignée de peptides antimicrobiens sur les tablettes en 2016. Parmi ceux-ci, les plus connus sont la nisine, qui est utilisée comme agent de conservation, la Gramicidine A, utilisée pour traiter les infections topiques aux bactéries à Gram positif, la Gramicidine S, utilisée topiquement pour le traitement de blessures et la polymyxine B, l’ingrédient principal du Polysporin®. Plus récemment, la Food and Drug Administration, a approuvé un nouveau peptide antimicrobien, la daptomycine, un peptide cyclique capable de tuer les bactéries à Gram positif33. Les structures de ces peptides sont présentées à la figure 4.
13
Figure 4 – Structure des différents peptides antimicrobiens disponibles sur le marché. 1.4.6 - Peptides antimicrobiens synthétiques
Bien que les peptides antimicrobiens aient un bon potentiel pour l’utilisation comme antibiotiques, plusieurs inconvénients discutés plus tôt limitent leur utilisation. C’est pourquoi plusieurs groupes de recherche partout autour du globe48 se concentrent sur le développement de peptides synthétiques. Ces peptides sont construits pour imiter les peptides antimicrobiens tout en évitant leurs problèmes, comme la toxicité ou la susceptibilité aux protéases. Deux approches générales sont utilisées. Premièrement, plusieurs vont modifier les peptides naturels pour tenter d’améliorer leur activité et atténuer leurs problèmes49,50. Cette approche est limitée par nos connaissances incomplètes des déterminants de l’activité et de la sélectivité de telles molécules. Par conséquent, il peut être difficile de faire un design rationnel du nouveau peptide. L’autre méthode consiste à créer un nouveau peptide à partir de zéro en tentant d’imiter une caractéristique des peptides antimicrobiens comme la structure, la charge ou la composition en acide aminé. Cette méthode « carte blanche » peut prendre beaucoup plus de temps pour obtenir un peptide efficace, mais on peut obtenir ainsi de nouvelles molécules pouvant avoir des caractéristiques tout à fait uniques51.
14
Chapitre 2 - Projet
2.1 - Antécédents au laboratoire
Le présent projet tire son origine des résultats obtenus dans des études précédentes visant à faire le design et la synthèse d’un canal ionique artificiel. Pour remplir cet objectif, un peptide de 21 acides aminés contenant 15 leucines et 6 phénylalanines, sur lesquelles ont été greffés des éthers-couronnes, a été synthétisé52. Nous l’appellerons 21-mère tout au long de ce mémoire.
Figure 5 – Représentation schématique du 21-mère en hélice alpha 52
Les éthers-couronnes ont été savamment placés pour s’aligner lorsque le peptide est replié en hélice alpha (figure 5). De cette façon, les éthers-couronnes peuvent créer un canal permettant le passage des ions. La longueur de 21 acides aminés a aussi été calculée pour obtenir un peptide capable de traverser la membrane à lui seul. La leucine a été choisie comme acide aminé non-polaire puisque le peptide constitué majoritairement de leucines devrait être assez hydrophobe pour s’incorporer aux membranes. De plus, la leucine est connue pour favoriser la conformation en hélice alpha53. Ensuite, les éthers-couronnes, connus pour leur capacité à complexer certains ions54, ont été choisis, car il serait théoriquement facile de moduler la sélectivité du canal simplement en changeant la taille de l’éther-couronne.
Pour faire un bon canal ionique, le 21-mère doit laisser les membranes intactes. La capacité à perturber les membranes a donc été testée à l’aide du test de relargage de la calcéine qui sera expliqué en détails plus tard dans ce mémoire. Les précurseurs de synthèse ont aussi
15
été testés, soit l’analogue à 7 acides aminés, le 7-mère, et l’analogue à 14 acides aminés, le 14-mère.
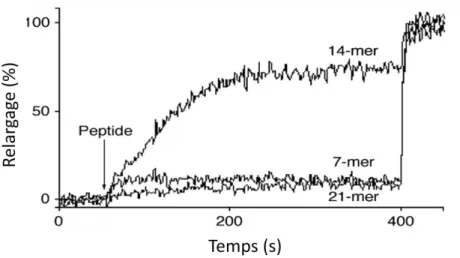
Figure 6 – Relargage de la calcéine des analogues du 21-mère dans des vésicules de EYPC55.
Comme démontré dans la figure 6, seul le 14-mère perturbe les membranes. C’est à la suite de ces résultats que le 14-mère, dont la structure est présentée à la figure 7, a été considéré comme modèle pour étudier les peptides antimicrobiens.
Figure 7 – Structure du 14-mère Bien que ce peptide n’ait aucune activité antimicrobienne56
, sa capacité à perturber les membranes en fait un candidat intéressant. En effet, il semble que ce peptide agisse comme les peptides antimicrobiens et il comporte plusieurs caractéristiques communes avec ceux-ci. Étant amphiphile et en hélice alpha, il ne manquerait que la charge globale positive pour
16
ressembler à un peptide antimicrobien. Une série de modifications débuta alors pour tenter d’identifier les caractéristiques responsables de l’activité des peptides antimicrobiens en utilisant comme modèle le 14-mère, un peptide facile à modifier et à synthétiser. Comme les résultats des modifications suivantes ont déjà été décrits dans d’autres comptes rendus56,57,58 , ils ne seront pas présentés en détails. L’effet de la modification de la taille du peptide et de la modification de la taille des éthers-couronnes a été observé sans voir d’améliorations majeures sur l’activité antimicrobienne, bien que les plus grands éthers-couronnes semblent augmenter légèrement l’efficacité des peptides. Par la suite, une série de modifications visant à augmenter la charge globale du peptide a été réalisée. Dans le but de comprendre l’effet de nos modifications, une approche systématique des changements a été adoptée. Tout d’abord, une leucine a été remplacée par les trois acides aminés positifs (lysine, histidine et arginine). Toutes les mono-substitutions possibles ont été réalisées, donnant un total de 30 peptides différents. Ensuite, les di-substitutions ont été réalisées de la même façon, donnant 135 peptides. La totalité de ces peptides a été aussi synthétisée avec l’extrémité N-terminale acétylée, pour voir l’effet de la protection du N-terminal. L’ensemble de ces peptides a ensuite été testé et plusieurs conclusions ont été tirées de ces résultats. Premièrement, il semblerait que les peptides comprenant l’arginine soient plus actifs que ceux comprenant la lysine, qui sont eux-mêmes plus actifs que les peptides comprenant l’histidine. Ensuite, il est évident que la position des charges est très importante et il semblerait que des charges aux positions 5 et 10 génèrent des peptides ayant une forte activité, mais une faible sélectivité, en attaquant autant les membranes bactériennes qu’humaines. Par contre, les peptides ayant des charges aux positions 4 et 11 seraient très sélectifs, bien que moins actifs. Finalement, les peptides ayant l’extrémité N-terminale protégée seraient moins antimicrobiens, mais plus hémolytiques.
Par la suite, la synthèse des analogues tri-substitués débuta en n’utilisant que l’arginine, qui présentait de meilleurs résultats, et ce, toujours en synthétisant les analogues non-protégés et protégés au N-terminal. L’accent a été tout particulièrement mis sur les séries de peptides ayant deux arginines fixes aux positions 4 et 11 (surnommés R4R11), puis 5 et 10 (surnommés R5R10), comme ces positions semblaient être particulièrement intéressantes. Ce mémoire présente la synthèse et la caractérisation de ces peptides.
17
2.2 - Objectifs du projet
Les objectifs du projet présenté dans ce mémoire sont d’étudier les déterminants de l’activité et de la sélectivité des peptides antimicrobiens. Par « activité », on parle ici du potentiel des peptides à tuer les cellules. La « sélectivité » correspond à la différence entre l’activité contre les cellules bactériennes et l’activité contre les cellules humaines. De plus, un autre objectif est d’étudier la relation structure-activité d’un peptide antimicrobien à l’aide d’un peptide modèle, le 14-mère. De façon plus spécifique, plusieurs objectifs peuvent être décrits :
Terminer la synthèse des 240 analogues tri-substitués.
Déterminer l’activité hémolytique des tri-substitués.
Déterminer l’activité antimicrobienne des tri-substitués.
Déterminer la capacité de relargage de la calcéine des analogues des séries R4R11 et R5R10.
Déterminer la structure tridimensionnelle des analogues des séries R4R11 et R5R10.
18
Chapitre 3 - Synthèse et caractérisation
3.1 - Synthèse de l’acide aminé éther-couronne
L’acide aminé éther-couronne, n’étant pas un acide aminé commercial, est synthétisé au laboratoire59. Pour réaliser cette synthèse, nous débutons avec la L-DOPA, un acide aminé commercial, mais non-naturel et l’hexaéthylène glycol. L’idée derrière cette synthèse est de cycliser l’hexaéthylène glycol, qui sera bromé, sur la L-DOPA en réalisant une double SN2
(figure 8).
Figure 8 – Rétrosynthèse de l’acide aminé éther-couronne
Le premier composé nécessaire est le dibromure d’hexaéthylène glycol. Celui-ci est formé en bromant l’hexaéthylène glycol, les conditions utilisées sont présentées à la figure 9. La triphénylphosphine se lie à un atome de brome, permettant de générer un premier bromure. Ensuite, l’atome de brome sur le phosphore est remplacé par l’oxygène de l’alcool de l’hexaéthylène glycol, générant un deuxième bromure. Celui-ci vient se substituer à l’oxygène sur la phosphine, devenu un excellent groupe partant puisqu’elle se transforme en oxyde de triphénylphosphine. Ce procédé sera répété pour le deuxième alcool de l’hexaéthylène glycol.
Figure 9 – Préparation du dibromure d’hexaéthylène glycol
Par la suite, la L-DOPA, qui est commerciale, doit être protégée pour éviter les réactions secondaires durant la macrocyclisation. Les deux protections sont illustrées à la figure 10. L’acide est tout d’abord protégé en ester méthylique à l’aide du chlorure de thionyle dans le
19
méthanol. Ensuite, la fonction amine est protégée en utilisant le Boc2O pour former le
tert-butoxycarbamate (Boc). Au terme de ces deux étapes, l’acide aminé doublement protégé est prêt pour la macrocyclisation.
Figure 10 – Protection de la L-DOPA
La macrocyclisation est ensuite réalisée dans le DMF (figure 11). Cette réaction de type SN2 est facilitée par la base choisie soit le carbonate de césium. L’ion césium en solution
facilite la fermeture du cycle en se complexant avec l’éther couronne en formation.
Figure 11 - Macrocyclisation de l’éther couronne
Au terme de cette étape de macrocyclisation, l’acide aminé éther-couronne est obtenu, mais protégé par un méthyle sur l’acide et par un Boc sur l’amine. Pour pouvoir l’utiliser dans la synthèse peptidique sur support solide, l’acide devra être libre et l’amine devra être protégée par un groupement 9-fluorénylméthyloxycarbonyle (Fmoc). Le procédé pour arriver à ce but est décrit à la figure 12. En effet, la première étape est de retrouver l’acide en réalisant une saponification dans le méthanol en milieu basique. Ensuite, le Boc est clivé à l’aide de l’acide trifluoroacétique. Après cette étape, la phénylalanine éther-couronne se retrouve non-protégée. Il ne reste seulement qu’à protéger l’amine par un groupement Fmoc à l’aide du réactif Fmoc-O-Su pour pouvoir l’utiliser dans la synthèse peptidique.
20
Figure 12 – Préparation de la phénylalanine éther-couronne pour la synthèse peptidique Au laboratoire Voyer, cette synthèse est réalisée sur plusieurs grammes étant donné la quantité d’acide aminé consommée par les nombreux couplages de synthèse peptidique.
3.2 - Synthèse peptidique sur support solide
La synthèse peptidique sur support solide est une technique de synthèse de peptides très facile et rapide. Cette technique révolutionnaire découverte en 196360 consiste à ajouter séquentiellement des acides aminés ayant leur amine protégé à une résine. La synthèse se fait du C-terminal au N-terminal. Le peptide étant lié de façon covalente à une résine, il est possible de retirer les différentes solutions nécessaires à la synthèse par simple filtration. La protection de l’acide aminé permet de contrôler la séquence du peptide en empêchant la double addition d’un même acide aminé. En effet, il est nécessaire de déprotéger l’acide aminé installé sur la résine avant d’ajouter le prochain. Cette technique a beaucoup d’avantages et permet de créer rapidement de courts peptides synthétiques, mais elle a aussi des inconvénients. Cette méthode peut rapidement devenir fastidieuse si le peptide à synthétiser est trop long et le coût peut rapidement devenir élevé lorsqu’on rallonge le peptide. En effet, au delà de 100 acides aminés on doit avoir recours à la condensation de
21
fragments, une technique où des fragments synthétisés par synthèse peptidique sur support solide sont liés par des enzymes ou chimiquement, pour synthétiser des peptides d’une telle longueur61. Pour cette raison, cette technique n’est pas privilégié pour la production industrielle de peptides, la biofermentation reste avantageuse pour la production en masse44.
Il existe plusieurs types de résines qui ont toutes des caractéristiques différentes. Certaines résines utilisent la stratégie « Boc » qui consiste à protéger l’amine par un groupement Boc qui est clivé à l’aide de TFA, tandis que le peptide est clivé à l’aide de HF. D’autres utilisent la stratégie « Fmoc » selon laquelle l’amine est protégée par un groupement Fmoc, labile en milieu basique, et le peptide est clivé en milieu acide. La résine utilisée pour la synthèse des peptides antimicrobiens est la résine de Wang. Il s’agit d’une résine utilisant la stratégie Fmoc et laissant l’extrémité C-terminale libre suite au clivage du peptide62. Cette résine a été choisie puisque le clivage final du peptide en milieu acide permet aussi de déprotéger les chaînes latérales des arginines, protégées par des groupements Pbf.
Le couplage du premier acide aminé est souvent plus difficile. En effet, pour greffer le premier acide aminé sur la résine plusieurs agents de couplages sont utilisés (figure 13). Le DIC (diisopropylcarbodiimide), DMAP (4-diméthylaminopyridine) et 6Cl-HOBt (1-hydroxy-6-chloro-benzotriazole) sont utilisés pour activer l’acide dans un milieu basique, ce qui permet à l’estérification de se réaliser. Le rendement de cette réaction n’est pas de 100%, ce qui laisse nécessairement des sites non-substitués sur la résine. Ceux-ci doivent être protégés avant de continuer l’élongation du peptide afin d’éviter les réactions secondaires. L’anhydride acétique est utilisé pour acétyler ces sites non-utilisés.
Figure 13 – Couplage du premier acide aminé sur la résine de Wang
Suite au premier couplage, le taux de substitution, c'est-à-dire la charge de la résine, aura changé par rapport à la valeur donnée par le fournisseur si le rendement du premier couplage n’était pas de 100% et il est nécessaire de le redéterminer pour connaitre la
22
quantité de réactifs à utiliser pour les étapes suivantes. Ceci est réalisé en dosant par UV le dibenzofulvène résultant de la déprotection du groupement protecteur Fmoc par le DBU (1,8-Diazabicyclo[5,4,0]undéc-7-ène).
Lorsque le nouveau taux de substitution est déterminé, il est possible de poursuivre la synthèse avec la déprotection du premier acide aminé. La déprotection se fait en milieu basique à l’aide de la pipéridine (figure 14).
Figure 14 – Déprotection de l’acide aminé
Par la suite, le deuxième acide aminé est ajouté à l’aide d’agents de couplage standards, soit le 6Cl-HOBt et le HCTU en présence de NMM (N-méthylmorpholine), une base, comme on peut le voir à la figure 15.
Figure 15 – Élongation du peptide
Pour s’assurer que la réaction a été complétée, le test qualitatif de Kaiser63
est réalisé. Ce test est utilisé pour détecter les amines primaires libres. La ninhydrine réagit avec les amines primaires créant ainsi une intense coloration bleue. Donc, le test est réalisé sur une infime partie de la résine et si une coloration bleue apparait, c’est signe qu’une portion de la résine n’a pas été couplée et le précédent couplage doit être repris. Lorsque le test est négatif, le peptide est allongé en répétant une séquence de déprotection, d’élongation et de test de Kaiser.
Lorsque l’élongation du peptide est complétée, le peptide est encore lié à la résine par le C-terminal ayant son N-C-terminal libre. Il est donc très facile à cette étape de modifier l’extrémité N-terminale. Les modifications qui ont été réalisées dans ce mémoire sont des
23
acétylations du N-terminal à l’aide de l’anhydride acétique dans des conditions similaires à l’acétylation de la résine au début de la synthèse.
Finalement, la dernière étape consiste à libérer le peptide de la résine en utilisant le TFA (acide trifluoroacétique) (figure 16). Les arginines qui ont été installées sur le peptide sont aussi déprotégées par le TFA. Par contre, il faut compter plus de temps pour réaliser cette déprotection et le réactif TIS (triisopropylsilane) est nécessaire pour capter les carbocations générés lors de la déprotection du guanidium.
Figure 16 – Clivage du peptide de la résine
Le peptide obtenu est alors trituré à l’éther pour le purifier, puis solubilisé et lyophilisé dans l’acide acétique afin d’obtenir une poudre facile à manipuler.
Par contre, certains peptides n’ont pas été synthétisés sur la résine de Wang. En effet, nous voulions avoir une série de peptides protégés en C-terminal et ce type de modifications n’est pas possible en synthèse sur support solide avec la résine de Wang. Nous nous sommes donc tournés vers une autre résine, soit la résine Rink amide. Cette résine s’utilise dans les mêmes conditions que la résine de Wang, soit la déprotection avec la pipéridine et le clivage du peptide au TFA62. Par contre, le groupement liant le peptide à la résine est différent, ce qui signifie que le mécanisme de clivage est légèrement différent et va laisser l’extrémité C-terminale du peptide protégée en amide.
3.3 - Purification et caractérisation
Suite à la synthèse, tous les peptides ont été caractérisés par HPLC pour déterminer leur pureté et par spectroscopie de masse pour confirmer la masse du peptide. Par contre, ces techniques ne permettent pas de confirmer la séquence des peptides. Un appareil LC/MS/MS est nécessaire pour obtenir cette information, malheureusement nous n’en avons pas à notre disposition. Par contre, étant donné que les acides aminés sont ajoutés l’un à la suite de l’autre lors de la synthèse peptidique, la séquence ne devrait pas être
24
[M+4H]4+
[M+NH4+4H]5+
[M+3H]3+
R3R12R14
différente de celle déterminée par l’expérimentateur. La masse obtenue par MS confirme que le peptide est complet et il serait surprenant que l’ordre ait changé. L’appareil HPLC utilisé est un chromatographe liquide 1260 Infinity d’Agilent Technologies et il a été utilisé avec la colonne à phase inverse C18 Vydac 218TP54. L’appareil de spectroscopie de masse utilisé est un MS Time-of-flight 6210 d’Agilent Technologies en paire avec un appareil LC 1200 series du même fournisseur.
La figure 17 présente un exemple de chromatogrammes obtenus grâce à ces deux techniques.
Figure 17 – Exemple de chromatogrammes MS et HPLC pour le peptide R3R12R14 Dans le cas où la pureté déterminée par HPLC ne serait pas suffisante, ces peptides ont été purifiés par HPLC semi-préparative. Cette technique permet d’injecter de plus grande quantité de peptides dans l’appareil et de récolter l’éluant contenant notre échantillon en temps réel. De cette façon, seul le pic correspondant à notre peptide est récolté et récupéré.
3.4 - Étude fluorimétrique du relargage de la calcéine
Le test de relargage de la calcéine est un test permettant d’observer l’effet d’un peptide sur une membrane modèle. La calcéine est un fluorophore trop volumineux pour traverser les membranes par lui-même. De plus, la calcéine ne fluoresce qu’à faible concentration, à haute concentration ce fluorophore s’autoéteint. L’idée du test est donc d’encapsuler la calcéine dans une vésicule de lipides modèles. À ce moment, aucune fluorescence n’est détectable. Puis, lors de l’ajout du peptide, on détectera l’apparition de la fluorescence au fur et à mesure que celui-ci fait des pores dans les membranes et permet à la calcéine de
25
quitter les vésicules. Pour pouvoir calculer un 100% de relargage de calcéine on ajoute, à la fin de l’expérience, un détergent qui viendra complètement lyser les vésicules nous donnant le 100% de fluorescence. Un exemple de spectre de fluorescence est présenté à la figure 18. L’appareil utilisé est un spectromètre de fluorescence Varian Cary Eclipse, produit d’Agilent Technologies.
Figure 18 – Exemple de graphique de fluorescence obtenu pour le peptide R1R4R11 dans des vésicules de POPG
Les lipides modèles utilisés pour ce test, mais aussi pour les expériences de dichroïsme circulaire et d’infrarouge, sont POPG et POPC (figure 19). Tout d’abord, les têtes polaires PC et PG ont été choisies pour leur charge. PC est globalement zwitterionique et est utilisé pour mimer les membranes des eucaryotes, qui sont aussi zwitterioniques. PG est chargé négativement et est utilisé pour mimer les membranes des procaryotes. Les deux lipides sont similaires en ce qui concerne leurs acides gras. Ils possèdent deux types d’acides gras, soit une chaîne oléyl (18 : 1) et une chaîne palmitoyl (16 : 0). Ceux-ci ont été choisis pour tenter d’imiter le plus possible les membranes biologiques. Leur longueur est idéale et l’insaturation donne une certaine fluidité à notre système.
Figure 19 – Structure de POPC et POPG respectivement
0 20 40 60 80 100 0 100 200 300 400 500 600 R e la rga ge (% ) Temps (s)
Pourcentage de relargage de la calcéine en fonction du temps
Ajout de peptide
26
3.5 - Détermination de la structure secondaire par dichroïsme circulaire et dichroïsme circulaire orienté
Le dichroïsme circulaire est une technique spectroscopique couramment utilisée pour la détermination de structure de protéines. Cette technique détecte la différence d’absorption de la lumière polarisée circulairement à gauche et à droite par une molécule chirale (figure 20)64. Les différentes structures secondaires d’une protéine absorbent différemment cette lumière incidente et un patron d’absorption caractéristique est détecté. En effet, les hélices alpha ont typiquement deux minimums à 208 et 222 nm, les feuillets beta ont un minimum à 215 nm et un maximum autour de 195 nm et les structures désordonnées ont un maximum à 215 nm et un minimum à 195 nm. L’appareil utilisé pour ces analyses est le Jasco J-815 de Jasco Analytical Instrument. Cette technique a l’avantage de permettre d’étudier des protéines en solution à de faibles concentrations. Pour étudier la structure secondaire des peptides à l’intérieur de membranes, des vésicules de POPG et POPC incorporant les peptides ont été utilisées. Par contre, il est important de noter que l’insaturation des lipides peut compliquer l’expérience puisqu’elle absorbe dans l’étendue de longueurs d’onde étudiées. En effet, dépendamment du nombre d’insaturation, les lipides absorbent à 240 nm et plus65.
Figure 20 – Schéma du fonctionnement du dichroïsme circulaire
Le dichroïsme circulaire orienté est une variante du dichroïsme circulaire utilisant des échantillons uniformément orientés. Cette technique permet d’étudier l’orientation de peptides en hélice alpha dans une membrane lipidique. La logique derrière cette technique est que si les échantillons sont tous orientés, l’orientation des différents dipôles présents dans une hélice sera alors synonyme de l’orientation de l’hélice dans la membrane et ces dipôles absorbent différemment la lumière polarisée circulairement (figure 21).
27
Concrètement, la bande à 208 nm diminuera jusqu’à disparaitre plus l’échantillon est inséré dans la membrane. En effet, lorsque le peptide est à la surface, le dipôle π-π* est parallèle à la membrane et interagira fortement avec la lumière incidente, ce qui va permettre d’observer une forte bande à 208 nm. Par contre, lorsque le peptide est inséré, ce même dipôle se retrouve parallèle à la lumière polarisée et n’interagira pas avec celle-ci, ce qui résultera en la disparition de la bande à 208 nm66. Cette technique demande plus d’intensité de signal et comme nous utilisons des lipides insaturés, un appareil standard est incapable de réaliser ce type d’expérience. Donc, nous avons travaillé en collaboration avec les chercheurs du Karlsruhe Institute of Technology, en Allemagne, qui ont à leur disposition un appareil de dichroïsme circulaire orienté à radiation synchrotron. Comme la radiation d’un tel appareil est plus intense et plus stable, il a été possible de réaliser ces expériences avec nos peptides.
Figure 21 – Schéma du fonctionnement du dichroïsme circulaire orienté
3.6 - Détermination de la structure secondaire par spectroscopie infrarouge
L’infrarouge à Transformée de Fourier ou FTIR est une autre technique permettant la détermination de structure secondaire de protéines ou de peptides. En infrarouge, la bande amide I’ correspondant à l’élongation des carbonyles du squelette d’une protéine est sensible aux liens hydrogènes. Par conséquent, si la structure secondaire change, l’orientation des liens hydrogènes fait avec les carbonyles va changer et il sera possible de l’observer dans la bande amide I’ 67






![Tableau 2 – Rendement et caractérisation par HPLC et spectroscopie de masse des analogues non-acétylés Peptide Rendement* (%) HPLC SM Temps retention (min) Pureté # (%) [M+NH 4 +3H] 4+ R1R3R4 76 25,650 52 750,1943 R1R3R5 74 27,487 65](https://thumb-eu.123doks.com/thumbv2/123doknet/5566849.133441/43.918.205.716.667.1083/tableau-rendement-caractérisation-spectroscopie-analogues-acétylés-rendement-retention.webp)
![Tableau 3 – Rendement et caractérisation par HPLC et spectroscopie de masse des analogues acétylés Peptide Rendement* (%) HPLC SM Temps retention (min) Pureté # (%) [M+NH 4 +3H] 4+ AcR1R3R4 7 22,497 64 760,6958 AcR1R3R5 18 25,658 68](https://thumb-eu.123doks.com/thumbv2/123doknet/5566849.133441/46.918.202.716.102.432/tableau-rendement-caractérisation-spectroscopie-analogues-acétylés-rendement-retention.webp)
