Étude des causes proximales des changements de
comportement de l'épinoche à trois épines
(Gasterosteus aculeatus) par son parasite
Schistocephalus solidus
Thèse
Lucie Grécias
Doctorat en biologie
Philosophiae doctor (Ph. D.)
Québec, Canada
© Lucie Grécias, 2017
Étude des causes proximales des changements de
comportement de l'épinoche à trois épines
(Gasterosteus aculeatus) par son parasite
Schistocephalus solidus
Thèse
Lucie Grécias
Sous la direction de :
iii
Résumé
L’infection par certains parasites coïncide avec des changements importants dans le comportement de leur hôte, ce qui a été proposé comme étant une adaptation des parasites afin d’augmenter leur taux de transmission et donc de pouvoir compléter leur cycle de vie. Cependant, cette hypothèse de la manipulation parasitaire du comportement de l’hôte a rarement été démontrée. Afin de mieux comprendre ces possibles mécanismes adaptatifs, il est nécessaire de comprendre les causes de ces changements de comportement. Au moins quatre hypothèses sont possibles. Les causes de ces changements peuvent être multiples. Elles peuvent être dues à la seule présence du parasite (masse parasitaire), à l’activation du système immunitaire, à la perte d’énergie ou à la modification de l’environnement neural. Notre objectif a donc été de tester les différentes prédictions qui découlent de ces hypothèses. Ces hypothèses ont été étudiées par une approche expérimentale ciblée afin de reproduire le syndrome comportemental d’un hôte parasité et de mettre en évidence sa signature génomique pour ainsi les comparer. Nous avons utilisé comme système d’étude l’épinoche à trois épines (Gasterosteus
aculeatus), un poisson osseux et son parasite (Schistocephalus solidus) un cestode.
Cette paire hôte-parasite est retrouvée en nature et est très bien étudiée au niveau des conséquences négatives de l’infection sur le changement de comportement face à un prédateur, la reproduction et la croissance. Notre première approche visait à recréer la présence parasitaire (masse) et de voir son impact sur les comportements de l’épinoche. L’hypothèse mécanique testée dans cette première approche n’avait jusque-là jamais été testée. Nos résultats ne semblent pas corroborer cette hypothèse, ils sont davantage présentés ici comme précurseurs d’études complémentaires sur la cause mécanique des changements de comportement. Dans une seconde approche, nous avons administré séparément plusieurs molécules connues comme agissant sur l’axe du stress, associées à une réponse immunitaire ou nous avons mis en place un arrêt de l’alimentation. Cette expérience avait pour but de recréer le syndrome comportemental lié au parasitisme grâce à ces différentes modifications phénotypiques. Les résultats obtenus montrent que la
iv
cause du syndrome comportemental de l’épinoche parasitée est plutôt multifactorielle qu’unique, regroupant les différentes hypothèses testées. Notre dernière approche examinait les profils transcriptomiques des individus infectés par
S. solidus, traités à un inhibiteur sélectif de la recapture de la sérotonine
(modification de l’environnement neural), exposés mais non infectés ou sains. Cette analyse nous a permis de comparer entre elles les signatures transcriptionnelles spécifiques à chacun des traitements et de mettre en évidence les mécanismes moléculaires associés aux changements comportementaux. Nos résultats ont mis en évidence la modification de l’expression de gènes liés à la voie métabolique de l’inositol chez les individus infectés, ainsi qu’une faible similarité entre les profils transcriptomiques des poissons infectés et ceux ayant eu une modification de l’environnement neural. Notre découverte a mis en lumière la signature génomique des poissons exposés qui s’avère être reliée au transport des acides aminés, ce qui n’avait jamais été fait auparavant. La combinaison de ces outils nous a permis d’avoir des connaissances plus poussées dans le domaine de la manipulation parasitaire en y intégrant des données sur la physiologie et la transcriptomique d’un système hôte-parasite.
v
Abstract
Infection with certain parasites coincides with major changes in host behaviour, which has been proposed as an adaptation of parasites in order to increase their transmission rate and thus to be able to complete their life cycle. However, the hypothesis of parasitic manipulation of host behaviour has rarely been demonstrated. In order to better understand these possible adaptive mechanisms, it is necessary to understand the causes of these behavioural changes. At least four hypotheses are possible. These changes may be due to the presence of the parasite alone (parasitic mass), activation of the immune system, energetic drain or modification of the neural environment. My objective was to test the various predictions that stem from these assumptions. These hypotheses have been studied by a targeted experimental approach in order to find the behavioural syndrome of a parasitized host and shed light on its genomic signature. We used as a model the interaction between the three-spined stickleback (Gasterosteus aculeatus), a bone fish, and its parasite (Schistocephalus solidus), a cestode. This host-parasite pair is found in nature and has been extensively studied in terms of the negative consequences of the infection on the change of behaviour towards a predator, reproduction and growth. Our first approach was to recreate the parasite presence (mass) to observe its potential impact on the stickleback’s behaviours. The mechanical hypothesis tested in this first approach had never been tested before. Our results do not support this hypothesis but are precursors of further studies on the mechanical cause of behavioural changes. Secondly we separately administered molecules known to the stress axis, associated with an immune response or we food-deprived sticklebacks. We tried to replicate the behavioural syndrome associated with parasitism through these different phenotypic changes. The results obtained show that the cause of the behavioural syndrome of the parasitized stickleback is certainly not unique but is rather multifactorial, regrouping the different hypotheses tested. Our last innovative approach was the transcriptomic analysis of individuals infected with S. solidus, treated with a selective serotonin reuptake inhibitor (neural environment modification), exposed but not infected or controls. This analysis allowed us to compare the transcriptional signatures specific to each of the
vi
treatments and to highlight the molecular mechanisms associated with the behavioural changes. This study revealed changes in the expression of genes linked to the inositol pathway in infected individuals and a small similarity between infected fish and those with a modification of their neural environment. In addition, this transcriptomic study, for the first time, highlighted the genomic signature of the exposed fish that is found to be related to the amino acids transport. The combination of these tools has allowed us to have more knowledge in the field of parasitic manipulation by integrating physiology and transcriptomics data.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations et des sigles ... xi
Remerciements ... xiii
Avant-propos ... xv
Chapitre I : Introduction générale ... 1
I.1 La vie parasitaire ... 1
I.2 Les cycles de vie parasitaires ... 3
I.3 La modification comportementale de l’hôte ... 4
I.4 Les causes de la modification comportementale de l’hôte ... 5
I.5 Système hôte-parasite modèle... 8
I.6 Les causes des changements comportementaux par S. solidus ... 10
I.7 Objectif de thèse ... 13
Chapitre II : Using phenotypic engineering to mimic a parasite’s physical presence to test the mechanical effect on behaviour modification in an intermediate host. ... 16
II.1 Résumé ... 17
II.2 Abstract ... 18
II.3 Introduction ... 19
II.4 Material and methods ... 22
II.5 Results and discussion ... 25
II.6 Acknowledgment ... 28
II.7 Figures ... 29
II.8 Additional tables ... 30
II.9 Additional figures ... 32
Chapitre III : Can the behaviour of threespine stickleback parasitized with Schistocephalus solidus be replicated by manipulating host physiology? ... 34
viii
III.2 Abstract ... 36
III.3 Introduction ... 37
III.4 Material and methods ... 40
III.5 Results ... 46
III.6 Discussion ... 47
III.7 Acknowledgements ... 53
III.8 Data availability ... 53
III.9 Tables ... 54
III.10 Figures ... 55
III.11 Additional tables ... 60
III.12 Additional Figures ... 61
Chapitre IV : An exploratory analysis of the brain of infected stickleback with S. solidus: the inositol pathway as a potential target of host manipulation. ... 66
IV.1 Résumé ... 67
IV.2 Abstract ... 68
IV.3 Introduction ... 69
IV.4 Material and Methods ... 73
IV.5 Results ... 77
IV.6 Discussion ... 79
IV.7 Acknowledgment ... 88
IV.8 Tables ... 90
IV.9 Figures ... 91
IV.10 Additional Tables ... 95
Chapitre V : Conclusion générale ... 101
V.1 Synthèse des résultats ... 101
V.2 Limitations sur la méthode ... 103
V.3 Perspectives ... 107
V.4 Mot de la fin ... 110
ix
Liste des tableaux
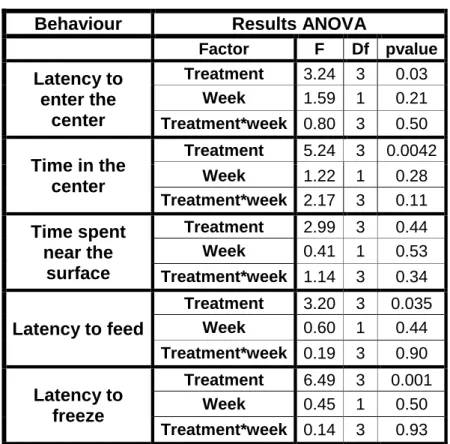
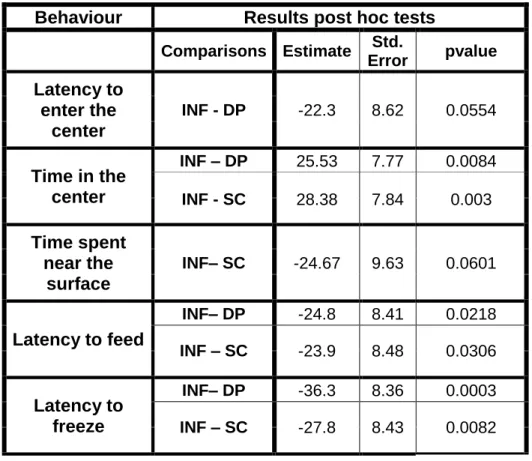
Table II.S1 Statistical parameters of anovas between two treatments for a given behaviour test. ... 30 Table II.S2 Statistically significant comparisons between two treatments for a
given behaviour test. ... 31 Table III.1 Summary of how the behaviours tested in the present study are
affected by different treatments in previous studies of various species. ... 54 Table III.S1 Statistical parameters of statistically significant comparisons
between two treatments for a given behaviour test ... 60 Table IV.1 Most differentially expressed genes in INF individuals compared to
CTRL (p<0.0005). ... 90 Table IV.S1 Differentially expressed genes with the largest log fold changes
(logFC>1.5) in INF individuals compared to CTRL ... 95 Table IV.S2 Significantly enriched GO terms for each comparison ... 96 Table IV.S3 Most differentially expressed genes in SSRI individuals compared
to CTRL (p<0.0005).. ... 97 Table IV.S4 Differentially expressed genes in common between INF and SSRI
individuals compared to CTRL (p<0.0005).. ... 98 Table IV.S5 Most differentially expressed genes in EXP individuals compared
to CTRL (p<0.0005). ... 99 Table IV.S6 The 9 specific genes found only in EXP individuals compared to
x
Liste des figures
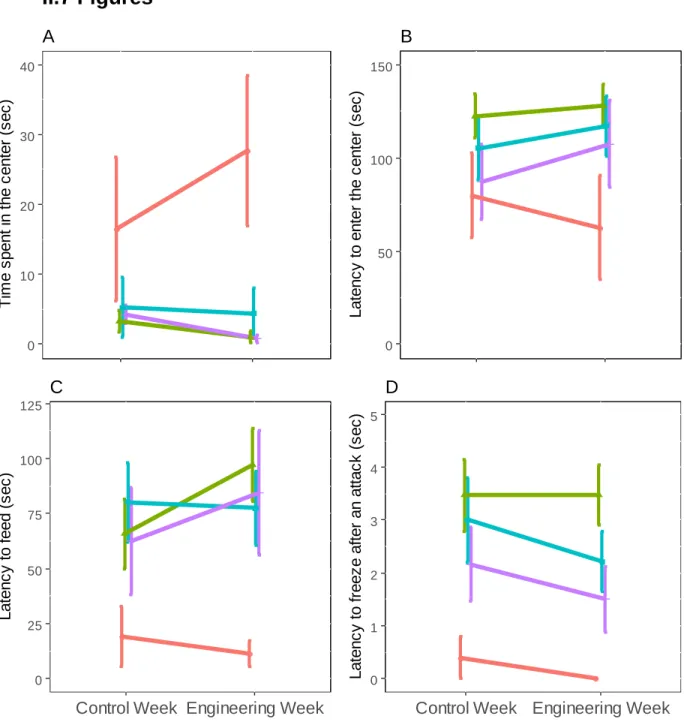
Figure II.1 Behavioural phenotypes across the four experimental conditions. ... 29 Figure II.S1 Representation of the similar density of the dummy parasite in
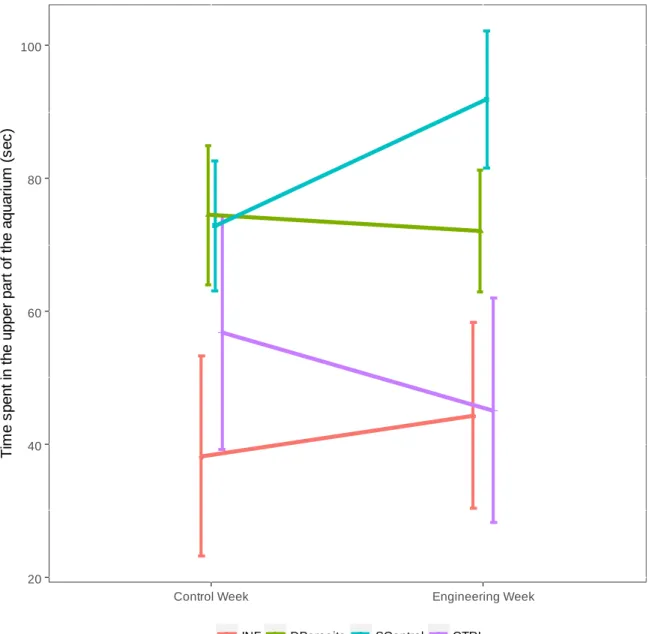
silicone (red) and the parasite S. solidus (green). ... 32 Figure II.S2 Time spent in the upper part of the aquarium across the four
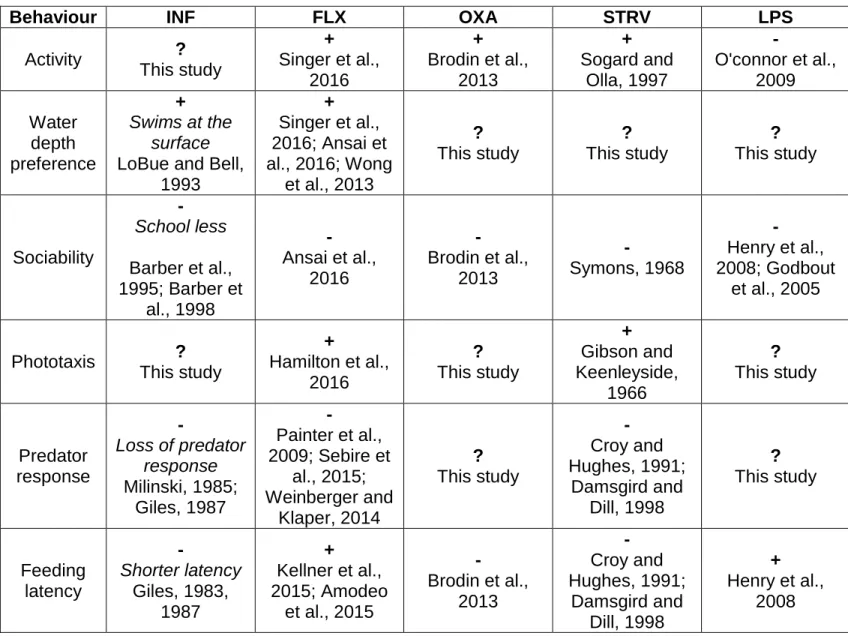
experimental conditions. ... 33 Figure III.1 Time spent in shallow water during a 150 s water depth preference
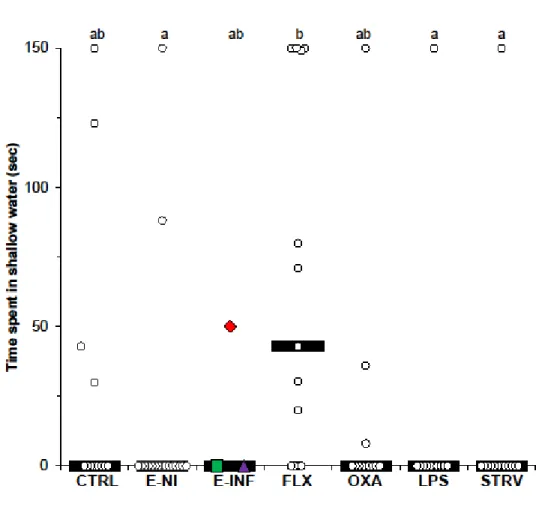
test, depending on treatment. ... 55 Figure III.2 Time spent near the shoal picture during a 150 s sociability test,
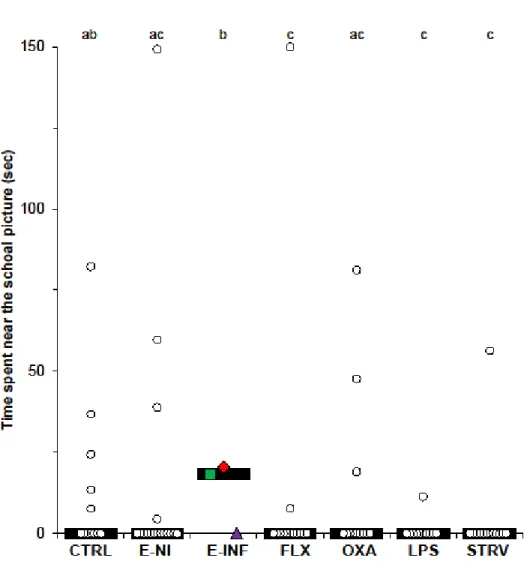
depending on treatment. ... 56 Figure III.3 Time spent in bright light during a 150 s light preference test,
depending on treatment. ... 57 Figure III.4 Time spent frozen after an attack during the anti-predator test,
depending on treatment. ... 58 Figure III.5 Distance moved after an attack during the anti-predator test,
depending on treatment. ... 59 Figure III.S1. Experimental setup. ... 61 Figure III.S2. Multidimensional scaling analysis performed on transcriptome of
S. solidus sampled at different developmental stages (non-infective and
infective stages in threespine sticklebacks, adult stage in the final host’s digestive system, data from Hébert et al. 2016a and 2016c). ... 62 Figure III.S3. Activity measured as a) distance travelled and b) time spent
moving, for each treatment. ... 63 Figure III.S4. Predator response measured as a) time to freeze after a predator
attack and b) distance moved before a predator attack, for each treatment. ... 64 Figure III.S5. Time before feeding for each treatment. ... 65 Figure IV.1 Summary of the transcriptomic analysis of brains of four different
conditions (CTRL, INF, EXP and SSRI). ... 91 Figure IV.2. Distribution of the expression and median (star) of the transcript
IMPase1 (ENSGACT00000006510) for each treatment ... 93 Figure IV.3 Partial inositol pathway ... 94
xi
Liste des abréviations et des sigles
Bp Baise pair (paire de bases)
CPM Counts Per Million
FC Fold Change
FDR False Discovery Rate
Gb Gigabases (1x109 acides nucléiques)
GO Gene Ontology
ug, mg, g, kg Microgramme, milligramme, gramme, kilogramme
mm, cm Milimètre, centimètre
DNA, cDNA, RNA Deoxyribonucleic acid,
complementary DNA, ribonucleic acid
SSRI Selective Serotonin Reuptake Inhibitor
GABA gamma-Aminobutyric acid
h Heure
L Litre
Lmer Linear mixed model
Glmer Generalized mixed effects model
Glht General linear hypotheses
Th1 Type 1 T helper
LPS Lipopolysaccharide
PBS Phosphate-buffered saline
IMPA Inositol monophosphatase
PTEN Phosphatase and tensin homolog
PIP 2, PIP3 Phosphatidylinositol 4,5-tri (bi) phosphate
ROS Reactive oxygen species
GTP Guanosine-5'-triphosphate
MAP mitogen-activated protein
5HTR 5-hydroxytryptamine (serotonin) receptor
xii
Aux deux femmes les plus importantes de ma vie, Ma Mère et Ma Grand-Mère.
xiii
Remerciements
J’ai commencé mon aventure québécoise après un entretien à plus de 5000km de distance. Un entretien où on a plus parlé de nos intérêts personnels et de nos passions que de mes capacités scientifiques et mes notes. Mais pourquoi m’a-t-elle choisi ? A été la question que je me suis posé en sautant de joie après avoir su que j’allais travailler sur un parasite « zombificateur ». Je tiens donc à remercier ma directrice de thèse Nadia Aubin-Horth qui m’a fait confiance et m’a permis de commencer une nouvelle étape de ma vie sur un continent inconnu. Il n'est jamais facile d’arriver dans un nouvel environnement et de devoir faire sa place. Nadia m’a toujours fait sentir à ma place et m’a accueillie comme son égale. Nadia qui a pris un temps incommensurable à m’apprendre le métier de scientifique. Nadia, je ne te remercierai jamais assez pour tes qualités professionnelles mais aussi humaines, je n’aurais pu rêver mieux comme laboratoire pour faire une thèse.
J’aimerai aussi remercier Julie Turgeon et Christian Landry qui ont suivi depuis le début mon projet doctoral. Grâce à leur point de vue extérieur et leurs connaissances scientifiques, ils ont toujours eu de bonnes réflexions et idées pour améliorer mes expériences ou discussions. Ce doctorat n’aurait pas aussi bien avancé sans eux. Merci également à Jacques Brodeur et Conrad Cloutier qui ont accepté de prendre du temps pour lire mes travaux.
Ma thèse n’aurait pu se faire sans l’aide de Iain Barber qui m’a acceptée dans son laboratoire de l’Université de Leicester pendant plus de cinq mois. Iain m’a appris à expérimenter sur notre fameux parasite et à mieux le comprendre. Merci aussi à Ceinwen Tilley et Stephan Grambauer pour leur gentillesse lors de ce séjour. J’aimerai bien sur remercier les membres du labo de Nadia, François Olivier Hébert, Sergio Cortez Ghio, Caroline Coté et Chloé Berger qui ont participé de près ou de loin à la mise en place de ce projet. En particulier FO qui m’a accueilli les bras ouverts et qui a été là pour répondre à mes multiples questions scientifiques ou existentielles, qu’est-ce que j’aurais fait sans toi à mes côtés? Un merci également à Noémie Leduc et Julie Valentin qui m’ont aidé à faire avancer mon projet.
xiv
Faire partie d’un institut, en particulier l’IBIS, amène à rencontrer d’autres scientifiques qui ont un impact positif sur notre recherche. C’est le cas de Laura Benestan, Jeremy Le Luyer, Ben Sutherland et Martin Laporte avec qui j’ai eu de bonnes discussions et qui m’ont aidée dès qu’ils le pouvaient.
Bien entendu la réussite d’un doctorat n’est possible qu’avec la présence de bons amis pour décompresser lorsque rien ne marche au labo. Je remercie donc Nath, Nico, Karine et Maya qui m’ont accueillie à mon arrivée à Québec, JP, Ben et Mika qui m’ont supportée 7jours sur 7 et un merci particulier à ceux de l’autre côté de l’Atlantique : Myriam, Chloé et Julian qui ont toujours été présents depuis plus d’une dizaine d’années et qui sont les meilleurs amis qu’on pourrait avoir. Finalement, un merci spécial à Gauthier pour m’avoir soutenu et supporté dans les derniers instants les plus stressants de cette thèse et qui a survécu à mes folies de doctorante finissante.
J’ai donc eu un environnement de travail impeccable et un groupe d’amis génial, mais je ne serai pas là où je suis, à écrire les derniers mots de ma thèse, sans ma famille et en particulier ma mère et ma grand-mère qui sont tout pour moi.
xv
Avant-propos
Cette thèse se compose de cinq chapitres incluant l’introduction générale (chapitre I), une conclusion générale (chapitre V) et trois articles originaux (chapitre II à IV).
Le premier article présenté dans cette thèse (chapitre II) intitulé: «Testing the mechanical hypothesis and its interaction with the immune system as an explanation for behaviour modification in parasitized hosts.», est en préparation pour être soumis au Journal of Experimental Biology. L.G. a conçu le projet avec la contribution de N.A.-H.. L.G. a effectué les expériences de manipulation et les analyses statistiques. L.G. a analysé les comportements des deux expériences et J.V. a participé à l’analyse des comportements de la première expérience. L.G. et N.A.-H. ont écrit le manuscrit.
Auteurs : Lucie Grécias, Julie Valentin et Nadia Aubin-Horth
Le deuxième article présenté dans cette thèse (chapitre III) intitulé: « Can the behaviour of threespine stickleback parasitized with Schistocephalus solidus be replicated by manipulating host physiology? », a été publié dans Journal of Experimental Biology sous la référence : Grécias, L., Hébert, F. O., Berger, C. S., Barber, I. & Aubin-Horth, N. 2017. Can the behaviour of threespine stickleback parasitized with Schistocephalus solidus be replicated by manipulating host physiology? The Journal of Experimental Biology, 220, 237-246. L.G. a conçu le projet avec la contribution de N.A.-H. et I.B.. L.G. et C.S.B. ont fait des tests préalables sur concentrations des traitements. L.G. a effectué les expériences de manipulation, les analyses comportementales, les analyses statistiques et a extrait l’ARN des parasites. F.-O.H. a effectué les analyses transcriptomiques pour confirmer le statut d’infectieux des parasites. L.G. et N.A.-H. ont écrit le manuscrit avec la contribution de I.B., F.-O.H et C.S.B..
xvi
Auteurs : Lucie Grécias, François Olivier Hébert, Chloé Suzanne Berger, Iain Barber et Nadia Aubin-Horth
Le troisième article présenté dans cette thèse (chapitre IV) intitulé: « An exploratory analysis of the brain of infected stickleback with S. solidus: the inositol pathway as a potential target of host manipulation.», est en préparation pour être soumis à Journal of Experimental Biology. L.G. a conçu le projet avec la contribution de N.A.-H. et I.B.. L.G. a effectué la récolte des cerveaux et extrait l’ARN de l’ensemble des cerveaux. L.G. et F.-O.H. ont effectué les analyses transcriptomiques et les analyses statistiques. L.B. a initié et conçu la représentation graphique globale des résultats de transcriptomique. L.G. et N.A.-H. ont écrit le manuscrit avec la contribution de IB, F.-O.H et L.B..
Auteurs : Lucie Grécias, François Olivier Hébert, Laura Benestan, Iain Barber et Nadia Aubin-Horth
1
Chapitre I : Introduction générale
I.1 La vie parasitaire
La vie parasitaire a toujours fasciné la société humaine. En effet, les parasites infectent la majorité des animaux et peuvent avoir des effets notables sur la survie de leur hôte alors que la plupart sont imperceptibles et restent mystérieux même aux yeux des scientifiques. Ces organismes constituent un groupe extrêmement diversifié et hautement spécialisé (Blaxter, 2003; Frank, 1993). Il existe des centaines de milliers d’espèces de parasites sur Terre qui sont distribuées dans tous les groupes taxonomiques du vivant, allant des unicellulaires aux vertébrés (Dobson et al., 2008). De récentes études suggèrent que les parasites sont bien plus nombreux que les prédateurs, jusqu’à 20 fois plus (Marcogliese and Cone, 1997). En effet Il existe entre 3 et 10 millions d’espèces sur Terre et environ 40% sont des espèces parasites (Poulin and Morand, 2000) et donc affectent probablement chaque organisme vivant sur Terre à un stade particulier du cycle de vie (Price, 1980). Les parasites vivent aux dépens d’un autre organisme, l’hôte. L’hôte est en quelque sorte un écosystème particulier à durée de vie limitée dont le parasite exploite les ressources. Cette relation obligatoire pour le parasite s’établit aux niveaux spatio-temporel et énergétique et se fait au détriment de l’hôte, ce qui différencie le parasitisme des autres types d’interactions durables comme le commensalisme ou le mutualisme, où le bénéfice du second protagoniste n’a pas d’impact négatif sur l’hôte. Les relations entre hôte et parasite sont souvent très complexes et font intervenir des adaptations permettant de prolonger la survie du parasite au sein de son hôte. En réponse, l’hôte utilise également des phénotypes (physiologiques, morphologiques ou comportementaux) développés par coévolution avec son parasite tendant à limiter ou arrêter le développement du parasite. On parle de phénotype étendu du parasite selon le concept de Dawkins (1982). Avec ce concept, Dawkins explique l’impact que les gènes d’un organisme peuvent avoir en dehors de leur propre phénotype. En effet, chaque organisme possède la capacité de modifier son environnement, qu’il soit interne ou externe. Les parasites (endoparasite) ont comme environnement extérieur le phénotype de leur hôte (Hughes, 2013). De nombreux cas de parasitisme dans le monde animal ont été
2
étudiés, certains amènent à des changements physiologiques ou morphologiques. Un exemple frappant de parasitisme est celui du vivaneau (Lutjanus guttatus) dont la langue s’atrophie lorsqu’il est parasité par un crustacé (Cymothoa exigua) qui s’alimente grâce aux vaisseaux sanguins irrigant la langue de l’hôte (Brusca and Gilligan, 1983). Cet type d’interaction engendre de faibles changements sur la physiologie de son hôte comme la diminution du taux de croissance (Parker and Booth, 2013). Le poisson utilise son parasite comme langue de substitution. Cependant dans certains cas les parasites exercent une profonde influence sur le phénotype de leur hôte (Weinersmith, 2014), telle qu’une baisse de croissance, de rendement reproducteur et même des changements morphologiques (Cézilly et al., 2013). Kleindorfer et al. (2014) ont étudié un parasite de couvée : le coucou (Chalcites basalis) qui pond dans le nid d’oiseau tel que le Mérion superbe (Malurus
cyaneus), ce qui diminue le rendement reproducteur de son hôte. Les femelles avec
des risques de parasitisme élevés augmentent l’apprentissage de l’appel vocal de leur progéniture au stade embryonnaire afin de solliciter leur nourrissage après l’éclosion : les oisillons coucou ne sont eux pas capables de reproduire ce son. L’interaction étroite entre les hôtes et leurs parasites est donc structurée par une coévolution permanente, ce qui contribue à leur survie. Cette condition de vivre aux dépens de l’autre semble être peu positive pour les individus qui doivent survivre et se reproduire le plus rapidement possible. Pourtant le fait d’être un parasite est apparu au moins quatre fois dans le clade des nématodes, preuve d’une évolution convergente vers un style de vie parasitaire (Poulin, 2011; Dorris et al., 1999). Les espèces qui sont devenues parasitaires ont donc eu des conditions aidantes qui leur ont permis de survivre dans ce nouvel environnement, comme les ancêtres des animaux terrestres qui devaient avoir des traits qui leur permettraient de survivre avec un mode de vie terrestre (Combes, 2001). Les parasites ont tendance à être spécialisés pour un hôte en particulier, ils infectent généralement qu’un ou un faible nombre d’hôtes (Poulin and Morand, 2000). Une course aux armements existe donc dans la plupart des couples hôte-parasite (Kawecki, 1998) et un des moyens pour améliorer la valeur sélective du parasite est la complexification du cycle de vie par
3
l’ajout d’une étape supplémentaire afin d’augmenter son succès reproducteur (Istock, 1967; Auld and Tinsley, 2015).
I.2 Les cycles de vie parasitaires
Le parasitisme est une relation non mutuelle entre espèces, où le parasite tire profit d'un organisme hôte pour se nourrir, s'abriter ou se reproduire, au détriment de l’autre (Goater et al., 2013). La relation entre le parasite et son hôte n’est pas anodine, elle est favorisée en fonction de différents aspects clés : capacité du parasite à survivre dans ce nouvel environnement, sa capacité à résister à ses défenses, sa capacité à se reproduire et à continuer son cycle de vie. e parasite situé dans son hôte n’a pas de problème d’accès à la nourriture, par contre il va devoir investir toute son énergie dans le succès reproducteur, d’autant que la mortalité due à la recherche de l’hôte sera très importante et la rencontre du partenaire sexuel difficile dans la plupart des cas (Seppälä et al., 2008). Les parasites doivent donc mettre en place de nombreuses stratégies afin d’être protégé d’un environnement hostile durant leur reproduction (Olsen, 1986). La première stratégie est le cycle de vie simple : monoxène. Le parasite passe d’un individu à un autre lors de son stade infectieux. Trichostrongylus retortaeformis est un exemple de parasite nématode avec un cycle de vie simple qui infecte des espèces ruminantes. La larve de ce parasite est non parasitaire, libre. Elle se développe dans les fèces des hôtes infectés. L’infection se fait par ingestion de la larve infectieuse. C’est dans l’hôte que la reproduction se passe, après plusieurs semaines d’infection (Audebert et al., 2002). La deuxième stratégie de reproduction est la mise en place de cycles de vie complexes : hétéroxènes (Rauch et al., 2005). Ces cycles de vie incluent un changement brutal dans la morphologie, la physiologie et le comportement d’un individu, qui est souvent associé à un changement d’habitat (Wilbur, 1980). Le nouvel habitat étant l’hôte pour une espèce parasite. Les parasites ayant des cycles de vie complexes ont besoin d’un hôte intermédiaire avant la transmission vers l’hôte final où se passe la reproduction (Choisy et al., 2003). Les cycles de vie complexes ont évolué par deux processus différents, dépendant de l’insertion du nouvel hôte. Soit le nouvel hôte est plus haut dans la chaine alimentaire et se trouve être un prédateur de l’hôte initial, soit le nouvel hôte
4
est plus bas dans la chaine alimentaire. Ces deux processus empêchent le parasite d’être prédaté à un stade non mature et facilitent la transmission vers l’hôte final (Parker et al., 2003). L’apparition des cycles complexes permettrait donc d’augmenter la valeur sélective du parasite en augmentant sa durée de vie, sa taille et sa fécondité ou en réduisant son taux de mortalité (Parker et al., 2003). Un exemple de cycle complexe est celui du parasite responsable de la malaria: un protozoaire de type plasmodium. Son cycle de vie comprend deux hôtes, un invertébré (moustique) et un vertébré (hôte intermédiaire). Suite à une piqure d’un moustique infecté, le parasite va se multiplier dans le sang de son hôte intermédiaire jusqu’à atteindre son stade infectieux. Quand un moustique pique cet hôte infecté, les parasites vont se retrouver dans le système digestif de l’hôte final où il pourra se reproduire de façon sexuée et continuer son cycle de vie (Bray and Garnham, 1982). Cependant les raisons pour lesquelles l’évolution de ces cycles de vie complexes a été favorisée chez certains parasites restent encore peu étudiées (Auld and Tinsley, 2015).
I.3 La modification comportementale de l’hôte
Les parasites aux cycles de vie complexes sont souvent associés à des modifications comportementales chez leurs hôtes. À des fins de reproduction, les parasites ont besoin de survivre assez longtemps pour passer à leur hôte final où ils pourront se reproduire et ainsi compléter leur cycle de vie. Contrairement aux organismes libres, les parasites comptent sur le comportement inné de leur hôte pour arriver à leurs fins. Souvent cela implique même une modification des comportements qui vont contre l’intérêt de l’hôte et peuvent même lui être fatal. Certains parasites sont donc capables de manipulation comportementale de l’hôte : la capacité de modifier le comportement de l’hôte afin d’augmenter leur taux de transmission (i.e. valeurs sélectives, Krimbas, 2004). L’hôte n’est donc plus en contrôle de son propre comportement (Lefevre et al., 2009). En effet ces derniers peuvent avoir une activité anormalement élevée, être désorientés ou avoir des réponses à un stimulus altérées (Holmes and Bethel, 1972). Avoir la capacité de modifier le comportement de son hôte peut être un grand bénéfice pour le parasite qui va par ce biais augmenter ses chances de se reproduire par transmission à l’hôte
5
suivant. Cependant, il y a très peu de données qui supportent l’hypothèse de la manipulation parasitaire qui présente les changements de comportement associés à une infection comme étant la conséquence d’une adaptation du parasite pour augmenter son taux de transmission (Moore and Gotelli, 1990; Barber et al., 2000). La manipulation parasitaire aurait évolué dans le contexte de la manipulation d’autres traits phénotypiques physiologiques qui sont nécessaires à la survie du parasite. Ces altérations comportementales (Hindsbo, 1972; Holmes and Bethel, 1972) peuvent être quantifiées de façon précise par des tests comportementaux, comme l’activité ou la réponse anti-prédateur. Biron et al. (2006) se sont intéressés au cas d’un ver nématomorphe (Paragordius tricuspidatus) qui infecte le grillon des bois (Nemobius sylvestris) et qui amène son hôte à se jeter dans l’eau où le nématomorphe peut se reproduire, tuant le plus souvent son hôte. Eberhard (2000) a lui étudié la manipulation du comportement d’une araignée parasitée par une guêpe. L’araignée cherche un endroit protégé contre d’autre parasite et construit une structure semblable à un cocon pour protéger la pupe de la guêpe contre la pluie. L’utilisation d’un phénotype complexe déjà présent chez l’hôte a permis d’augmenter la valeur sélective des parasites. Mais qu’en est-il des mécanismes moléculaires sous-jacents aux changements de comportement de l’hôte quand il est parasité ?
I.4 Les causes de la modification comportementale de l’hôte
En dépit du nombre impressionnant de modifications comportementales déclenchées par des infections parasitaires ayant été répertoriées dans la littérature, les mécanismes moléculaires sous-jacents demeurent peu décrits (Barber and Wright, 2005). La connaissance de ces mécanismes nous permettrait pourtant d’avoir une meilleure compréhension des mécanismes coévolutifs apparus entre le parasite et son hôte. La sélection naturelle a-t-elle favorisé l’apparition de nouveaux traits chez le parasite ou ces changements de comportements sont-ils dus à une simple utilisation du phénotype préexistant de l’hôte? Selon Poulin (2010) l’explication la plus simple et parcimonieuse de ces changements de comportement est l’effet secondaire dû à l’infection qui peut, ou pas, être avantageux pour le parasite. En effet les défenses de l’hôte contre les pathogènes ont un rôle important6
dans les changements de comportement (Adamo and Webster, 2013; Dantzer et al., 2008). Une deuxième explication pour ces changements de comportement serait un effet indirect de l’infection, des traits qui ont évolués pour d’autres fonctions qui ont un effet positif sur la transmission du parasite. C’est le cas de l’altération des réserves énergétiques (Thomas et al., 2011) qui joue un rôle très important sur le comportement (Filosa et al., 2016). La troisième explication étant que le parasite change le phénotype de son hôte directement en modifiant son environnement neural.
Le fait que ces changements de comportement peuvent être présents qu’à des moments particuliers du cycle de vie du parasite engendre une utilisation excessive du terme de manipulation comportementale (augmentation de la valeur sélective du parasite), En effet, au moment de l’infection de l’hôte, trois conséquences sont possibles : le parasite modifie immédiatement, plus tard ou jamais le comportement de son hôte (Poulin et al., 1994). Les modifications de comportements par les parasites devraient coïncider avec le stade de développement où ces changements sont importants pour la survie ou reproduction du parasite (Poulin, 2010). Par exemple, la modification immédiate du comportement de l’hôte peut s’appliquer quand les ressources de l’hôte sont déjà suffisantes pour que le développement du parasite. Le fait que l’hôte soit inactif et donc protégé des prédateurs est préférable pour le parasite, le parasite n’a pas besoin que son hôte continue à s’alimenter (Askew and Shaw, 1986). Ces changements de comportement peuvent aussi coïncider avec la maturation du parasite afin d’augmenter son taux de transmission (Bethel and Holmes, 1974; Poulin et al., 1992). Retarder les changements comportementaux serait donc positif pour le parasite.
Les études de biologie intégrative ont la capacité de répondre à ces questions de mécanismes liés à la plasticité phénotypique. En effet elles permettent de comprendre comment des systèmes complexes comme des organismes multicellulaires fonctionnent et évoluent (Ghalambor et al., 2015). La clarification des mécanismes moléculaires sous-jacents aux modifications de comportement
7
associées à la présence de parasite peut être mise en place par deux approches principales : la description des différences moléculaires et la modification de voies physiologiques candidates. Par exemple, des méthodes immunocytochimiques ont démontré que les niveaux de sérotonine (neurotransmetteur du système nerveux central impliqué dans le comportement) sont modifiés par l’infection d’un trématode (Microphallus papillorobustus) chez son hôte amphipode (Gammarus insensibilis). Ces modifications de niveaux de sérotonine sont connues comme étant responsables du changement de réponse aux stimuli photoniques (Helluy and Thomas, 2003). Suite à ces résultats, une étude modifiant la voie physiologique de la sérotonine a été conduite (Perrot-Minnot et al., 2014). L’injection de sérotonine chez des amphipodes sains a été suffisante pour recréer le syndrome typique de l’amphipode infecté. Ces études supportent l’hypothèse de la modification de l’environnement neural de l’hôte par le parasite. Dass and Vyas (2014) se sont intéressés au mécanisme épigénétique impliqué dans le comportement d’aversion pour l’odeur de chat chez des rats (Rattus novergicus) infectés par un parasite unicellulaire (Toxoplasma gondii). Ils ont trouvé que la méthylation du promoteur de la vasopressine est liée à la perte de la peur de cette odeur. De plus, des analyses d’immunochimie ont permis de détecter une augmentation importante du métabolisme de la dopamine dans les cellules neurales de l’hôte (Prandovszky et al., 2011). En effet ce taux est supérieur en présence et aux alentours de T. gondii qui est enkysté dans le cerveau de son hôte. Ceci est dû à l’activité de l’enzyme tyrosine hydroxylase qui fait partie du génome du parasite alors que ce gène a un important degré d’homologie de séquence avec celui des mammifères. Cette modification du système dopaminergique a été reliée au comportement impulsif des rats infectés (Tan et al., 2015). La conclusion de cette étude a été qu’il est peu probable que ces changements non généralisés du métabolisme de la dopamine soient la conséquence d’un effet indirect de l’infection et supporte plutôt l’hypothèse de la manipulation directe de l’environnement neural de l’hôte. Biron et al. (2005) se sont eux spécialisés dans l’approche parasito-protéomique qui leur a permis de mieux comprendre les mécanismes moléculaires responsables du comportement fatal d’orthoptères (Meconema thalassinum) parasités par un nématomorphe
8
(Spinochordodes tellinii). Ils ont pu mettre en évidence des différences d’expression de protéines liées au stade où le parasite change le comportement de son hôte. Certaines des molécules secrétées par le parasite sont impliquées dans la transduction du signal et ont un rôle majeur dans le système nerveux central de l’hôte (protéines de la famille Wnt). Ces résultats suggèrent que ce parasite a aussi la capacité de modifier l’environnement neural de son hôte. Élucider les mécanismes moléculaires responsables de l’altération des comportements de l’hôte permettra de mieux appréhender le rôle de la sélection naturelle dans l’apparition de ces nouveaux traits et l’évolution de ces interactions. La compréhension des mécanismes proximaux liés aux changements de comportement commence donc à être considérée comme nécessaires à l’étude de la modification comportementale par les parasites.
I.5 Système hôte-parasite modèle
I.5.1 Modèle animal
Les premières archives sur les infections parasitaires datent de la période de l’empire égyptien, il y a plus de 5000 ans avec la description de macro parasites infectant les humains (Bryan, 1930). Depuis plus de deux siècles, plusieurs systèmes modèles ont été utilisés pour mieux comprendre les interactions hôte-parasite (Linnaeus, 1793; Steenstrup, 1845). Le plus vieux d’entre eux est le système épinoche/ S. solidus (Abildgaard, 1790). En effet ce système est étudié depuis les années 1790 et son étude a permis de mettre en place la plupart des techniques actuelles de culture de parasites in vitro (Smyth, 1990). A l’heure actuelle, ces deux espèces ont leurs génomes séquencés (Peichel et al., 2001; Jones et al., 2012) et sont également considérées comme des espèces modèles autant en écologie (Wootton, 1976, 1984; Barber and Scharsack, 2010) qu’en biologie évolutive (Bell, 1995; Bell and Ortí, 1994; McKinnon and Rundle, 2002; Hammerschmidt et al., 2009). Les deux hôtes intermédiaires et le parasite peuvent être facilement conservés et utilisés en laboratoire (Smyth, 1946; Wedekind, 1997).
L’épinoche à trois épines est un petit poisson osseux commun des eaux froides et bien connu pour ses variations de tempérament, comme lors de la
9
reproduction (Shaw et al., 2007) ou face à un prédateur (Lacasse and Aubin-Horth, 2012), l’épinoche est donc un animal modèle en éthologie. Il existe de nombreuses populations que ce soit d’eau douce ou d’eau salée étudiées pour leur adaptation (Bell and Foster, 1994; Spence et al., 2013) et leur variation génétique (Jones et al., 2012). En plus d’être un modèle en évolution, l’épinoche est aussi un modèle en parasitologie de par son interaction très spécifique avec le ver plat Schistocephalus
solidus (Henrich et al., 2013). Ce parasite est un cestode transmis de manière
trophique à l’intérieur d’un cycle de vie complexe (Smyth, 1946). Ce cestode est connu pour infecter 40 types d’oiseaux piscivores, hôtes définitifs de ce parasite (Nishimura et al., 2011). Son cycle de vie complexe comprend trois hôtes et des changements anatomiques s’opèrent entre chaque hôte (Hopkins and Smyth, 1951; Wedekind, 1997). Le cestode qui quitte le système digestif de son hôte aviaire au stade œuf, se retrouve libre en milieu aquatique, il a 24 à 48 heures pour se faire ingérer par son premier hôte intermédiaire : un copépode. Il y développe un crochet postérieur et des cercomères (contenant les orifices du système osmorégulateur) et dispose de trois à quatre semaines avant d’infester son second hôte (Clarke, 1953). Une fois dans ce dernier, l’épinoche à trois épines, il perd ses cercomères et produit de 60 à 80 proglottides (segments contenant les organes du système reproducteur, Smyth, 1946). Il se développe fortement en environ 17 jours, seuil où le parasite est protégé du système immunitaire de son hôte (Scharsack et al., 2007). Après plus de six semaines, l’épinoche est ingérée par l’hôte final : un prédateur endotherme piscivore, le parasite peut alors se reproduire et produit de nombreux œufs (Clarke, 1954). Le système épinoche / S. solidus constitue donc un parfait système d’étude pour mettre en évidence les mécanismes moléculaires impliqués dans les changements de comportement de l’hôte du à son parasite.
I.5.2 Le phénotype étendu de S. solidus
La présence du cestode dans la cavité abdominale de l’épinoche est associée à des modifications physiologiques et comportementales. S. solidus est très bien étudié au niveau des conséquences négatives de l’infection sur le changement de comportement, la reproduction et la croissance de son hôte l’épinoche. De nombreuses études ont été faites sur la reproduction retardée des épinoches
10
parasitées (Meakins, 1974) ou sur leur taux de croissance diminué (Pennycuick, 1971). Les niveaux hormonaux sont aussi altérés, en particulier ceux de la reproduction (Shao et al., 2012). De plus, la croissance importante du parasite va amener à une possible déformation morphologique de celui-ci (Arme and Owen, 1967). Lorsque le parasite atteint un poids supérieur à 25% de son hôte (Milinski, 1985, 1984; Barber et al., 2004) ou qu’il pèse plus de 50mg (Tierney et al., 1993), les changements de comportement de l’épinoche commencent. Ces changements sont eux aussi bien documentés (Barber and Scharsack, 2010). L’activité du parasite induit une perte de la réponse anti prédateur de son hôte. Cette réponse a été étudiée par Quinn et al. (2012) qui ont démontré que les poissons pêchés à la surface en pleine journée sont plus souvent parasités. La nage près de la surface durant la journée augmenterait la vulnérabilité des épinoches face à une menace de prédation, permettant au parasite de compléter son cycle de vie. L’épinoche parasitée revient plus rapidement vers la nourriture après une attaque de prédateur : le comportement de témérité est modifié par le parasitisme (Giles, 1987, 1983). Il existe une corrélation négative significative entre la charge parasitaire et le temps de latence après une attaque de prédateur. Giles donne comme possible explication l’augmentation de la demande en oxygène étudiée par Lester (1971) et l’énergie utilisée par le parasite. Une seconde étude en lien avec la faim s’est également intéressée à l’effet du parasitisme sur le comportement de sociabilité (Barber et al., 1995). Les résultats démontrent que les poissons infectés ont une tendance à être moins sociables que les non infectés. Les poissons ayant faim, se sépareraient du banc de poisson afin d’avoir moins de compétiteurs sur la nourriture. Les auteurs suggèrent que le comportement de faim des poissons parasités vient de l’augmentation du taux métabolique du parasite.
I.6 Les causes des changements comportementaux par S.
solidus
Malgré toute cette littérature scientifique présente sur les comportements de l’épinoche parasitée, peu d’études ont été faites sur les causes proximales de la modification du comportement. Pourtant S. solidus amène à des changements drastiques de comportement, alors qu’il n’est pas présent au niveau du système
11
nerveux central, mais plutôt dans la cavité corporelle de l’épinoche. Une des seules études à s’être penchées sur les causes des modifications comportementales des épinoches parasitées est celle de Øverli et al. (2001). Ces travaux portent sur l’impact de la sérotonine et de l’adrénaline sur les femelles parasitées. Ils valident ainsi l’hypothèse que cette infection modifie l’activité cérébrale, notamment via le métabolisme de la sérotonine. Les auteurs en concluent que les changements comportementaux sont dus, soit à un stress chronique, soit à d’autres altérations du statut neuroendocrinien des poissons infectés. Une suite d’études a elle porté sur les modifications génomiques à différents stades du développement du parasite. Des peptides de S. solidus identifiés par analyses bio-informatiques ont mis en évidences des similarités avec des peptides de l’épinoche à trois épines, suggérant que ces protéines mimiques pourraient jouer un rôle dans la modification des différentes voies métaboliques pouvant avoir une conséquence sur le phénotype de l’hôte (Hébert et al., 2015). De plus une de ces protéines, de la famille Wnt, semble être surexprimées dans les parasites prêts à se reproduire, sensés changer le comportement de leur hôte (Hébert et al., 2016c). Les causes proximales de ces changements doivent néanmoins être davantage explorées afin d’améliorer notre compréhension des mécanismes évolutifs sous-jacents responsables de la coévolution entre S. solidus et son hôte l’épinoche.
Pour pouvoir conclure plus précisément sur les causes de ces changements de comportement induits par la présence d’un parasite, il est nécessaire de prendre en compte l’ensemble des hypothèses envisageables. Quatre possibilités ont été analysées dans cette thèse. La première possibilité est l’hypothèse mécanique qui prend en compte l’importance de la masse du parasite comme cause principale des changements comportementaux. En effet, le cestode peut atteindre à lui seul jusqu’à 40% de la masse de son hôte (Hopkins and Smyth, 1951) ou même excéder la masse de l’hôte lors d’une infection multiple (Arme and Owen, 1967). La place occupée par le parasite n’est donc plus disponible pour l’ensemble des organes vitaux de l’hôte et peut avoir un impact très important sur sa physiologie. Des études ont détecté une diminution de la taille des organes viscéraux dû au manque d’espace (Walkey and Meakins, 1970; Pascoe and Mattey, 1977). L’expansion de
12
l’estomac pourrait aussi être réduite par de lourdes infections (Milinski, 1985), avec comme résultat la diminution de la prise alimentaire (Wright et al., 2006). La deuxième hypothèse est celle de l’activation du système immunitaire de l’hôte qui aurait comme conséquence un comportement de maladie (Hart, 1988). Ces changements incluent la léthargie et la dépression. Selon l’hypothèse de l’effet secondaire, l’individu parasité se battrait contre le parasite grâce à son système immunitaire, ce qui affecterait son comportement. Des changements de comportement après une infection expérimentale ont été démontrés chez de nombreuses espèces (Ezenwa et al., 2016; Sullivan et al., 2016). Scharsack et al. (2007) ont étudié la réponse immunitaire des épinoches face à une infection parasitaire. Leurs résultats ont démontré que la présence du cestode est corrélée avec la prolifération des monocytes (précurseurs des macrophages et des granulocytes) dans les reins antérieurs de l’épinoche, ceci indiquant que les cellules immunitaires des épinoches infectées ont été mobilisées au début de l’infection. Cependant, durant la phase de croissance, aucune activation du système immunitaire par les leucocytes de l’hôte n’est visible (Scharsack et al., 2004). Cette phase est associée avec une diminution de la prolifération des monocytes de l’hôte (Scharsack et al., 2007). De plus, il a été proposé que le parasite soit capable d’éviter la réponse immunitaire innée de l’hôte au moment de sa croissance en ajustant la composition en carbohydrate de sa surface (Hammerschmidt and Kurtz, 2005; Maizels et al., 2004). S. solidus active le système immunitaire de l’épinoche seulement quand il est prêt à se reproduire, au moment où les changements de comportements de l’hôte apparaissent (Scharsack et al., 2007). La troisième hypothèse est celle de la perte énergétique due à la croissance parasitaire (Mayack and Naug, 2009; Maure et al., 2013). Par exemple, lorsque les épinoches infectées sont nourries jusqu’à satiété, elles ingèrent davantage de nourriture que des poissons sains (Walkey and Meakins, 1970). La réduction du foie des poissons infectés est probablement due à la demande accrue de nutriment par le parasite (Arme and Owen, 1967;Walkey and Meakins, 1970). De plus, lorsque la nourriture est éparse, la mortalité des poissons infectés est plus importante (Pascoe and Mattey, 1977) et durant une activité normale, ces poissons consomment plus
13
d’oxygène que leurs conspécifiques non infectés (Meakins and Walkey, 1975). La dernière hypothèse est celle de la modification de l’environnement neural de l’hôte avec comme explication plausible l’interaction du parasite avec le système nerveux de leur hôte. Les variations de comportement d’individus sains sont souvent corrélées avec la modification de messagers chimiques. Par exemple, les monoamines retrouvées dans le système nerveux central (dopamine, sérotonine, adrénaline and norépinephrine) ont une influence sur l’humeur et le comportement des vertébrés, incluant les poissons. Helluy and Holmes (1990) émettent l’hypothèse de la modification de l’environnement neural par un trématode (Microphallus
papillorobustus), qui modifierait l’intensité de l’activité sérotoninergique dans
différentes régions du cerveau de l’amphipode, l’hôte. Une activité élevée de sérotonine est aussi retrouvée dans les tissus neuraux (tronc cérébral et hypothalamus) de l’épinoche infectée par S. solidus (Øverli et al., 2001). Ce neurotransmetteur est connu comme étant impliqué dans les variations de nombreux comportements chez les vertébrés, incluant la géotaxie (i.e. comportement de sensibilité par rapport à la gravité) et la scototaxie (comportement de sensibilité par rapport à la lumière, Maximino et al., 2013) ainsi que le comportement d’alimentation (Alanärä et al., 1998; Ortega et al., 2013).
I.7 Objectif de thèse
L’objectif principal de ma thèse de doctorat a été de déterminer et de disséquer les mécanismes physiologiques et moléculaires de la modification du comportement de l’épinoche parasitée par S. solidus afin de définir, selon les hypothèses citées précédemment, si ces modifications comportementales étaient influencées par la masse parasitaire, la faim, la réponse immunitaire et/ou encore la modification de l’environnement neural. Afin de répondre à cette large question scientifique, mon étude s’est divisée en trois parties interconnectées.
Les deux premiers objectifs (Chapitre II et III) ont été de reproduire le syndrome comportemental d’un poisson parasité par deux méthodes complémentaires. La première méthode utilisée était l’ingénierie phénotypique, qui permet de dissocier un phénotype complexe afin d’étudier l’effet d’un trait spécifique
14
(Kliman, 2016). L’objectif principal du Chapitre II était d’analyser l’hypothèse mécanique, c’est à dire de répondre à la question suivante : « Les changements de comportement de l’épinoche parasitée sont-ils une conséquence de la diminution de l’espace de la cavité abdominale par la présence du parasite? ». Nous avons prédit que les épinoches contenant un faux parasite retrouveraient certains comportements typiques d’un poisson parasité mais que ces traitements ne seraient pas suffisants pour retrouver l’ensemble du syndrome comportemental.. Dans le chapitre III, la deuxième méthode utilisée était l’étho-pharmacologie, qui analyse les mécanismes liés au comportement en combinant des études éthologiques avec des méthodes pharmacologiques (Kavaliers et al., 1999). Nous avons étudié les hypothèses de la modification de l’environnement neural (par la modification du métabolisme des neurotransmetteurs sérotonine ou GABA), de l’activation du système immunitaire (effet secondaire) ainsi que de la perte énergétique (effet indirect). Nous avons prédit que si une de ces hypothèses était la cause des changements de comportement, la modification de l’axe du stress, l’activation du système immunitaire ou le jeûne serait suffisant pour recréer le syndrome comportemental typique d’une épinoche parasitée. Finalement, nous nous sommes intéressés aux variations d’expression génique dans le cerveau des poissons parasités comparés aux poissons exposés mais non parasités, sains ou traités pharmacologiquement (modification de l’axe de la sérotonine) pour mieux comprendre les causes proximales des changements de comportement (Chapitre IV). Pour ce faire nous avons mis en place une approche transcriptomique à l’échelle du génome qui permet de révéler les bases moléculaires des changements phénotypiques liés à l’infection par S. solidus (Hébert and Horth, 2014; Aubin-Horth and Renn, 2009). Nous avons prédit que par rapport aux épinoches témoins, les épinoches parasitées auraient une augmentation de l’expression des gènes reliés à l’immunité, en particulier ceux nécessaire à la prolifération de monocytes et leucocytes (Scharsack et al., 2004; Scharsack et al., 2007). Des gènes reliés au système nerveux central seraient aussi surexprimés chez les épinoches parasitées comparé aux témoins, en particulier ceux ayant un lien avec le système sérotoninergique (Øverli et al., 2001). Nous avons aussi prédit que si S. solidus
15
affectait le métabolisme de la sérotonine, les poissons avec un métabolisme de la sérotonine altéré auraient une expression génique similaire aux poissons infectés. Et finalement nous avons prédit que les poissons exposés mais non infectés par S.
solidus aurait, si différence il y a, une signature génomique principalement reliée à
l’immunité.
Cette thèse contribue donc aux connaissances sur la manipulation parasitaire en apportant une nouvelle méthode d’analyse des causes des changements de comportement. De nombreuses études faites sur la manipulation parasitaire négligent l’importance de tester toutes les hypothèses possibles avant de conclure sur les causes de ces changements de comportement. Développer et comprendre comment l’infection peut avoir une incidence sur la biologie de son hôte a une importance autant dans les domaines fondamentaux qu’appliqués. Ainsi, la modification du comportement par les parasites gagne l’intérêt des biologistes car elle a des impacts sur la stratégie de transmission et donc est importante dans le domaine de la conservation, l’économie et la médecine (Poulin and Levri, 2012). De plus, les parasites ont des conséquences très importantes sur la dynamique des écosystèmes (Brunner et al., 2017). Par exemple, la manipulation comportementale peut affecter les réseaux trophiques. En effet, quand le parasite augmente la vulnérabilité de son hôte à la prédation, le lien trophique entre les deux hôtes du cycle de vie du parasite est augmenté (Lafferty et al., 2008; Lafferty and Kuris, 2012). Les humains aussi peuvent être affectés par la manipulation comportementale comme hôte nécessaire au parasite (par exemple Plasmodium falciparum, responsable de la malaria) ou comme hôte intermédiaire accidentel (Toxoplasma
gondii notamment). Il est donc essentiel d’augmenter nos connaissances dans le
domaine de la parasitologie en les complétant par des études plus intégratives incluant des études expérimentales, comportementales, physiologiques et de génomiques.
16
Chapitre II : Using phenotypic engineering to mimic a
parasite’s physical presence to test the mechanical
effect on behaviour modification in an intermediate host.
Lucie Grécias1, Julie Valentin1, Nadia Aubin-Horth11Département de Biologie et Institut de Biologie Intégrative et des Systèmes (IBIS), Université Laval, Québec, Canada
17
II.1 Résumé
De nombreux parasites aux cycles de vie complexes affectent le comportement et des traits d'histoire de vie de leurs hôtes intermédiaires. Ces changements ont été proposés comme augmentant la transmission vers l’hôte final. Ces changements de comportement pourraient être la conséquence du fait que le parasite manipule activement son hôte, mais pourraient également être dus à la présence parasitaire, seule ou en combinaison avec d'autres facteurs. Malgré le fait que ce soit une explication simple et plausible, des études expérimentales testant l'hypothèse mécanique - que la présence du parasite peut affecter le comportement de l'hôte - sont peu communes. Nous avons utilisé l'ingénierie phénotypique dans un système où le parasite peut atteindre jusqu'à 92% de la masse de l'hôte intermédiaire et pour lequel un large éventail de changements de comportement ont été décrits- le cestode Schistocephalus solidus infectant l'épinoche à trois épines (Gasterosteus aculeatus) – afin de tester l'hypothèse selon laquelle le seul ajout d'un ver artificiel à l'intérieur de l'hôte pourrait entraîner des changements de comportement. Nous avons constaté que les individus phénotypiquement modifiés n'avaient pas de réponses comportementales similaires à celles des individus infectés, la plus grande différence entre les traitements étant celle entre les poissons infectés et les poissons injectés avec du silicone. Contrairement à nos prédictions, nous n'avons pas réussi à reproduire les comportements typiques des épinoches infectées par S. solidus à l'aide d'un faux ver ou en combinaison avec l'activation du système immunitaire. Nos résultats suggèrent que ni le faux parasite utilisé dans cette étude ni son interaction avec le système immunitaire n'étaient suffisants pour recréer le syndrome comportemental d'un poisson infecté. Nous ne pouvons donc pas en déduire que l'hypothèse mécanique et son interaction avec le système immunitaire ne constituent pas une cause possible des modifications du comportement par un parasite.
18
II.2 Abstract
Many parasites with complex life cycles modify their intermediate hosts’ behaviour, which has been proposed to increase transmission to their definitive host. This behaviour change could result from the parasite actively manipulating its host, but could also be explained by a mechanical effect, where the parasite’s physical presence affects host behaviour. We created an artificial internal parasite to test this mechanical effect hypothesis, using a host-parasite system where the internal parasite can reach up to 92% of the host mass - the cestode Schistocephalus solidus infecting the threespine stickleback (Gasterosteus aculeatus). Our proof-of-concept experiment suggests that the use of silicone might not be the correct substitute to recreate the parasitic mass of S. solidus. However, our study shows that using artificial parasites is a fruitful avenue to dissect the proximal causes of parasitic manipulation. Furthermore, our results show that thigmotaxis is greatly reduced in infected sticklebacks, adding to the behavioural assays in this host-parasite system.
19
II.3 Introduction
Many parasites have complex life cycles with multiple hosts, and alter various aspects of their host’s biology (Poulin, 2010). Infection can be accompanied by changes in morphology, physiology, life history and behaviour of the host (Poulin and Thomas, 1999). Those phenotypic modifications can stem from non-exclusive causes: specific manipulation, side effects (pathological consequences) or by products, which can be coincidentally beneficial (Thomas et al., 2005). Understanding these mechanisms will shed light on host–parasite interactions and coevolution (Poulin, 2007). However, in most host-parasite systems, the proposed causes of those changes are not tested using experimental confirmation (Moore, 1983). This is in part because it is technically complicated to do so, as multiple proximal causes may intervene to result in these altered host phenotypes (Grécias et al., 2017).
In host-parasite systems where the parasite infects its host internally, the presence of this foreign body could cause modification in the host phenotype, including its behaviour. The parasite’s “mechanical effect” can be defined as all physical or behavioural impacts of the parasite that are related to its presence and that have consequences on host phenotype in the time window in which the parasite exerts those physical or behavioural modifications. For example, the metacercariae of the Tylodelphys trematode infects the vitreous humour of the eyes of its fish host (Stumbo and Poulin, 2016). The parasite is not encysted and can cross from one side of the eye to the other. This trematode shows a daily rhythm of movement within the eye, obstructing its host’s retina during the day when its final fish-eating bird host is active, while leaving the eye fully functional at dusk and night. This example shows the combined effect of mechanical and parasite behaviour as a cause of potential host behaviour modification. Another example of manipulative parasite that might change its host behaviour through a mechanical modification combined with its behaviour is the trematode Leucochloridium paradoxum, which forms broodsacs, migrate to the tentacles of terrestrial snails and pulsate rapidly. Thanks to this parasite presence and behaviour, the snails’ eye stalks resemble caterpillars,
20
resulting in increased predation by the definitive bird host (Wesołowska and Wesołowski, 2014). In both cases, the parasite’s behaviour (circadian movement in the eye, migrating to eye stalk and pulsating) is coupled with the effect of physical presence to affect the host’s phenotype, but it is conceivable that the sole parasite presence could affect its host.
In some cases, the mass of the internal parasite approaches the mass of its host (Arme and Owen, 1967). The threespine stickleback (Gasterosteus aculeatus) can be infected by a tapeworm, Schistocephalus solidus. This macro parasite can attain 40% of the host weight and, as multi infection is common, combined worms can weigh up to 92% of the host weight (Hopkins and Smyth, 1951). The space taken by the parasite in the body cavity of the host could have major impact on the fish physiology. Size of visceral organs is forced to be smaller because of the lack of space (Pascoe and Mattey, 1977; Walkey and Meakins, 1970). The stomach’s capacity for expansion may thus be limited in heavy infections (Milinski, 1985), potentially resulting in a decrease in food intake (Wright et al., 2006).The fish’s abdomen becomes grossly distorted as the parasite grows inside it (Arme and Owen, 1967). This abdomen distortion may make sticklebacks more vulnerable to predatory birds that select the largest available fishes from the population (Van der Veer et al., 1997). S. solidus might also alter the buoyancy of its fish host, as the density of the cestode is higher than that of the stickleback (LoBue and Bell, 1993). This means that the host must use its swim bladder to reach higher buoyancy despite the parasite mass (Talarico et al., 2017). Concurrently with morphological changes, a suite of behaviours is changed in sticklebacks harbouring at least one infective parasite. They show more risky behaviours: they lose their anti-predator response and forage at a higher rate, even under the risk of predation (Milinski, 1985; Giles, 1987; Godin and Sproul, 1988; Barber et al., 2004) (Tierney et al., 1993). They also spend less time swimming with a group than uninfected ones when satiated (Barber et al., 1995; Barber et al., 1998). Moreover, infected fish tend to stay at the surface both in nature and in the laboratory (“geotaxis”, LoBue and Bell, 1993; Quinn et al., 2012). Several studies on host manipulation have been done to try to unravel the most plausible cause of behaviour modification. But to our knowledge, no study has
21
tested the mechanical effect hypothesis of host alteration by a parasite using an experimental approach, in this system or another.
The aim of this study was to assess the impact of a parasite presence on the behaviour of its host in order to test whether there is a causal link between the parasite “mechanical effect” and behaviour alteration in the stickleback-cestode system. We used phenotypic engineering, the experimental modification of an organismic phenotype, as it allows to separate a complex phenotype into its part and to focus on the effects of a single trait (Kliman, 2016) that allows testing predictions in a specific manner (Andersson, 1992; Aubret et al., 2003). We manipulated the space available in the body cavity of the fish by injecting an artificial “worm” that is inert but similar in physical property to a live parasite, allowing isolating the mechanical effect of Schistocephalus on its host. We quantified four different behaviours: geotaxis, response to a predator, feeding and thigmotaxis. We predicted that sticklebacks harbouring an artificial worm would increase time spent swimming at the surface (because of their buoyancy), as infected sticklebacks do. We also predicted that the phenotypically engineered sticklebacks would decrease their latency to freeze after an attack (they would freeze immediately instead of displaying a typical fleeing anti-predator response, because of an impairment in locomotion) and to feed. Finally, we measured a behaviour not previously quantified in infected sticklebacks, the tendency to avoid exposure to potential threats by hugging walls in an open field (thigmotaxis or centrophobic behaviour). This behaviour is used as a measure of anxiety in mammals, fish and insects (Maximino et al., 2010; Webster and Laland, 2015; Mohammad et al., 2016) and has been observed in other infected hosts (Poulin, 2001). We predicted that infected sticklebacks would have a low thigmotaxis (they would spend less time near the walls of the aquarium and more time in the center) as a response of increased exploration, and that sticklebacks harbouring artificial worms would have the same behaviour.