Étude du rôle de la voie ERK/MAPK dans le
développement embryonnaire chez la souris
Thèse
Rifdat Aoidi
Doctorat en biologie cellulaire et moléculaire
Philosophiæ doctor (Ph. D.)
Québec, Canada
Étude du rôle de la voie ERK/MAPK dans le
développement embryonnaire chez la souris
Thèse
Rifdat Aoidi
Sous la direction de
iii
Résumé
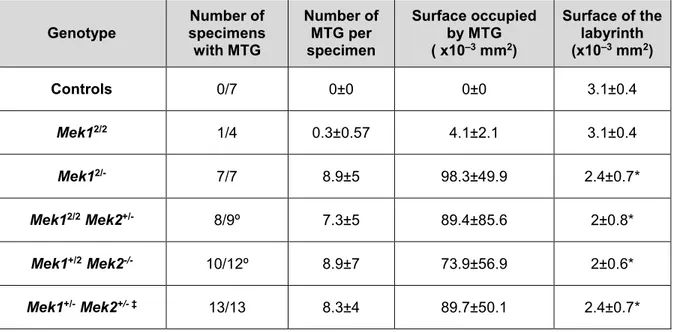
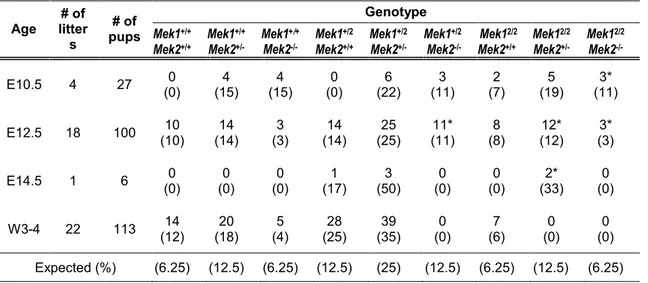
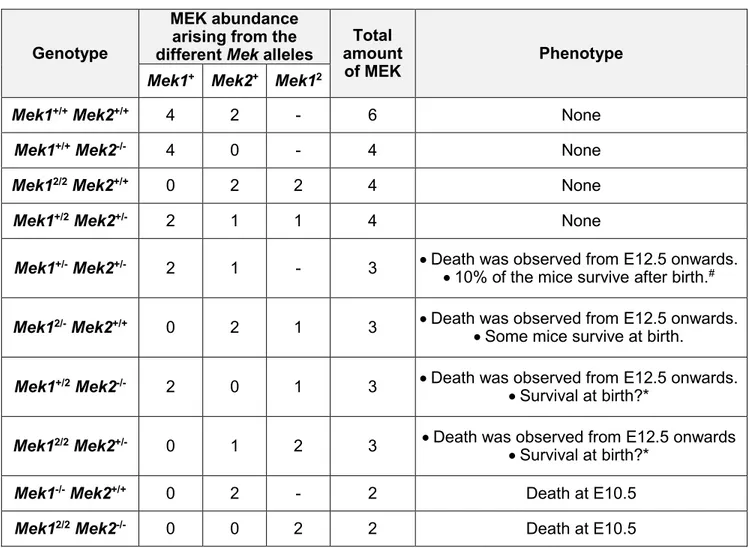
Les mammifères possèdent deux MAP kinases kinases (MEK1 et MEK2), impliquées dans l’activation de la voie ERK/MAPK essentielle pour la différenciation, la prolifération et la survie cellulaire. Le premier objectif de cette thèse était de déterminer si les fonctions des kinases MEK1 et MEK2 sont redondantes durant le développement embryonnaire. Les souris Mek1-/- meurent à mi-gestation d’une malformation du placenta. Les souris Mek2-/- ne présentent aucun phénotype majeur, suggérant que ces deux protéines ont des rôles différents. Cependant, la plupart des mutants Mek1 +/-Mek2+/- meurent pendant la gestation d’un sous-développement du placenta, indiquant que Mek1 et Mek2 ont chacun un rôle dans le développement des tissus extraembryonnaires. À ce jour aucune évidence claire ne permet de statuer sur la redondance fonctionnelle de MEK1 et MEK2. Afin de vérifier la spécificité fonctionnelle de Mek1 et Mek2, nous avons généré au laboratoire un allèle « knockin », exprimant l’ADNc de Mek2 sous contrôle du locus Mek1 (Mek12). L’analyse de ces souris a révélé la redondance fonctionnelle entre MEK1 et MEK2. L’analyse de combinaisons alléliques de Mek a démontré qu’une expression minimale de protéines MEK est cruciale pour le développement embryonnaire et la survie.
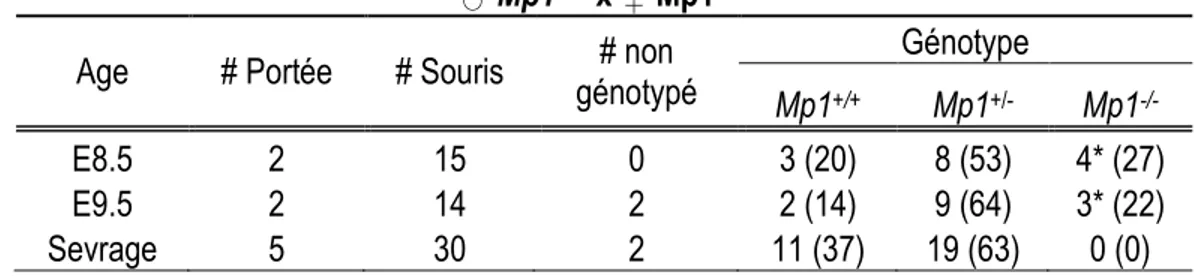
Le second objectif de cette thèse était de caractériser les mutants Mp1. Les protéines d’échafaudage permettent de moduler l’activité de la voie ERK/MAPK et facilitent la transmission rapide du signal. Parmi les protéines d’échafaudage connues, seule MP1 (Mek Partner 1) a été identifiée comme étant un partenaire spécifique de MEK1 et ERK1. Cette spécificité suggère que MP1 pourrait contribuer à la différence d’activation de MEK1 et MEK2 en spécifiant le signal qui passe par Mek1. Afin d’étudier le rôle de Mp1 au cours du développement chez la souris, nous avons généré des souris Mp1-/-. L’analyse de ces mutants indique que le gène Mp1 est essentiel pour la survie et que sa fonction est nécessaire suite à la post-implantation.
La dérégulation de la voie ERK/MAPK dans le développement chez l’homme a aussi des conséquences phénotypiques. Au cours des dernières années, une classe de syndromes a été caractérisée : Les « Rasophaties ». Ces syndromes partagent des caractéristiques communes qui sont, une mutation dans des gènes de la voie ERK/MAPK, une dysmorphologie cranio-faciale, des malformations cardiaques et cutanées ainsi qu’un retard mental. Parmi les mutations de la voie ERK/MAPK qui ont été identifiées, une mutation ponctuelle dans le gène Mek1 (Mek1Y130C) cause le syndrome Cardio-Facio-Cutané (CFC). Le dernier objectif de cette thèse était de générer un modèle animal pour le CFC portant la mutation Mek1Y130C. Les souris portant l’allèle Mek1Y130C présentent les
iv
phénotypes associés au CFC (i.e sténose pulmonaire, dysmorphologie cranio-faciale et défauts neurologiques).
v
Abstract
Mammals possess two MAP kinase kinase (MEK1 and MEK2), involved in ERK/MAPK pathway. This pathway is essential for proliferation, differentiation and cell survival. The first objective of my thesis was to determinate if MEK1 and MEK2 kinases are redundant during embryonic development. Mek1-/- mice die at
embryonic day E10.5 due to placental defects, whereas Mek2-/- mice survive with a normal lifespan suggesting that MEK1 possesses functions not shared by MEK2. However, most Mek1+/-Mek2 +/-embryos also die from placental defects, indicating that both Mek genes contribute to placental development. To date, no clear evidence on MEK1 and MEK2 redundancy has been provided. To assess the functional specificity of the Mek1 and Mek2 genes, we produced a Mek1-knockin allele in which the Mek2 coding sequences were placed under the control of Mek1 regulatory sequences. Analyzing these mice allowed us to demonstrate that MEK1 and MEK2 can substitute for each other and that a minimal amount of MEK is critical for placenta development and embryo survival.
The second objective of my thesis was to characterize Mp1 mutants. Scaffold proteins modulate MAPK pathway by providing spatial and temporal specificity. Among known ERK/MAPK scaffold proteins, only MP1 (Mek Partner 1) is specific to MEK1 and ERK1, raising the question of the specificity of MP1 in the regulation of ERK/MAPK pathway via MEK1. In order to investigate Mp1 function in vivo, we generated Mp1 knock-out mice. Analyzing these mice enable us to suggest that Mp1 is required for embryonic development and is essential during post-implantation.
Deregulation of Ras/MAPK pathway also causes developmental phenotypes in human. During the last decade, a new class of syndromes, which share common phenotypes such as mutations in Ras/MAPK pathway, cranio-facial dysmorphology, cardiac and cutaneous malformations and neurological delay has been described and named Rasophaties. Among the DNA mutations found in rasopathies, the Mek1 mutation, Mek1Y130C, causes cardio-facio-cutaneous syndrome (CFC). The last objective of my thesis was to generate a mouse model of CFC, with the Mek1Y130C mutation. I found that mice carrying the Mek1Y130C mutation partially recapitulate CFC syndrome (i.e pulmonary stenosis, crani-facial dysmophia and neurological defects).
vi
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vi
Liste des tableaux... x
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xvii
Chapitre 1. Introduction ... 1
1.1 Le développement embryonnaire... 1
1.1.1 De la fertilisation au stade blastocyste : la préimplantation ... 2
1.1.2 L’implantation ... 11
1.1.3 La gastrulation ... 14
1.2 Le développement du tissu extraembryonnaire : le placenta ... 15
1.2.1 Voie ERK/MAPK dans le développement des tissus extraembryonnaires ... 21
1.3 Les voies de signalisation MAPK ... 26
1.3.1 La voie de signalisation c-Jun NH2-terminal kinase (JNK) 1-3 ... 26
1.3.1.1 Propriétés de la voie JNK ... 26
1.3.1.2 Activation de la voie ... 26
1.3.1.3 Fonction biologique de la voie ... 27
1.3.1.4 Substrats et gènes régulés par la voie ... 30
1.3.2 La voie de signalisation p38α-β-γ-δ ... 31
1.3.2.1 Propriétés de la voie p38 ... 31
1.3.2.2 Activation de la voie ... 31
1.3.2.3 Fonction biologique de la voie ... 32
1.3.2.4 Substrats et gènes régulés par la voie ... 32
1.3.3 La voie de signalisation ERK5 ... 32
1.3.3.1 Propriétés de la voie ... 32
1.3.3.2 Activation de la voie ... 33
1.3.3.3 Fonction biologique de la voie ... 33
1.3.3.4 Substrats et gènes régulés par la voie ... 34
1.3.4 Les voies MAPK atypiques ... 34
1.3.4.1 ERK3 et ERK4 ... 34
1.3.4.2 Nem-like kinase (NLK)... 35
1.3.4.3 ERK7 ... 36
1.4 La voie de signalisation ERK/MAPK classique ... 36
1.4.1 Activation de la voie ... 37
vii
1.4.3 Les MAPKKs MEK1 et MEK2 ... 39
1.4.3.1 Structure des kinases MEK1 et MEK2 ... 39
1.4.3.2 Différences entre MEK1 et MEK2 ... 40
1.4.3.3 Rôles des kinases MEK1 et MEK2 ... 45
1.4.4 Les MAPK ERK1/2 ... 49
1.4.4.1 Fonctions des kinases ERK1/2 ... 49
1.4.4.2 Processus cellulaires régulés par ERK1/2 ... 50
1.4.5 Importance des protéines d’échafaudage dans le contrôle de la voie ERK/MAPK ... 50
1.4.5.1 KSR1 ... 51 1.4.5.2 Paxilline ... 52 1.4.5.3 β-arrestine 2 ... 53 1.4.5.4 IQGAP1 ... 53 1.4.5.5 MP1 ... 54 1.4.5.6 MORG1 ... 55
1.5 Dérégulation de la voie ERK/MAPK et ses conséquences chez l’humain ... 56
1.5.1 Les Rasopathies ... 56 1.5.1.1 Neurofibromatose de type 1 (NF1) ... 57 1.5.1.2 Syndrome de Noonan (SN) ... 60 1.5.1.3 Syndrome de Costello (SC) ... 61 1.5.2 Le syndrome cardio-facio-cutané (CFC) ... 62 1.5.2.1 Les symptômes du CFC ... 63 1.5.2.1.1 L’atteinte cardiaque ... 63 1.5.2.1.2 L’atteinte cranio-faciale ... 63 1.5.2.1.3 L’atteinte de l’ectoderme ... 64 1.5.2.1.4 L’atteinte neurologique ... 64
1.5.2.1.5 Les autres atteintes ... 64
1.5.2.2 Les aspects moléculaires du CFC ... 65
1.5.2.2.1 Les mutations du gène BRAF ... 65
1.5.2.2.2 Les mutations des gènes MEK1 et MEK2... 66
1.5.2.3 Les modèles animaux pour le syndrome cardio-facio-cutané ... 67
1.5.2.3.1 Les modèles animaux avec une mutation dans le gène BRaf ... 67
1.5.2.3.2 Les modèles animaux avec une mutation dans les gènes Mek1 et Mek2 ... 68
1.6 Problématiques et objectifs ... 69
Chapitre 2 ... 71
Functional redundancy of the kinases MEK1 and MEK2: Rescue of the Mek1 mutant phenotype by Mek2 knockin reveals a protein threshold effect ... 71
2.1 Avant-propos ... 73
2.2 Résumé ... 75
2.3 Abstract ... 77
2.4 Introduction ... 79
2.5 Results ... 81
2.5.1 Mek2 cdna knockin into the Mek1 locus rescues the Mek1-null phenotype ... 81
viii
2.5.3 Placental development requires a threshold of MEK activity ... 89
2.6 Discussion ... 92
2.7 Materials and Methods ... 98
2.7.1 Generation of the Mek1 knockin allele ... 98
2.7.2 Mice, genotype and tissue collection ... 99
2.7.3 Histological, immunohistochemical, and immunofluorescence analyses ... 100
2.7.4 Western blot analysis ... 100
2.7.5 RNA isolation and quantitative RT-PCR (qRT-PCR) ... 100
2.7.6 Statistical analyses ... 100
2.8 References ... 100
Chapitre 3. ... 119
Étude du rôle de Mp1 (Mek-Partner-1) au cours du développement embryonnaire de la souris... 119
3.1 Avant propos ... 119
3.2 Introduction ... 121
3.3 Matériels et méthodes ... 122
3.3.1 Génération de l’allèle Mp1- ... 122
3.3.2 Souris, collecte de tissus et culture des embryons ... 123
3.3.3 Analyses d’histologie, d’immunohistochimie et d’immunofluorescence ... 123
3.3.4 Hybridation in situ ... 124
3.4 Résultats ... 125
3.4.1 L’inactivation du gène Mp1 cause une mortalité embryonnaire ... 125
3.4.2 Dérégulation de l’expression des marqueurs des trophoblastes ainsi que de la voie MAPK ... 130
3.4.3 Défaut des cellules ES Mp1-/- in vitro ... 131
3.5 Conclusion et discussion ... 131
Chapitre 4 ... 143
Mek1Y130C mice partially recapitulate human Cardio-Facio-Cutaneous syndrome ... 143
4.1 Avant propos ... 145
4.2 Résumé ... 147
4.3 Abstract ... 149
4.4 Introduction ... 151
4.5 Results ... 152
4.5.1 Viability of MEK1Y130C mouse model ... 152
4.5.2 The Mek1Y130C allele contains a partial duplication of the Mek1 gene ... 156
4.5.3 Heart and cranial defects in Mek1Y130C mutants ... 157
4.5.4 Brain defects in Mek1Y130C mutants ... 164
4.5.5 Mek1Y130C capacity to activate ERK/MAPK pathway ... 164
4.6 Discussion ... 165
4.7 Materials and Methods ... 170
4.7.1 Mice, genotype and tissue collection ... 170
4.7.2 Histological analyses and pulmonary stenosis analysis ... 170
4.7.3 Brain immunostaining ... 170
ix
4.7.5 RNA isolation and quantitative RT-PCR (qRT-PCR) ... 171
4.7.6 Fibroblast isolation and pERK induction ... 171
4.7.7 Skeletal analysis ... 171
4.7.8 Statistical analyses ... 172
4.9 References ... 172
5. Discussion générale et conclusions ... 175
5.1. Redondance fonctionnelle des kinases MEK1 et MEK2 ... 176
5.2. Niveau d’expression des protéines MEK1 et MEK2 ... 177
5.3 Développement du placenta et effet de dosage... 182
5.4. Rôle de la protéine d’échafaudage MP1 au cours du développement ... 184
5.4.1 MP1 et la signalisation ERK/MAPK ... 185
5.4.2 MP1 et la signalisation mTORC1 ... 188
5.5 Modèle animal pour le syndrome cardio-facio-cutané avec la mutation Mek1Y130C ... 189
5.6 Conclusion générale ... 198
Bibliographie des chapitres 1, 3 et 5 ... 199
Annexe I: Lung development requires an active ERK/MAPK pathway in the lung mesenchyme ... 219
I.1 Avant-propos ... 221 I.2 Résumé ... 223 I.3 Abstract ... 225 I.3 Abstract ... 225 I.4 Introduction ... 227 I.5 Result ... 229
I.5.1 Tbx4Cre-directed Mek1 mesenchymal inactivation in a Mek2 null background causes neonatal death ... 229
I.5.2 Tracheal cartilage defects in Mek1flox/flox;Mek2-/-;Tbx4+/Cre mutants ... 231
I.5.3 Mesenchymal inactivation of Mek genes in the developing lung affects lung growth but not cell differentiation ... 231
I.5.4 Molecular impact of the mesenchymal inactivation of Mek genes in the lung ... 238
I.6 DISCUSSION... 246
I.7 EXPERIMENTAL PROCEDURES ... 247
I.7.1 Mice, genotyping and tissue collection ... 247
I.7.2 Histology, immunohistochemistry (IHC) and immunofluorescence (IF) analyses ... 248
I.7.3 Alcian blue cartilage staining ... 249
I.7.4 Quantitative RT-PCR (qRT-PCR) experiments ... 249
I.7.5 Morphometry analysis ... 250
I.7.6 Statistical analyses ... 250
I.8 ACKNOWLEDGMENTS ... 250
I.9 AUTHOR CONTRIBUTIONS ... 250
x
Liste des tableaux
CHAPITRE 2
Tableau 2.1: Viability relative to Mendelian predicted ratios for Mek11/1, Mek11neo2/1neo2 ... 84 Tableau 2.2: MTG phenotype in the different Mek1 Mek2 mutants ... 88 Tableau 2.3: Viability of Mek1Mek2compound mutants produced by crossing Mek1+/2 Mek2+/- with Mek1+/2 Mek2+/- mice ... 92 Tableau 2.S1: Viability of Mek11/1, Mek11neo2/1neo2, Mek12/2 and Mek12/- embryos and mice at various ages ... 107 Tableau 2.S2: A MEK1 and MEK2 protein dosage model in placenta development ... 109
CHAPITRE 3
Tableau 3.1: Survie des souris Mp1-/-... 120
CHAPITRE 4
Tableau 4.1: Viability of Mek1Y130C mice ... 144
CHAPITRE 5
Tableau 5.1 : Quantité de MEKs dans le placenta et phénotypes associés ... 171
ANNEXE I
Tableau I.1: Ratios of genotypes in litters from crosses between Mek1;Mek2;Tbx4+/Cre and
xi
Liste des figures
CHAPITRE 1
Figure 1.1 : Représentation schématique des stades de préimplantation : de la fertilisation au stade blastocyste ... 05 Figure 1.2 : La voie de signalisation Hippo et son implication dans la différenciation au stade pré-implantation ... 09 Figure 1.3 : Illustration de l’implantation et des mécanismes impliqués ... 13 Figure 1.4 : Représentation schématique du développement des tissus embryonnaires de
l’implantation à la gastrulation ... 17 Figure 1.5 : De la gastrulation au développement du placenta ... 19 Figure 1.6 : Structure du placenta de la souris : organisation des différentes couches cellulaires de la région du labyrinthe de souris ... 23 Figure 1.7 : Module d’activation des voies MAP kinase ... 29 Figure 1.8 : Schéma comparatif des séquences et des structures protéiques des kinases MEK1 et MEK2 ... 43 Figure 1.9 : Module d’activation de la voie Ras/MAPK et mutations associées aux Rasopathies ... 59
CHAPITRE 2
Figure 2.1: Underdevelopment of the labyrinth in the placenta from Mek11/1 andMek11neo2/1neo2
mutants ... 83 Figure 2.2: Normal development of the labyrinth in Mek12/2 mutants ... 87 Figure 2.3: Abnormal development of the labyrinth in Mek12/2 Mek2+/-, Mek1+/2 Mek2-/-, and Mek12/2 Mek2-/- mutants ... 91 Figure 2.4: Reduced ERK pathway activation in placentas from Mek12/2 Mek2+/-, Mek1+/2 Mek2-/-, and Mek1+/- Mek2+/- mice ... 95 Figure 2.5: Schematic representation of the phenotypes observed in Mek1 Mek2 mutants according to the genotype ... 97 Figure 2.S1: Targeted replacement of Mek1 gene with cDNA encoding tagged MEK1 or Myc-tagged MEK2 ... 111 Figure 2.S2: Mek12/- mutants showed intrauterine growth restriction ... 113 Figure 2.S3: Mek12 and Mek2+ alleles produce less Myc-tagged MEK2 and endogenous MEK2, respectively, when compared to MEK1 produced by the Mek1+ wild-type allele ... 115 Figure 2.S4: Cover page of Science Signaling, January 2016 ... 117
CHAPITRE 3
Figure 3.1 : Vecteur de ciblage pour l’inactivation du gène Mp1 ... 127 Figure 3.2 : Conséquence de la perte de Mp1 sur le développement de l’embryon et sa survie ... 129 Figure 3.3 : Profil d’expression des marqueurs de différents types cellulaires à E6.5 ... 133 Figure 3.4 : La diminution de l’activation de la voie ERK/MAPK affecte le développement des
embryons Mp1-/- ... 135 Figure 3.5 : Les blastocystes Mp1-/- se différencient sans aucun phénotype in-vitro ... 137
xii
Figure 3.6 : Évaluation de la pluripotence et de la différenciation des blastocystes Mp1-/- après 5 jours
en culture ... 139
CHAPITRE 4 Figure 4.1: Generating Mek1Y130C allele ... 155
Figure 4.2: New screen of Mek1Y130C mice ... 159
Figure 4.3: Duplication analysis ... 161
Figure 4.4: Mek1+/Y130C, Mek1Y130C/- and Mek1Y130C/Y130C mice present cardiac and facial defects .. 163
Figure 4.5: Mek1Y130C/Y130C mice exhibit an increased number of GFAP-expressing astrocytes in the adult neocortex ... 167
Figure 4.6: Kinetic of ERK/MAPK pathway activation in Mek1Y130C/- MEF ... 169
CHAPITRE 5 Figure 5.1: Séquences des 3’ et 5’ UTR des gènes Mek1 et Mek2 de souris ... 169
Figure 5.2 : Module d’activation de la voie ERK/MAPK ainsi que son ancrage à l’endosome tardif.175 Figure 5.3 : Recrutement des voies de signalisation ERK/MAPK et mTORC1 aux endosomes tardifs ... 177
Figure 5.4: Signalisation mTORC1... 179
ANNEXE I Figure I.1. Validation of the efficiency and specificity of the Cre recombinases in the developing lung and placenta ... 233
Figure I.2. Morphology and body weight of Mek1flox/flox;Mek2-/-;Tbx4+/Cre mutant embryos ... 235
Figure I.3. Abnormal tracheal development in Mek1flox/flox;Mek2-/-;Tbx4+/Cre mutant embryos ... 237
Figure I.4. Tbx4Cre-driven mesenchymal inactivation of Mek genes causes lung hypoplasia ... 241
Figure I.5. Characterization of lung epithelium cell integrity and microvasculature in Mek1flox/flox;Mek2 -/-;Tbx4+/Cre mutant embryos ... 243
Figure I.6. Changes in gene expression in lungs from Mek1flox/flox;Mek2-/-;Tbx4+/Cre mutant embryos ... 245
xiii
Liste des abréviations
3T3: 3-day transfer, inoculum 3x105 cells 4EBP1 : 4E-binding protein 1
ADN : Acide Désoxy-ribonucléique AP-1: Activator Protein-1
ARN : Acide Ribonucléique
AT1aR: angiotensin receptor subtype 1a ATF: Activating Transcription Factor
BCIP : 5-bromo-4-chloro-3-indolyl-phosphate BMK1: Big MAPK 1
BMP : Bone morphogenetic protein BrdU : Bromodésoxyuridine
B-ZIP : motif leucine-zipper basique CDK5 : Cycline-dependent kinase 5 CDX2 : Caudal type homeobox 2 CEP: Cône ectoplacentaire CMI : Cellules de la masse interne COX2: Cyclooxygenase 2
CRE : cAMP-repsonsive element
CSBP: Cytokine suppressive anti-inflammatory drugs binding protein DAB2: Disabled homolog 2
Deptor : DEP domain containing MTOR-interacting protein DMEM: Dulbecco’s Modofied Eagle Medium
EEx : Ectoderme extraembryonnaire EGFR : Epidermal Growth Factor Receptor EGFR: Epidermal growth factor receptor EP: endoderme primitif
EPI : épiblaste
ER: Estrogen Receptor
ERK1/2 : Extracellular signal-regulated kinase 1/2 EV : Endoderme viscéral
EVA : Endoderme viscéral antérieur EVD : Endoderme viscéral distal FAK: focal adhesion kinase FBS: Fetal bovine serum FGF: fibrobloblast growth facor
FGFR: fibrobloblast growth facor receptor 2 FOS : FBJ osteosarcoma oncogene
GAB1: Growth factor receptor bound protein 2-associated protein 1 GATA4 : GATA binding protein 4
xiv
GCM1: Glial Cell Missing-1
GFAP : Glial fibrillary acidic protein GLUT1 : Glucose transporter 1
GRB2: Growth factor receptor bound protein 2 HB-EGF: Heparin binding EGF
HeLa : Henrietta Lacks
HIPK2: Homeodomain-interacting protein kinase 2 HuR : Hu-antigen R
IL-1: Interleukine 1
IMP : impedes mitogenic signal propagation
IQGAP1: IQ Motif Containing GTPase Activating Protein 1 ITGA4: Integrin alpha 4
JNK: c-Jun NH2-terminal kinase JUN: Jun proto-oncogene
K14Cre: Keratin14 Cre recombinase KSR1: Kinase suppressor of Ras 1
LAMP-1 : Lysosomal-associated membrane protein 1
LAMTOR : late endosomal/lysosomal adaptor, MAPK and MTOR activator LATS1/2 : Large tumour suppressor 1/2
LBP1A/UBP1A: Upstream binding protein 1a LIF: Leukaemia inhibitory factor
LIFR: Leukemia inhibitory factor receptor LPS : Lipopolysaccharide
MAP2 : Microtubule-associated protein 2 MAPK: Mitogen-activated protein kinase MAPKK: MAPK kinase
MAPKKK: MAPK kinase kinase MBP : Myelin basic protein
MCT1 : Monocarboxylic acid transporter 1 MEF : Mouse embryonic fibroblast MEK1/2: MAP kinase or ERK kinase 1/2 MEKK1: MEK kinase 1
MET: hepatocyte growth factor receptor
mLST8 : MTOR associated protein, LST8 homolog MORG1: MAPK Organizer-1
MP1: MEK Partner-1
MST1/2: Mammalian Ste20-like kinases ½ MTG: Multinucleated Trophoblastic Giant cell mTOR : mammalian target of rapamycin
xv
NBT : Nitro blue tetrazolium NF1 : Neurofibromatose de type 1 NGF: Neuronal Growth Factor NLK: Nemo-like kinase
OCT4: Octamer-binding transcription factor 4 PABP: poly(A)-binding protein
PAK: p21-activated kinases PBS: Phosphate buffered saline PDGF: Platelet-derived growth factor
PDGFR: Platelet Derived Growth Factor Receptor PFA: Paraformaldéhyde
PGl2 :Prostaglandine 2 PK: Protéinase K
PKCζ : Protein kinase C, zeta PP2A : Protein phosphatase 2A
PPARγ: Peroxisome proliferator activated receptor gamma PR: Progesteron Receptor
PTP: Protein tyrosine phosphatase
PTPN11 : Protein tyrosine phosphatase non-receptor type 11 RAF: v-raf-leukemia viral oncogene 1
Rag : Ras-related GTP-binding protein Rag: Ras-related GTP-binding protein
Raptor : regulatory-associated protein of mTOR RBP: RNA-binding protein
RCPGs: Récepteurs couplés aux protéines G RTK: Récepteurs tyrosine kinase
S6K1 : ribosomal protein S6 kinase, polypeptide 1 SAPK : Stress-Activated Protein Kinase
SAPK: Stress Activated MAP Kinase
SAV1: Sav family WW domain-containing protein 1 SH2 : Src homology domain 2
ShhCre: Sonic Hedgehog Cre recombinase
SHP2 : Src Homology 2 domain containing protein tyrosine phosphatase 2 SOS1: Son of sevenless homolog 1
SRE : Serum response element
S-TGC: Sinusoïdal trophoblastic mononuclear giant cell SynA-B: Syncytine A-B
SynTI – SynTII : Syncytiotrophoblastes de type I et II TAK1: TGF beta-activated kinase 1
TAZ: transcriptional co-activator with PDZ-binding motif TCF/LEF: T-cell factor/lymphoïd enhence factor
xvi
TCF: Ternary complex factors TE: Trophectoderme
TEAD4: TEA Domain Transcription Factor 4 TEF: Transcriptional enhancer factor TNF: tumor necrosis factor
TNFα: Tumor Necrosis Factor α TRE: TPA responsive element
ULK1: unc-51 like autophagy activating kinase 1 UTR: Untranslated region
VCAM1: Vascular Cell-Adhesion Molecule 1 VEGF: Vascular endothelial growth factor WD-40 :
WNT: Wingless-type MMTV integration site family YAP: Yes-associated protein
xvii
Remerciements
Le travail présenté dans cette thèse est le résultat de plusieurs années de recherche pendant lesquelles j’étais entourée de belles personnes.
J’aimerais tout d’abord remercier le Dr Jean Charron, qui, après quelques conversations téléphoniques et courriels échangés m’a accordée sa confiance et m’a permis de vivre cette grande aventure humaine et scientifique que de venir faire mon doctorat à Québec. Je me rappelle la première fois que l’on s’est rencontré en vrai, un 4 Janvier, Jean m’a regardée et m’a dit : « On ne va pas parler du projet de recherche. Tu ne vas pas survivre habillée comme ça, va t’acheter du linge et on reparle après ! » S’en est suivi un cours 101 sur comment s’habiller en hiver à Québec (le type de bottes à acheter etc…). Jean, en plus de vous assurer que je ne congèle pas sur place, vous m’avez appris la rigueur scientifique, l’importance des contrôles dans toutes les expériences et de toujours analyser ses résultats avec un regard critique. Vous m’avez appris à « mettre la ceinture, les bretelles et s’il le faut apporter un pantalon de rechange ! » Merci pour votre disponibilité, vos conseils et votre soutien tout au long de mon doctorat. Je tiens également à remercier la Dre Lucie Jeannotte, qui a aussi été présente tout au long de mon doctorat. Merci Lucie pour tes encouragements, tes conseils, ta franchise, les discussions que l’on a pu avoir autant sur les projets de recherche que sur la vie, l’avenir de la recherche, la politique, la musique, le dernier « feel good movie » que l’on a apprécié, la présence des femmes en recherche et nos recettes de saison. Merci pour l’intérêt sincère à mes projets de recherche, d’avoir laissé la place à l’enthousiasme et partagé mes excitations face à des résultats. Ton « c’est excitant ! » est très contagieux . Merci à vous deux, Jean et Lucie ! J’estime que vous m’avez apporté les outils nécessaires pour mon évolution personnelle dans la recherche.
Durant toutes ces années passées dans le laboratoire Charron, j’ai eu l’occasion de côtoyer des personnes formidables. Annie Maltais, qui m’a initiée aux prélèvements à E6.5 et E3.5 dès mon arrivée. J’ai développé grâce à toi des yeux bioniques capables de voir ces embryons qui font exprès de se cacher. Ton travail rigoureux et consciencieux m’a permis de bien commencer mes projets de recherche. Merci à Laurent Beuret, avec qui on n’était pas forcément d’accord sur tout mais avec qui on était capables d’avoir des conversations enflammées. Merci pour tes encouragements ! Merci à Julie Plante et Simon-Pierre Fortier-Beaulieu (ah ouain !), vous côtoyer a été une joie. Merci à Emilie Pic, dernière arrivée au labo. Même si on n’est pas toujours d’accord, le chocolat et le café nous rassemblent. Un grand merci du fond du cœur à Valérie Nadeau (aka ma brenda ou madame
xviii
placenta). Tu as été présente tout au long de mon doctorat et même après ton départ du labo. Tu es une scientifique hors pair et avec qui il est agréable de brasser des idées. Nos discussions « brain storm » m’ont beaucoup manquée après ton départ. Merci pour tes conseils, ta bonne humeur et ton humour.
J’aimerais remercier les membres actuels et passés de l’équipe Jeannotte. Merci à Olivier Boucherat et Florian Gotti. Merci à Pascale Ontchangalt (et Cyril Roblet) chez qui j’ai squatté pendant mes premières années et avec qui il est toujours agréable de passer des bons moments de rigolade. Merci à Felix-Antoine Bérubé-Simard (Toinou), ça a été un réal plaisir de te côtoyer, ça n’a pas été très difficile tu es une crème ! Un grand merci du fond du cœur à Kim Landry-Truchon et Nicolas Houde sans qui les deux dernières années auraient été bien plates. Merci pour votre bonne humeur, votre sensibilité, votre écoute et vos jokes (je ne pensais jamais remercier vos jokes plates !). Merci pour ce fameux mois de septembre 2014 pendant lequel la salle in vivo était notre maison et les outils de dissection nos doigts. Merci de m’avoir supportée pendant mon écriture. D’avoir su ne pas me parler parce que parfois ça fait autant de bien d’être entourée dans le silence ! Kim tu as été un super coach d’écriture, tes « GO GO GO TU ES CAPABLE !!!! » ont été super efficaces. Merci pour ces soirées macreuses-frites maison, chez Gaston ou chez Girard parce que #jspp ! J’aimerais remercier les membres du centre de recherche qui, a un moment donné dans mon doctorat, m’ont aidée et conseillée (Nourdine, Kevin, Clémence, Michel et Emmanuelle).
Cette grande aventure à Québec m’a permis d’apprendre beaucoup scientifiquement mais aussi humainement. Toute fraîchement débarquée avec une valise je me suis faite une nouvelle famille remplie de gens merveilleux. Je tiens à remercier toutes ces personnes qui font partie de ma deuxième famille sans qui ma santé mentale n’aurait peut être pas survécue. Merci à Flavia, tu as joué le rôle de sœur, mère, matante et amie ! Ta bonne humeur, ta joie et ton énergie ont toujours été contagieuses. Que ce soit pour le parté ou un souper tu es toujours partante (même si ça finit toujours par un souper suivie d’un parté !). On a construit au fil du temps une belle amitié. Grâce à toi j’ai pu jouer avec Pé Na Rua et frapper sur un tambour tout les mardis soir pour sortir le méchant. Merci à Josée. Tu es une personne entière et sincère, je suis contente que tu fasses partie de ma deuxième famille ! À deux on était peut être capable de suivre l’énergie de Flavia qui « a une vie réveillée très active ». Merci à ton petit Naoé qui, du haut de ses 3 ans, est capable de te mettre le sourire aux lèvres. Qui a les mêmes goûts musicaux que moi et avec qui il est toujours agréable de
xix
danser sur « Segnora chicheraaaaaa ». Merci à Rosalie, ma poète préférée. Même si je ne comprends pas tous tes poèmes, on s’est très vite comprises et une belle amitié est née ! Merci pour ta présence et ta sincérité. Tu as été une superbe coloc de jardin. Merci à Fabien et Anne pour votre disponibilité, votre joie et votre bonne humeur. Merci de nous accueillir pour un dimanche à Deschambault avec la duchesse. Je suis heureuse que vous fassiez partie de ma grande famille ! Merci à la belle gang de Pé Na Rua avec qui faire de la musique est très agréable. La bonne humeur et la joie vous caractérisent. Dans toutes les situations on n’en ressort que le bon, que ce soit à Saint-Tite ou à Québec. Merci particulièrement à Cyndie, Amy, Neto et Johanne. Merci à Guylaine et Bernard pour votre belle énergie et votre bonne humeur. Merci d’avoir lu et corrigé le premier jet de mon introduction. J’ai hâte de passer plus de temps avec vous. Merci à Justin et Geneviève avec qui j’ai passé de beaux moments en colocation. Merci Justutu pour nos sessions Dj à l’appart. Merci d’avoir été les gens chez qui je pouvais passer à l’improviste à 18h et m’inviter à souper (en plus de me nourrir au souper je repartais avec un lunch !). Merci pour votre présence et votre soutien ! Une autre personne qui m’a nourrie à l’improviste est Marie-Ève. Il a aussi été très agréable de faire de la radio avec toi ! Giramundo était toujours le fun avec ma co-animatrice préférée. Merci à Mathieu pour tes encouragements et tes petites tisanes « Rock that doc ». J’aimerais remercier Carole qui m’a aidée à gérer mon stress/eczéma avec ses conseils en plantes médicinales. Merci particulièrement à Marie, merci pour ta présence dans ma vie et dans ma nouvelle famille ! Merci pour nos discussions jusqu’à pas d’heure sur la recherche, la vie, la politique ou la dernière chanson d’afro-house. Merci d’avoir été présente pendant ma rédaction, grâce à toi j’ai pu me concentrer sur l’écriture ! Merci d’avoir rempli mon frigo, d’avoir fabriqué des petits plats et rempli mon congélateur. Je n’avais qu’à réchauffer (parfois tu les réchauffais pour moi…). MERCI ! Merci aussi à Katell et Stéphane qui se sont assurées que Marie fasse bien son travail d’aide à l’écriture. Merci aussi à Tomy, Rodolphe et Antje qui ont toujours su m’encourager. J’aimerais remercier mes amiEs outre atlantique qui malgré la distance m’ont toujours soutenue. Merci à Jacqueline, Christelle, Lucile, Max, Alice, Carole, Amadou, Laurent et Cybèle. Heureusement que skype existe
Je tiens à remercier ma famille qui n’est pas physiquement avec moi mais qui a toujours été présente. Merci à mes parents et à mes frères et sœurs, vous êtes la meilleure fraterie que l’on puisse avoir ! Vous avez toujours été là pour moi Ndami nagni chondé rrrraaa !!!! Merci à Hilma, la centrale, qui a toujours été la sœur qui rassemble tout le monde et qui, malgré les épreuves de la vie,
xx
est toujours présente pour nous tous ! Merci à Sahyat et Mariam my sisters from another mother and another father !!!
Durant toutes ces années j’ai acquis des connaissances mais j’ai surtout appris à me connaître. Connaître mes réactions face à des échecs, des déceptions et des succès. J’ai aussi appris à connaître mes limites et mes besoins. Mon entourage me dirait « tu les connais mais tu ne les écoute pas assez ! » C’est un peu vrai, mais j’apprends !
xxi
À mes grands-mères (coco wa Rifdat, coco mo ntsini na coco mo darini) « Fouwou dzima kali foussou nda » : « un seul ongle ne peut écraser un poux » signifie « on ne peut pas réussir seul »
1
Chapitre 1. Introduction
1.1 Le développement embryonnaire
Le développement embryonnaire décrit le processus qui permet de passer de l’ovocyte fécondé à l’embryon, du passage d’une cellule unique à un être pluricellulaire complexe. Certains l’expliquent par le « miracle de la vie », et j’aime à croire à ce miracle, mais j’aime par-dessus tout essayer de comprendre ce miracle.
La première étude scientifique sur l’embryogénèse a été publiée par Aristote, au IVème siècle av J-C, sous le titre De Generatione Animalium (De la génération des animaux). Divisée en cinq livres, cette étude décrit les caractéristiques générales de la reproduction des animaux (livre I), les modes de reproduction des vivipares et ovipares (livres II et III), la formation de l’embryon et la différenciation des sexes (livre IV) et les caractères congénitaux (livre V). Aristote distinguait deux entités dans sa conception de la reproduction : une matière fécondable et un moteur fécondant, qui sont représentés respectivement par la femelle et le mâle dans le processus de reproduction sexuée. L’observation de plusieurs animaux (poissons, reptiles, oiseaux (poules)) lui a permis de décrire le développement embryonnaire. La publication de cet ouvrage a permis de mettre en place un cadre de réflexion sur la reproduction et le développement embryonnaire, qui a servi par la suite de base aux scientifiques.
Au XVIIIème siècle, la théorie qui explique le développement embryonnaire est la théorie du préformationnisme. Selon cette théorie, le développement embryonnaire représenterait uniquement une expansion d’une miniature préexistante. Cet embryon miniature serait préformé dans l’œuf (selon les ovistes) ou dans le sperme (selon les animalculistes). Pierre Louis Moreau de Maupertuis réfute la théorie préformationniste par ses observations anatomiques ainsi que ses observations de transmission de caractères héréditaires correspondant aux traits parentaux (Emery 1988).
Depuis le XIXème siècle, des découvertes majeures ont permis de mieux comprendre le développement embryonnaire. Plusieurs modèles animaux ont été utilisés pour en définir les principales étapes. Parmi ces modèles, les plus marquants, en ce qui a trait au développement embryonnaire, sont le poulet, le xénope ainsi que le poisson-zèbre. La ponte extérieure, la taille de l’œuf, la culture de celui-ci à l’extérieur de l’organisme ainsi que la rapidité des étapes du développement ont facilité l’observation morphologique du développement. Ces trois modèles ont
2
permis une accumulation de connaissances du développement morphologique et des processus cellulaires et moléculaires impliqués.
La souris, laquelle partage 99 % de son génome avec l’Homme et dont le développement de l’embryon est interne, présente un placenta et une gestation courte. Elle constitue un modèle de mammifère idéal pour l’étude du développement embryonnaire.
1.1.1 De la fertilisation au stade blastocyste : la préimplantation
La fertilisation est le moment de fusion des deux gamètes, le spermatozoïde et l’ovocyte, et de la génération du zygote. Pour que la fertilisation ait lieu, le spermatozoïde doit tout d’abord subir une étape de capacitation permettant son activation avant qu’il entre en contact avec l’ovule. Une fois que celui-ci a atteint la surface de l’ovule, il peut y avoir fusion. La fusion entre le spermatozoïde et l’ovule est propre à l’espèce et se fait via la glycoprotéine ZP3 (Zona Pellucida 3). La liaison du spermatozoïde à ZP3 permet la réaction acrosomale, induit l’exocytose et ainsi la fertilisation de l’ovocyte (Wassarman et al. 2008). L’entrée du spermatozoïde dans l’ovocyte active la fin de la méiose et la production du deuxième corps polaire.
Vingt-quatre heures après la fertilisation, vont se produire les premières divisions cellulaires. C’est durant ces premières étapes de division cellulaire qu’a lieu, chez la souris, l’activation du génome zygotique précédée par la dégradation de la plupart des ARNs maternels présents dans l’œuf (Li et al. 2013). Les premières divisions vont produire un nombre croissant de cellules appelées blastomères, sans augmentation de la taille de l’embryon jusqu’au stade 8 cellules. À ce stade, l’embryon est appelé morula, en raison de sa ressemblance avec une mûre. À partir du stade morula, l’embryon va subir des changements morphologiques menant à l’établissement et à l’augmentation des adhésions intercellulaires causant la compaction de l’embryon (Figure 1.1A). Durant la compaction, en plus des adhésions intercellulaires, les cellules de l’embryon vont subir une polarisation apico-basale. Au pôle extérieur, les cellules en surface présentent des microvilli et au pôle intérieur, les cellules présentent une surface lisse. Il a été montré que la présence de E-cadhérine et d’ions Ca2+ est essentielle au maintien de la compaction. En effet, les souris invalidées pour le gène codant pour E-cadhérine compactent normalement au stade 8 cellules, en raison de la présence de E-cadhérine maternelle, mais subissent une décompaction peu après et perdent leur polarisation cellulaire (Larue et al. 1994; Riethmacher et al. 1995).
3
Au stade 8 cellules, l’embryon est compact et polarisé. Il va, par la suite, subir deux divisions cellulaires qui vont mener aux stades 16 et 32 cellules. Durant ces divisions, la polarité des cellules va dépendre du plan de division du blastomère. En effet, si celui-ci est parallèle à l’axe intérieur-extérieur de l’embryon, la division va générer deux cellules filles à l’intérieur-extérieur, qui seront polarisées, c’est ce qu’on appelle la division préclinale. Par contre, si le plan de division du blastomère est perpendiculaire à l’axe intérieur-extérieur de l’embryon, la division va générer une cellule fille polarisée -à l’extérieur- et une cellule fille non polarisée -à l’intérieur-. C’est ce qu’on appelle la division anticlinale. Ces divisions cellulaires vont mener à une organisation polarisée de l’embryon avec deux populations de cellules : des cellules externes polarisées et des cellules internes non polarisées (Figure 1.1B) (Sutherland et al. 1990).
À partir du stade 32 cellules, l’embryon acquiert sa première identité cellulaire : l’identité de cellules trophoblastiques ou cellules du trophectoderme (TE). Les cellules du TE sont caractérisées par leur position à l’extérieur de l’embryon ainsi que par leur état polarisé. Les cellules trophoblastiques vont contribuer uniquement à la formation du placenta. Deux modèles sont décrits pour expliquer cette acquisition d’identité. Le modèle « intérieur-extérieur », aussi appelé modèle positionnel, et le modèle de polarité. Le modèle positionnel, premier modèle décrit par Tarkowski, A.K et Wroblewska, J en 1967, suggère que le devenir des cellules est déterminé par la position des cellules dans l’embryon (Tarkowski et al. 1967). Les cellules à l’extérieur vont devenir des cellules du trophectoderme (TE) tandis que les cellules à l’intérieur de l’embryon vont devenir des cellules de la masse interne (CMI). Ces cellules vont contribuer à la formation de l’embryon ainsi qu’a des lignées extraembryonnaires. Cette hypothèse a été vérifiée par l’équipe de Tarkowski en 2008. En effet, en faisant des expériences de réagrégation forcée de blastomères (extérieurs, intérieurs ou d’un mélange) issus d’embryons 16 cellules ou 32 cellules, les auteurs ont montré que, dans l’embryon reconstitué, les blastomères réajustent leur devenir selon leur position (extérieur : TE, intérieur : CMI) (Suwinska et al. 2008). Cette étude suggère que le devenir des cellules dépend de leur position dans l’embryon.
Le second modèle proposé pour expliquer l’acquisition d’identité des cellules de l’embryon est le modèle de polarité. Selon ce modèle, la polarité des blastomères définit leur devenir. Le devenir des cellules TE serait donc défini au stade 8 cellules lorsqu’a lieu la polarisation épithéliale des blastomères. Ainsi, lors des divisions cellulaires subséquentes, la transmission de l’état de polarisation se fait selon le plan de division cellulaire du stade 8 cellules au stade 16 cellules
4
Figure 1.1 : Représentation schématique des stades de préimplantation : de la fertilisation au stade blastocyste
(A) Premières étapes de développement. Après la fécondation, le zygote connait ses premières
divisions cellulaires, jusqu’au stade 8 cellules. L’embryon va ensuite se compacter et se polariser. (B) Lorsque l’embryon se divise passant du stade 8 cellules au stade 16 cellules, les blastomères, dont l’axe de division est parallèle à l’axe intérieur-extérieur génèrent deux cellules filles extérieures, polarisées. Les blastomères dont l’axe de division est perpendiculaire à l’axe intérieur-extérieur génèrent une cellule fille extérieure polarisée et une celllule fille intérieure non polarisée. (C) Au stade 32 cellules, les blastomères acquièrent une identités trophectoderme (TE) en exprimant le gène Cdx2 ou une identité masse interne cellulaire (CMI) exprimant le gène Oct4. Ces deux facteurs exercent un rôle antagoniste. (D) Au stade E3.5, les CMI se différencient en épiblaste (EPI) donnant naissance aux cellules de l’embryon et à l’endoderme primitif (EP), ce dernier étant à l’origine du sac vitellin. Les cellules de l’EPI expriment le facteur Nanog, alors que les cellules de l’EP expriment le facteur Gata4. (E) Interaction des gènes impliqués dans la différenciation de l’endoderme primitif et de l’épiblaste.
6
(Figure1.1B). Les blastomères extérieurs, polarisés, acquièrent l’identité TE, alors que les blastomères intérieurs, non polarisés, acquièrent l’identité CMI (Johnson et al. 1981).
Que ce soit dans le modèle positionnel ou dans le modèle de polarité, les facteurs qui contrôlent l’acquisition de l’identité TE ou CMI sont les facteurs de transcription dont l’expression est restreinte et associée au TE ou au CMI.
Plusieurs facteurs dont l’expression est associée à la ségrégation TE/CMI ont été mis en évidence. Par exemple, l’expression du gène Cdx2 (Caudal type homeobox 2) est restreinte aux cellules du TE dès le stade 32 cellules alors que l’expression des gènes Oct4 (Octamer-binding transcription factor 4) et Nanog est limitée aux CMI (Nichols et al. 1998; Mitsui et al. 2003). Il a été montré qu’au moment de la polarisation cellulaire (entre le stade 8 cellules et le stade 16 cellules) les cellules extérieures expriment plus fortement le gène Cdx2 alors que les cellules intérieures expriment plus fortement le gène Oct4 (Figure 1.1C). Strumpf et ses collaborateurs ont démontré, en 2005, que l’expression du gène Cdx2 est nécessaire et suffisante pour donner l’identité TE. En effet, les embryons Cdx2-/- meurent avant l’implantation et présentent une perte de l’intégrité épithéliale ainsi qu’une perte de l’identité TE, marquée par l’expression des gènes Oct4 et Nanog dans les cellules du TE. Cependant, dans des embryons Cdx2+/+, l’expression de Oct4 et Nanog est restreinte aux CMI (Strumpf et al. 2005). Par ailleurs, les embryons Oct4-/- meurent après l’implantation et ne présentent pas de dérivés des CMI (épiblaste et sac vitellin) indiquant que le gène Oct4 est essentiel pour le maintien des cellules ES (Nichols et al. 1998). Une analyse plus poussée de la régulation des gènes Cdx2 et Oct4 a montré que ces gènes sont capables de réguler leur propre expression (Xu et al. 1999; Okumura-Nakanishi et al. 2005). Niwa et ses collaborateurs ont montrés, via des analyses d’immunoprécipitation de la chromatine et d’immunoprécipitation, que Cdx2 régule l’expression d’Oct4 et inversement. En effet, la surexpression de Cdx2 dans des cellules ES entraine l’inhibition de l’expression d’Oct4 et la réduction de l’expression d’Oct4 entraine une augmentation de l’expression de Cdx2 (Niwa et al. 2000; Niwa et al. 2005). Ainsi, l’antagonisme mutuel entre Cdx2 et Oct4 serait responsable de la ségrégation de leurs domaines d’expression, menant à l’expression d’Oct4 dans les CMI ainsi que l’expression de Cdx2 dans les cellules du TE.
Deux équipes ont indépendamment mis en évidence le facteur de transcription de la famille TEAD/TEF, TEAD4, comme étant essentiel à la mise en place de l’identité TE, en régulant l’expression du gène Cdx2 (Yagi et al. 2007; Nishioka et al. 2008). Sachant que l’expression de Tead4 n’est pas restreinte aux cellules du TE, son rôle spécifique dans ces cellules a été mis en
7
évidence par Nishioka et ses collaborateurs en 2009. En effet, ces auteurs ont montré que dans l’embryon le co-activateur de TEAD4, YAP, est localisé dans le noyau des cellules à l’extérieur de l’embryon, alors qu’il est localisé dans le cytoplasme des cellules à l’intérieur de l’embryon. YAP est un membre de la voie de signalisation Hippo qui a été découverte par des études chez la drosophile (Huang et al. 2005). Plusieurs membres de cette voie sont conservés de la drosophile aux mammifères. La dérégulation de la voie Hippo conduit à des défauts de développements majeurs, tels qu’une mortalité embryonnaire ainsi que des anomalies de croissance des organes (Halder et al. 2011). La voie Hippo peut être divisée en trois composants majeurs : 1-Les modulateurs en amont (le contact cellulaire par l’intermédiaire de E-cadhérine (Kim et al. 2011)). 2-Les kinases (MST1/2 et LATS1/2) ainsi que leurs cofacteurs respectifs (SAV1 et MOB1A/B). 3-Les facteurs de transcription (TEAD1-4) et leurs co-activateurs transcriptionnels (YAP et TAZ) (Figure 1.2A).
L’ensemble des ces données suggère que, dans les cellules extérieures de l’embryon, la voie de signalisation Hippo est inactive et les kinases LATS1/2 ne phosphorylent pas YAP, permettant ainsi sa localisation nucléaire et son action comme co-activateur de TEAD4 menant ainsi à l’activation de la transcription du gène Cdx2. Par contre, dans les cellules à l’intérieur de l’embryon, la voie de signalisation Hippo est active, permettant aux kinases LATS1/2 de phosphoryler YAP, entraînant sa séquestration dans le cytoplasme via le complexe 14.3.3. Conséquemment, l’expression du gène Cdx2 n’est pas activée dans les cellules internes de l’embryon (Nishioka et al. 2009).
Sachant que le contact cellulaire influence l’activation de la voie de signalisation Hippo, ces données suggèrent que, dans les CMI, la proximité des cellules augmente la densité cellulaire ainsi que le contact cellule-cellule permettant ainsi l’activation de la voie Hippo et la séquestration de YAP dans le cytoplasme. Par contre, dans les cellules du TE, la densité cellulaire ainsi que les contacts cellule-cellule sont diminués, ce qui empêche l’activation de la voie Hippo. YAP est alors capable de transloquer au noyau et d’activer, avec TEAD4, la transcription de Cdx2 (Figure 1.2B).
Au stade 32 cellules, au moment où les cellules acquièrent leur identité TE, l’embryon subit ses premiers changements morphologiques, un processus appelé cavitation. La cavitation correspond à la formation du blastocœle. Au stade morula tardif, il y a formation d’une cavité qui se remplit progressivement d’un liquide aqueux et forme le blastocœle. Cette entrée d’eau dans l’embryon est due à un gradient osmotique formé par une pompe ATPase Na+/K+ entraînant une accumulation de Na+ du côté baso-latéral du TE (Watson et al. 2004). Dès que le blastocœle
8
Figure 1.2 : La voie de signalisation Hippo et son implication dans la différenciation au stade pré-implantation
(A) La voie Hippo est activée entre autres par l’adhésion cellulaire médiée par E-cadhérine. Cette
activation entraine la phosphorylation de YAP par les kinases successives MTS1/2 et LATS1/2. YAP phosphorylé est séquestré dans le cytoplasme. L’absence de YAP dans le noyau ne lui permet pas de jouer son rôle de co-activateur de la transcription avec le facteur TEAD1/4. L’activation de la voie Hippo diminue l’activité transcriptionnelle de TEAD1/4 (panneau de gauche). En revanche l’inactivation de la voie Hippo en traine une translocation de YAP au noyau et induit l’expression des gènes cibles (panneau de droite). (B) Dans les cellules à l’extérieur (cellules du TE), l’adhésion cellulaire est peu fréquente, ce qui empêche l’activation de la voie Hippo et entraine l’expression du gène Cdx2, cible du facteur de transcription Tead1/4. Par ailleurs, dans les cellules internes (CMI) l’adhésion cellulaire est plus fréquente entrainant l’activation de la voie Hippo et l’inhibition de l’expression du gène Cdx2.
10
commence à se former, son maintien est facilité par le caractère épithélial du TE, notamment par les jonctions serrées. À 3,5 jours après la fertilisation (E3.5), avec la formation du blastocœle, l’embryon est alors considéré comme blastocyste.
Au stade blastocyste se produit la deuxième différenciation cellulaire. Les CMI vont se différencier en deux types cellulaires : les cellules de l’épiblaste (EPI), qui vont donner naissance aux cellules de l’embryon ainsi qu’au mésoderme allantoique, et les cellules de l’endoderme primitif (EP), qui vont donner naissance, conjointement aux cellules du TE, aux structures extraembryonnaire. L’EP se juxtapose au blastocœle et l’EPI se trouve entre l’EP et le TE (Figure 1.1D). Les cellules de L’EP vont exprimer le gène Gata6, alors que les cellules de l’EPI vont exprimer le gène Nanog. Plusieurs études montrent que le récepteur tyrosine kinase du fibroblast growth factor (FGF) FGFR2 est requis pour l’expression de Gata4 dans l’EP. En effet, les souris invalidées pour les gènes Fgf4 et Fgfr2 ne développent pas d’EP (Feldman et al. 1995; Wilder et al. 1997; Arman et al. 1998). Chazaud et collaborateurs ont montré que l’expression de Nanog et Gata6 est hétérogène et complémentaire dans les CMI du blastocyste à E3.5, sans aucune spécificité positionnelle. De plus, ces auteurs ont montré que la signalisation via Grb2 est requise pour la ségrégation de ces cellules progénitrices car les embryons Grb2-/- ne génèrent pas de cellules de l’EP et toutes les CMI de ces embryons ont un devenir EPI avec une expression du gène Nanog (Chazaud et al. 2006). L’invalidation du gène Nanog a permis de mettre en évidence l’importance de ce facteur pour la mise en place de l’EP ainsi que pour l’EPI. En effet, les embryons Nanog-/- ne développent ni EPI ni EP (Mitsui et al. 2003). Ces données suggèrent qu’en plus de permettre l’identité EPI, des cellules de l’EPI exprimant le facteur Nanog sécrètent un facteur permettant l’expression de Gata4 dans les cellules de l’EP. Ce facteur serait le produit du gène Fgf4. FGF4 serait sécrété par les cellules de l’EPI, qui sont Nanog+, et il agirait via le récepteur FGFR2 exprimé sur les cellules de l’EP qui sont Gata4+ (Goldin et al. 2003). Ainsi l’initiation de la différenciation vers l’EPI ou l’EP serait dépendante de la voie FGF/MAP Kinase (Yamanaka et al. 2010) (Figure 1.1E).
Au stade blastocyste tardif, on distingue donc trois lignées cellulaires qui sont l’épiblaste (EPI), qui permet la mise en place des tissus embryonnaires, le trophectoderme (TE) qui permet la mise en place du placenta et l’endoderme primitif (EP), qui permet la mise en place du sac vitellin. À partir de ce stade, l’embryon subit des changements morphologiques majeurs qui faciliteront sa synchronisation avec l’utérus, permettant une bonne implantation.
11
1.1.2 L’implantation
L’implantation est une étape du développement spécifique aux mammifères placentaires. Elle correspond au moment de nidation où l’embryon et l’utérus fusionnent. L’implantation peut se résumer en trois étapes : 1-Une maturation coordonnée entre le blastocyste et l’endomètre utérin, 2-l’attachement du blastocyste et 3-l’invasion du tissu maternel par le trophectoderme (la déciduation) (Figure 1.3A).
L’utérus passe d’un état pré-réceptif à un état réceptif permettant l’implantation du blastocyste et la communication blastocyste-utérus : c’est la fenêtre d’implantation. Ce changement d’état de réceptivité de l’utérus est régi par les hormones ovariennes : la progestérone (P4) ainsi que l’œstrogène (E2). Chez la souris, il existe deux isoformes du récepteur à l’œstrogène (ESR1 (ERα) et ESR2 (ERβ) et à la progestérone (PGRA et PGRB). Les études des souris invalidées pour chacune des isoformes ont permis de mettre en évidence la fonction spécifique de chacune. En effet, les souris invalidées pour le gène Esr1 présentent un utérus hypoplasique et incapable de supporter l’implantation tandis que l’invalidation du gène Esr2 permet de supporter l’implantation (Lubahn et al. 1993). En outre, l’invalidation du gène Pgr chez la souris entraîne la perte des deux isoformes du récepteur à la progestérone et l’apparition de défauts utérins majeurs menant à l’infertilité (Lydon et al. 1995). Ces observations indiquent un rôle essentiel de ces deux isoformes à l’action de la progestérone sur l’utérus (Mulac-Jericevic et al. 2000). Un des intermédiaires de l’action de l’œstrogène sur la fenêtre d’implantation est la cytokine de la famille interleukin-6 : LIF (Leukaemia inhibitory factor). La cytokine LIF est nécessaire à la réceptivité utérine ainsi qu’à l’implantation puisqu’un utérus dépourvu de LIF ne permet pas l’implantation (Stewart et al. 1992). Des données suggèrent que la cytokine LIF régule l’expression du récepteur de EGF, HB-EGF (Heparin binding EGF). En effet, les souris Lif-/- n’expriment pas HB-EGF et ont une expression aberrante de COX2 (Cyclooxygenase 2), l’un des effecteurs de HB-EGF (Song et al. 2000). Il a été montré que la synthèse de prostaglandine (PGl2) est régulée par Cox2 et est indispensable pour l’implantation par son action sur le gène Pparγ (Lim et al. 1999) (Figure 1.3B). La voie de signalisation permettant une coordination optimale entre l’embryon et l’utérus est la voie Wnt/β-caténine. Cette voie est activée au site d’implantation et son activation requiert la présence de l’embryon ainsi que des hormones ovariennes. Enfin, la cytokine LIF est essentielle à l’activation de la voie Wnt (Mohamed et al. 2005). Ainsi, pour que l’implantation ait lieu, plusieurs facteurs sont impliqués : les hormones ovariennes, les cytokines ainsi que la voie de signalisation canonique Wnt/β-caténine.
12
Figure 1.3 : Illustration de l’implantation et des mécanismes impliqués
(A) Après la fécondation, l’œuf commence ses premières divisions cellulaires et se déplace pour
atteindre l’utérus. Pour que l’implantation ait lieu l’œuf et l’utérus doivent avoir une maturation coordonnée : l’utérus passe d’un état pré-réceptif à un état réceptif alors que l’œuf éclot de la zone pellucide. Le blastocyste peut alors s’attacher à l’utérus ce qui active la déciduation. (B) Régulation de la fenêtre d’implantation par les hormones ovariennes ainsi que par la cytokine LIF.
14
Pendant que l’utérus devient réceptif permettant une implantation optimale, le blastocyste « s’active ». Cette étape commence par son éclosion de la zona pellucida. Une fois qu’il est éclos, on distingue dans le blastocyste : l’épiblaste, l’endoderme primitif, le trophectoderme polaire (le plus proche des CMI) et le trophectoderme mural (le plus éloigné des CMI) (Figure 1.3B). Le trophectoderme polaire continue de proliférer et engendre l’ectoderme extraembryonnaire et le cône ecto-placentaire, tandis que le trophectoderme mural cesse de proliférer mais continue à répliquer son ADN (endoréplication) et devient polyploïde générant les cellules trophoblastiques géantes primaires (Figure 1.4). Les cellules épithéliales du trophectoderme vont exprimer des molécules adhésives comme les lectines et subir des changements morphologiques menant à l’apparition de protusions apicales au trophectoderme mural, ce qui permet le ralentissement du blastocyste à son arrivée au site d’implantation dans l’utérus. Chez la souris, le blastocyste s’attache du côté du trophectoderme mural. Lorsque le blastocyste est attaché au site d’implantation, les parois de l’utérus se rapprochent. Les cellules du stroma utérin sont stimulées, prolifèrent et se différencient en une structure appelée la décidua. Les cellules de l’épithélium utérin meurent par apoptose, la lame basale est détruite et les cellules du trophoblaste envahissent le stroma utérin. L’implantation terminée (à E5.5), on distingue quatre éléments qui constituent l’embryon : le cône ectoplacentaire (CEP), l’ectoderme extraembryonnaire (EEx), l’épiblaste (Epi) (aussi appelé ectoderme primitif) et l’endoderme viscéral (EV), entouré par les cellules trophoblastiques géantes (Figure 1.4).
1.1.3 La gastrulation
Quelque soit l’organisme, la gastrulation mène à l’émergence du plan corporel ainsi que la mise en place des trois feuillets embryonnaires : l’endoderme, l’ectoderme et le mésoderme. Les cellules de chacun de ces trois feuillets vont donner naissance à des organes, des structures et des systèmes spécifiques présents chez l’individu adulte. L’ectoderme est le feuillet extérieur de l’embryon en développement et donne la portion extérieure de la peau, les oreilles, les poils ainsi que le système nerveux. L’endoderme est le feuillet interne qui donne l’épithélium pulmonaire, et celui des organes digestifs, du foie et du pancréas. Le mésoderme est le feuillet intermédiaire qui se trouve entre l’ectoderme et l’endoderme. Le mésoderme donne naissance à tout ce qui se trouve entre la peau et l’épithélium, à savoir les os, le cartilage, les trois types de muscles (muscle cardiaque, muscles lisses et muscles squelettiques), l’appareil cardio-vasculaire et l’appareil reproducteur.
15
Au début de la gastrulation, l’embryon est formé de trois couches cellulaires distinctes : l’épiblaste (Epi), l’endoderme viscéral et pariétal (EV), qui enveloppe l’embryon, et le trophectoderme (constitué de l’ectoderme extraembryonnaire et du cône ectoplacentaire). Les cellules de l’épiblaste ont un fort taux de prolifération comparativement aux cellules de l’endoderme viscéral. Cette prolifération mène à la formation de l’embryon en « egg cylinder ». À E6.0, on distingue l’axe proximo-distal. Du côté distal de l’embryon, les cellules de l’endoderme viscéral distal (EVD) vont se séparer et migrer vers le futur côté antérieur de l’embryon formant ainsi l’endoderme viscéral antérieur (EVA) (Figure 1.4). Ces cellules vont se différencier de l’endoderme viscéral car elles expriment le facteur Hex1. Les voies de signalisation NODAL, BMP et WNT sont impliquées dans la formation ainsi que le mouvement des cellules de l’EVD (Rossant et al. 2009). À E6.5, un bris localisé va se produire à la jonction de l’ectoderme extraembryonnaire et de l’épiblaste. Ce bris détermine le côté postérieur de l’embryon. Au niveau du bris, les cellules de l’épiblaste vont se délaminer et la région où les cellules se délaminent est appelée ligne primitive (Figure 1.4). La ligne primitive est marquée par l’expression des gènes Brachyury, Nodal ainsi que Wnt3. Ce sont trois facteurs dont l’expression est inhibée dans l’EVA. Une fois la ligne primitive formée, les cellules délaminées vont migrer le long de l’épiblaste et former le mésoderme, entre l’épiblaste et l’endoderme viscéral.
La gastrulation se poursuit avec la formation du nœud ainsi que la mise en place de la notochorde.
1.2 Le développement du tissu extraembryonnaire : le placenta
Le placenta est le premier organe qui se forme pendant le développement. C’est un organe qui constitue l’interface entre l’environnement maternel et l’environnement fœtal. Il est essentiel pour la survie de l’embryon car il permet les échanges de nutriments, de gaz ainsi que de déchets entre l’embryon et la mère. C’est un organe producteur d’hormones qui fournit une barrière hémato-placentaire qui protège le fœtus contre le système immunitaire maternel (Rawn et al. 2008). Le placenta est un organe dont l’origine est multiple. Les cellules qui constituent principalement le placenta sont d’origine trophoblastique. La lignée trophoblastique est la première lignée cellulaire à se différencier pendant les stades précoces du développement.
Au jour E7.5, pendant que le développement se poursuit, les cellules de l’ectoderme extraembryonnaire vont former l’épithélium chorionique et les cellules du mésoderme vont donner lieu à l’allantoïde (Figure 1.5A). Chez les rongeurs, la zone d’échanges entre les circulations
16
Figure 1.4 : Représentation schématique du développement des tissus embryonnaires de l’implantation à la gastrulation
Une fois que l’embryon a éclos de la zone pellucide (E4.5) on distingue l’épiblaste (Epi), l’endoderme primitif (EP), le trophectoderme polaire (TEP) (le plus proche des CMI) et le trophectoderme mural (TEM) (le plus éloigné des CMI). Une fois l’implantation terminée (à E5.5), on distingue quatre éléments qui constituent l’embryon : le cône ectoplacentaire (CEP), l’ectoderme extraembryonnaire (EEx), l’épiblaste (Epi) (aussi appelé ectoderme primitif) et l’endoderme viscéral (EV), entouré par les cellules trophoblastiques géantes. À E6.0, on distingue l’axe proximo-distal. Du côté distal de l’embryon, les cellules de l’endoderme viscéral distal (EVD) vont se distinguer et migrer vers le futur côté antérieur de l’embryon et former ainsi l’endoderme viscéral antérieur (EVA). À E6.5, c’est le début de la gastrulation et on distingue la ligne primitive qui commence à se délaminer.
18
Figure 1.5 : De la gastrulation au développement du placenta
(A) À E7.5 pendant que le développement embryonnaire se poursuit, les cellules de l’ectoderme
extraembryonnaire vont produire le chorion alors que les cellules du mésoderme vont générer l’allantoïde. (B) À E8.5, l’allantoïde fusionne avec le chorion et continue sa ramification dans le chorion. (C) Plusieurs gènes sont impliqués dans les étapes majeures de développement du placenta. Les gènes Vcam (Vascular Cell-Adhesion Molecule 1) ainsi que Itga4 (Integrin alpha4) sont impliqué dans la fusion chorio-allantoïde. Le gène Gcm1 (Glial Cell Missing-1) a un rôle prédominant dans l’initiation de la ramification du labyrinthe. La voie de signalisation ERK/MAPK est essentielle pour la ramification du labyrinthe.