Badji Mokhtar –Annaba University
ﺔـﺑﺎﻨﻋ ﺭﺎــﺘﺨﻣ ﻲـــﺟﺎﺑ ﺔـــﻌﻣﺎﺟ
Université Badji-Mokhtar, AnnabaLaboratoire d’Ecobiologie des Milieux Marins et Littoraux
Faculté des Sciences
Département des sciences de la mer
Année 2005
Mémoire
Présenté en vue de l’obtention du diplôme de Magister en Sciences de la Mer
LES PEUPLEMENTS DE CYANOBACTERIES DE DEUX
PLANS D'EAU DOUCE
(LAC OUBEÏRA, LAC TONGA)
INVENTAIRE ET DYNAMIQUE SPATIOTEMPORELLE
Option :
Biologie et physiologie des organismes marins
Présenté par :
BENSAFIA NABILA
Devant le jury :PRESIDENT : BENYACOUB S. (Professeur, Univ. Annaba)
PROMOTEUR : BENSOUILAH M. (Professeur, Univ. Annaba)
EXAMINATEUR : DJEBAR A.B. (Professeur, Univ. Annaba)
Remerciements
Dans un premier temps, je voudrais remercier Monsieur le
Professeur BENSOUILAH pour m’avoir diriger tout au long de la
réalisation de ce travail. Sa grande rigueur scientifique et son
indéfectible passion pour la science ont été une inspiration pour moi.
Je remercie Monsieur le Professeur BENYACOUB pour avoir
accepter de présider le jury de mon travail.
Je tiens à exprimer mes remerciements à :
Monsieur le Professeur TAHAR Ali pour son aide précieuse
dans le traitement des analyses statistiques des données.
Monsieur le Professeur DJEBAR A.B pour son amabilité en
acceptant de faire part de ce jury.
Mes remerciements vont aussi à Monsieur CHAIBI R pour
son aide dans la réalisation de ce travail.
Je tiens à exprimer toute ma gratitude à mon mari Riad pour
son aide précieuse sur le terrain, son soutien et son encouragement
tout au long de mon cheminement.
J’exprime aussi ma profonde gratitude à tout le personnel de
l’ONDPA, El-Kala, l’équipe du laboratoire de recherche EMMAL
ainsi que l’équipe du groupe UNION INFO, ma famille et mes amis
d’avoir été là pour me soutenir.
Résumé:
Cette étude porte sur l'inventaire des cyanobactéries, la détermination des caractéristiques physicochimiques et l’évaluation du niveau d’eutrophisation deux plans d'eau douce «les lacs Oubeïra et Tonga» situés dans l'extrême Nord-Est algérien, de leurs écosystèmes.
Les résultats des mesures des paramètres physicochimiques de l’eau montrent des variations saisonnières.
Les teneurs en chlorophylle a et les valeurs de la transparence indiquent que le lac Oubeïra se situe dans la catégorie eutrophe à hypereutrophe en fonction des saisons.
L'observation des caractères morpho-anatomiques des cyanobactéries récoltées nous a permis de recenser 16 genres: (Microcystis*, Synechocystis*, Anabaena*, Cylindrospermum*,
Aphanizomenon*, Pseudoanabaena*, Oscillatoria*, Gomphosphaeria*, Spirulina, Lyngbya*, Gloeocapsa, Merismopedia*, Phormidium, Synechococcus Chroococcus, Anabaenopsis*).
C'est le lac Oubeïra qui abrite la communauté microalgale la plus importante et la plus diversifiée; ces deux plans d'eau douce présentent, néanmoins, une structure microalgale de base composée d'une dizaine de genres dont la majorité est reconnue potentiellement toxique.
Le suivi de l'évolution des densités microalgales montre que les densités les plus
élevées sont enregistrées en automne dans le lac Oubeïra avec la prédominance du genre
Aphanizomenon, et en été dans le lac Tonga avec la prédominance du genre Oscillatoria.
L'analyse de la variance à un critère de classification (AV1) montre l'existence de différences très hautement significatives entre les deux lacs pour la majorité des variables.
Summary:
This study relates to the inventory of the cyanobacteries, the determination of the physico-chemical characteristics and the evaluation of the level of eutrophication two soft water levels "the lakes Oubeïra and Tonga" located in the extreme Algerian North-East, their ecosystems.
The results of measurements of the physico-chemical parameters of water show seasonal variations.
The contents chlorophyl a and the values of the transparency indicate that the lake Oubeïra is located in the eutrophic category at hypereutrophe according to the seasons.
The observation of the morpho-anatomical characters of the collected cyanobacteries enabled us to count 16 kinds:(Microcystis*, Synechocystis*, Anabaena*, Cylindrospermum*,
Aphanizomenon*, Pseudoanabaena*, Oscillatoria, Gomphosphaeria*, Spirulina, Lyngbya*, Gloeocapsa, Merismopedia*, Phormidium, Synechococcus Chroococcus, Anabaenopsis*).
It is the lake Oubeïra which shelters the most significant community microalgale and the most diversified; these two soft water levels present, nevertheless, a structure basic microalgale made up of ten kinds whose majority is recognized potentially toxic.
The follow-up of the evolution of the densities microalgales shows that the highest densities are recorded in autumn in the lake Oubeïra with the prevalence of the Aphanizomenon kind, and in summer in the lake Tonga with the prevalence of the Oscillatoria kind.
The analysis of the variance to a criterion of classification (AV1) shows the existence of significant differences between the two lakes for the majority of the variables.
ﺦﻠﻣ
ــــ
ﺹ
ـﻟﺍ ﺩﺭﺟ ﻭﻫ ﺔﺳﺍﺭﺩﻟﺍ ﻩﺫﻫ ﻥﻣ ﻑﺩﻬﻟﺍ
Cyanobactérie
ﻡﻳﻳﻘﺗﻭ ﺔﻳﺋﺎﻳﻣﻳﻛﻭﻳﺯﻳﻔﻟﺍ ﺎﻬﺻﺋﺎﺻﺧ ﺔﻓﺭﻌﻣﻭ
ﻯﻭﺗﺳﻣ
Eutrophisation
ﻕﺭﺷ ﻝﺎﻣﺷ ﻰﺻﻗﺃ ﻲﻓ ﻥﺎﻌﻘﺗ ﻥﺎﺗﻠﻟﺍ ﺎﻘﻧﻭﻁﻭ ﺓﺭﻳﺑﻭﺃ ﺓﺭﻳﺣﺑ :ﻲﺋﺎﻣ ﺢﻁﺳﻣ ﻲﻓ
.
ﺭﺋﺍﺯﺟﻟﺍ
ﺔﻣﻳﻗ ﻭﺃ ﻝﻳﻓﻭﺭﻭﻠﻛﻟﺍ ﺔﺑﺳﻧﻓ ،ﺔﻳﻠﺻﻓ ﺕﺍﺭﻳﻐﺗ ءﺎﻣﻠﻟ ﺔﻳﺋﺎﻳﻣﻳﻛﻭﻳﺯﻳﻔﻟﺍ ﺹﺋﺎﺻﺧﻟﺍ ﺱﺎﻳﻗ ﺞﺋﺎﺗﻧ ﻥﻳﺑﺗ
ﺔﺟﺭﺩ ﻥﻣﺿ ﻑﻧﺻﺗ "ﺓﺭﻳﺑﻭﺃ" ﺓﺭﻳﺣﺑ ﻥﺃ ﺭﻳﺷﺗ ﺔﻳﻓﺎﻔﺷﻟﺍ
Eutrophe
ﻰﻟﺇ
Hypereutrophe
ﺏﺳﺣ
.
ﻝﻭﺻﻔﻟﺍ
ﺎﻬﻳﻠﻋ ﻝﺻﺣﺗﻣﻟﺍ ﺔﻳﻛﻳﻣﻭﺗﺎﻧﺃﻭﻓﺭﻭﻣﻟﺍ ﺹﺋﺎﺻﺧﻟﺍ ﺔﻅﺣﻼﻣ ﻥﺈﻓ ﻯﺭﺧﺃ ﺔﻬﺟ ﻥﻣ
ـﻟ
Cyanobactérie
ءﺎﺻﺣﺈﺑ ﺎﻧﻟ ﺕﺣﻣﺳ
16
ﻰﻠﻋ ﻱﻭﺗﺣﺗ ﻲﻬﻓ ،ﺎﻋﻭﻧﺗ ﺭﺛﻛﻷﺍ ﻲﻫ "ﺓﺭﻳﺑﻭﺃ" ﺓﺭﻳﺣﺑﻓ ،ﻉﻭﻧ
.
ﺎﻳﻋﻭﻧﻭ ﺎّﻣﻛ ﻑﺎﻧﺻﻷﺍ ﻥﻣ ﺩﺩﻋ ﺭﺑﻛﺃ
ﻝﻗﻷﺍ ﻰﻠﻋ ﺔﻧﻭﻛﻣ ﺔﻳﺩﻋﺎﻗ ﺔﻳﻧﺑ ﻥﺍﺯﺭﺑﻳ "ﺎﻘﻧﻭﻁﻭ ﺓﺭﻳﺑﻭﺃ" ﺔﺑﺫﻌﻟﺍ ﻩﺎﻳﻣﻠﻟ ﻥﺎﻳﺋﺎﻣﻟﺍ ﻥﺎﺣﻁﺳﻣﻟﺍ ﻥﻣ ﻝﻛﻓ
.
ﺔﻣﺎﺳ ﺭﺑﺗﻌﺗ ﺎﻬﻧﻣ ﺔﻳﺑﻠﻏﻷﺍ ﺙﻳﺣ ﻉﺍﻭﻧﻷﺍ ﺕﺍﺭﺷﻋ ﻥﻣ
ـﻟﺍ ﺔﻓﺎﺛﻛ ﺭﻭﻁﺗ ﺔﻌﺑﺎﺗﻣ ﻥﺇ
Cyanobactérie
ﺓﺭﻳﺣﺑ ﻲﻓ ﻑﻳﺭﺧﻟﺍ ﻲﻓ ﺔﻠﺟﺳﻣ ﺔﻓﺎﺛﻛ ﻰﻠﻋﺃ ﻥﺃ ﻥﻳﺑﺗ
ﺩﺣﺍﻭ ﺱﺎﻳﻘﻣﻟ ﻲﺋﺎﺻﺣﻹﺍ ﻝﻳﻠﺣﺗﻟﺍ ﻥﺈﻓ ﻯﺭﺧﺃ ﺔﻬﺟ ﻥﻣﻭ ،ﺔﻬﺟ ﻥﻣ ﺎﻘﻧﻭﻁ ﺓﺭﻳﺣﺑ ﻲﻓ ﻑﻳﺻﻟﺍ ﻲﻓﻭ ،ﺓﺭﻳﺑﻭﺃ
)
AV1
.
ﺕﺍﺭﻳﻐﺗﻣﻟﺍ ﻡﻅﻌﻣﻟ ﻥﻳﻳﺋﺎﻣﻟﺍ ﻥﻳﺣﻁﺳﻣﻟﺍ ﻥﻳﺑ ﻑﻼﺗﺧﺍ ﺩﻭﺟﻭ ﻥﻳﺑﻳ (
II- Matériel et méthodes………. 4
1-Présentation du milieu d’étude……….. 4
1-1-Lac Oubeïra………...………. 4
1-2-Lac Tonga………..……… ……… 6
2- Sites d’échantillonnage et récolte de Cyanobactéries……….. 6
3- Identification et comptage des cyanobactéries récoltées.……… 10
4- Mesure des paramètres physico-chimiques de l’eau……… 11
4-1- Dosage des sels nutritifs……… 12
4-1-1- Les nitrites……….. 12
4-1-2- Dosage de l’Azote Nitrique (les Nitrate NO3-)……….. 12
4-1-3- L’Azote ammoniacal total ( N-NH3 + N-NH4+)……… 13
4-1-4- Dosage des Orthophosphates (PO4-3)………...……….. 14
4-1-5- Matière en suspension (MES). ……….. 15
4-1-6- Dosage de la Chlorophylle a.………..……….. 15
5-Analyses statistique………..……… 17
5-1- Analyses statistiques univariées……… 17
5-2- Analyses statistiques bivariées………..……… 17
5-3- Paramètre structuraux des peuplements de cyanobactéries...……… 18
5-3-1- Richesse spécifique "S"……….. 18
5-3-2- Diversité spécifique ou diversité observée " H' "……….. 18
5-3-3- Equitabaité………... 19
III- Résultats………... 20
1- Caractéristiques physico-chimiques de l’eau du lac Oubeïra………. 20
1-1- La température……….. 20
1-2- L’oxygène dissous……… 21
1-3- Le pH……….………... 23
1-4- Les nitrates (NOˉ3)………. 24
1-5- L’azote ammoniacal (N H+4)………..………... 26
1-6-Les orthophosphates (PO4ˉ3)……….. 27
1-7- la matière en suspension (MES)……….………... 29
1-8- la transparence………..………. 30
1-9- Teneur en chlorophylle a………... 31
2- Étude qualitative des cyanobactéries récoltées dans le lac Oubeïra………. 32
2-1- Identification génériques des cyanobactéries……….………... 32
3- Étude quantitative des cyanobactéries récoltées dans le lac Oubeïra……….. 34
3-1- Distribution spatiale des cyanobactéries dans le lac Oubeïra…………... 34
3-2- Distribution temporelle des cyanobactéries dans le lac Oubeïra………... 35
3-5- Variation spatio-temporelle………...……… 37
4- Caractéristiques physico-chimiques de l’eau du lac Tonga……… 47
4-1- La température………... 47
4-2- L’oxygène dissous……….……… 48
4-3- Le pH……….………... 48
4-4- Les nitrates (NOˉ3)……….……… 49
4-5- L’azote ammoniacal (N H+4)……….……… 49
4-6-Les orthophosphates (PO4ˉ3)……….. 50
4-7- La matière en suspension (M E S)……….……… 50
4-8- Teneurs en chlorophylle a………... 51
5- Étude qualitative des cyanobactéries récoltées dans le lac Tonga………..……… 51
5-1- Identifications génériques des cyanobactéries……….. 51
6- Étude quantitative des cyanobactéries récoltées dans le lac Tonga………..……… 53
6-1- Distribution temporelle de la densité globale des cyanobactéries………..………... 53
6-2- Densité moyenne des genres des cyanobactéries identifiés…………..………. 53
6-3-Distribution saisonnière des cyanobactéries………... 54
6-4- Distribution temporelle des genres de cyanobactéries recensés……….. 55
7- Résultats de l'analyse statistique……….……….. 60
7-1- Analyses univariées du lac Oubeïra ……….……… 60
7-2- Analyses bivariées du lac Oubeïra ………..……….. 62
7-3- Analyses bivariées du lac Tonga………. 63
7-4- comparaison entre lac Oubeïra et lac Tonga... 64
8- Comparaison des peuplements de cyanobactéries des diverses stations……… 64
8-1- Richesse spécifique "S"………. 65
8-2- Diversité "H" et équitabilité "E"……… 65
9- Analyse en composante principale (ACP)………. 65
10- Analyse de co-inertie………. 69
IV- Discussion……….. 71
V- Conclusion et perspectives………... 69
Bibliographie……… 80
N° Titre page
1 Situation géographique des zones humides du Parc National d’El-Kala
(Benyacoub, 1996). 5
2 Position des sites de prélèvement dans le lac Oubeïra (Benyacoub, 2004). 7 3 Localisation des stations de prélèvement dans le lac Tonga (Benyacoub, 2004). 8
4 Schéma d’un filet à plancton. 9
5 Schéma synthétique du dispositif de comptage du phytoplancton. 11 6 Variations mensuelles de la température de l’eau (Lac Oubeïra ; Mai 2004- Avril
2005). 20
7 Variations mensuelles de la température moyenne de l’eau (Lac Oubeïra ; Mai
2004- Avril 2005). 21
8 Variations mensuelles des teneurs en oxygène dissous de l’eau (lac Oubeïra, Mai
2004- Avril 2005). 22
9 Variations mensuelles de la teneur moyenne en oxygène dissous de l’eau (lac
Oubeïra, Mai 2004- Avril 2005). 22
10 Variations mensuelles du pH de l’eau (lac Oubeïra; Mai 2004 –Avril 2005). 23 11 Variations mensuelles du pH moyen de l’eau (lac Oubeïra; Mai 2004 –Avril
2005). 24
12 Variations mensuelles des teneurs en nitrates de l’eau (lac Oubeïra; Mai 2004 –
Avril 2005). 25
13 Variations mensuelles de la teneur moyenne en nitrates de l’eau (lac Oubeïra; Mai
2004 – Avril 2005). 25
14 Variations mensuelles des teneurs en azote ammoniacal de l’eau (lac Oubeïra;
Mai 2004 – Avril 2005). 26
15 Variations mensuelles de la teneur moyenne en azote ammoniacal de l’eau (lac
Oubeïra; Mai 2004 – Avril 2005). 27
16 Variations mensuelles des teneurs en orthophosphates de l’eau (lac Oubeïra; Mai
2004 – Avril 2005). 28
18 Variations mensuelles des teneurs en matière en suspension dans l’eau (lac
Oubeïra; Mai 2004 – Avril 2005). 29
19 Variations mensuelles de la teneur moyenne en matière en suspension dans l’eau
(lac Oubeïra; Mai 2004 – Avril 2005). 30
20 Variations mensuelles de la transparence de l’eau au centre du lac Oubeïra (Août
2004 – Avril 2005). 30
21 Variations mensuelles de la chlorophylle a dans le lac Oubeïra (Mai 2004 – Avril
2005). 31
22 Variations mensuelles de la teneur moyenne en chlorophylle a dans le lac Oubeïra
(Mai 2004 – Avril 2005). 32
23 Distribution spatiale des cyanobactéries dans le lac Oubeïra (Mai 2004-Avril
2005). 35
24 Distribution temporelle des cyanobactéries dans le lac Oubeïra (Mai 2004-Avril
2005). 35
25 Densité moyenne des différents genres de cyanobactéries récoltées dans le lac
Oubeïra (Mai 2004-Avril 2005). 36
26 Distribution saisonnière des cyanobactéries (lac Oubeïra; Mai 2004 – Avril 2005). 36 27 Répartition spatio-temporelle de la densité cellulaire de Microcytis (lac Oubeïra;
Mai 2004 – Avril 2005). 37
28 Répartition spatio-temporelle de la densité cellulaire de Synechocystis (lac
Oubeïra; Mai 2004 – Avril 2005). 38
29 Répartition spatio-temporelle de la densité cellulaire de Anabaena (lac Oubeïra;
Mai 2004 – Avril 2005). 38
30 Répartition spatio-temporelle de la densité cellulaire de Cylindrospermum (lac
Oubeïra; Mai 2004 – Avril 2005). 39
31 Répartition spatio-temporelle de la densité cellulaire de Aphanizomenon (lac
Oubeïra ; Mai 2004 – Avril 2005). 40
32 Répartition spatio-temporelle de la densité cellulaire de Pseudoanabaena (lac
Oubeïra ; Mai 2004 – Avril 2005). 40
33 Répartition spatio-temporelle de la densité cellulaire d’Oscillatoria (lac Oubeïra ;
Mai 2004 – Avril 2005). 41
35
Mai 2004 – Avril 2005). 42
36 Répartition spatio-temporelle de la densité cellulaire de Lyngbya (lac Oubeïra ;
Mai 2004 – Avril 2005). 43
37 Répartition spatio-temporelle de la densité cellulaire de Gloeocapsa (lac
Oubeïra ; Mai 2004 – Avril 2005). 44
38 Répartition spatio-temporelle de la densité cellulaire de Merismopidia (lac
Oubeïra ; Mai 2004 – Avril 2005). 44
39 Répartition spatio-temporelle de la densité cellulaire de Phormidium (lac
Oubeïra ; Mai 2004 – Avril 2005). 45
40 Répartition spatio-temporelle de la densité cellulaire de Synechococcus (lac
Oubeïra ; Mai 2004 – Avril 2005). 45
41 Répartition spatio-temporelle de la densité cellulaire de Chroococcus (lac
Oubeïra; Mai 2004 – Avril 2005). 46
42 Répartition spatio-temporelle de la densité cellulaire de Anabaenopsis (lac
Oubeïra ; Mai 2004 – Avril 2005). 47
43 Variations mensuelles de la température de l’eau (lac Tonga ; Mai 2004- Avril
2005). 47
44 Variations mensuelles des teneurs en oxygène dissous de l’eau (lac Tonga, Mai
2004- Avril 2005). 48
45 Variations mensuelles du pH de l’eau (lac Tonga; Mai 2004 – Avril 2005). 48 46 Variations mensuelles des teneurs en nitrates de l’eau (lac Tonga ; Mai 2004 –
Avril 2005). 49
47 Variations mensuelles des teneurs en azote ammoniacal de l’eau (lac Tonga ; Mai
2004 – Avril 2005). 49
48 Variations mensuelles des teneurs en orthophosphates de l’eau (lac Tonga; Mai
2004 – Avril 2005). 50
49 Variations mensuelles des teneurs en matière en suspension dans l’eau (lac
Tonga ; Mai 2004 – Avril 2005). 50
50 Variations mensuelles de la chlorophylle a dans le lac Tonga (Mai 2004 – Avril
2005). 51
52 Densité moyenne des différents genres de cyanobactéries recensés dans le lac
Tonga (Mai 2004 – Avril 2005). 54
53 Distribution saisonnière des cyanoprocaryotes dans le lac Tonga (Mai 2004 –
Avril 2005). 53
54 Répartition temporelle de la densité cellulaire de Microcytis (lac Tonga ; Mai
2004 – Avril 2005). 55
55 Répartition temporelle de la densité cellulaire de Synechocystis (Lac Tonga ; Mai
2004 – Avril 2005). 55
56 Répartition temporelle de la densité cellulaire de Anabaena (lac Tonga ; Mai
2004 – Avril 2005). 56
57 Répartition temporelle de la densité cellulaire de Cylindrospermum (lac Tonga ;
Mai 2004 – Avril 2005). 56
58 Répartition temporelle de la densité cellulaire de Aphanizomenon (lac Tonga ;
Mai 2004 – Avril 2005). 57
59 Répartition temporelle de la densité cellulaire de Pseudoanabaena (lac Tonga;
Mai 2004 – Avril 2005). 57
60 Répartition temporelle de la densité cellulaire d’Oscillatoria (lac Tonga; Mai
2004 – Avril 2005). 58
61 Répartition temporelle de la densité cellulaire de Gomphosphaeria, (lac Tonga;
Mai 2004 –Avril 2005). 58
62 Répartition temporelle de la densité cellulaire de Spirulina (lac Tonga; Mai 2004
– Avril 2005). 59
63 Répartition temporelle de la densité cellulaire de Lyngbya (lac Tonga; Mai 2004 –
Avril 2005). 59
64 Graphe des valeurs propres de l’analyse en composantes principales. 66 65 Plan 1-2 de l’analyse en composantes principales de la matrice abondances –
stations. 67
66 Plan 1-3 de l’analyse en composantes principales de la matrice Abondances –
stations. 68
67 Plan 2-3 de l’analyse en composantes principales de la matrice abondances –
stations. 69
70 Remplissage de la colonne avec le cadmium traité sans contact de ce dernier avec
l’atmosphère. 89
71 Systématique des Cyanoprocaryotes (Bourrelly, 1985) 104 72 Photos de flocs de Cyanobactéries (Aphanizomenon) au lac Saint-Augustin à l’été
2002. [photos : Martin Bouchard Valentine, 2004]. 109 73 Photos d’écumes au lac Saint-Augustin à l’été 2002. [photos : Martin Bouchard
Valentine, 2004]. 110
74
Fleur d’eau de cyanobactéries sous la forme de particules individuelles et agglomérées de dimensions diverses − Baie Missisquoi, septembre 2001, (Sylvie Blais.
110
75 diagnose des genres toxiques de cyanobactéries recensés dans le lac Oubeïra
N° Titre Page
1 Localisation des sites d’échantillonnage. 6
2 Diversité générique mensuelle des cyanobactéries dans le lac Oubeïra (Mai
2004 – Avril 2005). 33
3 Fréquence d’apparition des genres de cyanobactéries dans le lac Oubeïra. 34 4 Diversité générique mensuelle des cyanobacteries dans le lac
Tonga (Mai 2004 – Avril 2005). 52
5 Fréquence d’apparition des genres de cyanobacteries dans le lac Tonga. 52 6
Résultats de l'analyse uni variée des différents paramètres mesurés dans les
différents sites du lac Oubeïra. 61
7
Résultats de l'analyse uni variée des différents paramètres mesurés dans les
différents mois (lac Oubeïra). 61
8
Résultats de l'analyse uni variée des différents paramètres mesurés dans les
deux lacs Oubeïra et Tonga 63
9
Résultats de l'analyse uni variée des différents paramètres mesurés dans les
différents mois (lac Obeïra - lac Tonga) 64
10
paramètres structuraux des peuplements de cyanobactéries des diverses
stations étudiés. 64
11
Valeurs propre de la matrice de corrélation, proportions et cumulées de la
variance expliquées par les composantes. 66
12 Qualité des eaux de surface à partir de plusieurs paramètres (l'agence
algérienne des bassins versants (1999)). 72
13 Valeurs des seuils de l'état trophique des plans d'eau à partir de la transparence. 74 Annexes
1 Exemples d'empoisonnements d'animaux associés aux cyanobactéries. 106 2 Exemples de cas d'intoxications aiguës de populations humaines. 107 3 Recommandation de l’OMS pour la protection de la santé publique dans les
I- INTRODUCTION :
A travers le monde entier, au fil des décennies, la grande majorité des lacs devient de plus en plus eutrophe (Bartram et a.l, 1999). L’eutrophisation perturbe leur situation naturelle et gène de nombreux usages. Depuis sa création par Naumann (1919), alors qu’il ne faisait référence qu’à la composition spécifique du phytoplancton, le concept d’eutrophisation a beaucoup évolué. Il est maintenant défini comme étant l’enrichissement d’un plan d’eau par des éléments nutritifs utiles à la croissance des plantes ou autres producteurs primaires (Kalff, 2002).
Les principaux nutriment à l’origine de ce phénomène sont le phosphore (contenu dans les phosphates) et l’azote (contenu dans l’ammonium, les nitrates et les nitrites) (Wetzel et Likens, 2000).
Un lac reçoit en effet, de manière naturelle et continue, des quantités de matières nutritives apportées par les torrents et les eaux de ruissellements. Stimulées par cet apport substantiel, certaines algues croissent et se multiplient de manière excessive. Ces algues en excès conduisent, lorsqu’elles se décomposent, à une augmentation de la charge naturelle de l’écosystème en matière organique biodégradable. Dans les profondeurs du lac, la où les algues mortes viennent se déposer, les bactéries aérobies qui s’en nourrissent prolifèrent à leur tour, consommant de plus en plus d’oxygène. Or, en absence d’une circulation suffisante des eaux, le fond du lac est peu oxygéné et les bactéries finissent par épuiser l’oxygène des couches d’eaux (Guillaud, 1998; Wetzel, 2001). Elles ne peuvent plus dégrader toute la matière organique morte et celle- ci s’accumule dans les sédiments. On dit que le lac vieillit. Une telle situation, lorsqu’elle se produit, s’aggrave encore quand il fait chaud car la solubilité de l’oxygène dans l’eau diminue lorsque la température augmente. Ce processus naturel est très lent : il peut s’étaler sur des siècles ou des millénaires. Mais l’eutrophisation peut être
fortement accélérée par l’apport d’effluents domestiques, industriels et agricole (Pitois et al., 2001) et conduire à la mort de l’écosystème aquatique en quelques décennies
voir même en quelques années. On parle alors d’hypereutrophisation ou encore de dystrophisation.
Dans un article résumant très bien les conséquences de l’eutrophisation sur l’ensemble des paramètres limnologiques, Smith (2003) indique que les symptômes des lacs eutrophes et
hypereutrophes incluent, entre autres : une turbidité élevée, un déficit sinon une anoxie complète de l’hypolimnion et une réduction de l’aspect esthétique (visuel et odeur), une diminution de la potabilité de l’eau. Une autre conséquence, qui est particulièrement critique, est la transition dans la composition spécifique du phytoplancton vers une dominance des cyanobactéries (Dokulil et Teubner, 2000).
Les cyanobactéries, appelées aussi algues bleu-vert, sont des bactéries Gram négatif qui se répartissent en 150genres regroupant quelques 2000 espèces (Duy et al., 2000). Longtemps considérées comme des algues en raison de leur capacité à réaliser la photosynthèse, des analyses de leur ultrastructure à partir de la microscopie électronique ont permis de démontrer qu’il s’agissait de bactéries photosynthétiques appartenant aux organismes procaryotes (Carmichael, 1994; Chorus et Bartram, 1999; Pitois et al., 2000). Les cyanobactéries peuvent se retrouver sous forme unicellulaire (Microcystis, Aphanocapsa,
Woronichinia, Merismopedia), filamenteuse (Aphamizomenon, Anabaena, Oscillatoria, Phormidium) (Chorus et Bartram, 1999).
Environ 40 espèces de cyanobactéries sont capables de produire différentes substances toxiques (Duy et al., 2000); appelées cyanotoxines, ces substances sont regroupées en trois classes : les neurotoxines, les hépatotoxines et les endotoxines de nature lipopolysaccharidique (Carmichael, 1994 ; Codd et al., 1997; Duy et al., 2000). Ces cyanotoxines, aux quelles sont sensibles les humains et les animaux s’abreuvant à partir des plans d’eau contaminés (Paerl et al., 2001), sont libérées à l’extérieur de la bactérie et
dissoutes dans l’eau principalement lors de la sénescence et de la lyse cellulaire (Duy et al., 2000).
Parmi ces micro-organismes toxiques, l’espèce Microcystis aeruginosa est la plus incriminée car selon Lacaze (1996) un mammifère peut mourir s’il passe dans son sang 0,07 mg de toxine de cette espèce par Kg de son poids.
D’autre part, il est curieux de constater qu’aux quatre coins de la planète on attribue à la
Spiruline, cyanobactérie à haute teneur en protéine (40% à 60% par rapport à la matière sèche),
toutes les vertus. A Madagascar, elle remet sur pied les enfants malnutris, diminue le cholestérol, réduit le diabète ou l’obésité, renforce le système immunitaire, inhibe la réplication du virus du sida (Rafael, 2005: http//www.com.univ-mrs.fr/IRD/urcyano/developpement/spiruli.htm).
Dans l’Est Algérien, plusieurs travaux, réalisés dans divers plans d’eau révèlent la présence d’un certain nombre de genre de cyanobactéries dont la majorité est reconnue potentiellement toxique.
Parmi ces études, on trouve celle de Aissani (2003) dans le barrage de Hammam D’bagh à Guelma où il décrit la présence de 10 genres de cyanobactéries; Boualleg et Kouachi (2001) ont recensé 11 genres dans le barrage de Ain Dalia à Souk Ahras ; Matmed (2000) rapporte la présence de 10 genres dans le lac Tonga. Cependant, le plus grand nombre de genre a été obtenu dans le lac Oubeïra où les auteurs ont recensé 11 à 16 genres dont 9 sont reconnus comme potentiellement toxiques (Nasri, 1999; Menail, 2000; Amissi et Yahiaoui, 2001; Boulesnane et Chaibi, 2002; Mazbour, 2004).
Cette étude entre dans le cadre d’un projet de recherche CNEPRU intitulé « Biosurveillance en milieu aquatique et évaluation des risques engendrés par l’utilisation de l’eau et la consommation des produits aquacoles ».
Ce travail a pour objectifs :
De suivre l’évolution des paramètres physico-chimiques des eaux des deux lacs (Oubeïra et Tonga).
D'évaluer le niveau trophique de ces deux plans d'eau.
D’évaluer qualitativement et quantitativement les peuplements de cyanobactéries des deux lacs et de suivre leur évolution spatiotemporelle.
II- MATÉRIEL ET MÉTHODES :
1-Présentation du milieu d’étude :
La région d’EL-kala compte principalement trois lacs importants: l’Oubeïra, le Tonga
et le Mellah distant les uns des autres de quelques kilomètres. Ces sites sont sous la protection légale du Parc National d’EL-kala (P.N.E.K). Les deux premiers lacs représentent notre milieu
d’étude (fig1). 1-1-LLaaccOOuubbeeïïrra : a
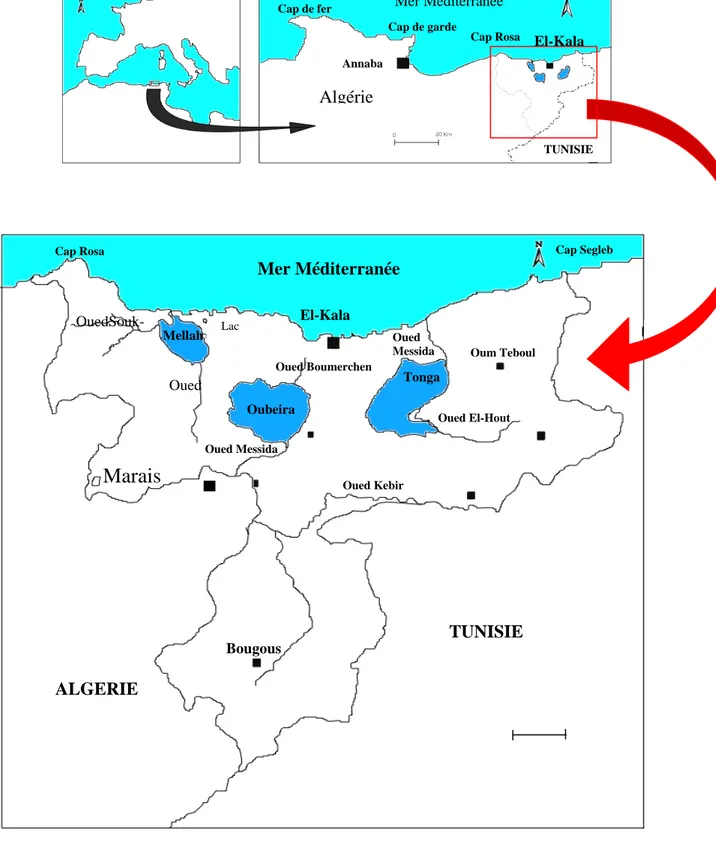
Le lac Oubeïra est situé à l’extrême Nord-Est algérien à une altitude de 25m (par rapport du niveau de la mer); ses coordonnées géographiques sont 36° 50' N et 38° 23' E (Marre, 1987). Il est limité au Nord-Est par Djebel Boumerchene, à l’Est par les monts D’El-Kalaet ceux d’El Frine et au Nord-Ouest par la lagune EL Mellah. Cette étendue d’eau douce totalise une superficie globale de 229.110 km² (fig 1).
Le lac Oubeïra est alimenté par quatre oueds: au Nord par l’Oued Demet el-Réhan, au Nord-Est par oued Boumerchene, oued Dey lagraa et au Sud-Est par oued Messida, celui ci joue le rôle d’effluent du lac Oubeïra vers l'oued El-Kebir en période de crue (Messerer, 1999).
Le lac a une forme de cuvette, avec un fond plus ou moins plat incliné légèrement vers le Nord. La profondeur moyenne de la lame d’eau est de l’ordre de 0,96 m, cette valeur est nettement inférieure comparativement à celle de la vase qui tapisse le fond du lac avec une valeur moyenne de 1,32 m (Messerer, 1999).
Les monts qui alimentent le lac Oubeïra sont couverts de forêts ; ce plan d’eau est fréquenté par de nombreuses espèces d’oiseaux aussi bien sédentaires que migratrices (Brahmia, 2002). Il a été utilisé par ailleurs comme exploitation piscicole de type extensif par l’O.N.D.P.A. Cet organisme a procédé à son repeuplement en Cyprinidés (diverses espèces de
Mer Méditerranée Cap de fer
Cap de garde
Cap Rosa El-Kala
Annaba Algérie TUNISIE Mer Méditerranée El-Kala Cap Segleb Cap Rosa Oum Teboul Oued Messida Oued Boumerchen Lac Tonga Oubeira Mellah
OuedSouk-Marais
Oued Messida Oued Oued Kebir TUNISIE ALGERIE Bougous Oued El-HoutFigure 1 : Situation géographique des zones humides du Parc National d’El-Kala (Benyacoub, 1996).
1-2-LLaaccTToonngga : a
Le lac Tonga est situé à l'extrême Nord-Est de l'Algérie à environ 5 km au Sud-Est de la ville d'El-Kala à proximité de la frontière algéro-tunisiènne (36° 49 - 36° 51' N / 8° 22' - 8° 25' E). Il a une superficie égale à 2500 ha avec une profondeur maximale 2 m.
Le lac Tonga est recouvert sur la majeure partie de sa superficie par de la végétation aquatique émergente et répond, de ce fait, davantage à la définition de marais. Sa profondeur est d’environ deux mètres. Il constitue un système exoréique, évacuant les eaux de crues dans l’Oued Messida vers la mer. Hormis les eaux de ruissellement provenant du bassin versant, il est principalement alimenté par Oued El Hout au Sud et Oued El Eurg à l’Est. Les prairies en bordure, essentiellement au Sud et à l’Ouest du lac, sont exploitées en maraîchage et offrent un pâturage estival à plus de deux mille têtes de bovins (Boulahbel, 1999).
Sa richesse biologique reste remarquable par rapport à d’autres sites. Sa flore, étudiée par Kadid (1989), représente un riche mélange de taxons floristiques d’origines biogéographiques différentes. On note de nettes affinités européennes, méditerranéennes et tropicales (Benyacoub et al, 1998).
La végétation émergente composée de phragmites (Phragmites australis), de massettes (Typha sp) de scirpes (Scrpus sp) et de saules (Salix pedicellata), fournit sécurité et sites de nidification à plusieurs espèces d’oiseaux d’eau (Ledant et Van dijk, 1977; Boumezbeur, 1993; Belhadj, 1996) et accueille en outre une importante héronnière plurispécifique (fig 1 ).
2- Sites d’échantillonnage et récolte de Cyanobactéries :
Dans le lac Oubeïra, cinq stations ont été retenues: quatre a l'embouchure des oueds qui alimentent le lac et une au centre (fig 2). Le choix des stations d'échantillonnage est fait sur la base des apports en eau par les oueds qui alimentent le lac Oubeïra (tableau 1).
Tableau 1 : Localisation des stations d’échantillonnage.
Station 1 : à l'embouchure de l’oued Demet el-Rihan
Station 2 : à l'embouchure de l’oued Boumerchene (considéré comme modérément exposé au vent).
Station 3 : à l'embouchure de l’oued Dey Lagraa.
Station 4 : à l'embouchure de l’oued Messida (en pleine direction du vent). Station 5 : au centre du lac.
Figure 2 : Position des stations de prélèvement dans le lac Oubeïra (Benyacoub, 2004) 8° 21’ 8° 22’ 8° 23’ 8° 24’ 8° 25’ 8° 26’ 8° 21’ 8° 22’ 8° 23’ 8° 24’ 8° 25’ 8° 26’ 3 6 °49 ’ 3 6 °5 0 ’ 3 6 °5 1 ’ 3 6 °5 2 ’ 3 6 °4 9 ’ 3 6 °5 0 ’ 3 6 °5 1 ’ 3 6 °5 2 ’ CW 109 ONDPA RN 44 0 1 2Km roc he station hydromobile station de pompage station de pompage REML EL BREL
1
2
3
5
4
Vents
Dans le lac Tonga, l’échantillonnage des cyanobactéries a été réalisé dans une seule station située à proximité des vannes (fig 3).
Figure 3 : Localisation des stations de prélèvement dans le lac Tonga (Benyacoub, 2004).
Mechta Dey Zitoun
Mechta ounsaya Mechta maïzîla Mechta fêd Emrâd Mechta Tonga Nec ha ’t Tonga Mec htet le Mzâra
Mechtet Oued el Hout
Mec hta Fêd el Allîga Haouc h Ta ’m âllah el Hâd î O u ed E l-H o ut RN 44 Ch em in d es ois ea ux O ue d M e ssid a vanne d ig ue 0 1 2 km 3 ha
Dans les deux lacs Oubeïra et Tonga, la récolte des cyanobactéries a été réalisée mensuellement pendant la période s’étalant de Mai 2004 à Avril 2005.
Pour la réalisation de l’étude qualitative des cyanobactéries, les prélèvements sont effectués à l’aide d’un filet à plancton de 20µm de vide de maille muni d’un collecteur (fig 4). Cette opération consiste à filtrer l’eau de surface (à 20 cm en dessous de la surface de l’eau) puis à transférer le contenu du collecteur dans un flacon en verre ombré contenant 5ml de formol à 10%.
Figure 4: Schéma d’un filet à plancton Collecteur Robinet d’arrêt Poids Maille de 20µm Collier en toile Bride 0 0,12 m
L’échantillonnage destiné à l’étude quantitative est effectué à l’aide d’une bouteille; l’opération consiste à prendre 1,5 litres d’eau de surface et à laisser décanter 100 ml pendant 6h et plus avant de procéder au comptage des organismes présents.
3- Identification et comptage des cyanobactéries récoltées :
La détermination des genres de chaque récolte est réalisée par l’observation sous microscope optique des caractères morpho- anatomiques représentant les clés d’identification (Bourrelly, 1985; Michel, 1987; Coute, 1995).
Les critères retenus sont :
La structure de la micro algue (cellulaire ou filamenteuse). La forme de la colonie ou du trichome.
La taille et la couleur.
Le dénombrement des cyanoprocaryotes se fait comme suit :
ajouter 5 ml de Lugol à 10 ml de l’échantillon. Le fixateur tue les algues, les alourdit (ce qui facilite leur sédimentation) et permet leur conservation pendant plusieurs mois.
Homogénéiser les échantillons d'eau fixés, par agitation du flacon.
Prélever un sous échantillon (Le volume est choisi en fonction de la densité algale) et le déposer dans une chambre à sédimentation.
Observer à l'aide d’un microscope optique
Compter les algues rencontrées sur les parcours horizontaux effectués sur toute la longueur de la bande ; Cette opération est répétée plusieurs fois (3 à 5 observations). Le comptage ne concerne pas l'ensemble de la surface de la chambre, mais seulement une « sous chambre » de superficie connue (fig 5).
Déterminer la densité algale de l’échantillon par :
Le calcul de la superficie de la chambre de comptage : S = L × La ; (S : superficie mm2, L : longueur de la chambre de comptage en mm, La : largeur de la chambre de comptage en mm).
Le calcul de la superficie de la sous chambre : s = l × la ; (s : superficie mm2,l : longueur en mm, la : largeur en mm).
Le calcul du nombre de cellules dans toute la chambre : n s SD = × ;
D : Densité des individus dans toute la chambre de comptage, n : Nombre des individus dans la sous chambre.
Figure 5 : Schéma synthétique du dispositif de comptage du phytoplancton.
4- Mesure des paramètres physico-chimiques de l’eau :
Les paramètres physico-chimiques étudiés sont la température, l’oxygène dissous, le pH, la transparence de l’eau, les nitrites, les nitrates, l’azote ammoniacal, les ortho-phosphates, la matière en suspension et la chlorophylle a.
Les mesures de la température l'O2 dissous et la pH sont réalisées «in situ» au moment
de l’échantillonnage à l’aide d’un multi paramètre (CONSORT 535) utilisant différentes sondes.
L’utilisation de cet appareil consiste à faire plonger la sonde appropriée dans l’eau, après étalonnage, puis attendre quelques secondes avant de lire le résultat de la mesure, après stabilisation de l’affichage de ce dernier sur l’écran.
La mesure de la transparence de l'eau a été effectuée «in situ» à l'aide du disque de Secchi uniquement dans le centre du lac Oubeïra durant la période s'étalant d'Août 2004 à Avril 2005.
En ce qui concerne les dosages des éléments nutritifs (nitrites, nitrates, azote ammoniacal et ortho-phosphates), ces derniers ont été réalisés dans le laboratoire à partir d’un litre d’eau brute conservé dans des bouteilles maintenues à basse température (dans une glacière), cette eau est filtrée et le filtrat est conservé dans un congélateur en vue du dosage.
L La l la Un flacon contenant 100 ml de l’échantillon
Prélèvement d’un sous échantillon. Le volume dépend de la concentration des cellules dans le flacon Exemple : V = 10 ml
4
4--11--DDoossaaggeeddeesssseellssnnuuttrriittiiffss :
Les sels nutritifs sont dosés par des méthodes colorimétriques (Aminot et al, 1983). 4-1-1- Les nitrites :
Dans le cycle de l’azote, les ions nitrites sont des intermédiaires entre l’azote ammoniacal et les ions nitrates. Les concentrations généralement trouvées dans les eaux, douces, saumâtres et marines vont de 0 à quelques micromoles d’azote nitreux par litre.
Principe
Cette technique, réalisée par Bendschneider et Robinson (1952), est une des plus sensibles et des plus spécifiques pour l’analyse des eaux naturelles. Elle est basée sur la formation d’un diazoïque après réaction des ions nitrites avec la sulfanilamide en milieu acide (pH<2) selon la réaction:
N H2S O2C6H4 - N H2 + N O2 + 2 H- → (NH2S O2C6H4 - N ≡ N) + 2H2O
Sulfanilamide
Le diazoïque obtenu, réagit avec le N-naphtyl-éthylènediamine pour former le colorant :
( NH2SO2C6H4 – N ≡ N) + C1 0H - NH - ( CH2)2 – NH2 → NH2SO2C6H4 – N =
N – C1 0H6 – NH - ( CH2 )2 - NH2H
- Mode opératoire :
Rincer d’abord une éprouvette de 50 ml avec l’eau à analyser. Introduire ensuite dans cette éprouvette 50ml (±1) de l’échantillon. Ajouter, d’abord, 1ml de R(1) puis mélanger et laisser reposer 2 à 8 mn.
Ajouter, ensuite, 1ml de R(2) et mélanger à nouveau puis attendre au moins 10mn (mais pas plus de 2 heures).
Lire l’absorbance à l’aide d’un spectrophotomètre à la longueur d’onde λ = 543 nm. NB : La préparation des réactifs R (1) et R (2) est rapportée en annexe.
4-1-2- Dosage de l’Azote Nitrique (les Nitrate NO3) :
L’ion nitrate est la forme oxydée stable de l’azote en solution aqueuse ; cet ion ne présente pas de faculté de compléxation ou d’adsorption. Il entre dans le cycle de l’azote comme support principal de la croissance du phytoplancton. Il est ensuite régénéré à partir des
formes organiques, par les bactéries. Lorsque la vitesse de régénération devient inférieure à la vitesse d’utilisation, les ions nitrates sont un facteur limitant de la croissance des algues.
Principe
Cette méthode est basée sur le dosage des ions NO2- obtenus par réduction quantitative
(>95%) des ions NO3-. La réduction est effectuée par passage de l’échantillon sur une colonne
de cadmium traité au cuivre (Wood et al., 1967).
Mode opératoire
Ajouter, à 100 ml d’eau de l’échantillon, 2 ml de NH4Cl concentrée.
Verser 50 ml d’eau de l’échantillon, dans la colonne, pour éliminer le risque d’interférence entre les échantillons.
Verser, ensuite le reste de l’eau de l’échantillon dans la colonne et rejeter les 30 premiers ml.
Rincer une éprouvette graduée avec quelques ml de la solution passée par la colonne puis récupérer 50ml de l’éluant.
Procéder ensuite selon le même mode opératoire comme pour le dosage des NO2-.
Lire l’absorbance à la longueur d’onde λ = 543 nm.
NB : La préparation du Cadmium et le montage de la colonne sont détaillés en annexe.
4-1-3- L’Azote ammoniacal total ( N-NH3 + N-NH4+):
L'azote ammoniacal est présent sous deux formes en solution, l’ammoniac NH, et l'ammonium NH,- dont les proportions relatives dépendent du pH, de la température et de la salinité. Dans les eaux marines et estuariennes, l’ammonium est prédominant, c'est pourquoi ce terme est souvent employé pour désigner l'azote ammoniacal.
Comme la forme NH3 est la plus toxique pour la vie aquatique, les concentrations
d'azote ammoniacal peuvent s'élever à plusieurs dizaines de micromoles par litre sans que le seuil de toxicité soit atteint, si le pH et la température restent dans certaines limites.
L'azote ammoniacal provient des excrétions animales et de la décomposition bactérienne des composés organiques azotés. Il est utilisé par le phytoplancton comme source d'azote et oxydé par les bactéries nitrifiantes.
Les concentrations sont très variables en fonction du lieu et de la saison :
En eaux côtières non polluées et en milieu océanique, les concentrations sont généralement inférieures à 1 µmol.l- .
Les eaux profondes ne contiennent pas d'ammonium, celui-ci ayant été oxydé ; Excepté en milieux anoxiques ou Koroleff (1976) rapporte, en mer Noire, des concentrations proches de 100 µmol.l-'.
Dans les estuaires les concentrations augmentent traduisant ainsi l'influence des rejets urbains ou agricoles. Lorsque l'on se rapproche des émissaires urbains. Les concentrations peuvent atteindre plusieurs dizaines de micromoles/l. L'ammonium devient dans ces conditions un bon traceur de la pollution urbaine.
Principe
La méthode décrite mesure la totalité de l’azote ammoniacal, soit N-NH3 + N-NH4, le
dosage se fait sur le terrain par fixation à l’aide de 2 réactifs, la lecture s’effectue au laboratoire à l’aide de spectrophotomètre à longueur d’onde λ = 630 nm (voir protocole en annexe)
Mode opératoire
Prendre 100 ml (plus au moins 5 ml) de l’échantillon. Ajouter 3 ml du R (1).
Boucher et agiter pour bien homogénéiser.
Ajouter sans attendre 3 ml du R (2) boucher et agiter à nouveau.
Placer immédiatement a l’abri de la lumière pendant 6 à 8 heures (température ambiante).
Mesurer l’absorbance à λ = 630 nm.
NB : Voir en annexe la préparation des réactifs R (1) et R (2).
4-1-4- Dosage des Orthophosphates (PO4-3):
Le dosage des orthophosphates est réalisé selon la méthode de Murphy et Riley (1962), cette méthode reste jusqu’à aujourd’hui une des plus rapides et des plus simples pour le dosage des orthophosphates.
Principe
Cette technique est basée sur la réaction des ions phosphates avec le molybdate d’ammonium, en présence d’antimoine III; cette réaction aboutit à la formation d’un complexe que l’on réduit par l’acide ascorbique; cette réduction mène à la formation d’une
solution de coloration bleue dont le maximum d’absorbance a lieu à une longueur d’onde égale à 885 nm.
Les poly-phosphates et phosphore organique ne sont pas dosés par cette méthode Mode opératoire
Prendre 100ml de l’échantillon.
Ajouter à cela 10ml du mélange réactif (Formule en annexe).
Attendre 5 mn et lire l’absorbance à la longueur d’onde λ = 885 nm. NB : La préparation de mélange-réactif est détaillée en annexe.
4- 1- 5- M a t i è r e e n s us pe ns i o n (MES)
La connaissance de la quantité de matières en suspension (MES) est importante pour l'étude des milieux aquatiques, les particules réduisent la transparence de l'eau et de ce fait la production primaire photosynthétique. Selon leur nature, elles sont également une source nutritive non négligeable pour la faune.
Principe et méthode:
La détermination des matières en suspension dans l’eau a été réalisée par l’application de la méthode de pesée différentielle après filtration sur un filtre de fibre de verre WHATMAN GF/C 47 µm; l’utilisation de ce type de filtre permet de retenir toutes les particules de taille variant entre 0.47 µm et 250µm.
Le filtre est séché et pesé avant et après la filtration. La différence de poids permet de connaître le poids sec t o t a l d e m a t i è r e e n s u s p e n s i o n d a n s l e v o l u me filtré correspondant (Aminot et chaussepied, 1983).
V
P
P
l
mg
MES
(
/
)
=
2−
1 4-1-6- Dosage de la Chlorophylle a :(Méthode monochromatique de LORENZEN (1967) solvant : acétone à 90%).
La détermination quantitative globale de la fraction particulaire vivante dans les milieux aquatiques est importante pour l'étude et la compréhension des phénomènes écologiques. Pour cela, une estimation de la biomasse phytoplanctonique par voie
P1 = poids du filtre avant filtration (mg).
P2 = poids du filtre après filtration et
séchage (mg).
chimique (par extraction et détermination des pigments photosynthétiques) s’avère satisfaisante, plus simple et plus rapide que des méthodes basées, par exemple, sur le comptage des cellules. L'analyse des principaux pigments chlorophylliens (chlorophylles a, b, c et leurs phéopigments) et celle des caroténoïdes nécessite l'extraction.
Pour la chlorophylle a, Yentsch (1967) résume la dégradation selon les schémas suivant :
L’acidification entraîne l’élimination de l’atome de magnésium et de la chaîne phytol. Principe de la méthode
Filtration d'un volume d'eau connu (sur filtre WHATMAN GF/C 47µm) en présence de carbonate de Mg.
Récupération du filtre et dissolution des pigments dans un solvant approprié (acétone à 90 %).
Filtration en vue de récupérer une solution dépourvue de particules en suspension. Mesure des densités optiques aux longueurs d'ondes appropriées (λ = 665 nm et λ =750 nm) avant et après acidification.
Mode opératoire :
L'eau doit être filtrée le plus rapidement possible après le prélèvement ; ceci permet l’élimination grossière du zooplancton. Cette opération consiste à filtrer l’eau brute dans un flacon jaugé de 1000 ml au travers d’un filet ou un tamis de 200 a 250 µm de vide de maille. L’échantillon d’eau brute est ensuite filtré sous vide, sur membrane en fibre de verre (WHATMAN GF/C 47 µm) sur laquelle sont déposées 3 à 4 gouttes de carbonate de magnésium afin de favoriser la filtration et d’éviter l’altération de la chlorophylle.
NB : Voir en annexe la préparation des carbonates de magnésium et l’acétone à 90 %.
Chlorophylle a -Chaîne phytol Chlorophyllide a -Mg Phéophorbide a
Chlorophylle a Chlorophytine a – chaîne phytol Phéophorbide a
5- Analyses Statistiques des données : 5-1- Analyses statistiques univariées :
Nous avons calculé pour chaque variable les paramètres de base qui sont les statistiques descriptives : la moyenne (x`), l'écart-type (s) et les valeurs max et min (Dagnelie, 2000).
La comparaison des deux stations entre eux, pour l'ensemble des variables étudiées, a été réalisée à l'aide de l'analyse de la variance à un critère de classification (AV1).
-Si p > 0.05 ⇒ il n’existe pas de différences significatives entre les stations ⇒ NS -Si P ≤ 0.05 ⇒ il y a des différences significatives entre les stations ⇒ *
-Si P ≤ 0,01 ⇒ il y a des différences hautement significatives entre stations ⇒ **
-Si P ≤ 0,001⇒ il y a des différences très hautement significatives entre les stations⇒ ***
5-2 Analyses statistiques bivariées :
L'analyse statistique bivariée consiste à calculer les corrélations linéaires simples entre les différentes variables deux à deux (Dagnelie, 2000).
Les corrélations
Pour mettre en évidence une quelconque relation entre les variables mesurées sur les individus, nous avons utilisé le coefficient de corrélation linéaire de Bravais-Pearson (Dagnelie, 2000). Ce coefficient de corrélation, r, mesure l'intensité du lien qui existe entre deux caractéristiques ou variables quantitatives quelconque pour autant que cette liaison soit linéaire ou approximativement linéaire.
Ce coefficient est compris entre -1 et +l. Il est en valeur absolue, d'autant plus proche de 1 que la liaison entre les deux séries d'observations est nette, pour autant que cette liaison soit linéaire ou approximativement linéaire. Au contraire, si le coefficient est nul ou approximativement nul c'est que les deux variables ne sont pas corrélées entre elles.
D'autre part, le signe du coefficient de corrélation indique si la relation entre les deux variables (séries d'observations) est croissante ou décroissante. En effet, lorsque le coefficient de corrélation est positif, les valeurs élevées d'une variable correspondent, dans l'ensemble, aux valeurs élevées de l'autre variable et les valeurs faibles d'une variable correspondent aux valeurs faibles de l'autre variable. Par contre, lorsque la corrélation est négative, les valeurs élevées d'une variable correspondent, dans l'ensemble, aux valeurs
H' = - ∑ Pi log 2 Pi
faibles de l'autre variable et vice-versa.
Si p > 0.05 ⇒ il n’existe pas de corrélations.
Si P ≤ 0.05 ⇒ il existe une corrélation significatives ⇒ *
Si P ≤ 0,01 ⇒ il existe une corrélation hautement significatives ⇒ ** Si P ≤ 0,001⇒ il existe une corrélation très hautement significatives ⇒ ***
Tous les calculs uni et bi variés ont été réalisés à l’aide du logiciel d'analyse et de traitement statistique des données, MINITAB version 13.13 pour Windows (X, 2000).
5-3- Paramètre structuraux des peuplements de cyanobactéries: 5-3-1- Richesse spécifique "S":
C'est le nombre d'espèces "S" contactées au moins une fois au terme de "N" relevés (Blondel, 1975). Dans notre cas, nous assimilons l'ensemble des relevés réalisés pendant l'année à un peuplement statistique. S sera mesuré sue l'ensemble de l'année.
5-3-2- Diversité spécifique ou diversité observée " H' ":
La diversité d'un peuplement, qui exprime son degré de complexité, est calculée à partir de l'indice de Shannon et Weaver (1949) (Daget, 1976 in Benyacoub, 1993).
Pi: Fréquence relative de l'espèce i dans un peuplement.
H': exprime en Bit par individu (Binary digit).
Une valeur élevée de cet indice correspond à un peuplement riche en espèces dont la distribution d'abondance est équilibrée. A l'inverse, une valeur faible correspond soit à un peuplement caracteris6 par un petit nombre d'espèces pour un grand nombre d'individus, soit à un peuplement dans lequel il y a une espèce dominante.
La diversité varie en fonction de la richesse du peuplement et de la distribution d'abondance des espèces de ce dernier. Plus la richesse est élevée et la distribution d'abondance équilibrée, plus la diversité est forte. Les fortes valeurs de H' traduisent généralement un degré élevé de complexité et de maturité d'un peuplement et, par la même, la complexité des facteurs mis en jeu dans l'environnement (Benyacoub, 1993).
H' max = log 2 S
E = H' / H max
La diversité maximale d'un peuplement H' max se calcule comme suit:
S: Richesse totale de ce peuplement H' max: Diversité théorique maximale.
5-3-3- Equitabaité:
L'équitabilité est Ie rapport de la diversité observée à la diversité maximale. Elle mesure Ie degré d'équilibre et de complexité d'un peuplement par 1'ecart de H' à H' max (Benyacoub, 1993).
Quand E est proche de 1, la diversité observée est proche de la diversité maximale. Elle traduit alors une distribution d'abondance proche de l'équilibre. A l'inverse, quand E est proche de 0, la diversité observée est faible et illustre une distribution d'abondance fortement hiérarchisée qui est Ie reflet d'un environnement simple, contraignant, dans lequel peu de facteurs structurent Ie peuplement (Benyacoub, 1993).
Les matrices des différents paramètres de structure des peuplements de cyanobactéries ont été établies sous MICROSOFT EXCEL.
III- RESULTATS :
1- Caractéristiques physico-chimiques de l’eau du lac Oubeïra: 1-1- Latteemmppéérraattuurree :
Les résultats obtenus durant la période d’étude montrent que la température présente des variations similaires dans l’ensemble des stations.
Les valeurs maximales sont obtenues en périodes estivales où la valeur maximale (27°C) est relevée en Juillet. A partir d’Octobre, la température montre une baisse progressive jusqu’à Février où les valeurs minimales sont relevées dans toutes les stations échantillonnées (fig 6). Demet el Rihan 0 5 10 15 20 25 30 Mai Juin
Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois T° C Boumerchene 0 5 10 15 20 25 30 Mai Juin Jui llet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois T° C Dey Lagraa 0 5 10 15 20 25 30 Mai Juin
Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois T° C Messida 0 5 10 15 20 25 30
Mai Juin Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois T° C
Figure 6 : Variations mensuelles de la température de l’eau (Lac Oubeïra ; Mai 2004- Avril 2005).
Centre 0 5 10 15 20 25 30 Mai Juin Juille t Août Sept Octb No v
Dec Janv Fév Mars Avril
Mois
T°
1-2- L’oxygèneddiissssoouuss::
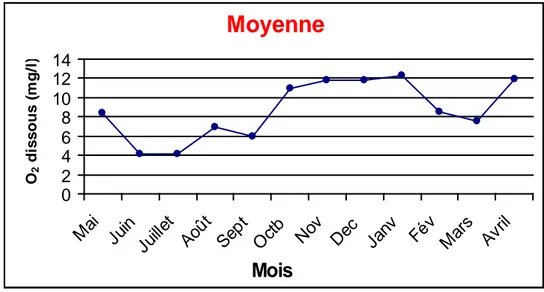
Les teneurs en oxygène dissous de l’eau varient d’une station à l’autre et d’un mois à l’autre. On note toutefois que dans l’ensemble des stations les teneurs les plus basses sont enregistrées en période estivale (avec un minimum de 2,86 mg/l) et les teneurs les plus élevées sont relevées en période automnale et hivernale (avec un maximum de 15,3 mg/l) (fig8).
Moyenne
0 5 10 15 20 25 30 Mai JuinJuillet Aoû
t Sep t Oct b Nov Dec Janv Fév Mars Avril
Mois
T° CFigure 7 : Variations mensuelles de la température moyenne de l’eau (Lac Oubeïra ; Mai 2004- Avril 2005).
Moyenne
0 2 4 6 8 10 12 14 Mai JuinJuillet Aoû t Sep t Oct b Nov Dec Janv Fév Mars Avril Mois O2 d is s o u s ( m g /l ) Demet el Rihan 0 2 4 6 8 10 12 14
Mai JuinJuillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois O2 d is s o u s ( m g /l ) Boumerchene 0 5 10 15 20
Mai Juin Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois O2 d is s o u s ( m g /l ) Dey Lagraa 0 2 4 6 8 10 12 14 Mai Juin Juille t Août Sept Oc tb No v De c
Janv Fév Mars Avril
Mois O2 d is s o u s ( m g /l ) Messida 0 2 4 6 8 10 12 14 Mai Juin Jui llet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois O2 d is s o u s ( m g /l ) Centre 0 5 10 15 20 Mai Juin
Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois O2 d is s o u s ( m g / l)
Figure 8 : Variations mensuelles des teneurs en oxygène dissous de l’eau (lac Oubeïra, Mai 2004- Avril 2005).
Figure 9 : Variations mensuelles de la teneur moyenne en oxygène dissous de l’eau (lac Oubeïra, Mai 2004- Avril 2005).
1
1--33--LLee pH :
Le pH de l’eau est généralement alcalin (dépassant 8) ; Les écarts entre les stations ne sont pas très élevés. Les valeurs maximales sont enregistrées en période estivale (entre 8,33 – 9,47). En revanche, c’est en Février que les valeurs les plus basses sont relevées (6,21) (fig 10). Demet el Rihan 0 2 4 6 8 10
Mai Juin Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois pH Boumerchene 0 2 4 6 8 10 Mai Juin Juille t Août Sept Octb No v
Dec Janv Fév Mars Avril
Mois pH Dey Lagraa 0 2 4 6 8 10
Mai Juin Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois pH Messida 0 2 4 6 8 10 Mai Juin
Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois pH Centre 0 2 4 6 8 10
Mai Juin Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois pH
Figure 10 : Variations mensuelles du pH de l’eau (lac Oubeïra;Mai 2004 –Avril 2005).
1-4- LLeessnniittrraatteess((NNOOˉˉ33))::
Les concentrations en nitrates varient d’une station à l’autre et d’un mois à l’autre. C’est en Mai et Juin que les teneurs les plus basses sont enregistrées (inférieure à 1 µmol/l). Toute fois, on enregistre au niveau de Demet El-Rihan, Boumerchene et Dey Lagraa 2 pics, l’un en Novembre (respectivement: 7,025 µmol /l, 15,71 µmol/l et 4,94 µmol/l) et l’autre en Mars (respectivement : 8,85 µmol/l , 8,76 µmol/l, 9,68 µmol/l).
Par contre, dans Messida et le Centre on note un pic (supérieur à 8,5 µmol/l) en Mars et Avril respectivement (fig 12).
Moyenne
0 2 4 6 8 10 Mai JuinJuillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois pH
Figure 11: Variations mensuelles du pH moyen de l’eau (Lac Oubeïra; Mai 2004 –Avril 2005).
Figure 12 : Variations mensuelles des teneurs en nitrates de l’eau (lac Oubeïra ; Mai 2004 – Avril 2005).
Dem et El Rihan 0 2 4 6 8 10 Mai Juin Juille t Aou t Sep t Octo Nov Dec Janv Fév Mar s Avril Mois NO 3 -(µ m o l/ l) Boum erchene 0 5 10 15 20 Mai Juin Juille t Aout Sept Octo Nov Dec Janv Fév Mars Avril Mois NO 3 - ( µ m ol /l ) Moyenne 0 1 2 3 4 5 6 7 8 9 10 Mai Juin Juille t
Aout Sept Octo No
v Dec Janv Fév Mars Avr il M ois NO 3 -( µ mo l/ l) Centre 0 2 4 6 8 10 12 14 Mai Juin Juillet Aou t Sep t Octo Nov Dec Janv Fé v Mars Avril Mois NO 3 -( µm o l/ l) Dey Lagraa 0 2 4 6 8 10 12 Mai Juin Juille t Aou t Sept Octo Nov Dec Jan v Fév Mar s Avri l Mois NO 3 -( µ m ol /l ) Messida 0 2 4 6 8 10 12 Mai Juin Juille t Aou t Sep t Octo Nov Dec Janv Fév Mar s Avril Mois NO 3 -( µ m ol /l )
Figure 13 : Variations mensuelles de la teneur moyenne en nitrates de l’eau (lac Oubeïra ; Mai 2004 – Avril 2005).
1
1--55--LL’’aazzootteeaammmmoonniiaaccaall((NHN +44)): :
Les teneurs en azote ammoniacal présentent une évolution similaire dans l’ensemble des stations échantillonnées. On note l’apparition de 2 pics, l'un en période automnale (proche de 3 µmol/l) et l'autre en période hivernale (dépassant 5 µmol/l). C'est en période estivale que les teneurs les plus basses sont relevées (fig 14).
Demet el Rihan 0 1 2 3 4 5 6
Mai Juin Juille t Aout Sept Octo No v Dec Jan v Fév Mars Avril Mois NH 4 + ( µ mo l/ l) Boumerchene 0 1 2 3 4 5 6 7 Mai Juin Jui llet Aou t Sep t Octo No v De c Jan v Fév Mars Avri l Mois NH 4 + ( µ mo l/ l) Centre 0 0,5 1 1,5 2 2,5 3 3,5 4
Mai Juin Juille t Aout Sept Octo No v Dec Janv Fév Mars Avril Mois NH 4 + ( µ mo l/ l) Dey Lagraa 0 1 2 3 4 5 6 Mai Jui n Juille t Ao ut Sep t Octo No v De c Janv Fé v Ma rs Avr il Mois NH 4 + ( µ m o l/ l) Messida 0 1 2 3 4 5 6 7
Mai Juin Juillet Aout Sept Octo Nov Dec Janv Fév Mars Avril
Mois NH 4 + ( µ mo l/ l)
Figure 14 : Variations mensuelles des teneurs en azote ammoniacal de l’eau (lac Oubeïra ; Mai 2004 – Avril 2005).
1-6- Les orthophosphates (PO-34) :
Les teneurs mensuelles en orthophosphates de l'eau du lac Oubeira montrent une évolution similaire dans l'ensemble des stations échantillonnées. Les valeurs moyennes présentent un pic en Mai (proche de 5µmol/l) un autre en Septembre (3,5 µmol/l) et un troisième en Décembre (proche de 3µmol/l).
Par ailleurs, c'est en Juin et Juillet que les teneurs les plus basses (inférieures à 1 µmol/l) sont relevées (fig 16). Les valeurs maximales sont relevées en Mai à Boumerchene et Messida, 6,5 µmol/l et 7,5 µmol/l respectivement.
Moyenne 0 1 2 3 4 5 6
Mai Juin Juillet Aout Sept Octo Nov Dec Janv Fév Mars Avril
Mois NH 4 + ( µ m o l/ l)
Figure 15 : Variations mensuelles de la teneur moyenne en azote ammoniacal de l’eau (lac Oubeïra ; Mai 2004 – Avril 2005).
Figure 16 : Variations mensuelles des teneurs en orthophosphates de l’eau (lac Oubeïra ; Mai 2004 – Avril 2005).
Demet el Rihan 0 1 2 3 4 5 6 Mai juin Juille t
Aout Sept Octo Nov Dec Jan v Fév Mars Avril Mois Po 4 -3 (µ mo l/ l) Boumerchene 0 1 2 3 4 5 6 7 Mai juin Juille t Aout Sept Octo No v Dec Jan v Fév Mars Avril Mois Po 4 -3 ( µ mo l/ l) Centre 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 Mai juin Juille t Aout Sept Octo Nov Dec Jan v Fév Mars Avril Mois Po 4 -3 ( µ mo l/ l) Dey Lagraa 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5
Mai juin Juillet Aout Sept Octo Nov Dec Janv Fév Mars Avril Mois Po 4 -3 ( µ mo l/ l) Messida 0 1 2 3 4 5 6 7 8 Mai juin Jui llet Aout Sept Oc to No v De c Jan v Fév Mars Avril Mois Po 4 -3 ( µ mo l/ l) Moyenne 0 1 2 3 4 5 6 Mai juin Jui llet Aout Sept Octo No v De c Jan v Fév Mars Avril Mois Po 4 -3 ( µ mo l/ l)
Figure 17 : Variations mensuelles de la teneur moyenne en orthophosphates de l’eau (lac Oubeïra ; Mai 2004 – Avril 2005).
1-7- La matière en suspension (M E S)::
Les teneurs maximales (dépassant 120 mg/l) sont relevées en Février dans l'ensemble des stations. La teneur moyenne minimale est relevée en Mars (inférieure à 25 mg/l).
Les teneurs relevées à Boumerchene et Demet el Rihan ne dépassent généralement pas 60 mg/l à l'exception du mois de Février. En revanche, les teneurs les plus élevées sont relevées à Dey Lagraa où des pics de 80, 100, 120 et 161 mg/l sont notés en Juillet, Septembre, Novembre et Février respectivement (fig 18).
Demet el Rihan 0 20 40 60 80 100 120 140
Mai JuinJuillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois M E S ( m g /l) Boumerchene 0 20 40 60 80 100 120 140 160
Mai Juin Juillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois M E S (m g /l) Dey Lagraa 0 20 40 60 80 100 120 140 160 180 Mai Juin Juillet Aoû
t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois M E S (m g /l) Messida 0 20 40 60 80 100 120 140 Mai Juin Juillet Aoû
t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois M E S ( m g /l) Centre 0 20 40 60 80 100 120 140
Mai JuinJuillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois M E S ( m g /l)
Figure18 : Variations mensuelles des teneurs en matière en suspension dans l’eau (lac Oubeïra; Mai 2004 – Avril 2005).
1-8- LLaattrraannssppaarreennccee: :
Les données obtenues montrent que le niveau de transparence de l’eau varie entre 0,12 m (en Septembre) et 0,28 m (en Mars). Nous notons par ailleurs, que l'écart de visibilité est faible d'un mois à l'autre (fig 20).
Moyenne
0 20 40 60 80 100 120 140 160 Mai JuinJuillet Aoû t Sep t Oct b Nov Dec Janv Fé v Mar s Avril Mois M E S ( m g /l)
Figure 20: Variations mensuelles de la transparence de l’eau au centre du lac Oubeïra (Août 2004 – Avril 2005).
Figure 19 : Variations mensuelles de la teneur moyenne en matière en suspension dans l’eau (lac Oubeïra; Mai 2004 – Avril 2005).
-0,3 -0,25 -0,2 -0,15 -0,1 -0,05 0 Aoû t Sept Octob re Nov Dec Janv Fév Mars Avr il Mois P r o fo nde ur ( m ) Centre