© Anne-Sophie Larivière-Lajoie, 2020
Évaluation de la qualité de la viande de lapin produite au
Québec
Mémoire
Anne-Sophie Larivière-Lajoie
Maîtrise en sciences animales - avec mémoire
Maître ès sciences (M. Sc.)
Évaluation de la qualité de la viande de lapin
produite au Québec
Mémoire
Anne-Sophie Larivière-Lajoie
Sous la direction du :
ii
Résumé
L’objectif de ce projet de recherche était d’évaluer la qualité de la viande de lapin produite au Québec en prenant en considération l’impact des différentes gestions préabattage. Pour ce faire, cinq producteurs furent sélectionnés en collaboration avec le Syndicat des producteurs de lapins du Québec. Les lapins furent abattus dans deux abattoirs sous juridiction provinciale située au Québec et dans deux abattoirs sous juridiction fédérale, un situé au Québec et l’autre en Ontario. Le pH musculaire du Longissimus lumborum (LL) et du Biceps femoris (BF) fut mesuré après 1h (pH1h) et 24h (pHu) post-mortem pour les lapins abattus au Québec. Les pertes en eau (par exsudation et à la cuisson) furent mesurées sur le LL. Tous les pH1hBF et 97,6% des pH1hLL étaient >6. Les valeurs variaient entre 5,70 et 6,58 pour le pHuLL, entre 5,80 et 6,83 pour le pHuBF et entre 0,00 et 2,56% pour la perte de poids par exsudation du LL. Une analyse en cluster hiérarchique basée sur le pHu, la perte en eau à la cuisson et la luminosité de 200 LL fut effectuée pour regrouper les LL ayant une qualité similaire. Des quatre groupes créés par l’analyse en cluster hiérarchique, les groupes 3 et 4 présentaient la plus faible qualité et une viande à pH élevé comme retrouvé pour la viande DFD (40% des LL analysées). Les groupes 1 et 2 avaient la meilleure et la deuxième meilleure qualité de viande, respectivement. Pour les lapins abattus en Ontario, la meilleure gestion préabattage était celle où les mangeoires étaient gardées en place, mais avec les lumières ouvertes avant le long voyage (7h). Même si la majorité (60%) des LL analysés se retrouvait dans les groupes 1 et 2, en général, la qualité de la viande de lapin produite au Québec est variable au sein du secteur suggérant que plusieurs facteurs ne sont pas encore complètement contrôlés dans la chaîne de valeur.
iii
Abstract
The aim of this study was to characterize meat quality from rabbits commercially raised in Quebec, taking into account, notably, the impact of the various preslaughter management practices, transport distances and feed withdrawal efficiency. Five producers were selected for this study in collaboration with the provincial rabbit producers’ association. Rabbits were slaughtered in two provincially inspected plants both located in Quebec and two federally inspected plants, one located in Quebec and one in Ontario. Muscular pH of the Longissimus lumborum (LL) and the Biceps femoris (BF) muscles were measured 24 h (pHu) and also after 1 h (pH1h) post-mortem for animals slaughtered in the abattoirs located in Quebec. Drip loss and cooking loss were measured on the LL. All pH1hBF and 97.6% of pH1hLL were >6. Values ranged from 5.70 to 6.58 for pHuLL and from 5.80 to 6.83 for pHuBF. Values for rabbit meat drip loss ranged between 0.00 and 2.56%. Of the four clusters created by the hierarchical cluster analysis based on pHu, cooking loss and L* and on 200 rabbit loins, clusters 3 and 4 had the lowest meat quality and presents meat with high pH as seen, notably, with DFD meat (40% of the loins analysed). The clusters 1 and 2 were the best and the second-best meat quality groups, respectively. For rabbits slaughtered in Ontario, due to the long journey, preslaughter management that worked best was when the feeders were left in place, but with the lights on prior to transport (7h). Though the majority (60%) of the loins analyzed were grouped into the upper quality clusters 1 and 2, overall, rabbit meat quality produced in Quebec is rather variable among the sector suggesting that many factors are not yet fully controlled in the value chain.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... viii
Liste des abréviations ... xi
Remerciements ... xiii
Avant-propos ... xv
Introduction ... 1
Chapitre 1 Revue de la littérature ... 3
1.1. Indicateur de stress et de bien-être animal ... 3
1.1.1. Comportement ... 3
1.1.2. Cortisol sanguin ... 5
1.1.3. Lactate sanguin ... 6
1.2. Qualité microbiologique de la viande ... 7
1.2.1. Rôle des microorganismes sur la durée de vie tablette et l’innocuité de la viande ... 7
1.2.2. Les bactéries pathogènes... 9
1.2.3. Les bactéries responsables de l’altération de la viande ... 12
1.2.4. La contamination des carcasses lors du processus d’abattage ... 13
1.3. Qualité physicochimique de la viande ... 18
1.3.1. Caractéristiques du muscle ... 18
1.3.2. Détermination de la qualité de la viande ... 21
1.3.3. La classification de la viande ... 34
1.4. Influence de la gestion préabattage sur la qualité de la viande ... 39
1.4.1. Le jeûne préabattage ... 39
1.4.2. Le transport vers l’abattoir... 43
1.4.3. La période de repos avant l’abattage ... 46
Conclusion ... 48
Liste des ouvrages cités ... 49
Chapitre 2 : Hierarchical clustering as a tool to develop a classification scheme for rabbit meat quality ... 61
Résumé ... 61
Abstract ... 61
2.1. Introduction ... 63
v
2.2.1. Producer selection ... 65
2.2.2. Behavioural observations ... 67
2.2.3. Physiological measures ... 67
2.2.4. Meat quality measurement ... 67
2.2.5. Statistical analysis ... 68
2.3. Results ... 69
2.3.1. Behavioural Parameters ... 69
2.3.2. Physiological parameters ... 72
2.3.3. Meat Quality characteristics ... 74
2.3.4. Correlations amongst physiological parameters ... 78
2.3.5. Correlations amongst meat quality characteristics ... 80
2.3.6. Relationship between physiological parameters and meat quality characteristics ... 82
2.3.7. Meat quality clustering ... 84
2.4. Discussion ... 89
2.4.1. Rabbit behaviour ... 89
2.4.2. Physiological parameters ... 89
2.4.3. Meat quality characteristics ... 90
2.4.4. Rabbit meat classification ... 91
2.5. Conclusion ... 95
vi
Liste des tableaux
Tableau 1.1
Incidences des toxi-infections alimentaires au Canada en 2016. ... 8
Tableau 1.2
Classements des bactéries pathogènes en fonction du nombre de
cas de toxi-infections alimentaires rapportées. ... 9
Tableau 1.3
Dénombrement des bactéries aérobes totales retrouvées sur des
carcasses de bœufs ayant différents niveaux de propreté de
pelage. ... 15
Tableau 1.4
Comparaisons des comptes de bactéries aérobes totales, de
coliformes et d’E. coli sur des carcasses de bœuf sortant de
l’habillage entre deux abattoirs. ... 16
Tableau 1.5
Dénombrement des bactéries aérobes en fonction du contenu en
gras de la viande. ... 18
Tableau 1.6
Caractéristiques des différents types de fibres musculaires. ... 20
Tableau 1.7
Couleur de la viande de différentes espèces animales (valeurs
moyennes du muscle Longissimus dorsi ; m. Pectoralis major
chez le poulet). ... 28
Tableau 1.8
Potentiel glycolytique chez différentes espèces et muscles. ... 33
Tableau 1.9
Caractéristiques des cinq classes de viande chez le porc. ... 34
Tableau 1.10
Comparaison des valeurs obtenues pour différents paramètres
physicochimiques du Longissimus lumborum par Koné et
al. (2016; 2018; 2019). ... 39
Table 2.1
Preslaughter management according to the producers and the
season
1... 66
Table 2.2
Percentage (%) of rabbits presenting different types of
interactions and activities during prefasting observations at the
farm
1... 71
Table 2.3
Correlations among the physiological parameter measured from
rabbits slaughtered in different abattoirs and raised at different
vii
Table 2.4
Correlations among the meat quality characteristics measured
from rabbits slaughtered in different abattoirs and raised at
different farms ... 81
Table 2.5
Meat quality characteristics of rabbit loin (Longissimus
lumborum muscle) grouped by a hierarchical cluster analysis
viii
Liste des figures
Figure 1.1
Structure d’un muscle strié. Adaptée de Marieb et
Laurendeau (1993). ... 19
Figure 1.2
Chute du pH du Longissimus dorsi suite à la mort d’un bovin.
Adapté de Byrne et al. (2000). ... 22
Figure 1.3
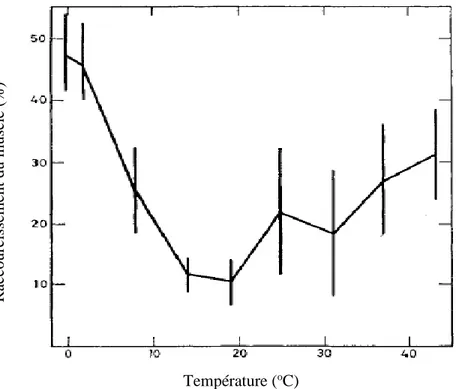
Raccourcissement du Sternomandibularis de bœuf entreposé à
différentes températures pendant le développement de la rigidité
cadavérique. Adapté de Locker et Hagyard (1963). ... 23
Figure 1.4
Le pH ultime (pHu) de la viande appartenant à différentes
espèces animales (valeurs moyennes du muscle Longissimus
dorsi ; m. Pectoralis major chez le poulet). Adapté de Dalle
Zotte (2000a) ; Correa et al. (2007) ; Karaca et al. (2016) ;
Ponnampalam et al. (2017) et de Cullere et Dalle Zotte (2018). ... 26
Figure 1.5
Les différentes formes de la myoglobine et leur couleur
associée. Adapté de Surendranath et Poulson (2013). ... 27
Figure 1.6
Relation entre le potentiel glycolytique (PG) et le pHu du
Longissimus du bœuf. Traduit de Wulf et al. (2002). ... 33
Figure 1.7
Apparence d’une viande pâle, molle et exsudative (« pale, soft
and exsudative »; PSE) comparativement à une viande normale.
Traduit de Adzitey et Nurul (2011). ... 36
Figure 1.8
Apparence d’une viande sombre, ferme et sèche (« dark, firm,
dry »; DFD) comparativement à une viande normale. Traduit de
Adzitey et Nurul (2011). ... 37
Figure 2.1
Percentage of rabbits sitting, lying down or moving during
prefasting observations at each farm visit (mean ± standard
error). Bars with different letters are significantly different from
each other with P < 0.05... 70
Figure 2.2
Descriptive statistics (means ± standard deviations) for the
physiological parameters measured from rabbits (n = 120)
slaughtered in the province of Quebec; blood lactate
concentration (A), gastrointestinal tract (GIT) weight (B),
stomach weight (C), caecum weight (D), stomach pH (E),
caecum pH (F), stomach DM (G) and caecum DM (H).
Max = maximum and Min = minimum. Stomach DM and
ix
Figure 2.3
Descriptive statistics (means ± standard deviations) for meat
quality characteristics measured from rabbits (n = 200)
slaughtered in different abattoirs and raised at different farms;
pH1hLL (A), pH1hBF (B), pHuLL (C), pHuBF (D), drip
loss (E) and cooking loss (F). Data for pH1h LL and BF were
available only for rabbits slaughtered in Quebec (n = 120).
Max = maximum and Min = minimum. The pH1hBF and
pHuBF = pH after 1 h and 24 h post-mortem of the Biceps
femoris (BF) muscle, respectively; pH1hLL and pH
uLL = pHafter 1 h and 24 h post-mortem of the Longissimus
lumborum (LL) muscle, respectively. Drip loss and cooking
loss were from the LL muscle. ... 75
Figure 2.4 Descriptive statistics (means ± standard deviations) for the meat
colour parameters measured from rabbits (n = 200) slaughtered
in different abattoirs and raised at different farms;
LL L* (A),
BF L* (B), LL a* (C), BF a* (D), LL b* (E), BF b* (F), LL
C* (G), BF C* (H), LL h (I) and BF h (J). Max = maximum and
Min = minimum.
LL = Longissimus
lumborum
muscle; BF = Biceps
femoris
muscle; LL C*,
LL h = chroma (C*) and hue angle (h) of the LL muscle,
respectively. BF C*, BF h = C* and h of the BF muscle,
respectively. ... 77
Figure 2.5
Principal
component
analysis:
relationship
between
physiological parameters and meat quality characteristics for
rabbits (n = 120) slaughtered in the province of Quebec.
StomachDM and CaecumlDM = stomach and caecum dry
matter, respectively; StomachpH and CaecumpH = pH of the
stomach and caecum, respectively; StomachWeight and
CaecumWeight = weight of the stomach and caecum,
respectively; lactate = blood lactate concentration; pH1hBF and
pHuBF = pH of the Biceps femoris (BF) muscle after 1 h and
24 h post-mortem, respectively; pH1hLL and pHuLL = pH of
the Longissimus lumborum (LL) muscle after 1 h and 24 h
post-mortem, respectively; DripLoss and CookingLoss = drip loss
and cooking loss of the LL muscle; LL C*, LL h = chroma (C*)
and hue angle (h) of the LL surface, respectively; BF C*,
BF h = C* and h of the BF surface, respectively. ... 83
Figure 2.6
Distribution of the 200 rabbit Longissimus lumborum (LL)
samples, assigned to one of the four clusters that were formed
using a hierarchical analysis, based on (A) pHuLL and cooking
loss (%), (B) pHuLL and LL L* and (C) cooking loss (%) and
meat lightness (LL L*). The horizontal line on (A) and (B)
xi
Liste des abréviations
Abréviations françaisesATP Adénosine triphosphate BF Biceps femoris
DEP Diarrhée épidémique porcine
HHS Axe hypothalamo-hypophyso-surrénalien LL Longissimus lumborum
Mb Myoglobine
PCC Points critiques de contrôle PG Potentiel glycolytique pHu pH ultime, pH 24 h SGI Système gastro-intestinal TIA Toxi-infections alimentaires UFC Unité formatrice de colonies
Abréviations anglaises
DFD Dark, firm, dry DM Dry matter
FAO Food and Agriculture Organization of the United Nations GIT Gastrointestinal tract
pHu Ultimate pH
xii
La première étape est de dire que tu peux
-Will Smith
xiii
Remerciements
Pendant toute ma maîtrise, j’ai eu la chance d’être accompagnée et guidée par des personnes géniales sans qui rien de tout cela n’aurait été possible. J’aimerais leur rendre hommage dans cette section.
Je tiens tout d’abord à remercier Linda Saucier, sans qui rien de tout cela n’aurait été possible. Merci de m’avoir intégrée à ton équipe dès le baccalauréat, en tant qu’auxiliaire de recherche, puis comme stagiaire en recherche et en tant qu’étudiante à la maîtrise. Je serai toujours reconnaissante pour ton écoute, tes conseils, ta motivation et ta disponibilité lors de ce projet. Finalement, j’aimerais te remercier profondément de m’avoir permis de gérer ce gros projet ; j’espère avoir été à la hauteur de tes attentes.
Merci beaucoup à Frédéric Guay et Dany Cinq-Mars qui m’ont accompagné lors de mon cheminement. Merci pour tous les conseils et suggestions que vous m’avez prodigués tout au long de ma maîtrise.
Joanie, je tenais à te remercier pour toute l’aide que tu m’as apportée en microbiologie, sans toi, je serais encore dans le laboratoire. J’aimerais aussi remercier la personne géniale que tu es pour tous les bons moments qu’on a passés ensemble! Bonne chance dans tes projets futurs.
Merci à Dominic Gagné, Annie Pelletier, Annick Rioux, Isabelle Laflamme, Nancy Bolduc et Micheline Gingras pour votre professionnalisme et votre aide lors des analyses autant en abattoir qu’en laboratoire. Vous fûtes d’une aide précieuse.
Un gros merci à Simon et Pascal pour toute l’aide que vous m’avez apportée lors de mon projet, ce fut extrêmement apprécié.
Je remercie aussi les stagiaires d’été qui m’ont aidé aux différentes étapes du projet.
Merci beaucoup à Hélène Fecteau et Marie-Pierre Fortier pour toute l’aide que vous m’avez apportée en abattoir et dans le réfrigérateur lors des analyses de qualité de la viande.
Je remercie aussi la Dre Dorine Tremblay pour son professionnalisme lors des abattages.
Un gros merci à tous les gens impliqués de près et de loin dans ce projet : autant les producteurs de lapins que j’ai eu la chance de connaître que le personnel des abattoirs, Cunico et les Gibiers Canabec.
xiv
Ce projet n’aurait également pas pu voir le jour sans le soutien financier du Programme de Soutien à l’innovation en agroalimentaire, un programme issu de l’accord Cultivons l’avenir entre le Ministère de l’Agriculture des Pêcheries et de l’Alimentation du Québec (MAPAQ) et Agriculture Agroalimentaire Canada (AAC). Merci au Syndicat des producteurs de lapins du Québec pour leur collaboration.
Merci à Jérome pour ton soutien, ton support et ta présence lors de cette maîtrise. Tu es parfait et je t’aime.
À ma famille, merci de m’avoir appuyée tout au long de cette maîtrise. À mes grands-parents, je vous remercie pour votre soutien et de votre intérêt pour tout ce que j’effectue. Un merci particulier à mes parents. Papa, je te remercie de m’avoir toujours supporté dans mes choix. Maman, merci de m’avoir toujours écoutée et remonté le moral lors des moments les plus difficiles. Je n’aurai pu rêver de meilleurs parents. Je vous adore et, maman, je n’ai pas lâché la patate!
xv
Avant-propos
Ce mémoire comporte deux chapitres. Le premier chapitre consiste en une revue des travaux antérieurs afin de bien comprendre ce qu’est la qualité de la viande, comment elle est mesurée et finalement de bien comprendre comment la gestion préabattage l’influence. Le deuxième chapitre, rédigé sous forme d’article scientifique, est intitulé : « Hierarchical clustering as a tool to develop a classification scheme for rabbit meat quality » et sera soumis pour publication dans la revue « Meat Science ». Je suis l’auteur principal de cet article, les coauteurs sont les chercheurs D. Cinq-Mars, F. Guay, A. Dalmau et L. Saucier ainsi que l’étudiant au doctorat, S. Binggeli.
1
Introduction
Dans le monde, l’Asie produit le plus de viande de lapin avec 75,3 % de la production mondiale, suivi de l’Europe (21,3 %), de l’Afrique (7,06 %) et finalement des Amériques (1,23 %; FAO, 2017). En 2014, la consommation était de 25 g par personne au Canada et de 40 g par personne au Québec (MAPAQ, 2015a). Par contre au Québec, sa consommation a augmenté de 3 % par année entre 2010 et 2014 (MAPAQ, 2015a). Au Canada et au Québec, la viande de lapin est considérée comme une viande de spécialité, c’est-à-dire destinée à certaines communautés ethniques, ou encore comme une viande pour les jours plus festifs, comme Pâques et Noël. Ces caractéristiques font en sorte que la consommation de viande de lapin est variable pendant l’année, ce qui apporte des défis majeurs pour le secteur en termes de gestion de la production et des inventaires.
Comme la population est, de plus en plus, à la recherche de saines habitudes afin de se maintenir en santé (Combes, 2004), la viande de lapin devient une source de protéines intéressante. En effet, sa faible teneur calorique, ses lipides fortement insaturés, sa richesse protéique (20-21 %) et son faible taux de cholestérol en font une viande ayant de bonnes qualités nutritionnelles (Dalle Zotte, 2000a). La viande de lapin est aussi intéressante pour les consommateurs curieux d’essayer de nouveaux produits et recherchant une alimentation variée (« foodies » ; Fread, 2014). Bien que marginale au Québec et au Canada, la production cunicole diversifie tout de même l’offre alimentaire et la qualité doit toutefois être au rendez-vous pour en justifier le prix.
Les attributs de qualité associés à la viande sont influencés par plusieurs facteurs tels que, l’espèce animale, la génétique, l’alimentation, la gestion préabattage (temps de jeûne, la durée du transport jusqu’à l’abattoir, le temps d’attente à l’abattoir) ainsi que la gestion des carcasses (e.g. température et vitesse de refroidissement ; Saucier, 2016). Si la gestion préabattage des animaux n’est pas adéquate, par exemple, à cause d’un jeûne, transport et temps d’attente trop long, des effets néfastes sur la qualité de la viande seront observés. Celle-ci est bien définie dans la littérature pour certaines espèces animales telles que le porc et la volaille. Au Canada, le temps de jeûne présentement recommandé est de 16-24 h (Faucitano et al., 2006) et 6-10 h (Les producteurs de poulet du Canada, 2015) pour le porc et le poulet, respectivement. Pour le bœuf, les animaux doivent seulement avoir bu et manger dans les 5 h précédant l’embarquement, si la durée du trajet est de plus de 24 h (CNSAE, 2013). Actuellement, pour le lapin, elle n’est pas bien définie. À notre connaissance, la seule littérature disponible à propos de l’effet du jeûne sur la qualité de la viande des lapins est un résumé de congrès (Bianchi et al., 2008) recommandant un temps de jeûne de 15 h
2
afin d’obtenir un poids d’estomac satisfaisant, tout en maintenant un niveau de qualité physicochimique de la viande adéquat. Malgré cela, la nouvelle convention de mise en marché du lapin au Québec demande qu’un jeûne préabattage minimal de 12 h soit appliqué par les producteurs (RMAAQ, 2019). Le maximum recommandé est équivalent à celui du porc, soit de 24 h (CNSAE, 2018).
Par conséquent, les travaux de recherches de ce mémoire ont comme objectif d’évaluer la qualité de la viande de lapin produite au Québec et provenant d’abattoirs sous inspection provinciale et fédérale tout en tenant compte de la gestion préabattage. Une fois terminé, ce projet permettra à la filière cunicole québécoise d’avoir une idée plus précise de la qualité de la viande qu’elle produit et de développer les stratégies pour l’améliorer. Notre hypothèse est que, malgré les efforts de concertation de la filière cunicole, la qualité de la viande des lapins élevés au Québec varie, notamment en fonction de la gestion préabattage utilisée par les producteurs.
Tout d’abord, ce mémoire permettra de mieux comprendre ce qu’est la qualité de la viande, comment elle est mesurée et finalement comment la gestion préabattage l’influence. Le second chapitre de ce mémoire traitera plus spécifiquement de l’évaluation de la qualité de la viande de lapin produite au Québec.
3
Chapitre 1 Revue de la littérature
1.1. Indicateur de stress et de bien-être animal
La réponse aux stress commence par la détection d’une menace afin d’enclencher les processus liés à l’homéostasie par le système nerveux central de l’animal. L’animal développe ensuite une réponse biologique ou de défense qui consiste en une combinaison de plusieurs réactions (Gregory, 1998). La réponse peut être comportementale ou physiologique. L’activation du système nerveux autonome (réponse physiologique et activation des glandes surrénales) et des réponses neuroendocriniennes et immunitaires (Moberg, 2000) s’ensuivent. Dans le cas de plusieurs types d’éléments déclenchant un stress, la première réponse est comportementale. Cependant, il n’est pas toujours possible de répondre de cette manière, car l’environnement peut empêcher son expression. Par exemple, un animal qui aura, normalement, la fuite comme première réaction face à un facteur de stress ne pourra pas s’éloigner s’il est dans un endroit confiné. La deuxième ligne de réponse est l’activation du système nerveux autonome. Ce système affectera plusieurs fonctions physiologiques de l’animal telles que les systèmes cardiovasculaire et gastro-intestinal, et activera les glandes surrénales qui produiront des catécholamines telles que l’adrénaline, l’épinéphrine, la noradrénaline et la norépinéphrine en quelques secondes (Gregory, 1998). La libération de ces hormones entraîne, entre autres, une augmentation du taux de dégradation du glycogène dans les muscles pour former du lactate et dans le foie pour former du glucose sanguin (Gregory, 1998). La réponse comportementale et l’activation du système nerveux automne sont des réponses de l’animal face au stress à court terme. Lorsque le stress persiste, la réponse est neuroendocrinienne et il y aura activation de l’axe hypothalamo-hypophyso-surrénalien (HHS). Cet axe produira le cortisol et les corticostérones qui se retrouveront en plus grande quantité dans le sang lorsqu’un animal subit un stress (Lapeyrade, 1998). Les effets de ces hormones sont de plus longue durée que ceux du système nerveux autonome (Moberg, 2000). Lorsqu’il faut évaluer le stress chez les animaux, le principal problème vient du fait que tous les animaux n’ont pas tous la même résilience face au stress. En effet, les expériences de l’animal, la génétique, les relations sociales, l’âge ainsi que les interactions humain-animal influenceront la réponse d’un animal face à un évènement (Moberg, 2000).
1.1.1. Comportement
Comme la domestication des lapins est relativement récente comparativement à d’autres espèces animales dont on fait l’élevage, le comportement des lapins domestiques n’est pas substantiellement différent de celui des lapins sauvages, si ce n’est pour certains comportements
4
qui ont été amplifiés. Par exemple, les lapins domestiques sont plus actifs le jour que les lapins sauvages. Malgré cela, les deux sont majoritairement actifs la nuit (Lebas, 1997 ; Trocino et Xiccato, 2006).
En milieu naturel, les lapins vivent en groupe d’un à quatre mâles et d’une à neuf femelles (Cowan et Bell, 1986 ; Lehmann, 1991 ; Trocino et Xiccato, 2006). Entre les mâles, la dominance est clairement établie. Le mâle alpha protège le territoire du groupe et est agressif envers les lapins étrangers. Entre les femelles, une hiérarchie s’établit aussi, car il existe une compétition pour les meilleurs sites de nidification (Cowan et Bell, 1986 ; Trocino et Xiccato, 2006). Cependant, en situation commerciale, aucune ségrégation hiérarchique n’existe (Vervaecke et al., 2010). Les lapins passent la majeure partie de leur temps de repos en contact étroit les uns avec les autres. Les contacts sociaux sont extrêmement importants pour un lapin. En contexte expérimental, ils sont prêts à mettre autant d’effort pour avoir un contact social que pour avoir accès à de la nourriture (Vervaecke et al., 2010). Dans la nature, un lapin est souvent vu en train de garder l’entrée du terrier et alertera les autres lapins en tapant une de ses pattes arrière sur le sol en cas de danger. Parmi les autres comportements reliés à la réponse aux dangers pouvant être observés, citons une position d’alerte lors de laquelle le lapin sera dressé sur son postérieur, une course rapide vers un abri ou une immobilité (Trocino et Xiccato, 2006).
En situation commerciale, les lapins sont engraissés en groupe, mâles et femelles mélangés, afin de reproduire leur comportement social (Trocino et Xiccato, 2006). Cependant, une densité maximale de 16-18 lapins/m2 est recommandée afin de limiter l’agressivité, les blessures, le taux de mortalité et afin d’optimiser la croissance et la qualité de la viande (Szendrő et Dalle Zotte, 2011). Au Québec, le respect de cette densité permet aux éleveurs d’avoir 6-7 lapins/cage lors de l’engraissement. Le poids d’abattage moyen de 2,5 kg est atteint lorsque les lapins sont âgés de 70-98 jours (Cliche et Sylvestre, 2009). La création de la hiérarchie débute aux environs de 70 jours de vie et elle est linéaire (Lehmann, 1991 ; Vervaecke et al., 2010). L’établissement de la hiérarchie est source de blessures, surtout aux oreilles, mais lorsque les animaux ont suffisamment d’espace, les agressions sont de courte durée, car les lapins dominés peuvent s’éloigner suffisamment. Toutefois, comme l’espace est limité au sein d’une cage, il peut arriver que les lapins subordonnés soient blessés par les dominants, car ils ne peuvent pas s’éloigner suffisamment en cas d’attaque (Lehmann, 1991).
Comme la majorité des animaux d’élevage sont des proies dans la nature, les humains sont généralement perçus comme des prédateurs et génèrent ainsi de la peur. La peur peut être une
5
source importante de stress et elle peut occasionner une diminution importante de la productivité des animaux ainsi que de rendre leur manipulation plus difficile et dangereuse tant pour les humains que pour les animaux. Dans les fermes traditionnelles, les animaux avaient des contacts plus fréquents et neutres avec les humains qui faisaient partie d’une routine journalière. Avec l’intensification des élevages, les animaux ont peu ou, dans certains cas, pas de contact avec les humains et lorsqu’ils en ont, les interactions sont négatives (vaccination, transport). Ainsi, si aucune interaction positive n’est faite, la peur envers les humains est renforcée et aura des conséquences négatives sur la physiologie, la production et le bien-être de l’animal (Rushen et al., 1999).
En production cunicole, comme les contacts entre les humains et les lapins sont relativement fréquents, une relation positive entre humain et lapin est observée, entraînant une réduction de la peur engendrée par la présence humaine (Csatádi et al., 2005). De plus, Csatádi et al. (2005) ont montré qu’un contact humain minimal (5 secondes), durant la première semaine de vie des lapereaux, permettrait de les rendre plus dociles en plus de réduire leur peur face aux humains.
1.1.2. Cortisol sanguin
Cette hormone stéroïdienne est sécrétée par le cortex cérébral et formée à partir du cholestérol. Lorsque relâchée dans le sang par l’activation de l’axe HHS, elle mobilise les réserves énergétiques via l’activation ou l’inhibition de certaines fonctions métaboliques. Parmi celles-ci, le cortisol active la gluconéogenèse (formation du glucose) et inhibe la glycolyse. Elle régule aussi l’activité lipolytique et protéolytique et module le système immunitaire en exerçant des effets immunosuppresseurs afin de maintenir l’homéostasie de l’animal (Sapolsky et al., 2000 ; Russel et al., 2012). La présence de cortisol affectera la production de certains globules blancs, augmentera les neutrophiles au détriment des lymphocytes et pourra également diminuer l’activité de ces globules sanguins (Bergeron et Lewis, 1999). Comme ces derniers ont un rôle important dans la défense contre les infections virales et bactériennes, le stress influence grandement la santé des animaux. La sécrétion de cortisol par l’organisme accélèrera aussi l’utilisation des réserves musculaires en glycogène afin de fournir l’énergie nécessaire à la formation du glucose (Accorsi et al., 2017). La concentration en cortisol est généralement utilisée comme mesure du stress à long terme, car celle-ci augmente lors d’un stress et se retrouve dans le sang plusieurs minutes après l’activation de l’axe HHS (Novak et al., 2013 ; Heimbürge et al., 2018). Le temps de demi-vie de cette hormone dans le sang varie de 20 à 60 minutes (Gregory, 1998). Ainsi, elle peut être utilisée
6
pour mesurer le niveau de stress d’un animal faisant face à un élément stressant persistant (marqueur de stress à long terme) et pour évaluer l’adaptation de l’animal face à ce stress.
Lors d’un stress prolongé, l’axe HHS restera activé sur une longue période de temps induisant des effets néfastes sur la santé des animaux tels que la suppression des capacités de reproduction et du système immunitaire. Ces suppressions augmenteront la sensibilité de l’animal à divers agents pathogènes (Lapeyrade, 2014).
Plusieurs facteurs peuvent influencer l’interprétation du taux de cortisol sanguin. Premièrement, le cortisol n’est pas seulement produit par l’organisme en réponse à un stress. Une augmentation de l’activité de l’axe HHS peut aussi être causée par un état affectif positif, des comportements d’accouplement et à la suite d’une activité physique (Ralph et Tilbrook, 2016). Deuxièmement, comme le cortisol est une hormone circadienne, c’est-à-dire que la concentration varie en fonction du moment de la journée, il faut s’attendre à la voir varier sur une période de 24 (Heimbürge et al., 2018). La concentration de cortisol sera maximale le matin (7-8 h) et diminuera tout le long de la journée pour être à son plus bas dans la nuit (23 h - 4 h ; Novak et al., 2013). De plus, comme tous les animaux n’ont pas la même résistance au stress, le taux de cortisol variera d’un individu à l’autre même si le traitement appliqué est le même (Novak et al., 2013).
1.1.3. Lactate sanguin
Une deuxième mesure pouvant être effectuée afin de déterminer le niveau de stress d’un animal est le lactate sanguin. Il est relâché dans le flot sanguin lors d’un stress ou bien lors d’une activité physique intense. Celui-ci est le produit final du métabolisme du glucose tant en aérobie qu’en anaérobie. Le lactate est reconnu pour être une mesure permettant d’évaluer la réponse d’un animal face à un stress, et ce chez plusieurs espèces (Langlois et al., 2014). Il est un indicateur de stress à court terme, car la concentration maximale est atteinte en quatre minutes et retombe à son niveau normal deux heures après une activité physique (Edwards et al., 2010). Chez un lapin en santé, la valeur moyenne de lactate sanguin est de 6,9 ± 2,7 mmol/L (Langlois et al., 2014). Cette valeur sera influencée par divers facteurs pouvant occasionner un stress pour l’animal tels que la gestion préabattage (jeûne, transport et temps d’attente à l’abattoir). Une valeur élevée de lactate sanguin avant l’abattage sera associée à un stress et à une viande de faible qualité (Edwards et al., 2010).
7
1.2. Qualité microbiologique de la viande
1.2.1. Rôle des microorganismes sur la durée de vie tablette et l’innocuité de la viande
La qualité microbiologique fait référence à l’altération ou à un problème d’innocuité associé à la présence de microorganismes indésirables ou leurs toxines. L’altération microbiologique de la viande est le résultat de la modification de la matrice alimentaire sous l’action des microorganismes (Lettelier, 2002). L’innocuité est liée au contrôle de toutes substances ou microorganismes qui, lorsque présents dans un aliment, pourraient rendre malade, provoquer des effets néfastes ou incommoder le consommateur (Lettelier, 2002). Celle-ci se divise en trois grandes catégories, soit physique, chimique (pesticides, antibiotiques, etc.) et microbiologique (microorganismes pathogènes et leur toxine). De plus, la viande est sujette à une contamination par des microorganismes tels les mésophiles totaux et les coliformes qui, sans que leur présence soit nocive pour la santé, peuvent être des indicateurs de la présence de microorganismes pathogènes. Le contrôle des microorganismes sur la viande n’est pas simple, c’est pourquoi ils posent problème à l’industrie alimentaire. Comme la viande est très périssable de nature (Saucier, 2016), sa durée de vie de tablette est limitée et sa contamination par les microorganismes pathogènes est responsable de nombreux cas de toxi-infections alimentaires chaque année. Entre le 1er avril 2014 et le 31 mars 2015, le groupe alimentaire viande et volaille était responsable d’environ 561 cas de toxi-infection alimentaire au Québec (MAPAQ, 2015b). 1.2.1.1. La durée de conservation de la viande
Étant donné que la viande est un produit très dense en nutriment, les bactéries n’ont pas de difficulté à croître et à l’utiliser comme substrat. De plus, d’autres caractéristiques de la viande viennent favoriser la croissance bactérienne, telles qu’une humidité élevée et un pH voisin de la neutralité. La durée de vie de la viande se définit comme étant le temps de conservation de celle-ci jusqu’à sa détérioration, principalement, par les bactéries (Borch et al., 1996). Une viande est considérée comme altérée et doit être retirée des tablettes si le consommateur la rejette quand sa couleur ou son odeur est jugée inacceptable ou si la concentration en microorganismes (à log 7) est trop élevée et devient problématique. Dans la viande fraîche, une concentration de 7 log unité formatrice de colonies (UFC) par g en aérobes mésophiles totaux constitue un point limite (ICMSF, 1986). C’est pourquoi, afin de réduire le gaspillage et l’altération des stratégies visant à améliorer l’innocuité et la qualité microbiologique de la viande doivent être mises en place.
8 1.2.1.2. Les toxi-infections alimentaires (TIA)
En 2016, au Canada, les autorités estimaient le nombre de toxi-infections à plus de 4 millions, dont près de 2,4 millions sont de causes inconnues (Santé Canada, 2016). Malgré le fait que les cas de norovirus sont les plus fréquents selon leur estimation, celui-ci ne cause pas le plus grand nombre de décès comme indiqué au Tableau 1.1. En effet, certaines bactéries telles Listeria monocytogenes et Escherichia coli O157:H7 ne font pas partie des organismes pathogènes ayant eu le plus de cas estimés de toxi-infections, mais sont ceux ayant causé respectivement 33 % et 8 % des décès estimés comparativement au norovirus avec 20 %.
Tableau 1.1 Incidences des toxi-infections alimentaires au Canada en 2016.
Nombre de cas estimés Nombres d’hospitalisations estimés Pourcentage des décès estimés Norovirus 1 048 000 (65 %) 1 180 (30 %) 20 % Salmonella spp. 87 500 (5 %) 925 (24 %) 16 % Campylobacter spp. 145 000 (8 %) 565 (14 %) N/D E. coli O157:H7 N/D 245 (6 %) 8 % Clostridium perfringens 177 000 (11 %) N/D N/D Listeria monocytogenes N/D N/D 33 % N/D : Non disponible. Tiré de Santé Canada (2016).
Au Québec, entre le 1er avril 2014 et le 31 mars 2015, la catégorie de produit ayant causé le plus de cas de TIA est le groupe viandes et volailles avec 35,6 % des déclarations. Les principales bactéries impliquées étaient : les salmonelles avec 79 cas, Campylobacter spp. avec 46 cas, E. coli entérohémorragique, dont O157:H7, avec 26 cas et Listeria avec 23 cas (MAPAQ, 2015b). Malgré la grande fréquence des toxi-infections rapportées ayant pour cause le norovirus au Canada, aucun cas ne fut rapporté au MAPAQ dans les dates de l’étude. L’explication la plus plausible serait que comme les symptômes sont de courte durée, la consultation d’un professionnel de la santé n’est pas jugée essentielle et n’est pas rapporté par le fait même (MAPAQ, 2015b). De plus, le nombre de cas rapporté pour Listeria occupe une plus grande proportion des déclarations que ce que l’on peut voir pour le Canada (Tableau 1.1).
En Ontario, entre 1992 et 2001, Campylobacter était le principal agent étiologique causant les TIA suivies des salmonelles, E. coli O157:H7, Yersinia, Shigella, Listeria et Clostridium botulinum. De
9
plus, entre 1997 et 2001, il y a eu 113 cas de décès reliés à l’ingestion de nourriture contaminée (OMAFRA, 2016).
Le tableau 1.2 illustre bien le rang des bactéries pathogènes en fonction du nombre de cas rapporté de toxi-infection au Canada, au Québec et en Ontario.
Tableau 1.2 Classements des bactéries pathogènes en fonction du nombre de cas de toxi-infections alimentaires rapportées.
Rang des organismes pathogènes
Canada1 Québec2 Ontario3
1 Norovirus Salmonelles Campylobacter spp.
2 Clostridium
perfringens
Campylobacter spp. Salmonelles
3 Campylobacter spp. E. coli O157:H7 E. coli O157:H7
4 Salmonelles Listeria spp. Yersinia
5 E. coli O157:H7 Virus indéterminé Shigella
6 Listeria monocytogenes N/D Listeria monocytogenes N/D : Non disponible 1 Santé Canada, 2016. 2 MAPAQ, 2015b. 3 OMAFRA, 2016.
1.2.2. Les bactéries pathogènes
Ces bactéries peuvent occasionner de graves problèmes de santé publique tel que discuté dans la section précédente. Ainsi, pour mieux les contrôler, il devient pertinent de connaître quelques-unes de leurs caractéristiques.
1.2.2.1. Listeria monocytogenes
L. monocytogenes est une bactérie pathogène ubiquitaire dans la nature pouvant se retrouver sur et dans la viande via une contamination lors de l’habillage des carcasses par les organismes provenant du pelage, des fèces ou encore de l’environnement d’abattage (Ferreira et al., 2014a). Celle-ci a la capacité de persister dans l’environnement de l’usine grâce à la formation de biofilm (Bridier et al., 2015).Un biofilm est une communauté composée de plusieurs bactéries plus ou moins complexes,
10
souvent symbiotiques, adhérant entre elles ainsi qu’à une surface, et marquée par la sécrétion d’une matrice adhésive et protectrice. Ce qui rend le nettoyage des équipements et de l’environnement de l’usine plus difficile afin d’éliminer sa présence. Bien que moins fréquente dans les cas rapportés de TIA (voir section sur les toxi-infections alimentaires), le taux de mortalité provoqué par la listériose est très élevé comparativement à d’autres maladies d’origine alimentaire tel qu’indiqué dans la section 2.2. En effet, la listériose est particulièrement dangereuse pour les personnes immunodéprimées, les jeunes enfants et les personnes âgées. De plus, elle peut occasionner des avortements chez les femmes enceintes (ACIA, 2016a). L. monocytogenes peut croître dans des milieux ayant un pH variant de 4,7 à 9,2, mais sa croissance n’est optimale que dans un milieu neutre ou faiblement alcalin. De plus, un des problèmes que l’on rencontre avec L. monocytogenes est qu’elle est psychrotrophe, c’est-à-dire qu’elle peut croître jusqu’à des températures aussi basses que -5 °C. Ce qui devient problématique en industrie, car sa croissance n’est pas complètement contrôlée par la réfrigération de la viande (Gray et Killinger, 1966 ; Petran et Zottola, 1989 ; Walker et al., 1990 ; Phan-Thanh et Montagne, 1998).
1.2.2.2. Enterobacteriaceae
Les entérobactéries sont des bacilles gram négatif qui sont retrouvés dans l’environnement, mais surtout dans l’intestin des animaux (Nychas et al., 2008). Ces bactéries sont fréquemment rencontrées en pathologie infectieuse. En effet, les entérobactéries sont un indicateur de sécurité alimentaire pour la viande et les produits carnés et leur dénombrement permet aussi l’évaluation de la contamination entérique (Ghafir et al., 2008 ; Nychas et al., 2008). Parmi les entérobactéries pathogènes, il y a, entre autres, les E. coli entérotoxiques tels qu’E. coli O157:H7, certaines Shigella et Yersinia, les salmonelles, etc. Cependant, une conservation en conditions anaérobes limiterait la croissance des entérobactéries, car le CO2 et l’acide lactique sont des agents inhibiteurs de leur croissance. Par contre, les effets inhibiteurs du CO2 et de l’acide lactique diminuent avec l’augmentation de la température, du pH de la viande ainsi que de la perméabilité de l’emballage (Dainty et Mackey, 1992). Ainsi, leur développement est favorisé lorsque la viande a un pH élevé (> 6) et lorsque les conditions de réfrigération ne sont pas adéquates (10 °C; Dainty et Mackey, 1992).
1.2.2.3. Pateurella multocida
Pasteurella multocida est une bactérie à gram négatif responsable de la pasteurellose. Celle-ci affecte plusieurs espèces animales telles que les porcs, bovins et lapins (Boucher et Nouaille, 2013).
11
La pasteurellose est la maladie bactérienne la plus fréquente et responsable de pertes économiques importantes dans les élevages de lapin du Québec (Doizé, 2009). Les symptômes respiratoires reliés à cette maladie sont le coryza, qui est une inflammation de la muqueuse des fosses nasales, la pneumonie et la bronchite. Si l’infection se propage jusqu’à l’oreille interne, les lapins présenteront une tête qui sera penchée sur un côté (torticolis; Coudert et al., 2006). Cependant, cette bactérie peut aussi former des abcès sous-cutanés souvent isolés et volumineux principalement retrouvés sur la gorge, les pattes et le dos (Boucher et Nouaille, 2013). Afin de limiter la contamination au sein d’un élevage, les animaux présentant des signes de pasteurellose doivent être éliminés et les facteurs responsables de la maladie, tels que les conditions environnementales et le transport, doivent être corrigés, car le traitement curatif est souvent infructueux en pratique (Doizé, 2009).
À l’abattoir, les tissus endommagés jugés impropres à la consommation incluant les ecchymoses et les abcès sous-cutanés sont responsables de pertes économiques et d’impacts négatifs sur la qualité de la viande (Ferreira et al., 2014b). En effet, la présence de plusieurs lésions ou des lésions importantes durant l’inspection de la carcasse mène à sa condamnation et élimination de la consommation humaine pour se retrouver au non comestible. Cependant, les abcès sous-cutanés ne sont pas seulement causés par Pasteurella spp. En effet, Staphylococcus aureus peut les provoquer. Sur 281 423 lapins abattus dans une année, Ferreira et al., (2014b) rapporte que 1 355 carcasses ont été jugées impropres à la consommation humaine due à la présence d’abcès. Toujours selon la même étude, la présence d’abcès a engendré la perte de 1 741 kg de viande supplémentaire dans le cas où les tissus endommagés ont pu être retirés de la carcasse. Pasteurella spp. était responsable d’environ 59,3 % des abcès détectés.
1.2.2.4. Autres bactéries pathogènes
Les salmonelles, les Campylobacter spp. ainsi qu’E. coli O157:H7 sont toutes trois dites mésophiles (Gill, 2001), c’est-à-dire que leur croissance est optimale lorsque la température se situe entre 20 et 40 °C, mais certaines peuvent croître à des températures aussi basses que 5 °C (Gill, 2001). En industrie, la pasteurisation et la réfrigération des carcasses sont des processus largement utilisés afin d’éliminer et de contrôler la prolifération des bactéries mésophiles sur la viande incluant ces organismes pathogènes de prévalence élevée dans les TIA. Cependant, contrairement à d’autres animaux d’élevage, la prévalence de Salmonella et de Campylobacter sur les carcasses de lapins est faible (Kohler et al., 2008).
12
1.2.3. Les bactéries responsables de l’altération de la viande
Afin de pouvoir améliorer l’innocuité ou d’améliorer la qualité microbiologique de la viande, il est essentiel de connaître quels sont les microorganismes responsables de son altération ainsi que leur source ou origine. De par sa nature, la viande est un excellent substrat pour soutenir le développement des bactéries. La disponibilité de composés à faible poids moléculaire comme le glucose, acides aminés ainsi que le glycogène en font un substrat de qualité et sont utilisés efficacement et rapidement (Saucier, 1999). La microflore d’altération de la viande se décrit comme étant l’ensemble des bactéries responsables de son altération (Doulgeraki et al., 2012). Les principales bactéries responsables de cette altération sont les Acinetobacter, Pseudomonas, Brochothrix, Flavobacterium, Psychrobacter, Moraxella, Spaphylococcus, Micrococcus, les bactéries lactiques ainsi que plusieurs Enterobacteriaceae (Jiménez et al., 1997 ; Doulgeraki et al., 2012).
1.2.3.1. Pseudomonas
Les principales bactéries aérobes responsables de cette altération, lorsque la viande est gardée entre -1 et 25 °C, sont, sans conteste, les Pseudomonas (Gill, 1983 ; Gennari et Dragotto, 1992 ; Koutsoumanis et al., 2006 ; Nychas et al., 2008). Celles-ci sont dites psychrotrophes, car elles peuvent croître à basse température, notamment lorsque la viande est réfrigérée (Ercolini et al., 2009). Elles vont consommer le glucose présent dans l’exsudat de viande afin de combler leur besoin énergétique et de croissance. Néanmoins, lorsque celui-ci n’est plus présent en quantité suffisante ou est épuisé, les Pseudomonas vont dégrader les acides aminés induisant la libération de dérivés soufrés et ammoniaqués donnant l’odeur caractéristique « d’œufs pourris » à la viande (Gill, 1983 ; Borch et al., 1996). Cependant, une quantité avoisinant les 107-8 UFC/g est nécessaire pour qu’il y ait une formation suffisante de mauvaises odeurs pour que le consommateur s’en aperçoit. Ce dernier jugera la viande impropre à la consommation et la rejettera (Lebert et al., 1998; Koutsoumanis et al., 2006). Pseudomonas fragi, plus particulièrement, produit des odeurs fruitées et putrides dans la viande de bœuf et occasionne une décoloration si elle est conservée à une température de 1 °C entraînant une apparence verdâtre et visqueuse (Lebert et al., 1998).
1.2.3.2. Bactéries lactiques
Les principales bactéries anaérobiques facultatives responsables de l’altération de la viande sont les Lactobacillus (Gill, 1983). Pour la viande gardée dans un environnement anaérobique
13
et à une température entre 2 et 15 °C, celles-ci croient plus rapidement que les autres contaminants (Newton et Gill, 1978). De plus, moins la température est élevée, plus leur croissance sera avantagée par rapport aux autres bactéries anaérobes (Newton et Gill, 1978). Lorsque leur concentration dans la viande avoisine 107 UFC/g, celles-ci interfèrent avec la croissance des autres bactéries via une production d’agents antimicrobiens et autres composés inhibiteurs tels que des acides organiques, de l’éthanol, du peroxyde d’hydrogène ainsi que des bactériocines (Newton et Gill, 1978) exerçant ainsi une exclusion compétitive sur les autres organismes. Lorsque leur concentration avoisine les 109 UFC/g, les bactéries lactiques vont avoir produit suffisamment d’acide lactique, un dérivé de leur métabolisme, pour aigrir la viande ; la rendant ainsi inapte à la consommation (Dainty et Mackey, 1992).
1.2.4. La contamination des carcasses lors du processus d’abattage
À l’exception des ganglions lymphatiques, les muscles des animaux en santé contiennent peu ou pas de microorganismes. C’est pendant les étapes suivant l’abattage que l’extérieur des découpes de viande se contamine (Huffman, 2002). Afin de réduire cette contamination, il est important de comprendre de quelle manière elle se produit. Dans ce sens, les principales portes d’entrée des contaminants et l’impact de la localisation sur la carcasse sur le profil microbiologique de la viande sont importants à considérer.
1.2.4.1. Les principales portes d’entrée des microorganismes
Plusieurs éléments peuvent être responsables de l’entrée des microorganismes sur les carcasses lors de l’abattage. Parmi ceux-ci, les principaux sont le pelage, les fèces, les voies respiratoires, le contenu du système gastro-intestinal des animaux ainsi que les mains et instruments des travailleurs (Dainty et Mackey, 1992 ; Bell, 1997). En effet, le pelage d’un animal peut transporter jusqu’à 9,0 log10 bactéries/cm2 de sol ou de matière fécale (Van Donkersgoed et al., 1997). Pour limiter la transmission de ces bactéries sur les carcasses, des mesures préventives à la ferme et en abattoir doivent être prises.
Comme le nombre et le type de microorganismes retrouvés sur la viande sont déterminés, entre autres, par l’environnement dans lequel les animaux sont élevés (Marshall et Bal'a, 2001), la biosécurité à la ferme n’est pas négligeable. Celle-ci se définit comme étant « l’ensemble des pratiques visant à réduire l’introduction de maladies et leur propagation au sein et hors des exploitations pouvant contenir du bétail » (ACIA, 2016b). Lorsque la diarrhée épidémique porcine (DEP) a fait son apparition dans des élevages aux États-Unis et en Ontario en 2013,
14
l’application de mesures de biosécurité adéquate dans les fermes du Québec c’est révélé efficace. Quelques cas seulement furent répertoriés au Québec en 2014, mais grâce à l’instauration de mesures préventives, elle ne s’est pas répandue de façon extensive. Parmi ces mesures préventives, il y a la limitation de la fréquence d’introduction de nouveaux animaux et la mise en place de protocoles d’assainissement des véhicules entrant sur le site (Conseil canadien de la santé porcine, 2010). En effet, les principales sources de transmissions de la maladie identifiées furent les véhicules qui ont servi à transporter des bêtes atteintes de la maladie, une surface ou du matériel contaminés, incluant les aliments du bétail ainsi que les vêtements et les chaussures souillées que portent les visiteurs (MAPAQ, 2017). Grâce à ces mesures, aucun nouveau cas de DEP n’a été identifié au Québec depuis novembre 2015 selon une étude menée par l’Équipe québécoise de santé porcine (EQSP, 2018).
L’implantation de plans de contrôle préventifs basés sur l’analyse des dangers et des points critiques à maîtriser, mieux connu sous le vocable de plan HACCP à la ferme ou en abattoir permet aussi de réduire la contamination. Les points critiques sont définis comme étant des étapes/procédures où l’on peut exercer un contrôle et où un danger peut être prévenu, éliminé ou amené à un niveau acceptable (Ropkins et Beck, 2000). Deux types de points critiques de contrôle (PCC) peuvent être identifiés. Le premier consiste à contrôler les PCC et le deuxième consiste à les minimiser (Gill, 2000). Ceux concernant la contamination de la viande par les agents pathogènes se retrouvent dans le deuxième type, car il n’est pas possible d’éliminer ou de prévenir entièrement la contamination microbiologique (Gill, 2000). Le choix des PCC est crucial afin qu’un plan de contrôle préventif soit efficace. Pour ce faire, des échantillons bactériologiques des carcasses doivent être pris à plusieurs étapes du processus d’abattage (Lammerding et Todd, 2006). De plus, plusieurs qualifient le plan de contrôle préventif de type HACCP comme étant le meilleur système présentement disponible afin d’améliorer l’innocuité des aliments en réduisant la contamination des carcasses dans les abattoirs (Tompkin, 1990 ; Biss et Hathaway, 1995). C’est pourquoi un plan de contrôle préventif est obligatoire pour les abattoirs et les usines de transformation de viande sous inspection fédérale (ACIA, 2014).
En abattoir, la viande peut se contaminer, à la fois par la microflore d’altération et par les microorganismes pathogènes, lors de plusieurs étapes du processus d’abattage comme celui-ci n’est pas effectué en conditions stériles. C’est pourquoi, au fil du temps, les procédures d’abattage se sont perfectionnées afin de limiter la contamination (Huffman, 2002). Cependant, certaines étapes comportent plus de risque que d’autres.
15
Premièrement, lors du dépiautage, des microorganismes peuvent être transférés sur la carcasse via un contact direct ou encore indirect avec le pelage souillé (Zweifel et al., 2014). Ainsi, la saleté du pelage d’un animal avant son abattage pourrait influencer la qualité microbiologique de la carcasse lorsque la peau est enlevée. Cependant, Van Donkersgoed et al. (1997) ont démontré que la saleté d’un animal n’a pas d’influence sur la quantité de bactéries aérobes totales retrouvées sur les carcasses (Tableau 1.3).
Tableau 1.3 Dénombrement des bactéries aérobes totales retrouvées sur des carcasses de bœufs ayant différents niveaux de propreté de pelage.
Condition du pelage1 Dénombrement moyen de bactéries aérobes
(Log10 UFC/cm2) 0 3,03 1 3,39 2 3,49 3 3,58 4 3,39 5 3,29 6 3,13 7 NO 8 NO 9 NO NO : Non observé
1 Condition du pelage : 0 = propre, 9 = pelage extrêmement sale. Adapté de Van Donkersgoed et al. (1997).
Ainsi, les animaux ayant des scores de saleté du pelage de 6, qui était les animaux les plus sales observés lors de l’étude, n’avaient pas un compte de bactéries aérobes significativement différent des animaux ayant un score de saleté de 1. Les résultats auraient peut-être été différents s’il avait été possible d’effectuer une analyse microbiologique de la viande d’animaux ayant un score de 9. Toutefois, dans les lots observés durant l’étude, les auteurs n’ont pas observé d’animaux ayant des conditions de pelage allant de 7 à 9 (extrêmement sale).
En revanche, si les animaux sont lavés afin de réduire la saleté se retrouvant sur leur pelage et que celui-ci est encore mouillé lors du dépiautage, le compte de bactéries aérobes total tend à être supérieur comparativement à des animaux n’ayant pas été lavés (Biss et Hathaway, 1995). Ces
16
auteurs ont démontré que le compte de bactéries aérobes de carcasses d’agneaux est supérieur s’ils sont lavés avant l’abattage. Toutefois, il a été remarqué que les animaux laineux et lavés ont un compte de bactéries aérobes plus élevé que des animaux tondus et lavés. Cela s’explique par le fait que, comme la laine est plus épaisse, les animaux restent mouillés plus longtemps que ceux tondus créant un environnement plus propice à la croissance bactérienne. Cependant, les carcasses ayant eu le compte de bactéries aérobes le plus bas sont celles dont les animaux étaient tondus, mais pas lavés, car le fait de laver les animaux crée un environnement plus propice à la croissance bactérienne et à leur dispersion dans l’environnement (humidité plus élevée, etc.) et ce, même si les animaux sont tondus préalablement.
Deuxièmement, l’étape d’éviscération peut aussi être critique, car si l’employé perfore le système gastro-intestinal (SGI) de l’animal, alors son contenu se déverse et contamine la viande ainsi que la ligne d’abattage. Si cela devait arriver, alors la carcasse est déviée de la chaîne de production vers un rail d’évitement pour inspection et parage. Par la suite, tout le matériel doit être décontaminé avant de redémarrer la chaîne d’abattage (Gill, 2000). C’est pourquoi il est important que la taille des viscères soit minimale avant l’abattage.
Finalement, la contamination lors de ces étapes dépend fortement des mesures sanitaires prises en abattoir ; il est donc possible que les dénombrements de bactéries aérobes totales, de coliformes et d’E. coli soient différents dans deux abattoirs après l’abattage (Tableau 1.4).
Tableau 1.4 Comparaisons des comptes de bactéries aérobes totales, de coliformes et d’E. coli sur des carcasses de bœuf sortant de l’habillage entre deux abattoirs.
Abattoir Bactéries aérobes totales
(Log10 UFC/cm2) Coliformes (Log10 UFC/100 cm2) E. coli (Log10 UFC/100 cm2) A 3,42 1,96 2,06 B 3,01 1,56 0,58 Adapté de Gill (2000).
1.2.4.2. Impact de la localisation sur la carcasse sur le profil microbiologique de la viande
La localisation sur la carcasse comme facteur influençant la contamination de la viande fut énoncée à plusieurs reprises dans la littérature (Berry et al., 1980 ; Kotula et al., 1987). Les résultats obtenus par Eisel et al. (1997) ont démontré que l’évaluation microbiologique de trimures provenant de la poitrine de bœuf avaient un dénombrement en bactéries aérobiques significativement supérieur
17
comparativement à des trimures provenant de la ronde et du flanc avec, respectivement, 6,9, 4,7 et 4,0 Log10 UFC/g. De plus, les auteurs ont obtenu un dénombrement de coliformes significativement supérieur sur les trimures provenant de la poitrine avec 3,2 Log10 UFC/g (P < 0,05) comparativement au flanc avec 1,4 Log10 UFC/g. Ainsi, ils ont émis l’hypothèse que, comme les animaux sont suspendus par les membres postérieurs, la poitrine est une zone plus susceptible à la contamination durant le processus d’abattage. En effet, la proximité de la carcasse avec le plancher pourrait faire en sorte que des éclaboussures atteignent cette partie plus facilement et donc que la localisation sur la carcasse aurait potentiellement un impact sur sa qualité microbiologique. Une autre hypothèse possible serait que le liquide de rinçage se déplaçant des membres postérieurs vers les membres antérieurs contaminerait la carcasse sur son passage.
En contrepartie, une étude récente menée par Chaves et al. (2017) a démontré que la localisation anatomique sur la carcasse n’a pas d’impact sur le profil microbiologique des trimures de bœuf destiné à la production de viande hachée. Ici, un total de 375 trimures provenant du bloc d’épaule, du talon et du jarret sur la carcasse fut échantillonné afin de compter le nombre de bactéries aérobes se développant sur celles-ci. En effet, les trimuresprovenant du bloc de l’épaule ont un compte en bactéries aérobes (2,00 ± 0,75 Log10 UFC/cm2) significativement supérieur (P < 0,05), de l’ordre > 0,50 Log10 UFC/cm2, aux trimures provenant du talon (1,24 ± 0,74 Log10 UFC/cm2) et du jarret (1,23 ± 0,83 Log10 UFC/cm2). Les auteurs concluent que cette différence, malgré le fait qu’elle soit significative, n’a pas d’impact pratique sur l’innocuité et la qualité de la viande parce que cette différence peut être expliquée par la variation naturelle de la concentration microbienne sur les trimures et celle de la méthode utilisée pour le dénombrement. De plus, le compte de coliformes ainsi que celui en E. coli étaient en dessous de la limite de détection. Et donc, les auteurs concluent que, s’il y a de bonnes conditions d’hygiène et de bonnes pratiques sanitaires mises en place dans l’abattoir, la localisation des trimures sur la carcasse devrait avoir un effet limité sur la qualité microbiologique de la viande hachée.
Une autre explication pour justifier que la localisation sur la carcasse a un impact sur le profil microbiologique est que, comme toutes les trimures n’ont pas le même pourcentage de gras, celui-ci pourrait être un des facteurs faisant varier le nombre de bactéries aérobes. Comme le gras a un pH de 6 et plus et possède autant de composés à faible poids moléculaire que le muscle pour la croissance microbienne, cela en fait un excellent milieu de croissance pour les microorganismes (Kauffman, 2001). Ce qui pourrait expliquer pourquoi des trimures plus grasses ont un compte en bactéries plus élevé que des trimures plus maigres. En effet, les résultats de la
18
recherche menée par Scanga et al. (2000) démontre que lorsque la viande à un contenu en gras plus élevé, alors le compte en bactéries aérobes tend à être plus élevé (Tableau 1.5).
Tableau 1.5 Dénombrement des bactéries aérobes en fonction du contenu en gras de la viande.
Contenu en gras (%) Bactéries aérobes (Log10 UFC/g)1 10 2,6 ± 1,1a 20 3,2 ± 1,1b 30 4,0 ± 1,8c 50 3,3 ± 1,3b
1Des lettres différentes au sein d’une colonne indiquent une différence significative (P < 0,05) Adapté de Scanga et al. (2000).
Étrangement, on remarque au tableau 1.5 que le compte en bactéries aérobes est plus faible lorsque les trimures ont un contenu en gras de 50 % comparativement à un contenu de 30 %. Une hypothèse qui pourrait expliquer ces résultats serait que, comme les trimures provenaient de 8 usines de transformation différentes à travers le Canada et les États-Unis, celles ayant un pourcentage de gras de 50 % auraient pu subir moins de contamination croisée et moins de manipulations que celles ayant un pourcentage en gras de 30 %. De plus, il est possible que les trimures avec 50 % de gras proviennent d’une usine ayant en place des mesures d’hygiène plus strictes.
1.3. Qualité physicochimique de la viande
La qualité pourrait être définie par les quatre mots suivants : Sécurité (innocuité, salubrité et suffisance), Santé (éléments nutritifs), Sens (qualités organoleptiques) et Service (conservation, diversité de format ; Letellier, 2002). Cette qualité peut être influencée par plusieurs facteurs tels que, entre autres, l’espèce animale, la génétique, l’alimentation, le stress, les maladies et blessures, le temps de jeûne, la durée du transport jusqu’à l’abattoir, le temps d’attente à l’abattoir et la gestion des carcasses (Saucier, 2016).
1.3.1. Caractéristiques du muscle
1.3.1.1. La contraction musculaire
La contraction musculaire est un processus qui requiert de l’énergie sous forme d’adénosine triphosphate (ATP), notamment pour le fonctionnement des pompes ioniques permettant
19
d’équilibrer la concentration en Ca2+ dans le sarcoplasme de la cellule musculaire. Sommairement, cette contraction débutera après la libération du calcium (Ca2+) dans le sarcoplasme par le réticulum sarcoplasmique à la suite de la réception d’un influx nerveux par le muscle. Le Ca2+ provoquera la contraction musculaire et utilisera l’ATP comme source d’énergie. Lorsque l’influx nerveux cesse, le Ca2+ est renvoyé dans le réticulum sarcoplasmique à l’aide des pompes ioniques, processus qui demande de l’ATP, et le muscle se relaxe (Greaser, 2001).
1.3.1.2. Composition du muscle squelettique
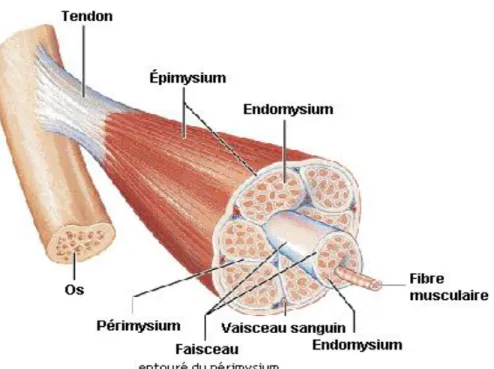
Le type de muscle le plus abondant dans une carcasse est le muscle squelettique qui représente 35 à 60 % du poids corporel (Listrat et al., 2016). Il est constitué de fibres musculaires, de vaisseaux sanguins, de cellules nerveuses et de tissus conjonctifs (Listrat et al., 2016). Sa représentation schématique est présentée à la Figure 1.1.
Figure 1.1 Structure d’un muscle strié. Adaptée de Marieb et Laurendeau (1993).
Un muscle squelettique est composé à 90 % de fibres musculaires et 10 % de tissus conjonctifs (Listrat et al., 2016). Chacune des fibres musculaires est entourée de tissus conjonctifs appelés endomysium. Un second, appelé périmysium, enveloppe un regroupement de plusieurs fibres afin de former les faisceaux. Finalement, les différents faisceaux sont regroupés ensemble par l’épimysium pour former le muscle (Listrat et al., 2016).