Écolocrp
DE
LA
MUE
crfrz
LEScANARDS
DEMER
:srnnrÉcrEs
ET coNTRATNTES
rnese
pnÉsBNrÉB
COMME EXIGENCE PARTIELLE
DU
DocroRAT
ENBIoLocIE
EXTENSToNNÉrB
L'LrNrvERsruÉ
nu
quÉnec
À
uoNrnÉar-PAR
ANOUCK
VIAIN
UNIVERSITÉ DU QUÉBEC À RIMOUSKI
Service de la bibliothèque
Avertissement
La diffusion de ce mémoire ou de cette thèse se fait dans le respect des droits de son auteur,
qui a signé le formulaire « Autorisation de reproduire et de diffuser un rapport, un
mémoire ou une thèse ». En signant ce formulaire, l’auteur concède à l’Université du
Québec à Rimouski une licence non exclusive d’utilisation et de publication de la totalité
ou d’une partie importante de son travail de recherche pour des fins pédagogiques et non
commerciales. Plus précisément, l’auteur autorise l’Université du Québec à Rimouski à
reproduire, diffuser, prêter, distribuer ou vendre des copies de son travail de recherche à des
fins non commerciales sur quelque support que ce soit, y compris l’Internet. Cette licence et
cette autorisation n’entraînent pas une renonciation de la part de l’auteur à ses droits
moraux ni à ses droits de propriété intellectuelle. Sauf entente contraire, l’auteur conserve
la liberté de diffuser et de commercialiser ou non ce travail dont il possède un exemplaire.
Cette
thèsen'aurait
pu
être
réaliséeni
f,rnalisée sansle
soutien
de
nombreuses personnestant
dans
le
contexte
professionnelque
dans
le
contexte
relationnel, personnes queje
tiens à remercier dans les quelques lignes qui suivent.En premier lieu
je
tiens à remercier mon directeur de thèse, Magella Guillemette,qui
a su me donner ma chance dans un pays nouvealJ,
m'a
assurée de son soutien etm'a
apporté de précieux conseils par ses commentaires constructifs.
Merci
surtout pour laconfiance
accordéeen
me
permettantnotamment
la
mise en place
d'un
travaild'imprégnation
quetu m'as
laissé mener avecune
grande autonomie.Je
souhaite aussi remercier les co-auteursqui
ont participé àla
publication de certains chapitresde
cette
thèse
:
Jean-PierreSavard,
Scott
Gilliland
et
Matthew Perry.
Merci
également
à
StevenPortugal,
Piero
Calosi,
Dan Esler
et
Peter
Pyle pour
leurs commentaires riches en enseignements sur la version préliminaire de certains articles. Je tiens à remercier tout particulièrement Pierre Drapeau, François Yézina et ShawnCraik, en tant que
présidentet
membresinterne
et
exteme,pour avoir
accepté d'évaluer mon travail.Un
grand
merci
à
Martin
Tremblay
et
sa famille
qui m'ont
accueillie
sur
leur propriété avec mes pensionnaires.Merci Martin
pour ta bonne humeur, ton ardeur autravail
dans les phases de construction.Merci
aussi pour les moments de complicité partagésau
seinde
ta famille, tout
spécialement avecValérie, Hubert,
Cassandre,petit
Félix
etAdèle.
Ce projetn'aurait pu aboutir
sanston
soutien et ta très grandecollaboration.
Merci
à
Sylvain Leblanc
et
la
famille Hartog
pour I'aide
aux prélèvements nécessairesau
chapitre
trI.
Je tiens
égalementà
remercier
Grantiii
Gilchdst
etAmie Black
pourleur
aide efficace dans les démarches pourla
collectedes
æufs
d'Eiders
à
duvet
à
Iqualit
et
avoir ainsi permis
la
coordination
des différentes étapes nécessaires à cette récolte.Merci
également àAlain
Caron pour sa disponibilité et son aide précieuse dans le monde des statistiques. Je tiens à remercier aussi le personnel du département deBiologie
: Jonathan Coudé, Pierre Rioux, Yves Iæmay, LouiseAmyot, Annie
Boulianne, Lyne Bélanger et Pauline Dubé.Un
grandmerci
aussià
Danie
Massépour
son
dynamismeet
sa bonne humeur dans
seséchanges
avec
les
étudiants
et
son efficacité
dans
la
gestion
et
le
suivi
des commandes de matériel.Je veux
aussi partager ces remerciements avecles
membresde mon laboratoire
: Samantha Richmanpour
ses précieux conseils concernant l'élevage et les soins des eiders, Jean-François Ouellet et Catherine Ayotte pour leurs conseils initiatiques pourmes
premières
heures
d'enseignement,Éhsabeth Varennes
pour
les
échanges scientifiqueset l'entraide lors d'interventions
ponctuelles avecles
eidersainsi
queMylène Delorme, Marie-Audrey
Nadeau,Frankie
Jean-Gagnonet
Marie-ChristineFrenette.
Merci
égalementà
Marie-JeanneRioux,
Katerine
Chalut
et
Florence Boucher.Un
merci
tout
particulier
à
Sylvain Christin pour
ses précieux coups de maintout
aulong
de ceprojet et
surtoutmerci
de ne pasavoir
eu peurd'affronter
avec
moi
l'hiver
québécoispétrifiant
régulièrement nos doigts au cours de travaux manuels tels la construction des bassins et l'avancement du bâtiment des eiders.Un
grandmerci
aussi à toutes les personnes quej'ai
pu
côtoyerau
coursde
cette expérimentation : Antoine Jean et son neveuMartin
pour l'autorisationd'utiliser
leurlac
pourla
baignade quotidienne des eiders. DannyBlais,
MélanieAsselin et
leurs enfantsEliott
et Xavier pourf
intérêt porté à mon projet et pourm'avoir
dépannée de temps en temps, mais également àleur
chien Bazou pour sa grande patience envers les eiders qui venaient s'amuser àlui
tirer
la queue ou les oreilles.Merci
également àde l'intérêt pour mon projet de
recherche.Merci
aussià
Lynn
Miller
et
au
Dr. Dancoste pour leurs précieux conseils concernant l'élevage des canards de mer.En
cette heure
d'accomplissement,j'adresse
une
pensée spécialeà
ma
secondefamille
celle des amoureux, protecteurs, défenseurs de la nature et grands naturalistes qui, depuis mon plus jeune âge,m'ont
entourée en contribuant grandement à éveiller ma curiosité lace au mondevivant,
entre autres Madame Odette Cordier, Jean-Yves Cretin,la
famille Michelat
et tant d'autres.Merci
à vous et plus particulièrement àMonique,
Jean-Yves, Jean-ClaudeRobert
et
JeannetteMichelat
qui ont pris
leur
envol trop tôt.
Merci
à Marion
Pillet
et Sylvain,
toujours présents dans les moments de doute, de stressou
dans les instants plusjoyeux
comme leslundis
desserts.Merci
à
tous les membresdu club
deslundis
desserts:
Sarah-Jane,Tarik, Lyria,
Thomas, Souad, Nassim, Wahiba,Amin,
Jessica, Mélanie,Amira
et Guillaume pour avoir contribué àla touche sucrée des repas et
fait
de ces moments des instants d'échanges mémorables dansla
joie
et
la
bonne humeur, permettantà
chacun de démontrer ses talents de pâtissier.Moments
devenusnotre
<( drogue sucrée >> incontournableet
essentiellepour bien démarrer la semaine. Je remercie aussi mes amis de longue date, qui malgré les distances
qui
nous séparent,m'ont
toujours témoigné leur amitié etleur
soutien, Stéphanie,Mimie,
Marie-Charlotte, Nathalie, Jean-Paul et Jeanne-Marie.Merci
à mafamille, qui
m'a
encouragée à distance et surtout à mes parents et mon frèrequi
ont toujours cru en moi etm'ont
soutenue tout au long de ces années au Canada.Merci
aux différents organismes qui ont soutenu financièrement ou logistiquement lesdifférents
aspects dece travail
de recherche:
Environnement Canada, CRSNG, la Fondation UQAR, BORÉAS, Québec-Océan.V
Enfin,
je
voulais terminer ces remerciements avec une pensée pour ceux qui au coursde
ces annéesde
doctoratont
grandement contribuéà
la
collecte
des données et beaucoup enrichi mes connaissances avec des informations écrites nulle part dans leslivres
de
biologie.
Merci
à
Charly,
Joséphine,Hector,
Fugueur,
Alto,
Futée,Capucine, Caline, Punky, Grognon, Sauterelle, Crevette, Denis, Juniore, Médor, Don-Juan, Plume, Jumpy, Rebelle,
Duckie,
Gasper,Plucky duck,
Sleepy, Arsène-Lupin, Bella, Chipie, Filou,April,
May et June, mes << enfants plumes >>.A
ma mère et mon pèren
[...]
chaque problèmequ'il
vous est donné de résoudre soulève,à I'instant même de sa solution, de nouveaux problèmes > Konrad Lorentz
<
A pilot
never dies, hejust
flies away and does not return >>TABLE
DESMATIERES
LISTE DES
FIGURES...
...XII
LISTE DES
TABLEAUX...
...XV[
nÉsutvtÉ.
..xvIrl
CHAPITRE
I
TNTRoDUCTIoN
cÉNÉnalr
1.1
Lesplumes
...11.1.1 Une structure hors du
commun
...11.7.2[-es fonctions du plumage
...
...2I.1.3
La qualité desplumes
...31.2
La mue desoiseaux
...51.2.I
I-Ê processus demue
...51.2.21-e,s différents patrons de
mue
...81.2.3
L'insertion
de la mue complète dans le cycle annuel des oiseaux... 10I.3
Latribu
desMergini...
...141.3.1 Iæs
Mergini
étudiés...
...15L3.2\-e
cas spécifique de la mue synchrone : pressions et contraintes...181.4
Objectifs del'étude..
...22CHAPITRE
II
DO SEADUCKSMINIMISE
TTIE FLIGHTLESS PERIOD? :INTER AND
INTRA.
SPECIFIC COMPARISONS OFREMIGIAL MOULT
2.1 Résumé
...282.2 Abstract....
...292.3
Introduction...
...302.4
Materials andmethods...
...322.4.2
Care of captiveseaducks
...322.4.3 Measurements
from
seaducks...
...332.4.4 Modelling feather
growth....
...342.4.5 Modelling
moult
allometry..
...342.4.6
Statisticalana1yses...
...352.5 Results
...362.5.1Tit:rxng of
initiation
of remigialmoult
...372.5.2 Inter-specific comparison of feather growth
rates...
...372.5.3
Moult
allometries...
...402.5.4
Dvation
of estimated flightlessperiod
...402.5.5 Yariatron of body mass during
flight
feathermou1t...
...422.6 Discussion
...452.6.1
Applicability towild
seaducks
...452.6.2
ATtometry of feathersgrowth
...482.6.3 Yariations in body mass during remigial
moult
...492.1 Acknowledgments
...512.8 References
...52CHAPITRE
III
BODY
AND
ORGAN MASSDYNAMICS
DURING
REMIGIAL MOULT IN A
V/ING-FOOT-PROPELLEDDIVING
SEADUCK:
TIIE
COMMON
EIDER.3.1 Résumé
...623.2 Abstract....
...633.3
Introduction...
...643.4
Materials andmethods...
...683.4.1 Specimen collection
...
...68 3.4.2 Dissectionprotoco1...
...68 3.4.3 Bodyreserves
...69 3.4.4 Dataanalvsis
...693.5 Results
...70 3.5.1 Bodym4ss...
...70 3.5.2 Disestiveorsans...
...721X
3.5.3
Vital
organs and bodyreserves
...753.5.4 Locomotor
organs
...763.5.5 Growth of
flisht
feathers
...813.6 Discussion
...833.7 Acknowledgments
...883.8 References
...89CHAPITRE
IV
KEEPINGV/ARM DURING WING MOULT:
TIIE
FLIGFTTLESS PERIOD IS SYNCHRONISEDWITH
SEA SURFACE TEMPERATURESIN A
LARGE
DIVING
BIRD.
4.I Résumé
...1004.2 Abstract....
...1014.3
Introduction...
...I02
4.4
Materials andmethods...
...1044.4.1
Model
species and populationstudied
... 1044.4.2 Pattern and location of moulting
quarters
... 1054.4.3 Deployment
of
dataloggers
... 1064.4.4 Identification of flightless and migration
periods
... 1074.4.5 Heart rate and body
temperature
... 1074.4.6
Sea surfacetemperature
... 1084.4.7 Resting metabolic
rate...
... 1094.4.8 Data
analvsis
...1094.5 Results
."...1104
5
1rimine::T::i:::::::1ï
::i::l::""::::
-':*::Ï::l
Tiià
4.5.2 SST of observed and predicted wingmoult
... 1114.5.3 Synchronism between SST5reBl and
SSTyaç
...I12
4.5.4 RHR, body temperature and duration of flightlessperiod
...112
4.6 Discussion
... 1184.6.L DeIta SST and
individual
variation
... 1194.6.3
Timing
and predictivecues...
....1214.7 Acknowledgements
...1244.8
DataAccessibilitv...
...I25
APPENDIX
A
COMPARISON OF SEA SURFACE TEMPERATURES OFBALTIC,
KATTEGAT
AND WADDEN
SEAS4.9 References
...131CHAPITRE
V
DOESWATER TEMPERATURE
AFFECTTI{E
TIMING
AND DURATION
OFREMIGIAL MOULT IN
SEADUCKS?AN
EXPERIMENTAL
APPROACH.5.1 Résumé
...1455.2 Abstract....
...1465.3
Introduction...
...1475.4
Materials andmethods...
...I49
5.4.1 Care of captiveseaducks
...I49 S.4.ZBxperimentaldesign...
...1505.4.3 Body mass and feather measurements
...
...152
5.4.4 Feather growth and flightlessness
duration....
....I52
5.4.5 Thermalconductance...
...1535.4.6
Analyses oftime-budgets...
... 1545.4.7 Statistical analysis
...
...1545.5 Results
...1555.5.1 Time-budget of birds and thermal
conductance...
... 1555.5.2 Effect of temperature on body
mass.
... 1555.5.3
Timing
and duration offlight
feathergrowth...
... 1585.6 Discussion
...1605.6.1 Effect of water temperature on body mass during remigial mou1t... 160
5.6.2 Effect of water temperature on the
timing
of moult and feather growth 161 5.6.3 Comparisonwith
previous studies onwild
eiders...
...1625.7 Acknowledgments
...166X1
CHAPITRE
VI
CONCLUSION GÉNÉRALE
6.I
Les différentes stratégies, revue desconnaissances
.... 1786.1.1
Migration
demue...
... 1786.1.2 Vitesse de remplacement des
rémiges...
... 1816.1.3 Gestion de la masse
corporelle.
... 1836.1.4 Gestion de la masse des
organes...
...1856.1.5
Modifications d'origine
comportementale
...1886.1.6
Bilan
comparatif
...188Limites de
l'étude
...189Implications pour la
conservation...
... 191Perspectives de
recherche...
...I94
6.4.I
Evalttation de la dépense énergétique et des zones de thermo-neutralité....r94
6.4.2 Intégration du signalinduit
par la température del'eau..
...I97
6.4.3
Adaptabilité face au réchauffementclimatique...
...1986.4.4 Stratégie
comportementale...
...199Conclusion
...200Références
...202 6.2 6.3 6.4 6.5 6.6Figure
Page Figure1.1
Les
différents
patronsde mue
des
ailes
chez
les
oiseaux
:
A)
mueséquentielle,
B)
mue pas à paset
C)
mue synchrone. [æs plumes blanches représentent les anciennes plumes et les plumes grises les nouvelles plumesen
croissance...
...9Figwe
I.2
Méthode de numérotation des primaires(P)
et
secondaires(S)
sur uneaile
d'oiseau
...10Figure
1.3
A)
Phénologiedu
cycle
annuelpour
la
population de
la
Bernache du Canada (Branda canadensis ssp.) qui présente une unique mue synchrone par an au cours de laquelle elle remplace la totalité de ses plumes de corps et devol. B)
Phénologiedu
cycle
annuelpour
la
population
deI'Eider
à
duvet(Somateria
mollissima
ssp.)
qui
subit deux
mues
du
corps
par
an.
Lapremière entraîne
la
constitution
du
plumage
dit
d'éclipse.
AprèsI'acquisition
du plumage d'éclipse, les eiders effectuent leur mue rémigiale avec incapacité devol.
Enfin,
ils
subissent une nouvelle muedu
corps pour acquérir leur plumagenuptial.
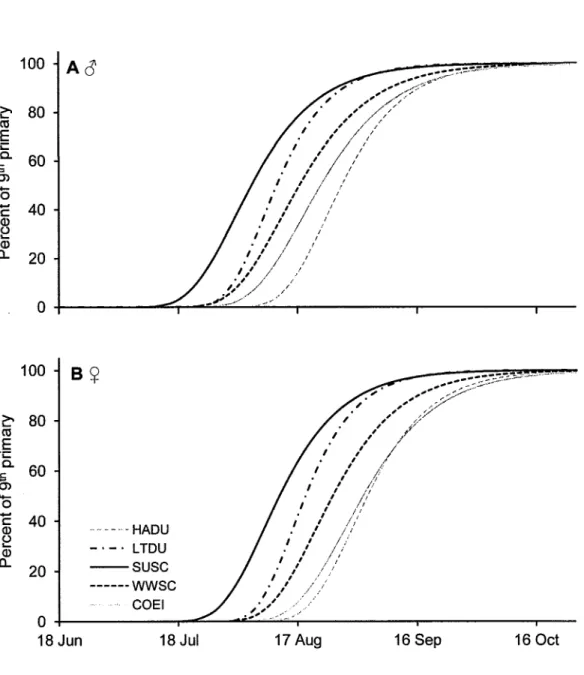
...12 Figure2.1
Feathergrowth
ratesof
the
5
seaduck species. Gompertz9ù
primarygrowth models
for
5
seaduck species;
Harlequin Ducks
(Histrionicushistrionicus,
HADU), t
ong-tailed Ducks(Clangula
hyemalis,LTDU),
Surf Scoters(Melanitta perspicillara,
SUSC),White-winged
Scoters (Melanitta fusca,WWSC)
and Common Eiders (Somateria mollissima dresseri, COEI)with
(A) representing males and (B)females.
...39 Figure2.2
Relationships betweenbody
mass
and primary growth rate, and
P9length
in
5
seaduck species.Allometric
relationships among
5
seaduck speciesbetween:
(A)
body
mass
(g)
and delta
9'n
primary growth
rate (mm.day-t),(B)
body mass(g)
andfinal
lengthof
9'n primary (mm). Dottedline
representsthe
allometric
relation
for
the
5
species_(HADU, LTDU,
SUSC,WWSC
and
COEI)
(A)
allometric relation:
Mu'ure,(B)
allometricrelation:
M0'28s...
...4IFigwe
2.3
Relationship betweenbody
massof 5
seaduck speciesand
flightless period. Representationof
the flightlessperiod
(days) accordingto
the bodyxlll
mass
for
the5
seaduck species(HADU, LTDU,
SUSC,WWSC
and COEI). Females are represented by white circles and males by black circles. ...42Figtre
2.4
Inter-specific body
massvariation during
remigial moult.
Changesin
mean
body
massof
birds.(as
percentageof
initial
weight)
basedon
the percentage growth of the 9tn primaryfor
5 seaduck species; Harlequin Ducks(HADU), t
ong-tailedDucks
(LTDU), Surf
Scoters (SUSC), White-winged Scoters(WWSC)
and Common Eiders (COEDwith (A)
representing males and (B) females. Phase 0 corresponds to the value ofinitial
weight before the shedding offlight
feathers, Phasel
represents feather emergence and the startof
feather growth, Phase 11 correspondsto
the periodof
fast feather growth rate and where maximal growth rate is reached, Phase 111is the periodof
thefirst
slowing down
of
growth
rate,
PhaseIV
conespondsto
the
secondslowing down
of
growth rate and the period during which birds are able tofly
again, Phase V
is
the endof
theremigial moult
whenfinal
lengthof
P9 isreached.
...:....
.1...,...qqFigure
2.5
Intra-specific
body
mass
variation
for
the
studied
species. Average deltas, representing the difference between body mass recorded at the phaseIV of
themoult
in
which
seaducks are ableto
re-fly
andinitial
body mass,and
their
respective confidenceintervals.
'Whenthe
confidence
intervalsexclude
the
zero
line, the
delta
is
declaredsignificant
at
5Volevel
(see Materials andmethods)...
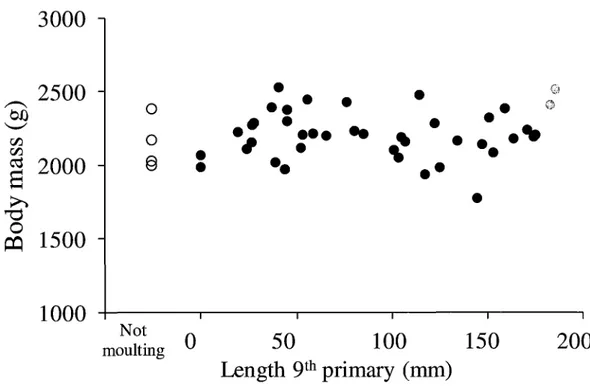
...+S Figure3.1
Changesin
total body
mass(g)
during the
9thprimary growth
in
maleCommon Eiders collected
in
theGulf of
St. Lawrence.Individual
values areplotted
againstthe
9thprimary length (an index
of
remigial growth
stage).Filled
circles representmoulting
eiders, grey circles represent eiders that had completed theirmoult
and open circles represent eiders that had not yet shedtheir
flight
feathers(non-moulting).
The
data
of
non-moulting eiders
are representedas
referenceand
plotted
independentlyof
the
values
on
theabscissa.
...12Figure
3.2
Changesin
fresh
massof
digestive
organs(g)
during the
9thprimary
growth
in
male CommonEiders.
(A) Filled
circles represent gizzard mass andfilled
triangles pancreas mass, and(B)
filled
circles represent intestine mass andfilled
triangles gallbladder
mass.Individual
valuesare
plotted againstthe
9'nprimary length
(anindex
of remigial
growth
stage).Filled,
grey
and open symbols aresimilar to
thosein
Fig.
3.1. The
dataof
non-moulting
eiders are represented as reference andplotted
independentlyof
the
valueson the
abscissa.The
data
of
grey
symbolswere
not
usedfor
modelling.^The
lines
representfitted
regressionmodels:
!
=
0.421
x
-2.608-03 x"+
129.627(r
=0.4I,
P
=0.038)
for
gizzardmass,!
=
-0.04I
x
+
2.LBE-04x"
+
9.14I (r
=
0.39,P
=
0.048)for
pancreas mass,)
=
- 0.040x
+ 72.995(r
=
-0.22, P=
0.174)for
intestine mass and y = 0.006 x+
I.929
(r
= 0.52, P < 0.001)for
gallbladdermass...
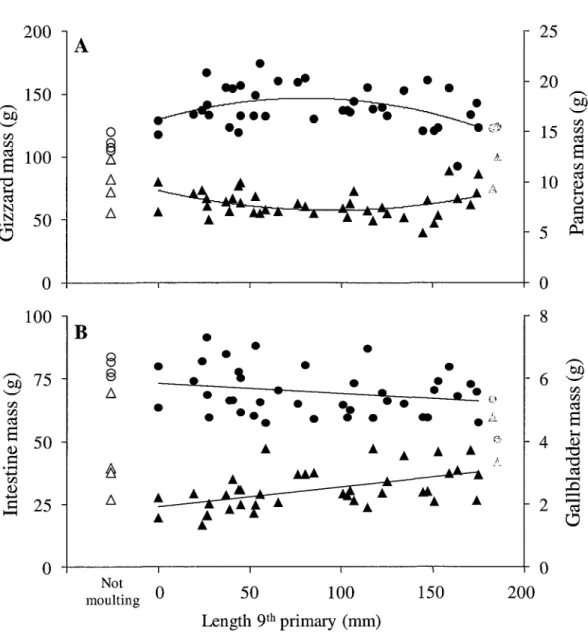
...14 Figure3.3
Changesin
sizeof
digestive organsduring
the
9thprimary growth
in
male Common Eiders.
Filled
circles represent intestine length (cm) andfilled
triangles oesophagus
length (mm). Individual
values areplotted
against the9tn primary length (an index
of remigial
growth stage).Filled,
grey and opensymbols are
similar
to thosein
Fig. 3.1. The dataof
non-moulting eiders are representedas
referenceand
plotted
independentlyof
the
values
on
the abscissa. The dataof
grey symbols werenot
usedfor
modelling.
The lines representfitted
regression models:!
=
- 0.444x
+
2.238-03x'
+
231.188(r
=
0.34, P=
0.1 12) for intestine length andy
= 0.032x
+
29.920(r
=
0.56,P
< 0.001)
for
oesophaguslength
...75 Figure3.4
Changesin
fresh massof
flight
musculature(g)
duringthe
9û
primarygrowth
in
male
Common Eiders.
(A)
Representspectoral muscles,
(B) represents supracoracoideusmuscles,
and
(C)
representswing
muscles.Individual
values are plotted
againstthe
9'nprimary
length
(an index of
remigial growth stage).
Filled,
grey and open symbols are similarto
those inFig.
3.1. The
dataof
non-moulting eiders are represented as reference and plotted independently of the values on the abscissa. The dataof
grey symbols were not usedfor modelling.
Lines representfitted
regression models: y = -0.848x
+
6.54F-03x'
+
237.227(r
7
0.72,P <
0.0001)for
pectoral muscle mass,y =
-
0.099
x
+
6.928-M
x"
+
41.497(t
=
0.42,
P =
0.032)for
supracoracoideus muscle mass, and y
=
0.119x
+ 98.660 (r = 0.51, P < 0.001) for wing musclemass...
...78 Figure3.5
Changesin
fresh leg muscle mass(g) during
the 9thprimary growth
in
male Common Eiders.
Individual
values are plotted against the 9tnprimary
length
(anindex
of
remigial growth
stage).Filled,
grey and open symbolsare similar
to
those
in
Fig.
3.1. The data
of
non-moulting
eiders
are representedas
referenceand
plotted
independently
of
the
values
on
the abscissa.The
dataof
grey
symbols werenot
usedfor
modelling. The line
represents
fitted
regressionmodel:
y=
0.482x
- 3.17E-03 x"+
20I.738 (r =0.50, P = 0.005)
for
leg musclemass...
...19 Figure3.6
Changesin
fresh mass offlight
organs (g) during the 9ft primary growth inmale Common Eiders.
(A)
Represent heart mass, and (B) represents lung mass. Individual values are plotted against the9*
primary length (an index of remigial growth stage). Filled, grey and open syrnbols are similar to those in Fig. 3.1. Thedata
of
non-moulting
eiders
are
representedas
reference
and
plotted independentlyof
the values on the abscissa. The dataof
grey symbols were not usedfor
modelling. Lines representfitted
regression models:y
=
-
0.172x
+xv
ô
1.11E-03
x"
+
32.029(r =
0.53,P =
0.003)for
heart mass andy
=
0.025x
+ 34.440 (r =0.2I,
P = 0.208) for lungmass.
...80 Figure3.7
Pictures
of
growing primary and
secondaryflight
feathers.(A)
In
afemale, and
(B)
in
a male Common Eider.At
the top, pictures represent the onsetof
feathergrowth
with
unprotectedgrowing primaries and
growing secondaries protectedby
greater underwing coverts.Up
to
onethird
grown,flight
feathers arenot
protected. Then,old
greater underwing coverts shed.Below, primaries
and
secondariesare
again
protected
by
upper
andunderwing
coverts.
...82Figure
4.1
The average SST('C)
from
2003to
2005, respectivelyin
a, b and c. The rangeof
moulting
period and the 957oCI of
instrumented female eiders are delimited by black vertical lines and by vertical dotted lines, respectively (n =l0
in
2003, n = 7in
2004 and n = 9in
2005)...
...114
Figure
4.2
Moult
migration
dateof
female eidersin
relation
with
startof
remigialmoult. Only individuals having
a
moult migration
have been
included.Significant
relationshipsresulting:
Y
=
0.4II X +
24003,r
=
0.653,
P
=0.001,
n=23.
...115Figure
4.3
The
average difference (+95VoCI)
between observed SST (SST9) andpredicted
SST
(SSTp)and between SST
at the
start
of
the
wing
moult
(SST516p1) and maximum SST (SSTMÆ| (n
=
26), where SSTp and SSTrraa<are computed
for
(a andc)
a given
year and(b
andd)
a ten year average, respectively.The
meandifference
betweenSSTg and
SSTpand
between SST5lapl and SSTyaç are declared significantly different when their 957oCI
exclude zero (see
methods).
... 116 Figure4.4
Synchronisation diagramof
wing moult
with
SSTfor
each instrumentedfemale eiders
of
this
study(n
=
26). For
eachindividual,
ablack
and grey rectangle representsthe
rangeof
50Voof
meanSST
(between1"
and
3'dquartiles)
for
the 55T6 duringwing
moult and SSTpfor
a similar time period, respectively.Fitted black
dots and grey dots represent the average SSTfor
SSTo and SSTp, respectively. Open dots and dotted
lines
correspondto
thetotal
range
of
SSTo
or
of
SSTp.Individuals
are ranked
from the
most synchronised (n=
14) to the less synchronised females(n=
l2).
Thefirst
and second group were discriminatedon
the baseof a
1 oC difference betweenSSTo
and
SSTp.A
high level
of
synchronisationleads
to
an
important matching between rectanglesdepicting
SSTqand
SSTp, whereasfor
non-synchronised females,the
average SST9is
outsidethe
75Vo rangeof
the warmest SSTp. Each female was represented by a ring colour code. ... 117Figure4.5
Diagramof
theoccuffenceofthewingmoultperiodof
31 speciesof divingand dashed lines represent both sexes. The simultaneous replacement
of
flight
feathers
mainly
occursduring
the
summeror
early
autumn.
Only
a
few exceptions to this pattern exist, such as adult loons moultingin
late winter andAtlantic
Puffins (Fratercula arctica), which can moultin fall
or
in
February-March. (1) Hohman etal.
1992,(2)
Savard eta\.2011,
(3)Viain
unpublished data, (4),Rail
&
Savard 2003,(5)
O'Connor 2008, (6),Flint
etal.
2000, (7)Frimer
1994, (8) Adams, Robertson&
Jones 2000, (9) Robertson etal.
1997, (10) Van De Wetering&
Cooke 2000, (11) Hogan, Esler&
Thompson 2013, (12) Iverson&
Esler 2007, (13) Craik 2009, (14) Petersen, McCaffery&
Flint
2003, (15) Palmer 1978, (16) Evers 2004, (11) Stout
&
Cooke 2003, (18) Pyle 2008, (19) Jehl 1988, (20)Otto
1985, (21) Peery et aL.2008, (22) Thompson etal.1998,(23)Pyte2009,(24)
Harris&
Yule
1977,(25) Harris&
Wanless 2011, (26) Harris&
Elkins 2013 and (27) Howell2002....
...122 FigureS.1
Map
of
the
moulting
quarters
and
the
breeding
origin
of
the
26instrumented female Common Eiders (5. m. mollis sima,
L.).
... ...I28
Figure
S.2
An
example of the temporalvariability
pattern of theBaltic,
Kattegat andWadden
Seas
for
the
year
2005. Dotted
line
represents
the
.periodcorresponding to the range of
moult
occuffence (July 1" to OctoberrcI\. n9
Figure5.1
Mean body mass(+
SE)at six
pointsin
time (1
MB:
one month before sheddingdate; 1
WB:
one week
before
the
sheddingdate; start:
at
the shedding dateof
P9; end: at the end of remigialmoult;
1WA:
one week after the endof
remigial moult; and
1MA:
one month after the endof
remigialmoult)
during themoult
of female(filled
bars,A)
and male (hatched bars, B) Common Eiders.Light
grey bars represent eiders exposedto
warm
water, and dark grey bars represent birds exposed to cold water. 66***
"
P < 0.001,"
*"
p
<0.05...
...157Figure
5.2
Mean emergence dateof
P9 and51
(t
SE), respectively,in A
andB
for
male
(hatchedbars) and female
eiders(filled
bars) exposedto
two
water temperatures(18
oC
in
light
grey and
8
oC
in
dark grey).
Significant differences were observed dueto
water treatmentwith
respectto
emergence date (P9,P=0.041;
S1,P:0.037).
" *)'
P<0.05...
...158LISTE
DESTABLEAUX
Table
Page'îabIe
2.1
Dateof
moulting,
morphometric measurements and feathergrowth
ratefor
5 speciesof
seaducks...
...38 Table3.1
Dynamicsof
body
mass, size and massof
organsat different
remigialmoult
stageof
Common Eiders. Variations
of
body
mass, massof
flight
locomotor
organs,swimming
organs,digestive
organs,vital
organs, and organ size acrossthe moulting
stagesof
male
CommonEiders
(Somateriamollisima dresseri
Sharpe,1871) collected
in
the Gulf
of
St.
l,awrence.Maximum
loss/gain
column
indicates
the
maximum
percentage change acrossremigial moult
stageswith
the
mean mass/length measurementsof
non-moulting eiders (pre-moult stage) used as reference value. ...7I
Table3.2
ANOVA
results
testing
for
effects
of
remigial moult
stageon
lipid
depositions
of
male Common Eiders collectedin
the
Gulf of
St. I-awrence. Valuesfor
moulting
stageswith
the
sameletter
aresimilar
and thosewith
different letters
differ
(P <0.05).
...11 TableS.1
Pearson correlation coefficient between sea surface temperatures (SSTin
'C)
of
Baltic,
Wadden and Kattegat Seasfor
each year (2003-05) and over the decadal year period (2001-11)....
... 130 Table5.1
Range and meanof
sea surface temperature (SSTin
'C)
including
15 years (2000-14)of
data, between 15frJuly and
I't
Octoberin
the moulting areasof
six subspeciesof
Common Eiders (Somateria mollissima sp.)... 165Chez
un
oiseau, les plumes sont des éléments essentielsqui
assurentI'isolation
ducorps
et
permettent
le
vol
pour
la
majorité des
espèces.La
mue des
ailes,renouvellement périodique
et
incontournable
des
pennes,constitue
le
principal évènementde
la
production
somatique annuelleet
permet d'assurerI'intégrité
du plumage. Iæs connaissances sur cette période demeurent néanmoins parcellaires chez la plupart des canards de mer qui restent peu accessibles à cette époque de I'année. La mue synchrone des ailes desMergini
est énergétiquement coûteuse et les rend inaptesau
vol
pendant plusieurs semaines.I-a plupart
des oiseaux dépendentdu vol
pour survivre etil
est donc sensé d'envisager quela
sélection naturelle a favorisé la miseen
place
de
stratégies conduisantà
maintenir
Ia
capacitéde
vol
tout
au
long
de l'année. Cette thèse a pour objectif de déterminer les stratégies auxquelles lesMergini
peuvent
avoir
recourspour
optimiser
la
phénolog1e,la
croissance des plumes, la dépense énergétique, et la masse corporelle pendant la mue.En premier
lieu, le
chapitreII
a pour objectifs de tester sur des oiseaux captifs si la vitesse de croissance des plumes dépend de leur masse corporelle puis devérifier
si lesMerginl
ont recours à une stratégie de gestion de leur masse pour écourter la duréede mue.
Irs
résultats obtenusmontrent
quela
croissance des plumes exerco une contrainte surla
durée de mue des ailes, contrainte d'autant plus accentuée pour lesindividus
de grandetaille.
[æs résultats suggèrent également que, quelquesoit
leurtaille,
lesMerginl
n'utilisent
pas de stratégie de gestion de la masse corporelle pour écourter la durée d'incapacité de vol.Le chapitre 111 explore cette fois la stratégie de gestion de la masse en
milieu
naturel et teste I'hypothèse selon laquelle les Eiders à duvet (Somnteria mollissima) utilisentla flexibilité
de leurs
organespour
faire
face aux
exigencesde
la
mue.Une
forteflexibilité
des
organes locomoteurset
de
certains organesdigestifs
a
été
notée.L'utilisation
d'unetelle
stratégiea
été interprétéeici
comme un moyen consistant à réduire les coûts de maintenance des organeslorsqu'ils
sont supérieurs aux bénéficesqu'ils
procurent.
D'autre part, l'importante mobilisation
des
réserves lipidiques corporelles observée au cours de l'émergence des rémiges, qui permet probablementXIX
de réduire le temps passé en plongée, semble correspondre à une stratégie permettant de
limiter
les risques de dommages aux nouvelles plumes en croissance.Enfin,
les résultats montrent quepour
les oiseaux sauvagesil
n'y
a pas de changement de la massecorporelle au cours
de
la
mue, ce
qui
suggère, commepour
les
individus captifs,qu'il n'y
a pas, chez cette espèce,utilisation
d'une stratégie de gestion de la masso corporelle pour réduire la durée d'incapacité de vol.Parallèlement
à
la
gestion
du
poids des
organes
et
des
réserves
lipidiques,l'hypothèse, selon laquelle
la
phénologie
de
la
mue est
en
synchronieavec
la température del'eau afin
d'économiser de l'énergie, a été testée dansle
chapitreIV
sur des eiders sauvages munis de consignateurs de données. Nos résultats mettent en évidence l'existenced'un
fort
synchronisme entrele
déroulement de la mue chez les eiders etla
température chaude dela
surface des mers deleurs
sites de mue.Il
est intéressant de constater que, comme stipulé par d'autres auteurs, les individus moins bien synchronisés avec la température chaude de l'eau subissent uns augmentation de leur dépense énergétique.Ir
but du chapitre
V
est d'évaluer
l'influence
de
la
températurede
l'eau
sur
le déroulementde
la
mue, mais
cette
fois
avec des
eiders
captifs
en
conditionscontrôlées. Contrairement
à
nos
attentes,
nos
résultats
montrent
l'absenced'augmentation
de
la
vitesse
de
croissancedes plumes avec
un
retard
dans le déroulement de la mue pour lesindividus
exposés en eau chaude comparativement àceux restés en eau
froide.
Nos résultats suggèrent également que les variations de la masse corporelle jouent un rôle primordial au cours du déroulement de la mue.L'ensemble de cette thèse souligne ainsi
le
rôle
prépondérant dela
température del'eau
dans lebon
déroulement dela
mue des canards demer et,
dansle
cadre d'un réchauffementclimatique global,
montrela
nécessité demieux
prendreen
compte cette période pour les décisions relevant du domaine de la conservation.Mots clés : masse corporelle,
Mergini,
phénologie de la mue des rémiges, température de I'eau, vitesse de croissance des plumes.CHAPITRE
I
TNTRoDUCTToN
cÉNÉnar-B
1.1
Les plumes1.1.1
Une structure hors du communAu
coursde
l'évolution,
les
plumes, certainement l'élémentle
plus
évocateur des oiseaux, se sont modifiées et diversifiées aussi bien au niveau de leur forme, de leurs couleurs que de leur taille.Il
existe 3 principales catégories de plumes : les plumes devol
(rémiges et rectrices), les plumes de contour,qui
recouvrentle
corps, etle
duvet qui constitue la couche proximale de plumes du corps.Les plumes, téguments épidermiques creux, sont insérées dans la peau par le calamus
et
se poursuivent versl'extérieur par
le
rachis surlequel
sont attachés les vexilles antérieurset
postérieurs.Ces derniers
sont
constituésd'une
structure
complexe composée de barbes accrochées les unes aux autres parf
intermédiaire des barbules et des barbicelles (Ginn etMelville,
1983; Stettenheim, 1972;Voitkevich,
1966). Cette structure rend les plumes à la fois souples et légères tout en leur permettant de résister aux fortes pressions et dépressions exercées parl'air
au cours duvol
: c'estl'un
des tissus biologiquesqui
possèdele
ratio résistance-poids leplus
élevé.I-es plumes ont ainsi évolué à l'échelle macroscopique mais également à l'échelle microscopique. Les caractéristiques microscopiques des barbules peuvent, elles-mêmes, souligner une réponsefonctionnelle suite
à l'influence du
mode de
recherchede nourriture,
par exemple chezles
canards.En effet, Dove
et
Agreda (2001)
ont
montré que
lesbarbules des plumes du duvet des canards plongeurs présentaient moins de nodosités
que
celles
du
duvet des
canards
de
surface;
leur
présence
est
inversementproportionnelle
à la
profondeur moyenne des
plongéesdes
espècesde
canards plongeurs, suggérant que ces nodosités permettraient alors de piéger davanlaged'aft.
Ainsi,
leur
plusfaible
densité, au niveau dela
microstructuredu
duvet des canards plongeurs,constituerait
une
adaptation permettantà
ces oiseaux
de
réduire
leurflottabilité pour plus d'efficacité lors
des plongées. Ces résultats,
à
eux
seuls, soulignentf
incroyableévolution,
la
spécificité
etla
complexité des plumesqui
ne sont pourtant que des téguments morts.1.1.2
Iæs fonctions du plumageLe
plumage estl'ensemble
desplumes
qui
recouvrentun individu,
cependant son origine évolutive reste obscure et est encore souvent controversée. D'unpoint
de vue fonctionnel,l'origine
de la plume pourrait être conjointe à I'acquisition du vol, ou à larecherche
d'une meilleure isolation
thermique,
ou
encore
simplement
au développementd'éléments importants
liés aux
comportementsterritoriaux ou
de parade.La
découverte récentede
dinosauresdu
Crétacé supérieur, recouverts de<<
proto
plumes
>>mais
incapablesde voler
(Xl
et
al.,
2003),
semble confirmerl'hypothèse selon laquelle
la
fonction première
desplumes
ne
seraitpas
le
vol
(Sumida et Brochu, 2000) mais bien I'isolation thermique (Bock, 2000).
L'acquisition
de
plumes
pourrait
alors être
considéréecomme une évolution visant
à
acquérir l'homéothermie, c'est-à-dire permettantla
conservation dela
température corporelle constante, indépendammentde
la
températuredu
milieu
environnant. Toutefois, le plumage, de parla
grande varie,té des plumes qui le constituent, présente aujourd'hui unemultitude
de fonctions.Bien
évidemment, enplus
de sesrôles d'isolant et
de barrière physique (protection contre les chocs, protection contre les frottements dans3
oiseaux et peut encore servir de bon indicateur de qualité
individuelle afin
d'assurerla
sélectiondu
meilleur
partenaire (Andersson, 1994;Delhey
et
a1.,2006;
Endler, 1980; Ferns et Lang, 2003;Fitzpatrick,
1998;Hill,
1990;Hill
etMontgomeie,1994;
Robertson et a1.,1998). En effet, en période de reproduction, les plumes, souvent très colorées, sont mises en valeur
lors
des parades nuptiales.Bien
entendu,le
plumage permet à la plupart des espèces d'oiseaux de voler. Ce moyen de locomotion présente alors de nombreux avantages:
il
permet aux oiseaux d'échapper à leurs prédateurs(Van
Den
Hout et
al.,
2010), de parcourir facilement de
grandes distanceset
de migrer vers des sites de reproduction, de mue ou d'hivernage plus appropriés à leurs besoinsdu
moment. Outreleurs
déplacementsau sol ou
à la
surface del'eau,
lesoiseaux
utilisent
égalementle
vol
pour
exploiter
plus
efficacement
les
zonespotentielles d'alimentation
(Pelletiet
et
al.,
2007; 2008;
Pennycuick, 1987).
IÊ,plumage
est enfin utilisé pour remplir
des fonctions
plus
étonnantes. Certaines espèces, cofirmeles
gangas (Pterocles sp.),utilisent leur
plumagepour
apporter del'eau
à
leurs jeunes (Cadeet Maclean,
1967), tandis queles pitohuis
(Pitohui
sp.)transportent sur leurs plumes une neurotoxine alcaloïde qui permet de lutter contre les parasites
(Dumbacher, 1999).
Enfin, les
plumes peuvent
être utilisées
commeinstrument
de
musique
pour
courtiser
les
femelles.
C'est ainsi que
le
mâle
duManakin
à ailes blanches (Machaeropterus deliciosus) essaied'attirer l'attention
en agitant àvive
allure les plumes de ses ailes, cequi
a pour effet de produire des sons (Bostwick et Prum, 2005).1.1.3
La
qualité des plumesLa
qualité des plumes, et par conséquent du plumage, estun
élémentprimordial
qui déterminela
duréeet
la
résistancede
ces tégumentsmorts face
à
la
dégradation temporelle.Malgré
la
structure microscopique particulière desvexilles
et l'entretien continu dont bénéficiele
plumage chaquefois
que les oiseauxle
lissent avecle
becou par
exempleutilisent
desfourmilières pour
se débarrasser des parasites etc.,la
plume
finit
par s'user, les barbules étant de moins en moins solidaires entre elles. Ce phénomène d'usure, que ce soit pour les plumes des ailes ou celles du reste du corps, est comparable àl'usure
des ailes des insectes tels quel'abeille
Bombus spp. (Haas, 2005; Haas et Cartar,2008). Toutefois, dans ce cas, et contrairement à ce qui se passe chezles
oiseaux, aucuncycle
de
remplacement desailes
uséesn'existe
chez les insectes. Iæs arthropodes sont donc << tributaires >> del'usure
de leurs ailes,leur
vie active étant directement liée à leur durée fonctionnelle. Pour les ouwières d'abeilles, la quantité detravail
accompli, c'est-à-direla
durée totale devol,
a été corrélée avec la durée de vie de ces dernières (Neukirch, 1982; Schmid-Hempel etWolf,
1988).Iæs plumes des jeunes oiseaux sont connues pour être moins sophistiquées et moins résistantes que celles des adultes (Ginn et
Melville,
1983;Merilâ
etHemborg,2000;
Pap et
aL,2007;
Svensson, 1992; Vâgâsi etal.,20II).1-a,
qualité des plumes est enparticulier
reliée àla
quantité de constituants déposée au cours dela
production de ces tégumentsainsi
qu'au temps disponible
pour leur
croissance(Dawson
et
aI., 2000;De la
Hera et a1.,2070;Griggio
et a1.,2009; Serra,200I;
Sena et a1.,2007).Voitkevich
(1966) a mis en évidence une relation négative existant entre la présence de granules de mélanine dansla
matrice dela
plumeet
la
vitesse de croissance de cette demière, tandis que la résistance de la plume augmente avec l'abondance de cesmêmes granules (Bonser, 1995; 1996;
Voitkevich,
1966). Par ailleurs, une plume qui présente des détériorations ou des malformations dans sa microstructure, c'est-à-dire despetits
trousou
des lacunes engendréspar
des parasites macrophagesou
encore des rayures de décoloration, sera plus fragile et plus sujette à la cassure qu'une plume sans défaut. La plus ou moins grande fréquence de ces rayures de décoloration peutavoir des
conséquencesnéfastes
sur
le
vol et
la
manæuwabilité
des
oiseaux notamment lorsqu'elles conduisent à la rupture d'une penne (Hedenstrôm et Sunada,5
présence de parasites sur les plumes avait un effet
indirect
sur la thermorégulation et la qualité des plumes de leurs hôtes.Ainsi,
pendant la période de mue, la réduction du temps total passé avec un plumage abîmé ou incomplet, donc supposé moins isolant,pourrait
permettreune réduction
des déperditionsde
chaleur. Iæsconditions
dans lesquellesla
synthèse des plumes s'effectue sont aussi importantes et déterminantespour
la
qualité
des plumes.L'intensité et
la
couleur desplumes
sont reliéesà
la présence de pigments tels la mélanine, les caroténoides et les porphyrines comme à la microstructure des vexilles (arrangement de la kératine, des couches de pigments). La qualité dela
lumière, de la nourriture, la photopériode, la présence d'hormones, etc.sont autant
de
facteurs
qui
affectent
la
microstructure des plumes
et
donc
leur durabilité et leur coloration (Butler et McCraw , 2009; DesRochers etal.,
2009;t
attin etal.,20lI).
Or la coloration du plumaged'un
oiseau est un signal, à la fois sexuel et social, soulignant la qualité génétique et phénotypiqued'un
individu.1.2
La mue des oiseaux1.2.1
Le processus de mueMalgré une structure qui présente à la fois une grande élasticité, une bonne souplesse
et
une
grande résistance,les
plumes,
soumisesà
de
fréquentes pressionset
de nombreuses agressions, finissentpar
s'user. Lesprincipaux
facteursde
cette usure sont,entre
autres,l'abrasion
mécaniqueinduite par
le vol
et
par
l'habitat
utilisé,l'action
de
la
lumière (Bergman,
1982),la
dégradatronpar les
bactéries(Burtt
etIchida,
t999),la
fatigue mécanique (V/eber et a1.,2005) et le parasitisme (Figuerolaa etal.,2003).
La
plume,qui
est une structure somatique morte, ne peut se régénérer continuellement contrairementaux
os.Des
altérationsde
sa structure apparaissent alors avec le temps, comme la formation de croissants d'usure ou la décoloration desà la rupture de certaines plumes. Ces altérations affectent directement
la
qualité de la<< surface portante >>
de
l'aile. Au
niveau
desplumes
corporelles,l'effrcacité
duplumage s'en trouvs réduite et son rôle de surface < imperméable
)
à l'eau et au vent diminue en même temps que les performances devol
(Murphy etKing,
1992; Tucker,r99r).
Iæ renouvellement de ces téguments somatiques devient donc essentiel pour
le
bon équilibre de l'oiseau tant du point de vue de la locomotion, de la régulation thermique quedu
comportement reproducteurou
simplementde
sa survie. Cette période, au cours de laquelle l'oiseau remplace ses anciennes plumes par de nouvelles, est ce quel'on
définit
sous le terme de << mue >(Ginn
etMelville,
1983; Hohman etal.,1992).
Elle
débute au moment où une nouvelle plume se forme àI'intérieur
dufollicule
alors quel'ancienne
esttoujours
en place.La
nouvelle plume en formation va
pousser l'anciennejusqu'à
cequ'elle
tombe pour pennettre àla
nouvelle de croître et de sedévelopper complètement.
Ia
mue peut
concernerle
remplacementd'une
région particulière, on parle alors de mue partielle, ou de l'ensemble du plumage d'un oiseauincluant
les rémiges et les rectrices (plumes devol)
etfait
alors référence àla
mue complète. Différents paramètres telsla
photopériode,la
température,la
disponibilité en nourriture, la quantité de pluie, les cycles hormonaux, etc., ont une influence sur le déroulement de la mue (Chilgren,1978; Dawson, 2005; Kuenzel, 2003; Pa1me, L972),mais leurs effets
restent variables, aussibien
à
l'échelle inter
qu'intra-spécifique (Barshep et a1.,2013;Blackmore,
1969; Kuenzel, 2003; Payne, 1972; Visser et aI., 2011).La
mue est un événementqui
demande du temps, des besoins spécifiques etqui
est énergétiquement coûteux (Guillemette etal.,
200'71' Hohman etal.,
1992; Portugal eta1.,2007)
:
il
s'agit d'un
processus considéré commepeu efficace
(Austin,
1983;Hoye et
Buttemer,20Il;
Murphy,
1996).Cet
événement estle
siège de nombreux7
changements physiologiques, cornme
les
augmentationsde
la
vascularisation, de l'ostéoporose, dela
déperdition de chaleur par évaporation, du taux métabolique de baseet enfin,
s'accompagned'une diminution
des défenses immunitairesainsi
que des réserveslipidiques, etc. (Chilgren et deGraw,
1977;Dolnik
et
Gavrilov,
I9l9;
Kng,
1981; Kuenzel, 2003;Murphy,
1996;Murphy et
King,
1992;Newton,
1968; Portugal etaI.,20ll;
Schieltz etMurphy,
19971,Yézina et a1.,2009; Walsberg, 1983).Chez les jeunes oiseaux,
l'alimentation au cours de
la
croissance desplumes
estprimordiale
d'autantplus
qu'ils
présentent une pousse simultanée de leurs rémiges.Chez
les
adultes,cette contrainte est
égalementvraie lors
des périodesde
mue,cependant
la
croissance
des plumes,
une
fois
débutée,
semble
relativement indépendantede
l'apport
en nourriture (Murphy
et
aI.,
1989)et
seuleune
sévèremalnutrition
(déficience en acides aminés sulfurés ou déséquilibre alimentaire) peut être responsable de la production de plumesmal
formées. Toujours d'aprèsMurphy
et
al.
(1989), en présence de carences alimentaires,il
y
a un ajustement métaboliquequi
entraîned'abord
le
ralentissementdu taux de
croissance des plumespuis
la production de plumes plus légères et plus courtes etenfin,
seulement si les carences se poursuivent,l'apparition
de
gravesmalformations. Parfois,
la
présencesur
les plumes de rayures décolorées (fines bandes translucides dues surtout à la raréfactionvoire
à l'absence de certaines barbules), souvent attribuée à une mauvaise nutrition, serait enfait
conélée à la présence de périodes de stress subies par l'oiseau pendant la mue (Sarasola et Jovani, 2006). Pour I'oiseau, enminimiser
la présence semble êtreune solution optimale (Jovani
et al.,
2010).En effet, le
processusde mue
est un évènement très important dansle
cycle biologiqued'un
oiseau et c'est uniquement àLa mue complète est un processus complexe qui peut être rapide et s'achever au bout de quelques semaines ou
bien
s'étaler sur plusieurs années chez certunes espèces (2ou
3
ans chez
les
albatrosPhoebastria
nigripes et
P.
immutabilis,
Langston et Rohwer, 1995). [æ patron de mue correspond àla
séquence avec laquelle les plumes sont remplacées. Dans ceprojet,
seulela
séquence de remplacement des rémiges afait I'objet
d'études. Plusieurs séquences de mue existent chez les oiseaux selon lafaçon dont les
rémiges tombent, selon
leur
nombre, selon
la
zone
touchée et l'intensité avec laquelle elles sont remplacées (Palmer,1972; Payne, 1972; Rohwer el a1.,2009; Stresemann et Stresemann, 1966). Iæs oiseaux ne remplacent pas tous leurs rémiges dansle
même ordre.
Ainsi
le
modèle
occasionnantla
perte
de
manière symétrique d'une penne après l'autre, en partant del'extrémité
des primaires puis des secondaires ou dansl'ordre
croissant de la numérotation des primaires, est un patron de mue séquentielle(voir Fig.
1.1). Dans notre étude,la
numérotation utilisée pour les primaires suit la méthode de numérotation descendante alors que la numérotation des secondairesutilise
la
méthode de numérotation ascendante,(voir Fig. L2).
La plupart des oiseaux suivent ce patron de mue séquentielle; c'est le cas notamment des passériformes ou des charadriiformes. Rohwer etal.
(2009) ont mis en évidence unelimite
supérieure de la masse corporelle (3 kg),limite
au-delà de laquelle un oiseau ne peut remplacer annuellement toutes ses primaires avec ce patron de mue.[,a
perted'une
penne sur deuxou la
perte d'uneplume
dansun
ordre quelconque constitue alorsla
séquence de muedite
< pas à pas >>ou
<< stepwisewing
moult
>(voir
Fig. 1.1).C'est
le
cas chez les albatrosqui
ne remplacent pas leurs pennes àf
intérieur d'une même année (Edwards,2008; Prince etal.,1997).
En effet,ils
ne perdront que quelques pennespat an,le
remplacement complet des plumesd'ailes
s'effectuant aufinal
sur deux outrois
ans.A
l'opposé, la perte de toutes les pennes en même temps correspondà
une
séquencede mue
synchrone(voir Fig.
1.1), rencontrée chez de nombreux oiseaux aquatiques (Hohman etaI.,
7992; Rohwer et a1.,2009). Ce type de9
mue induit notamment une période d'incapacité de vol plus ou moins longue selon les espèces (Hohman et
aI.,
1992; Pyle, 2008).C'est
le
cas notammentpour
la
famille
des Anatidés
qui,
avecles Anhingidés,
les
Podicipedidéset
certainsAlcidés,
fait
partie des onze
familles
présentant une perte simultanée des plumes devol
(Hohman etal.,
1992).+B
\c>
aP
Figure
L.L
Les différents
patronsde mue
desailes
chezles
oiseaux: A)
mue séquentielle,B)
mue pas
à
pas
et C)
mue
synchrone.
Les plumes
blanches représententles
anciennesplumes
et
les
plumes
grisesles
nouvelles plumes
en croissance.R
N
0
P9
P8
Figure
L.2
Méthode de numérotation des primaires (P) et secondaires (S) sur aile d'oiseau.I.2.3
L'insertion
de la mue complète dans le cycle annuel des oiseauxCertaines espèces
n'ont
qu'une
seulemue
au
cours
de
l'année.
C'est
le
cas par exemple des cygnes et des oies, tandis que d'autres espèces peuvent présenter 2 voire 3 mues du corps (Hohman etaL,
1992,voir Fig.
1.3). Selon les espèces, la durée etla
localisation de
la
période de remplacementde
l'ensemble des plumesd'un
oiseau sont très variables.Ainsi
l'âge et le sexe jouent un rôle sur le temps et I'intensité de lamue
(Billard
et Humphrey,
1972;Ginn et
Melville,
1983;Taylor,
1995), de même quele
statut reproducteur ou non desindividus (Frimer,
1994). Certains limicoles ne subissent unemue
complètequ'une
fois
arrivés sur leurslieux
d'hivernage, tandis que d'autres oiseaux muent complètement avant de migrer, comme c'estle
cas pour quelques espèces de canards. Chez quelques taxons, l'étape intermédiaire avec des oiseaux qui débutent leur mue avant la migration, I'arrêtent pour migrer et l'achèventune
fois
le
lieu
d'hivemage
atteint, existe
également(Ginn
et
Melville,
1983;11
Parkes, 1959;
Witherby,
1929)ou
encorepour le
Bécasseau semipalmé(Calidris
pusilla,
l.aguna et a1.,2012).t
a migration et la mue sont deux composantes du cycle annueld'un
oiseau parmi les processus physiologiques les plus coûteux au mêmetitre
que
la
reproduction;
aussiil
est habituel
de dire
que
cesdifférents
processus ne peuvent avoirlieu
en même temps (Clark,200I;
Payne, 1972). La plupart des oiseaux présententun
décalage temporel entrela
période de reproductionet
celle
de mue. Dans certains cas peu fréquents, pourle
manchot royal Aptenodytes patagonicus parexemple,
les
oiseaux
présententune
superpositiondes
périodes
de
mue
et
dereproduction.
Chezces
derniersil
y
a
alors
souvent concordanceentre
la
durée requisepour le
remplacement des plumes et celle requisepour
l'élevage des jeunes (Verrier, 2003). D'une manière générale, chez les oiseaux, la séparation temporelle de ces événements est principalementrégie, en période de mue, parle
compromis entre la demande physiologique importante et les limitations aérodynamiques du moment.A
B
I muc ailcs ct corps nruc du colps
période de reproduction
nrigration
Figure
1.3
A)
Phénologle du cycle annuel pour la population de la Bernache du Canada (Branda canadensis ssp.) qui présente une unique mue synchrone par an aucours
de
laquelleelle
remplacela
totalitéde
ses plumes de corpset
devol.
B) Phénologiedu
cycle
annuelpour
la
populationde l'Eider
à
duvet
(Somalerio mollissima ssp.)qui
subit deux muesdu
corpspar
an. L,a première entralne la constitution du plumagedit
d'éclipse. Après l'acquisition du plumage d'éclipse, leseiders effectuent leur mue rémigiale avec incapacité de vol. Enfin,
ils
subissent unenouvelle mue du cotps pour acquérir leur plumage nuptial.