EFFET D’INJECTIONS HEBDOMADAIRES D’UN
COMBINÉ D’ACIDE FOLIQUE ET DE VITAMINE B12 SUR
LA REPRISE DE L’ACTIVITÉ OVARIENNE POSTPARTUM
CHEZ LES VACHES LAITIÈRES
Mémoire
Seyedrocknaldin Ghaemialehashemi
Maîtrise en sciences animales
Maître ès sciences (M.Sc.)
Québec, Canada
Résumé abrégé
À partir de trois semaines prépartum jusqu’à huit semaines postpartum, les vaches traitées ont reçu une injection hebdomadaire de 320 mg d’acide folique et 10 mg de vitamine B12. La prise alimentaire, la production de lait, les pourcentages des composantes du lait, les solides totaux du lait, ainsi que le gras total, les concentrations sériques du glucose, des AGL et de l’urée, et les jours en lactation à la première insémination n’ont pas affectés par le traitement. Les concentrations de vitamine B12 et d’acide folique, les protéines totales et le lactose total du lait, la taille et le nombre de follicules et la perte de poids ont été affectés positivement par le traitement. Le supplément de vitamine B12 et d’acide folique aurait des effets positifs sur les performances productives et reproductives des vaches laitières.
Résumé
L’objectif du présent projet était de caractériser l’impact d’injections d’acide folique et de vitamine B12 sur la reprise de l’activité ovarienne postpartum chez des vaches laitières grâce à une amélioration de l’efficacité du métabolisme énergétique. La phase expérimentale s’est effectuée sur 24 vaches réparties en 12 blocs de deux vaches. À partir de trois semaines avant la date prévue du vêlage les vaches ont reçu une injection intramusculaire hebdomadaire de 5 ml de : 1) saline 0,9 % ou; 2) 320 mg d’acide folique et 10 mg de vitamine B12. La prise alimentaire et la production du lait ont été enregistrées. Des échantillons de lait ont été récoltés aux deux semaines et analysés pour les composantes du lait. Des échantillons sanguins ont aussi été prélevés à toutes les semaines, sauf pour les trois premières semaines postpartum durant lesquelles des échantillons sanguins ont été prélevés aux trois jours, afin d’évaluer le statut métabolique. À compter du jour 30 de lactation, des échantillons sanguins ont été prélevés aux trois jours afin de définir le point de reprise de l’activité ovarienne. Le développement folliculaire a été suivi par un examen échographique aux trois jours à partir du jour 42. Aux fin de caractériser le développement folliculaire, une classification basée sur le diamètre des follicules (f<8 mm; 8<f<10 mm; 10<f<12 mm; 12<f<13 mm and f>14 mm) a été utilisée. Durant chaque échographie, le nombre de follicules dans chaque classe a été enregistré. La comparaison de développement folliculaire entre les vaches demandait un moment précis et comparable, et pour ce faire, le profil de concentrations sanguines de progestérone à l’ovulation comme un point commun des animaux a été retenu. Pour le taux de gestation, seule une conception à la première insémination a été considérée comme un résultat positif. Les concentrations plasmatique plus élevées de vitamine B12 et d’acide folique chez les animaux traités (p<0,0001,
p=0,0014 respectivement) confirment que l’administration du traitement fut
efficace. Les résultats ont mis en évidence l’effet positif du supplément vitaminique sur la perte de poids en début de lactation, période de balance négative d’énergie (p=0,0036). Le traitement vitaminique a augmenté le lactose
la parturition et aussi la sécrétion de protéines totales du lait (p=0,0204), même si les gras totaux n’étaient pas significativement affectés par le traitement (p=0,3059). Ni les pourcentages des composantes du lait (gras, lactose et protéines), ni la prise alimentaire en périodes de pré- et postpartum, ont été affectés par le traitement (p>0,1). La production du lait tendait à augmenter chez les animaux traités (p=0,0543).
La concentration de BHB a été diminuée par les vitamines en période postpartum (p=0,032) et un effet du temps a aussi été observé (p=0,005). Les analyses des données postpartum confirment une tendance décroissante dans le temps du BHB chez les vaches traitées (p=0,063). La concentration plasmatique de l'urée n'a pas été influencée par le traitement. La concentration plasmatique des AGL n'a pas été affectée par le traitement, mais une interaction de traitement et temps (p=0,076, p=0,088 pour le pré et postpartum, respectivement) indique une tendance à être plus faible chez les vaches traitées. Il y avait plus de follicules pré-ovulatoires chez les vaches traitées (p=0,0263) et le follicule dominant était plus gros (p=0,0091). Une différence significative des concentrations sériques d’œstradiol à l’ovulation ± 1 jour (p=0,0433) confirme le nombre et la taille plus élevés des follicules chez les vaches traitées. La première insémination des vaches se faisait au premier œstrus après 57 jours de lactation. Les vaches recevant l’injection de vitamine B12 et d’acide folique ont été inséminées 5,5 jours avant les vaches témoins mais la différence n’était pas significative. Les résultats confirment l’hypothèse de départ que des injections de vitamine B12 et d’acide folique auraient des effets positifs sur les performances productives et reproductives de vaches laitières en début de lactation.
Avant-Propos
Le projet de maîtrise que j’ai effectué à l’Université Laval m’a permis d’acquérir des bases solides de connaissances et compétences en recherche expérimentale et sur la physiologie de la vache laitière. J’ai aussi pu constater l’importance d’une bonne coordination entre les membres d’une équipe pour atteindre les objectifs.
Je veux mentionner que l’article scientifique, dont je suis le premier auteur, sera soumis pour publication dans le « Canadian journal of animal science ». Je veux remercier les coauteurs d’avoir collaboré, par leur expertise, à la réalisation de ce projet.
Je tiens à remercier mon directeur de recherche, Jean-Paul Laforest, qui a su développer mes compétences en recherche scientifique en me donnant la confiance de prendre le rôle principal dans mon projet et pour son soutien dans les moments difficiles.
Je tiens aussi à remercier mon codirecteur de recherche, François Richard, qui a été une personne importante dans ma formation en reproduction bovine. François a su être toujours disponible pour mes interrogations. Il est un expert admirable que je tiens en haute estime.
Je veux remercier ma codirectrice de recherche, Christiane Girard, qui a su développer mes compétences en recherche en phase de laboratoire et pour les analyses. J’ai toujours apprécié ses précieux conseils et commentaires.
J’exprime ma reconnaissance à Rachel Gervais qui m’a aidé, avec un esprit ouvert, à approfondir mes connaissances en analyses des données. Pour mon projet de recherche, l’expertise d’autres chercheurs et l’aide des techniciens ont été fondamentales. En effet, je souligne que j’ai apprécié le soutien et l’aide technique et scientifique de Danny Pellerin, Christine Guillemette, Marie-Ève Tremblay, Isabelle Laflamme, Nancy Bolduc, Alexandre Bastien et Nicolas Santiquet. Aussi, j’exprime un remerciement spécial à Chrystiane Plante du
Centre de recherche et de développement sur le bovin laitier et le porc d’Agriculture et Agroalimentaire Canada à Sherbrooke.
De même, je remercie l’Action concertée FQRNT-Novalait-MAPAQ pour le soutien financier ainsi que l’Université Laval pour la formation hautement qualifiée que j’ai obtenue pendant mon projet d’étude.
Finalement, je veux remercier mon épouse, Shahnaz, pour son énorme patience et son soutien pour nos enfants au long de mes travaux de longues journées à Deschambault, spécialement les fins de semaines et les jours fériés. Merci encore de m’avoir permis de réaliser mes études.
Table des matières
Résumé abrégé ... iii
Résumé ... v
Avant-Propos ...vii
Table des matières ... ix
Liste des tableaux ... xiii
Liste des figures ... xv
Liste des abréviations ... xvii
1) Introduction ... 1
2) Revue des travaux intérieurs ... 3
2.1) Physiologie de la reproduction chez l’espèce bovine ... 3
2.1.1) Puberté et cyclicité sexuelle ... 3
2.1.1.1) Puberté... 3 2.1.1.2) Cyclicité sexuelle ... 3 2.1.2) Axe hypothalamo-hypophyso-ovarien ... 4 2.1.3) Hormones sexuelles ... 6 2.1.3.1) FSH ... 6 2.1.3.2) LH ... 6 2.1.3.3) Œstradiol ... 7 2.1.3.4) Progestérone ... 7 2.1.4) Fonction ovarienne ... 10 2.1.4.1) Ovaires ... 10 2.1.4.2) Folliculogenèse et follicules ... 10 2.1.4.3) Ovulation ... 12 2.1.4.4) Vagues folliculaires ... 14 2.1.4.5) Lutéogenèse et lutéolyse ... 14
2.1.5) Reprise de l’activité folliculaire en période post-partum ... 15
2.2.1) Sources de l’énergie ... 16
2.2.2) L’état de chair ... 19
2.2.3) Le bilan négatif de l’énergie ... 19
2.2.4) Prise alimentaire volontaire de matière sèche ... 24
2.3) Gestion nutritionnelle pendant la période peripartum ... 25
2.3.1) Les ingrédients de la ration alimentaire ... 25
2.3.2) Carences minérales et carences vitaminiques chez les vaches laitières ... 26
2.3.2.1) Minéraux ... 26
2.3.2.2) Vitamines ... 26
2.4) Vitamine B12 et acide folique ... 27
2.5) Le cycle de la méthionine et le cycle de Krebs ... 30
2.5.1) Le cycle de méthionine ... 30
2.5.2) Le cycle de Krebs ... 32
2.6)Rôles de la vitamine B12 et de l’acide folique sur le métabolisme énergétique ... 32
2.7) Hypothèses et objectifs ... 33
3) Article ... 35
Effet d’injections hebdomadaires d’un combiné d’acide folique et de vitamine B12 sur la reprise de l’activité ovarienne postpartum chez les vaches laitières. 3.1) Abstract ... 36
3.2) Introduction ... 38
3.3) Material and methods ... 41
3.3.1) Animals and treatments ... 41
3.3.2) Feeding ... 42
3.3.3) Milk and Blood sampling ... 45
3.3.3.1) Milk sampling ... 45
3.3.3.2) Blood sampling ... 45
3.3.4) Ultrasound records ... 48
3.3.6) Laboratory analysis ... 49 3.3.7) Statistical analysis ... 49 3.4) Results ... 51 3.4.1) Production performance ... 51 3.4.2) Reproduction parameters ... 59 3.5) Discussion ... 66 3.6) Conclusion ... 72 3.7) Acknowledgement ... 72 4) Conclusion ... 73
Liste des tableaux
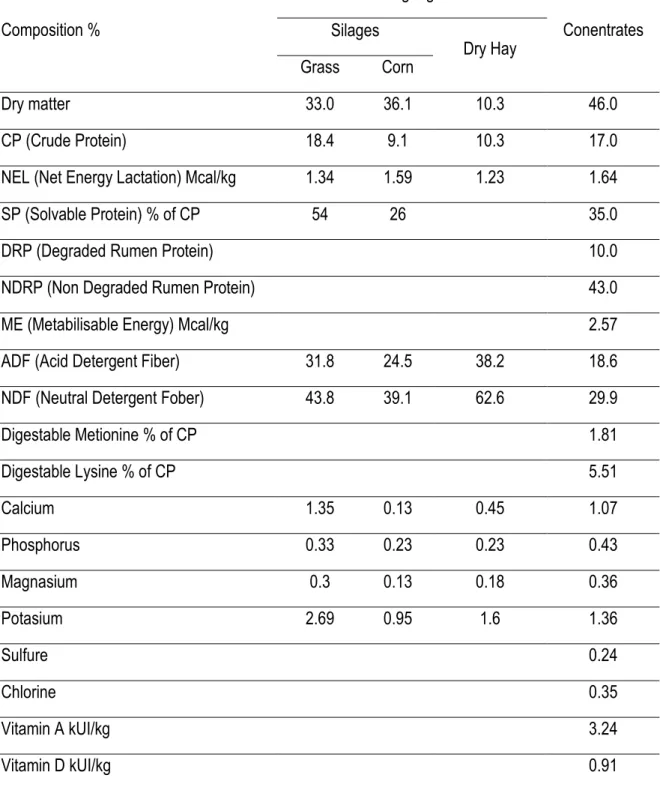
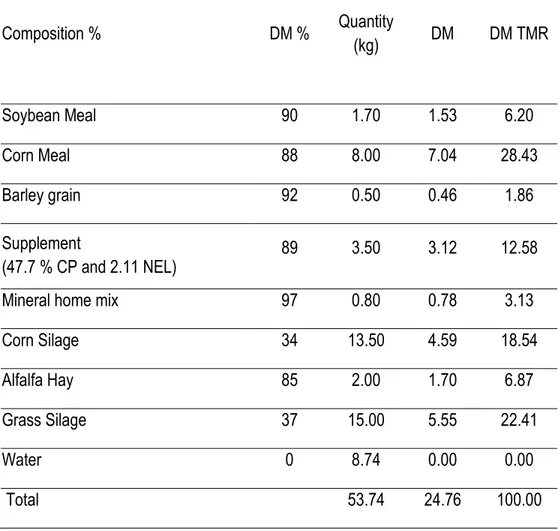
Tableau 3.1. Composition of the diet fed to lactating cows, during approximately the first 8 weeks of lactation ... 43 Tableau 3.2. Feed ingredients given to lactating cows with 39.3 kg milk (4.09 % fat, 4.7% lactose and 3.15 % protein), 675 kg weight and BCS 2.7 during approximately the first 8 weeks of lactation ... 44 Tableau 3.3. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately the first 8 weeks post-partum, in multiparous dairy Holstein cows, on the dry matter intake (kg/day) and milk production ... 53 Tableau 3.4. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately the first 8 weeks post-partum, in multiparous dairy Holstein cows, on milk composition ... 55 Tableau 3.5. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately the first 8 weeks post-partum, in multiparous dairy Holstein cows, on serum concentrations of metabolic factors ... 56
Liste des figures
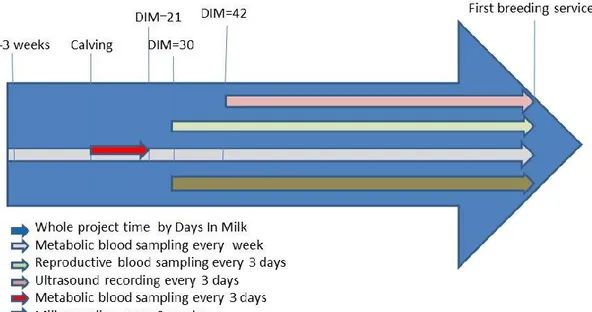
Figure 2.1. Mécanismes de rétroaction des principales hormones dans l’axe hypothalamo-hypophyso-ovarien qui pourraient moduler la fonction de reproduction ... 5 Figure 2.2. Trois stades de croissance folliculaire d’un ovaire : le recrutement, la sélection et la dominance ... 9 Figure 2.3. Schéma d’un ovaire bovin avec différents stades de croissances folliculaire ... 13 Figure 2.4. Métabolisme des hydrates de carbone chez les vaches laitières ... 18 Figure 2.5. Métabolisme protéique et du métabolisme lipidique dans le foie chez les vaches laitières ... 23 Figure 2.6. Schéma présentatif du cycle de la méthionine et l’adaptation avec le cycle des folates ... 29 Figure 2.7. Présentation schématique de l’interaction entre la vitamine B12 et l’acide folique ... 31 Figure 3.1. Project time table starting 3 weeks precalving until the first breeding service, approximately 8 weeks, postcalving. ... 47 Figure 3.2. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on weight change during lactation ... 54 Figure 3.3. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on serum concentrations of non-estrified fatty acids ... 57 Figure 3.4. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on the evaluation of milk components solid production kg per day
Figure 3.5. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on the insemination number per conception ... 60 Figure 3.6. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on the days in milk at the first breeding service ... 61 Figure 3.7. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on the follicular dispersion according to 5 category sizes ... 62 Figure 3.8. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on the mean number of the pre-ovulatory follicles, at ≤ 3 days before ovulation ... 63 Figure 3.9. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on the diameter (in millimeter) of dominant follicles at ≤ 3 days before ovulation ... 64 Figure 3.10. Effect of combined weekly injections of vitamin B12 (10 mg) and folic acid (320 mg), starting 3 weeks prepartum until the first breeding service, approximately 8 weeks post-partum, in multiparous dairy Holstein cows, on estradiol concentrations in serum ... 65
Liste des abréviations
ADF Acid detergent fiber
ado-B12 Adénosine cobalamine
AGL Acides gras libres
AGV Acides gras volatiles
AMPc Adénosine monophosphate cyclique
ATP Adénosine-5'-triphosphate
BHB β-hydroxybutyrate
BCS État de chair (« body condition score »)
cbi-B12 Cyanocobalamine
COCs Complexe ovocyte-cumulus
CRL Vaches témoins
DIM Jours en lactation (« days in milk »)
DMI Matières sèches ingérées (« dry matter intake »)
FSH Hormone folliculo-sitmulante
GnRH Gonadolibérine
GH Hormone de croissance (« growth hormone »)
JEL Jours en lactation
LH Hormone lutéinisante
me-B12 Méthyl cobalamine
MTHFR Méthylènetétrahydrofolate réductase
NDF Neutral detergent fiber
NEFA Acide gras non estérifié
SAMe S-adénosyl méthionine
Scc Numération des cellules somatiques
THF Tétrahydrofolate
TMR Ration totale mélangée (« total mixed ration ») VIT Vaches traitées avec vitamine B12 et acide folique 5-CH3-THF 5 méthyl tétrahydrofolate
1) Introduction
La production du lait par vache a été augmentée de façon spectaculaire au cours des dernières décennies chez les bovins laitiers principalement grâce à des programmes de sélection efficaces. Cependant, les vaches les plus productives présentent une incidence plus élevée de difficultés de reproduction. En effet, entre les années 1975 et 1997, une baisse de 0,45 % par an du taux de conception aux États-Unis a été observée (Butler & Smith, 1989). Elle était de 1 % par an entre 1975 et 1998 en Grande-Bretagne (Rogers et al., 1999). Cette diminution du taux de conception semble être directement associée à l’augmentation de la valeur génétique pour la production (Harrison et al., 1990; Pryce et al., 2000; Staples et al., 1990).
De 2005 à 2011 au Québec, en moyenne, plus de 30,8 % des réformes involontaires provenaient de problèmes liés à la reproduction (Valacta, 2005 à 2011). En début de lactation, les vaches fortes productrices sont en balance négative d’énergie et ceci pourrait affecter le système reproducteur des animaux. C’est pourquoi il est important d’optimiser le métabolisme énergétique durant la période postpartum. Environ 70 % du glucose fabriqué par la vache laitière provient du propionate qui est produit par la fermentation ruminale. De plus, les travaux d’Overton et al. (1998) montrent qu’en moyenne 70 % de glucose disponible est utilisé par la glande mammaire pour la synthèse de lactose. Donc, une forte production laitière provoque une demande énorme pour la production de glucose par le métabolisme énergétique. La vitamine B12 et l’acide folique sont impliqués dans le métabolisme énergétique. L’enzyme méthylmalonyl-CoA mutase catalyse la transformation réversible du succinyl-CoA pour entrer dans le cycle de Krebs qui dépend de la vitamine B12 (Zhao et al., 1992). Aussi, Girard et al. (2005) ont rapporté que la supplémentation en vitamine B12 diminue la concentration de l’acide méthylmalonique du sérum du sang des vaches nourris une ration enrichie avec la méthionine rumen protégé plus acide folique. Donc, une augmentation de vitamine B12 et d’acide folique par la supplémentation pourrait améliorer l’efficacité
du métabolisme énergétique. Parallèlement aux effets sur le métabolisme énergétique, la méthionine synthase, une enzyme qui dépend de la vitamine B12, catalyse la conversion de l’homocystéine en méthionine dans le cycle de la méthionine. Selon Boxmeer et al. (2009), une concentration optimale d’homocystéine serait nécessaire pour une fonction folliculaire adéquate. Il serait donc intéressant de vérifier si un supplément vitaminique de vitamine B12 et d’acide folique peut être bénéfique pour les performances reproductives des vaches laitières en début de lactation.
Le présent mémoire débute par une revue de littérature qui porte sur la physiologie de la reproduction bovine incluant les hormones sexuelles et la fonction ovarienne. Par la suite, il est question du métabolisme énergétique, du bilan négatif d’énergie, et de la prise alimentaire en début de lactation. La revue se termine par les effets des vitamines sur le métabolisme. Par la suite, un article scientifique présente les résultats du projet de recherche qui consistait à traiter des vaches avec un combiné de vitamine B12 et d’acide folique, sous forme d’injections intramusculaires, et de les comparer à des vaches non traitées. Le but était de déterminer si l’injection intramusculaire de ce supplément vitaminique améliore la reprise de l’activité ovarienne, augmente la taille et le nombre des follicules, améliore le développement folliculaire et diminue la perte de poids chez les vaches laitières en période postpartum.
2) Revue des travaux antérieurs
2.1) Physiologie de la reproduction chez l’espèce bovine
2.1.1) Puberté et cyclicité sexuelle2.1.1.1) Puberté
La puberté se définit comme le moment d’apparition des caractéristiques qui permettent à l’animal de se reproduire par la production et la libération des gamètes sexuels. La puberté peut se produire à un état précis de développement somatique (Hafez, 1968), et se caractérise, chez la femelle mammifère, par le développement des tissus mammaires et l’apparition des premières chaleurs. Elle se produit à un âge variable, notamment selon la race, mais aussi sous l’effet de facteurs environnementaux dont l’état de chair chez les mammifères d’élevage. Dans les conditions normales, sans aucune restriction alimentaire, une génisse atteint la puberté à 40 - 45 % de son poids adulte (Meyer & Yesso, 1991). L’âge à la puberté est influencé par le taux de croissance, et la nutrition est donc un déterminant majeur de l’apparition de la puberté chez les génisses (Schillo, 1992). Le génotype joue aussi un rôle clé pour l’atteinte de la puberté (Patterson et al., 1992). La restriction alimentaire peut altérer le développement corporel, quel que soit le niveau de restriction (Berge, 1991). La consommation de fortes quantités de concentrés dans l’alimentation pendant 60 jours chez les génisses sevrées diminue l’âge à la puberté (Marston et al., 1995).
2.1.1.2) Cyclicité sexuelle
L’activité sexuelle des génisses s’exprime de façon cyclique. Ce cycle comprend l’ensemble des phénomènes physiologiques qui surviennent de façon périodique. Le cycle sexuel ou cycle œstral est une activité qui se répète entre deux ovulations. Chez les mammifères, dont les vaches laitières, le cycle sexuel
développement, suite à une fécondation éventuelle. Chez les vaches, l’œstrus est la période spécifique du cycle pendant laquelle l’animal est dit « en chaleur » donc sexuellement réceptif au mâle. Il est sous le contrôle des gonadotrophines et stéroïdes sexuels. Selon les différentes étapes de l’activité ovarienne, le cycle sexuel bovin se divise en quatre phases : 1) prœstrus ou phase de croissance et de maturation des follicules; 2) œstrus ou phase de l’ovulation; 3) metœstrus, qui dure 1 à 5 jours, et constitue la période durant laquelle le corps jaune commence à se former et la paroi utérine commence à sécréter une quantité minimum de progestérone (Dobrowolski et al., 1971); 4) diœstrus ou anœstrus, qui correspond à la période de la lutéolyse. Cette période se caractérise par la dégradation structurelle et fonctionnelle de corps jaune. Cette phase est donc dépendante du succès de la fécondation.
2.1.2) Axe hypothalamo-hypophyso-ovarien
L’hypothalamus
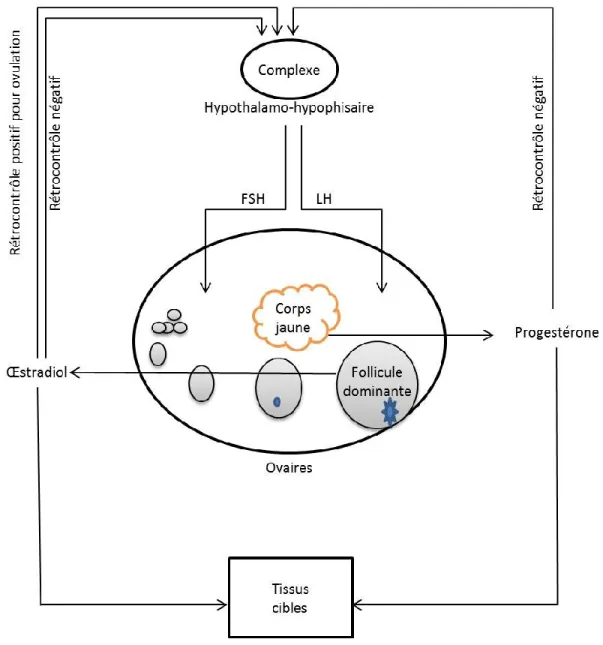
Une relation complexe et étroite entre l’hypothalamus, l’hypophyse et les ovaires est requise pour la reprise de l’activité ovarienne postpartum chez les vaches laitières (Short et al., 1990). L’hypothalamus est une portion du cerveau qui contient de petits neurones avec des fonctions variables. Une des fonctions de l’hypothalamus est de mettre en lien le système nerveux avec le système endocrinien par la glande hypophyse. La « gonadotropin releasing hormone » (GnRH), qui stimule la libération des deux hormones gonadotropes, l’hormone folliculostimulante (FSH) et l’hormone lutéinisante (LH) (Sternberg, 2006), est produite par l’hypothalamus (figure 2.1).
Figure 2.1 Présentation schématique des organes cibles et des mécanismes de rétroaction des principales hormones dans l’axe hypothalamo-hypophyso-ovarien qui pourraient moduler la fonction de reproduction (inspirée et adaptée de Sternberg, 2006).
2.1.3) Hormones sexuelles
2.1.3.1) FSH
La FSH contribue à la croissance du follicule par son effet sur la paroi de l’ovaire. La FSH stimule l’activité enzymatique de l’aromatase dans les cellules de la granulosa et aussi en absence de l’aromatase aucune stimulation significative de la sécrétion d’œstrogène a été observé chez groupe contrôle et traités par gonadotrophine (Erikson & Hsueh, 1978). L’aromatase est une enzyme ayant un rôle essentiel dans la biosynthèse des œstrogènes. Elle synthétise de l’œstrogène à partir des androgènes. La FSH déclenche la croissance folliculaire en agissant sur les cellules de la granulosa (Gong et al., 1996). Les cellules de la granulosa possèdent des récepteurs à la FSH alors que les cellules de la thèque possèdent des récepteurs à la LH à leur surface. La FSH stimule aussi les cellules de la granulosa à sécréter l’inhibine B qui a un effet négatif sur la synthèse et la sécrétion de la FSH.
2.1.3.2) LH
La LH, comme la FSH, est une hormone produite par la partie antérieure de l’hypophyse, de façon pulsatile sous le contrôle de la GnRH. La LH stimule l’activité des cellules de la thèque qui produisent des androgènes. Une augmentation aigüe de LH (pic de LH) cause aussi l’ovulation (Harman & Talbert, 1970). Ainsi, la LH est essentielle pour la formation et le développement du corps jaune. Une augmentation de la concentration et de la fréquence de sécrétion de la LH est suivie par la sécrétion préœstrus de l’œstradiol 17-β, suivie par le pic ovulatoire de LH (Humphrey et al., 1983). À mesure que le moment de l’œstrus approche, le mode de sécrétion pulsatile de la LH change (Rawlings et al., 1980; Williams et al., 1983). Lorsque le follicule atteint sa pleine maturité, un pic de production d’œstrogènes par le follicule déclenche une boucle de rétroaction positive dans l’hypothalamus qui stimule à son tour une libération accrue de LH par l’hypophyse antérieure (figure 2.2). Le pic de LH, qui dure 24 à 48 heures, déclenche l’ovulation et initie aussi la conversion du follicule résiduel en corps
jaune qui est la source de progestérone afin de préparer l’endomètre à une implantation éventuelle (Harman & Talbert, 1970). La progestérone est produite par le corps jaune dans les ovaires. Pendant la gestation, à partir de la huitième semaine environ, elle sera aussi produite par le placenta chez les vaches. Pendant la période postpartum, la progestérone sanguine est indétectable, mais sa concentration augmente 4 à 5 jours avant le premier œstrus postpartum qui se produit à 59,8 ± 3,7 jours postpartum. (Rawlings et al., 1980).
2.1.3.3) Œstradiol
L’œstradiol 17-β, le principal œstrogène retrouvé dans la circulation sanguine, est une hormone sexuelle produite par les cellules de la granulosa et dans les ovaires. De petites quantités d’œstradiol sont également produites par le cortex surrénalien. L’augmentation de la concentration sérique d’œstradiol induit le pic préovulatoire de LH chez les mammifères femelles qui ovulent spontanément (Kesner & Anderson, 1981). Après la parturition, la concentration sérique de l’œstradiol diminue rapidement au niveau le plus bas. Une augmentation de la concentration est observée juste avant le premier œstrus postpartum (Rawlings et al., 1980). En fin de période entourant la parturition, les concentrations des stéroïdes (œstradiol et progestérone) sont élevées et celles de FSH et LH sont minimales (Crowe, 2008).
2.1.3.4) Progestérone
La progestérone est produite par les ovaires, les glandes surrénales et le placenta lors de la gestation. Dans les ovaires, les cellules de la granulosa et le corps jaune sont les sources principales de progestérone. La progestérone est produite pendant la phase lutéale, après l’ovulation. La sécrétion de la progestérone se poursuit en cas de gestation, et elle est responsable de maintenir la gestation du moins au début de la gestation. Comme mentionné précédemment, à partir de la semaine 8 de gestation, c’est le placenta qui devient la source principale de la sécrétion de progestérone chez la vache. La concentration de progestérone baisse brusquement au cours des deux derniers jours de gestation (Smith et al., 1973). L’intensité et l’ampleur du bilan négatif
d’énergie ait un effet dissuasif à la production de la progestérone au cours des 2e
et 3e cycles d’œstrus postpartum (Villa-Godoy et al., 1988). Il existe une relation
fortement négative entre la prise alimentaire et la concentration de la progestérone chez le mouton (Rhind et al., 2001). La progestérone peut affecter la production pulsatile de LH par ses effets de rétroaction négative, donc elle peut jouer un rôle important dans la maturation ovocytaire et le développement embryonnaire (O'Callaghan et al., 2000). Une chute de concentration de la progestérone est nécessaire pour la rupture du follicule menant à l’ovulation.
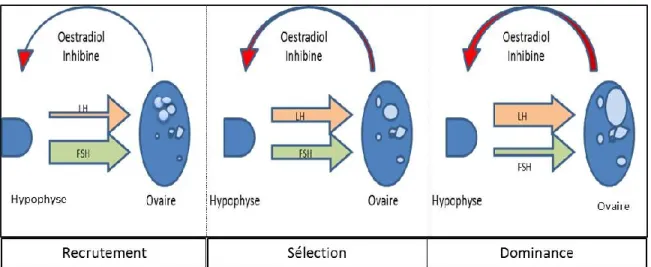
Figure 2.2 Schéma présentant les trois stades de croissance folliculaire d’un ovaire (inspirée de Clément & Monniaux, 2006).
Recrutement fait référence à la première phase de développement folliculaire qui engage plusieurs follicules entre 3 et 6 mm (Driancourt, 1991). Sélection est un processus durant lequel un seul follicule atteint le stade préovulatoire.
Dominance folliculaire fait référence à l’ensemble des changements
physiologiques et morphologiques permettant le développement du follicule dominant.
2.1.4) Fonction ovarienne
La fonction ovarienne se caractérise par les aspects suivants : le recrutement des follicules destinés à la croissance, la sélection des follicules qui poursuivront leur croissance, la dominance des follicules et, enfin, le phénomène de l’ovulation.
2.1.4.1) Ovaires
Les ovaires sont deux organes reproductifs qui sont situés dans la cavité abdominale, de chaque côté de l’utérus, en position latérale. Ils sont attachés à l’utérus par les ligaments de l’ovaire. Les ovaires ont pour rôle de délivrer un ovule pour chaque cycle sexuel afin de permettre, éventuellement, la fécondation par les spermatozoïdes. La partie centrale de l’ovaire contient les vaisseaux sanguins, les nerfs et les vaisseaux lymphatiques (Stevens et al., 1997). L’ovaire contient des cellules folliculaires, des cellules de la granulosa, entourant les cellules folliculaires qui ont proliféré pour produire un épithélium stratifié, ainsi que les gamètes (Sadler, 1988).
2.1.4.2) Folliculogenèse et follicules
La croissance folliculaire débute avec des follicules primordiaux qui forme une masse critique et non renouvelable de follicules pour la durée de la vie reproductive (Driancourt et al., 1991). Chez le bovin, les premiers follicules antraux apparaissent dans l’ovaire du fœtus vers le 270e jour de chaque gestation (Oxender et al., 1979). Le développement folliculaire est constituée des phases suivantes : le recrutement, la sélection et la dominance (Ginther et al., 2001). Les follicules primordiaux se développent afin de se transformer en follicules primaires (Peters et al., 1978). Le deuxième stade de développement folliculaire se caractérise par les follicules secondaires qui montrent une division mitotique avec apparition des cellules de la granulosa (Fair et al., 1995). Le troisième stade de développement folliculaire se traduit par la formation de l’antrum, une cavité unique remplie de liquide folliculaire. Le stade de formation de l’antrum dans le follicule correspond au recrutement folliculaire (Driancourt,
1991). Les cellules du cumulus projettent des jonctions communicantes vers la surface de l’ovocyte à travers de la zone pellucide (Wert & Larsen, 1989) en formant des « jonctions ouvertes » qui se développent en parallèle au développement folliculaire. L’ensemble de ces processus de développement folliculaire, depuis le stade primordial jusqu'au moment de l’ovulation ou à l’atrésie, s’opère sur une base continue, ce qui fait que les follicules entrent en différentes phases de développement chaque jour (Monniaux et al., 2009). L’atrésie se caractérise par la destruction presque totale des cellules de la granulosa qui conduit le follicule antral à perdre sa fonctionnalité. L’atrésie folliculaire entraîne une diminution des stocks folliculaires des ovaires aussi. La sécrétion de FSH augmente quelques jours avant la formation d’une nouvelle vague de développement folliculaire. Cette augmentation recrute plusieurs follicules antraux. La croissance folliculaire commence dès le recrutement et s’accompagne de sécrétion d’œstradiol, qui sert de rétro-contrôle négatif sur la production de FSH (Ginther et al., 2001). En augmentant la taille des follicules recrutés, les concentrations de l’inhibine et de l’œstradiol augmentent en diminuant la concentration de FSH. Le stade de recrutement se poursuit par le stade de sélection folliculaire de la phase de croissance folliculaire (figure 2.2). Il a été montré que la plupart des follicules recrutés deviennent atrétiques. Les cellules de la granulosa arrêtent alors de croître et elles se détachent de la membrane basale, ce qui entraine la mort de l’ovocyte. Cependant, un des follicules continue à croître et entre dans la phase de dominance dès que les récepteurs de LH apparaissent sur les cellules de la granulosa. À ce moment, le follicule atteint un diamètre de plus de 8,5 mm (Ginther, 2000). Le follicule ovarien est l’unité de base pour la reproduction. Il fournit un environnement spécial qui permet la croissance et la maturation d’un ovocyte à partir d’un follicule primordial (Lonergan et al., 1994). Les cellules qui constituent le follicule sont les cellules de la granulosa, les cellules de la thèque et les cellules du cumulus qui entourent directement l’ovocyte. Les cellules de la thèque sont différenciées en deux couches : l’externe et l’interne. Elles sont responsables de la sécrétion d’œstrogènes, de progestérone et d’androgènes (Mably et al., 1992).
2.1.4.3) Ovulation
Le produit du cycle œstral est la libération de l’ovule, une étape ultime lors de laquelle le follicule dominant délivre l’ovocyte pour une fécondation éventuelle. Suite au pic de LH, l’ovulation se manifeste après un temps précis, selon l’espèce, qui est 29-31 heures chez la vache (Thibault & Levasseur, 2001) en provoquant les changements morphologiques qui finissent par la rupture du follicule (figure 2.3).
Figure 2.3 Schéma d’un ovaire bovin avec les différents stades de la croissance folliculaire (inspirée et adaptée de Guénard, 2001).
2.1.4.4) Vagues folliculaires
Chez le bovin la croissance folliculaire s’effectue de façon continue par vagues de croissance à l’intérieur d’un cycle œstral. Chacune des vagues folliculaires comporte trois phases de croissance. Bien que Ginther (1989) ait rapporté que plus de 80 % des vaches ont 2 vagues de développement folliculaire, Sirois (1988) a indiqué que plus de 80 % des vaches ont 3 vagues de développement folliculaire. Les facteurs pouvant expliquer une telle différence n’ont pas encore été identifiés. La majorité des vaches ont donc deux ou trois vagues de développement folliculaire intra œstrus. En effet, une vague folliculaire se développe pendant 7 à 10 jours et affecte plusieurs follicules de 3 à 5 mm de diamètre. Cependant, il y aura un seul follicule dominant au cours de chaque vague folliculaire.
2.1.4.5) Lutéogenèse et lutéolyse
Une phase lutéale commence par la lutéogenèse et se termine par la lutéolyse. La lutéogenèse se caractérise par les transformations et la vascularisation extrêmement rapide qui ont lieu dans la couronne capillaire entourant le follicule juste après l’ovulation (Gospodarowicz & Thakral, 1978). En absence de gestation, une dégradation structurelle et fonctionnelle du corps jaune survient. Chez les bovins, l’hormone prostaglandine F2α, sécrétée par l’utérus, déclenche la lutéolyse (Gospodarowicz & Thakral, 1978).
2.1.5) Reprise de l’activité folliculaire en période post-partum
La durée de la gestation est variable chez la vache. Cependant, une durée moyenne de 280 à 284 jours est généralement rapportée (Beard, 1897). Les statistiques sur les moyennes de 7 ans en industrie laitière montrent que la moyenne des jours en lait à la première insémination est de 87 jours au Québec (Évolution de la production laitière, 2005 à 2011, Valacta). Toutefois, l’intervalle de vêlage optimal de 365 jours reste un objectif important en production laitière. Pour atteindre cet objectif, des intervalles de 55 jours et 85 jours sont nécessaires pour la première insémination et la conception, respectivement, suite au vêlage. Une reprise rapide de l’activité ovarienne postpartum est donc requise afin d’atteindre cette cible optimale de l’intervalle de vêlage. En début de lactation et après la régression du corps jaune de gestation, il y a une période anovulatoire plus au moins longue (Zemjanis, 1961). La durée de cette période anovulatoire est affectée par différents facteurs comme la régie nutritionnelle, l’état de chair de l’animal, l’allaitement des veaux, les dystocies, la race, l’âge et la saison de parturition (Tucker, 1982; Chauhan et al., 1986). La première étape de croissance folliculaire postpartum n’est pas clairement détectable en raison de l’incapacité de suivre précisément l’évolution quotidienne de la croissance et de la régression individuelle des follicules ovariens. Cependant, grâce à la technique par échographie, il est possible de mesurer individuellement les développements folliculaires et suivre leur modèle de développement et régression (Ginther et al., 1989; Savio et al., 1990). Des follicules de grand diamètre (f>8mm) sont présents au 7e jour de lactation (JEL), et les nombres des follicules de 4, 7 et 9 mm augmentent entre 7 et 42 JEL chez les vaches en lactations (Spicer & Echternkamp, 1986). La population des follicules antraux des vaches laitières a été étudiée à 15, 25 et 35 JEL par Dufour et Roy (1985) et ils ont rapporté une croissance des petits follicules antraux entre 15 et 35 JEL. Les études antérieures permettent donc de conclure qu’il y a un développement folliculaire actif avant la première ovulation.
2.2) Métabolisme énergétique et reproduction
La fabrication et la rupture des liaisons chimiques entre les molécules dans les cellules des organismes biologiques, représentent l’ensemble des processus qui produisent l’énergie. La croissance, le développement et la synthèse sont des processus biologiques qui dépendent de l’énergie sous la forme d’adénosine-5’-triphosphate (ATP). Le métabolisme est généralement divisé en deux catégories : le catabolisme, qui décompose les matières organiques et produit l’énergie par la respiration cellulaire; l’anabolisme, qui construit les composantes des cellules, comme les acides nucléiques et les protéines, en utilisant de l’énergie.
2.2.1) Sources de l’énergie
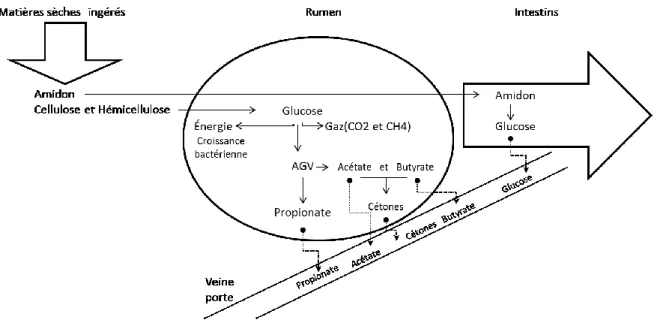
Plus de 70 % du glucose produit par les vaches est d’origine du propionate provenant de la fermentation ruminale et plus de 70 % du glucose disponible est utilisée pour la production de lait par la glande mammaire (Overton et al., 1998). L’ATP (adénosine-5’-triphosphate), une coenzyme, est l’unité universelle de l’énergie, qui a pour fonction de transférer l’énergie chimique entre les différentes réactions. Bien qu’il n’y ait que de très petites quantités d’ATP en réserve dans la cellule, cette molécule est générée de façon continue. Les sources les plus importantes pour former des substances aux fins de production d’ATP sont des hydrates de carbone, des lipides et les protéines qui constituent à son tour les ingrédients essentiels de la nutrition des êtres vivants. Chez les vaches laitières, les principales sources d’énergie sont les sucres (hydrates de carbone) structuraux (principalement les fibres) et non-structuraux (principalement l’amidon). La fermentation des hydrates de carbone est un indice de la densité de l’énergie disponible dans la ration alimentaire. La fermentation produit les acides gras volatiles (AGV), principalement l’acide butyrique, l’acide propionique et l’acide acétique (figure 2.4). Des hydrates de carbone ingérés par la vache doivent se transformer en AGV pour être une source d’énergie utilisable pour l’animal. La fermentation des acides aminés des protéines produit aussi des AGV, incluant des acides gras branchés (acide gras comportant une ou plusieurs
chaînes branchées par un ou plusieurs groupes méthyl) (Creuzot Garcher et al., 2007). La ration alimentaire est la source principale de substrats pour la fermentation ruminale et conduisent à la production d’AGV dans le rumen. Les AGV peuvent être subdivisés en deux sous-groupes. D’une part, les AGV lipogéniques, comme l’acétate et le butyrate, qui contiennent un nombre pair de carbones (AGV C2). D’autre part, les AGV glycogéniques comme le propionate, qui contiennent un nombre impair de carbones (AGV C3). Ce sont les ingrédients de la ration qui déterminent comment la transformation en AGV se fera vers la forme C2 ou C3. La voie finale pour l’oxydation consiste en un C2 (acétyl-coenzyme-A) et un C3 (oxaloacétate) afin de former le citrate selon un ratio moléculaire de 1 : 1 (van Knegsel et al., 2007). D’un côté, la mobilisation des réserves des tissus adipeux génère principalement des composés C2. D’un autre côté, en début de lactation, la production élevée de lait demande un taux élevé de production de lactose, à partir des composés C3, ce qui diminue les quantités circulantes de glucose dans l’organisme. La fabrication d’acétyl-CoA à partir d’acétate, butyrate et des AGV provenant des réserves corporelles est plus élevée que celle des composés en C3, dans la même fenêtre de temps (Knegsel et al., 2005). En effet, le ratio de l’oxaloacétate sur l’acétyl-CoA est déséquilibré donc, la disponibilité du citrate pour former de l’ATP durant le cycle de Krebs est aussi diminuée.
Figure 2.4. Présentation schématique du métabolisme des hydrates de carbone chez les vaches laitières (inspirée de Wattiaux and Karg, 2004).
2.2.2) L’état de chair
La cote de l’état de chair est un indice de la situation corporelle et de ses changements graduels pendant une lactation normale. Elle indique le statut et la capacité énergétique d’une vache laitière. Les vaches ayant une dystocie ont perdu plus de cote de l’état de chair pendant la période de tarissement que celles qui n’ont pas eu une dystocie (Gearhart et al., 1990). Une cote d’état de chair au vêlage peut donc être indicatrice de la situation de la production du lait, la santé et la fécondité des vaches laitières. L’équilibre énergétique de la ration, en période de tarissement, est très important pour parvenir à une bonne cote de l’état corporel en début de lactation afin de réduire la sévérité de la mobilisation des réserves de graisse. Le système le plus couramment utilisé est un pointage réparti sur une base de 1 à 5 par subdivisions de 0,25, de telle sorte qu’un changement d’un point d’état chair représente un changement d’environ 45 à 63 kg de poids corporel (Berry et al., 2003). La notation s’étend de la maigreur extrême (cote de 1) à l’obésité extrême (cote de 5). Une bonne cote de l’état de chair au moment du tarissement serait de 3,5 et la vache doit normalement maintenir cette même cote corporelle jusqu’à la parturition. La mobilisation intensive des réserves corporelles conduit à de fortes concentrations plasmatiques d’acides gras non estérifiés (NEFA), ce qui diminue la prise alimentaire par inhibition de l’appétit de l’animal (Overton & Waldron, 2004). Soumises à la même régie alimentaire, les vaches obèses lors du vêlage sont plus susceptibles d’avoir un bilan énergétique plus négatif comparées aux vaches ayant une cote corporelle (Meikle et al., 2004). La durée et l’intensité du bilan négatif de l’énergie dépendent principalement de la cote de l’état de chair et elles sont plus élevées chez les vaches qui avaient un état de chair plus élevé au vêlage (Broster, 1998).
2.2.3) Le bilan négatif de l’énergie
Les vaches laitières hautes productrices sont dans une situation cruciale de bilan négatif de l’énergie en début de lactation. Le bilan négatif de l’énergie favorise la mobilisation du tissu adipeux (Tamminga et al., 1997). Le bilan négatif de
l’énergie est associé avec l’extension d’anœstrus, manque de pic LH et de faibles concentrations sanguines de glucose, d’insuline et d’IGF-I (Butler, 2003). En début de lactation, en raison d’une haute demande de glucose, la prise alimentaire n’arrive pas à combler les besoins en énergie et l’animal compense le déficit énergétique par la mobilisation des réserves corporelles (tissus adipeux). Ingvarts et Anderson (2000) ont rapporté qu’en début de lactation, le pic de consommation atteint plusieurs semaines après le pic de la production du lait. En conséquence, la période entourant la parturition présente un énorme défi métabolique chez les vaches laitières hautes productrices. Le défaut de répondre adéquatement à ce défi peut entrainer une gamme de problèmes de santé en début de lactation (Bell, 1995). La stimulation de la mobilisation des tissus adipeux induit une augmentation considérable de la concentration des NEFA en circulation sanguine. Durant la période de néoglucogenèse qui fabrique le glucose à partir de sources non hydrate de carbone comme des acides aminés et AGV, une partie de NEFA sérique est dirigé vers la synthèse de corps cétonique dans le foie. C’est la raison pour laquelle la diagnostique de cétone chez la vache contient la haute concentration de NEFA ainsi que la concentration élevée des corps cétoniques comme acétone, acétoacétate et BHB. Dans la condition de haute niveau de NEFA absorbé par le foie, les NEFA peuvent se transformer en triacylglycérides et être stockés dans le foie, ce qui provoque le foie gras (Palmquist & Mattos, 1978). Une troisième voie consiste en la transformation en matières grasses du lait par la glande mammaire. L’importance d’un équilibre adéquat des nutriments lipogéniques et glycogéniques pour optimiser l’efficacité de la production et aussi pour diminuer les troubles métaboliques a été montrée (Kronfeld, 1976). Le bilan négatif de l’énergie survient en période de fin de gestation et surtout en début de lactation en raison de fortes augmentations des besoins énergétiques du fœtus et de la production du lait, respectivement. Dans ces conditions, les besoins énergétiques de l’animal vont être comblés par le métabolisme incomplet des réserves corporelles, ce qui entraîne une perte de poids et une dégradation de l’état de chair. La mobilisation excessive des réserves corporelles, surtout les tissus
adipeux, affecte le métabolisme des lipides hépatiques, de telle sorte que le surplus de la concentration de NEFA doit être oxydé ou estérifié par le foie, ce qui entraîne la production de corps cétoniques ou triglycérides stockés dans le foie. En effet, la mobilisation des réserves corporelles conduit l’animale à la réduction des performances productives et reproductives des vaches laitières. Selon O’Boyle (2008) presque moitié des vaches en hautes productions ont des difficultés métaboliques prépartum. La prise alimentaire, la production du lait, l’état de chair de l’animal pendant la période de tarissement sont les facteurs les plus importants qui définissent l’ampleur et la durée de la période de bilan négatif de l’énergie. Le bilan négatif de l’énergie, durant le premier mois suivant la lactation, est nuisible à la reprise de la fonction ovarienne chez les vaches laitières Holstein en première lactation (Senatore et al., 1996). Le stress du vêlage s’accompagne d’un ensemble de modifications hormonales, comportementales et environnementales suivant la mise bas. La période prépartum est une période critique pour les vaches haute productrices en raison d’une faible condition physique qui favorise plusieurs problèmes métaboliques ainsi que des problèmes reproductifs et physiologiques. Les données provenant d’environ 40 % de tous les producteurs laitiers canadiens, qui participent au programme d’enregistrement de santé animale en 2012, montrent que la majorité des cas de maladies surviennent pendant le premier mois de lactation. Les fréquences moyennes de huit maladies qui sont enregistrées par les producteurs sur une base volontaire étaient de 12,6 % pour la mammite, 3,7 % pour les déplacements de caillette, 4,5 % pour la cétose, 4,6 % pour la rétention placentaire, 10,8 % pour les métrites, 8,2 % pour les kystes ovariens et 9,2 % pour les problèmes de boiterie en première lactation (Koeck et al., 2012). Les mécanismes qui sont associés au bilan négatif de l’énergie et la performance reproductive ne sont pas encore entièrement connus. Cependant, il est probable que la relation entre le métabolisme énergétique et les performances de reproduction soit antagoniste. Une vache, en début de lactation, est en déficit énergétique. Elle mobilise ses réserves corporelles visant à combler des besoins énergétiques qui sont la raison principale de perte de poids. Les tissus adipeux
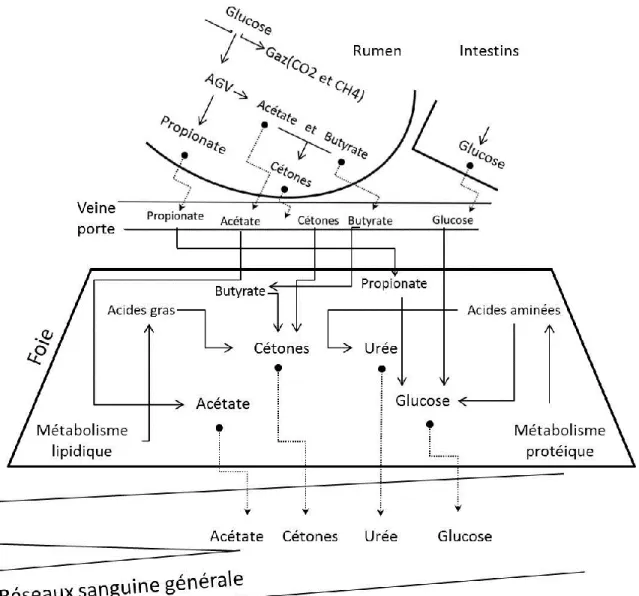
sont des sources plus importantes pour ces compensations énergétiques et dans la situation aigüe de déficit, la mobilisation des tissus musculaires squelettiques se déclenche. Les lipases catabolisent les triglycérols en AGL (acides gras libres). Sous le contrôle de la leptine, l’insuline et une cascade complexe hormono-dépendante le fait de l’hydrolyse des triglycérides s’active. Les hormones impliquées dans le processus de lipolyse sont l’adrénaline, le glucagon, l’hormone de croissance et l’insuline. Ces changements hormonaux augmentent la production d’AMPc (adénosine monophosphate cyclique), qui active la protéine kinase A (Wiliams et al., 2009). Cette dernière active ensuite la lipase dans les tissus adipeux. Les triglycérides se transforment, sous l’effet de la lipolyse, en glycérol et AGL qui sont libérés dans la circulation sanguine, et qui deviennent disponibles pour l’absorption cellulaire. Le glycérol entrant dans la circulation sanguine est capté par le foie, où il entre dans le processus de gluconéogenèse pour la production de glucose. Pendant la période de déficit intense de l’énergie, une grande partie des AGL est dirigée vers la synthèse de corps cétoniques dans le foie (figure 2.5). La concentration élevée de corps cétoniques dans la circulation sanguine, sans les signes cliniques de cétose, définit la cétose subclinique (Andersson, 1984).
Figure 2.5. Présentation schématique du métabolisme protéique et du métabolisme lipidique dans le foie chez les vaches laitières (inspirée de Wattiaux and Karg, 2004).
Une demande élevée en glucose et la mobilisation intense des tissus adipeux sont deux conditions qui accentuent la cétose. Les corps cétoniques dans le sérum sanguin sont l’acétone, l’acétoacétate et β-hydroxybutyrate (BHB). L’acétoacétate et BHB sont librement distribués et transportés dans la circulation sanguine et ils sont probablement inter convertibles (Cavestany et al., 2005). La cétose subclinique est une maladie courante chez les vaches laitières hautes productrices et elle est principalement causée par un bilan négatif de l’énergie en début de lactation qui peut affecter la production du lait (Dohoo & Martin, 1984). Une cétonémie clinique en début de lactation, causée par le déficit énergétique, peut avoir des répercussions sur les performances de reproduction (Gustafsson et al., 1993). Dans une situation de bilan négatif important de l’énergie, le métabolisme protéique et mobilisation des muscles squelettiques permet de fournir du glucose (figure 2.5). Cependant, la production de glucose par le catabolisme des acides aminés est associée à une libération d’urée, qui demande beaucoup d’énergie (Ruderman, 1975). Bref, le déficit calorique est une source potentielle qui pourrait retarder la reprise de l’activité ovarienne postpartum.
2.2.4) Prise alimentaire volontaire de matière sèche
La consommation volontaire de matière sèche s’établit à environ 2 % du poids vif pendant les premières semaines de la période de tarissement, mais elle diminue à partir de deux semaines avant la parturition (Hayirli et al., 2002). En début de lactation, la vache mobilise les réserves corporelles comme les tissus adipeux et même les tissus musculaires, pour soutenir l’augmentation de la production du lait. Le taux sanguin d’AGL est un indice de mobilisation des réserves corporelles. La baisse de la consommation alimentaire au cours de la dernière semaine pré-vêlage est un facteur important de développement du foie gras près la parturition (Bertics et al., 1992). La stéatose hépatique est associée à des concentrations élevées de NEFA chez les vaches laitières. En effet, le taux élevé de NEFA qui est associé à des changements hormonaux est un indice d’un bilan négatif de l’énergie postpartum (Grummer, 2008). La consommation volontaire
de matière sèche est sous le contrôle de la leptine, hormone qui est sécrétée par les tissus adipeux. Sa fonction principale est de contrôler la mobilisation ou le stockage les acides gras. Elle possède aussi un rôle important de contrôle de la sensation de satiété. En effet, la leptine contrôle l’appétit ou la consommation volontaire de matière sèche. Chez les vaches laitières, l’adaptation clé en début de lactation a été identifiée par la sécrétion accrue de l’hormone de croissance (GH), l’augmentation de leptine et une diminution de la réactivité des muscles squelettiques et les tissus adipeux à l’insuline (Block et al., 2001). Des études supplémentaires sont nécessaires pour déterminer le rôle et les interactions de ces facteurs. Les conséquences fonctionnelles de la réduction de la concentration plasmatique de leptine dans la période péripartum sont les facteurs les plus importants dans la limitation de l’ingestion des aliments en début de lactation chez les vaches laitières (Ingvartsen et al., 2003).
2.3) Gestion nutritionnelle pendant la période péripartum
2.3.1) Les ingrédients de la ration alimentaireLe pic de production du lait se produit avant le pic de consommation de matière sèche en début de lactation. En effet, entre ces deux pics, la vache est en condition de bilan nutritionnel négatif et mobilise ses réserves corporelles. Les vaches qui perdent énormément d’état de chair en début de lactation, généralement les fortes productrices auront souvent des problèmes de performance reproductive. Bien qu’il y ait de nombreux facteurs nutritionnels à considérer, l’énergie et la protéine sont les deux facteurs les plus importants de la ration des vaches laitières. L’apport insuffisant d’énergie chez les génisses et les vaches en début de lactation réduit les performances de reproduction. Une nutrition inadéquate en énergie et en protéines pendant les périodes prévêlage et postvêlage diminue le taux de gestation ainsi que le taux de conception en première insémination en augmentant l’intervalle entre les vêlages chez les vaches (Randel, 1990). Cependant, un apport protéinique élevé dans la ration,
même s’il peut augmenter la production du lait, diminue la fécondité des vaches laitières (Laven & Drew, 1999).
2.3.2) Carences minérales et carences vitaminiques chez les vaches laitières
2.3.2.1) Minéraux
Les minéraux sont des nutriments vitaux pour les vaches laitières. Ils doivent se retrouver dans la ration alimentaire en quantités suffisantes selon le stade de vie de la vache. Les carences en minéraux passent souvent inaperçues. Cependant, ces carences se traduisent par une production affaiblie et une ingestion réduite, avec une incidence plus forte de certaines maladies (Becker et al., 1953). Certains oligo-éléments et des vitamines sont impliqués dans le système immunitaire et une carence de l’un ou l’autre de ces éléments peut déprimer le système immunitaire des vaches laitières en période de transition (Spears & Weiss, 2008).
2.3.2.2) Vitamines
Les vitamines sont des composantes biologiques qui ne peuvent pas être synthétisées par l’organisme, et qui doivent se retrouver dans l’alimentation. Les vitamines sont nécessaires en faibles quantités. Les vitamines généralement sont classifiées en deux catégories : liposolubles, comme les vitamines A, D, E et K et ; hydrosolubles, comme la vitamine C et les vitamines du complexe B. Les vitamines liposolubles sont solubles dans le gras et elles sont absorbées par l’organisme avec la matière grasse de l’aliment alors que les vitamines hydrosolubles sont solubles dans l’eau et elles sont absorbées via des systèmes de transport actif présents au niveau de l’intestin grêle. Les vitamines facilitent le métabolisme des acides aminés, des lipides et des hydrates de carbone permettant la croissance et la régénération des cellules du corps. Les vitamines du complexe B agissent fréquemment comme cofacteurs d’enzymes qui favorisent aussi les activités de catalyseurs métaboliques (Liberman & Bruning, 1990). Les vitamines sont essentielles pour la croissance et le développement normal des organismes multicellulaires. Quand l’aliment ne contient pas
suffisamment d’une vitamine, des symptômes de carence sont observés et, dans la plupart des cas, les symptômes disparaitront dès que la supplémentation corrigera la carence vitaminique.
2.4) Vitamine B12 et acide folique
Aussi nommée cobalamine, la vitamine B12 intervient dans le métabolisme cellulaire, plus particulièrement dans la synthèse de l’ADN, et la production de l’énergie. La vitamine B12 est synthétisée lors des processus de fermentations bactériennes, les bactéries ayant les enzymes nécessaires. Elle existe sous plusieurs formes, comme l’adénosine cobalamine (ado-B12), la cyanocobalamine (CN-B12), la méthylcobalamine (me-B12) et l’hydroxycobalamine (Hodgkin et al., 1959). Une carence en vitamine B12 cause de l’anémie, une faiblesse du système immunitaire et une perte de poids ainsi qu’un déficit énergétique.
L’acide folique, aussi nommé vitamine B9. Elle existe sous de nombreuses formes dont la 5-méthyl-tétrahydrofolate qui est la forme circulante chez plusieurs espèces animales dont la vache. La vitamine B9 est indispensable à de nombreuses fonctions corporelles comme la synthèse de l’ADN. Elle est aussi nécessaire pour la méthylation de l’uracile en thymine dans le processus de réparation de l’ADN (Blount et al., 1997). Sans méthylation, l’uracile peut être intégrer dans l’ADN, mais cela conduit à des ruptures des chromosomes. Elle intervient dans certaines réactions cellulaires comme la régénération des globules rouges (Weinstein et al., 2003). En effet, l’acide folique est essentiel pour la croissance, dont la division cellulaire. Selon les travaux de Girard and Matte (1998), un apport insuffisant en vitamine B12, en particulier en début de lactation, pourrait interférer avec le métabolisme des folates et même avec la gluconéogenèse. Une combinaison de vitamine B12 et l'acide folique peut améliorer les fonctions métaboliques chez les vaches laitières, en augmentant la production laitière et la composition du lait sans augmenter l'apport alimentaire (Preynat et al., 2009). L’acide folique est en interaction étroite avec la vitamine
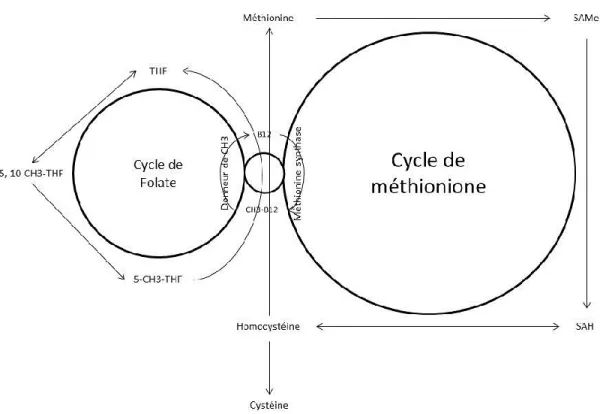
B12 dans son rôle de donneur de groupes méthyles pour la synthèse des bases purines et pyrimidines (figure 2.6). La forme méthylée de l’acide folique, le 5-méthyl-tétrahydrofolate (5 CH3-THF), se convertit en THF en présence de vitamine B12. Une carence en acide folique entraîne des troubles digestifs ainsi que des troubles de croissance. Lorsque l’apport en acide folique est adéquat, la concentration d’homocystéine devient dépendante de la vitamine B12 (Quinlivan et al., 2002). L'acide folique et la vitamine B12 sont importants dans la modulation du métabolisme de la méthionine (Drennan et al., 1994; Preynat et al., 2009). Une carence en vitamine B12 pourrait bloquer la déméthylation du 5-méthyl-THF en réduisant l’utilisation des folates au niveau de la cellule, ce qui conduit à l’accumulation de 5-méthyl-THF dans le plasma sanguin (Scott, 1999).
Figure 2.6. Présentation schématique du cycle de la méthionine et l’adaptation avec le cycle des folates (inspirée et adaptée de Finkelstein and Martin, 2000). S-adénosylméthionine accepte un groupement méthyl d’acide folique en présence de vitamine B12 via intersection biochimique critique de cycle de méthionine. En absence de vitamine B12 le CH3 restera sous la forme de CH3-THF et le cycle de méthionine sera incomplet.
2.5) Le cycle de la méthionine et le cycle de Krebs
Au moins deux enzymes sont dépendantes de la vitamine B12, la méthionine synthase qui est responsable de la régénération de la méthionine à partir de l’homocystéine dans le cycle de la méthionine, et le méthylmalonyl-CoA mutase qui catalyse l’isomérisation du méthylmalonyl-CoenzymeA en succinyl-Coenzyme-A pour faire entrer le propionate dans le cycle de Krebs. La vitamine B12 a donc un rôle de coenzyme dans le cycle de la méthionine, en présence de tétrahydrofolate (THF). Elle agit aussi en tant qu’une coenzyme dans le processus de l’entrée du propionate dans le cycle de Krebs pour la production de l’énergie (Drennan et al., 1994).
2.5.1) Le cycle de méthionine
Dans le cycle de la méthionine, la méthionine est convertie en S-adénosyl-méthionine (SAMe), qui est un donneur de groupes méthyles dans de nombreuses réactions. Le 5-méthyl-THF est un métabolite de l’acide folique qui fournit le groupe méthyle pour transformer l’homocystéine en méthionine (Strain et al., 2004). L’homocystéine, un acide aminé soufré, est un métabolite de la méthionine (acide aminé essentiel). Il y a une intersection déterminante dans cette voie métabolique entre l’homocystéine, la vitamine B12 et l’acide folique. La concentration élevée d’homocystéine est un signal de rupture de cette voie métabolique (Miller, 2003). La méthionine est essentielle pour la méthylation de l’ADN et la maladie métabolique de stéatose hépatique (foie gras) pourrait être en partie ou totalement soulagée en présence de méthionine (Oz et al., 2008). Le THF pourra accepter de nouveau un groupement monocarboné passant par le cycle des folates (figure 2.7), qui pourra ultérieurement être converti en groupement méthyle.
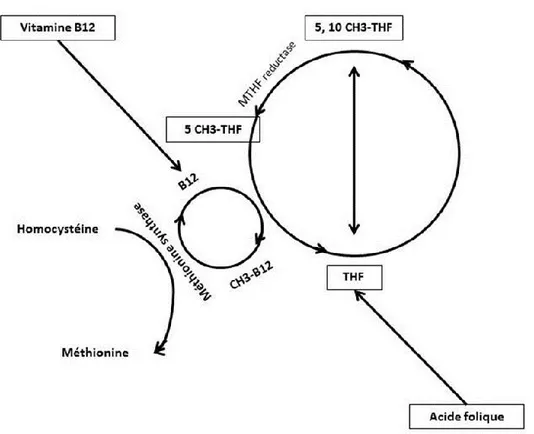
Figure 2.7. Présentation schématique de l’interaction entre la vitamine B12 et l’acide folique (inspirée de Gromer et al., 2006).
La conversion de 5, 10-CH3-THF en 5-CH3-THF est catalysée par la MTHFR et il est irréversible. En effet, la seule façon d’utilisation de 5-CH3-THF est de maintenir le cycle de folate qui consiste à déméthylation de 5-CH3-THF et méthylation de l’homocystéine en méthionine, une réaction vitamine B12 dépendante, qui régénère le THF.
2.5.2) Le cycle de Krebs
Aussi nommé cycle du citrate, il se caractérise par l’ensemble des réactions chimiques pour l’oxydation des glucides, des lipides et des acides aminés chez les organismes aérobies. Chez les vaches laitières, le propionate, produit par la fermentation du rumen, est la source principale de production d’énergie via le cycle Krebs. Le métabolisme du propionate commence par la conversion en propionyl-CoA qui est la première étape dans le métabolisme des acides carboxyliques. Puisque le propionate a trois unités de carbones, le propionyl-CoA ne peut pas entrer directement dans le cycle de Krebs. En effet le propionate doit passer par la voie métabolique suivante : le propionate se transforme en propionyl-CoA, le propionyl-CoA se transforme en méthylmalonyl-CoA sous l’effet de l’enzyme propionyl-méthylmalonyl-CoA carboxylase et le méthylmalonyl-méthylmalonyl-CoA se transforme en succinyl-CoA en présence de méthylmalonyl-CoA mutase. La formation de citrate depuis le succinyl-CoA et l’oxaloacétate est indispensable pour déclencher la production d’énergie via le cycle de Krebs (Lwenstein, 1969).
2.6) Rôles de la vitamine B12 et de l’acide folique sur le métabolisme
énergétique
La vitamine B12 et l’acide folique sont impliqués dans le métabolisme énergétique de façon indirecte. Plusieurs intrants intermédiaires ont des rôles de coenzymes qui catalysent des réactions chimiques afin de fournir le substrat principal pour le métabolisme. Deux enzymes B12 dépendantes ont des rôles plus importants.
L’enzyme méthylmalonyl-CoA-mutase catalyse la transformation du succinyl-CoA (produit essentiel de cycle de Krebs). Ce mécanisme de réaction est dépendant de la vitamine B12 (Zhao et al., 1992). Chez les vaches laitières, la supplémentation en vitamine B12 et acide folique diminue la concentration de méthylmalonyl-CoA du sérum sanguin (Navaid et al., 2013). Environ 70 % du glucose fabriqué par la vache laitière provient du propionate qui est produit par la