SYNTHÈSE
REVUES
médecine/sciences 2020 ; 36 : 581-91 médecine/sciencesLe cerveau
adulte produit de
nouveaux neurones
pour restaurer
l’équilibre
après une perte
vestibulaire
Brahim Tighilet, Guillaume Rastoldo, Christian Chabbert
>
Un phénomène appelé « compensation
vestibu-laire » se produit après une atteinte vestibuvestibu-laire
périphérique. Ce processus, qui permet un retour
progressif de l’équilibre, se produit
principale-ment au sein des noyaux vestibulaires du tronc
cérébral, et met en jeu une mosaïque de
réarran-gements structurels. Parmi ceux-ci, la
neuroge-nèse vestibulaire réactionnelle (NGVR) adulte est
peut-être la plus inattendue, car elle se produit
dans une région du cerveau qui n’a jamais été
signalée auparavant comme neurogène. La survie
et la fonctionnalité de ce réseau neuronal
nouvel-lement généré dépendent de son intégration dans
les réseaux préexistants des noyaux
désafféren-tés. Cette organisation permet au cerveau
d’uti-liser les apports d’autres modalités sensorielles
pour faciliter le rétablissement de la posture et
de l’équilibre. C’est à ce jour le meilleur exemple
du rôle réparateur de la neurogenèse adulte. Ces
observations soulèvent de nombreuses questions
sur la pertinence physiologique de la NGVR.
<
sur les muscles oculomoteurs, les muscles de l’abdomen, ainsi que sur ceux des membres supérieurs, inférieurs et paravertébraux pour le main-tien de la posture. Ces réseaux sont impliqués dans la stabilisation du regard et le contrôle de la posture au repos et en mouvement, via les réflexes vestibulo-oculaires, vestibulo-cervicaux et vestibulo-spinaux. Les NV ont la particularité d’être à la fois sensoriels et moteurs [1]. Ils traitent également des informations contribuant aux fonctions percep-tives ou cognipercep-tives, comme l’appréciation de la verticalité du corps et deson orientation dans l’espace [2]. Une autre particularité des NV est de
moduler l’information sensorielle vestibulaire par une action directe de contrôle de la sensibilité des capteurs vestibulaires périphériques via les
fibres vestibulaires efférentes [3]. Enfin, l’interconnexion des NV avec
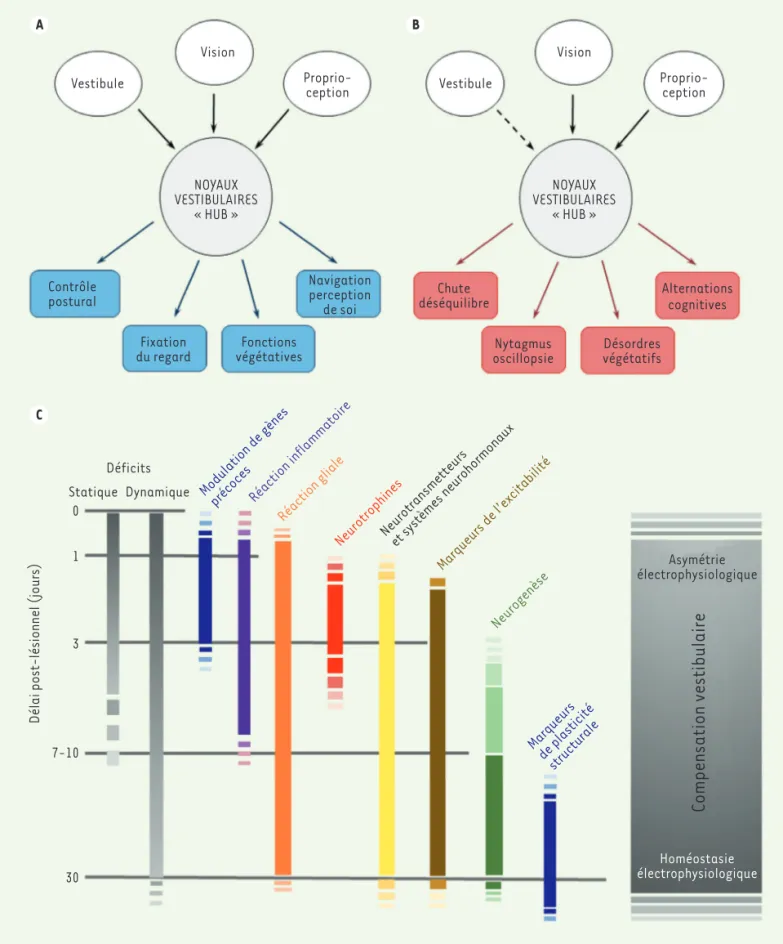
les structures neurovégétatives favorise l’inconfort ressenti dans les troubles vestibulaires [4](Figure 1A).
Le syndrome vestibulaire : un ensemble de troubles
oculomoteurs, posturaux, perceptifs, cognitifs et végétatifs
Lorsque les entrées sensorielles vestibulaires sont brusquement alté-rées, un syndrome vestibulaire aigu apparaît. Ce syndrome comprend un déséquilibre postural au repos et pendant le mouvement, ainsi que des pertes de coordination du mouvement des yeux (nystagmus, oscillop-sie), associés à des troubles cognitifs et neurovégétatifs. Ces troubles se manifestent par des altérations des réflexes vestibulo-spinaux et
Aix Marseille Université-CNRS, Laboratoire de neurosciences sensorielles et cognitives, LNSC UMR 7260. Équipe
Physiopathologie et Thérapie des Désordres Vestibulaires, Groupe de Recherche Vertige (GDR#2074),
3 place Victor Hugo,
13331 Marseille Cedex 3, France. brahim.tighilet@univ-amu.fr
Le système vestibulaire : une architecture
fonctionnelle finement ajustée
Les noyaux vestibulaires (NV) du tronc cérébral consti-tuent une zone particulière du cerveau à bien des égards. Tout d’abord, ils agissent comme un hub, recevant des informations sensorielles hétéromodalitaires liées à la position du corps dans l’espace. Les accélérations angulaires et linéaires de la tête (y compris celles issues de la gravité terrestre) sont détectées par des capteurs spécifiques situés dans l’oreille interne et transmises aux NV centraux, via le 8e nerf crânien. Les NV recueillent
également des informations proprioceptives, tactiles et visuelles. Leur rôle principal est d’intégrer ces différentes informations sensorielles et de les convertir en informa-tions motrices. En effet, les neurones des NV projettent
Alternations cognitives NOYAUX VESTIBULAIRES « HUB » NOYAUX VESTIBULAIRES « HUB » Proprio-ception Vision Vestibule
Vestibule Proprio-ception
Vision
Chute déséquilibre
Nytagmus
oscillopsie Désordresvégétatifs Navigation perception de soi Contrôle postural Fixation
du regard végétativesFonctions
Statique 0 1 3 7-10 30 Dynamique Asymétrie électrophysiologique Homéostasie électrophysiologique
Compensation vestibulaire
Modulation de gènesprécocesRéaction inflammatoire Réaction gliale
NeurotrophinesNeurotransmetteurset systèmes neurohormonaux Marqueurs de l’excitabilité
Neurogenèse
Marqueurs de plasticité structurale
Déficits
Délai post-lésionnel (jours)
A
C
B
Figure 1. Schéma des entrées sensorielles hétéromodales dans les noyaux vestibulaires et de leurs conséquences fonctionnelles en conditions normales (A) et lors d’une perte vestibulaire unilatérale (B). (C) Cinétique des mécanismes de neuroplasticité réactionnelle dans les noyaux vesti-bulaires désafférentés. La figure 1C illustre la corrélation temporelle entre le syndrome vestibulaire statique et dynamique, les méca-nismes de plasticité réactionnelle qui se produisent dans les noyaux vestibulaires après neurectomie vestibulaire unilatérale (NVU) et
SYNTHÈSE
REVUES
paroxysme deux heures après la lésion, tandis que les neurones exprimant le produit du gène Zif-268 (ou Erg-1, early growth response protein 1), détecté par immunohis-tochimie (IHC), atteignent un pic entre un et trois jours après la lésion. L’expression de ces deux gènes précoces diminue progressivement entre trois jours et une semaine
[5]. Beaucoup d’autres événements plastiques se
pro-duisent au cours de la même période : une augmentation d’expression de certaines neurotrophines, comme le fac-teur neurotrophique dérivé du cerveau (BDNF), et de son récepteur (TrKB, tropomyosin receptor kinase B) se pro-duit immédiatement après la lésion, avec une expression maximale à trois jours plus tard dans les NV et un retour à l’expression de base dans à la fin de la première semaine après la lésion. Un schéma spatiotemporel similaire est observé en ce qui concerne le facteur de croissance ner-veuse (NGF), la neurotrophine 3 (NT3) et leurs récepteurs
respectifs, TrKA et TrKC [5]. Ces changements modifient
à leur tour l’expression de neurotransmetteurs, tels que l’acide gamma-aminobutyrique (GABA), l’acétylcholine, l’histamine et la noradrénaline. Ces modifications sont observées dès le premier jour après neurectomie vesti-bulaire unilatérale (NVU). En parallèle, les marqueurs d’excitabilité neuronale, tels que le cotransporteur
cation-chlorure KCC2, les récepteurs GABAA et les canaux
K+ de petite conductance (SK) activés par le calcium,
sont radicalement reconfigurés dans cette fenêtre
tem-porelle précoce [11,12]. Des réactions astrocytaires et
microgliales, ainsi qu’une augmentation d’expression du facteur de nécrose tumorale alpha (TNF-α) sont
égale-ment observées au même moégale-ment [5,11,13,14]. Enfin,
le système neuro-hormonal, et plus spécifiquement l’axe hypothalamo-hypophyso-surrénalien (ou axe de stress) est également activé. L’activation de ces voies est carac-térisée par une expression accrue du facteur de libération de la corticotrophine (CRF) et de la vasopressine dans le noyau paraventriculaire de l’hypothalamus dès le
pre-mier jour post-lésionnel (déterminée par IHC) [15]. Une
corrélation temporelle entre l’expression des protéines impliquées dans ces mécanismes plastiques aigus et la réduction des déficits statiques a été observée.
Dans une seconde phase, plus chronique, une partie des modulations qui ont débuté pendant la période aiguë est maintenue, notamment la réaction gliale, les modi-fications affectant les systèmes GABAergique, choliner-gique, histaminergique et noradrénercholiner-gique, ainsi que les modifications neuroendocriniennes. Des changements structurels, comme la synaptogenèse réactionnelle ou la repousse de collatérales d’axones, se produisent
également dans les NV désafférentés [16,17]. Tous
ces événements plastiques qui se produisent au cours du premier mois post-lésionnel dans l’environnement vestibulo-oculomoteurs, ainsi que par la modification des signaux
vestibulo-corticaux [1,5]. Lors d’une vestibulopathie périphérique
uni-latérale, les patients présentent un syndrome vestibulaire aigu
caracté-ristique, rencontré dans la névrite vestibulaire1, la maladie de Ménière2
ou encore la fistule labyrinthique3 [6] (Figure 1B). Les symptômes
diminuent ensuite progressivement, chacun avec sa propre cinétique, ce qui conduit généralement à une disparition pratiquement complète du syndrome. Ce phénomène de récupération comportementale spontanée
est appelé compensation vestibulaire [7]. Chez la plupart des espèces,
le syndrome vestibulaire post-lésionnel comprend à la fois des déficits statiques (présents en l’absence de mouvement du corps) et des déficits dynamiques (présents lorsque le corps est en mouvement). Les déficits statiques regroupent les altérations oculomotrices (nystagmus spon-tané) et posturales (inclinaison de la tête et instabilité posturale) qui sont compensées en quelques jours ou semaines, tandis que les déficits dynamiques (réflexes vestibulo-oculaires, vestibulo-spinaux et perfor-mance locomotrice) sont compensés beaucoup moins complètement sur
une période de temps plus longue (examiné dans [8,9]).
Réarrangements moléculaires et biochimiques dans les noyaux
vestibulaires désafférentés après lésion vestibulaire
Les modèles animaux de perte vestibulaire ont révélé que le syndrome vestibulaire aigu provient d’une asymétrie électrophysiologique entre les NV intacts et les NV désafférentés et que le rétablissement
post-syndrome se fait par un rééquilibrage de cette activité électrique [9].
Le retour à l’homéostasie électrophysiologique, considérée comme le paramètre clé de la restauration fonctionnelle vestibulaire, s’effectue au travers d’une mosaïque d’événements biologiques se produisant spécifiquement dans les NV désafférentés.
Certains de ces changements se limitent à une phase aiguë qui dure de quelques heures à plusieurs jours, tandis que d’autres se maintiennent
sur une période de plusieurs mois (Figure 1C). Le décours temporel des
événements cellulaires et moléculaires qui gouvernent ce processus est
maintenant bien documenté [10]. Au cours de la phase aiguë,
l’aug-mentation d’expression des gènes précoces se produit dans les toutes
premières heures et premiers jours. L’immunoréactivité4 de Fos est à son
1 La névrite vestibulaire ou neuronite vestibulaire est un déficit vestibulaire périphérique unilatéral brusque isolé, caractérisé par l’apparition soudaine d’un vertige rotatoire intense et prolongé sur plusieurs jours, associé à un déséquilibre postural, des nausées et des vomissements, sans atteinte auditive ni autre symptôme neurologique. Son étiologie reste peu claire et certains traitements sont encore controversés. La névrite vestibulaire est la deuxième cause de vertige périphérique après le vertige paroxystique posi-tionnel bénin (VPPB). Elle représente environ 7 % des patients consultant pour des vertiges.
2 La maladie de Ménière (ou syndrome de Ménière) se caractérise par des crises récurrentes de vertige qui s’accompagnent de sifflements et de bourdonnements d’oreilles (acouphènes) et d’une baisse d’audition. Le plus souvent, une seule oreille est atteinte. Il s’agit d’une maladie chronique. La fréquence des crises est très variable et imprévisible. La plupart des personnes atteintes ont quelques crises par an, mais certaines en ont plusieurs par semaine. Entre les crises, les périodes de rémission peuvent durer plusieurs mois, voire plusieurs années. Il n’existe pas de traitement permettant de guérir la maladie de Ménière, mais les symptômes peuvent être soulagés efficacement dans la plupart des cas.
3 La fistule labyrinthique, ou fistule périlymphatique, se caractérise par une communication anormale entre la périlymphe et les cavités de l’oreille moyenne. Les symptômes associent vertiges intenses, acou-phènes, et maux de tête. Le diagnostic peut être confirmé par imagerie médicale de l’oreille moyenne. Une oblitération chirurgicale des deux fenêtres est conseillée.
4 L’immunoréactivité réfère à la réactivité des protéines révélées par immunohistochimie (IHC) à l’aide d’anticorps.
Figure 2. Preuves histologiques d’une prolifé-ration cellulaire adulte dans les noyaux vesti-bulaires désafférentés du chat et son impact sur les fonctions posturales et locomotrices. A, B. Cellules issues de prolifération post-lésionnelle (BrdU) (flèche) dans le noyau vestibulaire (NV) médian désaf-férenté de chats auxquels une solution saline témoin (NaCl, A) ou antimitotique (AraC, B) a été infusée dans le quatrième ventricule pendant 30 jours après la neu-rectomie vestibulaire unilatérale (NVU). La section du nerf vestibulaire montre une augmentation substantielle du nombre de cellules ayant incorporé le BrdU dans le NV médian désafférenté après per-fusion de NaCl, alors qu’aucune cellule ayant incorporé le BrdU n’est observée
dans le NV médian après perfusion d’AraC (échelle : 50 µm). C. Évolution postopératoire de la surface moyenne d’appui, délimitée
par le polygone entre les quatre pattes du chat en position debout sans marcher. Les données enregistrées après désafférentation vestibulaire sont rapportées à des références individuelles et normalisées par rapport aux valeurs préopératoires (1 étant proche de
50 cm2). Les erreurs standards des moyennes (ESM) sont représentées par des lignes verticales. On notera le temps de récupération
plus long lorsque l’AraC a été infusé immédiatement après NVU (86 jours au lieu de 50 jours). D.La performance maximale dans la
tâche d’équilibration dynamique est définie comme étant la vitesse de rotation de la poutre la plus élevée n’ayant pas entraîné de chute pendant quatre passages consécutifs. Cette valeur est présentée en % de la performance maximale préopératoire par rapport à la durée postopératoire en jours (en abscisse). Les ESM sont présentées sous forme de lignes verticales. La récupération complète est beaucoup plus longue lorsque l’AraC est infusé immédiatement après la neurectomie vestibulaire unilatérale (NVU) (146 jours au
lieu de 46 jours) (adapté de [19]).
résultats démontrent que, pendant cette période post-lésionnelle, la neurogenèse vestibulaire réactionnelle (NGVR) et l’astrogenèse jouent un rôle causal dans la
compensation vestibulaire chez le chat adulte [19]
(Figure 2C-D).
De nombreuses questions demeurent quant à l’éta-blissement et la pertinence de la neurogenèse ves-tibulaire réactionnelle. Premièrement, comment un environnement cérébral mature, non répertorié comme site neurogène, autorise-t-il la genèse de nouveaux neurones en période post-lésionnelle. Une possibilité est que ces neurones nouvellement générés migrent à partir de niches neurogènes établies, telles que la zone sous-granulaire du gyrus denté de l’hippocampe ou la zone sous-ventriculaire des ventricules latéraux
[20], via le sang ou le liquide céphalorachidien [21],
puis s’intègrent dans les NV en bordure du quatrième ventricule. Une autre option est que, dans des condi-tions normales, les NV constituent une niche neurogène hébergeant des progéniteurs neuronaux quiescents. Cette hypothèse est appuyée par la présence de cellules exprimant SYR ([région Y déterminant le sexe]-box 2, vestibulaire désafférenté, mettent en évidence une période critique
pendant laquelle la plasticité vestibulaire peut être façonnée par les thérapies de réadaptation vestibulaire afin d’optimiser la restauration de l’équilibre.
La neurogenèse réactionnelle chez l’adulte :
un mécanisme de réparation inattendu
Nous avons été les premiers à démontrer l’existence d’une neurogénèse
réactionnelle restreinte aux NV désafférentés [18]. Par utilisation du
bromodésoxyuridine (BrdU), nous avons montré qu’une forte prolifé-ration cellulaire débutait 24 heures après la lésion et atteignait un pic d’expression maximum trois jours après la NVU dans les NV
désaf-férentés chez le chat adulte (Figure 2A). Une infusion immédiate de
l’anti-mitotique cytosine-bêta-D-arabino-furanoside (AraC) dans le quatrième ventricule, bloquait la prolifération cellulaire et dimi-nuait le nombre d’astrocytes et de neurones GABAergiques dans les
noyaux vestibulaires de chats neurectomisés(Figure 2B). Au niveau
comportemental, après NVU et infusion immédiate d’AraC, le temps de récupération des fonctions posturales et locomotrices était considé-rablement retardé, mais aucune altération du nystagmus horizontal spontané n’était observée, comparée à une infusion de NaCl. Ces
NVU/NaCl JO-30 1 2 3 4 5 6 100 80 60 40 20 0 Équilibre statique NVU/AraC NVU/AraC NVU/NaCl NVU/NaCl Équilibre dynamique
Surface d’appui normalisée Performance maximale (%)
NVU/AraC JO-30 C D B A 2 2 12 22 32 42 52 62 72 82 92 102 112 122 132 142 10 18 24 30 38 46 54 62
Délai post-lésionnel (jours) 70 78
SYNTHÈSE
REVUES
ces cellules néoformées, 70 % survivaient au-delà de 2 mois. Parmi ces cellules, 40 % se différenciaient en neurones, 40 % en astrocytes et les 20 % restants en
cellules microgliales (Figure 3). Nous ne savons pas
encore ce qui conditionne la distribution dans chacune des lignées cellulaires. Cependant, on peut supposer que les cellules à destinée neuronale s’intégreront d’une manière ou d’une autre dans les réseaux vesti-bulaires fonctionnels préexistants. Cette hypothèse est soutenue par la forte proportion de neurones néoformés et par la morphologie mature de ces neurones, comme le développement d’une arborisation dendritique, un
mois après leur genèse [11]. Les approches
histolo-giques et électrophysiolohistolo-giques devraient confirmer cette hypothèse.
Pourquoi le blocage pharmacologique de la NGVR affecte-t-il principalement les fonctions posturales et locomotrices, mais pas la compensation du nystag-mus ? Bien que la prolifération cellulaire se produise dans tous les noyaux vestibulaires désafférentés, la différenciation en neurones (neurogenèse) se produit majoritairement dans les noyaux vestibulaires médians,
latéraux et inférieurs [18], qui sont principalement
dévolus aux fonctions posturales statiques et
dyna-miques [23]. Ainsi, le blocage spécifique de la
neu-rogénèse entrave exclusivement la restauration
pos-turo-locomotrice [19]. Le noyau vestibulaire supérieur
est exclusivement dédié à la stabilisation du regard et à l’oculomotricité. Dans ce noyau, les cellules se différencient essentiellement en astrocytes. De plus, la cinétique de disparition du nystagmus est très rapide (8 jours dans le modèle du chat neurectomisé NVU) et se produit avant l’intégration fonctionnelle des neurones SOX2) et la GFAP (protéine acide fibrillaire gliale), qui sont considérés
comme des marqueurs des cellules souches neurales [22], dans les NV
intacts de rats adultes.
Une deuxième question concerne les conditions qui induisent la migra-tion des cellules souches à partir des zones neurogènes, et l’identité des facteurs qui poussent ces cellules à entrer dans le cycle de division cellulaire à partir de l’état de repos. La NGVR ne se produit qu’après une désafférentation structurelle des NV (section du nerf crânien 8), plutôt qu’une désafférentation fonctionnelle (labyrinthectomie ou
blocage pharmacologique) [14]. Ainsi, la dégénérescence wallérienne5
des fibres nerveuses sectionnées et les cascades biochimiques qui s’en suivent peuvent déclencher la naissance de nouveaux neurones en attirant des cellules souches ou en supprimant les verrous environ-nementaux qui empêchaient la neurogenèse vestibulaire spontanée. Le sort de ces cellules néoformées indifférenciées, la façon dont elles parviennent à maturité et se différencient, et la façon dont elles s’insèrent dans un réseau neuronal préexistant et influent sur le rétablissement de la posture et de l’équilibre, demeurent à ce jour inconnus. Des approches par imagerie confocale et analyse stéréolo-gique dans un modèle félin de NVU ont permis de confirmer que, parmi
5 La dégénérescence wallérienne, consécutive à l’interruption physique d’un axone par section, se carac-térise par la dégénérescence de l’axone et de sa gaine de myéline en aval de la section, qui progresse dans le sens cellulifuge. 10 µm 10 µm 10 µm BrdU/IBA1 BrdU/NeuN BrdU/GFAP GFAP BrdU BrdU BrdU BrdU NeuN IBA1 GAD67 BrdU/GAD67 30 µm
Figure 3. Les cellules nouvellement générées se différencient en neurones, astrocytes et cellules microgliales. Des images en microscopie confocale de cellules nouvellement générées, ayant incorporé le BrdU (rouge) et exprimant des marqueurs spécifiques de la différenciation cellulaire (vert) (détectés par immunofluorescence), révèlent trois lignées cellulaires : les neurones (NeuN : marqueur des noyaux neuronaux), les astrocytes (GFAP : protéine acide fibrillaire gliale) et les cel-lules microgliales (IBA1 : molécule adaptatrice de liaison au calcium ionisé 1). Parmi les populations de cellules neuronales, une proportion exprimait GAD 67 (glutamate décarboxylase : enzyme de synthèse du GABA) (détecté par immunofluores-cence), ce qui indique leur phénotype GABAergique. Ces images représentatives de cellules en cours de différenciation ont été obtenues à partir de noyaux vestibulaires médians
Figure 4. Les noyaux vesti-bulaires désafférentés : un environnement permissif pour la neurogenèse réactive de l’adulte. Dans le cerveau adulte, en condition non lésionnelle, ou dans les noyaux vestibulaires (NV) du côté intact (à droite), la présence de cotransporteurs cation-chlorure (KCC2) à la membrane neuronale conduit à une faible concentration
interne de Cl-. Lorsque le
GABA active les récepteurs
GABAA, il déclenche un influx de Cl-, ce qui provoque une inhibition du système. Après la neurectomie vestibulaire unilatérale (NVU) (à
gauche), les cellules microgliales et les astrocytes sont fortement activés dans les NV désafférentés. Nous postulons que la micro-glie et les terminaisons nerveuses libèrent du BDNF (facteur neurotrophique dérivé du cerveau), qui à son tour active les récepteurs TrkB (tropomyosin receptor kinase B) et diminue l’expression des KCC2. La diminution d’expression des KCC2 réduit l’extrusion de chlorure
de la cellule. Les ions Cl- s’accumulent alors dans la cellule et le gradient de chlorure transmembranaire s’effondre. Comme le flux
d’anions est inversé, lorsque le GABA ouvre les récepteurs GABAA, les ions Cl- qui quittent la cellule dépolarisent la membrane
cel-lulaire et augmentent l’excitabilité de la cellule. Il est intéressant de noter qu’au même moment (3 jours après la NVU), un pic de
cellules BrdU+ est observé dans les NV désafférentés et est corrélé avec le pic d’expression du BDNF. Ainsi, le BDNF, qui est libéré à
la fois par les neurones et les cellules gliales, peut potentiellement moduler la prolifération, la survie et l’excitabilité des cellules. Tous ces mécanismes moléculaires ont pour objectif commun de restaurer l’excitabilité des NV désafférentés, qui est cruciale pour les différentes étapes de la neurogenèse (prolifération, survie, différenciation et intégration dans les réseaux neuronaux
fonction-nels) et la récupération fonctionnelle qui s’ensuit (adapté de [11]).
qu’elle n’apparaisse qu’un jour après la neurectomie vestibulaire unilatérale, elle ne devient fonctionnelle
que 30 jours après [18]. Ce phénomène se produit
pro-bablement à la fois par la reconstruction structurelle de la connectivité vestibulaire et par des adaptations fonctionnelles impliquant la modulation des effecteurs moléculaires (tels que les cotransporteurs KCC2), ce qui contribue à maintenir l’excitabilité homéostatique
nécessaire à la récupération fonctionnelle [11].
Les noyaux vestibulaires désafférentés :
un environnement permissif pour la neurogenèse
vestibulaire réactionnelle de l’adulte
Les mécanismes cellulaires et moléculaires qui sou-tiennent la NGVR endogène induite par des lésions ne sont pas encore entièrement élucidés. Cependant, certaines des conditions environnementales qui per-mettent son apparition ont été identifiées.
Dans les NV désafférentés, la NGVR repose sur au moins
trois conditions spécifiques (Figure 4). Premièrement,
elle dépend du niveau d’excitabilité de l’environnement vestibulaire désafférenté. Nous avons récemment mis néoformés dans les réseaux neuronaux vestibulaires préexistants
(30 jours), ce qui indique que ces deux processus sont indépendants. Les mesures du réflexe vestibulo-oculaire (RVO) après blocage de la neurogenèse vestibulaire réactionnelle pourraient confirmer l’absence de rôle de cette neurogenèse dans la récupération du réflexe. Quelles sont les contributions possibles de la NGVR dans la compensation sta-tique et dynamique ? La compensation des déficits stasta-tiques résulte de la restauration d’une activité électrique équilibrée entre les NV centraux. Cette constatation a été confirmée
électrophysiologique-ment chez le cobaye [24] et le chat [25]. En plus d’un rééquilibrage de
l’activité des NV, la compensation des déficits dynamiques nécessite
une réorganisation plus globale du système nerveux central [26]. Le
phénomène de NGVR (incluant la gliogenèse et l’astrogenèse) que nous soulignons est impliqué dans ces deux aspects. Comme nous l’avons montré dans notre étude précédente, la NGVR secondaire à la neurec-tomie contribue à la restauration des déficits posturaux statiques et dynamiques (fonction d’équilibration dynamique), alors qu’elle n’in-terfère pas avec la disparition du nystagmus vestibulaire horizontal
[19]. La NGVR ne semble pas être impliquée dans les mécanismes très
précoces de compensation vestibulaire statique, car son déroulement temporel ne correspond pas à la récupération des symptômes vesti-bulaires, comme le nystagmus. Nous avons plutôt postulé que la NGVR contribuait à la compensation à moyen et long terme, puisque bien
Niveau d’excitabilité Neurotrophines Réaction inflammatoire NV intact NV désafférenté Excitation TrkB BDNF microglie GABA Cl-KCC2 GABAAR Cellules BrdU+ Cl -[Cl-] i GABA KCC2 Cl -Inhibition GABAAR KCC2 Cl -NVU BDNF microglie prolifération, survie, différenciation astrocyte Astrocyte Cl -[Cl-] i
SYNTHÈSE
REVUES
aiguë dans les NV désafférentés peut faciliter l’expres-sion de la NGVR observée. De même, il a été démontré que les cellules gliales modulent l’excitabilité du réseau neuronal via différents processus, tels que la clairance
du K+ [34]ou la libération du BDNF [35]. Les cellules
gliales sont également considérées comme des compo-santes centrales de toutes les niches neurogènes dans les systèmes nerveux centraux embryonnaire et adulte
[36]. On sait que l’excitabilité neuronale est un facteur
clé de la neurogenèse et de la gliogenèse postnatales
[37]. La concomitance et l’interdépendance de ces
dif-férents mécanismes de neuroplasticité indiquent qu’ils fonctionnent de concert pour rééquilibrer le niveau d’excitabilité entre NV intacts et désafférentés. Cette homéostasie électrophysiologique est une condition préalable à l’induction d’une NGVR et à la récupération fonctionnelle qui s’ensuit.
Réémergence d’une période critique
post-traumatique et récapitulation
des processus de développement
Tous les phénomènes décrits ci-dessus se produisent pendant la fenêtre temporelle de trois jours après la neurectomie vestibulaire unilatérale. La perfusion d’AraC pendant cette phase aiguë bloque la NGVR et diminue le nombre de cellules exprimant la GFAP (protéine acide fibrillaire gliale) et de neurones GABAergiques dans
les NV des chats neurectomisés [19]. Au niveau
com-portemental, le temps de récupération de la fonction locomotrice posturale est considérablement retardé. En revanche, la perfusion d’AraC débutant trois semaines après la neurectomie n’a eu aucune influence ni sur le décours de récupération comportementale ni sur les différentes étapes de la NGVR. Nous concluons que les trois premières semaines suivant la neurectomie repré-sentent probablement une période critique au cours de laquelle d’importants mécanismes de neuroplasticité, y compris la NGVR, ont lieu pour favoriser la récupération fonctionnelle vestibulaire. À l’appui de cette hypothèse,
la restriction sensorimotrice (RSM)8, appliquée pendant
la première semaine suivant la neurectomie chez le babouin empêche la récupération posturale, tandis que son application ultérieure n’altère pas la récupération
fonctionnelle [38]. La réémergence d’une telle période
critique pendant la phase de réparation post-lésionnelle rappelle certains stades de développement, au cours desquels la neurogliogenèse, l’expression maximale de neurotrophines (BDNF) et le GABA excitateur (induit par une régulation négative des KCC2) sont sollicités de
8 Restriction de mouvements.
en évidence un remodelage des marqueurs d’excitabilité, tels que les
cotransporteurs KCC2 et les récepteurs GABAA, pendant les trois
pre-miers jours suivant la neurectomie vestibulaire unilatérale [11]. Ce
remodelage favorise une action dépolarisante, excitatrice du GABA,
neurotransmetteur qui inhibe généralement l’excitabilité [27]. La
modulation pharmacologique des récepteurs GABAA pendant la période
suivant la neurectomie modifie significativement la NGVR et altère la
restauration fonctionnelle [28]. La neurectomie vestibulaire
unilaté-rale induit également, dans les premiers jours suivant la lésion, une
régulation positive des canaux K+ de petite conductance (SK) dans
les noyaux vestibulaires ipsilatéraux6 (côté lésion) et controlatéraux7
(côté opposé à la lésion) [12]. L’administration d’apamine
(antago-niste sélectif des canaux SK) pendant la phase aiguë du syndrome ves-tibulaire réduit significativement les déficits posturo-locomoteur et vestibulo-oculaire induits par la neurectomie vestibulaire unilatérale
[12]. Ces changements se manifestent par une diminution du
nystag-mus spontané et de l’instabilité de l’équilibre statique et dynamique. Ainsi, les mécanismes qui régulent l’expression des canaux SK peuvent faire partie des changements d’excitabilité qui soutiennent le proces-sus de compensation vestibulaire.
La deuxième condition de NVGR implique le BDNF. Le nombre de neu-rones exprimant le BDNF et le TrkB (récepteur du BDNF) augmente de façon transitoire dans les NV désafférentés et atteint son apogée 3 jours plus tard, en même temps que le pic de prolifération cellulaire
[5]. Le blocage de la signalisation BDNF-TrkB réduit de façon
signifi-cative la NGVR et empêche la récupération posturo-locomotrice chez les animaux vestibulo-lésés. Inversement, une perfusion continue de BDNF dès le premier jour après la neurectomie vestibulaire unilatérale augmente les taux de prolifération, de survie et de différenciation cellulaires. Dans ces conditions, les animaux rétablissent plus tôt leur équilibre et leur posture [11].
La troisième condition essentielle de la NGVR est la présence de fac-teurs inflammatoires dans l’environnement désafférentés des NV. Dès que la neurectomie vestibulaire unilatérale est induite, de fortes réac-tions astrocytaires, microgliales et inflammatoires favorisent la NGVR
[11,13,19]. Un traitement de trois jours avec un anti-inflammatoire (Solumédrol®) chez des animaux neurectomisés réduit la prolifération cellulaire observée dans les NV désafférentés (données non publiées). La synthèse de l’histamine, dont on a également rapporté qu’elle fonc-tionnait comme un facteur pro-inflammatoire qui active la microglie
[29], est considérablement accrue après la neurectomie dans
l’hypo-thalamus postérieur et celle-ci est libérée dans les NV [30]. Comme
l’histamine favorise la neurogenèse hippocampique [31] et
subven-triculaire [32], elle pourrait être un facteur essentiel de la NGVR dans
les NV désafférentés. De plus, les médicaments pro-histaminiques, qui sont utilisés pour traiter les vertiges, favorisent la compensation
vestibulaire [18]. Étant donné que l’inflammation régule la
neuroge-nèse chez l’adulte [33], le phénomène inflammatoire exprimé de façon
6 Noyaux vestibulaires du côté désafférenté qui sont déconnectés du nerf vestibulaire par la section du nerf (neurectomie). Aussi nommés noyaux vestibulaires désafférentés.
des rats adultes [46]. Les conséquences fonctionnelles de ce processus n’ont pas été déterminées. On peut sup-poser que les nouvelles cellules subissent une apoptose ou restent non fonctionnelles. Une autre possibilité est que certains nouveaux neurones deviennent fonctionnels en s’intégrant dans les circuits neuronaux locaux, mais contribuent à une plasticité inadaptée, voire aberrante. Dans une étude plus récente, nous avons confirmé chez le chat, l’existence d’une neurogenèse réactionnelle dans les noyaux cochléaires désafférentés du tronc cérébral, après section du nerf cochléo-vestibulaire. Certains des mécanismes qui ont déjà été rapportés dans les noyaux vestibulaires désafférentés, comme la régulation néga-tive des KCC2 (suggérant que le GABA pourrait devenir excitateur), ont également été observés dans les noyaux cochléaires. La fonctionnalité des neurones nouvellement formés reste une question ouverte. Une possibilité est qu’ils favorisent une plasticité inadaptée comme l’acou-phène9 ou l’hyperacousie10[47].
Pertinence clinique
Au cours des deux dernières décennies, l’utilisation d’approches chirurgicales pour traiter la maladie de Ménière (y compris la neurotomie vestibulaire, la laby-rinthectomie ou l’ablation du sac endolymphatique) a fortement diminuée et l’administration intra-tympa-nique de gentamicine est devenue, simultanément, le
traitement le plus fréquemment utilisé [48]. L’un des
principaux avantages de la neurotomie est qu’elle
pré-serve l’audition chez 93 % des patients [49], alors que
la labyrinthectomie sacrifie systématiquement
l’audi-tion [50]. Malheureusement, les techniques actuelles
d’imagerie clinique ne permettent pas de vérifier la présence de neurones nouvellement formés dans les noyaux vestibulaires désafférentés en réponse à une neurotomie vestibulaire curative. Différents modèles animaux de lésions vestibulaires reproduisant soit un blocage réversible des entrées périphériques (injection
de tétrodotoxine11 dans l’oreille interne), soit une perte
définitive des seuls capteurs périphériques (modèle de labyrinthectomie unilatérale), soit une ablation com-plète des deux capteurs périphériques et du ganglion
de Scarpa12 (modèle de NVU) ont été développés pour
comparer les capacités de compensation en fonction du type de lésion périphérique et les mécanismes
9 Les acouphènes sont des sensations auditives que l’on entend sans qu’ils aient été émis par une source extérieure.
10 Hypersensibilité aux bruits.
11 La tétrodotoxine produite par le poisson-globe bloque les canaux sodiques vol-tage-sensibles, empêchant la production du potentiel d’action et sa propagation. 12 Ou ganglion vestibulaire.
concert. Par conséquent, le système vestibulaire de l’adulte lésé peut utiliser les mêmes recettes de développement pour sa reconstruction et sa fonctionnalité [11].
La compensation vestibulaire :
une forme de réapprentissage sensori-moteur ?
Les ingrédients utilisés par l’environnement vestibulaire mature désafférenté (Zif 268, Fos, BDNF, CamKII alpha [calcium/calmodulin-dependent protein kinase type II alpha]) sont similaires à ceux utilisés dans l’hippocampe pour l’induction du phénomène de potentialisation à long terme (PLT) qui représente éventuellement le substrat
neurobio-logique des apprentissages et de la mémoire [39]. Or ce phénomène
électrophysiologique de PLT est également présent dans les noyaux vestibulaires intacts [40] mais aussi après lésion vestibulaire [41]. On peut postuler que le phénomène de compensation vestibulaire puisse être comparable à un processus de réapprentissage sensorimoteur sollicitant les mêmes mécanismes que ceux utilisés par l’hippocampe. En outre, les noyaux vestibulaires sont étroitement liés à
l’hippo-campe [42]. Au niveau comportemental, le phénotype
posturo-loco-moteur aigu induit par la lésion vestibulaire rappelle les stratégies d’apprentissage et de développement de la marche. Cela suggère que la compensation de la marche et de l’équilibre postural chez l’animal vestibulo-lésé est une forme de réapprentissage sensoriel et moteur.
Neurogenèse vestibulaire réactionnelle adulte
et systèmes sensoriels
Peu d’études ont abordé la question de savoir si la neurogenèse réac-tionnelle adulte se produit dans les systèmes sensoriels à la suite de
dommages des nerfs sensoriels. Vessal et Darian-Smith [43] ont apporté
les premières preuves que la neurogenèse adulte se produit dans les zones corticales somatosensorielles et motrices primaires de réprésen-tation de la main de primates non humains en réponse directe à une lésion de la racine dorsale de la moelle épinière. Fait important, ils ont fourni des preuves que de nouveaux neurones se forment dans le cortex réorganisé mais non lésé, en réponse à une désafférentation cervicale, car de nombreuses synapses et une gliose réactive importante sont observées au niveau du site de la lésion. Ni les conditions environne-mentales qui favorisent la neurogenèse endogène induite par la lésion, ni la pertinence fonctionnelle de ce phénomène dans la récupération subséquente de la fonction de la main n’ont été établies.
La neurogenèse adulte est également impliquée dans les systèmes sen-soriels périphériques, lors de la régénération des photorécepteurs dans l’œil, des cellules sensorielles olfactives et des cellules ciliées vestibu-laires de l’oreille interne (pour revue [44]). Cependant, peu d’études ont rapporté qu’une lésion d’un capteur sensoriel périphérique induit une prolifération cellulaire qui pourrait être liée à une neurogenèse centrale. Les lésions chirurgicales bilatérales de la cochlée, au niveau de l’oreille interne, entraînent une prolifération cellulaire dans le noyau cochléaire
du tronc cérébral chez les rats adultes [45]. Un phénomène plastique
SYNTHÈSE
REVUES
neurogenèse fonctionnelle en cas de lésion trauma-tique. Selon ces résultats, les cellules des tissus vesti-bulaires adultes conservent des capacités importantes de régénération et de prolifération. L’identification des effecteurs moléculaires qui contrôlent ces proprié-tés pourrait être utile pour la médecine régénérative fondée sur le remplacement, par des cellules souches, des cellules ciliées et des neurones de l’oreille interne endommagés ou perdus, ainsi que pour le développe-ment d’implants cochléaires et vestibulaires. En effet, en fonction des avancées actuelles dans ces domaines respectifs [54,55], le prochain défi consistera à intégrer des cellules nouvellement générées ou des dispositifs dans des réseaux neuronaux fonctionnels préexistants.
Conclusion
Cette revue décrit le phénomène de la neurogenèse vestibulaire réactionnelle adulte qui se produit dans les noyaux vestibulaires lors de la perte des signaux provenant des capteurs vestibulaires périphériques. Ce phénomène trouve son origine dans un environnement désafférenté dans lequel différents processus biochi-miques et électrophysiologiques sont profondément remodelés. La concomitance et l’interdépendance de ces différents processus indiquent la présence de mécanismes coordonnés qui contribuent à l’établis-sement d’un nouveau réseau neuronal fonctionnel. La mise en place de ce nouveau réseau permet l’utilisation d’informations sensorielles substitutives pour rem-placer la perte des informations sensorielles d’origine vestibulaire. Bien que ce processus n’ait pas encore été confirmé chez l’homme, il pourrait constituer un mécanisme clé dans le processus de compensation ves-tibulaire. Les connaissances futures liées à notre com-préhension de l’origine et du devenir de la neurogenèse vestibulaire réactionnelle adulte devraient apporter des solutions thérapeutiques pour stimuler ce processus et optimiser le rétablissement de la marche et de l’équi-libre. Une meilleure connaissance des caractéristiques de ce phénomène pourrait, de plus, permettre de mieux comprendre les règles globales qui régissent la
neuro-genèse réactionnelle adulte. ‡
SUMMARY
The adult brain produces new neurons to restore balance after vestibular loss
Following partial or total loss of peripheral vestibular inputs, a phenomenon called central vestibular com-pensation takes place in the hours and days following the injury. This neuroplasticity process involves a mosaic of profound rearrangements within the brain stem
de neuroplasticité impliqués [14]. Dans les deux premiers cas, les
mécanismes qui interviennent dans les noyaux vestibulaires du tronc cérébral comprennent la modulation de la synthèse des neurotrans-metteurs, des neurohormones et/ou des facteurs neurotrophiques. À l’inverse, dans le cas de la NVU, où les entrées périphériques sont com-plètement perdues, les mécanismes de plasticité mentionnés ci-dessus sont accentués et des changements structurels, comme la neuroge-nèse, s’établissent dans les NV. Les durées et mécanismes de récupé-ration dépendent du type de désafférentation vestibulaire. À l’appui de cette hypothèse, il a été rapporté que les patients qui subissent une neurotomie connaissent une correction significative de leurs déficits fonctionnels dans les quelques mois qui suivent l’intervention
chirur-gicale [49]. Nous présumons que cet effet peut s’appuyer sur la NGVR.
Ce type de réparation d’urgence pourrait se produire pour remplacer la perte des neurones vestibulaires secondaires dans le tronc cérébral au
cours du vieillissement [51]. Cette question s’élargit également à la
perte liée à l’âge des neurones vestibulaires primaires et des cellules ciliées [52].
Perspectives
La découverte de l’implication de la neurogenèse vestibulaire réac-tionnelle adulte dans le processus de compensation vestibulaire sou-lève de nombreuses questions. En termes de priorité, des recherches plus approfondies sur les origines et le devenir des neurones nouvelle-ment formés dans les NV sont nécessaires. Des souches de souris chez lesquelles les cellules souches sont spécifiquement marquées pour-raient permettre aux chercheurs de définir les types de précurseurs neuronaux et leur emplacement, ainsi que les caractéristiques de leur intégration (arborisation et contacts synaptiques) dans les réseaux préexistants. Des approches électrophysiologiques sur tranches de tronc cérébral pourraient être développées afin de confirmer les signa-tures électrophysiologiques des différents types de cellules et leurs rôles dans la restauration de l’excitabilité de l’environnement vesti-bulaire désafférenté. La modulation pharmacologique de chacun des types de cellules (astrocytes, microglies et neurones) devrait égale-ment améliorer notre compréhension de leurs contributions respectives au processus global de récupération fonctionnelle.
La confirmation de l’existence d’un tel phénomène chez l’homme est bien sûr un préalable à toute intervention thérapeutique visant à accélérer et à optimiser la compensation vestibulaire pour une récu-pération optimisée et plus rapide de la marche et de l’équilibration. Cependant, les protocoles d’imagerie fonctionnelle permettant de valider la neurogenèse sur modèle animal sont loin d’être disponibles chez l’homme. L’observation d’une fenêtre temporelle critique de plas-ticité post-lésionnelle intense met en évidence une fenêtre thérapeu-tique dans laquelle les interventions médicamenteuses devraient être les plus efficaces pour moduler la plasticité locale et la restauration fonctionnelle qui en résulte. Contrairement au système auditif, le système vestibulaire périphérique adulte endommagé est capable de
générer de nouvelles cellules ciliées, bien qu’en nombre limité [53].
21. Hayashi Y, Jinnou H, Sawamoto K, et al. Adult neurogenesis and its role in brain injury and psychiatric diseases. J Neurochem 2018 ; 147 : 584-94
22. Kuhn HG, Eisch AJ, Spalding K, et al. Detection and phenotypic characterization of adult neurogenesis. Cold Spring Harb Perspect Biol 2016 ; 8 : a025981.
23. MacKinnon CD. Sensorimotor anatomy of gait, balance, and falls. Handb Clin Neurol 2018 : 159 : 3-26.
24. Ris L, Waele C de, Serafin M, et al. Neuronal activity in the ipsilateral vestibular nucleus following unilateral labyrinthectomy in the alert guinea pig. J Neurophysiol 1995 ; 74 : 2087-99.
25. Zennou-Azogui Y, Borel L, Lacour M, et al. Recovery of head postural control following unilateral vestibular neurectomy in the cat: neck muscle activity and neuronal correlates in Deiters’ nuclei. Acta OtoLaryngol 1993 ; 113 (suppl) : 5-19.
26. Curthoys IS. Vestibular compensation and substitution. Curr Opin Neurol 2000 ; 13 : 27.
27. Boulenguez P, Liabeuf S, Bos R, et al. Down-regulation of the potassium-chloride cotransporter KCC2 contributes to spasticity after spinal cord injury. Nat Med 2010 ; 16 : 302-7.
28. Dutheil S, Escoffier G, Gharbi A, et al. GABAA receptor agonist and antagonist alter vestibular compensation and different steps of reactive neurogenesis in deafferented vestibular nuclei of adult cats. J Neurosci 2013 ; 33 : 15555-66.
29. Rocha SM, Saraiva T, Cristóvão AC, et al. Histamine induces microglia activation and dopaminergic neuronal toxicity via H1 receptor activation. J Neuroinflammation 2016 ; 13 : 137.
30. Tighilet B, Trottier S, Mourre C, et al. Changes in the histaminergic system during vestibular compensation in the cat: Histamine and vestibular compensation. J Physiol 2006 ; 573 : 723-39.
31. Guilloux J-P, Samuels BA, Mendez-David I, et al. S 38093, a histamine H3 antagonist/inverse agonist, promotes hippocampal neurogenesis and improves context discrimination task in aged mice. Sci Rep 2017 ; 7 : 42946.
32. Eiriz MF, Valero J, Malva JO, et al. New insights into the role of histamine in subventricular zone-olfactory bulb neurogenesis. Front Neurosci 2014 ; 8 : 142.
33. Whitney NP, Eidem TM, Peng H, et al. Inflammation mediates varying effects in neurogenesis: relevance to the pathogenesis of brain injury and neurodegenerative disorders. J Neurochem 2009 ; 108 : 1343-59.
34. Bellot-Saez A, Kékesi O, Morley JW, et al. Astrocytic modulation of neuronal excitability through K+ spatial buffering. Neurosci Biobehav Rev 2017 ; 77 : 87-97.
35. Ferrini F, De Koninck Y. Microglia control neuronal network excitability via BDNF signalling. Neural Plast 2013 ; 2013 : 1-11.
36. Falk S, Götz M. Glial control of neurogenesis. Curr Opin Neurobiol 2017 ; 47 : 188-95.
37. Káradóttir RT, Kuo CT. Neuronal activity-dependent control of postnatal neurogenesis and gliogenesis. Annu Rev Neurosci 2018 ; 41 : 139-61.
38. Lacour M, Roll JP, Appaix M. Modifications and development of spinal reflexes in the alert baboon (Papio papio) following an unilateral vestibular neurotomy. Brain Res 1976 ; 113 : 255-69.
39. Whitlock JR, Heynen AJ, Shuler MG, et al. Learning induces long-term potentiation in the hippocampus. Science 2006 ; 313 : 1093-7.
40. Racine RJ, Wilson DA, Gingell R, et al. Long-term potentiation in the interpositus and vestibular nuclei in the rat. Exp Brain Res 1986 ; 63 : 158-62.
41. Pettorossi VE, Dutia M, Frondaroli A, et al. Long-term potentiation and depression after unilateral labyrinthectomy in the medial vestibular nucleus of rats. Acta Otolaryngol 2003 ; 123 : 182-6.
42. Smith PF. Vestibular-hippocampal interactions. Hippocampus 1997 ; 7 : 465-71.
43. Vessal M, Darian-Smith C. Adult neurogenesis occurs in primate sensorimotor cortex following cervical dorsal rhizotomy. J Neurosci 2010 ; 30 : 8613-23.
44. Farbman AI. Injury-stimulated neurogenesis in sensory systems. Adv Neurol 1997 ; 72 : 157-61.
45. Zheng Y, Begum S, Zhang C, et al. Increased BrdU incorporation reflecting DNA repair, neuronal de-differentiation or possible neurogenesis in the adult cochlear nucleus following bilateral cochlear lesions in the rat. Exp Brain Res 2011 ; 210 : 477-87.
46. Zheng Y, Smithies H, Aitken P, et al. Cell proliferation in the cochlear nucleus following acoustic trauma in rat. Neuroscience 2015 ; 303 : 524-34.
47. Tighilet B, Dutheil S, Siponen MI, et al. Reactive neurogenesis and down-regulation of the potassium-chloride cotransporter KCC2 in the cochlear nuclei after cochlear deafferentation. Front Pharmacol 2016 ; 7 : 281. vestibular nuclei. Among them, the setting of a new neuronal network
is maybe the most original and unexpected, as it involves an adult reactive neurogenesis in a brain area not reported as neurogenic so far. Both the survival and functionality of this newly generated neuronal network will depend on its integration to pre-existing networks in the deafferented structure. Far from being aberrant, this new structural organization allows the use of inputs from other sensory modalities (vision and proprioception) to promote the restoration of the posture and equilibrium. We choose here to detail this model, which does not belong to the traditional niches of adult neurogenesis, but it is the best example so far of the reparative role of the adult neurogenesis. Not only it represents an original neuroplasticity mechanism, interesting for basic neuroscience, but it also opens new medical perspectives for the development of therapeutic approaches to alleviate vestibular disorders. ‡
LIENS D’INTÉRÊT
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
RÉFÉRENCES
1. Angelaki DE, Cullen KE. Vestibular system: the many facets of a multimodal sense. Annu Rev Neurosci 2008 ; 31 : 125-50.
2. Lopez C. The vestibular system: balancing more than just the body. Curr Opin Neurol 2016 ; 29 : 74-83.
3. Brichta AM, Goldberg JM. Responses to efferent activation and excitatory response-intensity relations of turtle posterior-crista afferents. J Neurophysiol 2000 ; 83 : 1224-42.
4. Balaban CD. Vestibular autonomic regulation (including motion sickness and the mechanism of vomiting). Curr Opin Neurol 1999 ; 12 : 29-33.
5. Lacour M, Tighilet B. Plastic events in the vestibular nuclei during vestibular compensation: the brain orchestration of a deafferentation code. Restor Neurol Neurosci 2010 ; 28 : 19-35.
6. Strupp M, Arbusow V. Acute vestibulopathy. Curr Opin Neurol 2001 ; 14 : 11-20.
7. Lacour M, Helmchen C, Vidal PP. Vestibular compensation: the neuro-otologist’s best friend. J Neurol 2016 ; 263 : 54-64.
8. Darlington CL, Smith PF. Molecular mechanisms of recovery from vestibular damage in mammals: recent advances. Prog Neurobiol 2000 ; 62 : 313-25.
9. Smith PF, Curthoys IS. Mechanisms of recovery following unilateral labyrinthectomy: a review. Brain Res Rev 1989 ; 14 : 155-80.
10. Tighilet B, Chabbert C. Adult neurogenesis promotes balance recovery after vestibular loss. Prog Neurobiol 2019 ; 174 : 28-35.
11. Dutheil S, Watabe I, Sadlaoud K, et al. BDNF signaling promotes vestibular compensation by increasing neurogenesis and remodeling the expression of potassium-chloride cotransporter KCC2 and GABAA receptor in the vestibular nuclei. J Neurosci 2016 ; 36 : 6199-212.
12. Tighilet B, Leonard J, Mourre C, et al. Apamin treatment accelerates equilibrium recovery and gaze stabilization in unilateral vestibular neurectomized cats: cellular and behavioral aspects. Neuropharmacology 2019 ; 144 : 133-42.
13. Liberge M, Manrique C, Bernard-Demanze L, et al. Changes in TNFα, NFκB and MnSOD protein in the vestibular nuclei after unilateral vestibular deafferentation. J Neuroinflammation 2010 ; 7 : 91.
14. Dutheil S, Lacour M, Tighilet B. Neurogenic potential of the vestibular nuclei and behavioural recovery time course in the adult cat are governed by the nature of the vestibular damage. PLoS One 2011 ; 6 : e22262.
15. Tighilet B, Manrique C, Lacour M. Stress axis plasticity during vestibular compensation in the adult cat. Neuroscience 2009 ; 160 : 716-30.
16. Li H, Dokas LA, Godfrey DA, et al. Remodeling of synaptic connections in the deafferented vestibular nuclear complex. J Vestib Res 2002 ; 12 : 167-83.
17. Raymond J, Ez-Zaher L, Demêmes D, et al. Quantification of synaptic density changes in the medial vestibular nucleus of the cat following vestibular neurectomy. Restor Neurol Neurosci 1991 ; 3 : 197-203.
18. Tighilet B, Brezun JM, Dit Duflo Sylvie G, et al. New neurons in the vestibular nuclei complex after unilateral vestibular neurectomy in the adult cat. Eur J Neurosci 2007 ; 25 : 47-58.
19. Dutheil S, Brezun JM, Leonard J, et al. Neurogenesis and astrogenesis contribution to recovery of vestibular functions in the adult cat following unilateral vestibular neurectomy: cellular and behavioral evidence. Neuroscience 2009 ; 164 : 1444-56.
SYNTHÈSE
REVUES
53. Burns JC, Stone JS. Development and regeneration of vestibular hair cells in mammals. Semin Cell Dev Biol 2017 ; 65 : 96-105.
54. Czajkowski A, Mounier A, Delacroix L, et al. Pluripotent stem cell-derived cochlear cells: a challenge in constant progress. Cell Mol Life Sci 2019 ; 76 : 627-35.
55. Lenarz T. Cochlear implant: state of the art. GMS Curr Top Otorhinolaryngol Head Neck Surg 2017 ; 19 : Doc04.
RÉFÉRENCES
48. Silverstein H, Lewis WB, Jackson LE, et al. Changing trends in the surgical treatment of Ménière’s disease: results of a 10-year survey. Ear Nose Throat J 2003 ; 82 : 185-7, 191-4.
49. Pareschi R, Destito D, Falco Raucci A, et al. Posterior fossa vestibular neurotomy as primary surgical treatment of Menière’s disease: a re-evaluation. J Laryngol Otol 2002 ; 116 : 593-6.
50. Diaz RC, LaRouere MJ, Bojrab DI, et al. Quality-of-life assessment of Ménière’s disease patients after surgical labyrinthectomy. Otol Neurotol 2007 ; 28 : 74-86.
51. Zalewski CK. Aging of the human vestibular system. Semin Hear 2015 ; 36 : 175-96.
52. Rosenhall U. Degenerative patterns in the aging human vestibular neuro-epithelia. Acta Otolaryngol 1973 ; 76 : 208-20. TIRÉS À PART B. Tighilet m/s n° 4, vol. 36, avril 2020 357
SYNTHÈSE
REVUES
45. Wallentin L, Becker RC, Budaj A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009 ; 361 : 1045-57.
46. Cada DJ, Baker DE, Ingram KT. Cangrelor. Hosp Pharm 2015 ; 50 : 922-9.
47. Kim HH, Sawada N, Soydan G, et al. Additive effects of statin and dipyridamole on cerebral blood flow and stroke protection. J Cereb Blood Flow Metab 2008 ; 28 : 1285-93.
48. DiNicolantonio JJ, Lavie CJ, Fares H, et al. Meta-analysis of cilostazol versus aspirin for the secondary prevention of stroke. Am J Cardiol 2013 ; 112 : 1230-4.
49. Gessler T, Ghofrani HA, Held M, et al. The safety and pharmacokinetics of rapid iloprost aerosol delivery via the BREELIB nebulizer in pulmonary arterial hypertension. Pulm Circ 2017 ; 7 : 505-13.
50. De Luca G, Navarese E, Marino P. Risk profile and benefits from Gp IIb-IIIa inhibitors among patients with ST-segment elevation myocardial infarction treated with primary angioplasty: a meta-regression analysis of randomized trials. Eur Heart J 2009 ; 30 : 2705-13.
RÉFÉRENCES
38. Münzer P, Walker-Allgaier B, Geue S, et al. PDK1 determines collagen-dependent platelet Ca2+ signaling and is critical to development of ischemic stroke in vivo. Arterioscle Thromb Vasc Biol 2016 ; 36 : 1507-16.
39. Wadanoli M, Sako D, Shaw GD, et al. The von Willebrand factor antagonist (GPG-290) prevents coronary thrombosis without prolongation of bleeding time. Thromb Haemost 2007 ; 98 : 397-405.
40. Jilma-Stohlawetz P, Knöbl P, Gilbert JC, et al. The anti-von Willebrand factor aptamer ARC1779 increases von Willebrand factor levels and platelet counts in patients with type 2B von Willebrand disease. Thromb Haemost 2012 ; 108 : 284-90.
41. Sathish J, Falati S, Croce K, et al. Antibody cross-linking of human platelet P-selectin induces calcium entry by a mechanism dependent upon Fcγ receptor IIA. Thromb Haemost 2004 ; 92 : 598-605.
42. Tanasescu S, Lkvesque H, Thuillez’C. Pharmacology of aspirine. Rev Med Interne 2000 ; 21 (suppl 1) : s18-26.
43. Bennett CL, Connors JM, Carwile JM, et al. Thrombotic thrombocytopenic purpura associated with clopidogrel. N Engl J Med 2000 ; 342 : 1773-7.
44. Schnapf A. Prasugrel versus clopidogrel: new management strategies for acute coronary syndrome. J Cardiovasc Nurs 2013 ; 28 : 483-94.
TIRÉS À PART
Y. Zaid
190260_Khalki_Synthese.indd 357 20/04/2020 13:57:50
sexuality is confirmed, no major locus is found and the genetic influence appears extremely polygenic. Thus, there is no single gene, or even small set of genes, that have a strong influence on homosexuality.‡
LIENS D’INTÉ RÊ T
L’auteur dé clare n’avoir aucun lien d’inté rê t concernant les donné es publié es dans cet article.
RÉFÉRENCES
1. Risch N, Botstein D. A manic depressive history. Nat Genet 1996 ; 12 : 351-3.
2. Moldin SO. The maddening hunt for madness genes. Nat Genet 1997 ; 17 : 127-9.
3. Hamer DH1, Hu S, Magnuson VL, Hu N, Pattatucci AM. A linkage between DNA markers on the X chromosome and male sexual orientation. Science 1993 ; 261 : 321-7.
4. Pool R. Evidence for homosexuality gene. Science 1993 ; 261 : 291-2.
5. Rice G1, Anderson C, Risch N, Ebers G. Male homosexuality: absence of linkage to microsatellite markers at Xq28. Science 1999 ; 284 : 665-7.
6. Ganna, Verweij, Nivard MG, et al. Large-scale GWAS reveals insights into the genetic architecture of same-sex sexual behavior. Science 2019 ; 365. pii: eaat7693.
7. Pillard RC1, Bailey JM. Human sexual orientation has a heritable component. Hum Biol 1998 ; 70 : 347-65.
8. Kaiser J. Screening embryos for complex genetic traits called premature. Science 2019 ; 366 : 405-6.
avec une héritabilité de l’ordre de 30 %9– mais que cette influence
génétique résulte des variations de très nombreux gènes, probable-ment des milliers. Même une étude de grande puissance statistique comme celle qui est rapportée ici ne parvient à suggérer que cinq locus significatifs, dont l’influence combinée est très faible. Il n’y a donc pas de « gène de l’homosexualité », ni même de variant indivi-duel influant notablement sur ce caractère, contrairement au cas de la maladie de Crohn ou du diabète de type I. La manière dont cette influence génétique est modulée par la culture et l’environnement est
visible entre autres sur la Figure 1: la forte augmentation de la
pro-portion de personnes se déclarant homosexuelles n’est évidemment pas due à des différences génétiques entre celles qui sont nées en 1940 et celles de 1970. Vingt-cinq ans après l’article de Dean Hamer
[3], on ne devrait plus entendre parler du « gène de
l’homosexua-lité ».‡
SUMMARY
End of the road for the « homosexuality gene »
Evidence for a “homosexuality gene” was claimed in the early 1990’s on the basis of linkage studies that, by current criteria, were woefully underpowered. Indeed, follow up studies gave contradictory results. Genome-wide association studies, and very large databases with detailed genetic and phenotypic data, have made possible a re-exa-mination of this issue. While modest heritability (ca. 0.3) for homo-9 À titre de comparaison, l’héritabilité de la taille à l’âge adulte est de 90 %.
TIRÉS À PART
B. Jordan
Avec m/s, vivez en direct
les progrès et débats
de la biologie et de la médecine
CHAQUE MOIS / AVEC LES ARTICLES DE RÉFÉRENCE DE M/S CHAQUE JOUR / SUR WWW.MEDECINESCIENCES.ORG
Abonnez-vous sur
www.medecinesciences.org
médecine/sciences
Retrouvez toutes les Actualités de la Myologie sur les sites de :
la Société Française de Myologie
www.sfmyologie.org
la filière de santé neuromusculaire FILNEMUS
www.filnemus.fr