La physiologie des cellules souches dans le cerveau adulte.
Thèse
Archana Gengatharan
Doctorat en neurobiologie Philosophiæ doctor (Ph. D.)
Québec, Canada
La physiologie des cellules souches dans le cerveau adulte.
Thèse
Archana GENGATHARAN
Sous la direction de :
Armen SAGHATELYAN, directeur de recherche
R
ÉSUMÉLes cellules souches neurales (CSNs) persistent dans la zone sous ventriculaire dans le cerveau adulte.
Elles transitent d’un état quiescent à un état prolifératif afin de produire de nouveaux neurones. Les mécanismes régulant cette transition restent cependant méconnus. Les CSNs adultes étant enrichies en gènes calciques, nous avons déterminé si la transition d’un état quiescent vers un état de prolifé- ration était calcium-dépendant. Pour ce faire, nous avons utilisé des mini-endoscopes miniatures pour observer la division cellulaire et sa régulation par la signalisation calcique chez la souris en mouve- ment libre. Nos données révèlent différents dynamiques calciques et niveaux intracellulaires cal- ciques lors de la division des CSNs. Les expériences pharmacologiques et la technique d’édition gé- nomique CRISPR-Cas9 montrent que les réserves intracellulaires calciques IP3-dépendant et les ré- gulateurs à la protéine G régulent la transition d’un état quiescent vers l’état prolifératif. Nous avons aussi utilisé une approche optogénétique in vivo afin de mimer la dynamique calcique des CSNs quiescentes pour maintenir les CSNs dans un état de quiescence et bloquer son activation vers un stade prolifératif. Nos résultats démontrent que les dynamiques calciques et le niveau intracellulaire calcique jouent un rôle important dans l’activation des CSNs. Ensuite, nous avons investigué le mi- croenvironnement des CSNs notamment les vaisseaux sanguins et leur rôle dans la physiologie des CSNs. Les CSNs étendent un long prolongement basal et contactent les vaisseaux sanguins. Le con- tact direct et la libération de facteurs par les cellules endothéliales influencent le comportement des CSNs. Ici, nous avons utilisé des souris transgéniques pour altérer la communication entre les vais- seaux sanguins et les CSNs. Comme la signalisation Notch joue un rôle clé dans la signalisation des vaisseaux sanguins, nous avons inhibé in vivo la signalisation Notch spécifiquement dans les cellules endothéliales. Nous avons trouvé que l’inhibition de la signalisation Notch dans les cellules endothé- liales à des stades précoces (P0) ou à des stades tardifs (P30) augmentait le nombre de CSNs. L’ana- lyse morphologique des vaisseaux sanguins révèle aucune altération quand Notch est inhibé à des stades tardifs (P30). Ces résultats montrent que l’inhibition de la signalisation Notch maintient les CSNs dans un état de quiescence.
A
BSTRACTNeural stem cells (NSCs) persist in the subventricular zone of adult brain and transit from the quies- cent to the proliferative states to produce new neurons. The mechanisms regulating the transition from a quiescent to a proliferative state remain unclear. Since adult NSCs are enriched in genes associated with Ca2+ signalling pathways, we aimed to determine whether the transition from quiescence to a proliferative state is Ca2+ dependent. Here, we used miniature endoscopes (mini-endoscopes) to mon- itor NSC division and their regulation by Ca2+ signalling in freely behaving mice. Our data revealed different Ca2+ dynamics and steady-state Ca2+ intracellular levels during NSC division. Pharmacolog- ical and in vivo CRISPR-Cas9 gene editing showed that IP3-sensitive intracellular stores and G-pro- teins regulators regulate the transition from quiescence to proliferation. We further used in vivo opto- genetics to mimic Ca2+ dynamics of quiescence state to maintain NSCs in this state and prevent NSCs to transit into proliferative state. Our results demonstrate that Ca2+ dynamics and Ca2+ intracellular levels play an important role in NSC activation. Next, we investigated NSCs microenvironment mainly blood vessel and their role in their physiology. The NSCs contact the blood vessels by extend- ing their basal processes. Direct cell-cell contact and the release of factors such as VEGF (vascular endothelial growth factor) by endothelial cells (EC) influence the NSC behaviour. As Notch pathway is a key player in vasculature signalling, we inhibit in vivo the Notch signalling specifically in EC.
We found that inhibition of Notch signalling in EC at early stage (P0) or later stage (P30) increases NSC number. Morphological analysis of blood vessel reveals no alteration when Notch signalling is inhibited at later stages (P30). These finding showed that inhibition of Notch signalling in EC main- tains NSC in quiescence state.
T
ABLE DES MATIÈRESRÉSUMÉ ... ii
ABSTRACT... iii
TABLE DES MATIÈRES ... iv
LISTE DES FIGURES ... viii
LISTE DES TABLEAUX ... ix
LISTE DES ABRÉVIATIONS ... x
REMERCIEMENTS ... v
AVANT-PROPOS ... vi
INTRODUCTION... 1
1.LES CELLULES SOUCHES ADULTES NEURALES ... 1
1.1 Découverte des cellules souches neurales adultes ... 1
1.2 Origine des cellules souches neurales adultes ... 5
a) Les cellules souches embryonnaires à la glie radiaire ... 5
1.3 Identité et Propriété des cellules souches adultes neurales ... 6
a) Identification des cellules souches neurales adultes quiescentes et actives ... 6
b) Mode de division symétrique versus asymétrique ... 7
c) Lineage et régionalisation ... 8
1.4 Plasticité des cellules souches neurales adultes... 10
a) Régénération ... 10
b) Les blessures aiguës ... 11
c) Les maladies neurodégénératives ... 12
d) Vieillissement ... 13
1.5 Rôle des cellules souches neurales adultes ... 14
a) Bulbe olfactif ... 14
b) L’hippocampe ... 15
1.6 Les cellules souches humaines ... 16
2. MÉCANISMES RÉGULANT LA TRANSITION DU STADE QUIESCENTE VERS LE STADE PROLIFÉRATIF DES CELLULES SOUCHES NEURALES ADULTES. ... 17
2.1 Facteurs intrinsèques ... 18
a) morphogènes ... 18
b) Les facteurs de croissance, les facteurs neurotrophiques et les cytokines. ... 22
c) L’état métabolique ... 25
2.2 Facteurs de transcription ... 27
2.3 Neurotransmetteurs ... 28
2.4 Facteurs épigénétiques ... 29
2.5 Facteurs de la niche ... 31
a) Les vaisseaux sanguins ... 31
3. LA SIGNALISATION CALCIQUE ET LES CELLULES SOUCHES. ... 34
3.1 Calcium, second messager central ... 34
a) Acteurs de l’encodage du signal calcique ... 35
b) Acteurs du décodage du signal calcique ... 39
3.2 La signalisation calcique dans le développement neuronale. ... 40
a) Induction neuronale ... 40
b) La différenciation des progéniteurs neuronaux en neurones ... 42
3.3 Le rôle du calcium dans la physiologie des cellules souches somatiques ... 42
a) les cellules souches neurales ... 42
b) Les cellules souches intestinales ... 43
c) Les cellules souches des muscles striés squelettiques ... 43
d) Les cellules souches de la peau ... 44
e) Les cellules souches hématopoïétiques ... 44
4. LA SIGNALISATION NOTCH ... 45
4.1 La signalisation Notch ... 45
a) La structure du récepteur Notch ... 45
b) Cascade de la signalisation Notch ... 46
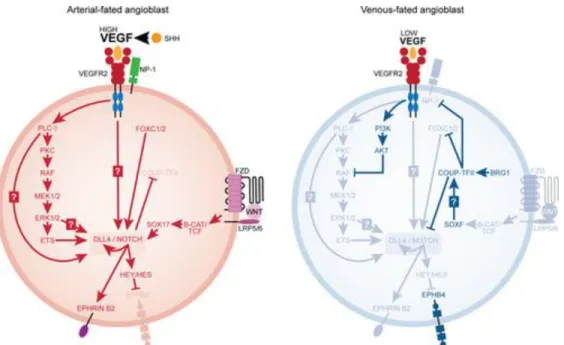
4.2 Les vaisseaux sanguins et la signalisation Notch ... 47
a) Notch et la spécification artères/veines ... 47
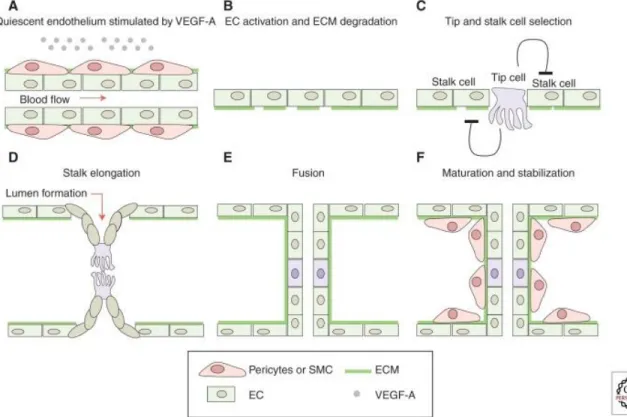
b) L’angiogenèse et la signalisation Notch... 48
c) Les cellules murales et la signalisation Notch ... 50
4.3 La signalisation Notch et les cellules souches ... 51
a) Développement embryonnaire et la signalisation Notch... 51
b) Les cellules souches et la signalisation Notch ... 52
5. HYPOTHESES ET OBJECTIFS ... 53
CHAPITRE 1: IMAGING NEURAL STEM CELL DIVISION IN FREELY BEHAVING MICE REVEALS THEIR REGULATION BY INTRACELLULAR CA2+ DYNAMICS. ... 55
1.1RÉSUMÉ ... 56
1.2ABSTRACT ... 57
1.3INTRODUCTION ... 58
1.4RESULTS ... 59
1.5DISCUSSION ... 62
1.6MATERIAL AND METHODS ... 63
a) Animals ... 63
b) Electroporation... 63
c) Gradient index (GRIN) lens implantation and in vivo imaging in freely behaving mice ... 64
d) In vivo optogenetic stimulation ... 65
e) BrdU label-retaining protocol ... 65
f) CRISPR target site selection and assembly ... 65
g) Immunostaining ... 67
h) Time-lapse Ca2+ imaging in acute brain slices ... 67
i) Ca2+ imaging analysis ... 68
j) Post hoc identification of imaged cells. ... 69
k) RNAscope in situ hybridization. ... 69
l) FACS and RT-qPCR analysis ... 69
m) Statistical analysis ... 70
1.7REFERENCES ... 71
1.8FIGURES ... 73
1.9SUPPLEMENTARY FIGURES ... 77
1.10TABLE ... 83
1.11SUPPLEMENTARY MOVIE LEGENDS ... 86
1.12 ACKNOWLEDGEMENTS ... 87
CHAPITRE 2:NOTCH SIGNALLING IN BLOOD VESSELS AFFECTS THE PHYSIOLOGY OF NSC. ... 88
2.1 RÉSUMÉ ... 88
2.2 ABSTRACT ... 89
2.3 INTRODUCTION ... 90
2.4 RESULTS ... 93
a) Impairment of Notch signaling in ECs. ... 93
b) Integrity of blood vessel is preserved when Notch signaling in ECs is altered at P30. ... 93
c) Inhibition of Notch signaling in ECs at P30 alters NSC proliferation. ... 94
d) Inhibition of Notch signaling in ECs at P0 alters NSC proliferation. ... 94
2.5 DISCUSSION ... 96
2.6 MATERIAL AND METHODS... 98
a) Animals ... 98
b) Notch inhibition in blood vessel ... 98
c) BrdU labeling ... 98
d) Whole mount preparation ... 98
e) Immunohistochemistry ... 98
f) BrdU immunohistochemistry ... 99
g) Image analysis ... 99
h) Statistics Analysis... 99
2.7 REFERENCES ... 100
2.8 FIGURES ... 103
DISCUSSION ET PERSPECTIVES ... 109
1. STIMULI PHYSIOLOGIQUES ET DIVISION CELLULAIRE... 109
2. REGENERATION ... 111
3. ISCHÉMIE ... 112
4.LES CELLULES EPENDYMALES... 113
5. CONCLUSION GENERALE ... 115
CONCLUSION ... 117
RÉFERENCES ... 118
ANNEX :THE ROLE OF ASTROCYTES IN THE GENERATION,MIGRATION, AND INTEGRATION OF NEW NEURONS IN THE ADULT OLFACTORY BULB ... 148
1.ABSTRACT ... 149
2.INTRODUCTION ... 150
3.NEUROGENIC AND NON-NEUROGENIC ASTROCYTES IN THE ADULT SVZ ... 150
4.ASTROCYTES IN THE ROSTRAL MIGRATORY STREAM ... 154
5.ASTROCYTES IN THE OB ... 155
6.CONCLUSION ... 156
7.FIGURES ... 156
8.REFERENCES ... 156
L
ISTE DES FIGURESFigure 1.1: Développement embryonnaire et neurogenèse. ... 2
Figure 1.2: La neurogenèse adulte dans l’hippocampe. ... 4
Figure 1.3 : La neurogenèse adulte dans le bulbe olfactif (BO). ... 5
Figure 1.4 : Régionalisation des cellules souches neurales adultes. ... 10
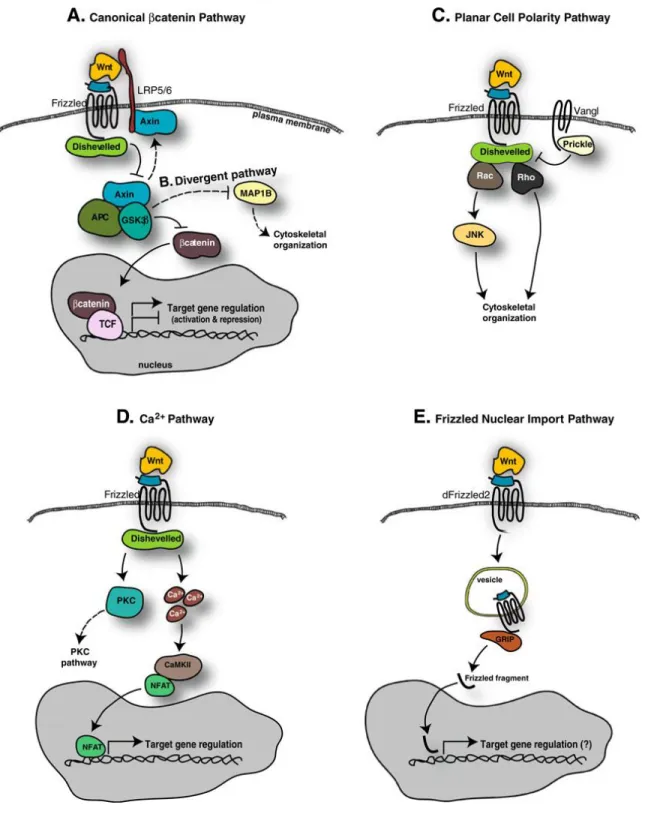
Figure 1.5 : Les différentes voies de signalisation de Wnt. ... 19
Figure 1.6 : Schéma représentatif de la niche neurogénique de la ZSV. ... 31
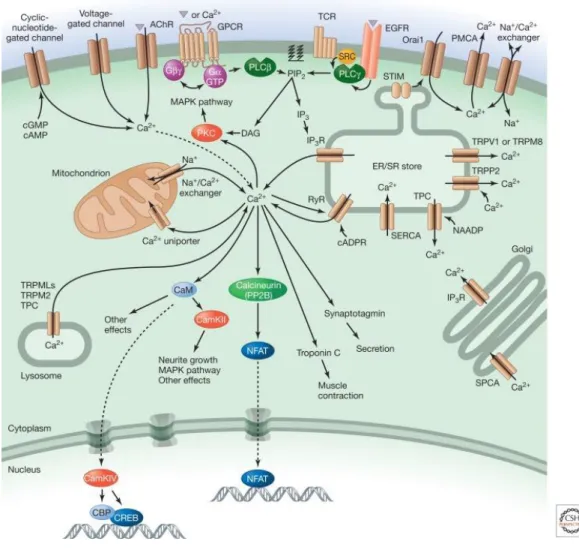
Figure 1.7 : Les principales voies de signalisation calciques. ... 35
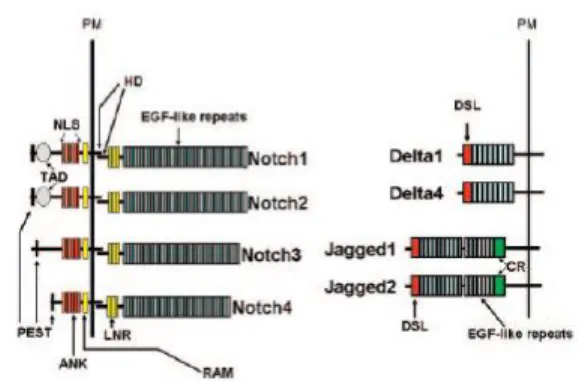
Figure 1.8 : Structure du récepteur Notch et des ligands de Notch chez le mammifère. ... 46
Figure 1.9 : La signalisation Notch. ... 47
Figure 1.10 : Différentiation artère ̸ veine... 48
Figure 1.11 : Schéma représentatif de l’angiogenèse. ... 49
Figure 2.1: Imaging NSCs division in freely behaving mice. ... 73
Figure 2.2: qNSCs and aNSCs display different Ca2+ dynamics. ... 74
Figure 2.3: Ca2+ dynamics in NSCs depends on IP3-sensitive intracellular stores. ... 75
Figure 2.4: In vivo optogenetic restoration of Ca2+ dynamics in NSCs reverses their transition to the proliferative state. ... 76
Supplementary 2.1 : Placement of different types of GRIN lenses used for the in vivo imaging and proliferation analyses of NSCs. ... 77
Supplementary 2.2 : NSC division in freely behaving mice. ... 78
Supplementary 2.3: Ca2+ activity in SVZ niche astrocytes... 79
Supplementary 2.4: Ca2+ activity in qNSCs and aNSCs measured using the Rhod2-AM organic Ca2+ indicator. ... 80
Supplementary 2.5 : Validation of gRNA efficiency. ... 81
Supplementary 2.6: A reduction in Itpr2 and Gpr17 expression in NSCs affects their proliferation at P10. ... 82
Figure 3.1: Impairment of Notch signaling in VE-cadherin-tTA (VEtTA)-tetracycline operator site (TetOS)-dominant negative Master-mind-like1 (dnMAML) mice. ... 103
Figure 3.2: Morphology analysis of blood vessel is not affected when Notch signaling is impaired in blood vessel at adulthood (P30 induction). ... 104
Figure 3.3: Induction P30. ... 105
Figure 3.4: Induction P0. ... 107
Figure 4.1 : Corrélation entre le comportement de la souris avec la division cellulaire. ... 111
Figure 4.2 : Activité calcique des cellules souches neurales en contact avec le vaisseau sanguin. . 112
Figure 4.3: La niche ependymale ... 115
L
ISTE DES TABLEAUXTable 1: Quantification of Ca2+ dynamics in NSCs and their proliferation under different
conditions. ... 85
L
ISTE DES ABRÉVIATIONSADN acide désoxyribonucléique aNSC active neural stem cell
AraC cytosine-β-D-arabiofuranoside Ars2 arsenite-resistance protein Ascl1 achaete-scute homolog 1 Ank-3 ankyrin 3
AMPK AMP-activated serine-threonine protein kinase mTOR (mamalian target of ra- pamycin)
BDNF brain derived neurotrophic factor BrdU bromodeoxyribonucleide
BLBP brain lipid binding protein BMP bone morphogenetic protein
BO bulbe olfactif
14C carbone 14
Ca2+ calcium
CASADIL cerebral autosomal dominant arteriopathy with subcortical infarcts and leu- koencephalopathy
CD133 prominin
Cdkn1a cyclin dependent kinase inhibitor 1A CMR Courant rostrale migratoire
CNTF cilary neurotrophic factor
CRAC calcium release activated calcium CRTC CREB-regulated transcriptional factor
CS cellule souche
CSL mammalian CBF1, Drosophila Su(H), and Caenorhabditis elegans LAG-1 CSN cellule souche neurale
CX3CL1 fractalkine
CXCR4 chemokine receptor 4
DBI diazepam binding inhibitor protein DISC1 disrupted in schizophrenia 1 DKK1 dickkopft-related protein 1 DNMT3a DNA méthyltransférase 3a
Dlx 2 distal-less
DSL Delta/Serrate/LAG-2 EC endothelial cell
EGF epithermal growth factor
EGFL7 epithermal growth factor like protein 7 Emx1 empty spiracles homeobox 2
ETC electron transfert chain FASN fatty acid synthase FGF fibroblast growth factor FGF-2 fibroblast growth factor-2
FRET fluorescence resonance energy transfer GABA γ-aminobutyric acid
GFAP glial fibrillary acidic protein GLAST glutamate transporter
HB-EGF heparin – binding EGF like growth factor HDAC histones désacétylase
Hes hairy ̸ Enhancer of Split Hey hes-related proteins HIF hypoxia -inducible factor Hopx homedomain only protein Id inhibitor of DNA binding IGF-1 insulin-like growth factor-1
IPC progéniteurs cellulaire intermédiaire IP3Rs Inositol1,4,5-triphosphate
IZ intermediate zone
LCR liquide cephalo rachidien LIF leukemia inhibitor factor
LRP2 low density lipoprotein related protein 2 MAM mitochondrial associated ER membranes MeCP2 methyl-CpG-binding protein 2
mHCX H+ ̸ Ca2+
Mll1 mixed lineage leukeurnia-1 mNCX échangeurs Na+ ̸ Ca2+
mPTP pores de transitions de perméabilité mitochondriale
MyoD myoblast determination protein MZ marginale zone
NCX l’échangeur Na+ ̸ Ca2+
NFAT nuclear factor of activated T cell NF-κB nuclear factor -kappa B
Nnat neuronatin
NO nitric oxide
NOS nitric oxide synthase
NSL nuclear localization sequences NSC neural stem cell
NT-3 Neurotrophin-3
OXPHOS phosphorylation oxydative mitochondriale PCNA proliferating cell nuclear antigen
PEDF pigment epithelium-derived factor
PFKFB3 regulator 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 3 PDGF platelet-derived growth factor
PIGF-2 placenta growth factor 2 PKC protein kinace C
PLCγ-1 phospholipase C γ-1
PMCA pompe Ca2+-ATP dépendante PRC1 polycomb repressive complexe 2 Prx1 paired related homeobox protein 1 POMC propiomelanocortin
qNSC quiescent neural stem cell ROS reactive oxygen species
RA retinoic acid
RyR récepteurs à la ryodine S100B Ca 2+ binding protein
SERCA sarco̸ endoplasmique réticulum Ca2+
SDF1 stromal derived factor
Sfrp3 secreted frizzled related protein 3
Shh sonic hedgehog
SLA sclerose laterale amyotrophique
Smo2 smoothened 2
STIM stromal interaction molecule Sox sry-related box
SVZ subventricular zone
TAD transcriptional activation domain
TCF̸ LEF T-cell factor̸ lymphoid enhancer- binding factor TGF-α transforming growth factor
TLX orphan receptor tailless TH tyrosine hydroxylase Trb2 T box transcriptiom factor TRP transient receptor potentiel VCAM1 vascular cell adhesion molecule 1 VEGF vascular endothelial growth factor VGC voltage gated Ca2+
VSMC vascular smooth muscle cell
VZ ventricular zone
Wnt wingless-related integration site ZSG zone subgranulaire
ZSV zone sous ventriculaire
A ma famille
R
EMERCIEMENTSJe remercie tout d’abord mon directeur de recherche, le Dr Armen Saghatelyan de m’avoir donné l’opportunité de faire mon doctorat et d’avoir travaillé sur un projet ambitieux. Durant ces huits années de thèse, il a été toujours disponible pour m’aider à améliorer mes compé- tences scientifiques et a su développer en moi ma persévérance et ma ténacité.
Je remercie également mon comité le Dr Martin Levesque, la Dre Lisa Topolnik et le Dr Igor Timofeev d’avoir suivi l’avancement de mon projet. Je remercie aussi le Dr Ayman ElAli et le Dr Antoine de Chevigny d’avoir accepté d’être mes examinateurs.
Je remercie la Dre Marina Snapyan pour son aide précieuse dans la réalisation des projets.
Je remercie également mes collègues Sarah, Cédric, Delphine qui sont devenus comme une seconde famille. Je les remercie d’avoir été là et m’aider à traverser les moments difficiles, mais aussi d’avoir partagé les bons moments. Je remercie également mes amis Axelle, Ay- meric, Karen, Armina, Linda, Thierry, Léa, Mélina, Yanina, Yoan, Flavien, Mike et Julien pour tous les bons moments. Nos moments passés tous ensembles vont beaucoup me man- quer.
Je remercie également tous les autres membres du laboratoire du Dr Armen Saghatelyan, présent et passé Vincent, Rodrigo, Caroline, Arthur, Qian, Alessandra, Tiziano, Majid, Vlad et Raquel.
Enfin, je remercie mes parents ainsi que mon petit frère Chandrou. Depuis le tout début, les sacrifices et leur soutien infaillible m’ont donné la détermination de ne jamais abandonner et d’en arriver là où j’en suis. Leurs confiances et leurs mots réconfortants m’ont aidé plus d’une fois à traverser les moments difficiles et les moments de stress. Pour tout ça, je les remercie infiniment.
A
VANT-
PROPOSLa première étude présentée dans cette thèse a été en grande partie réalisée par moi-même.
J’ai effectué la grande majorité des électroporations, des expériences ex vivo et in vivo et analysé les données. Majid Ghareghani a contribué aux expériences ex vivo et in vivo, effec- tué les électroporations et analysé les données ex vivo. Concernant les expériences in vivo, les mini-endoscopes ont été installé par le Dr Armen Saghatelyan, j’ai effectué la majorité des imageries in vivo et analysé les données. Majid Ghareghani et Sarah Malvaut ont contri- bué aux imageries in vivo. Pour les expériences optogénétiques, les fibres optiques ont été installées par le Dr Armen Saghatelyan et j’ai effectué les imageries in vivo. Le Dr David Petrik a effectué l’analyse qPCR pour le gène Itpr2. La Dre Marina Snapyan a designé et cloné les guides RNA ainsi que leur validation, elle a aussi effectué le RNAscope. Les scripts MatLab pour l’analyse calcique ont été écrits par Marie-Anne Lebel-Cormier et Come Mar- sac. Le Dr Armen Saghatelyan a écrit le manuscrit et supervisé le projet. Le Dr Magdalena Götz a révisé le manuscrit.
Pour la deuxième partie des résultats, les expériences ont été réalisées en grande partie par moi-même. Les comptages ont été en majorité faits par des étudiants d’été. J’ai effectué l’analyse morphologique et participé au comptage. Le Dr Armen Saghatelyan a supervisé ce projet.
I
NTRODUCTION1.LES CELLULES SOUCHES ADULTES NEURALES
1.1 Découverte des cellules souches neurales adultes
Les cellules souches (CSs) sont des cellules indifférenciées, elles sont capables de s’autorenouveler et de se différencier en différents types de cellules.
Lors de l’embryogenèse, le zygote va subir une succession de divisions. Au stade 8 cellules, les cel- lules du zygote sont totipotentes, c’est-à-dire qu’elles peuvent se différencier de manière à produire les types cellulaires embryonnaires ou extra embryonnaires. Le zygote va passer ensuite du stade morula 16 cellules, à 32 cellules puis aux 64 cellules appelées le stade blastocyte (1). Le blastocyte est composé de cellules périphériques qui constituent le trophoblaste et des cellules de la masse in- terne. Le trophoblaste va donner naissance au placenta et les cellules de la masse interne seront à l’origine de l’embryon entier, ces cellules sont définies comme des CSs pluripotentes (1). Les cellules de la masse interne vont donner naissance à l’hypoblaste et l’épiblaste.
Lors de la gastrulation, ces deux tissus vont générer 3 feuillets: l’ectoderme, l’endoderme et le méso- derme. L’ectoderme va se différencier en épiderme, tube neural et la crête neurale. La différenciation du tube neural va donner naissance au cerveau et à la moelle épinière. Les cellules du tube neural sont constituées de cellules neuroépithéliales. Ce sont les premières CSs embryonnaires neurales. Elles sont multipotentes c’est-à-dire leur capacité à se différencier est restreint aux progéniteurs neuronaux.
Les noyaux de ces cellules migrent le long de leur axe apico-basal durant leur cycle cellulaire, c’est la migration nucléaire inter cinétique. Elles se divisent de manière symétrique pour donner des cel- lules neuroépithéliales puis vers l’âge embryonnaire E9-10, elles commencent à se diviser de ma- nière asymétrique pour donner des cellules de la glie radiaire.
Ces cellules ont une morphologie distincte, elles présentent un long prolongement radial qui s’étend de la zone ventriculaire à la surface piale et expriment des marqueurs astrocytaires telles que les pro- téines GFAP (glial fibrillary acidic protein), S100β (Ca2+ binding protein), GLAST (glutamate aspar- tate transporter). Comme les cellules neuroépithéliales, les cellules de la glie radiaire vont subir la migration nucléaire inter cinétique, le noyau va subir une mitose au niveau de la zone apicale de la zone ventriculaire et migrer au niveau basal lors de la phase de division ou phase S. Les cellules de la glie radiaire vont se diviser de manière asymétrique pour donner d’autres cellules de la glie radiaire et des progéniteurs cellulaires intermédiaires (IPC) (2). Ces dernières vont se diviser de manière sy- métrique pour générer de nouveaux neurones. Les premiers nouveaux neurones vont donner des in- terneurones dans l’eminiscence ganglionnaire qui vont migrer tangentiellement dans la zone intermé- diaire et marginale (2).
Ensuite, les neurones immatures issus de la division de la glie radiaire vont migrer de manière radiale le long des prolongements radials pour former les cellules pyramidales du néocortex. Elles vont d’abord migrer dans les couches profondes (E11-E13) et ensuite dans les couches superficielles (E14- E16) (Figure 1.1). Les cellules de la glie radiale vont générer des astrocytes vers E16 jusqu’aux pre- mières semaines postnatales chez la souris et les oligodendrocytes vers la naissance. À la fin du dé- veloppement cortical, la plupart des cellules radiales disparaissent, mais certaines se différencient en CSs, ce sont les cellules souches neurales (CSNs) adultes.
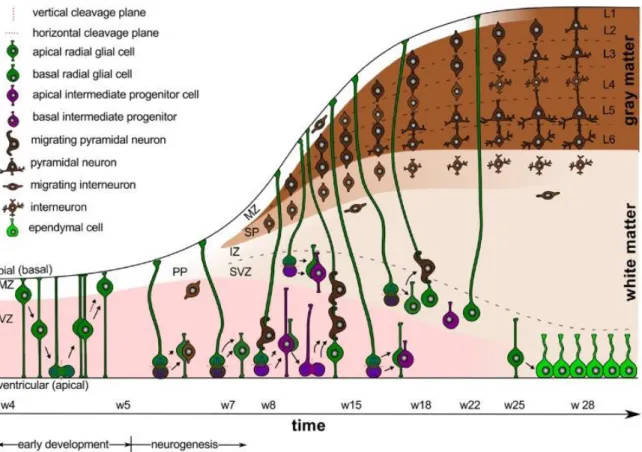
Figure 1.1: Développement embryonnaire et neurogenèse.
Le développement embryonnaire est caractérisé par la migration interkinetique nucléaire, un proces- sus oscillatoire durant lequel les cellules neuroepitheliales vont se diviser pour donner des cellules de la glie radiaire qui vont ensuite donner des progéniteurs neuronaux. Les premiers neurones vont migrer tangentiellement pour donner des interneurones dans la zone intermédiaire et marginale. En- suite, les progéniteurs neuronaux issus de la division de la glie radiaire vont migrer radialement pour former les cellules pyramidales du néocortex. Figure adaptée de Budday et al. 2015 (2).
Pendant longtemps, le dogme principal en neuroscience fut que les neurones étaient post-mito- tiques. Ce dogme a été remis en question par les premières études attestant la neurogenèse adulte chez les rongeurs (3-5).
Ces études utilisent la technique de l’autoradiographie, elle est basée sur l’incorporation de la thymi- dine radioactive dans l’ADN (acide désoxyribonucléique) lors de la prolifération, mais cette tech- nique reste controversée à l’époque et les résultats de ces études engendrent plus de scepticisme. En effet, une étude utilisant la même technique dans le cortex visuel chez le macaque rhésus à l’âge adulte montre qu’il n’y a pas de neurogenèse adulte (3).
Il faudra attendre les débutsdes années 90 par la découverte des CSNs par Brent Reynolds et Sam Weiss (4). L’isolation des CSNs du gyrus denté (5) et de la ZSV (zone sous ventriculaire) (6) mon- trent que la neurogenèse adulte persiste dans deux zones du cerveau. Des études beaucoup plus ré- centes ont identifié une nouvelle région neurogénique au niveau du troisième ventricule, l’hypotha- mus. Les tanycytes sont les CSs de l’hypothalamus. Ce sont des cellules ependymales non ciliées qui présentent des marqueurs de CSNs telles que la nestine, Sox 2 et vimentine (7-8). La moelle épinière présente aussi une capacité neurogénique (9). Dans les conditions normales, les oligodendrocytes sont capables de s’autorenouveler et donner naissance à de nouveaux oligodendrocytes (10). Lors d’une blessure, les astrocytes et les cellules ependymales se mettent aussi à proliférer. Seules les cellules ependymales peuvent générer différents types de progéniteurs mais elles restent limitées à devenir des cellules gliales ou indifférenciées (10-11).
Neurogenèse dans l’hippocampe.
La neurogenèse dans l’hippocampe a lieu dans le gyrus denté et génère de manière continue environ 9000 nouveaux neurones, principalement des cellules granulaires et à moindre mesure des astro- cytes (12). Les cellules granulaires sont des neurones excitateurs qui projettent dans la région CA3 des cellules pyramidales et les régions hilars. Elles reçoivent des afférences du cortex entorhinal et leurs activités sont modulées par les interneurones du gyrus denté et du hile (13). Les CSNs rési- dent dans la zone subgranulaire (ZSG), celle-ci se divisent et génèrent des progéniteurs intermé- diaires de type 2 qui expriment le facteur de transcription Trb2 (T-box transcriptional factor). À leur tour, ils se divisent et donnent naissance aux neuroblastes doublecortine (Dcx) positive ou cellules de type 3. Les neuroblastes migrent tangentiellement le long des vaisseaux sanguins (14) et se dévelop- pent en neurones immatures qui migrent radialement une distance courte dans la couche interne gra- nulaire et se différencient en interneurones glutamatergique (18). Les neurones granulaires formeront des synapses fonctionnelles avec les cellules pyramidales de couche CA3 deux à quatre semaines après leur naissance (15). La neurogenèse dans la ZSG est illustrée dans la Figure 1.2.
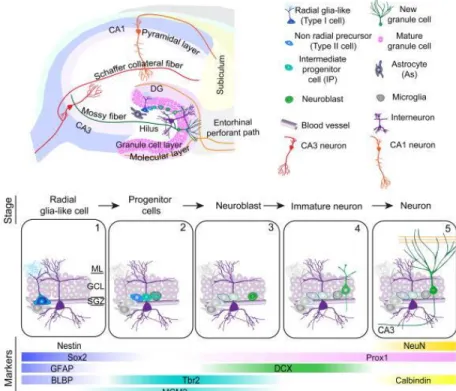
Figure 1.2: La neurogenèse adulte dans l’hippocampe.
Représentation schématique de la neurogenèse adulte dans le gyrus denté. Les CSNs quiescentes (étape 1) dans la ZSG une fois active vont donner des progéniteurs neuronaux (étape 2), ils vont à leur tour vont donner des neuroblastes (étape3) qui vont migrer et s’intégrer en neurones immatures dans la couche granulaire (étape 4) et se différentier en neurones matures (étape 5). L’expression des différents marqueurs est aussi mentionnée à chaque étape. Figure adaptée de Ming et al. 2011 (16).
Neurogenèse dans le bulbe olfactif.
Les CSNs résident dans la zone sous ventriculaire (ZSV) bordant les ventricules latéraux. Une fois qu’elles sont actives, elles se divisent et donnent naissance aux cellules de types C qui vont se diviser et générer des neuroblastes. Ces neuroblastes vont migrer de manière tangentielle le long du courant rostral migratoire (3 à 8 mm), un long tunnel formé par les cellules gliales et les neuroblastes utilisent comme support les vaisseaux sanguins (17-18). On compte environ 30 000 et 40 000 neuroblastes produits quotidiennement (19-20). Lorsque les neuroblastes atteignent le bulbe olfactif (BO), ils mi- grent de manière radiale dans les différentes couches du BO et se différencient en interneurones gra- nulaires (90-95 %) et periglomerulaires (5-10 %). Ces CSNs génèrent aussi des oligodendrocytes dans le corps calleux. La neurogenèse dans la ZSV est illustrée dans la Figure 1.3.
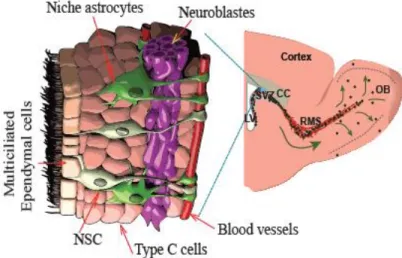
Figure 1.3 : La neurogenèse adulte dans le bulbe olfactif (BO).
Représentation de la neurogenèse adulte dans le BO. Les CSNs quiescentes représenté en vert une fois active se divisent et donne naissance aux cellules de type C en rose ou cellules à division rapide qui a leur tour vont générer des neuroblastes en violet. Les neuroblastes vont migrer le long du courant migratoire rostrale (CMR) et atteindre le BO pour se différentier en interneurones. Figure adaptée Gengatharan et al., 2016 (21).
1.2 Origine des cellules souches neurales adultes
a) Les cellules souches embryonnaires à la glie radiaire
Les CSNs de la ZSV dérivent de la glie radiaire (22). Le devenir des différents progéniteurs suite à la division des cellules de la glie radiaire est suivi par l’injection in utero d’un rétrovirus codant pour une bibliothèque de 100 000 tags génétiques. Ces tags permettent ainsi de tracer les différents clones suite à la division des cellules gliale radiale. En analysant les différents codes-barres géné- tiques des clones, on peut établir la lignée entre ces différents clones. Il est ainsi montré que les CSNs et les cellules du cortex, du striatum et du septum provenaient d’un progéniteur embryonnaire en commun avant E15. De même, cette étude a identifié qu’entre E13.5 et E15.5, une sous population de la glie radiaire se divise et génère les futures CSNs (23). Cette population devient quiescente tandis que les autres cellules radiales se divisent rapidement. Ce stade de quiescence est maintenu par la surexpression du régulateur négative du cycle cellulaire p57kip2 (Cdkn1c) (24) et l’expression de la protéine d’adhésion VCAM1 (vascular cell adhesion molecule 1) (25).
Pour les CSNs du gyrus denté, leurs origines proviennent des progéniteurs du neuroépithélium médial pallium appellés aussi neuroépithélium du gyrus denté ou matrice première autour de E13.5 (26). Les progéniteurs migrent ensuite vers le côté piale du cortex, à côté de la fimbria formant le courant migratoire du denté composé de cellules progénitrices intermédiaires et des cellules granulaires
immatures post mitotique. À la fin de la migration, les cellules granulaires s’accumulent dans le hilus et une troisième matrice germinative est établie (27). La majorité des cellules granulaires se forme pendant les deux premières semaines post-mitotiques et provient de la troisième matrice (28). Puis entre les jours postnatales P20 et P30, les cellules se confinent graduellement dans la ZSG pour de- venir les CSNs (26, 29-30). Le traçage de la lignée des cellules Hopx+ (homedomain only pro- tein), marqueur spécifique des CSNs quiescentes de l’hippocampe (31) et absent chez les CSNs de la ZSV (32), révèle que les CSNs de l'hippocampe proviennent d’un précurseur neuronal en commun qui génère de manière continue et exclusivement les CSNs de l’hippocampe (33). Ceci diffère avec le modèle de la ZSV où les CSNs proviennent d’une sous population de la glie radiaire : c’est le modèle « set aside » versus le modèle continu de la ZSG. De plus, le traçage des cellules actives Shh (sonic hedgehog) révèle que 69 % des CSNs à P15 proviennent des progéniteurs de l’hippocampe qui migrent autour de la naissance du pôle temporal vers le pôle septal (34).
1.3 Identité et Propriété des cellules souches adultes neurales
a) Identification des cellules souches neurales adultes quiescentes et actives
Les CSNs de la ZSV appelées aussi cellules de type B1 expriment des marqueurs astrocytaires telles que les protéines GFAP, GLAST et BLBP (brain lipid binding protein) (23, 35-36). Elles sont carac- térisées aussi par l’expression de la glycoprotéine transmembranaire, la prominine ou CD133 dans le cil primaire (35, 37-38). Ces CSNs coexistent dans deux états : soit elles sont quiescentes ou prolifé- ratives. L’état de quiescence est défini comme la phase G0 du cycle cellulaire et par l’absence d’ex- pression de marqueurs prolifératifs telle que PCNA (proliferating cell nuclear antigen) (39). Le pas- sage de l’état quiescent à l’état prolifératif est caractérisé par l’expression du récepteur au facteur de croissance EGFR (40-41). Une fois la cellule souche dans un stade proliférative, elle se divise et donne naissance aux cellules de type C qui sont EGFR+. Les cellules de type C vont à leur tour don- ner des neuroblastes CD24+. Il est très difficile d’isoler spécifiquement les CSNs car elles partagent plusieurs marqueurs en commun avec d’autres populations. Afin de contrer ce problème technique, la technique de cytométrie de flux a permis de trier spécifiquement les CSNs basées sur leur expres- sion de plusieurs marqueurs telles que GFAP, CD133, GLAST, Lex (35-36, 38, 42-44) ainsi par la présence ou l’absence de l’expression de EGFR pour distinguer leur stade de prolifération. L’analyse transcriptionnelle des CSNs dans chacun de leur stade révèle que les CSNs quiescentes n’expriment pas le marqueur nestine (35) et le stade de quiescence serait maintenu par les ligands S1P et PDG2 des récepteurs couplés à la protéine G (35) tandis que la protéine BLBP (45) et la protéine Syndecan- 1 (42) seraient associées à leur état prolifératif. Les CSNs quiescentes sont enrichies dans l’expression
de gènes associés à l’énergie métabo-lique, la glycolyse, les acides gras, la signalisation des récep- teurs à la protéine G, l’ancrage, l’adhésion cellulaire et la communication cellule-cellule tandis que la phosphorylation oxydative, les gènes impliqués dans le cycle cellulaire et la réparation de l’ADN sont plus exprimés dans les CSNs actives de la ZSV (37) et la ZSG (31). L’isolation des CSNs en utilisant les marqueurs GLAST et la prominine révèle que la population des CSNs quiescentes n’est pas homogène, il existe une population de CSNs amorcées. C’est un état de transition entre l’état quiescent dormant et l’état prolifératif (36). Elles sont caractérisées par une activité riboso- male plus élevée et une expression des marqueurs gliaux diminués, mais ne présentent pas de mar- queurs associés aux cycles cellulaires (36). Cet état est augmenté suite à une ischémie (36).
b) Mode de division symétrique versus asymétrique
La maintenance de la neurogenèse adulte nécessite que les CSNs puissent se diviser afin de s’autore- nouveler et de donner des progéniteurs neuronaux. Deux types de divisions peuvent avoir lieu : la division symétrique qui consiste à donner soit deux CSNs soit deux cellules progénitrices ou la divi- sion asymétrique qui donne une CSN et une cellule progénitrice. La capacité de l’autorenouvellement des CSNs disparait au fur et à mesure de l’âge et les CSNs finissent par se dépléter (46). Les raisons de cette déplétion restent encore controversées (47). Il peut agir soit du fait qu’il y a un nombre limité de CSNs qui s’épuise au cours de l’âge (48) ou soit le fait que les CSNs une fois activées échouent de retourner à leur état de quiescence (49). Dans la ZSV, l’analyse clonale in vivo montrent que ses CSNs GLAST+ se divisent asymétriquement avant d’être consumées par une division symétrique terminale perdant ainsi leur capacité à long terme de s’autorenouveler (50). Cette étude est aussi confirmée par l’imagerie in vivo de la neurogenèse adulte dans le télencéphale du poisson-zèbre in- tact. Cette étude observe que les nouveaux neurones sont issus soit de la division asymétrique des CSNs qui permet ainsi de maintenir le pool de CSNs ou la conversion directe des CSNs en neurones qui déplètent dans ce cas le pool de CSNs. La conversion directe des CSNs en neurones est plus fréquente (17 %) que le renouvellement du pool des CSNs par division symétrique (1 %) (51). L’ima- gerie in vivo dans l’hippocampe en enlevant une partie du néocortex permet d’avoir accès au gyrus denté et de suivre la division des CSNs sur plusieurs mois. Cette étude révèle qu’au cours du temps, les CSNs se divisent 2 à 3 fois symétriquement ou asymétriquement pour renouveler le pool des CSNs mais termine par une division symétrique finale pour générer des progéniteurs neuronaux. Cela en- traine ainsi leur déplétion à long terme (52). Cette déplétion est observée aussi dans les CSNs de la ZSV. En imageant ex-vivo les CSNs GFAP–GFP+ et leurs progéniteurs, Obernier et al. observent que les CSNs se divisent uniquement symétriquement. Ils génèrent 80 % des progéniteurs neuronaux et 20 % des CSNs. Cette étude est en contradiction avec d’autres études qui observent des
divisions asymétriques (53). Cette différence peut s’expliquer par lesdifférences de techniques utili- sées (54). Il n’est pas encore clair pourquoi les CSNs choisissent de s’autorenouveler ou de se déplé- ter mais montrent l’hétérogénéité de cette population.
c) Lineage et régionalisation
Les CSNs de la ZSV présentent une spécification régionale et temporale dans la génération des dif- férents types d’interneurones (23, 55-56). Basé sur des stratégies virales marquant les CSNs dans des subrégions distinctes, il a été montré que les CSNs dorsales génèrent les cellules granulaires les plus superficielles et les periglomerulaires dopaminergiques tandis que les CSNs ventrales produisent les cellules granulaires plus profondes et les periglomerulaires calbindine+ (55). Les cellules granulaires et periglomerulaires ainsi que quatres nouveaux sous types d’interneurones dans le bulbe dérivent des CSNs antérieures et de la zone antérieure de la partie ventrale de la ZSV respectivement (55, 57). La régionalisation des CSNs est déterminée par la combinaison de facteurs de transcriptions et de mor- phogènes. Par exemple, le traçage de la lignée des facteurs de transcription Emx1 et Gsh2 exprimés dans la zone ventriculaire du cortex embryonnaire et l’éminence ganglionnaire latérale respective- ment, montre que les progéniteurs de Emx1 résident dans la partie dorsale de la ZSV et génèrent les cellules granulaires calretinine+ superficielles tandis que les CSNs qui dérivent du lineage de Gsh2 produisent les interneurones calbindine+ et un nombre très faible de cellules calretinine+ (58). Les cellules granulaires profondes dérivent de progéniteurs de Nkx2.1 présent dans la zone ventrale de la ZSV (59), tandis que les quatre nouveaux types d’interneurones dérivent de microdomaines expri- mant les facteurs de transcriptions Nkx6.2 et Zic présent dans la partie antérieure ventrale de la zone ventriculaire (57). Une étude récente montre que les CSNs Nkx 2.1 sont innervées par les neurones POMC (propiomelanocortin) de l’hypothalamus. Ils libèrent de la β-endorphin et activent la prolifé- ration de ces CSNs. Ces neurones sont activés par la satiété et la faim (60). Le facteur de transcrip- tion Pax6 a un double rôle: il est nécessaire pour la génération de progéniteurs neuronaux mais aussi pour les différentier vers un phénotype periglomerulaire dopaminergique (61). Le facteur de trans- cription en doigt de zinc Sp8 est nécessaire pour la spécification des cellules calretinines et les cellules periglomerulaires gabaergiques non dopamergiques (62). Les CSNs génèrent aussi un petit nombre de cellules juxtaglomerulaires glutamatergiques dans le BO, ils sont spécifiques par l’expression des facteurs de transcriptions Neurog2 et Tbr2 exprimés par une sous-partie des progéniteurs dorsales de la ZSV (63). Toutes ces études montrent un répertoire de facteurs de transcriptions exprimés le long de l’axe dorso-ventral et rostro-caudal de la ZSV mais aussi une spécification régionale des CSNs dans la génération des différents types d’interneurones. En plus des facteurs de transcription, ceux de la morphogène sont aussi impliqués dans la régionalisation des CSNs. L’utilisation de souris
rapportrices qui marquent les cellules sensibles à Shh révèle un gradient morphogénique qui joue un rôle général dans la spécification dorso-ventral de la ZSV (64). Les cellules sensibles à Shh expriment GFAP et donnent principalement des interneurones dans la couche profonde granulaire du BO (55).
La suppression de Shh réduit la production d’interneurones du BO provenant de la zone ventrale.
Réciproquement, l’activation ectopique de Shh par l’expression de Smo2, un récepteur constitutive- ment actif, dans les CSNs dorsales génèrent des interneurones normalement produits par les progéni- teurs ventraux de la ZSV (64). De façon intéressante, un domaine transitoire de Shh dans la zone dorsale de la ZSV a été identifié comme étant responsable de la production de nombreuses cellules de type oligodendrocytes (65). Le domaine dorsal de la ZSV est aussi déterminé par la persistance de la signalisation Wnt / βcaténine dans les CSNs qui vont donner des oligodendrocytes (66-67). L’ima- gerie en temps réel et le traçage de la lignée des CSNs et ses progéniteurs révèlent que les lignées des CSNs qui génèrent les neurones et les oligodendrocytes respectivement sont deux lignées distinctes répondant différemment à la signalisation canonique Wnt (68).
En plus de l’hétérogénéité régionale, les CSNs présentent une spécificité temporale. Bastista-Brito et al. ont developpé une lignée de souris inductible pour tracer le lineage des progéniteurs neuronaux Dlx ½ positives. Ils ont pu ainsi suivre les précurseurs des sept sous-types d’interneurones dans le BO de l’embryogenèse jusqu’à l’âge adulte (56). En utlisant cette lignée de souris, ils ont observé que la production d’interneurones calbindine+ atteint son maximum vers la fin de l’embryogenèse puis diminue post natalement tandis que l’opposé est observé pour la production de cellule calreti- nine+ (56). Les interneurones parvalbumines+ dans la couche plexiforme externe sont produits peri- natalement tandis que les cellules blanes qui sont des interneurones bulbaires responsables de l’inhi- bition des cellules granulaires (69) sont produites durant l’embryogenèse (56). Ils ont aussi montré que les cellules tyrosine hydroxylase (TH +) dans la couche glomérulaire atteignent un pic durant le début de l’embryogenèse puis diminuent par la suite. Les cellules periglomerulaires TH+ sont pro- duites principalement postnatalement (70). Plus récemment, il a été montré que les interneurones dopaminergiques du BO générés postnatalement ne présentent pas d’axones tandis que ceux générés durant le développement embryonnaire présentaient un axone et sont plus excitables que les cellules générées postnatalement (71) (Figure 1.4).
La production de différents sous types d’interneurones est donc temporellement et régionalement spécifiée. La régionalisation permet à ceux que les informations embryonnaires soient maintenues de la cellule neuroepitheliale à la cellule radiale puis aux CSNs adultes, tandis que la spécification tem- porale contrôle l’ordre et les sous-types d’interneurones générés. Le lien entre la spécification tem- porale et régionale reste à être déterminé, de même à savoir comment la génération des différents sous types d’interneurones est régulée par le comportement de l’animal.
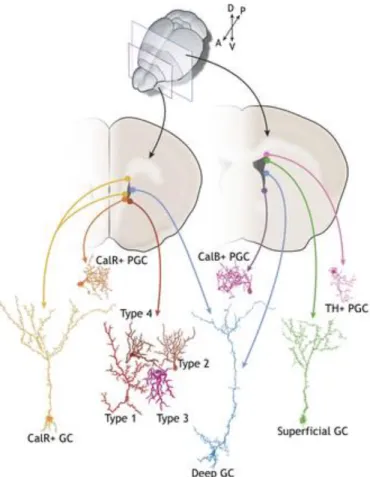
Figure 1.4 : Régionalisation des cellules souches neurales adultes.
Selon la localisation des CSNs la ZSV, ils vont générer différents types d’interneurones dans le BO.
Figure adaptée d’Obernier et al. 2019 (72).
1.4 Plasticité des cellules souches neurales adultes
Dans des conditions normales, les CSNs sont relativement quiescentes et occasionnellement se divi- sent pour produire de nouveaux neurones. Lorsque le cerveau subit un stress aigu ou une dégénéres- cence cela conduit à une perte neuronale massive et une perturbation de l’homéostasie des niches neurogéniques. Les CSNs sont activées et essayent de compenser en premier lieu la perte neuronale en recrutant les neuroblastes des niches neurogéniques vers le site pathologique. Cette caractéristique de régénération illustre la propriété de plasticité des CSNs, mais se perd au cours du vieillissement.
a) Régénération
La plasticité des CSNs a été mis en évidence lorsque les cellules en prolifération sont déplétées par l’infusion d’un antimitotique AraC (cytosine-β-D-arabiofuranoside) dans le ventricule, les blessures aiguës du cerveau ou les maladies neurodégénératives. Toutes les cellules de la ZSV en prolifération sont éliminées excluant les CSNs quiescentes. Suite au traitement d’AraC, les CSNs quiescentes se
mettent à proliférer et régénèrent toutes la ZSV en 10 jours (73). La préparation de coupes de ZSV en tissus entièrement montées après l’infusion d’AraC en continu pendant 6 jours montre l’apparition du marqueur prolifératif MCM2 12 heures post infusion dans les CSNs actives (41).
b) Les blessures aiguës
Les blessures aiguës perturbent aussi l’homéostasie des niches neurogéniques et entrainent un recru- tement spontané des neuroblastes de la ZSV vers les sites pathologiques. Ceci a été observé en cas d’épilepsies, de trauma, d’ischémie dans différents modèles animaux (74-77). En plus de la réponse de la ZSV, l’ischémie (78) et l’épilepsie aiguë (79) augmentent la neurogenèse dans l’hippocampe tandis que l’épilepsie chronique la diminue (80). Des études montrent que l’augmentation de la neu- rogenèse dans la ZSG peut être plus détrimentaire que bénéfique. Les nouveaux neurones granulaires sont localisés à des positions ectopiques et projettent des projections aberrantes dans l’hippocampe épileptique ce qui entraine une hyperexcitabilité dans le réseau neuronale et contribue à l’épilepto- gènese (77, 81-83) bien que ce lien de cause à effet soit encore controversé (84-86).
L’ischémie ou accident vasculaire cérébral est l’obstruction d’un vaisseau sanguin qui a pour consé- quence la privation des cellules en apport sanguin. Les tissus ne reçoivent plus d’oxygène, de glucose nécessaire à leur fonctionnement et entrainent la mort neuronale au niveau de la zone ischémique.
Cette lésion cérébrale affecte la niche des CSNs et leurs comportements. De nombreuses études ex- périmentales démontrent que chez les rongeurs suite à l’ischémie, les CSNs sont recrutées. La plasti- cité des CSNs se manifeste après la lésion cérébrale : la prolifération et la différenciation des CSNs sont augmentées. Des neurones immatures sont observés dans la zone ischémique ainsi des neurones en migration en provenance de la ZSV (74, 87). Une augmentation de l’angiogenèse dans la ZSV est observée, elle est caractérisée par une augmentation du volume des vaisseaux et une augmentation de la prolifération des cellules endothéliales (88). Les cellules en migration qui sont morphologiquement identiques aux neuroblastes et expriment la doublecortine migrent le long de ses nouveaux vaisseaux formés (88-89). Lors de l’ischémie, les cellules microgliales contribuent à la prolifération des CSNs ex-vivo et promeuvent la différentiation en neurones et en oligodendrocytes (90). Il a été montré que les cellules épendymales aussi deviennent des progéniteurs et génèrent des neuroblastes et des astro- cytes (91-92). Toutefois, ces cellules ependymales qui servent de réservoir de neurones lors d’une blessure ne sont pas considérées comme CSNs car ils ne sont pas capables de s’autorenouveller suf- fisamment et se déplètent lors de l’ischémie (93) et d’autres études mettent en doute le recrutement de ces cellules ependymales (94-95). De même, il est observé que des astrocytes devenus réactifs suite à l’ischémie deviennent multipotents et sont capables de s’autorenouveler (96-97). La de-diffe- renciation des astrocytes et des cellules épendymale montrent l’importance des facteurs exogènes
présents dans la niche ou en dehors qui peuvent déclencher une grande plasticité dans le destin cellu- laire. Ceci montre aussi l’existence d’un nouveau réservoir de CSNs pour maintenir l’homéostasie cellulaire. La de-differentiation est aussi observé dans d’autres systèmes lors d’une blessure (98-104).
Des études récentes montrent que l’expression ectopique de certains facteurs de transcription, tels que Sox 2+ et Ascl1 initie la dé-différenciation en neurones (105-106) mais cette capacité neurogénique reste limitée uniquement dans un contexte d’une blessure aiguë et pas dans le cas chronique d’une maladie neurodégénérative (107).
c) Les maladies neurodégénératives
La neurogenèse adulte est affectée dans les maladies neurodégénératives (108-109). Elle résulte par une perte des neurones existantes et une réduction de la capacité des CSNs à se renouveler (110).
Parmi les maladies neurodégénératives, on retrouve la maladie de Parkinson, d’Alzheimer, la maladie d’Huntington et la sclérose latérale amyotrophique. La maladie de Parkinson est caractérisée par un désordre du mouvement accompagné de troubles cognitifs (111). La perte des neurones dopaminer- giques dans la substance nigra entraine un désordre moteur et une accumulation de la protéine α- synucléine pour former les corps de Lewy qui sont des inclusions cellulaires cytoplasmiques (112).
Les cerveaux post mortem des patients parkinsoniens sont caractérisés par une réduction de la proli- fération des progéniteurs dans la ZSV (108, 113). Ceci peut s’expliquer par la dénervation progressive des neurones dopaminergiques dans la ZSV qui affecte la neurogenèse. En effet, des études ont mon- tré que la dopamine est impliquée dans la prolifération des cellules dans la ZSV (114-116). Le gyrus denté est innervé par des neurones dopaminergiques provenant de l’aire tegmentale ventrale ainsi que la substance nigra (117). La perte des neurones dopaminergiques par le 6-OHDA diminue la prolifé- ration du pool neurogénique et la survie des neurones granulaires (117). La neurogenèse dans l’hip- pocampe semble être affectée beaucoup plus tôt, l’hippocampe est innervé par les neurones sérotoni- nergiques provenant du noyau raphé et la synucleinopathie progressive altère les neurones sérotoni- nergiques et par conséquent l’hippocampe (118-121).
La maladie d’Alzheimer est caractérisée par une atrophie de l’hippocampe, des troubles de la mé- moire et cognitive ainsi que des déficits olfactifs (110). La maladie est associée par des enchevêtre- ments neurofibrillaires causés par l’hyperphosphorylation de la protéine tau et le dépôt des plaques amyloïdes-β (122). Le dépôt des amyloïdes-β et l’inflammation altèrent la maturation des neurones nouvellement génèrées et inhibent aussi la neurogenèse dans l’hippocampe (123). En effet, l’accu- mulation de plaques amyloïdes-β augmente l’expression des cytokines pro-inflammatoires IL-1β, IL- 6 et TNF-α et le facteur de croissance TGF-β qui joue un rôle négatif dans la prolifération et la survie des CSNs (124-127). La maladie de Huntington est une maladie autosomale dominante causée par la