FRANTZ-DANIEL LAFORTUNE
SUR L'ORIGINE DES VARIATIONS LENTES
LIÉES AU C 0
2DE L'EEG EN COURANT DIRECT
IMPLICATION DE LA
BARRIÈRE HÉMATO-ENCÉPHALIQUE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en neurobiologie
pour l'obtention du grade de Maître es Sciences (M. Se.)
FACULTE DE MEDECINE UNIVERSITÉ LAVAL
QUÉBEC
2010
Résumé
Ce mémoire de maîtrise soutient la thèse originale selon laquelle les déviations lentes du potentiel de courant direct (DC) liées au CO2 et enregistrées au moyen de l'électroencéphalogramme (EEG) prennent source à travers l'interface ionique de la barrière hémato-encéphalique (BHE).
Les circuits corticaux neuronaux ont longtemps été considérés comme étant les générateurs quasi exclusifs de l'ensemble de l'activité électrique constituant le signal électroencéphalographique. Des études ont démontré la contribution des cellules gliales comme source alternative de courant électrique participant, entre autres, aux décharges épileptiques et au sommeil. Or, plusieurs chercheurs suggèrent que les variations lentes du potentiel de l'EEG enregistrées en DC et modulées en fonction de la pression partielle du CO2 (PCO2) sont issues de l'interface entre le liquide céphalorachidien (LCR) et le sang que constitue la BHE.
Considérant les trois hypothèses mécanistiques susmentionnées, il devient essentiel d'élucider la contribution relative des générateurs électriques neuronaux et gliaux par rapport à l'interface de la BHE en ce qui a trait à la genèse des déviations lentes DC de l'EEG. Nous avons donc procédé à cette étude par l'entremise d'enregistrements épicrâniens, épiduraux, épicorticaux, intraventriculaires et intraparenchymateux (c.-à-d. intraneuronaux, intragliaux et les potentiels de champ) sur des chats anesthésies à la kétamine-xylazine. Les variations du potentiel DC ont été induites via la modulation des paramètres ventilatoires des chats anesthésies, causant ainsi des changements du COi de
11
l'ordre de 2 à 5 % en fin d'expiration. L'hypercapnie était invariablement associée à des déviations négatives du potentiel DC de l'EEG (déviation moyenne de -284.4 uV/C02 %, intervalle allant de -216 à -324 pV/C02%), tandis que l'hypocapnie provoquait des déviations positives (déviation moyenne de l'ordre de 307.8 uV/C02 %, intervalle allant de 234 à 342 ^V/C02%), et ce, dans toutes les électrodes d'enregistrement. L'hypocapnie a provoqué une augmentation significative de la pression intracrânienne, tandis que l'hypercapnie ne l'a diminué que très légèrement. La rupture de la barrière hémato-encéphalique a entraîné une déviation positive du potentiel DC et a réduit drastiquement les réponses subséquentes du potentiel DC à l'hypo-hypercapnie. Le thiopental et l'isoflurane ont aussi provoqué une déviation positive du potentiel DC reliée à la dose administrée, tandis qu'à des concentrations plus élevées, les réponses à l'hypo-/hypercapnie présentaient une polarité inversée. Pour ce qui est de la possible implication des neurones dans la production des déviations du potentiel DC, aucune inversion de polarité n'a été enregistrée entre le scalp, les diverses couches intracorticales et les structures profondes du cerveau. De plus, le potentiel de membrane des neurones et des glies n'a pas montré de variation significative ou systématique en association lors des déviations du potentiel DC liées au CO2. Durant les crises épileptiques de type « pointe-onde », l'activité pathologique des neurones s'est accompagnée de déviations du potentiel DC d'amplitude significativement moins élevée que celles générées par hyper-/hypocapnie. Enfin, des déviations du potentiel DC étaient encore observées lors même de la quiescence des circuits neuronaux associée à l'état de burst-suppression du tracé électroencéphalographique induit par l'anesthésie. Nous soutenons donc la thèse selon laquelle les potentiels générés à travers la BHE sont la source principale des variations épi-corticales/crâniennes du potentiel DC de l'EEG
Ul
enregistré à l'EEG dans des conditions qui affectent le pH du cerveau et/ou la circulation sanguine cérébrale.
IV
Abstract
This thesis provides evidence for the claim that C02-dependent direct current potential shifts (DC shifts) of the electroencephalogram (EEG) originate from the ionic interface of the blood-brain barrier.
Cortical neuronal dipoles were considered for many decades as the sole generator of all the electrical activity recorded on the scalp that constitute the electroencephalographic signal. Other studies have demonstrated the contribution of glial cells as an alternative source of electricity current involved, for instance, in the generation of seizures and sleep. Still further studies have proposed that slow DC shifts of the EEG are generated at the interface between cerebrospinal fluid (CSF) and blood as a function of the partial pressure of CO2 (Pco2) that constitute the brain-blood barrier (BBB).
In the face of these three mechanistic hypotheses, it becomes essential to elucidate relative contributions of neuronal and glial vs. non-neuronal (blood, CSF) mechanisms to the genesis of slow EEG shifts. We have this issue by using epicranial, epidural, epicortical, intraventricular and intraparenchymal (intraneuronal, intraglial and field) recordings in ketamine-xylazine anesthetized cats. DC shifts were elicited by changes in artificial ventilation, causing end tidal CO2 variations within a 2-5 range. Hypercapnia was consistently associated with negative scalp DC shifts (average shift -284.4 |xV/C02%, range -216 to -324 1J.V/CO2 %), while hypocapnia induced positive scalp DC shifts (average shift 307.8 p.V/C02 %, range 234 to 342 ^V/C02 %) in all electrodes referenced vs the
latter only slightly reduced ICP. Breakdown of the blood-brain barrier resulted in a positive DC shift and drastically reduced subsequent DC responses to hypo-/hypercapnia. Thiopental and isoflurane also elicited a dose-dependent positive DC shift and, at higher doses, hypo-/hypercapnia responses displayed reverted polarity. As to the possible implication of neurons in the production of DC shifts, no polarity reversal was recorded between scalp, various intracortical layers and deep brain structures. Moreover, the membrane potential of neurons and glia did not show either significant or systematic variations in association with the scalp-recorded C02-dependent DC shifts. Pathological activities of neurons during spike-wave seizures produced DC shifts of significantly smaller amplitude than those generated by hyper-/hypocapnia. DC shifts were still elicited when neuronal circuits were silent during anesthesia-induced burst-suppression patterns. In the light of theses findings, we advocate the idea that potentials generated by the blood-brain barrier are the major source of epicortical/cranial DC shifts recorded by EEG under conditions affecting brain pH and/or cerebral blood flow.
Avant-Propos
Ce mémoire est la présentation, d'un travail de recherche effectué sous la direction du Professeur Florin Amzica dans le cadre de mes activités de recherche au sein de l'équipe du laboratoire de neurophysiologie de la Faculté de médecine de l'Université Laval de 2003 à 2007. Ces travaux ont été supportés financièrement grâce à la bourse de formation de maîtrise pour les étudiants en médecine (M.D.-M.Sc.) du Fonds de recherche en santé du Québec (FRSQ) de 2005 à 2007.
L'étude a été publiée dans le Journal of Neurophysiology sous le titre : Nonneuronal Origin of C02- Related DC EEG Shifts : An In Vivo Study in the Cat. Les auteurs sont Nita, D.A.,
Vanhatalo, S., Lafortune F.-D, Voipio, J., Kaila K. et Amzica, F.. La référence exacte est : J Neurophysiol 92:1011-1022, 2004
La contribution des auteurs a été la suivante : le premier auteur, D.A. Nita, étudiant au doctorat de feu Professeur Mircea Steriade a effectué les enregistrements intraneuronaux réalisés au cours de l'étude et rédigé la version initiale de l'article.
Le deuxième auteur, S. Vanhatalo, chercheur invité au laboratoire du Professeur Amzica, a réalisé des travaux originaux qui ont inspiré le présent article. Il a participé à certaines des expériences sur la rupture de la barrière hémato-encéphalique et donné son avis sur la teneur du présent article.
Vil
Pour ma part, j'ai participé à la réalisation des expériences et à l'analyse des résultats, sauf pour les exceptions susmentionnées. J'ai notamment effectué les enregistrements intragliaux rapportés dans l'article. J'ai présenté les résultats préliminaires de ce travail de recherche au Colloque des stagiaires d'été de la Faculté de médecine de l'Université Laval, édition de 2003 (lre place : Prix Paul-A. Poliquin), puis comme présentateur invité au 45e
National Student Research Forum. Par ailleurs, l'ensemble des résultats a fait l'objet de présentations par affiche lors de la 6e Journée de la recherche de la Faculté de médecine de
l'Université Laval (Prix d'excellence 2004), ainsi qu'à la 34e assemblée annuelle de la
Society for Neuroscience en 2004.
En définitive, je suis redevable en tout et pour tout à mes parents, Daniel et Françoise, ainsi qu'à ma fratrie, Cindy et Jeff-Samuel, pour leur soutien inconditionnel tout au long de mes études. Je tiens également à remercier ma seconde famille : Pierre, Jean, Madeleine et Andrée, pour leurs amitiés indéfectibles ainsi que leurs encouragements féconds. Je tiens à exprimer ma gratitude au Professeur Florin Amzica pour m'avoir accueilli au sein de son laboratoire ainsi qu'au Dr Dragos A. Nita pour avoir été un mentor et un modèle à travers mon cheminement scientifique. Je tiens à remercier également Dr Laurent Descarries ainsi que Dr André Parent pour son soutien à travers les dédales de la rédaction de ce mémoire. Je tiens aussi à rendre hommage au souvenir de feu Dr Mircea Steriade pour m'avoir transmis une vision passionnée des sciences neurologiques. Je veux également remercier M. Pierre Giguère pour ses prouesses techniques et sa grande complicité. En me remémorant les années passées à Québec, je m'émeu au doux souvenir des nombreux collègues étudiants et des camarades, d'ici et d'ailleurs, que j'ai eu l'énorme privilège de
vin côtoyer au quotidien. Leur amitié fut et demeure toujours pour moi une offrande altruiste dont je leur suis très reconnaissant.
« La crainte de Dieu est le commencement de l'intelligence. »
Proverbes 1 : 7
« Nous sommes comme des nains sur des épaules de géants. Nous voyons mieux et plus loin qu 'eux, non que notre vue soit plus perçante ou notre taille plus élevée, mais parce que nous sommes portés et soulevés par leur stature gigantesque. »
Bernard De Chartres
«Ifl can have it back... All the time that we wasted I'd only waste it again. Ifl could have it back... You know I'd love to waste it again. Waste it again, and again, and again...
Table des matières
Résumé i Abstract iv Avant-Propos vi Table des matières x Liste des figures xi Liste des abréviations xii
1 Introduction 1 1.1 Problématique concernant l'origine des signaux de l'EEG 3
1.2 Objectif général 5 1.3 Hypothèses sur l'origine des variations du potentiel DC de l'EEG liées au CO2 ..6
2 Méthodologie 7 2.1 Préparation du chat in vivo 7
2.2 Électrodes et enregistrements 9 2.2.1 Enregistrement de l'EEG en DC 9 2.2.2 Enregistrements intracellulaires 10
2.2.3 Électrodes de référence 11 2.3 Induction des variations lentes du potentiel DC de l'EEG 11
2.4 Analyse 12 3 Résultats 14
3.1 Les variations du potentiel DC de l'EEG provoquées par les manœuvres
respiratoires 14 3.2 La rupture de la barrière hémato-encéphalique prévient les variations du potentiel
DC liées au C02. 16
3.3 Variations du potentiel DC induites par l'anesthésie 17 3.4 Paramètres associés aux variations du potentiel DC 20 3.5 Enregistrements intracorticaux du potentiel DC 21 3.6 Enregistrements intraneuronaux et intragliaux 22
4 Discussion 26 5 Conclusion 32 6 Figures 35 Bibliographie 44
Liste des figures
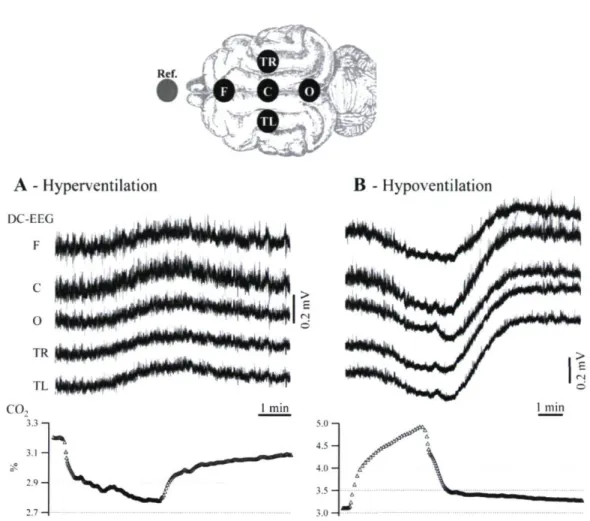
Figure 1 : Schéma du positionnement des électrodes sur le scalp et exemples des variations du potentiel DC induites par 1'hyperventilation (A) et 1'hypoventilation (B) chez le chat
anesthésie à la kétamine-xylazine 35 Figure 2: Enregistrement DC-EEG des variations lentes du potentiel DC lors de la rupture
de la barrière hémato-encéphalique (BHE) 36 Figure 3: Déviation lente du potential DC de l'EEG par suite de l'injection unilatérale de
thiopental dans l'artère carotidienne gauche 37 Figure 4: Inversion de polarité des variations lentes du potentiel DC secondaires à
1'hypoventilation, par suite d'un accroissement de profondeur de l'anesthésie menant à
l'état de burst-suppression du tracé électroencéphalographique 38 Figure 5: Absence de renversement de polarité des variations lentes du potentiel DC de part
et d'autre ainsi qu'à l'intérieur du cortex cérébral 40 Figure 6: Enregistrements DC-EEG et intraneuronal simultanés lors d'une manœuvre
d'hypoventilation associée à un status epilepticus chez le chat anesthésie à la
kétamine-xylazine 41 Figure 7: Absence de variation du potentiel membranaire glial pendant 1'hyperventilation
Liste des abréviations
AC Courant alternatif Ag Argent
BHE Barrière hémato-encéphalique Cl Chlore
co
2 Dioxyde de carbone DC Courant direct DHC Dehydrocholate EEG Électroencéphalogramme Hg Mercure HV Hyperventilation hv Hypoventilation Hz Hertz i.m. Intramusculaire i.v. Intraveineuse LCR Liquide céphalorachidien mV Millivolt M Molaire MQ Mégaohm n NombrepC02 Pression partielle de CO2
pH Potentiel Hydrogène Ref. Référence
SAL Salin
S.C. Sous-cutanée
SNC Système nerveux central Vm Potentiel de membrane
1 Introduction
C'est dans l'étude approfondie des détails que l'on surprend les secrets de la nature, et c'est à ceux qui ont le courage de tout entreprendre qu'il est permis de croire que l'on peut tout expliquer.
Félix VICQ D'AZYR
Le cerveau. Sentinelle bona fide de l'homéostasie, l'étendue de ses capacités ébahit. Les penseurs l'ont, jadis, considéré comme Y aima mater du cogito, l'écrin organique de l'âme; bon nombre de scientifiques l'ont pourtant statué à l'échelon de supercalculateur. Or, entre les courants métaphysiques du psyché et la complexité des connexions physionomiques, baigne un univers biologique qui reste encore à être démystifié.
Les fondations de l'étude des ondes cérébrales ont été érigées par l'allemand Hans Berger en 1929. Ses enregistrements de l'activité électrique du cerveau humain ont permis d'établir les premières descriptions des ondes observées lors de l'électroencéphalogramme (EEG) pendant l'état d'éveil (c.-à-d. les ondes alpha et bêta). Le concept du sommeil, comme condition discernable du cerveau, émane des expériences de Bremer (1935, 1936). Son expérience du cerveau isolé (sectionnement du mésencéphale derrière l'origine des nerfs oculaires) a mis en évidence la morphologie du sommeil profond tandis que son expérience de / 'encéphale isolé (sectionnement dans la partie inférieure du bulbe rachidien) a montré l'alternance de l'état de veille avec l'état de sommeil. Cette avancée scientifique a permis la découverte des ondes delta et des complexes-K durant le sommeil (Davis et coll., 1937). Or, depuis Adrian et Matthews (1934), les neuroscientifiques utilisaient les termes
d'ondes amples et d'ondes lentes pour décrire l'activité du cortex lors du sommeil; malgré l'absence de justifications scientifiques.
Dès cette époque, les états de vigilance (éveil-sommeil) furent considérés comme étant sous l'égide du système nerveux central (SNC). L'EEG devient alors un examen de routine dans l'étude du cerveau. Avec l'avènement des nouvelles technologies, nous sommes dorénavant à la recherche des prémices cellulaires des courants électriques cérébraux. Le neurone est au centre d'une myriade de modèles traitant de la physiologie du système nerveux. Nonobstant son rôle prépondérant en ce qui à trait au traitement et à la transmission des messages et informations en provenance de notre environnement, ce dernier n'est pas la seule lignée cellulaire connue au sein du cerveau, et ceux depuis 1859 grâce à la découverte des cellules gliales (du grec gloios = glu, c.-à-d. colle), par Rudolph Virchow.
1.1 Problématique concernant l'origine des signaux de l'EEG
Plusieurs questions se posent. Est-ce que les signaux de l'EEG sont le résultat d'une synchronisation ou est-ce simplement le fruit de la sommation de multiples générateurs indépendants de courants électriques, et ce, dans la mesure où ces deux hypothèses sont tout à fait plausibles (Elul, 1971)? Tenons en exemple le phénomène du battement fréquentiel (aussi connu sous le nom du « beat frequency phenomenon »). L'interaction de deux fréquences adjacentes, quoique distinctes l'une de l'autre, peut mener à une oscillation dont la fréquence égalerait la moyenne des deux fréquences initiales et dont l'amplitude serait modulée par une fréquence plus basse correspondante à la moitié de la différence entre les deux fréquences originelles. Ce modèle pourrait vraisemblablement s'appliquer aux communications neurone-glies.De plus, depuis Berger, l'amplificateur de l'EEG enregistre uniquement les signaux en courant alternatif (AC). Cette méthode discrimine les signaux DC et les autres composantes lentes du signal d'une part, et d'autre part, provoque une distorsion du signal enregistré. Récemment, des enregistrements DC (Vanhatalo et coll., 2002) ont démontré que certains éléments de l'activité électrique cérébrale demeurent encore nébuleux.
Les théories conventionnelles en électroencéphalographie considèrent que la majeure partie de l'activité électrique enregistrée sur le scalp est générée par des circuits neuronaux, grâce notamment à la production de dipôles corticaux (Daly et Pedley 1990; Niedermeyer et Lopes da Silva 1999). Plusieurs études ont également démontré l'implication des cellules
gliales dans la genèse des potentiels lents et locaux de champ, lors de la propagation corticale de l'onde de spreading depression (Somjen 1973; Somjen et Trachtenberg 1979), au cours des crises épileptiques (Amzica et Steriade 2000; Caspers et coll. 1987; Heinemann et Walz 1998; Somjen 1973) et durant le sommeil (Amzica et Neckelmann
1999). Nonobstant ces conceptions traditionnelles, des études avant-gardistes datant du début des années mille neuf cent cinquante et soixante-dix ont suggéré que les variations lentes du potentiel de l'EEG en DC étaient générées à l'interface entre le liquide céphalorachidien (LCR) et le sang, en fonction de la pression partielle du CO2 (PCO2) (Held et coll. 1964; Hornbein et Sorensen 1972; Kjàllquist et Siesjô 1968; Sorensen et Severinghaus 1970; Tschirgi et Taylor 1958). Il a été proposé que ces changements de potentiel prennent leur source à travers la barrière hémato-encéphalique (Revest et coll. 1993; Woody et coll. 1970). Malgré ces nombreux travaux, les variations du potentiel DC liées au CO2 sont encore fréquemment attribuées aux dipôles le long des dendrites apicales des neurones corticaux (Speckmann et Elger 1999). Par ailleurs, les innovations techniques autorisent dorénavant l'enregistrement systématique et intégral de l'EEG en courant direct chez l'humain (Vanhatalo et coll. 2002; Vanhatalo et coll. 2003), ce qui devrait permettre de déterminer les contributions relatives des mécanismes neuronaux et gliaux par rapport aux mécanismes non neuronaux (interface sang-LCR) dans la genèse des variations lentes de l'EEG. Une étude récente (Voipio et coll. 2003) a proposé un modèle électrophysiologique axé sur le rôle de la barrière hémato-encéphalique. Ce modèle rend compte des divers aspects mécanistiques entourant l'élaboration des potentiels DC résultants de manœuvres ventilatoires d'hyper- et d'hypoventilation.
1.2 Objectif général
Dans ce contexte, nous avons donc pour objectif principal d'examiner un large éventail d'éléments pouvant être impliqués dans la genèse des variations du potentiel DC de l'EEG reliées au CO2. Pour y parvenir, nous avons tout d'abord élaboré un protocole méthodologique facilement reproductible de cycle ventilatoire (c.-à-d. manœuvres
1.3 Hypothèses sur l'origine des variations du potentiel DC de
l'EEG liées au C0
2En supposant que ces variations lentes soient générées à travers la barrière hémato-encéphalique, nous avons testé l'hypothèse voulant qu'elles soient bloquées par la rupture de cette barrière. Par contre, si les déviations du signal DC proviennent du fonctionnement des circuits corticaux neuronaux et/ou gliaux, on s'attendra à ce que les potentiels membranaires des neurones et/ou des glies présentent pour leur part des variations correspondantes. De plus, un générateur dendritique de ces ondes devrait susciter une distribution laminaire corticale similaire à celle résultant d'une activité neuronale synchronisée telle que dans les potentiels évoqués (Freeman et Nicholson 1975; Mitzdorf et Singer 1979) ou dans les complexes K du sommeil (Amzica et Steriade 1998).
Les résultats de la présente étude, incluant des enregistrements intracellulaires et extracellulaires, supportent l'hypothèse voulant que les variations du potentiel DC induites par le CO2 soient attribuables à des générateurs non neuronaux.
2 Méthodologie
Ce protocole expérimental a été conçu conformément aux lignes directrices du National Institutes of Health (NIH) et approuvé par le comité d'éthique sur la recherche animale de l'Université Laval.
2.1 Préparation du chat in vivo
Des expériences aigties ont été effectuées sur 43 chats adultes des deux sexes, anesthésies profondément par voie intramusculaire avec un mélange de kétamine et de xylazine
(10-15 mg/kg et 2-3 mg/kg, respectivement, i.m.). L'anesthésie a été surveillée en continu et contrôlée via l'EEG, le rythme cardiaque ainsi que la concentration de CO2 expiré par l'animal. Au début de chaque expérience, une dose standard de 0.22 ml/kg de kétamine-xylazine est injectée. Ce type d'anesthésie produit un sommeil stable et profond tel qu'on le constate sur l'EEG. Durant le déroulement de l'expérience, des doses supplémentaires (0.3 ml, i.m.) sont administrées lors du moindre signe d'activation de l'EEG ou advenant une accélération du pouls (> 110 battements/min). Les procédures chirurgicales générales incluaient : la canulation d'une veine céphalique pour l'administration systémique de soluté et d'agents pharmacologiques; l'infiltration de tous les points de pression et de toutes les lignes d'incision avec de la lidocaïne (solution de 2 %, sans epinephrine, 0.5-1 ml, s.c); la paralysie des muscles squelettiques grâce à l'administration de gallamine triethiodide (0.2 g/10 ml, i.v.) à toutes les quatre heures; une trachéotomie aux fins de la ventilation assistée. Ce dernier procédé a permis d'oxygéner les animaux avec de l'air ambiant durant
toute la durée des expériences. La température de la peau située à proximité des électrodes sur le scalp a été enregistrée au moyen d'un thermocouple de cuivre-constantan. La température du chat a été maintenue entre 37-39 °C à l'aide d'une couverture chauffante. Une faible quantité (10 ml) d'une solution glucosée a été administrée à toutes les 3^. h sur toute la durée des expériences. Quelques chats (n = 10) ont aussi subi une canulation d'une artère carotidienne pour l'injection directe d'agents pharmacologiques dans le réseau vasculaire du cerveau. La tête de l'animal a été immobilisée dans un cadre stéréotaxique avec fixation à la hauteur des oreilles, des arcades zygomatiques et du palais.
Chez 18 chats, une craniotomie a été pratiquée afin d'exposer le cortex cérébral et notamment le gyrus suprasylvien en vue d'enregistrements intracellulaires et extracellulaires avec des micropipettes de verre. Dans cette préparation, la stabilité des enregistrements intracellulaires a été améliorée par drainage du liquide céphalorachidien via une ouverture de la cisterna magna, la suspension de la région lombaire de l'animal, l'induction d'un pneumothorax bilatéral et le remplissage du trou de trépan avec une solution 4 % d'agar. Au cours de certaines expériences (n = 6), les variations de pression intracrânienne ont été mesurées en insérant dans la cisterna magna une aiguille connectée à une colonne verticale graduée de LCR. Toutes les précautions ont été prises afin d'éviter l'évacuation de LCR autour du point d'insertion, afin de maintenir intacte la pression du compartiment sous-arachnoïdien.
À la toute fin des manipulations, les chats ont reçu une dose létale i.v. de pentobarbital sodique (50 mg/kg).
2.2 Électrodes et enregistrements 2.2.1 Enregistrement de l'EEG en DC
Les enregistrements EEG ont été effectués à l'aide d'amplificateurs DC (munis d'une stabilité à long terme supérieure à lpV/h et avec une largeur de bande passante de DC-300Hz (AM Systems). Nous avons utilisé des électrodes chlorées Ag/AgCl (E220N-LP, In Vivo Metric, Ukiah, CA) munies d'une surface active de 12 mm2. Ces surfaces actives ont
été placées sur un support au-dessus de la peau (environ 6 mm) afin de créer un espace clos rempli d'un gel conducteur (Berner, Helsinki, Finlande). Afin de court-circuiter les potentiels produits à travers la peau qui pourraient contaminer le signal, une incision a été pratiquée sous les électrodes. Ces mesures ont assuré la stabilité du signal DC (Vanhatalo et coll., 2002).
Cinq à sept électrodes DC ont été placées sur le scalp (configuration à cinq électrodes en Fig. 1) : sur la ligne médiane, une frontale (F), une centrale (C), et une occipitale (O), et symétriquement de chaque côté de ligne médiane, deux électrodes temporales (TL, TR) et deux électrodes mastoïdiennes (ML, MR).
Les potentiels périduraux et osseux ont été enregistrés avec des électrodes d'Ag/AgCl en forme de sphère, tandis que les potentiels intraparenchymateux ont été enregistrés au moyen de microélectrodes de verre (impédance 1-10 MQ).
10
2.2.2 Enregistrements intracellulaires
Les enregistrements intracellulaires des neurones et des glies dans le cortex cérébral (les aires 5 et 7 du gyrus suprasylvien) ont été obtenus à l'aide de micropipettes de verre (diamètre de la pointe < 0.5 pm) remplies d'acétate de potassium (3M; impédance in situ entre 35 et 50 MQ). Dans le cas des empalements neuronaux, seulement les enregistrements stables caractérisés par des potentiels membranaires de repos inférieurs à -60 mV, des potentiels d'action qui atteignent au moins + 10 mV, ainsi que des résistances d'entrée > 20 MD., ont été retenus aux fins d'analyse. Dans le cas des enregistrements intragliaux, ils devaient afficher un potentiel membranaire stable inférieur à -70 mV, et ce, sans aucune compensation de courant durant l'ensemble de l'enregistrement. Aucun potentiel d'action ne devait être enregistré lors de l'empalement ou de la sortie de la glie, ni même lors de l'administration de courants intracellulaires dépolarisateurs amenant le potentiel membranaire à une valeur proche de -55 mV. Seules les cellules gliales enregistrées au sein de la matière grise (c.-à-d. entre la surface corticale et une profondeur de 1.5 mm) ont été considérées pour cette étude.
Sachant que les manœuvres respiratoires produisent des variations significatives du volume du cerveau (voir Résultats), des précautions particulières ont dû être prises pour maintenir la stabilité des empalements intracellulaires. Par exemple, sachant que 1'hypoventilation est associée à une expansion du cerveau dans la boîte crânienne, il était important de boucher l'ouverture effectuée dans la calotte crânienne avec une solution d'agar. Cette solution a été
11
appliquée une fois les pipettes intracellulaires et extracellulaires mises en place, bien avant le début de l'hypoventilation. Par opposition, l'hyperventilation induit un rétrécissement du cerveau dans la boîte crânienne, ce qui explique le moindre nombre d'enregistrements intracellulaires stables obtenu durant de telles manoeuvres. Les signaux intracellulaires ont été passés à travers un amplificateur à haute impédance muni d'un circuit de ponts actifs (largeur de bande passante DC à 9 kHz). Tous les signaux ont été numérisés (fréquence d'échantillonnage de 20 kHz) et sauvegardés pour analyse subséquente.
2.2.3 Électrodes de référence
Pour tous les types d'enregistrements, une électrode de référence (Ag/AgCl avec mise à terre) a été placée sur le nasium ou dans l'un des muscles temporaux. Des résultats similaires ont été obtenus dans les deux cas. La référence au nasium a été utilisée pendant les enregistrements EEG ainsi que plusieurs enregistrements intracérébraux, alors que la référence musculaire a été principalement utilisée pour les enregistrements intracellulaires.
2.3 Induction des variations lentes du potentiel DC de l'EEG
Tout d'abord, les variations lentes du potentiel DC ont été induites par des fluctuations contrôlées du cycle ventilatoire de l'animal. Ces changements de fréquence respiratoire agissent sur les valeurs de pH différentielles à travers la barrière hémato-encéphalique, en raison des différences dans les divers systèmes de tamponnage du pH et leurs volumes (Voipio 1998). Elles se reflètent par la concentration de CO2 dans l'air expiré. L'abolition
12
des mécanismes régulateurs du rythme respiratoire par la ventilation artificielle assure que la variation du pH dépende uniquement de la fréquence respiratoire imposée par la pompe mécanique. La fréquence respiratoire au repos a été ajustée en fonction du poids du chat entre 20 et 28 cycles/min afin de maintenir un pourcentage de CO2 présent dans l'air expiré entre 3 et 3.7 %. L'hyperventilation a été provoquée en accélérant la fréquence respiratoire jusqu'à un maximum de 40 cycles/min, tandis que l'hypoventilation a été atteinte avec des
fréquences respiratoires aussi basses que 10 cycles/min.
De plus, d'autres variations lentes du potentiel DC de l'EEG ont été induites par injection de thiopental dans l'artère carotidienne, et ce, à diverses concentrations (2, 4, 8, 16, 32, et 64 mg/kg dissous dans 1 ml de solution saline à 0.9 %) afin d'étudier la relation entre la réponse DC et la dose de barbituriques administrée. Une rupture de la barrière hémato-encéphalique a été induite par l'administration intracarotidienne d'une solution à 17.5 % de dehydrocholate de sodium (3 ml) selon Spigelman et coll. (1983), ou encore de mannitol (0.5 g/kg), selon Pappius et coll. (1979).
2.4 Analyse
Dans cette étude, la plupart des constantes de temps des variations du potentiel DC de l'EEG étaient de l'ordre de plusieurs dizaines de secondes. Ainsi, nous avons occasionnellement utilisé un échantillonnage fragmenté à 0.3 Hz, après avoir supprimé de l'ensemble des tracés toute déviation non associée à la procédure expérimentale. Dans une telle série chronologique, chaque nouvel échantillon d'EEG représente la valeur moyenne
13 du voltage calculé sur une période de 3.3 secondes (entre l'échantillon précédent et actuel). Le sous-échantillonnage des signaux d'EEG a servi au marquage des temps de début/fin des variations lentes du potentiel DC. Le début d'une variation du potentiel DC de l'EEG a été déterminé comme étant le point à partir duquel le signal d'EEG de base a dévié de plus d'une déviation standard par rapport à son bruit de fond.
3 Résultats
En menant cette étude, nous avons cherché à mieux comprendre les mécanismes qui sous-tendent l'apparition des variations lentes du potentiel DC de l'EEG associées à l'hypo/hypercapnie. Pour ce faire, nous avons d'abord élaboré un protocole fiable et reproductible permettant d'induire de telles variations du potentiel DC de l'EEG. Ensuite, nous avons observé les événements EEG et les activités cellulaires (neuronales ou non) survenant lors de la modulation de ces réponses. Notre design expérimental a donc débuté par l'évaluation des variations du potentiel DC enregistrées sur le scalp (sans compromettre l'intégrité du crâne), avant d'aborder celle des composantes cellulaires du parenchyme cérébral, et de la barrière hémato-encéphalique.
3.1 Les variations du potentiel DC de l'EEG provoquées par les manœuvres respiratoires.
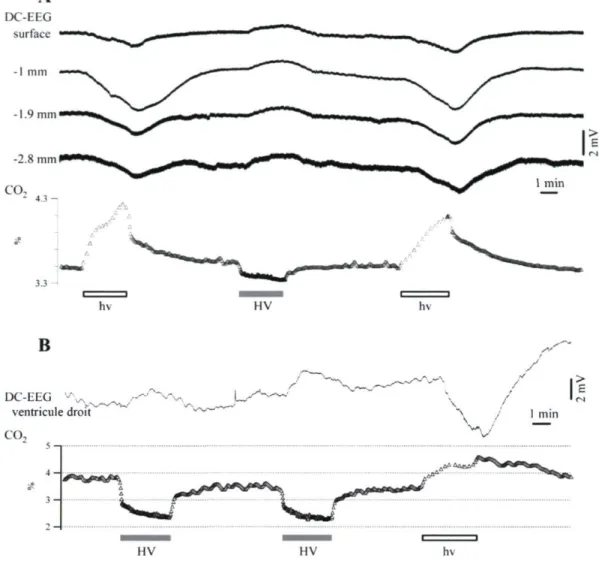
Dans le but d'obtenir un patron constant et aisément reproductible de variations du potentiel DC (Somjen 1973; Tschirgi et Taylor 1958; Woody et coll. 1970), nous avons procédé à l'hyperventilation ainsi qu'à l'hypoventilation chez le chat anesthésie. Ces manœuvres respiratoires ont mené à des variations du CO2 expiré qui correspondent respectivement à l'hypocapnie et l'hypercapnie. Sur l'ensemble des chats testés (n = 25), l'EEG enregistré sur le scalp a montré des déviations positives du potentiel DC suivant l'hypocapnie (Fig. IA) et des déviations négatives suivant l'hypercapnie (Fig. \B). Habituellement, la fréquence respiratoire était modifiée pendant 3 minutes, après quoi, la fréquence initiale
15 était rétablie. Chaque animal était soumis à au moins 3 cycles d'un tel paradigme respiratoire. Conformément aux résultats d'une étude antérieure (Voipio et coll. 2003), les réponses étaient remarquablement constantes chez un même animal. L'arrière-plan de l'activité électrique du cerveau était dominé par le patron imposé par l'anesthésie générale induite par la kétamine-xylazine. Ce patron électroencéphalographique consistait en des ondes lentes d'une fréquence d'environ 1 Hz (voir encadrés en Fig. 4) (Amzica et Steriade
1995; Steriade et coll. 1996). Ce rythme d'arrière-plan a été occasionnellement et transitoirement perturbé durant les manœuvres respiratoires : l'hyperventilation augmentait l'activité lente (principalement 1-4 Hz), tandis que l'hypoventilation réduisait ces composantes lentes et accroissait la valeur des rythmes plus rapides (autour d'environ 15-40 Hz).
Le délai initial ainsi que les variations relatives des réponses (voir Méthodologie) ont été évalués chez 25 chats, chez lesquels une séquence respective d'hyper et d'hypoventilation avait été réalisée. Tant les variations du potentiel DC induites par l'hyperventilation que celles produites par l'hypoventilation ont débuté environ 50 s après l'initiation de la manœuvre respiratoire [49.83 ± 6.68 s (moyenne ± déviation standard) pour l'hyperventilation, 52.76 ± 7.12 s pour l'hypoventilation, sans aucune différence statistique (test T pour séries appariées) entre les deux séries de latences]. Les variations du potentiel DC liées à l'hyperventilation et à l'hypoventilation étaient monophasiques et étroitement liées à la pCÛ2. De plus, ces dernières ont démontré un retour vers leurs valeurs de contrôle à la suite du rétablissement de la fréquence respiratoire à sa valeur initiale. Les déviations positives du potentiel DC induites par l'hyperventilation affichaient une amplitude
16 moyenne de 307.8 ± 100.8 [iV/%, tandis que les déviations négatives du potentiel DC induites par hypoventilation montraient une pente moyenne de -284.4 ± 120.6 ^V/%. En convertissant le pourcentage de CO2 en pCÛ2 (mmHg), les variations moyennes des déviations du potentiel DC pour l'hyperventilation et l'hypoventilation ont été chiffrées à 41.6[iV/mmHg et -38.4 uV/mmHg respectivement, et ce, conformément aux pentes calculées chez les sujets humains (Voipio et coll. 2003).
Occasionnellement, un surdépassement du potentiel DC a fait suite à l'arrêt de la manœuvre respiratoire. (Fig. IB) Ce phénomène était probablement attribuable au retour rapide du CO2 à des valeurs de contrôle à la suite d'une période d'hypoventilation relativement prolongée durant laquelle de nouvelles dynamiques homéostatiques avaient été établies.
3.2 La rupture de la barrière hémato-encéphalique prévient les variations du potentiel DC liées au CO2.
Suivant la thèse de Woody et coll. (1970), voulant que les variations lentes du potentiel DC de l'EEG liées au C02 représentent des changements de potentiels en provenance de la
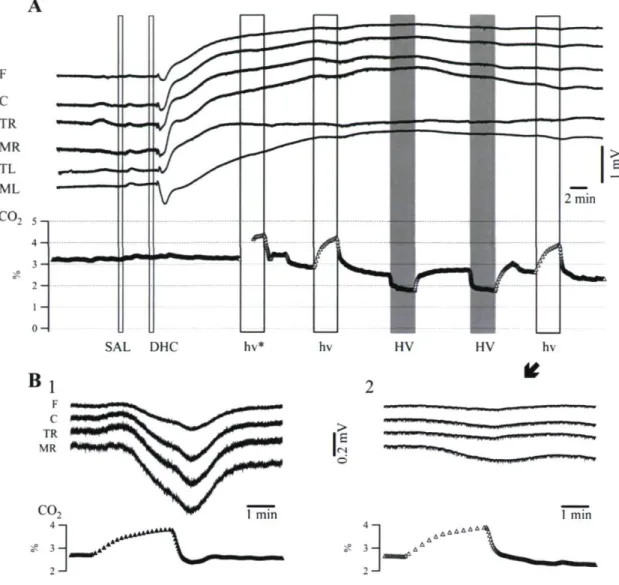
barrière-hémato-encéphalique (voir aussi, Voipio et coll. 2003; Woody et coll. 1970), et conformément au modèle moderne proposé (Voipio et coll. 2003), nous avons voulu savoir si une rupture de la barrière hémato-encéphalique entraînerait des variations du potentiel DC et/ou affecterait les déviations du potentiel DC provoquées par la ventilation. À cette fin, des injections intracarotidiennes de dehydrocholate de sodium ont été pratiquées (Spigelman et coll. 1983). Lors de chacune de ces expériences (n = 5), une déviation positive persistante du potentiel DC a été observée. (Fig. TA) L'injection d'un volume
17
identique d'une solution de salin physiologique (SAL, Fig. TA) n'a provoqué aucune déviation notable du potentiel DC à l'EEG.
La rupture de la barrière hémato-encéphalique a drastiquement fait chuter les déviations du potentiel DC consécutives aux manœuvres respiratoires (comparez les réponses obtenues lors d'une séquence de contrôle en Fig. 2B1 avec la dernière hypoventilation agrandie en Fig. 2B2). L'amplitude moyenne des déviations du potentiel DC a été de : 1.08 (xV/% pour l'hyperventilation et -1.26 \iWI% pour l'hypoventilation (n = 35 cycles de manœuvres respiratoires). Par conséquent, l'amplitude des variations du potentiel DC provoquées respectivement par hyper-/hypoventilation a été réduite de plus de 99 % par suite de l'administration du dehydrocholate. Des résultats similaires ont été obtenus à la suite d'injections intracarotidiennes de mannitol (0.5 g/kg), un autre agent qui ouvre la barrière hémato-encéphalique (non montré).
3.3 Variations du potentiel DC induites par l'anesthésie.
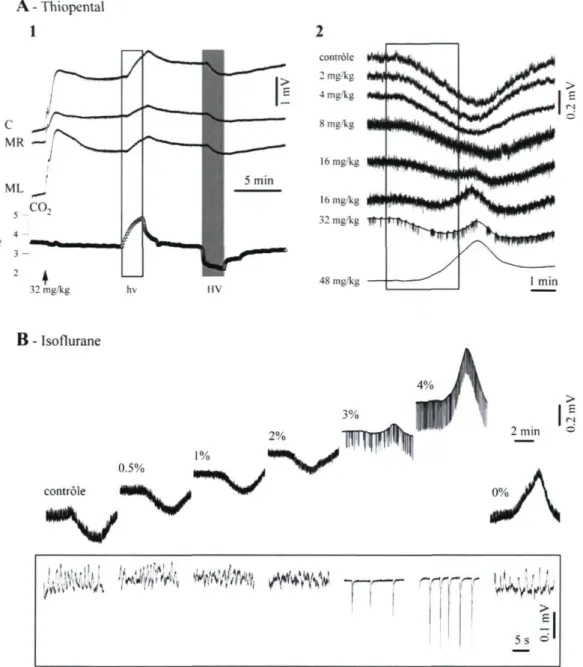
L'injection carotidienne unilatérale d'un barbiturique à action rapide (thiopental de sodium) a induit dans tous les cas (n = 5 chats), des déviations positives marquées par une amplitude plus élevée du côté ipsilatéral à l'injection, de même que dans les dérivations centrales du signal EEG (Fig. 3A). Ces déviations du potentiel DC étaient indépendantes des variations occasionnelles du CO2 expiré. De plus, des doses élevées de thiopental (> 24 mg/kg) ont aussi provoqué un changement de l'EEG, où le patron oscillatoire lent propre à l'anesthésie sous kétamine-xylazine (Fig. 3A, détaillé au panneau 1) a été remplacé par un état de
burst-18 suppression du tracé électroencéphalographique (panneau 2. Fig. 3A); traduisant une altération certaine de l'activité neuronale. L'état de burst-suppression du tracé électroencéphalographique a perduré lors de l'induction des déviations du potentiel DC, suggérant que les deux phénomènes soient le reflet de mécanismes différents (voir Discussion). Quant à l'amplitude des variations du potentiel DC, elle était dépendante de la dose de thiopental injectée. Cet agent pharmacologique a montré un effet cumulatif lorsqu'administré à des intervalles rapprochés (< 5 min; Fig. 3B). De petites doses de thiopental (< 8 mg/kg) ont provoqué des déviations du potentiel DC d'amplitude relativement peu élevée, tandis que des quantités supérieures (> 16 mg/kg) ont provoqué changement de plus grande amplitude. Qui plus est, une seconde injection de 32 mg/kg de thiopental a provoqué une déviation du potentiel DC plus élevée qu'une première injection à la même concentration.
Parmi les chats ayant reçu plusieurs injections de thiopental (n = 5), nous avons observé que les manœuvres respiratoires étaient suivies par des déviations de polarité inversée du potentiel DC (Fig. AAI). Lors d'expériences en succession (Fig. 4A2), une hypoventilation a été instaurée après chaque dose croissante de thiopental. La pente de la déviation négative du potentiel DC a diminué progressivement avec l'ajout de doses supplémentaires de barbituriques, et une très faible composante positive est apparue à 16 mg/kg de thiopental, initialement superposée à une déviation négative continue du potentiel DC de faible amplitude. À des doses élevées d'anesthésique (48 mg/kg) pendant de longues périodes en état de burst-suppression, les déviations du potentiel DC ont toujours été des réponses positives à l'hypoventilation (n = 5 chats). Malgré la suppression des composantes de haute
19 fréquence du signal d'EEG, la fréquence cardiaque et la concentration de CO2 sont demeurées à l'intérieur des limites de la normale. Des résultats similaires de polarité inversée ont été obtenus durant les manœuvres d'hyperventilation (non montré).
De cette série de résultats émerge le questionnement suivant : les changements observés étaient-ils fonction de à l'agent utilisé (thiopental) ou de la profondeur de l'anesthésie? Le thiopental est connu pour produire une vasoconstriction, réduisant ainsi la circulation sanguine cérébrale (Sakabe et Nakakimura 1994). Afin de discriminer entre une baisse de la circulation sanguine par rapport à d'autres mécanismes putatifs, nous avons répété le même protocole sur 5 animaux en remplaçant le thiopental par un agent volatil (l'isoflurane) (Fig. 4B). Ceci présentait l'avantage de permettre l'application de manœuvres réversibles plus rapidement et produisant par ailleurs une vasodilatation cérébrale (Sakabe et Nakakimura 1994). Des doses croissantes d'isoflurane ont été accompagnées de déviations positives soutenues du potentiel DC (voir la valeur du potentiel DC initial avant l'hypoventilation dans chaque tracé en Fig. 4B). Des manœuvres successives d'hypoventilation ont initialement provoqué des déviations négatives du potentiel DC caractérisées par des amplitudes progressivement décroissantes. Par la suite, à une concentration s'élevant entre 2 % et 3 % d'isoflurane, à laquelle un EEG typique de l'état de burst-suppression du tracé électroencéphalographique est associé, une composante positive a été observée dans la réponse induite par l'hypoventilation. Des augmentations additionnelles de la dose anesthésique ont été associées à des déviations du potentiel DC exclusivement positives, lesquelles ont persisté par suite de l'arrêt de l'isoflurane et du rétablissement d'un patron électroencéphalographique comparable au témoin (dernier panneau à droite en Fig. 4B).
20
3.4 Paramètres associés aux variations du potentiel DC.
Compte tenu de ce qui précède, il est clair que les variations du potentiel DC s'accompagnaient de changements de certains paramètres de la circulation sanguine, (ex. flux sanguin cérébral, pH), connus pour leurs fonctions régulatrices sur l'activité cérébrale. La pression intracrânienne était un des facteurs touchés par les manœuvres respiratoires. Les variations de pression intracrânienne survenant dans les présentes conditions d'expérience ont été mesurées à l'aide d'un cathéter rempli de liquide céphalorachidien artificiel introduit dans l'espace sous-dural de la cisterna magna. Des précautions ont été prises pour ne pas modifier la pression intracrânienne en exposant une infime surface de la dure-mère atlanto-occipital et en prenant soin d'éviter tout écoulement de liquide autour de l'aiguille. Chez quatre chats, l'hyperventilation a provoqué une diminution relativement minime de la pression intracrânienne (2.25 %). tandis que l'hypoventilation a causé une élévation prononcée de la pression intracrânienne, de l'ordre de 42.5 %.
Un mouvement du cerveau a pu être observé à travers la fenêtre craniotomique durant les manœuvres respiratoires. Ce déplacement a été mesuré via le système de microguidage portant la pipette tout en suivant de façon continuelle le signal électrique entre l'électrode d'enregistrement et la surface corticale. L'hyperventilation était invariablement associée (n > 100) à un affaissement de la surface corticale de l'ordre de 44 à 62 \im (en moyenne 53 ± 3 [xm; « = 25 épisodes sélectionnés) pour une réduction moyenne de la concentration de CO2 de 0.85 %. L'hypoventilation a provoqué une expansion du cerveau dans tous les cas
21 étudiés, avec un soulèvement du cortex de l'ordre de 2.3 ± 0.3 mm (1.6 à 2.7 mm, n = 25), pour une augmentation moyenne de la concentration de CO2 de 1.3 %.
3.5 Enregistrements intracorticaux du potentiel DC.
En raison des mouvements du cerveau résultant de l'hyperventilation et l'hypoventilation, certaines conditions ont dû être respectées pour obtenir des enregistrements stables du potentiel DC en intracortical.
a) Ces enregistrements ont été effectués uniquement après drainage du liquide céphalorachidien à partir de la cisterna magna.
b) Un bouchon d'agar a dû être placé sur le cortex au pourtour des électrodes.
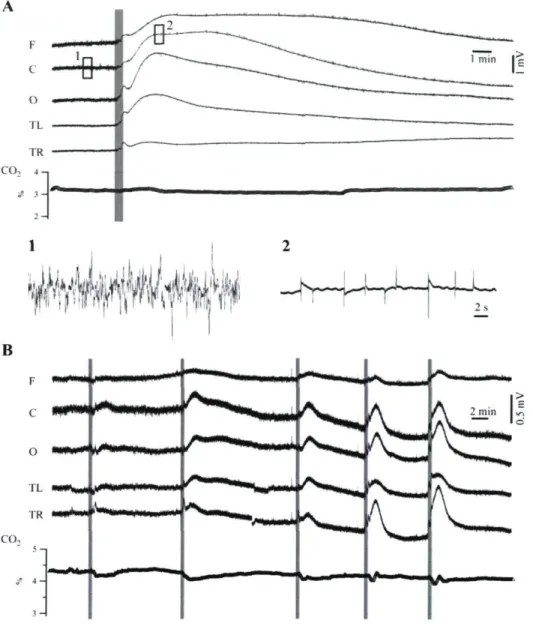
Les électrodes étaient un assemblage de quatre pipettes de verre, dont l'une touchait la surface du cortex, alors que les trois autres pénétraient à diverses profondeurs de la substance grise et de la substance blanche (Fig. 5/4). La polarité des variations du potentiel DC était la même, pour les enregistrements à partir du scalp et ceux de l'intérieur des ventricules latéraux (Fig. 55); aucune inversion de polarité n'a été notée (n = 12 chats). Le bouchon d'agar prévenait l'expansion du cerveau au site d'enregistrement lors des hypoventilations. Par contre, un rétrécissement du cerveau était encore possible lors de l'hyperventilation, de telle sorte que de faibles variations du CO2 expiré (environ 0.5 %) ont été imposées dans ces expériences, de façon à réduire la magnitude du déplacement du cerveau. Dans ces conditions, les enregistrements ont démontré que l'hyperventilation provoquait des déviations positives du potentiel DC à toutes les profondeurs du cortex cérébral. L'absence d'inversion de polarité aux différentes profondeurs réfute l'hypothèse
22
d'un potentiel générateur neuronal induisant les ondes EEG reliées aux manœuvres respiratoires.
3.6 Enregistrements intraneuronaux et intragliaux.
Afin d'explorer plus attentivement une possible contribution de générateurs dendritiques apicaux des cellules pyramidales aux réponses DC à la pC02, nous avons effectué des enregistrements intraneuronaux (n = 27). Toutefois, comme explicité ci-dessous, nous n'avons pas observé de changement de potentiel de membrane qui puisse expliquer les variations du potentiel DC. En raison de la faible amplitude des changements du potentiel DC induits par la ventilation à l'intérieur du parenchyme, lesquels se maintenaient à l'intérieur des intervalles usuels de l'activité des neurones et des glies, leur contribution aux potentiels enregistrés avec référence hors du cerveau était négligeable.
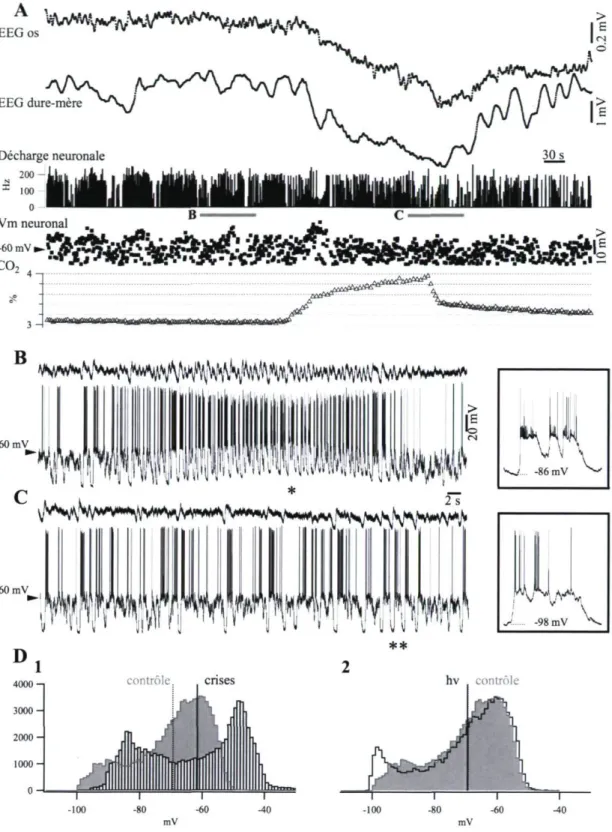
La séquence présentée à la Fig. 6 contient un enregistrement intraneuronal chez un chat qui présentait des crises de type « pointe-onde » spontanées et récurrentes (ceci à une fréquence d'environ une crise par minute). Ce type d'enregistrement présume une grande importance, car il est reconnu que les décharges épileptiques sont caractérisées par des variations de haute amplitude du potentiel de membrane reflétées par des déflexions prononcées de l'EEG. Le panneau A contient des séries chronologiques sous échantillonnés des signaux, permettant de discerner la tendance générale de leur évolution, (ce sous-échantillonnage ne dissimule cependant pas l'amplitude réelle des variations du potentiel DC enregistrées respectivement durant les crises épileptiques et les manœuvres d'hypoventilation) Le
sous-23 échantillonnage du potentiel de membrane intraneuronale a été effectué après soustraction des potentiels d'action. Le panneau indiquant la fréquence de décharge neuronale démontre le rythme impétueux des décharges des potentiels d'action et suggère les limites des crises successives (6 crises convulsives durant la première moitié de l'enregistrement). Le panneau du dessous illustrant le potentiel de membrane neuronal présente les valeurs de voltage échantillonnées selon la fréquence respiratoire. Elles révèlent l'amplitude maximale de dépolarisation atteinte durant les crises d'épilepsie. La période B, soulignée en gris, est agrandie au-dessous pour démontrer l'évolution complète et la qualité de l'enregistrement intraneuronal ainsi que de l'EEG durant une de ces crises. Les fragments plus détaillés en encadré à droite démontrent que les décharges épileptiques sont constituées de déviations de dépolarisation paroxystiques débutant lorsque le potentiel de membrane est plus dépolarisé que durant l'oscillation lente de contrôle, et atteignant des plateaux plus élevés que le seuil du potentiel d'action, inactivant ainsi la production de complexes pointe-onde. La superposition des histogrammes du potentiel de membrane en Fig. 6DJ montre une distribution bimodale des deux conditions (oscillation lente sans crises ni décharges épileptiques). En moyenne, le neurone était dépolarisé de -69.3 ± 12.9 mV durant la condition initiale, jusqu'à -61.5 ± 18.1 mV dans cette dernière condition.
La partie gauche de la Fig. 6A illustre comment les dépolarisations intracellulaires d'environ 10 mV sont associées à des variations électroencéphalographiques d'environ 1 mV en epidural, et dont la magnitude est moins élevée au sein des dérivations osseuses de l'EEG. L'hypoventilation provoque des déviations négatives du potentiel DC 4-5 fois plus amples que les potentiels DC produits durant les décharges paroxystiques. Toutefois,
24 aucune déviation du potentiel membranaire neuronal n'a été détectée (voir l'agrandissement détaillé en Fig. 6C et les histogrammes en Fig. 6D2). De plus, l'hypoventilation a temporairement empêché la survenue de nouvelles crises épileptiques.
La comparaison des distributions du potentiel de membrane des neurones pendant les périodes d'oscillation lente sans crises et les périodes équivalentes d'hypoventilation (Fig. 6D2) souligne le manque d'effet systématique de l'hypoventilation sur la polarité neuronale. Dans le cas présenté ici, l'oscillation lente était légèrement plus ample durant l'hypoventilation que dans la condition de contrôle, et ce, sans changement significatif de l'activité moyenne (-69.3 ± 12.9 mV vs -69.5 ± 14.9 mV). Dans l'ensemble des enregistrements intraneuronaux (n = 27), aucune différence statistique significative (test T : p < 0.05) n'a pu être détectée entre le potentiel de membrane moyen avant et pendant la manœuvre respiratoire. L'hyperpolarisation moyenne était de -1.3 ± 0.2 mV (dans un intervalle de -2.3 à + 0.4 mV; les dépolarisations et les hyperpolarisations ayant été enregistrées pour chaque neurone individuellement).
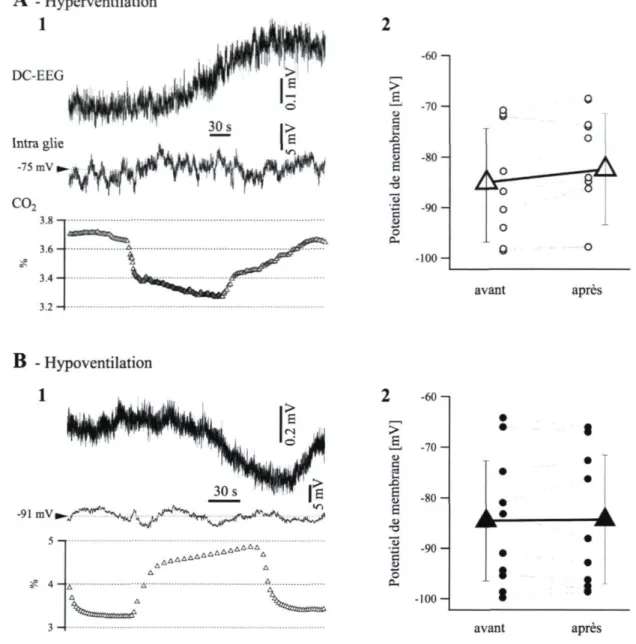
Les cellules gliales sont connues pour présenter des variations lentes de leur potentiel membranaire durant les crises épileptiques et lors de la propagation corticale des ondes de spreading depression. Or, des enregistrements fiables (n = 45) à l'intérieur de ces dernières cellules durant les manœuvres d'hyper-hypoventilation n'ont pas montré de variation significative du potentiel membranaire en relation avec les variations lentes CO2-dépendantes du potentiel DC de l'EEG (Fig. 7). Tant l'hyperventilation que l'hypoventilation ont provoqué une dépolarisation globale de la membrane gliale. Le
25
potentiel moyen des cellules gliales était de l'ordre de -84.6 ± 11.9 mV avant la manœuvre, et de -84.3 ± 12.8 mV durant les hypoventilation (n = 45 manœuvres), indiquant un changement minime du potentiel de membrane de l'ordre de 0.26 mV en moyenne dans un intervalle entre -4.8 mV et 4.8 mV. Les réponses induites par l'hyperventilation étaient associées à une dépolarisation globale moyenne de 2.7 mV (entre -9.2 et 2 mV; « = 31 manoeuvres), avec une moyenne de -85.1 ±11.7 mV, avant, et de -82.4 ± 11.0 mV durant l'hyperventilation. Dans le cas des deux manoeuvres respiratoires, les valeurs de potentiel de membrane des glies avant et après les manoeuvres respiratoires n'étaient pas statistiquement différentes les unes des autres (test T de Student pour séries appariées). De plus, sur une base individuelle, tant l'hyperpolarisation que la dépolarisation de la membrane ont été constatées lors des conditions d'hyperventilation et d'hypoventilation (Fig. 7A2 et 752).
Dans l'ensemble, aucun changement systématique du potentiel de membrane des neurones ou des glies n'a été observé en réponse à l'hyperventilation ou l'hypoventilation. Nous pouvons donc conclure que les variations du potentiel DC induites par les manœuvres respiratoires ne sont guère le reflet de variations correspondantes des potentiels membranaires neuronaux et gliaux.
4 Discussion
Cette étude suggère fortement que les variations lentes du potentiel DC enregistrées sur le scalp en réponse à l'hypo-/hypercapnie ne sont pas générées par les circuits neuronaux ou gliaux. Ceci peut sembler contraire à l'idéologie actuellement dominante voulant que le rôle de générateur de potentiel DC appartienne quasi exclusivement aux neurones corticaux et leurs ramifications dendritiques (Caspers et coll. 1984; Speckmann et Elger 1999). Notre conclusion s'appuie sur les données suivantes.
1) Les décharges épileptiques sont des événements paroxystiques durant lesquels les dépolarisations neuronales atteignent leur valeur maximale. Cependant, les composantes du potentiel DC associées aux décharges épileptiques sont de faible amplitude par rapport aux variations du potentiel DC induites par hyper-/hypoventilation.
2) Les variations du potentiel DC provoquées par la ventilation surviennent en l'absence de tout changement concomitant du potentiel de membrane neuronal (Fig. 6).
3) L'état de burst-suppression du tracé électroencéphalographique est un état durant lequel la capacité de réactivité neuronale est limitée (Steriade et coll. 1994). Par conséquent, il convient de noter que les variations du potentiel DC liées à la ventilation se retrouvaient durant les périodes de quiescence neuronale associées à l'anesthésie (Fig. 4).
4) Nonobstant que les cellules gliales puissent soutenir de très lents potentiels, et ce, particulièrement durant les crises d'épilepsie (Amzica et Neckelmann 1999; Caspers et coll. 1984; Heinemann et Walz 1998; Somjen 1973), nos résultats n'indiquent aucune variation du potentiel membranaire de la glie durant les variations du potentiel DC C02-dépendantes, excluant que ces dernières soient le reflet d'une quelconque activité gliale. Pareillement,
27
une étude antérieure (Carpenter et coll. 1974) avait démontré l'existence de fluctuations variables du potentiel de membrane glial en relation avec le pourcentage de CO2 expiré. Par ailleurs, les faibles variations du potentiel glial enregistrées durant l'hypo-/hyperventilation n'étaient pas toujours de même polarité, et ne pouvaient donc être à l'origine des variations du potentiel DC.
5) Nous n'avons jamais observé d'inversion de polarité des variations du potentiel DC lors des enregistrements intracorticaux effectués, puis de la surface corticale jusqu'à la substance blanche et aux structures profondes du cerveau (Fig. 5). Ce résultat confirme que les variations du potentiel DC ne sont pas tributaires du courant des dipôles corticaux générés en réponse à l'activité neuronale et/ou gliale.
Les cinq arguments qui précèdent vont à l'encontre de la possibilité que les variations du potentiel DC de l'EEG dépendantes du CO2 soient produites par des générateurs neuronaux ou gliaux. Il faut donc porter une attention particulière aux gradients de potentiel qui résident en permanence à travers les vaisseaux sanguins et la barrière hémato-encéphalique (Held et coll. 1964; Hornbein et Sorensen 1972; Revest et coll. 1993; Sorensen et coll. 1978; Tschirgi et Taylor 1958; Voipio et coll. 2003), dont la modulation par rapport aux variations du pH a été rapportée, à maintes reprises dans la littérature (Hornbein et Pavlin
1975; Sorensen et Severinghaus 1970; Voipio et coll. 2003; Woody et coll. 1970).
Notre principal modèle expérimental reposait principalement sur le contrôle de la fréquence respiratoire de l'animal anesthésie afin d'induire des variations du potentiel DC à l'EEG, et toutes nos données appuient l'hypothèse que la barrière hémato-encéphalique est le site
28 générationnel de ces variations du potentiel. Nous avons démontré tout particulièrement que la rupture de la barrière hémato-encéphalique produit une importante déviation de voltage, de polarité positive, et supprime les variations subséquentes du potentiel DC normalement observées lors des manœuvres d'hypo-/hyperventilation (Fig. 2). Chez l'humain, le potentiel de repos du liquide céphalorachidien est positif, et ce, par rapport à celui du sang (Sorensen et coll. 1978), mais la polarité des variations du potentiel DC consécutives à une rupture de la barrière hémato-encéphalique était précédemment inconnue. Chez le chat, la déviation positive du potentiel DC après rupture de la barrière hémato-encéphalique (laquelle suppose l'annulation de la polarisation de la barrière hémato-encéphalique) suggère une polarité négative au repos à l'interface sang-LCR. Ainsi, la polarité de la barrière hémato-encéphalique semble opposée chez l'humain et le chat. Ceci peut expliquer la polarité différente des variations du potentiel DC provoquées par la ventilation et observées dans certaines études ultérieures. Ainsi, dans l'étude de Voipio et coll. (2003) chez l'humain, l'hypoventilation était associée à des réponses principalement positives, alors que Woody et coll. (1970) et nous-mêmes avons observé des réponses négatives chez le chat. Voipio et coll. (2003) ont proposé que cette inconsistance apparente des variations du potentiel DC puisse être due aux divers emplacements électrodes d'enregistrement et de référence selon les études et les espèces.
Compte tenu de la durée de la déviation du potentiel DC observée lors de rupture de la barrière hémato-encéphalique (Fig. 2), la possibilité d'une propagation corticale de l'onde de spreading depression devait être considérée. Elle apparait peu vraisemblable, cependant, au regard des arguments suivants. Les déviations du potentiel DC débutent quasi
29 simultanément dans chacune des dérivations de l'EEG, ce qui n'avait jamais été le cas lors de dépolarisations corticales intracellulaires diffuses. Ce phénomène est connu pour se propager lentement (quelques mm/min selon Somjen 2001). De plus, malgré son amplitude moindre à la suite de la rupture de la barrière hémato-encéphalique, l'EEG affiche encore des signaux qui pourraient être attribuables à des activités phasiques des neurones et/ou des glies.
D'autre part, des variations du potentiel DC ont été induites par deux agents anesthésiques : le thiopental et l'isoflurane, et ce, proportionnellement à la dose administrée (Fig. 3 et 4). Ces deux agents anesthésiques n'ont pas d'effet connu sur la perméabilité de la barrière hémato-encéphalique. En revanche, ils sont connus pour réduire l'activité métabolique ainsi que le taux de consommation en oxygène du cerveau (Hall et Murdoch 1990; Hoffman et coll. 1998). On sait aussi que le thiopental peut provoquer une vasoconstriction artérielle (Tsuji et Chiba 1987), alors que l'isoflurane provoque une vasodilatation (Sakabe et Nakakimura 1994). Ainsi donc, les diminutions et augmentations respectives de la circulation sanguine cérébrale causées par ces agents peuvent être écartées comme facteur responsable de variations uniquement positives du potentiel DC. De plus, les variations du potentiel DC provoquées par les manœuvres respiratoires ont été affectées par la profondeur de l'anesthésie. À des doses faibles, les variations du potentiel DC montraient une diminution progressive, tandis qu'à des concentrations plus élevées, une composante de polarité opposée apparaissait parallèlement à la diminution probable du métabolisme cérébral durant l'état de burst-suppression du tracé EEG. De façon similaire, il est connu
30 que les dommages cérébraux secondaires à l'hypoxie et l'ischémie mènent pour leur part à des variations inversées du potentiel DC (Woody et coll. 1970).
Puisque les variations du potentiel DC reliées au CO2 résultent d'une polarisation de la barrière hémato-encéphalique, mais sans rupture apparente de l'intégrité de cette barrière, il se pourrait qu'une modification de l'homéostasie ionique entraîne une détérioration drastique de sa fonction métabolique avec un renversement du générateur de voltage à travers la barrière hémato-encéphalique, tel qu'observé durant l'ischémie (Gido et coll. 1994; Siesjô 1992a; Siesjô 1992b). Des études menées sur d'autres tissus épithéliaux serrés ont montré qu'un changement dans la différence de potentiel transepithelial pouvait refléter une altération du potentiel de la membrane apicale et/ou basolatéral des cellules épithéliales (Mustonen, 1998). Dans le cas de la barrière hémato-encéphalique, dont la polarisation peut être considérée comme le résultat de la connexion en série de deux potentiels de membrane, il est difficile de définir avec précision la nature et la localisation des mécanismes cellulaires qui pourraient être en cause lors des variations du potentiel DC associées à la ventilation.
Il est certain que les variations du potentiel DC liées au CO2 rapportées ici ne sont pas les seules sources de potentiel DC dans le cerveau. Comme démontré précédemment, d'autres phénomènes lents peuvent être générés à l'intérieur des circuits neuronaux et/ou gliaux, et ce, durant divers états tels comme la décharge épileptique (Amzica et Steriade 2000; Caspers et coll. 1987; Heinemann et Walz 1998; Somjen 1973) ou la propagation corticale de l'onde de spreading depression (Somjen 1973; Somjen et Trachtenberg 1979).
31 Néanmoins, des changements de pH au cours des crises d'épilepsie (Duffy et coll. 1975; Wang et Sonnenschein 1955) ainsi qu'au moment de la propagation corticale de l'onde de spreading depression (Somjen et Tombaugh 1998), rendant ainsi difficile l'évaluation de la contribution respective des neurones et des glies et celle du pH à la genèse des variations du potentiel DC.
5 Conclusion
Les variations du pH/C02 cérébral consécutives aux manœuvres ventilatoires induisent des variations persistantes du potentiel DC qui peuvent être enregistrées dans le tissu cérébral, mais sont aussi clairement observables à l'EEG.
Nous nous sommes donnés pour objectif d'examiner plusieurs éléments ayant une possible implication dans l'électrogenèse des variations du potentiel DC induites par des manœuvres respiratoires. De manière expérimentale, il a été démontré que les réactions pathologiques des neurones lors des crises épileptiques produisent des variations du potentiel DC de moindre amplitude (< 1 mV) et non similaires à celles induites par des manœuvres respiratoires (> 1 mV). De plus, des variations du potentiel DC ont pu être induites lorsque les neurones étaient inactifs, c.-à-d. en état de suppression de bouffées du tracé EEG. Finalement, aucun gradient électrique n'a été enregistré entre les diverses couches intracorticales du cerveau et aucun changement de potentiel de membrane neuronal n'a été observé, excluant ainsi l'hypothèse d'un générateur neuronal des variations du potentiel DC reliées à la ventilation.
Or, considérant leur rôle dans l'élaboration des potentiels locaux de champ lors du sommeil (Amzica et Neckelmann 1999) et des crises épileptiques (Amzica et Steriade 2000), les cellules gliales pouvaient être à l'origine des variations du potentiel DC de l'EEG liées à la ventilation. Advenant que ces variations soient induites par des circuits gliaux du cortex, nous pouvions anticiper que leurs potentiels membranaires subissent des variations
33 correspondantes aux diverses manœuvres respiratoires. Or, aucun changement du potentiel membranaire des cellules gliales n'a été enregistré lors de l'induction des variations du potentiel DC par hypo-/hyperventilation. Cela infirme la possibilité d'un générateur glial des variations lentes du potentiel DC de l'EEG.
Enfin, advenant l'élaboration des variations du potentiel DC à travers la barrière hémato-encéphalique, il est clair qu'une altération de l'intégrité de cette membrane provoquerait une absence de variations spécifiques aux manœuvres respiratoires, ce que nous avons démontré à la suite de l'injection de dehydrocholate.
Quant à l'action de la pCÛ2 sur la barrière hémato-encéphalique, il est clair qu'elle influence le pH du compartiment sanguin de l'interface sang-LCR. Ceci provoque un changement significatif de la différence de potentiel à travers la barrière hémato-encéphalique qui se reflète par des variations du potentiel DC dans l'EEG.
En somme, cette étude a permis de mettre en évidence, pour la première fois, des données concluantes chez l'animal, indiquant que l'activité électrique des cellules neuronales et gliales ne soit pas la source de ces variations du potentiel DC. Ce mémoire confirme le rôle clé qu'occupe la barrière hémato-encéphalique dans l'élaboration des variations du potentiel DC liées au PH/CO2.
Ce mémoire se dessine à être un jalon dans l'approfondissement de nos connaissances de l'EEG enregistré en DC, et ce, afin de permettre une meilleure compréhension des
34
mécanismes qui sous-tendent son élaboration et ses variations. D'autres études seraient nécessaires pour élucider la contribution relative et les interactions des générateurs neuronaux/gliaux et non neuronaux lors des variations du potentiel DC des enregistrements invasifs et non invasifs de l'activité cérébrale. Le lien étroit entre l'activité neuronale et les réponses hémodynamiques (Gjedde 2002) appelle à la prudence lors de l'interprétation mécanistique des signaux électroencéphalographiques lents reliés à plusieurs conditions particulières, incluant les tâches cognitives et les stades préparatoires aussi bien que l'activité cérébrale pathophysiologique (Vanhatalo et coll. 2003; Voipio et coll. 2003).
6 Figures
Réf. A - Hyperventilation DC-EEG o TR TL3> »»■*' www
CO, 1 min 3.3-3.1 B - HypoventilationFigure 1.Schéma du positionnement des électrodes sur le scalp et exemples des variations du potentiel DC induites par l'hyperventilation (A) et l'hypoventilation (B) chez le chat anesthésie à la kétamine-xylazine. Les variations de la concentration de CO2 dans l'air expiré sont indiquées sous les tracés EEG. Chaque manoeuvre d'hyperventilation a induit une déviation lente du potentiel DC positive tandis que chaque manœuvre d'hypoventilation a été associée à une déviation lente du potentiel DC négative. Dans cette figure ainsi que celles qui suivront, noter que la polarité des signaux d'EEG est positive. [F, frontal; C, central; O, occipital; TR, temporal droit; TL, temporal gauche]. Mentionnons ici que dans certaines expériences, nous avons enregistré en mastoïde droite [MR] et mastoïde gauche [ML].
36
Figure 2. A : Enregistrement DC-EEG des variations lentes du potentiel DC lors de la rupture de la barrière hémato-encéphalique. (BHE) Suite à une période de contrôle, 3 ml de solution saline (SAL) ont été injectés dans la carotide droite sans effet apparent. Ensuite, un volume identique de dehydrocholate de sodium (DHC; 17.5 %) a été injecté afin d'ouvrir la BHE. Il s'ensuit une importante déviation lente du potentiel DC positive se latéralisant vers la droite. Durant cette période d'ouverture de la BHE, l'amplitude des réponses aux manœuvres d'hypo-hyperventilation (hv/HV) a drastiquement diminué. L'astérisque dans la première hypoventilation (hv) indique qu'initialement le respirateur a été arrêté durant une minute. B : Agrandissement des variations lentes du potentiel DC induites lors de deux manœuvres d'hypoventilation, l'une durant une période de contrôle précédant celle indiquée en A (panneau 1) l'autre provenant de la dernière hypoventilation illustrée ci-dessus (panneau 2). Notez la diminution drastique de l'amplitude des variations lentes du potentiel DC après l'administration de DHC.
37 o IL TR C O , 4 - , '$■
ÉÉtaWiÉl ^r-W-HH
Figure 3. Déviation lente du potentiel DC de l'EEG par suite de l'injection unilatérale de thiopental dans l'artère carotidienne gauche (barres grises). A : Après une seule injection de thiopental (24 mg/kg), une déviation lente du potentiel DC positive est enregistrée par les électrodes au-dessus de l'hémisphère ipsilatéral par rapport à l'inhjection. Une réponse similaire, mais de moindre amplitude est enregistrée par les électrodes situées au-dessus de l'hémisphère contralateral à l'injection. Aucun changement significatif de la concentration de CO2 n'est observé. Les deux périodes encadrées sont détaillées en 1 et 2, pour démontrer le changement de patron EEG par suite de l'injection de thiopental. 5 : Les variations lentes du potentiel DC induites par le thiopental sont dose-dépendantes. Après l'injection de doses croissantes de thiopental (4, 8, 16 et 32 mg/kg à deux reprises) dans l'artère carotide droite, des déviations lentes du potentiel DC positives sont produites, caractérisées par une amplitude croissante, proportionnelle à la dose de barbituriques injectée.
38 contrôle 2 mg'kg 4 mg'„g 8 mg'kg 16 mglcg 16 mg/kg 32 mg/kg 48 mg/kg ___JIÉI____^ ^ * ^ V ^ * * ^ ^ y ^ ^ ^ ^^^^-H|W_ ***wm*^^ ____1 ntl i M ' ^ ' ' _ ^ 1 min B - Isoflurane 0.5% 2% 3% 1% contrôle
*\jf
WM__k_"""Vy/
" \ ^wifilH
2 min =SA
^ M M W W ^
*WW -p-» -r,
v-nr H'LIS^I1
1
5s o "Figure 4. Inversion de la polarité des variations lentes du potentiel DC secondaires à l'hypoventilation, en réponse à l'administratif cumulative de dose croissante d'anesthésie menant à l'état de burst-suppression du tracé électroencéphalographique. Al : Un cycle d'hypo- et d'hyperventilation suivant l'administration de 32 mg/kg de thiopental (lors de la flèche) démontre respectivement une déviation lente du potentiel DC positive dans un premier temps et négative dans un second temps. Ces réponses sont de polarité inversée par rapport aux réponses obtenues avant l'administration du barbiturique. A2 : Des doses croissantes et additives de thiopental ont été administrées au chat déjà anesthésie à la