Liaison membranaire et étude spectroscopique de la GCAP1
Mémoire
Audrey-Anne Prévèreau
Maîtrise en biochimie
Maître ès sciences (M. Sc.)
Québec, Canada
© Audrey-Anne Prévèreau, 2014
iii Résumé
Les protéines activatrices de la guanylate cyclase (GCAPs) font partie de la famille des neuroprotéines sensibles au Ca2+ (NCS) et celle des protéines à EF-Hand. Il a été proposé que le mécanisme de Ca2+-myristoyl switch avait lieu chez toutes les protéines de la famille des NCS. Les travaux présentés dans ce mémoire permettent de déterminer si ce mécanisme est observé chez la GCAP1. En effet, des travaux de liaison membranaire à des monocouches de Langmuir effectués avec la GCAP1 ont permis d’observer ce mécanisme. De plus, l’utilisation d’un analogue du myristoyle, le 13-oxa-myristoyle, a aussi permis d’observer un Ca2+-myristoyl switch chez la GCAP1. Effectivement, des mesures en résonance magnétique nucléaire (RMN) ont démontré que la présence de cet analogue favorise l’extrusion du myristoyle. Finalement, différentes analyses par RMN ont été effectuées afin de déterminer si cette méthode pourrait permettre de déterminer la structure de la forme active de la GCAP1.
v Table des matières
Résumé ... iii
Liste des tableaux ... vii
Liste des figures ... ix
Liste des abréviations ... xi
Remerciements ... xvii
Avant-propos ... xix
1. Introduction ...1
1.1 La vision ... 1
1.2 L’œil ... 1
1.3 La rétine et les photorécepteurs ... 3
1.4 La composition en lipides et en protéines des segments externes des bâtonnets ... 4
1.5 La phototransduction visuelle ... 6
1.5.1 L’activation de la cascade de phototransduction visuelle ... 8
1.5.2 L’inactivation de la cascade de phototransduction visuelle ... 9
1.6 Le rôle de la guanylate cyclase et des GCAPs dans la phototransduction visuelle ... 10
1.7 Les neuroprotéines sensibles au Ca2+ ... 13
1.7.1 Les motifs EF-Hand ... 14
1.7.2 L’acylation des NCS ... 15
1.7.3 Le mécanisme du Ca2+-myristoyl switch ... 16
1.8 Les protéines activatrices de la guanylate cyclase (GCAPs)... 17
1.8.1 Les particularités de la GCAP1 ... 19
1.9 Les membranes cellulaires et les monocouches de Langmuir ... 20
1.9.1 Les membranes cellulaires et les systèmes modèles pour les membranes ... 20
1.10 Spectroscopie de résonance magnétique nucléaire (RMN) ... 24
1.10.1 Principes de base de la RMN ... 24
1.11 Travaux antérieurs en appui au projet et objectifs spécifiques des travaux de recherche 30 2. Matériel et méthodes ... 37
2.1 Matériel ... 37
2.2 Méthodes ... 37
vi
2.2.2 Surexpression de la GCAP1 ... 38
2.2.3 Purification de la GCAP1 ... 40
2.2.4 Le système modèle des monocouches de Langmuir... 40
2.2.5 Utilisation de la RMN pour l’étude des protéines ... 42
3. Résultats et discussion ... 47
3.1 Purification de la GCAP1 ... 47
3.2 Mesure de la pression d’insertion maximale de la GCAP1 en monocouche ... 51
3.3 Existe-t-il un Ca2+-myristoyl switch chez la GCAP1 myristoylée ou 13-oxa-myristoylée? 60 3.4 Mesures préliminaires de spectres HSQC pour déterminer la structure de la GCAP1 ... 71
4. Conclusions et perspectives des travaux de recherche ... 77
4.1 Conclusions ... 77
4.2 Perspectives des travaux de recherche ... 78
vii Liste des tableaux
Tableau 1.1 : Composition en chaînes acyles des phospholipides retrouvés dans les segments externes des bâtonnets
Tableau 1.2 : Constantes de dissociation du Ca2+ et du Mg2+ pour les trois EF-Hand actives de la GCAP1
Tableau 1.3 : Les neuroprotéines sensibles au Ca2+
Tableau 2.1 : Paramètres expérimentaux utilisés pour la mesure de données RMN qui sont présentés dans différentes figures
Tableau 3.1 : Portion de la séquence de la GCAP1 qui a été décelée par spectrométrie de masse
ix Liste des figures
Figure 1.1 : Représentation schématique de l’œil Figure 1.2 : Représentation schématique de la rétine
Figure 1.3 : Représentation schématique des bâtonnets et de la rhodopsine qui est localisée dans ces disques membranaires du segment externe
Figure 1.4 : Structure des phospholipides et représentation des têtes polaires Figure 1.5 : La photoréponse des bâtonnets
Figure 1.6 : La photoactivation de la cascade de phototransduction visuelle dans les disques des bâtonnets rétiniens
Figure 1.7 : Inactivation de la phototransduction visuelle
Figure 1.8 : Rôle des GCAPs dans la phototransduction visuelle Figure 1.9 : Représentation de la structure des EF-Hand
Figure 1.10 Le Ca2+-myristoyl switch de la recoverine
Figure 1.11 : Structure de la GCAP1 de poulet myristoylée en présence de Ca2+ Figure 1.12 : Structure de la GCAP2 bovine en présence de Ca2+
Figure 1.13 : Structure de la GCAP3 humaine en présence de Ca2+ Figure 1.14 : Représentation schématique d’une membrane cellulaire Figure 1.15 : Illustration schématique de bicouche lipidique et de liposome
Figure 1.16 : Représentation schématique des protéines transmembranaires (integral
membrane protein) et des protéines liées aux membranes (peripheral membrane protein)
Figure 1.17 : Comportement des spins des atomes actifs en spectroscopie RMN Figure 1.18 : Différence énergétique entre deux populations de protons lorsqu’ils sont
soumis à un fort champ magnétique
Figure 1.19 : Mouvement de double précession crée lors de l’application de deux champs magnétiques
Figure 1.20 : Spectre de fréquence transformé en déplacement chimique par une transformée de Fourier
Figure 1.21 : PIM de la recoverine
Figure 1.22 : Mobilité du myristoyle perdeutéré de la recoverine et de la GCAP1 en présence et absence de Ca2+ et d’une bicouche de DOPC
Figure 1.23 : Acides aminés de la poche hydrophobe permettant de stabiliser le myristoyle à l’intérieur de la recoverine
Figure 2.1 : Appareil de la compagnie Kibron utilisé pour l’étude des interactions protéines-monocouches de phospholipides
Figure 2.2 : A) Exemple typique de cinétique d’adsorption d’une protéine à différentes valeurs de ∏i. B) Régression linéaire de Δ∏ en fonction de ∏i
Figure 3.1 : Gel de la purification de la GCAP1 sur colonne His-TrapTM
Figure 3.2 : Patron d’élution de la GCAP1 par chromatographie de filtration sur gel Figure 3.3 : Gel SDS-PAGE de la purification de la GCAP1 sur colonne de filtration
sur gel
Figure 3.4 : Immonobuvardage de type Western de la protéine purifiée avec un anticorps anti-GCAP1
Figure 3.5 : Patron de la séparation de la forme non-myristoylée et de la forme 13-oxa-myristoylée par HPLC
x
Figure 3.6 : Mesure de la PIM et de la synergie de la GCAP1 myristoylée en présence de calcium (Ca2+), de magnésium (Mg2+) ou en absence de ces deux cations (EGTA)
Figure 3.7 : Structure de la GCAP1 myristoylée en présence de Ca2+
Figure 3.8 : PIM de la GCAP1 myristoylée en présence de Ca2+ (A) ou de Mg2+ (B) à des concentrations de 100, 200 et 300 mM de NaCl
Figure 3.9 : Synergie de la GCAP1 myristoylée en présence de Ca2+ (A) et de Mg2+ (B) à des concentrations de 100, 200 et 300 mM de NaCl
Figure 3.10 : Isotherme de pression (Π) de surface du DMPC à 4,4ºC et à 18,3ºC Figure 3.11 : Isotherme de pression de surface d’une monocouche de DMPS en
présence () et en absence () de Ca2+
Figure 3.12 : PIM (A) et synergie (B) de la liaison de la GCAP1 myristoylée aux monocouches de DMPC en présence de Ca2+ à 20 ± 1ºC et à 30 ± 1ºC Figure 3.13 : Spectres de RMN des solides en deutérium de la recoverine
myristoylée-d27 en présence (10 mM Ca2+) et en absence de Ca2+ (0,5 mM EGTA) avec le DMPC à 5 °C(Potvin-Fournier, 2013)
Figure 3.14 : Spectres de RMN des solides en deutérium de la recoverine myristoylée-d27 en présence (10 mM Ca2+) et en absence de Ca2+ (0,5 mM EGTA) avec le DMPC à 30 °C (Potvin-Fournier, 2013)
Figure 3.15 : Spectre RMN de la recoverine en absence (A et B) et en présence de Ca2+ (C et D) pour la recoverine 13-oxa-myristoylée (spectres en rouge, Oxa-Myr) et myristoylée (spectres en noir, Oxa-Myr)
Figure 3.16 : Spectre RMN de la GCAP1 13-oxa-myristoylée (Oxa-Myr (B et D)) et myristoylée (Myr (A et C)) en présence de Ca2+
Figure 3.17 : Spectre RMN de la GCAP1 13-oxa-myristoylée (Oxa-Myr en rouge) et myristoylée (Myr en bleu)
Figure 3.18 : Spectre RMN de type NOESY de la GCAP1 13-oxa-myristoylée dont le 13-oxa-myristoyle a été marqué au 13C
Figure 3.19 : Spectre RMN de type 1H-15N HSQC de la GCAP1 myristoylée avec un myristoyle marqué au 13C sur le carbone en position 14
Figure 3.20 : Spectre RMN de type 1H-15N HSQC de la GCAP1 myristoylée dont tous les carbones du myristoyle sont marqués
Figure 3.21 : Spectre RMN à deux dimensions NOESY-HMQC filtré 13C(F3) de la GCAP1 en présence de Ca2+ avec un myristoyle marquée avec des 13C à toutes les positions
Figure 3.22 : Spectre RMN de type 1H-15N HSQC de la GCAP1 en absence de Ca2+ Figure 3.23 : Spectre RMN de type 1H-15N HSQC de la GCAP1 en présence de Ca2+ Figure 3.24 : Spectre RMN de type 1H-15N HSQC de la GCAP1
Figure 3.25 : Spectre RMN de type1H-15N HSQC de la GCAP1 myristoylée
Figure 3.26 : Spectre RMN de type1H-15N HSQC de la GCAP1 en présence de Ca2+ et de 25 mM d’octyl glucoside obtenu par Lim et al.
xi Liste des abréviations
Arr arrestine
ATP adénosine triphosphate
B0 champ magnétique
𝐵0
����⃗ champ magnétique externe
DDPC 1,2-didocosahexaénoyl-sn-glycéro-3-phosphatidylcholine DDPE 1,2-didocosahexaénoyl-sn-glycéro-3-phosphatidyléthanolamine DDPS 1,2-didocosahexaénoyl-sn-glycéro-3-phosphatidylsérine DMPC 1,2-dimyristoyl-sn-glycéro-3-phosphatidylcholine DMPE 1,2-dimyristoyl-sn-glycéro-3-phosphatidyléthanolamine DMPS 1,2-dimyristoyl-sn-glycéro-3-phosphatidylsérine DPPC 1,2-dipalmitoyl-sn-glycéro-3-phosphatidylcholine DSPC 1,2-distéaroyl-sn-glycéro-3-phosphatidylcholine E énergie
ECL enhance chemiluminescence
EGTA éthylène-glycol-bis-(β-aminoéthyle éther) N, N’-tetra acide acétique
FID Free Induction Decay
FT transformée de Fourier
G transducine
G*α transducine activée G*α-E* phosphodiestérase activée
GCAPs protéines activatrices de la guanylate cyclase GCAP1 protéine activatrice de la guanylate cyclase-1 GCAP2 protéine activatrice de la guanylate cyclase-2 GCAP3 protéine activatrice de la guanylate cyclase-3
GC1 guanylate cyclase-1
GC2 guanylate cyclase-2
GDP guanosine diphosphate
GMPc ou cG guanosine monophosphate cyclique GTP guanosine triphosphate
HMQC heteronuclear multiple-quantum coherence
HPLC chromatographie liquide à haute performance HSQC heteronuclear single quantum coherence
I moment de spin
I nombre quantique de spin
IPTG isopropyl β-D-thiogalactopyranoside Kb constante de Boltzmann
LC liquide-condensé
LE liquide-expansé
𝑀��⃗ vecteur d’aimantation élémentaire 𝑀𝑧0
�������⃗ aimantation longitudinale 𝑀𝑥𝑦
�������⃗ aimantation transversale
N population des spins
NCS neuroprotéines sensibles au Ca2+ NMT N-myristoyle transférase
xii
NOESY nuclear Overhauser effect spectroscopy
PC phosphatidylcholine
PDE6 ou Gα-E* phosphodiestérase
PE phosphatidyléthanolamine
PIM pression d’insertion maximale
polyHis10 étiquette de purification composée d’histidines ppm parties par million
PS phosphatidylsérine
R* rhodopsine activée
Rec recoverine
RF radiofréquence
RK rhodopsine kinase
RMN résonance magnétique nucléaire R-P rhodopsine phosphorylée
R*G activation de la transducine par la rhodopsine
SDS sodium dodecyl sulfate
SEB segment externe des bâtonnets
SDS-PAGE sodium dodecyl sylfate-polyacrylamide gel electrophoresis
SPR résonance plasmonique de surface
T température
T1 temps de relaxation longitudinale T2 temps de relaxation transversale
Π pression de surface
Πi pression de surface initiale
ΔΠ augmentation de pression de surface
ΔΠ0 augmentation de pression de surface à une pression de surface initiale de zéro mN/m
5’-GMP guanosine monophosphate-5’
ΔE différence d’énergie
ħ constante de Planck divisée par 2π
xiii
Épigraphe
La connaissance s’acquiert par l’expérience, tout le reste n’est que de l’information. -Albert Einstein, physicien scientifique, 1879-1955
xv
Dédicace
À mes parents à qui je dois beaucoup plus que ma naissance. Merci pour votre amour inconditionnel et toutes les belles valeurs transmises. Je vous aime beaucoup plus que je le laisse transparaître. ♥
xvii Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche Christian Salesse. Il a toujours su être là pour ses étudiants et il fait tout ce qui est en son pouvoir pour que chacun d’entre nous ait ce qu’il y a de mieux. Merci à vous d’être l’excellent chercheur que vous êtes. Merci de m’avoir permis de faire partie de votre équipe depuis 2010.
Je tiens ensuite à remercier Stéphane Gagné, mon co-directeur, qui m’a été d’une très grande aide dans mon projet de recherche et qui m’a permis d’apprendre une méthode d’analyse qui me passionne énormément aujourd’hui : la résonance magnétique nucléaire.
Je tiens aussi à remercier Line Cantin, qui est très importante pour le laboratoire. Merci d’être qui tu es et de toujours être présente pour chacun d’entre nous, même si parfois le temps manque. Ton aide est précieuse et tu es irremplaçable. Maman Line, sans toi, mon projet ne serait certainement pas où il en est aujourd’hui. Merci aussi pour ton soutien à l’extérieur du cadre du laboratoire, tu as vraiment été une personne particulièrement importante pour moi!!!!
Je tiens à remercier particulièrement Élodie Boisselier et Habib Horchani pour les longues discussions et les propositions par rapport à mon projet. Vous m’avez permis d’aller beaucoup plus loin. Un merci particulier à Élodie qui a été la première à m’introduire les bases de la biochimie. Tu as su me montrer ta passion et m’apprendre beaucoup en peu de temps. Tu seras une excellente professeure. Habib, je n’ai pas d’inquiétude de ce côté aussi!
Merci à Sarah Bernier et Mustapha Lhor, deux personnes extraordinaires avec qui j’ai eu extrêmement de plaisir à travailler et à discuter. Merci particulièrement à Sarah pour les sorties extra et tout le plaisir en dehors du laboratoire. Merci d’être l’amie que tu es. J’espère que ça continuera longtemps encore. Je veux aussi remercier Samuel Lemire qui a été mon stagiaire durant deux sessions. Je te souhaite une très belle carrière.
Merci à tous les étudiants du CUO-Recherche pour les discussions, les gâteaux et le plaisir partagé au cours des deux dernières années.
Un énorme merci à mes amies chimistes pour qui j’ai eu un peu moins de temps au cours des deux dernières années, mais qui comptent énormément pour moi. Merci pour les soupers, les jeux, les bouteilles de vino et la danse. Merci particulièrement à Amélie, Laetitia, Vanessa et Marie-Ève pour les nombreuses soirées de jeux plus que plaisantes. Merci à Sébastien et Marie-Pier, les beaucerons, pour les partys et pour les discussions
xviii
beaucoup trop courtes depuis la fin de notre baccalauréat. Merci à Mélanie, une amie qui est là depuis longtemps et qui est toujours présente dans les bons tout comme les moins bons moments. Les discussions avec toi me sont toujours d’une grande aide, et ce, sur tous les plans de la vie!! Merci pour les conseils que tu m’as donnés dans toutes les sphères de ma vie : dans mes amours, dans la science et ma carrière, mais aussi dans la danse. Merci de m’avoir tordu un bras pour que je commence à danser, aujourd’hui cette passion représente une des meilleures échappatoires.
Merci à mes amies matanaises qui sont présentes depuis très longtemps. Merci d’être les amies que vous êtes!! Merci d’être présentes pour moi depuis si longtemps. Merci Anne, Anne-Marie, Audrey, Claudie, Marie-Ève, Marie-Hélène, Nadia et Sabrina!
Une petite mention spéciale à mon amoureux, Carl Imbeault, qui n’est là que depuis peu, mais qui m’a encouragée tout au long de ma dernière année de maîtrise, qui a su comprendre lorsque je devais rentrer la fin de semaine et m’épauler lorsque j’étais à bout et que je n’avais pratiquement pas de temps pour lui. Merci d’être qui tu es!
Finalement, un énorme merci à ma famille, mes deux sœurs et plus particulièrement à mes parents. Merci de votre soutien, de votre aide. Sans vous, je ne serais certainement pas la personne que je suis, je ne serais certainement pas rendu où j’en suis. Merci pour l’amour inconditionnel et pour toutes les valeurs que vous m’avez transmises. Je vous dois énormément et vous adore tout autant. Merci aussi à ma marraine, Jacynthe Gauthier, qui est aussi toujours présente pour moi et qui sait très bien me remettre sur le droit chemin.
Merci aussi à vous qui prenez le temps de lire ce mémoire qui contient le cœur et l’âme de ces deux dernières années. J’espère que la lecture de ce mémoire saura vous passionner autant que mon projet a su me passionner au cours de ces années.
xix Avant-propos
Mon travail consistait à étudier la forme active de la protéine activatrice de la guanylate cyclase 1 (GCAP1). La forme inactive (en présence de Ca2+) ainsi que sa forme en absence de Ca2+ (aussi inactive) avaient déjà été étudiées au laboratoire par Philippe Calvez, un étudiant au doctorat.
Ce projet a été réalisé avec l’aide de mon directeur de recherche, Christian Salesse, ainsi que de Stéphane Gagné qui est devenu mon co-directeur de recherche en milieu de parcours. Il a aussi été réalisé avec l’aide de Line Cantin, professionnelle de recherche du laboratoire du Pr Salesse.
Afin de réaliser les études sur la forme active de la GCAP1, il fallait tout d’abord la produire et l’étudier à l’aide de différentes méthodes : monocouches de Langmuir (interaction protéine-membrane) et RMN (informations structurales). Deux formes de la GCAP1 ont été étudiées soit la protéine native en présence de myristoyle et la protéine possédant un analogue du myristoyle, le 13-oxa-myristoyle.
1 1. Introduction
1.1 La vision
La vision permet de distinguer les couleurs, les formes, les textures, les reliefs ainsi que les mouvements. Elle représente plus des trois quarts de l’information sensorielle et occupe un tiers de l’activité cérébrale chez l’homme durant les périodes d’éveil (Sharma et Ehinger, 2003). Cette perception vient du rayonnement électromagnétique de la lumière visible qui est émis ou réfléchi par l’environnement. La longueur d’onde de la lumière visible se situe entre 400 et 700 nm (Brown et Wald, 1963). Pour que le cerveau perçoive une image, il y a implication d’un phénomène physiologique et d’un phénomène cognitif au niveau du cortex cérébral, ce qui permet de relier les images mentales à des expériences. La composante physiologique est liée à la lumière perçue par l’organe sensitif, soit l’œil.
1.2 L’œil
La vision repose sur un organe très important : l’œil. Soixante-dix pourcent de tous les récepteurs sensoriels se retrouvent dans l’œil (Harris et Harris, 1999). Il est composé de plusieurs tissus (Figure 1.1) (Harris et Harris, 1999). La lumière suit une trajectoire spécifique lorsqu’elle pénètre dans l’œil. Elle passe par la cornée, le cristallin pour finalement atteindre la rétine, i.e. l’endroit où les photorécepteurs sont localisés (Figure 1.1). La cornée sert de protection. Elle est transparente et laisse facilement passer la lumière; elle permet aussi de réfracter la lumière. La pupille se trouve au centre de la partie visible de l’œil et est entourée par l’iris qui est la partie colorée de l’œil (Figure 1.1). La pupille contrôle la quantité de lumière qui entre dans l’œil car son diamètre varie en fonction de l’intensité lumineuse. Le cristallin agit à titre de lentille; il permet de focaliser la lumière sur la rétine. Il est transparent et non vascularisé (Figure 1.1). Finalement, la rétine tapisse l’intérieur de la partie postérieure de l’œil (Figure 1.1). Elle est composée de plusieurs types de neurones (Figure 1.2), dont les photorécepteurs qui sont excités par la lumière, soit les cônes et les bâtonnets (Laurendeau et Marieb, 1993; Rodieck, 2003).
2
Figure 1.1 : Représentation schématique de l’œil (Harris et Harris, 1999).
3 La rétine permet la transformation du signal lumineux en un influx nerveux qui est par la suite envoyé au cerveau. La rétine est d’ailleurs une extension du système nerveux central (Luo et al., 2008).
1.3 La rétine et les photorécepteurs
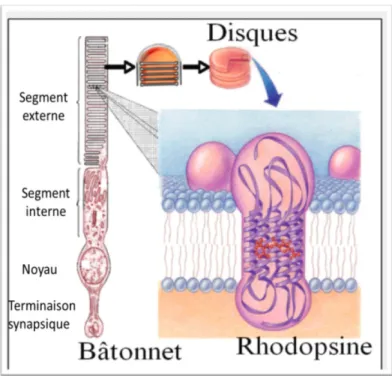
La rétine est composée d’une partie pigmentaire ainsi que d’une partie neurale (Figure 1.2). Elle contient cinq classes de neurones : les photorécepteurs ainsi que les cellules horizontales, bipolaires, amacrines et ganglionnaires. La rétine possède une fonction principale : elle est le siège de la phototransduction visuelle qui a lieu dans les cônes et les bâtonnets. Ces derniers permettent de capter et de convertir les photons en un signal électrique qui est ensuite transmis au cerveau via le nerf optique. La rétine est composée d’environ 250 millions des cellules photoréceptrices (Rodieck, 2003). Les cônes et les bâtonnets possèdent des fonctions complémentaires. En effet, les cônes sont responsables de la vision diurne et de la perception des couleurs et des détails, alors que les bâtonnets sont responsables de la vision de la lumière atténuée en conditions scotopiques (en condition de noirceur) (Rodieck, 2003; Sharma et Ehinger, 2003). Les cônes sont localisés en grande majorité dans la macula (Figure 1.1) alors que les bâtonnets, qui sont très sensibles à la lumière, sont surtout présents en périphérie de la rétine (Harris et Harris, 1999; Laurendeau et Marieb, 1993). Les bâtonnets sont formés d’un segment externe, d’un segment interne, d’un noyau et d’une terminaison synaptique (Figure 1.3). Le segment externe est constitué d’un empilement de disques membranaires qui sont indépendants de la membrane plasmique (Figure 1.3). C’est à l’intérieur de la membrane de ces disques que se situe la rhodopsine, le pigment visuel (Figure 1.3). C’est la rhodopsine qui est responsable de l’absorption des photons qui résulte en une cascade de réactions biochimiques appelée « phototransduction visuelle ». Chaque bâtonnet contient environ 100 millions de molécules de rhodopsine (Roof et Heuser, 1982). La rhodopsine est composée de l’opsine, une protéine, et d’un chromophore, le 11-cis-rétinal, qui permet l’absorption de la lumière. Trois types de cônes sont présents dans la rétine; L (ou Low) permet la vision du rouge, M (ou Middle) permet la vision du vert et S (ou Supra) permet
4
la vision du bleu (Rodieck, 2003). Il existe toutefois une seule sorte de bâtonnets (Brown et Wald, 1963).
Figure 1.3 : Représentation schématique des bâtonnets et de la rhodopsine qui est localisée dans les disques membranaires du segment externe (tirée de (Steinberg et al., 1980)).
1.4 La composition en lipides et en protéines des segments externes des bâtonnets Les disques des segments externes des bâtonnets (SEB) sont composés majoritairement de lipides et de protéines. La rhodopsine représente 95% des protéines intrinsèques des disques membranaires et 85% du contenu protéique total des segments externes des bâtonnets (Krebs et Kuhn, 1977). La fraction lipidique des SEB est majoritairement formée de phospholipides. La structure des phospholipides est représentée en Figure 1.4. Le cholestérol représente environ 10% des lipides du SEB alors qu’il compose environ 25% de toutes les autres membranes cellulaires (Tandford, 1980). Le tableau 1.1 présente la composition en chaînes acyles des phospholipides des SEB. Dans ce tableau, il est possible de voir que les phospholipides neutres de type phosphatidylcholine (PC) et phosphatidyléthanolamine (PE) comprennent respectivement 43 et 41% de l’ensemble des phospholipides des segments externes des bâtonnets (Fliesler et Anderson, 1983).
5 Figure 1.4 : Structure des phospholipides et représentation des têtes polaires. X représente les différentes têtes polaires (le groupement OH situé à gauche de la ligne pointillée est substitué par le O-P de la structure des phospholipides). R1 et R2 représentent les deux chaînes acyles (voir Tableau1.1) (Figure adaptée de (Joson, 2009).
Pour ce qui est de la phosphatidylsérine (PS), un phospholipide chargé négativement, elle représente 16% de la fraction phospholipidique (Fliesler et Anderson, 1983). De plus, ce tableau montre que la majorité des phospholipides des SEB possèdent des chaînes acyles polyinsaturées. En effet, 60% des chaînes acyles des phospholipides des SEB sont polyinsaturés (Fliesler et Anderson, 1983; Miljanich et al., 1979; Salesse et al., 1984; Stone et al., 1979). Dans les SEB, l’acide docosohexaénoïque (22:6ω3) représente près de 80% des chaînes hydrocarbonées insaturées; il est composé de 22 carbones et comprend six insaturations. Ces insaturations vont influencer la stéréochimie des phospholipides en imposant une courbure à ces chaînes acyles, rendant la barrière énergétique entre les différentes conformations plus petite, ce qui fait en sorte que les membranes composées de ce type de phospholipides sont plus fluides (Mitchell et Litman, 1998; Soubias et Gawrisch, 2007). Il est possible que cette fluidité favorise la modulation des réactions biochimiques prenant place au cours de la phototransduction visuelle.
6 Chaîne acyle PC (43 %) PE (41 %) PS (16 %) 16:0 19,6 10,7 1,2 16:1 1,2 1,1 0,6 18 :0 17,3 22,3 18,2 18:1ω9 3,7 3,9 1,6 18:2ω6 1,5 1,3 0,4 20:3ω6 0,7 0,8 0,6 20:4ω6 3,4 2,4 1,0 22:4ω6 1,1 0,9 4,0 22:5ω6 0,8 1,2 2,1 22:5ω3 1,7 1,5 3,1 22:6ω3 41,9 50,6 49,2 24:4 0,3 0,1 6,1 24:5 1,0 0,9 9,4
Tableau 1.1 : Composition en chaînes acyles des phospholipides retrouvés dans les segments externes des bâtonnets. Le pourcentage des différents types de phospholipides (PC : phosphatidylcholine, PE : phosphatidyléthanolamine, PS : phosphatidylsérine) est indiqué entre parenthèses. La terminologie 16:0 indique que cette chaîne acyle comprend 16 carbones et aucune double liaison (insaturation) et 18:1ω9 correspond à 18 carbones et une double liaison. De plus, ω9 spécifie que la double liaison est située au niveau du carbone 9 à partir de la fin de la chaîne acyle. Les pourcentages ont été recalculés à partir de Fliesler et Anderson, (1983).
1.5 La phototransduction visuelle
Dans les conditions de noirceur, un courant ionique traverse constamment la membrane plasmique des photorécepteurs; il est nommé courant d’obscurité. Les ions impliqués dans ce courant incluent majoritairement le Na+, mais aussi le Ca2+, le K+ et le Mg2+ (Kaupp et Koch, 1992). L’équilibre entre la concentration cytosolique et externe de ces différents ions est maintenue grâce à divers canaux, dont les canaux GMPc (guanosine 3’-5’-monophosphate cyclique)-dépendants, les canaux Na+/K+ ATPase ainsi que les échangeurs Na+/K+-Ca2+ (Schnetkamp, 1989). La polarisation et l’hyperpolarisation des
7 bâtonnets est principalement due aux canaux Na+/K+ ATPase qui utilisent de l’adénosine triphosphate (ATP) pour pomper les ions Na+ et K+ contre un gradient, donc vers l’extérieur de la cellule (Skou et Esmann, 1992). Les canaux GMPc-dépendants sont actifs seulement lors de la liaison d’une à quatre molécules de GMPc (Kaupp et Seifert, 2002; Koutalos et al., 1994). Leur fermeture mène à l’hyperpolarisation de la cellule. En conditions de noirceur, la concentration en GMPc est élevée; les canaux GMPc-dépendants sont donc ouverts, ce qui permet l’observation d’un courant d’obscurité et la sécrétion de glutamate (Figure 1.5A) (Yau et Baylor, 1989). Lorsqu’un rayon lumineux est capté par la rhodopsine, il y a début de la cascade de phototransduction. Cette cascade mène à la conversion du GMPc en 5’-GMP (guanosine monophosphate 5’) et donc à une diminution de la concentration de GMPc à l’intérieur des bâtonnets, ce qui entraîne la fermeture des canaux GMPc-dépendants.
Figure 1.5 : La photoréponse des bâtonnets (figure adaptée de (Pepe, 2001)). (A). Les conditions de noirceur mènent à la sécrétion de glutamate au niveau de la terminaison nerveuse. (B) En conditions photopiques, les canaux à Ca2+, Na+/K+-GMPc dépendants sont fermés, ce qui engendre l’hyperpolarisation des bâtonnets et un arrêt de la sécrétion de glutamate.
A
B
8
Les canaux Na+/K+ ATPase et les échangeurs Na+/K+-Ca2+ restent toutefois actifs, ce qui mène à l’hyperpolarisation du bâtonnet (Figure 1.5B) (Toyoda et al., 1970). La concentration en Ca2+ chutera alors drastiquement en conséquence de l’activité des échangeurs Na+/K+-Ca2+ qui permettent l’entrée de Na+ et la sortie de K+ ainsi que de Ca2+ (Gray-Keller et Detwiler, 1994), ce qui joue un rôle clé dans la phototransduction visuelle.
1.5.1 L’activation de la cascade de phototransduction visuelle
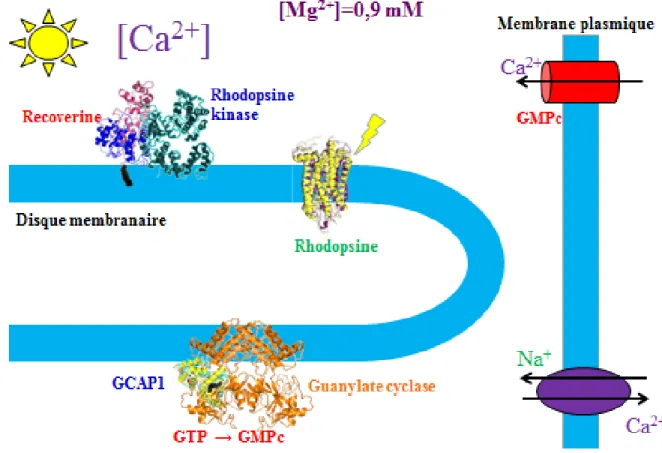
Figure 1.6 : La photoactivation de la cascade de phototransduction visuelle dans les disques des bâtonnets rétiniens. Le 11-cis-rétinal de la rhodopsine absorbe un photon, ce qui entraîne la photoisomérisation de ce chromophore et un changement conformationnel de cette protéine pour produire la forme photoexcitée (R*). La rhodopsine activée (R*) va interagir avec la transducine (G), une protéine G qui va libérer sa sous-unité α suite à l’échange de son GDP pour du GTP. Cette sous-unité α (G*α) va ensuite lier la sous-unité inhibitrice γ de la phosphodiestérase (G*α-E*) pour activer cette dernière. La photodiestérase activée (E*) hydrolyse le GMPc (cG) en 5’-GMP (GMP), ce qui entraîne la fermeture des canaux ioniques GMPc-dépendants et l’hyperpolarisation du photorécepteur par l’activité des échangeurs Na+/K+, Ca2+ et des canaux Na+/K+ ATPase. La concentration de GMPc est ensuite rétablie grâce à la guanylate cyclase (GC) suite à son activation par la protéine activatrice de la guanylate cyclase (GCAP) dont l’activité est régulée par la chute de la concentration en Ca2+ (DeGrip et al., 2000).
9 La phototransduction visuelle débute par l’absorption d’un photon par la rhodopsine (Figure 1.6), ce qui mène à l’isomérisation de son chromophore, le 11-cis-rétinal, en
tout-trans-rétinal (Hubbard et Kropf, 1958). Cette isomérisation provoque un changement
conformationnel de la rhodopsine pour former la métarhodopsine II, soit la forme active de la rhodopsine (R*, Figure 1.6) (Bennet et al., 1982; Cook et al., 1985; Emeis et Hofmann, 1981; Hofmann et al., 1983; Liebman et Pugh, 1982; Schleicher et Hofmann, 1985). La rhodopsine activée va interagir avec la transducine (G), rendant sa sous-unité α active en permettant l’échange de son GDP (guanosine diphosphate) par une molécule de GTP (guanosine triphosphate) (R*G, Figure 1.6) (Fung et al., 1981; Fung et Stryer, 1980). La sous-unité α activée (G*α, Figure 1.6) va se dissocier des sous-unités βγ de la transducine et aller lier la sous-unité γ de la phosphodiestérase-6 (PDE6 ou Gα-E*, Figure 1.6) (Heck et Hofmann, 1993; Spickofsky et al., 1994). La PDE6 est une protéine hétérotétramérique qui est composée de deux sous-unités inhibitrices γ et de sous-unités α et β qui forment la région enzymatique de la protéine (Baehr et al., 1979). Les sous-unités α de la transducine vont alors lever l’inhibition des sous-unités γ permettant donc l’activation de la PDE6. La PDE6 activée hydrolysera ensuite le GMPc (cG, Figure 1.6) en 5’-GMP (GMP, Figure 1.6), ce qui entraînera une chute de la concentration de GMPc dans les photorécepteurs et donc la fermeture des canaux GMPc-dépendants (Attwell, 1985). Ce processus mène finalement à l’hyperpolarisation des bâtonnets (Bauer, 2002).
1.5.2 L’inactivation de la cascade de phototransduction visuelle
Suite à la cascade de phototransduction visuelle, le retour à l’état de la noirceur doit rapidement être atteint afin de permettre une nouvelle réponse rapide aux stimuli lumineux. Suite à la fermeture des canaux GMPc-dépendants, une chute drastique de la concentration en Ca2+ a lieu dans les bâtonnets (environ de 550 à 50 nM) (Gray-Keller et Detwiler, 1994). Cette diminution de la concentration en Ca2+ a un effet sur la structure de la recoverine (Rec, Figure 1.7) et les protéines activatrices de la guanylate cyclase (GCAPs, Figure 1.8). Ces protéines font partie de la famille des neuroprotéines sensibles au Ca2+ (NCS). La recoverine permet l’inhibition de la rhodopsine kinase (RK, Figure 1.7) qui phosphoryle la rhodopsine, ce qui permet la liaison de l’arrestine (Arr, Figure 1.7) à cette dernière. Ce dernier phénomène empêche la liaison de la transducine, ce qui
10
rend la rhodopsine inactive (Figure 1.7) (Fowles et al., 1989; Palczewski et al., 1989) L’inactivation de la transducine entraîne aussi celle de la PDE6, donc l’arrêt de l’hydrolyse du GMPc (Hu et al., 2003).
Figure 1.7 : Inactivation de la phototransduction visuelle. Suite à la diminution de la concentration de Ca2+ intracellulaire, la recoverine (Rec) se dissocie de la rhodopsine kinase (RK), ce qui lui permet de phosphoryler la rhodopsine. La rhodopsine phosphorylée (R-P) va par la suite lier l’arrestine (Arr), ce qui mènera à son inactivation (DeGrip et al., 2000).
De plus, la diminution de la concentration de Ca2+ permet aussi l’activation des GCAPs qui sont responsables de la régulation de l’activité de la guanylate cyclase, comme leur nom l’indique (Burgoyne et Haynes, 2012). L’activation de la guanylate cyclase mène à la synthèse du GMPc à partir du GTP. L’augmentation de la concentration en GMPc dans les bâtonnets permet la réouverture des canaux GMPc-dépendants qui résulte en une augmentation de la concentration de Ca2+ dans les bâtonnets et donc un retour aux conditions de noirceur (Sharma, 2010).
1.6 Le rôle de la guanylate cyclase et des GCAPs dans la phototransduction visuelle
Regardons maintenant plus précisément le rôle de la protéine activatrice de la guanylate cyclase 1 (GCAP1, Figure 1.8) dans la phototransduction visuelle. Tout d’abord, en
11 conditions de noirceur, la GCAP1 lie le Ca2+ et est dans sa conformation inactive (Koch et al., 2002; Koch et al., 2010; Palczewski et al., 2004; Sharma et Duda, 2012; Stephen et al., 2008; Tesmer, 2008). Elle ne permet donc pas l’activation de la guanylate cyclase. La guanylate cyclase ne montre alors aucune activité enzymatique. Cependant, lorsqu’il y a fermeture des canaux GMPc-dépendants, il y a diminution de la concentration de Ca2+, ce qui mène à la dissociation du Ca2+ de la GCAP1 et permet à la GCAP1 de lier le Mg2+, un autre ion divalent pour lequel elle possède moins d’affinité. Cette nouvelle liaison lui permet de devenir active (Peshenko et Dizhoor, 2004; Peshenko et Dizhoor, 2006; Peshenko et Dizhoor, 2007).
Figure 1.8 : Rôle des GCAPs dans la phototransduction visuelle. Suite à l’excitation de la rhodopsine par un signal lumineux, il y a début de la cascade de phototransduction visuelle, ce qui mène à une diminution de la concentration de Ca2+. La GCAP1 est alors disponible pour lier le Mg2+, ce qui permet l’activation de la guanylate cyclase. Cette dernière synthétisera du GMPc à partir du GTP, ce qui permettra la réouverture canaux GMPc dépendants et, par conséquent, une augmentation de la concentration de Ca2+ et un
12
retour à l’état de la noirceur (Figure inspirée de la soutenance de thèse de Philippe Calvez).
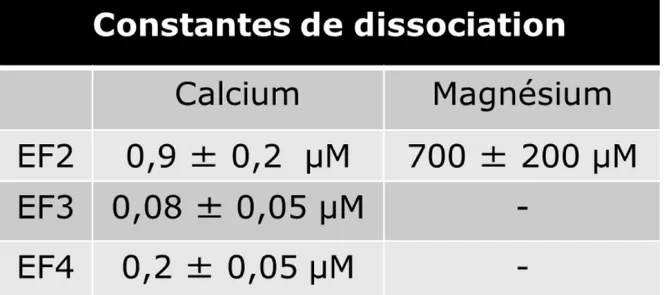
La GCAP1 active donc la guanylate cyclase-1 (GC1) qui synthétise le GMPc. Cette synthèse permet la réouverture des pores à Na+/Ca2+ GMPc-dépendants (Figure 1.8) de la membrane plasmique et, par conséquent, de rétablir la concentration cytosolique initiale de Ca2+, ce qui mène à l’inactivation de la GCAP1 et, par conséquent, de la guanylate cyclase. En effet, la GCAP1 lie préférentiellement le Ca2+ et est inactive en présence de ce cation. Les différentes constantes de dissociation de la GCAP1 pour le Ca2+ et le Mg2+ sont connues et montrent une forte préférence pour le Ca2+ (Lim et al., 2009). Ces constantes de dissociation sont présentées dans le tableau 1.2.
Tableau 1.2 : Constantes de dissociation du Ca2+ et du Mg2+ pour les trois EF-Hand
actives de la GCAP1 (Lim et al., 2009).
Le tableau 1.2 présente les différentes constantes de dissociation du Ca2+ et du Mg2+ pour les trois EF-Hand de la GCAP1 permettant la liaison de ces cations. L’EF-Hand 3 possède une plus grande affinité pour le Ca2+ que les deux autres. Le Ca2+ se liera donc en premier à cet EF-Hand. Par la suite, c’est l’EF-Hand 4 qui possède la deuxième plus grande affinité alors que l’EF-Hand 2 possède une très faible affinité pour le Ca2+. Pour ce qui est du Mg2+, la seule constante connue est celle pour l’EF-Hand 2. Les constantes
13 de dissociation des autres l’EF-Hand n’ont pas pu être déterminées car elles sont trop faibles comparativement à celles du Ca2+ (Lim et al., 2009). Il est important de noter que la concentration en Mg2+ ne change pas au cours de la phototransduction visuelle (Chen et al., 2003), i.e. 0,9 mM. Il y a donc un équilibre entre la liaison du Ca2+ et celle du Mg2+ pour l’EF-Hand 2, même en conditions de noirceur. Lorsque la concentration de Ca2+ diminue (550 à 50 nM) (Gray-Keller et Detwiler, 1994) au cours de la phototransduction visuelle, le Mg2+ se liera aux EF-Hand 2 et 3, permettant ainsi l’activation de la GC1 (Lim et al., 2009). L’activité de la GC1 est donc modulée par la concentration en Ca2+ par le biais de la GCAP1 (Sokal et al., 1999). La protéine activatrice de la guanylate cyclase 2 (GCAP2) possède une affinité semblable à celle de GCAP1 pour la GC1. Toutefois, le site de liaison de ces deux protéines n’est pas le même (Haeseleer et al., 1999). Les sites de liaison de la GCAP1 et de la GCAP2 sont très près l’un de l’autre, ce qui fait en sorte qu’il y a un recouvrement entre ces deux sites de liaison (Haeseleer et al., 1999). La GCAP2 peut stimuler et inhiber l’activité de la GC1 tout comme la GCAP1 (Haeseleer et al., 1999). Toutefois, la GCAP2 régule aussi l’activité de la guanylate cyclase-2 (GC2) par le même processus, ce que la GCAP1 ne permet pas. De plus, la GCAP2 joue un rôle dans le processus d’adaptation à la lumière (Sokal et al., 1999).
1.7 Les neuroprotéines sensibles au Ca2+
Quatorze protéines font partie de la famille des NCS. Cette famille est divisée en cinq sous-classes (A à E). Ces protéines font également partie d’une autre famille, celle des protéines comprenant des EF-Hand (Braunewell et Gundelfinger, 1999). Les NCS agissent au niveau du système nerveux central et assurent différentes fonctions telles que le trafic membranaire, le contrôle des canaux ioniques, la survie cellulaire ainsi que la phototransduction visuelle (Burgoyne et Weiss, 2001). Une des protéines les plus étudiées des NCS est la recoverine. Les NCS sont décrites par deux caractéristiques : leur acylation du côté N-terminal ainsi que leurs motifs EF-Hand. Quelques NCS sont présentées dans le Tableau 1.3.
14
NCS Fonction Expression N-acylation
(14:0) EF-Hand active/ totale Sous-classe
Fréquénine Neurotransmission Cerveau et rétine
Oui 3/4 A
Neurocalcine Synthèse lipidique Cerveau et rétine
Oui 3/4 B
Hippocalcine Apoptose Rétine Oui 3/4 B
VILIPs1-3 Neurotransmission Cerveau et rétine
Oui 3/4 B
Recoverine Phototransduction Rétine Oui 2/4 C
GCAPs1-3 Phototransduction Rétine Oui 3/4 D
KChIPs1-4 Canaux K+ Cerveau Oui/non 2/4 E
Tableau 1.3 : Les neuroprotéines sensibles au Ca2+ (Burgoyne, 2004). Le Tableau
présente différentes NCS, possédant différentes fonctions. Les NCS sont localisées au niveau de la rétine et/ou du cerveau. Elles sont acylées en N-terminal et possèdent 2 ou 3 sites de liaison du Ca2+ actifs sur 4 sites possibles.
1.7.1 Les motifs EF-Hand
Toutes les NCS possèdent quatre EF-Hand (dont la structure est montrée en Figure 1.9). Les motifs EF-Hand sont composés de 29 acides aminés et possède une topologie hélice α – boucle – hélice α. Les sites de liaison du Ca2+ des EF-Hand sont composés d’une séquence de douze acides aminés conservés dont cinq incluent un ou deux oxygènes qui permettent la liaison avec le Ca2+. C’est un des motifs les plus communs dans le génome humain (Burgoyne, 2007). Sur les quatre EF-Hand des NCS, seulement deux ou trois sont actifs selon les protéines. Effectivement, le motif EF-Hand 1 de toutes les NCS possède des acides aminés différents dans la boucle de liaison au Ca2+ qui ne permettent pas la liaison des cations, rendant donc cet EF-Hand inactif (Burgoyne, 2004).
15 .
Figure 1.9 : Représentation de la structure des EF-Hand. i) Représentation de la structure d’un EF-Hand en absence de Ca2+. ii) Représentation de la structure d’un
EF-Hand en présence de Ca2+ (Figure tirée de (Yap et al., 1999)).
1.7.2 L’acylation des NCS
Les NCS possèdent aussi une acylation du côté N-terminal (Tableau 1.3). Il s’agit d’une liaison covalente d’un groupement acyle à une glycine. Onze des quatorze membres des NCS possèdent une myristoylation (groupement myristoyle; 14:0, quatorze carbones, aucune insaturation). Les trois autres NCS possèdent une palmitoylation (groupement palmitoyle; 16:0, seize carbones, aucune insaturation) (McCue et al., 2010; Takimoto et al., 2002). KChIP 2 et 4 sont parfois non-myristoylées (An et al., 2000; Holmqvist et al., 2002). Pour que la myristoylation ait lieu de façon post-traductionnelle, une séquence consensus doit être présente chez la protéine (G-X-X-X-S/T/A-X-X); cette séquence permet la reconnaissance du site pour l’attachement d’un acide gras par la N-myristoyle transférase (NMT) (Boutin, 1997; Maurer-Stroh et al., 2002). La séquence de la GCAP1 a été modifiée par mutagénèse dirigée afin de promouvoir sa myristoylation. En effet, l’acide aspartique en position 6 a été mutée en sérine. Cette mutation permet de créer une séquence consensus qui favorise l’activité de la NMT de levure (Hwang et Koch, 2002). La myristoylation peut servir à ancrer les protéines aux membranes mais elle est aussi impliquée dans les interactions protéine-protéine et joue donc un rôle très important dans la transduction des signaux (Hayashi et Titani, 2010). La myristoylation est donc
16
impliquée dans la reconnaissance moléculaire d’autres protéines et peut aussi être essentielle pour le maintien de la structure de certaines autres protéines (Resh, 1999).
1.7.3 Le mécanisme du Ca2+-myristoyl switch
Le mécanisme du Ca2+-myristoyl switch est souvent utilisé pour expliquer l’effet de la liaison du Ca2+ sur la structure des NCS. En effet, à faible concentration de Ca2+, le groupement myristoyle de certaines NCS est enfoui à l’intérieur d’une poche hydrophobe. Les protéines ont donc une forme globulaire, plus compacte. Lorsqu’il y a liaison du Ca2+ par les EF-Hand, un changement conformationnel important est observé chez les NCS (pour revue, consulter Ames et Lim, 2012). Chez la recoverine, la liaison du Ca2+ entraîne l’extrusion complète du myristoyle (Ames et al., 1997). En fait, le Ca2+ -myristoyl switch a seulement été démontré sans équivoque avec la recoverine car sa
structure est connue en présence et en absence de Ca2+ (Ames et al., 1995; Ames et al., 1996; Tanaka et al., 1995). La Figure 1.10 montre que la recoverine a subi un changement conformationnel important suite à la liaison du Ca2+. En effet, en absence de Ca2+, le myristoyle est enfoui dans une poche hydrophobe (Figure 1.10). Cependant, la liaison du Ca2+ résulte en l’extrusion du myristoyle de la recoverine (Figure 1.10). Il a été montré que la liaison et la dissociation du Ca2+ sont responsables de la modulation de la liaison réversible de la recoverine myristoylée aux membranes par le biais de son Ca2+
-myristoyl switch (Ames et al., 1997; Ames et al., 1995; Desmeules et al., 2007; Desmeules et al., 2006; Tanaka et al., 1995; Zozulya et Stryer, 1992). En effet, puisque le myristoyle de la recoverine est enfoui dans une poche hydrophobe à l’intérieur de la protéine en absence de Ca2+, l’ancrage de cette protéine aux membranes par ce regroupement n’est pas possible (Kollmann et al., 2012) (Figure 1.10). Cependant, la liaison du Ca2+ par la recoverine mène à un changement conformationel important et à l’extrusion de son myristoyle, ce qui favorise sa liaison aux membranes (Ames et al., 1997) (Figure 1.10).
17 Figure 1.10 : Le Ca2+-myristoyl switch de la recoverine. Le mécanisme de Ca2+
-myristoyl switch est observé chez la recoverine. L’extrusion du -myristoyle de la
recoverine permet sa liaison membranaire (pdb 1IKU à gauche et 1JSA à droite).
1.8 Les protéines activatrices de la guanylate cyclase (GCAPs)
Chez l’humain, trois types de GCAPs ont été identifiés (GCAP1, GCAP2 et GCAP3, protéine activatrice de la guanylate cyclase-3). Elles sont composées respectivement de 201, 200 et 209 acides aminés et possèdent une masse moléculaire de 22,9, 23,4 et 23,8 kDa. Les GCAPs sont très semblables au niveau de leur séquence. En effet, il y a 42% (59%) d’identité (similarité) de séquence entre la GCAP1 et la GCAP2, 45% (69%) entre la GCAP1 et la GCAP3 et, finalement, 39% (52%) entre la GCAP2 et la GCAP3 (alignement global, matrice BLOSUM62). Pour ce qui est de la GCAP1, les séquences sont très similaires entre les espèces. En effet, 81% (91%) d’identité (similarité) de séquence est retrouvé entre la GCAP1 du poulet et la GCAP1 humaine et 94% (97%) d’identité (similarité) de séquence entre la forme bovine et la forme humaine. La GCAP1 et la GCAP2 sont principalement retrouvées dans les bâtonnets alors que la GCAP3 est présente dans les cônes (Makino et al., 2008). Ces protéines sont physiologiquement N-myristoylées. La structure de la GCAP1 est présentée en Figure 1.11, celle de la GCAP2 en Figure 1.12 et celle de la GCAP3 en Figre 1.13.
Ca
2+18
Figure 1.11 : Structure de la GCAP1 de poulet myristoylée en présence de Ca2+.
Structure obtenue par diffraction des rayons-X (PDB 2R2I). Les atomes de Ca2+ sont représentés en gris et le myristoyle en noir. La structure de la GCAP1 montre la séquestration du myristoyle à l’intérieur d’une poche hydrophobe en présence de Ca2+.
Figure 1.12 : Structure de la GCAP2 bovine en présence de Ca2+. Structure obtenue
par résonance magnétique nucléaire (RMN), (PDB 1JBA). Les atomes de Ca2+ sont représentés en gris.
19 Figure 1.13 : Structure de la GCAP3 humaine en présence de Ca2+. Structure obtenue
par diffraction des rayons-X (PDB 2GGZ). Les atomes de Ca2+ sont représentés en gris.
1.8.1 Les particularités de la GCAP1
La GCAP1 permet d’activer ou d’inhiber la GC1 (Dizhoor, 2002). Il existe beaucoup moins d’information sur le changement structural de la GCAP1 induit par la liaison du Ca2+ que pour la recoverine. Il est connu que la GCAP1 active faiblement la GC1 en présence de Ca2+ et très fortement en absence de Ca2+ (Koch, 2002). L’activation de la GC1 est induite par la présence de cations Mg2+ liés aux EF-Hand 2 et 3 et, possiblement, 4 (Lim et al., 2009). L’inhibition de la GC1 est donc causée par la liaison du Ca2+ par ces
EF-Hand (Lim et al., 2009; Peshenko et Dizhoor, 2006; Peshenko et Dizhoor, 2007).
La structure de la GCAP1 myristoylée en présence de Ca2+ a été déterminée par diffraction des rayons X (Figure 1.11) (Stephen et al., 2007). Cette structure montre que le myristoyle reste enfoui à l’intérieur de la protéine en présence de Ca2+ (Figure 1.11), ce qui suggère donc que le Ca2+-myristoyl switch n’est pas fonctionnel chez la GCAP1. La myristoylation de la GCAP1 augmente son activité, mais sa contribution à l’activation de la GC1 est encore mal comprise (Lim et al., 2009). Il est toutefois connu que la myristoylation est nécessaire à l’interaction entre la GCAP1 et la GC1 (Hwang et Koch, 2002; Otto-Bruc et al., 1997; Peshenko et al., 2012). Neuf mutations de la GCAP1
20
entraînent la dystrophie autosomique dominante des cônes ou des cônes et des bâtonnets, ce qui mène à une perte de l’acuité visuelle et de la perception des couleurs (Baehr et Palczewski, 2007; Behnen et al., 2010; Jiang et Baehr, 2010; Newbold et al., 2002; Sokal et al., 2000; Weleber, 2005). Les mutations E89K (Kitiratschky et al., 2009), Y99C (Payne et al., 1998), D100E (Kitiratschky et al., 2009) et N104K (Jiang et al., 2008) et les mutations I143NT (Nishiguchi et al., 2004), L151F (Jiang et al., 2005; Sokal et al., 2005), E155A (Huang et al., 2013), E155G (Wilkie et al., 2001) et G159V (Kitiratschky et al., 2009) sont respectivement situées près ou à l’intérieur des EF-Hand 3 et 4. Ces mutations entraînent la perte de la coordination des cations dans les boucles de ces
EF-Hand. Par conséquent, ces GCAP1 mutées ne sont pas complètement inactivées en
conditions de noirceur, ce qui entraîne une stimulation constante de la GC1 et donc un niveau élevé de concentration de GMPc et de Ca2+, et éventuellement, la mort des photorécepteurs. En outre, une autre mutation, la mutation P50L, mène aussi à la dystrophie autosomique dominante des cônes mais cette protéine est connue pour être moins stable thermiquement que la GCAP1 native (Newbold et al., 2001). Il serait donc intéressant de déterminer la structure de la GCAP1 native et de ses mutants pour comprendre le rôle de cette protéine, mais aussi des mutations impliquées dans la dégénérescence des photorécepteurs.
1.9 Les membranes cellulaires et les monocouches de Langmuir
1.9.1 Les membranes cellulaires et les systèmes modèles pour les membranes Les membranes cellulaires jouent un rôle majeur chez le vivant. En effet, elles permettent de contrôler les échanges entre l’intérieur et l’extérieur des cellules ainsi qu’entre le cytoplasme et les différents organites cellulaires (Voet et Voet, 2005). Les membranes sont constituées d’une bicouche lipidique et de protéines. La Figure 1.14 montre un schéma d’une membrane cellulaire qui contient à la fois des lipides et des protéines (Singer et Nicolson, 1972).
21 Figure 1.14 : Représentation schématique d’une membrane cellulaire. Les lipides sont représentés en gris et les protéines en mauve (Introduction to Biological Membranes, 2014). (Membranes, 2014)
Chez les eucaryotes, ce sont les lipides membranaires et surtout les phospholipides qui permettent la compartimentation cellulaire. En effet, les phospholipides sont des molécules qui possèdent une tête polaire et une queue apolaire (composée de deux chaînes acyles hydrophobes); ce sont donc des molécules dites amphiphiles (Schechter, 1990). Les phospholipides s’organisent en bicouche lorsqu’ils se retrouvent dans l’eau, afin de diminuer les forces exercées par l’eau. Ils s’organisent de façon à ce que les têtes polaires soient localisées à l’extérieur de la bicouche, ce qui permet de créer une barrière pour la zone centrale qui est hydrophobe (voir le schéma d’une bicouche lipidique en Figure 1.15A).
Figure 1.15 : Illustration schématique de bicouche lipidique et de liposome. A) Bicouche de phospholipides, B) Liposome composé de phospholipides (Jesorka et Orwar, 2008).
22
L’eau n’aura donc que très peu accès à la zone hydrophobe, diminuant ainsi les forces de répulsion entre l’eau et cette région apolaire des lipides (Schechter, 1990). Les membranes jouent aussi plusieurs rôles physiologiques très importants et variés tels que l’ancrage des protéines membranaires, la signalisation intercellulaire ainsi qu’intracellulaire, etc. (Voet et Voet, 2005). Il existe un grand nombre de lipides différents dans les membranes. Par exemple, on retrouve près d’une centaine de phospholipides différents dans les membranes des disques des photorécepteurs (Miljanich et al., 1979). De plus, ces cellules contiennent aussi un nombre important de protéines différentes qui sont associées aux membranes des disques (pour une revue, voir (Ebrey et Koutalos, 2001)). Par conséquent, les membranes biologiques sont très complexes et des systèmes modèles plus simplifiés doivent être utilisés pour comprendre les interactions entre les lipides membranaires et les protéines. Il existe plusieurs systèmes modèles pour les membranes qui incluent les bicouches lipidiques et les monocouches. Le modèle membranaire des bicouches lipidiques est abondamment utilisé, en particulier celui de vésicules lipidiques, souvent appelées « liposomes » (voir Figure 1.15B) (pour une revue, voir (Jesorka et Orwar, 2008; Mozafari, 2005)). Cependant, des vésicules lipidiques ne peuvent pas être formées avec certains phospholipides spécifiques, comme la PE insaturée, car ils forment des phases hexagonales et non des bicouches comme celles retrouvées dans les membranes (Gruner et al., 1985; Verkleij, 1984). De plus, ces vésicules ont une courbure importante étant donné leur petite taille. Seulement les vésicules géantes ne montrent pas ce problème de courbure mais elles sont plus instables et plus difficiles à préparer que les vésicules lipidiques de plus petite taille (Walde et al., 2012).
La méthode des monocouches de Langmuir est aussi énormément utilisée en tant que système modèle pour les membranes (pour une revue, voir (Boucher et al., 2007; Brezesinski et Mohwald, 2003; Brockman, 1999; Bussières et al., 2008; Calvez et al., 2009; Giner-Casares et al., 2014; Kaganer et al., 1999; Lipowski et Sackmann, 1995; Maget-Dana, 1999; Moghaddam et al., 2011; Thakur et al., 2009; Vollhardt et Fainerman, 2000)) dont la courbure est la même que celle retrouvée pour les membranes biologiques. Il s’agit d’une couche monomoléculaire de phospholipides à l’interface gaz/eau qui
23 représente un seul feuillet lipidique des membranes. Lorsque les phospholipides sont étalés à la surface de l’eau, de très fortes contraintes thermodynamiques s’exercent entre la queue apolaire des phospholipides et l’eau, ce qui résulte en une organisation particulière des lipides qui peut être contrôlée par la variation de l’aire moléculaire et, conséquemment, par la pression de surface. Cette méthode permet donc de contrôler la densité des lipides. Il a été démontré qu’il existe une relation thermodynamique directe en les monocouches et les bicouches (Feng, 1999; MacDonald et Simon, 1987; Marsh, 2006). Par ailleurs, c’est le seul système modèle pour les membranes qui permet d’étudier de façon indépendante la monocouche interne et externe des membranes. En effet, les lipides et les protéines associées aux membranes cellulaires sont distribués de façon asymétrique (Zhao et Lappalainen, 2012). Cette méthode permet donc de les étudier de façon indépendante. C’est particulièrement important pour mes travaux de recherche car il a été montré que 75% de la PE et la PS sont localisées dans la monocouche externe des disques des photorécepteurs alors que la monocouche interne est fortement enrichie en PC (Hubbell, 1990; Miljanich et al., 1981; Tsui et al., 1990; Wu et Hubbell, 1993). C’est important puisque la GCAP1 est localisée du côté de la monocouche externe des disques.
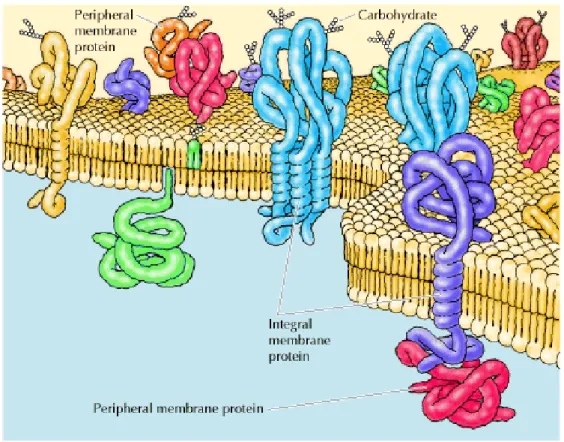
Il existe deux types de protéines qui ont des interactions privilégiées avec les membranes lipidiques : les protéines transmembranaires (ou intrinsèques) et les protéines liées aux membranes (ou extrinsèques) (White et Wimley, 1999). Pour schéma de ces différents types de protéines, voir la Figure 1.16. Les protéines transmembranaires, comme la rhodopsine, possèdent des segments en hélices alpha qui traversent la membrane et leur repliement dépend de la présence de la phase hydrophobe des membranes (White et Wimley, 1999). Leur fonction est assurée par leur localisation transmembranaire (White et Wimley, 1999). Par ailleurs, les protéines extrinsèques sont stabilisées par des interactions électrostatiques avec la partie polaire de la membrane ou des interactions hydrophobes avec la partie apolaire (Johnson et Cornell, 1999). Le modèle des monocouches de phospholipides à l’interface gaz/eau permet l’étude des protéines extrinsèques par la caractérisation de leurs paramètres de liaison et ainsi d’obtenir des informations sur l’affinité des protéines pour des lipides.
24
Figure 1.16 : Représentation schématique des protéines transmembranaires (integral membrane protein) et des protéines liées aux membranes (peripheral membrane protein) (Castro, 2014).
1.10 Spectroscopie de résonance magnétique nucléaire (RMN) 1.10.1 Principes de base de la RMN
En décembre 1945 et janvier 1946, deux chercheurs de deux universités différentes ont découvert le phénomène de la RMN (pour revue(Günther, 2013)). Ils ont reçu le prix Nobel pour cette découverte en 1952. Depuis ce moment, quatre autres prix Nobel ont été attribués en rapport avec cette méthode spectroscopique. Le fondement physique de la RMN vient des propriétés magnétiques des noyaux atomiques (pour revue, voir (Kastler et al., 2003)). La RMN permet l’étude d’une propriété quantique intrinsèque des noyaux qui est appelée le spin. Tous les noyaux possédant un nombre de masse ou un nombre atomique impair possèdent un nombre quantique de spin (I) qui n’est pas égal à zéro ainsi qu’un moment de spin (I) qui se comporte comme un dipôle magnétique (comme des
25 aimants) (Günther, 2013). Les noyaux sont chargés et tournent sur eux-mêmes, ce qui engendre un moment magnétique (µ). Ce moment magnétique est orienté dans le même axe que le spin et a une valeur qui varie en fonction de l’atome. Cette relation est représentée par
µ = γ I ħ
où γ correspond au rapport gyromagnétique, I est le moment de spin, µ est le moment magnétique et ħ est la constante de Planck divisée par 2π. Le rapport gyromagnétique est une constante qui est caractéristique des noyaux et elle permet de déterminer la fréquence de résonance de ce noyau dans un champ magnétique précis. En RMN, les noyaux les plus utilisés pour l’étude des protéines sont le 1H, le 13C ainsi que le 15N. Ces trois noyaux possèdent un spin de ½. De leur côté, les noyaux de 12C et de 14N possèdent respectivement des spins de 0 et de 1; ils sont remplacés par le 13C et le 15N lors du marquage isotopique. Ils peuvent interagir avec un champ magnétique externe (𝐵����⃗), selon 0 les règles de la mécanique quantique (Günther, 2013). En absence d’un champ magnétique externe, le vecteur d’aimantation élémentaire (𝑀��⃗) des atomes actifs en RMN sera orienté de façon aléatoire. L’échantillon est à l’équilibre et la somme des vecteurs d’aimantation de ces atomes actifs est alors nulle (Kastler et al., 2003). Lorsque cet échantillon est placé en présence d’un champ magnétique, les vecteurs des atomes vont s’orienter de façon parallèle ou antiparallèle à ce champ, comme illustré à la Figure 1.17.
Figure 1.17 : Comportement des spins des atomes actifs en spectroscopie RMN. A) En absence d’un fort champ magnétique. B) En présence d’un fort champ magnétique (Kastler et al., 2003).
26
En fonction de l’orientation des moments magnétiques des atomes (parallèles ou antiparallèles), l’énergie (E) sera différente. Comme il y a deux orientations possibles pour les noyaux possédant un spin de ½, il y a donc aussi deux niveaux d’énergie. En effet, il est possible d’observer plusieurs niveaux d’énergie dont le nombre est défini par 2I + 1. Dans les cas typiques pour la RMN des protéines, I = ½; par conséquent, on observe alors deux niveaux d’énergie et leur nombre quantique magnétique est soit + ½ ou – ½. La répartition sur les deux niveaux d’énergie se fait selon la distribution de Boltzmann
𝑁𝛽 𝑁𝛼 = 𝑒
−𝛥𝐸 𝑘𝑏𝑇
où N représente la population de spins sur les niveaux de basse (α) et haute (β) énergie, E représente l’énergie, kb la constante de Boltzmann et T la température.
Les noyaux qui possèdent une orientation parallèle seront situés au niveau de la plus basse énergie, alors que ceux qui sont antiparallèles correspondront à un plus haut niveau d’énergie; le nombre de noyaux possédant les deux niveaux d’énergie est environ équivalent. Toutefois, une faible proportion de protons aura un alignement préférentiel de façon parallèle, ce qui crée une aimantation macroscopique qui sera alignée avec le champ magnétique (B0) permettant ainsi la génération d’un signal RMN. L’excès de noyaux préférentiellement alignés engendre un vecteur d’aimantation macroscopique au niveau de l’échantillon. Cette différence varie selon la température ainsi que la force du champ magnétique. La Figure 1.18 montre l’effet de la force du B0 sur la différence d’énergie. Comme γ et ħ sont des constantes, la différence d’énergie (ΔE) est directement proportionnelle à 𝐵����⃗. 0
Lorsque l’échantillon est à l’équilibre dans le champ magnétique, le moment magnétique des atomes possède un mouvement de précession autour de 𝐵����⃗ avec un angle précis; il 0
27 s’agit de la composante z qui est aussi appelée aimantation longitudinale ((𝑀�����⃗) ≠ 0) (voir 𝑧 Figure 1.19).
Figure 1.18 : Différence énergétique entre deux populations de protons lorsqu’ils sont soumis à un fort champ magnétique (Kastler et al., 2003).
Afin d’enregistrer un spectre RMN, il faut appliquer un champ de radiofréquence (RF) aux molécules pendant un temps donné. Ce champ de RF est aussi appelé impulsion de RF. Cette impulsion varie en fonction du noyau à étudier. Lorsque la résonance du spin du noyau est égale à B0, il y a une inversion de spin qui est caractérisée par une transition entre les différents niveaux d’énergie (- ½ et + ½). Il y a résonance seulement lorsque l’énergie d’un proton (la fréquence de l’onde électromagnétique) permet la transition entre les niveaux d’énergie. Un mouvement de précession sera créé comme illustré à la Figure 1.19 (Deleu et al., 1998). Comme illustré à la Figure 1.19, lors de la génération de l’onde RF, la composante d’aimantation longitudinale ((𝑀�����⃗) diminuera et il y a aura une 𝑧 augmentation progressive de la composante d’aimantation transversale ((𝑀�������⃗). Cette 𝑥𝑦 impulsion est très courte, de l’ordre des µsec. Le vecteur d’aimantation basculera, normalement à 90º (𝑀�����⃗=0) ou à 180º ((𝑀𝑧 �����⃗)= -((𝑀𝑧 �������⃗)). Après la génération de l’onde RF, 𝑧0 soit après l’excitation, le vecteur d’aimantation retourne à son état initial d’équilibre, soit dans la direction de 𝐵����⃗. Lors de ce retour, la composante 𝑀0 �������⃗ diminuera et la composante 𝑥𝑦 𝑀𝑧
28
Figure 1.19 : Mouvement de double précession créé lors de l’application de deux champs magnétiques (Kastler et al., 2003).
Le vecteur des atomes tournera donc autour de l’axe du champ 𝐵�����⃗. C’est l’onde générée 0 par le retour à l’équilibre de ces vecteurs qui permet d’obtenir un signal RMN. Il s’en suit une perte de cohérence des spins qui est due à une interaction entre les différents vecteurs d’aimantation. Les champs magnétiques générés par les noyaux vont modifier la fréquence de précession des noyaux qui sont à proximité les uns des autres (Kastler et al., 2003). Le mécanisme du retour à l’équilibre des noyaux excités par une onde de RF inclut deux composantes de relaxation. La première est dans le plan transversal; elle est due aux interactions entre les différents spins (temps de relaxation transversal (T2)). La deuxième est le temps de relaxation longitudinal qui est dû au spin-réseau (temps de relaxation longitudinal (T1)). Le signal qui sera enregistré se nomme FID (Free Induction
Decay) et correspond à une superposition de plusieurs ondes sinusoïdales. Afin d’obtenir
un spectre de fréquence, il suffit de transformer cette superposition d’onde à l’aide de la transformée de Fourier (FT, Figure 1.20). Les déplacements chimiques sont caractéristiques de chaque noyau. En effet, ils dépendent de l’environnement chimique où se situe ce noyau. Les noyaux et les électrons possédant un moment magnétique vont créer un écran qui sera ressenti par tous les noyaux environnants. L’aire du pic en RMN
29 correspond au nombre d’atomes ayant les mêmes caractéristiques (même environnement chimique = même déplacement chimique).
Figure 1.20 : Spectre de fréquence transformé en déplacement chimique par une transformée de Fourier (Auger, Spectroscopie moléculaire avancée, 2012). (Auger, 2011)
Tous les atomes ne donnent pas des singulets (pics possédant un seul maximum); en effet, il y a un phénomène de couplage qui se produit lorsque des noyaux actifs sont près les uns des autres. La fréquence de résonance de tous les noyaux est donc reliée à leur environnement. C’est cet effet qui crée les couplages ainsi que les déplacements chimiques (δ). Les spectres RMN sont représentés par des déplacements chimiques qui sont exprimés en partie par millions (ppm) car leur position ne varie pas en fonction de la force de l’aimant utilisé. Ils sont donc les mêmes pour tous les appareils RMN. Cependant, la fréquence de résonance, soit l’autre unité de mesure en RMN, dépend du champ magnétique utilisé. Par la suite, des spectres à deux dimensions sont enregistrés, les premiers étant généralement des 1H-15N HSQC. Ces mesures ne nécessitent pas de marquage au 13C, qui est beaucoup plus coûteux, et permettent d’obtenir plusieurs informations. En effet, ces spectres permettent d’observer les différents groupements