Structure et composition de la végétation de marécages
isolés et riverains dans le sud du Québec
Mémoire
Laurie Bisson Gauthier
Maîtrise en biologie végétale
Maître ès sciences (M. Sc.)
Québec, Canada
iii
Résumé
Ce projet visait à caractériser la structure et la composition de la végétation de marécages isolés et riverains dans la région des Basses-terres du Saint-Laurent, dans le sud du Québec. Des inventaires de végétation ont été réalisés dans 56 marécages répartis dans deux bassins versants. Les caractéristiques physiques du sol, la micro et la macrotopographie, ainsi que l’occupation du territoire y ont été inventoriés.
Des différences de composition ont été observées entre les marécages isolés et riverains, ces derniers montrant une abondance plus élevée d’herbacées latifoliées et de ptéridophytes, deux groupes de plantes associés à un bon drainage des sols. Les marécages isolés montraient une richesse et une diversité en espèces plus élevées que les marécages riverains, mais ces derniers possédaient le plus d’arbres à fort diamètre. Les résultats de cette étude suggèrent que des mesures de gestion distinctes devraient être élaborées pour ces deux types de marécages.
v
Abstract
This project aimed to characterize the structure and composition of isolated and riparian swamps in the St. Lawrence lowlands region of southern Quebec. Vegetation surveys were made in 56 swamps distributed in two watersheds. We also collected data on soil physical characteristics, microtopography, topography and land use of those swamps.
Isolated and riparian swamps showed differences in vegetation composition. Herbaceous broad-leaved plants and pteridophytes which are both associated with good soil drainage were more abundant in riparian swamp. The most important factors driving this pattern were associated with soil wetness that positively impacted plant establishment. Isolated swamps showed higher richness and diversity than riparian swamps but the latter had bigger trees. These distinctions might reflect the differences in the ecosystem services such swamps provide and suggest the need for management scenarios adapted to swamp types in order to preserve their biodiversity and associated ecosystem services.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ...ix
Liste des figures ...xi
Remerciements ...xv
Avant-propos ... xvii
Chapitre 1 : Introduction générale ... 1
1.1 Problématique ... 1
1.2 Définitions ... 2
1.3 Facteurs déterminant la composition végétale des marécages ... 4
1.4 Le recrutement et les adaptations des espèces ... 7
1.5 Pressions humaines sur les marécages ... 9
1.6 Services écologiques rendus par les marécages ... 10
1.7 Objectifs et hypothèses ... 11
Chapitre 2 : Influence des conditions hydrologiques sur la structure et la composition de la végétation de marécages dans le sud-est du Canada. ... 13
2.1 Résumé ... 13
2.2 Introduction ... 14
2.3 Méthodes ... 16
2.3.1 Aire d’étude ... 16
2.3.2 Sélection des marécages et plan d’échantillonnage ... 18
2.3.3 Récolte des données ... 19
2.3.4 Analyses statistiques ... 22
2.4 Résultats ... 25
2.4.1 Composition des communautés végétales des marécages ... 25
2.4.2 Stratification verticale de la végétation... 28
2.4.3 Composition des strates de végétation selon le type de marécage ... 30
2.4.4 Influence des variables environnementales sur la végétation herbacée ... 32
2.4.5 Diversité alpha, diversité bêta et richesse... 33
2.4.6 Diamètre des arbres et importance relative des espèces arborescentes ... 35
viii
2.5.1 Dynamique et répartition de la végétation ... 38
2.5.2 Influence des conditions environnementales sur la composition en herbacées latifoliées et en ptéridophytes... 40
2.5.3 Richesse et diversité ... 41
2.5.4 Abondance des gros arbres ... 43
2.5.5 Implications pour la conservation ... 44
Chapitre 3 : Conclusion générale ... 47
3.1 Apport de la recherche ... 47
3.2 Avenues de recherche ... 48
Liste des références ... 51
ix
Liste des tableaux
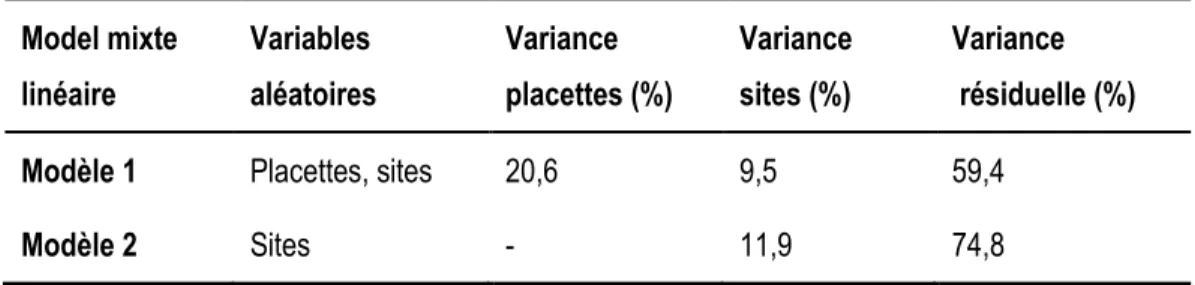
Tableau 1 Variables de l’environnement utiles à la caractérisation des marécages récoltées sur le terrain ou obtenues à partir de documents cartographiques. ... 20 Tableau 2 Stratification de la végétation et nombre d’espèces observées au sein de chacune des classes. Certaines espèces peuvent être classées dans plus d’une strate étant donné les différents stades de croissance sous lesquels on peut les trouver (ex : Acer rubrum peut se trouver dans les strates régénération 0-1 m, Arbustive haute 1-4 m, arborescente inférieure et supérieure). ... 22 Tableau 3 Description détaillée des 13 communautés végétales formées selon l’analyse de partitionnement par la méthode des K centroïdes et leurs espèces indicatrices. Les groupes ont été placés dans le tableau suivant leur ressemblance en termes de composition. (Voir annexe 3 pour le détail des acronymes) ... 27 Tableau 4 Variance expliquée par les variables aléatoires (placettes et sites) et variance résiduelle pour deux modèles mixtes linéaires qui comparent les DHP des gros arbres (<25 cm DHP) des marécages isolés et riverains. ... 36 Tableau 5 Fréquence, dominance, densité et valeur d’importance relative des gros arbres (DHP>25 cm) des marécages isolés et riverains. La valeur d’importance relative est obtenue par l’addition de la fréquence, de la dominance et de la densité relative d’une espèce. (Voir annexe 3 pour le détail des acronymes) ... 37
xi
Liste des figures
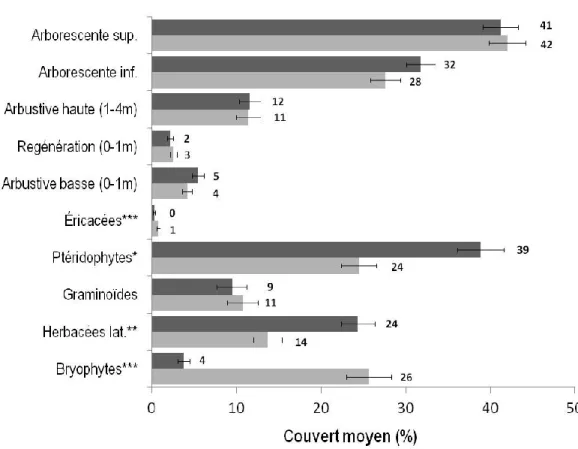
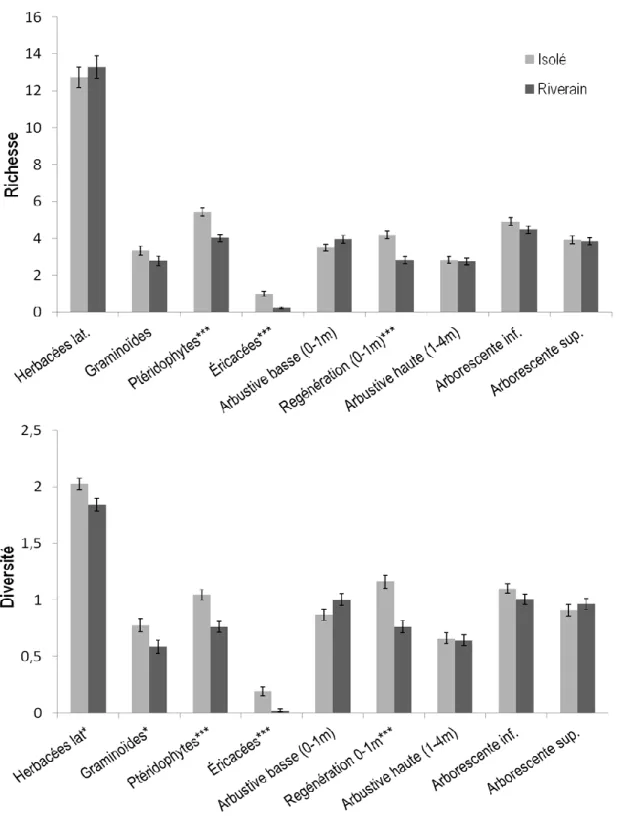
Figure 1 Localisation des 56 marécages (carrés verts, isolés ; triangles bleus, riverains) dans les bassins versants des rivières Bécancour et Yamaska, sud du Québec, Canada. Les histogrammes indiquent la température moyenne mensuelle (⁰C) et les précipitations mensuelles sous forme de pluie (mm) et sous forme de neige (cm) sur une période de 30 ans pour les villes de Trois-Rivières, Thetford Mines, Sorel et Brome (Météo Media 2013). ... 17 Figure 2 Pourcentage de recouvrement moyen (avec erreur-type) des 10 strates de la végétation pour les marécages isolés et riverains. Les astérisques correspondent au seuil de signification de la régression ordinale : * p≤0,05, ** p≤0,01, *** p≤0,001. Les valeurs coiffant chaque bâtonnet correspondent aux pourcentages de couvert moyen. ... 29 Figure 3 Analyses en composantes principales (ACP) de la végétation selon les strates. Chaque graphique montre la distribution des 213 placettes en fonction de leurs données d’abondance d’espèces pour une strate en particulier selon les deux premiers axes de l’ACP. Les cercles verts illustrent les placettes isolées, les cercles bleus les placettes riveraines. ... 31 Figure 4 Analyse canonique de redondance des données d’abondance d’espèces contraintes aux variables environnementales. Le graphique affiche les 213 placettes (cercles verts, placettes isolées ; cercles bleus, placettes riveraines) selon l’abondance d’espèces herbacées. Le détail des abréviations des variables environnementales présentées dans ce graphique se trouvent au tableau 1. ... 33 Figure 5 Richesse et diversité moyenne (avec erreur-type) des différentes strates de la végétation (excluant les invasculaires) des marécages isolés et riverains. Les astérisques correspondent au seuil de signification du test de t par permutations : * p≤0,05, ** p≤0,01, *** p≤0,001... 34 Figure 6 Fréquence de distribution des gros arbres (DHP> 25 cm) dans les marécages isolés et riverains, toutes espèces confondues. ... 36
xiii
À ces amoureux de la nature, dévoués, qui consacrent un temps fou à faire avancer la recherche pour la conservation des écosystèmes et qui gardent espoir qu’un jour, l’Homme en réalisera toute l’importance et la splendeur.
xv
Remerciements
J’aimerais d’abord remercier Monique Poulin d’avoir cru en mes capacités et de m’avoir confié ce projet de maîtrise. J’ai toujours senti que tu étais là pour me supporter dans toutes les étapes de ce projet, mais je voudrais surtout te remercier pour ta douceur, ton dynamisme et ta façon de mettre en valeur les bons coups plutôt que les échecs. Merci pour tous ces commentaires positifs qui donnent juste assez d’énergie pour terminer les moments de travail intensif! Finalement, merci pour tes fous rires qui ont si souvent égaillé nos rencontres. Merci aussi à Marcel Darveau de m’avoir accepté dans son équipe Boréale même si mon projet était plutôt méridional et qu’il ne concernait ni les canards, ni les castors! Merci aussi pour ta vision d’ingénieur forestier qui m’a fait voir les marécages sous un autre œil. Merci aussi à Richard Fournier pour avoir si bien chapeauté ce projet Ouranos. J’aimerais remercier tous les étudiants du laboratoire Poulin. Sans vous, les études graduées auraient été beaucoup moins divertissantes! Merci pour les conversations de statistiques et de rédaction, les 5 à 7, les congrès ici ou à l’international, les voyages en train Québec-Montréal et les dîners tout simples au labo, mais qui donnaient un boost pour terminer la journée. Un grand merci à vous tous pour vos conseils et votre support incroyable. J’ai eu la chance de vous avoir comme mentors puisque j’ai commencé après la majorité d’entre vous. Vous m’avez conseillée et aidée dans toutes les étapes de ma maîtrise et je vous en remercie grandement. Je voudrais remercier tout spécialement Laurent de Vriendt, Frédérique Gagnon-Lupien, Audrey Comtois et Émilie Lessard pour avoir passé tellement de temps avec moi dans les marécages à identifier plus de 300 espèces végétales, les deux pieds dans la bouette et en compagnie des moustiques. Merci Fred pour tes connaissances en foresterie qui ont su compléter ma formation d’écologiste…animale! Sans cette équipe d’une efficacité légendaire sur le terrain, je serais sûrement encore en train de terminer la première placette. Un gros merci à Eduardo Gonzalez Sargas pour ses conseils et son implication dans le choix et l’exécution de mes analyses statistiques multivariées. Merci à tous les membres du GRET, pour votre présence fidèle aux présentations, pour les midis GRET et pour le prêt de matériel. Je voudrais aussi remercier toute l’équipe de Canards Illimités Canada qui m’ont accueillie à bras ouverts. Ce fût un privilège de faire ma maîtrise au sein d’une équipe multidisciplinaire et vivante comme la vôtre. Un grand merci à Jason Beaulieu, Stéphanie Murray, mais surtout à Simon Perrault pour m’avoir énormément aidé avec ArcGIS au moment où j’en avais vraiment besoin ! Sans toi mon terrain n’aurait jamais pu commencer à temps. Un gros merci à Christian Roy qui a donné beaucoup
xvi
de son temps et de son énergie à tenter de régler la pseudo-réplication dans mon jeu de données et qui s’est acharné à m’expliquer les dessous des régressions ordinales. Merci à Geneviève Courchesne, pour tous les conseils que tu m’as donnés quand j’étais en début de projet et qui ont forgé la base de mon protocole d’échantillonnage. Ta passion pour les marais m’a vraiment motivée à en savoir plus sur les milieux humides et à tripper sur les marécages. Merci à Martin Joly et Adeline Bazoge du MDDEFP pour m’avoir montré mes premiers marécages et m’avoir fait découvrir le bassin versant de la rivière Bécancour.
Merci à mes amis, biologistes ou pas, qui m’ont conseillée mais qui ont surtout été compréhensifs lors de mes moments de travail intense. Plusieurs d’entre vous avez été des modèles pour moi. Un merci spécial pour Geneviève Dufour Tremblay, qui a toujours accepté avec plaisir de relire mes textes et qui m’a donné de très bons conseils. Merci aussi à ma famille, mes parents, ma sœur, les enfants, pour votre présence et nos petits soupers du dimanche soir. Je voudrais aussi dire merci à Pierre-Étienne de m’avoir écoutée, supportée, encouragée, rassurée, aidée avec tout ce qui concerne l’informatique et la correction de textes. Merci de m’avoir faite rire dans les moments plus difficiles.
Finalement, j’aimerais remercier tous les partenaires financiers de ce projet : l’organisme de conservation Canards Illimités Canada, le Ministère du Développement Durable, de l’Environnement, de la Faune et des Parcs, le Fond BMP lnnovation (un partenariat entre le Fond de recherche du Québec-Nature et technologie et le Conseil de recherches en sciences naturelles et en génie du Canada), le Consortium sur la climatologie régionale et l'adaptation aux changements climatiques Ouranos, le Centre de la Science de la Biodiversité du Québec, l’Université Laval et l’Université de Sherbrooke.
xvii
Avant-propos
Cette maîtrise a été réalisée dans le cadre du projet Outils d'analyses hydrologique, économique et
spatiale des services écologiques procurés par les milieux humides des Basses-terres du St-Laurent : adaptations aux changements climatiques, dirigé par Richard Fournier de l’Université de
Sherbrooke et financé par le Plan d’action 2006-2012 sur les changements climatiques du Québec - mesure 26, par l’entremise du Consortium sur la climatologie régionale et l'adaptation aux changements climatiques Ouranos. Mon projet de maîtrise abordait l’écologie végétale des marécages et était complémentaire aux travaux portant sur l’hydrologie, la cartographie des services écologiques et la valeur économique des milieux humides du sud du Québec.
Le chapitre 2 de ce mémoire, intitulé Influence des conditions hydrologiques sur la structure et la
composition de la végétation de marécages dans le sud-est du Canada a été rédigé sous la forme
d’un article scientifique. Ce chapitre constitue le cœur de mon mémoire, pour lequel j’ai (Laurie Bisson Gauthier) élaboré le plan d’échantillonnage, récolté les données sur le terrain, effectué les analyses statistiques, ainsi que l’interprétation des résultats obtenus, et rédigé un manuscrit. Monique Poulin (directrice), Marcel Darveau (co-directeur), Richard Fournier (co-directeur) et Eduardo González Sargas (stagiaire post-doctoral) m’ont conseillée pour la mise en œuvre du plan d’échantillonnage, pour les analyses statistiques et lors de la révision du manuscrit. De ce fait, je suis la principale auteure de cet article et ces quatre collaborateurs en sont co-auteurs. L’article a été rédigé en français pour le mémoire mais sera traduit en anglais et adapté pour publication dans la revue scientifique Plant Ecology.
1
Chapitre 1 : Introduction générale
1.1 Problématique
Avant que l’importance des milieux humides pour les services écologiques qu’ils rendent à la société ne soit reconnue, ces écosystèmes étaient plutôt considérés comme des espaces perdus limitant l’expansion des surfaces cultivables. La seule façon de les utiliser était alors le drainage intensif (Mitsch et Gosselink 1986). Ainsi, dans la première moitié du 20e siècle uniquement, l’ensemble des
pressions anthropiques ont causé la perte d’au moins 50 % des milieux humides planétaires (IUCN 1996).
Au Québec, la région des Basses-terres du Saint-Laurent est la plus populeuse et est bien connue pour sa production agricole soutenue (Jobin et al. 2003). En effet, au cours du dernier siècle, l’expansion agricole a fortement modifié le paysage de cette région (Ruiz et Domon 2005). Plus précisément, 30 000 km de cours d’eau y ont été linéarisés et 10 000 km y ont été créés de toutes pièces afin d’améliorer le drainage et la productivité des terres cultivables (Beaulieu 1999). De ce fait, la majorité des milieux humides des Basses-terres du Saint-Laurent ont disparu et ceux qui sont encore présents aujourd’hui sont altérés par une activité humaine incessante (Joly et al. 2008). Selon Canards Illimités Canada (2006), les marécages résiduels de ce secteur sont très fragmentés et leurs fonctions écologiques en sont grandement affectées, ce qui souligne l’urgence d’étudier les communautés végétales de ces milieux pour mieux encadrer leur conservation.
Les prochaines sections de l’introduction de ce mémoire permettront de définir ce qu’est un marécage, un système riverain et un système isolé, ainsi que d’aborder les facteurs qui influencent l’établissement des communautés végétales dans les marécages, les services écologiques rendus par ces derniers et les menaces qui les guettent.
2
1.2 Définitions
Marécage
Notre façon de classifier les terres humides est directement liée à la perception qu’on se fait de ces milieux et à l’utilisation qu’on souhaite donner au système de référence employé (Zoltai et Vitt 1995). Pour les besoins de ce projet, nous avons retenu le Système de classification des terres humides du
Canada élaboré par le Groupe de travail national sur les terres humides (1997). Ce système de
classification définit les différentes classes de milieux humides en se basant sur les interrelations qui existent entre les composantes biotiques et abiotiques de ces écosystèmes (Zoltai et Vitt 1995). Il s’attarde plus précisément à leurs particularités en ce qui concerne les sols, l’hydrologie et la végétation (Groupe de travail national sur les terres humides 1997). La définition d’un marécage établie par le Système de classification des terres humides du Canada est à la base de la cartographie détaillée des milieux humides utilisée pour ce projet, ce qui renforce le choix de cette classification (Canards Illimités Canada et Ministère du Développement durable, de l’Environnement, de la Faune et des Parcs 2012).
Selon le Système de classification des terres humides du Canada, un marécage se définit de façon générale comme étant : «une terre humide dominée par les arbres ou les grands arbustes et influencée par l’eau souterraine minérotrophe, sur des sols minéraux ou organiques». Plus précisément, la strate arborescente ou arbustive de ces milieux couvre au minimum 25 % de la superficie et fait généralement plus d’un mètre de hauteur (Groupe de travail national sur les terres humides 1997). La nappe phréatique des marécages est généralement très superficielle et inonde le terrain selon le cycle des périodes de crues (Zoltai et Vitt 1995), mais dépasse rarement deux mètres au-dessus du niveau du sol (Groupe de travail national sur les terres humides 1997). En période d’étiage, la nappe phréatique s’abaisse et peut se situer jusqu’à environ 50 cm sous la surface du sol (Buteau et al. 1994). On trouve dans les marécages de petites dépressions, généralement peu profondes, qui accumulent l’eau des précipitations de façon temporaire ou semi permanente. Ces dépressions, appelées étangs vernaux, retiennent l’eau au niveau du sol et s’assèchent normalement en période d’étiage (Brooks et Hayashi 2002; Zedler 2003; Calhoun et DeMaynadier 2007). Dans certains marécages, on trouve aussi une accumulation de tourbe d’origine ligneuse très décomposée, c’est-à-dire pour laquelle on attribue une cote plus grande que cinq sur l’Échelle de
3
Von Post (Saucier 1994; Groupe de travail national sur les terres humides 1997). L’état de cette
tourbe est dû aux fluctuations de la nappe, qui permettent la dégradation de la matière organique par les bactéries lors du retour de l’oxygène dans le sol (Mitsch et Gosselink 1986). Selon Buteau et al. (1994), l’épaisseur de la couche de tourbe varie entre les sites et peut égaler 50 cm, voire même atteindre 1 m selon le Groupe de travail national sur les terres humides (1997). Cette quantité de tourbe est comparable à celle que l’on retrouve dans les tourbières ombrotrophes et minérotrophes. Par contre, la tourbe ligneuse trouvée dans les marécages est principalement composée de fragments de végétation arborescente, arbustive et herbacée, alors que celle des bogs (ombrotrophes) se compose de sphaignes, d’éricacées, ainsi que de linaigrettes, et que celle des
fens (minérotrophes) est plutôt constituée de mousses brunes et de carex (Buteau et al. 1994;
Groupe de travail national sur les terres humides 1997).
Le Système de classification des terres humides du Canada, on reconnait quatre groupes physionomiques de marécages : arbustifs (taillis), conifériens, feuillus et mixtes. Les érablières argentées (Acer saccharinum L.) et les cédrières (Thuja occidentalis L.) sont, par exemple, deux types de marécages trouvés au Québec. Les marécages sont les milieux humides qui ont la structure verticale la plus complexe ; la végétation s’y organise en trois strates principales soit arborescente, arbustive et non ligneuse. Cette dernière inclut les bryophytes, les ptéridophytes, les herbacées latifoliées et les graminoïdes (Zoltai et Vitt 1995). D’une part, la végétation des strates végétales plus basses reflète les perturbations hydrologiques qui ont lieu à court terme et qui limitent l’établissement des espèces. D’autre part, la strate arborescente traduit les fluctuations du niveau d’eau qui s’y produisent à long terme (Naiman et al. 2005).
Systèmes isolés et riverains
Bien que notre définition d’un marécage se base sur le Système de classification des terres humides
du Canada, une approche hydrogéomorphologique de la classification des milieux humides est
également nécessaire pour décrire adéquatement le contexte hydrologique des marécages. Le
Système de classification américain des terres humides (Cowardin et al. 1979) et les précisions
apportées par Brooks et al. (2011) ont permis de définir les systèmes riverains et isolés en tenant compte de leurs différences géomorphologiques, de leur position dans le paysage et des sources hydrologiques associées à ces écosystèmes.
4
Les systèmes riverains
Les systèmes riverains englobent toute terre humide et eau profonde comprise dans le canal d’un cours d’eau (Cowardin et al. 1979) ainsi que les plaines inondables bordant ce dernier (Brooks et al. 2011). Cette définition s’appuie sur le fait qu’un cours d’eau et sa plaine d’inondation sont fonctionnellement liés par l’hydrologie (Friedman et Auble 2000) et l’apport en éléments nutritifs associé (Brinson 1993). L’hydropériode des milieux riverains est régie par l’eau souterraine (Mitsch et Gosselink 1986) et par l’apport en eau de surface provenant directement du cours d’eau adjacent et suivant la fréquence des inondations (Middleton 2002). Selon Naiman et al. (2005), la fréquence des inondations varie d’un type de cours d’eau à un autre. Par exemple, le régime de précipitations aura un effet plus grand sur de petites rivières que sur des grosses, causant un nombre plus important de débordements vers l’écosystème riverain adjacent (Naiman et al. 2005).
Les systèmes isolés
Les systèmes isolés (ou palustres, selon Cowardin 1979) se distinguent des systèmes riverains par leur absence de connectivité à un cours d’eau ou à un plan d’eau et ne subissent donc pas l’effet de leurs périodes de débordement. Ces milieux sont plutôt sous l’influence des fluctuations de la nappe phréatique. On regroupe les milieux isolés en trois catégories : de terrain plat, de pente et de dépression (Brooks et al. 2011; Teixeira et al. 2011). Ces trois types de milieux se forment dans des systèmes de précipitations et d’écoulements, c'est-à-dire que leur nappe phréatique est respectivement alimentée par l’eau des précipitations ou par l’eau riche en éléments nutritifs et minéraux qui ruisselle dans le sol (Buteau et al. 1994).
1.3 Facteurs déterminant la composition végétale des
marécages
L’hydrologie
L’amplitude, la fréquence, le moment et la durée des inondations affectent les communautés végétales au sein des milieux humides (Mitsch et Gosselink 1986; Cronk et Fennessy 2001; Naiman
et al. 2005). De tous ces facteurs, la durée de l’inondation est celui qui a le plus d’impact sur la
végétation (Naiman et al. 2005). Ces conditions de stress qui prévalent dans les marécages vont limiter le nombre d’espèces qui peuvent s’y établir et donc la richesse en espèces (Amigo et al. 2004;
5 Rodriguez-Gonzalez et al. 2008; Mata et al. 2011). En période d’anoxie prolongée, même les espèces spermatophytes tolérantes aux inondations ont besoin du retrait de l’eau pour la germination des graines (Rheinhardt et Hershner 1992; Casanova et Brock 2000). En milieu tropical, plusieurs auteurs ont observé une faible diversité et une dominance de quelques essences d’arbres dans les marécages, contrairement à ce que l’on retrouve dans les milieux terrestres adjacents (Koponen et
al. 2004; Macia 2011; Mata et al. 2011). Plusieurs études montrent aussi que les strates inférieures
de la végétation ont une bien plus grande diversité d’espèces grâce à la microtopographie qui prévaut au niveau du sol et qui permet à certaines d’entre elles de s’établir au-dessus de la nappe phréatique à certains endroits (Dabel et Day 1977; Rheinhardt 1992; Mata et al. 2011).
L’hydrologie affecte aussi la productivité et la décomposition de la végétation dans les marécages (Zoltai et Vitt 1995). Premièrement, la productivité est très influencée par la durée des inondations. Aux États-Unis, plusieurs études ont montré une variation de la production primaire dans des marécages possédant des degrés de drainage différents. Dans une étude menée par Mitsch et Ewel (1979), la productivité primaire de forêts marécageuses de cyprès (Taxodium distichum L.) était plus importante pour les sites où les conditions de drainage étaient intermédiaires, contrairement aux sites plus humides ou secs. Conner and Day (1982) ont observé le même phénomène, leur étude montrant que la productivité est plus importante dans les marécages inondés de façon saisonnière que dans les marécages où l’eau est plutôt stagnante ou mieux drainée. Cette plus grande productivité primaire dans les marécages aux conditions de drainage intermédiaires s’explique par la quantité importante de d’éléments nutritifs laissés par le cours d’eau adjacent lors de chaque débordement (Mitsch et Gosselink 1986). Deuxièmement, dans certains marécages, les inondations prolongées ralentissent la décomposition des débris végétaux au sol et favorisent l’accumulation de la tourbe. La quantité de tourbe trouvée sur un site peut donc être un bon indicateur de l’humidité d’un marécage (Rheinhardt 1992; Rheinhardt 2007). À l’inverse, la décomposition s’exerce plus rapidement dans les sites possédant un bon taux d’humidité, à condition qu’ils ne soient pas inondés de façon permanente (Mitsch et Gosselink 1986)
6
La biochimie
Selon Lockaby et Walbridge (1998), la biochimie des milieux humides forestiers est extrêmement complexe et difficile à étudier en raison des différences de valeurs de pH et d’abondance en éléments nutritifs qui existent à l’intérieur d’un même marécage. Dans les marécages isolés, les pH de l’eau et du sol sont généralement acides (pH=4-5); on a même rapporté un pH de 3,5 dans les marécages de cyprès du sud-est des États-Unis (Mitsch et Gosselink 1986). Le pH acide des marécages isolés dépend de l’épaisseur de la tourbe, mais aussi de la proportion que prennent les précipitations dans l’alimentation en eau des marécages. Les pH les plus faibles sont mesurés lorsque la tourbe est épaisse et que les eaux de précipitations sont la principale source d’eau qui alimente le milieu. Dans les marécages riverains, les pH de l’eau et du sol sont plutôt neutres (pH=6-7) en raison de l’apport en eau provenant de la rivière adjacente (Mitsch et Gosselink 1986). Selon Brinson (1977), le cycle des éléments nutritifs et minéraux d’un marécage est lié à la fréquence des inondations qu’il subit. La quantité d’éléments nutritifs et minéraux varie de faible pour les marécages isolés du réseau hydrographique à élevée dans le cas des marécages riverains (Mitsch et Gosselink 1986; Mata et al. 2011). La grande quantité d’éléments nutritifs des sols des marécages riverains favorise la croissance de la végétation (Økland et al. 2001).
Pendant les périodes d’inondations, il y a aussi accumulation de certains composés comme les cations de zinc, de manganèse et de cuivre (Laanbroek 1990) qui, en grande quantité, peuvent être toxiques pour les plantes (Cronk et Fennessy 2001). L’action des bactéries anaérobiques dans le sol libère aussi des déchets comme l’éthanol, qui viennent s’ajouter aux autres composés toxiques qui nuisent à la croissances des plantes de milieux humides (Cronk et Fennessy 2001).
La lumière
Selon Gavin et Peart (1997), les trouées dans la voûte forestière, qui créent un gradient d’intensité lumineuse dans le milieu, ont une influence directe sur la structure et la composition des communautés végétales des marécages. En effet, les multiples conditions de luminosité contribuent à augmenter l’hétérogénéité dans le milieu et favorisent la coexistence d’espèces tolérant différents degrés de lumière (Rheinhardt 1992). Selon Canham (1989), les trouées dans le couvert forestier agissent aussi comme un facteur essentiel à la régénération de la strate arborescente. Par exemple, une étude menée dans un marécage en milieu tropical a montré que la présence de trouées a un
7 effet important sur la germination ainsi que sur la croissance et sur la densité des semis de l’espèce arborescente Tetramerista glabra (Gavin et Peart 1997). Une autre étude visant à comparer l’importance du drainage et de la luminosité sur la structure et la composition de la végétation dans les marécages apporte toutefois des éléments de nuance quant à l’importance des trouées pour la végétation (Teixeira et al. 2011). En effet, ces résultats montrent que le drainage peut influencer davantage la composition de la végétation que ne le fait la luminosité.
La microtopographie
La microtopographie joue également un rôle important dans l’arrangement des communautés végétales au sein d’un marécage. En effet, dans un milieu où les inondations sont prolongées, la microtopographie du sol forme un gradient de drainage (Scarano et al. 1997) qui permet l’établissement des communautés végétales dans les différentes niches écologiques disponibles (Rheinhardt 1992).
L’hétérogénéité du milieu à fine échelle est donc très importante pour la coexistence d’un nombre varié d’espèces végétales, nécessitant toutes des conditions environnementales particulières (Teixeira et al. 2011). Par exemple, dans un marécage de dépression, des espèces moins tolérantes aux conditions anoxiques peuvent s’établir en bordure de la dépression où il y a une légère pente, car les périodes d’inondation y sont plus courtes (Mata et al. 2011). Dans les marécages riverains, les inondations irrégulières et parfois violentes combinées à des sols instables entraînent la création de chablis (Teixeira et al. 2011), ceux-ci étant des éléments importants de la microtopographie. La colonisation de ces nouvelles niches écologiques par la végétation est influencée par les méthodes d’adaptation et de survie aux inondations des espèces ainsi que par leur mode de dispersion (Urquhart 2004).
1.4 Le recrutement et les adaptations des espèces
La dissémination des graines est très importante pour maintenir la biodiversité d’un écosystème. Pour certaines espèces des milieux humides, un des modes de dissémination est l’hydrochorie, soit le transport des diaspores (graines ou fragments de plante) par l’eau. Le rehaussement de la nappe d’eau lors de la fonte des neiges, le courant et les débordements d’un cours d’eau alimentés par de fortes précipitations et par le vent disséminent ces diaspores vers l’aval d’un bassin versant (Naiman
8
et al. 2005). Ainsi, chaque crue des eaux est un apport en graines pour le milieu (Mata et al. 2011).
La distance qui sépare un marécage d’un cours d’eau influence fortement la végétation qui s’y trouve (Rodriguez-Gonzalez et al. 2008). En effet, comme les graines sont disséminées à partir des écosystèmes de périphérie (Nilsson et al. 1994) vers l’ensemble du bassin versant par les corridors que forment les cours d’eau, un marécage plus isolé du réseau hydrographique aura un apport en diaspores plus faible qu’un marécage riverain (Rodriguez-Gonzalez et al. 2008). Pour les marécages isolés, la dissémination des graines par l’eau suit uniquement l’amplitude du rehaussement de la nappe à l’intérieur de la cuvette, ce qui en limite l’étendue. Par contre, d’autres modes de dissémination ont lieu dans les marécages, comme la zoochorie (dissémination par les animaux), l’anémochorie (dissémination par le vent, Mata et al. 2011) ainsi que par les pratiques agricoles et horticoles propres à l’humain (Naiman et al. 2005). Les graines des plantes de milieux humides doivent ainsi être adaptées à ces modes de dissémination. Par exemple, certaines espèces des marécages du golfe du Mexique profitent des inondations pour disséminer leurs graines flottantes à la surface de l’eau (Infante et Moreno-Casasola 2005). Pour d’autres espèces, comme celles de peupliers (Populus spp), les graines légères et duveteuses assurent une dissémination efficace par le vent (Braatne et al. 1996).
Lorsqu’un sol est inondé, tous les petits espaces normalement occupés par l’oxygène (O2) se
remplissent d’eau. Cette situation est problématique pour les plantes normalement adaptées aux milieux secs, puisqu’elles ne peuvent tolérer une nappe phréatique trop près du système racinaire (Malik et al. 2001). Le succès d’établissement des espèces végétales dans les marécages est dû à des adaptations physiologiques leur permettant de contourner les effets indésirables de ces conditions anoxiques. Le mouvement d’O2 de la tige vers les racines est crucial pour les plantes dont
le système racinaire est inondé sur une courte ou sur une longue période, ou pour les plantes complètement submergées (Voesenek et al. 2006). Les plantes faisant face à de telles conditions d’anoxie ont développé un aérenchyme, un tissu composé de grands espaces qui facilitent la diffusion de l’O2 de la partie émergée vers la partie inondée de la plante. De plus, chez les espèces
arborescentes, une hypertrophie des lenticelles sur le tronc et les branches permet une plus grande entrée d’oxygène dans les tissus (Topa et McLeod 1986). La formation d’un réseau de racines en surface et de racines adventives poussant hors de l’eau s’ajoute aux adaptations des plantes de marécages, leurs permettant de pallier le manque d’oxygène prolongé (Cronk et Fennessy 2001). L’élargissement de la base du tronc observé chez certaines espèces arborescentes est aussi une
9 adaptation en réponse aux sols humides et instables des marécages (Mitsch et Gosselink 1986), puisqu’il leur apporte une plus grande stabilité (Cronk et Fennessy 2001). Ainsi, lorsque le sol des marécages est inondé, que ce soit pour une courte ou pour une longue période, plusieurs traits fonctionnels travaillent en synergie pour approvisionner la plante en O2 et pour lui permettre de
survivre dans de telles conditions de stress (Colmer et Voesenek 2009).
1.5 Pressions humaines sur les marécages
Selon Brinson et Malvárez (2002), on peut regrouper les pressions exercées sur les terres humides en quatre catégories : 1) l’altération géomorphologique et hydrologique, 2) les contaminants et éléments nutritifs, 3) les récoltes, extinctions et invasions d’espèces et 4) les changements climatiques.
Depuis le milieu du 18ème siècle, les changements d’occupation des sols et des paysages,
principalement pour l’agriculture et l’urbanisation, ont engendré une perte de milieux humides importante en Amérique du Nord (Brinson et Malvárez 2002). Encore aujourd’hui, toute modification du régime hydrologique (moment, fréquence, amplitude des inondations et eutrophisation des masses d’eau) a un impact direct sur l’intégrité écologique des milieux humides qui persistent. Dans les régions où l’agriculture est intensive, c’est le drainage des terres qui cause le plus de dommages aux milieux humides (Zedler et Kercher 2005). À cette perturbation s’ajoute la construction de barrages (Cronk et Fennessy 2001) qui modifie considérablement le régime hydrologique des milieux humides, tant en amont qu’en aval des ouvrages (Brinson et Malvárez 2002).
En matrice agricole, les terres humides de l’aval d’un bassin versant subissent un apport élevé en éléments nutritifs. Cette eutrophisation permet l’établissement de plantes envahissantes qui font compétition aux plantes indigènes (Zedler et Kercher 2004). Les espèces envahissantes peuvent produire une quantité importante de graines qui seront dispersées vers les milieux humides (Cronk et Fennessy 2001). Par exemple, le roseau commun (Phragmites australis (Cavanilles) Trinius ex Steudel) est une des espèces de plantes envahissantes les plus répandues dans les milieux humides de l’est de l’Amérique du Nord. Des travaux menés sur l’importance des modes de dissémination de cette espèce ont mené à la conclusion que les graines jouent un rôle déterminant pour son établissement (Belzile et al. 2010). Suite à leur implantation, les plantes envahissantes vont coloniser de façon efficace et rapide le milieu grâce à leur mode de reproduction clonale, notamment par la
10
formation de rhizomes. Comme ces espèces tolèrent des concentrations élevées en éléments nutritifs, elles forment généralement un couvert dense qui ombrage les sites et limite la présence d’espèces intolérantes à l’ombre. Selon Perry et al. (2004), la grande quantité de rhizomes et de grosses racines produites par les plantes exotiques limite aussi l’espace disponible pour d’autres espèces.
La perte de biodiversité au sein des milieux humides est directement reliée à leur dégradation physique (Cronk et Fennessy 2001). En effet, un recensement des plantes rares et en danger aux États-Unis a montré que leur survie dépend directement de la protection des milieux humides résiduels (Murdock 1994). De plus, l’augmentation de la température planétaire moyenne causée par les émissions de CO2 augmentera ou diminuera la quantité de précipitations selon une région donnée
(IPCC 2013), et accroîtra ou limitera par le fait même la superficie de ses milieux humides (Brinson et Malvárez 2002). Selon Brinson et Malvárez (2002), les changements climatiques pourraient causer le retrait des milieux humides côtiers vers l’intérieur des terres et l’assèchement des milieux humides des zones intérieures comme les systèmes plats, de bas de pente ou de dépression. Ces changements affecteront aussi la qualité et la quantité des services écologiques fournis par les milieux humides.
1.6 Services écologiques rendus par les marécages
Selon Costanza et al. (1997), les services écologiques se définissent comme les bénéfices directs ou indirects que la population humaine retire des fonctions des écosystèmes. Selon le Millennium Ecosystem Assessment (2005), les services écologiques se classent en quatre grands groupes : 1) les services d’approvisionnement (nourriture, eau potable, combustible, etc.), 2) les services de régulation (climat, régime hydrologique, détoxification, etc.), 3) les services socioculturels (plein air, tourisme, etc.) et 4) les services de support (biodiversité, formation des sols, pollinisation, etc.). Les services écologiques plus spécifiques aux marécages se trouvent majoritairement dans les catégories des services d’approvisionnement et de support. La chasse, la rétention et la purification de l’eau, la protection des rives contre l’érosion, la présence d’espèces endémiques, l’accumulation et le recyclage des éléments nutritifs, ainsi que l’accumulation de matière organique en sont des exemples (Millennium Ecosystem Assessment 2005).
11 Le contrôle des inondations est un des plus importants services écologiques des marécages. En effet, les plaines d’inondation et les marécages isolés ont une très grande capacité de rétention de l’eau de surface et contribuent grandement à diminuer l’intensité des débordement lors des crues (Zedler et Kercher 2005; Fournier et al. 2013). Les marécages riverains améliorent aussi la qualité de l’eau en permettant le dépôt des particules en suspension dans la colonne d’eau, grâce au ralentissement du débit d’écoulement (Jonhston 1991). Dans les sols anoxiques des milieux humides se déroule aussi le processus de dénitrification, c’est-à-dire la réduction des nitrates en azote par les bactéries anaérobiques. De plus, les sols imperméables des marécages confinent l’eau et les sédiments à long terme, ce qui permet la sédimentation du phosphore qui s’unit aux particules du sol (Smil 2000). Ainsi, à l’échelle d’un bassin versant, les marécages isolés et riverains jouent un rôle déterminant dans la gestion de l’eau, en abaissant le débit lors des périodes de crues, en fournissant de l’eau en période d’étiages et en améliorant la qualité de l’eau.
1.7 Objectifs et hypothèses
L’objectif de ce projet de recherche était de mieux comprendre l’organisation de la végétation dans les marécages isolés et riverains des zones peuplées du sud du Québec, dans le but d’établir des connaissances de bases sur leur écologie et de contribuer à mieux encadrer leur conservation. Les objectifs spécifiques étaient 1) de caractériser la composition de la végétation des marécages isolés et riverains et déterminer l’influence des variables environnementales sur cette végétation, 2) de décrire la structure de la végétation des marécages isolés et riverains et 3) d’évaluer la richesse et les diversités alpha et bêta des deux types de marécages. La diversité alpha est la diversité en espèces que l’on trouve dans un seul site ou un seul quadrat, tandis que la diversité bêta est plutôt la variation de la composition en espèces entre les sites ou les quadrats de l’aire d’étude.
Plusieurs études ont montré l’importance du régime hydrologique sur l’établissement des communautés végétales dans les marécages (Rheinhardt 1992; Rheinhardt et Hershner 1992; Koponen et al. 2004; Teixeira et al. 2011). Les connaissances actuelles sur la végétation des marécages isolés et riverains en zone tempérée (Rheinhardt 2007; Cameron 2009; Peterson-Smith
et al. 2009) et en milieu tropical (Macia 2011; Mata et al. 2011) permettent d’émettre les hypothèses
12
1) Des différences devraient être observées dans la composition et dans la structure de la végétation des marécages isolés et riverains, et les principales variables environnementales responsables de cette divergence devraient êtres reliées aux conditions hydrologiques distinctes que l’on trouve dans ces deux types de marécages. Entre autre, on s’attend à observer des arbres de plus forte taille dans les marécages riverains, en raison des sols riches qui s’y trouvent.
2) Une richesse et une diversité alpha supérieures devraient être observées dans les marécages riverains, puisqu’ils ne sont inondés que de façon sporadique, que le cours d’eau facilite le transport des diaspores et que les débordements du cours d’eau enrichissent le sol en éléments nutritifs. On peut aussi s’attendre à ce que la diversité bêta des marécages riverains soit plus importante que celle des marécages isolés, en raison de la présence de variabilité dans les régimes hydrologiques des cours d’eau.
13
Chapitre 2 : Influence des conditions
hydrologiques sur la structure et la composition de
la végétation de marécages dans le sud-est du
Canada.
2.1 Résumé
Les marécages jouent un rôle déterminant dans le contrôle des inondations, améliorent la qualité de l’eau, limitent l’érosion des berges et soutiennent une grande biodiversité. Malgré l’importance de ces services écologiques pour les populations humaines, les marécages sont en déclin et très peu documentés dans le sud est du Canada. Cette étude visait à décrire les communautés végétales de marécages isolés et riverains ainsi que leur richesse et leur diversité. Nous avons échantillonné la végétation dans 28 marécages isolés et 28 marécages riverains répartis dans deux bassins versants, ainsi que les caractéristiques physiques du sol, la microtopographie, la topographie et l’occupation du territoire. Des 13 communautés végétales définies par analyse multivariée, quatre étaient inféodées aux marécages isolés, cinq aux marécages riverains et quatre étaient plutôt généralistes. La végétation des marécages isolés était caractérisée par l’abondance de bryophytes et la présence d’éricacées, suggérant que certains de ces marécages sont en processus de paludification. Dans les marécages riverains, l’abondance d’espèces à reproduction clonale (herbacées latifoliées et ptéridophytes) indiquait plutôt un rajeunissement fréquent de ces sites causé par les débordements du cours d’eau. La différence de composition végétale entre les deux types de marécages était d’autant plus prononcée pour les strates des herbacées latifoliées et des ptéridophytes. Cette distinction était principalement expliquée par des variables environnementales liées à l’humidité du sol, cette dernière étant plus importante dans les marécages isolés. Ceux-ci montraient aussi une richesse et une diversité en espèces plus importante que les marécages riverains. L’organisation hydrogéomorphologique des marécages ayant une influence sur la composition, la structure et la diversité de la végétation qu’on y trouve, ce qui nous porte à croire que les marécages isolés et riverains rendent des services écologiques différents dont on devrait tenir compte lors de l’élaboration de plans de conservation des ces milieux humides.
14
2.2 Introduction
Les milieux humides forestiers sont des écosystèmes d’une grande importance puisqu’ils rendent d’innombrables services écologiques, par exemple en participant au contrôle des débits d’eau en période de crue ou d’étiage, à la purification de l’eau, à la séquestration du carbone et au support d’une grande biodiversité (Golet et al. 1993; Cronk et Fennessy 2001; Millennium Ecosystem Assessment 2005; Zedler et Kercher 2005; Fournier et al. 2013). Dans le nord-est de l’Amérique du Nord, les marécages arborescents sont principalement dominés par l’érable rouge (Acer rubrum L.) (Golet et al. 1993; Tiner 2010; Sharbrough et Derry 2012) et se trouvent sous différentes patrons de conditions hydrogéomorphologiques (HGM). Ils se forment essentiellement dans des dépressions mal drainées, sur des terrains inclinés où il y a du drainage latéral (seepage) et dans les plaines inondables d’un cours d’eau (Rheinhardt 2007; Peterson-Smith et al. 2009), d’un lac (Groupe de travail national sur les terres humides 1997) ou dans les zones d’incidence des marées (Rheinhardt et Hershner 1992; Groupe de travail national sur les terres humides 1997). Le régime hydrologique des marécages de dépressions est influencé par les fluctuations de la nappe phréatique (Yetter 2004) et par l’eau d’écoulement (Rheinhardt et Hollands 2007), tandis que celui des marécages riverains est régulé par les crues et les étiages du cours d’eau et se distingue par un apport en eau de surface qui enrichit le sol en éléments nutritifs et minéraux (Mitsch et Gosselink 1986; Middleton 2002). Plusieurs études ont montré que le régime hydrologique d’un milieu humide, par ses différentes composantes (moment, fréquence, amplitude et durée des inondations), est le principal facteur abiotique déterminant l’établissement des communautés végétales (Mitsch et Gosselink 1986; Wheeler 1999).
Bien qu’il y ait des différences marquées au niveau de leur régime hydrologique, peu d’études ont mis en évidence les différences de structure et de composition de la végétation des marécages isolés et riverains. Dans le cadre de deux études menées en milieux tropicaux, des assemblages d’espèces différents ont été observés selon le caractère isolé ou riverain de marécages (Macia 2011; Mata et al. 2011). Les résultats de ces études ont aussi montré que la richesse et la diversité végétale étaient plus importantes dans les marécages riverains que dans les marécages isolés. En milieux tempérés, des différences de composition ont aussi été observées entre des marécages isolés et riverains dominés par l’érable rouge, et ce principalement au niveau des espèces de sous-étage (Rheinhardt 2007). Dans cette étude, la diversité était aussi plus importante dans les
15 marécages riverains. Une autre étude menée au nord-est des États-Unis a montré que les marécages d’une même région possédaient des patrons de végétation liés à l’hydrogéomorphologie des sites (Peterson-Smith et al. 2009) mais aucune information ne concernait leur diversité végétale. Certaines des études sur la végétation des marécages isolés et riverains réalisées dans le Nord des États-Unis (Rheinhardt 2007) et au Canada (Cameron 2009) se limitaient à l’inventaire de quelques marécages (< 30) et ciblaient uniquement les peuplements dominés par l’érable rouge. Enfin, les études menées en milieu tempéré ont principalement été faites en paysage peu perturbé par l’homme et concernaient des marécages jugés relativement intacts (Rheinhardt 2007; Cameron 2009; Peterson-Smith et al. 2009).
Le drainage, le développement urbain et agricole, la construction de barrages ainsi que la coupe forestière menacent les marécages dans les zones densément peuplées (Golet et al. 1993; Cronk et Fennessy 2001; Zedler et Kercher 2005; MacKenzie 2008), comme c’est le cas dans le sud du Québec où la majorité de ces milieux humides ont déjà disparu. De plus, la récolte des forêts ceinturant ces milieux humides diminue leur interconnectivité. Ces altérations ont un impact considérable sur la biodiversité que soutiennent ces écosystèmes et accentuent la détérioration des services écologiques qu’ils rendent (Cronk et Fennessy 2001; Foley et al. 2005). La réduction des services écologiques est une situation particulièrement préoccupante dans les zones plus densément peuplées où les milieux humides sont rares et altérés. Dans ces zones, la proximité des milieux humides avec les populations humaines leur confère une grande importance en raison des services écologiques qu’ils rendent, notamment en ce qui concerne la qualité et le contrôle de l’eau régionale (Balmford et al. 2002; Foley et al. 2005; Ferlatte et al. 2011). De ce fait, des connaissances sont requises concernant l’écologie des marécages dans les paysages perturbés des milieux tempérés et l’étude de la composition et de la structure de leurs communautés végétales est un élément essentiel à l’élaboration de plans de conservation de ces milieux humides (King et al. 2009).
Cette étude visait à mieux comprendre l’organisation de la végétation de marécages isolés et riverains dans deux bassins versants jugés représentatifs du Québec méridional, en vue d’en améliorer la gestion. Les objectifs spécifiques étaient (1) de caractériser la composition de la végétation des marécages isolés et riverains ainsi que l’influence des variables environnementales sur cette végétation, (2) de quantifier leur richesse et leur diversité et (3) d’évaluer la structure de la végétation dans les deux types de marécages. Nous nous attendions à observer des assemblages
16
d’espèces différents selon le caractère isolé ou riverain des marécages. De plus, comme un sol inondé de façon prolongée est un obstacle à l’établissement de la végétation (Casanova et Brock 2000), nous avons prédit que la diversité serait plus grande dans les marécages riverains où les inondations sont sporadiques.
2.3 Méthodes
2.3.1 Aire d’étude
L’aire d’étude se situait dans le sud de la province du Québec (Canada) et recoupait deux provinces naturelles délimitées par le Ministère du Développement durable, de l’Environnement, de la Faune et des Parcs (MDDEFP, 2010) correspondant au niveau III des Régions écologiques de l’Amérique du Nord de la US Environmental Protection Agency (U.S. environmental protection agency western ecology division 2013) : les Basses-terres du Saint-Laurent et les contreforts des Appalaches (Figure 1). L’assise rocheuse des Basses-terres du Saint-Laurent se compose de calcaire, de dolomies, de grès et de schistes datant du paléozoïque. Le relief plat et l’accumulation de dépôts marins sableux et argileux à la suite du retrait de la mer de Champlain ont contribué à la formation de nombreux milieux humides dans cette région (Payette et Rochefort 2001). La province naturelle des Basses-terres du Saint-Laurent est densément peuplée (4 millions d’habitants) et plus de 50 % de son territoire est consacré à l’agriculture (Gosselin 2005a; Ministère du Développement durable de l’Environnement de la Faune et des Parcs 2010). Dans les contreforts des Appalaches, le relief montagneux se compose de roches sédimentaires volcaniques (Payette et Rochefort 2001). Les terres forestières dominent le paysage et les milieux moins accidentés servent à l’agriculture qui couvre 15 % du territoire. On trouve très peu de lacs dans ces deux provinces naturelles, l’hydrographie étant dominée par les rivières et le fleuve Saint-Laurent (Ministère du Développement durable de l’Environnement de la Faune et des Parcs 2010). Le climat de l’aire d’étude est caractérisé par un gradient altitudinal conférant aux Basses-terres du Saint-Laurent une saison de croissance plus longue (199 à 214 jours), une température annuelle moyenne plus élevée (4,2 à 5,8 ⁰C) et des précipitations annuelles moyennes sous forme de pluie plus importantes (989 à 998 mm) que dans les Appalaches (163 à 202 jours; 1,1 à 4,6 ⁰C; 1025 à 1155 mm) (Ministère du Développement durable de l’Environnement de la Faune et des Parcs 2010). La végétation forestière de la plaine du Saint-Laurent est dominée par un couvert feuillu dont 35 % se compose d’érable rouge (Acer rubrum) alors que celle des coteaux des basses Appalaches est caractérisée par un
17 couvert mixte, dominé par le l’érable rouge et le sapin baumier (Abies balsamea) (Gosselin 2005a; Gosselin 2005b).
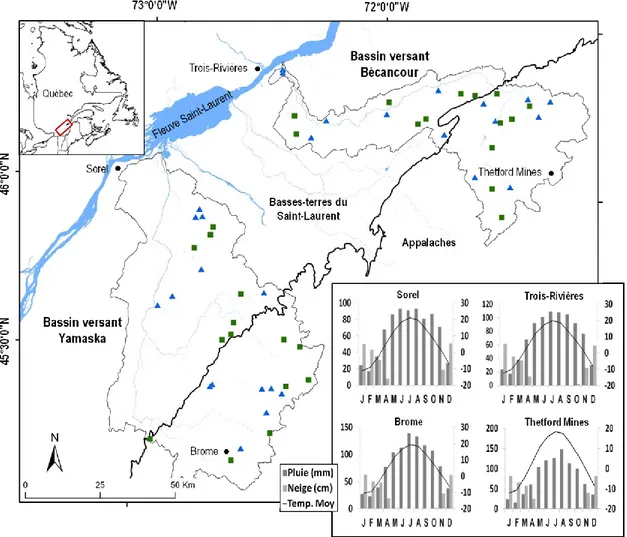
Figure 1 Localisation des 56 marécages (carrés verts, isolés ; triangles bleus, riverains) dans les
bassins versants des rivières Bécancour et Yamaska, sud du Québec, Canada. Les histogrammes indiquent la température moyenne mensuelle (⁰C) et les précipitations mensuelles sous forme de pluie (mm) et sous forme de neige (cm) sur une période de 30 ans pour les villes de Trois-Rivières, Thetford Mines, Sorel et Brome (Météo Media 2013).
Les marécages étudiés étaient localisés dans les limites hydrologiques de deux bassins versants dont les principaux tributaires se jettent dans le Fleuve Saint-Laurent du Sud vers le Nord. Le bassin versant de la rivière Yamaska occupe une superficie de 478 400 hectares (ha), dont 35 % se situent dans les Appalaches, 60 % dans les Basses-terres du Saint-Laurent et 5 % couvrent les collines Montérégiennes. Son point le plus haut, le Sommet Rond, culmine à 962 m d’altitude. Le lac Brome est le principal lac à la source de la rivière Yamaska, qui se jette dans le lac Saint-Pierre. La période
18
de crue printanière débute en mars pour la rivière Yamaska, mais c’est en avril que l’on enregistre les plus gros débits. La période d’étiage a lieu au cours de l’été, soit de juillet à septembre (COGEBY 2010) . Le bassin versant de la Yamaska compte un total 17 564 ha de milieux humides (4 % du territoire), dont 5 809 ha (33 %) sont des marécages (Canards Illimités Canada et Ministère du Développement durable de l'Environnement de la Faune et des Parcs 2012). Plus à l’est, le bassin versant de la rivière Bécancour occupe une superficie de 262 000 ha et la portion Basses-terres du Saint-Laurent en couvre un peu moins de la moitié (44 %). Le lac Bécancour est à la tête du bassin et l’embouchure de la rivière Bécancour se situe à la hauteur de Trois-Rivières. La période de crue printanière de la rivière Bécancour s’étend de mars à mai, pour atteindre son amplitude maximale en avril, et l’étiage a lieu au mois d’août (Morin et Boulanger 2005). Le bassin versant de la rivière Bécancour possède une superficie d’environ 51 324 ha en milieux humides (soit 5,8 % du territoire), dont 17 133 ha (33 %) sont classifiés comme des marécages (Canards Illimités Canada et Ministère du Développement durable de l'Environnement de la Faune et des Parcs 2012).
2.3.2 Sélection des marécages et plan d’échantillonnage
Au total, 28 marécages isolés et 28 marécages riverains ont été sélectionnés aléatoirement, selon un agencement équilibré entre les bassins versants et les provinces naturelles (Figure 1). Nous avons omis les marécages limitrophes représentant des degrés intermédiaires de connexion au réseau hydrographique (voir Annexes 1 et 2 pour plus de détails). Dans le cadre de cette étude, un marécage isolé se trouvait à une distance d’au moins 300 m d’un cours d’eau cartographié, de largeur variable mais jamais intermittent, tandis qu’un marécage riverain était traversé par un de ces cours d’eau ou en était situé à moins de 20 m. Les marécages adjacents au fleuve Saint-Laurent, aux lacs, ainsi que ceux possédant une superficie inférieure à 1 ha ont été éliminés. L’exclusion des marécages sous l’influence hydrologique du fleuve Saint-Laurent a écarté la majeure partie de l’aire de répartition de l’érable argenté (Acer saccharinum L.) de notre aire d’étude (Frère Marie-Victorin et
al. 1964), ce qui explique son absence dans nos relevés de végétation. Les sites ayant subi des
perturbations anthropiques importantes (canal de drainage, coupe généralisée, plantation) ont aussi été écartés. Une distance d’au moins 500 m entre chaque marécage a été respectée. La largeur des rivières bordant les marécages riverains était très variable, cette dernière pouvant passer d’une dizaine de mètre à une centaine de mètres de large. La superficie des marécages sélectionnés variait de 1 à 8 ha ( ± ET = 3± 2 ha). La cartographie détaillée des milieux humides a été utilisée
19 pour calculer la superficie, le périmètre et le ratio périmètre/surface de chaque marécage échantillonné.
De façon à échantillonner équitablement chaque marécage sélectionné, un nombre de placettes égal à sa taille en hectares a été déterminé (ex : 5 ha=5 placettes), sauf pour les marécages de 1 à 3 hectares auxquels un nombre fixe de trois placettes a été attribué. Au total, 213 placettes (101 isolées et 112 riveraines) ont été inventoriées dans les 199 hectares de marécages sélectionnés, ce qui représentait un effort d’échantillonnage de 1,1 placette à l’hectare ou 4,3 % de la superficie. Les inventaires se sont déroulés de juin à août 2012. La visite des sites s’est faite en constante alternance entre les bassins versants et les provinces naturelles afin de limiter l’effet du moment de la prise de données au cours de la saison.
2.3.3 Récolte des données
Variables environnementales prises sur le terrain.
Trois indices de microtopographie et huit caractéristiques du sol ont été évalués dans une placette circulaire de 11,28 m de rayon (400 m2,Saucier 1994) (Tableau 1). Le pourcentage de recouvrement
des étangs vernaux, des dépressions inondées temporairement et généralement asséchées en période d’étiage, a été évalué à l’aide de l’échelle de Braun-Blanquet (˂1; 1-5; 5-25, 25-50; 50-75; ˃75; .Westhoff et Van Der Maarel 1978). Nous avons procédé de la même façon pour estimer le pourcentage de recouvrement du substrat non pédologique, qui correspond à un amalgame de débris ligneux, de racines, de bases de troncs d’arbres et de pierres qui créent des micro-sites mieux drainés dans le marécage (un seul pourcentage pour l’ensemble des éléments). Le degré d’ondulation du sol, décrivant l’abondance de petites buttes de sol minéral ou organique, a été estimé selon une échelle de 0 (terrain plat) à 3 (terrain ondulé). Une cote de drainage du sol variant d’excessif (1) à très mauvais (6) a été attribuée à chaque placette (Saucier 1994). Les épaisseurs (cm) des deux premiers horizons minéraux (A et B) ont été mesurés sur un échantillon de sol positionné aléatoirement dans la grande placette et prélevés à l’aide d’une sonde pédologique manuelle. Ces échantillons ont aussi permis de classifier la texture du sol de très fin (1) à grossier (12) et d’évaluer l’abondance (<2 %, 2-20 %, >20 %), la profondeur d’apparition (cm) et la dimension de mouchetures (˂5 mm, 5-15 mm, ˃15 mm, Saucier 1994). En raison de contraintes de temps et d’instrumentation, des relevés annuels sur les fluctuations du niveau d’eau n’ont pu être effectués.
20
Pour cette raison, les mouchetures, la texture et la cote de drainage du sol ont été utilisés comme des indicateurs de l’hydropériode et du degré d’humidité des sites. Par ailleurs, les marécages inventoriés étaient tous des boisés de ferme situés en territoire privé, soumis à des interventions fréquentes et non documentées de récolte de bois de chauffage. Il aurait donc été difficile de faire un historique des coupes et des travaux de drainage effectués dans ces milieux humides. De plus, les taux de décomposition varient généralement avec les taux d’humidité du sol (McComb et Lindenmayer 1999). Il aurait donc été complexe d’obtenir un estimé juste de l’âge des souches car le taux d’humidité du sol des marécages varie fortement d’un site à l’autre et d’une année à l’autre.
Tableau 1 Variables de l’environnement utiles à la caractérisation des marécages récoltées sur le
terrain ou obtenues à partir de documents cartographiques.
1 Déterminé à l’aide du tableau Évaluation tactile de la texture du sol et ordonné suivant le tableau Classes de
diamètre des particules du Point d’observation écologique (Saucier 1994)
2Tiré du Point d’observation écologique p. 46. (Saucier 1994)
3 Les milieux humides comprennent les tourbières (bogs, fens), les tourbières boisées, les marécages, les
marais et les eaux peu profondes
4 Les milieux aquatiques comprennent les ruisseaux, les rivières, les lacs et le fleuve Saint-Laurent.
Variables mesurées
in situ
Sol (unités) Codes Détails
Épaisseur de l’horizon A (cm) Ep_hA Épaisseur de l’horizon B (cm) Ep_hB
Texture1 Text 1 à 12 (très fin à grossier)
Cote de drainage2 Drg 1 à 6 (Excessif à très mauvais)
Abondance des mouchetures (%) Mou_abon ˂ 2, 2-20, ˃ 20 Dimension des mouchetures (mm) Mou_dim ˂ 5, 5-15, ˃ 15 Profondeur d’apparition des
mouchetures (cm) M_prof
Microtopographie
Étangs vernaux (%) Etg_ver Cotes de Braun-Blanquet, Substrat non pédologique (%) Sub_np Cotes de Braun-Blanquet, Ondulation du terrain Ondu 0 à 3 (Aucune à forte)
Variables obtenues à partir de cartes d’occupation du territoire et de modèle numérique d’élévation Occupation du territoire (%) Agricole Agr_1km Urbain Urb_1km Forêt For_1km Milieux humides3 Mhs_1km Aquatique4 Aqu_1km
Forme des marécages
Périmètre (m) Peri
Superficie (m2) Sup
Ratio périmètre surface P/S Topographie
Altitude (m) Alt
21
Données géomatiques
L’occupation du territoire autour chaque marécage a été caractérisée dans une zone tampon d’un kilomètre autour de chaque site selon les catégories suivantes : agricole, urbain, forestier, zones humides et aquatiques (Tableau 1). La cartographie détaillée des milieux humides réalisée par Canards Illimités Canada et le Ministère du Développement durable, de l'Environnement, de la Faune et des Parcs (2012) a été utilisée pour quantifier les milieux humides dans la zone tampon, alors que des données provenant d’images satellitaires Landsat-7 ont été utilisées pour quantifier les autres classes d’occupation du territoire (Service canadien de la faune et al. 2004). Ces données ont été traitées dans un système d’information géographique (ArcGIS, Version 10, Environmental Systems Research Institute Inc., USA). La pente moyenne dans une zone tampon de 300 m autour des marécages, ainsi que l’altitude de chaque site par rapport au niveau de la mer ont été calculées à l’aide d’un modèle numérique d’élévation (1/100 000) (Ministère des Ressources naturelles 2008).
Inventaire de la végétation
L’échantillonnage de la végétation a été divisé en dix strates afin de bien capter l’étagement de la végétation (Tableau 2) et de tenir compte des différents stades de succession végétale présents dans les marécages. D’abord, un recouvrement de surface a été estimé pour chaque taxon observé dans une strate grâce à l’échelle catégorique de Braun-Blanquet. Ensuite, le recouvrement total de la végétation par strate été déterminé suivant la même échelle. Les couverts des strates arborescentes inférieure et supérieure (voir le tableau 2 pour les détails) ont été évalués dans une placette circulaire de 11,28 m de rayon (400 m2, Saucier 1994). Pour les strates inférieures (voir le tableau 2 pour les
détails), le recouvrement a été évalué dans une placette circulaire de cinq mètres de rayon (79 m2),
centrée sur la grande placette. La majorité des taxa ont été identifiés à l’espèce (n=303), quelques-uns au genre (n=28) et les plantes invasculaires ont été classifiées selon trois catégories : les mousses, les sphaignes et les lichens. La nomenclature utilisée provient de la base de données des plantes vasculaires du Canada (Brouillet et al. 2010+). En plus des mesures de recouvrement, nous avons déterminé la surface terrière totale de la grande placette à l’aide d’un prisme et le diamètre à hauteur de poitrine (DHP) a été mesuré pour les arbres de plus de 25 cm, pour évaluer le potentiel d’arbres à forts diamètres disponibles pour la faune, par exemple pour la nidification de la sauvagine.