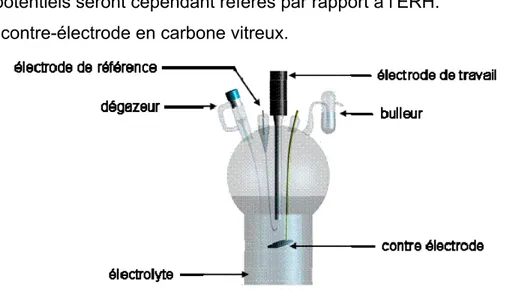
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National- Arrêté du 7 août 2006)Ecole doctorale : Ingénierie Chimique Biologique Géologique Secteur de Recherche : Chimie Théorique, Physique et Analytique
Présentée par :
Rémy SELLIN
***********************
Dégradation de catalyseurs Pt/C sous des conditions
mimant celles d’une PEMFC en fonctionnement
***********************
Directeur de thèse : Christophe COUTANCEAU, Professeur
Co-directeur de thèse : Jean-Michel LEGER, Directeur de Recherche au C.N.R.S ***********************
Soutenue le 12 juin 2009 devant la Commission d’Examen ***********************
JURY
Elena SAVINOVA (Pr) UMR 7515 CNRS LMSPC Strasbourg Rapporteur
Eric CHAINET (CR) UMR 5631 CNRS LEPMI Grenoble Rapporteur
Sylvie ESCRIBANO (Ing. CEA) LITEN, CEA Grenoble Examinateur
Christophe COUTANCEAU (Pr) UMR 6503 CNRS LACCO Poitiers
Jean-Michel LEGER (DR) UMR 6503 CNRS LACCO Poitiers
Résumé en français
Des catalyseurs Pt/C pour piles à combustible ont été préparés par des méthodes colloïdales. Des études par ATG, ATG-SM, MET et DRX de 323 à 573 K ont été réalisées sous atmosphère oxydante et réductrice pour mimer les conditions de travail d’anodes et de cathodes de PEMFCs et pour accélérer le processus de vieillissement. Sous débit d’air, on observe peu d’agrégation et aucune fusion des particules, donc pas d’augmentation de Lv. Ceci est expliqué par la présence
d’oxydes à la surface du platine. Sous atmosphère réductrice (H2 3%/He),
l’agrégation des entités de platine et l’augmentation de Lv se produisent. Deux
cinétiques de croissance de cristallites existent. De plus, le support carboné subit une dégradation par combustion sous air et reformage sous atmosphère réductrice. L’effet du traitement thermique sous atmosphères contrôlées sur la surface active et sur l’activité pour la réduction de l’oxygène et l’oxydation du CO a été évalué.
Mots-clés en français : agglomération, agrégation, carbone, combustion, PEMFC, platine, reformage, dégradation, vieillissement, catalyseur
Résumé en anglais
Fuel cell Pt/C catalysts were prepared via different colloidal methods. TGA, TGA-MS, TEM and XRD studies from 323 to 573 K were carried out under oxidative and reductive atmospheres to mimic fuel cell anode and cathode working conditions and to accelerate ageing process. Under air flow, little aggregation of platinum is observed, but no fusion and increase of Lv. This is explained by the presence of
oxygen species on the platinum surface. Under reductive atmosphere (H2 3%/He),
aggregation and increase of the mean crystallite size are observed. Two kinetics of grain growth process seem to exist. Moreover, the carbon support undergoes degradation by combustion under air and reforming under reductive atmosphere. The effect of thermal treatment under controlled atmospheres on the electrochemical active surface area and on the electrocatalytic activity towards oxygen reduction reaction and CO oxidation of the Pt/C catalyst were evaluated.
REMERCIEMENTS
Je tiens à remercier en tout premier lieu Christophe COUTANCEAU pour son humanité et sa rigueur scientifique. Je tiens à remercier Jean-Michel LEGER pour m’avoir accueilli au sein de l’équipe « Electrocatalyse » du laboratoire de Catalyse en Chimie Organique de Poitiers.
Je tiens à remercier l’ensemble des doctorants que j’ai pu croiser au cours de ma thèse, pour les discussions, parfois rudes, que nous avons pu avoir et qui m’ont fait progresser dans ma recherche.
Je tiens à remercier Claude ROUVIER et Jean-Jacques COLLIN pour la qualité de leurs réalisations en verrerie. Sans eux, pas d’électrochimie.
Je tiens à remercier Stéphane PRONIER et Julie ROUSSEAU pour la réalisation des clichés de microscopie électronique en transmission.
Je remercie Sandrine ARRII-CLACENS pour la réalisation des manipulations de diffraction.
Table des matières
REMERCIEMENTS ... 3
1 Introduction... 7
1.1 Contexte énergétique mondial... 7
1.2 Pile à combustible PEMFC... 11
1.3 Verrous technologiques... 15 1.4 Problématique ... 23 2 Etat de l’art ... 25 2.1 Introduction générale... 25 2.2 La pile à combustible... 25 2.3 Interactions... 32 2.4 Mécanismes de dégradation ... 41 3 Partie expérimentale ... 47 3.1 Méthodes de synthèse ... 47 3.2 Méthodes de caractérisation ... 51 3.3 Analyse thermogravimétrique... 59 3.4 Caractérisations électrochimiques... 60 4 Structure du catalyseur ... 65 4.1 Préambule ... 65
4.2 Traitement sous air... 67
4.3 Traitement sous Ar ... 78
4.4 Traitement sous H2 à 3% dans Ar ... 87
4.5 Conclusion... 93 5 Agglomération du platine ... 95 5.1 Préambule [90] ... 95 5.2 Outils de mesure ... 103 5.3 Modélisation ... 107 5.4 Observations microscopiques ... 110 6 Reconstruction cristalline... 125 6.1 Rappels théoriques ... 125
6.2 Résultats sous atmosphères contrôlées... 133
6.3 Evolution de la longueur de Scherrer sous atmosphère... 138
6.4 Discussion ... 148
6.5 Conclusion... 154
7 Caractérisation éléctrochimique ... 157
7.1 Mesures électrochimiques... 157
7.2 Surface active et activité vis-à-vis de la réaction de réduction de l’oxygène après traitement sous air... 163
7.3 Surface active et activité vis-à-vis de la réaction de réduction de l’oxygène après traitement sous atmosphère réductrice ... 166
7.4 Conclusion... 170
8 Conclusion et Perspectives... 173
Références ... 179
1 INTRODUCTION
1.1
Contexte
énergétique
mondial
1.1.1 Motivations
L’humanité, au sens de l’ensemble des êtres humains présents sur la planète, se trouve aujourd’hui confrontée à un défi majeur : satisfaire ses besoins croissants en énergie tout en préservant un environnement compatible, en termes de toxicité notamment, avec sa survie. Ces besoins croissants peuvent être répartis en quatre postes :
les productions industrielles, primaires et secondaires (agriculture, industrie) les services et télécommunications (informatique, téléphonie)
les transports, commerciaux (transport routier, frets aérien, ferroviaire, fluvial et maritime) ou de loisir (automobile de tourisme, transports aérien, ferroviaire, maritime et fluvial)
le confort domestique ou urbain (chauffage, éclairage, alimentation, informatique).
Plusieurs de ces secteurs utilisent l’électricité comme source d’énergie, au travers de systèmes portatifs (ordinateur et téléphone portable) ou stationnaires (chaÎne de montage, lampadaires) nécessitant des gammes de puissances différentes allant de la dizaine de watts (téléphone portable) au million de watts (TGV). Un bref rappel historique est nécessaire afin de mieux comprendre les évènements fondateurs de cet état de fait actuel.
1.1.2
Historique
Les sociétés humaines ont initialement développé des sources énergétiques à visée essentiellement domestique (alimentation, chauffage) utilisant des combustibles solides (bois, charbon) ou pour le transport (animal ou éolien). Une démographie exponentielle a contraint l’humanité à conquérir de nouveaux territoires et à créer de nouveaux modes de production d’énergie de masse. Cette démarche se cristallisa sous la forme de deux révolutions industrielles s’étalant de la fin du XVIIIème siècle à la fin du XIXème siècle selon les régions du monde considérées. Ces révolutions entrainèrent une utilisation massive de combustibles d’origine fossile, principalement solide sous forme de charbon. Ces périodes correspondirent à des découvertes scientifiques majeures : électricité, machine à vapeur, moteur à explosion. Toutefois, à ces époques, la consommation d’électricité était quasi-inexistante.
Au début du XXème siècle, une nouvelle ère énergétique commence : les premiers barrages hydroélectriques voient le jour ; dans le même temps une consommation massive de pétrole et de gaz naturel débute. L’utilisation de ces deux nouvelles sources d’énergie fossiles progresse rapidement pour dépasser, dans les années 1960, la consommation de charbon. Dans cette première partie du XXème siècle, l’électricité se démocratise et devient une énergie de consommation courante.
Une troisième révolution industrielle associée au développement de l’informatique entraina un accroissement de l’utilisation d’électricité, tant d’un point de vue industrielle que domestique (robotisation, ordinateurs, téléphonie).
Dans le même temps, l’énergie nucléaire fut développée et des centrales nucléaires créées, notamment en France. Cependant cette énergie électrique d’origine nucléaire est, comme toute énergie électrique actuellement, appelée à être utilisée à brève échéance après sa production, aucun système de stockage durable de l’électricité n’existant aujourd’hui.
De plus, cette exploitation se fait aux prix de nombreuses pertes énergétiques (conversion thermique-mécanique puis conversion mécanique-électrique) et de la production de déchets encore aujourd’hui non recyclables et non neutres vis-à-vis de
La nécessité d’utiliser des sources de refroidissement accroit encore la pression environnementale de ce type d’installation. En effet, les centrales sont généralement associées à un cours d’eau, lequel sert de source de refroidissement. Ceci a pour conséquence directe des rejets importants d’eau à température élevée dans l’écosystème à proximité des centrales. Tout ceci fait que si cette énergie possède un caractère propre à court terme, son utilisation prolongée mènera assurément à des problèmes environnementaux majeurs.
De nos jours, la majeure partie des combustibles fossiles est encore simplement convertie en force motrice ou en électricité par voie thermique (combustion). Cette transformation s’effectue par exemple dans un moteur de voiture avec un faible rendement, proche de 30%. La filière énergétique principalement utilisée par l’humanité a donc aujourd’hui encore une structure majoritairement unidirectionnelle, quelque soit la source énergétique considérée.
Inquiétés par le tarissement proche de certaines réserves énergétiques fossiles (pétrole) et par les effets plus ou moins directs de leur consommation massive sur l’environnement global de la planète, les états tentent aujourd’hui de créer des filières énergétiques dites renouvelables, ainsi que les réseaux d’approvisionnement associés. La France est un de ces pays. Ce tarissement est généralement évoqué sous la forme d’un pic pétrolier (ou peak oil). Par définition, le sommet ce pic correspond au début de la baisse de production pétrolière, par manque de ressources. Si ce pic est attendu, du fait du caractère non renouvelable de la source d’énergie pétrolière et des réserves terrestres finies, son avènement est difficilement prévisible, étant donné le caractère relatif des facteurs prévisionnels (progrès des techniques d’extractions, fiabilité des cartes de ressource). Néanmoins l’occurrence d’une situation globale de pénurie de pétrole est une certitude à plus ou moins longs termes, et constitue un argument supplémentaire pour le développement de systèmes énergétiques alternatifs, susceptibles d’assumer une transition énergétique paisible.
Ainsi depuis quelques années, les sources d’énergies dites renouvelables ont fait leur apparition dans le débat public. Energies éolienne, marée-motrice, solaire et biocarburants ont ainsi connu un regain d’intérêt notamment de la part des différents gouvernements des pays industrialisés.
s’avèrent incapables de se substituer aux systèmes traditionnels, que ce soit en termes de puissance délivrée ou de disponibilité des ressources.
C’est dans ce cadre que s’inscrit le développement des piles à combustible ; si le principe de la pile à combustible est connu depuis le milieu du XIXème siècle
(découverte par Sir William Robert Grove en 1836), les premiers systèmes opérationnels modernes datent de la fin des années 50, et furent développés par la NASA avec une application spatiale. Lors des missions GEMINI et APPOLLO au début des années 60. Les piles utilisées alors furent d’abord des AFCs (Alkaline Fuel Cell), puis des PEMFCs [1].
Le caractère renouvelable du combustible (hydrogène) de la PEMFC est résumé dans le schéma de la figure 1.
Hydrogène
PEMFC
Oxygène
Eau
Hydrolyse
Figure 1. Caractère renouvelable d'une pile à combustible.
L’hydrogène pourra, dans ce cadre, être utilisé comme vecteur énergétique ; en effet il pourra à la fois servir de combustible et également de stockage d’énergie, lequel reste aujourd’hui un des verrous majeurs.
1.2 Pile à combustible PEMFC
1.2.1 Principe de fonctionnement
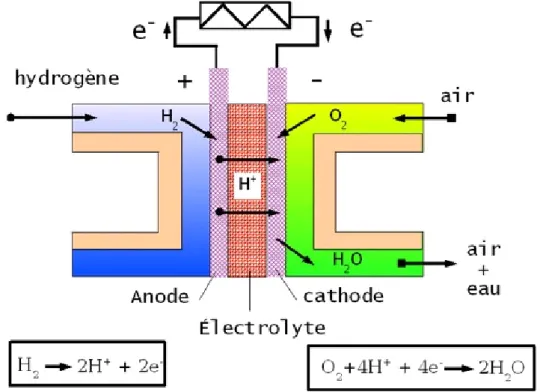
Le principe de la pile à combustible échangeuse de protons (ou PEMFC) consiste en l’oxydation d’un combustible à l’anode afin de libérer des protons. Ces protons sont acheminés par l’intermédiaire d’un conducteur protonique (électrolyte) à la cathode où la synthèse de l’eau est réalisée par réaction avec de l’oxygène. La figure 2 montre le schéma de principe d’une pile hydrogène/air de type PEMFC. Les réactions se déroulent à la surface d’un catalyseur, à base d’un métal noble, rare et cher : le platine. Ce catalyseur est en contact, d’une part avec l’électrolyte (apport des protons) et d’autre part avec le circuit électrique via un support conducteur électronique. L’ensemble est en contact avec le gaz diffusant à travers la couche de diffusion. Cette zone de réaction particulière est dénommée point triple. Les électrons récupérés lors de l’oxydation anodique sont acheminées au sein du circuit électrique, leur déplacement générant, par définition, un courant électrique.
Le potentiel d’équilibre du couple H2/H+ dans les conditions normales à 25°C sert
de référence ; il est égal à 0V/ENH (notée ENH pour électrode normale à hydrogène). Le potentiel à l’équilibre du couple H2O/O2 à 25°C est égal à 1,23
V/ENH. L’oxydation de l’hydrogène se produit donc pour des potentiels supérieurs à 0 V, la réduction de l’oxygène en milieu acide se déroule pour des potentiels inférieurs à 1,23 V/ENH. Des potentiels de l’ordre de E1=0,1 V/ENH à l’anode et
E2=0,8 V/ENH à la cathode correspondent à un point de fonctionnement classique
d’une pile hydrogène/oxygène.
1.2.2
Rendements
L’un des principaux avantages d’une pile à combustible est son rendement énergétique global. Celui-ci est théoriquement très supérieur à celui d’un moteur thermique classique. Ce rendement global peut être considéré comme faisant intervenir trois limitations principales, représentées par trois rendements distincts.
1.2.2.1 Rendement thermodynamique (ou réversible)
Le rendement réversible traduit le rapport entre le travail électrique fourni et l’énergie totale thermodynamiquement accessible grâce à la réaction chimique de synthèse de l’eau à partir d’hydrogène et d’oxygène. Pour cette raison ce rendement sera généralement qualifié d’idéal.
Les demi-équations associées à chacune des réactions intervenant aux deux électrodes en milieu acide sont les suivantes :
Anode : H2(g) 2H 2e E10=0 V/ENH (1) Cathode : O 2H 2e H O 2 1 2 ) g ( 2 E20=1,23 V/ENH (2)
La réaction globale est donc la suivante :
) l( 2 ) g ( 2 ) g ( 2 21O H O H (3)
La force électromotrice de système à l’équilibre, dans les conditions standard, est donc égale à : V 23 , 1 E E E0eq. 02 10 (4)
Cette dernière grandeur est reliée au nombre d’électrons échangés et à la variation d’enthalpie de Gibbs selon la relation :
0 nFE
G0eq. 0eq.
(5)
avec n=2 et F, la constante de Faraday, égale à 96485 C.mol-1. On obtient donc :
0 1
eq.
G 2 96485 1,23 237,36 kJ.mol
Le rendement réversible associé à la réaction est donc donné par :
0 . eq 0 . eq 0 . eq 0 r 0 . eq 0 eq 0 . eq e . rev H S T 1 H G H nFE H W (6) avec [79] H0eq. Hf(H2O)285,83 kJ.mol1 (7) d’où : εrev. 83% (8) Cette valeur représente le rendement théorique maximal. Si la valeur élevée de ce rendement est souvent utilisé pour vanter la pile à combustible relativement aux systèmes thermiques classiques, nous allons voir que le rendement global de la pile va être abaissé par différents phénomènes.
1.2.2.2 Rendement en potentiel
Lors du fonctionnement en pile, les potentiels des électrodes vont s’écarter de leurs valeurs d’équilibre pour plusieurs raisons. Ces écarts vont être quantifiés par des surtensions anodique et cathodique, respectivement notées a et c. Ces
surtensions aux électrodes sont dues aux transferts de charge et aux diffusions des espèces. De plus des résistances ohmiques importantes, associées à chaque composant de la pile (anode et cathode) et aux interfaces les séparant, matérialisées
par les différentes interfaces de transfert, existent au sein du circuit électrique que constitue la pile. On peut donc écrire :
0
2 1 eq a c e a c surtension
totale
E(I)=E -E =E -( η + η )-R I-R I-R I
1 4 4 44 2 4 4 4 43 (9)
où Ra est la résistance des interfaces anode/circuit électrique extérieur et
anode/électrolyte, Rc est la résistance des interfaces cathode/circuit électrique
extérieur et cathode/électrolyte et Re est la résistance de l’électrolyte. Un rendement
en potentiel E peut alors être défini comme suit :
E 0 eq
E(I) ε =
E . (10)
Dans les conditions typiques de fonctionnement d’une anode et d’une cathode de PEMFC données dans le paragraphe 1.2.1 (E1 = 0,1 V/ENH et E2 = 0,8 V/ENH), le
rendement en potentiel à 25°C de la pile devient :
E 0 eq E(I) 0,7 ε = = =0,57 E . 1,23 (11)
1.2.2.3 Rendement faradique
Enfin, une dernière limitation peut intervenir résultant du nombre d’électrons échangés lors de la réaction d’oxydation du combustible. Si la réaction est incomplète, le nombre d’électrons échangés mesurés expérimentalement (nexp.) peut
être inférieur à celui prévu théoriquement (nth.). Ceci se traduit par un rendement
faradique F défini comme suit :
th. exp F n . n ε (12)
Cependant, dans une pile utilisant le couple H2/O2 ce rendement est de 1. Il s’agit
d’un des principaux avantages du couple H2/O2. Cette condition n’est pas forcément
respectée dans le cas de pile à combustion directe d’alcool, ou plusieurs produits d’oxydation incomplète peuvent être formés.
1.3 Verrous technologiques
Cependant, plusieurs verrous technologiques doivent être forcés pour permettre l’éclosion d’une filière pile à combustible, notamment dans le secteur automobile, utilisant l’hydrogène comme combustible.
1.3.1 Production de l’hydrogène
Il s’agit là peut être du principal verrou technologique. La production d’hydrogène est aujourd’hui un des défis majeurs associé à la création d’une filière énergétique reposant sur cette molécule. Théoriquement, plusieurs procédés sont envisageables. Ce paragraphe tentera de décrire rapidement certaines de ces voies de production d’hydrogène et d’évaluer leur pertinence. Ces dernières ont récemment été résumées par Holladay et al. [2].
1.3.1.1 Microorganismes photosynthétiques
Certains micro-organismes ont la capacité de synthétiser l’hydrogène par voie photochimique [2].
1.3.1.2 Combustion partielle de biomasse
Dans un cadre énergétique, la biomasse peut être définie comme l’ensemble des matières organiques convertibles en énergie. Ce terme regroupe donc un ensemble de matériaux très différents, ayant tous comme point commun une origine vivante. Cette diversité de sources est à la fois un avantage et un inconvénient. En effet la diversité de source est un avantage car elle permet de ne pas être dépendant d’une filière de production particulière pour un système de conversion. D’un autre côté, cette diversité de sources implique une diversité de compositions chimiques, rendant l’utilisation d’un procédé unique de conversion impossible. Toutefois des procédés existent aujourd’hui qui permettent de convertir des déchets de bois en gaz riche en
1.3.1.3 Vaporeformage
Si cette filière est aujourd’hui une de celles présentant le plus grand avancement technologique, elle est aussi la moins intéressante d’un point de vue environnemental. En effet cette conversion consiste à effectuer une réaction entre des hydrocarbures et de l’eau afin de produire de l’hydrogène et du dioxyde de carbone via un équilibre, dont l’équation chimique est la suivante :
x y 2 2 2
y C H +2x H O x CO +(2x+ ) H
2
(13)
Cette conversion, de par sa production de dioxyde de carbone, annulerait donc partiellement le caractère « propre » de la pile à combustible. A mon sens cette méthode est donc à proscrire.
Ce procédé de reformage à la vapeur fait généralement intervenir des catalyseurs à base de cobalt ou de fer. De plus, le procédé fait généralement intervenir la réaction dite « Water Gas Shift » ou WGSR. Cette dernière consiste en un équilibre entre, d’une part le monoxyde de carbone et l’eau, et d’autre part le dioxyde de carbone et l’hydrogène, comme le montre l’équation chimique suivante :
2 2 2
CO+H CO +H (14)
1.3.1.4 Electrolyse de l’eau
L’électrolyse de l’eau est une filière intéressante pour une simple raison : la matière première que constitue l’eau est présente en grande quantité à la surface de la planète. Il s’agit également d’une matière première mieux partagée que le pétrole, et susceptible de générer moins de conflits à grande échelle pour son appropriation (même si des conflits plus localisés pour le partage des ressources en eau sont à craindre). Néanmoins cette méthode possède également un gros désavantage : l’électrolyse nécessitant une dépense énergétique conséquente. Où trouver cette énergie ? Trois grandes voies sont envisageables :
l’électrolyse classique, généralement réalisée à l’aide de membranes oxydes solides.
la photoélectrolyse, réalisée à l’aide de matériaux semi-conducteurs immergés.
1.3.2 Stockage de l’hydrogène
Différentes recherches sont menées aujourd’hui afin de résoudre le second verrou majeur pour l’éclosion de la filière : le stockage de l’hydrogène. Deux grandes voies peuvent être distinguées : le stockage sous forme de réservoir à haute pression et le stockage sous forme d’hydrure.
La première voie consiste à compresser l’hydrogène au sein de bouteilles. Cette méthode présente le désavantage d’avoir un coût énergétique non négligeable. En effet la mise sous pression nécessite l’utilisation d’un compresseur, ce dernier fonctionnant généralement à l’aide d’énergie électrique. Le bilan global d’une filière utilisant ce procédé de stockage s’en trouverait grevé de façon forte. Le coût des matériaux utilisés pour la réalisation de ces bouteilles est aussi à considérer. L’amélioration des matériaux constituant ces dernières est l’essentiel de la recherche menée aujourd’hui.
Le stockage sous forme d’hydrures est également une voie très prometteuse. Elle repose sur la capacité de certains matériaux à former de façon réversible des hydrures au sein d’une matrice solide. Cette méthode présente l’avantage de ne pas nécessiter de mise sous pression et de stocker l’énergie sous forme solide. Toutefois la masse d’hydrogène stockée relativement au poids du matériau total (matériau stockant +hydrogène) reste faible (environ 5%).
Il est intéressant de constater que ce stockage sous forme solide constituerait un retour aux anciennes modalités de stockage énergétiques (charbon ou bois).
Les données de sécurité associées à l’hydrogène sont données en annexe 1.
1.3.3 Distribution de l’hydrogène
Dans l’hypothèse d’une production massive d’hydrogène sous forme compressée, se pose le problème de l’alimentation sous forme de gazoduc ?
Comment sécuriser de telles installations ? Ces problématiques ne sont aujourd’hui pas résolues.
1.3.4
Combustibles
alternatifs
Plusieurs autres combustibles que l’hydrogène sont également envisagés et font l’objet d’études approfondies. Ainsi l’éthanol, le glycérol et le méthanol sont autant de candidats sérieux pour l’alimentation de piles à combustible. Plusieurs problématiques sont néanmoins associées à l’utilisation de ces combustibles.
La première d’entre elle est environnementale. Argument majeur pour le développement des piles à combustible, la combustion de ces carburants, même au sein d’une pile produit des oxydes de carbone ou des alcanes de faibles masses moléculaires. Ces molécules possèdent de forts pouvoirs à effet de serre et contribuent, même en faibles quantités, au réchauffement climatique. Se pose donc la question de l’origine de ces combustibles. Considérant le cycle du carbone global, il est nécessaire de produire ces combustibles à partir de sources neutres. La biomasse s’impose comme une source évidente. Toutefois sa disponibilité limite les quantités productibles à l’échelle de la planète.
1.3.5
Platine
1.3.5.1 Production
Le minerai principal de platine est la sperrylite [3, 4]. Il s’agit d’un arséniure de platine de formule brute PtAs2. Cette simple donnée nous indique que l’extraction de
ce métal va produire des quantités importantes d’arsenic. Ce dernier élément est relativement toxique et sa présence dans l’environnement doit être contrôlée de façon drastique, notamment dans les cours d’eau. Les dernières réglementations internationales de l’OMS limitent son taux à 0,01 mg/L.
partie de la production mondiale de platine (90%) est réalisée dans seulement deux zones géographiques : la Russie et l’Afrique du sud, ce dernier pays étant le plus important producteur de minerai et de métal. La rareté naturelle au sein de la croûte terrestre de ce métal, la complexité de son extraction, et surtout la localisation et la restriction des zones géographiques où le minerai est exploitable, confère à ce matériau un caractère économique et géopolitique comparable à celui du pétrole actuellement.
De plus, les investissements matériels associés à cette filière de production sont donc importants, empêchant une éventuelle augmentation rapide et massive de la production mondiale.
Pays Tonnage de platine / an
Afrique du sud Russie Canada Zimbabwe Etats Unis Colombie Autres 166,0 27,0 6,2 5,3 3,8 1,4 3,5 Total mondial 213,2
Tableau 1 : Production minière mondiale de platine et sa répartition dans les pays en 2007 (source : US Geological Survey).
1.3.5.2 Marché
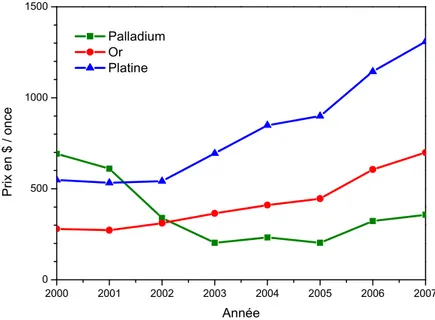
Le marché des métaux précieux est un marché assez peu élastique étant données les contraintes associées à ses fondamentaux. Ainsi le cours des différents métaux précieux usuels (or, argent, platine, palladium) sont généralement relativement constants, leur hausse dépendant principalement de la demande. Toutefois le platine a connu une récente augmentation de son cours par un facteur 3 de 2000 à aujourd’hui. L’évolution du cours du platine sur les dix dernières années est donnée en figure 3.
2000 2001 2002 2003 2004 2005 2006 2007 0 500 1000 1500 Pr ix en $ / on ce Année Palladium Or Platine
Figure 3 : graphique représentant l’évolution du cours du platine sur les dix dernières années (source : US Geological Survey).
Tout ceci permet d’entrevoir un des problèmes liés à l’utilisation de platine dans les piles à combustible dans l’optique d’une application à l’échelle mondiale. Une utilisation massive de ce métal entrainera une hausse importante de la demande. Ceci aura pour conséquence directe une hausse sensible du coût de la matière première qu’est le platine, donc du coût de revient d’une pile à combustible. Or ce coût est déjà trop élevé actuellement pour assurer la rentabilité de systèmes type pile à combustible. De plus, la production mondiale de quelque centaines de tonnes par année reste faible au regard des besoins énergétiques et des performances de pile actuellement proposées (de l’ordre de 0.7 – 0.8 W cm-2 à 0.6 V pour 0.2 mg de Pt
[5]). Afin d’assurer la pérennité d’une filière énergétique basée sur la pile à combustible, la mise en place d’une filière de recyclage à haut rendement est donc une nécessité absolue. Cette filière devra permettre a priori de recycler non seulement les espèces métalliques présentes dans les systèmes usés mais également les autres composants de l’assemblage, notamment les composés issus de la membrane (composés fluorés dans le cas d’une membrane perfluorée telle que le Nafion® généralement utilisée dans les PEMFCs) ; ceci devra s’ajouter au bilan énergétique de la filière globale et à son éventuel impact environnemental.
1.3.6 Support carboné
Les noirs de carbone peuvent être produits en utilisant plusieurs types de procédés, dont la liste ne sera pas détaillée ici. Le Vulcan XC 72 de la société Cabot est pour sa part produit selon un procédé baptisé « Oil furnace ». En résumé, un mélange d’hydrocarbures est amené dans un four à haute température (environ 1000°C). En jouant sur les paramètres (température du four, nature des hydrocarbures de départ, etc.), on peut modifier les caractéristiques du produit final (taille des sphéroïdes obtenues, taux de graphitisation, morphologie des agrégats).
1.3.7
Membrane
Plusieurs types de membrane existent aujourd’hui. Cependant, les polymères les plus utilisés actuellement comme électrolyte solide pour PEMFC sont les PFSA dont le plus connu est le Nafion® de chez Dupont de Nemours. Même si d’intenses
recherches sont menées afin de créer de nouveaux polymères conducteurs protoniques [6] alternatifs aux PFSA, cette famille de polymères sert encore aujourd’hui d’étalon de comparaison pour ces différentes membranes alternatives. Force est de constater que peu de matériaux réussissent aujourd’hui à rivaliser en terme de performances (résistances mécanique et thermique, conductivité protonique, mise en forme, capacité d’hydratation,…) avec cette référence.
La mise au point de matériaux alternatifs présente à la fois un intérêt d’un point de vue scientifique mais également économique. Du premier point de vue, ce matériau doit permettre à la pile de travailler à plus hautes températures (supérieures à 120°C) afin d’améliorer les phénomènes de transfert thermique et le rendement énergétique. Du second point de vue, un monopole sur une matière première essentielle à la fabrication des PEMFCs entrainerait un quasi-monopole énergétique et un frein au développement de la filière associée. Aujourd’hui plusieurs fournisseurs existent (Dupont de Nemours, BASF, Fumatech) assurant une concurrence entre plusieurs systèmes et une émulation, donc une recherche pérenne pour l’amélioration des systèmes.
Le Nafion® coûte aujourd’hui environ 400 € le m2. Ce caractère prohibitif est un des freins à la création d’une filière pile à combustible automobile notamment, lorsqu’il s’ajoute au coût d’un métal catalytique comme le platine. Cependant, dans l’hypothèse où un marché se développe, les coûts de production de la membrane ne peuvent que baisser, tandis que la part du platine, régie comme nous l’avons vu précédemment par les réserves mondiales et les capacités d’extraction, ne peut qu’augmenter.
1.3.8
Durabilité
La durabilité d’une pile est un autre verrou technologique important ; la durée de vie permettant une commercialisation est aujourd’hui fixée à 40 000 heures pour une application stationnaire et 5000 heures pour un système pour la propulsion automobile. Cette dernière limite repose sur un simple calcul : la durée de vie d’une voiture est approximativement de 250000 km. En supposant que cette voiture roule à 50 km/h en moyenne, on retrouve ce chiffre de 5000 heures.
Cependant, la durabilité est limitée par de multiples phénomènes de dégradation susceptibles d’intervenir au sein d’un assemblage composite, présentant des conditions « dures » d’un point de vue physico-chimique (différence de potentiel, milieu réducteur ou oxydant, température élevée). Les différents phénomènes de dégradation intervenant seront développés au chapitre II. Néanmoins il est bon de signaler ici que des phénomènes de dégradation propres aux cycles de marche/arrêt peuvent se produire. Cet aspect prend toute son importance lors d’une utilisation pour la propulsion automobile, par exemple. De plus, plusieurs agences de recherche (DOE et ANR HPAC, par exemple) affichent clairement la nécessité d’augmenter les températures de fonctionnement des PEMFCs au delà de 120°C afin d’augmenter les cinétiques de réaction aux électrodes, de rendre les catalyseurs moins sensibles aux poisons contenus dans les gaz et d’améliorer les transferts de chaleur [7, 8] afin de faciliter et réduire le cout énergétique du refroidissement.
1.4 Problématique
L’objectif de cette introduction était de remonter aux verrous économiques, technologiques et scientifiques qui freinent le développement des piles à combustible, en partant de leurs composants et de leur principe de fonctionnement. Un verrou important identifié concerne le catalyseur lui-même : sa durabilité ou stabilité dans le temps en fonctionnement ou lors des étapes arrêt/démarrage. Cet aspect sera d’autant plus prépondérant que les objectifs récents s’orientent vers l’augmentation de la température de fonctionnement des PEMFCs au dessus de 120°C [9-12], sous gaz secs. Ceci permettrait potentiellement d’obtenir plusieurs bénéfices :
Une amélioration du rendement due a l’accélération des cinétiques aux électrodes
Une gestion de l’eau facilitée, par diminution de la quantité d’eau liquide présente dans le système
Une tolérance accrue, notamment au CO, dans le cas des piles qui utilisent le méthanol comme combustible
Une amélioration du rendement global par suppression du système de refroidissement
L’équipe « Electrocatalyse » du Laboratoire de Catalyse en Chimie Organique travaille depuis plusieurs décennies sur la problématique des piles à combustibles. Dans ce cadre, son expertise concerne la synthèse de catalyseurs actifs pour les réactions d’oxydation de petites molécules à intérêt énergétique (hydrogène, CO, alcools, éthers…) et pour la réaction de réduction de l’oxygène, et les caractérisations physiques, physicochimiques et électrochimiques de ces catalyseurs. En milieu acide, ces catalyseurs sont inévitablement à base de platine. Or, comme nous l’avons dit précédemment, la durabilité de ces catalyseurs est un des verrous important pour le développement des PEMFCs. A ce titre, l’équipe « Electrocatalyse » se devait d’entamer des études sur les phénomènes se produisant au sein des couches actives de piles à combustible, conduisant à la perte de performances électriques dans le temps.
Cet aspect est au cœur d’un contrat de recherche mené en collaboration avec différents partenaires, coordonné par le CEA de Grenoble, le projet ANR PANH 05 DVD AME (Durée de Vie et Dégradation des Assemblages Membrane Electrodes).
Le travail présenté dans cette thèse a consisté tout d’abord à mettre en place des modes de dégradation pouvant mimer certains phénomènes se produisant aux électrodes, dans des conditions proches de celles existant au sein des PEMFCs. Ensuite, il s’est focalisé sur la mise en évidence des phénomènes de dégradation de des poudres catalytiques présents au sein des couches actives et des mécanismes sous-jacents qui les entraînent, sous températures et atmosphères contrôlées. Ce travail constitue aussi une étude prospective du comportement des catalyseurs et supports carbonés dans l’optique de développement de PEMFCs fonctionnant à des températures supérieures à 120°C.
2 ETAT DE L’ART
2.1 Introduction générale
La complexité des phénomènes intervenant au sein d’une pile à combustible n’a rien à envier à la complexité du problème posé par l’élaboration d’une filière piles à combustible complète (production, stockage, transport, systèmes). Si la cathode et les phénomènes qui y interviennent ont été intensément étudiés depuis des décennies [13, 14], la connaissance des phénomènes intervenant à l’anode reste lacunaire. Même si plusieurs connaissances fondamentales sont aujourd’hui disponibles, mais disséminées dans des sources bibliographiques très éloignées les unes des autres, d’autres sont tout simplement absentes. Le caractère pluridisciplinaire de ce type d’étude explique en partie la difficulté pour un chercheur à acquérir une vue d’ensemble fine des phénomènes de dégradation au sein des piles à combustible qui plus est en un temps limité.
2.2 La pile à combustible
La nature composite de l’assemblage constituant le cœur d’une PEMFC (cf. chapitre I) m’a conduit à vouloir d’abord la considérer comme un simple assemblage de matériaux initialement indépendants (analyse structurale). Il m’a ainsi semblé pertinent d’acquérir une connaissance approfondie sur ces matériaux préalablement à l’étude de la dégradation des catalyseurs au cours d’un fonctionnement en pile (analyse fonctionnelle) d’un point de vue plus global. Les composants principaux (combustibles, électrolyte polymère et catalyseurs) verront donc leurs natures et leurs propriétés physicochimiques brièvement décrites dans la suite de ce chapitre.
Les interactions binaires, puis ternaires, entre l’environnement (liquide ou gazeux) et les composants des catalyseurs (support et phase métallique) seront considérées.
2.2.1
Réactifs
Comme rappelé précédemment (cf. chapitre I), une PEMFC utilise classiquement le couple H2/O2 comme réactifs. Je vais rappeler ici quelques propriétés
physicochimiques de ces composés.
2.2.1.1 Dioxygène
Contrairement à ce que semble indiquer sa formule de Lewis, le dioxygène est un gaz paramagnétique à température et pression ambiantes. L’atome d’oxygène possède une électronégativité de 3,44 sur l’échelle de Pauling, ce qui en fait un des atomes les plus électronégatifs de la classification périodique. Sa structure, représentée dans un formalisme de Lewis est la suivante :
2.2.1.2 Dihydrogène
La molécule de dihydrogène est une molécule diatomique composée de deux atomes d’hydrogène. L’électronégativité de l’atome d’hydrogène est de 2,2 sur l’échelle de Pauling. Il est bon de rappeler que l’hydrogène est un métal à très fortes pressions [15] ; cette propriété permet d’envisager que l’interaction de cet élément avec d’autres métaux comme analogue à celle existant au sein d’un alliage métallique classique.
2.2.2 Electrolyte polymère
L’électrolyte solide le plus souvent utilisé au sein de PEMFCs est le Nafion®. Ce polymère peut être obtenu à partir de plusieurs procédés différents, lesquels vont avoir une influence sur ses propriétés mécaniques et physico-chimiques (notamment sur sa conductivité protonique et sa résistance mécanique). Les différents procédés diffèrent principalement par le mode de mise en forme du copolymère (extrusion ou coulée évaporation). Ce dernier point fait encore actuellement l’objet de recherche. La formule chimique générale du polymère Nafion® sous forme acide est la suivante :
avec 6 ≤ n ≤ 10.
Cette simple formule nous montre que ce polymère est un copolymère, c'est-à-dire un polymère composé de séquences différentes. Ce copolymère est de plus ramifié. Sa température de dégradation est relativement faible, le fournisseur préconisant une utilisation en dessous de 150°C.
Malgré ses propriétés intéressantes, qui en font actuellement le matériau électrolytique principal des PEMFCs, ce composé comporte certaines limitations pour son utilisation dans de tels systèmes.
La présence relativement importante de fluor dans ce polymère est un de ces défauts évident, la dégradation de ce matériau produisant de l’acide fluorhydrique. Contrairement à ce que l’on pense, cet acide est faible (pKa=3,20) du fait de la nature très électronégative du fluor (de 4 sur l’échelle de Pauling) qui empêche une dissociation totale du compose en solution. Cette espèce est extrêmement nocive.
Ceci pose donc les problèmes de la gestion des effluents issus de la pile et de la mise en place d’une filière de recyclage de ces matériaux.
Plusieurs problèmes de dégradation chimiques et physiques existent également, notamment de dégradation de fonctions sulfoniques et de tenue mécanique. Ces deux phénomènes influent directement sur deux fonctions essentielles de la membrane qui sont la séparation des gaz et la conduction des protons.
De plus la gestion de l’eau au sein de ce polymère est encore aujourd’hui problématique. La membrane gonfle sous l’effet de l’hydratation, pouvant entrainer des problèmes structuraux au cours du temps (décollement). De plus la structure intime d’un polymère Nafion® n’est pas encore complètement déterminée. Si aujourd’hui certains points semblent faire consensus, les structures et phénomènes associés au transport de l’eau et des protons, au sein du polymère, ne sont pas aujourd’hui élucidés. Ceci souligne encore une fois le caractère appliqué, et ce encore actuellement, d’une grande partie des recherches effectuées sur la pile à combustible à électrolyte polymère.
2.2.3 Catalyseurs de PEMFC
Un catalyseur classique de pile à combustible est composé d’une phase métallique finement divisée à l’échelle nanométrique, majoritairement composée de platine, déposée à la surface d’un support conducteur carboné.
2.2.3.1 Support carboné
Les supports carbonés utilisés aujourd’hui dans les piles sont généralement des noirs de carbone (carbon black ou CB) pulvérulents, composés de nano-agrégats de sphéroïdes. Ces noirs de carbone possèdent de grandes surfaces spécifiques (variant de la dizaine au millier de mètres carré par gramme). A cause du caractère apolaire des liaisons C-C et C-H majoritairement présentes au sein de la matrice carbonée, les structures résultantes sont elles-mêmes globalement apolaires, ce qui
Vulcan XC 72 de chez Cabot Corp., le plus souvent utilisé pour la dispersion de catalyseurs métalliques.
Le carbone existe sous plusieurs formes allotropiques, les deux plus connues étant le diamant et le graphite [1]. Cette dernière forme est la forme thermodynamiquement stable à température et pression ambiante. La structure du graphite est représentée sur la figure 5. Elle consiste en un empilement de plans de type graphène. Dans cette structure la distance entre atomes de carbone est de 1,42 Å au sein d’un plan. La distance entre plans est de 3,35 Å.
Figure 4 : photographies (a) MET et (b) MET HR représentant la structure d’un noir de carbone Vulcan XC72 de chez Cabot Corp.
Figure 5 : structure du graphite.
Les noirs de carbone sont le plus souvent choisis pour leur caractère conducteur électronique et pour leur grande surface spécifique (proche de 250 m2 g-1 pour le
Vulcan XC 72). Le caractère conducteur électronique fait partie du cahier des charges des matériaux associées aux électrodes. Une grande surface spécifique
dans un volume réduit. Néanmoins il est à noter que le caractère conducteur est essentiellement assuré par la fraction graphitée présentant des carbones hybridés sp2 (existence d’e- délocalisés). L’augmentation de la surface spécifique nécessite quant à elle une destruction de ces mêmes zones graphitées, et entraine une augmentation de la microporosité. Un compromis doit donc être réalisé entre ces deux paramètres dans le choix d’un carbone pour une application en pile. Ce compromis est réalisé par le choix du Vulcan XC72 comme matériau support du platine.
2.2.3.1.1 Réactivité
Le carbone est utilisé depuis fort longtemps, sous forme de coke, comme réducteur industriel des oxydes métalliques pour la production de métaux. Sous forme de charbon, son utilisation comme combustible domestique est millénaire.
2.2.3.2 Platine
2.2.3.2.1 Propriétés physico-chimiques
Il est vain de vouloir résumer les propriétés physico-chimiques du platine en quelques lignes. Néanmoins il est bon de rappeler qu’il s’agit d’un métal, généralement qualifié de « noble », c.-à-d. qu’il est considéré comme difficilement oxydable à température ambiante. Le platine partage cette appellation avec l’or et l’argent. Cette affirmation est partiellement inexacte. En effet, plusieurs études ont démontré la présence en surface de lingot de platine d’espèces oxydées sur une faible épaisseur [16, 17]. De plus sa température de fusion est de 2041,4 K soit 1768,3 °C, ce qui en fait un métal particulièrement réfractaire.
2.2.3.2.2 Comportement électrochimique
Le diagramme de Pourbaix simplifié pour le platine massif dans l’eau à 25°C est présenté sur la figure 6 [18]. On peut y observer qu’une zone de corrosion existe aux très faibles pH et aux potentiels élevés (E>0,8V). Or dans la pile, un flux de protons
Localement, toute zone en contact avec le polymère conducteur (point triple) va ressentir ce caractère acide. A la cathode, où le potentiel d’électrode est élevé, le milieu très acide aura une action importante en favorisant la formation d’espèces ioniques métalliques par corrosion. Ces espèces ioniques métalliques sont impliquées dans plusieurs phénomènes de dégradation. Cet aspect de la dégradation du catalyseur cathodique fera l’objet d’un développement ultérieur (cf. 2.4.2.2). 0 2 4 6 8 10 12 14 1,6 0,8 0,0 -0,8 -1,6 Corrosion? passivation immunité pH E / V 0 2 4 6 8 10 12 14 1,6 0,8 0,0 -0,8 -1,6 Corrosion? passivation immunité pH E / V
Figure 6 : diagramme simplifié de Pourbaix pour le platine massif dans l’eau à 25°C [18].
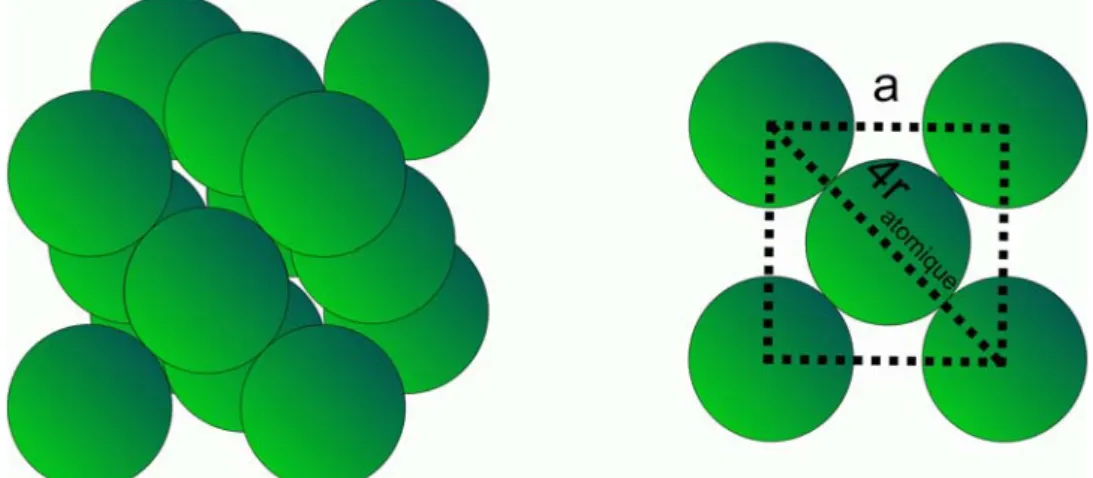
2.2.3.2.3 Structure cristalline
Le platine cristallise selon une maille cubique face centrée (Fm3m) de paramètre a proche de 0,392 nm. L’évolution du paramètre pour un platine massif en fonction de la température est donnée par Arblaster [20]. La maille élémentaire du platine est représentée sur la figure 7.
2.2.3.3 Produits commerciaux existants
Aujourd’hui deux types de catalyseurs principaux Pt/C sont disponibles dans le commerce, auprès de BASF (Gamme Selectra™ Series E catalysts) et Johnson
Matthey (Gamme HiSPEC™). Il est à noter que cette diversité restreinte est due à la
fusion au cours des dernières années des entreprises E-TEK, PEMEAS et Engelhard au sein de la branche BASF Fuel Cell.
2.3 Interactions
Les systèmes H2/Pt/C et O2/Pt/C peuvent être considérés globalement comme
des systèmes ternaires. Dans ce cas, l’interaction avec le Nafion® sera généralement négligée ; néanmoins il sera considéré que l’ensemble des phénomènes interviennent en milieu acide. Le nombre d’interactions binaires possibles pour chaque système est donc, dans chacun des cas, de trois. Dans le cas du système H2/Pt/C, les interactions considérées seront regroupées dans les classes suivantes :
Pt/H2
Pt/C H2/C
Chacun de ces types d’interactions peut se décliner en plusieurs phénomènes physico-chimiques distincts, en fonction des concentrations et de la forme physique sous laquelle se trouve chacune des composantes. Les paragraphes suivants regroupent donc une bibliographie, par nature non exhaustive, concernant certaines de ces interactions. Par analogie, des interactions du même type peuvent être envisagées pour le système O2/Pt/C, et seront détaillées dans la suite de ce chapitre.
2.3.1 Système
H
2/Pt/C
2.3.1.1 H-Pt
L’interaction entre l’hydrogène et le platine peut être étudiée dans deux environnements distincts : soit gazeux (hydrogène pur ou dissous dans un gaz vecteur) et soit liquide (hydrogène dissous dans une phase aqueuse). Dans une pile, l’interaction platine-hydrogène intervient côté anode. Le milieu est gazeux et généralement pauvre en eau (malgré l’humidification du gaz). De plus, le fonctionnement de PEMFCs sous gaz secs est de plus en plus étudié [21-24] dans le cadre de la nécessité d’augmenter la température de fonctionnement des PEMFCs au-delà de 150°C [9-12]. Cependant, lors d’études électrochimiques, l’hydrogène se trouve généralement dissous dans une phase liquide majoritaire (électrolyte aqueux). Il convient donc de considérer que ces deux milieux sont très différents, en termes de concentration en réactif et de nature physique. Il est alors nécessaire de ne pas transposer directement les mécanismes déterminés dans l’un à ceux intervenant dans l’autre. Cette dernière remarque reste valable quelque soit l’interaction binaire considérée ci-dessous, à partir du moment où elle fait intervenir une espèce soit à l’état gazeux, soit dissoute dans un électrolyte.
2.3.1.1.1 Diffusion de H2 dans le platine
Même si comparé aux autres métaux de transition le platine est un métal relativement peu perméable à l’hydrogène, il n‘en possède pas moins une certaine perméabilité à ce gaz comme une grande majorité de matériaux. La diffusivité associée à ce phénomène a été mesurée par différentes techniques dans différentes équipes sur des échantillons de platine le plus souvent polycristallins [15, 25, 26]. Cependant, la forme sous laquelle l’hydrogène est véhiculé au travers d’une matrice de platine reste encore aujourd’hui non élucidée et problématique.
2.3.1.1.2 Chimisorption de H2 sur Pt
La chimisorption de l’hydrogène sur le platine peut se produire soit en milieu liquide à partir du l’hydrogène moléculaire dissous, soit en milieu gazeux. Une distinction sera faite entre ces deux milieux dans les prochains paragraphes.
La variété de sites observables à la surface d’une structure de platine est multiple. Néanmoins la structure cubique face centrée du cristal de platine incite généralement à considérer les trois familles de plans de plus bas indices de Miller {(1; 0;0) ;(1;1;0) ;(1;1;1)} comme les plus probables et tous les sites existant comme dérivant de ces structures.
2 . 3. 1 .1 . 2.1 M i l i eu li qu i d e
La chimisorption de l’hydrogène sur le platine a été étudiée, sur des échantillons massifs polycristallins dans différents électrolytes acides, principalement en milieu H2SO4 et HClO4. La nature de l’électrolyte a une influence sur l’aspect du signal
enregistré en électrochimie.
Pour chaque famille de plans susceptible de s’exhiber à la surface d’une structure de platine métallique, il est possible de calculer la charge faradique associée à une adsorption d’une monocouche d’hydrogène. Considérons par exemple un plan cristallographique {1,1,1}, tel que représenté sur la figure 8.
La valeur obtenue pour ce type de plan est alors de 243 µC.cm2. Ce type de calcul peut être effectué pour chaque famille de plan. Léger [27] a aussi mesuré 208 μC.cm−2 pour les plans (100), pour des valeurs théoriques respectives de 240 et 210 μC.cm−2. Le cas du plan (110) est plus complexe. Une valeur expérimentale de 213
μC.cm−2 a été mesurée sur ce dernier pour une valeur théorique de 149 μC.cm−2. La
mobilité relative des atomes superficiels de ce plan rend son comportement plus complexe [28, 29]. 50 % de la seconde couche atomique semble occupée par des atomes d’hydrogène du fait de la présence d’une distance interatomique plus importante entre les atomes de surface que les distances interatomiques des plans (111) et (100). Dans le cas d’une surface polycristalline présentant une distribution de ces plans, un standard arbitraire Q0H égal à 210 μC.cm−2 a été suggéré par
Biegler et coll. [30] et sera utilisé dans ce travail. Cette valeur ne constitue qu’une estimation, valable a priori pour des échantillons massifs, mais dont la pertinence pour les nanoparticules n’est pas triviale.
2 . 3. 1 .1 . 2.2 M i l i eu gaz e ux
La nature des sites et les énergies d’adsorption associées à ces sites ont également été déterminées par diverses techniques, notamment par désorption programmée en température (TPD) ou réduction programmée en température (TPR) en phase gazeuse. Divers matériaux ont été utilisés, il s’agit généralement de platine micro- ou nano-structuré déposé à la surface de supports tels que l’alumine et la silice. Ces supports présentent l’avantage d’être stables thermiquement et inertes vis-à-vis de l’hydrogène à basse température (supports non réductibles). A partir des résultats obtenus, il est aujourd’hui considéré que l’isotherme décrivant le mieux l’adsorption de l’hydrogène en milieu gazeux est une isotherme de type Frumkin. Cependant, l’attribution de telle ou telle valeur d’énergie d’adsorption à un site précis est impossible pour plusieurs raisons :
la dépendance locale à l’environnement, c’est-à-dire que les adsorbats s’influencent mutuellement
la mobilité éventuelle des espèces adsorbées en surface du matériau ; elle doit être prise en compte : les différentes résolutions temporelles obtenues lors des observations, en comparaison avec la vitesse de réorganisation des espèces adsorbées, entraînent l’enregistrement de
2.3.1.1.3 Diffusion Pt-H en surface Pt
Récemment la diffusion d’un complexe Pt-H a été observée par effet tunnel sur une surface de platine (100)(2x1) [31]. L’article conclut que la mobilité du complexe Pt-H en surface du platine augmente d’un facteur 500 par rapport à la mobilité intrinsèque de Pt en surface du platine. Il est donc important de considérer le système Pt-H comme un système dynamique, susceptible de donner lieu à des phénomènes de diffusion à la surface du platine, même en l’absence de variation de potentiel. Or, il est connu que les phénomènes surfaciques modifient les propriétés physico-chimiques (température de fusion, susceptibilités magnétique et diélectrique) d’un matériau à l’échelle nanométrique ; cette indication peut prendre toute son importance dans le cadre du comportement d’une structure nanométrique soumise à un milieu (gazeux ou liquide) contenant de l’hydrogène. Cet aspect sera développé ultérieurement dans ce manuscrit (cf Chapitre IV, V, VI et VII)
2.3.1.2 Interaction Pt-C
La nature de l’interface Pt-C dans le cadre d’un cristal déposé à la surface d’un carbone conducteur est l’interface la plus critique pour le transfert électronique. En effet si la conduction électronique au sein d’un cristal métallique s’envisage relativement facilement, dans un formalisme classique, celle intervenant à l’interface entre une phase cristalline métallique et une surface carbonée para-cristalline, partiellement graphitique, comportant des fonctions oxygénées de surface s’avère plus ardue.
2.3.1.3 Quel type de liaison ?
La nature de la liaison Pt-C, dans le cas d’un catalyseur élaboré par une méthode de synthèse colloïdale suivie d’un dépôt sur carbone par simple mise en contact, peut être décrite de façon électrostatique. Elle peut donc être assimilée à une liaison de type van der Waals et interprétée comme une interaction entre dipôles. L’origine des charges au sein d’un système nanométrique peut être envisagée comme
L’existence d’un déficit électronique partiel des atomes de surface du cristal crée une inhomogénéité. Ces charges positives de surface sont neutralisées, à l’échelle du cristal, par l’existence de charges négatives au sein du cristal. Le support carboné présente des charges superficielles qui peuvent être notamment portées par des fonctions oxygénées.
La présence en surface de la nanoparticule d’hétéroatomes (hydrogène, oxygène, azote, carbone ou alcalins) peut modifier l’équilibre des charges présentes au sein de la nanoparticule.
Ces deux phénomènes, interdépendants, doivent inciter le lecteur à considérer la nanostructure comme une entité chargée, sensible à son environnement électronique direct. Le passage à un formalisme orbitalaire semble donc bien adapté à la description de ce type de liaison. En effet un nano-cristal se situe à la limite entre l’échelle atomique (existence de niveaux d’énergie discrets, quantifiés) et l’échelle microscopique (existence de bandes de conductions). Un cristal de platine, dans le cas d’une entité nanocristalline cubique de 2 nm de côté possède déjà plusieurs milliers d’atomes. Ses niveaux énergétiques sont donc partiellement dégénérés, laissant apparaître des bandes de conduction, analogues à celles présentes dans un cristal de plus grande taille. Néanmoins, la quantité d’atomes de surface étant importante, ce système orbitalaire va être beaucoup plus sensible à l’interaction avec des espèces adjacentes, chimisorbées ou non.
Le support carboné est, quant à lui, un ensemble de nano-agrégats sphéroïdes conducteurs. L’hybridation des atomes de carbone sp2 assure la conductivité électronique du matériau. Des niveaux dégénérés existent donc dans cette structure, générant un système orbitalaire complexe. Une particule de noir de carbone doit donc être envisagée comme une macromolécule présentant des niveaux énergétiques, certains vides, d’autres occupés, complètement ou partiellement.
Considérons l’interaction d’une nanoparticule avec une particule de support. Les deux systèmes orbitalaires vont s’approcher et des niveaux d’énergie vont interagir, créant potentiellement une interaction constructive. On voit donc que l’interaction successive de nanoparticules métalliques avec le support va progressivement modifier le système orbitalaire global du système (particules+carbone) rendant la description de ce système excessivement complexe.
2.3.1.4 Interaction C-Hydrogène
La liaison carbone-hydrogène est le sujet de nombreux ouvrages. Les hydrocarbures sont autant d’exemples de sa présence massive dans la nature. C’est une liaison d’énergie moyenne avec 412 kJ.mol-1. Elle est apolaire si l’on considère
les électronégativités relatives du carbone et de l’hydrogène (respectivement 2,55 et 2,2 dans l’échelle de Pauling). Ceci explique notamment le caractère apolaire des hydrocarbures.
Les complexes carbone-hydrogène présents au sein des noirs de carbone sont stables au dessous de 1000°C [32]. Une désorption complète de cet hydrogène nécessite un traitement à une température supérieure ou égale à 1200°C. La chimisorption de l’hydrogène sous forme atomique sur le carbone se produit à température ambiante, mais ne devient vraiment significative que pour des températures supérieures à 200°C. De plus, la présence de platine est susceptible d’accroître le phénomène de chimisorption d’hydrogène sur le carbone à faibles températures, via un phénomène de « spillover ». Ce terme, traduit littéralement par débordement, désigne la migration d’une éspèce mobile d’une phase initiale vers une phase secondaire.
La quantité d’hydrogène présente au sein d’un noir de carbone est susceptible de changer profondément les propriétés de ce dernier (résistance électrique notamment).
2.3.2 Interactions ternaires
2.3.2.1 Spillover (débordement) de H sur C via Pt
Ce phénomène, suggéré depuis plusieurs décennies [33, 34] a récemment été prouvé par diffusion inélastique des neutrons par Mitchell et al. [35, 36]. Il apparaît raisonnable de penser que ce phénomène sera d’autant plus visible que la pression d’hydrogène au contact du catalyseur sera importante et que le nombre d’interactions Pt-C est important. Ceci nécessite de considérer que l’espèce hydrogène adsorbée
du carbone (exacerbation ou affaiblissement du caractère hydrophobe) est d’un grand intérêt dans l’optique d’une application en pile.
2.3.3 Système O
2/Pt/C
2.3.3.1 Interaction O
2/PtLe système O2/Pt peut se décliner à l’état solide sous la forme de plusieurs
oxydes. Plusieurs structures sont rapportées : PtO, Pt3O4, PtO3, PtO2 [18]. Ce dernier
oxyde existe sous deux formes distinctes, l’une anhydre (PtO2) et l’autre
monohydrate (PtO2.H2O). Néanmoins l’existence de plusieurs de ces structures est
aujourd’hui encore sujette à caution. Le dioxyde de platine est utilisé de façon classique en chimie organique sous le nom de catalyseur d’Adams et possède des propriétés semi-conductrices.
Comme toute famille homologue d’oxydes, celle-ci peut présenter des structures intermédiaires présentant des écarts à la stœchiométrie. Pour cette raison, les oxydes de platine sont souvent désignés sous la forme générale PtOx. L’existence
d’oxydes à la surface du platine massif est rapportée dans la littérature. Une fine couche d’oxyde se forme en effet spontanément à la surface du métal au contact de l’air, sur un faible nombre de couches atomiques [16, 17]. Il est admis qu’une couche analogue se forme à la surface des nanoparticules de platine au contact de l’air. Néanmoins le nombre d’atomes de surface est important relativement au nombre total d’atomes constituant une nanoparticule, cette couche d’oxyde constitue donc une fraction importante de la quantité de platine présente au sein de cette entité.
Le domaine de potentiel de formation des oxydes de platine est situé au-delà d’une limite égale à 0,8 V/ ERH pour des pH acides. La signature obtenue en voltammétrie traduit bien le caractère multiple des espèces oxygénées en surface du platine.
2.3.3.2 Interaction Pt/C
2.3.3.3 Interaction O2-C
Deux oxydes de carbone existent : le monoxyde et le dioxyde de carbone. Les réactions de formation de ces deux espèces à partir de carbone et d’oxygène sont les suivantes :
C + O2 CO2 (15)
C+ ½ O2 CO (16)
La réaction de conversion du monoxyde en dioxyde peut être écrite l’équation suivante :
CO+ ½ O2 CO2 (17)
Cette réaction correspond à une réaction de nettoyage du catalyseur, lors d’un empoisonnement préalable par le CO.
Ces réactions peuvent intervenir en milieu gazeux ou liquide. Le CO est une molécule connue pour empoisonner les catalyseurs. Cependant, l’interaction avec l’oxygène peut se matérialiser sur un noir de carbone par la formation de fonctions oxygénées de surface. Plusieurs fonctions organiques peuvent ainsi être présentes :
-des fonctions « acide carboxylique » (-COOH) -des fonctions « lactones » (-O-CO-C)
-des fonctions « hydroxyle » (-OH)
Cette liste non exhaustive présente les grandes familles de fonctions généralement présentes [37-39]. Il est bon de noter que du fait de la différence d’électronégativité entre le carbone et l’oxygène, ces différentes fonctions sont polaires. Elles amènent donc des charges de surface permanentes et localisées. Du fait de la présence de liaisons doubles et de doublets non liants sur l’oxygène, ces fonctions de surface vont pouvoir se conjuguer au système du graphite. Ces fonctions vont aussi pouvoir jouer un rôle dans les interactions de Van der Waals responsables de l’accroche des particules à la surface du support. De plus ces espèces possèdent souvent un caractère acide (au sens de Brönsted). Le support carboné présentant de larges domaines avec une forte délocalisation électronique, il peut donc être considéré comme une macromolécule possédant une multiplicité de sites acides de différentes forces. Le carbone majoritairement apolaire pourra ainsi prendre
la méthode de Boehm ne permet de différencier que quelques domaines de force acide, et ne traduit pas la grande variété de structures parfois très complexes présentes en surface. Cette variété peut être vue comme une conséquence de la variété de structures chimiques présentes au sein du mélange initial constituant la source de carbone dans le procédé de production du noir de carbone.
2.3.4 Interaction ternaire C/O
2/Pt
Un phénomène analogue (spillover) au phénomène observé avec l’hydrogène peut intervenir avec l’oxygène. Ceci renforce encore le caractère réactif de l’oxygène vis-à-vis des matériaux catalytiques utilisés dans la pile [40, 41].
2.4 Mécanismes de dégradation
2.4.1
Problématique
Le développement de la pile à combustible est aujourd’hui limité d’une part par la création d’une filière hydrogène performante (principalement son stockage et son transport), le coût et la disponibilité des matériaux de pile, mais également par la durabilité des systèmes. La gamme de température de travail (aujourd’hui 80°C environ, 150°C à l’avenir), le caractère agressif des combustibles, l’humidité et l’environnement fortement acide sont autant de facteurs de dégradation des systèmes de type PEMFC. En outre, le caractère composite d’une PEMFC entraîne un nombre important d’interactions potentielles entre matériaux distincts, et donc un nombre important de sources de dégradation potentielles. Les mécanismes sous-jacents ne sont donc pas, pour la plupart, complètement élucidés.
2.4.2 Mécanismes de dégradation en fonctionnement
2.4.2.1 Cross-over des combustibles
La pile est alimentée à la cathode par du dioxygène utilisé pur ou dans l’air et par du dihydrogène à l’anode. Deux gradients de concentration opposés de ces espèces existent donc au sein de la membrane, entrainant une diffusion de dihydrogène vers la cathode et une diffusion de dioxygène vers l’anode. Ces phénomènes vont entrainer une modification des potentiels aux électrodes, et un état stationnaire va s’établir en fonction des paramètres de fonctionnement de la pile. Les potentiels aux électrodes doivent donc être perçus comme des potentiels mixtes. Des gradients de diffusion vont également exister de l’intérieur de la pile vers l’extérieur au travers des plaques bipolaires, par exemple.
2.4.2.2 Dissolution [42-46]
L’observation du diagramme de Pourbaix du platine, évoqué précédemment (cf. page 34), nous indique qu’un phénomène de dissolution peut intervenir si trois conditions sont réunies :
Un pH faible
Existence d’une phase aqueuse liquide au contact du platine Un potentiel élevé
Du fait de la nécessité de l’existence d’une phase liquide et d’un potentiel élevé, ce phénomène est essentiellement observé à la cathode. Des espèces ioniques sont libérées dans le milieu liquide. A partir de ce moment, ces ions, espèces extrêmement mobiles, sont susceptibles de donner naissance à trois grands phénomènes. Ces trois phénomènes, issus de la dissolution, sont détaillés ci-dessous.