Effets de l'inhibition des protéases de la coagulation dans un modèle porcin d'ischémie reperfusion rénale
Texte intégral
(2) THESE pour l’obtention du Grade de. DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté de Médecine et Pharmacie) (Diplôme National - Arrêté du 7 août 2006) Ecole Doctorale : BioSanté N°524 Champ disciplinaire : Biologie, Médecine, Santé Secteur de Recherche : Aspects moléculaires et cellulaires de la biologie. Présentée par :. Solenne TILLET ************************. Effets de l’inhibition des protéases de la coagulation dans un modèle porcin d’ischémie reperfusion rénale ************************ Directeur de Thèse : Professeur Gérard MAUCO Co-directeur de thèse : Docteur Sébastien GIRAUD ************************ Soutenue le 16 avril 2014 devant la Commission d’Examen. JURY Pr. Hugues CHAP. Rapporteur. Pr. Georges MOURAD. Rapporteur. Pr. Omar BENZAKOUR. Examinateur. Pr. Alexandre HERTIG. Examinateur. Pr. Gérard MAUCO. Directeur de Thèse. Dr. Sébastien GIRAUD. Co-Directeur de Thèse 1.
(3) 2.
(4) Remerciements. Je remercie les professeurs Hugues Chap et Georges Mourad d’avoir accepté d’être les rapporteurs de ce travail. Je remercie également les professeurs Omar Benzakour et Alexandre Hertig d’avoir accepté d’examiner mon travail de thèse. C’est un grand honneur pour moi de vous compter parmi mon jury de thèse. Je remercie le Professeur Gérard Mauco d’avoir été mon directeur de thèse et de m’avoir accueuillie au sein du l’unité INSERM U927 de Poitiers, lorsque je débutais mon stage de master 2. J’ai eu la chance de poursuivre à ses côtés ce travail dans les domaines de la transplantation rénale et de l’hémostase durant ma thèse. Merci pour vos conseils avisés, pour votre esprit critique qui m’ont permis de faire avancer ce projet. Et enfin merci pour votre écoute et pour votre amitié. Je veux aussi remercier le Professeur Thierry Hauet de m’avoir accepté au sein de l’unité INSERM U1082. Merci pour votre contribition essentielle à la mise en place et à l’élaboration de ce projet. Merci d’avoir mis à ma disposition les moyens techniques et matériels pour que je puisse mener à bien tous ces travaux. Merci pour votre implication et pour votre expertise. Merci pour m’avoir poussée dans mes retranchements et d’avoir eu confiance en moi. Je souhaite remercier de tout cœur le Docteur Sébastien Giraud, qui a été un codirecteur de thèse incroyable. Merci pour tout ce que tu m’as appris : l’organisation, les techniques, la détermination et l’optimisme. Merci pour ton implication et ton engagement dans ce travail de thèse. Merci pour la confiance que tu as eu en moi. Tu as été un soutien de chaque instant, un encadrant soucieux de son étudiante et au-delà un « chef » bien veillant. J’ai été très heureuse d’apprendre et de travailler à tes côtés pendant toutes ces années. Je voudrais également remercier tous les partenaires institutionnels et privés qui ont financé cette thèse. Notamment remercier l’entreprise Endotis Pharma qui m’a permis de débuter cette étude et d’avoir la chance de travailler sur la molécule EP217609. Je remercie tout particulièrement le Dr Maurice Petitou et le Dr Stéphane Degove qui ont suivi l’avancé 3.
(5) de mon travail dans la première année de ma thèse. J’adresse aussi tout mes remerciements à la Fondation Transplantation et à la Société Francophone de Transplantation. Je voudrais exprimer tout mes remerciements à l’équipe de recherche de l’INSERM U1082 et tout particulièrement toutes les techniciennes qui m’ont aidé dans ce travail de thèse. Merci à Virginie Ameteau, pour son engagement à mes côté, pour ses compétences techniques, pour son dynamisme, son sérieux, sa gentillesse et son amitié qui ont été indispensables pour moi. Un grand merci aussi à Maïté Jacquard pour son aide, pour sa rigueur scientifique et sa gentillesse. Un grand merci aussi à Sandrine Joffrion pour m’avoir transmis « l’amour » du western blot, merci pour tes compétences et ta sympathie. Je voudrais aussi remercier Sihem Hosni, assistante ingénieur, pour son soutien. Merci aussi à Nadège Boildieu, je n’ai pas eu l’occasion de travailler avec toi, mais merci pour ta gentillesse et ton soutien. Merci à Marianne et à Aurélie pour leur gentillesse. Merci aussi aux gestionnaires Françoise Chauvelon et Christine Chaleroux. Merci aussi à toute l’équipe des techniciennes du service d’anatomopathologie du CHU de Poitiers. Merci au Pr Jean Michel Goujon pour son investissement et pour le travail effectué sur mon projet de thèse. Merci à Nathalie Quellard et Béatrice Fernandez du service de microscopie électronique du CHU de Poitiers, merci pour vos compétences et pour votre soutien. Je remercie aussi le Dr Laurent Macchi et le Dr Jérôme Duchemin pour leur aide précieuse. Un immense merci aussi à toute l’équipe de l’INRA de Surgères qui fait un travail formidable. Merci à William Hebrard à Catherine Henry à Pierre Couturier et à Irène Launay. Merci aux chirurgiens pour leur travail à la plate-forme de Surgères et merci à tous les internes en médecine qui ont participé à ce travail. Je voudrais aussi remercier le Dr Dephine Bon. Merci pour tes remarques constructives, merci pour le temps que tu as pris dans la correction de cette thèse. J’ai été très heureuse de travailler à tes côtés, tu es pour moi un exemple de réussite. J’ai pu admirer au cours de mes années passées dans l’unité le chemin que tu as parcouru, porté par ta passion pour la recherche. J’admire ton professionalisme et ton engagement dans le travail. Merci aussi pour les sorties et les bon moments passés au PLB ! J’adresse aussi tous mes remerciements au Dr Nicolas Chatauret. Je te remercie pour le temps que tu m’as consacré. 4.
(6) J’admire ton engagement dans le travail et ton amour pour la recherche. Je voudrais aussi remercier le Dr Raphael Thuiller pour son implication dans mon projet de thèse et pour ce qu’il m’a transmis. Je remercie aussi le Pr Patrick Hannaert, pour ses compétences, son professionalisme, sa gentillesse et sa bonne humeur. J’adresse aussi mes remerciements au Dr Frédéric Favreau qui a toujours été disponible pour répondre à mes questions et pour m’aider. Merci aussi au Pr françois Seguin, pour ses conseils et sa gentillesse. J’adresse aussi un énorme merci à tous mes collègues thésard(e)s que j’ai cotoyés au cours de ma thèse. Merci à Ludivine et à François pour leur gentillesse et leurs encouragements. Merci à toi aussi Vanessa pour ces années passées à tes côtés, merci pour ce que tu m’as appris quand je débutais, merci pour ta gentillesse et pour ton écoute. A toi aussi Sylvain, un immense merci, pour tout ce que tu m’as donné, le temps passé à l’analyse des résultats, merci pour tes conseils avisés, pour cette passion pour la Science qui t’anime et merci de me l’avoir faite partager. Merci aussi pour ton soutien moral et pour ta bonne humeur et ton écoute. Merci aussi à Edouard, c’était chouette de travailler avec toi. Merci aussi à Vivien qui a investi notre bureau depuis plus d’un an maintenant, j’ai été très heureuse de travailler à tes côtés. Merci pour ta bonne humeur et ta gentillesse, bon c’est normal quand on fait une thèse sur Pacman ! Non je plaisante ! Merci pour tous ces repas chinois le midi, qui ont parfois été difficiles à digérer ! Ca va être dur pour moi de quitter ce bureau. Merci à toi Seb pour toutes les musiques que tu m’as faites découvrir, merci pour tes délires en chanson, merci pour toutes ces conversations où nous avons expérimenté tous les accents de la terre, avec une petite préférence pour l’accent québecois !! Et un grand merci pour ces moments passés sur les routes en direction de Surgères à compter les buses variables, c’était que du bonheur !! Je voudrais aussi remercier de tout cœur, tous mes ami(e)s qui m’ont soutenu dans ce projet de thèse dans les bons comme dans les mauvais moments. Les filles vous êtes des amies en or, je vous adore, vous êtes un vrai rayon de soleil dans ma vie. Un immense merci à mes parents, pour leur soutien, leur affection et la confiance qu’ils ont en moi. Merci à ma sœur qui m’a toujours soutenue et aidée et merci à mon frère pour ses encouragements et son admiration. Merci à toi aussi Tony, tu m’as fait grandir et évoluer, tu as été un soutien immense durant toutes ces années. J’espère que nous continuerons notre chemin ensemble, car vivre avec toi au quotidien est la chose qui me rend la plus heureuse. 5.
(7) Résumé La pénurie d’organes est un problème majeur en transplantation, aussi, en France, depuis 2005 sont autorisés les prélèvements sur donneurs décédés après arrêt cardiaque (DDAC). Cependant, ces organes sont soumis à d’importantes lésions d’ischémie reperfusion, en particulier liées à la coagulation induite par la stase. La formation de microthrombi entraîne à la reperfusion un défaut d’irrigation qui aboutit à la mort celullaire. Parallèlement, l’endothélium rénal amplifie la coagulation par l’expression du facteur tissulaire. Ce processus engendre une synthèse accrue de molécules pro-inflammatoires via les PAR (Protease-Activated-Receptors) activés par les facteurs IIa et Xa. Dans le cadre de ce travail, nous avons évalué in vivo, dans un modèle porcin d’autotransplantation rénale, l’effet de deux molécules anticoagulantes de synthèse, l’une anti-Xa et l’autre combinant un effet anti-Xa et anti-IIa. Le modèle préclinique est composé d’une période d’ischémie chaude suivie d’une conservation de 24h à 4°C en UW, modèle sévère mimant les lésions observées chez les DDAC. L’utilisation de ces anticoagulants a permis de réduire les lésions de fibrose et d’inflammation responsables de la perte du greffon rénal à long terme. In vitro, les effets bénéfiques de la molécule anti-Xa+IIa, seraient dûs à une limitation de l’activation endothéliale et à une réduction de l’inflammation. En conclusion, l’injection de ces anticoagulants avant l’ischémie chaude et/ou durant la conservation des reins a montré un bénéfice sur la reprise de fonction et sur la réduction des dysfonctions chroniques des greffons. Mots clés : transplantation rénale, conservation du greffon, ischémie reperfusion, coagulation, inflammation.. Abstract Organ shortage is a major limitation for transplantation, then since 2005 the use of deceased after cardiac arrest donors (DDAC) became legal in France. However these organs undergo severe ischemia-reperfusion injury, partly due to stasis activated coagulation. Microthrombi impair a correct reperfusion of the implanted organ. Conversely activated renal endothelium is the cause of an amplification of coagulation. This leads to increased production of proinflammatory molecules via the PAR (protease-activated receptors) activation by coagulation factors IIa and Xa. In this work we have used a severe in vivo ischemia-reperfusion model and tested the effect of inhibitors of Xa and IIa on the outcome of renal autotransplantation. One of these synthetic molecules was an anti-Xa heparinoid, while the other was acombined of direct anti-IIa + anti-Xa heparinoid. The pre-clinical model included a sequence of warm ischemia followed by a cold storage 24 h at 4°C in UW, mimicking what happens in DDAC. The use of both molecules was followed by a reduction of fibrosis and inflammation, known to cause long term kidney loss. In an in vitro model, we have shown that beneficial effects of the combined anti IIa-Xa could be the consequence of a reduction in endothelial activation and subsequent inflammation. We conclude that anti Xa, and anti Xa-IIa, use before warm ischemia and/or during organ preservation, is beneficial for kidney function and survival and that they may be used as protectors against chronic renal dysfunction Keywords: kidney transplantation, graft preservation, ischemia/reperfusion, coagulation, inflammation. 6.
(8) Sommaire Sommaire ............................................................................................................ 7 Abréviations ..................................................................................................... 12 Listes des figures et des tableaux .................................................................................................. 16 Avant propos .................................................................................................... 21 GENERALITES ...................................................................................................................................... 22 I.. La transplantation ............................................................................................................ 23 1.. Histoire de la transplantation .......................................................................... 23. 2.. La transplantation rénale en France ................................................................ 26 a.. La transplantation rénale : le traitement de choix de l’insuffisance rénale terminale ...................................................................................................... 26. b.. La transplantation rénale en chiffres ............................................................ 26. II.. Le rein ................................................................................................................................... 27 1.. Structure et fonction du rein ........................................................................... 27 a.. La structure du rein ...................................................................................... 27. b.. Les fonctions du rein .................................................................................... 28. 2.. Néphron et filtration glomérulaire .................................................................. 29 a.. La structure du néphron ............................................................................... 29. b.. La filtration glomérulaire ............................................................................. 32. III.. Les étapes de la transplantation rénale ................................................................... 32 1.. Les donneurs d’organes en France ................................................................. 33 a.. Les donneurs vivants.................................................................................... 34. b.. Les donneurs décédés .................................................................................. 35. 2.. Le prélèvement ............................................................................................... 40. 3.. La conservation ex vivo des organes ............................................................... 41 a.. Les débuts de la conservation des organes .................................................. 42. b.. Les solutions de conservation ...................................................................... 43. c.. La conservation statique .............................................................................. 45 7.
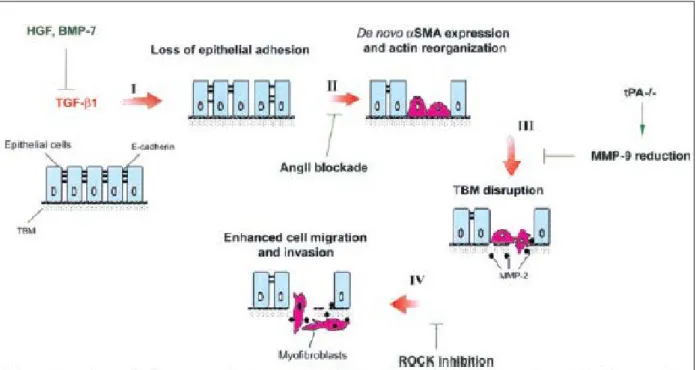
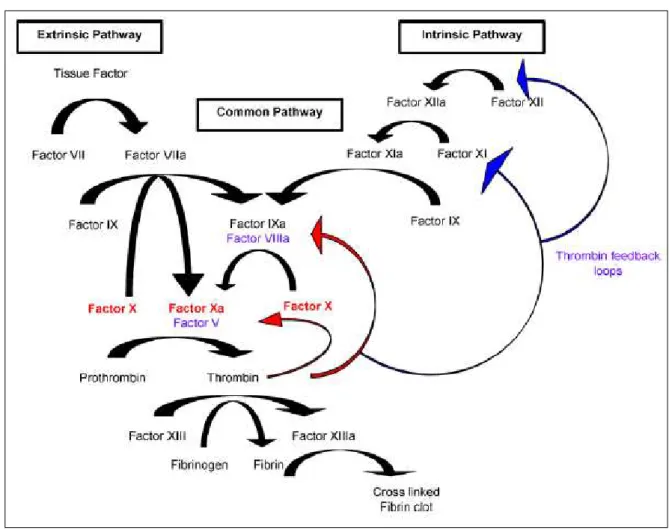
(9) 4.. La reperfusion ................................................................................................. 45. IV.. Les lésions d’ischémie reperfusion ........................................................................... 45 1.. Les lésions d’ischémie .................................................................................... 47 a.. Acidose et déplétion énergétique ................................................................. 48. b.. Altération des canaux, pompes et échangeurs ioniques ............................... 49. c.. Désorganisation du cytosquelette et phospholipolyse ................................. 50. d.. Lésions mitochondriales .............................................................................. 51. 2.. Les lésions de reperfusion .............................................................................. 53 a.. Lésions primaires ......................................................................................... 53. b.. La coagulation, l’activation endothéliale et l’inflammation ........................ 57. c.. Incidences primaires en clinique .................................................................. 61. 3.. I/R et réaction immunitaire ............................................................................. 62. 4.. Lésions associées à la dysfonction chronique du greffon............................... 63 a.. La transition épithélio-mésenchymateuse (TEM) ........................................ 63. b.. La fibrose ..................................................................................................... 66. c.. L’inflammation chronique ........................................................................... 70. 5.. Incidences cliniques à plus ou moins long terme ........................................... 71 a.. Le rejet aigu ................................................................................................. 71. b.. Le rejet chronique ........................................................................................ 71. Thérapies anticoagulantes envisagées afin de réduire les lésions d’I/R ............ 72 1.. Mécanismes et acteurs de la coagulation ........................................................ 73 a.. La coagulation .............................................................................................. 73. b.. Les récepteurs PAR...................................................................................... 80. 2.. Lien entre les acteurs de la coagulation, l’inflammation et la fibrose ............ 86 a.. Effets des facteurs IIa et Xa et de l’activation de PAR1 et PAR2 ............... 87. b.. Rôle du facteur tissulaire ............................................................................. 92. 3.. Effets des anticoagulants dans des modèles d’I/R .......................................... 96. 4.. Modulation de la coagulation au cours de la séquence d’I/R rénale .............. 96 8.
(10) a.. Anticoagulant naturel utilisé dans l’étude.................................................... 97. b.. Anticoagulants de synthèse utilisés dans l’étude ......................................... 99. OBJECTIFS............................................................................................................................................103 MATERIELS ET METHODES ........................................................................................................106 I.. Modèles cellulaires et méthodes relatives à l’analyse des échantillons ...107 Modèles cellulaires in vitro .......................................................................... 107. 1. a.. Isolement des cellules endothéliales microvasculaires de porc (EMIP) .... 107. b.. Amplification et culture des cellules HAEC .............................................. 108 Méthodes d’analyses relatives aux résultats in vitro de l’étude sur le fondaparinux (résultats 1)............................................................................. 109. 2. a.. Etude de l’effet du fondaparinux sur des cellules EMIP en présence de plasma ........................................................................................................ 109. b.. Dosage du monoxyde d’azote .................................................................... 110. c.. Extraction d’ARN à partir de cellules EMIP récupérées en TRIzol .......... 110. d.. Dosage de l’ARN ....................................................................................... 111. e.. Synthèse des ADNc : Reverse transcription (RT) ..................................... 111. f.. Méthode d’analyse d’expression des ARNm par RT-PCR quantitative en temps réel ................................................................................................... 112 Méthodes relatives aux résultats in vitro de l’étude sur EP (résultats 2) ...... 114. 3. a.. Séquences d’hypoxie réoxygénation des cellules HAEC en présence de la molécule EP ............................................................................................... 114. b.. Quantification du taux d’ATP .................................................................... 117. c.. Quantification du taux de LDH extracellulaire .......................................... 117. d.. Analyses en cytométrie de flux .................................................................. 118. e.. Dosage de la génération de thrombine ....................................................... 119. f.. Quantification des protéines cellulaires par western blot .......................... 121. g.. Extraction d’ARN à partir des cellules HAEC .......................................... 123. h.. Dosage d’ARN après extraction et réalisation d’un gel d’agarose 0.5% ... 124. i.. Synthèse des ADNc : Reverse transcription .............................................. 124. j.. Préparation de la plaque PCR et conditions de PCR ................................. 124 9.
(11) II.. Modèle in vivo d’autotransplantation chez le porc Large White et méthodes relatives à l’analyse des échantillons......................................................................126 1.. Modèle animal et modes opératoires de l’auto-transplantation .................... 126 a.. Modèle animal ........................................................................................... 126. b.. Protocole d’anesthésie ............................................................................... 127. c.. Modes opératoires d’auto-transplantation.................................................. 128. 2.. Prélèvements des échantillons biologiques et dosage de la créatinine ......... 129 a.. Prélèvements et préparation des échantillons ............................................ 129. b.. Dosage de la créatinine .............................................................................. 130. 3.. Analyses des extraits biologiques ................................................................. 131 a.. Analyses histologiques............................................................................... 131. b.. Analyses immunohistologiques ................................................................. 131. c.. Dosage des protéines plasmatiques ............................................................ 132. d.. Extraction et quantification des ARNm de cortex rénal ............................ 132. e.. Quantification des protéines tissulaires par Western blot .......................... 135. f.. Analyses Statistiques ................................................................................. 136. RESULTATS .........................................................................................................................................137 Rappel des objectifs expérimentaux ............................................................... 138 I.. Résultats 1 : Effet du fondaparinux dans un modèle d’auto-transplantation rénale chez le porc .........................................................................................................139 1.. Groupes de l’étude ........................................................................................ 139. 2.. Résultats obtenus (papier soumis) ................................................................ 141. II.. Résultats 2 : Effets d’EP217609 dans un modèle d’auto-transplantation rénale chez le porc .........................................................................................................168 1.. Groupes de l’étude ........................................................................................ 168. 2.. Résultats obtenus .......................................................................................... 172 a.. Effets de l’utilisation d’EP durant la période d’hypoxie des cellules HAEC, sur la mortalité et la viabilité cellulaire...................................................... 172. b.. Effets de la molécule EP sur la génération de thrombine dans notre modèle d’hypoxie/réoxygénation en plasma actif .................................................. 173 10.
(12) 3.. c.. Effets du traitement par EP sur l’expression et l’activation de certains récepteurs des protéases de la coagulation................................................. 175. d.. Effets du traitement par EP sur l’expression et l’activité des protéines kinases et la protéine TNFα ....................................................................... 178. e.. Effets du traitement par EP sur les transcrits impliqués dans l’activation endothéliale et l’inflammation ................................................................... 179. f.. Effets du traitement par EP, durant la conservation du greffon, sur la fonction rénale dans un modèle in vivo d’I/R. ........................................... 181. g.. Effets du traitement par EP, durant la conservation du greffon, sur l’expression des protéines plasmatiques dans un modèle in vivo d’I/R. .... 183. h.. Effets du traitement par EP sur les lésions chroniques du greffon, 3 mois après transplantation .................................................................................. 184 Résultats 2 : Bilan et discussion ................................................................... 191. Synthèse et perspectives des effets des inhibiteurs des protéases de la coagulation en transplantation préclinique .................................................202 Potentiel des inhibiteurs des protéases de la coagulation en transplantation clinique..............................................................................................................................206 I.. II.. Intérêts au cours du traitement des donneurs et du greffon ........................207 1.. Utilisation chez les DME et les DCE ........................................................... 207. 2.. Utilisation chez les DDAC ........................................................................... 208 Intérêt au cours du traitement du receveur ........................................................209. BIBLIOGRAPHIE ...............................................................................................................................211. 11.
(13) Abréviations 6-MP α-SMA AA ABM ACTH ACE ADH ADN ADNc Ang II ARN ASAT Asp AT ATP BMP7 BSA CD CINC-1 Cl CMH CML CRN CTGF Ctl DAB DAMPs DCE DCS DD DDAC DFG DME DMEM EGF EMIP eNOS EOR EP EPCR EPO ERK ET-1 FAD FGF FSC FSP-1. 6-mercaptopurine α actine du muscle lisse Acides aminés Agence de la biomédecine Hormone corticotrope Angiotensine I converting enzyme Hormone antidiurétique Acide désoxyribonucléique Acide désoxyribonucléique complémentaire Angiotensine II Acide ribonucléique Aspartate amino transférase Asparagine Antithrombine Adénosine triphosphate Bone morphogenetic protein 7 Bovin Serum Albumin Cellules dendritiques Cytokine-induced neutrophil chemoattractant 1 Chlore Complexe majeur d’histocompatibilité Cellules musculaires lisses Circulation régionale normothermique Connective tissue growth factor Contrôle Diaminobenzidine Damaged associated molecular patterns Donneurs à critères étendus Donneurs à critères standards Donneurs décédés Donneurs décédés après arrêt cardiaque Débit de filtration glomérulaire Donneurs en mort encéphalique Dulbecco’s Modified Eagle’s Medium Epidermal growth factor Cellules endothéliales microvasculaires de porc Endothelial nitric oxide synthase Espèces oxygénées réactives EP217609 Récepteur endothélial à la protéine C Erythropoïétine Extracellular-related kinase Endothéline Flavine Adénine Dinucléotide Fibroblast growth factor Forward Scatter Fibroblast specific protein 1 12.
(14) FT GAPDH GEF GRK H2 O2 HAEC HBPM HES HGF HIF His HLA HMGB1 HNF . HO HO-1 H/R HRP HSP HTA HUVEC IBiSA ICAM-1 IFNγ IGL-1 IL iNOS IV I/R K KHPM KIM-1 KLK KO LAP LLC LSGS LTBP MAPK MCP-1 MDB MEC MIP-2 MMP Na NAD NFP NGAL. Facteur tissulaire Glycéraldéhyde Phosphate Déshydrogénase Guanidine-nucleotide exchange factors G protein receptor kinase Péroxyde d’hydrogène Cellules endothéliales aortiques humaines Héparine de bas poids moléculaire Hydroxyéthyl starch (hydroxyéthylamidon) Hepatocyte growth factor Hypoxia inductible factor 1 Histidine Human Leukocyte Antigen High mobility group boxe 1 Héparine non fractionnée Radical hydroxyle Hème oxygénase 1 Hypoxie réoxygénation Horseradish peroxydase Heat Shock Protein Hypertension artérielle Human umbilical vein endothelial cells Infrasctructure Biologie Santé et Agronomie Interstitial cell adhesion molecule-1 Interferon gamma Institut Georges Lopez-1 Interleukine NO synthase inductible Intraveineuse Ischémie reperfusion Potassium Kininogène de haut poids moléculaire Kidney injury molecule-1 Kallikréine Knockout Latency-associated peptide Large latent complx Low serum growth supplement Latent TGFβ-binding protein Mitogen-activated protein kinase Monocyte chemoattracttant protein-1 Membran desalting buffer Matrice extracellulaire Macrophage inflammatory-protein 2 Métalloprotéases Sodium Nicotinamide Adénine Dinucléotide Non fonction primaire Neutrophil gelatinase-associated lipocalin 13.
(15) NK NKT NO O2 .O2 ORS PAI-1 PAMPs PAR PBMC PBS PCa PCR PDGF PECAM-1 PEG PGI2 PI3kinase PKCα PL PpO2 PPP PRR PS PTA PVDF RCPG RIPK ROCK RRF RT SAMPs Ser SLC SP SSC SVF T3 T4 TAFI TAT TBE TBS TCD TCP TEM TFPI TGF-β1. Natural killer Natural killer T cell Monoxyde d’azote Dioxygène Anion supéroxyde Organ recovery system Plasminogen activator inhibitor type-1 Pathogen-associated molecular patterns Protease-activated receptor Peripheral blood mononuclear cells Phosphate Buffered Saline Protéine C activée Réaction de polymérisation en chaîne Platelet derived growth factor Platelet endothelial cell adhesion molecule 1 Polyéthylèneglycole Prostacycline Phosphoinositide 3 kinase Protéine kinase C α Phospholipides Pression partielle en oxygène Plasma pauvre en plaquettes Pattern-recognition receptors Phosphatidylsérines Produit thérapeutique annexe Polyfluorure de vinylidène Récepteur couplé aux protéines G Receptor-interacting protein kinase Rho-associated, coiled-coil-forming protein kinase Retard de reprise de fonction Reverse transcription Stress-associated molecular patterns Sérine Small latent complexe Sérine protéase Side Scatter Sérum de veau fœtal Triiodothyronine Thyroxine Thrombin-activatable fibrimolysis inhibitor Complexe thrombine-antithrombine Tris borate EDTA Tris Buffer Saline Tube contourné distal Tube contourné proximal Transition épithélio-mésenchylateuse Tissue factor pathway inhibitor Transforming growth factor β1 14.
(16) TLR TM TMB TNFα t-PA TSH TSP-1 UFH u-PA UW VCAM VE-cadherin VEGF vWF. Toll like receptor Thrombomoduline 3,3′,5,5′-tetramethylbenzidine Tumor necrosis factor α Tissue plasminogen activator Thydroïde stimulating hormone Thrombospondine-1 Unfractionned heparin Urokinase-type plasminogen activator University of Wisconsin Vascular cell adhesion molecules Vascular endothelial- cadherin Vascular endothelial growth factor Facteur Von Willebrand. 15.
(17) Listes des figures et des tableaux. 16.
(18) Liste des figures Figure 1 : Localisation et structure des reins (figure modifiée issue de (14)) .............. 28 Figure 2 : Structure du Néphron (21) ........................................................................... 31 Figure 3 : Les différentes étapes de la transplantation rénale ...................................... 33 Figure 4 : Survie du greffon rénal selon l’âge du donneur entre 1993 et 2010 (10) .... 37 Figure 5 : Vue d'ensemble des lésions d'I/R : lésions d’ischémie chez le donneur et durant la conservation, lésions de reperfusion pendant la transplantation et effets sur le devenir des cellules (56) ............................................................................................... 46 Figure 6 : Effets cellulaires de l'hypoxie ...................................................................... 49 Figure 7 : Modèle schématique de la phosphorylation oxydative et de la production des EOR. Cytc, cytochrome c, CoQ, co enzyme Q10 (68) .......................................... 52 Figure 8 : Les différents mécanismes de la mort cellulaire induits suite à l'I/R (76) ... 55 Figure 9 : Schéma du mécanisme de recrutement des leucocytes, de l’activation endothéliale et de la génération de médiateurs inflammatoires et vasoactifs qui perpétuent les lésions du tissu après reperfusion (58) .................................................. 59 Figure 10 : Représentation des événements possibles intervenant dans la TEM (104) 64 Figure 11 : Modulation et signalisation de la voie du TGFβ (102) .............................. 69 Figure 12 : Structure des principales protéines de la coagulation (119) ...................... 75 Figure 13 : Activation de la prothrombine en thrombine (122) ................................... 76 Figure 14 : La cascade de coagulation (126) ................................................................ 78 Figure 15 : Schéma d'activation de la protéine C et de son activité (128) ................... 80 Figure 16 : Structure des PAR (133) ............................................................................ 81 Figure 17 : Mécanisme d'activation des PAR suite à la protéolyse (136) .................... 82 Figure 18 : Voies de signalisation intracellulaires activées par PAR1 (142) ............... 85 Figure 19 : Rôles possible des PAR reliant la coagulation et l'inflammation (142) .... 87 Figure 20 : Rôle proposé du FXa dans la fibrose (156) ............................................... 92 Figure 21 : Modèle moléculaire du complexe TF-FVIIa-FXa (161) ........................... 93 Figure 22 : Schéma de la formation d’un complexe cryptic du FT en complexe actif en présence de PS (PS en rouge dans la membrane) (163) ............................................... 94 Figure 23: Exemple d'HNF (171) ................................................................................. 97 Figure 24 : Action de l'HNF sur l'AT ........................................................................... 99 17.
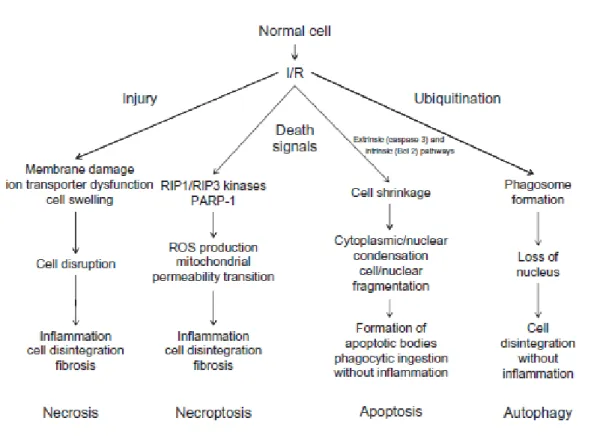
(19) Figure 25 : Structure pentasaccharidique du fondaparinux (175) ................................ 99 Figure 26 : Structure chimique d' EP217609 (173) .................................................... 101 Figure 27 : Inhibition du FXa et de la thrombine par différents anticoagulants dont EP217609 (178) .......................................................................................................... 102 Figure 28 : Courbe de décroissance de la PpO 2 obtenue dans le milieu UW sur un tapis de cellules d’HAEC, durant 24h. Mesures réalisées avec la sonde Oxyview de Presens. .................................................................................................................................... 115 Figure 29 : Réaction enzymatique réalisée afin de quantifier l’ATP intracellulaire .. 117 Figure 30 : Paramètres de la courbe de génération de thrombine (183) ..................... 120 Figure 31: Mode opératoire de l'auto-transplantation rénale des deux études (fondaparinux et EP)................................................................................................... 129 Figure 32 : Effets de la molécule EP à 16,3 mg/L sur la mortalité (LDH release : A-B) et la viabilité des HAEC (% ATP : C-D) (N= 3), en fin d’hypoxie ou en fin d’hypoxie/réoxygénation 2h. LDH: Kruskal-Wallis Multiple-Comparison Z-Value Test (Dunn's Test), * p<0.05 to control cells (ctl), ATP: test 2 à 2 Mann Withney. .. 172 Figure 33 : Mesure de la génération de thrombine suite à la séquence in vitro d'H/R et effet d'EP à la réoxygénation à 37°C (N=3). .............................................................. 174 Figure 34 : Effets de l'ajout d'EP durant l’hypoxie sur l’activation des récepteurs PAR et FT 15 min et 1h après réoxygenation en plasma actif (N=3) ................................. 176 Figure 35 : Effets d’EP durant l’hypoxie sur la modulation des voies de signalisation intracellulaires après réoxygénation ........................................................................... 178 Figure 36: Expression relative des ARNm, exprimés par les cellules HAEC, après H/R à différents temps (2h et 4h) de réoxygénation à 37°C, par rapport aux cellules contrôles saines (ctl) (N=3) ........................................................................................ 180 Figure 37 : Délais de reprise des diurèses des animaux transplantés ......................... 181 Figure 38 : Effet d'EP sur la fonction rénale post transplantation, comparaison avec UW seul, UW + UFH 5000 UI/L et le groupe contrôle NEP ..................................... 182 Figure 39 : Dosage du complexe thrombine/antithrombine (TAT) (A) et de l’IL-6 (B) dans le plasma et des ARNm de PAR1 et du TNFα exprimés par les leucocytes (C) après 60 minutes de reperfusion (N=5-6) ................................................................... 184 Figure 40 : Quantification des lésions de fibrose et des cellules mésenchymateuses, dans le tissu rénal 3 mois après transplantation.......................................................... 185 Figure 41 : Quantification des ARNm et protéines des marqueurs impliqués dans les voies de fibrose et de TEM au sein des greffons rénaux 3 mois après transplantation .................................................................................................................................... 186 18.
(20) Figure 42 : Expression des marqueurs impliqués dans les voies de l'inflammation dans le cortex rénal 3 mois après transplantation. .............................................................. 188 Figure 43 : Analyse histologique de l’infiltration leucocytaire au sein du greffon à 14 et 90 jours après transplantation. ................................................................................ 190. 19.
(21) Liste des tableaux Tableau 1 : Evolution de la liste d’attente et devenir des candidats en greffe rénale (10) ...................................................................................................................................... 27 Tableau 2 : Evolution entre 2006 et 2012 du prélèvement et de la greffe à partir de donneurs décédés après arrêt cardiaque (9) .................................................................. 38 Tableau 3 : Classification de Maastricht (modifié de (26)) .......................................... 39 Tableau 4 : Caractéristiques des solutions de conservation courantes (44) ................. 44 Tableau 5 : Facteurs "donneurs" influençant le rejet d'allogreffe à court et à long terme ...................................................................................................................................... 47 Tableau 6 : Liste des protéases activatrices et inactivatrices de l'activité des PAR (132) ...................................................................................................................................... 84 Tableau 7: Effets cellulaires du FXa par son action sur les PAR (152) ....................... 90 Tableau 8 : Effets in vivo et in vitro de la sousexpression du FT et de l’utilisation d’anticoagulants (165) .................................................................................................. 95 Tableau 9: Amorces sens et anti-sens dirigés contre les ADNc porcins pour la RTq PCR............................................................................................................................. 113 Tableau 10: cinétiques d'hypoxie réoxygénation des cellules .................................... 116 Tableau 11: liste des anticorps utilisés pour la quantification d'expression des protéines par western blot .......................................................................................................... 123 Tableau 12 : Amorces sens et anti-sens dirigés contre les ADNc humains utilisés pour la RTq PCR................................................................................................................. 125 Tableau 13 : Liste des anticorps utilisés en immunohistochimie ............................... 132 Tableau 14: Séquences des amorces sens et anti sens utilisées pour l'étude fondaparinux (Resultats 1) ......................................................................................... 134 Tableau 15: Séquences des amorces sens et anti sens utilisées pour l'étude EP (Résultats 2) ................................................................................................................ 134 Tableau 16: liste des anticorps utilisés pour la quantification d'expression des protéines par western blot .......................................................................................................... 136 Tableau 17 : cinétiques d'hypoxie réoxygénation des HAEC .................................... 169. 20.
(22) Avant propos. Ce travail de thèse a été effectué dans le but de répondre à la problématique actuelle en transplantation que représente la pénurie des greffons. Afin d’augmenter le nombre de greffons disponibles, le champ des donneurs a été élargi. L’accès aux organes provenant des donneurs décédés après arrêt cardiaque (DDAC) a permis d’augmenter le nombre d’organes susceptibles d’être transplantés. Cependant les reins provenant de ce type de donneurs sont plus lésés, notamment à cause de la séquence d’ischémie chaude qu’ils subissent durant l’arrêt cardiaque qui précède la conservation ex vivo. La transplantation rénale est un modèle clinique d’ischémie reperfusion (I/R). L’activation de la coagulation est une des conséquences majeure de l’I/R. Elle entraîne une stase à l’origine de la non vascularisation de certaines régions du rein à la reperfusion. Ces phénomènes de coagulation participent à la perte de fonctionnalité du rein. Cela entraîne l’apparition des retards de reprise de fonction ou des nonreprises de fonction de l’organe transplanté. Ce travail de thèse a consisté à étudier l’effet de deux molécules inhibitrices des protéases de la coagulation dans l’objectif de réduire les lésions tissulaires induites au cours de l’I/R. Ces molécules, le fondaparinux et EP217609 sont deux anticoagulants de synthèse, ayant respectivement un effet anti Xa indirect et un effet anti IIa direct et anti Xa indirect.. Ce mémoire aborde dans une première partie des généralités sur la transplantation, les lésions d’I/R et les conséquences cliniques associées, puis les mécanismes de la coagulation et leurs liens avec les phénomènes inflammatoires et l’I/R. Dans une seconde partie, la méthodologie et les techniques d’analyse des études in vitro et in vivo ont été expliquées. Dans une troisième partie, les résultats obtenus ont été présentés et discutés et enfin dans une dernière partie, une discussion plus générale a été abordée concernant le potentiel des inhibiteurs des protéases de la coagulation en clinique.. 21.
(23) GENERALITES. 22.
(24) I. La transplantation La transplantation est le transfert d'un organe entier d'un donneur à un receveur, impliquant le rétablissement de la continuité vasculaire afférente et efférente de cet organe avec le réseau vasculaire du receveur. Cette définition distingue la transplantation de la greffe, qui consiste en un transfert de tissu ou de cellules ou d’une partie d'organe. Cependant dans un sens plus élargi le terme "greffe" est aujourd'hui employé pour parler de transplantation (1). L’autogreffe consiste en la réimplantation d’un organe chez le même individu donneur, l’allogreffe est la transplantation d’un organe provenant d’un individu donneur sur un individu receveur de la même espèce avec un génome différent, l’isogreffe est l’implantation d’organe entre des jumeaux monozygotes. Enfin, la xénogreffe est l’implantation d’un organe provenant d’une espèce différente de celle du receveur.. 1. Histoire de la transplantation Les balbutiements de la transplantation d’organes datent du début du XX ème siècle, après la découverte des groupes sanguins ABO en 1900 par Karl Landsteiner. Entre 1902 et 1908, Alexis Carrel développa la technique de suture des vaisseaux sanguins (2) et l’appliqua aux transplantations de rein, de cœur, d’intestins et de membres chez l’animal. En 1906, Le docteur Jaboulay, médecin lyonnais publia dans le « Lyon Medical » la greffe d’un rein de porc et d’un rein de chèvre respectivement aux plis du coude de deux femmes en insuffisance rénale (2). Ces essais se révéleront être des échecs et les organes furent retirés dans les quelques jours après la greffe. Le médecin écrivit « Ainsi la circulation artificielle avait été réalisée dans le rein greffé, mais elle avait été de peu de durée ; une rapide thrombose l’avait interrompue ; elle fut cependant suffisante pour faire fonctionner le rein… » (2). Dèjà, le Dr Jaboulay soulignait l’importance de l’apparition des thromboses comme responsables de la non fonction du greffon. A cette date, la notion de rejet immunologique n’était pas encore connue, il aura fallu attendre 1933 pour qu’elle soit mise en évidence par le russe Serguey Voronoy qui réalisa les premières allogreffes humaines. En 1950, à Chicago, Richard Lawler publia avec ses collaborateurs un article intitulé « homotransplantation of the kidney in the human». Ces derniers remplacèrent le rein polykistique gauche non fonctionnel chez une 23.
(25) femme de 44 ans par un rein prélevé chez une malade décédée ; 52 jours plus tard, le rein semblait toujours fonctionnel. En revanche, un an plus tard l’organe était totalement atrophié (3). C’est en 1952 que la France va se distinguer avec la première tentative de greffe à partir de donneur vivant. L’opération, réalisée à l’hôpital Necker par l’équipe du Professeur Jean Hamburger, est un succès, mais 21 jours après sa greffe, le jeune homme décèdera. Jean Hamburger fut un pionnier de la médecine scientifique et selon lui, les trois éléments les plus importants à résoudre en transplantation étaient : 1) « éviter les modifications vasculaires du rein transplanté », il mit l’accent sur la vascularisation et la vasculopathie du transplant, 2) « N’y aurait-il pas des groupes tissulaires, similaires aux groupes sanguins, permettant une compatibilité ? » et enfin 3) « Serait-il possible d’empêcher la perte des greffons incompatibles via les propriétés pharmacodynamiques de quelques molécules? ». Il écrivit cela, sept ans avant que Jean Dausset ne découvre le système HLA (human leukocyte antigen) et plus de 15 ans avant que le premier immunosupresseur, le 6-MP (6-mercaptopurine) ne soit expérimenté par Roy Calne (4). En 1954 à Boston, Merill et Murray réussirent la première greffe rénale entre deux jumeaux génétiquement identiques, la démonstration de l’obligatoire compatibilité était faite (5). En 1958, Jean Dausset et Jean Bernard mirent en évidence le rôle et les groupes HLA (6) . La compréhension de la nécessité de compatibilité entre les donneurs et les receveurs (système d’histocompatibilité ABO et HLA), pour la réussite de la greffe, permit d’entraîner la réussite de nombreuses transplantation ultérieures. Entre 1954 et 1958, sept transplantations entre jumeaux identiques furent réalisées avec succès, dans le monde entier. Ces résultats démontrèrent que les greffes à partir de donneurs vivants étaient possibles, l’obstacle à surmonter étant la maîtrise du rejet. En 1959, l'école neurologique parisienne et en particulier le Docteur Mollaret décrivit l'état de mort cérébrale ouvrant ainsi le champ immense du prélèvement à cœur battant (7). L'idée du don d'organe apparaissait. Dans la suite des années 60, la technique d’épuration extrarénale se développa, permettant plus de souplesse par rapport à la transplantation dans la gestion de l’urémie. De plus, le transport des organes à basse température commença à cette période et la notion de rejet chronique apparut. L'immunosuppression débutait, elle était induite par irradiation totale ou par traitement aux 6MP, corticoïdes, azathioprine, méthotrexate... L’irradiation ne constituait pas une solution 24.
(26) d’immunosupression fiable. L’azathioprine, dérivé du 6-MP, fut démontré comme étant moins toxique et plus efficace que le 6-MP. En 1960, la transplantation s’installa comme médecine « fiable ». En 1962, les équipe de Dausset et Van Rood en Hollande décrivirent et développèrent des techniques d’identification des antigènes majeurs du système HLA (3). Malgré. l’efficacité. limitée. et. les. lourds. effets. secondaires. des. traitements. immunosuppresseurs de l’époque, les greffes rénales entre personnes non apparentées se multiplièrent dans les années 60. En 1967, le Pr Christian Barnard tenta la première greffe du coeur au Cap, en Afrique du Sud. En 1968, le Pr. Christian Cabrol réalisa la première greffe cardiaque européenne, à Paris. Un an après la première greffe de cœur, 102 tentatives furent réalisées dans le monde (8). En. 1976,. Jean-François. Borel,. biologiste. suisse. découvre. les. propriétés. immunosuppressives de la cyclosporine qui améliorera sensiblement la survie des greffes rénales comparé au régime précédent (bithérapie azathioprine et corticostéroïdes) (3). Avec cette nouvelle génération de médicaments anti-rejets la survie des patients est considérablement améliorée, le nombre de prélèvements et de greffes explosa : il passa en France d’environ 650 en 1982 à plus de 2400 cinq ans plus tard, tous organes confondus (9). Il aura fallu un siècle d’expérimentations et de recherches pour que la technique de la transplantation d’organe soit maîtrisée. Cette technique est aujourd’hui fréquemment utilisée et est considérée comme une thérapie de choix (en France, en 2012, 3044 greffes de rein ont été réalisées, 1161 greffes de foie, 397 greffes de cœur). On a recensé une augmentation de 42% de greffes en 21 ans. Pour exemple, la greffe de rein se développe avec 45% des insuffisants rénaux qui sont greffés et 55% qui sont en dialyse. Cependant, il existe toujours un déséquilibre entre le nombre de personnes en attente de greffes et le nombre de greffons disponibles (9).. 25.
(27) 2. La transplantation rénale en France a. La transplantation rénale : le traitement de choix de l’insuffisance rénale terminale La transplantation rénale est le traitement de choix pour un patient atteint d’une insuffisance rénale terminale. Les maladies qui conduisent les patients vers une transplantation rénale n’ont pas changé au cours de ces dernières années. Elles sont les suivantes: les glomérulonéphrites (1/4 des patients), la polykystose rénale, les néphropathies interstitielles, les néphroangio-scléroses et les néphropathies diabétiques entre autres. Seize pourcent sont de nature inconnue ou indéterminée (10). La transplantation rénale a un intérêt unanimement reconnu dans l’amélioration de la qualité et de la durée de vie des patients transplantés (11). De plus, elle représente un coût moindre (86000 euros l’année de la greffe, puis 20000 euros/an les années suivantes), comparée à l’hémodialyse (89000 euros/an) ou à la dialyse péritonéale (64000 euros/an) (12).. b. La transplantation rénale en chiffres Au premier janvier 2012, on comptait 9064 patients en liste d’attente, dont 4265 patients nouveaux inscrits dans l’année, soit une augmentation de + 6,5% par rapport à 2011 (Tableau 1). En 2012, le nombre de greffes réalisées est de 3044 et augmente de 2,3% par rapport à 2011, confirmant la progression régulière observée depuis 2009, qui reste néanmoins faible au regard de celle du nombre total de candidats en liste d’attente. La greffe de rein est quantitativement la plus importante. Elle progresse du fait du nombre de greffes réalisées à partir de donneurs vivants (+ 18% par rapport à 2011, 357 greffes), mais elle reste encore insuffisante, compte tenu du nombre de patients en attente de greffe (9). Entre 1996 et 1999, la médiane du temps d’attente pour une greffe rénale était de 14,5 mois, elle est passée à 23,2 mois pour la période 2008-2012. En 2012, il y avait 4,4 candidats pour un greffon utilisable dans l’année, ce qui est très insuffisant d’où l’importance d’élargir le champ des donneurs et de préserver au mieux les organes les plus fragiles pour qu’ils soient fonctionnels chez le receveur. En effet, la meilleure préservation des organes passe par une diminution du temps de conservation extra-corporelle 26.
(28) des greffons, cette durée d’ischémie froide étant significativement corrélée à la durée de survie des greffons (13). En 2012, le temps moyen d’ischémie, en excluant les malades greffés à partir d’un greffon de donneur vivant ou de donneur décédé après arrêt cardiaque (DDAC) était stable par rapport à 2011 avec 17,4 ± 0,3 heures (9). Les progrès actuels ont pour but d’améliorer, à durée d’ischémie froide identique, la qualité des greffons en les perfusant sous machine (reins et poumons) et en améliorant la qualité des liquides de conservation et de perfusion (9). En 2012, 2964 greffons rénaux ont été prélevés dont 90,6% ont été greffés (10). Malades restant en attente au 1er janvier de chaque année Malades en attente au 1er janvier et en CIT Part des malades en CIT parmi les malades en attente au 1er janvier Nouveaux inscrits dans l'année Décédés en attente dans l'année Sortis de liste d'attente. pmh : par million d'habitants. indication temporaire. 2007. 2008. 2009. 2010. 2011. 2012. 2013. 6162. 6490. 6881. 7594. 8459. 9064. 9835. 1084. 1500. 1838. 2266. 2677. 3145. 3787. 18%. 23%. 27%. 30%. 32%. 35%. 38%. 3551 153 158. 3731 220 183. 3901 212 150. 4158 224 177. 4006 223 202. 4265 211 239. CIT : contre. Tableau 1 : Evolution de la liste d’attente et devenir des candidats en greffe rénale (10). II. Le rein Les reins sont des organes ayant un rôle majeur dans le contrôle de l’homéostasie. Ils ont permettent de filtrer le plasma sanguin. 1. Structure et fonction du rein a. La structure du rein Les reins sont des organes pairs mesurant environ 12 cm de long et pesant 150 grammes chacun. Chaque rein est enveloppé par une membrane fibreuse appelée la capsule. Le hile est la zone où arrivent et partent les vaisseaux sanguins, les lymphatiques, les nerfs et l’uretère. Le tissu rénal fonctionnel ou parenchyme est constitué de deux zones, le cortex en périphérie et la médullaire au centre (Figure 1). La médullaire regroupe les pyramides de 27.
(29) Malpighi et les colonnes de Bertin, l’apex des pyramides formant les papilles rénales. Ces dernières se poursuivent par les petits calices qui vont drainer l’urine jusqu’aux grands calices.. Figure 1 : Localisation et structure des reins (figure modifiée issue de (14)). b. Les fonctions du rein Les reins en filtrant le plasma, permettent l’excrétion des toxines provenant du foie, des déchets métaboliques (urée, acide urique, créatinine…) et des ions en excès. Le débit sanguin rénal est en moyenne de 1200 ml/minute (15). Les reins participent au maintien de la composition en eau et en électrolytes des liquides de l’organisme et ils régulent le pH, en association avec les poumons et les systèmes tampons. Ils ont aussi un rôle endocrine, ils sécrètent notamment de l’EPO (érythropoïétine) qui augmente la production d’hématies par la moelle osseuse. Ils permettent aussi l’activation de la vitamine D et produisent de la rénine. Cette hormone intervient dans le système rénine-angiotensine. La rénine est produite par les cellules spécialisées de l’artériole afférente glomérulaire et sécrétée dans la lumière de l’artériole. La production de rénine est stimulée par une baisse de la perfusion rénale, par la présence de catécholamines (nerfs sympathiques connectés à l’artériole afférente) et par une baisse du débit chloré. La rénine convertit l’angiotensinogène en angiotensine I qui va devenir angiotensine II (Ang II) par l’intermédiaire de l’enzyme ACE (angiotensin I converting 28.
(30) enzyme). L’Ang II est responsable, entre autre de la réabsorption d’eau, de Na+ et de Cl- et d’une élévation de la pression artérielle et permet le maintien d’une volémie efficace. La filtration du plasma aboutit à la formation d’urine qui va être libérée dans les calices du rein et sera évacuée vers l’uretère qui s’abouche dans la vessie.. 2. Néphron et filtration glomérulaire a. La structure du néphron L’unité fonctionnelle du rein permettant la formation d’urine est le néphron. Le rein en compte plus d’1 million. Le néphron est composé par un corpuscule rénal qui regroupe le glomérule et la capsule de Bowman, par un tube contourné proximale (TCP), qui s’abouche dans l’anse de Henlé (partie descendante et partie ascendante), puis se termine par un tube contourné distale (TCD) qui est relié à un tube collecteur (Figure 2). Le glomérule est formé par un peloton capillaire, avec des artérioles afférentes et efférentes par lesquelles le sang entre et sort du néphron (16). Le sang est filtré par le filtre glomérulaire qui est constitué de plusieurs couches : côté urine, l’épithelium viscéral de la capsule de Bowman est formé de cellules (les podocytes) disposées en une succession de digitations séparées par des interstices en forme de fentes recouvertes par une membrane dotée de pores de 5 nm de diamètre ; côté sang, la membrane basale et l’endothélium capillaire (chargé négativement) constituent les deux autres couches de la membrane filtrante (17). Seules les protéines dont la taille est inférieure à 68000 Da et dont le diamètre moléculaire est inférieur à 4 nm peuvent passer le filtre avec le plasma et les électrolytes. La plupart des protéines du plasma ont un point isoélectrique inférieur au pH du plasma ce qui leur confère de se comporter, in vivo, comme des anions. Ces protéines là vont alors être repoussées par l’électronégativité de la membrane basale. Les capillaires glomérulaires sont « enroulés » autour du mésangium (cellules mésangiales et matrice mésangiale). Les cellules mésangiales sécrétent un tissu de soutien et peuvent communiquer directement avec les cellules endothéliales par l’intermédiaire de plusieurs médiateurs : cytokines, facteurs de croissance ou encore médiateurs lipidiques. Le complexe mésangium-capillaires glomérulaires forme un peloton sur lequel repose la 29.
(31) membrane basale glomérulaire. Le feuillet viscéral (podocytes) de la membrane basale se réfléchit au pôle vasculaire et se prolonge par le feuillet pariétal. Ces deux feuillets délimitent l’espace urinaire de Bowman. Les cellules mésangiales ont des propriétés contractiles et participent à la réduction du diamètre des capillaires glomérulaires et la surface de filtration (18). Les cellules de la macula densa font parties d’une portion des TCD qui vient s’accoler au glomérule, ces cellules vont engendrer un signal en direction des cellules de l’artériole afférente qui sont capables de produire la rénine. Les glomérules et les tubes contournés se situent dans le cortex rénal tandis que les anses de Henlé et les tubes collecteurs s’étendent en profondeur dans la medulla pour les néphrons juxta-médullaires (19). L’apport sanguin aux reins se fait par les artères rénales. Les capillaires glomérulaires naissent d’une artériole afférente mais se drainent dans une artériole efférente et non dans une veinule. Le sang provenant de l’artériole efférente pénètre dans les lits capillaires péritubullaires et les vasa recta. Ces derniers vaisseaux descendent dans la medulla pour vasculariser les anses de Henlé et les canaux collecteurs. Finalement, tous ces vaisseaux se drainent vers le cortex et le sang quitte le rein par les veines rénales (16). La pression en oxygène dans la médullaire est relativement basse, environ 10 mmHg. Au sein du cortex, celle-ci est plus variable, avec une moyenne de la pression partielle en O 2 (ppO 2 ) d’environ 30 mmHg, elle peut diminuer considérablement en fonction de la perfusion rénale (20).. 30.
(32) Figure 2 : Structure du Néphron (21). 31.
(33) b. La filtration glomérulaire La première étape dans la formation de l’urine est la fabrication d’un ultrafiltrat du plasma par le glomérule. Le liquide qui pénètre dans l’espace de Bowman (l’ultrafiltrat) a la même composition que le plasma, à l’exception des protéines. Ce liquide va être modifié par réabsorption et sécrétion durant son passage à travers le néphron. Le débit de filtration glomérulaire (DFG) est égal à la somme du taux de filtration de tous les néphrons fonctionnels, il permet d’estimer la masse rénale fonctionnelle. Le DFG est de 120 ml/min. L’insuffisance rénale est définie par une réduction du nombre de néphrons fonctionnels, proportionnelle à la réduction du débit de filtration glomérulaire. Le dosage de la créatinine plasmatique est le principal paramètre biologique utilisé pour estimer le DFG. La créatinine est un déchet endogène, non toxique, provenant du catabolisme de la créatinine musculaire. Sa production quotidienne est constante du fait du renouvellement de la masse musculaire. Son élimination est exclusivement urinaire, principalement par filtration glomérulaire, mais aussi par sécrétion tubulaire. Une réduction importante du DFG se traduit par une élévation de la créatininémie (19).. III. Les étapes de la transplantation rénale. La transplantation est le transfert d'un organe ou tissu d'un donneur à un receveur, impliquant le prélèvement, la conservation extracoporelle et l’implantation. La durée et les caractéristiques de ces étapes varient selon le type de donneur (Figure 3).. 32.
(34) PRELEVEMENT. CONSERVATION. Ischémie froide. GREFFE. Reperfusion. Figure 3 : Les différentes étapes de la transplantation rénale en fonction du type de donneur. 1. Les donneurs d’organes en France La loi qui régit le don d’organe est issue de la loi bioéthique du 29 juillet 1994 et du 6 août 2004. Les principes fixés par la loi, parallèles à l'inviolabilité et à la non patrimonialité du corps humain, concernent le consentement du donneur, la gratuité et l'anonymat du don à partir du corps humain. On peut ajouter aux principes généraux l'interdiction de la publicité, la sécurité sanitaire et la biovigilance. Si un patient n’a pas fait état, de son vivant, de son opposition au prélèvement d’organe, il est en théorie possible d’effectuer celui-ci. Cependant, la famille est consultée en priorité afin de connaître les intentions du défunt à ce sujet. L’ABM a pour mission de définir les règles de répartition nationale des dons d’organes en gérant notamment la liste nationale d’attente. Il existe plusieurs types de donneurs d’organe : les donneurs vivants apparentés ou non, les donneurs décédés (DD), comprenant les donneurs en état de mort encéphalique (DME) et les donneurs décédés après arrêt cardiaque (DDAC). Les donneurs qui représentent 33.
(35) la part la plus importante sont les DME (92,5% des greffes réalisées en France). La pénurie actuelle des donneurs d’organe et notamment des reins a conduit les équipe de greffe à élargir le pool des donneurs vers les donneurs à critères étendus (DCE).. a. Les donneurs vivants Le nombre de greffes provenant de donneurs vivants est très différent en fonction des pays, de la culture, des convictions religieuses, des choix politiques et de la pénurie d’organe. Au Japon environ 90% des transplantations rénales proviennent de donneurs vivants et 36,4% aux Etats-Unis. Les pays industrialisés présentant le nombre de donneurs vivants le plus bas (environ 10%) sont : la France, l’Espagne et la Belgique (3). L’ABM a placé le développement de la greffe à partir de donneurs vivants parmi ses quatre projets stratégiques pour les années 2011-2013. Le don d’organe de son vivant concerne essentiellement la greffe de rein et de manière moindre, la greffe d’un lobe de foie. Le temps de conservation des organes prélevés chez un donneur vivant est court, de l’ordre de 2 à 4 heures. Aujourd’hui le devenir d’un greffon rénal issu d’un donneur vivant est significativement meilleure à court et à long termes par rapport à une greffe issue de donneur décédé. Une étude réalisée entre 1988 et 1996 aux Etats-Unis, a mis en évidence que le taux de survie des greffons rénaux à un an provenant de donneurs vivants était de 93.9% tandis qu’il était de 87.7% chez les personnes ayant reçu un greffon provenant de DD. La demi-vie était de 21,6 ans pour les greffons transplantés à partir de donneurs vivants (en 1995) et de 13,8 ans pour ceux provenants de DD. Cette étude comptait un total de 93934 transplantations rénales (22).. 34.
Figure



Documents relatifs
— arrange(xmin,xmax,pas) ( array range ) : cr´ ee un array dont le premier ´ el´ ement est xmin et dont chaque ´ el´ ement est distant de pas, le dernier ´ etant strictement
Courant primaire (A) Primary rated
La comparaison de l'activité biologique de certaines molécules et de leurs structures a permis d'établir dans de nombreux cas des corrélations entre les paramètres structuraux et les
La comparaison de l'activité biologique de certaines molécules et de leurs structures a permis d'établir dans de nombreux cas des corrélations entre les paramètres structuraux et les
Le premier chapitre, intitulé généralités sur les céphalosporines antibiotiques, et les oxazoles antibiotiques au début, on a représenté un bref aperçu sur
Dès lors que le patient présente un débit de filtration glomérulaire inférieur à 15 ml / min, il peut être inscrit sur la liste d'attente de transplantation rénale Une consultation
Appel : appeler l'enseignant pour lui rendre votre copie et votre calculatrice en mode graphique avec les points, la droite et le point moyen..5. Représenter cette série statistique
Si l’on colorie en bleu ou en rouge les quinze segments qui relient les six points deux à deux, il y a nécessairement au moins un triangle dont tous les trois côtés sont de la