Universite de Sherbrooke
Decouverte de nouveaux complexes proteiques impliques dans la synthese et le transport intracellulaire des recepteurs couples aux proteines G
par Audrey Parent Departement de Medecine
Service de rhumatologie
These presentee a la Faculte de medecine et des sciences de la sante en vue de l'obtention du grade Philosophiae Doctor (Ph.D) en Biochimie
Mai 2010
Evaluateurs :
Dr. Xavier Roucou, Departement de biochimie Dr. Jean-Luc Parent, Departement de medecine
Dr. Philippe Sarret, Departement de physiologie et biophysique
1*1
Library and Archives Canada Published Heritage Branch 395 Wellington Street Ottawa ON K1A 0N4 Canada Bibliotheque et Archives Canada Direction du Patrimoine de I'edition 395, rue Wellington Ottawa ON K1A 0N4 CanadaYour file Votre reference ISBN: 978-0-494-70605-3 Our file Notre r6f6rence ISBN: 978-0-494-70605-3
NOTICE:
The author has granted a
non-exclusive license allowing Library and Archives Canada to reproduce, publish, archive, preserve, conserve, communicate to the public by
telecommunication or on the Internet, loan, distribute and sell theses
worldwide, for commercial or non-commercial purposes, in microform, paper, electronic and/or any other formats.
AVIS:
L'auteur a accorde une licence non exclusive permettant a la Bibliotheque et Archives Canada de reproduce, publier, archiver, sauvegarder, conserver, transmettre au public par telecommunication ou par I'lnternet, prefer, distribuer et vendre des theses partout dans le monde, a des fins commerciales ou autres, sur support microforme, papier, electronique et/ou autres formats.
The author retains copyright ownership and moral rights in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission.
L'auteur conserve la propriete du droit d'auteur et des droits moraux qui protege cette these. Ni la these ni des extraits substantiels de celle-ci ne doivent etre imprimes ou autrement
reproduits sans son autorisation.
In compliance with the Canadian Privacy Act some supporting forms may have been removed from this thesis.
Conformement a la loi canadienne sur la protection de la vie privee, quelques
formulaires secondaires ont ete enleves de cette these.
While these forms may be included in the document page count, their removal does not represent any loss of content from the thesis.
Bien que ces formulaires aient inclus dans la pagination, il n'y aura aucun contenu manquant.
1+1
II
TABLE DES MATIERES
TABLE DES MATIERES II
LISTE DES ILLUSTRATIONS VI
LISTE DES ABREVIATIONS X
RESUME
INTRODUCTION 1
1. Les recepteurs couples aux proteines G (RCPGs) 1
2. Synthese et maturation des RCPGs 3
2.1 Repliement des RCPGs dans le RE 3
2.2 Export des recepteurs nouvellement synthetises 6 2.2.1 Motifs essentiels a l'export des RCPGs hors du RE 7
2.2.2 Motifs de retention dans le RE 8
2.3 Voie de degradation associee au reticulum endoplasmique (ERAD) 9
3. Signalisation par les RCPGs 14
3.1 Les proteines G heterotrimeriques 14
3.2 Les effecteurs des proteines G heterotrimeriques 16 3.3 Signalisation independante des proteines G heterotrimeriques 17
4. Mecanismes d'inactivation des RCPGs 18
4.1 Decouplage fonctionnel par phosphorylation 18
4.2 Endocytose des RCPGs 20
4.2.1 Ciblage aux endosomes : implication des Rabs GTPases 22 5. Nouvelles proteines regulatrices de l'activite des RCPGs 27 5.1 Proteines facilitant la synthese et la maturation des RCPGs 27
Ill 5.2 Proteines modulant la signalisation des RCPGs 28 5.3 Proteines influen9ant le trafic intracellulaire suite a une stimulation 29
6. Les recepteurs modeles 32
6.1 Les recepteurs de la prostaglandine D2 32
6.2 Les recepteurs du thromboxane A2 36
6.3 Le recepteur p2-adrenergique 38
7. La proteine a repetitions ankyrine ANKRD13C 40
8. La proteine adaptatrice RACK1 42
8.1 RACK1 comme recepteur de laPKC activee 43
8.2 Nouvelles fonctions de RACK1 44
OBJECTIFS DE L'ETUDE 45
RESULTATS 46
MANUSCRIT #1 : ANKRD13C displays chaperone-like properties towards G
protein-coupled receptors 46 Resume 47 Summary 48 Introduction 49 Results 51 Discussion 74
Materials and methods 79
Acknowledgments 84
IV MANUSCRIT #2 : RACK1 Regulates the Cell Surface Expression of the G
Protein-Coupled Receptor for Thromboxane A2 91
Resume 92
Abstract 93
Introduction 94
Results 96
Discussion 121
Materials and methods 126
Acknowledgments 133
Abbreviations 134
References 134
MANUSCRIT #3 : Rabl 1 regulates the recycling of the p2-adrenergic receptor
through a direct interaction 141
Resume du manuscrit #3 142 Abstract 143 Introduction 144 Experimental 146 Results 152 Discussion 168 Acknowledgments 173 References 174
V
DISCUSSION 181
1. ANKRD13C : une nouvelle chaperonne pour les RCPGs 181 1.1 Le role d'ANKRD13C dans l'inhibition de la degradation des recepteurs
nouvellement synthetises 183
1.2 Le role d'ANKRD13C dans la retention des recepteurs immatures dans le RE 186 1.3 Le role potentiel d'ANKRD13C dans la degradation par le proteasome des
recepteurs retenus dans le RE 190
1.4 ANKRD13C est-elle une chaperonne ou une co-chaperonne? 192 1.5 Homologie d'ANKRD13C avec d'autres proteines a repetitions ankyrine 194 2. Une nouvelle fonction pour RACK1 dans l'export des RCPGs 196
2.1 Implication de la PKC 196
2.2 RACK1 comme proteine d'echafaudage 198
3. L'interaction entre le P2-AR et Rabl 1 regule plusieurs fonctions du recepteur 199 3.1 Implication dans le trafic intracellulaire du P2-AR suite a une stimulation200 3.2 Implication dans le trafic intracellulaire du P2-AR en absence de stimulation
203
CONCLUSION 205
REMERCIEMENTS 206
VI
LISTE DES ILLUSTRATIONS
INTRODUCTION
Figure 1. Structure tridimensionnelle de la rhodopsine et du recepteur
p2-adrenergique 2
Figure 2. Facteurs favorisant le repliement des proteines dans le RE 3 Figure 3. Mecanisme d'action des chaperonnes lectines 5
Figure 4. Motifs de retention dans le RE 8
Figure 5. Ciblage vers la degradation des proteines N-glycosylees 10 Tableau 1. Composantes de la voie de degradation ERAD 11
Figure 6. La voie de degradation ERAD 13
Figure 7. Cycle d'activation des proteines G heterotrimeriques 15 Figure 8. Effecteurs classiques des proteines G heterotrimeriques 17
Figure 9. Mecanismes d'inactivation des RCPGs 19
Figure 10. Cycle d'activation des Rabs 23
Figure 11. Fonctions des Rabs GTPases dans le trafic vesiculate 25 Figure 12. Les Rabs dans le trafic intracellulaire des RCPGs .26 Tableau 2. Nouvelles proteines regulatrices du trafic intracellulaire des RCPGs..32
Figure 13. Biosynthese des prostanoides 32
VII Figure 15. Representation schematique du recepteur CRTH2 35 Figure 16. Representation schematique de TPa etTPP 37 Figure 17. Representation schematique du recepteur p2-adrenergique 39 Figure 18. Sequence consensus et structure d'une repetition ankyrine 40
Figure 19. Structure predite de RACK 1 43
RESULTATS MANUSCRIT #1
Figure 1. Homology of ANKRD13C proteins from different species 53 Figure 2. ANKRD13C is associated with ER membranes 54 Figure 3. ANKRD13C interacts with the DP receptor 56 Figure 4. ANKRD13C regulates the biogenesis of DP 58 Figure 5. DP is retained in the ER in ANKRD13C overexpressing cells 60 Figure 6. DP receptors retained in the ER by ANKRD13C are eventually degraded
by the proteasome 62
Figure 7. DP receptors targeted for degradation associates with a cleaved form of
ANKRD13C 65
Figure 8. The ankyrin repeats and amino acids 489-498 of ANKRD13C are
essential for its function 67
Figure 9. ANKRD13C promotes the biogenesis and cell surface expression of
VIII Figure 10. ANKRD13C regulates the expression of other GPCRs but not of other
tested types of proteins 73
MANUSCRIT #2
Figure 1. RACK1 interacts with the C-terminus and the first intracellular loop of
TPp 98
Figure 2. Identification of the RACK1 WD repeats implicated in the binding of the
first intracellular loop and C-tail of TPP 101
Figure 3. RACK1 regulates the cell surface expression of TPP 104 Figure 4. TPP localization is impaired in RACK 1-depleted cells 107 Figure 5. Subcellular localization of TPP in RACK 1-depleted cells 110 Figure 6. Co-localization analysis of RACK1 and TPP by confocal
immunofluorescence microscopy 113
Figure 7. Deletion of a RACK1 binding site on TPP affects its cell surface
expression 116
Figure 8. Inhibition of PKC and dynamin function blocks the RACK 1-mediated
increase in TPP cell surface expression 119
Figure 9. Regulation of cell surface expression of various G protein-coupled
receptors by RACK1 120
MANUSCRIT #3
IX Figure 2. Rabl 1 associates with the p2-adrenergic receptor 155 Figure 3. The C-terminus of the P2-adrenergic receptor interacts directly with
Rabll 156
Figure 4. The P2AR-Rabl 1 interaction is dependent on the GDP/GTP nucleotide
status of Rabl 1 159
Figure 5. Amino acids 330-335 and 345-352 of the P2ARCT are essential for
Rabl 1 binding 162
Figure 6. Amino acids R333 and K348 of the P2ARCT are involved in the
interaction with Rabl 1 163
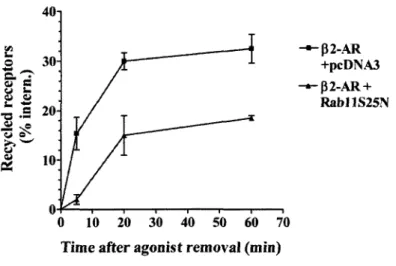
Figure 7. The role of the Rabl l-p2AR interaction in receptor internalization and
recycling 165
Figure 8. The p2AR-RK/AA mutant receptor recycles inefficiently following a
prolonged exposure to agonist 167
DISCUSSION
Figure 20. Resume des fonctions d'ANKRD13C dans la biogenese des RCPGs 182 Figure 21. Expression totale de DP et CRTH2 dans les cellules MG-63 185 Figure 22. Exemple de proteines isolees par SNAP pull-down 193 Figure 23. Alignement des sequences en acides amines d'ANKRD13A,
ANKRD13B, ANKRD13C et ANKRD13D 195
X
LISTE DES ABREVIATIONS
AA Acide arachidonique
ACTH Adreno CorticoTropic Hormone
AKAP A-kinase anchor protein
ANKRD13C Ankyrin repeat domain-containing protein 13C
AP-2 Adapter Protein 2
P2-AR Recepteur P2-adrenergique
BLAST Basic Local Alignment Search Tool
CFTR Cystic Fibrosis Transmembrane conductance Regulator
CNX Calnexine
CRT Calreticuline
COX Cyclooxygenase
DRiP78 Dopamine receptor-interacting protein 78
EDEM ER Degradation Enhancing a-Mannosidase-like protein
EEA1 Early Endosome Antigen 1
ERAD Degradation associee au reticulum endoplasmique ER Man I a-mannosidase I
ERP Endosome de recyclage perinucleaire ETB Recepteur de l'endotheline de type B
GABAB Sous-unites du recepteur de l'acide y-aminobutyrique
GAP GTPase-Activating Protein
GASP GPCR-associated sorting proteins GDF Facteur de deplacement de Rab-GDI
XI GDP GEF GRK GTP Hsp IP3 M6PR MAPK MC1R MRAP MVB ninaA NMDA NSF OST PDE PDI PKA PKC PLC PGD2 PGDS PI-3-K Guanosine diphosphate
Facteur d'echange de nucleotide guanine G protein-coupled receptor kinase Guanosine triphosphate
Heat Shock Proteins Inositol triphosphate
Recepteur mannose-6-phosphate Mitogen-Activated Protein Kinase Recepteur de la melanocortine de type 1 MC2-receptor accessory protein
corps multivesiculaire
neither inactivation nor afterpotential protein A N-methyl-D-aspartate
NEM-sensitive factor Oligosaccharyl transferase Phosphodiesterase
Proteine disulfure isomerase Proteine kinase A Proteine kinase C Phospholipase C Prostaglandine D2 Prostaglandine D synthetase Phosphoinositide-3-kinase
Rab-GDI RACK1 RanBP2 RCPGs RE TGM TPa TPP TSH TXA2 TxAS UGGT VIP1
Inhibiteur de la dissociation de Rab-GDP Receptor for Activated C-kinase 1 Ran-binding protein 2
Recepteurs couples aux proteines G Reticulum endoplasmique
Reseau trans-golgien ou « Trans Golgi Network » Isoforme a du recepteur du thromboxane A2 Isoforme p du recepteur du thromboxane A2 Thyrotropine
Thromboxane A2
Thromboxane synthetase
UDP-glucose:glycoproteine glucosyltransferase Vasoactive intestinal peptide type 1
RESUME
Decouverte de nouveaux complexes proteiques impliques dans la synthese et le transport intracellulaire des recepteurs couples aux proteines G
par Audrey Parent
Departement de Medecine, service de rhumatologie
These presentee a la Faculte de medecine et des sciences de la sante en vue de l'obtention du grade Philosophiae Doctor (Ph.D) en Biochimie
Les recepteurs couples aux proteines G (RCPGs) constituent la plus grande famille de recepteurs membranaires et sont impliques dans le controle de la majorite des processus physiologiques. Dans le modele classique, la signalisation par les RCPGs se resumait a l'activation de proteines G heterotrimeriques capables de moduler Pactivite d'effecteurs, qui, a leur tour, controlent la concentration intracellulaire de seconds messagers tels que l'AMPc ou le calcium. Cette vision classique de la signalisation s'est par contre complexifiee au fils des annees et Ton sait maintenant que les RCPGs interagissent avec une multitude d'autres proteines afin de transmettre de facon specifique les signaux extracellulaires. Ainsi, pour bien comprendre comment est regule un RCPG, il devient primordial de connaitre les proteines interagissant avec celui-ci. Nous avons done entrepris d'identifier de nouveaux partenaires d'interaction pour les recepteurs DP (recepteur de la prostaglandine D2), TPP (recepteur du thromboxane A2)
et P2-adrenergique, puis, de determiner le role de ces complexes proteiques dans la fonction des recepteurs.
Lors d'un criblage par double-hybride visant a identifier de nouveaux partenaires d'interaction pour DP, nous avons identifie la proteine ankyrin repeat domain-containing protein 13C (ANKRD13C), une proteine n'ayant pas encore ete caracterisee jusqu'a maintenant. Des etudes de localisation ont montre qu'ANKRDBC est associee a la membrane du reticulum endoplasmique (RE), ou elle interagit avec DP. Cette interaction facilite d'abord la biogenese du recepteur en ralentissant la degradation des recepteurs nouvellement synthetises. Elle regule aussi le transport de DP vers la membrane plasmique en induisant la retention dans le RE des formes immatures du recepteur. Elle facilite finalement la degradation par le proteasome des formes de recepteurs retenues dans le RE. Ces experiences suggerent done un role de chaperonne pour ANKRD13C dans la biogenese du recepteur DP.
La proteine adaptatrice RACK1 (Receptor for Activated C-Kinase 1) a ensuite ete identified comme nouveau partenaire d'interaction pour l'isoforme P du recepteur du thromboxane A2 (TPP). Les resultats presentes dans cette etude montrent que les deux proteines interagissent directement et qu'elles forment un complexe au niveau du RE. L'interaction entre TPP et RACK1 s'est d'ailleurs averee essentielle pour que le recepteur puisse etre exporte du RE vers la membrane plasmique. Ces travaux ont done revele un role majeur de RACK1 dans la fonction de TPp, plus precisement au niveau de son transport vers la surface cellulaire.
Finalement, une nouvelle interaction entre le recepteur P2-adrenergique (P2-AR) et la petite proteine G Rabll a ete caracterisee. Les experiences realisees demontrent que les deux proteines s'associent en cellules via une interaction directe. Une construction du P2-AR ou les sites d'interaction avec Rabl 1 sont mutes a ete generee. La mise en evidence d'un defaut de recyclage de ce mutant suite a une stimulation avec un agoniste specifique a permis d'etablir que l'interaction directe avec Rabl 1 est essentielle pour que le P2-AR puisse recycler de facon adequate.
Les resultats presentes dans cette these illustrent le role joue par trois nouveaux complexes proteiques dans la synthese, l'export et le recyclage de RCPGs. L'identification et la caracterisation de ces nouvelles interactions permettra de mieux comprendre comment sont regules les recepteurs DP, TPP et P2-adrenergique, et permettra eventuellement d'ameliorer les connaissances quant a la regulation de l'ensemble des recepteurs couples aux proteines G.
Mots-cles : repliement des proteines, transport de proteines membranaires, recepteurs des prostano'ides, recepteur p2-adrenergique, proteines adaptatrices
INTRODUCTION
1
1. Les recepteurs couples aux proteines G (RCPGs)
Les recepteurs couples aux proteines G (RCPGs) represented la plus grande classe de recepteurs membranaires avec plus de 800 membres (Millar and Newton, 2010). Cette famille de recepteurs est impliquee dans divers processus physiologiques tels que les reponses visuelle, gustative et olfactive, la neurotransmission, la regulation des systemes nerveux sympathique et parasympathique, la regulation du systeme immunitaire et de 1'inflammation, etc. Des stimuli de nature tres variee, comme par exemple, des photons, des ions (ex.: calcium), des amines (ex. : adrenaline), des peptides (ex. : angiotensine II), des proteines (ex.: thyrotropine (TSH)), des composes lipidiques (ex. : prostaglandins) ou des nucleotides (ex. : ATP) peuvent done activer les RCPGs.
Les RCPGs presentent une structure commune composee de sept helices a transmembranaires reliees entre elles par trois boucles extracellulaires et trois boucles intracellulaires (Figure 1). L'extremite amino-terminale des recepteurs est extracellulaire tandis que leur extremite carboxy-terminale est intracellulaire. De nombreux recepteurs de la famille de la rhodopsine possedent aussi une huitieme helice a, parallele a la membrane plasmique, dans leur extremite carboxy-terminale (Huynh et al, 2009). Les RCPGs subissent des modifications post-traductionnelles qui vont influencer leur structure et qui jouent generalement un role crucial dans leur fonction. Parmi ces modifications, on retrouve la glycosylation sur des residus asparagine (N-glycosylation), la formation de ponts disulfures entre les chaines laterales de residus cysteine ainsi que
4 Ces chaperonnes favorisent le repliement tridimensionnel adequat des proteines en liant les surfaces hydrophobes, les oligosaccharides ou les cysteines non reliees par un pont disulfure. Parmi celles impliquees dans la biogenese des RCPGs, on note entre autres la calnexine et la calreticuline qui agissent au niveau de la lumiere du RE (Dong et al, 2007a). Comme ce sont des chaperonnes de type lectine, elles lient specifiquement les oligosaccharides et sont done impliquees dans la biogenese de RCPGs qui sont glycosyles. Les sequences consensus Asn-X-Ser/Thr presentes dans l'extremite N-terminale et/ou dans les boucles extracellulaires de ces recepteurs sont glycosylees par l'oligosaccharyl transferase (OST) qui catalyse le transfert d'un oligosaccharide precurseur forme de 14 residus (3 glucoses, 9 mannoses et 2 acetylglucosamines) sur le residu Asn (Figure 3). Deux glucoses sont immediatement enleves par les glucosidases I et II pour permettre la reconnaissance de la proteine monoglucosylee par la calnexine ou la calreticuline. Ces chaperonnes aident les proteines nouvellement synthetisees a adopter une bonne conformation en prevenant l'agregation irreversible des proteines immatures. Pour mettre fin a l'interaction entre la proteine et les chaperonnes lectines, la glucosidase II clive le troisieme glucose de 1'oligosaccharide precurseur. Si le repliement n'est pas encore complet, l'UDP-glucose:glycoproteine glucosyltransferase (UGGT) va le reconnaitre et remettra un glucose sur 1'oligosaccharide precurseur afin de permettre de nouveau l'interaction avec les chaperonnes lectines. Ce cycle se repetera jusqu'a ce que la proteine soit bien repliee ou jusqu'a ce qu'elle soit redirigee vers la
6 Les RCPGs nouvellement synthetases peuvent aussi interagir avec d'autres chaperonnes luminales qui vont stabiliser les proteines mal repliees en liant les parties hydrophobes (BiP/Grp78 ou Grp94) ou en favorisant la formation de ponts disulfures (proteines disulfure isomerase (PDI)) (Dong et al, 2007). Certaines proteines de la famille des « Heat Shock Proteins » (Hsp) pourraient aussi etre impliquees dans le repliement des portions cytosoliques des recepteurs. II a par exemple ete montre que le variant Hsc70t, exprime au niveau des testicules et de 1'epithelium olfactif, favorise l'expression des recepteurs olfactifs lorsque ceux-ci sont exprimes dans un systeme heterologue (Neuhaus et al, 2006). Une autre etude a aussi demontre que la surexpression d'HSJlb, une cochaperonne d'Hsp70, affecte l'expression et le transport vers la membrane plasmique de la rhodopsine en induisant la retention du recepteur dans le RE (Chappie et Cheetham, 2003). Les chaperonnes comme la calnexine et Hsp70 font partie du systeme general de chaperonnes puisqu'elles ne sont pas specifiques aux RCPGs, mais sont plutot impliquees dans le repliement de la majorite des proteines synthetisees dans la voie de secretion. Certaines chaperonnes specifiques aux RCPGs ont aussi ete identifiees. Quelques exemples sont presentes a la section 5.1.
2.2 Export des recepteurs nouvellement synthetises
Une fois le repliement dans le RE termine, les recepteurs sont envoyes vers l'appareil de Golgi pour continuer leur maturation. Ce processus est hautement regule puisque la machinerie responsable du controle de qualite doit s'assurer que seuls les RCPGs bien replies sont transportes vers la membrane plasmique (Achour et al, 2008). Ceux-ci sont recrutes dans des sites specialises (« ER exit sites ») qui permettent la
7 sortie des proteines du RE vers le Golgi. Le bourgeonnement des vesicules de transport a partir de ces sites se fait via les proteines de recouvrement de type COPII, comprenant la petite proteine G Sari ainsi que les proteines Sec23/24 et Secl3/31 (Barlowe, 2003). La GTPase Sari, associee aux membranes sous sa forme liee au GTP, recrute le complexe Sec23/24 via son interaction avec la sous-unite Sec23. Par la suite, Pheterotetramere Secl3/31 (compose de 2 sous-unites Secl3 et 2 sous-unites Sec31) s'unit au complexe Sarl/Sec23/Sec24 pour permettre le bourgeonnement de la vesicule (Sato et Nakano, 2007). Afin d'etre transporters efficacement hors du RE, les proteines transmembranaires peuvent lier directement les composantes du complexe COPII. Cette interaction se fait avec la proteine Sec24 qui reconnait des motifs di-acide ((D/E)X(D/E)) ou di-phenylalanine (FF) presents dans la partie cytosolique des proteines transmembranaires a transporter (Sato et Nakano, 2007).
2.2.1 Motifs essentiels a l'export des RCPGs hors du RE
Bien que les motifs di-acide et di-phenylalanine ne semblent pas etre impliques dans l'export des RCPGs, des etudes ont revele l'existence d'autres types de motifs d'export pouvant se trouver dans leur queue C-terminale. Les principaux motifs repertories sont: E(X)3LL, FN(X)2LL(X)3L, F(X)6LL et F(X)3F(X)3F (Duvernay et al, 2005). Le fait de muter ces motifs entraine une retention dans le RE et une diminution de 1'expression de surface des recepteurs qui les contiennent, suggerant qu'ils sont impliques dans le transport hors du RE (Dong et al, 2007). Contrairement aux motifs di-acide et di-phenylalanine, le mecanisme d'action est par contre peu connu. Une possible interaction entre ces motifs et les proteines de recouvrement de type COPII a ete
9 C'est le motif RXR qui est principalement retrouve chez les RCPGs. Comme il induit une retention active dans le RE, il doit etre masque pour que les RCPGs qui le contiennent puissent etre exportes vers la membrane plasmique. Deux mecanismes de masquage des motifs riches en arginine ont ete decrits jusqu'a maintenant: masquage par une interaction avec des proteines cytosoliques ou par assemblage de complexes multimeriques (Michelsen et al, 2005). Dans le cas du mecanisme impliquant des proteines cytosoliques, des interactions entre les motifs RXR et des proteines 14-3-3 ou des proteines a motifs PDZ ont ete repertoriees (Kuwana et al, 1998;Standley et al, 2000). Pour ce qui est du masquage via Passemblage de complexes multimeriques, ce mecanisme a entre autres ete decrit pour la sous-unite 1 du recepteur de l'acide y-aminobutyrique (GABABI). Lorsque celle-ci est exprimee seule, la presence d'un motif
RXR dans sa queue C-terminale induit sa retention dans le RE. Cette retention n'est par contre plus observee quand la deuxieme sous-unite du recepteur (GABAB2) est
co-exprimee avec GABABI puisque Pheterodimerisation entre les deux RCPGs masque le
motif RXR (Margeta-Mitrovic et al, 2000).
2.3 Voie de degradation associee au reticulum endoplasmique (ERAD)
L'efficacite de repliement dans le RE est une propriete intrinseque a chaque proteine et dans le cas des RCPGs, une fraction significative (jusqu'a 50%) des recepteurs nouvellement synthetises n'atteindront jamais leur conformation native (Ayala Yanez et Conn, 2010;Petaja-Repo et al, 2000). Ces proteines non natives sont generalement redirigees vers la voie de degradation associee au reticulum endoplasmique, le ERAD (Petaja-Repo et al, 2001;Vembar et Brodsky, 2008).
12 Le clivage d'un premier residu mannose par la a-mannosidase I inhibe 1'interaction avec les chaperonnes lectines et permet plutot la liaison a des proteines menant au ERAD comme les proteines EDEM (ER Degradation Enhancing a-Mannosidase-like protein). Ces proteines accelerent le clivage d'autres residus mannoses, rendant impossible la re-glucosylation par l'UGGT et creant un site de reconnaissance pour la proteine OS-9 (Hoseki et ah, 2010). La liaison des proteines EDEM inhibe aussi l'agregation des proteines mal repliees, ce qui facilite leur retrotranslocation vers le cytosol. En effet, comme la machinerie responsable de la degradation des proteines par la voie du ERAD (le proteasome) se trouve dans le cytosol, les proteines membranaires et luminales doivent etre transferees au cytosol avant d'etre degradees (Figure 6). Ce processus est assure par le complexe du retrotranslocon et ses proteines associees (Tableau 1, Retrotranslocation). II est entre autres regule par l'AAA-ATPase Cdc48 (Ye et al., 2001). Afin de favoriser leur ciblage vers le proteasome, les proteines a degrader peuvent etre ubiquitylees par un complexe E2/E3 ligase membranaire ou associe a la membrane du RE (Tableau 1, Ubiquitylation). Une fois transferees au cytosol, les proteines sont acheminees vers le proteasome 26S pour leur degradation. Ce processus est regule par differents facteurs cytoplasmiques ou associees a la membrane du RE (Tableau 1, Ciblage et degradation par le proteasome). Les composantes du ERAD identifiees a ce jour chez les mammiferes sont presentees dans le tableau 1. Dans le cas des RCPGs, certaines des composantes impliquees dans la reconnaissance des substrats a degrader ont ete identifiees (ex. : calnexine et BiP) mais celles impliquees dans les etapes de ciblage au retrotranslocon, de retrotranslocation, d'ubiquitylation et de ciblage au proteasome des RCPGs sont peu connues.
14
3. Signalisation par les RCPGs
L'identification et la caracterisation des molecules responsables de la signalisation des RCPGs remonte a la fin des annees 1970. Cette importante decouverte a ete attribute aux groupes d'Alfred Gilman et Martin Rodbell qui ont ete les premiers a demontrer que la transmission du signal des RCPGs vers les differents effecteurs intracellulaires est assuree par les proteines G heterotrimeriques composees des sous-unites a, p et y (Gilman, 1995;Rodbell, 1995).
3.1 Les proteines G heterotrimeriques
Selon le modele classique d'activation des proteines G (Figure 7), a l'etat inactif, la sous-unite Ga est liee a une molecule de guanosine diphosphate (GDP) et est associee au dimere Gpy. L'activation d'un RCPG par son ligand entraine un remaniement de la structure du recepteur favorisant son couplage avec les proteines G heterotrimeriques. Ce couplage induit un changement conformationnel au niveau de la proteine G qui favorise la relache du GDP et son remplacement par une molecule de guanosine triphosphate (GTP). La liaison du GTP amene une dissociation du complexe pour liberer deux unites distinctes, soit la sous-unite Ga-GTP et le complexe GPy. Ces sous-unites sont les formes actives capables de reguler 1'activite de divers effecteurs (voir section 3.2). L'activite des proteines G est terminee par Phydrolyse du GTP en GDP par 1'activite GTPasique intrinseque de la sous-unite Ga.
16 II est par contre possible que ce modele soit reevalue puisque des etudes publiees recemment suggerent que la sous-unite Ga ne se dissocie pas necessairement du dimere GPy suite a l'activation par un RCPG (Bunemann et al, 2003;Gales et al, 2006). Ces conclusions ont ete tirees suite a des experiences employant les techniques de transfert d'energie par resonance de type Forster (FRET) ou de type bioluminescent (BRET) qui ont montre une augmentation du signal de FRET ou de BRET entre la sous-unite Ga et le dimere GPY suite a l'activation d'un recepteur. Ces resultats suggerent un rearrangement des proteines G heterotrimeriques plutot qu'une dissociation.
3.2 Les effecteurs des proteines G heterotrimeriques
Plusieurs effecteurs intracellulaires sont regules suite a l'activation des proteines G heterotrimeriques. Les sous-unites Ga sont divisees en 4 classes selon leur homologie de structure et selon les enzymes effecteurs qu'elles regulent: Gas, Gai/o, Gaq/11 et Gal2. Elles peuvent activer ou inhiber des enzymes a seconds messagers tels que la phospholipase C (PLC) et les adenylyl- et guanylyl-cyclases (Figure 8) (Ritter and Hall, 2009). Les sous unites Ga peuvent egalement moduler l'activite d'autres effecteurs tels que des phosphodiesterases (PDE), des tyrosines kinases (ex.: src), la phospholipase D (PLD), des regulateurs des petites proteines G (Rap 1 GAP et pll5RhoGEF), etc. (Cabrera-Vera et al, 2003;Milligan et Kostenis, 2006). Pour ce qui est du dimere GPy, il est aussi implique dans la regulation de l'activite de nombreux effecteurs : les adenylyl cyclases, la PLCp, des canaux potassiques rectifiant entrant dependant des proteines G (GIRK) ou sensible a l'ATP (KATP), certaines kinases des RCPGs (GRK2 et GRK3), la
18 independantes des proteines G heterotrimeriques. En effet, parallelement a leur role dans l'inactivation des voies de signalisation dependantes des proteines G (voir section 4.1), les arrestines peuvent initier une seconde cascade signaletique impliquant les serine/threonine kinases de la famille des MAPKs («Mitogen-Activated Protein Kinases ») (Gesty-Palmer et Luttrell, 2008). Par leur interaction avec les proteines Raf, ERK et JNK3, les arrestines facilitent le recrutement des composantes de la voie des MAPKs aux RCPGs actives (DeFea et al, 2000;Luttrell et al, 2001;McDonald et al, 2000). II en resulte une retention des kinases au cytosol, favorisant la phosphorylation de leurs substrats cytosoliques, au detriment des substrats nucleaires.
4. Mecanismes deactivation des RCPGs
La stimulation soutenue d'un RCPG par un agoniste specifique entraine une diminution graduelle de la sensibilite du recepteur a son ligand. Ce processus de retrocontrole negatif appele desensibilisation permet de controler la duree de la transmission du signal et permet d'eviter les effets potentiellement dangereux d'une stimulation excessive de la cellule. II necessite un decouplage physique entre le recepteur et les proteines G et implique generalement le retrait du RCPG de la membrane plasmique via un processus appele endocytose.
4.1 Decouplage fonctionnel par phosphorylation
Le processus de desensibilisation debute generalement par la phosphorylation des regions intracellulaires du recepteur par des serine/threonine kinases specifiques aux
20 La desensibilisation est dite homologue si la phosphorylation des parties cytoplasmiques du recepteur est initiee apres liaison specifique de son ligand. Cette desensibilisation fait intervenir principalement les GRKs. Pour ce qui est de la desensibilisation dite heterologue, la phosphorylation du RCPG ne necessite pas la presence de son ligand mais est plutot induite par l'activation d'un autre recepteur. Ce type de desensibilisation est assuree par les kinases activees par les seconds messagers. Un RCPG phosphoryle est ensuite reconnu par des molecules adaptatrices telles que les arrestines, une famille de proteines qui lient avec haute affinite les portions cytoplasmiques phosphorylees du recepteur active (les arrestines peuvent aussi reconnaitre les recepteurs non phosphoryles mais avec une affinite moins elevee) (Mukherjee et al, 1999). Les arrestines inhibent alors le couplage entre le recepteur et les proteines G, le rendant incapable d'activer l'echange GDP-GTP au niveau de la sous-unite Got (Tobin, 2008).
4.2 Endocytose des RCPGs
L'activation d'un RCPG est generalement suivie par Pinternalisation du complexe ligand-recepteur a l'interieur de la cellule par differentes voies d'endocytose. La voie empruntee par la majorite des recepteurs est celle qui fait intervenir les vesicules recouvertes de clathrine et qui depend de la dynamine (Figure 9). Ce processus est d'ailleurs facilite par les arrestines qui servent aussi de proteines adaptatrices puisqu'elles peuvent interagir avec la clathrine et AP2 (Adapter Protein 2), deux composantes de la machinerie d'endocytose (Goodman et al, 1996;Laporte et al, 1999). L'interaction entre les arrestines, la clathrine et AP2 permet le recrutement des RCPGs
21 actives au niveau des puits d'endocytose recouverts de clathrine, ce qui facilite lew internalisation. Pour certains RCPGs comme le recepteur du « vasoactive intestinal peptide » de type 1 (VIP1) et le recepteur de Pendotheline de type B (ETB), leur
internalisation est par contre independante des arrestines (Claing et ai, 2002). Des RCPGs comme les recepteurs sst2 de la somatostatine et B2 de la bradykinine peuvent aussi emprunter des voies d'endocytose qui n'impliquent pas les vesicules recouvertes de clathrine mais qui sont plutot dependantes des caveoles (Mentlein et ai, 2001;de Weerd et Leeb-Lundberg, 1997).
Les RCPGs endocytes peuvent ensuite etre recycles vers la membrane plasmique ou cibles aux lysosomes pour etre degrades. Dans le cas des recepteurs qui sont recycles, ils peuvent etre retournes vers la membrane plasmique directement a partir des endosomes precoces (recyclage rapide), ou ils peuvent d'abord transiter dans les endosomes perinucleaires de recyclage (recyclage lent) (Seachrist et Ferguson, 2003). Le processus d'internalisation est important pour la resensibilisation des RCPGs puisque les recepteurs internalises qui sont recycles sont d'abord decouples du ligand, dephosphoryles et retournes a la membrane plasmique dans un etat fonctionnel (von Zastrow, 2003). L'endocytose est egalement importante pour l'initiation d'une seconde cascade signaletique independante des proteines G (voir section 3.3).
Parmi les facteurs pouvant influencer le ciblage des recepteurs internalises vers la voie de degradation versus une des voies de recyclage (rapide ou lente), on retrouve entre autres le niveau d'association du recepteur avec les arrestines. En effet, les RCPGs
22 comme le recepteur p2-adrenergique qui presentent une faible affinite pour les arrestines (recepteurs de classe A) sont internalises apres s'en etre dissocies et ils sont rapidement recycles vers la membrane plasmique. A 1'inverse, les RCPGs comme le recepteur V2 de la vasopressine qui lient fortement les arrestines (recepteurs de classe B) sont internalises avec celles-ci et ils sont majoritairement retenus au niveau intracellulaire pour etre degrades ou retournes vers la surface cellulaire par une voie de recyclage lente (Zhang et al, 1999;Oakley et al, 2000). Pour certains RCPGs, le routage intracellulaire suite a une stimulation depend aussi de la presence de motifs specifiques dans leur queue C-terminale. II a par exemple ete montre que la mutation d'une sequence de recyclage dans le recepteur p2-adrenergique (P2-AR) inhibe le retour a la membrane plasmique des recepteurs endocytes qui sont alors cibles vers les lysosomes. L'introduction de cette sequence dans la queue cytoplasmique d'un autre recepteur (le recepteur opioide de type 5) a d'ailleurs permis de modifier ses proprietes endocytiques suite a une stimulation en favorisant son recyclage plutot que sa degradation (Cao et al, 1999a;Gage et al, 2001). Le ciblage vers les voies de recyclage et de degradation peut done etre influence par des proteines qui interagissent directement avec des motifs retrouves dans les parties cytoplasmiques des RCPGs. Quelques exemples de ces proteines sont presentes a la section 5.3.
4.2.1 Ciblage aux endosomes : implication des Rab GTPases
Le mouvement des vesicules de transport entre les differents compartiments intracellulaires est un processus specifique et hautement regule. Parmi les proteines regulant le trafic vesiculate, on retrouve les petites proteines G de la famille des Rab
24 A l'etat inactif, Rab-GDP est maintenue dans le cytosol via une interaction avec la Rab-GDI (inhibiteur de la dissociation de Rab-GDP). Ce facteur sequestre les groupements geranylgeranyl des Rabs qui servent a l'attachement membranaire. La specificite d'attachement des Rabs a la membrane d'un organelle implique la reconnaissance du complexe Rab-GDP avec Rab-GDI par un facteur GDF (facteur de deplacement de Rab-GDI), present dans la membrane de cet organelle. Une fois ancree dans la membrane, la proteine Rab est activee par un facteur d'echange de nucleotide guanine (GEF) qui catalyse Pechange du GDP pour un GTP. Sous sa forme active, Rab-GTP peut interagir avec ses differents effecteurs. L'activation des Rabs se termine par l'hydrolyse du GTP en GDP via leur activite GTPase intrinseque, stimulee par les proteines GAP (GTPase-Activating Proteins). La forme Rab-GDP est par la suite extraite de la membrane par la Rab-GDI (Grosshans et al, 2006).
Sous leur forme liee au GTP, les Rabs peuvent interagir avec des effecteurs qui sont impliques dans diverses etapes du transport vesiculate (Figure 11). Elles peuvent entre autres influencer le tri des proteines cargos en facilitant leur recrutement au niveau des vesicules de transport (Stenmark, 2009). Rab5 et Rab9 sont deux exemples de Rabs qui remplissent cette fonction. Dans le cas de Rab5, il a ete montre qu'elle favorise 1'incorporation du recepteur de la transferrine dans les puits d'endocytose recouverts de clathrine. Pour ce qui est de Rab9, en recrutant TIP47 aux endosomes tardifs, elle facilite la formation d'un complexe entre cette proteine et les recepteurs mannose-6-phosphate (M6PRs) qui augmente 1'incorporation des recepteurs dans les vesicules de transport. Certaines Rabs jouent aussi un role dans le desassemblage des proteines de
27 Rab5 est impliquee dans l'endocytose a partir de la membrane plasmique jusqu'aux endosomes precoces. Rab4 controle le recyclage rapide a partir des endosomes precoces, vers la membrane plasmique. Rabll regule le recyclage lent des endosomes de recyclage perinucleaires vers la membrane plasmique et est aussi impliquee dans le transport entre les endosomes de recyclage et le TGN ainsi qu'entre le TGN et la membrane plasmique. Rab7 participe au transport des endosomes precoces vers les lysosomes (Seachrist et Ferguson, 2003).
5. Nouvelles proteines regulatrices de l'activite des RCPGs
De facon generate, les RCPGs interagissent avec les proteines G, les GRKs et les arrestines. Au cours des dernieres annees, il a par contre ete montre que les RCPGs s'associent aussi avec une multitude d'autres partenaires afin de transmettre de facon specifique les signaux extracellulaires. Contrairement a 1'interaction avec les partenaires classiques comme les proteines G, la plupart de ces nouvelles associations semblent etre specifiques a un recepteur ou a une famille de recepteurs.
5.1 Proteines facilitant la synthese et la maturation des RCPGs
Parmi les nouveaux partenaires d'interaction identifies pour les RCPGs, on retrouve des proteines regulant le repliement et/ou le transport des recepteurs nouvellement synthetises vers la membrane plasmique. C'est le cas notamment de ninaA (neither inactivation nor afterpotential protein A) de Drosophila melanogaster et de son homologue chez les vertebres RanBP2 (Ran-binding protein 2), des cyclophilines de
28 type II possedant une activite peptidyl prolyl isomerase. Ces proteines favorisent le repliement et le transport dans la voie de secretion de la rhodopsine (Baker et al, 1994;Colley et al, 1991;Ferreira et al, 1996). Les proteines MRAP (MC2-receptor accessory protein) et DRiP78 (dopamine receptor-interacting protein 78) constituent d'autres exemples de proteines facilitant la maturation de RCPGs. MRAP est essentielle a l'expression au niveau de la membrane plasmique du recepteur MC2 de l'hormone corticotrope ACTH (Adreno CorticoTropic Hormone) (Metherell et al, 2005) alors que la liaison de DRiP78 au motif d'export F(X)sF(X)3F du recepteur Dl de la dopamine induit sa retention au niveau du reticulum endoplasmique (Bermak et al, 2001).
5.2 Proteines modulant la signalisation des RCPGs
Une autre classe de partenaires d'interaction des RCPGs comprend les proteines pouvant moduler leur signalisation. Certaines proteines vont augmenter la signalisation suite a une stimulation alors que d'autres vont l'inhiber. Des exemples de proteines pouvant favoriser la signalisation des RCPGs sont les proteines NHERF1 (aussi connue sous le nom de EBP50) et NHERF2. Ces proteines a domaines PDZ (domaines initialement identifie chez les proteines Post synaptic density protein, Drosophila disc large tumor suppressor et Zonula occludens-1 protein) s'associent avec certains RCPGs (le recepteur de l'hormone parathyroidienne (PTH1R), le recepteur de l'acide lysophosphatidique LPAR2, le recepteur purinergique P2RY1 et le recepteur du glutamate mGluR5) pour favoriser leur signalisation via la PLCP (Fam et al, 2005;Mahon et al, 2002;Oh et al, 2004;Paquet et al, 2006). Un autre exemple de proteines pouvant moduler la signalisation des RCPGs sont les proteines AKAP79
(A-29 kinase anchor protein 79 kDa), aussi appelee AKAP5, et AKAP250, aussi appelee AKAP12 et gravin. Ces proteines sont capables de lier directement le recepteur P2-adrenergique (P2-AR) pour permettre l'ancrage de la PKA au recepteur et favoriser la phosphorylation du recepteur lui-meme ainsi que celle de substrats impliques dans sa signalisation (Scott et al, 2000;Shih et al, 1999).
5.3 Proteines influencant le trafic intracellulaire suite a une stimulation
En plus de faire intervenir les GRKs et les arrestines, le processus d'endocytose suite a une stimulation est aussi influence par d'autres partenaires d'interaction des RCPGs. Certaines proteines vont favoriser la degradation des recepteurs internalises en augmentant leur ciblage vers les lysosomes alors que d'autres vont favoriser le recyclage des RCPGs auxquels elles sont liees. Parmi celles qui augmentent la degradation, on retrouve les proteines de la famille GASP (GPCR-associated sorting proteins). Celles-ci vont s'associer a certains recepteurs, dont le recepteur opioide de type 8 (DOR) et le recepteur D2 de la dopamine, pour favoriser leur ciblage vers les lysosomes (Bartlett et al, 2005;Whistler et al, 2002). A l'inverse, la proteine NHERF1 va s'associer a des recepteurs comme le P2-AR et le recepteur opioide de type K (KOR) pour promouvoir leur recyclage vers la membrane plasmique, au detriment du ciblage vers les lysosomes (Cao et al., 1999b;Li et al., 2002). Certaines petites proteines G de la famille des Rabs peuvent aussi reguler le routage intracellulaire des RCPGs internalises via une interaction directe avec les recepteurs. II a par exemple ete montre qu'une interaction entre Rab5 et le recepteur de l'angiotensine II ainsi qu'entre Rabll et le recepteur du
30 thromboxane A2 (TPP) peut influencer le trafic intracellulaire de ces recepteurs (Hamelin et al, 2005;Seachrist et al, 2002;Seachrist et Ferguson, 2003).
Bien que seulement quelques exemples de nouveaux partenaires d'interactions des RCPGs ont ete presenter, une liste plus exhaustive de ceux-ci peut etre trouvee dans des revues de litteratures parues recemment (Achour et al, 2008a;Ritter et Hall, 2009). Un tableau resumant le role de plusieurs nouveaux partenaires d'interactions impliques dans la synthese et la maturation des RCPGs ainsi que dans le controle du trafic intracellulaire suite a une stimulation est presente (tableau 2).
33 La PGD2 est impliquee dans divers processus physiologiques dont la regulation du sommeil et des reactions inflammatoires (Hayaishi et Urade, 2002;Pettipher et al, 2007). Elle joue d'ailleurs un role important dans certaines pathologies allergiques comme l'asthme. Elle est aussi impliquee dans le metabolisme osseux (Gallant et al, 2005). La PGD2 agit sur ses cellules cibles via l'activation de deux recepteurs distincts soit les recepteurs DP, pour D-prostanoTde (aussi appele DPI), et CRTH2, pour « Chemoattractant Receptor-homologous molecule expressed on Th2 cells» (aussi appele DP2). La caracterisation moleculaire de DP a ete effectuee pour la premiere fois en 1995 (Boie et al, 1995). Ce recepteur est compose de 359 acides amines pour une masse moleculaire approximative de 40 kDa. II possede trois sites potentiels de N-glycosylation, dans sa partie N-terminale et dans ses lere et 3e boucles extracellulaires, ainsi qu'un pont disulfure entre des cysteines de sa lere et 2e boucle extracellulaire (Figure 14). DP est couple a la sous-unite Gas done son activation entraine une augmentation de la concentration intracellulaire d'AMPc (Boie et al, 1995). Le recepteur CRTH2 humain a ete clone pour la premiere fois en 1999 en tant que recepteur orphelin nomme GPR44 (Marchese et al, 1999) mais a par la suite ete renomme CRTH2. Ce n'est qu'en 2001 qu'il a ete montre que la PGD2 est le ligand naturel de CRTH2 (Hirai et al, 2001). Cela s'explique entre autres par le fait qu'il ne contient pas de sequences consensus des recepteurs des prostanoi'des et qu'il demontre plutot de l'homologie avec les membres de la famille des recepteurs des chimiokines (Narumiya et al, 1999). CRTH2 est forme de 395 acides amines pour une masse moleculaire approximative de 43 kDa et il possede deux sites potentiels de glycosylation en N-terminal ainsi qu'un pont disulfure entre les cysteines de la lere et 2e boucle
36
6.2 Les recepteurs du thromboxane A2
Le thromboxane A2 (TXA2) fait aussi partie de la famille des prostanoides. II est forme suite a l'isomerisation de la PGH2 en TXA2 par la thromboxane synthetase (TxAS) (Figure 13). Le TXA2 regule l'activation des plaquettes en induisant des changements dans leur morphologie et en augmentant l'agregation et la secretion plaquettaire (Narumiya et al, 1999). II stimule aussi la contraction des cellules musculaires lisses des vaisseaux sanguins (vasoconstriction) et des bronches (bronchoconstriction) (Breyer et al, 2001). D'autres fonctions ont aussi ete attributes au TXA2 (Nakahata, 2008).
Le recepteur humain du TXA2 norarae TP a ete le premier recepteur de prostanoides a etre clone en 1991 (Hirata et al, 1991). II existe deux isoformes de ce recepteur (TPa et TPp) generees par epissage alternatif qui partagent leur 328 premiers acides amines mais different dans leur portion C-terminale (Raychowdhury et al, 1994). TPa est forme de 343 acides amines alors que TPp en comporte 407 pour des masses moleculaires predites de 37 kDa et 44 kDa, respectivement (Figure 16). Les acides amines 4 et 16 des deux isoformes sont modifies par de la N-glycosylation (Walsh et al, 1998) et TPP est palmitoyle sur ses cysteines 347, 373 et 377 (Reid et Kinsella, 2007). Comme TPa et TPp sont principalement couples a la sous-unite Gaq, leur activation amene une augmentation de la production d'inositol triphosphates (IP3) ainsi qu'une elevation de la concentration de calcium intracellulaire (Kinsella, 2001). Le couplage du recepteur TP avec d'autres sous-unites Ga a aussi ete demontre (Hata et Breyer, 2004;Huang et al, 2004;Kinsella, 2001).
38
6.3 Le recepteur p2-adrenergique
L'adrenaline (ou epinephrine) et la noradrenaline (ou norepinephrine) sont des composes appartenant a la famille des catecholamines. L'adrenaline agit en tant que neurotransmetteur lorsqu'elle est secretee par le systeme nerveux central et elle peut aussi agir comme hormone lorsqu'elle est secretee dans la circulation sanguine par les glandes surrenales (Davis et al, 2008). L'adrenaline est secretee en reponse a un etat de stress, entrainant principalement une acceleration du rythme cardiaque, une augmentation de la force des contractions du coeur et une hausse de la pression arterielle. Elle agit aussi sur le metabolisme en augmentant la glycemie et en stimulant la degradation de substrats tels que les triglycerides (Davis et al, 2008). Pour ce qui est de la noradrenaline, elle agit principalement comme neurotransmetteur dans le systeme nerveux sympathique peripherique ou elle joue un role dans l'attention, les emotions, le sommeil, le reve, l'apprentissage et la perception de la douleur. Elle est aussi liberee comme une hormone dans le sang ou elle contracte les vaisseaux sanguins et augmente la frequence cardiaque (Haller et al., 1998).
Les effets de ces catecholamines passent par l'activation de recepteurs qu'on appelle recepteurs adrenergiques. II en existe plusieurs sous-types soit al, a2, pi, P2 et P3. Dans le cas des recepteurs (32-adrenergiques (P2-AR.S), ils sont principalement exprimes au niveau des cellules musculaires lisses ou leur activation entraine une vasodilatation et une bronchodilatation (Guimaraes et Moura, 2001). Le P2-AR est couple principalement a une sous-unite Gas et son activation entraine une augmentation de la concentration intracellulaire d'AMPc (Levitzki, 1988). Le P2-AR possede 413
41 Ces motifs sont generalement retrouves en plusieurs copies, colles les uns aux autres, afin de stabiliser les repetitions ankyrines adjacentes. On les retrouve chez plus de 1800 proteines, ce qui en fait un des motifs d'interaction proteine-proteine les plus communs (Mosavi et al, 2004). lis sont presents chez des proteines impliquees dans divers processus comme la regulation de la transcription, le developpement, le maintien de l'integrite du cytosquelette et la regulation du cycle cellulaire. Ces repetitions doivent d'ailleurs leur nom a une des proteines qui en contient le plus, la proteine ankyrine qui en contient vingt-quatre. II s'agit d'une proteine adaptatrice impliquee dans le maintien de l'integrite de la membrane plasmique par son interaction avec des proteines membranaires et avec le cytosquelette de spectrine (Rubtsov et Lopina, 2000). On les trouve aussi chez la proteine IKB, ou ils permettent l'interaction avec le facteur de transcription NF-KB (Huxford et al, 1998), et chez plusieurs membres de la famille de
suppresseurs de tumeurs INK4 (pl5, pl6, pl8 et pl9) (Mosavi et al, 2004).
Pour ce qui est du domaine DUF3424, comme son nom l'indique, (DUF = Domain of Unknown Function), aucune fonction ne lui a encore ete attribute. II est conserve chez les homologues d'ANKRDBC dans d'autres organismes eucaryotes (voir Figure 1 du manuscrit #1), mais encore la, aucune fonction n'est connue pour ces proteines.
Selon la base de donnees Aceview repertoriant les ADN complementaires (cDNAs) extraits de differents tissus humains (Thierry-Mieg et Thierry-Mieg, 2006), ANKRD13C serait exprime de facon ubiquiste, avec une expression predominate au
42 niveau du cerveau, de l'uterus et du pancreas. La base de donnees UniProtKB/Swiss-Prot suggere aussi l'existence d'une deuxieme isoforme d'ANKRD13C qui serait generee par epissage alternatif excluant l'exon 3 (numero d'identification Q8N6S4-2). La proteine produite contiendrait une deletion de 35 acides amines au niveau des repetitions ankyrine. Une troisieme isoforme potentielle correspondant aux acides amines 1 a 147 d'ANKRD13C a aussi ete repertoriee (numero d'identification Q8N6S4-3).
8. La proteine adaptatrice RACK1
RACK1 (Receptor for Activated C-Kinase 1) est une proteine de 36 kDa appartenant a la famille des proteines a domaines WD. Elle possede sept repetitions de type WD40 composees d'environ 40 acides amines qui debutent par un dipeptide glycine-histidine et se terminent avec un dipeptide tryptophane-aspartate ( [GH-X WD] N4~8 ou N = le nombre de repetitions WD) (McCahill et al, 2002). La sequence en acides amines de RACK1 est homologue a celle de la sous-unite pi des proteines G heterotrimeriques avec 57% d'identite. Les modeles de prediction de structure prevoient que, tout comme pour la sous-unite Gp, les repetitions WD40 qui composent RACK1 forment une structure en helice de type « P-propeller » (Figure 19) (Chen et al, 2004b). Lorsqu'on compare les sequences de RACK1 et de Gp, on remarque par contre que RACK! ne contient pas la region responsable de la liaison avec Gy et possede une region additionnelle dans la boucle qui relie ses domaines WD 6 et 7. Cette region est d'ailleurs impliquee dans l'interaction entre RACK1 et plusieurs de ses partenaires.
44 augmente son activite en la maintenant dans sa conformation active (Schechtman et Mochly-Rosen, 2001). RACK1 a d'abord ete caracteiisee comme un recepteur pour la PKC conventionnelle de type pil (Ron et al, 1995;Stebbins et Mochly-Rosen, 2001), mais elle peut aussi interagir avec d'autres PKC comme la PKCs (Besson et al, 2002).
8.2 Nouvelles fonctions de RACK1
D'autres fonctions de RACK1 ont aussi ete mises en evidence au cours des dernieres annees. RACK1 regule entre autres certaines fonctions du dimere Py des proteines G heterotrimeriques. Suite a l'activation d'un RCPG, l'association entre RACK1 et le dimere GPy inhibe l'activation de la PLCp et de l'adenylyl cyclase II par celui-ci (Chen et al, 2004a). Cette interaction induit aussi une translocation de RACK1 vers la membrane plasmique, favorisant le recrutement de la PKC activee a la membrane afin d'augmenter la phosphorylation des substrats de la kinase qui s'y trouvent (Chen et al, 2004b). RACK1 joue aussi un role dans la regulation du cycle cellulaire puisque son interaction avec la tyrosine kinase Src inhibe 1'activite de la kinase, entrainant un prolongement de la phase Go/Gi (Chang et al, 1998). RACK1 est aussi impliquee dans de nombreux autres processus tels que le metabolisme de l'AMPc (via une interaction avec la phosphodiesterase PDE4D5), la relache calcique (via une interaction avec le recepteur a l'IP3), Padhesion cellulaire (via une interaction avec les integrines), la regulation du systeme immunitaire (via une interaction avec la sous-unite P des recepteurs a l'IL-3/IL-5/GM-CSF) et du systeme nerveux (via de nombreuses interactions dont celle avec le recepteur NMD A) (McCahill et al, 2002;Sklan et al, 2006).
45
OBJECTIFS DE L'ETUDE
Traditionnellement, la signalisation par les RCPGs se resumait a 1'activation des proteines G heterotrimeriques capables de moduler l'activite de differents effecteurs, modifiant ainsi la concentration intracellulaire de seconds messagers comme l'AMPc ou le calcium. Cette vision classique de la signalisation s'est par contre complexifiee au fils des annees et on sait maintenant qu'en plus d'interagir avec les proteines G, les RCPGs s'associent avec une multitude d'autres proteines afin de transmettre de facon plus specifique les signaux extracellulaires. Comme ces nouveaux partenaires d'interaction sont generalement specifiques a un recepteur ou a une famille de recepteurs, on peut imaginer que les complexes proteiques regulant la fonction d'un RCPG vont etre differents d'un recepteur a l'autre. Ainsi, pour bien comprendre comment fonctionne un RCPG, il devient primordial de connaitre les proteines interagissant avec celui-ci.
Nous avons done entrepris d'identifier de nouveaux partenaires d'interaction pour certains recepteurs utilises comme modeles dans notre laboratoire, soit les recepteurs DP (recepteur de la prostaglandine D2), TPp (recepteur du thromboxane A2) et P2-adrenergique. Pour chacun des nouveaux partenaires d'interaction identifie, nous avions aussi comme objectif de determiner le role joue par celui-ci dans la fonction du recepteur.
46 RESULTATS
MANUSCRIT#1
ANKRD13C DISPLAYS CHAPERONE-LIKE PROPERTIES TOWARDS G PROTEIN-COUPLED RECEPTORS
Audrey Parent, Marie-Claude Lepine, Sebastien J. Roy, Pascale Labrecque, Maxime A. Gallant, Deborah Slipetz et Jean-Luc Parent
Soumis a Journal of Cell Science (avril 2010)
CONTRIBUTION
J'ai participe activement a Pelaboration du projet et j'ai realise la majorite des travaux presentes dans cet article, mis a part le criblage par double-hybride, l'essai de liaison in vitro avec les proteines purifiees et le clonage des constructions d'ANKRD13C avec les epitopes en N-terminal. J'ai fait le montage de toutes les figures et j'ai aussi redige le manuscrit.
RESUME DU MANUSCRIT #1
47
Bien que les mecanismes qui regulent le repliement et la maturation des recepteurs couples aux proteines G (RCPGs) nouvellement synthetises soient cruciaux pour leur fonction, ils demeurent peu caracterises. Lors d'un criblage par double-hybride visant a identifier de nouveaux partenaires d'interaction pour le recepteur DP de la prostaglandin D2, nous avons repeche ANKRD13C, une proteine de fonction inconnue. Des essais de co-localisation en microscopie confocale avec un marqueur du reticulum endoplasmique (RE) combines a des experiences de fractionnement cellulaire et a la demonstration qu'ANKRD13C interagit avec la queue C-terminale de DP suggerent que cette nouvelle proteine est associee a la face cytosolique de la membrane du RE. La co-expression d'ANKRDBC avec DP augmente les niveaux d'co-expression du recepteur alors que l'inhibition de l'expression endogene d'ANKRD13C les diminue. Des essais de marquage metabolique au 35S ont d'ailleurs montre que cette augmentation dans l'expression de DP est due a une inhibition de la degradation des recepteurs nouvellement synthetises par ANKRD13C. Une co-expression prolongee d'ANKRD13C avec DP induit par contre une retention dans le RE des formes immatures du recepteur et leur subsequente degradation par le proteasome. Nous avons aussi observe une regulation de l'expression d'autres RCPGs (CRTH2, TPa, recepteur p2-adrenergique) mais pas des autres types de proteines testees, ce qui demontre une specificite d'action d'ANKRD13C envers les RCPGs. Les resultats de cette etude suggerent done qu'ANKRD13C est une nouvelle chaperonne pour les RCPGs, aidant initialement au repliement des recepteurs nouvellement synthetises mais pouvant aussi induire leur retention dans le RE ainsi que leur subsequente degradation par le proteasome.
SUMMARY
48
Although the mechanisms that regulate folding and maturation of newly synthesized G protein-coupled receptors are crucial for their function, they remain poorly characterized. By yeast two-hybrid screening, we have isolated ANKRD13C, a protein of unknown function, as an interacting partner for the DP receptor for prostaglandin D2. Co-localization by confocal microscopy with an endoplasmic reticulum (ER) marker, subcellular fractionation experiments, and demonstration of the interaction between ANKRD13C and the cytoplasmic C-terminus of DP suggest that ANKRD13C is a protein associated with the cytosolic side of ER membranes. Co-expression of ANKRD13C with DP initially increased, while siRNA-mediated knockdown of endogenous ANKRD13C decreased receptor protein levels, respectively. Pulse-chase experiments showed that ANKRD13C can promote the biogenesis of DP by inhibiting the degradation of newly synthesized receptors. However, a prolonged interaction between ANKRD13C and DP resulted in ER retention of misfolded/unassembled forms of the receptor and in their proteasome-mediated degradation. ANKRD13C also regulated the expression of other GPCRs tested (CRTH2, TPa and P2-adrenergic receptor), whereas it did not affect the expression of GFP, GRK2 and VSVG, showing specificity towards G protein-coupled receptors. Altogether, these results suggest that ANKRD13C is a dual function protein reminiscent of chaperones, displaying pro-folding and pro-degradative functions towards GPCRs.
/
49
INTRODUCTION
As the largest family of membrane receptors, G protein-coupled receptors (GPCRs) mediate physiological responses to a vast array of cellular mediators such as hormones, neurotransmitters, lipids, nucleotides, peptides, ions and photons. To be fully functional, GPCRs need to be delivered to the plasma membrane in a ligand-responsive and signalling competent form. The synthesis and maturation of these receptors require a complex combination of processes that include protein folding, posttranslational modifications and transport through distinct cellular compartments of the secretory pathway (Achour et al., 2008). In recent years, GPCRs were found to interact with many proteins besides G proteins and such interactions were shown to play important roles in receptor biogenesis and trafficking. For example, the Drosophila cyclophilin protein ninaA (neither inactivation nor afterpotential A) and its mammalian homolog, RanBP2 (Ran binding protein 2), associate with rhodopsin and opsins, respectively. They have been characterized as chaperones that can facilitate the receptor's folding and are essential for efficient localization of opsins at the cell surface (Baker et al., 1994;Colley et al., 1991;Ferreira et al., 1996). The receptor-activity-modifying proteins (RAMPs) represent another example of GPCR-interacting proteins implicated in the trafficking and functionality of receptors. Association of these transmembrane proteins with the calcitonin receptor-like receptor and the calcium-sensing receptor is required for their transport to the plasma membrane (Bouschet et al., 2005;McLatchie et al., 1998). The endoplasmic reticulum (ER) membrane-associated dopamine receptor-interacting protein of 78 kDa (DRiP78) is also known to regulate the transport to the plasma membrane of various GPCRs including the Dl receptor for dopamine and the
50 angiotensin II ATI receptor (Bermak et al., 2001;Leclerc et al., 2002). Expression of DRiP78 causes retention of the Dl receptor in the ER through binding of a conserved F(X)3F(X)3F motif found in the C-terminus of the receptor.
Our laboratory is interested in the biology of the DP receptor for prostaglandin D2 (PGD2). PGD2 is a lipid mediator produced from the sequential metabolism of arachidonic acid by the cyclooxygenases and prostaglandin D synthases and is mostly known for its role in sleep induction as well as its effects on the immune system and in inflammation (Hayaishi and Urade, 2002;Kostenis and Ulven, 2006). PGD2 is critical to the development of allergic diseases such as asthma (Pettipher et al., 2007;Pettipher, 2008) and recent evidence also suggests a role for PGD2 in bone physiology (Durand et al., 2008;Gallant et al., 2005;Gallant et al., 2010). PGD2 elicits its biological responses by activating two pharmacologically distinct G protein-coupled receptors, the D-prostanoid receptor DP (also known as DPI) and the chemoattractant receptor-homologous molecule expressed on Th2 cells (CRTH2, also known as DP2) (Boie et al.,
1995;Hiraietal.,2001).
Identification and characterization of accessory proteins confirmed that GPCR-interacting proteins can play crucial roles in the biogenesis and function of GPCRs. Therefore, to identify putative proteins implicated in the regulation of DP, we used a yeast two-hybrid screen to identify proteins that associate with its C-terminus. In the present study, we demonstrate that DP can interact directly with a previously uncharacterized protein named ankyrin repeat domain-containing protein 13C
51 (ANKRD13C). We found that this novel protein is localized at the ER where it binds to DP to control its biogenesis and trafficking. Further experiments showed that ANKRD13C modulated the expression and maturation of other GPCRs as well, indicating that ANKRD13C acts as a novel cytoplasmic ER-associated chaperone or cochaperone for GPCRs.
RESULTS
Identification ofANKRDBC
To identify potential DP-interacting proteins, we used a yeast two-hybrid system to screen a human brain cDNA library with the C-terminus of DP as bait. We screened a total of 1,6 x 107 independent clones and out of the five galactosidase-positive clones obtained, one encoded a gene called ANKRD13C. The product of the ANKRD13C gene (Entrez Gene ID 81573, accession NM030816) is a previously uncharacterized molecule. The full length open reading frame (ORF) of ANKRD13C was cloned by RT-PCR using template RNAs extracted from HEK293 cells. The main ORF for this gene encodes a 541 amino acids protein (accession NP110443) containing an ankyrin repeats region (amino acids 113 to 199) and a C-terminal domain of unknown function termed DUF3424 (amino acids 259 to 533) (Fig. 1A). Examination of the Aceview database revealed that ANKRD13C is ubiquitously expressed in body tissues with the most prominent expression levels found in the brain and uterus (Mieg and Thierry-Mieg, 2006). Through Blast searches of the GenBank database, we found ANKRD13C