HAL Id: pastel-00001979
https://pastel.archives-ouvertes.fr/pastel-00001979
Submitted on 28 Jul 2010
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Synthèse et évaluation des propriétés de nouveaux
agents modérateurs de la polymérisation radicalaire.
Nouvelles préparations d’hétérocycles azotés.
Catherine Mougin
To cite this version:
Catherine Mougin. Synthèse et évaluation des propriétés de nouveaux agents modérateurs de la polymérisation radicalaire. Nouvelles préparations d’hétérocycles azotés.. Chimie. Ecole Polytech-nique X, 2006. Français. �pastel-00001979�
!" # $ !" #$% & ' !% ( ) !" $)) ( ( * $ !$ + , - & '('* $
% &'
( "
)
'
)
'
)"(
"*
'
)
" '
) %
'
)
+
)"(
'
) '
) %
' ,) '+
.
SOMMAIRE
Remerciements 7
'
.
) "
)
-.
-
!"
/
'%
&'
'
)
" '
01
-+ ) " ) / 02 / / 0 0+ !" / '% &' ' ) " ' 13 1+ ' * ' ) () &' / )"( ' ' " " ' -405 ) ' ) / '% &' ) % ' ,) ' 31 ! "# $ % & "# $ ' ( ( # ) ( & 3+ ) "' ) 660
) %
'
)
) 7
68
-+ ) % ' ) '' !" .0 * & * $ ( ( & * $ ( ( & 0+ ) % ' ) ) 7 9 : .2 * & * $ ' *+, &&1 , ( ' & - ' 1+ ' ' % ' ;1 * # ( . ( ( * # ( . ( ( ( ( * # ( . ( (% / -0* 1 * # ( ( %( ( ( ( ( ( 1 3+ ) "' ) -<<
1 =
) "
)
#=
> /
'%
&'
?"
)"(
" '"
)
') "@
-<1
-+ ' AA ' ) ' '% &' -<2 "# $ "# $ "# $ 0+ ' ) " '" ) ) % & --< ( # $ ( 1+ % &' ' '" ) ' ') "@ ' AA " ' " @) ) --1 2 ( - % % ( 3+ ) ' ' --; "# $ ' "# $ ' 2+ % &' " ' ) " '" ) -06 "# $ # $ 3 0 6+ ) "' ) -133
%
&'
)"(
"*
'
)
" '
) %
'
)
4
'
%
)5 %
,) ) '
-1.
-+ $ &' " )B -3-4 ) 5 ( 6 0+ ' ) " )B -3. 7 ( ( ( & 8 % ( ( 5 8 " 1 1+ ) ' ' -& ) -23 +( # $ "# $ 6 & 9 3+ ( " ) A) ') 5= -68 0 ( 1 +( & , 2+ ) ' ' 0& ) -;-* , ( , ( , 6+ ) "' ) -;82
AA
'
'
-&
0&
) '"
) %
'
)
-8--+ ( " ) ' ) ' ' ' ' ) ) & ' -81 , 1 +( 1 , 0+ ( " ) " ) 7 ' ) % ' ) ' / --<C 0<2 2% # $ % $ 2 ( 6 +( ' & , 1+ ( " ) " ) 7 ' ) % ' ) ' / -1<C 0-82 ( 6 # ( ( # ! # 2 ( 6 # ( # $ +( ' 3+ = %' ' ) ' 01; 2 ( 0 !8 " +0- 1 2+ ) "' ) 03<
6
)"(
' ' " " '
'
( '
031
-+ % &' ' ' 1& ) 036 9 ( # ( 6 "# $ # # ) 0 + ! ! ! ) 0 + ( # , * % 0+ % &' % ' '" A) ' 026 5 "# $ , 1+ % &' @ ,)A" ) ' 060 5 "# $ ( # ) ! ! "# $ ( # ) ! ! &) "' )
0.2
*
0.8
2
Remerciements
Je voudrais tout d’abord adresser mes remerciements aux membres de mon jury président et
rapporteurs : Messieurs Bernard Boutevin, Laurent Bouteiller et Daniel Taton pour avoir
accepté de juger mon travail de thèse. Je vous remercie également pour vos conseils et
remarques pertinentes concernant mon manuscrit. J’espère être parvenue à les transcrire au
mieux dans cette nouvelle version de ma thèse.
Je voudrais ensuite exprimer toute ma gratitude envers la société Rhodia qui a financé cette
thèse et tout particulièrement à Claire Pitois et Mathias Destarac qui m’ont encadrée. Merci
pour l’intérêt que vous avez toujours porté à mes travaux et pour vos précieux conseils
concernant aussi bien la polymérisation que la suite à donner à ma carrière.
J’adresse également mes remerciements à l’ensemble des membres du laboratoire de synthèse
des polymères de spécialité Rhodia à Aubervilliers qui m’ont accueillie à bras ouverts durant
plusieurs semaines. Je remercie tout particulièrement Bertrand Pavageau pour son aide
inestimable lors de l’utilisation du système automatisé. Merci également à Catherine
Mignaud et Eric Van Gramberen pour leur gentillesse et leur aide précieuse dans la vie de
tous les jours sur le site d’Aubervilliers.
Un merci tout particulier également à Bruno Boizot, chercheur au laboratoire des solides
irradiés de l’Ecole Polytechnique qui a accepté immédiatement de me laisser travailler sur
l’appareil RPE de son laboratoire. Bien que cette collaboration n’est pas été aussi fructueuse
que prévue, je lui suis très reconnaissante pour son aide.
J’aimerai à présent adresser mes plus vifs remerciements au professeur Samir Zard pour
m’avoir acceptée au sein de son laboratoire et s’être battu pour m’obtenir un financement de
thèse. Merci de parvenir à maintenir au sein du laboratoire une ambiance à la fois pleine de
travail et de bonne humeur ce qui est rare et hautement appréciable. Je n’oublierai pas de
sitôt ce laboratoire exceptionnel !
Si le DCSO est exceptionnel, c’est aussi beaucoup grâce à Béatrice que l’on ne remerciera
jamais assez. Merci Béa pour ta gentillesse, ta bonne humeur et les 1001 conseils que tu m’as
prodigués. Ce fut un plaisir de travailler avec toi, de partager ta hotte, ta paillasse, de
surveiller tes plaques CCM… Merci pour tout.
Enfin si quelqu’un a encore des doutes sur le caractère exceptionnel de Béa, il faut savoir
qu’il s’agit du seul organisme vivant connu à ce jour capable de transformer la cellulose (elle
ne mange que des légumes) en triglycérides !!! Je ne comprends pas que le CNRS ne l’ait pas
encore clonée !
Un grand merci également à Brigitte, notre secrétaire. Des difficultés pour remplir un
dossier, besoin d’un numéro de téléphone, d’une adresse ou tout simplement d’un
conseil…pas de problèmes, Brigitte est là. Alors, merci Brigitte pour ton aide et je croise les
doigts pour l’ouverture de ton salon de thé. Dès que je rentre de Philadelphie, promis je
passe y faire un tour !
3
Bien sur, je ne peux pas, dans cette partie consacrée aux remerciements, ne pas avoir une
pensée émue pour tous les étudiants du DCSO avec lesquels j’ai eu le plaisir de travailler
durant ces 4 années. Bien plus que des « collègues » de labo, bons nombres d’entre eux sont
devenus de véritables amis que je ne pourrai pas quitter sans verser une petite larme.
Heureusement que cette fois-ci les remerciements se fassent par écrit…cela me laisse une
petite chance de réussir à aller jusqu’au bout !
Dans le souci de n’oublier personne et de ne pas froisser les susceptibilités des uns ou des
autres, procédons labo par labo :
,
:
/
;
8<3
(
' )
6
=
>
'
4
=
? ) )
@
Merci tout d’abord à Soizic qui m’a supporté avec calme et lucidité pendant ces 4 années.
Des soirées enflammées au Memphis, on a passé. Le 20 décembre, bien à toi je penserai.
Bonne chance ma grande !
Merci à Nico, le préféré de nos « fayots ». De toutes nos secrétaires, il est le Zorro et de loin,
le plus dévoué pour aider les membres du labo.
Garde ta belle énergie et ton sens de l’organisation et rendez-vous vendredi pour un petit
tour de la circulaire et une bonne douche ( ) !
A Michiel merci, pour ses conseils avisés en chimie.
Allez, arrête un peu de râler et viens prendre une petite bière …
Merci à Twana, le seul à être entré avec moi dans le monde merveilleux des polymères
Rhodia. Il ponctuait avec fracas, chacune de nos rencontres d’un « ca polymerdise ou quoi
?».
Merci aussi à Inès, sa tortilla et son délicieux accent et à Camilla et ses tenues improbables.
Enfin merci à ceux que le destin ne m’a pas permis de mieux connaître Ali, Adi, Olga, Can et
Matthieu.
5
%
$%
/
=
%
A
BC
4
Merci à Aurélien, cowboy des temps modernes qui dégaine les CDs aussi vite que les
piluliers. Mais où étais-tu pendant toutes ses années où sans toi, dans ce labo, je me suis
retrouvée ? Dommage que tu aies temps tardé ... Ta bonne humeur, j’ai beaucoup appréciée.
Thomas : ta vision très expérimentale de la chimie m’a fait bien peur plus d’une fois. Mais
toujours de petites blagues, la journée tu agrémentas et plein de réactions sympas, tu me
montras. Merci Thomas pour tout cela.
Notre cher Alejandro : de la chimie il est accro. Chaque soir, je culpabilisais de partir si tôt
alors que lui campait au labo. C’était un sacré numéro !!
Merci Alex pour ta bonne humeur et les conseils précieux que tu m’as prodigués. Tu as
toujours été pour moi un modèle de travail et de persévérance.
Ah petite Celia : ma partenaire de galère face à ces garçons-là (et surtout face à leur
musique) ! Le petit rayon de soleil du labo 2, pour moi tu resteras et ton enthousiasme jamais
ne s’effacera. Bonne chance et merci à toi.
Merci également à Jean-Pierre et ses électrodes. Pas toujours habillé à la dernière mode (c’est
du fait de « son grand age »…euh, je veux dire de « sa grande sagesse » !) mais toujours prêt
à l’exode !
Merci enfin à ceux qui sont partis trop tôt ou arrivés trop tard et que je n’ai pas eu le temps
de bien connaître. Je pense à Graziela et sa gentillesse, Juan-Carlos et sa galanterie, Igor et
ses tubes à évaporer, Alexandrew et sa Kristina.
5
(
'
6
0
E (
# >
F
B
7
$
(
G
'
%
( B
Que dire sur Myriem, sans provoquer sa colère … en effet, cette fille au fort caractère
supporte difficilement les impairs. J’ai cependant apprécié sa compagnie : ces rires et ces cris,
dans les labos, m’ont souvent réjouie et sans elle je n’aurais jamais atterri ici. Pour tout
cela, je lui dis un grand Merci.
Merci à Gillian, notre petite écossaise à la gentillesse sans pareil. Tout enthousiasme m’a
ravie…et passe le bonjour à « Annnnnnndy ».
Mille mercis à Jon et sa toute petite voix qui, pour mon postdoc, souvent me conseilla. Je n’y
serai jamais arrivée sans toi. Merci.
Julien : en seulement 6 mois parmi nous, tu nous a re-motivé un grand coup.
Merci pour ton dynamisme et tes nombreux conseils.
Markus (dit couscous). En plus d’être un as de la chimie, ce jeune et brillant postdoc
allemand a développé une qualité insoupçonnée, celle de parvenir à supporter notre Mimi,
un an sans (trop) broncher.
Rien que pour cela je te tire mon chapeau.
Une petite pensée également pour Grégory, Dominique, Edzer, Emilie (je penserai bien a toi
en février !), les 2 Dave, Frédéric et Lisa.
Enfin, bonne chance à Diego, Nahid et Yann qui débutent.
0
6
! !
=!
H
6
# (
6
'
%
' ;
%
I
(
H
,
'
6
(
>
Un grand merci tout d’abord à Aurélie. La bonne humeur et l’exubérance qui te
caractérisent, sont des grands bols d’air frais qui nous re-dynamisent. Sans toi, aucun
« Téléphooone » et « à taaaable » ne rétentissent. Qu’est ce que cela est triste !
J’ai également apprécié les nombreuses soirées passées à tes cotés.
Mieux que Billetreduc et Ticketac réunis, Lilie est la reine des soirées théâtrales réussies.
Que dire à présence de sa comparse Lucie, brin de femme pétillante et sportive, toujours prête
à rire entourée de convives. Merci pour ta joie de vivre communicative.
Merci à Xavi dont le calme et la gentillesse face à ces 2 furies, resterons légendaire… à mon
avis.
Merci à Cong et Raphael, les 2 inséparables. Votre complicité et votre bonne humeur font
plaisir à voir. Et puis…voilà enfin quelqu’un qui a accent de l’Est plus marqué que le mien.
Quel soulagement !
Merci à Gilles ...pour le café ! Merci pour ta bonne humeur et le coté fédérateur que tu as
apporté au labo.
Merci à Cécile et Trévor pour leurs conseils de la 1ère heure.
Une petite pensée pour la « petite » Delphine, ses rendez-vous chez le médecin et ses kilos
d’oranges…, pour Shuji « Yeh, Yeh », Kristina, Mehdi et Rémi.
'(
' ; (
Un grand merci tout d’abord à Dédé pour sa gentillesse et son amitié. Nos soirées DVDs,
nos courses effrénées, nos soirées endiablées …jamais je ne les oublierai.
De plus, grâce à toi on a tous appris, la faune et la flore d’Australie. Dommage, 1000 fois
dommage que ton postdoc fini, nous ne puissions être réunies. Mais t’inquiètes, je pourrais
aussi, te faire admirer la flore de Philadelphie !
Merci à Julie, dont le dynamisme irradie au-delà du Mississippi (et du labo 5 aussi !).
Alors courage la fin de la thèse est proche.
Merci à Patrick pour sa jovialité.
A noter, qu’il s’agit du seul être animé capable de converser uniquement par onomatopées !
J’espère que, ou que tu sois, tu as trouvé ta voie.
Merci à Andrea, si dévouée et prête à tout organiser.
Cette jolie poupée toujours calme et pomponnée est toutefois remontée à bloc…quant elle se
voit refuser un JOC !
Merci à Florin, qui sait rester calme et serein en toute occasion.
Merci à Fabien pour les conseils qu’il m’a prodigués au cours de ces années. Bises à Maëlle.
Merci enfin à Sharan, Stéphanie, Jacques Alexis et François.
Je voudrais à présent remercier mes amis du « Dream 118 » qui me supportent depuis déjà 7
ans. (C’est quoi un ami ? C’est quelqu’un qui te connais mais qui t’aime bien quand
même…). Alors un grand merci à Adrien, Oliv’, Maud, Sofy, Djoul, Adeline, Jack von Jack,
Alexissss et PAC. Je vous souhaite de réussir dans vos différents projets.
Je voudrais enfin remercier mes parents et ma sœur pour leur soutien. Vous m’avez laissée
libre de choisir la voie que je voulais suivre sans même savoir où tout cela allait me mener !
Merci pour cette confiance sans faille.
.
Abréviations (Partie théorique)
Unités 5* & * * 6 & & 0 7 8 ) ) , * 9 /): ; % 6 , , -Groupements chimiques ' ' < '**% =>= :'? : :9 < - ; '$ % =>= :'? : :9 < ; ' ' : 6 @ A ' ' < ' ' < < : < < 9 !*9!;:; > :&* > :& - -&) < ) < &,' 1:& -< < &,B & -< @ &, ! & -< @ < -< , -< -
-1 : < )&' & < -* ' ' : - ? CA ,,' , - < -< , , -< , , < 9* . ! :; % -: - - < < < 6 < 6 &, : < > -< < : < , ! > > > : -< :-: < B -< @ ,0 -< , -< < B' ' @ A D* ,' , - < : < < 9 :* . -:; < 9 :* . - ! :; # ? :9 :*< : >.: -< : : < ? ;: >1: -< : Autres Abréviations E & - A 9 ; F *- @@ @ ' ( ' @ ( < ? **, *- - * - , * *- - A / / * 9,; , 9 G; 9 G;/ & 6 G> H < 6 9 ;
/ !,! ! -7 * 8 * A $ $ $ $ < $( $ @ )",! ! ,'&$I , & $ - @ I -, : @ , :' ) & $ ? : !@ B - J -A < 6 / , , < < 6 9 / : ; , , < < 6 9 / : ; %, % , < ? (* < ( * A / ( A @ ( ('B ( ' B - @ ($ $ ( @ (,% ( , A % ( ( A A !,! ! : - K - A "# "
2
4
Introduction générale
* @@ @ +'(&> * $ !$ , - & '('* (- / A > A 0 4 > @ J - < -< / K A > 8 - 4. H 6 8- -/ ) 6 H - / @@ > @ - - H @ < / $ - A A 9 ;> L 9 @ ;> > M * A H 42 A - H - / ) < :, * > A < N > > A - A O < -6 / " - @ : / ' @ > @ -- > A < @ @ P > @@ / & > - A < -6 / * > @ 3 @ < A < -6 < 6 > 0 > ,/ J 9 , " /> -8<<> > 2 2/@ / $ 9 A > > - ///;/ 443> / / + (- 6 @@ Q < > - - / * - A R -,'&$I 9,' & $ - @ I - ;/ , -6 H @ > A A < > @ < 6 < / * @ P J & - > R A A -R > > - -/ % - H < -6 - < A / ) - H < @ P / ) < < Q / ' 6 - > R < ,'&$I H < -6 / ) R @ A @ A < > < -6 / ) - 1 H A R -6 / ) - 1 H > < -6 9 - 1; 9 - ; @ < / * > /S *- > &/S > /S + > /+/S , - > &/ T!43 3421> -88; S , 9 > . J 3 3/
N @ > - > A @ / ) > 6 H / * / ) J " - > + " )/ > / ' > - 1 < - U -/ O N O N O O 4.14-ts A < -6 > / ' > > - 1> < - V / O N O 4.29
.
-!"
/
-
!"
/
'% &'
'
)
" '
1. Introduction à la chimie radicalaire
1.1. Généralités " @ / $ O > - -A 9@ : ;/ * H / CH3 radicaux libres O radical anion N radical cationFigure 1- 1 : exemple de radicaux libres, anions et cations
) @ > A @@ 6 - A 9 ;> H : O 9@ : ;/ * O < J A / *:* / ) / * : A -< 6 = / ) -< 6 @ > < / ) @ @ :H: < 6 /
& C + C C C & C H C + C C H C H C H + C C ' W < 6 C + O2 C O O
Figure 1- 2 : Réactions de base des radicaux libres
$ < J @
> A 6 - 6 @@ / N H
- 6 A /
1.2. Les radicaux fugaces3
/ / / & ) H : O A / ) X @ Y @ H :. / * R / A 6 @ > O / * O H @@ -< R H @@ 9@ :.;/ & > @@ < A 9 @@ : @1;/ . ) R @ J B <> N/S ) @ > &/S > N/ 6 > , > > -881 - 6 -< - A @@ @ + / 1 < > )/S > )/ 8 /> -8;2> > 214/
2 SOMO π* (C=O) substituant électroattracteur O O SOMO Doublet X X X substituant électrodonneur SOMO Doublet X π* (C=O) O X Effet captodatif
Figure 1- 3 : Stabilisation du radical par mésomérie en présence de substituants électro-donneurs et attracteurs
$ A H A A - A @@ !,! / ) > A H > H !,! / / / / ( ) @ > 6 @ > A @ / $ A < 9' ; J R + A=B R-A-B @ R + A-B R-A + B Z:@ R-A-B A=B + R R-A-B A-B-R
3 * @ J - A > A / * Q - A ) @ - A / $ - 9F ; H - 9F [;/ ' > ( % ( ' % 6 ' = ' ' % % K / @ :1> A @ -< 6 -+ A 9 & ; @ / Ph + R-H Ph-H + R (: 7 9,: : ; /. ./. & 97 D ; 43 4 4
Figure 1- 4 : Exemple de contrôle enthalpique, abstraction d’hydrogène par Ph./ 32C
B A 6 ' 6 ' L ( ( ( ( % 6 ( 6 (/ * A A > @ : > 9-+-; < < A / ) -+0 -+1 R O / 0 > / 9 M , 7 2 2 /> -8;1> > 2. B - > /S ( > )/ 9 M , 7 2 2 /> 0<<-> > .1 / ( U -/
4 O N O NO O CN O N O CN CN O N O CN O N O CN O N O NC
X
X
1.1 1.2 1.3Figure 1- 5 : Influence de l’effet stérique sur l’addition du radical isobutyronitrile
* @@ A A A A @ Z 9@ : ;/ R1 R3 R2 favorisé défavorisé
Figure 1- 6 : Attaque d’un radical sur une oléfine substituée
@@ ) 6 / * > 6 - -/ &6 > > @ - / * @@ O A - @ 6 / @@ > @ :.> @@ !,! J 6 - / $ @
. @ !,! - J H @ -9@ :2;/ ' > > A H > H !,! A A 6 6 - / $ @ @ )",! J :H: @ / SOMO
Cas d'un radical électrophile O
LUMO X
Cas d'un radical nucléophile Donneur
HOMO
SOMO
attracteur
Figure 1- 7 : Réactivité des radicaux nucléophiles et électrophiles
* @@ R Q R
@ /
' 6 @
< -6 > R
/
1.3. Les radicaux persistants et stables
/./ / & ) H :. / " O @@ J @@ - < A \ H > -+3 9@ :3;/ ! /
. @@ A \ @ > -+2/ ! /2 N N O2N O2N NO2 1.4 Si Si CF3 1.5
Figure 1- 8 : Exemple de radicaux stables et persistants
) 4 0 3J - < -< 9 -.*+;/ &6 > < - / $ R A 6 @ / /./ / ( ) 6 A : O A A / & > @ A A O - / / & > @ 6 / * -< : < ? 4 @ :4/ N N Ph O N N Ph O NO2 O2N 2 NO2 NO2 25°C
Figure 1- 9 : Dimérisation réversible du radical dihydro-pyrazolone
2 0 > &/S $ > 8/ 9 , + /> -8.6> 1> .: 4/ 3 0 > ,/ J 9 , " /> -8<<> > 2 2/ 4 ] > (/S ( > ,/S T > &/ , D /> -8.1> > 2 2: 23 /
. ) 6 @ :H: < 6 @ / '@ @ O - C X Y X Y> R > > @ P > X Y @ H @ / N A 6 A 6 H @ / /././ ) @@ ) @6 :H: @ H @ 6 A @@ / source R source Y R + R R2 Y + Y Y2 R + Y R-Y (1) (2) (3) (4) (5)
Figure 1- 10 : Réactions mises en jeu dans l’exemple considéré
$ (+ ^+ O > ? (:%_%:^/ J (+ ( 9 9.;> @ : ;> ^+ ^ 9 91;; (+ ^+ (:^ 9 9 ;;/ ) ( > ^ (:^ A / $ G> G G/ B - > / , + %/> 0<<-> > . 3 :. + > /+/ + + N "# > ! @ *- < , > 0<<1/
.. * H A ^+ / ) 91; A > ( (:^ O @ ..G 2G/ ! > @ A : (:^/ * : ` > - A > (+ ^+ V @ ( (:^ D / ! > (+ V ^+ / * - 6 9 ; 9.; R A H A a H (+ ^+/ &6 > (+ H < - 6 (:^> 9.; / $ @ A : (:^/ @ > @@ - 6 A @ A A @ > / ) @@ A 6 > -/ $ < / % - > @@ < / & 6 - > R - H @@ < 9 @ ; A / ) - O 6 H -@ < - / ' 6 6 - V @ > - -/ K A @@ - A J + > /+/ + + N "# > ! @ *- < , > 0<<1/
.1
2. La chimie radicalaire appliquée à la synthèse de petites
molécules
& 6 > @ R A J @> 9 ; @ 9 ; 9 ; 9 ; 6 / 6 @ @6 6 H @ > - V / $ < R H - H @ A /2.1. La chimie radicalaire par propagation de chaîne
/ / / ) - V 9@ : ; J P A 6 / @ H @ @ - < A 6 - / ) - : H H A / ) D Q H A / & > A : - A A 6 (+ / A 9 ; @ / ' @ > @ 9( I; 6 9(+; A - V / A @@ J / H 6
. - V / * O / > @ 9 a - ;/ R R' R-X = ) D ) ) R'-X produit de départ produit final ') A + B A-B A H + B A + BH R-X
Figure 1- 11 : Mécanisme radicalaire par propagation de chaîne
/ / / , - -< ) -< < @ < -/ $ @@ - V : 9@ : ;/ Bu3SnH ) D Bu3Sn R R' ) % ' ) +++ R'-H R-H R-X Bu3Sn-X Bu3SnH Bu3SnH
. * @ @ . + H -< 6 @ : / ) < (:I 9 a I @ A - 6 > @ > ; (+/ * @ P @@ J -< < @ (: < A - V / * @ A @@ - / O @ A 6 H ( +/ * H -< < ( : < A - V / - O > -R / @ 6 H @ @@ - 6 A 7< > < < / $ @ A (+> > -< / * > @ A @ > A @/ * / ) O @@ @ A @ @@ 6 6 / @ > A 6 @ > A / / /./ , - @ ) - @ H @ - V > - 9I; @ @ ) '$ % A 6 : - H 3 5*/
.2 / * @ I/ $ > H > O R A / & @ > 8- -/ ) @ : . A / R = ) D R' ) % ' ) +++ R'-X R ) R-X R-X R-X R-X
Figure 1- 13 : Mécanisme radicalaire du transfert d’atome ou de groupe
' 6 P > (+ J > > @ (+ (:I/ * A / $ > > O @ A ( +/ * ( :I @ (+A - V / ) @@ H @ (:I/ & - > > < / * @@ @ > / @ @ > R H 6 H - - /
.3
2.2. La chimie radicalaire des xanthates
) - 9@ : 1;> - >
6 @ 3 + / .
S O S R1 R2
Figure 1- 14 : La fonction xanthate
' A H 6 6 > - A / & R > @ A A @ - > @ *- / ) > A A > @ @ + / 6 ( + !:( @ - 9@ : ;/ ) @ + > A H > H ( + :( @ - / * - > A > A R H / S O S R1 R2 rupture de la liaison O-R1
R1
rupture de la liaison S-R2
, (% ( D , (% (
R2
Figure 1- 15 : Deux aspects de la chimie radicalaire des xanthates
/ / / ,
) @ - @ :
J
.
.4 S O S R1 R2 In In = ) D S O S In R1 R2 R2 S O S R2 R1 R2 ) S O S R1 In R'2 ) % ' ) +++ S O S R'2 R1 R2 S O S R1 R2 1.7 1.8 1.9 S O S R1 R'2 1.10 1.6 1.6
Figure 1- 16 : Mécanisme radicalaire du transfert de xanthate
) $ + @ - -+6 H @ -+./ * : @ / ) 6 H @ $ + :$ > H @ ( + !:( 6 H @ ( + :( / '@ @ @ A ( +> J '@ $ +> : O - A ( +/ * A 7 # 6 / * A < < J 9* .9* ; *!!; / $ H @ $ + @ * .9* ; +> 6 > - A /
1 '@ @ ( +> : O > > -A ( +/ , ( 6 + / > ( _ -< @ !:( / " @ :( @@ > ( + @ P @@ J $ @ - < --+; A @ ( + - / ) @ A @ > A / ' A > / $ @ ( +/ ) ( + A H @ - < --+8 A > 6 > @ H ( + ( +/ ) @ @ A - > 6 + + 6 +' +/ > @ ( : -+8 6 H @ -+-< ( + A - V / 0 > H @ @ -( ( > 6 @ 9 - / 2;/ S O S R1 R2 ( ) 'A) ) R'2 'A S O S R1 R'2 R2
1 / / / ' - -) - A R > < - A > - - / * J A / ) - @ / $ - 6 - 98b : *9 ;! ;/ @ H c A @@ @ @ -6 A / ) > - -< > H / ) < 6 @@ @ / ) 6 R @ - / $ 6 O A A / $ @ - A @ / $ A - A H < -6 A @ / N H - - H / / /./ ' < -6 < -6 ) - -< -6 ' ) 19@ : 3;/ 1 > )/S ) > '/S K : > /S + > /+/ 9 M , 7 2 2 /> -88;> &> 3: . /
1 N O MeO2C CO2Me N CO2tBu O EtOC(S)S DLP (cat) benzene, ∆ N N MeO2C CO2Me O CO2tBu EtOC(S)S O DLP (stoech) iPrOH, ∆ N N MeO2C CO2Me O O H H H CO2tBu 65% N N O H H H H matrine 1.11 1.12 1.13 N N MeO2C CO2Me O O H H H CO2tBu 1.14 1.15 iPrOH 31%
Figure 1- 18 : Synthèse de la matrine
) A J -+---+-0 < - - -+-1 S < -+-3+ * - @ -< 6 -+-2> > / * < -6 A A J @ > 9 ; Q @ @ / ' H < -6 " B < -6 / ) < -6 @ < H 3 - V < - / A < A 9@ : 4;/ A > / S > B/ S + > / +/ N /> 0<<1> > .> . :. 3/
1. O O H O SC(S)OEt DLP (cat) 1,2-dichloroethane, ∆ 60% O O EtOC(S)S O O OH O O OH pleuromutiline
Figure 1- 19 : Formation du squelette tricyclique de la pleuromutiline
) - @ - 6 O - 6 @@ @ 6 *:*/ ) A R < - A @@ > A - H -@ / ' A > R - H < - A - - H / % - < -> : 6 O - < A /
3. La chimie radicalaire des xanthates comme voie d’accès à de
nouvelles structures 1,2-diones et application à la synthèse
d’hétérocycles azotés
3.1. La structure 1,2-dione ./ / / & " > : @ - A < = / $ @ J < A @ < -< A @ < / 9@ : ;11 R H O O R1 R2 O O
forme glyoxale forme dione
Figure 1- 20 : La fonction 1,2-dione
$ < -6 / ) H < = 9 9 ;> @ : ;/ ) @ < / ) H < / ) @ < O 9 9 ;> @ : ;/ R1 O R2 SeO2 ou KMnO4 dioxane/eau R1 O R2 OH oxydation R1 O R2 O (1) R1 R2 dioxane/eau KMnO4 R1 O R2 O (2)
Figure 1- 21 : Synthèse de 1,2-diones
) @ < > : -A @ < A =/ &6 > @ - A @ < > A - @ B * @ > O @@ > : @@ / & > @ @ > R @ < @ / " @ > : @ < -6 A R O / * A H < -6 < ? < ? /
1 ./ / / < -6 < ? ) < ? < A H - V ? . 9@ : ;/ ) A ( ( @ O < A > ? ? / N H N R3 R2 R1 N H N R3 imidazole benzimidazole
Figure 1- 22 : Le noyau imidazole
) < ? 6 - A @ A / 2 * < -< A > - 9@ : .;/ NH2 NH2 R HO O N H N R 200°C
Figure 1- 23 : Synthèse d’une benzimidazole par addition d’une diamine sur un acide carboxylique
* O < - -( ? ? U 7 3A H A -< < 6 > : 9@ : 1;/ N H N R3 R2 R1 R1 O O R2 NH3 NH3 R3 H O
Figure 1- 24 : Synthèse de Radziszewski des imidazoles
< ? 8 ?7<> '/(/S ( > */T/S > /B/8/ , % < # , # 77> # .> 22: / 2 ! > ,/S , > /S 7 - - > 8/S - ? > /S 8 > /S , < - > '/S - > ,/S U > 8/ J 0 , /> -8;.> > 1: 3/ 3 @ > 8/ 8 # # > * 7 7 ) % % $ - $ /> % U ^ 7> -821/
1 * A > > < -< ? / ./ /./ < -6 < < ? 4 ) < < ? < A H - V ? 1 9@ : ;/ ) A ( ( @ O < A > A / N N R1 R2 R3 R4 pyrazine quinoxaline N N R4 R3
Figure 1- 25 : Le noyau pyrazine
* A @ / $ 9b;: 9-+-6> @ : ; A / ) -+-. @ A , > A ' ? / ) -+-; @ A - ' > > O < - A / N N O Me OH HO N N N N N N HN SEt (+)-septorine 1.16 1.17 1.18 Ohexyl
Figure 1- 26 : Quelques exemples de composés portant un noyau pyrazine
4
< < ? 8 ?7<> '/(/S ( > */T/S > /B/8/ , % < # , # 77> # > ..: 23/
T > N/S , > )/S * > &/S < > B/S - > /S U< > /S , -> */S & > N/S > / / J 0 , /> -882> > .1 4:.13 /
% > /S * > /S - > ,/S 0 > 0/S $ ? > ,/S ) - > '/S ( > ,/0/S > '/S & > '/S @ > 0/ / J 0 , /> 0<<2> > 3 .:3 /
12 ( > A - - A # 9-+-8> @ : 2; A α1β @@ A A / ) @ A # @ -+0< @ > < / H N N C(O)CF3 O2N NO2 MeOH N C(O)CF3 H2N NH2 H O O H N C(O)CF3 N N H N N N 1.20 H2, Pd(OH)2 96% THF/H2O, 80°C 60% 1.19
Figure 1- 27 : Synthèse de la Varenicline
3.2. Synthèse de nouvelles diones
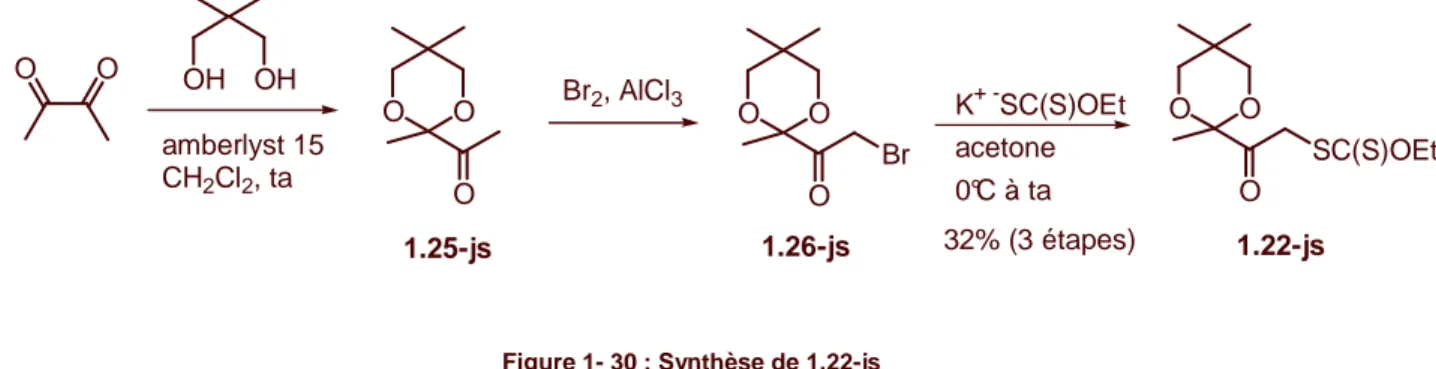
) > : > > A / * > @@ 6 - A / &6 A - - H < -6 / % H - J -+0-5B' A @ -< -+005B' A @ 9@ : 3;/ O O O S OEt S 1.21-js O O O S OEt S 1.22-js
Figure 1- 28 : Structure des deux xanthates utilisés
* N P > H A - - :
/ * A @@ < -6 - /
* > N/T/S 7 > /(/S # > ,/0/S T ?> ,/*/S ' > / /S > N/S > / /S & > /$/S ) > )/'/S B > */ / / J 0 , /> 0<<2> > .121:.122/
13 ./ / / -< -6 -+0-5B' ) - -+0-5B' < - H -< < A 9@ : 4;/ & > @ -< @ -< - -< - / ) -+015B' -+035B' -: @ - < / @ > -+035B' - - / ) - -+0-5B' . G / O H O TMS-Cl O O O O O O Br O O O SC(S)OEt 1.21-js 1.23-js MeOH 40°C à ta 1.24-js 1> LDA, TMS-Cl THF, -78°C 2> NBS, NaHCO3 THF, -10°C K+ -SC(S)OEt acetone 0°C à ta 36% (3 étapes) Figure 1- 29 : Synthèse de 1.21-js < -6 -+005B' ) - -+005B' < - H >.: 9@ :. ;/ & > @ @ > : -< : >.: < / . ) -+025B' -+065B' - 9$$$;/ @ > -+065B' . $ - > /
14 - - / ) - -+005B' . G / O O O SC(S)OEt O O OH OH O O O O O O Br 1.22-js K+ -SC(S)OEt acetone 0°C à ta 32% (3 étapes) amberlyst 15 CH2Cl2, ta 1.25-js Br2, AlCl3 1.26-js Figure 1- 30 : Synthèse de 1.22-js ./ / / ' @ * - @ @ > : - - > ? / ) < < < 9&) ; A 6 : -. H 3 5*/ & - > A : - A 9@ :. ;/ PO OP O R1 SC(S)OEt R1= H 1.21-js R1= Me 1.22-js + R3 R2 PO OP O R1 R3 SC(S)OEt R2 DLP (sous-stoech) 1,2-dichloroethane, ∆ 1.2 éq
Figure 1- 31 : Addition radicalaire de 1.21-js et 1.22-js sur diverses oléfines
) J I - ! @ ! &) 9G; ( 9G; O O O 1.21-js SC(S)OEt O O O EtOC(S)S O O O O 1.27-js 31
-+0-5B' O O O SC(S)OEt O O O 1.28-js O 2 -+0-5B' P(O)(OEt)2 CN O EtOC(S)S O O P(O)(OEt)2 CN 1.29-js . -+0-5B' O O O SC(S)OEt 1.30-js 2 2. -+0-5B' 7 O SC(S)OEt O O 1.31 7 3 2 -+0-5B' CO2Et NHAc CO2Et O EtOC(S)S O O 1.32 CO2Et NHAc CO2Et 3 -+0-5B' N O O O EtOC(S)S O O 1.33 N O O 3 -+0-5B' O MeO O O O SC(S)OEt O O 1.34 O MeO O O . 23
-+0-5B' EtOC(S)S O O O 1.35 O O O SC(S)OEt 1.22-js O O O O O O SC(S)OEt O 1.36 2. -+005B' 7 O O O SC(S)OEt 1.37 7 3 % A A - -+0-5B' -+005B' @ / * H / $ H @ @ A < 9 < -6 -+0.5B' -+16; A @ : 6 9 < -6 -+1- -+1.;/ % H -+0-5B' @ < A A Z: 6 9 < -6 -+1<5B'; 6 9 < -6 -+12;/ @ > O 6 H @ / % A < -6 J -+085B' @ - - / * T : / -+11 @ / -+10 A / -+13 A / * 6 A 6 A /
> @ > @ - / $ O @ > @ @ > -A @ / > O @ P @@ H / ./ /./ ( @ -$ - @ - 9@ :. ;/ ) 6 9 - ';> A A > A -< < J '$ %/ ) 9 - ;> > 1 A : - A < < > / ) R > > Q -< 6 / S S O R Et toluène, ∆ Méthode A Bu3SnH,AIBN Méthode B DLP iPrOH, ∆ R H
Figure 1- 32 : Réduction de la fonction xanthate
) J
1
. I - * ( , - ' 9G; ( , -9G; O EtOC(S)S O O O O 1.27-js O O O O O 1.38 4 43 O SC(S)OEt O O O 1.28-js O O O O O O 1.39-js 4 O O O SC(S)OEt 1.30-js O O O 1.40-js 4 O SC(S)OEt O O 1.31 7 O O O 7 1.41 3 O EtOC(S)S O O 1.32 CO2Et NHAc CO2Et O O O CO2Et NHAc CO2Et 1.42 4 92 ; O O O O SC(S)OEt O 1.36 O O O O O 1.43 3 3 ) -6 / $ > A @ A 6 /
1 ) - - 6 / ) - > H H -< > A > @ - / $ @ A A > @ > 6 6 9 @ @ A ;/ ) < -6 -+185B' A @ / 4G < / ./ /1/ *< A " A - - > < < A / * RH A H < -6 / 2 * 6 A @ / ) 9 ; > > @@ < 6 - - A / ) < @ :../ $ / & > - -+33> A : - A 9&) ;> -: < < - < - -+32/ " R -+32 A @ -+36 A < A / * < < < -+3. @ -+3;/ ' > > 6 A : - A < < / ) > '/S K : > /S > /S + > /+/ 8 /> -88.> > 2 4: 2 / 2 )<> /,/S K : > /S > /S + > /+/ 8 /> -888> > ..: . /
X EtOC(S)S R X R X R (C11H23COO)2 X R C11H23 C 11H23CO2H X EtOC(S)S R X R X= O, NR' DLP (sous-stoech) 1,2-DCE, ∆ 1.44 DLP (sub-stoech) 1,2-DCE, ∆ 1.48 1.45 1.46 1.47 + CO2 + acide laurique (C11H23COO)2 C11H23CO2
Figure 1- 33 : Addition radicalaire d’un xanthate sur un aromatique
* :O @@ A @ X Y A -+32/ $ Q @ 6 @ / % A - H < -6 > @ / ) J ' < A &) 9G; ( 9G; N O O O O O EtOC(S)S 1.49 N O O O O O 1.50 2
N O O O EtOC(S)S Br SO2 1.51 N O O O Br SO2 1.52 1 1 N O O O EtOC(S)S MeO2C SO2 1.53 N O O O MeO2C SO2 1.54 1 1 4 N O O O MeO SO2 1.55 3 .3 ) < - 6 / * : A < A X Y 9 -+22;/ ) < 6 @@ A A 9-+22; 9-+23;> 9-+2<;/ $ < - 9-+20; A > > O @ / ) A R J @ > @ - < A > < - @ > : / %
2
H @
- < A ? /
3.3. Synthèse d’hétérocycles azotés
./ / / ) N P / > -+185B' > : - < 6 A < A ' 9@ :.1;/ ' 6 - - @@ @ 6 > H > A -+26 / ' > N P @ A ? ? -+2.5B'/ O O O O O 1.39-js H2N H2N + N N O O 1.56 O O 1.57-js N H N
X
APTS (cat) toluène, ∆ quant.Figure 1- 34 : Synthèse inattendue d’un benzimidazole
" - 3 a > :
- < 6 < 6 < @ - H
@ A H ? ? 9@ :. ;/
3
3 H2N H2N N H N O O NHBoc CO2tBu N H N CO2tBu NHBoc
X
N O Boc HO CO2tBu But-O O N N CO2tBu ButO2C NHBoc EtOH, ∆ + ou 64%Figure 1- 35 : Synthèse inattendue d’un benzimidazole par Pritchard
- A - 6 9@ :. ;/ > ? > : - < 6 O @ < -+2; < A -+28/ ) @ = R < A @ ? ? -+6</ + H2N H2N O O N Boc HO CO2tBu But-O O H N H N CO2tBu N Boc CO2tBu -H2O N H N CO2tBu NHBoc O N H N H N Boc OtBu O OtBu OH 1.58 1.59 1.60
Figure 1- 36 : Mécanisme proposé par Pritchard
"
= @ < / %
4 H N N H R O H N N H R O O H H+ R N N H H N N H R O O -H2O O H H2N H2N R O O O + -MeOH 1.61 1.62 1.63 X +
Figure 1- 37 : Mécanisme proposé pour expliquer la formation du benzimidazole
& > ? @ < > -+6-/ * V @ -+60 - / -+60 > Z ? / & @ @ / & > - > - R 9 - ;/ & > > H A 9-+61:/ % A - H < - / ./ / / < -6 ? ? ? % - H < -6 H @ < < ? A / ) J
$ & * ( 4 9G; N O O O 1.50 Boc H2N H2N N Boc HN N 1.64 3 N O O O MeO2C Ms 1.54 H2N H2N N Ms HN N 1.65 MeO2C 3 N O O O MeO Ms 1.55 H2N H2N N Ms HN N 1.66 MeO 1 N O O O MeO Ms 1.55 N H2N H2N N Ms HN N N 1.67 MeO 1 93 ; 4 ) -6 / $ > A @ A 6 /
N O O O MeO Ms 1.55 H2N CN H2N CN N Ms HN N CN 1.68 MeO CN N Ms 1.69 MeO N N CN CN 9 2; 1 9 3; N O O O MeO Ms 1.55 NH2 NH2 N Ms 1.70 MeO O HN NH O 21 * - < - H @ < < ? 6 @@ A / ) -+62 / @@ > - A A ? ? H @ < A / &6 > ? ? -+62 @ @ / ) / ) > : - < 6 -+2<> -+23 -+22 @@ -+2< -+23/ ) @ -+22 O \ H / ) >.: < H 6 -+22 -+6. H @ - < < /
) > @ ? -+6; > < ? -+68/ * - 6 A 6 @ - A @ < -+22/ * H -< O H @ A < ? 9@ :.3;/ N O O O MeO Ms APTS H2N CN H2N CN N Ms HN N CN MeO CN APTS N O O MeO Ms H H2N CN H2N CN N Ms MeO N N CN CN 1.55 1.68 1.69
Figure 1- 38 : Réaction avec le diaminomaléonitrile
@ > >3: - 6 H @ -+.< R @ -< / & > * 9!, ; H < 6 / * A :O A @ / ) -+.< / ./ /./ < -6 A < ? ' 6 @@ < -6 ? ? ? > < -6 @ A < ? / ' > > < ? > -< / &6 > > > . R H 5*> BD '
. @ < 6 9@ :.4;/ APTS THF/H2O 50°C, 3jours H O O R1 O O O R1 H2N R3 R2 H2N N N R2 R3 R1
Figure 1- 39 : Voie de synthèse des pyrazines et quinoxalines
* @ > H < -6 > > < > > < < ? A / ) J $ & * ( 9G; N O O O MeO Ms 1.55 H2N H2N N Ms MeO N N 1.71 13 N O O O MeO Ms 1.55 N H2N H2N N Ms MeO N N N 1.72 N O O O MeO Ms 1.55 H2N CN H2N CN N Ms 1.69 MeO N N CN CN 34
1 * @ : > A < ? R / ) < ? -+68/ $ A -+.- -+.0 A / $ A H - @@ / ./ /1/ ' < c ( B * @ % @ @ B * @ / @ > -+22 < A - / 6 < A -+.1 -+.3 9@ : 1 ;/ N O O O MeO Ms N MeO Ms OHC N Ms O 1.55 acide 1.73 1.74
Figure 1- 40 : Cyclisation de 1.55 par réaction de Friedel et Crafts
& > J -+22 - H 5* @ A / -+22 . -> H > @ A / -+22 - @@ . R H 5* 6 A ' / -+22 . -> H > - -- @ / ) 6 H / ) A / ' -+.1 -+.3 O /
< -6 -< < % - - H @ < -6 -+38 @ -< < -+.2 9@ :1 ;/ N O O O EtOC(S)S Boc H N O O O EtOC(S)S -H2O N O O SC(S)OEt N OHC SC(S)OEt 1.49 acide 1.75 quant.
Figure 1- 41 : Synthèse d’une tétrahydropyridine
* @ / % < H < - A > @ A @ A A < @ A @ A / < - -< < -+.2 A / ) -+38> H @ A / -+.2 @ P A / * 6 - @ J @ - < 6 -< =>Z: / ? 9 < < 6 =>Z: ;/ $ 6 @ /
4. Conclusion
' - > R - > > H @ P 6 > > @ > / ) - A @ P A @ / % -< @@ @ / $ - -< < @ / '@ - @ -> R - H < -6 > : / % A - 6 @@ H @ / " < A > > < - A A / > < @ > : H < -6 - < A A < ? A / & > ? ? ? / &6 > - H A > H < - - < A @@ A 9@ :1 ;/2 O O O SC(S)OEt N P R1 DLP N P O O O R1 APTS toluene, 110°C H2N R3 R2 H2N N P R1 HN N R3 R2 1> APTS THF/H2O, 50°C H2N R3 R2 H2N 2> N P R1 N N R2 R3 ) ''"' ) ''"' ) !"
Figure 1- 42 : Synthèse de structures hétérocycliques originales en couplant un processus radicalaire à un processus ionique
& > H @ < < < ? 9
A ; ? 9 ? ? ; A
4
0
2
Chapitre 2 : la polymérisation radicalaire contrôlée
) > > R @ R - - A / & < 6 > - 6 H < -6 @ > - @ < Q / N A H > < A - < - / < 6 < A A J ) 6 6 6 6 @ / ) < 6 A < / ) @ A H A @@ Q / , > < A - V < 6 Q - > < < 6 9 < 6 ; < - / & R > < X < Q Y 9 (*; A / ' - > R - H < . A < Q / & > R < < Q A / . " @ - J , > 0/> > &/ / 8 , # + * # ) > > ) > ! @ > 0<<2 ! 0/ * # ) > 1 - > T <:$ > -883/
2
La polymérisation radicalaire classique
1.1. Principe ) A > A A < 6 > 9@ : ;J P 9 ;> > 6 9 ;/ O - A > - - A 9 < ? ;> - - A < : / @ 9.; A > > > J 91; 9 ;/ , ' , b P ' b , , b , , b , , b , b , , DD b , 9 ; 9 ; 9.; 91; 9 ; # _ 7 d'/
e d,e # _ 7 d,/
e d,e # _ 7 d,/
e d,/
eFigure 2- 1 : Principe de la polymérisation radicalaire classique
, 6 / ) < , + - V 6 / , b < 6 A A b 6 / , DD , < 6 6 *_* -< 6 - V / # > # # P > - V < 6 / 7 > 7 7 P > - V < 6 /
2.
1.2. Problèmes liés aux réactions de transfert
& X Y R H / $ @ / $ A < J @ H 9' ;> 6 9,;> 9 ; < 6 9, ; 9@ : ;/ , , , , b @ , b , b @ H W ' b , , :' b ' @ 6 , b , , b , @ < 6 , b , b , ' b , , b ,
Figure 2- 2 : Les différentes réactions de transfert
) 6 @ @@ - V / @ < 9 @ @ - V @;> @@ < < 6 / ) @ < 6 > A H > @ < 6 A @ 9 - 6 : ; / ) @ H @ / $ O @ 6 > @ A A 6 A < - < / ) @@ < 6 / * R / $ > < > A < 6 @ @ /
21
1.3. Problèmes liés aux réactions de terminaison
* < A J / * @@ < 6 / ) @@ A < 6 / @@ > - V A ν9 < 6 @ @; J
(
K
K
)
[ ]
9
[ ]
0
K
×
×
×
=
− −υ
a ' < , 6 / 7 > 7 7 > - V < 6 / @ @ @@ P / % A A ν H 7 D7 D / ' > 6 > ( ( # $ 6 % L # ( ( / ) @@ < < 6 / @@ > -P D D < < V ( # # $ / @@ > > - V < 9 6 ; A - V @ < / & - A A < < - < A R H > / ) @@ < 6 / ) / H @ < 6 A 9 X Y;/ ' $ = = / " - < A A @@ / $ Q @@2
< < 6 A - H
< 6 X Y/ N H /
La polymérisation radicalaire contrôlée (PRC)
2.1. Principe * > X 6 Y < H / Q > / A A A 9 < J # _ 7 d, +ed,e a 7 ; A 9 J # _ 7 d, +e a 7 ;> $ ( $ @ 6 ^+ - V 99.;> @ :.;/ ) P 9 ; @ > > / ' $ < A H @ / ' $ % R A H A H @ / * @ @6 - V - A A < A /2 ' , , b , :^ P ' b , , b ^ , b , , b , , b > , DD , 9 ; 9 ; 9.; 91; 9 ; 7 7 7 7 7 6 6
Figure 2- 3 : Principe de la polymérisation radicalaire contrôlée
7 P < / 7 6 ^+/ 7 6 ( :^/ 7 < / 7 - V < 6 / $ - Q J ) A , :^ @ - < A H 99.;> @ :.;/ @ - V X @ Y 9 ; A , + A 6 9, +;/ $ @ ^ - V , - V , / , :^ b , , b ^:, 7 7: ) @@ @ ^ @ * 9^;_ 7 D 7 / 7 @ ^ - V , H - V , 7: @ ^ - V , H - V , 7 < $ A H (* R - V < 6 @ / &6 > a :
22
6 H < > : X Y
O Q / ) < -6 < 6 H /
2.2. Premières conditions permettant d’obtenir une PRC
) A R 9@ :.; 6 H A A Q < J @ < 6 > A 6 ( # $ ( ( ( L / * @ P J P 7 O O A 7 & @ A < : - V > (* J. A Q @@ > @ A # $ ( ( % 6 ' # ( J 7 O H 7 / ) 6 R O H 6 @ @ / > > > A 6 ( ! O ( = 6 ( ( ( ( > > A 7 H 7 99.;> @ :.;/ > @ A A P Q K RK 9 : )/ : ;/ & > 6 6 - H < 6 / * < - / & @ A < @ @ ^> (* J . 9 % , R % + * # ) > '* < 3 1> ' *-<> 8/ , <R ? U 7 /> 0<<1/
23
# $ L ( ( % 6 '
# ( J @ ^ - V H O
H > H A * 9^; O H /
2.3. Conditions déduites de l’effet radical persistant
& < Q : - V > ^+/ % A : @ - V / % /. A > H (*> - < Q A H R > < / N A A (* A / /./ / 6 B - .. A A (* A 6 / @@ 6 A (*> @ / ) @ :1 .1 a d,e 6 > d$e - V > d^e : > d(e d e < 6 X Y/ > ,+ ^+ A @ 6 / . @ > A - /# ! > / S ^ - > ,/ S ? 7 > / 0 K , + , /> -8;0> > ..: 1 ! > / J * # " * 9 / * # , /> 0<<<> .3> : . / .. > ,/S B - > / 0 > 0<<<> > 2.23:2.41 B - > / , + %/> 0<<-> > . 3 : . / .1 '@ > 6 - J 7 _ 3,:> 7 _ ,: :> 7 _ / 2 ,: :> 7 _ 1/ :. :> d$ e_ / ,> d, e_ ,/
24 Figure 2- 4 : Evolution des concentrations des espèces lors d’une PRC35
* A @ ( ^+ / K ( @@ 9 :1 ;> @ < 6 6 (/ * A ( A ^+ / ) 6 ^+ ( -@@ / &6 - V ( O @ A / " @ A A < A 6 6 > < > 6 / H - V 6 J $ A @ V 6 A > > (+ H @@ Q < / ) < Q A @ A @@ / $ H < / . * @ @ @@ B -, > @ 2.3 /
3 $ > < > A < A 6 6 / ) 6 @ 6 / * - 6 d$e A < / ' < > J ^+ (+ R / % A A ^+ / ! a ^+ A 6 > A d^e d$ e 9 6 ;/ $ A A @ A < @ A H - A d^e f d$ e/ * A J K K 7 P e d << 9 ; e d7 << P 9 ; e d7 K K ≤ × 9.; 7 J 6 7 J 6 : 8_7 D7 J A @ 7 J - V /./ / ) V (* B - A 6 < / &6 > @ H < < > >
3 B - > Q A / ) J ) J . .
.
e
d
/
e
d
e
d
K
K
7
K
K
0
0
=
×
6 A 7 > A 9d, eDd,e; D./ A > 7 < 6 < - > > 6 A (*> AS0 TRS0TC % ( % ( ) < 9, ; ) - V < 6 J(
)
(
K
)
7
0
0
U
−
−
×
×
−
=
e
d
e
d
e
d
0 # $ $ & > > 0 % ( % % $ ) < 9$ ; ' > < J .d
e
e
d
e
d
+
+
=
K
K
K
7
K
0
7
7
π
) O < d$ eDd, e @ - V < 6 / % A A (*> 7 6 ' ( =3 2.4. Notion d’iniferter 36 H < (* A > R @ 6 H < Q / % R A H < : 6 @@ / $ A O H @ H < : / ! 6 @ 43 / $ @ ':, : 6 < A , @ ': 9 ' O A ;/ ': b , ':, : $ > H @ < - V < 6 > 9 : ; 9 : ; A - < 6 @ - V 9@ : ;/ ':, b ': ':, : b ' * W @ * W ': ' b ':, b ':, :
Figure 2- 5 : Notion d’initer et d’inifer
A @@ H @ > 9 : : ;/ . ! > /S ^ - > ,/S ? 7 > / 0 K , + , /> -8;0> > 2: . S > 8/S , > 8/S ! > / 0 > -880> > 1: S & > /S , > '/S ! > / J * # " * 9 / * # , > -883> > 4 : 4 3 S ! > J * # " * 9 / * # , /> 0<<<> > : . S % > */S * > 0/S *- > / J * # " * 9 / * # , /> -8;8> &> 24 : 3 4 S &]?> '/S ? > 0/S ^ > ^/ 2 * J 0<<<> > .2.: .23/
3. ) @ @ 9 -< - < ;/ ! .2 A - @@ H 5* @ < 6 - < -< H @ < 6 H - @ - < - / 9@ : ;/ S S N S S N disulfure de bis(diéthylcarbamoyle) R2 R1 60°C S N S R2 R1 S N S n R1= H, R2 = Ph R1= Me, R2= CO2Me
Figure 2- 6 : Utilisation du disulfure de bis(diéthylcarbamoyle) comme iniferter par Otsu
$ A @ @ < 6 9 H - @ ' ; A @ A < 6 / ' < @@ H @ @ Q D / ) H < Q A R > @@ @ P - -/ N > H > < < H R /
Les grands types de PRC
< > H R > (*/ ) / ) Q < / ) @ H - V A / $ / ) @ @ - 6 A ' ( 9 ' @ ( < ? ;/ .2 ! > /S ^ - > ,/S ? 7 > / 0 K , + , /> -8;0> > 2: . /
31 ) > A H > @ @ - V < 6 H / * - A > > @ / & R > < ('B ,'&$I A / & > A Q < / * - A R < @ .3 < /.4 ) < < J %, 9 % , < ? ;/ * O 1 : / ) 6 H < (* : / ) 16 H < > /
3.1. Polymérisations contrôlées par des métaux de transition
./ / / < 1 ) Q < - V A 9$$;/ ) 6 < @ :2/ , b * ) , :* ) 6 ,
Figure 2- 7 : mécanisme de la polymérisation au cobalt
$ A : R ) A / ) -< / .3 ! > J * # " * 9 / * # , /> 0<<<> > : . @ / .4 , > */ /S * > N/!/ J 9 , " /> -832> &> 3 / 1 0 > '/S $ > / , + %/> 0<<-> > . :. 4/
3 * < Q @@ < < 6 < / ) Q < @ A - < αg -< < 6 @@ / @@ > < 6 > @ -< 6 - V A O - V H @ < 6 9 @ :3;/ , b * ) , DD b * ) , b * ) , b * ) < 6
Figure 2- 8 : Transfert irréversible d’hydrogène au cobalt
./ / / ) ' ( 1 ./ / / / ) ' ( < < Q A 441 A @ - 6 9I_ * ; A / ) < A A @ < 9I:, ) ; 9, ) ; A - @ :4/ , :I b , ) , b I:, ) 6 ,
Figure 2- 9 : Mécanisme de l’ATRP
* < A < I:,
) a ) /
1
> /> , <R ? U 7 > 8/ 9 % 0 /> -88;> > 4 S * > #/S > /S , <R ? U 7 > 8/ * * # " /> 0<<-> > ..2:.22S 8 > ,/S ' > /S U > ,/ , + %/> 0<<-> > . 34:.21 /
3 ./ / / / , A P ' > A :- 6 < / $ A :- 6 - 6 9 @@ A A ; A P @@ / A > - @ P H - V / $ O A - V / &6 > =: < J 9* .; * *! ( < - < > =: J * .* *! ( < : -< ? J * * 9* .; < 6 / ) - @ < A O < 6 /1 $ < < - A '$ %/ & > A O @ < / ! ' ( /1 ) -) < < U 1. - 9$$;/ 6 > , <R ? U 711 A 9$; Q < / * < < > H > O Q < b > A @ A A @ < @ A < A @ 6 / 1 > #/S > /S 8 > /:N/ J 9 , " /> -88;> > . :. / 1. 8 > ,/S 8 > ,/S U > ,/S - > / 0 > -882> > 2 : 2 ./ 11 T > N/S , <R ? U 7 > 8 J 9 , " /> -882> &> 1: /
32 & R > - A < A @ >1 7 >1 >12 - >13 - 14 < 6 / , < 6 < A > ' ( / ) -) ) Q < / & > A < / & > H @ < A @ < : / & > / * A @ ? / $ < > < > ./// ./ / /./ ' ) < J H c A 6 < -6 A / Q < @ 6 R A < > - < < 6 / O / @ = h < 6 / @@ > = < 6 < / * X A Y A 1 ' > /S 8 > ,/S U > ,/ 0 > -88.> > 1 2:1 > ) > N/ S 0 > (/ / , , /> 0<<<> 124: 13 / 1 0 > */S & > -/S N > (/S < > -/ 0 > -886> 1> 3 2 :3 3 12 ) > -/ S & > $/ S & > -/ S < > -/ S N > (/ 0 > -88.> > 2 . :2 ../ 13 > #/S > /S % > '/S ( > N/*/ S +- > ,/ 0 > -886> 1> . :. 3 S , > 0/ S 0 > */ S & > -/ S N > (/ S < > -/ 0 > -88;> > 1 : 11/ 14 8 > ^/ S 8 > ,/ S U > ,/ 0 -888> > 1 : 1 1/ > N/'/,/S 0 R > /S B > / /S > N/S 8 > 0/ J N , > -888> > 1 : ./ T > N/ /S , <R ? U 7 > 8/ J 9 , " /> -882> &> 1: / & ( ? > 0/,/S , - > ,/S ,] - > (/ 0 K + , /> -88;> 1> .3 :.31/ . ^ > / S ( 7 > / J * # " * 9/ * # , /> -888> &> 1 4 :1 42/
33 - 6 9':I; O ' ( > @ = < 6 / & > @ < > h < 6 - 6 / ! - 6 6 @ - A / $ @ h < 6 A A α - 6 - / * < X Y> @ h < 6 6 @ < 6 : / < - < 6 - A < 6 > @@ > -< @ M ) - J Q < 6 R A < - < @ A *:I A @ > @@ H / Q < 6 -A < < @ A - @ A / < 6 6 @ / $ @ A 6 @@ / 1
3.2. Polymérisations contrôlées par transfert dégénératif
./ / / < ) < $ 9 $ @ < ? ; @ - V < 6 H @ : / 1 - > ^/S > /S & > / * * # " /> 0<<3> > .: 23 N 7 U 7 > T/S , <R ? U 7 > 8/ 9 M , 7 2 /> 0<<6> > 113 :113 / > ,/ P + > -880> 1> > 2 :23. S , <R ? U 7 > 8/S 0 < > /S T > N/ 0 > -882> > 4.: 4 S 0 < > /S T > N/ /S , <R ? U 7 > 8/ 0 > -882> > 3 :3 S 0 > '/S !- > 8/S B 7 > / 0 > -88;> > 3 4: 3 1/
34
, b , :$ , :$ b ,
6 6
, ,
Figure 2- 10 : Mécanisme de l’ITP
) @ A - $ 9 ? < ;/ ) $ + > @ P @@ 9@ : ;/ $ 6 < / & > $ + - V ':$ / * A '+A - V < 6 / $ b ':$ $ :$ b ' ' b , ':, $ b , $ : , , b ':$ , :$ b '
Figure 2- 11 : Amorçage de la polymérisation aux dérivés iodés
A < Q @@ A @ : @ '+/ > ' 6 A * B . * * 9* .;/ * < Q < 6 A < 6 > < < / * ':$> '+ -> / & > @@ @ / * R < / A A < Q - < > H R > R $ /
4 ) @ @ A @@ > H ':$> / ./ / / < ('B 2 ,'&$I 3> 4 ./ / / / * @ 9, +; @ - < - 6 @ 0+- / * @ 9, +; 6 9@ : ;/ ) 6 @ @ @ @ - < - - V , - V , / * @@ 433/ , b S Z S Mp Z S S Mn Mp S Z S Mn + Mp espèce dormante 1 M M addition fragmentation 2.1 espèce dormante 2
Figure 2- 12 : Mécanisme de la polymérisation par addition/fragmentation
) Q 0+-/ $ A : @@ A - V 6 / * > O @@ @ @@ - V / ) + R Q 0+- / 443> R / < > */S ) :& ? > / S ( > N/N/ S > / 0 > 0<<6> 1> > 1 11:1 ./ 2 ) > / /S , > 0/S ( ?? > /S - > / / $ 43 123> -88;S , 9 > 3J .4 / 3 * > /S *- > &/S > /S + > /S , - > &/ T!43 3421> -88; S , 9 > . J3 3/ 4 < ('B ,'&$I> J , > 0/ S ( ? > / S - > / / 9 J , /> 0<<2> > .24 > / S 7 7 > / J * # " * 9 / * # , /> 0<<2> > .12/ & > /S - > */S + > /+/ J , " , , /> -8;;> > . 3:. /
4 ) > @ + (- > 3 ,'&$I 9, & $ - @ I - ;/ $ - -/ * @ : . A I < 6 9 A I @ > - - ? ; ( ( / ) > @ ( ?? & % > 2 ('B 9( ' B - @ ;/ * @ : . A I -< 6 > - 6 > > @ - - 9 9!;9!( ; ( ( / S X S R2 R1 X= O (mais aussi S, P, N) R1 et R2 variés
structures des agents MADIX
X= C, S, H, Cl, P(O)(OR)2, R1 et/ou R2 variés
structures des agents RAFT
Figure 2- 13 : Différences entre les agents MADIX et RAFT
./ / / / , A P > - ' ) > > @ A - $ 9 ? < ; A 6 A A , +/ * ('B 0+0 9@ : 1;> A 6 '+/ * '+A - V < 6 / # - /
4 , b S Z S A In2 Z S S Mm A 2 In In-M1 A-M1 S Z S Mm In + M + A A + M 2.2
Figure 2- 14 : Amorçage de la polymérisation par addition/fragmentation
A P @@ > A 9@ : 1; @ '+/ * @ A 9 6 0 / $ O @ 6 / * A > ' < < > *9*! (;9* .; *9* .; - / " - H - ' @ P H - V < 6 9 J '_ * 9*! , ;* . < > '_ * 9* .; -< 6 ;/ * O A - V / - + . A < D@ @@ > A - - V - < - / ) + O 0+- 9@ : ;/ * 6 J ) < 6 9 A < ; - V @ - < - / '@ @ > + - @ P H 0+-/ & ('B > +_ -7 7 > /S , > */S > /S ' - > / 0 > 0<<2> > 2: / . * @ , - * &* ! < - A D 4D <> &/S * > ,/ 0 > 0<<2> > 1 : 1../
4. < / & ,'&$I> +_ !* *B. +_ !* 9*B.; 9!;9! ; A / 1 ) ('B ,'&$I A :H: 6 6 @ - < / @@ > > ,'&$I> @ < 6 α *_ 6 6 @ / &6 > < - < @@ A < ('B / $ 6 Q < - < ,'&$I A O ('B / * 6 J ) < 6 9 A < ; @ / @@ > -@@ / '@ @ > + 9+_ !( +_ %( ; A 6 9@ : ;/ * A A ,'&$I Q < < A ('B / ./ / /./ ' ) < < J Q 6 @ / O / ) - V < 6 @ @ - < - / $ @ V R 6 < 6 H / $ - A @ - < -@ h < 6 / $ +:*9 ; -< 6 > - M 1 & > ,/S > &/S + > /S -/ /S > ^/ 9 % , R % + * # ) > '* < 3 1> ' *- <> 8/ , <R ? U 7 /> 0<<1> *- .2> . / > '/S & > /S , > 0/S ! - > ,/ 0 > 0<<2> > .2 : .21 @ /
41 ) < < J Q / @ 0+- R 9 ('B ;/ $ H < / < 6 9 ('B ; @ - < - / $ @ A - A Q @@ @ - < -< 6 6 / $ H @ Q < - < < A J ('B Q @@ < 6 A < S ,'&$I Q < 6 @ - < /
3.3. Polymérisation contrôlée par terminaison réversible : la NMP 66
././ / ) %, H < 9@ : ;/ Mn + O N C B Mn O N C B M espèce dormante chauffage Figure 2- 15 : Mécanisme de la NMP * < 6 @ @@ / 2 $ @ 6 R 6 A * < / U7 > */S > '/S -> / , + %/> 0<<-> > . :. 33/ 2 8 - > /S , A > /S , -7 > (/S > ,/S B - > / J , " * K 8 > -88;> > .: 4/
4 ././ / , * < 0+1 A @ @@ - < '+A 6 , - V < 6 9@ : ;/ O N C B A O N C B A + A + M A-M 1 chauffage 2.3 Figure 2- 16 : Amorçage de la NMP A P @@ > A '+ @@ @ A H @ 6 / $ @ A 6 / & A > ' - @ P H - V 9 J '_ * 9*! , ;* . < > '_ * 9* .; -< 6 ;/ $ O A - V / $ < - < - A < > A '$ % < / & < < > > Q < > P R - A '$ %/ $ A A Q < 6 O R 6 < / ./././ " , ! > , ! < < %, / * H A = ( * # $ !820*N
4 @@ > @ A H H 9 H 5*; / & > H > - V / ) - V H 6 A A 9@ : ; @ 6 / ) < O / & 6 - A > 6 A @ A - A - V 6 / 820*N . # ( $ # ( 6 & < 6 A < > Q < / $ R 6 - 9 A '$ %; / ././1/ & < J 0 3 ) - - @@ %, < Q < 6 / > @@ @ A > A < @ *:! / 4' - - < 0 9@ : 2; ' - D' 7 /2 3 0 > !/S * > N/)/ 0B 4D .D > :. / 4 >&/S 0 > &/S , A > /S > 0 > 0<<2> > .3: S B - > /S 8 > '/S , A > /S % > / 0 > 0<<2> > 4421:4431S - > 8/S > '/ 0 > 0<<6> 1> .12: . S 0 > /S B > N/ /S ) , > B/S + - > '/S > /S > &/S B > ,/S 0 > ^/ 0 > 0<<<> > 1 : 12S , A > /S ) , > */S > /S B - > / 0 > 0<<<> > 11 .:11 S 8 > */S > '/ J 9 , " /> 0<<1> > . 2: ...S > &/S *- 7 > #/S > (/S U7 > * J 9 , " /> -888> > .4 1:.4 / 2 > &/S 0 > /S ( /S B > N/ /S > /S 0 > ^ J 9 , " /> 0<<<> > 4 4: 4.4/
42 N O P OEt O OEt Figure 2- 17 : Structure de SG1 * 6 6 @@ Q < 6 < A < A /2 & > < Q 9 ; H -- < -< H 5*/ @ /2 ./././ * ) , ! A %, / , > Q < 6 < A A 6 / $ < - < 6 H -9 < 6 > @ M;/ * - A < ('B > ,'&$I ' ( > , ! / &6 > - A > Q @ A , !/ ) 0 %, / $ A Q @@ < 6 < A < A / & < - < < 6 / 2 0 > /S ) > B/S B > N/ /S > /S % > /S - > ,/S 0 > ^/ . 4 > / 2 % > N/S *- > /S 0 > !/S , > / 9 M , 7 2 /> 0<<3> > 3 : 34/
43
3.4. Polymérisations utilisant des dérivés téllurés et séléniés
@ H < Q > R < < / * < > H ,'&$I> A - > H - < 6 / A A > - / ./1/ / < 2. ) ( 9 : ( < ? ; - @ : 3/ " @ < 0+3 @ @@ -: '+ A - V < 6 / ) - 6 D @ H @ - A 6 @ @ - V H / $ A > >21 @ @ - A / M A-TeMe M AM1 Mn-TeMe M chauffage A + TeMe A + M Mn + MeTe-Mp Mn-TeMe + Mp 2.4 Mn + TeMe chauffage amorçage dissociation thermique transfert dégénératif espèce dormante
Figure 2- 18 : Mécanisme de la TERP
) 0+3 '_ < / $ @@ Q < 6 2. ^ > / "# > 0<<3> > 32 : 34 ^ > /S $ > 8/S ^ - > N/ J 9 , " /> 0<<0> > . : . 2/ 21 0 > '/S 8U 7> ^/S B 7 > /S ^ > /S $ > 8/S % 7 R > ,/S ^ - > N/$/ J 9 , " /> 0<<1> > 32 :32 /
44 < 6 A < A / & > < Q - < -< H @ A / @ > < < @@ H c @ H < 6 \ / ./1/ / < 2 ) < H @ - + 6 @ @ 6 9@ : 4;/ A2 PhSe-SePh M M Mn-SePh A-M1 2 A 2 PhSe amorçage A + M hν Mn + PhSe
Mn + PhSe-SePh Mn-SePh + SePh
dissociation photochimique addition réversible transfert dégénératif espèce dormante
Figure 2- 19 : Mécanisme de la polymérisation aux dérivés séléniés
* A 6 H < -6 < < 6 Q / * Q < < 6 @@ /2 * A - H R / 2 8U > /S 8 > /S 8 > /S ^ 7 > ^/ 2 * J/ > -888> > 2 2:2.2 U > '/S > %/S -> J 0 " /> 0<<3> 1> 12: 14/ 2 8U > /S 8 ? U > /S ^ 7 > /S 8 > /S 8 > /S ^ 7 > ^/ 0 " * 9 , /> -88.> '.1> ./
Conclusion
) < Q < -< 6 @ 9 < 6 H > @ > M; L > > < < Q J ' ( > ('B D,'&$I %, / ) @ = h < 6 @ - A / ) @ = -@@ O @ H < / ) h < 6 ^/ & O J R 6 H / @ @ h - A A / " @ ^/ @ < Q A R @ < A A O / ) 6 A > < - A > 6 9@ ;/ & > A > > > > X @ Y Q - A A / * < < / > @@ R < A < / & > O A @ / " < 6 H / @ > A @ (* 6 > @ J 6 @ @ / ' > Q <6 / $ < H - A 6 / ) - - Q > > < @ / & A R R @ / &6 > - 1 H H > < -6 < /
.
1
=
)
"
)
#=
> /
Chapitre 3 : Application du procédé MADIX à la synthèse
d’un nouveau support soluble
& R > - A - - A @ A > / ) < -6 > 6 > A c / * 6 / ' - > R @ P - < 6 O A H < -6 / & > R - > > H < -6 < -6 / % c ,'&$I O @ < < -6 /
1. Les différents modes de synthèse
1.1. Synthèse en solution) < -6 H
@ / ) @ @@
- A @ A > > >
Substrat organique Réactifs Produit sous-produits réactifs en excès " A ) Brut réactionnel Produit pur + 'A) ) !" ') " )
Figure 3- 1 : Principe de la synthèse en solution
$ < -6 A A c A - A < A - - -9**,;> @ 9$(; (,% V / & > -@ @@ > > @ - A / @ - A 6 V < -6 > @ 6 /
1.2. Synthèse sur support solide
4 .> , @ 22 - @ @ < -6 / H - A < 6 / " @ @ - A > - R -O @ / $ A H -- 9@ .: ;/ 22 , @ > (/ / J 9 , " /> -861> > 14: 1/
2 Substrat organique Réactifs Support-Produit sous-produits réactifs en excès 'A) ) !" Support polymère Support-Substrat ) + A ) Support-Produit ) Produit Support polymère A ) Produit pur '%' & ) &
Figure 3- 2 : Principe de la synthèse sur support solide
" O H A A J - < 6 - / * > A @ > H c H @ H A @ < -6 / & > H O A / ) @@ - A @ - A / @@ > - A > < -6 > < 6 - 6 / ) @ - A @ A / $ @@ -9 (,%> $( **, ;/ @ > < 6 @@ 6 @ / * < -6 A / % 23 > > 442 < -6 - ' 9@ .:.;/ ) --6 / 23 % > 8/*/S T > %/S > N/S % 7 > /S > B/S > ^/S # > &/S ^ > +/S ) > /S 0 7 7 > /S > / - > -88.> &> 3: 2 /
3 Cl O O HO O O N S OTBS P(Cy)3 Ru Ph (Cy)3P Cl Cl O HO O O N S O OH O HO O O N S OTBS Résine de Merrifield commerciale Epothilone A
Figure 3- 3 : Synthèse de l’Ephilone A sur support solide par Nicolaou
" < -6 / '
@ < 6 > @ A - / &6 >
@ 6 @ /
) <24 < -6 9b;: A @
/ * < < -6 @ \ @ /
1.3. Synthèse sur support soluble80
) < -6 A H < -6 @ A < 6 H 9@ .:1;/ 24 > $/S ) <> /S > */ 9 M , , 7 2 /> 0<<0> > > 41: 42/ 3 0 > &/S N > 8/ , + %/> -88.> 1&> 134: 4/
4 Substrat organique Réactifs Support-Produit sous-produits réactifs en excès 'A) ) !" Support polymère Support-Substrat ) + ) Support-Produit ) Produit Support polymère ) Produit pur ') " )
Figure 3- 4 : Principe de la synthèse sur support soluble
) @ - A - 6 / ' > - A O c > A < -6 A / & > - A < 9**,> $(> (,%; > H > R / " @ - A @@ > @ A < 6 / ' < -6 H @ < -6 < -6 > H @ - A @ H c @ / , > < -6 A /3 " H A > H R > H @ > @ - A :H: H - A / &6 > H @ < -6 A A < -6 < 6 ,'&$I> < -A > > H / * > A A > A R @ < 6 / 3 K A < -6 J T U - N /> /S N > 8/ , , /> -888> 4 2: 4 1 T U - N /> / 8 D /> -888> &> 113:1 /