Rôle de la PTPase Shp1 dans les adipocytes
Mémoire
Marie-Pier Forest
Maîtrise en médecine moléculaire
Maître ès sciences (M. Sc.)
Québec, Canada
© Marie-Pier Forest, 2017
Rôle de la PTPase Shp1 dans les adipocytes
Mémoire
Marie-Pier Forest
Sous la direction de :
Résumé
L’obésité, liée à la résistance à l’insuline, au diabète de type 2 et aux maladies cardiovasculaires, est un problème de santé majeur de notre société. Nous avons démontré que la protéine tyrosine phosphatase Shp1, dont l’expression est significativement augmentée dans les tissus cibles de l’insuline chez les souris obèses, est un régulateur de l’homéostasie du glucose dans le foie et le muscle. Shp1 est impliqué dans la modulation de l’expression et de l’activité du récepteur nucléaire PPAR dans le foie. Nos recherches ont porté sur la caractérisation de Shp1 dans les adipocytes, la signalisation de l’insuline et le transport du glucose soit en sous-exprimant ou en sous-exprimant de façon constitutive Shp1 dans les cellules adipeuses 3T3-L1. L’état physiologique des cellules a été caractérisé par la mesure de la coloration Oil-Red-O, des triglycérides, de l’expression de PPAR et de ses gènes cibles et de leurs protéines, de la réponse à l’insuline par le transport du glucose ainsi que l’expression et de la phosphorylation des protéines impliquées dans la signalisation de l’insuline. La diminution de l’expression de Shp1 a entraîné un délai lors du début de la différenciation mesurée par l’expression retardée de PPAR et certains de ses gènes cibles, mais n’a pas beaucoup affecté le phénotype des cellules complètement différenciées. Bien que la réduction de Shp1 ait augmenté la phosphorylation d’Akt stimulée par l’insuline, le transport de glucose n’a pas été modifié dans ces cellules, et l’expression de glut4 a légèrement diminué. L’expression constitutive de Shp1 a entraîné une forte diminution des niveaux de PPAR, inhibant totalement la différenciation, l’expression de glut4 et le transport du glucose. Nos données suggèrent que Shp1 joue un rôle important dans les adipocytes comme régulateur de l’adipogenèse par la modulation de l’expression et l’activité de PPAR et par la régulation de la signalisation de l’insuline.
Abstract
Obesity, which is causally linked to the development of insulin resistance, type 2 diabetes (T2D) and cardiovascular disease (CVD), is a major health issue in our society. We have demonstrated that the protein tyrosine phosphatase Shp1, whose expression is significantly increased in insulin target tissues of obese mice, is a regulator of glucose homeostasis in liver and muscle. Shp1 is implicated in the modulation of expression and activity of the nuclear receptor PPAR in liver. Here, we describe the characterization of Shp1 in adipocytes by analyzing its role in adipocyte differentiation, insulin signaling and glucose transport by either knocking-down or constitutively expressing Shp1 in 3T3-L1 adipose cells. The physiological state of the cells was characterized by measuring Oil-Red-O staining, triglyceride content, expression of PPAR and its target genes and their proteins, insulin response by glucose uptake and the expression and phosphorylation of proteins involved in insulin signaling. Knockdown of Shp1 led to a retardation in the onset of differentiation as measured by delayed expression of PPAR and some of its target genes, but did not much affect the phenotype of fully differentiated cells. Although reducing Shp1 increased insulin-stimulated Akt-phosphorylation, glucose transport was not changed in these cells, and glut4 expression was slightly decreased. Constitutive expression of Shp1, resulted in a strong decrease of PPAR levels thereby totally inhibiting differentiation, glut4 expression and glucose transport. Our data suggest that Shp1 plays an important role in adipocytes both by acting as a regulator of adipogenesis through modulation of the expression and activity of PPAR and by regulating the insulin signaling pathway.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... ix
Remerciements ... xiii
Avant-propos ... xiv
Chapitre 1 : Introduction ... 1
L’obésité ... 1
Le concept de résistance à l’insuline ... 3
Le diabète ... 7 Le tissu adipeux... 9 La lipogenèse ... 11 La lipolyse ... 11 L’adipogenèse ... 12 PPAR... 13
Modèles pour étudier l’adipogenèse ... 17
Shp1 ... 18
Hypothèse et objectifs ... 20
Chapitre 2 : Role of Shp1 in adipocyte differentiation and insulin signaling ... 21
Résumé ... 22
Abstract ... 23
Introduction ... 24
Results ... 25
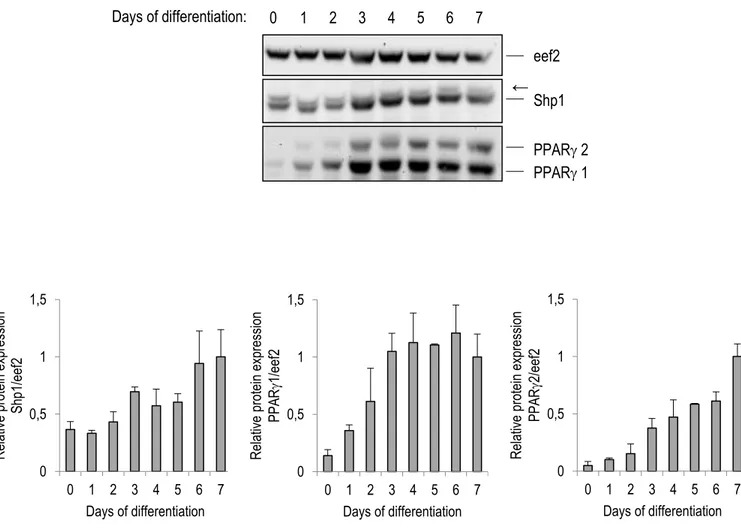
Expression of Shp1 and PPAR in differentiating adipose cells... 25
Effect of Shp1 knockdown on adipogenesis ... 26
Shp1 knockdown affects the expression of key players of adipogenesis ... 27
Knockdown of Shp1 does not affect glucose transport ... 28
Akt phosphorylation is improved by knockdown of Shp1 ... 28
Discussion ... 29 Experimental procedures ... 33 Cell culture ... 33 shRNA for Shp1 ... 33 Immunoblotting ... 33 qPCR... 34
Oil Red O staining and triglyceride content ... 34
Glucose transport ... 34 Statistical Analysis ... 34 Acknowledgements ... 34 Conflict of interest ... 35 Author contributions... 35 REFERENCES ... 36 TABLES ... 39 Figures ... 40 Supplementary figures ... 47
Chapitre 3 : Conclusion et perspectives ... 52
Liste des tableaux
Table 1. shRNA sequences ... 39 Table 2. qPCR primer sequences ... 39
Liste des figures
Figure 1.1 Prévalence (%) de l’obésité chez les adultes (âgés de 18 ans et plus) ... 1
Figure 1.2 L'obésité induit des altérations qui entraînent une résistance à l'insuline et une inflammation... 4
Figure 1.3 La voie de signalisation de l'insuline ... 6
Figure 1.4 Estimations mondiales de la prévalence du diabète chez les adultes (âgés de 35 à 64 ans) ... 8
Figure 1.5 La différenciation adipocytaire ... 12
Figure 1.6 Rôles de PPAR dans le tissu adipeux. ... 14
Figure 1.7 Structure primaire de PPAR représentant les modifications post-traductionnelles ... 16
Figure 2.1 Shp1 and PPAR are co-expressed during early differentiation of 3T3-L1 cells ... 40
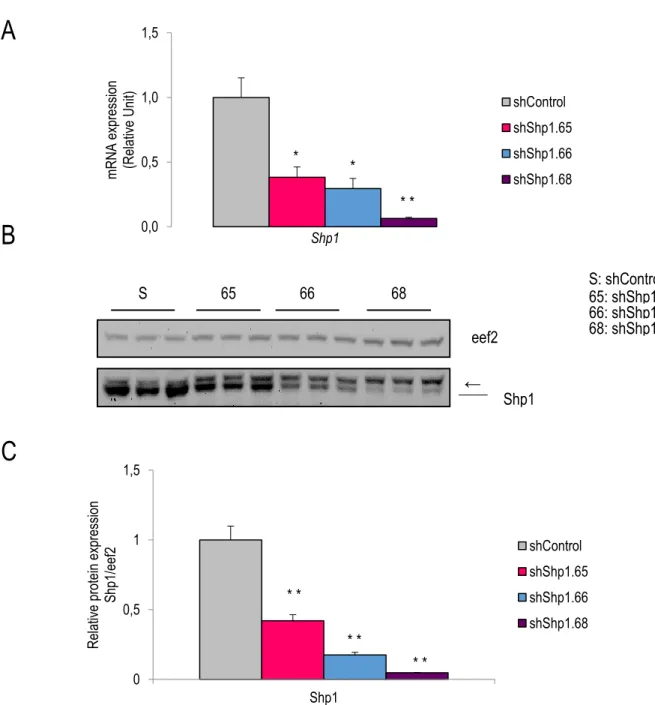
Figure 2.2 Knockdown efficiency varies between different, Shp1-specific shRNAs. ... 41
Figure 2.3 Shp1 knockdown does not affect the final differentiation of adipose cells. ... 42
Figure 2.4 Shp1 knockdown delays the expression of Pparg and some of its target genes in adipogenesis. .. 43
Figure 2.5 Shp1 knockdown affects protein accumulation of PPAR, CD36 and FABP4. ... 44
Figure 2.6 Glucose uptake and glut4 mRNA levels are not changed after knockdown of Shp1 in 3T3-L1. ... 45
Figure 2.7 Phosphorylation of Akt, but not of its substrates is increased in differentiated 3T3-L1 cells with reduced expression of Shp1. ... 46
Figure S2.1 Reduction of Shp1 by shShp1.65 and shShp1.66 seems to slightly affect the differentiation of adipose cells. ... 47
Figure S2.2 Knockdown of Shp1 by shShp1.65 and shShp1.66 delays the expression of Pparg and some of its target genes in adipogenesis. ... 48
Figure S2.3 Decrease of Shp1 by shShp1.65 and shShp1.66 affects protein expression of PPAR, CD36 and FABP4. ... 49
Figure S2.4 Glucose uptake and glut4 mRNA levels seem to be minimally affected by reduction of Shp1 with shShp1.65 and shShp1.66. ... 50
Figure S2.5 Decreased Shp1 expression leads to increased phosphorylation of Akt and GSK3... 51
Figure 3.1 L’expression constitutive de Shp1 dans les cellules 3T3-L1 affecte PPAR. ... 54
Figure 3.2 L’expression constitutive de Shp1 affecte la différenciation terminale des cellules 3T3-L1. ... 55
Figure 3.3 Le transport de glucose et les niveaux d’expression de glut4 sont diminués en présence de Shp1 exprimé de façon constitutive dans les cellules 3T3-L1 différenciées. ... 56
Liste des abréviations
AF1 Domaine de transactivation N-terminal
AF2 Domaine de transactivation dépendante du ligand AKT/PKB Protéine kinase B
aP2 Adipocyte protein 2 apoB Apolipoprotein B
ATGL Adipose triglycéride lipase
c-Abl Nonreceptor tyrosine kinase Abelson murine leukemia viral oncogene C/EBP CCAAT enhancer binding proteins
CD36 Cluster of differentiation 36
Cdk Cyclin-dependent kinases
CEACAM1 Carcinoembryonic antigen-related cell adhesion molecule 1 ChREBP Carbohydrate-responsive element-binding protein
CVD Cardiovascular disease
DN Dominant-negative
DBD Domaine de liaison à l’ADN hautement conservé
eEF2 Eukaryotic elongation factor
EGFR Récepteur du facteur de croissance épidermique FABP4 Fatty acid binding protein 4
FAT Fatty acid translocase
FoxO Forkhead box sub-group O GLUT1 Transporteur de glucose 1
GLUT4 Transporteur de glucose 4 GSK3 Glycogen synthase kinase-3
HDL Lipoprotéine à haute densité (high density lipoprotein)
HFD Diète riche en gras (high fat diet)
HSL Hormone-sensitive lipase
IBMX 3-isobutyl-1-methylxanthine IL-1β Interleukin 1 beta
IL-6 Interleukin 6
IL-10 Interleukin 10
IMC Indice de masse corporelle
INF Interféron gamma
IR Récepteur de l’insuline
IRS Substrat du récepteur de l’insuline
JNK c-Jun N-terminal kinases
KD Knockdown
KO Knockout
LBD Domaine de liaison au ligand C-terminal
LPL Lipoprotéine lipase
MAPK Mitogen-activated protein kinase MCP-1 Monocyte chemotactic protein 1
MGL Monoacylglycerol lipase
MEF Mouse embryo fibroblast
MSC Cellules souches mésenchymateuses (mesenchymal stem cells)
mTOR Mechanistic target of rapamycin NAFLD Stéatose hépatique non alcoolique
OMS Organisation mondiale de la santé
ORO Oil-red-O
PDK1 Phosphoinositide-dependent kinase-1
PH Pleckstrin homology
PI3K Phosphatidylinositol 3-kinase
PIP2 Phosphatidylinositol (4,5)-bisphosphate PIP3 Phosphatidylinositol (3,4,5)-trisphosphate PPAR Peroxisome proliferator activated receptor alpha
PPAR Peroxisome proliferator activated receptor delta
PPAR Peroxisome proliferator activated receptor gamma
PPRE Élément de réponse à PPAR
PTB Phosphotyrosine-binding domain
Ptpn6 Protein tyrosine phosphatase non receptor 6
Rheb RAS homolog enriched in brain
RSK Ribosomal S6 kinase
RXR Récepteur X de l’acide rétinoïque
S6K S6 kinase
SEM Standard error of the mean
SH2 Scr-homology 2
Shp1 Src homology region 2 domain-containing phosphatase-1
SREBPs Sterol regulatory element-binding proteins
TG Triglycéride
TNF-α Tumor necrosis factor
TZD Thiazolidinediones
T2D Diabète de type 2
VLDL Lipoprotéine de très faible densité (very low density lipoprotein)
Remerciements
Je tiens à remercier avant tout mon directeur de recherche Dr André Marette pour m’avoir offert l’opportunité de faire de la recherche fondamentale dans un laboratoire bien équipé ayant tout le nécessaire pour avancer mon projet de recherche, et ce, dans un environnement de recherche très dynamique. Au cours de ces années, j’ai acquis de nombreuses connaissances utiles à ma carrière scientifique. Merci de m’avoir encouragé à présenter mes travaux de recherche, sous forme de présentation orale ou d’affiche, lors de divers congrès. Ensuite, je pense à Kerstin Bellmann et Michael Schwab. Je voudrais les remercier d’avoir pris le temps de me superviser tout au long de mes stages et de ma maîtrise, sans qui ma formation académique n’aurait pas été aussi enrichissante. J’admire les personnes que vous êtes et vous demeurez un modèle à mes yeux. J’aimerais également dire un gros merci à Marie-Hélène Lavallée-Bourget pour ces moments de travail d’équipe de qualité. Tu es la « best partner ever » que tout le monde aimerait avoir. J’ai une pensée toute spéciale pour l’homme de la situation Bruno Marcotte. Il a été d’une aide extraordinaire pour tous les étudiants désemparés que nous sommes de temps en temps. Je tiens à remercier toute l’équipe exceptionnelle du Dr Marette pour cet accueil chaleureux. Un merci tout spécial à mes collègues et amis sans qui mon passage au sein de l’équipe du Dr Marette n’aurait été le même.
La recherche ne pourrait pas être autant d’envergure si ce n’était pas des nombreuses collaborations. Plusieurs collaborations interuniversitaires ont permis des échanges scientifiques bénéfiques. Dr Nicole Beauchemin est impliquée depuis le début dans le projet Shp1 dû à ses conseils judicieux. Je remercie le Dr Pedro Miguel Geraldes de ses précieux conseils et échanges suite à mon passage dans son laboratoire de recherche, où j’ai effectué des crédits de recherche lors de mon baccalauréat en biologie moléculaire et cellulaire à l’Université de Sherbrooke. Sans oublier Dr Mathieu Laplante, chercheur du CRIUCPQ dans l’axe Obésité-Métabolisme, qui a été d’une aide précieuse pour la caractérisation du rôle de Shp1 au niveau du tissu adipeux. Il nous a fourni la lignée cellulaire 3T3-L1 qui a été un outil indispensable à la réalisation de mon projet de recherche en plus de nous donner gracieusement les plasmides viraux nécessaires à l’infection des cellules adipeuses par des shRNA spécifiques pour Shp1.
Merci également à la Direction de la recherche universitaire de l’IUCPQ, au Département de médecine via la bourse d’études Louise-Côté, au Conseil Professionnel de Diabète Québec (CPDQ) ainsi qu’à l’Institut sur la nutrition et les aliments fonctionnels (INAF) pour leur support financier à mes travaux de recherche.
Je tiens également à remercier l’amour inconditionnel de ma famille et amis, tout spécialement mes parents qui m’ont supporté tout au long de mes études universitaires.
Avant-propos
Ce mémoire porte sur l’étude du rôle de la protéine tyrosine phosphatase Shp1 dans la modulation du tissu adipeux et des perturbations métaboliques de l’obésité via la régulation du récepteur nucléaire PPAR. Les cellules 3T3-L1 sont utilisées dans le cadre de ce projet de recherche.
Le premier chapitre comprend une revue de la littérature en lien avec le projet de recherche.
Le deuxième chapitre comprend les résultats de recherches sous forme d’un article scientifique en anglais. Étant donné qu’il s’agit d’une sous-section du projet de recherche sur Shp1, l’article sera soumis en intégralité avec quelques modifications et expériences supplémentaires. Je présente les résultats en tant que premier auteur avec l’élaboration de l’écriture de cet article scientifique et la réalisation de l’ensemble du projet. Le design expérimental, la contribution à certaines expériences, l’interprétation des résultats ainsi que la révision du manuscrit ont été réalisés conjointement par les auteurs.
Le troisième chapitre sert à appuyer les résultats présentés dans l’article par la démonstration du modèle inverse à celui utilisé pour l’élaboration de l’article.
Chapitre 1 : Introduction
L’obésité
Selon l’Organisation Mondiale de la Santé (OMS), le surpoids et l’obésité se définissent comme une accumulation anormale ou excessive de graisse corporelle qui peut nuire à la santé (OMS). L’indice de masse corporelle (IMC) est une mesure du poids par rapport à la taille (kg/m2) qui permet de classer le surpoids (IMC
≥ 25) et l’obésité (IMC ≥ 30). L’obésité est un problème de santé publique à l’échelle mondiale. Le nombre de cas d’obésité a doublé depuis 1980 (OMS). En 2014, plus d’un adulte sur trois, âgé de plus de 18 ans, était en surpoids et plus d’un sur dix était obèse (OMS). Autrefois considéré comme un problème lié aux pays développés, la prévalence de l’obésité est désormais en augmentation partout dans le monde autant chez les adultes (figure 1.1) que chez les enfants (OMS).
Figure 1.1 Prévalence (%) de l’obésité chez les adultes (âgés de 18 ans et plus) selon les estimations de l’Organisation Mondiale de la Santé en 2014 (OMS).
La principale cause du surpoids et de l’obésité est un déséquilibre énergétique entre la consommation et la dépense calorique (OMS). Des facteurs environnementaux et génétiques influencent le développement de l’obésité (Kopelman, 2000). Plusieurs chercheurs associent l’industrialisation et la mondialisation aux problèmes liés à l’obésité (Hawkes, 2006; Kopelman, 2000; Malik et al., 2013). La croissance économique est associée avec une augmentation de la consommation d’aliments à haute densité énergétique, de céréales raffinées et la présence de sucres ajoutés (Malik et al., 2013). La mondialisation affecte l’industrie alimentaire en modifiant la
quantité, le type, le coût et la disponibilité des aliments (Hawkes, 2006). Le rythme de vie rapide favorise la consommation de mets préparés ayant une qualité nutritionnelle moindre. La restauration rapide amène les gens à consommer plus que nécessaire par la commercialisation des aliments et la grosseur des portions. Ce changement est combiné à une réduction de l’activité physique, dû aux avancements technologiques (ascenseur, escalier roulant, moyen de transport, automatisation du travail physique, etc.), ce qui résulte un bilan énergétique positif. Les éléments de l’environnement obésogène interagissent avec des variations génétiques, et possiblement épigénétiques, qui augmentent la susceptibilité de certains individus à cet environnement (Sellayah et al., 2014). L’obésité est l’adaptation normale au mode de vie dans lequel on vit, qu’on peut caractériser comme un environnement obésogène.
Le surpoids et l’obésité sont des facteurs de risque pour certaines maladies chroniques telles que les maladies cardiovasculaires, le diabète de type 2, les troubles musculo-squelettiques et certains cancers (OMS). En tant que société, un programme de santé publique s’impose pour diminuer les risques associés à l’obésité en favorisant un environnement plus sain. L’accès à des aliments bons pour la santé et à des activités physiques permet aux gens de faire un choix plus éclairé. Voici quelques recommandations de l’OMS : limiter l’apport énergétique provenant des lipides et des sucres ; consommer davantage de fruits et légumes, de légumineuses, de céréales complètes et de noix ; avoir une activité physique régulière. L’industrie agro-alimentaire a également son rôle à jouer : réduire la teneur en graisse, sucre, sel des aliments préparés ; proposer des produits sains et nutritifs à un prix abordable ; limiter la commercialisation d’aliments riches en lipides, sel et sucre (OMS). Par contre, certaines interventions politiques spécifiques sont mieux adaptées pour améliorer les habitudes alimentaires. Les mesures d’information visant à soutenir un choix éclairé ont généralement eu un faible effet positif sur l’amélioration des habitudes alimentaires, tandis que les campagnes d'information ont permis de sensibiliser les gens aux mauvaises habitudes alimentaires. De plus, les mesures visant à cibler l'environnement de marché, telles que les mesures fiscales et les normes nutritionnelles, sont plus intrusives mais peuvent être plus efficaces (Brambila-Macias et al., 2011). L’intervention sur les habitudes de vie a ses limites et la compréhension de la biologie adipocytaire permettra peut-être éventuellement de mieux intervenir, par exemple, en ciblant certains individus ou certaines parties de la population.
La définition de l’obésité par la mesure de l’IMC agit seulement à titre indicatif, car elle ne distingue pas les différents types d’obésité : androïde et gynoïde. L’obésité androïde, une morphologie en forme de « pomme », est caractérisée par le dépôt de graisses viscérales, également appelé dépôt ectopique, c’est-à-dire près des organes. L’obésité gynoïde, une morphologie en forme de « poire », est la présence de graisses sous-cutanées pour protéger les organes internes. Il est bien connu que la distribution des graisses montre un dimorphisme sexuel chez l’humain. La composition corporelle des hommes est de type androïde tandis que celle des femmes est plutôt gynoïde. La présence de tissu adipeux sous-cutané est associée à un meilleur profil métabolique et
de moins grands risques pour la santé comparativement au tissu adipeux viscéral. Afin d’évaluer le risque associé à l’obésité, d’autres mesures sont nécessaires. Pour un IMC donné, un tour de taille élevé est associé à une augmentation du risque de diabète et de maladies cardiovasculaires (Balkau et al., 2007). En plus de la mesure de l’IMC et du tour de taille, la mesure des triglycérides est essentielle pour distinguer le type d’obésité et évaluer les risques associés à l’obésité viscérale, également appelée obésité abdominale (Lemieux et al., 2000).
L’obésité sous-cutanée est considérée comme un tissu adipeux « en santé » tandis que l’obésité viscérale est un marqueur d’un tissu adipeux dysfonctionnel par l’accumulation excessive de graisse intra-abdominale. La présence de dépôt de graisses ectopiques dans les autres tissus, qui ne sont pas faits pour emmagasiner les graisses, altère le profil métabolique. Le muscle, le cœur ainsi que le foie sont ciblés par ce surplus lipidique (Despres & Lemieux, 2006). La stéatose hépatique non alcoolique (NAFLD) est caractérisée par l’accumulation de gouttelettes lipidiques au niveau du foie et en présence d’inflammation, la maladie progresse vers une stéatose hépatique non alcoolique plus sévère, et peut conduire à la cirrhose. Bien qu'une augmentation de la graisse corporelle totale soit associée à une augmentation des risques pour la santé, la quantité de graisse abdominale a été associée à un risque accru de comorbidités comme le diabète de type 2, la maladie coronarienne, l’accident vasculaire cérébral, l'apnée du sommeil, l'hypertension, la dyslipidémie, l'insulinorésistance, l'inflammation, et certains types de cancer (Tchernof & Despres, 2013).
Le concept de résistance à l’insuline
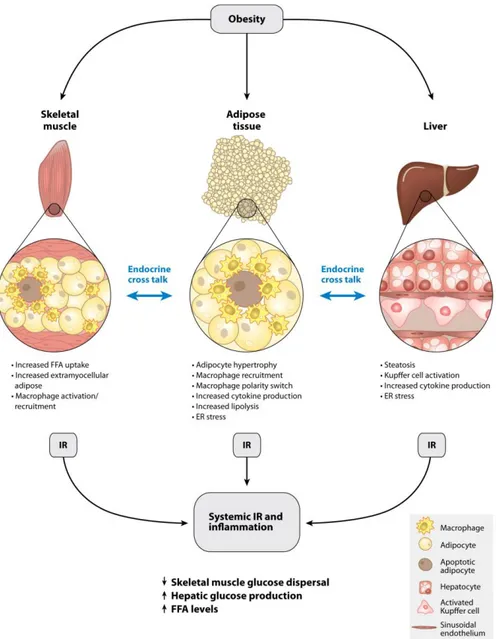
La résistance à l’insuline se développe chez les individus obèses et précède le diabète de type 2. Le concept de ce syndrome métabolique silencieux est illustré dans la figure 1.2 (Olefsky & Glass, 2010). L’insuline est une hormone peptidique sécrétée par les cellules bêta des îlots de Langerhans du pancréas (Wilcox, 2005). La résistance à l’insuline s’installe quand les cellules des tissus métaboliques (i.e. foie, muscles, tissu adipeux) répondent moins à l’insuline. Ceci va mener à une sécrétion compensatoire de l’insuline par les cellules bêta du pancréas afin de gérer les épisodes d’hyperglycémie post-prandiale (Olefsky & Glass, 2010).
Figure 1.2 L'obésité induit des altérationsqui entraînent une résistance à l'insuline et une inflammation dans le tissu adipeux, le foie et le muscle squelettique (Olefsky & Glass, 2010).
L’insuline exerce ses effets métaboliques en activant des voies de signalisation qui permettent, entre autres, de stimuler la captation et le métabolisme du glucose dans les cellules de façon spécifique par des protéines de transport (transporteurs de glucose ou GLUT). Tel qu’illustré à la figure 1.3, l’insuline se lie à son récepteur (IR), qui consiste en un hétérotétramère composé de deux sous-unités et deux sous-unités situé à la membrane cellulaire, et engendre un changement de conformation. L’auto-phosphorylation de l’IR permet la liaison de ses « insulin receptor substrate » (IRS) et phosphoryle ces derniers sur tyrosine. Les substrats IRS phosphorylés sont reconnus spécifiquement par le domaine « Src homology 2 (SH2) » et le domaine de liaison à la
phosphotyrosine (PTB) (Taniguchi et al., 2006) de protéines impliquées dans différentes voies de signalisation. La phosphatidylinositol 3-kinase (PI3K) est une enzyme permettant la transformation du phosphatidylinositol (4,5)-bisphosphate (PIP2) en phosphatidylinositol (3,4,5)-trisphosphate (PIP3) (Wilcox, 2005). PIP3 active la protéine phosphoinositide-dependent kinase-1 (PDK1) et recrute Akt, également connu sous le nom de protéine kinase B, à la membrane cellulaire. PDK1 phosphoryle Akt sur le site Thr308, l’un des deux résidus clés requis pour l’activation d’Akt, et la protéine p70 S6 kinase (S6K). À son tour Akt va activer AS160 pour faciliter l’absorption du glucose dans les adipocytes et les cellules musculaires en permettant la translocation de GLUT4 à la membrane. Parmi les cibles d'Akt, les facteurs de transcription, tels que glycogen synthase kinase-3 (GSK3) et forkhead box sub-group O (FoxO), jouent un rôle essentiel dans le maintien de l’homéostasie du glucose. La phosphorylation inactive de GSK3 par Akt conduit à une augmentation de la synthèse du glycogène (Manning & Cantley, 2007). FoxO est inactivé par la phosphorylation d’Akt, ce qui résulte en l’inhibition de la gluconéogenèse dans le foie, tandis que dans le tissu adipeux, cela permet l’activation de PPAR engendrant ainsi la différenciation des adipocytes (Nakae et al., 2003; Puigserver et al., 2003). Dans le muscle, FoxO joue un rôle dans la différenciation des myoblastes en myotubes et ce, indépendamment de sa phosphorylation (Gross et al., 2008). Le mechanistic target of rapamycin (mTOR) joue également un rôle au niveau de la signalisation de l’insuline. mTOR est une sérine (ser)/thréonine (thr) kinase sensible à la rapamycine qui se retrouve dans deux complexes protéiques distincts, soit mTORC1 et mTORC2. La signalisation de mTOR Complex 1 (mTORC1) est facilitée par raptor, une protéine adaptatrice. La GTPase RAS homolog enriched in brain (Rheb) déclenche la signalisation de mTORC1. Lorsqu’il est activé, mTORC1 phosphoryle p70 S6K, ce qui inhibe la signalisation de l’insuline. mTOR Complex 2 (mTORC2) contient la protéine adaptatrice rictor, ce qui permet la phosphorylation d’Akt au site S473, qui est l’autre résidu clé nécessaire à l’activation d’Akt. Ainsi, mTOR est un régulateur clé de la voie de signalisation de l’insuline qui phosphoryle et active à la fois p70 S6K et Akt (Hajiaghaalipour et al., 2015).
Figure 1.3 La voie de signalisation de l'insuline favorise l’absorption du glucose, la traduction de protéines
et la croissance cellulaire (Hajiaghaalipour et al., 2015)
Il existe 3 gènes Akt : Akt1, Akt2 et Akt3. La sérine/thréonine kinase Akt/PKB joue un rôle clé dans la régulation de la croissance cellulaire, la survie et le métabolisme. La fonction de chaque isoforme est distincte. Les souris invalidées pour Akt1/PKB présentent un retard de croissance tandis que les souris invalidées pour alpha Akt2/PKB beta développent une résistance à l’insuline (Garofalo et al., 2003). Ainsi, Akt1 favorise la survie cellulaire en bloquant l’apoptose, ce qui est d’ailleurs un facteur important dans de nombreux types de cancer. Akt2 est impliqué dans la signalisation de l’insuline. Akt3 joue quant à lui un rôle au niveau du cerveau. Selon une étude menée afin de déterminer l’importance des isoformes d’Akt, il a été démontré que les souris déficientes en Akt2 et Akt3 sont viables. L’isoforme Akt1 est en mesure d’effectuer les fonctions d’Akt essentielles, comme l’homéostasie du glucose, la prolifération, la différenciation et le développement. Par contre, les souris Akt2 KO et Akt3 KO présentent une intolérance au glucose et à l’insuline, ce qui démontre le rôle de ces derniers (Dummler et al., 2006).
Tel que mentionné précédemment, le glucose pénètre dans les cellules de façon spécifique par des protéines membranaires intégrales, les transporteurs de glucose (GLUT). Plusieurs isoformes de GLUT maintiennent l’homéostasie du glucose (Herman & Kahn, 2006). GLUT1 se retrouve dans toutes les cellules, dont les cellules endothéliales de la barrière hémato-encéphalique, et permet le transport du glucose basal afin d’assurer les fonctions vitales. Ce transporteur agit par diffusion facilitée. Il n’a donc pas besoin d’insuline pour être activé, ce
qui permet de conserver son activité pendant l’état de jeûne. Issu de la même famille, GLUT4 est le principal transporteur de glucose sous l’action de l’insuline dans les cellules adipeuses et musculaires (Huang & Czech, 2007). En période de jeûne, GLUT4 est localisé à l’intérieur des cellules. Après stimulation par l’insuline, il est recruté à la membrane, ce qui permet l’entrée subséquente de glucose dans la cellule. La cascade de signalisation de l’insuline (figure 1.3) illustre bien l’importance d’Akt dans la translocation de GLUT4 à la membrane cellulaire via AS160 (Hajiaghaalipour et al., 2015). Dans l’obésité et le diabète type 2, l’expression de GLUT4 est diminuée dans le tissu adipeux, mais conservée dans le muscle (Abel et al., 2001). La résistance à l’insuline s’explique notamment par une translocation inadéquate de GLUT4 de vésicules intracellulaires à la surface des cellules (Tremblay et al., 2003).
En temps normal, la cascade de l’insuline mène à l’internalisation du glucose et la diminution de la glycémie. Par contre, lors d’une résistance à l’insuline, l’insuline est incapable d’effectuer son action. Plusieurs molécules inhibitrices interfèrent avec la phosphorylation de la tyrosine du récepteur d’insuline (Taniguchi et al., 2006). En plus d’être phosphorylé positivement sur les résidus tyrosine par une stimulation insulinique, IRS-1 est phosphorylé sur des résidus sérines ce qui inhibe la signalisation d’insuline (Draznin, 2006). Lors d’un excès de nutriments, la voie mTORC1/S6K1 est suractivée ce qui mène à la phosphorylation d’IRS1 sur plusieurs serines (Tremblay & Marette, 2001). De plus, l’insuline et l’hyperglycémie active p90 ribosomal S6 kinase (RSK), qui est connu pour activer la voie mTORC1. RSK est un nouveau régulateur de la signalisation de l’insuline, qui agit en phosphorylant la sérine S1101 de l’IRS-1 (Smadja-Lamere et al., 2013). Ainsi, mTORC1/S6K1 et RSK sont impliquées dans le développement de la résistance à l’insuline, de l’obésité et du diabète de type 2 par la phosphorylation sur sérine de IRS-1. De plus, l’inflammation chronique associée à l’obésité rend les personnes plus susceptibles de devenir résistantes à l’insuline. Les c-Jun N-terminal kinases (JNK) sont activées par des cytokines inflammatoires et des acides gras libres. Son activité est élevée dans l’obésité et conduit également à la phosphorylation de la sérine d’IRS-1. Les souris invalidées pour JNK démontrent une diminution de l’adiposité et une amélioration de la sensibilité à l’insuline (Hirosumi et al., 2002).
Le diabète
La prévalence mondiale du diabète ne cesse d’augmenter. Chez les adultes de plus de 18 ans, elle est passée de 4,7% en 1980 à 8,5% en 2014 (figure 1.4) (OMS). Selon l’organisation mondiale de la santé (OMS), le nombre de personnes vivant avec le diabète a pratiquement quadruplé depuis 1980 (OMS). Le diabète est une maladie chronique qui apparaît lorsque le pancréas ne produit pas suffisamment d’insuline ou que l’organisme n’est pas en mesure d’utiliser correctement l’insuline qu’il produit. Il existe différentes formes de diabète : diabète de type 1, le diabète de type 2 et le diabète gestationnel. Le diabète de type 1, anciennement appelé diabète
insulino-dépendant ou juvénile, peut être diagnostiqué à n’importe quel âge mais c’est l’une des maladies chroniques les plus courantes de l’enfance (Atkinson et al., 2014). La prise en charge du diabète de type 1 nécessite l’injection quotidienne d’insuline. Le diabète de type 2 est le plus fréquent et résulte d’une surcharge pondérale et de la sédentarité. La prévention du diabète est essentielle car la maladie est souvent diagnostiquée des années après son apparition lorsque les complications sont déjà présentes. L’intervention est requise lorsque la glycémie à jeun est égale ou supérieure à 7,0 mmol/L (OMS). Comme son nom l’indique, le diabète gestationnel apparaît temporairement chez la femme durant sa grossesse ayant des valeurs de glycémie supérieures à la normale sans pour autant atteindre le seuil du diagnostic. Elle est alors plus à risque de développer un diabète de type 2 à long terme. Le diabète est une cause majeure de cécité, d’insuffisance rénale, d’accidents cardiaques, d’accidents vasculaires cérébraux et d’amputation des membres inférieurs. La prévention du diabète de type 2 nécessite une alimentation saine en évitant la consommation de sucre, de gras saturés et également l’usage du tabac. De plus, il est recommandé de pratiquer régulièrement une activité physique pour le maintien d’un poids corporel sain (OMS).
Figure 1.4 Estimations mondiales de la prévalence du diabète chez les adultes (âgés de 35 à 64 ans) pour 2000 et 2030 selon l’Organisation Mondiale de la Santé (OMS).
Le tissu adipeux
Le tissu adipeux est composé d’une variété de cellules : adipocytes, préadipocytes, fibroblastes, cellules endothéliales, cellules mésothéliales, monocytes, macrophages et cellules souches multipotentes pouvant se différencier en plusieurs types cellulaires (Moreno-Navarrete & Fernández-Real, 2012). La formation du tissu adipeux est liée à sa capacité de vascularisation. La fraction stroma-vasculaire du tissu adipeux contient des cellules souches mésenchymateuses (en anglais : mesenchymal stem cells (MSC)) multipotentes qui possèdent la capacité de se différencier in vitro en différentes cellules de la lignée mésenchymateuse, y compris les adipocytes, ostéoblastes, les chondrocytes et les myoblastes (Zuk et al., 2002). Deux types de tissu adipeux sont présents chez l’humain : le tissu adipeux blanc et le tissu adipeux brun. Le premier constitue la principale source d’énergie tandis que le second est le lieu de la thermogenèse. Étant donné les propriétés biochimiques et fonctionnelles distinctes, le tissu adipeux blanc sera considéré dans le cadre de ce mémoire. Le tissu adipeux blanc se distingue également en deux catégories : le tissu adipeux blanc sous-cutané et le tissu adipeux blanc viscéral. Tel que mentionné précédemment, les propriétés sont différentes dépendamment de la localisation du tissu adipeux blanc. Généralement, le tissu adipeux est situé sous la peau dans divers dépôts sous-cutanés et occupe un rôle protecteur en agissant comme isolant thermique. À l’inverse, le tissu adipeux peut s’établir près des organes internes, et constituer ce que l’on nomme graisse viscérale. Le corps peut ainsi utiliser les réserves pour produire de l’énergie par catabolisme, ce qui permet d’alimenter les fonctions vitales, c’est-à-dire le système nerveux central et le cœur. Le tissu adipeux a une capacité d’expansion impressionnante suite à un apport calorique excessif. Deux mécanismes sont impliqués dans le développement du tissu adipeux : l’hyperplasie et l’hypertrophie. L’hyperplasie est l’augmentation du nombre d’adipocytes tandis que l’hypertrophie est l’augmentation de la taille des cellules (Spalding et al., 2008). Ces processus sont influencés par l’alimentation et la génétique (Jo et al., 2009).
La proximité avec les vaisseaux sanguins permet au tissu adipeux de communiquer avec les autres tissus. Ainsi, le tissu adipeux joue un rôle endocrinien essentiel pour maintenir l’homéostasie physiologique. Il synthétise et sécrète des cytokines/chimiokines, telles que TNF-, IL-1, IL-6, IL-10 et la protéine chimiotactique des monocytes 1 (MCP-1). La production des cytokines est augmentée chez les personnes obèses (Grundy, 2004). La sécrétion d’adipokines (leptine, adiponectine, résistine, etc.) exerce des effets négatifs ou positifs sur la sensibilité à l’insuline (Rajala & Scherer, 2003). Ces hormones circulantes permettent de communiquer avec le système nerveux central et de l’informer des réserves d’énergie. Par exemple, la leptine réduit l’apport alimentaire tandis que la ghréline, produite principalement par l’estomac, le stimule (Meier & Gressner, 2004). Ce système de régulation permet de maintenir l’équilibre énergétique du corps. Un déficit en leptine cause l’obésité. Dans le cadre d’essai clinique, l’administration quotidienne de leptine humaine recombinante à des patients présentant un déficit congénital en leptine a entraîné une perte de poids impressionnante (Farooqi &
O'Rahilly, 2009). Par contre, un traitement à la leptine ne s’avère pas à être une solution efficace chez les obèses n’ayant pas de déficit congénital en leptine. Au contraire, chez les obèses, la concentration de leptine est élevée, ce qui résulte plutôt à une résistance à la leptine, empêchant ainsi de réduire l’apport alimentaire (Meier & Gressner, 2004). L’adiponectine est sécrétée de façon constitutive dans le tissu adipeux. L’adiponectine a plusieurs effets. Dans le foie, elle améliore l’oxydation des acides gras et réduit la production de glucose hépatique (Turer & Scherer, 2012; Yamauchi et al., 2002). Dans le muscle, elle stimule l’utilisation du glucose et de l’oxydation des acides gras (Yoon et al., 2006). Dans le tissu adipeux, l’adiponectine augmente la captation des acides gras (Turer & Scherer, 2012). Elle est un bon biomarqueur de la résistance à l’insuline étant donné que son expression et sa sécrétion sont diminuées dans l’obésité viscérale (Turer & Scherer, 2012). Le tissu adipeux est également un site majeur pour le métabolisme des stéroïdes sexuels et des glucocorticoïdes (Kershaw & Flier, 2004). Dans l’obésité, on observe des dysfonctionnements hormonaux. Les glucocorticoïdes sont impliqués dans la régulation du métabolisme et de la distribution de la graisse corporelle. Chez les individus obèses, il y a augmentation de la production locale de cortisol, un glucocorticoïde, ce qui contribue en partie à l’obésité viscérale. La progestérone, quant à elle, compétitionne pour le même récepteur que le cortisol, ce qui peut protéger contre les effets délétères du cortisol. Ainsi, la présence des différentes hormones dans les dépôts adipeux détermine le patron de distribution des graisses (Wajchenberg, 2000).
Tel que mentionné, le tissu adipeux peut subir une expansion importante suite à un surplus calorique, ce qui n’est pas nécessairement associée à des désordres pathologiques. Lorsque l’expansion du tissu adipeux est saine et anatomiquement limitée à la graisse sous-cutanée, on parle alors d’obèses métaboliquement sains. Lors du recrutement des cellules précurseurs d’adipocytes, il y a vascularisation du tissu jusqu’à la limite d’apport en oxygène. L’expansion adipeuse malsaine, associée à l’inflammation chronique dans le tissu adipeux viscéral, survient lorsque l’expansion rapide engendre l’hypertrophie des adipocytes, l’infiltration massive de macrophages, le développement limité de vaisseaux sanguins et la présence de fibrose (Sun et al., 2011). Ainsi, l’hypoxie est un déterminant qui limite la capacité de remodelage du tissu adipeux. Cette inflammation chronique joue d’ailleurs un rôle majeur dans le développement de la résistance à l'insuline et du diabète de type 2 (Neels & Olefsky, 2006; White & Marette, 2008). Le nombre d’adipocytes morts, positivement corrélé avec l’augmentation de la taille des adipocytes, est augmenté chez les individus obèses. Les macrophages entourent les adipocytes morts et constituent des « structures en forme de couronne », ce qui est une caractéristique de l’inflammation chronique (Cinti et al., 2005). Les macrophages ont deux phénotypes différents : M1 (pro-inflammatoire) et M2 (anti-(pro-inflammatoire). Il a été démontré chez la souris qu’une alimentation riche en matières grasses augmente le nombre de macrophages de type M1 et change le ratio M1/M2 (Fujisaka et al., 2009) ce qu’il rend l’environnement plus pro inflammatoire.
La lipogenèse
Les adipocytes permettent de conserver les surplus de lipides provenant de l’alimentation. Ils sont stockés sous forme de triglycérides, qui contiennent trois molécules d’acides gras formant un ester avec une molécule de glycérol. Par contre, les adipocytes peuvent également synthétiser de nouveaux lipides à partir de glucides en utilisant la lipogenèse de novo. Le contrôle de la lipogenèse s’effectue par une régulation hormonale et transcriptionnelle. L’insuline joue un rôle essentiel dans l’absorption et le stockage des sucres par le tissu adipeux via SREBP-1 (Kersten, 2001). La leptine est également impliquée dans le processus, en partie, via la voie SREBP-1 en limitant le stockage des graisses par l’inhibition de l’apport de glucose (Kersten, 2001). De plus, les hormones de croissance empêchent la stimulation de la lipogenèse dans les cellules adipeuses. La régulation transcriptionnelle s’effectue par les facteurs de transcription SREBPs (sterol regulatory element-binding proteins), qui sont des régulateurs importants de l’expression de gènes impliqués dans le métabolisme des lipides. Les différents isoformes permettent la synthèse d’acides gras et de cholestérol, principalement au niveau hépatique. Dans le tissu adipeux, ChREBP (Carbohydrate-responsive element-binding protein) est un facteur de transcription important pour la synthèse des acides gras et la sensibilité à l’insuline (Herman et al., 2012) PPAR est également un acteur majeur impliqué dans la lipogenèse au niveau du tissu adipeux. Une diminution de l’expression de PPAR peut conduire à une augmentation des taux de leptine et, par conséquent, diminuer la prise alimentaire (Kersten et al., 2000). Paradoxalement, l’expression de PPAR et de la leptine est faible à jeun, mais même dans cet état, la lipogenèse continue et dépend de PPAR (Kersten et al., 2000).
La lipolyse
Pendant la période de jeûne, l’hydrolyse enzymatique des lipides (triglycérides, diglycérides et monoglycérides) par le processus de la lipolyse, produit du glycérol et des acides gras libres (ou non estérifiés). La lipolyse est effectuée par trois enzymes majeures. Le clivage primaire du triacylglycérol en diacylglycérol est effectué par l’enzyme Adipose triglyceride lipase (ATGL). La lipase hormono-sensible (HSL) est une lipase de diglycérides essentielle dans les adipocytes. La lipase de monoglycérides (MGL) complète le processus en générant du glycérol et des acides gras libres afin qu’ils puissent être oxydés par les autres organes et produire une grande quantité d’ATP (Young & Zechner, 2013).
Les individus obèses ont une quantité importante d’acides gras non estérifiés dans la circulation sanguine, notamment dans le jeûne, étant donné le tissu adipeux imposant. Après un repas, l’insuline bloque la lipolyse via l’activation d’Akt. Lorsqu’il y a résistance à l’insuline, ce processus est inefficace dû à l’inaction de l’insuline entraînant une dyslipidémie (Choi et al., 2010). L’insuline ne peut pas contrôler la quantité d’acides gras libres.
L’excès d’acides gras non estérifiés, via une lipolyse basale augmentée à jeun ou une diminution de l’effet inhibiteur de l’insuline en condition postprandiale, est un déterminant important des altérations métaboliques associées à l’obésité abdominale. La concentration élevée d’acides gras non estérifiés provoque la résistance à l’insuline (Boden & Shulman, 2002).
Ainsi, le tissu adipeux agit comme régulateur du bilan énergétique en étant un site de réserve d’énergie dans l’état postprandial et une source d’acides gras libres pendant le jeûne. Le tissu adipeux a cependant une capacité de réserve limitée. Le débordement d’acides gras non estérifiés dans la circulation sanguine se dirige vers d’autres organes non spécialisés pour le stockage de lipides et altère leur fonctionnement normal.
L’adipogenèse
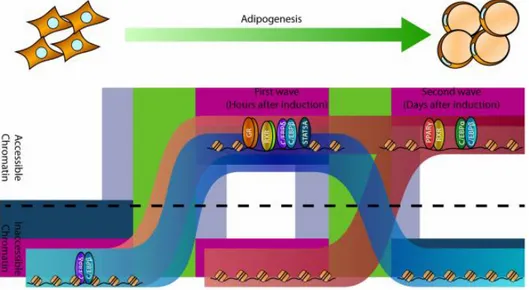
Les cellules adipeuses, aussi appelées adipocytes, sont dynamiques et constamment en renouvellement. Grâce à l’analyse de l’intégration du carbone 14 généré lors des essais des bombes nucléaires durant la guerre froide, une étude a démontré qu’environ 10% des cellules adipeuses sont renouvelées chaque année chez l’adulte (Spalding et al., 2008). Le nombre d’adipocytes est fixé durant l’adolescence et reste relativement stable à l’âge adulte. Ainsi, une perte de poids induit une réduction de la taille mais non du nombre d’adipocytes. La formation d’un adipocyte mature se produit en deux phases : la détermination et la différenciation terminale. La détermination implique l’engagement de la cellule précurseur en un pré-adipocyte. Ce dernier acquiert, lors de sa différenciation terminale, les caractéristiques d’un adipocyte mature (figure 1.5) (Lefterova et al., 2014).
Figure 1.5 La différenciation adipocytaire
se fait à travers deux ondes d’activation des facteurs de transcription.
La coordination d’un réseau complexe de signaux, stimulants ou inhibiteurs, régule l’adipogenèse comprenant les facteurs de transcription, les régulateurs du cycle cellulaire, les signaux extracellulaires, les hormones, facteurs angiogéniques et les petites molécules (Rosen & MacDougald, 2006). Deux facteurs de transcription, C/EBP- et C/EBP-, induisent le processus de différenciation cellulaire selon lequel des pré-adipocytes deviennent des adipocytes matures, ce qui conduit à l’expression du « Peroxisome proliferator-activated receptor gamma (PPAR) » et de C/EBP- (Hishida et al., 2009). Ces ondes d’activation sont associées à des changements dans l’accessibilité de la chromatine pour la liaison des facteurs de transcription (Lefterova et al., 2014). La réaction en chaîne des C/EBPs et de PPAR permet d’assurer la différenciation complète des pré-adipocytes. Le maître de l’adipogenèse est le facteur de transcription PPAR.
PPAR
PPAR est un membre de la superfamille des récepteurs nucléaires. Cette famille est également composée de PPAR et PPAR. Grâce à leur distribution tissulaire distincte et à une activation spécifique du gène cible, les trois PPARs contrôlent divers aspects du métabolisme des acides gras, du bilan énergétique, de la sensibilité à l'insuline et de l'homéostasie du glucose (Evans et al., 2004).
Fortement exprimé dans les adipocytes, PPAR est requis pour la différenciation du tissu adipeux in vivo et in
vitro (Rosen et al., 1999). Dépendant de la liaison à un ligand, PPAR forme un hétérodimère avec le récepteur
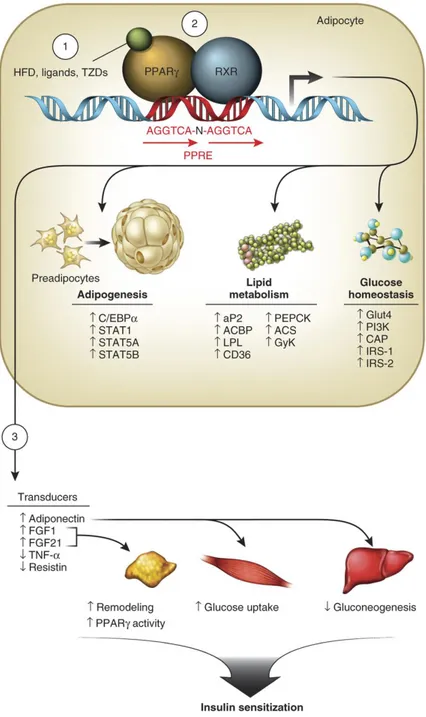
X de l’acide rétinoïque (RXR) et se dissocie des corépresseurs. Le complexe PPAR/RXR se fixe sur une séquence spécifique de l’ADN appelée PPRE (peroxisome proliferator response element), suivi du recrutement de coactivateurs et de la machine transcriptionnelle pour initier l’expression des gènes cibles (Tontonoz. et al., 1994). PPAR a plusieurs rôles dans l’adipocyte (figure 1.6), en contrôlant l’expression de gènes impliqués dans l’adipogenèse (C/EBP, CCAAT/enhancer-binding protein ; STAT1, STAT5A and STAT5B, signal transducer et activator of transcription 1, 5A and 5B), le métabolisme lipidique (aP2, fatty acid binding protein 2; ACBP, acyl-CoA–binding protein; LPL, lipoprotein lipase; CD36, cluster of differentiation 36; PEPCK, phosphoenolpyruvate carboxykinase; ACS, acyl-CoA synthetase; GyK, glycerol kinase) et l’homéostasie du glucose (GLUT4, glucose transporter 4; PI3K, phosphoinositide 3 kinase; IRS-1 and IRS-2, insulin receptor substrate 1 and 2). De plus, PPAR contrôle l’expression de nombreux facteurs sécrétés par le tissu adipeux, tels que l’adiponectine, les facteurs de croissance des fibroblastes (FGF), TNF- et la résistine, qui influencent également la sensibilité à l’insuline (Ahmadian et al., 2013).
Figure 1.6 Rôles de PPAR dans le tissu adipeux.
La diète riche en gras (HFD), les ligands ou les thiazolidinediones (TZD) (1) activent les hétérodimères fonctionnels PPAR-RXR (2) et maintiennent l’homéostasie métabolique par la régulation de gènes impliqués
dans la différenciation des adipocytes (adipogenèse), le métabolisme lipidique et l’homéostasie du glucose. De plus, PPAR contrôle l’expression de facteurs sécrétés à partir du tissu adipeux (3), ce qui influence
également la sensibilité à l’insuline (Ahmadian et al., 2013).
Au niveau du métabolisme lipidique, deux protéines ont retenu notre attention, soit FABP4 et CD36. Le cluster de différenciation 36 (CD36) est aussi connu sous le nom de fatty acid translocase (FAT), est une protéine
transmembranaire codée par le gène CD36. Elle permet l’importation des acides gras dans les cellules (Aitman et al., 1999). Les souris CD36 KO ont une réduction de la taille ainsi que du nombre d’adipocytes matures. L’absence de CD36 affecte négativement le recrutement de préadipocytes, ce qui augmente la lipolyse (Vroegrijk et al., 2013). La protéine de liaison aux acides gras FAPB4, aussi appelé aP2, codée par le gène Fabp4, est fortement sécrétée par les adipocytes pour réguler le métabolisme du glucose dans le foie. Les taux circulants de FABP4 sont plus élevés chez les individus obèses (Cao et al., 2013). Les études sur les souris déficientes en aP2 ont montré que cette protéine joue un rôle important dans le diabète de type 2 et l’athérosclérose. Ainsi, il a été démontré qu’un inhibiteur de la protéine aP2 est un agent thérapeutique efficace contre ces maladies (Furuhashi et al., 2007).
Ayant un rôle central dans les adipocytes, PPAR est une cible intéressante pour le traitement du diabète. La structure linéaire de PPAR, représentée dans la figure 1.7, est constituée de domaines fonctionnels distincts, y compris un domaine de transactivation N-terminal (AF1), un domaine de liaison à l’ADN hautement conservé (DBD) et un domaine de liaison au ligand C-terminal (LBD) contenant une fonction de transactivation dépendante du ligand (AF2). Ces domaines sont tous des cibles potentielles pour la modulation de PPAR. Les coactivateurs se lient à la région AF2 de PPAR et cette liaison est souvent caractérisée par un segment hydrophobe d’acides aminés contenant un motif LXXLL (Rosen et al., 2000).
Il existe 2 isoformes de PPAR, soit PPAR1 et PPAR2 (Tontonoz. et al., 1994). Ce dernier contient 30 acides aminés supplémentaires à son extrémité N-terminale (Tontonoz. et al., 1994). PPAR2 est un inducteur puissant de l’adipogenèse et spécifique dans le tissu adipeux, tandis que PPAR1 est plutôt ubiquitaire (Harris & Phipps, 2001). Il a été démontré que l’expression rétrovirale de PPAR2 est suffisante pour induire la différenciation des fibroblastes en adipocytes (Tontonoz et al., 1994). Les co-activateurs de PPAR2 favorisent la différenciation cellulaire selon une dose-réponse (Tontonoz et al., 1994).
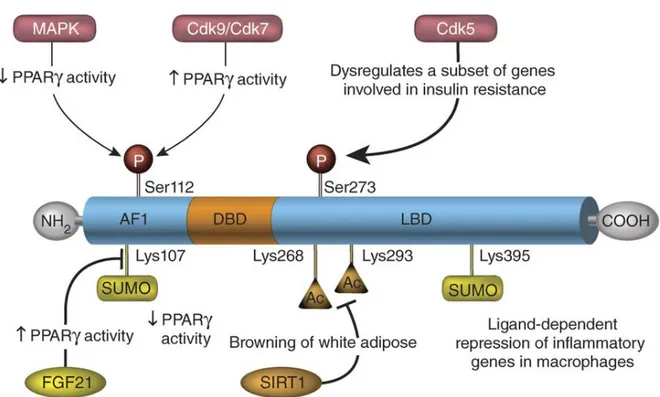
Plusieurs mécanismes permettent la régulation de l’activité de PPAR, tels que par des interactions protéines-protéines, les cofacteurs nucléaires (co-represseurs et co-activateurs), la phosphorylation ainsi que différentes modifications post-traductionnelles covalentes (acétylation, ubiquitylation, O-GlcNacylation et SUMOylation) (figure 1.7) (Ahmadian et al., 2013). PPAR est phosphorylé dans la région AF1 sur la sérine 112 par la mitogen-activated protein kinase (MAPK), ce qui inhibe son activité transcriptionnelle en réprimant la liaison du ligand et en modifiant le recrutement des cofacteurs (Hu et al., 1996). Fait surprenant, la phosphorylation du même site par les cyclin-dependent kinases (Cdk7 et Cdk9) augmentent l’activité de PPAR (van Beekum et al., 2009). Un autre site bien connu de phosphorylation sur sérine est le site Ser273 dans la région LBD par Cdk5 (Choi. et al., 2011), une protéine kinase qui peut être activée par diverses cytokines pro-inflammatoires dont les quantités
sont élevées dans l’obésité (Ahmadian et al., 2013). De nouvelles études portent sur la phosphorylation sur tyrosine de PPAR. Parmi celles-ci, une étude a démontré que la nonreceptor tyrosine kinase Abelson murine leukemia viral oncogene (c-Abl), activée pendant la phase précoce de la différenciation des préadipocytes 3T3-L1, favorise la différenciation des adipocytes en ciblant PPAR2. L’activité de la protéine tyrosine kinase c-Abl est essentielle et son inhibition bloque la différenciation des adipocytes matures. C-Abl augmente la stabilité de PPAR2 en phosphorylant deux résidus de tyrosine (Y78 et Y102) (Keshet et al., 2014). Au contraire, le récepteur du facteur de croissance épidermique (EGFR) induit la phosphorylation du résidu Y74 de PPAR, ce qui conduit à la dégradation de ce dernier (Xu. et al., 2016). Selon une autre récente étude, la phosphorylation du résidu Y78 par la kinase c-Src supprime l’expression de gènes pro-inflammatoire ainsi que la sécrétion de chimiokines et de cytokines dans les adipocytes. De plus, la phosphorylation sur tyrosine (Y78) améliore la sensibilité à l’insuline. Ce processus est d’ailleurs inversé par la protéine tyrosine phosphatase PTP-1B (Choi et al., 2015).
Figure 1.7 Structure primaire de PPAR représentant les modifications post-traductionnelles qui influencent à la fois son activité transcriptionnelle et sa stabilité protéique de manière dépendante du type cellulaire et du contexte. Ac : acétylation; P : phosphorylation; SUMO : sumoylation; Ser : serine; Lys : lysine;
AF1: domaine de transactivation N-terminal; DBD : domaine de liaison à l’ADN hautement conservé; LBD : domaine de liaison au ligand C-terminal (Ahmadian et al., 2013)
Les thiazolidinediones (TZD) forment une classe de médicament, utilisée autrefois pour le traitement du diabète de type 2, qui permet de réguler PPAR en réduisant la glycémie. Ces molécules de TZD (rosiglitazone, pioglitazone, troglitazone, etc.) sont des agonistes synthétiques activant PPAR. La structure tertiaire de PPARrévèle une poche de liaison au niveau de la région LBD où se lient les TZD. Cela entraîne un changement conformationnel, permettant la dissociation des répresseurs ainsi que la liaison des co-activateurs, ce qui active PPAR (Nolte et al., 1998). Par contre, plusieurs effets secondaires ont été signalés tels que : prise de poids, risque maladie cardiaque, œdème pulmonaire et défaillance hépatique (Nesto et al., 2003; Scheen, 2001).
Modèles pour étudier l’adipogenèse
La lignée cellulaire de souris, 3T3-L1, est l’un des modèles les plus utilisés pour étudier l’adipogenèse in vitro. Les cellules 3T3-L1 dérivent des cellules 3T3 obtenu pour la première fois en 1963 par Todaro et Green (Todaro & Green, 1963). Le nom « 3T3 » fait référence au protocole utilisé « 3-day transfer, inoculum 3 x 105 cells ».
Cette lignée cellulaire a été générée à partir de fibroblastes embryonnaires de souris qui ont été trypsinisés pour permettre le transfert tous les 3 jours à une densité cellulaire de 3 x 105. Après 20-30 générations, les cellules
étaient immortalisées. À partir de la lignée 3T3, ils ont isolé des cellules qui accumulent des triglycérides, lorsqu’elles ont atteint la confluence. Cette autodifférenciation a permis de générer la lignée 3T3-L1 (Green & Kehinde, 1974). Les 3T3-L1 permettent ainsi d’étudier le processus de différenciation terminale.
En pratique, les fibroblastes sont mis en plaques lors de la phase de croissance exponentielle et un arrêt de croissance est observé lorsque les cellules atteignent la confluence (Gregoire et al., 1998). Les cellules sont exposées à un cocktail de différenciation (insuline, dexamethasone, 3-isobutyl-1-methylxanthine (IBMX)) 2 jours post-confluence pour enclencher le processus de différenciation (Ruiz-Ojeda et al., 2016). Des événements morphologiques, biochimiques et moléculaires sont enclenchés. Une variété de gènes est influencée sous le contrôle de facteurs de transcription, tel que démontré précédemment dans la figure 1.6 (Ahmadian et al., 2013).
D’autres modèles in vitro, ayant des avantages et des inconvénients, permettent d’étudier l’adipogenèse. Les modèles de cellules souches, de cellules trans-différenciées et de cellules dédifférenciées sont relativement nouveaux (Poulos et al., 2010). Des modèles in vivo peuvent également permettre d’étudier les étapes précoces du développement du tissu adipeux (dépôt viscéral) et la différenciation terminale (dépôt sous-cutané) (Berry et al., 2013; Rodeheffer et al., 2008). Par contre, dans les deux cas, il faut considérer l’effet de la présence d’autres types cellulaires ainsi que la variabilité entre les individus (Berry et al., 2013).
Shp1
La régulation de la voie de signalisation de l’insuline est issue de l’interaction entre les kinases et les phosphatases, dont les protéines tyrosine phosphatases (PTPs), ce qui permet de conserver une fine régulation de la concentration de glucose dans le sang. Les PTPs sont des enzymes qui déphosphorylent leur substrat sur leurs résidus de tyrosine, tandis que les protéines tyrosine kinases (PTKs) les phosphorylent. La plupart du temps, les PTPs sont des régulateurs négatifs de la cascade de signalisation de l’insuline, comme par exemple, la Src homology region 2 domain-containing phosphatase-1 (Shp1).
La protéine tyrosine phosphatase Shp1 est produite grâce aux informations contenues dans le gène protein tyrosine phosphatase, non-receptor type 6 (Ptpn6) et est un membre de la famille des PTPs (Xu et al., 2014). Les PTPs régulent une variété de processus cellulaires, y compris la croissance cellulaire, la différenciation et l’adhésion (Wheeler et al., 2002). Dans les années 90, Shp1 a été identifiée pour la première fois dans les cellules hématopoïétiques (Matthews et al., 1992). Fortement exprimée dans les cellules hématopoïétiques, les cellules neuronales, les astrocytes, les oligodendrocytes, les microglies, les cellules épithéliales, Shp1 est également exprimée dans les cellules cibles de l’insuline, soit les cellules hépatiques, musculaires et adipeuses (Dubois et al., 2006). Shp1 se retrouve dans le cytoplasme et le noyau. Shp1 possède 2 domaines SH2 au N-terminale pour la liaison de substrat et un domaine phosphatase catalytique au C-N-terminale. Sa forme inactive est une structure repliée qui bloque son site catalytique. Son activité est stimulée lors de la liaison avec le site phosphorylé de la tyrosine du substrat (Xu et al., 2014).
Shp1 est impliquée dans une variété de voies de signalisation telles que PI3K/Akt, Jak-STAT, MAPK (ERK et JNK) et NFB, qui sont responsables de nombreuses fonctions cellulaires dans la survie, le développement, la régulation immunitaire, l’oncologie et le métabolisme. Shp1 est important pour la survie et le développement en agissant à différents stades de développement des cellules hématopoïétiques en régulant ainsi le processus d’hématopoïèse (Paling & Welham, 2005). La preuve la plus significative que Shp1 régule les fonctions immunitaires provient des modèles de souris avec l’absence de Shp1 dans tout le corps, ce qui provoque de l’inflammation et la mort prématurée (Lorenz, 2009). Ainsi, pour étudier le rôle de Shp1, un modèle viable de souris est utilisé par un épissage différent, ce qui la rend inactive (Lorenz, 2009). De plus, Shp1 est impliquée dans les cellules cancéreuses, où elle exerce différentes fonctions dans le contrôle de la croissance cellulaire et la médiation des activités des cellules immunitaires. Shp1 a été proposé comme un gène suppresseur de tumeur (Wu et al., 2003). La dysfonction de la régulation de Shp1 peut provoquer une croissance cellulaire anormale et induire différents types de cancers (Wu et al., 2003). Au niveau du métabolisme, Shp1 est également exprimée dans les tissus cibles de l’insuline tel que le muscle, le foie et le tissu adipeux et son expression est augmentée dans un contexte d’obésité (Xu et al., 2014). Shp1 régule négativement l’homéostasie
du glucose (Dubois et al., 2006). Shp1 agit sur la voie de régulation de l’insuline et de sa clairance en ciblant plusieurs molécules (Xu et al., 2014). Shp1 module l’activité de Carcinoembryonic antigen-related cell adhesion molecule 1 (CEACAM1), un régulateur clé dans la clairance de l’insuline et de son action, en la déphosphorylant sur la membrane plasmique, réduisant ainsi l'endocytose du complexe insuline-IR, mais aussi en la déphosphorylant après l'internalisation, empêchant ainsi sa dégradation lysosomale et favorisant son recyclage sur la surface de la cellule (Huber et al., 1999). Shp1 déphosphoryle l'IR à la fois sur la membrane plasmique et après internalisation dans les endosomes (Xu et al., 2014). Cette protéine tyrosine phosphatase inhibe également PI3K en déphosphorylant la sous-unité régulatrice p85 (Cuevas et al., 2001).
En utilisant une forme inactive de Shp1 qui augmente le captage des substrats, le transport de glucose est augmenté dans les cellules musculaires. L’inhibition de Shp1 augmente la signalisation de l’insuline et l’expression du transporteur de glucose GLUT4 (Bergeron et al., 2011). La délétion spécifique de Shp1 dans les hépatocytes protège les souris contre la résistance à l’insuline liée à l’obésité (Xu et al., 2012). Ces dernières accumulent plus de gouttelettes lipidiques que les souris obèses contrôles, mais elles sont protégées contre l'inflammation et les dommages hépatocellulaires. Une analyse de type « microarray » a révélé une augmentation significative de l’expression de Pparg en l’absence de Shp1 dans les hépatocytes comparativement aux souris contrôles. De plus, l’activité de PPARs’est révélée être directement régulée par Shp1 in vitro. Donc, Shp1 joue potentiellement un rôle dans le métabolisme des lipides hépatiques via la régulation de PPAR (Xu. et al., 2014).
Hypothèse et objectifs
Sachant que Shp1 joue un rôle clé dans la signalisation de l’insuline dans le foie et le muscle, il était de mise de caractériser le rôle de Shp1 dans le tissu adipeux, un tissu également insulino-dépendant. Des travaux antérieurs du laboratoire ont montré une possible interaction entre Shp1 et PPAR dans les hépatocytes. Dans les souris Shp1 KO dans les hépatocytes, l’absence de Shp1 augmente l’expression et l’activité de PPAR (Xu. et al., 2014). Étant donné que PPAR est un régulateur majeur du stockage des acides gras dans le tissu adipeux, notre hypothèse de recherche est que Shp1 joue un rôle dans l’adipogenèse via la régulation de PPAR. Peu de recherches ont été effectuées jusqu’à présent sur le rôle de Shp1 dans les cellules adipeuses.
Les objectifs spécifiques du projet étaient de déterminer le rôle de Shp1 dans : 1. le processus de différenciation des adipocytes.
2. la signalisation de l’insuline, et 3. la fonction adipocytaire.
Afin de caractériser le rôle de Shp1 dans la différenciation des cellules 3T3-L1 nous avons utilisé des lentivirus spécifiques pour diminuer l’expression de Shp1 ou pour surexprimer de façon constitutive son expression dans ces cellules. L’état physiologique des cellules a été mesuré par la coloration Oil-Red-O (ORO), le contenu en triglycérides (TG), l’expression de gènes cibles et de leurs protéines, la réponse à l’insuline par le transport du glucose et l’expression et la phosphorylation de protéines associées à la cascade de l’insuline.
Chapitre 2 : Role of Shp1 in adipocyte
differentiation and insulin signaling
Marie-Pier Forest
1, Marie-Hélène Lavallée-Bourget
1, Michael Schwab
1, Kerstin
Bellmann
1, and André Marette
11Department of medecine, Cardiology Axis of the Institut Universitaire de Cardiologie et de
Pneumologie de Québec, Québec, Canada.
Running title: Role of Shp1 in adipogenesis
To whom correspondence should be addressed: André Marette, Ph.D.
Cardiology Axis of the Institut Universitaire de Cardiologie et de Pneumologie de Québec (IUCPQ),
Québec, Canada.
Tel: 418-656-8711 (ext. 3781); Fax: 418-656-4749 ; E-mail: andre.marette@criucpq.ulaval.ca
Résumé
La protéine tyrosine phosphatase Shp1 régule négativement la signalisation de l’insuline et l’homéostasie du glucose dans le foie et le muscle, mais son rôle dans le métabolisme des glucides et des lipides dans le tissu adipeux est inconnu. Les travaux récents ont montré un lien possible entre Shp1 et PPARdans le foie. En utilisant les cellules 3T3-L1 pour étudier l’adipogenèse, nous avons observé une régulation fine de l’expression de Shp1 lors de la différenciation. La réduction de l’expression de Shp1 par shRNA n'a pas montré d'effet majeur sur la différenciation terminale des adipocytes, mais l'expression de plusieurs régulateurs clés incluant PPARa été retardée. Le transport du glucose des cellules différenciées n'a pas été affecté par la réduction de Shp1, bien que la phosphorylation d'Akt après stimulation à l'insuline ait été augmentée. Shp1 semble être impliquée dans l'adipogenèse et régule négativement la voie de signalisation de l'insuline PI3K-Akt dans les adipocytes.
Abstract
The protein-tyrosine phosphatase Shp1 negatively regulates insulin signaling and glucose homeostasis in liver and muscle, but its role in carbohydrate and lipid metabolism in adipose tissue is unknown. Recent work has shown a possible link between Shp1 and PPAR in the liver. Using 3T3-L1 cells as a model for adipogenesis, we observed a fine regulation of Shp1 expression during differentiation. Knocking down Shp1 by shRNA did not show any major effect on the final differentiation of adipocytes, but the expression of several key regulators including PPAR was delayed during early adipogenesis. Glucose transport in fully differentiated cells was not affected by knockdown of Shp1, although Akt phosphorylation after stimulation with insulin was increased in those cells. Shp1 appears to be involved in adipogenesis and negatively regulates the PI3K-Akt insulin signaling pathway in adipocytes.
Introduction
Adipocytes are dynamic and constantly renewed (Spalding et al., 2008). The formation of a mature adipocyte occurs in 2 phases: determination and terminal differentiation. Determination is defined as the commitment of a precursor cell to become a pre-adipocyte. During terminal differentiation, the pre-adipocyte acquires the mature adipocyte characteristics. Adipogenesis is regulated by a complex network of signals, stimulators or inhibitors such as transcription factors, cell cycle regulators, extracellular signals, hormones, angiogenic factors and small molecules (Rosen & MacDougald, 2006). Peroxisome proliferator-activated receptor gamma (PPAR), a transcription factor, is a master regulator of adipogenesis. Its activity is modulated on many different levels including transcription, posttranslational modifications and binding of co-activators and co-repressors. A prerequisite for activation of PPAR is the formation of a heterodimer with the retinoid X receptor (RXR) and dissociation of co-repressors. By binding to a specific sequence of the DNA called peroxisome proliferator response element (PPRE) the PPAR-RXR heterodimer in complex with other co-activators recruits the transcriptional machinery and initiates expression of the target genes (Tontonoz. et al., 1994). PPAR regulates many genes involved in lipid metabolism, such as FABP4 and CD36.
Protein tyrosine phosphatases (PTPs) are critical regulators of cellular phosphorylation acting on processes such as cell growth, differentiation, and adhesion (Wheeler et al., 2002). Different PTPs play a role in adipogenesis, such as PTP1B and Shp2. Adipocyte-specific PTP1B deletion increases lipogenesis and adipocyte cell size (Owen et al., 2012). Also, these mice exhibit decreased glucose tolerance. On the other hand, Shp2 promotes adipogenesis through inhibition of p38 MAP kinase (He et al., 2013). Ablation of Shp2 in adipocytes leads to premature death, lack of white fat, low blood pressure, compensatory erythrocytosis, and hepatic steatosis. Src homology region 2 domain-containing phosphatase-1 (Shp1), another member of the PTP family related to Shp2, is encoded by the protein tyrosine phosphatase gene, non-receptor type 6 (Ptpn6) (Yi et al., 1992). Shp1 contains two SH2 domains located in the N-terminal half for binding to phospho-tyrosine motifs and a C-terminal catalytic phosphatase domain. In its inactive form, the N-terminal SH2-domain folds back to the catalytic site thereby inhibiting its activity. Shp1 is activated upon binding of either one of the SH2-domains to a phospho-tyrosine site rendering the catalytic domain accessible for its substrates.
Although Shp1 is predominantly expressed in hematopoetic cells (Yi et al., 1992), it has also been shown to be expressed in insulin-sensitive organs such as skeletal muscle, liver and adipose tissue (Dubois et al., 2006). Shp1 plays a major role in immunity as revealed by the impact of mutations in the Ptpn6 gene, which leads to inflammation and premature death, known as the motheaten (me/me) phenotype. To study the role of Shp1, a viable mouse model (mev/mev) was used via a different splicing making it non-functional (Tsui et al., 1993). We