INFORMATION TO USERS
This manuscript has been reproduced from the microfilm master. UMI films the text directly from the original or copy submitted. Thus, some thesis and dissertation copies are in typewriter face, white others may be from any type of computer printer.
The quality of this reproduction is dependent upon the quality of the copy submitted. Broken or indistind print, colored or poor quality illustrations and photographs, print bleedthrough, substandard margins, and improper alignment can adversely affect reproduction.
ln the unlikely event that the author did not send UMI a complete manuscript and there are missing pages, these will be noted. Also, if unauthorized copyright material had to be removed, a note will indicate the deletion.
Oversize materials (e.g., maps, drawings, charts) are reproduced by sectioning the original, beginning at the upper left-hand comer and continuing from left to right in equal sections with small overlaps.
ProQuest Information and Leaming
300 North Zeeb Road, Ann Arbor, Ml 48106-1346 USA 800-521-0600
Université de Sherbrooke
Propriétés oxydantes et antioxydantes des estrogènes et de ses métabolites impliqués dans un cycle rédox
par Paul A. Thibodeau
Département de médecine nucléaire et de radiobiologie
Thèse présenté à la Faculté de médecine en vue de l'obtention du grade de
l+I
National Libraryof Canada Bibliothèque nationale du Canada AcQuisitions and
Bibliographie Services Acquisitions et services bibliographiques
385 Wellnglon Street Ollawa ON K1A ON4 c..a
385, rue WeWngean
ana-ON K1AON4 CMMla
The
author
bas
granted
a
non-exclusive licence allowmg the
National Library of
Canada to
reproduce, loan, distnbute
or
sen
copies of
tbis
tbesis
in
microfonn,
paper
or
electronic
formats.
The author retains ownership of the
copyright in tbis thesis. Neither the
thesis nor substantial extracts ftom it
may
be printed
or
otherwise
reproduced
without
the
autbor's
permission.
L'
autelU' a accordé unelicence non
exclusive
permettant à
la
Bibliothèque nationale du
Canada
de
reproduire, prêter, distribuer ou
vendre
des
copies de cette thèse sous
la forme
de
microfiche/film,
de
reproduction sm papier ou sur format
électronique.
L'auteur conserve la propriété du
droit
d'auteur qui protège
cettethèse.
Ni la thèse
ni
des extraits substantiels
de celle-ci ne doivent
être
imprimés
ou autrement reproduits sans son
autorisation.
Je dédie ma thèse de doctorat à la mémoire des victimes des attentats terroristes du 11 septembre 2001 du World Trade Center et du Pentagone
'Il est plus difficile de briser un préjugé qu 'un atome. · Albert Einstein
Liste des figures Liste des abréviations Résumé
TABLE DES MATIÈRES
Chapitre 1 - Introduction ... 1
l . Estro gènes ... 1
2. Récepteur des estrogènes ... 2
2.1 ERa. et ERP ... 3
2.2 Mode d'action des stéroïdes ... 5
2.3 Migration du ER vers l' ADN ... 7
2.3 .1 Dissociation des protéines de choc thermique ... 7
2.3.2 Dimérisation des récepteurs ... 8
2.3.3 Doigts de zinc ... 8
2.3 .4 Protéines accessoires au ER ... l 0 3. Métabolisme des estrogènes ... 11
3.1 Cytochromes P450 ... 11
3.2 Métabolites des estrogènes ... 13
3 .2. l l 6a.-hydroxyestrone ... 16
3.2.2 Catécholestrogènes ... 17
3 .2.3 Méthoxyestrogènes ... 20
3.3 Cycle rédox des estrogènes (CYP450-dépendant) ... 22
4. Stress oxydatif ... 25
4.1 Espèces réactives de l'oxygène ... 27
4. 1.1 L'anion superoxyde ... 2 7 4.1.2 Le peroxyde d'hydrogène ... 28
4.1.3 Le radical hydroxyle ... 30
4.2 La réaction de Fenton ... 30
4.3 Stress oxydatif et cancer ... 31
4.4 Dommages oxydatifs à l' ADN ... 33
4.5 La peroxydation des lipides ... 35
5. Estrogènes et cancer du sein ... 39
5.1 Estrogènes et prolifération cellulaire ... 39
5.2 Épidémiologie du cancer du sein ... .41
5.3 Facteurs de risque ... 41
5.4 Estrogènes et dommages oxydatifs ... .44
5.5 Estrogènes et mutations ... 46
6. Effets bénéfiques des estrogènes ... 46
7. Description du projet de recherche ... .4 7 Chapitre II - Premier article ... 52 DNA damage induced by catecholestrogens in the presence of copper(II) :
Generation ofreactive oxygen species and enhancement by NADH P.A. Thibodeau et B. Paquette
Chapitre III - Deuxième article ... 64 Thiols can either enhance or suppress DNA damage induction by catecholestrogens P.A. Thibodeau, S. Kocsis-Bédard, J. Courteau, T. Niyonsenga, et B. Paquette
Free Radical Biology and Medicine 30( l) :62-73; 200 l
Chapitre IV -Troisième article ... 77
A model to determine the average number of single strand breaks induced in DNA plasmid
J. Courteau, T. Niyonsenga, P.A. Thibodeau, et B. Paquette
Journal of Theoretical Biology : soumis le 5 septembre 2001
Chapitre V - Quatrième article ... 92
Estrogens can behave as pro-oxidants or antioxidants
P.A. Thibodeau, R. Kachadurian, R. Lemay, B.J. Day, et B. Paquette
Journal ofSteroid Biochemistry and Molecular Biology: en préparation
Chapitre VI - Discussion ... 134
Chapitre VII -Conclusion ... 151
Remerciements ... 154
Liste des figures
FIGURE 1. Domaines du récepteur des estrogènes FIGURE 2. Doigts de zinc du récepteur des estrogènes FIGURE 3. Biosynthèse des stéroïdes
FIGURE 4. Estrogènes et métabolites FIGURE S. Adduit 16a.-hydroxyestrone FIGURE 6. Formation des méthoxyestrogènes
FIGURE 7. Cycle rédox du 2-0HE2
FIGURE 8. Cycle rédox du 2-0HE2 en présence de Cu(ll)
Liste des abréviations
ADN: acide désoxyribonucléique A TP: adénosine triphosphate bp: paire de bases
BRCAl: BReast CAncer Gene 1
BRCA2: BReast Cancer Gene 2 Ca2+: calcium
CE: catécholestrogènes
-CH2-: groupement méthylène
COMT: catéchol-0-méthyltransférase Cu(II): cuivre(II)
CuZnSOD: cuivre-zinc superoxyde dismutase CYP450: cytochrome P450
DES: diéthylstilbestrol
DHLA: acide dihydrolipoïque DHFR: dihydrofolate réductase OTT: dithiotreitol
E1: estrone
E2: estradiot
ER: récepteur des estrogènes
ERE: élément de réponse estrogénique ERO: espèces réactives de l'oxygène
PB: Plasma binding protein
PP: Protéines de liaison du promoteur
PUF As: acides gras polyinsaturés
R: récepteur
RDA: Relative Binding Affinity S: stéroïde
SHBG: Sex Hormone Binding Globulin T AF: Transcriptional Activation Protein
TNFa: Tumor Necrosis Factor alpha 2-0HE2: 2-hydroxyestradiol 4-0HE2: 4-hydroxyestradiol 2-MeOHE2: 2-méthoxyestradiol 4-MeOHE2: 4-méthoxyestradiol 2-0HE1: 2-hydroxyestrone 4-0HE1: 4-hydroxyestrone 2-MeOHE 1: 2-méthoxyestrone 4-MeOHE 1: 4-méthoxyestrone
RÉSUMÉ
Certains métabolites des estrogènes sont impliqués dans la carcinogénèse et dans le développement d'une résistance au méthotrexate. Dans cette étude, nous avons déterminé la corrélation entre ces effets biologiques et l'efficacité relative des estrogènes
à induire des cassures de brins del' ADN. Les cassures de brins de l' ADN induits par les
estrogènes étaient mesurés par la conversion de la forme surenroulée de l' ADN du bactériophage cpX-174 en ses formes circulaire et linéaire. Les plus actifs étaient les dérivés 4-hydroxy, lesquels ont produit 2.5 fois plus de cassures doubles brins de l' ADN que les dérivés 2-hydroxy, alors que l'estradiot et le 16a.-hydroxyestrone étaient inactifs.
Nos résultats démontrent aussi que le 4-hydroxyestradiol ( 4-0HEi) à des concentrations
physiologiques était capable d'exhiber une activité de clivage. Il devient alors important de développer des stratégies afin de bloquer la production d'espèces réactives de l'oxygène par le cycle rédox des catécholestrogènes. De plus, notre étude a démontré que certains antioxydants pouvaient soit inhiber ou amplifier le niveau de cassures de brins de l' ADN induit par le catécholestrogène 4-0HE2 en présence de Cu(U). Le NADH et le N-acétylcystéine étaient capables d'amplifier le niveau de dommage produit par le système
4-0HE2/Cu(II), alors que le GSH, DTT, et DHLA ont tous inhibé à différents degrés le
niveau de dommage. D'autres antioxydants devront être évalués pour leurs habiletés à neutraliser les effets néfastes des catécholestrogènes. Nous proposons aussi, dans cette étude, un modèle mathématique afin de déterminer le nombre moyen de cassures de brins simples nécessaires à la conversion de la forme circulaire du plasmide en sa forme linéaire. En utilisant ce modèle, la quantification des trois formes de l' ADN du plasmide
brins requis pour chacune des conversions. Finalement, nous avons aussi démontré que les estrogènes peuvent agir comme pro- ou antioxydants. Ainsi, nos résultats démontrent que les catécholestrogènes peuvent agir principalement comme pro-oxydants envers l' ADN alors que les catéchol- et méthoxyestrogènes agissent comme antioxydants dans un milieu lipidique in vitro. L'effet global de chacune de ces molécules d'estrogènes doit être clarifié afin de déterminer quels patients peuvent bénéficier des estrogènes, comme cardioprotecteurs, et quelles patientes ne devraient pas utiliser la thérapie de remplacement afin d'éviter une augmentation du risque des cancers du sein et de l'utérus.
CHAPITRE I
INTRODUCTION
l. Estrogèoes
Les estrogènes sont des hormones stéroïdiennes sécrétées par deux tissus: 60% des estrogènes sont formés par les ovaires, alors que 40% proviennent des surrénales qui sécrètent des androgènes transformés en estrogènes dans les tissus périphériques par un enzyme spécifique des cytochromes P450 nommée aromatase (Martucci and Fishman
1993).
Les estrogènes exercent plusieurs effets biologiques chez les animaux et les humains, et plusieurs de ces effets résultent en une interaction directe de l'estrogène avec un récepteur intracellulaire qui activent l'expression de gènes encodant des protéines avec d'importantes fonctions biologiques (Zhu and Conney 1998). Un des effets importants des estrogènes est son action mitogénique chez des tissus hormono-sensibles tels que l'utérus (Quannby and Korach 1984) et le sein (Banerjee 1976; Holland and Roy 1995). Une exposition prolongée de ces tissus ou cellules cibles à une stimulation mitogénique excessive par des estrogènes naturels ou synthétiques a longtemps été considéré comme un facteur étiologique important dans l'induction de certains cancers hormono-dépendants chez des animaux expérimentaux et chez les humains (Feigelson and Henderson 1996; Nandi et al. 1995; Pike et al. 1993).
Autrefois, il était considéré que ces hormones estrogéniques étaient éliminées par conversion métabolique en des composés inactifs ou moins actifs excrétés dans l'urine ou dans les fèces (Martucci and Fishman 1993). Cette disposition métabolique des estrogènes inclut le métabolisme oxydatif (largement des hydroxylations), et un métabolisme conjugatif tel que la glucuronidation (Zhu et al. 1996), la sulfonation (Brooks and Hom 1971; Hobkirk 1985) et/ou la 0-méthylation (Guldberg and Marsden 1975). Aujourd'hui, il est maintenant connu que la conversion des estrogènes en ses métabolites ne mène pas nécessairement à des composés inactifs. Plusieurs études ont démontré que les catecholestrogènes sont des métabolites impliqués dans un cycle rédox (Liehr 1990) capables de produire des espèces réactives de l'oxygène qui mènent ultimement à des modifications au niveau de l'ADN (Liehr 1990; Liehr 2000b), de lipides (Han et al. 1995; Wang and Liehr 1995) et de protéines (Ahmed et al. 1994; Winter and Liehr 1991 ).
2. Récepteur des estrogènes
Le récepteur des estrogènes (ER) est une protéine sur laquelle se lie les estrogènes afin de migrer au noyau et exercer son action biologique. L'estradiot, l'estrogène le plus biologiquement actif au niveau de la prolifération cellulaire, se lie avec une grande spécificité et affinité envers le récepteur des estrogènes. Cette affinité est représentée par le "Relative Binding Affinity" (RBA), qui est de 100 pour l'estradiot et varie selon le métabolite. Le tableau 1 démontre les différents RBA obtenus avec l'estradiot et les métabolites des estrogènes.
Tableau 1. Relative Binding Affinity (RDA) obtenus avec les différents estrogènes
Estrogènes RBA RBA
(Martucci and (Hersey et al. 1982)
Fishman 1979) (Martucci 1983) Estradiot 100 100 Estrone 11 2-0HE2 24 23 4-0HE2 45 2-MeOHE2 0.05 4-MeOHE2 1.3 2-0HE1 1.9 3 4-0HE1 11 2-MeOHEi 0.01 4-Me0HE1 0.13 16a.- OHE1 2.8
La présence des récepteurs des estrogènes semblent être nécessaire pour obtenir une réponse du tissu cible à une stimulation estrogénique. Les conséquences de l'interaction estrogène-ER incluent la synthèse de l' ADN, la division cellulaire, la production de protéines biologiquement actives, incluant les facteurs de croissance et les récepteurs à la progestérone (Habel and Stanford 1993).
2.1 ERa. et ERJ3
Depuis que le gène du ER a été identifié en 1986 (Green et al. 1986a; Green et al. 1986b), il a longtemps été reconnu comme étant le seul récepteur (maintenant nommé ERa.) responsable d'une action estrogénique au niveau des tissus cibles. Récemment, un deuxième ER nommé ERP a été identifié chez le rat (Kuiper et al. 1996), la souris
La distribution de ces récepteurs dans le corps humain est différente: le ERa est distribué au niveau de l'utérus et des glandes mammaires, alors que le ERP est retrouvé au niveau des ovaires, des testicules et de la prostate, des poumons et de l'hypothalamus. (Kawata et al. 2001; Levin 2001).
2.2 Mode d'action des stéroides
Le modèle classique pour le mode d'action des stéroïdes propose que la liaison du ligand au récepteur induit un changement allostérique qui permet au complexe hormone-récepteur de se lier à des éléments de réponse sur l' ADN au niveau du promoteur d'un gène cible. C'est cette liaison qui mène à l'activation de l'expression génique. Il paraît que le domaine de liaison de l'hormone prévient normalement le domaine de liaison à l' ADN d'activer la transcription, c'est apparemment l'addition de l'hormone qui supprime cette inhibition (Evans 1988) ainsi que l'inhibition d'une protéine répresseure SSN6. Cette protéine empêche la transactivation de gène par le récepteur, mais la liaison du ligand à son récepteur réprime cette fonction du SSN6 (McDonnell et al. 1992).
Le domaine de liaison à l' ADN (région C) des récepteurs nucléaires contient deux ions zinc qui sont coordonnés tétrahédriquement par huit résidus cystéines. La coordination de zinc est importante pour l'intégrité structurale et la fonction de liaison à l' ADN du domaine de liaison à l' ADN. Le domaine de liaison à l' ADN interagit avec des éléments de réponse estrogéniques dans les régions régulatrices de gènes spécifiques
(Fuller 1991; Zilliacus et al. 1995). En ce qui concerne la région D (hinge), elle contient des séquences qui sont critiques à la localisation du récepteur protéique au noyau après qu'il ait été synthétisé dans le cytoplasme (Pike et al. 1993).
Il est aussi connu que deux régions localisées dans les domaines du ER sont directement impliquées dans l'activation de la transcription génique inductible par les estrogènes. La région T AF-1 (Trancriptional Activation Function-l) située dans le bout N-terminal est un domaine de transactivation indépendant de l'hormone. Et, la région T AF-2 (Transcriptional Activation Function-2) située au bout C-terminal dans le domaine de liaison à l'hormone est un site de transactivation dépendant de l'hormone (Danielian et al. l 992; Lemieux and Fuqua 1996; Tora et al. l 989; Tsai and O'Malley 1994 ).
De plus, il a récemment été démontré que l'estradiot peut se lier à un récepteur membranaire ayant une homologie semblable au ERa (Pappas et al. 1995). Cette liaison de l 'estradiol au récepteur membranaire semble avoir une action non-génomique
puisqu'une réponse biologique pouvait être obtenue en quelques secondes (Moss et al. 1997). Ainsi, il a été démontré que l'estradiot, en quelques secondes ou minutes, pouvait amener une accumulation du Ca2+ intracellulaire, stimuler l'adénylate cyclase, activer la phospholipase C, ou être impliqué dans plusieurs autres voies de signalisation cellulaire (protéine kinase C, protéine kinase A, la famille des MAP-kinases) (Levin 1999; Levin
2.3. Migration du ER vers I' ADN
Afin d'avoir une action génomique, les hormones doivent initialement se lier à
leur récepteur afin de former un complexe hormone-récepteur. L'hormone doit donc passer la membrane nucléaire pour former ce complexe, ce qui mène ultimement à la transactivation de gènes spécifiques. Pour que ceci se réalise, des protéines liées sur le récepteur, nommées protéines de choc thermique, doivent se dissocier de celui-ci afin de permettre à deux récepteurs de se dimériser et de se lier sur des séquences nucléotidiques spécifiques nommées éléments de réponse estrogénique.
2.3.1 Dissociation des protéines de choc thermique
Les protéines de choc thermique sont qualifiées par les spécialistes de ce champ de recherche comme étant des chaperons moléculaires. Les chaperons moléculaires sont définis comme une famille de protéines qui assure l'assemblage correcte d'autres polypeptides mais qui ne sont pas des composantes de la structure fonctionnelle finale (Ellis and van der Vies 1991).
Le récepteur lié aux chaperons est stabilisé dans un état qui a une grande affinité pour l'hormone, mais qui ne peut pas se lier à l 'ADN. L'activation des récepteurs liés aux hsp90 (heat-shock proteins 90) par l'addition d'un ligand (i.e. les estrogènes) est une réaction nécessitant l' A TP qui implique: la liaison du ligand, la dissociation des hsp90, et un changement de conformation du récepteur en une forme qui a une grande affinité pour
l' ADN (Bohen et al. 1995; Chambraud et al. 1990; Hendrick and Hartl 1993; Pratt et al. 1990).
2.3.2 Dimérisation des récepteurs
Le récepteur des estrogènes doit se dimériser afin d'activer efficacement la transcription. Les éléments de réponse pour les estrogènes consistent en des séquences répétitives inversées dans lesquelles deux demi-sites (half-sites) sont séparées par 3 paires de bases (bp ).
Puisque les éléments de réponse estrogénique sont basés sur une séquence palindromique et ont une symétrie rotationnelle, il a été suggéré que les récepteurs des
estrogènes se lient à l' ADN comme dimères protéiques (Fawell et al. 1990; Kumar and
Chambon 1988; Kumar et al. 1987).
2.3.3 Doigts de zinc
Une partie essentielle de l'expression génique et de sa régulation est la liaison d'une protéine régulatrice (e.g. le ER) à une séquence de reconnaissance d'un gène approprié ( e.g. le ERE). Plusieurs de ces protéines ont, encastré dans leurs structures, un
En 1985, l'équipe de Klug à Cambridge en Angleterre ont identifié un motif structural pour la reconnaissance de l'ADN, nommé doigt de zinc (Miller et al. 1985). Klug proposait initialement que les paires d'acides aminés cystéines et histidines dans chaque module se combineraient avec un seul ion zinc, amenant les acides aminés entre
ces paires à se replier. En même temps, trois acides aminés hydrophobiques permettraient
de stabiliser l'arrangement (Rhodes and Klug 1993).
Les deux doigts de zinc présents chez le récepteur des estrogènes contiennent deux paires d'acides aminés cystéines chacun, plutôt qu'une paire de cystéines et une paire d'histidines de la structure initiale découverte par Klug. La première unité doigt de zinc fait le contact principal avec l' ADN. La deuxième unité a une fonction différente de
la première: elle contient cinq acides aminés qui permettent à une molécule de récepteur
de se combiner, ou de se dimériser, avec une deuxième molécule de récepteur. Ce pairage est requis afin que les récepteurs des estrogènes s'attachent efficacement à l'ADN (Rhodes and Klug 1993).
FINGERLIKE UNIT FINGERUKE UNtT
DIMERIZATION
REGlON
Figure 2. Doigts de zinc du récepteur des estrogènes Rhodes D., Klug A. (1993) Scientific American fév.: 56-65
2.3.4 Protéines accessoires au ER
Le récepteur des estrogènes est un facteur de transcription qui, lorsque complexé avec l'estradiol, peut se lier à l' ADN et réguler l'expression de gènes-répondant aux estrogènes. Des études de Halachrni et al. (1994) (Halachrni et al. 1994) ont démontré que l 'habilité du récepteur à activer la transcription est parallèle à son habilité de lier la ERAP160 (une protéine de 160 KD). Cette protéine associée au récepteur des estrogènes, est liée spécifiquement à la région TAF-2 du domaine de liaison de l'hormone du ER. Il semble que la ERAP160 reconnaît seulement la conformation active du ER. Leurs données suggèrent que la ERAP160 peut être un médiateur de la transactivation-dépendante de TAF-2 par le récepteur des estrogènes. Aussi, d'autres protéines récemment découvertes ont été identifiées comme accessoires aux ER, telles que les ERAP140, ERAP80 ainsi que SPT6; mais il est toutefois difficile de définir présentement
la fonction de ces protéines accessoires aux ER (Baniahmad et al. 1995; Cavailles et al. 1994).
3. Métabolisme des estrogènes
Autrefois, il était considéré que le métabolisme oxydatif des estrogènes était un processus d'inactivation des estrogènes afin de les rendre plus facilement excrétables; aujourd'hui, il est maintenant apparent que cette situation est de loin plus complexe.
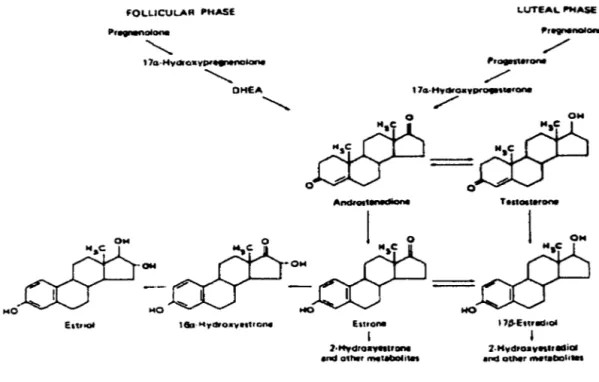
Les enzymes des cytochromes P450 jouent un rôle critique dans la formation des estrogènes et dans leur métabolisme oxydatif subséquent. La biosynthèse des hormones estrogéniques à partir des androgènes est médiée par l'action d'un enzyme spécifique nommé aromatase (F:shrnan 1982) (Figure 3). Une fois formés, les estrogènes entreprennent un métabolisme extensif, largement oxydatif, via l'action de différents enzymes des cytochromes P450 (CYP450).
3.1 Cytochromes P4SO
Le terme cytochrome P450 (CYP450) fait référence à un groupe d'hémoprotéines enzymatique dont le complexe Fe2+-monoxyde démontre un spectre d'absorption près de 450 nm. Les enzymes des cytochromes P450 sont reconnus pour avoir un rôle dominant dans les réactions d'oxydation dans le métabolisme de plusieurs groupes de composés
chimiques, incluant les drogues, les carcinogènes, les stéroîdes, les pecticides, les hydrocarbures, et certains produits naturels (Guengerich 1992).
FOl.LICULAA Pti.SE LUTEAI. ..,..A$E
...
-
...
-
...
""'-
/
17CJ-Hydlc>•VP" ... lane ,.,_,.,_ ... / OHEA17CJ-Hydtoay-ta•-"""
/~
•,cN;
oo~
Anclfoe..-iane Te11ot1er-OM 0 1 0 1 ON~=-~~~=~
MO MO MO HO EnrlOI Eurane 1•HydrOrf911'-•nd otlwr metaCIOlotatFigure 3. Biosynthèse des stéroïdes
170-Eurmdool
1
2-Hydroay .. lf .. iol •.-..S otfler
,,,.,.œ11-Greenspan F.S., Baxter J.O. (1994) Basic and Clinicat Endocrinology
La superfamille de gènes des cytochromes P450 encode plusieurs enzymes, dont plus de 150 sont présentement caractérisés. Ces enzymes ont une homologie variant de 10 à 90 % et sont retrouvés au niveau de sources biologiques aussi diversifiées que les microorganismes, les plantes, et les animaux. Presque tous les tissus de mammifères contiennent un ou plusieurs de ces cytochromes au niveau de différents organelles, plus particulièrement le réticulum endoplasmique et la mitochondrie (Caon et al. 1992).
Certaines des isoformes des CYP450 sont assez spécifiques dans le choix de leur substrat (e.g., les cytochromes stéroïdogéniques), mais plusieurs, et plus particulièrement celles dans le réticulum endoplasmique hépatique, catalyse un grand nombre de réactions chimiques impliquant des composés biologiques ou xénobiotiques (Coon et al. 1992). De plus, les CYP450 sont reconnus pour être impliqués dans le métabolisme de composés physiologiquement importants, tels que les stéroïdes, les prostanoïdes et autres écosanoïdes, certaines vitamines liposolubles, des acides gras, et des alkaloïdes (Guengerich 1992). De plus, certaines isoformes des CYP450 ont été retrouvées au niveau de tissus responsables de la biosynthèse de l'aldostérone et des hormones sexuelles (Coon et al. 1992). Finalement, des altérations dans les activités de ces CYP450 semblent être impliqué au niveau de certaines maladies.
3.2 Métabolites des estrogènes
Les métabolites oxygénés des estrogènes représentent des structures avec des fonctions hydroxyle et keto nouvellement générés, lesquels sont analogues aux autres catégories de stéroïdes qui entreprennent un métabolisme conjugatif, e.g. les androgènes (W axman 1988), la vitamin D (Henry et al. 1992) et les acides biliaires (Setchell et al.
1988). Tout comme avec les autres stéroïdes, la génération de groupements hydroxyles à
des sites spécifiques des estrogènes a un effet sur leurs propriétés biologiques puisque la distinction structurale primaire des estrogènes, l'anneau A, confère des charactéristiques inhabituelles aux métabolites oxygénés (Martucci and Fishman 1993). Après la formation
de l'estradiot ou de son isomère l'estrone, des enzymes (2-, 4-, et 16a-hydroxylases) modifient la position d'un de ses groupes hydroxyle-OH formant ainsi les 2- et 4-hydroxyestradiol (2-, 4-0HEz) ou soit les 2-, 4- et hydroxyestrone (2-, 4- et 16a-OHE1).
0
HO
/ l 6a.-hydroxyestrone ( l 6~-0HE1)OH
0HO
~I
HO
~
2-hydroxyestrone (2-0HE1)HO
HO
0 Estradiol (E2)HO
OH
HO
4-hydroxyestrone (4-0HE1) 2-hydroxyestradiol (2-0HE2)OH
HO
OH
4-hydroxyestradiol ( 4-0HE2)3.2.1 16a.-hydroxyestrone
Le 16a.-hydroxyestrone est un estrogène réactif unique, il est présent chez les
humains à des niveaux comparables à l'estradiot (Martucci and Fishman 1993). Cet
estrogène à l'habileté de former des liens covalents stables avec des composés
comportant un groupement aminé. Ceci a été démontré avec la lysine (Bucala et al. 1986), l'albumine (Bucala and Cerami 1983), les protéines membranaires de l'érythrocyte (Bucala et al. 1984), les histones (Yu and Fishman 1985) et avec les ER de cellules cancéreuses du sein (Swaneck and Fishman 1991 ).
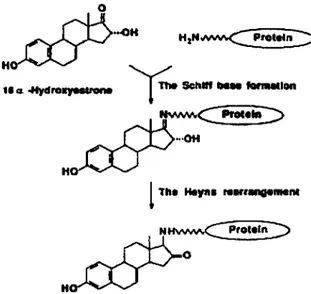
La formation d'un lien covalent entre le l 6a.-hydroxyestrone et les protéines est un mécanisme en deux étapes, il a été suggéré qu'elle procède via la formation d'une
base de Schiff avec des protéines suivit par un réarrangement de Heyns de l'a.-hydroxyimine tel que démontré à la figure 5 (Miyairi et al. 1991 ).
l
Tlle Hepa re•rmnQelMIMNH~
-~
Figure S. Adduit 16cx-hydroxyestrone Miyairi S. et al (1991) Steroids 56: 361-366
3.2.2 Catécbolestrogènes
Les catécholestrogènes (CE) sont des dérivés hydroxylés de l'estradiot et de l'estrone en position C2 ou C4 de l'anneau A formant ainsi les 2- et 4-hydroxyestradiol
ou les 2- et 4-hydroxyestrone (Figure 4). Ces catécholestrogènes sont générés in vivo par
l'action de différentes hydroxylases des cytochromes P450 (Martucci and Fishman 1993).
Mis à part le foie, qui est l'organe de détoxification par excellence, au moins neuf isoformes différentes des cytochromes P450 ont été détectées dans la glande mammaire du rat (Hellmold et al. 1995), et plusieurs isoformes au niveau de la glande mammaire du rat et de l'humain sont sujets à une régulation endocrine (Smith et al. 1993). Plusieurs études ont aussi démontré la présence de niveaux élevés de l'activité de l'enzyme estradiot 4-hydroxylase (médiée par le cytochrome P450 181) chez l'utérus humain (Lieh.r et al. 1995), le tissu d'un cancer du sein (Liehr and Ricci 1996), et chez une lignée cancéreuse humaine du sein (Hayes et al. 1996; Spink et al. 1994). De plus, cette activité est aussi exprimée chez le rein du hamster Syrian male (Hammond et al. 1997; Weisz et al. 1992; Zhu et al. 1993), un organe cible du cancer hormono-dépendant (Li and Li 1987).
Aussi, de multiples cytochromes P450 sont présents et sont exprimés de façon sélective dans certaines régions du cerveau (Kapitulnik et al. 1987; Ravindranath and Boyd 1995; Wamer et al. 1988), mais leur rôle dans le métabolisme des estrogènes est largement inconnu. Certains enzymes catalyzant la formation des catécholestrogènes ont
été détectés dans le système nerveux central de rats (Bui and Weisz 1989; Fishman and Norton 1975; Sugita et al. 1987) et le niveau de ces enzymes dans certaines régions du cerveau est significativement augmentés pendant la lactation (Fishman et al. 1980). Il a été postulé que ces changements dans la formation des catécholestrogènes pourraient jouer un rôle dans l'ovulation (Ball et al. 1982; Franks et al. 1980) et dans la fonction de certains neurotransmetteurs, tels que les catécholamines (Hiemke et al. 1992). Toutefois, la fonction de ces métabolites hydroxylés des estrogènes formés dans le cerveau demeure inconnue.
Les hydroxylations métaboliques de l'estradiot et de l'estrone, formant ainsi les catécholestrogènes, rendent ces molécules plus hydrosolubles ce qui diminueraient de façon significative leur activité estrogénique classique (Zhu and Conney 1998). Il a été démontré que les catécholestrogènes se lient au récepteur des estrogènes mais avec une affinité grandement réduite comparativement à l'estradiot (Tableau 1 ). De plus, les catécholestrogènes peuvent subir par la suite une 0-méthylation catalysée par la catéchol-0-méthyltransférase (COMT) (Weisz et al. 1998), un enzyme capable de catalyser aussi la 0-méthylation des catécholamines et de d'autres catéchols d'importance physiologique (Axelrod and Weinshilboum 1972). Cette 0-méthylation des catécholestrogènes résulte en la formation des méthoxyestrogènes (Butterworth et al. 1996). Ces métabolites ont de très longues demi-vies (Lamer et al. l 985; Vazquez-Alcantara et al. 1989) et ne se lient que très faiblement au récepteur des estrogènes (Janocko et al. 1984).
Récemment, cette activation métabolique des estrogènes a gagné de l'intérêt en tant que joueur important dans le processus carcinogénique (Liehr 1997). En effet, une modulation des oxydations métaboliques a pour conséquence d'augmenter l'incidence de tumeurs induites par l'estradiot chez un modèle de rongeur, le rein du hamster Syrian, d'une façon qui ne concordait pas avec les hypothèses précédentes (Jefcoate et al. 2000). Antérieurement, il était postulé que les estrogènes jouaient un rôle au niveau des cancers hormono-dépendants, incluant le cancer du sein, principalement via une prolifération incontrôlée médiée par une action hormone-récepteur. Cette perte de contrôle de la proliferation permettrait ensuite d'incorporer des erreurs spontanées de réplication
menant ultimement à des mutations. Selon cette hypothèse, l'inhibition du métabolisme
des estrogènes devrait augmenter la formation de tumeurs puisque les métabolites des estrogènes ont une activité hormonale plus faible que l'estradiot ou l'estrone. Toutefois, deux études intéressantes ont démontré au contraire, que le a-napthoflavone (Blaich et al. 1990) (un inhibiteur de l'hydroxylation de l'estradiot ou de l'estrone) et la vitamine C (un agent réducteur capable de réduire les intermédiaires quinones d'hydrocarbures polycycliques aromatiques (Cavalieri and Rogan 1998) en leurs formes hydroquinones réduites) ont soit complètement ou partiellement inhibé l'induction de tumeurs au niveau du rein chez les hamsters par l'estradiot (Liehr et al. 1991; Liehr and Wheeler 1983). Ainsi, il était devenu évident que l'activation de l'estradiot ou de l'estrone résultait en la formation d'intermédiaires hautement réactifs, capables de jouer un rôle important dans l'induction de tumeurs chez des tissus hormono-dépendants.
Les catécholestrogènes font maintenant l'objet de plusieurs études dans le contexte de cancers induits par les estrogènes puisque ces composés sont les métabolites majeurs chez la plupart des mammifères et sont les précurseurs d'intermédiaires réactifs (Jefcoate et al. 2000). Ces métabolites catéchols peuvent être oxydés chimiquement ou par des processus enzymatiques en intermédiaires semiquinones (Kalyanaraman et al. 1984), lesquels sont des radicaux libres, et finalement en leurs intermédiaires quinones. Un survol du cycle rédox des estrogènes sera présenté plus loin.
3.2.3 Méthoxyestrogènes
Tel que mentionné précédemment, l'O-méthylation des catécholestrogènes est catalysée par la catéchol-0-méthyltransférase. L'activité de cet enzyme est présente en grande quantité dans le foie et le rein, et elle existe aussi en quantitié significative dans les globules rouges, l'endomètre utérin, la glande mammaire et plusieurs autres tissus (Axelrod 1959). Dans tous les tissus examinés jusqu'à présent, l'activité de la COMT est retrouvée presqu'exclusivement dans le cytosol, mais une activité est aussi retrouvée sous sa forme liée aux membranes (Bertocci et al. 1991; Guldberg and Marsden 1975). Étant des produits d'excrétion, les métabolites méthoxy sont retrouvés en concentration plus élevé dans le plasma (Ball et al. 1979). De plus, il a été rapporté que les métabolites 2-methoxyestrone et 2-methoxyestradiol ont une plus grande affinité pour le Sex Hormone-Binding Globulin (SHBG), une protéine de transport plasmatique des estrogènes, que l'estradiot et le 2-hydroxyestradiol (Dunn 1983). Il se peut alors que ces affinités élevés de ces deux méthoxyestrogènes contribuent à leur niveau plasmatique élevé.
Comme nous le verrons dans la prochaine section, les catécholestrogènes sont impliqués dans un cycle rédox générant des radicaux libres. Dans le cas des méthoxyestrogènes, cette 0-méthylation des catécholestrogènes en des métabolites méthoxy empêche la formation des radicaux libres en bloquant le cycle rédox des catécholestrogènes (Liehr and Roy 1990). Par conséquent, les méthoxyestrogènes sont catalogués comme étant des métabolites inactifs des estrogènes (Martucci and Fishman
1993).
·--
..
~-/
Estronefi
2-hydroxyestronel~
~
2-Methoxyntrone 4-MethoxyestroneFigure 6. Formation des méthoxyestrogènes
Spicer L.J., Hammond J.M. (1989) J. Steroid Biochem. 33: 489-SOI
Des études précédentes sur la réactivité chimique et le potentiel génotoxique des catécholestrogènes ont mené à la suggestion que l'O-méthylation enzymatique était essentiellement une voie de détoxification de ces métabolites catéchols (Liehr 1990; Liehr and Roy 1990; Liehr et al. 1986). Néanmoins, plusieurs études indiquent que le
2-méthoxyestradiol exerce des effets biologiques uniques qui ne sont pas associés avec l'estradiot, le 2-hydroxyestradiol ou d'autres dérivés méthoxy de l'estradiot. Par exemple, le traitement de rats avec le 2-méthoxyestradiol diminue les niveaux de cholestérol et de triglycérides dans le sang et cet effet n'était pas associé avec l'activation classique du récepteur des estrogènes (Ferreri and Naito 1978). D'autre part, le 2-methoxyestradiol inhibe la croissance de certaines lignées cancéreuses du sein in vitro et in vivo puisqu'il : i) perturbe la fonction des microtubules (D' Amato et al. 1994; Hamel et al. 1996), et i i)
inhibe l 'angiogénèse (F otsis et al. 1994; Klauber et al. 1997).
3.3 Cycle rédox des estrogènes (CYP450-dépendant)
Les catécholestrogènes peuvent être métabolisés par un cycle rédox entre les formes hydroquinones (catéchols) et quinones via la formation intermédiaire de radicaux semiquinones (Les trois formes du 2-0HE2 sont représentés à la Figure 7). L'oxydation
des hydroquinones est catalysée par le cytochrome P450 lAl/lA2. La réduction des quinones estrogéniques peut être catalysée par la NADPH-dépendante cytochrome P450 réductase, la NADH-dépendante cytochrome b5 réductase, la xanthine-xanthine oxydase, et d'autres enzymes (Y ager and Liehr 1996).
2·0H-E2
Figure 7. Cycle rédox du 2-0HE2
Le cycle rédox de ces métabolites catécholestrogènes peut causer des dommages aux macromolécules cellulaires, tels que I' ADN, les lipides, et les protéines, par plusieurs mécanismes (Y ager and Liehr 1996).
Les intermédiaires semiquinones du cycle rédox peuvent réagir avec l'oxygène moléculaire pour former des radicaux superoxydes. Cette réaction a été démontrée pour la quinone diéthylstilbestrol (DES) et la quinone 3,4-E1(3,4-estrone) (Nutter et al. 1994).
Les anions superoxydes sont éventuellement dismutés et forment le peroxyde d'hydrogène. Le H202. lui, subit ensuite la réaction de Fenton en présence d'ions métaux. N.B. La réaction de Fenton ainsi que les diverses espèces réactives de l'oxygène seront discutés dans la section Stress oxydatif.
3.4 Cycle rédox des estrogènes (CYP450-indépendant)
Deux différentes voies sont impliquées dans le cycle rédox des estrogènes. La première voie, décrite dans la section précédente, implique le complexe enzymatique des cytochromes P450 oxydase/réductase (Liehr 1990; Liehr and Roy 1990). La deuxième voie, un mécanisme non-enzymatique, implique le cuivre (Cu(Il)) dont la réactivité avec différents molécules, tels que la quercétine, d'autres phytoestrogènes ou même l'acide aminé tryptophane a été étudié (Fazal et al. 1990; Hiraku et al. 1995; Naito et al. 1994; Said Ahmad et al. 1992; Y amashita et al. 1998).
La concentration du cuivre dans le sang est d'environ 16 µM (Sagripanti et al. 1991). D'autre part, cet ion a été retrouvé à des concentrations plus élevées dans les
tumeurs cancéreuses du sein comparativement au tissu mammaire normal (Margalioth et al. 1983). Au niveau cellulaire, approximativement 20% du cuivre est situé dans le noyau (Agarwal et al. 1989), associé de façon plus spécifique aux bases de l' ADN, particulièrement la guanine (Bryan et al. 1981; Prutz et al. 1990). Plusieurs études ont démontré que le Cu(II) peut médier l'oxydation de composés hydroquinones, tels que les composés polycycliques aromatiques, en leurs formes benzoquinones (Naito et al. 1994;
Yamashita et al. 1998). Li et Trush ont démontré que l'oxydation du
1,4-dihydroxybenzene médiée par le Cu(U) résulte en la formation de cassures de brins de l' ADN, tel que détecté in vitro avec l' ADN du bactériophage cpX-174 (Li and Trush
1993a; Li and Trush 1993b). Us ont aussi démontré que le Cu(ll) peut médier l'oxydation
du 2-hydroxyestradiol résultant en la production de cassures de brins simples et doubles à
l'ADN du bactériophage cpX-174 (Li et al. 1994). De plus, il semble que ce type de cycle rédox de composés hydroquinones médié par le Cu(II) peut être maintenu par un agent réducteur tel que le nicotinamide adénine dinucléotide réduit (NADH) (Flowers et al. 1997; Hiraku and Kawanishi 1996; Nappi and Vass 1997; Winterboum 1979). Le rôle du NADH dans le cycle rédox des catécholestrogènes n'a pas encore été vérifié.
OH HO HO
1t:~~
OH 0 0Figure 8. Cycle rédox du 2-0HE1 en présence de Cu(ll)
4. Stress oxydatif
Les espèces réactives de l'oxygène sont continuellement générés dans les
cellules exposées à un environnement aérobique. Les systèmes de défense antioxydants
ont co-évolués avec le métabolisme aérobique afin de contrer les dommages oxydatifs produits par les espèces réactives de l'oxygène (ERO). Malgré la défense antioxydante,
n
a été postulé que ces dommages mènent à des maladies reliées à l'âge telles que l'athérosclérose, l'arthrite, des désordres neurodégénératifs et le cancer (Halliwell 1999).Le terme stress oxydatif a été introduit en 1985 par Sies (Sies 199 l) lors de la publication du livre 'Oxidative Stress', et il a défini le terme stress oxydatif comme étant «une perturbation dans l'équilibre pro-oxydant/antioxydant en la faveur du premier, menant à un dommage potentiel »,ce dommage faisant référence au dommage oxydatif.
En principe, le stress oxydatif peut survenir lorsque :
l. Les niveaux d'antioxydants sont diminués, e.g. mutations affectant les enzymes antioxydants tel que la cuivre-zinc superoxyde dismutase (CuZnSOD), la manganèse superoxyde dismutase (MnSOD) ou la glutathione peroxydase. Diminution des vitamines antioxydantes et autres constituents de la diète peuvent aussi mener au stress oxydatif.
2. Augmentation de la production des espèces réactives de l'oxygène (ERO) et des espèces réactives de l'azote (ERN), e.g. par une exposition à des concentrations élevés d'02, la présence de toxines qui sont métabolisés pour produire des ERO/ERN, ou une activation excessive des systèmes naturels de production de ERO/ERN (Halliwell 1999).
4.1 Espèces réactives de l'oxygène
Les espèces réactives de l'oxygène font référence à un terme collectif souvent utilisé afin d'inclure non seulement les radicaux libres de l'oxygène (02 •- et HO•) mais aussi certains dérivés non-radicalaires de l'oxygène. Ces dérivés non-radicalaires incluent le peroxyde d'hydrogène (H202), l'acide hypochlorique (HOCI) et l'ozone (03) (Halliwell 1999).
4.1.1 L'anion superoxyde
Le radical superoxyde (02•-) est le produit de l'addition d'un électron sur
l'oxygène. Il est produit par les cellules phagocytaires (neutrophiles, monocytes, macrophages, éosinophiles) et il les aident à inactiver les virus et les bactéries. Plusieurs évidences s'accumulent démontrant que 1'02•- peut être produit in vivo par plusieurs types cellulaires autres que les macrophages, incluant les lymphocytes, les fibroblastes et les cellules endothéliales vasculaires (Burdon and Rice-Evans 1989).
En plus de cette production métabolique délibérée de 02•-, ce radical peut être
produit par les 'accidents de la chimie'. L'anion superoxyde et le H20 2 peuvent aussi être
générés par des réactions d'autoxydation. L'02·- peut alors oxyder d'autres composés et initier une chaîne de réactions radicalaires. Cette autoxydation dépend fréquemment de la présence d'ions métaux.
Un autre site de formation de 0 2•- est la mitochondrie_ La chaîne de transport d'électrons mitochondriale est un gradient de potentiel rédox, à partir du couple fortement réductant NADH/NAD+ à 1'02 moléculaire. Il doit être mentionné que les humains sont des mammifères consommant énormément d'02. Par conséquent, avec seulement la consommation d'02 de repos, le corps humain produit environ 2kg de 0 2·- par année (Halliwell 1994).
L'anion superoxyde 02 •-, en comparaison avec le radical hydroxyle, est beaucoup moins réactif avec des espèces non-radicalaires en solution. Il est à noter que les effets dommageables de 1'02·- sont principalement dûs à sa formation de H20 2. Comme nous le verrons dans la section 4.2, le Hi02 peut être impliqué dans une réaction de Fenton avec des ions métalliques afin de générer un radical très réactif, le radical hydroxyle Ho•. Toutefois, 1'02·- réagit rapidement avec d'autres radicaux, tel que l'oxyde nitrique (9NO), certains enzymes avec un site actif fer-soufre et certains radicaux phenoxyl, e.g. ceux formés par l'abstraction d'un hydrogène du groupement -OH de l'acide aminé tyrosine (Halliwell 1999).
4.1.2 Le peroxyde d'hydrogène
La plupart de 1'02•- généré in vivo subit une réaction de dismutation catalysée par la superoxyde dismutase (SOD), représentée par l'équation suivante:
SOD
Ceci génère du peroxyde d'hydrogène (H202), un non-radical. H202 ressemble à l'eau dans sa structure moléculaire et il diffuse facilement à travers les cellules et entre elles (Halliwell 1996).
H202 peut réguler l'expression de certains gènes en menant le déplacement d'une sous-unité inhibitrice du facteur cytoplasmique de transcription génique NF- KB. Le déplacement de cette sous-unité inhibitrice permet au facteur actif de migrer au noyau et d'activer différents gènes en se liant à des séquences spécifiques au niveau de promoteurs. Ainsi H20 2 et d'autres peroxydes (tels que les lipoperoxydes) peuvent induire l'expression de gènes contrôlés par NF- KB (Schreck et al. 1992).
D'autre part, le H202 est un agent oxydant et réducteur faible et est généralement
très peu réactif. Par exemple, seulement qu'une faible oxydation survient à l' ADN, aux lipides ou la plupart des protéines lorsqu'ils sont incubés avec le H202, même à des concentrations de l'ordre du millimolaire. Ceci lui permet alors de traverser rapidement les membranes cellulaires et, une fois à l'intérieur, peut réagir avec des ions métalliques tels que le fer et le cuivre formant ainsi des espèces réactives telles que le radical hydroxyle (Halliwell 1999).
4.1.3 Le radical hydroxyle
Un des plus puissant pannis les radicaux libres est le radical hydroxyle (HO.).
L'exposition des organismes vivants aux radiations ionisantes cause la fission de liaisons 0-H de l'eau pour donner H• et Ho•. Le radical hydroxyle réagit avec presque toutes les molécules des cellules vivantes. Lorsque le radical hydroxyle est fonné in vivo, il endommage tout ce qui est près de lui, puisque Ho• ne peut pas migrer sur une distance significative dans la cellule. Les effets néfastes du radical hydroxyle Ho• sont ses attaques sur les protéines, les hydrates de carbone, les lipides et l' ADN {Halliwell 1999).
4.2 La réaction de Fenton
Le peroxyde d'hydrogène est fonné dans plusieurs cellules aérobiques. La réaction des ions métalliques avec le H20 2 est une source probable de Ho• in vivo,
compte tenu que ces ions sont présents. Cette génération de Ho• par le H20 2 en présence de métaux (M) a principalement été démontré pour les ions fer et cuivre. Cette interaction entre le H202 et les ions métalliques a été observée la première fois par Fenton en 1894. La première des deux réactions suivantes est la .. superoxide-driven Fenton reaction" alors que la deuxième est la réaction de Fenton.
Mn+ 02•- ? Mn-l + 02
Hi02 + M"-1 ? M0 + OH-+ Ho•
La résultante de ces deux réactions a été nommée la réaction de Haber-Weiss :
4.3 Stress oxydatif et cancer
L'exposition d'organismes aux radiations ionisantes est depuis longtemps connu comme une cause du développement du cancer. Il a été démontré que la carcinogénèse induite par les radiations ionisantes implique l'initiation et la promotion. Le dommage à
l' ADN induit par les radiations peut survenir principalement de deux façons : par l'absorption directe d'énergie par cette molécule, et par l'effet indirect produit par l'ionisation de l'eau et la formation d'espèces réactives de l'oxygène. Le radical hydroxyle peut attaquer l' ADN et générer toute une série de bases puriques et pyrimidiques modifiées (Voir dans la section Dommage oxydatif à l' ADN). Il devient alors important d'étudier les espèces réactives de l'oxygène comme mutagènes sérieux (Halliwell 1996).
Vu l'importance du dommage à l' ADN en carcinogénèse, il est concevable que
tout agent capable de réagir avec l' ADN et modifier sa structure chimique peut être carcinogénique. Le développement du cancer est reconnu comme un processus microévolutionnaire qui requiert l'action cumulative d'événements multiples. Ces
événements surviennent dans une cellule clonale et incluent un modèle simplifié à trois
étapes : i) l'induction de mutations à l' ADN dans une cellule somatique (initiation), ii) la stimulation de l'expansion tumorigénique d'une cellule clonale (promotion) et iii) la conversion maligne d'une tumeur en un cancer (progression). Les espèces réactives de l'oxygène peuvent stimuler le développement d'un cancer au niveau de ces trois étapes:
l'initiation, la promotion et la progression (Dreher and Junod 1996; Troll and Wiesner 1985).
Le dommage oxydatif aux lipides et aux protéines ( e.g. enzymes de réparation de l 'ADN) peut aussi mener à des effets mutagéniques (Bartsch 1996). De plus, de faibles niveaux de ERO peuvent stimuler la prolifération cellulaire alors que des niveaux élevés l'inhibent. Les ERO peuvent aussi augmenter la phosphorylation de protéines pour ainsi promovoir la prolifération et l'expression de gènes tels que c-fos et c-myc; plusieurs facteurs de transcription (NF-k.B et AP-l) et certaines protéines kinases sont sujets à une régulation par les ERO (Irani et al. 1997).
D'un autre côté, il a été démontré que plusieurs enzymes antioxydantes (MnSOD,
CuZnSOD, catalase, et glutathione peroxydase) démontrent de faibles activités chez des lignées cellulaires transformées et au niveau de biopsies de tumeurs (Sun et al. l 993). Une diminution de l'activité de ces enzymes pourraient contribuer à une accumulation du niveau des ERO, augmentant ainsi le risque de dommages oxydatifs pouvant mener ultimement au cancer. Aujourd'hui, il n'est pas encore clair si cette faible activité des enzymes antioxydantes au niveau de cellules cancéreuses est le résultat d'une sélection favorisant l'accumulation de ERO ou un effet dommageable produit par ces ERO.
Le stress oxydatif pourrait, entre autre, être augmenter et contribuer au processus carcinogénique par le relâchement de cuivre par sa protéine de transport, la caeruloplasmine. La caeruloplasmine, une glycoprotéine de 1046 acides aminés, est
normalement synthétisée au niveau du foie et lie 90-95 % du cuivre dans le plasma. La caeruloplasmine est une protéine multifonctionnelle impliquée dans : (i) l'oxydation du Fe2+ en Fe3+ et son incorporation subséquente au niveau de la transférine, (ii) l'oxydation
de composés aromatiques, (iii) transport du cuivre aux différents tissus pour son incorporation dans différents enzymes, (iv) l'enlèvement de l'anion superoxyde, et (v) la modulation de la réponse inflammatoire puisque les niveaux de caeruloplasmine sont augmentés lors de l'inflammation, l'infection et l'arthrite rhumatoïde. De plus, les niveaux de caeruloplasmine sont augmentés chez différentes formes de cancer incluant les lymphomes, le cancer du poumon, du sein et du tractus gastro-intestinal. Le rôle de la caeruloplasmine dans l'induction du cancer n'est pas clair, toutefois, il a été démontré que cette protéine est impliquée dans l'induction de l'angiogénèse ou la néovascularization (Kunapuli et al. 1987) Finalement, il a été de plus démontré que l'estradiol augmente la synthèse de la caerulopasmine en augmentant indirectement la concentration de son ARNm au niveau du foie (Middleton and Linder 1993).
4.4 Dommages oxydatifs à I' ADN
Tel que mentionné précédemment, les ERO et ERN sont impliqués dans le développement du cancer, non seulement via leurs effets directs à l' ADN mais aussi en modulant la transduction de signaux, la prolifération cellulaire, la mort cellulaire et la communication intracellulaire. Les ERO/ERN peuvent mener à des dommages à I 'ADN par attaque chimique directe sur l' ADN, et par mécanismes indirects. Les mécanismes indirects incluent l'activation d' endonucléases Ca2+ -dépendantes, suite à l'augmentation
des niveaux de Ca2+ intracellulaire, et à la perturbation des enzymes de réplication ou de
réparation de l'ADN (Halliwell 1999). Toutefois, cette présente section ne fera l'objet que du dommage direct à l' ADN. Ce dommage est essentiellement oxydatif et peut survenir sur les bases purines et pyrimidines et/ou du sucre désoxyribose.
Les cassures de brins de l' ADN et les modifications des bases de l' ADN sont fréquemment observées chez des cellules exposées à un stress oxydatif. lequel peut être produit de différentes façons (Halliwell 1999) :
1. Exposition aux radiations ionisantes, concentrations élevées d'02, activation de cellules phagocytiques, molécules chimiques capable de générer un cycle rédox, la fumée de cigarette ou l'ozone;
2. Addition d'H202, de peroxynitrite, d'acide nitrique, d'hydroperoxides organiques 3. Exposition à des molécules capables d'autoxydation en présence de métaux (e.g.
dihydroxyfumarate, dopamine, L-dopamine, catécholamines, catécholestrogènes); 4. Exposition à la xanthine oxydase et ses substrats (xanthine ou hypoxanthine);
5. Addition du cytokine 'Tumor Necrosis Factor alpha' (TNFa) (Park et al. 1998).
Une exposition de l' ADN au radical hydroxyle Ho• résulte en une génération d'une multitude de produits, puisqu'il attaque les sucres et les bases purines et pyrimidines (Breen and Murphy 1995; Olinski et al. 1996). Par exemple, Ho• peut s'ajouter à la guanine aux positions 4, 5 ou 8 dans l'anneau de la purine. Une addition Ho• au C-8 produit un radical et un adduit-OH en position C-8, lequel peut être oxydé en 8-oxo-7,8-dihydroxyguanine ou entreprendre une ouverture de l'anneau imidazole suivit
d'une réduction d'un électron et une protonation afin de donner le 2,6-diamino-4-hydroxy-5-formamidopyrimidine, communément appelé F APyG.
De façon similaire, Ho• peut s'ajouter aux C-4, C-5, ou C-8 de l'adénine. Les pyrimidines peuvent, eux aussi, être attaqué par le Ho• pour donner de multiples produits. La thymine peut subir une abstraction d'un hydrogène du groupement méthyl. Les radicaux ainsi formés sont convertis en une variété de peroxydes de thymine, lesquels sont transformés en cis- et trans-thymine glycols : 5,6-dihydroxy-6-hydrothymines, 5-hydroxy-5-méthylhydantoine, 5-hydroxy-6-hydrothymine, 6-hydroxy-5-hydrothymine et 5-hydroxyméthyle uracile. En ce qui concerne la cytosine, suite à une attaque du Ho•, plusieurs produits sont formés incluant la cytosine glycol et le 5,6-dihydroxycytosine.
Finalement, ces modifications de bases del' ADN peuvent mener à des mutations, soit directement produits par les ERO/ERN ou pendant la réplication et les tentavives de réparation de l' ADN endommagé (Rodriguez et al. 1995).
4.S La peroxydation lipidique
L'initiation de la peroxydation lipidique est causée par une espèce ayant suffisamment de réactivité pour enlever un atome d'hydrogène du groupement méthylène (-CH2-) d'un lipide. Les acides gras qui ont un ou pas de doubles liens sont plus résistants à une telle attaque que les acides gras polyinsaturés (PUF A). La liaison double affaiblie l'énergie d'attachement des atomes d'hydrogène présents sur le carbone adjacent,
spécialement si la liaison double est adjacente à un groupement méthylène -CH2-(Halliwell 1999).
Il est maintenant connu que le radical hydroxyle Ho• peut initier la peroxydation lipidique, à l'exception où il réagirait avec une autre molécule avant de se rendre à la chaine d'hydrocarbures des lipides.
En ce qui concerne l'anion superoxyde 02·-, il est insuffisamment réactif pour enlever un hydrogène des lipides. De plus, l'02•- ne peut traverser la plupart des membranes biologiques. Toutefois, la forme protonée de l'02·-, le H02·, est plus réactif et peut enlever un hydrogène des acides gras, tels que les acides linoléïque, linolénique et arachidonique. H02 •, étant sans charge, peut traverser les membranes beaucoup plus
facilement que 1'02·-.
En plus de cette réaction, le Ho2• peut stimuler la peroxydation en réagissant avec des hydroperoxides lipidiques déjà formés. Cette réaction, plutôt que l'enlèvement d'un groupement hydrogène, pourrait être le contributeur majeur de la lipoperoxydation (Aikens and Dix 1991).
En présence d'02, les carbones radicalaires de chaîne lipidique donnent naissance
à un radical peroxyl, R02·. Ces radicaux peroxyles sont capables ensuite d'enlever un atome d'hydrogène d'un autre lipide, i.e. une chaîne d'acide gras adjacente.
R02• +CH~ -ROOH +
c·
Ces réactions représentent les étapes de propagation de la peroxydation lipidique. Le radical carbonyle formé peut réagir avec l '02 pour former un autre radical peroxyle et alors une réaction en chaîne de la lipoperoxydation s' entame .
La terminaison de la réaction en chaîne et de la peroxydation lipidique s'effectue lorsque deux espèces radicalaires se combinent.
R02• + R• ~ ROOR
2 R02• ~ ROOR+02
L'autre voie des radicaux peroxyles est la formation de peroxydes cycliques pouvant donner naissance au malondialdéhyde. Le malondialdehyde (MDA) provient généralement de la peroxydation des acides gras polyinsaturés avec plus de deux doubles liaisons, tels que les acides linolénique, arachidonique et docosahexaenoique. Le MDA peut aussi être formé de façon enzymatique pendant le métabolisme des eicosanoïdes.
Sous des conditions physiologiques, le MDA peut attaquer des protéines résultant en des modifications de plusieurs résidus d'acides aminés, spécialement la lysine, en plus de faire des 'cross-links' intra- et intermoléculaires protéiques. Il peut aussi réagir avec les bases de l'ADN, introduisant ainsi des lésions mutagéniques. La contribution globale des adduits MDA-ADN à la mutagénèse in vivo est incertaine puisque le MDA pur est faiblement mutagénique dans des systèmes d'essai mutagénique bactériens. Toutefois, lorsque l' ADN pré-traité avec le MDA est exprimé chez E. coli, une augmentation d'environ 10-fois de la fréquence de mutations est observée. Les mutations prédominantes étaient des transversions G 7 T, des transitions A 7 G et des transitions C 7 T, ainsi que des délétions (Halliwell 1999).
Les modifications des transporteurs de cholestérol, les lipoprotéines de faible densité (LOL), semblent être une étape première dans le développement de l'athérosclérose (Lynch and Frei 1995). Les ions cuivre sont des promoteurs puissants de la décomposition de peroxydes, de plus il est un excellent catalyste de la peroxydation des LOL. Comme le fer, le cuivre agit principalement en décomposant les peroxydes déjà
formés (Gutteridge 1982).
ROOH + Cu2+ 7 Cu++ R02· + H+ ROOH + Cu+ 7 Ro· + Cu2+ +
OH-De plus, un autre métal, le cobalt(m, est capable de décomposer les peroxydes lipidiques. Certains ions métalliques, tel que l'aluminium(III) et le plomb(II), ne peuvent
par eux-mêmes stimuler la peroxydation lipidique mais semblent se lier aux membranes de sorte à faciliter une lipoperoxydation-dépendante du fer (Halliwell and Gutteridge
1990).
S. Estrogènes et cancer du sein
Il est maintenant bien connu que les estrogènes sont impliquées dans l'apparition du cancer du sein (Henderson et al. l 988). Il existe deux voies différentes dans l'attribution d'un rôle qu'exercent les estrogènes dans cette implication. La première est celle où les estrogènes stimulent la prolifération cellulaire, augmentant ainsi la probabilité qu'une mutation se fixe; et la deuxième celle où le métabolisme des estrogènes amènent la formation des métabolites catécholestrogènes qui sont impliqués dans la génération d'espèces réactives de l'oxygène pouvant endommager l'ADN, via un cycle rédox. Il est donc possible que les tumeurs surviennent suite à une prolifération ER-dépendante de cellules transformées par un dommage génétique spécifique en combinaison avec d'autres lésions probablement produits par les espèces réactives de l'oxygène générés par le cycle rédox des estrogènes (Liehr 2000a).
S.1 Estrogènes et prolifération cellulaire
La prolifération cellulaire requiert la réception de signaux extracellulaires qui sont traduits en signaux intracellulaires. Ces signaux intracellulaires déclenchent une cascade d'événements culminants éventuellement à la mitose. Des altérations dans une ou
plusieurs de ces étapes peuvent causer la dérégulation de la prolifération cellulaire (McKenzie and Sukumar 1996).
Il a été proposé que les estrogènes sont carcinogéniques dû à leur habilité de stimuler la prolifération cellulaire des cellules épithéliales du tissu mammaire (Preston-Martin et al. 1990). Ces cellules recouvrent les cavités glandulaires, ou acini, et les galactophores par lesquels s'écoulent le lait.
Figure 9. Vue latérale d'une coupe sagittale du sein. Lee Davis D.,. Bradlow L. (1995) Pour la science 218: 74-80
L'hormone modifie la croissance cellulaire en se liant à une protéine intracellulaire nommée récepteur des estrogènes. Le complexe constitué par l'hormone et son récepteur se lie à l' ADN et active des gènes qui commandent la division cellulaire (Lee Davis and Bradlow 1995). En accélérant la vitesse de réplication de l' ADN, ceci peut faciliter la carcinogénèse en favorisant la fixation des mutations spontanées et induites par les carcinogènes, ou en allouant l'expansion clonale de cellules pré-néoplasiques (Barrett 1993).
5.2 Épidémiologie du cancer du sein
Il est bien connu que les hormones ovariennes jouent un rôle crucial dans toutes les étapes du développement du cancer du sein. Les deux hormones ovariennes majeures, l'estradiot et la progestérone, augmentent le risque de développer un cancer du sein (Pike et al. 1993). Il a été établi qu'une femme sur neuf risque de développer un cancer du sein au cours de sa vie. En 1998, 240 000 nouveaux cas ont été décelés aux Etats-Unis, plaçant le cancer du sein comme troisième cause de mortalité après les maladies cardio-vasculaires et le cancer du poumon (Service 1998).
5.3 Facteurs de risque
Plusieurs facteurs de risque pouvant être impliqués dans le cancer du sein ont été suggérés, voici brièvement les plus importants :
Méoarcbe et Ménopause
Les femmes qui ont eu leurs premières règles très jeunes et une ménopause tardive ont un risque plus élevé de développer un cancer du sein. Ceci peut être simplement relié à une plus longue exposition aux estrogènes.
Grossesse
L'effet de la reproduction sur le cancer du sein demeure incompris, mais certaines données suggèrent que la grossesse à un effet sur la biodisponibilité des estrogènes (Bernstein and Ross 1993). Deux études ont démontré que la capacité de liaison des SHBGs (Sex Hormone Binding Globulin) chez les femmes préménopausées ayant donné naissance est 10 à 12% plus élevée que chez les femmes préménopausées n'ayant eu aucune grossesse, suggérant ainsi que les estrogènes libres atteignent plus facilement le récepteur des estrogènes chez les femmes préménopausées n'ayant eu aucune grossesse (Bernstein et al. 1985; Moore et al. 1987).
En plus, certains suggèrent que la grossesse diminue les probabilités d'obtenir un cancer du sein dû à une différenciation des cellules épithéliales du sein causée par la forte concentration des estrogènes présents pendant cette période. La différenciation des cellules épithéliales du sein diminue aussi la probabilité que ces cellules puissent fixer une mutation.
Obésité
L'obésité mène à une augmentation de la production périphérique d'estrone à partir de l'androstenedione, puisque les cellules adipeuses sont riches en aromatase, un
fortement associée avec une production diminuée de SHBG, ce qui augmente les proportions d'estradiol libre et lié à l'albumine (Moore et al. 1987). Alors, une plus grande biodisponibilité des estrogènes ainsi qu'une production diminuée de SHBG peuvent agir en synergie; ce qui expliquerait la relation entre l'obésité et le risque de développer un cancer du sein.
Situation géographique
Key et al. (1990) (Key et al. 1990) ont conduit une étude chez des femmes âgées entre 35 et 64 ans de régions rurales de la Chine, où le taux de cancer du sein est extrêmement faible. Ces résultats ont été comparés avec le profil hormonal de femmes britanniques à haut risque. Parmi les femmes préménopausées âgées entre 35 et 44 ans, les femmes britanniques avaient des concentrations d'estradiot 36 fois plus élevées, en moyenne, que celles des Chinoises. li a été proposé que ceci pourrait être partiellement expliqué par une fréquence réduite d'ovulations, et une formation moins efficace du corps jaune chez les Chinoises. Les différences dans la diète et de la dépense d'énergie pourraient créer ces différences ovulatoires ou contribueraient directement aux différences estrogéniques (Bernstein and Ross 1993).
Histoire familiale
On estime que 5% des cancers du sein sont d'origine génétique. En décembre 1990, grâce à la collaboration de familles comptant plusieurs cas de cancer du sein, le groupe de Mary-Claire King, de l'Université de Berkeley, localise sur le chromosome 17