MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE BADJI MOKHTAR –ANNABA- FACULTE DES SCIENCES
DEPARTEMENT DE BIOCHIMIE
Laboratoire de Biochimie et Microbiologie Appliquée Thèse
Présentée en vue de l’obtention du diplôme de Doctorat en sciences
Option : Biochimie Appliquée (en Agroalimentaire et Santé)
Thème
Effet de la combinaison de la vitamine C et la vitamine E sur
le métabolisme et la distribution du zinc chez des rats
diabétiques sous un régime alimentaire pauvre en zinc
Présentée parDERAI EL-HADJELA Devant le jury
Présidant: Mr BOUZERNA N Prof Université Badji Mokhtar- Annaba Promoteur: Mr KECHRID Z Prof Université Badji Mokhtar- Annaba Examinateur: Mr ATTALAH S Prof Université Mentouri- Constantine Examinateur: Mr NOUADRI T MCA Université Mentouri- Constantine
J’exprime d’abord mes profonds remerciements à Allah qui m’a donné le courage et la volonté d’achever ce travail.
Je voudrais tout d’abord remercier grandement mon directeur de thèse, KECHRID Z, Professeur, Université Badji Mokhtar Annaba, pour toute son aide, il a toujours été là pour me soutenir et me conseiller au cours de l’élaboration de cette thèse.
J’adresse également mes remerciements aux membres du jury :
A notre président de jury le Professeur BOUZERNA N, Université Badji Mokhtar- Annaba, Qui nous a fait l’honneur d’accepter la présidence de notre jury de thèse, et qui a sacrifie de son temps afin d’évaluer ce travail. Nous lui témoignons toutes nos reconnaissances.
Monsieur le Professeur ATTALAH S, Université Mentouri- Constantine, Qui nous a fait l’honneur de participer à notre jury de thèse. Toute notre gratitude.
Monsieur le Docteur NOUADRI T, Université Mentouri- Constantine, pour avoir eu l’honneur d’accepter d’évaluer ce travail de thèse. Qu’il trouve ici notre gratitude et nos sincères remerciements.
Je remercie en particulier le Professeur EXBRAYAT J.M. Université catholique de Lyon, pour son aide concernant la réalisation de l’étude histologique et histochimique au sein de son laboratoire,
Un grand merci au Docteur Bouden L, laboratoire d’hygiène, Jijel, pour m’avoir conseillée
en histologie et partagée des observations sous le microscope.
A Mme Bouhafs L, Université de Jijel, Pour son aide précieuse et ses conseils dans la réalisation de ce travail. Un grand merci.
A mes parents, ma famille, Pour leur amour et leur soutien, ils m’ont tant aidé durant toutes mes années d’études et dans tous les moments qui accompagnent ma vie.
Je remercie également, l’équipe du laboratoire de Biochimie, Département de Biologie Moléculaire et Cellulaire, Université de Jijel.
Ainsi toutes les personnes qui nous ont aidés de près ou de loin pour réaliser cette modeste thèse.
INTRODUCTION GENERALE ETUDE BIBLIOGRAPHIQUE CHAPITRE I : Le diabète sucré
1. Définition………... 2.Épidémiologie………. 3. Critères biologiques de diagnostic………. 4. Classification………. 5. Diabète gestationnel……….. 6. Autres types du diabète sucré……… 7. Complications……… 8. Traitements………
CHAPITRE II : Le Zinc
1. Historique et importance biologique du zinc dans les organismes vivants………... 2. Définition et caractéristiques générale……….. 3. Sources et besoins……….. 4. Métabolisme……….. 5. Fonctions………... 6. La carence en zinc………. 7. La relation entre le zinc, l’insuline et le diabète sucré………..
CHAPITRE III : Le stress oxydatif
1. Définition du stress oxydatif………. 2. Définition d’un radical libre……….. 3. Les sources des dérivés réactifs de l’oxygène………... 4. Dommages oxydatifs………. 5. Systèmes de défenses antioxydants………..
1 2 2 3 4 4 5 5 6 6 6 7 8 9 10 11 11 12 15 18
5.2.1. Le glutathion GSH………... 5.2.2. Métaux de transition……… 5.2.3. Les caroténoïdes……….. 5.2.4. Le Coenzyme Q10 ou ubiquinone………... 5 .2.5. La vitamine E……… 5.2.5.1. Définition et caractéristiques……… 5.2.5.2. Métabolisme………. 5.2.5.3. Rôles biologiques………. 5.2.6. La vitamine C………. 5.2.6.1. Définition et caractéristiques……… 5.2.6.2. Métabolisme………. 5.2.6.3. Rôles biologiques………. 5.2.7. La synergie entre la vitamine E et la vitamine C………..
CHAPITRE VI: La relation diabète - stress oxydatif
1. Mécanisme de l’augmentation du stress dans le diabète sucré……….. 2. La modification des défenses antioxydantes au cours du diabète………. 3. Stress oxydatif et cellules β pancréatique………..
4. Effet de la carence en zinc sur le stress oxydatif au cours du diabète………..
ETUDE EXPERIMENTAL MATERIEL ET METHODES
1. Matériel biologique et conditions d’élevage………. 2. Induction du diabète………
3. Composition des régimes alimentaires……….. 4. Traitement des animaux………. 5. Prélèvement des échantillons………. 5.1. Prélèvement sanguin………. 5.2. Prélèvement des organes……… 6. Dosage du zinc……….. 21 21 21 22 24 24 24 25 27 27 27 28 29 30 35 36 36 38 38 38 40 41 41 41 43
7.2. L’hémoglobine glyquée………. 7.3. Le glycogène hépatique……….. 7.4. Le cholestérol total………. 7.5. Les triglycérides………. 7.6. L’activité d’aspartate aminotransférase (ASAT)……… 7.7. L’activité d’alanine aminotransférase (ALAT)……….. 7.8. L’activité de lactate déshydrogénase (LDH)……….. 7.9. L’activité de la phosphatase alcaline (PAL)……….. 7.10. La bilirubine………. 7.11. L’albumine………... 7.12. Les protéines totales………. 7.13. L’urée………... 7.14. La créatinine………. 7.15. L’acide urique……….. 8. Dosage des paramètres du stress oxydatif………. 8.1. Dosage de malondialdéhyde (MDA)……….. 8.2. Dosage du glutathion réduit (GSH)……… 8.3. Dosage de l’activité des enzymes antioxydants………. 8.3.1. Préparation de la fraction cytosolique (hépatique et rénal)………. 8.3.2. Dosage de l’activité enzymatique de la catalase………. 8.3.3. Dosage de l’activité enzymatique de la glutathion peroxydase (GSH-Px)………… 8.3.5. Dosage de l'activité de la superoxide dismutase (SOD)……….. 8.4. Dosage des protéines tissulaire………... 9. Analyse histologique et histochimique………... 9.1. Réalisation des coupes histologiques des reins (Coloration hématoxyline-éosine)…... 9.2. Evaluation du stockage de glycogène hépatique par méthode histochimique (Coloration Acide Périodique-Schiff: APS)………. 10. Analyse statistique………. 44 45 45 46 46 47 47 47 48 48 48 49 49 49 50 50 51 52 52 52 53 54 55 56 56 57 58
1. Suivi de l’évolution du poids corporel et la consommation alimentaire des animaux au cours du traitement……… 2. Effet du traitement sur le métabolisme des rats diabétique sous un régime alimentaire pauvre en zinc……….. 2.1. Sur le métabolisme glucidique (Glucose, HbA1c, Glycogène hépatique)……….
2.2. Sur le métabolisme lipidique (Cholésterol, Triglycérides)……… 2.3. Sur l’activité des transaminases (AST et ALT) et le taux de la bilirubine…………... 2.4. Sur le métabolisme protéique (Protéine, Urée, Créatinine et Acide urique)…………. 3. Effet du traitement sur le statut en zinc chez des rats diabétique sous un régime alimentaire pauvre en zinc……….. 3.1. Sur la distribution du zinc dans l’organisme……….. 3.2. Sur l’activité des enzymes à zinc (PAL, LDH)……….. 4. Effet du traitement sur les paramètres du stress oxydatif chez des rats diabétique sous un régime alimentaire pauvre en zinc………... 4.1. Concentration de malondialdéhyde (MDA)………... 4.2. Concentration tissulaire du GSH réduit……….. 4.3. Variation de l’activité des enzymes antioxydantes……… 4.3.1. Evaluation de l’activité de la catalase………. 4.3.2. L’activité de la GSH-Px tissulaire………... 4.3.3. L’activité de la superoxyde dismutase (SOD)………. 5. Analyse des coupes histologiques et histochimiques………. 5.1. Effet des traitements sur l’histologie des reins………... 5.2. Résultats d’identification histochimique du glycogène………..
DISCUSSION………... CONCLUSION……… REFERENCES BIBLIOGRAPHIQUES ANNEXES 59 61 61 64 67 70 75 75 79 82 82 82 86 86 86 87 91 91 93 96 05
ADO : Anti-Diabétiques Oraux AGE : Produits de glycation avancés AL : Aliment
CM : Chylomicrons DAG : Diacylglycérol
DHAA : Acide déhydroascorbique DID : Diabète insulinodépendant DNID : Diabète non insulinodépendant
EDTA : Acide éthylène diamine tétraacétique EOA : Espèces oxygénées activées
ERA : Espèces réactives d’azote ERO : Espèces réactives de l’oxygène HDL: High Density Lipoprotein
IDF : International Diabetes Federation INSP Institut Nationale de Santé Publique LDL: Low Density Lipoprotein
LPL : Lipoprotéine lipase
MAI : Maladie Auto-Immune. MDA : Malonyldialdéhyde
OMS : Organisation mondiale de la santé Pc : Poids corporel
PLA2 : Phospholipase A2 PLC : Phospholipase C PKC: Protéine kinase C
TAHINA: Transition Health Impact in North Africa TBA : Acide thiobarbiturique
TBARS: Substances réactives de l’acide thiobarbiturique VLDL: Very Low Density Lipoprotein
Figure 1: Représentation schématique de la molécule d’insuline………1
Figure 2: Origine des différents radicaux libres oxygénés et espèces réactives de l’oxygène impliqué en biologie.………12
Figure 3 : Sources des espèces réactives de l’oxygène…..………14
Figure 4: Etapes de la peroxydation lipidique...……….……….16
Figure 5: Nature de quelques modifications des chaînes latérales d’acides aminés des protéines après attaque radicalaire………17
Figure 6: Lésions de l’ADN formées par attaque radicalaire du patrimoine génétique des cellules………18
Figure 7: Systèmes antioxydants enzymatiques : Superoxyde dismutase et Glutathion Peroxydase.…...………..20
Figure 8: Site d’action des systèmes antioxydants enzymatiques et non enzymatiques...………22
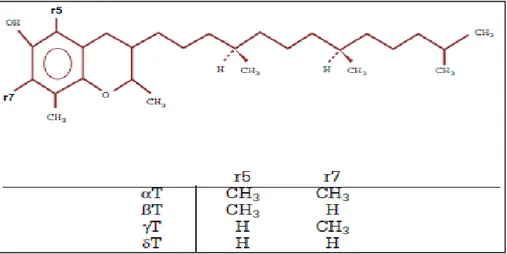
Figure 9 : Structure de la vitamine E..………24
Figure 10: Les différents états de l’acide ascorbique.………..………..28
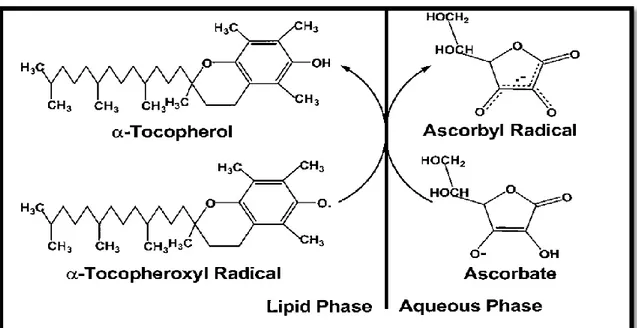
Figure 11: Régénération de l’α-tocophérol par l’acide ascorbique...………...29
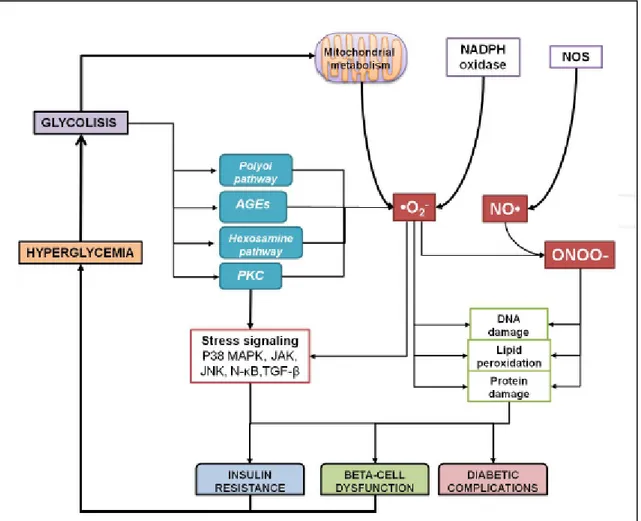
Figure 12: Augmentation du stress oxydatif au cours du diabète sucré.………30
Figure 13 : Voies de formation des ROS au cours du métabolisme du glucose…….35
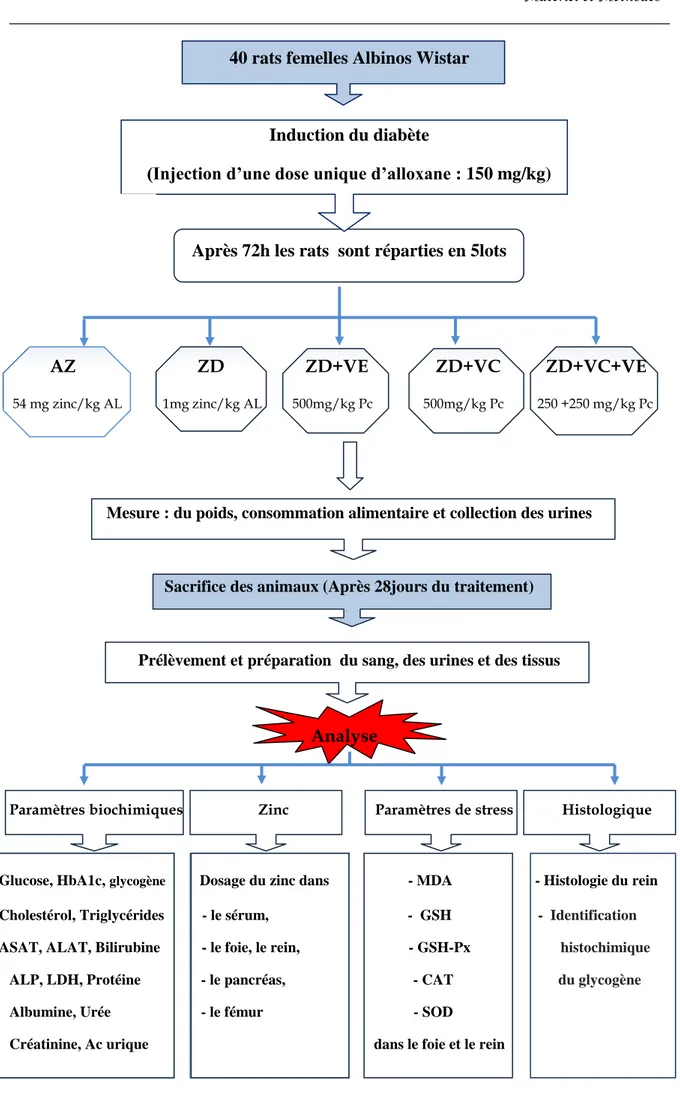
Figure 14: Protocole expérimental………...….……..42
Figure 15: Variation du poids corporel et de la consommation alimentaire au cours du traitement chez les groupes (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC).………60
Figure 16: Variation de la glycémie et HbA1C au cours du traitement chez les groupes (AZ), (ZD), (ZD +VE), (ZD +VC) et (ZD +VE+VC)..…………63
Figure 17 : Variation de la concentration du cholestérol et des triglycérides au cours du traitement chez les groupes (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE +VC)………..66
Figure 18 : Variation de l’activité des transaminases (AST et ALT) et le taux de bilirubine chez les groupes (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC).………69
VC) et (ZD + VE + VC)………..72 Figure 20 : Concentration d’urée, d’acide urique et de la créatinine sérique chez des
rat diabétiques sous un régime alimentaire (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC).………73 Figure 21 : Concentration de protéines, urée et acide urique urinaire chez des rat
diabétiques sous un régime alimentaire (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC).………74 Figure 22 : Concentration du zinc dans le sérum, le foie et le rein chez les groupes
(AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC) ………..77 Figure 23 : Concentration du zinc dans le pancréas et le fémur chez les groupes (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC)...………78 Figure 24 : Variation de l’activité de la PAL et LDH chez les groupes (AZ), (ZD), (ZD + VE), (ZD +VC) et (ZD + VE + VC).………...81 Figure 25 : Concentration de GSH et MDA hépatique chez les groupes (AZ), (ZD),
(ZD +VE), (ZD + VC) et (ZD + VE + VC)...……….84 Figure 26 : Concentration de GSH et MDA rénal chez les groupes (AZ), (ZD), (ZD +VE), (ZD + VC) et (ZD + VE VC)..………85 Figure 27: Activité de la catalase, GSH-Px et la superoxyde dismutase hépatique
chez les groupes (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + V)....89 Figure 28: Activité de la catalase, GSH-Px et la superoxyde dismutase rénale chez
les groupes (AZ), (ZD), (ZD +VE), (ZD +VC) et (ZD +VE+ VC)………90 Figure 29: Histologie de rein des rats diabétiques sous un régime alimentaire (AZ) (ZD), (ZD+VE), (ZD+VC), et (ZD+VE+VC) (coloration par Hématoxyline et Eosine) (Gr×100)………92
Figure 30: Coupes histochimiques du glycogène hépatique chez des rats diabétiques
sous un régime alimentaire (AZ) (A), (ZD) (B). (Coloration Acide
Périodique-Schiff: APS)………...94
Figure 31: Coupes histochimiques du glycogène hépatique chez les groupes
(ZD+VE) (C), (ZD+VC) (D), (ZD+VE+VC) (E) (Coloration Acide
Liste des tableaux
Tableau 1: Caractéristiques des diabètes de type 1 et de type 2..………... 4 Tableau 2: Tableau récapitulatif des principaux antioxydants et de leurs modes
d'action...23 Tableau 3 : La composition des régimes alimentaires...………… ..... ……… 39 Tableau 4 : La quantité des métaux dans la nourriture..………...39
Tableau 5 : Variation du poids corporel et de la consommation alimentaire au cours du traitement chez les groupes (AZ), (ZD), (ZD+VE), (ZD+VC) et (ZD +VE+VC)..………..59 Tableau 6 : Variation de la glycémie et HbA1C au cours du traitement chez les groupes
(AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC)...……...62 Tableau 7 : Variation de la concentration du cholestérol et des triglycérides au cours du
traitement chez les groupes (AZ), (ZD), (ZD +VE), (ZD + VC) et (ZD +VE + VC)………..65 Tableau 8 : Variation de l’activité des transaminases (AST et ALT) et le taux de
bilirubine chez les groupes (AZ), (ZD), (ZD + VE), (ZD + VC) et (ZD + VE + VC) ………...…...68 Tableau 9 : Variation des paramètres rénaux (protéines totale, urée, créatinine et acide
urique) dans le sérum et les urines des rat diabétiques sous un régime
alimentaire (AZ), (ZD), (ZD+VE), (ZD+VC) et (ZD+VE+
VC)...………... 71
Tableau 10 : Concentration du zinc dans le sérum, le foie, le rein, le pancréas et le fémur chez les groupes (AZ), (ZD), (ZD + VE), (ZD + VC) et ZD + (VE + VC)..………….76
Tableau 11 : Variation de l’activité de la PAL et LDH chez les groupes (AZ), (ZD), (ZD + VE), (ZD +VC) et (ZD + VE + VC)...………..80 Tableau 12: Concentration de GSH et MDA hépatique et rénal chez les groupes (AZ), (ZD), (ZD+ VE), (ZD + VC) et (ZD + VE + VC)...………..83 Tableau 13: Activité enzymatique de la catalase, GSH-Px et SOD hépatique et rénal,
Le but de ce travail est d'étudier l'effet de la vitamine C et la vitamine E seul ou en combinaison sur le métabolisme glucidique, lipidique, protéique, sur le statut en zinc et les paramètres antioxydants chez les rats diabétiques sous un régime alimentaire pauvre en zinc.
Des rats diabétiques de souche Wistar, ont été répartis en cinq lots : Le premier a reçu un
régime alimentaire contenant 54 mg zinc/kg d'aliment (adéquat en zinc AZ), le deuxième a
reçu un régime contenant 1 mg de zinc/kg d'aliment (groupe déficient en zinc ZD) et les trois autres groupes ont reçu le régime alimentaire DZ et traité par voie orale: par la vitamine E (500mg/kg poids corporel) (ZD+VE), la vitamine C (500mg/kg poids corporel) (ZD+VC) et
les vitamines E et C en association (250+250 mg/kg poids corporel) (ZD+VC+VE). Le poids
corporel et la consommation alimentaire ont été effectués régulièrement.
Selon les résultats obtenus, la carence en zinc dans l'alimentation a provoqué un déficit
pondéral, une diminution de: la consommation alimentaire, le taux de glycogène hépatique, la
concentration du zinc dans le sérum et les différents tissus, l’activité de la phosphatase alcaline, la lactate déshydrogénase et le taux des protéines sériques et l’albuminémie chez les
animaux diabétiques. La carence en zinc a également augmenté la glycémie, l’HbA1c, la
concentration du cholestérol, triglycérides, bilirubine, l’activité de la glutamate oxaloacétate transaminase, glutamate-pyruvate transaminase, la protéinurie, l’urée, l’acide urique sérique et urinaire, la créatininémie et le taux de MDA hépatique et rénal. Alors que l’activité de la catalase, la glutathione peroxidase, la superoxid-dismutase et le taux du glutathione hépatique et rénal ont été réduits.
En conclusion, l’administration de la vitamine E et la vitamine C seule ou en association a amélioré le taux de la glycémie, le profil lipidique, le statut en zinc, les paramètres antioxydant, la fonction hépatique et rénale. Ainsi, l'action préventive des vitamines C et E peuvent être liée à leur efficacité antioxydante par l’inhibition de la peroxydation lipidique due à la sévérité de la carence en zinc et le diabète expérimental.
Mots clés : Diabète expérimental, carence en zinc, vitamine E, vitamine C, stress oxydatif, métabolisme des carbohydrates.
This study was carried out to investigate the combined effect of vitamin C and vitamin E on glucides, lipides and proteins metabolism, zinc status and some parameter of antioxidant system in diabetic rats fed low zinc diet.
Diabetic Wistar rats were randomly assigned into five groups. The first group received a diet containing a 54 mg zinc/kg diet (adequate zinc, AZ), the second group received a diet containing 1mg zinc/kg diet (zinc deficient group, ZD), and the three other groups received ZD diet and treated orally with vitamin E (500mg/kg body wt) (ZD+VE), vitamin C (500mg/kg body wt) (ZD+VC), and vitamins E plus vitamin C (250 + 250 mg/kg body wt) (ZD+VC+VE). Body weight and food intake were recorded regularly.
Acording to results wich have been obtained zinc deficiency led to a reduction in body
weight and food intake, liver glycogen, serum and tissues zinc concentration, alkaline
phosphatase, lactate desydrogenase activities, serum albumin and total protein of diabetic animals. Dietary zinc deficiency increased also blood glucose, HbA1c, cholesterol, triglycerides, bilirubin concentrations, glutamate oxaloacetate transaminase, glutamate-pyruvate transaminase activities, protein urea and uric acid excretion, serum urea, serum uric acid, serum creatinine, kidney and hépatic malondialdehyde levels of low zinc diabetic rats. In contrast, catalase, glutathione peroxidase and superoxid-dismutase activities, liver and kidney glutathione were reduced.
However, the combined administration of vitamins C and E together or separathly to diabetic rats fed low zinc diet attenuated hyperglycemia, improved: lipid profile, the depletion of serum, tissues zinc concentrations, antioxydants parameters, hepatic and renal function. So preventive action of vitamins C and E may related to their antioxidant efficacy that inhibits lipid peroxidation and free radicals alterations due to the severity of zinc deficiency and diabetes mellitus.
Key words: Experimental diabetes, zinc deficiency, vitamin E, vitamin C, oxidative stress, carbohydrate metabolism
ٌ ذه فذه ا لا ذحب ًنإ تطارد ٍُيبخُفنا زُرأح E و ٍُيبخُفنا C زظُػ غَسىح ، تُحارذُهىبزكنا داىًنا وشُنىببخُي ًهػ ًهػو ،كَشنا ثازشؤي صىقُي ٍئاذغ وبظَ ًهػ تػىػىي ٍبَزجخنا ٌزكظنا ءاذنبب تببظي ٌازئف ذُػ ةذظكلأا ثادبؼي كَشنا زظُؼن . تنلاط ٍي ٌازئف ًهػ تطارذنا جَزجأ ( Wistar ) و ةبطة ٌزكظنا ءاذنبب ٍبَزجخنا ثبػىًجي ضًخ ًنإ بهًُظقح ىح ، : ًهػ ٌىخحَ ٌدبػ ٍئاذغ وبظَ ًهػ تػىػىي ًنولأا 54 كَس غهي / وبظَ ًهػ تػىػىي تَُبزنا تػىًجًنا ،ءاذغ غهك ًهػ ٌىخحَ كَشنا زظُؼن صىقُي ٍئاذغ 1 كَس غهي / ٍئاذغ وبظَ ًهػ تػىػىي تُقبخًنا ثبػىًجي دلازنا ،ءاذغ غهك تجنبؼيو كَشنا زظُؼن صىقُي : ة ٍُيبخُفنا E ( 500 غهي / ٌاىُحنا ٌسو غهك ) ٍُيبخُفنا ، C ( 500 غهي / ٌسو غهك ٌاىُحنا ) ٍُُرلإا وأ ، بؼي ( 250 غهي / ٍُيبخُفهن تبظُنبب غهك E + 250 غهي / ٍُيبخُفهن تبظُنبب غهك C ) ، للاخ ةزخف تجنبؼًنا ،تكههخظًنا ءاذغنا تًُكو ٌاىُحنا ٌسو ثازُغح غبخح ىح تًظخُي تفظب . تًُك ،ىًُنا لذؼي ٍي مك عبفخَا ًنإ يدأ ءاذغنا ٍف كَشنا زظُػ ضقَ ٌأ ٍُبح بهُهػ مظحخًنا جئبخُنا للاخ ٍي تكههخظًنا ءاذغنا يىخظي ،ذبكنا ٍف ٍُجىكُهغنا تبظَ ، تجظَلأا غؼب ٍفو مظًنا ٍف كَشنا زظُػ ( ،تُهكنا ،ذبكنا ذخفنا ىظػو صبَزكُبنا ) لا سبخفطىفنا ىَشَإ ؽبشَ عبفخَا ، ا و ٌىهق ل لا مظًنا ٍف سبُُجورذُهَد ثبخك . كَشنا زظُػ ضقَ ،سىكىهغنا زكط ٍي مك شُكزح عبفحرإ ًنإ بؼَأ يدأ ءاذغنا ٍف (HbA1c) ، ،لوزخظنىكنا ،تُرلازنا ثاذَزُظُهغنا ،بَرىُنا ٍُبوزُهُبناو كَرىُنا غيبح ،ٍُُُحبَزكنا ٍُيلأا ثلاقبُك ثبًَشَلإا غؼب ؽبشَ عبفحرا و ( ALT, AST ) بُهجط بًك ، ثبَاىُحنا مظي ٍف ٍُيىبنلأاو تُهكنا ثبُُحوزبنا شُكزح ٍف عبفخَا تَربقي كَشنا زظُؼن صىقُي ٍئاذغ وبظُن تؼػبخنا ٌدبػ ٍئاذغ وبظُن تؼػبخنا بهحزُظُب . ذُح ةذظكلأن دبؼًنا وبظُنا ٍف ةازطػا ًنإ يدأ كَشنا زظُؼن صىقًُنا ءاذغنا سلابخكنا ىَشَأ ؽبشَ ضقَ بُهجط ، SOD ذظكؤًنا ٌىُربحىهجنا ، ( GSH-Px ) لشخخًنا ٌىُربرىهجنا تًُكو ( (GSH ٍف تَذُبهنا ةذظكلأا زشؤي تًُك ةدبَشب ببىحظي تُهكناو ذبكنا ٍي مك ( (MDA ٍُيبخُفنا ٍي مكب ثبَاىُحنا تجنبؼي ٍكن ، E و ٍُيبخُفنا C بهُي تُجىنىَشُفنا زكذنا تفنبظنا زَُبؼًنا ٍُظحح ًهػ جهًػ تُهكناو ذبكنا ٍي مك تفُظوو تُئبًُُكىُبناو . جخُخظَ زُخلأا ٍف ٍُيبخُفهن ٌأ E و ٍُيبخُفنا C دبهجلإا ةذح غُفخح ًهػ لاًػ ذُح ةذظكلأن ٍَدبؼًك وبه رود ٌذظكأخنا ؾُبزحو تَذُبهنا ةذظكلأا جحبُنا ة و ءاذغنا ٍف كَشنا زظُػ ضقَ ٍػ ٍنبخنبب ٌزكظنا ءاذنا رىطح ٍي تَبقىنا . ةيحاتفملا تاملكلا : عزي ٌزكظنا ٍبَزجخنا ،ٌذظكأخنا دبهجلإا ،كَشنا زظُػ ضقَ ، ا ٍُيبخُفن E ، ا ٍُيبخُفن C ، تُحارذُهىبزكنا داىًنا وشُنىببخُي ،ة
Introduction
générale
Introduction
Depuis quelques années, le monde des sciences biologiques et médicales est envahi par un nouveau concept, celui du « stress oxydant », c'est-à-dire d'une situation où la cellule ne contrôle plus la présence excessive des radicaux oxygénés toxiques. Actuellement, il est bien admis que même si un stress oxydant n’est pas une maladie en soi, il est potentiellement impliqué dans de nombreuses maladies comme facteur déclenchant ou associé à des complications lors de leur évolution comme dans le cas du diabète (Favier, 2003).
Le diabète sucré est une maladie considérée par l’OMS comme une épidémie et dont la prévalence a augmenté de façon très importante au cours de ces dernières années. C’est une maladie potentiellement mortelle, responsable chaque année dans le monde de près de 4 millions de décès. Le diabète sucré se caractérise par une hyperglycémie résultant d’un défaut de sécrétion, d’action de l’insuline ou de ces deux anomalies associées (Drouin et al, 1999).
L’état d’hyperglycémie chronique et les fluctuations glycémiques du diabète sucré conduit à un stress oxydatif, ce qui est défini comme un déséquilibre de la balance entre les
pro-oxydants et les antipro-oxydants incluant plusieurs mécanismes : auto-oxydation du glucose,
glycation des protéines, voie des polyols, surproduction de radicaux superoxyde au niveau de la mitochondrie et de la NADPH oxydase. L’implication du stress oxydatif dans la maladie du diabète sucré est considéré comme le moteur mobilisant les différents facteurs pathologiques vers les complications micro et macro-vasculaires du diabète ; dont l’athérosclérose, la néphropathie, la rétinopathie et la neuropathie (Delattre, 1999).
Le zinc est un oligo-élément majeur, sa carence entraîne la prévalence et la sévérité du diabète sucré, du fait qu’il joue un rôle évident dans la synthèse, le stockage, la sécrétion, ainsi que l’intégrité conformationnelle de l’insuline sous forme héxamérique. La déficience en zinc se manifeste par une hyperglycémie, l’une des causes majeures du stress oxydatif, qui contribue elle-même à l’évolution des complications diabétiques et des désordres métaboliques telles que, l’élimination de grandes concentrations du zinc dans les urines, la diminution du taux du zinc dans le sérum et les différents tissus de l’organisme, plus une chute de l’activité des enzymes à zinc comme la superoxyde dismutase (SOD), la première ligne de défense antioxydante (Chausmer, 1998).
Les diabétiques ont une protection antioxydante déficiente qui augmente leur vulnérabilité aux dommages oxydatifs et favorise le développement des complications diabétiques (Maxwell et al, 1997; Nourooz-Zadeh et al, 1997). Pour cela le traitement du diabète doit faire appel non seulement à un régime alimentaire équilibré et moins calorique, mais aussi à une alimentation qui doit être riche en oligoélément ou en vitamines antioxydants comme la vitamine E et la vitamine C. Ces deux vitamines luttent efficacement de façon synergique contre le stress oxydatif et leurs effets délétères sont considérées par les chercheurs comme ayant un pouvoir antioxydant, ce qui signifie qu'elles sont capables de limiter les agressions des radicaux libres et, de ce fait, d'avoir la faculté de protéger la vie cellulaire de notre organisme (Jane et al, 2000).
L’objectif de notre étude est de mettre en évidence l’impact de la vitamine E, la vitamine C et de leur administration en association sur le métabolisme glucidique, lipidique et protéique d’une part, et d’autre part sur le statut en zinc et antioxydant, chez des rats diabétiques et sous un régime alimentaire pauvre en zinc.
Etude
bibliographique
Chapitre I
Page | 1 1. Définition
Le diabète sucré est une pathologie métabolique caractérisée par une hyperglycémie chronique (Marshall and Bangert, 2005) accompagnée d’une perturbation des métabolismes, glucidique, lipidique et protéique, et résultant d’un défaut de sécrétion d’insuline, de son activité ou de ces deux défauts associés (Delattre et al., 2003).
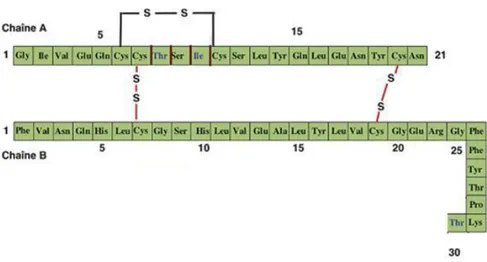
L’insuline est une protéine globulaire de 51 acides aminées (aa) (5808Da) (Delattre et al., 2003), composée de deux chaînes principales A (21aa) et B (30 aa) reliées entre elles par des ponts disulfures (Figure 1) (Gmenez et al., 2002), elle est synthétisée par les cellules béta des ilots de Langerhans du pancréas (Gaw et al., 2004).
L’insuline est en effet la seule hormone hypoglycémiante de l’organisme (Sapin and Dermangeat, 2001). Elle stimule l’absorption du glucose sanguin par les tissus dits insulinodépendants (tissus adipeux, muscles squelettiques) et son stockage sous forme du glycogène, l’absorption et le métabolisme glucidique sont proportionnels à la concentration sanguine en glucose et sont donc plus élevés au cours du diabète (Frier et al., 2000).
L’hyperglycémie chronique est la cause principale de la survenue des complications dégénératives de la maladie diabétique, mais celles-ci sont néanmoins susceptibles d’être évitées ou tout au moins retardées par un traitement adéquat (Rodier, 2001).
Page | 2 2. Épidémiologie
La prévalence du diabète est en forte augmentation depuis quelques années, principalement le type 2 mais aussi dans une moindre mesure, le type I. En 2014 l’OMS estime la prévalence mondiale du diabète à 9% chez les adultes âgés de 18 ans et plus, et prévoit qu’en 2030, le diabète sera la septième cause de décès dans le monde
En Algérie, la dernière étude nationale basée sur l’approche de l’OMS (organisation mondiale de la santé), réalisée en 2004 par l’INSP (Institut Nationale de Santé Publique) retrouvait une prévalence du diabète de 5,5% chez les sujets âgés entre 25 et 55 ans et 13,7% chez les sujets âgés entre 55 et 60 ans (Mimouni, 2008). Mais selon une enquête nationale, l’étude TAHINA (Transition Health Impact in North Africa) réalisée en 2006, la prévalence du diabète est de 12,4% en Algérie, l’accroissement démographique et le vieillissement de la population, sont responsables d’une augmentation du nombre de diabétique de type 2 (Mimouni, 2008).
Selon IDF (International Diabetes Federation), l’incidence du diabète de type 1, évaluée entre 0 et 14 ans est de 8,6 pour 100.000 sujets (Mimouni, 2008). Les estimations prédisent que plus de 300 millions des personnes souffriront du diabète en 2025 (Eli and Friedaman, 2010).
3. Critères biologiques de diagnostic
De nouveaux critères ont été proposés en juin 1997 par American Diabetic Association (ADA). Ils ont été adoptés en 1998 par l’OMS, puis par l’Association de Langue Française pour l’Etude du Diabète et des Maladies métaboliques (ALFEDIAM), et ont été retenus par l’Agence Nationale d’Evaluation en Santé (ANAES) en 1999 (Spinas and Lehman, 2001). Une personne est considérée comme diabétique si elle présente un des éléments suivants :
Présence des signes cliniques du diabète (polyurie, perte de poids inexpliquée, polydypsie…).
Glycémie à jeun (8 heures de jeune ou plus) ≥ 1,26 g/l (7 mmol/l).
Page | 3 4. Classification
Il existe deux principales formes cliniques de diabète correspondant à deux mécanismes pathogéniques différents : le diabète insulino-dépendant ou diabète de type 1 et le diabète non insulino-dépendant ou diabète de type 2 (Tableau 1).
4.1. Le diabète type 1
Le diabète de type 1, auparavant appelé diabète insulino-dépendant (DID), représente environ 10% des cas de diabète mondiaux. Il apparaît le plus souvent chez l'enfant et le jeune adulte, c'est pourquoi il est aussi appelé "diabète juvénile". Les symptômes classiques les plus manifestes sont, une sécrétion excessive d'urine (polyurie), une sensation de soif (polydipsie) ainsi qu'une perte de poids, d'où son autre dénomination de "diabète maigre".
C'est une maladie auto-immune conduisant à la destruction sélective et progressive des cellules β pancréatiques, productrices d'insuline. Cette destruction résulte de la production d'auto-anticorps dirigés contre des antigènes des cellules β. Ce processus de destruction entraîne une carence en insuline absolue et définitive responsable de l'apparition d'une hyperglycémie chronique permanente. Le pancréas étant incapable de produire l'insuline, la survie de ces malades dépend entièrement d'injection quotidienne de cette hormone, d'où son nom de diabète insulino-dépendant. (Buysschaert et al., 1999; Boitard, 2002; Delattre et al., 2003).
4.2. Le diabète type 2
C‘est la forme la plus fréquente du diabète sucré, regroupe près de 85% des cas diabétiques. Parfois faussement appelé « diabète gras », elle survient majoritairement après 40 ans chez les sujets obèses et sa prévalence augmente avec l’âge (Buysschaert et al., 1999).
Le diabète non insulinodépendant (DNID) est caractérisé par une sécrétion persistante et importante d'insuline, qui est sécrétée par le pancréas chaque fois que la glycémie a tendance à s’élever, après les repas et au contraire, freinée dans les situations de jeûne à distance des repas. On parle de résistance à l'insuline ou d'insensibilité à l'insuline (Geoffrey et al., 2005). Les principaux facteurs cliniques d’insulino-résistance sont, l’obésité, la sédentarité, l’âge et les facteurs génétiques familiaux, cette forme peut être maîtrisée par un régime alimentaire spécial, des médicaments par voie orale et un exercice physique systématique (Gmenez et al., 2002).
Page | 4 Tableau 1 : Caractéristiques des diabètes type 1 et type 2 (Rodier, 2001).
Caractéristiques Diabète type 1 Diabète type 2
Fréquence relative 10-15% 85-90%
ATCD familiaux + +++
Age de début Avant 30 ans Après 40 ans
Mode de début Brutal Progressif
Surpoids Absent Présent
Symptômes +++ ---
Insulinosécrétion Néant Persistante
Cétose Fréquente Absente
MAI associées * Oui Non
Auto-anticorps Présents Absents
Traitement Insuline Régime, exercice, ADO**
MAI* : Maladie Auto-Immune. ADO** : Anti-Diabétiques Oraux
5. Diabète gestationnel
L’OMS, définit le diabète gestationnel comme un trouble de la tolérance glucidique conduisant à une hyperglycémie de sévérité variable, débutant ou diagnostiqué pour la première fois pendant la grossesse, quelque soit le traitement nécessaire et l’évolution dans le post-partum. Le diabète gestationnel ou le diabète gravidique touche 4 à 7% des femmes enceintes, il disparaît après l’accouchement. Le traitement repose sur l’administration d’insuline à la femme enceinte lorsque la mise en place des mesures hygiéno-diététiques ne suffit pas à contrôler la glycémie.
6. Autres types du diabète sucré
Les autres types de diabètes sont représentés par les déficits génétiques altérant la fonction des cellules des ilots de Langherhans, les déficits génétiques altérant l'action de l'insuline, les maladies du pancréas exocrine, les endocrinopathies, les diabètes induits par des médicaments ou des toxiques, les diabètes de cause infectieuse et les diabètes rentrant dans le cadre de syndromes génétiques (Ricordeau et al., 2000).
Page | 5 7. Complications
Malgré le développement de molécules normalisant la glycémie et l’amélioration de schémas thérapeutiques, le diabétique reste soumis à une surmorbidité et à une surmortalité liées essentiellement à des atteintes dégénératives tissulaires notamment au niveau des nerfs, des reins, de la peau, de la rétine et du cœur. Le diabète sucré induit fréquemment l’apparition des complications aiguës ou chroniques. La principale complication diabétique aiguë est un coma causé soit par une hyperglycémie (acidocétose) soit par une hypoglycémie (due par exemple à une prise trop importante d’un médicament hypoglycémiant). Les complications chroniques du diabète consistent surtout en des maladies vasculaires dégénératives dont les caractéristiques principales sont l’obstruction progressive de la lumière des vaisseaux et, au niveau de la microcirculation, le passage anormal des protéines de la circulation sanguine vers les tissus. Ces complications concernent à la fois les gros vaisseaux (macroangiopathie) et les microvaisseaux (microangiopathie). La persistance de l’hyperglycémie est étroitement liée à l’augmentation de l’incidence et de la gravité des complications vasculaires diabétiques (Sheetz and King, 2002).
8. Traitements
En ce qui concerne le diabète de type 1, le premier objectif est de normaliser la glycémie. L’insulinothérapie et la maîtrise des variations physiologiques de la glycémie provoquées par l’alimentation et l’exercice physique, en attendant la maîtrise de la greffe du pancréas, doit permettre d’atteindre cet objectif idéal. Le traitement du diabète de type 2 passe essentiellement par un contrôle diététique strict et une médication adaptée. Les objectifs de la diététique sont doubles : d’une part diminuer l’insulinorésistance en réduisant une éventuelle surcharge pondérale et d’autre part éviter les pics hyperglycémiques notamment la nuit et après les repas. Les sulfamides hypoglycémiants (dérivés de la sulfonylurée) stimulent la sécrétion d’insuline basale et induite par le glucose. Ils ont également des effets extrapancréatiques (qui n’ont cependant qu’une importance clinique limitée) en potentialisant le transport de l’insuline et le stockage du glucose. Les biguanides ont une action hypoglycémiante par un effet extrapancréatique : ils potentialisent l’action de l’insuline au niveau des cellules cibles (foie et muscles surtout). De plus, ils réduisent la néoglucogenèse hépatique et l’absorption intestinale des glucides (Ouedraogo et al., 2000).
Chapitre II
Le zinc
Page | 6 1. Historique et importance biologique du zinc dans les organismes vivants
En biologie, Raulin (1869) découvre qu’Aspergillus niger contient du zinc. Quelques années plus tard, Lechartier and Bellamy (1877) constatent sa présence dans divers organismes végétaux et animaux; la même année, Raoult and Breton révèlent sa présence dans le foie humain. Dans les années qui suivent, le zinc a été mis en évidence dans la plupart des plantes et des animaux à des concentrations un peu moins élevées que le fer, mais plus importantes que celles du manganèse et du cuivre. En 1934, la diminution des performances de croissance des rats et des souris, induite par la réduction de l’apport alimentaire de zinc a révélé le caractère essentiel de cet élément. Cette observation a été rapportée presque simultanément en Europe (Bertrand and Bhattacherjee, 1934) et en Amérique (Todd et al., 1934).
En 1940, le zinc fut identifié dans l’enzyme anhydrase carbonique isolée et purifiée (Kielin and Mann, 1940). En 1955, le caractère essentiel du zinc préalablement démontré chez le rat et la souris, a été mis en évidence chez le porc (Tucker and Salmon, 1955) et en 1958 chez les poulets de chair (O’Dell et al., 1958).
2. Définition et caractéristiques générale du zinc
Le zinc est un métal de transition, caractérisé par une bonne conductivité électrique. Il fait partie du groupe IIb de la classification de Mendeleïev avec le cadmium et le mercure. Il
possède le numéro atomique 30. Le potentiel redox de Zn/Zn++ est de 0,763 V. En biologie, le
zinc est généralement un cation divalent (Zn++), donne facilement des complexes avec les groupes chargés négativement. Les complexes du zinc sont généralement de coordination tétraédrique, mais peuvent aussi être octaédrique ou pentaédrique. Les principaux ligands donnant des liaisons de covalence avec le zinc sont les groupes thiols, amines ou imidazoles des acides aminés ou des protéines. La formation de complexe est indispensable pour comprendre le rôle biochimique ou le métabolisme du zinc (McCall et al., 2000).
3. Sources et besoins
Les apports de zinc conseillés par l’OMS sont de 12,8 à 54,5 mg/j selon la disponibilité alimentaire, les besoins étant doublés pendant la grossesse et quintuplés pendant la lactation. Les doses toxiques sont situées plus de dix fois au dessus de ces ordres de grandeur. Un apport prolongé de 200mg/j semble atoxique.
Page | 7 Les principales sources alimentaires de zinc sont les produits d’origine animale : viandes (2-6 mg/100g), poissons et fruits de mer (plus de 1,5 mg/100g), lait (0,3 à 0,5mg/100g).
Les viandes rouges sont plus riches en zinc que les viandes blanches. Les huîtres sont l’aliment le plus riche en zinc, 1mg/g de poids humide. Les eaux de distribution sont généralement plus riches en zinc que les eaux de source. Les aliments d’origine végétale sont de moins bonnes sources de zinc car le zinc qu’ils contiennent est moins disponible pour l’absorption digestive, du fait de la présence de phytates (Prasad, 1979).
4. Métabolisme
4.1. Répartition du zinc dans l’organisme
Le zinc est l’élément trace le plus abondant après le fer. Le corps contient environ 2,5g de zinc dont 30% dans les os et 60% dans les muscles. Les tissus les plus riches en zinc sont la prostate, les cheveux et l’œil. Les concentrations tissulaires varient en fonction de l’âge. Chez le nouveau-né, le foie et les os sont plus riches en zinc que chez l’adulte et le muscle en contient des quantités moindres. Les liquides de l’organisme ne représentent en quantité qu’une faible part du zinc total, les éléments figurés du sang étant bien plus riches que le plasma (Jackson, 1989).
4.2. Transport sérique
Le transport actif du zinc n’est pas assuré par une protéine spécifique, mais par plusieurs transporteurs capables de capter plus ou moins de zinc selon leurs concentrations et leurs affinités respectives (Jackson et al., 1984).
- Alpha 2 macroglobuline : Est une glycoprotéine anti-protéase formée de quatre sous-unités identiques fixant chacune deux atomes de zinc. Environ 20% du zinc est lié très fortement à
cette protéine (Osterberg andMalmensten, 1984).
- La sérumalbumine : Le zinc se fixe de façon non spécifique sur la molécule d’albumine par les résidus histidinyl de cette protéine. La sérumalbumine transporte environ 60 à 65% du zinc sérique total (Cousin, 1985).
- La transferrine : L’extrémité N terminale possède une affinité suffisante pour fixer le zinc, environ 12% du zinc serait lié à cette protéine. La liaison zinc-transferrine est très labile, d’où une très grande disponibilité de ce métal pour les tissus demandeurs de zinc (Philips and Azari, 1974).
- La glycoprotéine riche en histidine : C’est une protéine de poids moléculaire58 000 et dans laquelle l’histidine représente 10% de la composition. L’affinité de cette protéine pour le
Page | 8 zinc est très forte et pour certains auteurs elle transporterait plus de zinc que la sérumalbumine (Morgan, 1985).
4.3. Absorption
L’absorption intestinale est une étape clé du métabolisme du zinc car elle assure en grande partie la régulation de la concentration de ce métal dans l’organisme.
L’absorption est définie comme étant la quantité d’un nutriment de l’aliment qui passe de la lumière digestive, à travers la muqueuse, dans la circulation portale. L’intestin grêle est le principal site d’absorption du zinc chez la plupart des espèces animales. Chez le rat, l’absorption de zinc la plus intense se situe au niveau du duodénum, la section la plus courte de l’intestin grêle (Davies, 1980). Mais, compte tenu de la longueur des différentes sections, le zinc absorbé serait respectivement 20% dans le duodénum, 20% dans le jéjunum et 60% dans l’iléon (Lonnerdal, 1989).
4.4. Excrétion
Le zinc peut être excrété par différentes voies :
- La voie fécale : le zinc fécal correspond au zinc non absorbé des aliments et au zinc endogène. Le zinc endogène provient des sécrétions gastriques et pancréatiques, de la bile, de la salive et de la muqueuse intestinale. L’excrétion fécale est en moyenne de 10 mg/j et participe de façon importante à la régulation de l’homéostasie zincique (Jackson et al., 1984). - La voie urinaire : de nombreux travaux montrent que l’élimination urinaire du zinc est directement liée à la fraction ultra-filtrable du plasma, formée des complexes avec des acides aminés et du citrate. Le zinc filtré au niveau glomérulaire est réabsorbé au niveau du tube distal. L’excrétion urinaire de zinc est normalement très faible. Elle augmente lors de néphropathies avec des troubles de la filtration glomérulaire (Abu-Hamdan et al., 1981).
5. Fonctions
Le zinc participe à de nombreuses fonctions dans l’organisme par son rôle structural, régulateur, ou catalytique d’un grand nombre d’enzymes. Il joue un rôle important dans la stabilisation du matériel génétique et est un composant essentiel de certaines enzymes qui participent à la synthèse des acides nucléiques.
Page | 9 Antioxydant puissant, il protège contre les agressions par les radicaux libres et permet ainsi de ralentir le vieillissement des cellules. Le zinc a une action sur le système nerveux du fait de son intervention dans le métabolisme glucidique, et joue un rôle dans le fonctionnement des neurones dont les vésicules sont riches en zinc.
Il intervient dans le métabolisme des protéines, mais aussi dans les mécanismes de division cellulaire et de croissance tissulaire, par conséquent, il est nécessaire à la cicatrisation, au développement normal du fœtus durant la grossesse et à une croissance normale des enfants et des adolescents.
Il joue aussi un rôle essentiel dans la régulation du système immunitaire, il augmente le nombre des lymphocytes T permettant de mieux résister aux maladies, il possède des propriétés anti-inflammatoires, il favorise la résistance aux infections de la peau (acné, herpès, vergetures, etc.) et des muqueuses. Le zinc favorise l’appétit et préserve le goût car la gustine en est dépendante. Notons également que le zinc est présent dans le liquide séminal et intervient dans la reproduction et la mobilité des spermatozoïdes, il joue donc un rôle important dans la reproduction et la fertilité (Sandstead et al., 2008; Roussel and Hininger-Favier, 2009 ) .
6. La carence en zinc
Les carences en zinc se traduisent par un certain nombre de signes cliniques, en fonction de la gravité de la maladie. Les carences sont d’origines variables, elles peuvent être dues à un apport insuffisant de zinc dans l’alimentation, à une malabsorption de cet oligoélément, à une augmentation des besoins (croissance, grossesse) ou à des différents états pathologiques (diarrhée, alcoolisme, diabète, infection). Les symptômes carentiels varient selon leurs gravité : retard de croissance, altérations de la peau et des muqueuses (dermite séborrhéique, inflammation de la commissure des lèvres, éruption semblable à l’eczéma ou au psoriasis), chute des cheveux, perte du goût, diminution de l’appétit, problèmes de cicatrisation, troubles de l’immunité et de la maturation sexuelle (atrophie des gonades : testicules, ovaires), diminution de la spermatogenèse et, chez la femme enceinte, risque de malformations et d’hypotrophie fœtales (Roth et al.,2008).
Page | 10 7. La relation entre le zinc, l’insuline et le diabète sucré
Il existe une relation physico-chimique entre le Zn et l’insuline, bien connue depuis des décennies, dans les années 30 et avant l’existence de preuves biochimiques sur la relation entre le Zn et l’insuline dans les cellules β du pancréas. Scott (1934) découvre la nécessité du zinc pour former les cristaux d’insuline. En effet, au cours de sa maturation dans le réticulum endoplasmique rugueux, l’insuline est complexée sous forme d’hexamères avec deux atomes de Zn, ce complexe relativement peu soluble se cristallise dans les vésicules sécrétoires (Dunn, 2005). Des analyses en fluorescence ont permis de mettre en évidence que la concentration en Zn dans les îlots de Langerhans était en relation avec la synthèse, le stockage et la sécrétion d’insuline. L’ajout de Zn aux doses d’insuline commerciale permettait de prolonger l’action de l’insuline et ainsi de diminuer le nombre d’injections aux diabétiques (Zalewski et al., 1994).
Chapitre III
.
Page | 11
1. Définition du stress oxydatif
Le stress oxydatif est un déséquilibre entre la production des radicaux libres et la capacité des mécanismes protecteurs de l’organisme à neutraliser ces composés toxiques avant qu’ils occasionnent des dégâts aux différents constituants de nos cellules: ADN, protéines, lipides… et peuvent provoquer à long terme le vieillissement des cellules et conduire à des maladies (cancer, Alzheimer, Parkinson…) (Favier, 2003).
2. Définition d’un radical libre
Les radicaux libres sont des espèces chimiques qui possèdent un ou plusieurs électrons célibataires sur leur couche externe (Halliwell and Gutteridge, 1999). La présence d’un électron célibataire confère aux radicaux libres une grande instabilité et une réactivité, ils
peuvent être aussi bien des espèces oxydantes que réductrices. Ils retrouveront leurs stabilités
en participant à des réactions chimiques dont la conséquence est l'oxydation des lipides membranaires, l'oxydation des acides aminés composant les protéines et l'oxydation des
glucides composant les acides nucléiques (Tremellen, 2008). De façon générale, les radicaux
libres contribuent au stress oxydatif par une série de réactions en chaîne. Ils peuvent être dérivés de l’oxygène (espèces réactives de l’oxygène ERO ou ROS) ou d’autres atomes comme l’azote (espèces réactives d’azote ERA).
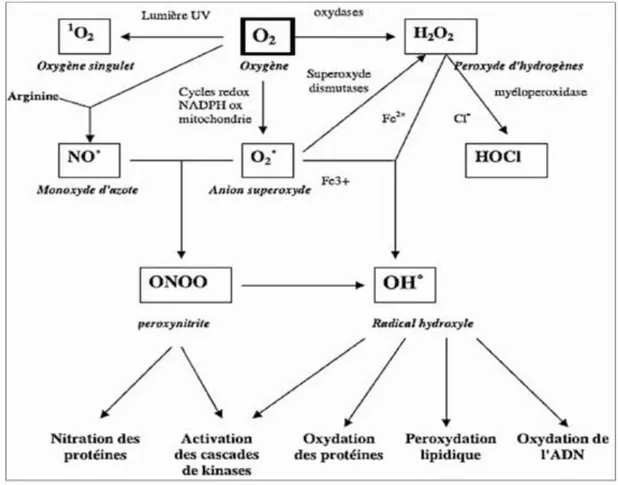
Actuellement, on emploie le terme d’espèces réactives de l’oxygène pour désigner un ensemble plus large des molécules :
- Des radicaux oxygénés caractérisés par un électron non apparié (l’anion superoxyde O2•
-, les radicaux hydroxyles HO•, peroxyle ROO•, alkoxyle RO•) (Favier, 2003).
- Des dérivés de l’oxygène non radicalaires comme le peroxyde d’hydrogène H2O2, l’oxygène singulet 1
O2 et le nitroperoxyde (ONOOH) (Figure2), mais qui sont aussi réactives et peuvent être des précurseurs des radicaux libres (Favier, 2003).
.
Page | 12
Figure 2: Origine des différents radicaux libres oxygénés et espèces réactives de l’oxygène impliqué en biologie (Favier, 2003).
3. Les sources des dérivés réactifs de l’oxygène
Nos cellules sont continuellement agressées par des radicaux libres, essentiellement des espèces réactives de l’oxygène, dont la formation est liée aussi bien à des facteurs exogènes qu’endogènes (Castronovo, 2003).
3.1. Les sources exogènes
Les sources exogènes peuvent être représentées par des facteurs environnementaux, pollutions diverses, produits chimiques ainsi que des contaminations par des métaux lourds ou certaines carences nutritionnelles (Castronovo, 2003).
3.2. Sources endogènes
Dans l’organisme il y a de nombreuses sources de ROS dont l’importance varie selon les tissus et les organites, que ce soit au niveau des mitochondries, des membranes, du réticulum endoplasmique, ou tout simplement dans le cytosol. D’une manière générale, toute réaction biochimique faisant intervenir de l’oxygène moléculaire est susceptible d’être à l’origine d’une production des radicaux libres oxygénés (Thannickal and Fanburg, 2000).
.
Page | 13 3.2.1. Les ions métalliques
A des concentrations élevées, le fer et le cuivre sont des ions métalliques considérés comme des remarquables promoteurs des processus radicalaires (Fontaine et al., 2002), ils ont la capacité de transformés le H2O2 en radical hydroxyle encore plus toxique, selon la réaction de fenton (Gardès-Albert et al., 2003) :
H2O2 + Fe2+ OH• + OH- + Fe3+
3.2.2. Peroxysome
Le peroxysome est une source importante dans la production cellulaire de H2O2 car cet organite contient de nombreuses enzymes générant l’H2O2, toutefois ce dernier est utilisé comme substrat par la catalase peroxysomale afin de réaliser des réactions de peroxydation. Ces réactions sont importantes dans le processus de détoxification présent dans le foie et les reins. Il semble cependant que seule une faible quantité du H2O2 produit au niveau du peroxysome, pourrait échapper à la catalase (Servais, 2004).
3.2.3 Le réticulum endoplasmique
Le réticulum endoplasmique lisse contient des enzymes qui catalysent des réactions pour détoxifier les drogues liposolubles et d’autres produits métaboliques toxiques. La plus connue de ces enzymes est le cytochrome P450 qui oxyde les acides gras insaturés et les xénobiotiques et produit ainsi des ROS (Servais, 2004).
3.2.4. Xanthine oxydase
La xanthine oxydase est une enzyme soluble qui génère des ROS en réduisant l’hypoxanthine en xanthine et la xanthine en acide urique. Cette enzyme est présente dans le sang, les cellules endothéliales des capillaire et de façon très importante dans le foie et les intestins (Mc Nally et al., 2003). La localisation cellulaire de la xanthine oxydase est faible en condition basale, mais jouerait un rôle important lors de l’ischémie-reperfusion (Mc Cord, 1985).
3.2.5. La lipoxygénase et acide arachidonique
L’acide arachidonique, provenant de l’hydrolyse des phospholipides par la phospholipase A2, est le substrat de la lipoxygénase pour la synthèse des leucotriènes. Cette
synthèse met en jeux une série d’oxydation qui implique la production des ROS (Marnett, 1999).
.
Page | 14 3.2.6. NADPH oxydase
C’est une oxydase liée à la membrane plasmatique. Elle a été initialement décrite dans les cellules phagocytaires où elle joue un rôle fondamentale dans la réponse immunitaire, notamment dans les poumons, ainsi que dans la lutte contre les micro-organismes. Il semble qu’il existe d’autres NADPH oxydases dans les cellules non phagocytaires dont le rôle serait
de réguler la croissance cellulaire (Piotrowskiand Marczak, 2000).
3.2.7. Les oxyde nitrique synthases
Beaucoup de cellules sont capables de produire du monoxyde d’azote (NO•) à partir de l’arginine et de l’oxygène, dans une réaction catalysé par l’oxyde nitrique synthase (NOS), selon la réaction ci-dessous. En effet, des études réalisées à l’aide des enzymes purifiées ont montré que la NOS est capable de générer des anions superoxydes dans des situations de déficit de son substrat, L-arginine, ou de ces cofacteurs d’activation (Xia et al., 1998).
Oxyde nitrique synthase
L.Arginine + O2 + NADPH L.Citruline + NO + NADP
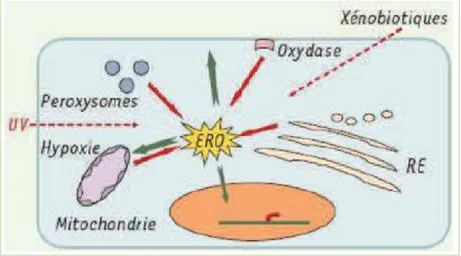
3.2.8. La mitochondrie
La mitochondrie est un organite intracellulaire qui est responsable de la majorité de la production de l’énergie. Elle est considérée comme une des principales sources des ROS dans la cellule (Figure 3), par le fonctionnement de la chaîne respiratoire mitochondriale où 1 à 2%
de l’oxygène consommé est convertie en O2.
, essentiellement à travers la fuite des électrons au cours de leurs transfert au niveau de cette chaîne (Chance et al., 1979).
.
Page | 15 4. Dommages oxydatifs
4.1. L’oxydation des lipides
Les acides gras polyinsaturés sont les cibles privilégiées des espèces oxygénées activées (EOA) en raison de leurs hydrogènes bis-allylique facilement oxydable.
Il s’agit d’un enchaînement de réactions radicalaires organisées en trois phases successives: initiation, propagation et terminaison (Figure 4) (Halliwell and gutteridge, 1999).
La phase d’initiation consiste en une déshydrogénation d’un acide gras (LH) en un radical d’acide gras (L•), provoquée par un initiateur radicalaire tel que le •OH et le HOO•.
Le radical lipidique L• subit ensuite un réarrangement moléculaire pour donner un radical plus stable, qui peut réagir avec une molécule d’O2 et former un radical peroxyle (LOO•) (Esterbauer et al., 1992), ce radical est suffisamment réactif pour arracher à nouveau, un hydrogène d’un acide gras polyinsaturé voisin, propageant ainsi la réaction. Il est généralement admis que chaque radical R• peut être à l’origine d’une centaine de molécules d’hydroperoxyde avant que la phase de terminaison survienne. L’hydroperoxyde lipidique
(ROOH) formé peut être oxydé en présence de métaux de transition divalents de Fe2+ ou Cu2+
et entraîne la formation d’alcalanes et d’aldéhydes toxiques dont le malonyldialdéhyde (MDA) ou le 4-hydroxynonenal (4-HNE) ; ces derniers ont été étudiés comme marqueurs de la peroxydation lipidique (Marnett, 1999) et peuvent réagir avec les protéines et l’ADN. Cette réaction est à l’origine de la formation d’hydroperoxydes lipidiques, Ceux-ci s’accumulant dans la membrane, entraînent la diminution de sa fluidité et de sa perméabilité, sa fonction étant complètement perturbée, la membrane se désorganise. Si les dégâts sont trop importants, les peroxydes peuvent conduire à la mort de la cellule. Les peroxydes lipidiques peuvent aussi réagir avec d’autres composés cellulaires et être à l’origine de molécules très toxiques, par exemple, ils peuvent réagir avec l’ADN et être à l’origine de substances mutagènes.
.
Page | 16 Figure 4: Etapes de la peroxydation lipidique (Michel et al., 2008).
4.2. L’oxydation des protéines
En présence d’EOA, les protéines peuvent se dénaturer, se fragmenter ou perdre leurs structures primaires et secondaires (Figure 5).
Les modifications oxydatives des protéines par les ERO provoquent l’introduction d’un groupement carbonyl dans la protéine (Levine, 2002). Elles sont fréquemment influencées par
les cations métalliques comme le Fe2+ ou le Cu2+. Comme elles peuvent être classées en deux
catégories: d’une part, celles qui cassent les liaisons peptidiques et modifient la chaîne peptidique , et d’autre part, les modifications des peptides par addition des produits issus de la peroxydation lipidique comme le 4-HNE. De telles modifications conduisent généralement à une perte de la fonction catalytique ou structurale des protéines affectées (Levine, 2002) et deviennent généralement plus sensibles à l’action des protéases et sont donc éliminées. L’oxydation de la cystéine est réversible mais peut également perturber les fonctions biologiques du GSH ou de certaines protéines, ce qui conduit à un dysfonctionnement qui peut bouleverser le fonctionnement cellulaire (enzymes, protéines structurales) (Delattre et al., 2005).
.
Page | 17 Figure 5: Nature de quelques modifications des chaînes latérales d’acides aminés des
protéines après attaque radicalaire (Favier, 2003).
4.3. L’oxydation de l’ADN
L’ADN nucléaire et mitochondrial constituent une cible cellulaire importante. Cinq classes principales des dommages oxydatifs de l’ADN médiés par l’OH• peuvent être générées. Parmi elles, les bases oxydées, les sites abasiques, des adduits intra-caténaires, des cassures de brins et des pontages ADN-protéines (Cadet et al., 2002).
Les bases qui composent l'ADN, et particulièrement la guanine, sont sensibles à l'oxydation. L'attaque radicalaire peut être directe et entraîne l'oxydation des bases, engendrant un grand nombre de bases modifiées. Mais le stress oxydant peut aussi attaquer la liaison entre la base et le désoxyribose, créant un site abasique (Figure 6), ou attaquer le sucre lui-même, créant une coupure de chaîne simple brin (Cadet et al., 2002).
Des dommages indirects peuvent résulter de l'attaque des lipides dont la peroxydation génère des aldéhydes mutagènes, formant des adduits sur les bases de l'ADN de type MDA-guanine ou éthénodérivés (Cadet et al., 2002).
.
Page | 18 Figure 6 : Lésions de l’ADN formées par attaque radicalaire du patrimoine génétique des
cellules (Favier, 2003).
5. Systèmes de défenses antioxydants
Les antioxydants sont définis par (Halliwell, 1999) comme « toute substance qui, en faible concentration par rapport au substrat susceptible d’être oxydé, prévient ou ralentit l’oxydation de ce substrat ». Ils peuvent être classés selon leur mode d’action, leur localisation cellulaire et leur origine. La nature des systèmes antioxydants diffère selon les tissus et les types cellulaires et selon qu’on se trouve dans le milieu intracellulaire ou extracellulaire (Bonnefont-Rousselot et al., 2003). Il existe différents types de molécules qu’elles soient naturelles ou synthétiques et dont le mode d’action repose sur un système enzymatique (premières lignes de défense) ou non (molécules piégeuses d’électrons) (Tableau 2).
5.1. Les systèmes antioxydants enzymatiques
Pour contrôler la production permanente des ROS, les organismes vivants possèdent des systèmes de défense enzymatique qui les protègent contre les dommages des ROS. Ces défenses permettent de maintenir la concentration en espèces radicalaires à un taux basal (homéostasie physiologique). En effet, elles possèdent une grande affinité pour les ROS, avec lesquelles elles réagissent très rapidement pour les neutraliser.
.
Page | 19 5.1.1. Les superoxyde dismutases (SOD)
Les superoxyde dismutases (EC 1.15.1.1) sont des métalloenzymes qui catalysent la dismutation des anions superoxydes en peroxyde d’hydrogène et en oxygène moléculaire (Figure 7) selon la réaction suivante :
Il existe plusieurs isoformes de SOD chez les mammifères, qui diffèrent selon leur localisation et selon les métaux de transition présents dans leur structure et nécessaires à leur activité catalytique : la forme mitochondriale nécessitant le manganèse comme cofacteur (Mn-SOD), ainsi que la forme cytosolique (CuZn-SOD) et extracellulaire (EC-SOD) nécessitant le cuivre et le zinc comme cofacteurs. C’est toutefois le cuivre qui participe à la réaction d’oxydoréduction pour la CuZn-SOD et EC-SOD. Chez l’humain, la EC-SOD est davantage exprimée dans le coeur, le placenta, le pancréas les poumons, les reins, les muscles squelettiques et le foie (Folz and Crapo, 1994). Les deux autres SOD seraient exprimées dans la plupart des tissus (Li et al., 1995).
5.1.2. La catalase (CAT)
La catalase (EC 1.11.1.6) est une protéine héminique dépendante du Fe, qui catalyse la transformation du peroxyde d’hydrogène en eau et en oxygène moléculaire selon la réaction suivante :
La catalase prévient l’accumulation de H2O2 pour former le OH. . Cette enzyme est surtout
présente dans les peroxysomes, là où le H2O2 est formé en grande quantité lors de l’oxydation
.
Page | 20 5.1.3. Glutathion peroxydase (GSH-Px)
La glutathion peroxydase est une enzyme antioxydante du plasma, des fluides extracellulaires et du cytosol, dépendante du sélénium (Sayre et al., 2008). Elle catalyse la réaction de transformation des peroxydes d’hydrogène H2O2 et lipidiques ROOH respectivement en eau et en alcool ROH. Cette réaction met en jeu une molécule antioxydante non enzymatique, le glutathion, sous sa forme réduite GSH (Figure 7) (Rush and Sandiford, 2003).
Figure 7: Systèmes antioxydants enzymatiques : Superoxyde dismutase et Glutathion peroxydase (Medart, 2009)
GSH-Px GSH-Px
.
Page | 21 5.2. Les antioxydants non enzymatiques
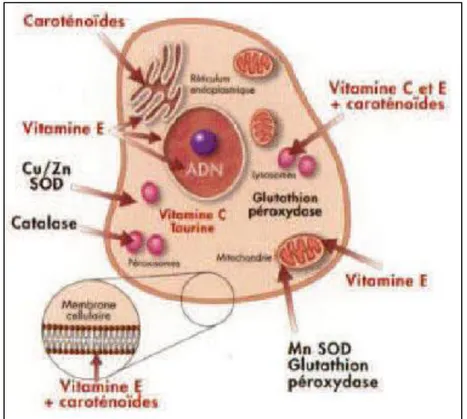
Certaines substances ont la propriété de piéger et de détruire les espèces oxygénées réactives. Il s’agit de composés facilement oxydables présents dans le cytoplasme (glutathion, acide ascorbique) ou dans les membranes cellulaires (α-tocophérol, caroténoïdes et l’ubiquinol) (Figure 8).
5.2.1. Le glutathion GSH
Le gluthation est formé par la condensation de trois acides aminés (acide glutamique, cystéine et glycine). Il est le thiol (-SH) majoritaire dans la cellule où il est présent sous forme réduite (GSH). En condition physiologique normale, sa forme oxydée (GSSG) est présente en très faible concentration. Le rapport GSH/GSSG est un excellent marqueur de la peroxydation lipidique. Le glutathion possède d’autres propriétés antioxydantes comme: cofacteur de la GSH-Px, chélateur de métaux de transition, régénérateur final des vitamines E et C (Haleng et al., 2007).
5.2.2. Métaux de transition
Certains métaux de transition servent de cofacteurs d’enzymes antioxydantes, et sont à ce titre regroupés au sein des antioxydants : Zinc, Manganèse, Cuivre pour la SOD, Sélénium pour la GSH-Px et la thioredoxine réductase (Grandjean, 2001).
5.2.3. Les caroténoïdes
Ils sont très nombreux et représentent la principale source alimentaire de rétinol. En plus de leur activité de provitamine A, les caroténoïdes sont capables d’inactiver l’oxygène singulet et les radicaux libres. D’après Burton and Ingold (1984), l’effet antioxydant du β-carotène serait dû à une interaction entre le radical et le système de doubles liaisons conjuguées de la chaîne insaturée du piégeur. Le β-carotène est particulièrement réactif vis-à-vis des lipoperoxydes : le radical peroxyde se fixerait sur un carbone de la chaîne polyinsaturée et serait stabilisé par résonance. L’effet antioxydant des caroténoïdes serait dépendant de la pression d’oxygène. Différents systèmes in vitro ont confirmé le rôle protecteur de ces molécules. Cependant, les études effectuées in vivo sont peu nombreuses et le rôle antiradicalaire des caroténoïdes reste à préciser.
.
Page | 22 5.2.4. Le Coenzyme Q10 ou ubiquinone
C’est un dérivé benzoquinolique à longue chaîne latérale isoprénique. Sa chaîne latérale lui confère un caractère lipophile. Il joue un rôle essentiel dans la chaîne mitochondriale de transport d’électrons et il est un puissant inhibiteur de la peroxydation lipidique (Haleng et al., 2007).
Figure 8 : Sites d’action des systèmes antioxydants enzymatiques et non enzymatiques (Pastre, 2005)