© Soureyatou Hamidou, 2018
Capture passive du phosphore d'une eau usée
municipale en contexte de biofiltration : impact des
nitrates sur la performance
Mémoire
Soureyatou Hamidou
Maîtrise en génie des eaux - avec mémoire
Maître ès sciences (M. Sc.)
ii
Capture passive du phosphore d'une eau usée
municipale en contexte de biofiltration : impact des
nitrates sur la performance
Mémoire
Soureyatou Hamidou
Sous la direction de :
Paul Lessard, directeur de recherche
Gerardo Buelna, codirecteur de recherche
iii
Résumé
En quantité excessive, le phosphore est responsable de l’eutrophisation des plans d’eau. De ce fait, les normes de rejet du phosphore des eaux usées municipales font l’objet d’un resserrement. Des travaux ont porté sur la mise au point d’un procédé de capture passive de phosphore caractérisé par des biofiltres dotés de média actif à base de bois imprégné par l’hydroxyde de fer. L’abattement de phosphore se fait par le mécanisme de sorption qui regroupe l’adsorption, la dissolution réductive et les échanges d’ions. Le présent mémoire s’inscrit dans la continuité des travaux sus-cités. L’objectif est d’évaluer l’influence des nitrates sur la performance d’enlèvement du phosphore.
Des essais en colonne ont été réalisés à partir d’une broyure activée opérée en anaérobie et par immersion sur une période de 150 jours. Les colonnes ont été alimentées durant 30 jours par une solution synthétique dopée à 5 mg P/L. Différentes concentrations de nitrates (5, 10 et 25 mg N-NO3/L) ont ensuite été appliquées sur trois colonnes (C2, C3 et C4), la colonne C1 servant de témoin.
Les résultats ont démontré que l’addition des nitrates réduit les performances d’enlèvement du phosphore des biofiltres. Le suivi du phosphore montre que la concentration en P à la sortie des biofiltres dépasse l’objectif de 0.3 mg P/L, 30 jours après l’injection des nitrates pour la colonne C2 et 15 jours après pour les colonnes C3 et C4.
L’ajout des nitrates augmente le potentiel d’oxydoréduction. Il en résulte une inhibition de la dissolution réductive, caractérisée par une baisse de production des ions ferreux. Une dénitrification simultanée se produit au sein des colonnes. Elle est à la fois biologique et chimique à travers l’oxydation des ions ferreux par NO2, produit lors de la dénitrification biologique. Par ailleurs, des tests d’identification bactérienne ont mis en évidence la présence des bactéries reliées au fer, dénitrifiantes, sulfo-oxydantes, réductrices de sulfate, productrices de biofilm ainsi qu’une variété de microorganismes hétérotrophes tels que les Pseudomonas et les bactéries entériques dans les biofiltres.
iv
Abstract
In excessive quantities, phosphorus is responsible for eutrophication of water surfaces. Thereby, phosphorus discharge standards for municipal wastewater are subject to a tightening. Researches have focused on the development of a passive phosphorus entrapment process characterized by biofilters with active wood-based media impregnated with iron hydroxide. Phosphorus removal is done by sorption which includes adsorption, reductive dissolution and exchange of ions. This MSc thesis is a continuation of the above-mentioned studies. The objective is to evaluate the influence of nitrates on the phosphorus removal performance.
Columns tests were performed with anaerobic activated wood-based media and immersion over a period of 150 days. Columns were fed for 30 days with a synthetic solution of 5 mg P/L. Different concentrations of nitrate (5, 10 and 25 mg N-NO3/L) were then applied on three columns (C2, C3 and C4), column C1 serving as a control.
The results demonstrate that the addition of nitrate reduces the phosphorus removal performance of biofilters. Phosphorus tracking shows that the concentration of P at the outlet of the biofilters exceeds the target of 0.3 mg P/L, 30 days after nitrate injection started for column C2 and 15 days later for columns C3 and C4.
Addition of nitrate increases the oxidoreduction potential. This results in an inhibition of the reductive dissolution, characterized by a decrease in the release of ferrous ions. Simultaneous denitrification occurs within the columns. It is both biological and chemical through the oxidation of ferrous ions by NO2, produced during biological denitrification. Furthermore, bacterial identification tests have highlighted the presence of iron-related bacteria, denitrifying bacteria, sulfur oxidizing bacteria, sulfate reducing bacteria, biofilm-producing bacteria and a variety of heterotrophic microorganisms such as Pseudomonas and enteric bacteria in biofilters.
v
Table des matières
Résumé ...iii
Abstract ... iv
Liste des figures ...x
Liste des abréviations ... xv
Liste des unités de mesure ... xvii
Quelques définitions ... xviii
Dédicaces ... xxi
Remerciements ... xxii
Chapitre 1 : Introduction ... 1
1.1 Généralités sur le phosphore ... 1
1.2 Eutrophisation ... 1
1.3 Position ministérielle sur la réduction du phosphore ... 2
1.4 Structure du document ... 5
Chapitre 2 : Revue de littérature ... 6
2.1 Sources du phosphore... 6
2.2 Cycle du phosphore ... 6
2.3 Différentes formes de phosphore ... 7
2.3.1 Orthophosphates ... 7
2.3.2 Polyphosphates ... 8
2.3.3 Phosphates organiques ... 8
2.4 Systèmes de déphosphatation conventionnels ... 9
2.4.1 Déphosphatation biologique ... 9
2.4.2 Déphosphatation physico-chimique ... 10
2.4.3 Limitations d’utilisation de procédés conventionnels ... 12
2.5 Capture passive du phosphore ... 13
2.5.1 Sorption ... 13
2.5.2 Matériaux utilisés pour la sorption du phosphore ... 14
2.5.3 Description des mécanismes de sorption du phosphore ... 15
2.5.3.1 Adsorption/échange ionique ... 15
pH ... 15
Granulométrie ... 17
Concentration en phosphore ... 17
vi
Concentration du réactif chimique ... 18
2.5.3.2 Dissolution réductive ... 20
2.5.3.2.1 Facteurs influençant la dissolution réductive ... 21
2.5.3.3 Réactions d’adsorption/précipitation avec le chlorure ferrique ... 24
2.6 Rappel des travaux antérieurs au CRIQ ... 25
2.7 L’azote ... 29
2.7.1 Nitrification ... 29
2.7.2 Dénitrification ... 30
2.7.2.1 Dénitrification biologique ... 30
2.7.2.2 Dénitrification biologique et chimique couplée à l’oxydation de Fe2+ ... 31
Chapitre 3 : Hypothèses et objectifs ... 38
3.1- Hypothèses de travail ... 38
3.2- Objectifs de l’étude ... 38
3.2.1- Objectif général ... 38
3.2.2- Objectifs spécifiques ... 38
Chapitre 4 : Matériel et méthodes ... 39
4.1- Description du montage expérimental ... 39
4.2- Activation de la broyure ... 44
4.2-1. Type de broyure ... 44
4.2-2. Granulométrie... 44
4.2-3. Activation de la broyure ... 45
4.3- Caractérisation du média activé ... 46
4.3.1 Isothermes d’adsorption ... 46
4.3.2 Masse volumique ... 48
4.3.3 Masse de fer par gramme de média activé ... 48
4.3.4 Temps de résidence hydraulique (TRH) du média activé neuf ... 48
4.4- Caractérisation de fin de vie ... 48
4.4.1 Caractérisation des boues ... 49
4.4.2 Analyse du garnissage usagé ... 50
4.5- Bilan de masse ... 51
4.6- Échantillonnage et suivi analytique ... 54
4.6.1 Échantillonnage ... 54
4.6.2 Suivi analytique ... 56
4.7- Identification bactérienne ... 57
vii
4.7.2 Bactéries dénitrifiantes ... 58
4.7.3 Bactéries sulfo-oxydantes : Thiobacillus ... 61
4.7.4 Autres bactéries : utilisation des KIT BART ... 63
4.7.5 Compte hétérotrophe ... 64
Chapitre 5 : Résultats et discussion ... 65
5.1 Granulométrie ... 65
5.2 Activation de la broyure ... 66
5.3 Caractérisation du média activé ... 68
5.3.1 Isothermes d’adsorption ... 68
5.3.2 Masse volumique de la broyure activée ... 69
5.3.3 Masse de fer par gramme de broyure activée ... 69
5.3.4 Teneur en eau (TEE) de la broyure activée neuve ... 70
5.4 Résultats de suivi des paramètres physico-chimiques ... 70
5.4.1 Suivi du phosphore et des nitrates ... 70
5.4.2 Bilan du phosphore ... 74
5.4.3 Suivi du fer et du POR ... 76
5.4.4 Bilan du fer ... 81
5.4.5 Capacité de sorption du phosphore ... 82
5.5 Discussion et mécanismes en jeu dans la baisse de performance des colonnes alimentées en nitrates ... 84
5.5.1 Augmentation du POR ... 84
5.5.2 Compétition entre les bactéries dénitrifiantes et réductrices de Fe3+ sur la matière carbonée 84 5.5.3 Oxydation du fer ferreux (Fe2+) par les nitrates ... 85
5.6 Autres paramètres suivis ... 87
5.6.1 Suivi de l’oxygène dissous (OD) ... 87
5.6.2 Suivi du pH... 88
5.6.3 Alcalinité ... 89
5.6.4 MES et MVES ... 90
5.7 Caractérisation de fin de vie ... 90
5.7.1 Texture des boues des tuyaux ... 91
5.7.2 Concentration du fer et du phosphore dans les boues ... 92
5.7.3 Analyse du garnissage usagé ... 93
5.7.3.1 TRH de la broyure usée ... 93
5.7.3.2 Détermination du fer des colonnes ... 93
viii
5.7.3.4 TEE et masse volumique de la broyure usée ... 97
5.7.3.5 Texture et couleur de la broyure au démantèlement ... 97
5.8 Résultats de l’identification bactérienne ... 100
5.8.1 Bactéries dénitrifiantes ... 100
5.8.2 Bactérie sulfo-oxydante : Thiobacillus ... 102
5.8.3 Autres bactéries : KIT BART ... 103
5.8.3.1 Mise en évidence des bactéries reliées au fer (IRB) ... 104
5.8.3.2 Mise en évidence des bactéries réductrices de sulfate (SRB) ... 106
5.8.3.3 Mise en évidence des bactéries productrices de biofilm (SFB) ... 107
5.8.3.4 Mise en évidence de APB (Bactéries productrices d’acide) ... 109
5.8.3.5 Formation de biofilm dans les tuyaux d’alimentation ... 110
5.8.3.6 Compte hétérotrophe ... 110
Chapitre 6 : Conclusion et limites ... 112
6.1 Conclusion ... 112
6.2 Limites de l’étude ... 114
Chapitre 7 : Recommandations ... 115
7.1 Optimisation de l’activation ... 115
7.2 Solutions pour une déphosphatation et une dénitrification efficaces par les biofiltres ... 116
7.3 Suivi des nitrites ... 118
7.4 Suivi des espèces Fe2+ et Fe3+ ... 118
7.5 Mesure de la teneur en phosphore et en fer dans l’effluent ... 118
7.6 Ajout d’un filtre percolateur ... 118
7.7 Régénération du média et récupération du phosphore ... 119
7.8 Valorisation du phosphore en agriculture ... 120
Bibliographie ... 122
Annexes ... 133
Annexe 1 – Méthodologie d’activation de la broyure ... 134
Annexe 2 : Isothermes d’adsorption ... 136
Annexe 3- Détermination de la masse volumique de la broyure... 141
Annexe 4- Détermination du TRH des colonnes... 142
Annexe 5- Méthode d’échantillonnage pour l’analyse des espèces Fe2+et Fe3+ ... 143
Annexe 6 : Broyage pour analyse de fer et du phosphore ... 148
Annexe 7 : Reproductibilité des essais antérieurs: colonne C6 ... 149
ix
Annexe 9- Effet d’ajout de carbone et comparaison des colonnes alimentées en eau déminéralisée et en eau de robinet ... 163 Annexe 10- Optimisation de l’activation de broyure : ... 178 Influence des paramètres type de broyure, volume de NaOH et granulométrie sur le pH
d’activation. ... 178 Annexe 11- Guides BART pour les tests d’identification bactérienne ... 188 Annexe 12- Données recueillies lors du suivi des différents essais ... 192
x
Liste des figures
Figure 1 : Algues bleu-vert sur un étang de l'Estrie (MDDELCC)
http://www.mddelcc.gouv.qc.ca/rapportsurleau/images/gr-12/g_GR12_P01_Estrie_2011_Petit-lac-St-Francois.jpg ... 2
Figure 2: Cycle du phosphore en milieu aquatique (Reddy, 1998) ... 7
Figure 3: Formes d’orthophosphates en fonction du pH (Kronos, 2003) ... 8
Figure 4: Mécanisme de déphosphatation biologique (ITP, 2000) ... 10
Figure 5: Différentes configurations de déphosphatation chimique (Nutt, 1991) ... 12
Figure 6: Adsorption entre un sesquioxyde et un ion phosphate (adapté de Karam, 2014) tiré de Roy-Dumesnil (2015) ... 15
Figure 7: Échange ionique ente un sesquioxyde et un ion phosphate (adapté de Karam, 2014) tiré de Roy-Dumesnil (2015) ... 15
Figure 8: Effet du pH sur l'enlèvement du phosphore par les scories BOF ... 16
Figure 9: Effet de la concentration initiale en phosphore sur l’adsorption du phosphore (adapté de Mortula et Gagnon, 2007) ... 18
Figure 10: Effet du dosage du Ca2+ sur la précipitation du phosphore (Yang et al., 2017) ... 19
Figure 11: Diagramme d’équilibre du fer (adapté de Sarrazin et Verdaguer, 1991) ... 20
Figure 12: Réduction de Fe3+ par Thiobacillus thiooxidans avec soufre comme source d’énergie (Brock et Gustafson, 1976) ... 22
Figure 13: Schéma des voies de réactions du phosphore et du fer en fonction du pH et du POR (Kim, 2014) ... 24
Figure 14 : Paramètres optimaux pour l’enlèvement du phosphore ... 26
Figure 15: Performances des colonnes de déphosphatation en fonction du mode d'aération (Roy-Dumesnil, 2015) ... 27
Figure 16: Cycle de l'azote (Tran, 2005) ... 29
Figure 17: Évolution de N-NO3-, OD, Fe2+, Fe2+ par Pseudomonas sp. SZF15 ... 33
Figure 18: Schéma de la dénitrification chimique (Kampschreur et al., 2011) ... 35
Figure 19: Réduction de Fe(III) et formation de NO2- par une Pseudomonas Sp N° 200 en présence de NO3- (tiré et adapté de Obuekwe et al., 1981) ... 36
Figure 20: Colonnes d'essai ... 42
Figure 21: Schéma du montage expérimental ... 43
Figure 22 : Tamis vibratoire ... 44
Figure 23 : Grande roue d'activation ... 45
Figure 24: Solutions retirées de la chambre d'agitation et prêtes pour la filtration ... 47
Figure 25: Curage des boues des tuyaux en sortie ... 49
Figure 26: Boues dans l’effluent décantées au fond ... 50
Figure 27: Séparation solide-liquide de biomasse pour C1 ... 58
Figure 28: Tubes d'essais pour les bactéries dénitrifiantes ... 61
Figure 29: Dispositif de mise en évidence de Thiobacillus ... 63
Figure 30: Classe de granulométrie de la broyure non activée ... 65
Figure 31 : Broyure avant activation ... 66
Figure 32: Allure de la broyure activée ... 67
Figure 33: Isotherme de Langmuir de la broyure activée ... 69
Figure 34: Suivi du phosphore en sortie de la colonne témoin C1 ... 70
Figure 35: Suivi du phosphore (P) à la sortie des colonnes ... 71
xi
Figure 37: Bilan du phosphore à la fin des jours d'opération ... 75
Figure 38: Évolution du potentiel d'oxydoréduction à l’intérieur des colonnes ... 77
Figure 39: Suivi du fer en sortie des colonnes ... 79
Figure 40: Bilan du fer des colonnes ... 81
Figure 41: Compétition entre Fe3+ et les nitrates (Zhang et al., 2014b) ... 85
Figure 42: Suivi du pH en sortie des colonnes ... 89
Figure 43: Boue dans la tuyauterie de C1 Figure 44: Boue dans la tuyauterie de C2 ... 91
Figure 45: Boue dans la tuyauterie de C3 Figure 46: Boue dans la tuyauterie de C4 ... 91
Figure 47: Texture de la broyure C1 (Témoin) au démantèlement ... 98
Figure 48: Texture de la broyure de C2 (5 mg N-NO3/L) au démantèlement... 98
Figure 49: Texture de la broyure C3 (10 mg N-NO3/L) au démantèlement ... 98
Figure 50 : Photos des particules minérales a) Boue de sortie b) Au niveau du milieu filtrant (Desrochers, 2013) ... 99
Figure 51: Suivi de l'activité de dénitrification : (a) colonne témoin C1 (b) colonne C3 ... 101
Figure 52: Suivi de la baisse du pH pour la mise en évidence des bactéries sulfo-oxydantes ... 102
Figure 53: Différents changements décelés dans le tube BART des bactéries reliées au fer ... 105
Figure 54: Évidence des bactéries réductrices de sulfate dans la colonne C1 ... 106
Figure 55: Dégagement d'un gaz au fond de la colonne C1 ... 107
Figure 56 : Évidence des bactéries productrices de biofilm dans la colonne C1 ... 108
Figure 57: Observation au jour 1 sur C1 Figure 58: Coloration jaune au 3e jour sur C1... 109
Figure 59: Schéma simplifié des différents variables (POR, P, Fe) en lien avec les nitrates ... 113
Figure 60: Configuration triangulaire pour l'activation de broyure (CRIQ) ... 116
Figure 61: Configuration pour le suivi du phosphore à différents niveaux et ajout du carbone ... 117
Figure 62: Ajout d'un filtre percolateur pour le contrôle des relargages de fer ... 119
Figure 63 : Concentration totale moyenne en P dans le Ray-grass cultivé sous 5 différents traitements (Cucarella et al., 2008) ... 121
Figure 64 : Erlenmeyers fermés à l’aluminium et placés dans la chambre d’agitation ... 138
Figure 65 : Dispositif expérimental pour l’échantillonnage et l’analyse des ions Fe2+ et Fe3+ ... 144
Figure 66: Schéma du montage de l'essai C6 ... 150
Figure 67: Colonne C6 ... 150
Figure 68: Comparaison du phosphoreen sortie ... 151
Figure 69: Comparaison du fer en sortie ... 152
Figure 70: Comparaison de pH ... 152
Figure 71: Comparaison de l'évolution du POR ... 153
Figure 72: Agitateur électrique pour l’ajustement du pH ... 156
Figure 73: Broyure avant séchage (à gauche) et après séchage à 105°C (à droite) ... 157
Figure 74: Suivi du phosphore en sortie de la colonne C5 ... 158
Figure 75: Suivi du phosphore de la broyure rincée et non rincée (Roy-Dumesnil, 2015) ... 159
Figure 76: Suivi du POR de la colonne C5 ... 160
Figure 77: Suivi du fer en sortie de la colonne C5 ... 160
Figure 78: Suivi du pH en sortie de C5 ... 161
Figure 79: Décrochement du fer de la broyure activée ... 161
Figure 80 : Différence de granulométrie entre deux types de broyure : ... 164
Figure 81 : Comparaison de profil granulométrique des différents broyures ... 165
Figure 82: Isotherme de Langmuir du mélange de bran de scie et de broyure... 166
Figure 83: Suivi du phosphore en sortie des colonnes ... 167
Figure 84: Suivi du POR à l’intérieur des colonnes alimentées en eau déminéralisée ... 168
xii
Figure 86: Suivi du pH en sortie des colonnes alimentées en eau déminéralisée ... 170
Figure 87: Diagramme d'équilibre du fer (Sarazin et Verdaguer, 1991) ... 171
Figure 88: Suivi du phosphore après alimentation en eau de robinet au 123e jour et ajout de carbone au 111e jour ... 173
Figure 89: Suivi du POR après alimentation de C2 et C3 en eau de robinet ... 174
Figure 90: Suivi de l’oxygène dissous après alimentation de C2 et C3 en eau de robinet ... 175
Figure 91: Suivi du fer après alimentation de C2 et C3 en eau de robinet ... 175
Figure 92: Suivi du pH en sortie des colonnes ... 176
Figure 93: Broyure usée de C4 alimentée en eau déminéralisée ... 177
Figure 94: Broyure C2 alimentée en eau déminéralisée et en eau de robinet ... 177
Figure 95 : Graphiques des résidus ... 182
Figure 96: Graphique de probabilité normale des résidus ... 183
Figure 97: Graphique de prédictions de pH par rapport aux observations expérimentales ... 183
xiii
Liste des tableaux
Tableau 1: Exigences en phosphore total pour les rejets d’eaux usées d’origine domestique
(MDDELCC, 2017) ... 4
Tableau 2: Quelques espèces capables de réduire le fer (adapté de Nelson et Saffarini, 1994) ... 23
Tableau 3 : Caractéristiques techniques du montage de l’essai ... 40
Tableau 4 : Suivi analytique ... 56
Tableau 5: Caractéristiques des essais de dénitrification ... 59
Tableau 6: Caractéristiques des erlenmeyers pour le soufre ... 62
Tableau 7: pH de la broyure après activation ... 67
Tableau 8: Masse volumique de la broyure activée ... 69
Tableau 9: Bilan du phosphore au dépassement de la norme ... 75
Tableau 10: Pourcentage d'enlèvement du phosphore ... 76
Tableau 11: Capacité d'adsorption et CSP des colonnes ... 82
Tableau 12 : Classification des matériaux en fonction de leurs CSP et leur granulométrie (tiré de Thibault, 2013, adapté de Cucarella et Renman, 2008) ... 83
Tableau 13 : Oxygène dissous en entrée des colonnes ... 87
Tableau 14: Oxygène dissous à l'intérieur des colonnes ... 88
Tableau 15: Suivi du pH en entrée et sortie des colonnes ... 88
Tableau 16: Alcalinité mesurée au 141e jour... 90
Tableau 17 : Fer et phosphore des boues ... 92
Tableau 18: TRH de la broyure usagée de C2 ... 93
Tableau 19: Teneurs en fer dans les colonnes ... 94
Tableau 20: pH en haut et en bas des colonnes ... 95
Tableau 21: Phosphore capté par les colonnes ... 96
Tableau 22: Masse volumique de la broyure usée ... 97
Tableau 23 : Observations du tube BART des bactéries reliées au fer ... 105
Tableau 24: Observations sur le tube BART des bactéries réductrices de sulfate ... 106
Tableau 25: Observations pour les bactéries productrices de biofilm ... 108
Tableau 26: Tableau de dilutions des solutions filles à effectuer ... 140
Tableau 27: Fe2+ et Fe3+ déterminés par la méthode « pratique » ... 146
Tableau 28: Fe2+ et Fe3+ déterminés par la méthode « théorique » ... 147
Tableau 29: Caractéristiques de la colonne C6 ... 149
Tableau 30: pH de la broyure obtenus ... 154
Tableau 31: pH avant et après lavage de la broyure ... 155
Tableau 32: pH mesurés après l’immersion et l’agitation électrique de la broyure ... 156
Tableau 33: Caractéristiques techniques de la colonne C5 ... 158
Tableau 34: MOT et cendres inorganiques ... 161
Tableau 35: Caractéristiques des colonnes ... 163
Tableau 36: Suivi des paramètres ... 167
Tableau 37: Moyennes et valeurs maximales de fer en sortie des colonnes alimentées en eau déminéralisée ... 169
Tableau 38: Modifications apportées aux colonnes ... 172
Tableau 39: Niveaux de facteurs pour un plan factoriel complet 23 ... 178
Tableau 40: Combinaison de facteurs pour les dix expériences réalisées ... 179
xiv
Tableau 42: Paramètres estimés significatifs et leurs intervalles de confiance ... 181 Tableau 43: Résultats de l’ANOVA sur la significativité du modèle linéaire ... 185 Tableau 44: ANOVA lack of fit du modèle linéaire retenu ... 186
xv
Liste des abréviations
ADN Acide désoxyribonucléique AGV Acides Gras Volatiles
Al Aluminium
Al2(SO4)3 Sulfate d’aluminium
APB Acid Producing Bacteria (bactéries productrices d’acide) ARN Acide Ribonucléique
ATP Adénosine triphosphate
BART Biological Activity Reaction Test BOF Basic Oxygen Furnace
C Carbone
Ce Concentration à l’équilibre CaCO3 Carbonate de Calcium CO2 Dioxyde de Carbone
CRIQ Centre de Recherche Industrielle du Québec Cs Concentration à saturation
CSP Capacité de sorption du phosphore
DBO Demande Biologique en Oxygène (sur 5 jours) DCO Demande Chimique en Oxygène
ddl Degré de liberté EU Eaux usées
Fe Fer
Fe3+ Ion ferrique Fe2+ Ion ferreux FeCl3 Chlorure Ferrique FeSO4 Sulfate ferreux HCl Acide Chlorhydrique HDPE Polyéthylène Haute Densité HNO3 Acide nitrique
H2S Sulfure d’hydrogène H3PO4 Acide Phosphorique
ID Diamètre Intérieur (Inner Diameter) IRB Iron Related Bacteria
ITP Institut Technique du Porc
LAM Lignocellulose-based anion-absorbing medium MES Matières en Suspension
MDDELCC Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques
Mg Magnésium
Mn4+ Ion Manganèse (IV) MOT Matière Organique Totale
MVES Matières Volatiles en Suspension NaCl Chlorure de Sodium
NaOH Hydroxyde de Sodium N2O Oxyde nitrique
xvi NO Oxyde nitreux NO2- Nitrite NO3- Nitrate O2 Dioxygène OD Oxygène dissous
OD Diamètre extérieur (Outer Diameter)
P Phosphore
PAO Phosphate Accumulating Organisms PASS Poly-Aluminium-Silico-Sulfate PHA Poly-Hydroxy-Alcanoates POR Potentiel d’oxydoréduction
Psi Pound per square inch (équivaut à 6.895 kPa) PVC Polychlorure de vinyle
Ptotal Phosphore Total
Q Débit
R2 Coefficient de corrélation rpm Révolution par minute SFB Slime Forming Bacteria SRB Sulfate Reducing Bacteria S2O32- Thiosulfate
TEE Teneur en eau
TRH Temps de rétention Hydraulique UFC Unité Formant Colonies
xvii
Liste des unités de mesure
j Jour g Gramme kg Kilogramme L Litre µl Microlitre mL Millilitre M Molarité mg Milligramme mM Millimole mV Millivolt N Normalité T/an Tonne/an
xviii
Quelques définitions
Adsorption (cas du phosphate) : attachement des phosphates sur les surfaces chargées des matériaux filtrants (Zheng et Dunets, 2013).
Alcalinité : est la mesure du pouvoir tampon d’une eau; c’est-à-dire sa capacité à résister à un accroissement ou à un abaissement du pH. L’alcalinité mesure les concentrations d’ions de bicarbonates, de carbonate et d’hydroxyde. Elle est exprimée en tant que concentration équivalente de carbonate de calcium (CaCO3).
(https://novascotia.ca/nse/water/docs/droponwaterFAQ-Alcalinite-pH-Fr.pdf)
Bactérie hétérotrophe : Bactéries qui utilisent des substrats carbonés organiques comme source de carbone et d’énergie.
Bactérie autotrophe : Bactérie qui utilise une source de carbone minérale (CO2 et bicarbonate) et qui obtient son énergie par l’oxydation d’un substrat inorganique (soufre, thiosulfate, hydrogène).
Biofilm: Communauté microbienne constituée d’un ensemble de microorganismes liés les uns aux autres, capables de s’attacher à certaines surfaces ou interfaces et incorporés dans une matrice adhésive, protectrice composée de substances polymères extracellulaires (Donlan et Costerton, 2002).
Chimiodénitrification : La chimiodénitrification est une réduction chimique et spontanée de NO2- en NO par transfert d’électrons provenant de l’ion Fe2+ ou d’autres ions métalliques réduits (Tiedje, 1988; Brons et al., 1991; Van Cleemput et Baert, 1984).
Chimiolitotrophe : Organisme qui utilise au choix une molécule organique ou un composé minéral comme source d’énergie (chimiosynthèse) et des composés minéraux oxydants comme le nitrate NO3, le dioxygène O2 comme donneurs d’électrons.
https://www.aquaportail.com/definition-11558-chimiolithotrophe.html
xix
Potentiel d’oxydoréduction : Le potentiel d’oxydoréduction ou potentiel redox (POR) est une mesure de grandeur physique exprimée en millivolt qui qualifie le potentiel oxydant (preneur d’électrons) ou réducteur (donneur d’électron) d’une substance par rapport à une autre. Les POR élevés se rencontrent quand la teneur en oxygène est élevée alors que des valeurs basses sont plutôt rencontrées dans des situations d’anaérobie. La mesure est effectuée par une sonde qui mesure la différence de tension entre l’électrode de mesure et l’électrode de référence (Le Guennec, 2015).
xx
« Le savoir est un champ, mais s’il n’est ni labouré, ni surveillé, il ne sera pas récolté » Proverbe Peul
xxi
Dédicaces
Je dédie ce travail à mes chers parents (Hamidou MAMOUDOU et Djara YAOUBA), source d’inspiration et d’amour. Les mots ne sauraient être suffisants pour vous remercier. L’éducation que vous m’avez inculquée est un trésor inépuisable. Merci de toujours m’encourager dans la voie que je suis. Merci pour tous vos sacrifices. Je vous aime.
À ma famille en qui je trouve la force de mon inspiration au quotidien. À mon feu frère Faiçal : cela fait exactement sept ans que tu nous as quitté sans que je ne puisse te dire aurevoir. Sortie de notre terre natale pour une longue aventure afin d’accroitre mes connaissances, je n’ai pas pu te revoir. Malgré ton absence, j’ai l’impression que tu es toujours présent à mes côtés.
À mon directeur de recherche, Monsieur Paul Lessard pour m’avoir marqué profondément à travers ce projet.
À mes meilleurs amis(es) avec qui j’ai tant partagé: Alioum Bouba, Hawa Boukar, Djanabou Mal Haman, Mairamou Salman, Kassim, Moustapha Hamadou Yougouda, Ibrahim Hamidou, Hajar Bennadou, Badini Ibrahim Axel, Faiçal, Mouna Idriss Douksieh, Ange, Laurie, Zara, Mounira et Hanae Maali. Je suis reconnaissante de vous avoir dans ma vie. Merci de m’avoir choyée par votre amour, votre soutien et vos encouragements.
À mon parrain Marc-André Lemay. Merci pour tes conseils, ta présence et pour avoir facilité mon intégration à Québec.
À toi KADRY Mohammadou Aminou, qui m’est très cher. Tu m’as encouragée et accompagnée tout au long de ce projet. Trouve en ce travail, le témoignage de toute ma reconnaissance et l’amour que je te porte.
À ces trois familles : Mohammadou, Ousseini et Oussoumanou qui ont facilité mon intégration à Québec et m’ont encouragé tout au long de ce mémoire. Je vous dédie ce travail.
À tous ceux qui me sont chers, que ce travail soit le témoignage de ma profonde reconnaissance et jouissance de vous compter dans ma vie.
xxii
Remerciements
Ce mémoire est le fruit de deux années de recherche effectuées à l’université Laval au sein du département génie civil et génie des eaux et dans les laboratoires du centre de recherche industrielle du Québec.
Ma première pensée va à mon directeur de recherche, monsieur Paul Lessard. Sans vous, il n’y aurait pas eu de réalisation de ce travail tout simplement. Vous m’avez donné la chance de réaliser ce projet dans cette merveilleuse ville de Québec. Vous m’avez fait confiance bien que j’étais à des kilomètres loin du Canada et du Québec. C’est en hiver 2016 que j’ai été chaleureusement accueillie par vous à l’aéroport Jean Lesage de Québec. J’ai été grandement marqué par l’hospitalité dont votre famille a fait preuve à mon égard. Je vous remercie pour votre disponibilité, votre encadrement, vos conseils, votre soutien indéfectible et la confiance dont vous m’avez témoigné. Merci de m’avoir permis de développer mes connaissances et mener à bien ce projet. Veuillez trouver ici l’expression de toute ma gratitude. Au-delà de ce projet, vous m’avez également apporté de l’aide sur le plan personnel. Votre disponibilité et votre sens de l’écoute m’ont permis de travailler sereinement.
J’exprime toute ma gratitude à mon codirecteur, M. Gerardo Buelna pour votre encadrement, vos idées pertinentes et vos commentaires précieux qui m’ont beaucoup aidé durant la réalisation de ce travail. Merci pour ce savoir que vous m’avez transmis durant tous nos réunions d’avancement de travail et bien en dehors de celles-ci.
Merci à M. Caetano Chang Doréa, pour son encadrement, ses conseils, sa patience, sa disponibilité afin que je mène à bien ce projet. Vous avez ménagé beaucoup d’efforts pour m’accompagner tout au long de ce travail, je vous remercie.
Je remercie Monsieur Rino Dubé, superviseur de ce projet au sein du CRIQ pour votre soutien infaillible, votre disponibilité et la confiance que vous m’avez accordé. Je vous remercie de m’avoir supervisé. Auprès de vous, j’ai beaucoup appris et j’aimerai continuer à apprendre. Merci de m’avoir orienté et donné de bonnes directives lors de multiples discussions afin de mener à bien ce projet.
Je suis reconnaissante à l’université Laval et tous mes professeurs du programme de Maîtrise en génie des eaux.
xxiii
Mes vifs remerciements à l’organisme d’accueil, le CRIQ qui m’a fourni un cadre de travail adéquat afin de mener à bien mon travail. Je remercie toute l’équipe du CRIQ pour leur disponibilité, les outils et les efforts mis à ma disposition afin que je puisse travailler dans les meilleures conditions. Je remercie Mme Marie-Josée Hardy d’avoir accepté que je mène mes travaux au sein du département écoefficacité industrielle et environnement du CRIQ. J’aimerais souligner particulièrement Jean Nadeau qui a été formidable envers moi dans l’accompagnement et la réussite de ce travail. Je vous remercie de votre aide sur tout l’aspect technique dudit projet. Je remercie Alain Sauve, Odette Peticlerc, André Trembay, Eric Legaré pour leur importante participation à mon projet.
Je remercie M.Yann Le Bihan de m’avoir encadré sur tout l’aspect microbiologique de ce travail. Au-delà de ça, je vous remercie également pour votre disponibilité à répondre à mes questions. Je remercie aussi le chimiste M. Sylvain Savard. Je ne peux compter le nombre de fois où j’ai été vous voir à votre bureau, merci pour tous ces échanges fructueux. Je remercie les membres du jury, Monsieur Christian Bouchard, Mme Céline Vaneeckhaute et M. Gerardo Buelna, qui étaient présents et ont évalué mon séminaire de maîtrise. Je remercie également les membres du jury d’évaluation de ce mémoire pour leur disponibilité accordée pour l’évaluation de mon travail.
Merci à Gabriel Roy-Dumesnil, mon collègue prédécesseur ayant réalisé la maîtrise avant moi dans le cadre du même projet. Il a su répondre à mes questions lorsque j’ai eu recours à lui.
Je remercie l’organisme Mitacs (Accélération) et le CRIQ pour avoir permis la réalisation de ce travail sur le plan financier à travers la bourse d’étude qu’ils m’ont attribué et tout le matériel nécessaire mis à ma disposition. Je suis également reconnaissance à l’université Laval pour sa contribution financière à travers la bourse d’excellence.
Je remercie mes collègues du département de génie civil et génie des eaux dont Gabrielle Rydiard, Jessy Carpentier, Bernard Patry, Cathérine Bourgault, Samuel Charrette, Sovanna Tik, Caroline Brodeur-Doucet, Julia Ledergerber. Merci à Etienne Leroux pour son soutien.
Je ne saurai terminer sans remercier chaleureusement mes proches parents et amis pour leur soutien indéfectible, leur présence et leur encouragement. Merci à ma grande famille DANDY et MAMOUDOU. De même, merci à toute personne qui, de près ou de loin a contribué à la réalisation de ce travail.
1
Chapitre 1 : Introduction
1.1 Généralités sur le phosphore
Le phosphore (P) est un macronutriment qui est nécessaire à toutes les cellules vivantes. Il est essentiel au métabolisme énergétique de toutes les formes de vie. C'est un nutriment limitant en ce qui concerne la croissance des algues et des plantes dans les lacs. Le phosphore dans les eaux usées représente une ressource renouvelable considérable. Les ménages déversent de plus en plus de phosphore dans les eaux de surface entraînant des problèmes environnementaux indésirables tels que l'eutrophisation et la floraison des algues. À titre d’exemple, Senthhikumar et al. (2012) estiment à près de 85500 T/an de phosphore rejetés dans l’environnement à travers les eaux usées domestiques en France. La concentration moyenne du phosphore total (forme organique et inorganique) dans les eaux usées se situe entre 5-20 mg P/l (Bitton, 1994).
1.2 Eutrophisation
L’eutrophisation est un enrichissement en nutriments (composés azotés et phosphorés) utilisés par les végétaux pour leur croissance conduisant à une prolifération excessive de cyanobactéries (algues bleu-vert pouvant libérer des toxines) et à un déséquilibre de l’écosystème. Le phosphore est le facteur limitant sur lequel il est possible de jouer efficacement pour réduire l’eutrophisation (Deronzier et Choubert, 2004). Les conséquences de l’eutrophisation des eaux de surface sont multiples. Le développement excessif d’algues augmente la turbidité des eaux de surface, modifie leur couleur et peut être source d’odeurs nauséabondes. Une réduction de l’oxygène peut être observée dans des milieux peu aérés; ce qui nuit à la respiration des animaux aquatiques (Trépanier, 2000). Il s’opère alors un appauvrissement du nombre d’espèces de poissons. L’eutrophisation nuit alors à la qualité des eaux de surface ce qui limite leurs usages : production d’eau potable, loisirs (pêche, baignade, sport nautique, lâcher d’eau), activités industrielles (transport, production d’énergie électrique) (Deronzier et Choubert, 2004).
2
Au Québec, on assiste à un accroissement des algues bleu dans les plans d’eau dû à un enrichissement en phosphore. La figure 1 présente un cas d’algues bleu-vert développé sur un étang du sud-est de Québec (Estrie).
Figure 1 : Algues bleu-vert sur un étang de l'Estrie (MDDELCC)
http://www.mddelcc.gouv.qc.ca/rapportsurleau/images/gr-12/g_GR12_P01_Estrie_2011_Petit-lac-St-Francois.jpg
1.3 Position ministérielle sur la réduction du phosphore
Toutes les informations dans cette section sont tirées de la position ministérielle du Québec sur la réduction du phosphore dans les rejets d’eaux usées d’origine domestiques (MDDELCC, 2017). Comme mentionné ci-haut, les milieux riches en phosphore sont propices à la prolifération d’algues bleu-vert dans les plans d’eau. Devant l’accroissement de la présence des algues bleu-vert dans les plans d’eau du Québec, et pour contrer ce problème, le gouvernement du Québec a adopté le plan d’intervention sur les algues bleu-vert. À travers ce plan,le gouvernement préconise l’implantation d’équipements permettant de réduire le rejet de phosphore dans des endroits où le milieu récepteur le requiert. La position ministérielle sur la réduction du phosphore dans les rejets d'eaux usées s'applique
3
aux rejets de nature domestique d'origine municipale, institutionnelle ou privée. Elle vise à accentuer les efforts de déphosphatation des ouvrages de traitement qui rejettent leurs eaux usées traitées dans les milieux récepteurs sensibles à ce contaminant, en vue de limiter la prolifération de plantes et d’algues. La position ministérielle se résume en trois principaux axes. D’abord, il est exigé de réduire les concentrations de phosphore des eaux usées rejetées dans les eaux de surface quand la protection des usages du milieu le requiert. Ensuite, la meilleure technologie disponible, compte tenu des contraintes techniques, économiques et environnementales, doit être mise en place pour réduire les concentrations de phosphore dans les eaux usées. Enfin, la technologie de traitement retenue doit respecter le niveau de performance reconnu pour cette technologie, et ce, durant la période d'application de l'exigence. Tous les lacs sont visés par la position ministérielle. En fonction de leur sensibilité, le MDDELCC a défini 4 catégories de lacs :
• Les lacs prioritaires sont des plans d’eau ayant connu des épisodes importants ou récurrents d’algues bleu-vert, ou qui sont jugés très sensibles au phosphore.
• Les lacs préoccupants sont des plans d’eau ayant connu des épisodes localisés d’algues bleu ou qui n’ont pas connu de tels épisodes, mais dans lesquels les apports en phosphore sont jugés problématiques à long terme.
• Les lacs sous surveillance sont des plans d’eau qui n’ont pas connu d’épisodes d’algues bleu-vert, mais dans lesquels le phosphore doit faire l’objet d’un certain contrôle. • Enfin, les lacs exclus sont des plans d’eau caractérisés par une très faible pression
humaine ou par des conditions géographiques qui les rendent peu sensibles aux apports en phosphore.
À ces 4 catégories de plans d’eau, s’ajoutent les rivières situées dans les bassins en surplus de phosphore et qui ne déversent pas dans un lac. En fonction de ce classement, le tableau 1 présente les exigences de rejet en phosphore. Le MDDELCC peut définir une exigence plus sévère que celle indiquée au tableau 1 dans des cas particuliers tels qu’une rivière abritant une espèce à protéger ou par soucis de protection d’une prise d’eau de surface.
4
Tableau 1: Exigences en phosphore total pour les rejets d’eaux usées d’origine domestique (MDDELCC, 2017)
Des efforts de développement d’un procédé de déphosphatation sur support organique qui répond aux normes de rejet (< 0.3 mg P/L) sont entrepris notamment par le Centre de Recherche Industrielle de Québec (CRIQ). C’est dans ce cadre que s’inscrit le présent projet.
5
1.4 Structure du document
Outre cette introduction qui constitue le premier chapitre, ce mémoire se divise en 9 chapitres. Le second chapitre aborde la revue de littérature sur le phosphore dans les eaux usées. Le troisième chapitre de ce mémoire expose les hypothèses ainsi que les objectifs du travail. Le quatrième chapitre décrit l’ensemble du matériel utilisé et la méthodologie adoptée permettant d’aboutir aux différents résultats. Les principaux résultats obtenus dans ce travail et leur discussion font l’objet du chapitre cinq. La conclusion et les limites de l’étude sont présentées au sixième chapitre 6. Le chapitre sept porte sur les recommandations pour la suite de l’étude. Enfin, le présent mémoire se termine respectivement par les références bibliographiques et les annexes.
6
Chapitre 2 : Revue de littérature
Ce chapitre présente en premier lieu, un état des connaissances sur les sources, le cycle et les formes du phosphore (sections 2.1, 2.2 et 2.3 respectivement). Les différentes voies d’élimination du phosphore sont ensuite évoquées aux sections 2.4 et 2.5. Un rappel sur les travaux de déphosphatation antérieurs à ce projet et menés au CRIQ fait l’objet de la section 2.6. Enfin, la dernière partie de la revue de littérature (section 2.7) se consacre aux nitrates et aux différentes méthodes d’élimination (dénitrification) de ceux-ci.
2.1 Sources du phosphore
Contrairement aux cycles du carbone et de l’azote, la présence du phosphore se limite dans les sols et les environnements aquatiques compte tenu du fait qu’il est non-volatile (Baetens, 2001) à part la phosphine dans le domaine industriel (Kim, 2014). Les eaux usées constituent une source importante de rejets de phosphore dans l’environnement. Elles contiennent du phosphore provenant principalement (Deronzier et Choubert, 2004):
• Du métabolisme humain (urines et fèces) dans les eaux vannes (toilettes). • Des détergents ménagers (linge, vaisselle, douche).
• De divers types de déchets (alimentaires, taches de linge, etc.) rejetés avec les eaux grises (effluents de salle de bain et de cuisine).
• Des effluents industriels : agro-alimentaires, laveries industrielles, abattoirs, industries chimiques.
• Des phytosanitaires utilisés en agriculture.
2.2 Cycle du phosphore
Le cycle du phosphore dans l’eau est présenté à la figure 2. Les phosphates inorganiques insolubles vont se dissoudre en phosphates inorganiques. Ceux-ci sont par la suite assimilés et absorbés par le phytoplancton et algues. Ensuite, le phytoplancton libère dans la colonne d’eau des orthophosphates dissous et des phosphates organiques, qui se transforment en orthophosphates (Côté, 1996). Suivant la chaine alimentaire, le phosphore des algues est repris par le zooplancton et les carnivores pour finalement se retrouver sous forme de
7
phosphore organique dont une bonne partie va s’accumuler et s’enfouir dans les sédiments.
Figure 2: Cycle du phosphore en milieu aquatique (Reddy, 1998)
2.3 Différentes formes de phosphore
Le phosphore est généralement présent sous forme de phosphates (PO4). Les composés phosphorés qui se retrouvent dans les eaux usées sont sous forme dissoute ou particulaire. Les formes dissoutes les plus courantes sont les orthophosphates (PO43-), les phosphates organiques et les polyphosphates (P2O74-). Les formes particulaires correspondent au phosphore lié à la matière organique (débris végétaux) ou aux minéraux (argiles). Le phosphore total (Ptot) représente la somme des formes particulaires et dissoutes.
2.3.1 Orthophosphates
Les orthophosphates sont les espèces les plus abondantes en raison de l’hydrolyse des phosphates organiques et des polyphosphates (Kim, 2014). La dissociation de l’acide phosphorique (H3PO4) peut aboutir à la formation des espèces d’orthophosphates : H2PO4 -(conditions acides), HPO42- et PO43- (conditions alcalines). La présence de ces différentes formes dépend du pH comme l’indique la figure 3. Les deux premiers prédominent dans
8
la plage de pH comprise entre 5 et 9; tandis que la forme PO43- prédomine à pH>9. Les orthophosphates peuvent réagir avec plusieurs ions métalliques (Ca, Mg, Fe) dépendamment du pH de la solution.
Figure 3: Formes d’orthophosphates en fonction du pH (Kronos, 2003)
2.3.2 Polyphosphates
Les polyphosphates peuvent être considérés comme des polymères de l’acide phosphorique dans lequel l’eau a été retirée. L’hydrolyse complète des polyphosphates donne des orthophosphates. Les polyphosphates constituent des composés importants des poudres de lavages et autres détergents (Maurer et Boller, 1999).
2.3.3 Phosphates organiques
Les bactéries et de nombreux autres organismes utilisent des orthophosphates pour créer des phosphates organiques. En tant que tel, il s'agit d'un composant important de l'adénosine triphosphate (ATP), des acides nucléiques (ADN et ARN) et des phospholipides dans les membranes cellulaires. Dans les procaryotes et les eucaryotes, le phosphore peut être stocké dans des granules intracellulaires comme polyphosphates (Baetens, 2001). Les phosphates organiques sont des composés contenant des liaisons C-O-P ou C-C-O-P.
9
2.4 Systèmes de déphosphatation conventionnels
Plusieurs techniques ont été développées pour éliminer le phosphore des eaux usées. L’élimination du phosphore peut être réalisée par voie biologique ou par précipitation chimique avec des coagulants comme les sels d’aluminium, FeCl3 et FeSO4 (Brett et al, 1997 ; Sincero et Sincero, 2003). Dans les deux cas, le produit final est une boue chimique ou biologique à laquelle P est étroitement lié (Cucarella, 2009).
2.4.1 Déphosphatation biologique
Dans le processus d'élimination biologique du phosphore, les conditions alternées (anaérobies, aérobies) favorisent la prolifération des bactéries accumulatrices de polyphosphate (Polyphosphate Accumulating organisms : PAO) en excès (Bashan et Bashan, 2004; Canadian Water Network, 2015). La capacité d'élimination dépend directement de l'absorption et du stockage du phosphore par les PAO. Ces dernières consomment du phosphore non seulement pour leurs composants cellulaires, mais accumulent aussi de grandes quantités de polyphosphate dans leurs cellules (entre 20 et 30 % de VSS). En zone anaérobie, les bactéries accumulatrices du phosphore libèrent leurs réserves de polyphosphates présents dans leur matériel cellulaire en vue de fournir de l’énergie pour l’assimilation des acides gras volatiles (AGV). Les AGV sont convertis en Poly-Hydroxy-Alcanoates (PHA) dans les cellules bactériennes et conservés jusqu’à la phase aérobie (Canadian water Network, 2015). La dégradation des polyphosphates produit des phosphates inorganiques qui sont expulsés hors de la cellule augmentant de ce fait la concentration en phosphore dans la solution. Le milieu aérobie permet d’abaisser la concentration du phosphore dans la solution à une valeur inférieure à la concentration initiale. En effet, les bactéries hydrolysent leurs réserves de PHA pour leur croissance et stockent davantage de réserves de polyphosphates en accumulant plus de phosphore que ce qui était libéré. La figure 4 présente le mécanisme de déphosphatation biologique.
10
Figure 4: Mécanisme de déphosphatation biologique (ITP, 2000)
2.4.2 Déphosphatation physico-chimique
La déphosphatation chimique du phosphore se fait par addition des sels d’ions métalliques qui forment des précipités de phosphate. Elle vise la transformation sous la forme particulaire d'une quantité suffisante d'orthophosphates après liaison chimique avec un coagulant métallique (MDDELCC, 2015). Trois types de précipitants métalliques sont généralement utilisés pour l’élimination chimique du phosphore, à savoir le fer (II), le fer (III) et l'aluminium. Les sels de calcium sont utilisés très occasionnellement (Thistleton et al., 2002).
Les réactions de précipitation avec les sels de fer, d’aluminium et de calcium en présence des orthophosphates dans l’eau sont décrites par Maurer et Boller (1999) comme étant un transfert rapide vers des précipités crystallines Fe(PO ).2H O4 2 (strengite), AlPO .2H O4 2
(variscite) et Ca (PO )x 4 y
OH
2(apatite). Les précipités ou flocs formés vont être séparés de la phase liquide par décantation et/ou filtration (MDDELCC, 2015).Au Québec, les coagulants les plus utilisés pour la précipitation du phosphore sur la chaine dite liquide des stations d’épuration municipaux sont, dans l’ordre d’utilisation : l’alun constitué de sulfate d’aluminium Al2(SO4)3 pour environ 48 % des cas, le sulfate ferrique « Fe2(SO4)3 » pour environ 36 % des cas et le chlorure ferrique « FeCl3 » pour environ 1 % des cas. Certains coagulants pré-hydrolysés moins acides, comme les Poly-Aluminium-Silico-Sulfate (PASS) sont utilisés pour environ 1 % des cas.Dans les autres cas (15 %), les informations sont imprécises ou il n’y a pas de produit chimique dosé spécifiquement,
11
comme ceux qui bénéficient du pouvoir résiduel des boues chimiques rejetées, au réseau d’égout d’eau usée, par les stations de production d’eau potable (MDDELCC, 2015). Plusieurs paramètres tels que la spéciation chimique des composés phosphorés, le pH, les solides en suspension, les produits organiques dissous, le type et la dose de précipitant, les conditions du mélange ainsi que la configuration des procédés influencent fortement la performance des procédés et le niveau possible du phosphore résiduel dans l’effluent (Maurer et Boller, 1999).
La précipitation des phosphates avec le calcium se fait dans des conditions alcalines suivant l’équation 1 (Yang et al., 2017). Le produit formé est l’hydroxyapatite.
2+
3-4 5 4 3
5 Ca
+ 3 PO + OH
Ca
PO
OH
[Équation 1]La réaction chimique entre le chlorure ferrique et les anions orthophosphates PO43- pour former les phosphates de fer est présentée à l’équation 2 (MDDELCC, 2015):
3
3 4 4
FeCl
PO
FePO
Cl
[Équation 2]Sur une filière classique de traitement des eaux, la précipitation du phosphore par ajout de sels de métaux peut se faire par pré-précipitation au niveau du traitement primaire, par précipitation simultanée au niveau du bassin d’aération ou par post-précipitation après le clarificateur secondaire (ITP, 2000). La figure 5 présente les différents niveaux d’injection de sels de métaux pour la déphosphatation chimique.
12
Figure 5: Différentes configurations de déphosphatation chimique (Nutt, 1991) tiré de MDDELCC (2015)
2.4.3 Limitations d’utilisation de procédés conventionnels
Quoique performant, les procédés conventionnels d’élimination du phosphore tels que le traitement biologique et les procédés chimiques utilisant le principe de coagulation/précipitation nécessitent des opérations d’entretien élevées, souvent difficiles pour les petites municipalités et les résidences isolées. Ils sont aussi onéreux compte tenu des coûts des produits chimiques, de la maintenance et des coûts opérationnels (Moelants et al., 2011). Par ailleurs, ces procédés génèrent une importante quantité de boues chimiques souvent difficile à disposer et à valoriser en agriculture. Par conséquent, ils sont moins adaptés pour les petites municipalités et les résidences isolées qui requièrent plutôt de technologies de déphosphatation par capture passive. La capture passive du phosphore se
13
définit comme étant l’accumulation d’une substance problématique (i.e. : phosphore) au sein d’un filtre composé de matériaux ayant une forte affinité chimique pour le polluant (Thibault, 2013).
2.5 Capture passive du phosphore
Pour l’enlèvement du phosphore par capture passive, les médias utilisés sont caractérisés par une forte affinité avec le phosphore (Cucarella, 2009). L’enlèvement se fait par accumulation et rétention du phosphore sur le média filtrant selon plusieurs mécanismes complexes et difficiles à dissocier. Ils regroupent une combinaison d’adsorption, de précipitation et d’échange ionique regroupés sous l’appellation de sorption.
2.5.1 Sorption
Le terme sorption est décrit par McBride (1994) comme un processus continu qui part des réactions d’adsorption aux réactions de précipitation. Ce terme est plus pratique puisque les processus chimiques gouvernant les interactions (ions phosphates avec les différents matériaux) ne sont pas complètement connus (Cucarella, 2009). La sorption est déterminée en capacité de sorption du phosphore (CSP) exprimée en mg de P capté par gramme de média sec.
Le calcium (Ca), l’aluminium (Al) et le fer (Fe) sont des composants très actifs pour la sorption du phosphore (Johansson Wesholm, 2006). En effet, l’abondance des éléments Al, Ca et Fe à la surface d’un matériau définit le nombre de sites de sorption (Cucarella, 2009).
La capacité d'un matériau à éliminer P des eaux usées dépend de ses propriétés physiques et chimiques (Cucarella, 2009). La composition chimique du média ainsi que le pH déterminent l’affinité et la force d’interaction avec le phosphore. Ainsi, la capacité de sorption dépend à la fois du nombre et de l’affinité des sites d’adsorption. La capacité d’enlèvement du phosphore d’un filtre peut être affectée par le temps de contact de l’eau avec le matériau filtrant, la concentration en phosphate de l’eau qui est traitée, ou d’autres facteurs tel que la température (Cucarella et Renman, 2009).
14
2.5.2 Matériaux utilisés pour la sorption du phosphore
La quantité de phosphate qui peut être prise en charge par un matériau avant qu'il ne devienne saturé varie largement selon le type de matériau et même au sein d’un même matériau c'est-à-dire selon la source, la taille des particules, etc. (Zheng et Dunets, 2013). Vohla et al. (2011) répertorie en détail une soixantaine de travaux concernant les matériaux qui éliminent le phosphore par capture passive. Plus de détails concernant les caractéristiques de ces produits à savoir la CSP, le mode de détermination (batch, colonne), le pH, les études réalisées ainsi qu’une comparaison de l’efficacité de ces matériaux peuvent être trouvés dans la revue de Vohla et al. (2011) dont quelques-uns sont présentés par Roy-Dumesnil (2015) dans sa revue de littérature. Ces matériaux peuvent être classés en trois catégories (Johansson Westholm, 2006; Vohla et al., 2011):
• Les matériaux naturels proviennent de l’environnement. Les matériaux naturels comprennent plusieurs roches et minéraux; entre autres, le gravier, l’apatite, l’alunite, le calcaire, le sable, la polonite, la zéolite, la tourbe. L’avantage des matériaux naturels est le fait qu’ils sont peu dispendieux et sont disponibles en grande quantité.
• Les sous-produits industriels comme leur nom l’indique sont des sous-produits issus des procédés industriels, considérés comme des résidus destinés aux sites d’enfouissement. Les produits tels que les scories d’aciers, les cendres volantes, la boue rouge, le cendre de charbon font partie de cette catégorie.
• Les produits manufacturés tels que le leca, l’alumine activé, la filtratite P, l’hydroxyde de fer en granule, prennent en charge le phosphore ou d’autres polluants et possèdent de bonnes capacités de prise en charge en général. Cependant, les produits manufacturés sont plus dispendieux que les sous-produits industriels ou les produits naturels.
Pour effectuer la capture passive du phosphore, les surfaces des matériaux sont conditionnées par imprégnation aux produits d’aluminium, de fer ou de calcium. Les formes de fer et d’aluminium ayant une plus grande affinité avec le phosphore sont les oxydes et hydroxydes de fer/d’aluminium appelés sesquioxydes (Roy-Dumesnil, 2015).
15
2.5.3 Description des mécanismes de sorption du phosphore
2.5.3.1 Adsorption/échange ionique
L’adsorption est l’attachement des phosphates sur les surfaces chargées des matériaux filtrants, le plus souvent sur le fer et les oxydes d’aluminium (Zheng et Dunets, 2013). Les charges négatives des phosphates peuvent établir des liaisons avec des ions chargés positivement (calcium, fer, ou aluminium) fourni par le média filtrant, formant des composés insolubles (Zheng et Dunets, 2013). L’adsorption de phosphates sur les sesquioxydes se fait principalement à pH acide et se présente à la figure 6.
Figure 6: Adsorption entre un sesquioxyde et un ion phosphate (adapté de Karam, 2014) tiré de Roy-Dumesnil (2015)
À pH neutre ou basique, le mécanisme d’enlèvement prédominant est l’échange ionique montré à la figure 7.
Figure 7: Échange ionique ente un sesquioxyde et un ion phosphate (adapté de Karam, 2014) tiré de Roy-Dumesnil (2015)
Plusieurs paramètres tels que le pH, la granulométrie, la concentration de réactif chimique, la température, la concentration initiale en polluant peuvent affecter la capacité d’adsorption d’un média.
pH
Le pH joue un rôle important dans le mécanisme de rétention ou de libération des phosphates (Farrah et Pickering, 1979). L’établissement des liaisons P-Fe, P-Ca, et P-Al
16
dépend du pH. À pH > 7, le calcium est le cation dominant qui réagit avec le phosphate. Une augmentation du pH diminue la capacité de fixation de Fe3+, Al3+ à cause de la compétition des ions OH- et de PO43- sur les complexes (Pradhan et al., 1998). Dans les conditions alcalines, les ions OH- sont en compétition et dominent les ions phosphates en ce qui concerne les sites de fixation à la surface des hydroxydes de fer (Pratt et al, 2007). D’un autre côté, à pH élevé, la surface des hydroxydes de fer peut transporter de plus en plus des charges négatives, entrainant une répulsion entre les ions phosphates et la surface des hydroxydes de fer (Xue et al., 2009).
En étudiant la cinétique d’adsorption du phosphore en solution sur les sédiments d’un lac au Maroc, Benzizoune et al. (2004) ont trouvé qu’une augmentation de pH ne favorise pas la fixation des ions phosphates sur les sédiments (adsorption faible en milieu basique). Par ailleurs, leurs résultats ont montré qu’une plage de pH entre 5.5 et 7.5 est favorable pour l’élimination des ions phosphates.
Han et al. (2016) ont étudié l’effet du pH sur la capacité d’enlèvement du phosphore par des scories de type Basic Oxygen Furnace (BOF). Ils ont trouvé que l’enlèvement du phosphore par l’aluminium et le fer est efficace dans la gamme de pH acide (4.5-4.51) et neutre tandis que les phosphates de calcium peuvent s’établir à des pH élevés. La figure 8 présente les résultats qu’ils ont obtenus.
Figure 8: Effet du pH sur l'enlèvement du phosphore par les scories BOF (Han et al., 2016)
17
Granulométrie
La capacité d’adsorption d’un média est reliée à sa surface spécifique. Plus la surface spécifique est élevée, plus il y aura des sites spécifiques pour l’adsorption du phosphore. Le média est alors considéré efficace. Une granulométrie faible offre une grande surface spécifique et un bon temps de contact avec le milieu filtrant, ce qui favorise l’enlèvement du phosphore. Toutefois, la conductivité hydraulique du milieu devra être suffisante pour éviter qu’il y ait colmatage. À l’inverse, une granulométrie grande favorise la conductivité hydraulique mais l’enlèvement du phosphore est atténué (Drizo et al., 1999 ; Johansson, 1997). Benzizoune et al. (2004) ont démontré que la rétention des phosphates par deux sédiments (même quantité et à pH égal) est plus importante pour le sédiment ayant les tailles des particules les plus fines.
Concentration en phosphore
Benzizoune et al (2004) ont étudié la cinétique d’adsorption du phosphore par deux sédiments en testant respectivement deux concentrations initiales de 3.1 mg/L et 6.2 mg/L à pH fixe. Les résultats trouvés par ces auteurs indiquent que le rendement d’adsorption diminue presque de moitié avec le double de la concentration en ions phosphates dès la deuxième demi-heure d’adsorption. L’adsorption dépend donc de l’utilisation des sites de fixation pour les ions phosphates. Mortula et Gagnon (2007) ont effectué des travaux portant sur l’adsorption du phosphore par des résidus solides d’alun séchés au four dont l’efficacité est comparable au charbon activé. Ils ont abouti à la conclusion selon laquelle l’efficacité d’enlèvement du phosphore était affectée par la concentration initiale en phosphore. Tel qu’indiqué sur la figure 9, une concentration initiale élevée en phosphore (10 mg P/L) a eu une plus grande fraction de phosphore en sortie (taux d'adsorption plus faible) contrairement à une faible concentration initiale en phosphore de 2.5 mg P/L (Mortula et Gagnon, 2007).
18
Figure 9: Effet de la concentration initiale en phosphore sur l’adsorption du phosphore (adapté de Mortula et Gagnon, 2007)
Température
Zamparas et al. (2012) ont testé l’influence de la température sur l’adsorption des phosphates. En utilisant une gamme de température comprise entre 5 et 35°C, ils ont trouvé qu’une augmentation de température était favorable à l’adsorption des phosphates sur la bentonite modifiée (argile). À mesure que la température augmente, la capacité d’adsorption des phosphates augmente également. D’autres auteurs abondent dans le même sens. Il s’agit de Kamiyango et al. (2011) et Agyei et al. (2002) dont les travaux ont démontré qu’une hausse de température entraine une augmentation de la capacité de sorption du phosphore. Pour plus de détails sur ces travaux, Thibault (2013) présente leurs résultats dans sa revue de littérature.
Concentration du réactif chimique
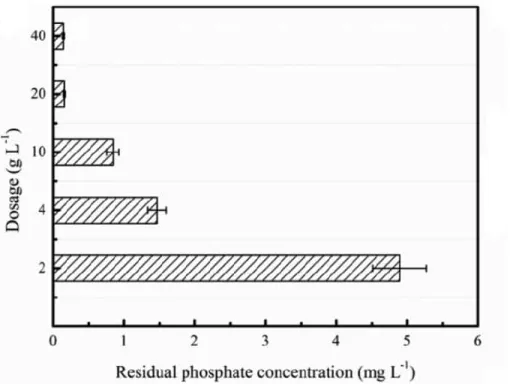
Yang et al. (2017) ont évalué l’effet de la concentration du Ca2+ sur la précipitation des phosphates par un matériau granuleux à base de ciment blanc utilisé. Ils ont trouvé que l’enlèvement des phosphates est efficace lorsque le dosage en Ca2+ est élevé. La figure 10 montre que la concentration en phosphate résiduelle est de 0.16 mg /L pour un dosage de 20 g/L tandis qu’elle est de 4.83 mg/L à 2 g/L.
19
Figure 10: Effet du dosage du Ca2+ sur la précipitation du phosphore (Yang et al., 2017)
Cependant, l’élimination du phosphore par le calcium n’est efficace qu’à un pH basique et nécessiterait des ajustements de pH pendant et après le traitement. L’utilisation des sels d’aluminium, bien que performants peut poser des problèmes de toxicité surtout lorsqu’on considère la réutilisation potentielle des boues comme engrais (Meers et al., 2006). Le chlorure ferrique (FeCl3) et le sulfate ferreux (FeSO4) sont les sels de fer les plus utilisés pour éliminer le phosphore. L'un des principaux inconvénients de l'utilisation de FeSO4 est lié à la diminution de l'oxygène dissous due à l’oxydation de Fe2+ (Caravelli et al., 2010). Pour cette raison, le chlorure ferrique qui est abondamment disponible sur le marché est préféré dans le cadre de ce travail.
20
2.5.3.2 Dissolution réductive
La précipitation par dissolution réductive s’ajoute aux deux mécanismes d’adsorption et d’échanges d’ions (présentés à la section 2.5.3.1) et contribue considérablement à l’enlèvement du phosphore par le mécanisme de sorption. La précipitation du phosphore par dissolution réductive se fait en présence de fer.
Le fer est après l'oxygène, l'élément redox-actif le plus abondant dans la croûte terrestre. Il possède deux valences (+2 et +3) et peut passer facilement d’une forme à l’autre (Ségalen, 1964) comme le montre l’équation 3. Il peut jouer le rôle d’accepteur d’électrons dans un milieu gorgé d’eau et où le taux d’oxygène est faible (Vizier, 1971).
3 2
Fe + e
Fe
[Équation 3]
En effet, le potentiel d’oxydoréduction (POR) conditionne le degré d’oxydation du fer ferrique Fe3+ ou fer ferreux Fe2+. À des valeurs de POR < 200 mV (milieu réducteur) et à l’intérieur de la gamme de pH usuels (5.5-7.5) dans l’eau, les formes ferriques (Fe3+, Fe(OH)3) se dissolvent et se réduisent en Fe2+ comme l’indique le diagramme de Sarrazin et Verdaguer (1991) à la figure 11. Ce mécanisme s’appelle la dissolution réductive.