CAPTURE PASSIVE DU PHOSPHORE D’UNE EAU USÉE MUNICIPALE EN
CONTEXTE DE BIOFILTRATION
Mémoire
THOMAS THIBAULT
Maîtrise en génie des eaux
Maître ès sciences (M. Sc.)
Québec, Canada
iii
Résumé
Les rejets de phosphore en milieux aquatiques ont le potentiel de conduire à l’eutrophisation d’un plan d’eau et sont la principale cause des proliférations de cyanobactéries (algues bleues), dont la dégradation entraîne la libération de toxines (cyanotoxines), nocives pour la santé humaine et animale. Le phosphore contenu dans les eaux usées municipales est donc particulièrement visé par un resserrement des exigences de rejet qui risque de rendre inadéquats certains systèmes épuratoires actuellement utilisés. Des travaux ont été réalisés afin de développer un traitement simple au niveau opérationnel tout en étant assez performant pour abaisser la concentration en phosphore d’une eau usée municipale concentrée à 5,0 mg Ptot/l à des valeurs de 0,3 mg Ptot/l. L’approche retenue
consiste en l’utilisation d’un média filtrant innovateur permettant une prise en charge passive du phosphore. Ce média filtrant est constitué de sous-produits du bois activés par une imprégnation d’hydroxyde de fer, substance qui possède une forte affinité chimique avec le phosphore.
Des travaux ont d’abord permis de cibler un procédé permettant d’activer efficacement les sous-produits du bois selon une procédure qu’il a fallu mettre au point. Par la suite, différents montages ont été élaborés afin d’être en mesure d’activer des quantités suffisantes de médias filtrants permettant de mener des essais en colonnes.
Une première série d’essais a été réalisée sur des colonnes de biofiltration. Les performances observées ont été intéressantes, mais non suffisantes pour atteindre la valeur cible de 0,5 mg Ptot/l. Une série d’essais supplémentaires a donc été réalisée dans le but
d’optimiser l’utilisation du média filtrant.
À partir des connaissances acquises lors de ces essais d’optimisation, des essais en colonnes ont permis d’abaisser la concentration d’une solution contenant 5 mg/l de phosphore à des valeurs inférieures à 0,2 mg Ptot/l sur une période de 80 jours. Ces essais
ont démontré que le média filtrant était en mesure d’accumuler une quantité de phosphore minimale de 13,5 mg Ptot/gsec, ce qui est très performant pour ce type de procédé.
v
Abstract
Phosphorus discharges in aquatic systems have the potential to lead to eutrophication of a waterbody. Moreover, this nutrient is the main cause of cyanobacteria’s bloom (blue-green algae), whose degradation liberates toxic compounds (cyanotoxins), harmful to animal and human’s health. Phosphorus contained in municipal wastewater will soon be subject to a tightening of discharge requirements which will make unsuitable a lot of currently used wastewater treatment plant.
Researches have been realized to develop a simple treatment on the operational aspect is effective enough to reduce wastewater’s phosphorus concentration from 5.0 mg Ptot/l to
0.3 mg Ptot/l. The principle of the chosen method consists in the use of a filter media that
allows passive phosphorus entrapment. This filter media is made of wood’s by-products which are activated by impregnation of iron hydroxide, a substance having a strong chemical affinity with phosphorus.
Works were first allowed to target a process to effectively activate wood’s by-products according to a procedure that has been developed. Thereafter, different experimental settings have been developed in order to be able to activate sufficient amounts of filter media to perform column tests.
A first series of tests was performed on biofiltration columns. Observed performances were interesting, but not sufficient to achieve the target value of 0.5 mg Ptot / l. Additional tests
were therefore performed in order to optimize the use of the filter media.
Based on the knowledge gained from these optimization tests, column trials have lowered the phosphorus concentration of a solution containing 5 mg Ptot/l to values below 0.2 mg
Ptot/l over a period of 80 days. These tests showed that the filter media was able to
accumulate an amount of phosphorus in the range of 13,5 mg Ptot/gdry, which is very
vii
Remerciements
La réalisation de ce projet n’aurait jamais été possible sans la contribution de nombreuses personnes à qui je souhaiterais transmettre mes plus grandes gratitudes.
Tout d’abord, j’aimerais remercier Paul Lessard, mon directeur de maîtrise à l’Université Laval. Par son écoute, ses conseils, ses inspirations et sa générosité, M. Lessard a été ma principale référence dans ce projet et a gagné tout mon respect.
Je veux ensuite remercier Gérardo Buelna, mon co-directeur de recherche au CRIQ. Ses remarques pertinentes ainsi que ses intuitions rigoureuses ont apporté beaucoup au projet. Je voudrais ensuite remercier Rino Dubé, le superviseur-responsable du projet au CRIQ. Son accessibilité et ses suivis réguliers ont permis aux travaux d’avancer très efficacement. Je souhaiterais aussi remercier tout le personnel du CRIQ pour l’accueil chaleureux, pour la grande confiance qu’ils m’ont accordée ainsi que pour le soutien exceptionnel auquel j’ai eu droit. J’aimerais souligner la participation exceptionnelle d’André Tremblay, de Jean Nadeau, de Marc Daigle, d‘Odette Petitclerc, de Sylvain Savard et de Yann LeBihan. Ces personnes ont grandement contribué au succès de ce projet en apportant des idées, des conseils et surtout en étant très généreuses de leur temps.
J’aimerais ensuite remercier tous les organismes et personnes ayant contribué à mon soutien financier durant ma maîtrise. Merci au CRIQ, à l’Université Laval, à M. Jean Raby, à Marthe et Robert Ménard et à SNC-Lavalin.
Et comment passer sous silence les êtres qui m’ont permis de passer à travers cette épreuve la joie au cœur et le sourire aux lèvres. Merci à ma famille; Claire, Robin, Zoé, Noémi et Simon pour votre écoute, vos encouragements et votre présence qui rendent ma vie si agréable. Merci aussi à tous mes précieux amis et à mes collègues de travail pour les bons moments passés ensemble; Vincent, Fred, David, Scott, la gang de génie des eaux, Marie-Jeanne, Guillaume, Joëlle, Viviane, Ariane, Rafaël, Pere, Bowei, Olivier, Éric, et le Club Techno du CRIQ.
ix
Plus on va loin dans la forêt, plus il y a de bois…
xi
Table des matières
Résumé ... iii
Abstract ... v
Remerciements ... vii
Table des matières ... xi
Liste des tableaux ... xv
Liste des figures ... xvii
Liste des symboles ... xxi
CHAPITRE 1 : INTRODUCTION... 1
1.1 Mise en contexte ... 1
1.1.1 Spécification du phosphore ... 1
1.1.2 Problématiques reliées au phosphore ... 4
1.1.3 Plan d’action du gouvernement québécois ... 6
CHAPITRE 2 : ÉTAT DES CONNAISSANCES ... 9
2.1 Méthodes conventionnelles d’enlèvement du phosphore ... 9
2.1.1 Déphosphatation biologique ... 9
2.1.2 Déphosphatation par produits chimiques ... 17
2.2 Systèmes de capture de phosphore passifs ... 23
2.2.1 Mécanismes de déphosphatation des systèmes à capture passive ... 23
2.2.2 Média de déphosphatation utilisés dans la littérature ... 27
2.2.3 Méthodes de détermination de la capacité de sorption en phosphore ... 34
2.2.4 Facteurs influençant la capacité de sorption de phosphore d’un média ... 39
2.2.5 Régénération d’un filtre à capture passive ... 44
2.2.6 Récupération du phosphore ... 46
2.3 Déphosphatation par capture passive au CRIQ ... 48
CHAPITRE 3 : HYPOTHÈSE, OBJECTIFS ET IMPACTS DU PROJET ... 49
3.1 Hypothèse ... 49
3.2 Objectifs ... 49
3.3 Impacts potentiels du projet ... 49
CHAPITRE 4 : ACTIVATION DES SOUS-PRODUITS DU BOIS... 50
4.1 Essais d’activation préliminaires ... 51
4.1.1 Prétraitement ... 52
4.1.2 Imprégnation de fer ... 52
4.1.3 Posttraitement ... 54
4.2 Optimisation de l’activation des copeaux de bois ... 58
4.2.1 Planification de l’expérience ... 59
4.2.2 Méthodologie et matériel ... 61
4.2.3 Méthodologie et analyse des données ... 62
4.2.4 Résultats ... 63
4.2.5 Discussion ... 65
4.3 Comparaison des sous-produits du bois et modélisation d’isotherme d’adsorption ... 66
4.3.1 Méthodologie de la caractérisation et de l’activation de différents sous-produits du bois ... 67
4.3.2 Résultats de la caractérisation et de l’activation de sous-produits du bois ... 69
xii
4.3.4 Résultats de la modélisation d’isotherme d’adsorption ... 70
4.3.5 Discussion ... 73
4.3.6 Quantité de matières premières requises pour l’activation ... 74
4.4 Conclusion générale de la section ... 75
CHAPITRE 5 : MATÉRIEL ET MÉTHODOLOGIE ... 76
5.1 Copeaux activés en contexte de biofiltration ... 76
5.1.1 Plan d’expériences ... 77
5.1.2 Matériel et méthodologie ... 78
5.1.3 Suivi analytique ... 82
5.1.4 Méthode de calcul des bilans de phosphore ... 83
5.2 Investigation pour l’optimisation de l’utilisation du bois activé ... 84
5.2.1 Influence de la qualité de l’eau sur la déphosphatation ... 85
5.2.2 Influence de la granulométrie du bois sur la déphosphatation ... 88
5.2.3 Cinétique de prise en charge du phosphore ... 90
5.2.4 Influence du mode d’opération des colonnes ... 94
5.3 Déphosphatation par des sous-produits du bois activés en colonnes immergées ... 97
5.3.1 Caractérisation et opération du montage ... 98
5.3.2 Détermination du débit à appliquer sur les colonnes ... 99
5.3.3 Suivi analytique ... 101
5.3.4 Analyse des boues ... 102
5.3.5 Analyse de la composition du garnissage neuf et usagé ... 103
CHAPITRE 6 : RÉSULTATS ET DISCUSSION ... 104
6.1 Copeaux activés en contexte de biofiltration ... 104
6.1.1 Discussion ... 108
6.2 Investigation pour l’optimisation de l’utilisation du bois activé ... 109
6.2.1 Influence de la qualité de l’eau sur la déphosphatation ... 109
6.2.2 Influence de la granulométrie ... 113
6.2.3 Cinétique de prise en charge du phosphore ... 114
6.2.4 Influence du mode d’opération des colonnes ... 117
6.2.5 Discussion ... 121
6.3 Déphosphatation par des sous-produits du bois activés en colonnes immergées .... 123
6.3.1 Détermination du débit à appliquer sur les colonnes ... 123
6.3.2 Suivi des colonnes ... 125
6.3.3 Analyse des boues ... 129
6.3.4 Analyse de la composition du garnissage neuf et usagé ... 130
6.3.5 Discussion ... 132
6.4 Conclusion générale de la section ... 134
CHAPITRE 7 : ÉTUDE TECHNICOÉCONOMIQUE ... 135
7.1 Coûts reliés à l’activation de sous-produits du bois ... 135
7.1.1 Coûts des matières premières ... 135
7.1.2 Coûts de fabrication du bois actif ... 138
7.1.3 Discussion ... 142
7.2 Étude technicoéconomique de divers scénarios ... 143
7.2.1 Scénarios à l’étude ... 143
7.2.2 Résultats des modélisations ... 148
CHAPITRE 8 : CONCLUSION ... 152
xiii
8.2 Recommandations ... 154
8.2.1 Perspective d’utilisation du filtre à capture passive ... 154
8.2.2 Configuration visant à réduire le fer et les MeS relargués ... 155
8.2.3 Enlèvement avancé des nutriments ... 156
8.2.4 Principe d’activation ... 157
8.2.5 Hydraulique des filtres immergés ... 157
8.2.6 Utilisation pour différents contextes ... 158
8.2.7 Régénération du média et récupération du phosphore ... 159
Bibliographie ... 160
ANNEXE 1 : DÉPHOSPHATATION PAR CAPTURE PASSIVE AU CRIQ ... 166
ANNEXE 2 : PROTOCOLE D’UTILISATION DU NEUTRALISEUR ... 167
ANNEXE 3 : OPTIMISATION DE L’ACTIVATION ... 168
ANNEXE 4 : MÉTHODOLOGIE POUR LA MODÉLISATION D’ISOTHERMES D’ADSORPTION ... 174
ANNEXE 5 : COPEAUX ACTIVÉS EN CONTEXTE DE BIOFILTRATION ... 180
ANNEXE 6 : INVESTIGATIONS POUR L’OPTIMISATION DE L’UTILISATION DES SOUS-PRODUITS DU BOIS ACTIVÉS ... 183
ANNEXE 7 : COMPARAISON DES SOUS-PRODUITS DU BOIS ET MODÉLISATION D’ISOTHERMES D’ADSORPTION ... 194
ANNEXE 8 : DÉPHOSPHATATION PAR DES SOUS-PRODUITS DU BOIS ACTIVÉS EN COLONNE IMMERGÉES ... 200
xv
Liste des tableaux
Tableau 1: Origines des apports anthropiques de phosphore dans les eaux de surface en
France (Aubert, 2007) ... 2
Tableau 2: Décomposition des rejets domestiques de phosphore par individu (adapté de Stricker et al., 2010) ... 3
Tableau 3: Exigence en fonction du classement du point de rejet (MDDEP, 2012 c) ... 8
Tableau 4: Ratio aluminium : phosphore requis pour différentes réductions du phosphore (Metcalf & Eddy, 2003) ... 19
Tableau 5: Classification de matériaux en fonction de leurs capacités de sorption de phosphore et de leur granulométrie (adapté de Cucarella et Renman, 2009) ... 27
Tableau 6: Capacité de prise en charge de l'alumine activée AAFS50 (Axens, 2010) ... 30
Tableau 7 : Sélectivité de l'oxyhydroxyde d'aluminium (Tanada et al., 2003) ... 39
Tableau 8: Caractéristiques des copeaux de qualité papetière ... 50
Tableau 9: Apparence et capacité de prise en charge de phosphore en fonction du posttraitement des copeaux ... 54
Tableau 10: Premier plan d'expériences pour l'optimisation des paramètres d'activation .... 60
Tableau 11: Deuxième plan d'expériences pour l'optimisation des paramètres de l'activation ... 60
Tableau 12 : Description de sous-produits du bois fins commercialement disponibles ... 67
Tableau 13: Capacité de prise en charge maximale de phosphore selon le modèle de Langmuir ... 72
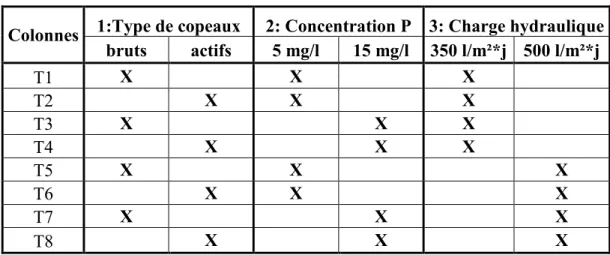
Tableau 14: Plan d'expériences des essais en colonne de copeaux activés en contexte de biofiltration ... 77
Tableau 15: Propriétés des colonnes de copeaux activés en contexte de biofiltration ... 78
Tableau 16: Paramètres de suivi des colonnes de biofiltration ... 82
Tableau 17: Granulométrie des différents lots de copeaux et sous-produits du bois testés .. 88
Tableau 18: Suivi analytique des colonnes visant à comparer le mode d'opération ... 96
Tableau 19: Suivi analytique des colonnes de sous-produits du bois immergées ... 101
Tableau 20: Comparaison du type de copeaux pour l'enlèvement du phosphore ... 104
Tableau 21: Concentrations moyennes du fer, de la DCO et de l'N-NH4 selon le type de copeaux ... 106
Tableau 22: Effet de la concentration du phosphore à l’entrée ... 107
Tableau 23: Effet de la charge hydraulique ... 107
Tableau 24: Concentration en N-NO3, DCO et P des solutions testées ... 109
Tableau 25: Résultats des essais traceurs dans les biofiltres ... 115
Tableau 26: Quantité de phosphore et quantité d'eau ayant circulé dans les colonnes ... 117
Tableau 27: Composition en fer et en phosphore de la broyure activée neuve et usagée .. 120
Tableau 28: Détermination du volume total occupé par l'eau dans les colonnes de sous-produits du bois activé ... 123
Tableau 29: Débits à appliquer pour obtenir un TRH de 12 heures ... 123
Tableau 30: MeS, MVeS et fer dissout d'un échantillon prélevé à la sortie de la colonne de bran de scie activée ... 129
Tableau 31: Concentration en phosphore d'une sortie d’une colonne non filtré par rapport à un échantillon filtré ... 129
xvi
Tableau 33: Quantité requise pour l'activation de 1 kg de bois et gamme de prix... 137
Tableau 34: Coûts reliés aux matières premières pour l’activation d’un kilogramme de bois ... 137
Tableau 35: Hypothèses de dimensionnement de l'équipement ... 139
Tableau 36: Coûts reliés aux installations requises pour la construction d'une usine d'activation ... 140
Tableau 37: Frais annuels liés à la production de bois activé ... 141
Tableau 38: Frais liés à la production de bois activé par kilogramme ... 141
Tableau 39: Frais considérés par le logiciel ... 144
Tableau 40: Données pertinentes aux scénarios de capture passive avec bois activé et alumine activée ... 148
Tableau 41: Résultats de la simulation CAPDETWORKS au débit de 100 m³/j ... 149
Tableau 42: Résultats de la simulation CAPDETWORKS au débit de 200 m³/j ... 149
Tableau 43: Coûts totaux liés aux scénarios modélisés sur un horizon de 20 ans ... 150
Tableau 44: Comparaison de différents médias déphosphatant sur une base technicoéconomique ... 151
xvii
Liste des figures
Figure 1: Cycle du phosphore en milieu aquatique (adapté de Correll, 1998) ... 1
Figure 2: Algues bleu-vert (Source : Google image) ... 5
Figure 3: Systèmes de boues activées effectuant la déphosphatation (Metcalf & Eddy, 2003) ... 10
Figure 4: Biomasse déphosphatante en condition anaérobie (Baljic-Zelovic et Leduc, 2002) ... 11
Figure 5: Biomasse déphosphatante en condition aérobie (Baljic-Zelovic et Leduc, 2002) 12 Figure 6: Courbe de relargage et de réabsorption du phosphore (adapté de Déronzier et Choubert, 2002) ... 13
Figure 7: Coupe transversale d'un marais filtrant artificiel (Poulet et al., 2004) ... 16
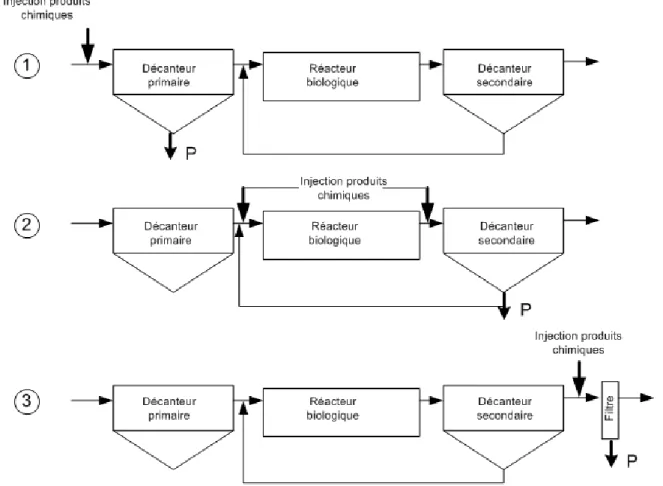
Figure 8: Différents points d'injection de produits chimiques (adapté de Metcalf & Eddy, 2003) ... 20
Figure 9: Liaison chimique d'un ion phosphate avec un sesquioxyde (adapté de Karam, 2012) ... 24
Figure 10: Attraction électrostatique d'un ion phosphate avec un sesquioxyde (adapté de Karam, 2012) ... 25
Figure 11: Mécanismes du phosphore avec le Calcium (adapté de Comeau et al., 2006) ... 26
Figure 12: Forme du fer en fonction du pH et du potentiel redox (Sarrazin et Verdaguer, 1991) ... 32
Figure 13: Exemple d’isotherme d'adsorption de Freundlich ... 37
Figure 14: Exemple d’isotherme d’adsorption de Langmuir ... 38
Figure 15: Effet du pH sur la quantité de phosphore pris en charge par des bentonites dopées (Yan et al., 2010) ... 40
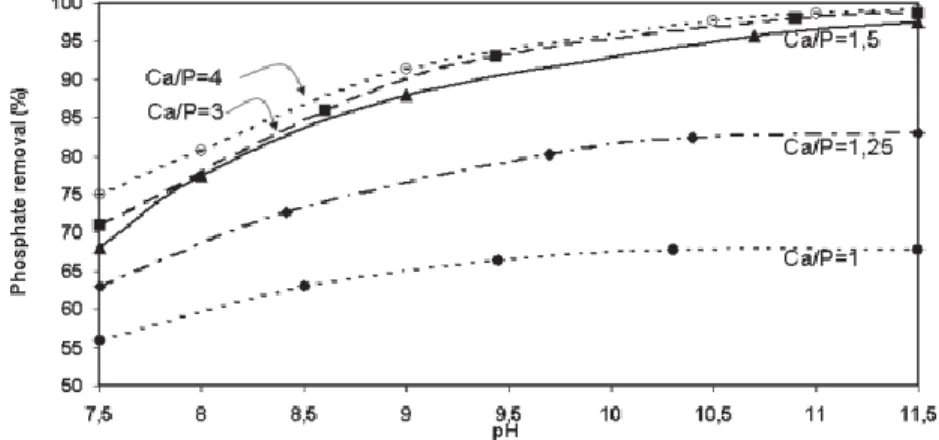
Figure 16: Enlèvement de phosphates en fonction du pH et du ratio Ca/P (Hosni et al., 2007) ... 40
Figure 17: CSP de scories d'acier dopées à la chaux en fonction de la surface spécifique (Gong et al., 2009) ... 41
Figure 18: Isothermes de Freundlich de la bauxite à différentes températures (Kamiyango et al., 2011) ... 42
Figure 19: Enlèvement des phosphates en fonction de la température par différents produits à base de Ca (Agyei et al., 2002) ... 42
Figure 20: Capacité de capture de phosphore de granules d'hydroxyde de fer selon le nombre et le type de produit régénérant (Genz et al., 2004) ... 44
Figure 21: Concentration du phosphore à la sortie d'une colonne en fonction du volume de solution régénérante utilisée en terme de volume du garnissage (Sugupta et Pandit, 2011) ... 45
Figure 22: Procédé OSTARA© (adapté de Oleszkiewicz et al., 2011) ... 47
Figure 23: Montage expérimental - La Grande Roue ... 53
Figure 24: Mise en contact de copeaux imprégnés de fer avec de l'ammoniaque ... 55
Figure 25: Montage expérimental - Le Neutraliseur ... 56
Figure 26: Schéma du montage expérimental - Le Neutraliseur ... 57
Figure 27: Surface modélisée lors de la deuxième série d’essais d’optimisation ... 64
Figure 28: Profil granulométrique des sous-produits du bois ... 69
xviii
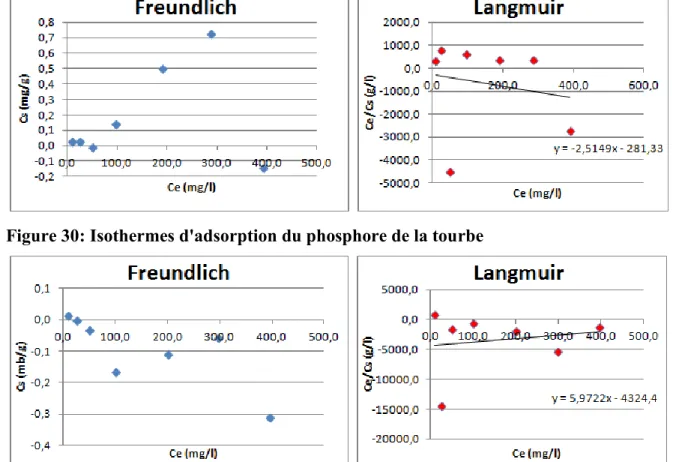
Figure 30: Isothermes d'adsorption du phosphore de la tourbe ... 70
Figure 31: Isothermes d'adsorption du phosphore du bran de scie brut ... 70
Figure 32: Isothermes d'adsorption du phosphore de la broyure activée ... 71
Figure 33: Isothermes d'adsorption du phosphore du bran de scie activé ... 71
Figure 34: Isothermes d'adsorption du phosphore de la planure activée... 71
Figure 35: Isothermes d'adsorption du phosphore de l'alumine activée ... 71
Figure 36: Montage des colonnes de copeaux activés en contexte de biofiltration ... 78
Figure 37: Configuration des colonnes de biofiltration ... 79
Figure 38: Constituants des colonnes de biofiltration ... 80
Figure 39: Tamisage des copeaux en différentes classes de granulométrie ... 88
Figure 40: Différentes catégories de granulométrie et de sous-produits du bois activés ... 89
Figure 41: Montage de mesure de conductivité pour l’essai traceur ... 91
Figure 42: Concentration du KCl en fonction de la conductivité à 23 °C ... 92
Figure 43: Schéma du montage à l’étude ... 94
Figure 44: Configuration du montage comparant le mode d'opération des colonnes ... 95
Figure 45: Photographie du montage des trois colonnes immergées ... 98
Figure 46: Échantillon de sortie de colonne contenant des boues ... 102
Figure 47: Dépôts de boues dans les conduites d'évacuation des colonnes ... 102
Figure 48: Bilan du phosphore des huit colonnes de biofiltration en 66 jours... 104
Figure 49: Suivi de la concentration de phosphore des colonnes T1 et T2 ... 105
Figure 50: Suivi de l'azote ammoniacal des biofiltre selon le type de copeaux utilisé ... 106
Figure 51: Quantité de phosphore prise en charge selon le type d’eau ... 109
Figure 52: Biofilm dans un biofiltre avec copeaux activés ... 110
Figure 53 : Quantité de phosphore prise en charge selon le pH de la solution ... 111
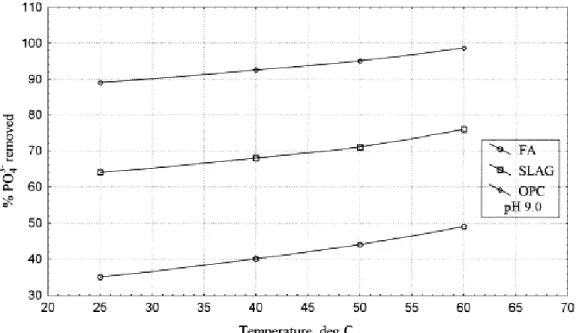
Figure 54: Quantité de phosphore prise en charge en fonction de la température ... 112
Figure 55: Quantité de phosphore pris en charge selon la granulométrie et le sous-produit du bois activé ... 113
Figure 56: Cinétique de prise en charge du phosphore par le bois activé ... 114
Figure 57: Concentration en sortie en KCl en fonction du temps (essai #2) ... 115
Figure 58: Concentration du phosphore en entrée et en sortie des colonnes immersion et percolation ... 117
Figure 59: Concentration du fer à l'entrée et à la sortie des colonnes en immersion et en percolation ... 118
Figure 60: Suivi de la concentration en phosphore à l'entrée et à la sortie des colonnes immergées ... 125
Figure 61: Efficacité de prise en charge du phosphore des colonnes immergées ... 125
Figure 62: Suivi du pH à l'entrée et à la sortie des colonnes immergées ... 126
Figure 63: Suivi du Fer à l'entrée et à la sortie des colonnes immergées ... 126
Figure 64: Suivi de l'azote ammoniacal de la colonne contenant de la broyure activée .... 128
Figure 65: Formation d'un précipité au dessus du garnissage d’une colonne immergée ... 131
Figure 66: Équipements proposés pour le procédé d'activation du bois ... 138
Figure 67: Mélangeur industriel de style batch de la compagnie WAM ... 140
Figure 68: Modélisation du scénario déphosphatation physico-chimique ... 145
Figure 69: Filtre à capture passive garni d’alumine activée ... 146
Figure 70: Filtre immergé garni de sous-produits du bois activé ... 147
Figure 71: Filtre immergé garni de sous-produits du bois activé suivi d'une filtration au sable ... 147
xix Figure 72: Perspective d'utilisation d'un filtre a capture passive en contexte de biofiltration
... 154 Figure 73: Filtre au bois activé immergé avec couche pour retenir les MeS et le fer ... 155 Figure 74: Perspective d'utilisation pour un enlèvement avancé des nutriments ... 156
xxi
Liste des symboles
AGV Acide gras volatil
Al Aluminium
Bio-P Biomasse déphosphatante
Ce Concentration à l’équilibre
Cs Concentration à saturation
Ca Calcium
CRIQ Centre de recherche industriel du Québec CSP Capacité de sorption maximale de phosphore
DBO Demande biologique en oxygène
DCO Demande chimique en oxygène
Fe Fer
FeCl3 Chlorure ferrique
H3PO4 Acide phosphorique
KCl Chlorure de potassium
MDDEP Ministère du Développement durable, de l’Environnement et des Parcs du Québec
MeS Matières en suspension
MVeS Matières volatiles en suspension
N-NH4 Azote ammoniacal
NaOH Hydroxyde de Sodium
NH3 Ammoniaque NO3 Nitrate O Oxygène P Phosphore PHA Poly-β-alcanoate PO4 Phosphate PVC Polyvinyle chloré Q Débit R² Coefficient de corrélation
rpm Révolution par minute
1
CHAPITRE 1 : INTRODUCTION
1.1 Mise en contexte
1.1.1 Spécification du phosphore
La densification de l’occupation du territoire ainsi que l’intensification de l’industrialisation et de l’exploitation agricole connue à l’échelle mondiale ont eu pour conséquence d’affecter le cycle naturel de divers nutriments contenus dans les plans d’eau de surface. Des différents polluants ayant un impact sur la qualité de la ressource hydrique, le phosphore en est un qui attire de plus en plus l’attention. Cette substance, qui est présente dans l’acide désoxyribonucléique (ADN) ainsi que dans plusieurs métabolites intermédiaires, est essentielle à toute forme de vie (Correll, 1998). Le phosphore est très dynamique, capable de se transformer biologiquement et chimiquement à travers une série de processus conceptuels appelés cycle du phosphore (Karam, 2012). La figure 1 présente un diagramme de ce cycle en milieu aquatique. En milieu aqueux, cet élément est généralement retrouvé sous forme particulaire ou soluble. Le phosphore soluble inclut les orthophosphates et les polyphosphates. La forme orthophosphate, souvent nommée phosphate, attire particulièrement l’attention, car il s’agit de la seule forme directement assimilable par les bactéries, les plantes et les algues (Correll, 1998). Les polyphosphates, qui sont les composés ayant deux molécules de phosphore ou plus, se décomposeront plus ou moins rapidement en orthophosphates par hydrolyse (Metcalf & Eddy, 2003). L’appellation « phosphore total » regroupe l’ensemble des formes de phosphore dans l’eau et est la référence dans la règlementation en vigueur (Bourget, 2011).
2
Le phosphore existe à l’état naturel et est exploité par l’homme afin de satisfaire les besoins industriels et agricoles. Les usages du phosphore sont nombreux, mais l’agriculture consomme à elle seule 97% de la production mondiale : 80% pour les engrais, 5% pour l’alimentation du bétail et 12% pour la fabrication de détergents (Castillon, 2005). La production mondiale de phosphate naturel était de 136 millions de tonnes en 1999 (Aubert, 2007). Le phosphore qui est utilisé à des fins industrielles, entre autres pour l’agriculture, provient essentiellement de roche de phosphore. Certaines études prévoient que cette ressource naturelle sera épuisée d’ici 70 ans si d’autres sources ne sont pas découvertes (Isherwood, 2000). Il existe d’autres sources de qualité inférieure, mais qui implique des coûts beaucoup plus grands que l’utilisation des roches de phosphore.
Le phosphore retrouvé dans les eaux de surface provient essentiellement de sources anthropiques (Smith et al., 1999). Ces sources sont essentiellement partagées entre les secteurs urbain, industriel et agricole. Le tableau 1 indique la façon dont sont partagés les rejets de phosphore anthropiques en France.
Tableau 1: Origines des apports anthropiques de phosphore dans les eaux de surface en France (Aubert, 2007)
Origine Années 1985-90 Années 2000 Urbaine 50 % 39 %
Industrielle 25 % 27 %
Agricole 25 % 34 %
Depuis les années 1985-90, les procédés de déphosphatation des stations de traitement d’eaux usées ainsi que l’utilisation de détergents moins riches en phosphore ont contribué à diminuer la part du phosphore urbain et industriel au profit du phosphore d’origine agricole (Aubert, 2007). Les rejets en eaux usées d’origine urbaine constituent une des principales source ponctuelle de phosphore à l’eau de surface (Smith et al., 1999).
3 Le phosphore contenu dans les eaux usées d’origine municipale provient pour l’essentiel des rejets métaboliques humains (urine, fèces), ainsi que de divers détergents ménagers, entre autre ceux utilisés pour les lave-vaisselles (Stricker et al., 2010). Le tableau 2 indique que les rejets journaliers domestiques de phosphore par individu se situent entre 1,2 et 2,1 g Ptot/j.
Tableau 2: Décomposition des rejets domestiques de phosphore par individu (adapté de Stricker et al., 2010)
Origine P Unité Min. Max Valeur retenue
Métabolisme humain g Ptot/(j*individu) 1,2 1,6 1,4
Détergents lessiviels ménagers g Ptot/(j*individu) 0,0 0,1 0,0
Détergents lave-vaisselle
ménagers g Ptot/(j*individu) 0,0 0,4 0,2
Total rejets domestiques g Ptot/(j*individu) 1,2 2,1 1,6
Au Québec, dans les quartiers résidentiels, la quantité d’eau usée envoyée à l’égout représente en moyenne de 200 à 225 l/(personnes * jour) (Brière, 2006). Cependant, si on tient compte des eaux usées provenant des bâtiments qui desservent la collectivité, le débit d’eau usée moyen domestique moyen atteint plutôt 320 l/(personne*jour) (Brière, 2006). Si on considère cette quantité d’eau usée produite journalièrement par individu, il convient d’affirmer que la concentration moyenne de phosphore total dans l’eau usée d’origine municipale est d’approximativement 5 mg Ptot./l. Si on considère que 2-3% des solides
organiques sont constitués de phosphore, alors une eau usée type contenant 20 mg/l de matière en suspension contiendrait environ 0,5 mg/l de phosphore particulaire (Strom, 2007). La reste, soit environ 4,5 mg/l, serait donc constituée de phosphore soluble, soit d’orthophosphate et de polyphosphate.
4
1.1.2 Problématiques reliées au phosphore
En présence d’azote et de carbone, une quantité excessive de phosphore peut conduire à l’eutrophisation d’un plan d’eau. Ce phénomène se définit par l’enrichissement en nutriments associé au vieillissement naturel d’une étendue d’eau, entraînant un ensemble de conséquences néfastes, dans la mesure où cet enrichissement est accéléré par les activités humaines (Bourget, 2011).Le phosphore est particulièrement significatif, car il s’agit généralement de l’élément limitant pour l’eutrophisation dans les milieux naturels d’eaux douces (Correll, 1998). Le concept d’élément limitant signifie que la concentration de l’élément limitant dictera les impacts sur l’écosystème, même si les autres éléments se retrouvent en abondance. Les conséquences de l’eutrophisation d’un plan d’eau sont nombreuses. Elles se caractérisent entre autres par une augmentation de la croissance de plantes et d’algues, une augmentation de la biomasse bactérienne, l’apparition d’espèces indésirables (cyanobactéries), une réduction de la transparence de l’eau qui privent la colonne d’eau de lumière, une diminution de l’oxygène dissous, une augmentation du pH, des problèmes de goût et d’odeur nuisant à la production d’eau potable ainsi que multiples nuisances pour les activités et les organismes aquatiques (Smith et al., 1999). Il est connu que l’eutrophisation peut même conduire à une baisse de diversité biologique des eaux douces (Karam, 2012). En effet, les déficits d’oxygène induits par les fortes concentrations bactériennes et les toxines libérées par les masses d’algues en dégradation peuvent causer la mort de certains poissons et rendre l’eau non sécuritaire pour les oiseaux. Il est aussi possible que des espèces indésirables, mieux adaptées aux nouvelles conditions, prennent la place des espèces aborigènes. De plus, la qualité esthétique des plans d’eau est réduite par la décomposition de la biomasse formée par les algues, ce qui implique une diminution de la profondeur des lacs par une sédimentation accrue, une production d’écume à la surface de l’eau, la prolifération d’insectes nuisibles ainsi que la libération de mauvaises odeurs (Karam, 2012).
5 La présence de phosphore en eau douce a le potentiel d’entraîner un phénomène qui a grandement retenu l’attention au Québec ces dernières années, soit les épisodes d’éclosion de cyanobactéries, aussi nommées algues bleu-vert. Il a été mis en évidence que les surplus de phosphore étaient la principale cause d’éclosion de fleurs d’eau (blooms) de cyanobactéries (MDDEP, 2012 b). Les blooms, qui résultent de la prolifération excessive de cyanobactéries, vont fortement colorer les eaux d’une teinte verte, turquoise ou rougeâtre, tel que présenté à la figure 2. Ces microscopiques entités, qui possèdent à la fois des caractéristiques des bactéries et des algues, ont le potentiel de porter de sérieux risques à la santé des usagers des milieux aquatiques. En effet, certaines espèces vont produire des toxines (cyanotoxines) lorsqu’elles sont présentes en trop grande quantité, dont certaines composantes sont plus toxiques que le venin de cobra (Smith et al., 1999). Les plans d’eau de surface servant de sources d’approvisionnement d’eau potable peuvent aussi être touchés par l’éclosion massive d’algues bleu-vert, causant de sérieux problèmes pour les stations de production d’eau potable concernées. La problématique des algues bleu-vert dans les plans d’eau est un phénomène complexe qui a pris de l’ampleur au cours des dernières années et qui ne pourra être résolu à très court terme (MDDEP, 2012 b).
6
1.1.3 Plan d’action du gouvernement québécois
Devant les problématiques occasionnées par le phosphore et les algues bleu-vert dans les plans d’eau du Québec, le ministère du Développement durable, de l’Environnement et des Parcs (MDDEP) a adopté, en 2009, le Plan d’intervention sur les algues bleu-vert. Dans ce plan d’action, il est prévu de minimiser les apports en phosphore provenant des rejets d’eaux usées, notamment par les actions suivantes (actions 2.5):
Munir d’équipements de déphosphatation les ouvrages municipaux de traitement des eaux usées se déversant dans un lac ou en amont d’un lac lorsque de tels équipements ne sont pas présents, et ce, durant les périodes de l’année où cette protection est nécessaire;
Réviser les exigences de rejet des ouvrages de traitement des eaux usées se déversant dans un lac ou en amont d’un lac lorsque des équipements de déphosphatation sont présents et que la technologie le permet.
L’objectif principal visé par le MDDEP est de définir une action structurée afin de favoriser la mise en place de technologies de déphosphatation appropriées aux endroits où elles sont requises afin de protéger et conserver les nombreux usages récréatifs et utilitaires associés à la ressource eau. Le MDDEP définit les exigences de rejets en phosphore adéquats en fonction de la sensibilité du milieu récepteur, des limitations technologiques, des contraintes économiques, des contraintes liées au développement du territoire municipal ainsi que des contraintes législatives. Les avantages de cette approche sont multiples :
Les acquis et les investissements des programmes d’assainissement des eaux usées sont consolidés;
Elle contribue à la consolidation et à la récupération des usages sensibles du milieu récepteur;
Les exigences en phosphore sont rationalisées en fonction des besoins du milieu récepteur, ce qui évite des dépenses peu profitables ainsi que la consommation inutile de produits chimiques et la génération inutile de boues chimiques.
7 À la lumière des renseignements précédents, les meilleures technologies disponibles compte tenu des contraintes techniques, économiques et environnementales doivent être mises en place afin de réduire les concentrations en phosphore des eaux usées.
Tous les lacs sont visés par la proposition ministérielle. Comme les lacs n’ont pas tous la même sensibilité, le MDDEP a conçu un classement en quatre catégories afin de fixer des exigences de rejets. Les lacs prioritaires sont les plans d’eau ayant connu des épisodes importants ou récurrents d’algues bleu-vert, ou qui sont jugés très sensibles au phosphore. Les lacs préoccupants sont les plans d’eau ayant connu des épisodes localisés d’algues bleu-vert ou n’ayant pas connu tels épisodes, mais où les apports en phosphore sont jugés problématiques à long terme. Les lacs sous surveillance sont des plans d’eau qui n’ont pas connu d’épisodes d’algues bleu-vert, mais où le phosphore doit faire l’objet d’un certain contrôle. Finalement, les lacs exclus sont des plans d’eau caractérisés par une très faible pression humaine ou par des conditions géographiques qui les rendent peu sensibles aux apports en phosphore. Une liste des lacs répertoriés est mise à jour régulièrement par la Direction du suivi de l’état de l’environnement. À noter qu’un lac ne se retrouvant pas dans la liste ne signifie pas qu’il n’est pas visé, mais que son classement reste à déterminer. Le tableau 3 présente les exigences de rejets en fonction du classement du milieu récepteur. Il est à noter que ces exigences de déphosphatation s’appliquent à tous les rejets d’eaux usées domestiques d’origine municipale, institutionnelle ou privée qui se déverse dans un milieu sensible comme un lac ou l’amont d’un lac.
8
Tableau 3: Exigence en fonction du classement du point de rejet (MDDEP, 2012 c)
Afin de prioriser les actions prévues par ce plan d’intervention :
Les municipalités rejetant leurs effluents en amont ou dans un lac et qui ont à se doter de nouveaux équipements doivent se conformer aux nouvelles exigences de rejet formulées dans la position du Ministère au plus tard le 1er janvier 2017;
Les municipalités qui rejettent leurs effluents dans un bassin versant en surplus de phosphore et qui ont à se doter de nouveaux équipements doivent se conformer aux nouvelles exigences de rejet formulées dans la position du Ministère au plus tard le 1er janvier 2018.
Tous les détails concernant le Plan d’intervention sur les algues bleu-vert se retrouvent sur le site internet du MDDEP (MDDEP, 2012 c).
9
CHAPITRE 2 : ÉTAT DES CONNAISSANCES
2.1 Méthodes conventionnelles d’enlèvement du phosphore
Il existe plusieurs procédés de déphosphatation qui sont largement utilisés à travers le monde. Dans tous les cas, ces procédés consistent à fixer les ions phosphates dans ou sur des solides qui seront ensuite séparés de l’effluent (de-Bashan et Bashan, 2004). Le terme utilisé sera alors déphosphatation. Selon la méthode utilisée, ces solides peuvent prendre la forme d’un précipité de sel métallique insoluble, des substances ayant de fortes affinités chimiques pour le phosphore, de biomasse bactérienne ou de biomasse végétale. La présente section vise à répertorier et à décrire les principales technologies connues servant à retirer le phosphore de l’eau usée. Il est à noter que cette liste est non-exhaustive.
2.1.1 Déphosphatation biologique
Comme il a été mentionné précédemment, le phosphore est essentiel à toute forme de vie. Il est donc possible, sous certaines conditions, d’effectuer une déphosphatation par certains agents biologiques, soit les bactéries ou les plantes. La présente section vise donc à répertorier les principaux procédés biologiques servant à la déphosphatation de l’eau usée.
10
2.1.1.1 Déphosphatation biologique par biomasse bactérienne
Depuis les années 70, l’amélioration des connaissances des mécanismes biologiques a permis de concevoir divers procédés de type boues activées permettant d’effectuer une déphosphatation pouvant atteindre des concentrations aussi basses que 0,1 mg/l à l’effluent (Strom, 2007). Cette déphosphatation est effectuée par des bactéries accumulatrices de phosphate (Bio-P) qui sont en mesure d’accumuler jusqu’à 10% de leur masse en phosphore sous certaines conditions, comparativement à environ 2% pour les bactéries utilisées dans les systèmes de boues activées classiques (Déronzier et Choubert, 2002). De manière générale, le mécanisme de déphosphatation biologique repose sur le passage des bactéries Bio-P dans une séquence de réacteur anaérobie, donc sans oxygène ni nitrate, et de réacteur anoxie ou aérobie, contenant de l’oxygène ou des nitrates. Plusieurs configurations, telles qu’illustrées à la figure 3, permettent la déphosphatation biologique en boues activées. Il est à noter que l’enlèvement de l’azote est généralement effectué conjointement à la déphosphatation.
Figure 3: Systèmes de boues activées effectuant la déphosphatation (Metcalf & Eddy, 2003)
11
En plus de posséder une certaine concentration de phosphore dans leur enveloppe cellulaire comme toutes les autres cellules, les bactéries Bio-P ont la propriété d’emmagasiner des réserves de polyphosphate sous forme de granules intracellulaires, servant de source d’énergie. En condition anaérobie, celles-ci vont synthétiser un produit de réserve énergétique, les poly-β-alcanoates (PHA), à partir de substrat facilement biodégradable, entre autres l’acide gras volatile (AGV). À noter que des bactéries anaérobies fermentatrices vont avoir un rôle à jouer dans ce procédé en transformant une partie de la matière biodégradable en AGV. Afin de produire les PHA, les bactéries Bio-P utilisent l’énergie libérée par l’hydrolyse intracellulaire de leur réserve de polyphosphate, relargant ainsi des phosphates dans le milieu externe. La figure 4 permet de visualiser les mécanismes des bactéries Bio-P en condition anaérobie.
Figure 4: Biomasse déphosphatante en condition anaérobie (Baljic-Zelovic et Leduc, 2002)
12
Quand ces bactéries Bio-P seront en milieu aérobie, celles-ci vont oxyder leur réserve de PHA et la matière organique présente dans l’eau usée pour leurs activités métaboliques ainsi que pour refaire une réserve de polyphosphate encore plus importante que celle initiale. L’élimination du phosphore est donc liée à une réabsorption en condition aérobie plus importante que le relargage en condition anaérobie (Déronzier et Choubert, 2002). La figure 5 permet de visualiser les mécanismes des bactéries Bio-P en condition aérobie.
Figure 5: Biomasse déphosphatante en condition aérobie (Baljic-Zelovic et Leduc, 2002)
13 La plupart de ces bactéries seront évacuées avec les boues du décanteur secondaire, entrainant avec elles le phosphore qu’elles auront puisé de l’eau usée. Il y aura des recirculations de boues afin d’être assuré d’avoir continuellement des bactéries Bio-P dans le système. La figure 6 présente l’évolution de la concentration de phosphore durant la phase aérobie et la phase anaérobie.
Figure 6: Courbe de relargage et de réabsorption du phosphore (adapté de Déronzier et Choubert, 2002)
Comme la déphosphatation biologique en contexte de boues activées n’est pas l’objet principal de ce travail, les critères de conceptions et les facteurs affectant les performances des systèmes ne seront pas abordés.
14
2.1.1.2 Déphosphatation biologique dans les systèmes à milieu fixe
Si la déphosphatation biologique des eaux usées a grandement été étudiée dans les systèmes à biomasse en suspension, elle l’a été beaucoup moins dans les systèmes à milieu fixe. Dans ce type de système, un biofilm composé de biomasse se développe sur un support fixe. Les biofiltres sur support organique, tel que le système BIOSORMD, font partie de ce type de procédé.
Le problème majeur pour la déphosphatation biologique en contexte de milieu fixe réside dans la difficulté à exposer la biomasse fixée à une alternance d’anaérobiose et d’aérobiose, essentiel pour les bactéries Bio-P (Baljic-Zelovic et Leduc, 2002). Sans cette alternance, le maximum de prise en charge en phosphore est d’environ 20% (Baljic-Zelovic et Leduc, 2002). Dans un système de boues activées, cette alternance est accomplie par l’espace alors que dans un biofilm, celle-ci est réalisée dans le temps. Cette contrainte rend la croissance des bactéries Bio-P particulièrement difficile dans un réacteur à milieu fixe opérant en condition continue (Baljic-Zelovic et Leduc, 2002). Même si divers travaux ont réussi à obtenir une alternance de ces conditions, la déphosphatation biologique peut être limitée par deux situations (Baljic-Zelovic et Leduc, 2002). La première est que la source de substrat facilement biodégradable sera limitée par la disponibilité de l’affluent à traiter, ce qui limitera la quantité de phosphore relargué lors de la phase anaérobie. Deuxièmement, la charge de phosphore introduite instantanément lors de la phase aérobie se montre plus faible que la capacité maximale d’accumulation de la biomasse en contexte de milieu fixe. Dans le cas des biofiltres sur support organique, un problème encore plus fondamental se pose, car les boues, qui pourraient contenir les bactéries Bio-P, ne sont jamais évacuées du système, rendant impossible une déphosphatation biologique efficace. De plus, le phosphore issu de la lyse cellulaire sera de nouveau rendu disponible pour les nouvelles cellules, ce qui implique une saturation du phosphore dans le biofiltre quand l’équilibre cellulaire sera atteint.
En résumé, la déphosphatation biologique efficace en contexte de systèmes en milieux fixes soulève plusieurs défis de taille qui restent à élucider.
15
2.1.1.3 Déphosphatation biologique végétale Microphytes
Diverses recherches ont été orientées vers l’utilisation de microalgues, dits microphytes, afin d’effectuer la déphosphatation des eaux usées. Cependant, tous ces travaux se sont heurtés à une problématique de taille, soit la difficulté à récolter ces microorganismes flottants une fois le traitement effectué (de-Bashan et Bashan, 2004). À la lumière de la revue de littérature effectuée par de-Bashan et Bashan (2004), peu d’avancées technologiques intéressantes ont été faites dans cette direction au courant des dernières décennies.
Macrophytes
Il a été démontré que certaines plantes aquatiques macrophytes ont des capacités de prise en charge en phosphore importantes. de-Bashan et Bashan (2004) ont révélé que certaines jacinthes d’eau étaient en mesure de prendre en charge 8 mg P/g sec. Des résultats intéressants ont été obtenus en introduisant des plantes aquatiques flottantes, telles les jacinthes d’eau ou les lenticules, à la surface d’étangs aérés. Un projet de démonstration utilisant des jacinthes d’eau a été mené au Québec à St-Élie-d’Orford par le Groupe Steica en 1996 a démontré qu’il était possible d’enlevé 200 mg P/jour*m² à partir de cette technologie (MDDEP, 2001). Afin de réaliser une déphosphatation efficace, ce type de système requiert qu’on retire régulièrement une partie des plantes du bassin, soit environ 2 fois par mois (MDDEP, 2001). Cette opération est communément appelée faucardage. Cependant, les conditions climatiques québécoises faisant en sorte que ces plantes sont efficaces pour la prise en charge du phosphore pour une période qui couvre les mois de juin à octobre, cette solution ne peut constituer une solution pour la déphosphatation au Québec.
16
Les macrophytes plantés démontrent aussi des capacités de prise en charge en phosphore intéressantes, et ce, particulièrement dans les systèmes d’épuration de type marais filtrant artificiels. En effet des travaux ont démontré qu’il était possible d’abattre la concentration de phosphore d’un effluent à plus de 98% (Drizo et al., 1997). Sommairement, le principe de fonctionnement de ces marais filtrants consiste à faire circuler l’eau usée dans un lit de gravier ou de sable planté par des macrophytes. L’eau traitée sera collectée à la sortie du système et les plantes seront faucardées à la fin de leur période de croissance. La figure 7 présente un schéma de ce type de système.
Figure 7: Coupe transversale d'un marais filtrant artificiel (Poulet et al., 2004)
Étant efficace pour l’enlèvement de la matière organique et des produits azotés, peu dispendieux et simple d’opération, l’utilisation de marais filtrant artificiel attire actuellement l’attention de plusieurs chercheurs. Toutefois, si les normes sont en vigueur à l’année longue, le concept n’est pas viable, car le cycle de croissance des plantes ne couvre pas la période hivernale. De nombreux travaux s’intéressent présentement aux substrats dans lesquels sont plantées les macrophytes qui auraient des capacités de prise en charge en phosphore importantes. Le mécanisme de capture de phosphore est alors un hybride entre le biologique et la capture passive. Le second mécanisme sera développé dans la section 2.2.
17
2.1.2 Déphosphatation par produits chimiques
La majorité des stations d’épuration qui pratiquent la déphosphatation utilisent des procédés qui font appel à l’injection de produits chimiques dans le but de faire précipiter les ions phosphates (de-Bashan et Bashan, 2004). Le précipité sera par la suite séparé de l’effluent par décantation ou par filtration. Ces méthodes sont souvent appelées déphosphatation physico-chimique. Au Québec, ces procédés sont généralement utilisés dans des stations d’épuration de type physico-chimique, étangs aérés, boues activées, disques biologiques et biofiltration (MDDEP, 2001). Les principales caractéristiques à considérer pour ce type de système sont les produits chimiques utilisés, le dosage requis, le point d’injection, les équipements requis ainsi que les boues produites (MDDEP, 2001).
2.1.2.1 Produits chimiques utilisés
Dans la majorité des cas, des sels métalliques trivalents sont utilisés. Ces produits, généralement distribués sous forme liquide, sont le sulfate d’aluminium (Al2(SO4)3*7H2O)
(aussi connu sous le nom d’alun), le chlorure ferrique (FeCl3) ainsi que le sulfate ferrique
(Fe2(SO4)3*9H2O). Les réactions des ions de fer et d’aluminium pour la précipitation des
ions phosphates sont respectivement présentées aux équations 1 et 2. (1)
18
La chaux (CaO ou Ca(OH)2), anciennement largement utilisée en raison de son faible coût,
l’est maintenant beaucoup moins en raison de la masse de boue produite qui devient beaucoup plus importante qu’avec l’utilisation des sels métalliques (Metcalf & Eddy, 2003). De plus, divers problèmes reliés aux opérations et à la manutention du réactif font en sorte que ce produit est maintenant très rarement utilisé (Metcalf & Eddy, 2003). Un autre désavantage important relié à son utilisation est qu’il s’agit d’un produit peu soluble dans l’eau (1,65 g/l à 20°C), soit 220 fois plus basse que la solubilité de l’alun et 550 fois plus basse que celle du chlorure ferrique (Rybicki, 1997). La réaction des ions de calcium pour la précipitation des ions phosphates est présentée à l’équation 3. Le produit formé est l’hydroxyapatite.
(3)
Il est à noter que le pH est un paramètre très important dans cette réaction en raison de la forte compétitivité de l’ion carbonate (CO32-), qui sera aussi précipité par le calcium. Un pH
de 7,5 – 8,5 sera idéal pour la précipitation du phosphore, alors qu’un pH situé entre 9 et 11 favorisera la précipitation des carbonates, créant donc un précipité à faible concentration en phosphore (de-Bashan et Bashan, 2004).
19
2.1.2.2 Dosage
En raison des particularités des eaux à traiter, qui ont des pH spécifiques et qui contiennent certains éléments susceptibles d’être compétiteurs pour la précipitation du phosphore, le dosage requis ne peut être établi de façon précise à partir de calculs théoriques (MDDEP, 2001). Afin d’avoir un dosage idéal, des essais en laboratoire de type « Jar Test » sont requis. Dans le cas du fer, le ratio massique théorique Fe : P de la réaction de précipitation est de 1,8 : 1 alors que pour l’aluminium, le ratio Al : P est de 0,87 : 1. Toutefois, en raison des réactions compétitrices, les ratios massiques M : P doivent être beaucoup plus élevés afin d’effectuer un enlèvement plus complet du phosphore. Metcalf & Eddy (2003) proposent des valeurs de ratio aluminium : phosphore afin d’obtenir un enlèvement du phosphore désiré (tableau 4).
Tableau 4: Ratio aluminium : phosphore requis pour différentes réductions du phosphore (Metcalf & Eddy, 2003)
Réduction du phosphore (%) Ratio molaire typique Al : P
75 1,4 : 1
85 1,7 : 1
95 2,3 : 1
20
2.1.2.3 Point d’injection des produits chimiques
Il existe plusieurs configurations pour l’injection et le mélange des produits chimiques utilisés pour la déphosphatation selon la disposition de la filière de traitement. Mis à part les filières d’épuration de type physico-chimique, qui repose essentiellement sur l’injection de produits chimiques coagulants et sur la décantation, Metcalf & Eddy (2003) répertorie trois configurations possibles pour l’injection de produits chimiques. Ces configurations sont illustrées à la figure 8.
Figure 8: Différents points d'injection de produits chimiques (adapté de Metcalf & Eddy, 2003)
21 Dans la pré-précipitation, première configuration de la figure 8, les produits chimiques sont injectés en amont du décanteur primaire. Le phosphore précipité sera alors retiré avec les boues primaires. Selon Metcalf & Eddy, les avantages de cette configuration sont qu’elle peut être applicable pour la plupart des filières d’épuration, que l’enlèvement de la DBO et des MES sera amélioré et que c’est la configuration qui permettra à moins d’ions métalliques de sortir avec l’effluent. Par contre, cette configuration a comme inconvénient d’être moins efficace pour la précipitation du phosphore en raison des nombreuses substances compétitrices présentes dans l’eau brute, de nécessiter des polymères pour la floculation et de rendre les boues primaires plus difficiles à déshydrater.
Dans la co-précipitation, deuxième configuration de la figure 8, les produits chimiques sont injectés en amont ou en aval du réacteur biologique. Le phosphore précipité sera retiré en même temps que les boues biologiques. Dans le cas d’un système de type étang aéré, l’injection de produits chimiques se fait souvent entre l’avant-dernier et le dernier étang (MDDEP, 2001). Toujours selon Metcalf & Eddy, les avantages de cette configuration sont qu’elle engendrera les coûts les plus faibles en raison de l’utilisation de moins de produits chimiques, qu’elle améliorera la stabilité des boues secondaires et que les polymères ne seront pas requis pour la floculation. Par contre, cette configuration entraîne une forte consommation d’alcalinité, donc un système de contrôle de pH peut être requis. De plus, des solides inertes seront ajoutés à la liqueur mixte dans le cas d’un système de type boues activées, ce qui est indésirable.
Finalement, dans la post-précipitation, troisième configuration de la figure 8, l’injection de produit chimique est faite en aval du décanteur secondaire. Dans ces cas, la séparation solide-liquide est faite par filtration au sable ou membranaire en raison de la faible taille des flocs qui rend plus difficile la sédimentation (Metcalf & Eddy, 2003). Les avantages de cette configuration sont qu’elle sera en mesure d’obtenir la plus faible concentration de phosphore à l’effluent. Par contre, c’est la configuration la plus dispendieuse et qui entraînera le plus d’ions métalliques à l’effluent de la station.
22
2.1.2.4 Équipements requis
Les équipements généralement requis sont un bassin d’emmagasinement de produit chimique, des pompes doseuses, un système de régulation, une unité de séparation solide-liquide et dans certains cas, une unité de mouillage et de mélange si le sel métallique est utilisé sous forme solide ou si un polymère est utilisé.
Le bassin d’emmagasinement de produits chimiques devrait permettre d’avoir une autonomie d’au moins 10 à 14 jours ou correspondant à environ 1,5 fois le volume de livraison prévu (MDDEP, 2001). Les pompes doseuses doivent être en mesure de répondre à toutes les conditions de débits et de charges susceptibles de connaître la station.
Le point d’injection doit se faire dans une zone de forte agitation afin d’assurer une bonne dispersion des produits chimiques, suivi d’une zone d’agitation moyenne qui permettra la floculation tout en évitant un brassage excessif qui détruirait les flocs. Certains équipements peuvent être prévus afin d’améliorer le mélange du produit chimique à l’eau usée. De plus, tous les matériaux composant le système de dosage doivent être en mesure de résister à la nature corrosive des produits chimiques utilisés, en mesure de protéger les produits chimiques du gel et d’être aménagés de manière à faciliter le nettoyage (MDDEP, 2001).
Afin de doser les produits chimiques, différents modes de régulation sont disponibles, soit le dosage manuel, le dosage proportionnel au débit, le dosage préprogrammé ou le système à rétroaction (MDDEP, 2001).
La séparation solide-liquide se fait généralement à l’aide de décanteurs. Il est préférable d’y prévoir une zone de floculation. Il est important de prendre en considération le volume de boues produites par la déphosphatation ainsi que de l’incidence que ce procédé aura sur les caractéristiques des boues. Il faudra prévoir l’équipement relié au traitement des boues, soit l’épaississement, la déshydratation et l’évacuation. Finalement, si une concentration de phosphore à la sortie inférieure à 0,5 mg/l est requise, il sera généralement nécessaire de procéder à une décantation tertiaire ou à la filtration de l’effluent (MDDEP, 2001).
23
2.2 Systèmes de capture de phosphore passifs
Dans un contexte où les débits à traiter sont de faible importance, les techniques de déphosphatation précédemment présentées sont plus ou moins applicables, notamment en raison des coûts importants reliés à l’acquisition du matériel requis ainsi que de la complexité des opérations nécessitées. Afin de répondre aux besoins des petites installations ayant un budget et une main d’œuvre limitée, plusieurs travaux se sont intéressés à la déphosphatation par des filtres à capture passive. La présente section vise à décrire les mécanismes de déphosphatation au sein de ces filtres, présenter brièvement certains matériaux utilisés, décrire les méthodes ainsi que les modèles utilisés afin de prédire les capacités de prise en charge de phosphore des matériaux, exposer les facteurs affectant la performance des ces filtres et finalement certaines considérations générales par rapport à ces systèmes.
2.2.1 Mécanismes de déphosphatation des systèmes à capture passive
Le principe général de la capture passive consiste à accumuler une substance problématique au sein d’un filtre composé de matériaux ayant une forte affinité chimique pour le polluant. On dit qu’il y aura rétention du polluant, qui se définit comme le passage d’une espèce chimique d’une phase liquide à une phase solide (Dubus, 1997). Le média filtrant sera en mesure de prendre en charge le polluant jusqu’à ce qu’il soit saturé, après quoi celui-ci devra être remplacé ou régénéré. Afin de limiter les remplacements, il est donc important que le média filtrant ait une forte capacité de prise en charge pour le polluant (Cucarella et Renman, 2009). Il est aussi important de considérer les propriétés physiques du média filtrant. En effet, sa surface spécifique est un paramètre très significatif, car les mécanismes de prise en charge sont, pour la plupart, des phénomènes de surface. La forme des particules, leur taille ainsi que leur porosité vont définir sa surface spécifique (Cucarella et Renman, 2009).
24
Comme les mécanismes agissants au sein de ces filtres sont variables et qu’ils ne sont pas toujours bien connus, il est généralement convenu de parler de sorption. Ce terme désigne une combinaison d’adsorption, d’échange d’ions et de précipitation (Cucarella et Renman, 2009). Il est connu que les trois éléments actifs pour la sorption du phosphore sont le fer (Fe), l’aluminium (Al) et le calcium (Ca) (Johansson Westholm, 2006). Les mécanismes de prise en charge du phosphore par le Fe et l’Al sont assez similaires alors que l’action du Ca est différente.
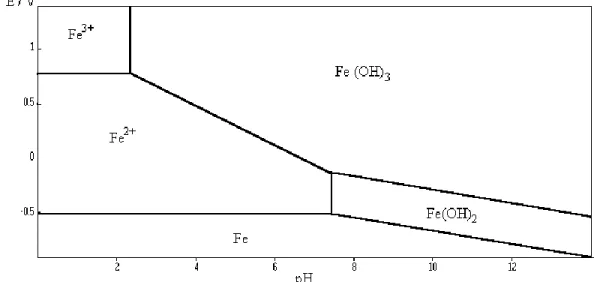
Il est connu que les formes de Fe et d’Al ayant le plus d’affinité pour le phosphore sont les oxyhydroxyde, aussi appelés sesquioxydes (Karam, 2012). Les sesquioxydes métalliques sont composés d’un assemblage compact d’ions oxygène et/ou hydroxyle (OH-) qui contiennent des ions métalliques dans leur cavité octaédrique (Dubus, 1997). L’hydroxyde de fer (Fe(OH)3) et l’oxyde d’aluminium (Al2O3) sont des exemples de sesquioxyde. En
milieux hydratés, de nombreuses études ont démontré que les oxyhydroxydes peuvent avoir une interaction avec les ions phosphates en remplaçant un de leurs groupements hydroxyles par un anion d’orthophosphate (Dubus, 1997; Karam, 2012). Il y aura alors une liaison chimique directe entre l’ion phosphate et l’ion métallique. Selon les sources, on parle alors d’adsorption spécifique (Dubus, 1997) ou d’échange ionique (Karam, 2012). La figure 9 illustre la réaction décrite.
Figure 9: Liaison chimique d'un ion phosphate avec un sesquioxyde (adapté de Karam, 2012)
Un autre phénomène, nommé attraction électrostatique, peut se manifester en milieu acide, soit lorsque le pH de la solution est inférieur à 5,5. Dans ces conditions, la charge nette de la surface des sesquioxydes deviendra positive et sera alors propice à former des liaisons électrostatiques avec les ions phosphates, qui sont chargés négativement (Karam, 2012). La figure 10 illustre la réaction décrite.
25
Figure 10: Attraction électrostatique d'un ion phosphate avec un sesquioxyde (adapté de Karam, 2012)
L’échange ionique et l’attraction électrostatique avec les sesquioxydes peuvent aussi s’accomplir avec d’autres anions, tels que l’arsenic, le chrome, le fluorure, le molybdène, le sélénite, le sulfate, le silicate ainsi que la matière organique (Dubus, 1997). Ces composés sont donc tous susceptibles d’être des compétiteurs du phosphore pour les sites de fixation sur les sesquioxydes. La force d’attraction est cependant différente pour les différents ions. Les sesquioxydes peuvent avoir une structure cristalline ou amorphe, soit sans organisation particulière. Il est connu que la forme amorphe peut prendre en charge beaucoup plus d’ions d’orthophosphates que les formes bien cristallisées (Dubus, 1997). Cela s’explique par le fait que la surface spécifique des sesquioxydes amorphes est beaucoup plus importante que les formes cristallisées et parce que les cristaux ont une charge de surface qui est nulle. De plus, certaines études font part d’une précipitation des ions d’orthophosphates par les ions métalliques au sein de ces filtres (Robertson et Lombardo, 2011). Il est connu qu’en milieu anaérobie, où le potentiel d’oxydoréduction est faible ou négatif, le fer solide peut retourner en solution (Karam, 2012). La précipitation des ions phosphates sera alors possible. Selon le contexte, il est donc possible d’obtenir une synergie entre l’échange ionique, l’attraction électrostatique et la précipitation.
26
Dans les cas des matériaux composés de calcium, les auteurs s’entendent généralement sur le fait que le mécanisme de prise en charge du phosphore dominant est la précipitation (Vohla et al., 2011). Un article de Comeau et al. (2006) relate qu’il est aussi possible de produire des liaisons électrostatiques avec les molécules contenant du calcium, tel que présenté à la figure 11. Le calcium, retrouvé sous forme de CaO, de CaSO4 ou de CaCO3,
se solubilisera progressivement afin de faire précipiter les ions d’orthophosphates (Chen et al., 2007). Le produit formé est généralement l’hydroxyapatite (Comeau et al., 2006). La figure 11 illustre le mécanisme de prise en charge des orthophosphates par le calcium provenant de CaO.
Figure 11: Mécanismes du phosphore avec le Calcium (adaptéde Comeau et al., 2006)
Lors de cette réaction, des ions OH- sont remis en solution, ce qui fait augmenter le pH de l’eau. De plus, les ions carbonates en solution (HCO3-) précipiteront avec les ions de Ca
pour former du carbonate de calcium (CaCO3). Ces ions sont souvent présents en
abondance dans les milieux aqueux, car ils proviennent entre autres de la solubilisation du CO2 atmosphérique (Comeau et al., 2006). Il est à noter que les composés de calcium n’ont
pas tous le même niveau de réactivité. En ordre croissant de réactivité, on aura le CaCO3,
27
2.2.2 Média de déphosphatation utilisés dans la littérature
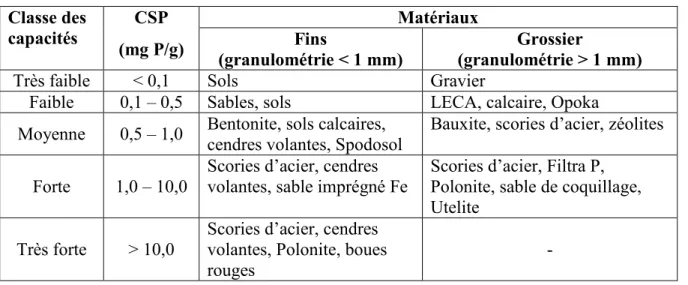
Depuis près de deux décennies, de multiples travaux ont porté sur des matériaux ayant des capacités de sorption du phosphore (CSP) susceptibles de constituer le garnissage de filtres à capture passive (Johansson Westholm, 2006). Une revue de littérature, produite par Vohla et al. (2011), répertorie 64 articles concernant des travaux qui ont porté sur la capture passive du phosphore alors qu’un travail effectué par Cucarella et Renman (2009) répertorie 41 produits différents ayant été étudiés pour cette fin. Ces produits ont tous en commun de contenir de fortes concentrations de Fe, d’Al ou de Ca. De manière générale, les matériaux potentiels pour les filtres à capture passive de phosphore peuvent être divisés en trois groupes, soit les produits naturels, les sous-produits industriels et les produits manufacturés (Johansson Westholm, 2006). Cucarella et Renman (2009) ont effectué une classification des médias déphosphatants en fonction de leur CSP et la taille de leur particule (tableau 5). Cette section vise à présenter une vue d’ensemble des différents médias qui ont été étudiés dans la littérature ainsi que de faire ressortir ceux qui sont le plus prometteur.
Tableau 5: Classification de matériaux en fonction de leurs capacités de sorption de phosphore et de leur granulométrie (adapté de Cucarella et Renman, 2009)
Classe des capacités
CSP Matériaux
(mg P/g) (granulométrie < 1 mm) Fins (granulométrie > 1 mm) Grossier
Très faible < 0,1 Sols Gravier
Faible 0,1 – 0,5 Sables, sols LECA, calcaire, Opoka Moyenne 0,5 – 1,0 Bentonite, sols calcaires,
cendres volantes, Spodosol
Bauxite, scories d’acier, zéolites
Forte 1,0 – 10,0
Scories d’acier, cendres volantes, sable imprégné Fe
Scories d’acier, Filtra P, Polonite, sable de coquillage, Utelite
Très forte > 10,0
Scories d’acier, cendres volantes, Polonite, boues rouges