CAPTURE PASSIVE DU PHOSPHORE D’UNE EAU
USÉE MUNICIPALE EN CONTEXTE DE
BIOFILTRATION
Mémoire
GABRIEL ROY-DUMESNIL
Maîtrise en génie des eaux
Maître ès sciences (M. Sc.)
Québec, Canada
iii
Résumé
En concentration excessive, le phosphore rejeté à l’environnement favorise la croissance anormalement rapide de la flore aquatique. Des efforts doivent donc être faits pour développer des traitements qui permettront d’abaisser la concentration des rejets à des valeurs pouvant être aussi basses que 0,3 mgPtot/L. En ce sens, des travaux de recherche ont été réalisés.
La méthodologie utilisée est basée sur l’utilisation d’un média filtrant constitué de broyure de bois activée imprégnée d’hydroxyde de fer à sa surface. Des essais en colonne ont été réalisés à partir de ce média filtrant. Opérées en immersion durant plus de 250 jours, des colonnes ont été alimentées avec une eau synthétique dopée en phosphore.
Par ces essais, il a été mis en évidence que les colonnes opérées en milieu anaérobie sont plus efficaces que les colonnes opérées en aérobie. L’absence d’oxygène entraine une chute progressive du potentiel d’oxydoréduction. Lorsqu’il atteint des valeurs de l’ordre de -100mV, le fer en surface de la broyure se réduit et passe de la forme Fe3+ à la forme Fe2+. La
forme Fe2+ étant plus soluble que la forme Fe3+, il y a donc une augmentation de la
concentration en fer dissout. Appelé dissolution réductive, ce phénomène lent permet la complexation du fer solubilisé avec les ions phosphates en solution. C’est la combinaison de l’adsorption et de la complexation du fer qui permet d’obtenir un média performant. Sur une période de 291 jours, la colonne opérée en anaérobie a permis de maintenir à 85% l’enlèvement du phosphore. Puisque le phénomène de dissolution réductive entraine des relargages de fer et de phosphate ferrique à la sortie de la colonne, le contrôle de ces relargages par l’ajout d’une zone aérobie permet une hausse de la performance globale d’enlèvement du phosphore pour un % d’enlèvement global de 95%.
v
Table des matières
RÉSUMÉ ... III
TABLE DES MATIÈRES ... V
LISTE DES TABLEAUX ... IX
LISTE DES FIGURES ... IXIII
LISTE DES SYMBOLES ... XVII
REMERCIEMENTS ... XIX
1. INTRODUCTION ... 1
1.1 SPÉCIFICATION SUR LE PHOSPHORE ... 1
1.2 IMPACTS SUR L’ENVIRONNEMENT ... 2
1.3 POSITION MINISTÉRIELLE ... 4
2. ÉTAT DES CONNAISSANCES ... 7
2.1 MÉTHODES CONVENTIONNELLES DE DÉPHOSPHATATION ... 7
2.1.1 Physique ... 7
2.1.2 Physico-chimique ... 8
2.1.3 Biologique ... 8
2.2 LA CAPTURE PASSIVE DU PHOSPHORE ... 9
2.2.1 Mécanismes d’enlèvement : La sorption ... 9
2.2.1.1 Fer et aluminium ... 10
2.2.1.2 Calcium ... 12
2.2.2 Facteurs influençant la CSP ... 12
2.2.2.1 Temps de rétention hydraulique ... 12
2.2.2.2 Température ... 13
2.2.2.3 Granulométrie ... 13
2.2.2.4 Le pH ... 14
2.2.3 Les médias à capture passive... 14
2.2.3.1 Médias naturels ... 15
2.2.3.2 Médias provenant de sous-produits industriels ... 18
2.2.3.3 Médias synthétiques ... 24
2.2.3.4 Médias activés ... 26
2.2.3.5 Synthèse ... 29
2.3 DÉVELOPPEMENT AU CRIQ ... 30
3. OBJECTIFS ... 33
vi
4.1 MATÉRIEL ET MÉTHODOLOGIE ... 34
4.1.1 Caractérisation du garnissage ... 40
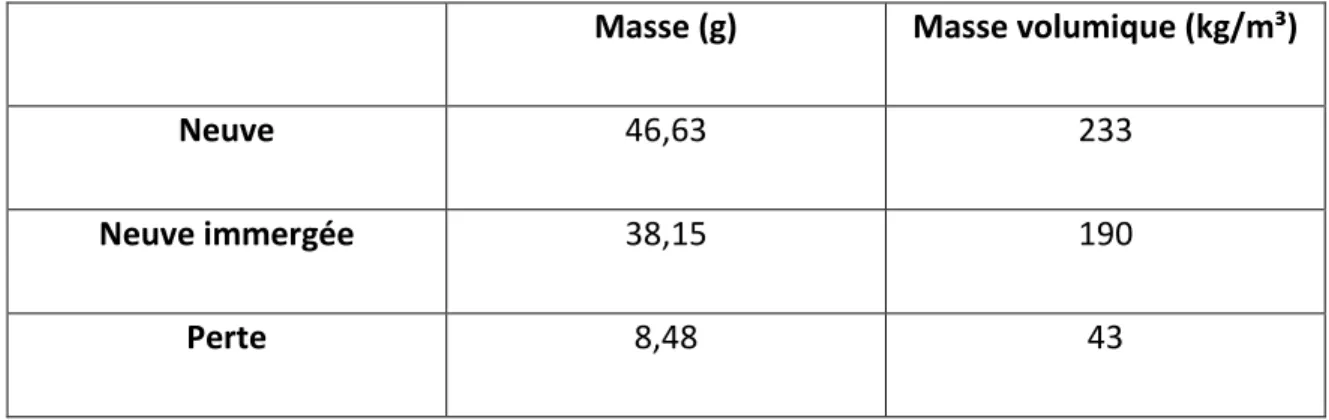
4.1.1.1 Masse volumique ... 41
4.1.1.2 Isotherme d’absorption... 41
4.1.1.3 Masse de fer par gramme sec de garnissage ... 42
4.1.1.4 Sel en surface de la broyure ... 42
4.1.2 Suivi analytique et échantillonnage ... 43
4.2 RÉSULTATS ... 45
4.2.1 Caractérisation du garnissage ... 45
4.2.1.1 Masse volumique ... 45
4.2.1.2 Isotherme d’adsorption... 46
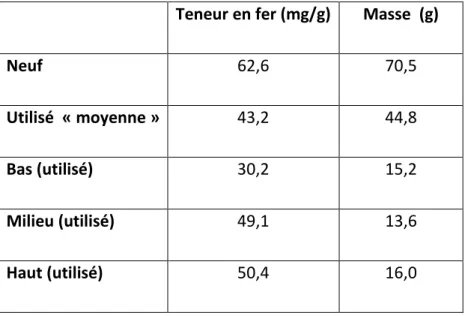
4.2.1.3 Masse de fer par gramme sec de garnissage ... 47
4.2.1.4 Sel en surface de la broyure activée ... 47
4.2.2 Suivi des colonnes ... 50
4.2.2.1 Colonne C1 : anaérobie ... 50
4.2.2.2 Colonne C2 : aérobie ... 56
4.2.2.3 Colonne C3 : hybride ... 59
4.2.3 Conclusion ... 63
5. ESSAIS SUR L’OXYDATION DU FER PAR UNE ZONE AÉROBIE ... 65
5.1 MATÉRIEL ET MÉTHODOLOGIE ... 65
5.1.1 Suivi analytique et échantillonnage ... 68
5.1.2 Méthodologie pour le calcul des bilans de masse ... 70
5.1.3 Analyse des boues (relargage de fer)... 72
5.1.4 Analyse du ganrissage ... 73
5.2 RÉSULTATS ... 74
5.2.1 Comportement à long terme de la colonne anaérobie C1 ... 74
5.2.1.1 Suivi de la colonne anaérobie C1 ... 74
5.2.1.2 Analyse des boues ... 81
5.2.1.3 Analyse au démantèlement de la colonne ... 82
5.2.1.4 Analyse des garnissages neufs et usagés ... 86
5.2.2 Oxydation du fer et capture du phosphore résiduel par une zone aérobie sous forme de filtre percolateur ... 89
5.2.2.1 Suivi analytique ... 89
5.2.2.2 Performance globale de déphosphatation ... 93
5.2.2.3 Analyse du garnissage neuf et usagé ... 94
6. CONCLUSIONS ET LIMITES... 97
7. RECOMMANDATIONS ... 101
7.1 ACTIVATION DE LA BROYURE ... 101
7.2 LES PARAMÈTRES D’OPÉRATION ... 102
vii
7.3.1 Effectuer une recirculation de l’eau en sortie de la colonne ... 104
7.3.2 Composition et opération de la zone aérobie ... 104
7.3.3 Combiner les zones aérobie et anaérobie en une seule colonne ... 104
7.3.4 Échantillonnage ... 105
7.4 RÉGÉNÉRATION DU MÉDIA ET RÉCUPÉRATION DU P ... 106
8. RÉFÉRENCES... 107
ANNEXE A : INFLUENCE DE LA MÉTHODE DE STABILISATION DE LA BROYURE ... 115
ANNEXE B : ACTIVATION DE LA BROYURE ... 117
ANNEXE C : DÉTERMINATION DE LA MASSE VOLUMIQUE DU MÉDIA FILTRANT ... 119
ANNEXE D : ISOTHERME D’ADSORPTION ... 121
ANNEXE E : ESSAI SUR LE RINÇAGE DE LA BROYURE ... 125
ANNEXE F : ESSAI GRANULOMÉTRIQUE ... 139
ANNEXE G : DÉTERMINER LE TRH DES COLONNES ... 155
ANNEXE H : INFLUENCE DE LA NATURE DE L’EAU D’ALIMENTATION ... 157
ix
LISTE DES TABLEAUX
Tableau 1 : Exigences de rejet en phosphore total pour les rejets d'eaux usées d'origine
domestique (MDDELCC, 2015)... 5
Tableau 2 : Résultats d'études réalisées sur différents médias naturels ... 15
Tableau 3 : Résultats d'études réalisées sur différents médias provenant de sous-produits industriels ... 19
Tableau 4 : Résultats d'études réalisées sur différents médias synthétiques ... 25
Tableau 5 : Synthèse des matériaux à capture passive ... 29
Tableau 6 : Paramètres d'opération déterminés par Thibault, (2012) ... 32
Tableau 7 : Caractéristique des colonnes de l’essai sur l’aération ... 34
Tableau 8 : Caractéristiques techniques du montage de l’essai sur les conditions d’aération ... 37
Tableau 9 : Suivi analytique pour l’essai d’aération ... 43
Tableau 10 : Masse volumique du garnissage brut et activé ... 45
Tableau 11 : Masse de la broyure avant et après le test d’immersion ... 47
Tableau 12 : Variation de la teneur en fer du média qui subit un test d’immersion... 49
Tableau 13 : Caractéristiques techniques du montage du filtre percolateur ... 66
Tableau 14 : Suivi analytique sur l’essai avec le filtre percolateur ... 69
Tableau 15 : Phosphore capté par la colonne C1... 76
Tableau 16 : Capacité d’enlèvement du phosphore ... 77
Tableau 17 : Capacité d’enlèvement du phosphore avec masse ajustée... 78
Tableau 18 : Analyse de la boue de la colonne anaérobie C1 ... 81
Tableau 19 : Calcul du TRH dans la colonne C1 ... 84
Tableau 20 : Test sur la composition des matières en suspension contenue dans le liquide à l'intérieur de la colonne ... 85
x
Tableau 22 : Analyse des garnissages neufs et usagés de la colonne ... 88
Tableau 23 : Taux d'abattement du phosphore pour la colonne et le filtre percolateur combinés ... 93
Tableau 24 : Capacité de sorption incluant les effets d'un filtre percolateur ... 94
Tableau 25 : Analyse du garnissage usagé du filtre percolateur ... 95
Tableau E1 : Essai sur le rinçage des copeaux ... 126
Tableau E2 Caractéristique technique du montage pour l’essai de rinçage ... 127
Tableau E3 : Suivi analytique sur les colonnes de l'essai de rinçage ... 128
Tableau E4 : Suivi du pH sur les colonnes de l'essai de rinçage de la broyure ... 132
Tableau E5 : Analyse comparative des garnissages pour l'essai de rinçage de la broyure 133 Tableau E6 : Définition des termes pour l'essai de rinçage de la broyure ... 135
Tableau E7 : Plan de l'essai sur le rinçage de la broyure ... 135
Tableau E8 : Capacité de prise en charge maximale de phosphore pour l’essai de rinçage de la broyure ... 138
Tableau F1 : Composition des colonnes ... 140
Tableau F2 : Caractéristique technique du montage de l’essai sur la granulométrie ... 143
Tableau F3 : Suivi analytique sur les colonnes de l'essai de rinçage ... 144
Tableau F4 : Suivi du pH sur les colonnes de l'essai sur la granulométrie ... 150
Tableau F5 : Analyse comparative des garnissages pour l'essai sur la granulométrie .... 150
Tableau H1: Caractéristiques techniques de la colonne de déphosphatation ... 159
Tableau H2: Suivi analytique sur la colonne alimentée en eau prétraitée ... 160
xi Tableau H4 : Suivi du pH de la colonne alimentée en eau usée prétraitée... 164 Tableau H5 : Composition du garnissage du filtre ... 165 Tableau H6 : Comparatif de l'enlèvement selon la nature de l'eau... 169 Tableau H7 : Différences des caractéristiques selon la nature de l’eau d’alimentation .. 171
xiii
LISTE DES FIGURES
Figure 1 : Cyanobactérie dans un plan d’eau
(http://www.agencesss04.qc.ca/sante-publique/environnement/ep-cyanobacteries.html) ... 4
Figure 2 : Échange ionique entre un sesquioxyde et un ion phosphate (adapté de Karam, 2014) ... 10
Figure 3 : Adsorption entre un sesquioxyde et un ion phosphate (adapté de Karam, 2014) 11 Figure 4 : Répartition de la granulométrie de la broyure ... 36
Figure 5 : Schéma global du montage de l'essai sur les conditions d'aération ... 39
Figure 6 : Photo du montage des colonnes de l’essai sur les conditions d’aération ... 40
Figure 7 : Un morceau de broyure activé recouvert de sel ... 42
Figure 8 : Isotherme de Langmuir pour la broyure activée sèche ... 46
Figure 9 : Suivi du phosphore en sortie de la colonne anaérobie C1 (84 jours) ... 51
Figure 10 : Suivi du fer en sortie de la colonne anaérobie C1 (84 jours) ... 52
Figure 11 : Suivi du POR de la colonne anaérobie C1 (84 jours) ... 52
Figure 12: Diagramme d’équilibre du fer (Sarrazin et al., 1991) ... 55
Figure 14 : Colonne réduite ... 56
Figure 13 : Colonne à la mise en marche ... 56
Figure 15 : Suivi du phosphore en sortie de la colonne aérobie C2 ... 57
Figure 16 : Suivi du fer en sortie de la colonne aérobie C ... 58
Figure 17 : Suivi du POR de la colonne aérobie C2 ... 58
Figure 18 : Suivi du phosphore en sortie de la colonne hybride C3 ... 60
Figure 19 : Suivi du fer en sortie de la colonne hybride C3 ... 60
Figure 20 : Suivi du POR de la colonne hybride C3 ... 61
xiv
Figure 22 : Suivi des colonnes de l’essai sur les conditions optimales d’aération sur 84 jours
... 63
Figure 23 : Schéma et photo du montage de la colonne et du filtre percolateur ... 67
Figure 24 : Boue recueillie à la sortie de la colonne anaérobie C1 ... 72
Figure 25 : Boue recueillie sur les parois de la tuyauterie... 72
Figure 26 : Suivi du phosphore de la colonne C1 anaérobie (291 jours) ... 75
Figure 27 : Suivi du fer en sortie de la colonne C1 (291 jours) ... 79
Figure 28 : Accumulation de fer dans les tuyaux ... 80
Figure 29 : Suivi du POR à l'intérieur de la colonne anaérobie (291 jours) ... 80
Figure 30 : Aspect de la broyure à l'intérieur de la colonne anaérobie C1 neuf et après 291 jours d'opération ... 82
Figure 31 : récupération de l'eau à l'intérieur de la colonne anaérobie C1 ... 85
Figure 32 : Suivi du phosphore en entrée et en sortie de la zone aérobie ... 90
Figure 33 : Suivi du fer en entrée et en sortie de la zone aérobie ... 91
Figure 34 : Accumulation de fer dans le filtre percolateur ... 92
Figure 35 : Suivi combiné du fer et du phosphore du filtre percolateur ... 92
Figure 36 : Optimisation du procédé d’activation tiré de Thibault, 2012 ... 101
Figure 37 : Combiner les zones anaérobie et aérobie en une seule colonne ... 105
Figure 38 : Échantillonnage en zone réduite ... 106
Figure A1: Concentration en phosphore à la sortie des colonnes selon l'activation pour une alimentation à 15mg/L ... 115
Figure E1 : : Suivi du phosphore en sortie des colonnes pour les copeaux rincés et non rincés avec une alimentation à 5 mgP/L ... 129
Figure E2 : Suivi du phosphore en sortie des colonnes pour les copeaux et copeaux rincés avec une alimentation à 15 mgP/L ... 129
xv Figure E3 : Suivi du fer en sortie des colonnes pour les copeaux et copeaux rincés avec une
alimentation à 5 mgP/L ... 130
Figure E4 : Suivi du fer en sortie des colonnes pour les copeaux et copeaux rincés avec une alimentation à 15 mgP/L ... 131
Figure E5 : Suivi du POR pour les copeaux et copeaux rincés avec une alimentation à 5mgP/L ... 131
Figure E6 : Suivi du POR pour les copeaux et copeaux rincés avec une alimentation de 15 mgP/L ... 132
Figure E7 : Isotherme de Langmuir des copeaux rincés ... 133
Figure E8 : Isotherme de Langmuir des copeaux ... 133
Figure E9: Isotherme de Langmuir sur E1 ... 136
Figure E10 : Isotherme de Langmuir sur E2 ... 136
Figure E11 : Isotherme de Langmuir sur E3 ... 136
Figure E12 : Isotherme de Langmuir sur E4 ... 137
Figure E13 : Isotherme de Langmuir sur E5 ... 137
Figure E14 : Isotherme de Langmuir sur E6 ... 137
Figure F1: Montage expérimental de l’essai sur la granulométrie ... 145
Figure F2 : Détails du dessous des colonnes de l’essai sur la granulométrie ... 146
Figure F3 : Suivi du phosphore en sortie des colonnes pour les différentes granulométries et une alimentation à 5mgP/L ... 147
Figure F4 : Suivi du phosphore en sortie des colonnes pour les différentes granulométries et une alimentation à 15 mgP/L ... 147
Figure F5 : Suivi du fer en sortie des colonnes pour les différentes granulométries et une alimentation en phosphore à 5 mgP/L ... 148
Figure F6 : Suivi du fer en sortie des colonnes pour les différentes granulométries et une alimentation à 15 mgP/L ... 148
Figure F7 : Suivi du POR pour les différentes granulométries et une alimentation à 5mg/L ... 149
xvi
Figure F8 : Suivi du POR pour les différentes granulométries et une alimentation à 15mg/L
... 149
Figure F9 : Isotherme de Langmuir des copeaux à granulométrie grossière... 151
Figure F10 : Isotherme de Langmuir des copeaux à granulométrie moyenne ... 151
Figure F11: Isotherme de Langmuir des copeaux à granulométrie fine ... 151
Figure H1: Colonne BiosorMD ... 158
Figure H2: Suivi de l'azote dans la colonne C4 ... 161
Figure H3: Suivi du phosphore de la colonne Mini-Biosor... 163
Figure H4 : Suivi du fer à la sortie de la colonne ... 163
Figure H5 : Suivi du POR de la colonne alimenté en eau usée prétraitée ... 164
Figure H6 : Diagramme d’équilibre du fer (Sarrazin et coll., 1991) ... 165
Figure H7 : Suivi du phosphore en entrée et en sortie du filtre percolateur de la colonne alimentée en eau usée prétraitée ... 166
Figure H8 : Suivi du fer en entrée en sortie du filtre percolateur de la colonne C4 ... 167
Figure H9: différence de couleur entre les deux filtres percolateurs ... 168
xvii
LISTE DES SYMBOLES
ADN Acide Désoxyribonucléique
ARN Acide ribonucléique
Al Aluminium Ce Concentration à l’équilibre Cs Concentration à saturation C Carbone Ca Calcium Cr Chrome CMC Cellulose de carboxymethyl
CRIQ Centre de recherche industriel du Québec CSP Capacité de sorption maximale de phosphore
Fe Fer
FeCl3 Chlorure ferrique
g Gramme
H3PO4 Acide phosphorique
MDDELCC Ministère du Développement durable, de l’Environnement et de la lutte aux changements climatiques
MeS Matières en suspension
Mg Milligramme
MOT Matière organique Total
Mg Manganèse
N Molaire
N Azote
N-NH4 Azote ammoniacal
NaOH Hydroxyde de Sodium
NH3 Ammoniaque
NO3 Nitrate
O Oxygène
OCDE Organisation de coopération et de développement économique
OD Oxygène Dissout
xviii
PVC Polychlorure de vinyle
PO4 Phosphate
POR Potentiel d’oxydoréduction
Q Débit
rpm Révolution par minute
T Température
xix
REMERCIEMENTS
J’aimerais d’abord remercier mon directeur de maitrise, le professeur Paul Lessard. Sans lui, je n’aurais sans doute jamais pu entreprendre ce projet. Je le remercie d’avoir eu confiance en moi au printemps 2013 lorsqu’il a appuyé ma candidature à la maitrise. Je le remercie d’avoir su habilement me guider tout au long de mon parcours en m’apportant de précieux conseils et un support dans les moments difficiles. Merci pour les moments moins pertinents qui sont pourtant importants pour moi.
J’aimerais ensuite remercier mon co-directeur de recherche au CRIQ, Gerardo Buelna. Gerardo m’a fait confiance et a toujours été disponible pour me promulguer ces précieux conseils et partager sa riche expérience professionnelle. Je voudrais aussi remercier le responsable du projet au CRIQ, Rino Dubé. Les nombreuses rencontres et discussions que nous avons eues m’ont été d’une grande aide et je suis reconnaissant d’avoir pu travailler avec quelqu’un d’aussi compétent. Merci au CRIQ pour l’accueil chaleureux, le soutien financier et surtout pour m’avoir permis de réaliser mes travaux dans un environnement de travail stimulant. Les hauts et les bas vécus lors des nombreuses heures passées à mon bureau et dans le hall d’essai font que ces endroits resteront marqués dans ma mémoire. J’aimerais spécialement remercier Jean Nadeau pour son aide sur l’aspect technique, pour sa patience lorsque ma dextérité faisait défaut et simplement pour avoir été d’une agréable compagnie. Également du CRIQ, je souligne l’importante participation d’Alain Sauvé, d’André Trembley, d’Odette Petitclerc, de Michael Desrochers, de Sylvain Savard et de Yann LeBihan.
Merci à mes collègues et aux profs de l’université Laval, le département de génie civil et de génie des eaux est exceptionnel et je suis fier d’y avoir passé les 6 dernières années. Merci à Bernard pour les moments Barista durant la rédaction.
Il n’y a pas de mots assez forts pour remercier ma famille (Bib, Martin et Cicko) pour le soutien inconditionnel lors des 20 dernières années; m’avoir permis d’étudier est le plus beau cadeau que vous auriez pu me faire. Merci à mes chums trop nombreux pour être nommé, le
xx
CP crew, le convoi, la gang du RO, la gang de GEX. Merci à mes colocs: Paul, Pete, Sim. Merci à la belle Jeannot pour son soutien quotidien.
1
1. INTRODUCTION
1.1 Spécification sur le phosphore
Le phosphore est un élément essentiel à la vie pour tous les organismes vivants, il entre dans la composition des organismes vivants. En effet, le phosphore est l’un des constituants principaux des protéines phosphorées, de l’ADN, de l’ARN et des lipides phosphorés. Il a aussi un rôle important dans plusieurs métabolismes végétal et animal (Karam, 2014). Dans l’environnement, il est généralement retrouvé sous forme de phosphate dissout (H2PO4-,
H2PO42-, PO43-) ou lié à des phases solides comme l’apatite (Sigg et Behra, 2014). Sa mobilité
est grandement influencée par la faible solubilité de ses sels, par exemple le phosphate de calcium et de fer (III) (Sigg et Behra, 2014). Le phosphore est capable de se transformer biologiquement selon une série de processus conceptuels appelés cycle du phosphore (Karam, 2014).
Le phosphore retrouvé dans les eaux de surface provient essentiellement de sources anthropiques. Ces sources sont de provenance agricole, industrielle ou municipale (Aubert, 2007). En ce qui concerne les eaux usées municipales, le phosphore provient principalement des rejets métaboliques (urine et fèces). Les autres sources notables sont les détergents pour lave-vaisselle, les eaux de vaisselle, les détergents à lessives ménagers et les produits de lavage industriels utilisés dans les laveries, les restaurants, les commerces et les industries agroalimentaires (Stricker et al., 2010). Une concentration typique d’une eau usée municipale en phosphore total est d’environ 5mgP/L (Henze, 2008). Le phosphore total comprend le phosphore soluble et le phosphore particulaire. Le phosphore total peut également être séparé en phosphore organique et inorganique, le phosphore inorganique (orthophosphates, les polyphosphates) correspond typiquement à 80% du phosphore total et il s’agit de la portion réactive du phosphore total (Sigg et Behra, 2011).
2
1.2 Impacts sur l’environnement
Le phosphore en soi n’est pas toxique pour la vie animale et végétale, mais il l’est indirectement par un phénomène nommé eutrophisation (Galvez-Cloutier, 2002). L’eutrophisation peut mener à des conséquences importantes pour les écosystèmes (Smith et al., 1999). Selon l’OCDE, l’eutrophisation se définit comme un « enrichissement des eaux en matières nutritives qui entraîne une série de changements symptomatiques, tels que l’accroissement de la production d’algues et de macrophytes, la dégradation de la qualité de l’eau et autres changements considérés comme indésirables et néfastes aux divers usages de l’eau » (OCDE, 1982). L’eutrophisation est un processus naturel de vieillissement des lacs qui peut devenir néfaste lorsqu’il est accéléré par l’homme. La croissance de la biomasse dépend de la présence de nutriments, en particulier l’azote, le carbone et le phosphore. Selon la stœchiométrie de la biomasse des algues, la consommation en nutriments suit la proportion suivante (Sigg et Behra, 2011) :
𝐶 ∶ 𝑁 ∶ 𝑃 = 106 ∶ 16 ∶ 1
Le phosphore est le nutriment qui est majoritairement considéré responsable d’une augmentation de la croissance de la biomasse, car il est souvent l’élément limitant (Bitton, 2011). Les autres éléments (N et C) sont souvent en excès, car ils sont disponibles naturellement alors que les apports en phosphore proviennent principalement des eaux de surface; la concentration en phosphore des eaux a tendance à être augmentée par les effets des activités humaines (Correll, 1998). Les algues vont croitre à une vitesse supérieure à laquelle elles pourraient être consommée par les animaux, dispersées par les courants ou décomposées par les bactéries. L’accumulation qui est suivie de la décomposition de cette biomasse aura pour conséquence de désoxygéner l’eau et de créer des conditions anoxiques dans les couches profondes des lacs et les couches de surface des lacs tranquilles durant la nuit (Correll, 1998). Combinée avec la respiration nocturne du phytoplancton la concentration en oxygène dissout va chuter dans l’ensemble de la colonne d’eau. Les effets de cette chute d’OD sont entre autres, la libération de gaz nocifs et d’autres substances
3 indésirables, l’altération de la qualité de l’eau et la modification des valeurs de pH (Galvez-Cloutier, 2002).
Les conséquences de l’eutrophisation sont nombreuses. D’abord, il est connu que l’eutrophisation peut mener à une baisse de la biodiversité des eaux douces (Karam, 2014). Une eau eutrophe présente un risque sanitaire pour l’homme et les animaux, une augmentation du pH peut, par exemple, provoquer l’apparition de conjonctivites ou de dermatites chez l’homme (Galvez-Cloutier, 2002). La vulnérabilité des prises d’eau est augmentée par la présence de certaines algues (Lavoie et al., 2007a). La décomposition de la biomasse va entrainer une sédimentation accrue, une production d’écume en surface des plans d’eau, la prolifération d’insectes nuisibles ainsi que la libération de mauvaises odeurs (Karam, 2014).
Au Québec, l’une des principales conséquences des fortes concentrations de phosphore dans les plans d’eau est la prolifération de cyanobactéries. Cette bactérie peut libérer des toxines qui sont dommageables pour la santé humaine et animale (Galvez-Cloutier, 2002). Entre 1999 et 2007, le Ministère du développement durable de l’environnement et de la lutte aux changements climatiques (MDDELCC) a reçu 197 signalements de présence de cyanobactéries sur les plans d’eau québécois (Lavoie et al., 2007b). La Figure 1 montre un lac qui est infesté par des cyanobactéries.
4
Figure 1 : Cyanobactérie dans un plan d’eau ( http://www.agencesss04.qc.ca/sante-publique/environnement/ep-cyanobacteries.html)
1.3 Position ministérielle
Face à la problématique des cyanobactéries dans les plans d’eau du Québec, le gouvernement a adopté un plan d’intervention sur les algues bleu vert. Les informations contenues dans cette section proviennent de la position ministérielle sur la réduction du phosphore dans les rejets d’eaux usées d’origine domestique (MDDELCC, 2015). Dans ce plan d’intervention, le gouvernement recommande, entre autres, l’implantation d’équipements permettant de réduire les rejets de phosphore dans le milieu récepteur, et ce aux endroits où ce milieu le requiert. La réduction des rejets en phosphore s’applique aux rejets domestiques, d’origine municipale, institutionnelle ou privée. L’objectif principal visé par la position du MDDELCC est de définir une action structurée afin de favoriser la mise en place de technologies de déphosphatation appropriées aux endroits où elles sont requises. Tous les lacs et les points de rejet en amont d’un lac sont visés par la position ministérielle. Pour permettre de déterminer les interventions requises lorsque d’autres solutions ne sont pas possibles, le MDDELCC a défini les catégories de lacs suivantes : prioritaire, préoccupants, sous surveillance et exclus. Les bassins versants qui subissent des apports en phosphore importants sont considérés étant « en surplus de phosphore ». Les rivières situées dans ces
5 bassins et qui ne se déversent pas dans un lac ont été ajoutées à celles qui sont visées par la position ministérielle. Les exigences de rejet en phosphore sont détaillées dans le .
Tableau 1.
Tableau 1 : Exigences de rejet en phosphore total pour les rejets d'eaux usées d'origine domestique (MDDELCC, 2015)
Selon le plan d’intervention gouvernemental sur les algues bleu vert, toutes les actions planifiées doivent être achevées en 2017. Afin de prioriser les actions prévues par ce plan d’intervention, les municipalités qui rejettent leurs effluents dans un lac ou en amont d’un lac et qui ont à se doter de nouveaux équipements de déphosphatation doivent se conformer aux nouvelles exigences de rejet formulées dans la position du Ministère au plus tard le 1er janvier 2017. Pour les municipalités qui rejettent leurs effluents dans un bassin versant en surplus de phosphore et qui ont à se doter de nouveaux équipements de déphosphatation doivent se conformer aux nouvelles exigences de rejet formulées dans la position du
6
Ministère au plus tard le 1er janvier 2018. Des technologies de déphosphatation seront donc requises afin de réduire la concentration en phosphore des effluents municipaux. Pour l’instant, 77,5% du débit total des effluents d’eau usée sont munis d’un système de déphosphatation (MDDELCC, 2015).
7
2. ÉTAT DES CONNAISSANCES
Tel que mentionné précédemment, le phosphore en solution se retrouve sous deux formes; particulaire et soluble. La forme soluble comprend les orthophosphates et les polyphosphates. Comme les polyphosphates vont naturellement s’hydrolyser en orthophosphates, le terme phosphate est couramment utilisé pour englober les deux formes de phosphore. C’est sous cette forme que le phosphore est directement assimilable par les microorganismes et la végétation. Rappelons ici la stœchiométrie d’assimilation des algues (Sigg et Behra, 2011).
𝐶 ∶ 𝑁 ∶ 𝑃 = 106 ∶ 16 ∶ 1
Donc, une partie du phosphore sera assimilée par les micro-organismes dans les installations de traitement biologique d’eau usée. Cette assimilation n’est toutefois pas suffisante à l’atteinte des normes de rejets énoncées à la section 1.3, des systèmes de déphosphatation supplémentaires sont donc requis.
2.1 Méthodes conventionnelles de déphosphatation
L’enlèvement du phosphore ou « déphosphatation » peut être réalisé par un traitement physique, physico-chimique (précipitation chimique ou échange d’ions), ou biologique (Metcalf & Eddy, 2003). Les technologies conventionnelles seront brièvement expliquées sans entrer dans le détail car la méthode de déphosphatation étudiée dans ce mémoire est la capture passive.
2.1.1 Physique
Le traitement physique comprend la sédimentation, la flottation et la filtration. Ces méthodes sont seulement efficaces pour enlever le phosphore particulaire qui représente au maximum 25% de la quantité totale de phosphore de l’effluent (Metcalf & Eddy, 2003).
8
2.1.2 Physico-chimique
La méthode de déphosphatation la plus courante dans le secteur du traitement des eaux est la méthode physico-chimique (de-Bashan et Bashan, 2004). Cette méthode consiste à ajouter un agent coagulant pour les phosphates. Le phosphore passe donc de la phase aqueuse à la phase solide en s’accumulant sous forme de boues qui doivent être retirées périodiquement ou en continue (Gagnon, 2010). La précipitation du fer est généralement faite par l’ajout d’ions métalliques divalents ou trivalents tel que : Fe2+, Fe3+, Al3+ou Ca2+. Ces ions se lient
aux phosphates et forment des composés insolubles, ces composés sont ensuite retirés de l’eau par décantation, flottation ou filtration. Les ions sont ajoutés sous forme de sels métalliques qui peuvent prendre plusieurs formes et peuvent être ajoutés à différentes étapes du traitement (Gong et Zhao, 2014). La précipitation peut être affectée par plusieurs facteurs, les principaux sont : la température, le pH, l’alcalinité, les ions présents, la concentration de phosphore et la matière organique dissoute. Au Québec, la grande majorité des stations utilisent un procédé physico-chimique pour faire la déphosphatation (MDDELCC, 2015). En utilisant le bon dosage de coagulant, il est possible d’obtenir un enlèvement de plus de 95% (Gong et Zhao, 2014). Le dosage idéal est déterminé en laboratoire par des tests nommés « Jar Test ».
2.1.3 Biologique
Tous les procédés de traitement des eaux vont capter une partie du phosphore des eaux usées par assimilation, mais cette assimilation ne procure pas de grands pourcentages d’enlèvement. La déphosphatation biologique repose sur l’optimisation du principe d’assimilation du phosphore par les micro-organismes. L’enlèvement se fait par la circulation d’une boue activée dans une séquence de réacteurs anaérobies et aérobies. La déphosphatation se fait par des bactéries accumulatrices de phosphate. Les bactéries larguent le phosphore durant la phase anaérobie et le captent durant la phase aérobie. L’effet de l’alternance des phases permet de capter une plus grande quantité de phosphore (Metcalf & Eddy, 2003). Lorsque les conditions d’opération optimales sont atteintes, ils peuvent accumuler jusqu’à 10% de leur masse en phosphore, soit environ 5 fois plus que les bactéries
9 présentes traditionnellement dans les réacteurs de boue activée (Déronzier et Choubert, 2002). Au Québec, cette technologie est difficilement implantable en raison du rigoureux climat hivernal qui nuit à la performance et en raison de la forte dilution des eaux usée, le ratio P : C est généralement trop bas pour employer ce type de procédé (Comeau, 1990). Les technologies conventionnelles de traitement du phosphore comme le physico-chimique et le traitement biologique sont associées à des besoins d’opération et d'entretien réguliers, des équipements spécialisés, une grande quantité d’énergie et une grande quantité de boues souvent chimique à disposer (Letshwenyo et al., 2014). Ces éléments font en sorte que ces technologies sont couteuses et particulièrement difficiles à implanter pour les petites installations comme les résidences isolées et les petites municipalités. C’est pourquoi des efforts de recherche sont faits pour développer une technologie passive de capture du phosphore.
2.2 La capture passive du phosphore
La section résume l’état des connaissances sur les technologies passives de capture du phosphore qui utilisent la sorption. Généralement, des filtres sont utilisés comme réacteur. Le procédé consiste à faire circuler l’eau usée à travers ces filtres pour accumuler le phosphore, le média filtrant sera en mesure de prendre en charge le phosphore jusqu’à ce qu’il soit saturé.
2.2.1 Mécanismes d’enlèvement : La sorption
L’enlèvement se fait selon plusieurs mécanismes qui sont difficiles à différencier et à isoler, une combinaison d’adsorption, de précipitation et d’échange d’ions. Le processus d’enlèvement se décrit donc comme l’accumulation d’une substance à la surface d’un média, il s’agit du passage d’une espèce chimique d’une phase liquide à une phase solide (McKay, 1996). La plupart des technologies de capture passive du phosphore sont sous forme d’un
10
média doté d’une forte affinité chimique avec le P. Il est généralement convenu de parler de sorption, un terme qui englobe les trois mécanismes (Cucarella et Renman, 2009).
La sorption est calculée en termes de CSP (capacité de sorption du phosphore), cette valeur est exprimée en mg P capté par gramme de média sec (Johansson et Westholm, 2006). La qualité d’un média sera déterminée par la combinaison de l’affinité du substrat pour le phosphore et la quantité de sites de liaison disponibles (Cucarella et Renman, 2009). Les trois éléments les plus actifs pour la sorption du phosphore sont le fer, l’aluminium et le calcium (Johansson et Gustafsson, 2000; Wendling et al., 2013; Grubb et al., 2000).
2.2.1.1 Fer et aluminium
Pour le fer et l’aluminium, les mécanismes de sorption sont semblables contrairement à ceux du calcium qui diffèrent.
Les formes de fer et d’aluminium qui ont la plus grande affinité avec le phosphore sont les oxydes et hydroxydes de fer/aluminium, ce groupe de métal est appelé sesquioxydes. Les sesquioxydes peuvent capter le phosphore selon les trois principaux mécanismes d’enlèvement (adsorption, échange ionique, précipitation) (Karam, 2014). Dans le milieu à pH neutre et basique, le mécanisme d’enlèvement prédominant est l’échange ionique, la Figure 2 montre ce processus.
Figure 2 : Échange ionique entre un sesquioxyde et un ion phosphate (adapté de Karam, 2014)
Lorsque le pH est plutôt acide (<5,5) les ions phosphates seront plutôt adsorbés selon le mécanisme montré à la Figure 3.
11
Figure 3 : Adsorption entre un sesquioxyde et un ion phosphate (adapté de Karam, 2014)
Certaines études démontrent que dans un milieu réducteur, donc à potentiel d’oxydoréduction (POR) faible ou négatif, il est possible que les hydroxydes de fer se dissolvent en se réduisant (Lovley et Phillips, 1996; Zurawsky et al., 2004; Roberge et al, 1999). Dans ce cas puisque le milieu est anaérobique, les ions de fer sont plutôt présents sous la forme de Fe2+, la
précipitation avec le phosphore est principalement sous forme de vivianite (Gong et Zhao, 2014). Cette précipitation entre les ions ferreux et le phosphore est la suivante:
3𝐹𝑒2++ 2𝑃𝑂
43−= 𝐹𝑒3(𝑃𝑂4)2 (Équation 1)
Si des ions ferreux se retrouvent en contact avec un milieu oxydant, ils seront oxydés en 𝐹𝑒3+
selon la réaction suivante :
𝐹𝑒2++ 0.25𝑂2 = 𝐹𝑒3++ 0.5𝐻
2𝑂 (Équation 2)
Les ions ferriques pourront alors précipiter avec le phosphore selon : 𝐹𝑒3++ 𝑃𝑂
43−= 𝐹𝑒𝑃𝑂4 (Équation 3)
Les ions Fe3+ en solution peuvent également former/reformer de l’hydroxyde de fer en
consommant de l’alcalinité selon : 𝐹𝑒3++ 3𝐻𝐶𝑂
12
Cet hydroxyde de fer pourrait capter le phosphate selon les mécanismes décrits aux figures 2 et 3. Ces équations pourraient varier considérant que les réactions de précipitation des phosphates par le fer sont fortement dépendantes du pH et du POR (Huang et al, 2011).
2.2.1.2 Calcium
Les médias qui utilisent le calcium comme élément actif dans la déphosphatation captent le phosphore par précipitation. En effet, le calcium se dissout tranquillement pour précipiter avec le P. Le procédé de dissolution du calcium augmente le pH tout en réduisant la solubilité des complexes Ca-P (Chazarenc et al., 2007). La forme que prendra le précipité dépendra des autres composées du média et du pH (Baker et al., 1998). La déphosphatation passive par le calcium n’est efficace que pour des gammes hautes de pH (>9,5) (Liu et al, 2010).
La forme chimique que prend le calcium a un rôle important dans la capacité de sorption en phosphore (CSP) d’un média. Les médias à base de CaO offrent de meilleures performances que les médias où le CaCO3 est la forme dominante (Li et al., 2006). Certaines opérations
simples sur les médias peuvent engendrer des gains au niveau de la capacité de prise en charge du phosphore. Par exemple, le chauffage à température élevée d’un média à haute teneur en Ca permet d’augmenter la CSP, car le chauffage va permettre de transformer une partie du CaCO3 en CaO.
2.2.2 Facteurs influençant la CSP
Les mécanismes d’enlèvement décrits précédemment sont influencés par différents paramètres, cette section fait état de ces facteurs d’influence.
2.2.2.1 Temps de rétention hydraulique
Le temps de rétention hydraulique (TRH) dans le réacteur doit être suffisant pour que le système atteigne l’équilibre, car c’est à l’équilibre que la sorption sera maximale (Dubus, 1997). L’équilibre se décrit comme le moment où la proportion de phosphore dans la phase liquide et dans la phase solide ne changent plus et sont constants. Comme le processus de sorption est complexe et s’effectue en plusieurs étapes et selon plusieurs processus, le temps requis pour atteindre l’équilibre est extrêmement variable d’un média à l’autre. Les médias à
13 base de fer et d’aluminium ont des temps de contact optimal pouvant être inférieurs à 1 heure (Tanada et al., 2003) alors que pour les matériaux à base de calcium le temps de contact idéal peut atteindre 72 heures (Cucarella et al., 2009). Les facteurs qui influent sur la valeur du TRH optimal sont la température, la granulométrie, la porosité et la concentration en phosphore en solution (Cucerella et al., 2009).
Plus un matériau sera poreux et aura de surface par volume (surface spécifique) plus il y aura de sites pour la sorption du phosphore dont plusieurs difficilement accessibles allongeant la période nécessaire pour atteindre l’équilibre, mais, procurant généralement de meilleures CSP (Cucacella et al., 2009). La concentration de phosphore en solution joue également un rôle, plus la concentration en phosphore de la solution est grande plus les processus de sorption se feront rapidement (Cucarella et al., 2009).
2.2.2.2 Température
La température permet généralement de favoriser la réaction en cours que ce soit l’adsorption, la précipitation ou l’échange ionique (Dubus, 1997). La majorité des études concluent que la baisse de température diminue la CSP (Agyei et al., 2001; Park et Dong, 2011; Herrmann et al., 2014). L’effet de la température est plus marqué pour les médias avec le Ca comme élément actif que pour ceux avec le Fe ou Al.
2.2.2.3 Granulométrie
Plus la granulométrie d’un média est fine plus la surface spécifique sera grande et plus il y aura de sites de liaisons. Une granulométrie fine augmente la CSP du phosphore pour la majorité des médias (Park et Dong, 2011; Drizo et al., 1999; Litter et al., 2011). Plusieurs des médias étudiés dans la littérature (Yan et al., 2010; Li et al., 2006; Zeng et al., 2006; Wei et al., 2008) ont d’ailleurs des granulométries ultrafines, ces granulométries favorisent des CSP élevées en batch, mais sont difficilement utilisables en situation réelle. Plusieurs études réalisées sur des filtre opérées avec de l’eau usée municipale suggèrent qu’une granulométrie inférieure à 5 mm de diamètre mène à de trop grands risques de colmatage (Chazenrec et al., 2007; Shilton et al., 2006; Vohla et al., 2011).
14
2.2.2.4 Le pH
Selon l’élément actif utilisé, le pH aura un effet différent sur la CSP du média. Dans le cas du fer et de l’aluminium le procédé d’enlèvement du phosphore consiste à lier un anion phosphate avec un cation métallique. Voici l’ordre d’affinité anionique déterminé par Fatehi (2002) pour les oxydes de fer et d’aluminium :
𝑂𝐻− > 𝑃𝑂
43−> 𝐶2𝑂4 > 𝐹− > 𝐶𝑟𝑂42−> 𝑆𝑂42−> 𝐶𝑟2𝑂72−> 𝐶𝑙− > 𝑁𝑂3−
Donc, le seul anion ayant plus d’affinité chimique que le P pour le Fe et l’Al est l’OH-. Comme la concentration en solution d’ions OH- dépend directement du pH, un pH élevé nuit
à la sorption du phosphore par les oxydes. Certaines études confirment que la sorption par les oxydes de fer est favorisée à faible pH, la CSP d’oxydes de fer passe de 8,6 mgP/g pour un pH de 3,2 à 4,6 mgP/g à un pH de 9,5 (Zeng et al., 2004). D’autres études ont également trouvé que la sorption du phosphore par les hydroxydes de fer augmente lorsque le pH diminue (Genz et al., 2004; Wenhui et Peng, 2008; Seida et Nakano, 2001).
Pour ce qui est du calcium, le pH joue un rôle inverse et encore plus important. En effet, comme discuté précédemment le bon enlèvement du phosphore passe par un pH élevé (> 9,5) (Chazarenc et al., 2007). Un essai sur un média filtrant à base de coquilles d’huitres réalisée par Liu et al. (2010) a montré que le pourcentage d’enlèvement du phosphore par un filtre opéré en eau usée naturelle est passé de 90 à 25% pour une baisse du pH de 10 à 7.
2.2.3 Les médias à capture passive
Une multitude de matériaux ont été utilisés et testés pour réaliser la capture passive du phosphore. La nature des matériaux varie beaucoup et ils peuvent être classés en trois groupes : les matériaux naturels, les sous-produits industriels et les matériaux synthétiques (Johansson et Westholm, 2006). Les méthodes utilisées pour tester la performance des substrats sont généralement également classées en trois catégories : les essais en batch, les essais en colonne et les essais pilotes. Les essais en batch sont les plus rudimentaires et servent à caractériser et quantifier le potentiel de différents médias, les essais en colonne sont plus précis et permettent d’estimer le potentiel de traitement avec une plus grande précision
15 et permettent d’établir l’influence des paramètres d’opérations et l’essai pilote permet de déterminer la capacité réelle de déphosphatation d’un média. Les trois types d’essais produisent des résultats différents qu’il faut éviter de comparer en absolu, c’est-à-dire qu’il est hasardeux de comparer une CSP obtenue en batch et une autre obtenue dans un essai pilote. La nature de l’eau, la concentration en phosphore et les conditions d’opérations (TRH, température, pH) vont varier selon le type d’essai et affecter les résultats. De plus, pour un même type de matériel la granulométrie et la composition peuvent varier, il se peut qu’une tourbe testée en Chine ne contienne pas la même proportion de fer qu’une testée aux États-Unis. Tous ces facteurs font que la comparaison des différents résultats de la littérature est difficile et qu’elle doit surtout être faite avec précaution (Cucarella et Renman, 2009).
2.2.3.1 Médias naturels
Les matériaux naturels proviennent directement de l’environnement et ils ne subissent pas ou peu de transformation, ils sont donc généralement peu couteux et disponibles en grande quantité. Les manipulations qu’ils subissent sont par exemple un concassage ou un chauffage thermique. Parmi les matériaux utilisés on retrouve notamment le sable, le gravier, l’argile, la tourbe, la calcite, la bauxite, la bentonite, des mélanges de sols, le sable de coquillage, la pyrrhotite, la zéolite, la dolomite, l’opoka et les coquilles d’huitres (Vohla et al., 2011). Le Tableau 2 présente plusieurs études réalisées avec la majorité des matériaux naturels testés. Pour chaque média utilisé, le tableau donne la méthodologie employée, la performance d’enlèvement, les éléments actifs et la référence de l’étude.
Tableau 2 : Résultats d'études réalisées sur différents médias naturels Média Méthode CSP mgP/g * Élément actif / Commentaires Référence
16 Bauxite 6-13 mm Colonne 38,5 mgP/L (40j) + 80 mg/L (40j) 0.61 Al + Fe Drizo et al., 1999 Bentonite 149 µm Batch (25-60 mgP/L) pH = 3 12,7 Al Yan et al., 2010 10,5 Al+Fe 11,2 Fe Bentonite 0,25mm Batch pH = 3 0,93 Al Xu et al., 2006 Calcite 6-13 mm
Batch 0.68 Ca Drizo et al., 1999
Calcite 0,5-1 mm Batch (5,6 mgP/L) pH = 7,25 0,07 Ca Letshwenyo et al., 2014 Coquille d’huitre 2-5 cm Colonne Eau usée (1,7 mgP/L) 23.2 % pH=7 90.6% pH 10 Ca Liu et al., 2010 Gravier 0,5-1 mm Batch (5,6 mgP/L) pH = 7,25 0,12 Ca Letshwenyo et al., 2014
17 Loess < 850 µm Batch (1,4-3,0 mgP/L) Eau usée 0,09 Fe + Al Park et Dong, 2011 Opoka 0,9 mm Batch 0.10 Al + Ca + Fe Johansson, 1999 Pyrrhotite Batch (17.1 mgP/L) T=[11-29]°C 0,79-1,13 Fe Li et al., 2013 Schiste argileux 2-13 mm Colonne 38,5 mgP/L (40j) + 80 mgP/L (40j) 0.675 Ca Drizo et al., 1999 Tourbe Essai pilote (6 mois) 0,081 (58%) Koiv et al., 2009 Tourbe minérale chine Batch pH = 5,2 8,91 Fe + Al Xiong et Mahmood, 2010
Tourbe Batch 0,3 James et
18
* Certaines études réalisées en colonne présente les performances d’enlèvement sous forme de % d’enlèvement
Les résultats des études réalisés sur les médias naturels montrent que la plupart des CSP calculées sont inférieures à 1 mg P/g. De telles capacités de sorption ne sont pas suffisantes pour considérer utiliser de tels médias pour la capture du phosphore (Cucarella et al., 2009). La bentonite testée par Yan et al. (2010), présente les meilleurs résultats avec des CSP entre 10,5 et 12,7 mg P/g selon sa composition en fer en aluminium; ces résultats sont bons. Toutefois, en plus d’avoir été réalisés en batch, l’eau utilisée avait un pH de 3 et la granulométrie utilisée était très fine, ces paramètres posent des problèmes d’utilisation dans une situation de traitement d’une eau usée municipale. L’autre bonne performance notable provient d’une tourbe minérale en Chine avec une CSP de 8,51 mg P/g. Comme discuté précédemment, la composition chimique des matériaux naturels peut fortement changer selon l’endroit de prélèvement, les résultats des autres études réalisées sur d’autres tourbes ne donnent pas de résultats aussi bons. Il est donc difficile de reproduire cette performance. De plus, l’exploitation des tourbières est une activité d’exploitation qui peut nuire à la biodiversité (Barkham, 1993).
2.2.3.2 Médias provenant de sous-produits industriels
Les matériaux provenant de sous-produits industriels sont issus d’activités industrielles diverses. Ils sont généralement peu dispendieux à acquérir, car ils sont souvent catégorisés comme déchets à être envoyés dans un lieu d’enfouissement technique. Parmi les matériaux utilisés, on retrouve la boue rouge, plusieurs types de scories, les cendres volantes, les oxydes de fer, des cendres de charbon et le schiste (Vohla et al., 2011). Le Tableau 3 présente plusieurs études réalisées avec des matériaux provenant de sous-produits industriels.
19
Tableau 3 : Résultats d'études réalisées sur différents médias provenant de sous-produits industriels
Média Méthode Performance CSP mgP/g * Élément actif / Commentaires Référence Al alloy foam plate (AA 6101) 10 mm Batch (20 mgP/L) 90% La capacité maximale n’est pas déterminée. Le média se régénère à 100%. Seo et al., 2013 Boue rouge Batch (1 mgP/L) 0,58 Fe + Al Huang et al., 2008 Boue rouge 149 µm Batch (155 mgP/L -3100 mg/L) 113,9 Ca + Fe Li et al., 2006 345,5 La CSP est augmentée par un chauffage thermique et un traitement à l’acide. Boue ferrique <0,098mm Batch (100 mgP/L) pH=5,5 36,67 Ca+ Fe Activation : Song et al., 2011
20 4h (103°C) + concassage + 4hr (450°C) Cendres volantes Colonne 400 mgP/L pH = 9
32 Al + Ca +Fe Agyei et al., 2002
Cendres volantes Batch
63,2 Al + Ca +Fe Li et al., 2006 78,4 Al + Ca +Fe La CSP est augmentée par un chauffage thermique et un traitement à l’acide.
Cendres volantes Batch
0,67 Al Liang et He, 2011 1,72 Al Les cendres volantes ont été traitées au NaOH pour augmenter la capacité d’adsorption
21 pH = 12,3 Ciment Portland Colonne 400 mgP/L pH = 9 83 Ca Agyei et al., 2002 Drainage minier acide 149 µm Batch (utilisé comme un coagulant) 31,97 Fe + Al Wei et al., 2008 Ocre ferreux en granule 1,18 mm Colonne 11,2 mgP/L pH 7,8 [P]<1ppmm Ca + Fe pH final = 9-11 Litter et al., 2013 Batch 28-560 mgP/L 5,81 Oxyde de fer 68,6 µm Batch 5-150 mgP/L pH = 3,2 8,6 Al + Fe Zeng et al., 2006
22 Scorie d’acier brulée Batch (20-10000 mgP/L) 1,43 Ca Sakadevan et Bravor, 1998 Scorie Colonne 400 mgP/L pH = 9 60 Ca Agyei et al., 2002 Scorie (Furnace) Batch pH = 12,3 8,89 Xu et al., 2006 Scorie d’acier (Electric arc) 20-40 mm Pilote 2 ans (7,8 mgP/L) PT 37% Ca Barca et al., 2013 Scorie d’acier (Basic oxygène) 20-40 mm Pilote 2 ans (7,8 mgP/L) PT 62% Ca Barca et al., 2013 Scorie (Blast furnace ) Batch (20-10000 mgP/L) 44,2 Ca Sakadevan et Brevor, 1998
Scorie d’acier Colonne 8,26 Ca Claveau-Malette
23 Blast furnace « FS » (11-107 mgP/L) Scorie d’acier Blast furnace « B » Colonne (11-107 mgP/L) 4,54 Ca Claveau-Malette et al., 2013 Scorie d’acier Blast furnace Essai pilote 5 ans 8,2 mgP/L 72% Ca Shilton et al., 2006
* Certaines étude réalisée en colonne présente les performances d’enlèvement sous forme de % d’enlèvement
La majorité des médias les plus performants de cette catégorie utilisent le Ca comme élément actif. Les médias à base de CaO offrent de meilleures performances que les médias où le CaCO3 est la forme dominante. Claveau-Malette et al. (2013) vont encore plus loin en
identifiant la forme de calcium qui a l'impact le plus significatif sur la CSP (Tableau 3), selon cette étude le Ca14Mg2(SiO4)8 est directement responsable de la différence de performance
des deux types de scories qui contiennent pourtant une proportion semblable de CaO. Les matériaux comme la scorie utilisant le Ca comme élément actif sont efficaces en termes de CSP, mais ils sont aussi difficiles à opérer en contexte de traitement du phosphore provenant d’un effluent municipal. Le TRH, la température et le pH sont des facteurs qui influencent beaucoup la performance d’enlèvement. Certains facteurs peuvent nuire à la précipitation du P comme la présence de carbonates qui précipitent avec les Ca2+ en carbonate
de calcium ayant comme conséquence, la forte possibilité de colmater les filtres (Vohla et al., 2011). Une température faible réduit aussi les performances d’enlèvement (Barca et al., 2013). De plus, comme une quantité importante de Ca doit se solubiliser pour précipiter la
24
phosphore et que cette solubilisation est lente, la performance des filtres utilisant les scories est fortement lié au TRH. Plus le TRH est long plus le pH à la sortie sera élevé (Barca et al. 2013; Claveau-Malette et al., 2013). Donc, pour obtenir une haute performance d’enlèvement du P, le TRH doit être assez élevé pour qu’une quantité suffisante d'ions Ca2+ se solubilisent
et se complexent avec le P, cette dissolution entraine une hausse du pH à des niveaux dépassant souvent les normes de rejet et les risque de colmatage des filtres. Une étape supplémentaire de traitement est alors requise pour abaisser le pH avant le rejet à l’environnement (Vohla et al., 2011). Hussain et al. (2014) ont pallié à ce problème en ajoutant un bassin où du CO2 est diffusé pour augmenter le pH, cette opération augmente
toutefois le coût du système de traitement.
Pour la boue rouge, un autre matériel à base de Ca, les travaux de Zhao et al. (2009) ont montré que la CSP sera optimale pour un pH initial de 3.0 et un pH final de 10,9. Ces facteurs opérationnels sont particulièrement limitants dans le contexte d’une technologie passive d’enlèvement du phosphore des eaux usées municipales.
Outre les résidus de drainage minier acide utilisé comme coagulant par Wei et al. (2008), la meilleure performance d’un média utilisant un autre élément actif que le calcium a été trouvée par Zeng et al. (2006) avec une CSP de 8,6 mgP/g. Le pH de la solution utilisé est de 3,2 et la granulométrie est très fine (<70µm). Des tests avec des paramètres normaux d’opération seraient plus révélateurs de la capacité du média.
2.2.3.3 Médias synthétiques
Les matériaux synthétiques étudiés dans cette section sont à la base fabriqués pour capter divers polluants sous forme d’anion. Certains ont été conçus pour le phosphore et d’autres pas, mais tous les tests présentés dans le prochain tableau sont des résultats obtenus pour le traitement du phosphore. Parmi les matériaux utilisés on retrouve l’alumine activée, le Bauxsol, PhosphateTM, la Zéolite. Le Tableau 4 présente plusieurs études réalisées avec des
25
Tableau 4 : Résultats d'études réalisées sur différents médias synthétiques
Média Méthode CSP mgP/g Élément actif Référence
Alumine Activée 40 (pH =5) 14 (pH =7) Infos provenant du manufacturier Axens, 2010 Alumine Activée 0,3-1 mm Batch 10-1000 mgP/L 13,8 Al Genz et al., 2004 Bauxsol Batch (5,6 mgP/L) 0,46 Al + Fe + Ca Letshwenyo et al., 2014 Hydroxyde de fer en granule 0,3 – 2 mm Batch 10-1000 mgP/L pH = 5,5 23,3 Fe Genz et al., 2004 PhosfateTM Colonne synthétique (5,6 mgP/L) 2,3 Al + Fe + Ca Letshwenyo et al., 2014
Zéolite Batch 0,46 AL Drizo et al.,
1999 Zéolite Batch (20-10000 mgP/L) 2,15 Al Sakadevan et Brevor, 1998
26
Certains de ces matériaux comme l’alumine activée (14-40 mgP/g) et l’hydroxyde de fer en granule (23,3 mgP/g) offrent de bonnes CSP. Il s’agit des plus hautes CSP de matériaux qui n’utilisent pas le calcium comme élément actif. La performance de ces médias est quand même affectée par le pH, la CSP des matériaux de fer et d’aluminium augmente généralement avec un pH plus bas. Le gros problème avec ces matériaux est qu’ils sont beaucoup plus dispendieux que les produits naturels et les sous-produits industriels.
Certaines études ont également été menées sur l’utilisation de nanoparticules pour le traitement de divers polluants contenus dans les eaux usées (Xu et al., 2012). L’utilisation de nanoparticules à base d’oxydes de fer est particulièrement prometteuse dans le cas du traitement du phosphore, leurs fortes capacités d’adsorption, leurs tailles et leurs biocompatibilités en font des médias prometteurs. Par contre, pour que la technologie soit applicable elle doit répondre à plusieurs critères de faisabilités dont le coût est le plus limitant (Oller et al., 2011). En effet, le coût production souvent élevé de ces nanoparticules empêche leur utilisation à des fins de traitement de l’eau municipale décentralisée.
2.2.3.4 Médias activés
Comme peu des média naturels testés offrent des performances supérieures à 1 mgP/g de CSP, que les médias provenant de rejets industriels engendrent des problèmes opératoires (particulièrement ceux avec le Ca comme élément actif) et que les médias synthétiques sont trop dispendieux, plusieurs recherches se sont intéressées au conditionnement de matériaux pour obtenir des médias efficaces. L’efficacité d’opérations simples (augmentation de la surface spécifique, traitement thermique) a déjà été répertoriée dans les sections 2.2.2.1 et 2.2.2.2, mais la majorité des techniques d’activation concernant le fer et l’aluminium sont répertoriées et décrites dans cette section.
Les oxydes de fer et d’aluminium amorphes ont une plus grande capacité de sorption que les formes cristallines (Karam, 2014), un traitement thermique ou à l’acide permet de faire passer les oxydes cristallins à la forme amorphe, avec comme conséquence d’augmenter leur CSP (Liang et He, 2011; Seo et al., 2013). Li et al. (2006) utilisent un traitement thermique et à l’acide sur la boue rouge et sur les cendres volantes pour améliorer la CSP; un traitement
27 thermique à 700 °C permet de tripler la CSP de la boue rouge. Un traitement à l’acide (HCL 0,25M) a permis d’augmenter la CSP des cendres volantes de 25%.
Des épines de pin ont été modifiées par un procédé chimique couramment utilisé qui permet d’améliorer la capacité d’adsorption en surface de la lignocellulose. Les éléments adsorbant naturellement présents dans la lignocellulose n’ont pas de forte affinité avec le phosphore; les résultats n’ont donc pas été très concluants, la CSP trouvée étant de 0,889mgP/g (Benyoucef et Amrano, 2011).
Les médias activés qui ont les meilleurs potentiels sont souvent constitués d’un support chimiquement enrobé d’oxydes de fer et d’aluminium. Parmi les supports les plus utilisés, il y a les sous-produits du bois et la lignocellulose. Les produits naturels sont souvent les moins couteux et ceux disponibles en plus grande quantité (Cucarella et Renman, 2009).
Kuo et Bembenek (2008) ont développé une technique pour imprégner des oxydes de fer et d’aluminium sur du bois pour capter le chrome. Le chrome est un anion qui peut être capté de la même manière que le phosphore. La technique consiste à brasser des copeaux de bois dans une solution de chlorure ferrique puis à les mettre en contact avec de l’ammoniac gazeux pour former les oxydes de fer et d’aluminium, le média activé contient 120mg de fer par gramme de média. Kim (2005) a déposé un brevet présentant une technique d’imprégnation similaire. Le média préparé est constitué de feuilles de papier roulées finement puis découpées en fines tranches, les tranches sont mises en contact avec du chlorure ferrique avant d’être mises en contact avec une base liquide plutôt que gazeuse comme ce fut le cas pour Kuo et Bemnebek (2008). Les bases suggérées sont le NaOH, le KOH, le Ca(OH)2, et
le NH4OH. Sans déterminer la capacité maximale de sorption, Kim (2005) montre qu’elle est
minimalement de 2,95 mg P par gramme de média. Eberhardt et Min (2008) ont traité des copeaux de bois à l’aide de cellulose de carboxymethyl (CMC) avant de les imprégner au chlorure ferrique. Selon cette étude, le traitement avec CMC augmente le nombre de sites de liaison pour le fer. La CSP trouvée pour leur média est de 5,67 mg P par gramme de média. Par contre, la granulométrie choisie est particulièrement fine donc le média serait difficile à utiliser en essais en colonne ou en essai pilote.
28
Plusieurs matériaux non organiques ont aussi été activés comme la diatomite (Wenhui et Peng, 2008) ce qui a résulté à une CSP de 13,6 mgP/g à un pH de 8,5. Mostafa et al., (2011) ont développé une perlite activée qui est très efficace pour l’enlèvement de l’arsenic, le média n’a pas été testé pour le phosphore, mais les deux polluants ont des compositions chimiques semblables. L’un des médias activés qui présentent la meilleure CSP est le charbon activé imprégné à l’oxyde de fer développé par Shi et al., (2011). Le charbon activé est lavé au HCL puis trempé dans une solution de HNO3 pour une durée de 12 heures. Après un séchage
thermique de 24 heures, le charbon est trempé dans une solution de Fe(NO3)3*H2O et est
finalement exposé à du NaOH pour former les oxydes de fer. À un pH de 3, la CSP de ce média est de 98,39 mg P / g de média. Une activation a aussi été tentée sur des fibres de charbons activés (Zhou et al., 2012). La technique employée pour l’activation est comparable à celle de Shi et al., (2011), la CSP trouvée est de 12,9 mg P par gramme de média.
29
2.2.3.5 Synthèse
La synthèse des différents types de média est donnée au Le Tableau 5. Pour chaque type de média, la gamme générale de CSP ainsi que les principaux avantages et inconvénients sont donnés.
Tableau 5 : Synthèse des matériaux à capture passive
Matériel Gamme de CSP Avantage/inconvénient
Naturel Faible à Moyenne Peu coûteux. Disponibilité du matériel selon la géographie. Performance insuffisante.
Rejet industriel Moyenne à très forte
Peu coûteux. Bonne performance d’enlèvement. Problèmes opératoires majeurs.
Synthétique Forte à très forte Bonne performance d’enlèvement. Très coûteux.
Activée Moyenne à très
forte
Bonne performance. Cout de fabrication variable.
Les médias activés représentent probablement l’avenue la plus intéressante de développement pour un système de capture passive du phosphore. Ces matériaux ont généralement de fortes CSP et comme ils utilisent principalement le fer et l’aluminium comme élément actif ils ne font pas face aux problèmes opératoires rencontrés par les médias à base de calcium. Les coûts sont variables mais, ils peuvent être maintenus relativement bas en utilisant des supports naturels ou provenant de sous-produits industriels qui sont généralement peu coûteux et une activation simple à base de produits chimiques largement disponibles sur le marché.
30
2.3 Développement au CRIQ
Actif dans le domaine de l’éco-efficacité environnementale depuis plus de 25 ans, le centre de recherche industriel du Québec (CRIQ) travaille, entre autre, à développer des procédés de traitement passifs des eaux usées. Notamment, le procédé de biofiltration BiosorMD traite
efficacement la matière organique et l’azote ammoniacal des eaux usées. Le procédé BiosorMD consiste en un bassin rempli d’un lit organique constitué principalement d’un mélange de tourbe (20%) et de copeaux (80%) servant de support aux micro-organismes épuratoires (CRIQ, 2015). En raison des problématiques de rejets de phosphore énoncées précédemment pour les installations de traitement d’eau usée municipale à petits débits, le CRIQ a jugé bon de développer une technologie passive de capture du phosphore des eaux usées municipales afin de compléter le traitement effectué par le procédé BiosorMD.
Un projet de maitrise (Thibault, 2012) a donc été débuté pour analyser, à partir des recherches déjà faites au CRIQ, les possibilités et les voies à suivre pour développer un procédé de traitement passif du phosphore. Considérant la présence de copeaux de bois dans le biofiltre BiosorMD et le faible coût du matériel dans la région, l’utilisation d’un média activée à base
de broyure de bois a été favorisée par rapport à d’autres médias. La broyure activée est recouverte d’hydroxyde de fer pour augmenter son affinité chimique avec le phosphore. Une technique d’activation de la broyure a dû être développée et optimisée par Thibault (2012); celle-ci consiste à mélanger la broyure dans une solution de chlorure ferrique puis à l’exposer à du NH3 gazeux pour former des oxydes de fer en surface de la broyure. La technique
d’activation a été optimisée et les critères optimaux étaient :
Utiliser une solution de chlorure ferrique à 1,5 mole/l (240 g FeCl3/l)
Utiliser un temps d’imprégnation de 1 heure
Utiliser un ratio massique liquide d’imprégnation/broyure de 0,6:1
Thibault (2012) a conduit une série d’expériences pour optimiser l’utilisation de la broyure. Les paramètres optimaux déterminés lors de ces essais ont d’ailleurs été réutilisés dans ce projet.
31 Des essais en batch ont été menés pour déterminer l’effet de la température sur la capacité du média à capter le phosphore. La hausse de la température favorise légèrement la capture du phosphore. Toutefois, l’effet est négligeable pour la gamme attendue de température de l’eau usée municipale qui varie entre 7 et 24°C (MDDELCC, 2015).
D’autres tests ont été effectués sur l’effet du pH. La prise en charge du phosphore n’est pas affectée significativement par une variation du pH entre 4 et 9. Une valeur de pH en dehors de cet intervalle est peu probable pour un effluent municipal.
Le Tableau 6 présente les paramètres opératoires qui ont été utilisés pour les essais en colonnes réalisés par Thibault (2012). Alors que la granulométrie et le TRH ont été optimisés dans le cadre d’essai en batch, le mode opératoire idéal (percolation vs immersion) a été déterminé par un essai en colonne. Ces paramètres sont ceux qui seront repris dans le présent projet.