Mémoire de fin d’études : Master 2 Ingénierie de la Santé Parcours Qualité, Environnement, Santé et Toxicologie
Option « Toxicologie »
2017-2018
N
ANOPARTICULES
DANS LES ADDITIFS ALIMENTAIRES
ET LEUR TOXICIT
É
Benjamin L
EP
OLLOZECOctobre 2018
Directeur de mémoire : Sébastien Anthérieu
Président du jury : Franck-Olivier Denayer
Membre du jury : Bruno Teste
UNIVERSITÉ DE LILLE - Faculté Ingénierie et Management de la Santé 42 rue Ambroise Paré - 59120 LOOS
Table des matières
REMERCIEMENTS ... 8
AVANT-PROPOS ... 10
CHAPITRE 1: GENERALITES SUR LES NANOPARTICULES ... 14
1 Nanotechnologies, nano-objets et nanoparticules ... 14
1.1 Les sources de nanoparticules ... 17
1.1.1 Les sources naturelles et accidentelles ... 17
1.1.2 Les sources intentionnelles ... 18
2 Les usages des nanomatériaux ... 18
2.1 Exemples d’application des nanomatériaux par domaine ... 18
2.2 Application des nanomatériaux dans l’alimentation ... 19
3 Nanoparticules et société ... 21
CHAPITRE 2: CARACTERISER ET IDENTIFIER LES NANOPARTICULES DANS L'ALIMENTATION PAR DES MOYENS ANALYTIQUES ET REGLEMENTAIRES ... 24
1 Introduction ... 24
2 Caractéristiques physico-chimiques essentielles ... 24
2.1 Propriétés physico-chimiques pouvant affecter la toxicité des nanoparticules ... 24
2.2 Propriétés physico-chimiques innées ... 25
2.3 Propriétés acquises ... 26
3 Méthodes analytiques adaptées à l’étude des nanoparticules ... 27
3.1 Déterminer la taille, la forme et la surface spécifique des nanoparticules ... 27
3.1.1 Taille et distribution en taille des nanoparticules ... 27
3.1.2 Cas particulier de la XRD (X-ray diffraction) ... 27
3.1.3 Cas particulier de la DLS (dynamic light scattering) ... 27
3.2 Morphologie des nanoparticules ... 28
3.3 Surface spécifique des nanoparticules ... 28
3.4 Identifier la chimie élémentaire des nanomatériaux ... 28
3.5 Choix des méthodes analytiques et des paramètres à étudier ... 29
4 Premières preuves des effets des nanoparticules sur la santé... 31
4.1 Exposition professionnelle aux nanoparticules... 31
5 Réglementations sur les nanomatériaux manufacturés dans les additifs alimentaires ... 33
5.1 Réglementation sur les additifs : ... 33
5.2 Dispositifs de déclarations obligatoires des usages industriels des nanomatériaux ... 34
5.2.1 Le règlement REACH et l'enregistrement des nanomatériaux ... 34
5.2.2 R-Nano et les déclarations d'usages des nanomatériaux ... 35
5.3 Définitions réglementaires et règle d’étiquetage des nanomatériaux dans l’alimentation ... 36
5.3.1 Etiquetage des nanomatériaux en alimentation ... 38
5.3.2 Incohérence entre les analyses métrologiques dans l'alimentation et les déclarations R-Nano 39 5.4 Comment ces nanoparticules arrivent-elles dans les additifs alimentaires ? ... 40
6 Conclusion sur la caractérisation et l’identification des nanomatériaux ... 41
CHAPITRE 3: EFFETS TOXICOLOGIQUES LIES AUX NANOPARTICULES DANS LES ADDITIFS ALIMENTAIRES: EXEMPLES DU E 170 ET DU E 551 ... 42
1 L’expertise de l’Anses sur la question des nanomatériaux dans l’alimentation ... 42
1.1 Rôles et missions de l’ANSES ... 42
1.2 Travaux en cours sur les nanomatériaux dans l'alimentation ... 43
1.3 La démarche d’évaluation des risques dans l'alimentation ... 43
1.4 Les besoins du GT "nanomatériaux et alimentation"... 45
1.5 Plus-value de la base de données bibliographiques pour le GT et son utilisation dans ce mémoire 45 2 Méthode de recherche bibliographique ... 46
2.1 Choix des substances ... 46
2.2 Critères de sélection des articles scientifiques ... 47
2.3 Méthode d’extraction des données ... 48
2.4 Méthode de tri des articles ... 49
3 Etat de l’art des données toxicologiques sur les nanoparticules sélectionnées ... 50
3.1 Méthode employée pour l'état de l'art ... 50
3.2 Le carbonate de calcium (E 170) ... 50
3.2.1 Présentation de l’additif ... 50
3.2.2 Précisions concernant les connaissances actuelles sur la toxicité du E 170 ... 51
3.2.3 Preuves de la présence de nanoparticules dans le E 170 ... 52
3.2.4 Toxicité des CaCO3 NPs... 53
3.3 Etat de l'art de la toxicologie des NPs dans le E 551 ... 55
3.3.1 Présentation de l’additif ... 55
3.3.1 Preuve de SiO2 nano dans l’alimentation ... 56
3.3.1 Comportement du SiO2 ... 57
3.3.2 Revues de la littérature existantes sur les SiO2 NPs ... 57
3.3.4 données toxicologiques in vivo ... 62
4 Discussion ... 64
4.1 Déséquilibre de la quantité d'informations disponibles en fonction de la substance ... 64
4.2 Critique de la subjectivité dans le choix et l'analyse des articles des revues de la littérature ... 66
4.3 Critique des concentrations de SiO2 utilisées dans les études toxicologiques ... 67
4.4 Autres critiques des protocoles expérimentaux employés dans les études sélectionnées ... 68
4.5 Importance de l'état d'agrégation et des propriétés de surface dans la toxicité des nanoparticules 69 4.6 Les SiO2 NPs, des particules aussi toxiques par ingestion que par inhalation ? ... 70
4.7 Possible effet synergique des nanomatériaux ... 70
4.8 Effet "cheval de Troie" ... 71
4.9 Avis de l'EFSA sur l’évaluation des nanomatériaux ... 71
4.10 Mes recommandations ... 72
4.11 Vers des modifications ou améliorations des réglementations sur les nanomatériaux ? ... 73
CONCLUSION ... 76
ANNEXES: ... 78
Liste des figures:
Figure 1: Schéma d'une nanoparticule: ... 14
Figure 2: Schéma d'un nanotube ... 15
Figure 3: Schéma d'une nanoplaque ... 15
Figure 4: Nanostructure de la feuille de lotus ... 18
Figure 5: Propriétés physico-chimiques d'une nanoparticule ... 25
Figure 6: Propriété de la nanoparticule à adsorber des protéines (corona) ... 26
Figure 7: Liste d’ingrédients d’un emballage de complément alimentaire ... 38
Liste des tableaux:
Tableau 1 Code additif par fonction ... 34
Tableau 2 Récapitulatif des réglementations concernant les nanomatériaux dans les additifs alimentaires : ... 36
Tableau 3 Règlements sur la déclaration de nouveaux additifs ... 38
Tableau 4 Règlement relatif à la déclaration des nanomatériaux dans R-Nano ... 40
Tableau 5 : Sous-requêtes pour l'extraction des articles scientifiques ... 48
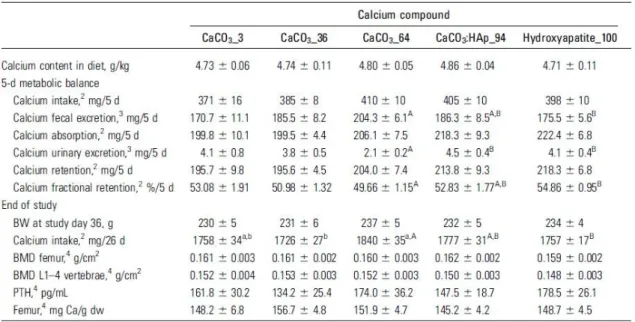
Tableau 6 Rétention et excrétion des NPs de carbonate de calcium ... 54
Tableau 7 Tableau récapitulatif des différentes dénominations du E 551: ... 55
Tableau 8 Etudes de toxicité in vitro des nanoparticules de SiO2 food-grade ... 59
Tableau 9 Etudes de la toxicité in vivo des nanoparticules de SiO2 food-grade ... 62
Tableau 10 Caractérisation de la taille des NPs dans l'étude de Decan et al. ... 67
Liste des abréviations:
Anses: Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail
CES: Comité d’Experts Spécialisés EFSA: European Food Safety Authority ERS: Evaluation des Risques Sanitaires
FAO: Organisation des Nations unies pour l’alimentation et l’agriculture FG: Food-grade
GT: Groupe de Travail
MCDA: Matériau au contact des denrées alimentaires
MTT: 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide
MP: Microparticule (particule dans la taille est de l'ordre de 1 µm ou plus)
N° CAS: Numéro d'enregistrement unique auprès de la banque de données Chemical
Abstracts Service (CAS)
NP: Nanoparticule
OMS: Organisation Mondiale de la Santé ONG: Organisation Non Gouvernementale PUF: particule ultrafine
REACH: Règlement sur l'enregistrement, l'évaluation et l'autorisation des produits chimiques
R-Nano: Registre français de déclaration des substances à l'état nanoparticulaire ROS: Espèces réactives de l'oxygène
SEM: Microscopie électronique à balayage TEM: Microscopie électronique à transmission
UERCA – Unité d’Evaluation des Risques Chimiques liés aux substances dans les Aliments
Remerciements
Je tiens d’abord à remercier toute l’équipe pédagogique de l’ILIS et monsieur le doyen Franck-Olivier Denayer. Plus particulièrement je voudrais remercier monsieur Guillaume Garçon, pour son soutien dans ma recherche de stage, monsieur Sébastien Anthérieu, pour son aide dans la rédaction de ce mémoire, ainsi que madame Sophie Lecuona pour ses conseils et sa gentillesse.
Mes remerciements vont également à mes maîtres de stage de l’Anses, messieurs Gilles Rivière et Bruno Teste, qui m’ont chaleureusement accueilli au sein de l’unité UERALIM, grâce à qui j’ai eu la chance d’entreprendre un stage passionnant et de découvrir les travaux d’expertise menés par l’agence.
J’en profite d’ailleurs pour remercier le président du groupe de travail « nanomatériaux et alimentation », monsieur Fabrice Nesslany, et tous les experts du groupe de travail, pour m’avoir impliqué au sein de ce travail, pour tous ces échanges enrichissants et pour l’intérêt porté à mes travaux durant mon stage à l’Anses.
Enfin, je souhaite remercier toutes les personnes de l’Anses qui m’ont apporté leur soutien, leurs conseils et leur bonne humeur au cours de ce stage, en particulier mes acolytes du bureau 601, Ludovic Pépin, Manon Pruvost-Couvreur et Samuel Sitruk, sans oublier Victoire Lamarca, Hélène Serra, Fernando Aguilar, Frédérique Audiat-Perrin et Géraldine Carne.
Avant-propos
Au début des années 2000, l’essor rapide de nouvelles technologies utilisant des nanoparticules, dans de nombreux secteurs industriels, amène de nouveaux enjeux sanitaires. En effet, les risques pour la santé dus à l’usage de ces particules dites « infiniment petites » sont alors inconnus. Pour tenter de comprendre ces risques, des projets internationaux tel que NANOSAFE sont mis en place. Initié par le CEA (Commissariat à l’Energie Atomique et aux énergies alternatives) et soutenu par la Commission Européenne (CE), ce projet européen avait pour but d’évaluer les risques émergents liés aux nanotechnologies (NANOSAFE 2004). Cet intérêt international a permis de promouvoir la recherche scientifique sur les nanotechnologies, afin de développer ces technologies tout en maitrisant leurs risques. D’autres projets internationaux sont nés à l’instar de NANOSAFE comme les projets NANOINTERACT, NANOSH et NANOGENOTOX. L’objectif de NANOINTERACT était de développer des outils capables d’étudier les interactions des nanoparticules avec le vivant (NANOINTERACT 2011). Dans le cas de NANOSH, c’est la toxicité des nanoparticules qui a été étudiée, en particulier dans le cas d’expositions professionnelles par inhalation (NANOSH 2006). Quant au projet NANOGENOTOX, celui-ci s’est focalisé sur la caractérisation physico-chimique des nanoparticules et l’évaluation de leur génotoxicité (NANOGENOTOX and Fessard 2009). C’est également à partir de ce moment que le nombre de publications scientifiques sur les risques des nanoparticules a commencé à croître rapidement, avec la publication des premières revues de la littérature sur le sujet (Hoet, Brüske-Hohlfeld, and Salata 2004). Ces avancées ont permis à la communauté scientifique de se rendre compte que la toxicité et les risques liés aux nanoparticules ne peuvent être évalués de la même façon que les substances chimiques conventionnelles. Par conséquent, il est nécessaire d’appliquer une méthodologie adaptée aux nanoparticules afin de générer des données toxicologiques pertinentes pour leur évaluation.
La capacité à explorer le « nano-monde » est au cœur de cette méthodologie, et c’est aussi cette capacité qui a permis aux nanotechnologies de naître dans les années 80. En effet, l’exploration du « nano-monde » est devenue possible grâce au perfectionnement du microscope électronique à transmission inventé 50 ans plus tôt. Il est alors devenu possible d’observer l’atome en atteignant des résolutions d’image de l’ordre
de 0,1 nanomètre, soit 10-10 mètres. En 1981, le premier microscope à effet tunnel voit le jour et permet d’observer des atomes et même de les manipuler de manière simple. En 1985, le premier microscope à force atomique permet de réaliser la topographie de surface des échantillons à l’échelle atomique. La même année, une nouvelle forme du carbone, qui n’existe pas dans la nature, est inventée par Harold Kroto, James Heath, Sean O'Brien, Robert Curl, and Richard Smalley (Kroto et al. 1985). C’est une sphère de 1 nm de diamètre composé de 60 atomes de carbone que l’on nommera « fullerène », et grâce à laquelle ils obtinrent le prix nobel de chimie en 1996. Grâce à cette découverte, une autre forme de carbone non naturelle est découverte par hasard en 1991 par Iijima : le nanotube de carbone. Ce tube de carbone de 1nm de diamètre s’avèrera d’après Smalley 100 fois plus résistant et 6 fois plus léger que l’acier (Smalley R 1999). Ce matériau sera alors produit en masse et utilisé dans de nombreux domaines (militaire, automobile, électronique, etc.). Ce sont autant d’inventions qui créeront l’engouement vis-à-vis des
nanosciences, dont l’engouement et l’intérêt technologique deviendra multidisciplinaire.
Leurs utilisations vont ainsi s’étendre au domaine de l’agroalimentaire. En effet, la forme nanoparticulaire procure dans certains cas une (ou plusieurs) fonction(s) technologique(s) nouvelle(s) aux substances chimiques, comme c’est le cas pour le dioxyde de silicium qui, sous sa forme nanoparticulaire uniquement, devient anti-agglomérant, une propriété très utile en agroalimentaire.
C’est pourquoi à partir de 2013, en France, un système de déclaration obligatoire, baptisé R-Nano, est mis en place à destination des fabricants et importateurs de substances à l’état particulaire. Celui-ci révèle qu’en 2017 108 entreprises ont déclaré utiliser des nanoparticules dans le secteur d’utilisation « fabrication de produits alimentaires ». L’utilisation des nanoparticules s’est donc bien étendue à l’agroalimentaire, ce qui pose un nouveau problème en termes d’enjeux sanitaires. Depuis, des Organisations Non Gouvernementales (ONGs) ont alerté sur le sujet, en pointant notamment du doigt les additifs alimentaires comme responsables de la présence de ces nanoparticules (Agir pour l'environnement 2016). L'exposition des consommateurs par l'intermédiaire de l'alimentation et la toxicité propre à ces nanoparticules sont pour l'heure mal décrites par manque de données pertinentes, et le risque sanitaire qui en résulte est inconnu. Dans le but d'élucider en partie le risque lié à l'exposition aux nanoparticules dans l'alimentation, ainsi que les obstacles inhérents à cette évaluation du risque, nous essaierons de répondre aux questionnements suivants:
1) Quels sont les moyens analytiques et les dispositions réglementaires permettant, ou ayant pour vocation, l'acquisition de données sur l'exposition et la toxicité des nanoparticules à travers leur présence dans les additifs alimentaires ?
2) Quelle est la toxicité des nanoparticules présentes dans les additifs alimentaires et est-elle significativement différente de la toxicité générée par les mêmes particules à l'échest-elle non nanométrique ?
Pour se faire, nous définirons ce qu’est une nanoparticule et ses usages. Pour ensuite montrer que, s'il est difficile d'identifier et de caractériser les nanoparticules dans l’alimentation et dans l’organisme, il est nécessaire d'employer des méthodes analytiques adaptées. Puis, après avoir établi la preuve de l'existence de nanoparticules dans les additifs alimentaires, nous étudierons les effets toxicologiques spécifiquement induits par ces nanoparticules à travers deux exemples: Les nanoparticules de carbonate de calcium dans l'additif E 170, et les nanoparticules de dioxyde de silicium dans l'additif E 551. Enfin, nous discuterons des incertitudes et des limites associées à ces données toxicologiques, ainsi que des besoins futurs pour permettre une évaluation du risque sanitaire pertinente de ces substances.
Chapitre 1:
Généralités sur les nanoparticules
1 Nanotechnologies, nano-objets et nanoparticules
Les sciences étudiant "l'infiniment petit", ou nanosciences, ont donné naissance à ce que l’on appelle «les nanotechnologies ». Ces nanotechnologies désignent toutes les technologies engendrées par les nanosciences, visant à fabriquer, manipuler et
caractériser les éléments à l’échelle nanométrique. Le préfixe « nano », qui apparaît
souvent dans le domaine des nanosciences, provient du grec "nânos" signifiant "nain", et sert à rappeler cette particularité des nanosciences à étudier l'échelle nanométrique.
Définition de l’échelle nanométrique :
Échelle de longueur s’étendant approximativement de 1 à 100 nanomètres.
Un nanomètre, abrégé « nm » dans le système international d’unités (SI), représente un milliardième de mètre, soit 10-9m. A titre de comparaison, le virus de la grippe, qui est sphérique, mesure approximativement 100 nm.
Ces éléments à l’échelle nanométrique sont caractérisés par leur taille mais aussi par leur forme. Ils forment ce que l’on nomme les « nano-objets » et constituent les particules primaires des nanotechnologies. On distingue 3 catégories de nano-objets, selon qu’ils possèdent 1, 2 ou 3 dimensions à l’échelle nanométrique (c’est-à-dire inférieure à 100 nm). Cette catégorisation est définie au niveau européen par la norme ISO/TS 80004-2:2015, on y retrouve :
Figure 1: Schéma d'une nanoparticule:
Les nanoparticules (figure 1):
Nano-objet dont toutes les dimensions externes sont à l’échelle nanométrique et dont les longueurs du plus grand et du plus petit axe ne diffèrent pas de façon significative. Elles sont par conséquent généralement sphériques :
Les nanofibres (figure 2): Nano-objet ayant deux dimensions externes à l'échelle nanométrique et la troisième dimension externe significativement plus grande. Ces nanofibres peuvent être creuses, auquel cas on les appellera « nanotubes »:
Figure 2: Schéma d'un nanotube
Les nanoplaques (figure 3):
Et les nano-objets dont une seule dimension externe est à l’échelle nanométrique (entre 1 et 100 nm) et les deux autres significativement plus grandes forment des « nanoplaques »:
Figure 3: Schéma d'une nanoplaque
Il est important de noter qu’une même substance chimique peut être sous forme nanométrique (constituée de nanoparticules par exemple), ou sous forme conventionnelle (non-nanométrique). Cet état dépend de son origine ou du gradient de taille dans lequel la substance a été fabriquée. De plus, une substance nanométrique peut observer des distributions en taille très variées, du moment que les particules qui la compose restent comprises entre 1 et 100 nm, ou conservent les propriétés de la nano-échelle. Cette diversité dans la distribution en taille des particules peut aussi provenir de conséquences naturelle ou résulter de leur processus de fabrication.
N'importe quelle substance chimique pouvant en théorie être considérée comme un nano-objet selon un critère de taille, ce qui explique l'existence d'une grande diversité de nano-objets, pouvant remplir de nombreuses fonctions. Ceci est d’autant plus vrai que la nano-échelle peut modifier les propriétés physico-chimiques de la substance au point de
lui conférer une fonction technologique qui n’existera qu’à cette échelle. C'est pourquoi il existe une si grande variété d'usages des nanoparticules et autres nano-objets dans différents domaines (cf p.18).
Les formes vues précédemment constituent les formes primaires des matériaux à base de nano-objets (ou nanomatériaux), mais il existe des niveaux supérieurs de structuration de particules nanométriques, notamment sous forme d'agrégats, d'agglomérats ou de polymères. Des propositions de classification de ces "nanostructures" existent mais ne sont à ce jour fixées réglementairement (e.g. classification des nano-objets par Bouwmeester et al. (Bouwmeester et al. 2009): Annexe 1)
Au niveau mondial, ce seuil de 100 nm pour décrire la nano-échelle et la nanoparticule est couramment admis. La Food and Drug Administration (FDA) américaine utilise également le seuil de 100 nm pour décrire la nano-échelle, et au niveau européen, des définitions comparables à celles de la norme ISO/TS 80004-2:2015 pour décrire les nanoparticules sont utilisées:
Définition d'une nanoparticule par le SCENIHR (Scientific Committee on Emerging and Newly Identified Health Risks): « a discrete entity that has three dimensions of the order of 100 nm or less. » (SCENIHR 2007)
Les nanomatériaux:
Le consensus pour ce qui est de définir ce qu'est la nano-échelle, et par la même occasion une nanoparticule, est relativement bien établie. Nous n'avons ici présenté qu'une proposition de catégorisation des nano-objets parmi plusieurs propositions existantes, néanmoins celles-ci se rejoignent sur la description des formes existantes. A contrario, les choses se compliquent lorsqu’il s’agit de définir un nanomatériau (cf page 36). Il est vraisemblablement plus difficile d'avoir un consensus sur une définition lorsque celle-ci engendre de nombreuses conséquences réglementaires, politiques et économiques.
Nous définirons un nanomatériau selon la définition suivante:
Nanomatériaux: particules à l’échelle nanométrique ou ayant des propriétés typiques de la nano-échelle, pouvant se trouver à l’état dispersé, agrégé ou aggloméré.
Un nanomatériau peut être composé de plusieurs substances (composite), il peut également présenter des impuretés.
Lorsqu'un nanomatériau est fabriqué par l'Homme et a pour but de réaliser une fonction bien précise on l'appelle "nanomatériau manufacturé".
Autrement dit, un nanomatériau manufacturé est produit intentionnellement dans le but d'avoir une fonctionnalité bien précise.
Terminologie choisie pour décrire l es particules nanométriques:
Nous nous intéresserons ici aux nanoparticules présentes dans les additifs alimentaires. Par soucis de simplification, nous parlerons uniquement de "nanoparticules" (ou NPs) car bien qu'il existe d'autres formes de nano-objets dans l'alimentation, celles qui nous intéresserons plus particulièrement sont sphériques et sont des nanoparticules.
De plus, comme nous parlerons principalement des nanoparticules dans les additifs alimentaires, et que la notion d'additif intègre également les notions "d'intentionnalité" et de "fonctionnalité" des nanomatériaux manufacturés, nous utiliserons indifféremment les termes "nanoparticules" et "nanomatériaux" pour parler d'elles.
1.1 Les sources de nanoparticules
1.1.1 Les sources naturelles et accidentelles
Les nanoparticules peuvent être produites accidentellement par des procédés industriels, généralement thermiques (galvanisation, soudage, découpage) ou mécanique (ponçage, perçage, polissage), ou par simple combustion (incinération, émissions des moteurs thermiques). Les procédés qui utilisent ou fabriquent ces nanoparticules peuvent également en émettre accidentellement dans l’air. Pour nommer ces nanoparticules émises dans l’air, dont la voie d’exposition majoritaire est l’inhalation, on utilisera aussi le terme de « particule ultrafine » (abrégé « PUF »).
Les particules ultrafines peuvent également être émises naturellement dans l’environnement, par exemple lors des éruptions volcaniques.
Outre ces particules fines atmosphériques, des nanostructures peuvent être trouvées dans la nature. On peut citer l'exemple de la feuille de lotus (figure 4), dont la nanostructure en picots au niveau de sa cuticule lui confère une super-hydrophobicité par réduction des tensions de surface (Zheng et al. 2008) :
Figure 4: Nanostructure de la feuille de lotus
1.1.2 Les sources intentionnelles
Un nanomatériau peut être produit accidentellement par l’Homme, mais dans la majorité des cas il est manufacturé pour remplir un objectif technologique précis. Parmi eux ces nanomatériaux manufacturés, on distingue :
- Les nanomatériaux inorganiques : solides et généralement constitués de métaux (argent, aluminium, or) ou d’oxydes de métaux (oxyde de fer, dioxyde de titane, dioxyde de silicium, dioxyde de zinc) ou d’autres minéraux (carbonates, phosphates,…).
- Les nanomatériaux organiques : vésicules lipidiques d’origine naturelle (micelles de
la caséine du lait) ou manufacturée, qui permettent d’augmenter la disponibilité de molécules hydrophiles (Aguilera 2014).
- Les nanomatériaux composites : Nanocomposites à base de graphène, de nanotubes de carbone (NTCs)(propriétés mécaniques), zéolites (techniques de purification et de séparation), oxydes de métaux mésoporeux (adsorbants, catalyseurs) etc. (Visakh and Martínez Morlanes 2016)
2 Les usages des nanomatériaux
2.1 Exemples d’application des nanomatériaux par domaine
De nos jours les nanomatériaux sont utilisés dans de nombreux domaines : cosmétiques, biomédicale, électronique, science des matériaux :
En science des matériaux :
Certains nanomatériaux comme les NTCs mono-feuillets (Single-Walled Carbon
MWCNTs), sont très utiles pour leurs propriétés mécaniques. Ils sont plus solides, six fois moins denses et dix fois plus élastiques que l'acier.
Dans le domaine de l’électronique :
Les nanoplaques (de sélénium par exemple) sont utilisées comme semi-conducteurs.
En cosmétique :
Les nanoparticules peuvent être utilisées pour augmenter l’absorption percutanée des substances actives (Khezri, Saeedi, and Maleki Dizaj 2018), par exemple avec des fullerènes (Mousavi, Nafisi, and Maibach 2017). Elles sont aussi utilisées en tant qu’additifs pour stabiliser le produit, augmenter sa conservation ou encore le colorer, avec des nanoparticules de dioxyde de titane utilisées comme colorant blanc (Weir et al. 2012).
Dans le domaine biomédical :
Du fait de leur taille et de leur réactivité les nanomatériaux sont capables de servir de véhicule à d’autres substances pour délivrer des médicaments ou des gènes grâce aux liposomes par exemple (Panahi et al. 2017). Des nanoparticules poreuses comme la silice mésoporeuse (Bitar et al. 2012) sont particulièrement efficace en thérapie ciblée. Les nanoparticules de silice peuvent aussi être utilisées pour faire de la détection d’ADN par fluorescence. La silice peut également servir d’auxiliaire en imagerie médical, tout comme les nanoparticules d’or (Viarbitskaya et al. 2011), d’argent (Gong et al. 2007) ou d’oxydes de fer (Lee et al. 2009). De nombreux nanomatériaux peuvent aussi servir d’outils diagnostiques, pour la détection ou la quantification de biomarqueurs (e.g. la nanocellulose (Golmohammadi et al. 2017), les nanoparticules magnétiques (Zhang, Guo, and Cui 2009), les quantum dots (Deng et al. 2007), les nanoparticules de dioxyde de zinc (Lu et al. 2008), les nanoparticules de carbonate de calcium (Shan et al. 2007))
Ces nombreuses applications montrent bien l'intérêt fonctionnel des nanomatériaux, et c'est pourquoi ils ont également trouvé leur place en agroalimentaire.
2.2 Application des nanomatériaux dans l’alimentation
Les nanomatériaux sont utilisés dans l’agroalimentaire selon 3 usages :
- En tant qu’additif alimentaire dans le produit fini - En tant qu’additif support
Fonction des nanomatériaux dans les MCDA :
Les MCDA ont pour rôle de prévenir la détérioration des qualités nutritives et organoleptiques des aliments, et d’assurer leur conservation. Pour assurer ces fonctions, on y trouve des matériaux empêchant le passage de l’oxygène et des UV à travers l’emballage, le développement des micro-organismes, régulant l’humidité et le pH, et permettant la stabilité des nutriments. Or certains nanomatériaux permettent de remplir cette fonction mieux que le ferait des substances non nanoparticulaire, c’est pourquoi ils sont utilisés dans les MCDA (Martirosyan and Schneider 2014). Les nanomatériaux peuvent être utilisés pour concevoir des MCDA intelligents, qui permettent par exemple de suivre ces paramètres de pH, d’humidité, etc (Neethirajan and Jayas 2011).
Exemple de nanomatériaux MCDA par fonction :
- Antimicrobienne : nanoparticules d’argent (Ag NPs)(Panea et al. 2014).
- Anti-oxygène : nanocomposites contenant des nanoparticules de dioxyde de titane (TiO2 NPs)(Mills et al. 2006).
- Contrôle de l'humidité :nanoparticules d’oxyde de zinc (ZnO NPs), nanoparticules
d’oxyde d’aluminium (Al2O3 NPs), TiO2 NPs (Goudarzi, Shahabi-Ghahfarrokhi, and Babaei-Ghazvini 2017, He et al. 2016).
- Conservation des qualités nutritives: Nanocomposites (polymères à base de silicates, titanate, NTC) et nanocomposites biodégradables (cellulose, amidon, polylactide (PLA), pectine, etc.)(Tang et al. 2012).
Fonction des nanomatériaux dans les additifs :
D’après l’EFSA (European Food Safety Authority) les additifs alimentaires sont des substances ajoutées intentionnellement aux aliments pour exercer certaines fonctions technologiques spécifiques, par exemple pour colorer, sucrer ou contribuer à la conservation des aliments. Ils peuvent aussi servir à améliorer la texture de l’aliment, ou encore sa qualité nutritionnelle. Ces fonctions sont généralement assurées par des particules non-nanométriques, néanmoins certaines fonctions n'existent que grâce aux nanoparticules:
Les nanoparticules peuvent par exemple servir à l’encapsulations des nutriments. En plus de protéger les nutriments, elles leur permettent d’être mieux absorbées par l’intestin grâce à la petite taille et la grande surface spécifique des particules produites, mieux absorbées qu’elles ne le seraient à l’échelle non nanométrique (Dwyer et al. 2015).
Exemples de nanomatériaux dans les additifs alimentaires par fonction:
- Encapsulants : nanoparticules de carbonate de calcium (CaCO3 NPs)(Kurapati and Raichur 2013) et nanoparticules de dioxyde de silicium (SiO2 NPs)(Pérez-Esteve et al. 2016)
- Enrichissant alimentaire : Les nanoparticules d’oxyde de fer (Fe2O3 NPs) utilisées
comme supplément en fer en cas d’anémie (Behera et al. 2014), ou les CaCO3 NPs pour augmenter la biodisponibilité du calcium dans le lait (Erfanian, Rasti, and Manap 2017)
- Colorant : nanoparticules d’oxyde de fer (Aquilina et al. 2016) - Anti-agglomérant : SiO2 NPs
Actuellement les nanomatériaux les plus utilisés en termes d’usages dans l'alimentation sont des inorganiques (Ariyarathna, Rajakaruna, and Karunaratne 2017). Ils ne sont pas les plus utilisés en terme de quantité, car il est plus simple et préférable pour les industriels d'utiliser des additifs reconnus sans danger (U.S. Food and Drug Administration 2007). Néanmoins, ils sont fréquents et sont les plus douteux en matière de toxicité. Ces additifs inorganiques emploient un nombre limité d'éléments chimiques (Zn, Al, Ti, Au, Ag, Si, Cu, Co, et Fe) et sont généralement sous forme de métaux ou d'oxydes de métaux (ZnO, Al2O3, TiO2, SiO2, Fe2O3). Parmi eux, les plus fréquents sont le dioxyde de titane (TiO2), les aluminosilicates, et le dioxyde de silicium (SiO2)(Lomer et al. 2004).
3 Nanoparticules et société
Le développement de technologies utilisant les nanomatériaux offre une valeur ajoutée à ces technologies, comme on a pu le voir à travers leurs nombreux champs d’application, mais constitue aussi un risque émergent encore mal cerné. Le caractère anxiogène associé à toute exposition, outre le danger qu’elle peut représenter, est très lié aux preuves que cette exposition existe et touche le public. En effet, si nous prenons pour exemple l’usage des nanotubes de carbone (NTC) pour augmenter la résistance mécanique des matériaux (ex : équipements sportifs en fibre de carbone, carrosseries automobiles), cet usage des NTCs n’est pas anxiogène pour le consommateur car il ne semble pas présenter de risque pour la population générale en termes d’exposition. D’autres voies d’exposition sont en revanche plus anxiogènes pour la population, c’est le cas de l’alimentation. A l’instar des OGMs (Organismes génétiquement modifiés), dont le risque perçu a rapidement été considérable du simple fait de leur présence dans notre
alimentation, un phénomène similaire semble gagner les consommateurs vis-à-vis des nanoparticules, ce qui peut être lié au fait que l'exposition aux nanoparticules dans l'alimentation est cachée et non consentie.
A partir du moment où cette exposition est suggérée mais mal expliquée et mal cadrée réglementairement elle n'en devient que plus anxiogène.
Les risques alimentaires sont d'ailleurs particulièrement anxiogènes pour les français car ils concernent inévitablement tout le monde, à tous les âges, y compris les populations sensibles : les femmes enceintes, les enfants et les personnes âgées. Ces risques doivent être maitrisés en amont par les différents acteurs de la chaine de fabrication des aliments et évalués par des agences publiques de sécurité sanitaire des aliments, comme l’Anses ou l’EFSA. Mais dans le cas d’un risque encore mal connu et mal circonscrit, le seul recours pour le consommateur est d’être le mieux informé possible de ce que contiennent ses aliments, ce qui passe par l’étiquetage des ingrédients.
Or, la présence de nanoparticules dans les aliments, bien que réelle, n’est à ce jour pas étiquetée en vertu de la réglementation sur l'étiquetage que nous verrons par la suite. La question de la présence de nanoparticules dans l’alimentation est soulevée pour la première fois par l’institut national néerlandais pour la santé publique et l’environnement (RIVM) en 2007 (Bouwmeester et al. 2007), puis par l’Afssa en 2009 sous l’impulsion de la Direction générale de la santé (DGS)(Afssa 2009). En juin 2016, l’ONG Agir pour l’environnement publie un communiqué de presse démontrant cette fois la présence de nanoparticules dans l’alimentation selon des analyses métrologiques.
Ces analyses sont les seuls moyens irréfutables pour identifier et caractériser les nanoparticules directement dans la matrice alimentaire. Il s’agit là d’une étape préliminaire importante pour justifier de la nécessité de mener une évaluation des risques liée à ces nanoparticules dans l’alimentation. En outre, il est essentiel de disposer de méthodes analytiques adaptées aux nanoparticules pour mener à bien les essais toxicologiques. Il faut pouvoir vérifier à tout moment la présence de ces nanoparticules, de l’aliment à l’organisme, ou de la dose administrée à la cellule cible, de manière quantitative et qualitative. Pour une substance classique, connaître la dose administrée peut être suffisante, mais pour une nanoparticule, l’effet est fortement associé à ses propriétés physico-chimiques, par exemple la distribution en taille des particules au sein de l’échantillon : de la poudre de nanoparticules de dioxyde de silicium dont les particules mesurent 10 nm en moyenne n’aurait pas la même toxicité que si ses particules
mesuraient 100 nm. On a donc besoin de méthodes analytiques capables de mesurer cette distribution en taille (caractérisation quantitative). Il faut également être sûr que ce que l’on quantifie correspond à la nanoparticule que l’on recherche (caractérisation qualitative).
C’est pourquoi il est nécessaire d’avoir des méthodes qualitatives et quantitatives adaptées aux nanoparticules pour évaluer leur toxicité.
Chapitre 2:
Caractériser et identifier les nanoparticules dans
l'alimentation par des moyens analytiques
et réglementaires
1 Introduction
Comme toutes particules ou substances, les nanoparticules (NPs) peuvent être définies par un grand nombre de paramètres physico-chimiques, mais les particularités des NPs rendent leur l'identification et leur caractérisation difficile dans l'alimentation.
Dans un premier temps, nous nous intéresserons plus spécifiquement aux paramètres physico-chimiques importants pour caractériser les nanoparticules. Comprendre ces paramètres est essentiel car ce sont eux qui modulent le comportement particulier des nanoparticules dans leurs interactions avec l’organisme, et par la même occasion leur toxicité.
Dans un deuxième temps, nous verrons les méthodes analytiques permettant de caractériser ces paramètres en vue d'être utilisé pour identifier les nanoparticules dans l'alimentation ou dans les protocoles expérimentaux.
Dans un troisième temps, nous discuterons des moyens réglementaires existants pour montrer la présence des nanoparticules dans l'alimentation, et de la nécessité d'avoir recours aux méthodes analytiques pour étudier notre exposition aux nanoparticules par l'alimentation.
2 Caractéristiques physico-chimiques essentielles
2.1 Propriétés physico-chimiques pouvant affecter la toxicité des nanoparticules
Selon l’EFSA, dans son guide sur l’évaluation du risque relatif aux nanotechnologies dans l’alimentation (Hardy et al. 2018), il est difficile de faire une liste courte et exhaustive des paramètres pouvant influencer la toxicité d'une nanoparticule l'EFSA, mais elle retient:
1) Sa morphologie, sa taille et sa surface spécifique,
2) Sa capacité à changer de propriétés de surface, et à produire des néoformés ou métabolites,
3) Son hydrophobicité/hydrophilie,
4) Sa stabilité/persistance (dans l'eau, les graisses, les fluides corporels, et son manque de capacité à se dissoudre/se dégrader),
5) Sa réactivité chimique et biologique (par exemple sa biodisponibilité)
6) Son activité antimicrobienne (sur l'équilibre de la flore intestinale par exemple). 7) Sa mobilité (transport à travers les membranes ou via macrophages etc.)
8) Sa capacité à potentialiser d'autres substances (par exemple en les adsorbants et en les aidant à franchir les barrières)
9) Plus généralement sa capacité à interagir avec d'autres molécules 10) Et sa bioaccumulation.
Ces lignes directrices nous permettent de comprendre la diversité d'étudiés de multiples paramètres physico-chimiques. C'est cette étude scrupuleuse, notamment des paramètres les plus importants que sont la morphologie, la taille, la charge de surface et la nature chimique, qui permettra aux articles scientifiques étudiant les nanoparticules (NPs) d'être pertinent.
La physico-chimie d'une NP peut être décomposée en deux catégories: les propriétés innées de la NP, et ses propriétés acquises.
2.2 Propriétés physico-chimiques innées
Source: (Rauch et al. 2013)
Les propriétés innées de la NP sont celles qui sont uniquement liées à la nature de la particule en elle-même et qui n'ont pas vocation à changer au cours du temps. C'est le cas de la forme de la nanoparticule, de sa composition chimique, de sa fonction et de sa taille (en tout cas de la taille du coeur de la NP, ici figuré en rouge sur la figure 5)
2.3 Propriétés acquises
Une fois dans l’organisme, les nanoparticules ont la faculté d’adsorber à leur surface les protéines de l’organisme. La force de cette adsorption dépend de l’affinité des protéines avec la particule, elle-même dépendante de la fréquence de contact entre la protéine et la particule, et de la force de la liaison (soit du coefficient de dissociation à l’équilibre (Kd)). Les protéines ainsi adsorbées forment la « corona » (figure 6) de la NP, et influencent sa toxicocinétique, c'est-à-dire sa capacité à se déplacer dans les tissus. A l'inverse, la corona des NPs peut également permettre à d'autres molécules d'être absorbées sur le passage de la nanoparticule, pendant que celle-ci franchie une barrière épithéliale par exemple, augmentant par conséquent l'absorption cette fois de ces autres molécules (Saptarshi, Duschl, and Lopata 2013). L'adsorption de ces protéines est un processus très dynamique, avec adsorptions et désorptions fréquentes. Cette corona est très importante car elle influe sur l'ADME de la NP (Absorption, Distribution, Métabolisation, Elimination)
Figure 6: Propriété de la nanoparticule à adsorber des protéines (corona)
Source : (Devineau, Boulard, and Labarre 2013)
Une autre propriété acquise essentielle est la charge de surface, qui peut varier en fonction du milieu dans lequel se trouve de la NP, et est également liée à sa corona. Cette charge peut fortement moduler les interactions de la NP avec son milieu et sa biodisponibilité, un facteur important influençant la toxicité.
La particularité des nanoparticules est que sa petite taille rend certains de ces paramètres particulièrement compliqués à étudier, ce qui nécessite l'emploi de méthodes analytiques bien précises.
3 Méthodes analytiques adaptées à l’étude des nanoparticules
3.1 Déterminer la taille, la forme et la surface spécifique des nanoparticules
3.1.1 Taille et distribution en taille des nanoparticules
TEM (transmission electronic microscopy) et SEM (scanning electronic microscopy):
La microscopie électronique permet d'obtenir des images en très haute résolution (jusqu'à 0,1 nm), et de mesurer la taille des particules par observation directe.
SAXS (Small Angle X-rays Scattering) et USAXS (Ultra Small Angle X-rays Scattering):
Technique qui quantifie les changements de densité dans l'échantillon par passage d'un rayon X à faible longueur d'onde (0,1-0,2 nm), et permet de reconstituer une distribution en taille pour des échantillons de 1 à 100 nm pour le SAXS, et inférieurs pour l'USAXS.
La spectrométrie de masse à couplage inductif simple particule (ou spICP-MS pour single
particule Inductively Coupled Plasma Mass Spectrometry) permet de quantifier la masse
des échantillons particule par particule et, grâce à un étalonnage et à des transformations mathématiques, de calculer la taille des particules. Cette méthode jusqu'ici peu utilisée est en train de se démocratiser (Laborda, Bolea, and Jiménez-Lamana 2014).
3.1.2 Cas particulier de la XRD (X-ray diffraction)
Cette technique permet d'identifier et de quantifier la phase cristalline, et par le calcul d'obtenir une distribution en taille de cette phase cristalline. Elle peut servir à déterminer un ratio de matériaux cristallins par rapport aux matériaux amorphes, mais elle ne sera pas pertinente pour décrire des nanomatériaux entièrement amorphes (comme c'est le cas pour la silice amorphe synthétique par exemple).
3.1.3 Cas particulier de la DLS (dynamic light scattering) La DLS est une technique qui utilise la diffusion de la lumière pour mesurer le mouvement brownien des particules et qui, par une conversion mathématique, permet d'estimer la taille des particules. Cette technique rapide et peu onéreuse est très utilisée pour estimer la taille des particules et leur distribution en taille, néanmoins sa précision est limitée pour analyser des mélanges de particules primaires et d'agrégats de tailles hétérogènes. La DLS a tendance à surestimer la taille des particules primaires en solution si celles-ci ne
sont pas suffisamment dispersées et forment des agrégats ou agglomérats. C'est la raison pour laquelle les résultats scientifiques se basant sur une caractérisation de la taille des nanoparticules réalisée exclusivement par DLS ne pourront être considérés fiables.
3.2 Morphologie des nanoparticules
Pour étudier la morphologie des nanoparticules nous avons besoin d'une méthode donnant des images directes des NPs et donc d'une résolution d'images très élevée, ce qui est possible uniquement par TEM, SEM et AFM.
L'AFM (Atomic Force Microscopy) est une technique en champ proche permettant
d'obtenir des images de la topologie de surface d'un échantillon jusqu'à une résolution verticale de 0,01 nm.
3.3 Surface spécifique des nanoparticules
On désigne ici par surface spécifique l'aire de surface des particules par rapport à leur volume (en m2/m3), que nous abrégerons VSSA pour volume specific surface area.
La SAXS (Small Angle X-rays Scattering) et USAXS (Ultra Small Angle X-rays Scattering) se base sur le principe de la diffraction des rayons-X traversant un échantillon. En mesurant et en analysant l'intensité et l'angle de diffusion de ces rayons-X, la technique parvient à déterminer la distribution en taille et l'aire de surface de l'échantillon.
La méthode de calcul par l'équation dite de Brunauer, Emmett et Teller (BET) permet de calculer la quantité de gaz adsorbée par un échantillon par unité de volume, et par extension la surface spécifique des particules (en m²/g).
La reconstitution d'images en 3D grâce à la tomographie par TEM peut également être utilisée pour calculer une surface spécifique mais cette méthode n'est pas fréquemment utilisée.
3.4 Identifier la chimie élémentaire des nanomatériaux
La Spectrométrie à Emission Optique couplée à l'ICP (ICP-OES) et la Spectrométrie de Masse couplée à l'ICP (ICP-MS) permettent tous deux de mesurer les concentrations élémentaires dans un échantillon solide mis en solution. La résolution de ces deux techniques est très élevée (de l’ordre du ppb voire ppt)
A noter que d'autres variantes de l'ICP-MS sont utilisables pour détecter la chimie élémentaire des nanomatériaux, par couplage avec d'autres techniques de séparation comme le fractionnement d’écoulement de champs.
Le fractionnement d’écoulement de champ (ou FFF pour field frow fractionation) est capable de séparer les nanoparticules en fonction de leur diamètre hydrodynamique (de 1 nm à 1 µm) et permet d’obtenir leur distribution en taille. Une variante de cette technique est la FFF asymétrique (ou AF4) qui, associée à la spectrométrie de masse, bénéficie d'une plus grande sensibilité de détection des NPs et permet l'analyse de la composition élémentaire de l'échantillon (AF4-ICP-MS)(Barahona et al. 2016).
La chromatographie en phase gazeuse couplée à la spectrométrie de masse (GC-MS) est une technique d’analyse de la composition des composés organiques. Elle est plus couramment utilisée sur des liquides ou des gaz mais elle peut aussi être utilisée sur des solides préalablement extraits par solvant, dégazage ou pyrolyse.
L'EDS, aussi abrégée EDX (Energy Dispersive X-ray Spectroscopy) est une technique polyvalente, répandue et peu onéreuse, permettant l'analyse compositionnelle rapide des échantillons « au premier coup d’œil » en étant couplée à de la TEM ou SEM. Elle est très efficace mais les échantillons doivent être compatibles avec le vide (problématique pour l'analyse des matériaux organiques humides, mais pas pour les matériaux inorganiques) et a une sensibilité limitée pour les éléments à faible numéro atomique Z.
3.5 Choix des méthodes analytiques et des paramètres à étudier
La caractérisation des paramètres physico-chimiques des nanoparticules est essentielle car leur toxicité est dépendante de ces paramètres (Hardy et al. 2018), mais cela n'est pas la seule raison. Notre objectif est également d'étudier les méthodes analytiques capables de mettre en évidence la présence des NPs dans les additifs alimentaires ajoutés aux denrées alimentaires. Pour rendre cette identification possible, il est nécessaire de recourir à une méthode analytique montrant de façon directe et imagée ces NPs, et permettant de mesurer leurs tailles pour s'assurer qu'elles sont bien à l'échelle nanométrique. Afin de confirmer que les nanoparticules observées correspondent bien à l'additif alimentaire soupçonné de contenir ces nanoparticules, il faut également caractériser la composition chimique des échantillons.
De la même façon, pour étudier la toxicité des NPs dans les études toxicologiques (in vitro ou in vivo), nous avons besoin d'une caractérisation de la taille, de la morphologie et de la composition chimique précise des NPs testées pour nous assurer que ces dernières correspondent aux NPs utilisées dans les additifs alimentaires. Cette condition est essentielle pour que les données toxicologiques obtenues soient pertinentes pour servir une future évaluation des risques sanitaires (ERS) liée aux NPs dans l'alimentation. L'identification directe et imagée des NPs dans les modèles testés (lignées cellulaires, tissus animaux) après exposition du modèle aux NPs est également importante pour établir un lien de causalité entre exposition aux NPs et effets observés.
Pour obtenir toutes ces informations, la méthode analytique la plus adéquate, permettant de caractériser à la fois la morphologie et la taille des NPs par observation directe, est la microscopie électronique à transmission (TEM). La microscopie électronique à balayage (SEM) et la microscopie à force atomique (AFM) correspondent également à ces critères mais sont moins répandues. Leurs résolutions verticales respectives de 0,1 nm, 1 nm et 0,1 nm les autorisent à étudier finement la nano-échelle (Eaton et al. 2017).
Pour mesurer la taille des particules, le guide de l’EFSA sur l'évaluation du risque lié aux NPs (Hardy et al. 2018) recommande l’utilisation d’au moins deux méthodes analytiques complémentaires, dont l’une d’elle sera de préférence de la microscopie électronique. La DLS peut être une méthode complémentaire pour mesurer la taille des particules, néanmoins celle-ci a des limites. Outre son efficacité pour mesurer la distribution en taille de particules hétérogènes et agrégées (Hoo et al. 2008), elle peut aussi être inadaptée à l'étude de certaines particules diffusant mal ou irrégulièrement la lumière comme c’est respectivement le cas des poudres de silice et des nanofibres (Babick et al. 2016). La caractérisation en taille peut aussi être complétée par la mesure de la surface spécifique (VSSA), qui dépend de la forme et de la taille de la NP.
L’AFM, également performante pour étudier la taille des NPs, a l'inconvénient que pour caractériser des nanoparticules dans une matrice alimentaire l'échantillon devra subir un pré-traitement et on ne pourra pas obtenir la composition élémentaire de cet échantillon alimentaire (Lu et al. 2015). Le TEM n'a pas cet inconvénient car il peut être couplé à l’EDX pour analyse la composition élémentaire, ce qui requiert uniquement une dilution et une dispersion de l’échantillon à analyser.
Nous avons présenté d'autres méthodes analytiques couplées (e.g. AF4-ICP-MS) ou complémentaires (e.g. EDS + DLS + spICP-MS) utilisables pour caractériser la forme, la taille, et la chimie élémentaire des NPs, mais nous estimerons qu'une caractérisation par TEM des NPs est indispensable pour juger de la pertinence des résultats observés.
La construction d'un protocole analytique pertinent est une étape clé de l'évaluation de la toxicité des substances. Les obstacles métrologique concernant les NPs commencent à être élucidés peu à peu, et des lignes directrices à être rédigées. Toutefois, l'étude des NPs et les premières preuves de leur toxicité ne sont plus si récentes, et c'est grâce à ces preuves que l'amélioration des protocoles analytiques a pu se faire et que des cadres réglementaires appliqués aux NPs ont vu le jour.
4 Premières preuves des effets des nanoparticules sur la santé
4.1 Exposition professionnelle aux nanoparticules
Les nanoparticules ont en premier lieu été étudiées pour leur toxicité par inhalation en milieu professionnel. L'inhalation de poussières en milieu professionnel est un problème sanitaire bien connu, mais quid de l'inhalation de particules encore plus petites ? Y a t-il un risque différent lié à l'inhalation de nanoparticules (également appelées "particules ultrafines", ou PUF) ? Il a alors été prouvé que la taille des particules inhalables influence la façon dont celles-ci se déposent dans le système respiratoire (INRS 2005): Les nanoparticules, ou PUF, ont la capacité de se déposer majoritairement au niveau alvéolaire, alors que les particules de plus de 100 nm se déposent presque exclusivement au niveau des voies extra-thoraciques (Annexe 2). Cette différence dans le comportement des particules en aérosol en fonction de leur taille a ainsi témoigné d'un risque nouveau et spécifiquement lié aux propriétés de la nano-échelle.
Outre la taille des particules, la surface spécifique (VSSA) des nanoparticules (en m²/m3) est aussi à mettre en cause dans ces résultats. Elle est inversement proportionnelle à la taille de la particule, donc particulièrement élevée chez une nanoparticule (Diedrich et al. 2012). Sa VSSA lui confère une plus grande surface réactive, pour adsorber d’autres molécules à sa surface (cf propriétés de la corona page 26) et pour s’adsorber elle-même aux cellules.
un effet délétère sur l'activité des macrophages et donc sur le mécanisme de défense qu'est la phagocytose. De plus, les ROS (espèces réactives de l'oxygène) générées endommageraient les barrières épithéliales. En conséquence, la toxicité potentielle par inhalation des nanoparticules se distingue de celles des particules micrométriques par sa propension à pouvoir provoquer des effets systémiques (INRS 2005). La clairance des NPs est davantage macrophagique que mucociliaire, or les NPs ont également une longue capacité de rétention dans ces macrophages alvéolaires à l'état non dissous (Takenaka et al. 2001) et les NPs, en entrant dans la paroi alvéolaire, ont la possibilité de passer dans les capillaires sanguins et de se distribuer dans tout l'organisme.
L'évaluation du risque associée à l'inhalation de nanoparticules a donné suite à de nombreuses études toxicologiques, notamment sur les nanoparticules les plus ubiquitaires et abondantes telles que les NPs de dioxyde de titane (TiO2 NPs)(Cattaneo et al. 2010). Dans les années 2000, les études concernant les TiO2 NPs s'accordent à montrer un effet inflammatoire des TiO2 NPs et aggravant sur les pathologies d'origines inflammatoires (Brayner 2008, Stone, Johnston, and Clift 2007).
L’ERS des NPs reste complexe du fait du manque de lignes directrices pour évaluer leur toxicité et des multiples formes de nanoparticules existantes par substance (e.g. TiO2 NPs sous forme rutile de 25 nm, TiO2 NPs sous forme rutile/anatase de 100 nm, etc.). Néanmoins, ces premières preuves de la toxicité des NPs ont alimenté les inquiétudes quant à l'usage des NPs dans l'alimentation, notamment avec l'usage du TiO2 en tant qu'additif alimentaire (codifié E 171).
4.2 Exposition alimentaire aux nanoparticules
L'ERS liée aux nanoparticules dans l'alimentation présente une difficulté supplémentaire par rapport à l'ERS en milieu professionnel: réussir à identifier des NPs dans une matrice alimentaire. Si les preuves de la présence de nanoparticules dans la denrée alimentaire n’arrivent que tardivement (2016), des études commencent à suggérer une toxicité par ingestion de nanoparticules supérieure à la toxicité de leur équivalent non nanoparticulaire dès 2000 (Bouwmeester et al. 2009).
On montre par exemple que les NPs ont une plus grande capacité à franchir la barrière gastro-intestinale, ce qui leur permet d’atteindre une multitude d’organes par le système circulatoire sanguin, en particulier le cerveau, la moelle osseuse, la rate et le foie (Hoet, Brüske-Hohlfeld, and Salata 2004, Borm et al. 2006). Ces premières preuves de toxicité des NPs ont suscité la mise en place de réglementations pour cadrer leur utilisation dans
l'alimentation. Il y a deux grandes catégories d'utilisations des NPs en alimentation (cf page 19), en tant qu'additif et en tant que matériau au contact des denrées alimentaires (MCDA). Ce travail ayant pour objectif d'étudier la toxicité des NPs dans les additifs, nous nous intéresserons ici qu'aux réglementations spécifiques aux nanomatériaux dans l'alimentation et aux additifs. Nous essaierons également de comprendre en quoi la réglementation actuelle est aussi un frein à l'évaluation du risque liée à ces nanoparticules dans les additifs alimentaires.
5 Réglementations sur les nanomatériaux manufacturés dans les
additifs alimentaires
5.1 Réglementation sur les additifs :
Avant de définir ce qu'est un nanomatériau pour le domaine alimentaire, il nous faut déjà comprendre la réglementation sur les additifs, qui sont les produits contenant ces nanomatériaux ajoutés intentionnellement (rappel: pour simplifier, nous considérerons de la même façon les termes nanomatériaux et nanoparticules).
Selon l’EFSA, les additifs alimentaires sont des substances ajoutées intentionnellement aux aliments pour exercer certaines fonctions technologiques spécifiques, par exemple pour colorer, sucrer ou contribuer à la conservation des aliments. L’usage de ces additifs dans la denrée alimentaire doit être étiqueté sur les emballages, en précisant la fonction de l’additif ainsi que son nom complet ou son numéro E. Les numéros E ont un code numériques à 3 chiffres, appelé numéro SIN (pour Système international de numérotation) qui permet de connaître facilement leur usage grâce au 1er chiffre (Tableau 1).
Le dioxyde de titane par exemple, utilisé comme colorant blanc, est aussi désigné par le code E 171. Cette classification en termes d’usage n’est pas absolue. Une même substance peut par exemple avoir un usage principal en tant que colorant et d’autres usages, mais son numéro E, tout comme son numéro CAS demeure unique.
Il existe un programme issu d’une action conjointe entre la FAO (Food Agriculture and Organization of the United Nations) et l’OMS (Organisation Mondiale de la Santé), « The Codex Alimentarius Commission », qui liste les additifs autorisés dans l’alimentation, leurs usages et restrictions d’usage dans les denrées et leurs limites maximales d’utilisation (FAO/OMS 2017). Il est important de noter que la plupart d’entre eux sont utilisés en
quantum satis, c’est-à-dire en quantité suffisante pour obtenir l’effet escompté, ce qui ne
fixe pas de réelle limite en terme de quantité. En Europe, tous les additifs sont évalués par l’EFSA avant leur mise sur le marché. Les autorisations d’utilisations des additifs alimentaires et leurs spécificités sont alors édictées par le règlement 1129/2011 de la Commission Européenne (Commission Européenne 2011b).
Tableau 1 Code additif par fonction
Si ces additifs contiennent des NPs, comment la réglementation le prend en compte ? Quelles sont les obligations réglementaires obligeant les industries alimentaires qui utilisent des NPs en tant qu'additif à déclarer cet usage ? Enfin, quels sont les dispositions réglementaires permettant au consommateur d'être informé de cette exposition aux NPs par l'intermédiaire des additifs alimentaires ?
5.2 Dispositifs de déclarations obligatoires des usages industriels des nanomatériaux
5.2.1 Le règlement REACH et l'enregistrement des nanomatériaux
Le règlement européen REACH est une disposition du Parlement Européen et du Conseil, qui oblige fabricants et importateurs à déclarer, enregistrer, soumettre à autorisation et à évaluation toute substance produite ou importée à plus d’une tonne par an. REACH a pour objectif de protéger la santé et l’environnement en proposant des restrictions d’usages des substances chimiques évaluées s’il s’avère que celle-ci présentent un risque inacceptable. Malheureusement, à ce jour aucune exigence spécifique aux nanomatériaux n'existe dans REACH, les conditions pour leur enregistrement en termes de tonnages annuels sont les mêmes que pour les substances chimiques conventionnelles. Or, la nature même des
Code E Fonction E 100 Colorant E 200 Conservateur E 300 Anti-oxygène E 400 Texturant E 500 Acidifiant E 600 Exhausteur de goût E 900 Edulcorant
nanoparticules fait qu’elles sont caractérisées par un nombre de particule par unité de volume très important, et peuvent être utilisées de manière efficace à de faibles quantités. Par conséquent, les conditions d’enregistrement dans REACH (emploi d'une tonne par an minimum) sont difficilement satisfaites pour les nanomatériaux. De plus, REACH ne distingue pas les substances chimiques en fonction de leur état nanoparticulaire ou non, ce qui rend ce puissant outil d’évaluation des risques inadapté (pour le moment) à la problématique des nanomatériaux.
Bien qu’il existe d’autres obligations dans REACH pour des déclarations inférieures à 1 tonne par an, par exemple la communication des informations sur l’utilisation de la substance, de ses restrictions et autorisations d’usage, ou de sa fiche de données de sécurité (FDS), il reste inadéquat pour obtenir des données toxicologiques sur des substances à faible tonnage annuel (<1 t).
5.2.2 R-Nano et les déclarations d'usages des nanomatériaux Afin de pallier à une absence totale de connaissance sur les emplois des nanomatériaux en termes d'usages et de quantité, le gouvernement français a mis en application depuis le 1er janvier 2013 un système d’obligation de déclaration des substances à l’état nanoparticulaire appelé « R-Nano » et qui est géré par l'Anses. Uniquement dédié aux substances nanoparticulaires, ce dispositif oblige tous fabricants, importateurs ou distributeurs de NPs à déclarer leur usage si la quantité utilisée dépasse les 100 grammes par an. Ainsi, les déclarants devront fournir le nom chimique de la substance, la quantité importée ou fabriquée, et son utilisation.
Les déclarations obligatoires dans R-Nano requièrent une quantité d’information limitée, néanmoins elles permettent d’apporter la preuve de l’utilisation des nanomatériaux dans l’alimentation. En effet, les rapports annuels de R-nano précisent tous les usages déclarés par substance, et catégorisent ces usages par domaine. Dans R-Nano une seule catégorie concerne l’alimentation, nommée « Fabrication de produits alimentaires » et codée « su4 » selon la nomenclature propre à R-Nano. En 2015, on retrouve par exemple le carbonate de calcium déclaré dans la catégorie « su4 : fabrication de produits alimentaires » (Annexe 3), qui existe d’ailleurs sous forme d’additifs alimentaires sous le nom E 170. Parmi les substances reportées dans cette catégorie "alimentaire" on trouve parfois la substance nommée directement par son code additif, par exemple le dioxyde de silicium déclaré sous le nom E 551 (Annexe 3), ce qui apporte la preuve que ces additifs contiennent des NPs.
5.3 Définitions réglementaires et règle d’étiquetage des nanomatériaux dans l’alimentation
Si des substances à l'état nanoparticulaire sont effectivement utilisées en alimentation, comment se fait-il que l'exposition aux nanomatériaux dans l'alimentation reste controversée et que le consommateur n'en soit pas informé ?
Nous l’avons vu, le consensus pour définir ce qu'est un nano-objet, et par la même occasion une nanoparticule, est bien établi (page 14), mais ce n'est pas le cas de la définition des nanomatériaux manufacturés qui n'est décrite dans aucune règlementation transversale à tous les domaines d'application. Au contraire, les nanomatériaux manufacturés sont définis par de nombreux textes rien que pour le domaine de l'alimentation:
Tableau 2 Récapitulatif des réglementations concernant les nanomatériaux dans les additifs alimentaires :
Intitulés des textes relatifs à la définition des nanomatériaux
Apports des textes à la définition des nanomatériaux
Recommandation de la Commission du 18 octobre 2011 relative à la définition des
nanomatériaux
Elle définit un nanomatériau comme étant un agrégat ou agglomérat de particules dont au moins 50% présentent une ou plusieurs dimensions externes se situant entre 1 nm et 100 nm (Commission Européenne 2011a).
Règlement (UE) N°1169/2011 du Parlement Européen et du Conseil du 25 octobre 2011
concernant l’information des consommateurs sur les denrées
alimentaires dit « INCO »
Dans ce règlement, un nanomatériau est composé de particules de moins de 100 nm, ou d’agglomérats ou d’agrégats dont beaucoup de leurs particules élémentaires ont une ou plusieurs dimensions de l’ordre de 100 nm ou moins.
De plus, leur présence doit clairement être indiquée dans la liste des ingrédients, en indiquant « nano » entre crochet après le nom de l’ingrédient(Parlement Européen and Conseil de l'Union Européenne 2011).