HAL Id: hal-02594465
https://hal.inrae.fr/hal-02594465
Submitted on 15 May 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
l’octylphénol et du nonylphénol dans les sédiments et les
organismes biologiques
S. Schiavone, Marina Coquery
To cite this version:
S. Schiavone, Marina Coquery. Synthèse bibliographique : méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments et les organismes biologiques. [Rapport de recherche] irstea. 2010, pp.32. �hal-02594465�
Partenariat 2009 – Domaine Substances Polluantes - Action 13 : Développement et optimisation des méthodes physico-chimiques
Synthèse bibliographique
Méthodes d’analyse de
l’octylphénol et du nonylphénol
dans les sédiments et les
organismes biologiques
Rapport final
Schiavone S. et Coquery M. (Cemagref Lyon)
Mars 2010
Avec les partenaires :
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 2/32
Contexte de programmation et de réalisation
Ce rapport a été réalisé dans le cadre du programme d'activité AQUAREF pour l'année 2009 dans le cadre du partenariat ONEMA – Cemagref 2009, au titre de l’action 13 « Développement et optimisation des méthodes physico-chimiques » du domaine « Substances polluantes ».
Les auteurs Séverine Schiavone Ingénieur d’études severine.schiavone@cemagref.fr Cemagref Lyon Marina Coquery
Directrice de recherche, responsable scientifique du laboratoire d’analyses physico-chimiques des milieux aquatiques, UR MALY.
marina.coquery@cemagref.fr Cemagref Lyon
Les correspondants
Onema : Pierre-François Staub, ONEMA-DAST, pierre-francois.staub@onema.fr. Cemagref : Marina Coquery, Cemagref Lyon, marina.coquery@cemagref.fr.
Référence du document : Schiavone S., Coquery M. (2010). Synthèse bibliographique : méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments et les organismes biologiques. Cemagref, 32 p.
Droits d’usage : Accès libre
Couverture géographique : Niveau géographique : International National Niveau de lecture : Nature de la ressource : Professionnels, experts Document CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 3/32
Synthèse bibliographique : méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments et les organismes biologiques
Rapport final S. Schiavone et M. Coquery
Sommaire
Résumé... 4 Abréviations ... 5 1. Contexte et objectifs ... 6 2. Méthodologie et résultats ... 7 2.1 Méthodologie ... 72.2 Analyse des publications ...19
2.2.1 Sédiments...19
2.2.2 Biote ...21
3. Conclusion : proposition de méthode...24
Bibliographie ...28
LISTE DES TABLEAUX : Tableau 1 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments.……….………..………..9
Tableau 2 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les organismes biologiques ………...14
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 4/32
Synthèse bibliographique : méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments et les organismes biologiques
S. Schiavone et M. Coquery
Résumé
RESUME
La directive cadre eau (2000/60/CE) et la directive européenne du 16 décembre 2008 stipulent que le contrôle des sédiments et du biote doit être régulièrement effectué pour les substances prioritaires et autres substances polluantes jugées bioaccumulables. Cependant aucune norme existe actuellement pour l’analyse de certaines de ces substances dans les sédiments et le biote, telles que l’octylphénol (OP) et le nonylphénol (NP).
Il a donc été effectué une synthèse bibliographique sur l’analyse de l’OP et du NP dans les sédiments et les organismes biologiques. A partir de celle-ci, une méthodologie analytique est proposée :
o Une extraction par solvant pressurisé ou une extraction aux ultrasons sont recommandées, avec un solvant d’extraction apolaire. Le dichlorométhane, largement utilisé, est un cancérigène suspecté. Le cyclohexane ou l’isooctane sont préférables.
o Une purification à pression ambiante (sur colonne ou cartouche par extraction sur phase solide) est recommandée avec l’utilisation d’une phase de silicate de magnésium ou de silice. Le solvant d’élution utilisé doit être apolaire. L’hexane ou un mélange d’acétate d’éthyle/hexane donnent de bons résultats. Cependant, étant donné la toxicité de l’hexane, il est préférable de le remplacer par de l’heptane ou de l’isooctane. Pour les organismes biologiques, dans le cas de matrices riches en lipides (poisson gras par exemple), une purification supplémentaire par chromatographie sur gel perméable est utile afin d’éliminer les grosses molécules lipidiques pour éviter les interférences lors de l’analyse.
o Un dosage par chromatographie gazeuse couplée à la spectrométrie de masse, en mode ionisation électronique est recommandé. L’utilisation d’un traceur méthode est conseillé.
o Validation : les limites de quantification les plus basses obtenues sont de 0,5 µg/kg poids sec dans les sédiments. Dans le biote, elles sont de 0,9 µg/kg poids sec pour le NP et de 0,2 µg/kg poids frais pour l’OP.
o Etalon interne : afin de s’affranchir des interférences lors du dosage des alkylphénols dans ces matrices complexes, l’utilisation d’un étalon interne est recommandé. Il a été montré que les étalons deutérés du NP n’étaient pas stables en milieu aqueux, l’utilisation d’un étalon interne marqué 13C est donc recommandée.
o Contamination : la vaisselle utilisée doit être décontaminée minutieusement et tout
outil en plastique doit être proscrit. Des blancs méthodes doivent être régulièrement vérifiés.
MOTS CLES (THEMATIQUE ET GEOGRAPHIQUE)
Analyse chimique, directive cadre eau, biote, nonylphénol, norme, octylphénol, sédiment, substance prioritaire. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques Mars 2010 - p 5/32
Abréviations
AP Alkylphénols BSTFA Bis-(trimétylsilyl)trifluoroacétamide CV Coefficient de variation GC Chromatographie gazeuseGPC Chromatographie de partage sur gel
LC Chromatographie liquide
LD Limite de détection
LQ Limite de quantification
MS Spectrométrie de masse
MSPD Dispersion de matrice sur phase solide
NP Nonylphénol
OP Octylphénol
PFE Extraction par fluide pressurisé
PFPA Pentafluoropropionie anhydre
p-NP (ou 4-NP) Para-nonylphénol p-OP (ou 4-OP) Para-octylphénol
SPE Extraction sur phase solide
TFAA Trifluoroacétique anhydre
TMCS Triméthylchlorosilane
t-OP Tert-octylphénol
tpm Tours par minute
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 6/32
Synthèse bibliographique : Méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments et les organismes biologiques
Schiavone S. et Coquery M.
1. Contexte et objectifs
La directive cadre eau (DCE ; EC, 2000) et la directive européenne du 16 décembre 2008 (EC, 2008) définissent 33 substances prioritaires et 8 autres substances polluantes à surveiller dans les masses d’eau et fixent les normes de qualité environnementale (NQE) à respecter dans les eaux. Ces directives stipulent également que le contrôle des sédiments et du biote (ou organisme biologique) doit être régulièrement effectué pour les molécules bioaccumulables, telles que l’octylphénol et le nonylphénol (MEDAD, 2007), afin de donner une image réelle de l’état des masses d’eau et de suivre sur le long terme les concentrations des substances prioritaires.
Dans une synthèse intitulée « Méthodes de référence existantes pour l’analyse des substances prioritaires dans les sédiments et le biote » (Schiavone et Coquery, 2009) réalisée dans le cadre du programme d'activité AQUAREF pour l'année 2008 et du partenariat ONEMA – Cemagref 2008, il a été mis en évidence qu’aucune norme n’existait pour l’analyse de l’octylphénol et du nonylphénol dans les sédiments et le biote. Il a donc été décidé d’effectuer une étude bibliographique sur les méthodes d’analyse pratiquées. Le but de cette synthèse est de parvenir à dégager un protocole pouvant servir de point de départ pour le développement et la validation d’une méthode d’analyse de ces substances.
Les nonylphénols, de formule brute C6H4(OH)C9H19, et les octylphénols, de formule
brute C6H4(OH)C8H17, regroupent une grande quantité d’isomères qui présentent une
nomenclature complexe (Becue et Nguyen, 2005). On peut noter que le nonylphénol le plus utilisé est le 4-nonylphénol qui représente environ 80% des nonylphénols dans les productions commerciales ; c’est un mélange de nonylphénols ramifiés et substitués en position 4. Au niveau des octylphénols c’est le 4-tert-octylphénol qui est utilisé en milieu industriel.
Les nonylphénols sont utilisés le plus souvent afin de produire des éthoxylates de nonylphénols utilisés dans l’industrie pour leurs propriétés émulsifiantes et mouillantes. On en retrouve donc dans les détergents, les cosmétiques ou dans certains plastiques. Les octylphénols sont eux utilisés la plupart du temps comme intermédiaire dans la fabrication des résines phénoliques ou de formaldéhyde. Il est important également de noter que
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 7/32
certains polyéthoxylates d’alkylphénols, utilisés en grande quantité dans l’industrie, se dégradent en alkylphénols en milieu naturel (Cailleaud et al, 2007).
Les alkylphénols, en tant que perturbateurs endocriniens (Becue et Nguyen, 2005) doivent être surveillés, en particulier le 4-nonylphénol et le 4-tert-octylphénol fabriqués en grandes quantités en milieu industriel et produits de dégradation des éthoxylates eux aussi très présents. Les nonylphénols et octylphénols sont particulièrement accumulables dans les sédiments et le biote comme le montre leur logKow de 4,48 et 4,12 respectivement (Ying et
al, 2002), il est donc important de pouvoir les quantifier dans ces deux matrices.
2. Méthodologie et résultats
2.1 Méthodologie
Les moteurs de recherche Science Direct1 et celui de Scopus ont été utilisés en cherchant les mots clés suivants couplés deux à deux : alkylphenol, analysis, biota, fish, nonylphenol, octylphenol, organisms, sediment.
Les publications en langue anglaise postérieures à 2004 ont été retenues. Les publications sont présentées par ordre chronologique puis, pour chaque année, par auteur. Dans la synthèse (cf. tableaux 1 et 2), les éléments suivants sont décrits :
Titre publication
Composé analysé : 4-NP, OP,… Auteurs
Année de publication
Prise d’essai et, dans le cas du biote, type d’organisme
Préparation échantillon : description des étapes d’extraction, de purification,… Dans cette partie les méthodes de conservation, qui ne font pas l’objet de cette synthèse, ne sont pas détaillées.
Technique analytique
Informations sur la validation et sur l’assurance qualité (linéarité, étalon interne, répétabilité, rendements, blancs…)
LQ ou LD en µg/kg – en poids sec (sédiments) ou en poids frais (biote)2
1
www.sciencedirect.com
2
La concentration de la substance exprimée en poids sec est présentée en fonction de la masse de l'échantillon sec (ex : après lyophilisation ; ou vérifié par séchage d’un aliquot non dédié à l’analyse à 105°C jus qu’à obtention d’une masse constante). La concentration exprimée en poids frais est présentée en fonction de la masse de l'échantillon « brut » ou humide (c’est-à-dire non préalablement séché).
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 8/32
Concentrations mesurées en µg/kg poids sec (sédiments) ou à l’état frais (biote). Ces concentrations, pour pouvoir être comparées, peuvent être normalisées par la teneur en carbone organique (sédiments) ou par la teneur en lipides (poisson ou mollusque) trouvée dans l’échantillon. Cependant, celles-ci n’étant que très rarement précisées, elles ne sont pas mentionnées dans les tableaux 1 et 2.
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
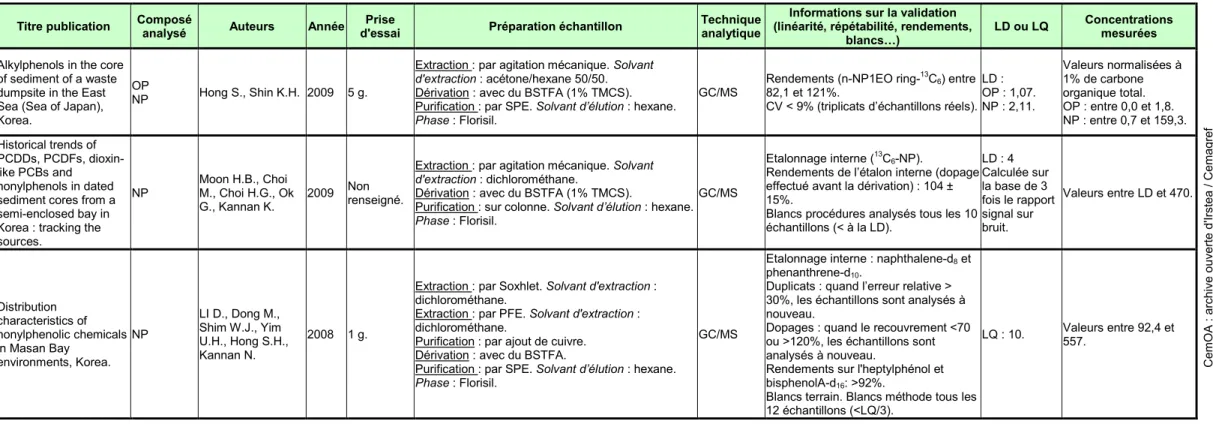
Tableau 1 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments
Toutes les valeurs données concernant les sédiments sont en µg/kg, en poids sec.
Titre publication Composé
analysé Auteurs Année
Prise
d'essai Préparation échantillon
Technique analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…)
LD ou LQ Concentrations
mesurées
Alkylphenols in the core of sediment of a waste dumpsite in the East Sea (Sea of Japan), Korea.
OP
NP Hong S., Shin K.H. 2009 5 g.
Extraction : par agitation mécanique. Solvant
d'extraction : acétone/hexane 50/50.
Dérivation : avec du BSTFA (1% TMCS). Purification : par SPE. Solvant d’élution : hexane.
Phase : Florisil.
GC/MS
Rendements (n-NP1EO ring-13C6) entre
82,1 et 121%.
CV < 9% (triplicats d’échantillons réels). LD : OP : 1,07. NP : 2,11. Valeurs normalisées à 1% de carbone organique total. OP : entre 0,0 et 1,8. NP : entre 0,7 et 159,3. Historical trends of PCDDs, PCDFs, dioxin-like PCBs and nonylphenols in dated sediment cores from a semi-enclosed bay in Korea : tracking the sources. NP Moon H.B., Choi M., Choi H.G., Ok G., Kannan K. 2009 Non renseigné.
Extraction : par agitation mécanique. Solvant
d'extraction : dichlorométhane.
Dérivation : avec du BSTFA (1% TMCS).
Purification : sur colonne. Solvant d’élution : hexane.
Phase : Florisil.
GC/MS
Etalonnage interne (13C 6-NP).
Rendements de l’étalon interne (dopage effectué avant la dérivation) : 104 ± 15%.
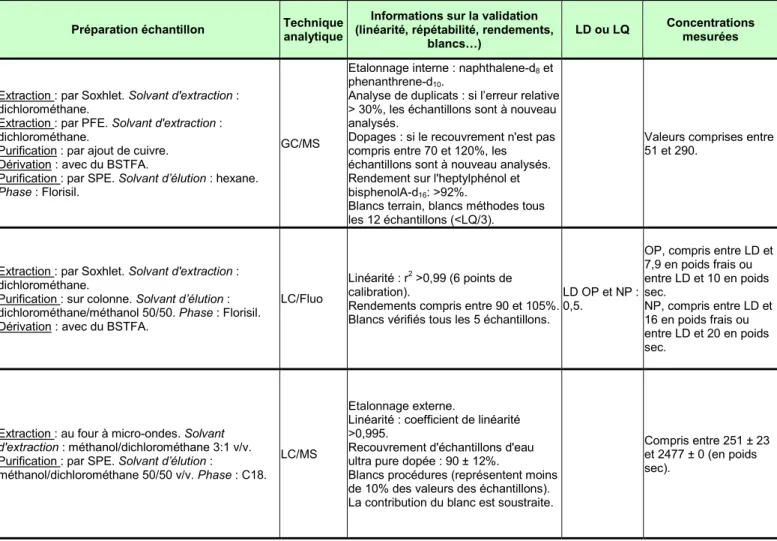
Blancs procédures analysés tous les 10 échantillons (< à la LD). LD : 4 Calculée sur la base de 3 fois le rapport signal sur bruit. Valeurs entre LD et 470. Distribution characteristics of nonylphenolic chemicals in Masan Bay environments, Korea. NP LI D., Dong M., Shim W.J., Yim U.H., Hong S.H., Kannan N. 2008 1 g.
Extraction : par Soxhlet. Solvant d'extraction : dichlorométhane.
Extraction : par PFE. Solvant d'extraction : dichlorométhane.
Purification : par ajout de cuivre. Dérivation : avec du BSTFA.
Purification : par SPE. Solvant d’élution : hexane.
Phase : Florisil.
GC/MS
Etalonnage interne : naphthalene-d8 et
phenanthrene-d10.
Duplicats : quand l’erreur relative > 30%, les échantillons sont analysés à nouveau.
Dopages : quand le recouvrement <70 ou >120%, les échantillons sont analysés à nouveau.
Rendements sur l'heptylphénol et bisphenolA-d16: >92%.
Blancs terrain. Blancs méthode tous les 12 échantillons (<LQ/3). LQ : 10. Valeurs entre 92,4 et 557. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 1 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments
Titre publication Composé
analysé Auteurs Année
Prise
d'essai Préparation échantillon
Technique analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…) LD ou LQ Concentrations mesurées Contamination profiles of heavy metals, organochlorine pesticides, polycyclic aromatic hydrocarbons and alkylphenols in sediment and oyster collected from marsh/estuarine Savannah GA, USA.
OP NP Senthil Kumar K., Sajwan K.S., Richardson J.P., Kannan K. 2008 Non renseigné.
Extraction : par Soxhlet. Solvant d'extraction : dichlorométhane.
Purification : par ajout de cuivre.
Purification : sur colonne. Solvant d’élution : dichlorométhane/méthanol 50/50. Phase : Florisil. Dérivation : avec du BSTFA.
LC/Fluo
Linéarité : r2 >0,99.
Rendements entre 90 et 105%. Blancs vérifiés tous les 5 échantillons.
LD : 0,2.
OP : entre LD et 29 en poids sec. (ou entre LD et 11 poids frais). NP : entre LD et 78 poids sec (ou entre LD et 34 en poids frais).
Vertical distribution of nonylphenol and nonylphenol ethoxylayes in sedimentary core from the Beipaiming Channel, North China.
NP Jin F., Hu J.Y.,
Yang M. 2007 10 g.
Extraction : par Soxhlet. Solvant d'extraction : dichlorométhane/méthanol 70/30 v/v. Purification : sur colonne. Solvant d’élution : hexane/dichlorométhane 50/50 v/v, dichlorométhane, dichlorométhane/méthanol 85/15 v/v puis dichlorométhane/méthanol 50/50 v/v. Phase : alumine. GC/MS Rendements : 80%. CV <20% (triplicats). Valeurs entre LD et 3539 (valeurs sur les 40 premiers centimètres de la carotte : entre 579 et 3539). Estrogenic activity in sediments contaminated by nonylphenol in Tokyo Bay (Japan) evaluated by vitellogenin induction in male mummichogs (Fundulus heteroclitus).
NP
Kurihara R., Watanabe E., Ueda Y, Kakuno A., Fujii K., Shiraishi F., Hashimoto S.
2007 5 g.
Extraction : aux ultrasons. Solvant d'extraction : dichlorométhane. Répétée une 2ème fois. Dérivation : avec du BSTFA (10% TMCS).
GC/MS Entre LD et 20700.
Occurrence of
alkylphenolic substances in a Great Lakes coastal marsh, Cootes Paradise, ON, Canada. 4-t-OP 4-NP Mayer T., Bennie D., Rosa F., Rekas G., Palabrica V., Schachtschneider J. 2007 1 g.
Extraction : par PFE. Solvant d'extraction : dichlorométhane.
Dérivation : par acétylisation (acétique anhydre). Purification : sur colonne. Solvant d’élution : isooctane. Phase : gel de silice.
GC/MS
Après vérification de la linéarité, quantification par rapport à un seul point (analysé après chaque échantillon).
Rendements >80% (dopage avec du p-n-NP-13C
6).
Blancs méthodes vérifiés lors de chaque série d’analyse.
LD calculées selon 'US EPA Guidelines Establishing Test Procedures for the Analysis of Pollutants' 4-t-OP : 0,005 4-NP : 0,010 4-NP : entre <LD et 1750. 4-t-OP : entre <LD et 52. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 1 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments
Titre publication Composé
analysé Auteurs Année
Prise
d'essai Préparation échantillon
Technique analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…) LD ou LQ Concentrations mesurées Temporal trends of nonylphenol and bisphenol A contamination in the Pearl River Estuary and the adjacent South China Sea recorded by dated sedimentary cores. NP Peng X., Wang Z., Mai B., Chen F., Chen S., Tan J., Yu Y., Tang C. Li K., Zhang G., Yang C. 2007 10 g.
Extraction : aux ultrasons. Solvant d'extraction : acétone/dichlorométhane 50/50 v/v. Répétée 3 fois. Purification : sur colonne. Solvant d’élution : méthanol. Phase : gel de silice.
Dérivation : au PFPA.
GC/MS
Rendements : 86 ± 17% (échantillons réels dopés avec du NP).
Rendements du bisphénol A-d16 : 86%
en moyenne avec un CV de 20%. Blancs procédure (traces retrouvées).
Valeurs entre 76,9 et 702,7.
Natural and synthetic endocrine disrupting compounds (EDCs) in water, sediment and biota of a coastal lagoon. NP Pojana G., Gomiero A., Jonkers N., Marcomini A.
2007 20 g. Extraction : aux ultrasons. Solvant d'extraction :
méthanol/acétone 80/20. Répétée une 2ème fois. LC/MS
Rendements (dopages par NP sur échantillons réels à 20 et 100 µg/kg) : > 83%. Les analyses ont été faites en triplicat avec un CV < 7%. LD calculée sur la base de 3 fois le rapport signal sur bruit. Comprise entre 0,2 et 5,0. Valeurs entre 47 et 192. Distribution of
alkylphenols in the Pearl River Delta and adjacent northern South China Sea, China. OP NP Chen B., Duan J.C., Mai B.X., Luo X.J., Yang Q.S., Sheng G.Y., Fu J.M. 2006 10 g.
Extraction : par Soxhlet. Solvant d'extraction : dichlorométhane.
Purification : sur colonne. Solvant d’élution : dichlorométhane/hexane 80/20 v/v. Phase : gel de silice.
GC/MS
Linéarité : r2 >0,995.
Etalonnage interne (4- α-cumylphénol). Rendements (réplicat d'échantillons dopés n=6) : 106% pour NP et 87% pour OP et CV de 5% pour NP et de 7% pour OP.
Duplicat analysé tous les 8 à 10 échantillons.
Blancs procédures et blancs dopés tous les 8 à 10 échantillons. LQ : OP : 1 NP : 10 Calculée sur la base de 10 fois le rapport signal sur bruit. NP (somme de 11 isomères) : entre 59 et 7808.
OP (1 seul pic) : entre 1 et 93.
Occurrence and seasonal variation of alkylphenols in marine organisms from the coast of Taiwan.
4-t-OP 4-NP
Cheng C.Y., Liu
L.L., Ding W.H. 2006 0,5 g.
Extraction : par entraînement à la vapeur. Solvant
d'extraction : n-hexane. GC/MS LQ : < 20. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 1 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments
Titre publication Composé
analysé Auteurs Année
Prise
d'essai Préparation échantillon
Technique analytique
Informations sur la validation (linéarité, répétabilité, rendements,
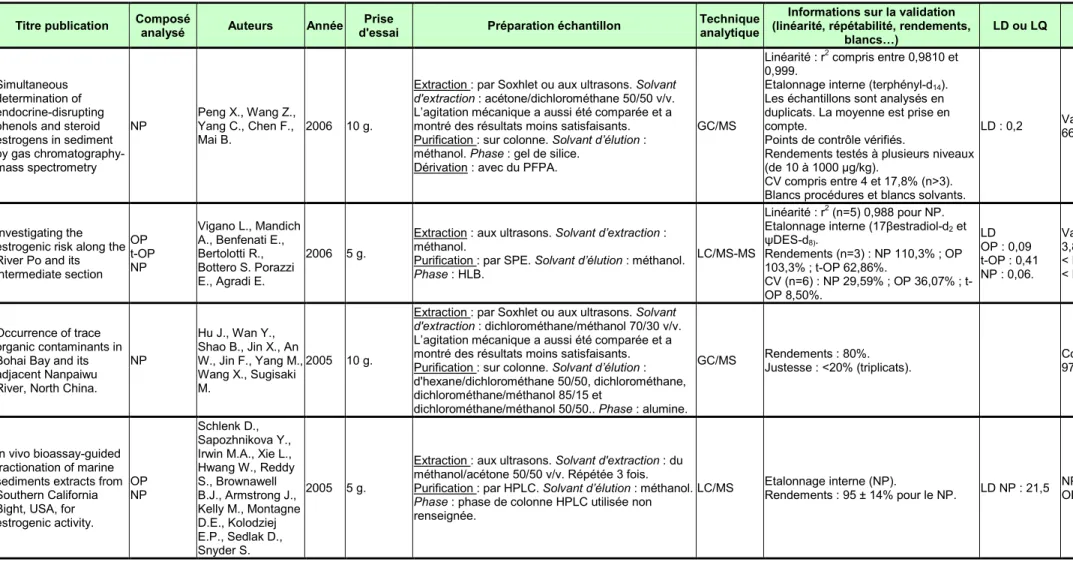
blancs…) LD ou LQ Concentrations mesurées Simultaneous determination of endocrine-disrupting phenols and steroid estrogens in sediment by gas chromatography-mass spectrometry NP Peng X., Wang Z., Yang C., Chen F., Mai B. 2006 10 g.
Extraction : par Soxhlet ou aux ultrasons. Solvant
d'extraction : acétone/dichlorométhane 50/50 v/v.
L’agitation mécanique a aussi été comparée et a montré des résultats moins satisfaisants. Purification : sur colonne. Solvant d’élution : méthanol. Phase : gel de silice.
Dérivation : avec du PFPA.
GC/MS
Linéarité : r2 compris entre 0,9810 et
0,999.
Etalonnage interne (terphényl-d14).
Les échantillons sont analysés en duplicats. La moyenne est prise en compte.
Points de contrôle vérifiés.
Rendements testés à plusieurs niveaux (de 10 à 1000 µg/kg).
CV compris entre 4 et 17,8% (n>3). Blancs procédures et blancs solvants.
LD : 0,2 Valeurs entre 204,2 et 664,5.
Investigating the estrogenic risk along the River Po and its intermediate section
OP t-OP NP
Vigano L., Mandich A., Benfenati E., Bertolotti R., Bottero S. Porazzi E., Agradi E.
2006 5 g.
Extraction : aux ultrasons. Solvant d’extraction : méthanol.
Purification : par SPE. Solvant d’élution : méthanol.
Phase : HLB.
LC/MS-MS
Linéarité : r2 (n=5) 0,988 pour NP. Etalonnage interne (17βestradiol-d2 et
ψDES-d8). Rendements (n=3) : NP 110,3% ; OP 103,3% ; t-OP 62,86%. CV (n=6) : NP 29,59% ; OP 36,07% ; t-OP 8,50%. LD OP : 0,09 t-OP : 0,41 NP : 0,06. Valeurs entre : 3,89 et 120 pour NP < LD pour OP < LD et 6,09 pour t-OP. Occurrence of trace organic contaminants in Bohai Bay and its adjacent Nanpaiwu River, North China.
NP Hu J., Wan Y., Shao B., Jin X., An W., Jin F., Yang M., Wang X., Sugisaki M. 2005 10 g.
Extraction : par Soxhlet ou aux ultrasons. Solvant
d'extraction : dichlorométhane/méthanol 70/30 v/v.
L’agitation mécanique a aussi été comparée et a montré des résultats moins satisfaisants. Purification : sur colonne. Solvant d’élution : d'hexane/dichlorométhane 50/50, dichlorométhane, dichlorométhane/méthanol 85/15 et
dichlorométhane/méthanol 50/50.. Phase : alumine.
GC/MS Rendements : 80%. Justesse : <20% (triplicats). Comprises entre <LD et 970. In vivo bioassay-guided fractionation of marine sediments extracts from Southern California Bight, USA, for estrogenic activity.
OP NP
Schlenk D., Sapozhnikova Y., Irwin M.A., Xie L., Hwang W., Reddy S., Brownawell B.J., Armstrong J., Kelly M., Montagne D.E., Kolodziej E.P., Sedlak D., Snyder S. 2005 5 g.
Extraction : aux ultrasons. Solvant d'extraction : du méthanol/acétone 50/50 v/v. Répétée 3 fois. Purification : par HPLC. Solvant d’élution : méthanol.
Phase : phase de colonne HPLC utilisée non
renseignée. LC/MS Etalonnage interne (NP). Rendements : 95 ± 14% pour le NP. LD NP : 21,5 NP : entre 122 et 3200. OP : entre <LD et 8,2 . CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 1 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les sédiments
Titre publication Composé
analysé Auteurs Année
Prise
d'essai Préparation échantillon
Technique analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…) LD ou LQ Concentrations mesurées Flame retardants surfactants and organotins in sediment and mysid shrimp of the Scheldt estuary (The Netherlands)
NP
Verslycke T.A., Vethaak A.D., Arijis K., Janssen C.R.
2005 Non renseigné.
Extraction : par Soxhlet. Solvant d'extraction :
méthanol. LC/MS Analyse des échantillons en duplicat.
Valeurs entre <LD et 1222.
Distribution characteristics of nonylphenols in the artificial Lake Shihwa, and surrounding creeks in Korea.
NP Li D., Kim M., Oh J.R., Park J.
Dans des criques : entre <LD et 31,7 (valeurs normalisées entre <LD et 1620 µg/g COT). Dans un lac : entre 11 et 624. Seasonal flux of nonylphenol in Han River, Korea. NP Li D., Kim M., Shim W.J., Yim U.H., Oh J.R. Kwon Y.J. 2004 3 g.
Extraction : par agitation mécanique. Solvant
d’extraction : dichlorométhane. Répétée 3 fois.
Purification : ajout de cuivre. Dérivation : avec du BSTFA.
Purification : sur colonne. Solvant d’élution : hexane.
Phase : Florisil.
GC/MS
Etalonnage interne.
Etalonnage interne (naphthalène-d8,
phenanthrène-d10 et pyrène-d10). Valeurs entre 25,4 et 932. Microwave-assisted extraction followed by gas chromatography-mass spectrometry for the determination of endocrine disrupting chemicals in river sediments. 4-t-OP 4-NP Liu R., Khou J.L., Wilding A 2004 5 g.
Purification : ajout de cuivre.
Extraction : au four à micro-ondes. Solvant
d’extraction : méthanol. Mais meilleurs rendements
sur le 4-t-OP et le 4-NP avec acétate d’éthyle/hexane 50/50).
Purification : sur colonne. Solvant d’élution : acétate d’éthyle/hexane 40/60 v/v (même si 20/80 v/v donne de meilleurs rendements pour le 4-NP). Phase : gel de silice.
Dérivation : avec de la pyridine et du BSTFA (1% TMCS). GC/MS Linéarité : 4-t-OP r2>0,99 4-NP r2 entre 0,96 et 0,99. Rendements : 4-t-OP > 80%
4-NP entre 61,5 et 133% (pour des dopages allant de 5 à 100 µg/kg) avec un CV<24,3%. Analyses en triplicat. 4-tert OP : LD 0,5 et LQ 1,7 4-NP : LD 0,5 et LQ 1,7 LD calculée comme étant égale à 3 écart-types de 10 blancs indépendant. LQ calculée sur la base de 10 fois le rapport signal sur bruit. Valeurs entre : <LQ et 12 pour le 4-t-OP <LQ et 5 pour le 4-NP. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 2 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les organismes biologiques
Toutes les valeurs données pour le biote sont en µg/kg et en poids à l'état frais sauf indications contraires.
Titre publication Composé
analysé Auteurs Année
Type d’organisme
et prise d'essai
Préparation échantillon Technique
analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…)
LD ou LQ Concentrations
mesurées
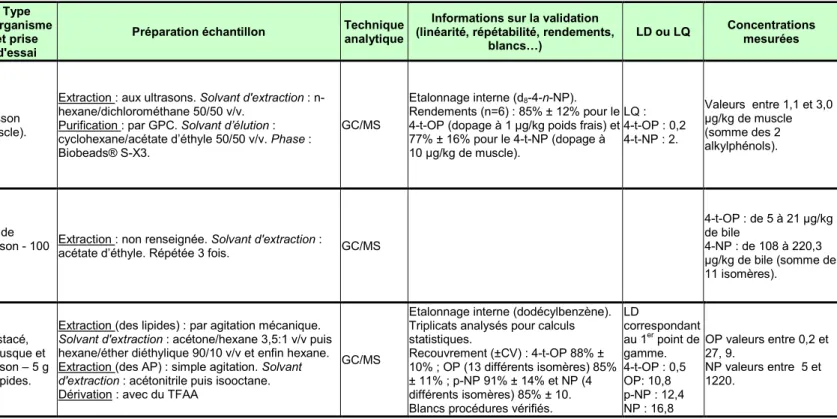
Effects of pollution on chub in the River Elbe, Czech Republic. 4-t-OP 4-t-NP Randak T., Zlabek V., Pulkrabova J., Kolarova J., Kroupova H., Siroka Z., Velizek J., Svobodova Z., Hajslova J. 2009 Poisson (muscle).
Extraction : aux ultrasons. Solvant d'extraction : n-hexane/dichlorométhane 50/50 v/v.
Purification : par GPC. Solvant d’élution : cyclohexane/acétate d’éthyle 50/50 v/v. Phase : Biobeads® S-X3.
GC/MS
Etalonnage interne (d8-4-n-NP).
Rendements (n=6) : 85% ± 12% pour le 4-t-OP (dopage à 1 µg/kg poids frais) et 77% ± 16% pour le 4-t-NP (dopage à 10 µg/kg de muscle). LQ : 4-t-OP : 0,2 4-t-NP : 2. Valeurs entre 1,1 et 3,0 µg/kg de muscle (somme des 2 alkylphénols). Assessment of pollution along the Northern Iberian shelf by the combined use of chemical and
biochemical markers in two representative fish species. 4-t-OP 4-NP Fernandes D., Andreu-Sánchez O., Bebianno M. J., Porte C. 2008 Bile de poisson - 100 mg.
Extraction : non renseignée. Solvant d'extraction :
acétate d’éthyle. Répétée 3 fois. GC/MS
4-t-OP : de 5 à 21 µg/kg de bile
4-NP : de 108 à 220,3 µg/kg de bile (somme de 11 isomères).
Alkylphenols and their ethoxylates in seafood from the Tyrrhenian Sea.
OP (14 isomères) 4-t-OP NP (21 isomères) p-NP Ferrara F., Ademollo N., Delise M., Fabietti F., Funari E. 2008 Crustacé, mollusque et poisson – 5 g de lipides.
Extraction (des lipides) : par agitation mécanique.
Solvant d'extraction : acétone/hexane 3,5:1 v/v puis
hexane/éther diéthylique 90/10 v/v et enfin hexane. Extraction (des AP) : simple agitation. Solvant
d'extraction : acétonitrile puis isooctane.
Dérivation : avec du TFAA
GC/MS
Etalonnage interne (dodécylbenzène). Triplicats analysés pour calculs statistiques.
Recouvrement (±CV) : 4-t-OP 88% ± 10% ; OP (13 différents isomères) 85% ± 11% ; p-NP 91% ± 14% et NP (4 différents isomères) 85% ± 10. Blancs procédures vérifiés.
LD correspondant au 1er point de gamme. 4-t-OP : 0,5 OP: 10,8 p-NP : 12,4 NP : 16,8 OP valeurs entre 0,2 et 27, 9. NP valeurs entre 5 et 1220. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 2 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les organismes biologiques
Titre publication Composé
analysé Auteurs Année
Type d’organisme
et prise d'essai
Préparation échantillon Technique
analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…) LD ou LQ Concentrations mesurées Distribution characteristics of nonylphenolic chemicals in Masan Bay environments, Korea. NP LI D., Dong M., Shim W.J., Yim U.H., Hong S.H., Kannan N. 2008 Mollusque.
Extraction : par Soxhlet. Solvant d'extraction : dichlorométhane.
Extraction : par PFE. Solvant d'extraction : dichlorométhane.
Purification : par ajout de cuivre. Dérivation : avec du BSTFA.
Purification : par SPE. Solvant d’élution : hexane.
Phase : Florisil.
GC/MS
Etalonnage interne : naphthalene-d8 et
phenanthrene-d10.
Analyse de duplicats : si l’erreur relative > 30%, les échantillons sont à nouveau analysés.
Dopages : si le recouvrement n'est pas compris entre 70 et 120%, les échantillons sont à nouveau analysés. Rendement sur l'heptylphénol et bisphenolA-d16: >92%.
Blancs terrain, blancs méthodes tous les 12 échantillons (<LQ/3).
Valeurs comprises entre 51 et 290. Contamination profiles of heavy metals, organochlorine pesticides, polycyclic aromatic hydrocarbons and alkylphenols in sediment and oyster collected from marsh/estuarine Savannah GA, USA.
OP NP Senthil Kumar K., Sajwan K.S., Richardson J.P., Kannan K. 2008 Mollusque.
Extraction : par Soxhlet. Solvant d'extraction : dichlorométhane.
Purification : sur colonne. Solvant d’élution : dichlorométhane/méthanol 50/50. Phase : Florisil. Dérivation : avec du BSTFA.
LC/Fluo
Linéarité : r2 >0,99 (6 points de
calibration).
Rendements compris entre 90 et 105%. Blancs vérifiés tous les 5 échantillons.
LD OP et NP : 0,5.
OP, compris entre LD et 7,9 en poids frais ou entre LD et 10 en poids sec. NP, compris entre LD et 16 en poids frais ou entre LD et 20 en poids sec. Seasonal variation of hydrophobic organic contaminant concentrations in the water-column of the Seine Estuary and their transfer to a planktonic species Eurytemora affinis (Calanoïd, copepod). Part 2 : alkylphenol-polyethoxylates. 4-NP Cailleaud K., Forget-Leray J., Souissi S., Lardy S., Augagneur S., Budzinski H. 2007 Plancton.
Extraction : au four à micro-ondes. Solvant
d'extraction : méthanol/dichlorométhane 3:1 v/v.
Purification : par SPE. Solvant d’élution :
méthanol/dichlorométhane 50/50 v/v. Phase : C18.
LC/MS
Etalonnage externe.
Linéarité : coefficient de linéarité >0,995.
Recouvrement d'échantillons d'eau ultra pure dopée : 90 ± 12%.
Blancs procédures (représentent moins de 10% des valeurs des échantillons). La contribution du blanc est soustraite.
Compris entre 251 ± 23 et 2477 ± 0 (en poids sec). CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 2 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les organismes biologiques
Titre publication Composé
analysé Auteurs Année
Type d’organisme
et prise d'essai
Préparation échantillon Technique
analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…)
LD ou LQ Concentrations
mesurées
Distribution of Polycyclic Aromatic Hydrocarbons (PAHs) and phenolic endocrine disrupting chemicals in South and Southeast Asian mussels. NP OP Isobe T., Takada H., Kanai M., Tsutsumi S., Isobe K.O., Boonyatumanon d R., Zakaria M.P. 2007 Mollusque (tissus mous) - 20 g.
Extraction : par agitation mécanique. Solvant
d'extraction : dichlorométhane. Répétée 2 fois.
Purification : par GPC. Solvant d’élution : dichlorométhane. Phase : non renseignée. Purification : sur colonne. Solvant d’élution : dichlorométhane/hexane 65/35 v/v. Phase : gel de silice.
Dérivation : acétylisation (composé de dérivation non renseigné).
GC/MS
Réplicats (n=4) : NP CV=8,6% et OP CV=20%.
Recouvrement d'échantillons dopés : 105% pour le NP et 107% pour l'OP.
NP : valeurs entre 18 et 663 (poids sec) ou entre 0,2 et 13,1 µg/g de lipide.
OP : valeurs entre 1 et 16 (poids sec).
Natural and synthetic endocrine disrupting compounds (EDCs) in water, sediment and biota of a coastal lagoon. NP Pojana G., Gomiero A., Jonkers N., Marcomini A. 2007 Mollusque (tissus mous) - 5 g.
Extraction : aux ultrasons. Solvant d'extraction : n-hexane/acétone 70/30. Répétée une 2ème fois. Purification : sur colonne. Solvant d’élution : n-hexane/isopropanol 90/10. Phase : Florisil.
LC/MS
Dopages à 2 niveaux (100 et 20 ng/g poids sec) de NP analysés en triplicat : rendements > 62% (CV < 15%). LD calculée sur la base de 3 fois le rapport signal sur bruit. Valeurs NP entre 0,3 et 5,0 (poids sec). Valeurs entre 115 et 240 (poids sec). Occurrence and seasonal variation of alkylphenols in marine organisms from the coast of Taiwan.
4-t-OP 4-NP
Cheng C.Y., Liu L.L., Ding W.H. 2006
Mollusque - 0,5 g.
Extraction : par entraînement à la vapeur. Solvant
d'extraction : n-hexane. GC/MS
Rendements pour les huîtres (n=6) : 91% en moyenne pour le 4-t-OP et 92% en moyenne pour le 4-NP avec des CV compris entre 7 et 14%.
OP
Huîtres : valeurs entre 20 et 1460.
Escargots : valeurs entre 21 et 1370 ng/g. NP
Huîtres : valeurs entre 130 et 5190.
Escargots : valeurs entre 66 et 3910. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Titre publication Composé
analysé Auteurs Année
Type d’organisme
et prise d'essai
Préparation échantillon Technique
analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…)
LD ou LQ Concentrations
mesurées
Invertébré - 5 g.
Extraction : aux ultrasons. Solvant d’extraction : méthanol.
Purification : par SPE. Solvant d’élution : méthanol.
Phase : HLB.
LC/MS-MS.
Etalonnage interne (17βestradiol-d2 et
ψDES-d8).
Linéarité : r2 (n=5) 0,996 (NP et OP). Recouvrement (n=3) : 95,25% pour le NP, 74,51% pour l'OP et 98,85% pour le tert-OP.
CV (n=6) : 39,88% pour le NP, 35,13% pour l'OP et 29,30% pour le tert-OP.
LD : NP : 22,50 OP : 7,41 t-OP : 16,01 NP : valeurs entre 32,76 et 95,66 OP : < LD
t-OP : valeurs entre 28,02 et 49,81 Investigating the
estrogenic risk along the River Po and its intermediate section NP OP t-OP Vigano L., Mandich A., Benfenati E., Bertolotti R., Bottero S. Porazzi E., Agradi E. 2006 Bile de poisson - 50 µL.
Purification : sur colonne. Solvant d’élution : méthanol. Phase : sorbant polymérique. Dérivation : BSTFA GC/MS. Etalonnage interne (4-n-NP) LD : NP : 2,53 µg/L OP : 0,86 µg/L t-OP : 0,94 µg/L. NP : valeurs entre < LD et 151690 µg/L. OP : valeurs entre < LD et 4000 µg/L.
t-OP : valeurs entre <LD et 3720 µg/L. Alkylphenols and
alkylphenol ethoxylates contamination of crustaceans and fishes from the Adriatic Sea (Italy). OP NP Ferrara F., Fabietti F., Delise M., Funari E. 2005 Crustacé et poisson - 1 à 1,5 g de lipides (poids sec)
Extraction : par agitation mécanique. Solvant
d'extraction : acétone/hexane 3,5 :1 v/v.
Extraction : par agitation mécanique. Solvant
d'extraction : hexane/éther diéthylique 90/10 v/v.
Extraction : non renseignée. Solvant d'extraction : acétonitrile puis isooctane.
GC/MS
Etalonnage interne (dodécylbenzène). Recouvrement (n=3) : 94 ± 0,9% pour l'OP et 89 ± 3,9% pour le NP. Les blancs se situent toujours sous la LD. LD : OP : 0,5 µg/L NP : 8,1 µg/L OP : comprises entre 0,3 ± 0,002 et 4,7 ± 0,2 ng/g NP : comprises entre 2,7 ± 0,3 et 1285 ± 11 ng/g Trophodynamic behavior of 4-nonylphenol and nonylphenol polyethoxylate in a marine aquatic food web from Bohai Bay, North China : comparison to DDTs
4-NP
Hu J., Jin F., Wan Y., Yang M., An L., An W., Tao S. 2005 Phytoplancton , zooplancton, invertébré (tissus mous), poisson et oiseau de mer (muscles) - 5 à 30 g.
Extraction : par Soxhlet. Solvant d'extraction : dichlorométahne/méthanol 70/30 v/v. Purification : par SPE. Solvant d’élution : hexane/isopropanol 90/10 v/v. Phase : NH2.
Etapes supplémentaires pour les muscles d’oiseau : Purification: par SPE. Solvant d’élution :
non renseigné. Phase : C18. Dérivation : avec du BSTFA.
GC/MS
Recouvrements compris entre 79 et 84%.
Dopage systématique avec du 4-n-NP, rendements obtenus de 95±12%. Pour n=3 justesse <20%. Blancs procédures. Comprises entre 142,6 ± 23,4 et 677,8 ± 136 ng/g de lipide. Nonylphenol and nonylphenol ethoxylates in river water, drinking water, and fish tissues in the area of Chonqing, China. 4-NP Shao B., Hu J., Yang M., An W., Tao S. 2005 Poissons (muscle, foie et branchies) - 0,5 g.
Extraction : par Soxhlet. Solvant d'extraction : méthanol/dichlorométhane 30/70 v/v. Purification : par SPE. Solvant d’élution : dichlorométhane/méthanol 80/20 v/v. Phase : SupelcleanTM Envi-CarbTM.
GC/MS
Recouvrement compris entre 92 et 117% avec un CV compris entre 2 et 20%. LD 4-NP : 5,0 Comprises entre < LD et 1,9 µg/g CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes
Action 13 : Développement et optimisation des méthodes physico-chimiques
Tableau 2 : Synthèse bibliographique - Méthodes d’analyse de l’octylphénol et du nonylphénol dans les organismes biologiques
Titre publication Composé
analysé Auteurs Année
Type d’organisme
et prise d'essai
Préparation échantillon Technique
analytique
Informations sur la validation (linéarité, répétabilité, rendements,
blancs…) LD ou LQ Concentrations mesurées Flame retardants surfactants and organotins in sediment and mysid shrimp of the Scheldt estuary (The Netherlands) NP Verslycke T.A., Vethaak A.D., Arijis K., Janssen C.R.
2005 Crustacé. Extraction : par Soxhlet. Solvant d'extraction : méthanol. LC/MS Analyse des échantillons en duplicat.
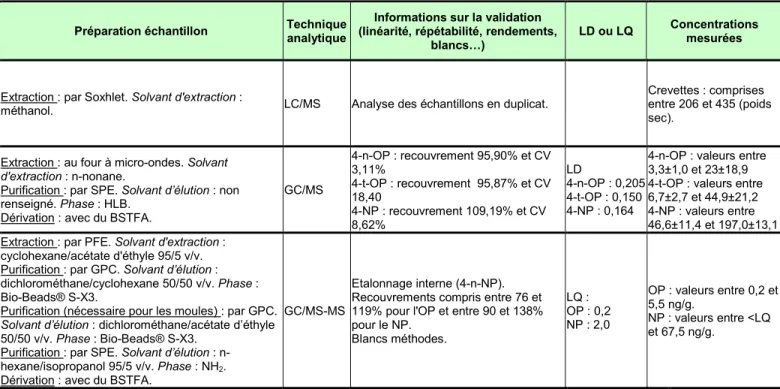
Crevettes : comprises entre 206 et 435 (poids sec). Endocrine disrupting alkylphenols and bisphenol-A in coastal waters and supermarket seafood from Singapore
4-n-OP 4-t-OP 4-NP Basheer C., Lee H.K., Tan K.S. 2004 Mollusque (corps entier), crustacé et poisson (muscle) - 0,2 g.
Extraction : au four à micro-ondes. Solvant
d'extraction : n-nonane.
Purification : par SPE. Solvant d’élution : non renseigné. Phase : HLB.
Dérivation : avec du BSTFA.
GC/MS 4-n-OP : recouvrement 95,90% et CV 3,11% 4-t-OP : recouvrement 95,87% et CV 18,40 4-NP : recouvrement 109,19% et CV 8,62% LD 4-n-OP : 0,205 4-t-OP : 0,150 4-NP : 0,164
4-n-OP : valeurs entre 3,3±1,0 et 23±18,9 4-t-OP : valeurs entre 6,7±2,7 et 44,9±21,2 4-NP : valeurs entre 46,6±11,4 et 197,0±13,1 Retrospective monitoring of alkylphenols and alkylphenol monoethoxylates in aquatic biota from 1985 to 2001 : results from the German Environmental Specimen Bank. OP NP Wenzel A., Böhmer W., Müller J., Rüdel H., Schröter-Kermani C. 2004 Poisson (muscles) et mollusque - 0,2 à 1 g
Extraction : par PFE. Solvant d'extraction : cyclohexane/acétate d'éthyle 95/5 v/v. Purification : par GPC. Solvant d’élution : dichlorométhane/cyclohexane 50/50 v/v. Phase : Bio-Beads® S-X3.
Purification (nécessaire pour les moules) : par GPC.
Solvant d’élution : dichlorométhane/acétate d’éthyle
50/50 v/v. Phase : Bio-Beads® S-X3. Purification : par SPE. Solvant d’élution : n-hexane/isopropanol 95/5 v/v. Phase : NH2.
Dérivation : avec du BSTFA.
GC/MS-MS
Etalonnage interne (4-n-NP). Recouvrements compris entre 76 et 119% pour l'OP et entre 90 et 138% pour le NP. Blancs méthodes. LQ : OP : 0,2 NP : 2,0 OP : valeurs entre 0,2 et 5,5 ng/g. NP : valeurs entre <LQ et 67,5 ng/g. CemOA : archive ouverte d'Irstea / Cemagref
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 19/32
2.2 Analyse des publications
2.2.1 SEDIMENTS
Un total de 19 publications a été obtenu, ces publications sont détaillées dans le tableau 1. Quatre d’entre elles suivent exactement le même protocole analytique deux à deux et ont été regroupées :
Les 2 publications de Li et al, 2004.
La publication de Jin et al, 2007 et celle de Hu et al, 2005. C’est la première, comportant moins d’informations dans la partie « validation » qui est exclue de la synthèse.
L’analyse de ces résultats ramenés à 17 publications est présentée ci-après :
Isomères de l’OP et du NP analysés : dans 8 publications sur les 17 étudiées, le composé analysé est détaillé clairement. Le plus souvent c’est le p-NP (ou 4-NP) qui est analysé (mélange d’isomères ramifiés) et le p-t-OP (ou 4-t-OP ou t-OP) correspondant au composé utilisé majoritairement dans l’industrie. Le n-OP et le p-n-NP sont cités 1 fois chacun mais ne sont pas des composés utilisés dans l’industrie (INERIS, 2005). Dans les autres publications, peu de précisions sont apportées. On ne peut pas savoir si ces publications analysent le 4-NP et le p-t-OP, les composés considérés perturbateurs endocriniens et majoritairement utilisés dans l’industrie ou d’autres isomères peu pertinents.
Préparation de l’échantillon : cette étape de pré-traitement des échantillons n’est pas détaillée dans cette synthèse où l’effort est mis sur l’extraction, la purification des échantillons et le dosage des alkylphenols. On peut cependant relever que, le plus souvent, l’échantillon est congelé, lyophilisé et homogénéisé.
Prise d’essai : elle varie de 0,5 à 20 g, poids sec. Elle est le plus souvent de 5 ou 10 g (dans 5 et 4 cas respectivement). 3 publications ne renseignent pas l’information.
L’étape d’extraction : sur les 17 publications étudiées, l’extraction par solvant organique aux ultrasons est réalisée dans 5 cas et celle par Soxhlet dans 4 cas. De plus, dans 2 publications, ont été testées l’une et l’autre technique ainsi que l’extraction par agitation mécanique. Cette dernière est utilisée dans 3 autres publications. L’extraction par PFE et par micro-onde sont elles décrites dans une publication chacune.
Le solvant d’extraction le plus souvent utilisé, en ne considérant pas les méthodes multirésidus, est le dichlorométhane, cité dans 5 publications sur 8. L’hexane, un
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 20/32
mélange hexane/acétone et un mélange dichlorométhane/méthanol sont chacun cités 1 fois.
L’étape de purification : sur les 17 publications étudiées, 13 effectuent une purification. Dans 12 cas elle s’effectue à pression ambiante, sur colonne (9 cas) ou sur cartouche SPE (3 cas), et dans 1 cas par HPLC. Parmi celles-ci, 4 publications mentionnent l’ajout de cuivre pour l’élimination du soufre.
Les phases les plus souvent utilisées sont le silicate de magnésium (Florisil®) et le gel de silice dans 5 cas respectivement. L’alumine et la phase HLB sont mentionnées 1 fois. Une publication ne précise pas la phase utilisée (cas de la purification par HPLC).
Le solvant d’élution le plus souvent utilisé, en ne considérant pas les méthodes multirésidus, est l’hexane cité dans 4 publications sur 8, ces 4 publications effectuant une purification sur silicate de magnésium. De l’isooctane, un mélange de dichlorométhane/méthanol, un mélange dichlorométhane/hexane 80/20, sont mentionnés chacun dans une publication.
Dérivation : 7 publications décrivent une dérivation utilisant du BSTFA, 2 avec du PFPA et une utilisant une acétylation. Dans 9 cas sur 10 l’analyse est effectuée par GC. Dans le dernier cas l’analyse se fait par LC/Fluo.
Les techniques analytiques : l’analyse par GC/MS est utilisée dans 12 publications sur 17. La LC/MS dans 3 puis la LC/MS/MS et la LC/Fluo dans 1 cas. Au niveau des détecteurs de masse, la quadripôle et la trappe d’ions sont cités, avec, en GC, le mode ionisation électronique et, en LC, le mode d’ionisation par électrospray.
Les LQ : pour comparer les valeurs des différentes publications entre elles, lorsque seules les LD étaient mentionnées, celles-ci ont été multipliées par 3 pour obtenir la LQ.
Les LQ sont comprises entre 0,030 µg/kg (pour une prise d’essai de 1 g) et 64,5 µg/kg (prise d’essai de 5 g) poids sec pour le NP. Pour le OP elles sont comprises entre 0,015 µg/kg (pour une prise d’essai de 1 g) et <20 µg/kg (prise d’essai 0,5 g) poids sec. On peut noter que 5 publications ne citent pas de LQ.
Les comparaisons de LQ sont difficiles, celles-ci dépendant entre autres de la prise d’essai ou de la manière de la calculer (on considère la LQ instrumentale ou globale de méthode) ce qui n’est pas toujours précisé.
Autres paramètres de validation :
o Etalonnage interne : 6 publications sur 17 l’utilisent. Dans un seul cas le composé marqué utilisé est un alkylphénol : le 13C6-NP.
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 21/32
o Rendements : les rendements présentés sont compris entre 70 et 120%. Cependant, la plupart du temps, le protocole n’est pas détaillé et parfois la la valeur du point de dopage n’est pas précisée.
o Précision : 11 publications sur 17 donnent un CV ou un écart-type sur les concentrations, la plupart du temps obtenu à partir de l’analyse d’un triplicat d’échantillon réel. La valeur la plus élevée obtenue s’élève à 24% pour le 4-NP.
Une publication analyse tous les échantillons en duplicat et calcule pour chaque une erreur relative : quand celle-ci est supérieure à 30%, les
échantillons sont analysés de nouveau.
o Blancs : 7 publications vérifient les blancs. Des blancs méthodes, des blancs solvants et, beaucoup moins souvent, des blancs terrains sont analysés. La valeur maximum admise dans le blanc est mentionnée dans 2 cas et correspond à <LD ou <LQ/3.
2.2.2 BIOTE
Un total de 16 publications a été obtenu, décrites dans le tableau 2. Deux d’entre elles suivent exactement le même protocole analytique et ont donc été regroupées pour cette synthèse : Ferrara et al, 2008 et Ferrara et al, 2005.
L’analyse de ces résultats, ramenés à 15 publications est présentée ci-après :
Isomères de l’OP et du NP analysés : contrairement aux sédiments, beaucoup plus de publications précisent en détail les isomères suivis. En effet, 10 publications sur 15 détaillent ce point et analysent le plus souvent le 4-NP et le 4-t-OP. Le 4-t-NP est aussi mentionné et on peut se demander à quel isomère il correspond, le groupement tert étant normalement présent dans le 4-tert-butylphénol et le 4-tert-octylphénol. Dans les autres publications, peu de précisions sont apportées.
Préparation de l’échantillon : cette étape de pré-traitement des échantillons n’est pas détaillée dans cette synthèse où l’effort est mis sur l’extraction, la purification des échantillons et le dosage des alkylphenols. On peut cependant relever que, le plus souvent, l’échantillon est congelé, le cas échéant disséqué et homogénéisé. Dans 4 cas, il est également lyophilisé (les résultats étant ensuite bien évidemment donnés en poids sec). Dans une publication, la congélation se fait sous atmosphère inerte et dans une autre publication, seule une réfrigération de l’échantillon est appliquée.
Prise d’essai : elle varie de 0,1 à 30 g poids frais et est en général autour de 5 g. Sur les 15 publications, 5 n’ont pas renseigné l’information.
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 22/32
Type d’organisme analysé : des mollusques sont analysés dans 8 publications sur les 15 étudiées (auxquelles on peut rapprocher les 2 publications sur l’analyse des invertébrés). Le muscle de poisson est analysé dans 6 publications, la bile de poisson dans 2, le foie de poisson et le poisson entier dans 1. Les crustacés sont analysés dans 3 publications, le plancton et le muscle d’oiseau dans 1 publication chacune. Bien que les performances de la méthode (LQ, rendements) dépendent du type d’organisme, le protocole analytique en lui-même reste identique, sauf dans le cas de matrices riches en lipides telles que les filets ou foies de poissons où une purification supplémentaire est nécessaire.
L’étape d’extraction : sur les 15 publications étudiées, l’extraction par Soxhlet est réalisée dans 4 cas, celle aux ultrasons dans 3 cas, celle par simple agitation mécanique et par micro-ondes dans 2 cas et, enfin, par PFE dans 1 cas. Une publication ne précise pas la technique utilisée.
Les solvants d’extraction le plus souvent utilisé, en ne considérant pas les méthodes multirésidus, sont le dichlorométhane et un mélange dichlorométahne/méthanol 70/30, cités chacun dans 2 publications sur 8. L’hexane, un mélange hexane/acétone et un mélange dichlorométhane/méthanol sont chacun cités 1 fois. Chaque publication utilise ensuite un solvant ou un mélange de solvants différent : hexane, mélange cyclohexane/acétate d’éthyle 95/5, mélange méthanol/dichlorométhane 3/1. Une publication effectue 2 extractions en série avec de l’acétone puis de l’isooctane.
L’étape de purification : la purification se fait dans 8 cas par SPE et dans 4 sur colonne sur les 15 publications étudiées, dont certaines mettent en œuvre plusieurs purifications successives. La GPC est elle utilisée dans 3 publications, dont 2 fois après une purification par SPE ou sur colonne. Une publication mentionne l’ajout de cuivre pour l’élimination du soufre. De plus, 4 publications ne font pas de purification.
La phase utilisée pour la purification est le plus souvent du silicate de magnésium (3 publications), du polymère présentant un support hydrophile-lipophile (2 publications), de la silice greffée C18 (2 publications) ou de la silice greffée NH2 (2 publications).
Dans le cas de la GPC, lorsque la phase est précisée (2 fois sur les 3 publications faisant une purification par GPC), une phase de type polymère applicable à des composés ayant une masse molaire allant jusqu’à 2000 Daltons est utilisée.
Le solvant d’élution diffère d’une publication à l’autre (aucun des solvants ou mélange de solvants n’est cité plus de 2 fois chacun) même en ne considérant pas les
méthodes multirésidus. Cela peut être de l’hexane, un mélange de
dichlorométhane/méthanol, un mélange de dichlorométhane/méthanol 80/20 ou un
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 23/32
mélange hexane/isopropanol. Aucune corrélation n’a pu être établie entre les phases utilisées et les solvants d’élution employés.
Dérivation : 7 publications effectuent une dérivation, dont 6 avec par silylation à l’aide de BSTFA et 1 par acétylation avec du TFAA. La dérivation s’effectue avant une analyse par GC, sauf dan s1 cas où elle se fait par LC/Fluo.
Les techniques analytiques : l’analyse par GC/MS est utilisée dans 10 cas sur 15 et celle par GC/MS/MS dans 1 cas. Dans 3 cas une analyse par LC/MS est effectuée et dans 1 cas par LC/MS/MS. Enfin la LC/Fluo est utilisée dans une publication. Au niveau des détecteurs de masse, la quadripole et la trappe d’ions sont cités, avec, en GC, le mode ionisation électronique et, en LC, le mode d’ionisation par électrospray.
Les LQ : pour comparer les valeurs des différentes publications entre elles, lorsque seules les LD étaient mentionnées, celles-ci ont été multipliées par 3 pour obtenir la LQ.
Les LQ sont comprises entre 0,2 µg/kg (en poids frais. Donnée au départ en poids sec, calculée en poids frais avec comme hypothèse : pourcentage de matière sèche 20%. Valeur pour une prise d’essai de 5 g) et 67,5 µg/kg (poids frais, prise d’essai de 5 g) pour les isomères du NP. Pour les isomères de l’OP elles sont comprises entre 0,2 µg/kg (pour une prise d’essai comprise entre 0,2 et 1 g ) et 48 µg/kg (prise d’essai de 5 g). On peut noter que 7 publications ne citent pas de LQ.
Les comparaisons de LQ sont difficiles, celles-ci dépendant entre autres de la prise d’essai, de la manière de la calculer (on considère la LQ instrumentale ou globale de méthode) ce qui n’est pas toujours précisé.
Autres paramètres de validation :
o Etalonnage interne : 5 publications sur 15 l’utilisent. Dans un seul cas le composé marqué utilisé est un alkylphénol : le d8-4-n-NP.
o Rendements : 11 publications donnent les rendements obtenus. Ils sont compris entre 62 et 105% toutes molécules confondues, avec le plus souvent un rendement >80%. Cependant, la plupart du temps, le protocole n’est pas détaillé et parfois la nature du dopage n’est pas précisée.
o Précision : 10 publications sur 15 donnent un CV ou un écart-type sur les concentrations, la plupart du temps obtenu à partir de l’analyse d’un triplicat d’échantillon réel. La valeur la plus élevée obtenue s’élève à 20%. Une publication montre des valeurs élevées pour ses CV, allant de 23% pour le t-OP à 40% pour le NP. Une publication analyse tous ses échantillons en
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 24/32
duplicat et calcule pour chaque l’erreur relative : quand celui-ci est supérieur à
30%, les échantillons sont analysés de nouveau.
o Blancs : 6 publications sur les 15 étudiées vérifient les blancs. 4 blancs
méthode, 1 blanc terrain et un blanc (sans plus de précisions) sont analysés. Les valeurs maximum admises sont dans un cas la LQ/3 et dans l’autre 10% du blanc. Les autres publications ne précisent pas de valeurs critiques.
3. Conclusion : proposition de méthode
A partir de cette synthèse bibliographique sur l’analyse de l’octylphénol et du nonylphénol dans les sédiments et les organismes biologiques, une base à un développement analytique plus complet est ici proposée :
Isomères de l’OP et du NP analysés : trop souvent les composés d’intérêt sont cités comme OP et NP et peu de détails dont donnés sur les isomères analysés (4-tert-octylphénol ou 4-nonylphénol par exemple). Il est important d’être plus précis et de présenter par exemple l’étalon utilisé pour la quantification ou le nombre de pics considérés pour arriver aux données présentées.
A ce jour, ce point engendre de nombreux problèmes de quantification, les isomères quantifiés n’étant pas ceux réellement ciblés. Un soin particulier doit être apporté au choix de l’isomère, aux étalons utilisés et à l’élaboration d’une méthode de quantification pertinente.
Extraction : l’extraction par PFE est recommandée en raison de à sa plus grande efficacité par rapport aux autres méthodes et à son automatisation (ultrasons, Soxhlet ou simple agitation mécanique). Cette technique permet aussi de limiter la consommation de solvant et de diminuer le temps d’extraction. L’étude a également montré que l’extraction aux ultrasons est souvent utilisée et donne de bons rendements. Si l’efficacité de l’extraction est prouvée, celle-ci peut aussi être envisagée. L’extraction par Soxhlet n’est pas recommandée, la technique étant longue à mettre en œuvre et utilisant une grande quantité de solvant. De plus elle est souvent utilisée dans cette synthèse avec du dichlorométhane, solvant très volatil, ce qui entraîne une perte de solvant pendant le processus d’extraction. Concernant l’extraction par agitation mécanique, en plus de ses points faibles comparables à ceux de l’extraction par Soxhlet, deux publications (Peng et al., 2006 et Hu et
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 25/32
al.,2005) ont montré que, pour les sédiments, son efficacité est moindre par rapport à
une extraction aux ultrasons ou par Soxhlet.
Les solvants utilisés balaient une polarité très large : cela va de l’hexane au méthanol. En revanche, si on ne s’intéresse qu’aux publications traitant des alkylphénols et non de méthodes multirésidus, le solvant utilisé est toujours apolaire. Le dichlorométhane, utilisé dans les publications du tableau 1, induit de bons rendements (supérieurs à 80%, lorsqu’ils sont indiqués). Le produit étant un cancérigène suspecté, il serait préférable d’utiliser un autre solvant ou mélange de solvants comme du cyclohexane ou de l’isooctane si le rendement d’extraction obtenu est jugé satisfaisant.
Purification : afin de purifier et concentrer l’extrait, une purification à pression ambiante (sur colonne ou cartouche SPE) est, comme le montre cette synthèse, recommandée (12 publications sur les 17 étudiées effectuent une purification sur colonne ou par SPE). Une phase de silicate de magnésium ou de silice (mécanisme d’adsorption) peut être utilisée.
Pour les organismes biologiques, dans le cas de matrices riches en lipides (poisson par exemple), une purification supplémentaire par GPC peut se révéler utile afin d’éliminer les grosses molécules lipidiques. Dans cette synthèse, c’est une phase applicable à des composés ayant une masse molaire allant jusqu’à 2000 Daltons qui est utilisée.
Solvant : les solvants utilisés sont très différents mais, ici aussi, si on ne considère que les publications traitant des alkylphénols, ce sont des solvants ou des mélanges de solvants apolaires qui sont utilisés. L’hexane ou un mélange d’acétate d’éthyle/hexane donnent de bons résultats. Vu la toxicité de l’hexane, il serait intéressant d’utiliser d’autres solvants tels que par exemple l’heptane ou l’isooctane, seuls ou en mélange.
De plus, si des interférences liées au soufre sont observées lors de la quantification, une désulfurisation pourra être effectuée par ajout de cuivre.
Dosage : selon cette synthèse, le dosage est autant effectué par GC que par LC. Cependant, ce ne sont que les méthodes multirésidus qui utilisent la LC (Fluo ou MS) pour le dosage. En effet, la GC est une technique plus sensible pour les alkylphénols (Shao et al, 2005) et est celle que nous recommandons, couplée à la masse, en mode ionisation électronique. Cette technique est d’ailleurs utilisée dans la norme ISO 18857-2 (2009) d’analyse des nonylphénols dans les eaux.
CemOA
: archive
ouverte
d'Irstea
Domaine Substances Polluantes Action 13 : Développement et optimisation des
méthodes physico-chimiques
Mars 2010 - p 26/32
Egalement, vu le nombre d’étapes que comprend l’analyse des alkyphénols, un traceur méthode est conseillé. Il permettra d’obtenir un rendement global de la méthode et de corriger ainsi la concentration mesurée. Il est important, surtout pour le biote, de doper chaque échantillon. En effet, d’un échantillon à l’autre les effets de matrice sont différents selon la teneur en lipides par exemple ou la fraction analysée.
Validation : peu de données de validation sont présentées qui permettraient de comparer les performances des méthodes décrites. Les meilleures performances en terme de LQ sont de l’ordre de 0,030 µg/kg poids sec pour le NP dans les sédiments et de 0,015 µg/kg poids sec pour le OP dans cette même matrice. Ces concentrations sont obtenues dans des grands lacs, dans les autres cas, les LQ les plus basses obtenues sont 0,5 µg/kg poids sec. Dans le biote, des LQ de 0,9 poids sec pour le NP et de 0,2 µg/kg poids frais pour le OP. Encore beaucoup de publications ne communiquent pas les performances de leur méthode ou ne donnent pas la méthode de calcul de la LQ.
Egalement, peu de publications utilisent un étalonnage interne. Il est cependant important d’utiliser ce type d’étalonnage pour s’affranchir des interférences lors du dosage de ces matrices complexes. Une attention particulière doit être apportée au choix de l ‘étalon interne. En effet, l’INERIS a montré que les composés deutérés du NP avaient tendance à l’échange hydrogène/deutéré en milieux aqueux du à la proximité entre le groupe OH et les substitutions du cycle (M.P. Strub, communication
personnelle). Les masses molaires ne coïncidant plus, la quantification en masse
s’en retrouve erronée. Des étalons marqués 13C doivent donc être utilisés, comme indiqué dans les normes NF EN ISO 18857-1 (2006) et ISO 18857-2 (2009) qui préconisent l’utilisation du 4-n-nonylphénol(cycle-13C6), C9H19-[13C6]H4-OH pour la
première et du 4-tert-octylphénol(cycle-13C6) et 4-(3,6-diméthyl-3-heptyl)phénol(cycle-13C
6) comme étalons internes respectifs du 4-tert-octylphénol et du 4-nonylphenol
pour la seconde.
Contamination : une des difficultés de l’analyse les alkylphénols est d’obtenir des blancs méthodes propres. Il est important de décontaminer la vaisselle utilisée (rinçage et passage au four à moufles, ce qui oblige à travailler par gravimétrie) et de proscrire tout outil en plastique, susceptible de contenir des alkylphénols, lors de la préparation de l’échantillon. CemOA : archive ouverte d'Irstea / Cemagref