This manuscript has been reproduœd from the microfilm m3ster. UMI films the
text directly from the original or copy submitted. Thus, some thesis and
dissertation copies are in typewriter face, while others may be from any type of
computer printer.
The quality of this reproduction is dependent upon the quality of the copy
submitted. Broken or indistinct print, colored or poor quality illustrations and
photographs, print bleedthrough, substandard margins, and improper alignment
can adversely affect reproduction.
ln the unlikely event that the author did not send UMI a complete manuscript and
there are missing pages, these will be noted. Aise, if unauthorized copyright
material had te be removed, a note will indicate the deletion.
Oversize materials (e.g., maps, drawings, charts) are reproduced by sectioning
the original, beginning at the upper left-hand corner and continuing from left ta
right in equal sections with small overlaps. Each original is also photographed in
one exposure and is included in reduced form at the back of the book.
Photographs included in the original manuscript have been reproduced
xerographically in this copy. Higher quality 6" x 9" black and white photographie
prints are available for any photographs or illustrations appearing in this copy for
an additional charge. Contact UMI directly to order.
UMf
Bell & Howell Information and Leaming
300 North Zeeb Road, Ann Arbor, Ml 48106-1346 USA 800-521-0600
This reproduction is the best ·capy available
Caractérisation fonctionnelle des protéines de transition
de la spermiogenèse
Par
M. Dominique Lévesque Département de Biochimie
Mémoire présenté à la Faculté de Médecine en vue de l'obtention du grade de Maître
ès
sciences (M.Sc.) en Biochimiel+I
of Canada du Canada Acquisitions andBibliographie Services Acquisitions et services bibliographiques
395 Wellington Street Ottawa ON K1A ON4 Canada
395, rue Wellington
Ottawa ON K1A ON4 Canada
The author has granted a
non-exclusive licence allowing the
National Library of Canada to
reproduce, loan, distribute or sell
copies of this thesis
in
microform,
paper or electronic formats.
The author retains ownership of the
copyright
in
this thesis. Neither the
thesis nor substantial extracts from it
may be printed or otherwise
reproduced without the author' s
permission.
Your hie Votre referoncs Our t.Je Notre r11te1snce
L'auteur a accordé une licence non
exclusive permettant à la
Bibliothèque nationale du Canada de
reproduire, prêter, distribuer ou
vendre des copies de cette thèse sous
la forme de microfiche/fihn, de
reproduction sur papier ou sur format
électronique.
L'auteur conserve la propriété du
droit d'auteur qui protège cette thèse.
Ni la thèse
ni
des extraits substantiels
de celle-ci ne doivent être imprimés
ou autrement reproduits sans son
autorisation.
0-612-40604-0
TABLE DES MATIÈRES
LISTE DES FIGURES ... III
LISTE DES ABRÉVIA TlONS ... IV
RÉSUMÉ
1. INTRODUCTION ...
l l. l LA SPERMATOOENÈSE CHEZ LES MAMMIFÈRES... ll .2
LA SPERMIOOENÈSE ...4
1.2. l Condensation de la chromatine chez les cellules germinales et somatiques ... 4
1.2.2 Modèle proposé de condensation de la chromatine du spermatozoïde ... 6
1.2.3 Organisation nucléaire de la chromatine chez le spermatozoïde ... 7
1.2.4 Activité transcriptionnelle durant la spenniogcnèse ... 8
1.2.5 Régulation traductionnelle durant la spe1TI1iogenèse ... IO
1.3
LES PROTÉINES DE TRANSITION MAJEURES DE LA SPERMIOGENÈSE ...12
l.3.1 La protéine de transition TPl. ... 12
1.3.2 Dimérisation de la protéine de transition TPl. ... 14
1.3.3 La protéine de transition TP2 ... 15
l .3.4 Motifs en doigt à zinc de TP2 ... 15
l.4 AUTRES PR01$INES NUCLÉAIRES IMPLIQUÉES DURANT LA SPERMIOOENESE ... 17
1.4. l Les variants testiculaires des histones ... 17
l.4.2 Les protamines ... 20
l.4.3 Les protéines de transition TP3 et TP4 ... 20
1.5 OBJECTIFS DE LA RECHERCHE ... 21
2. RÉSULTATS ...
23
2.1 ARTICLE: Architectural DNA-binding properties of the spermatidal transition
proteins
l and 2 3ummary ... 24Introduction ... 25
Experimental procedures ... 26
Results ...
31Discussion ... 44
Ref erence ... 49
3. DISCUSSION ...
51
3.1 PRODUCTION DE PROTÉINES RECOMBINANTES ... 51
3.2 MESURE DES ACTIVITÉS TOPOLOGIQUES DE TP l ET TP2 ... 52
3.3 PHOSPHORYLA TION DE TP l ET TP2 ... 55
3.4 RÔLE PHYSIOLOGIQUE DES PROTÉINES DE TRANSITION ... 57
3.5 CONCLUSIONS ET PERSPECTIVES ... 59
4. REMERCIEMENTS ...
615. RÉFÉRENCES ...
62
LISTE DES FIGURES
1. INTRODUCTION
Figure 1. Différentiation des cellules germinales au cours de la spermiogenèse ... 3
Figure 2. Structure de la chromatine dans les cellules germinales et somatiques ... 5
Figure 3. Organisation nucléaire de la chromatine chez le spermatozoïde ... 9
Figure 4. Variation de l'activité transcriptionnelle durant la spermiogenèse ... 11
Figure 5. Alignement de la séquence protéique de TP 1 chez les mammifères ... 13
Figure 6. Alignement de la séquence protéique de TP2 chez les mammifères ... 16
Figure 7. Apparition séquentielle de TP 1 et TP2 durant la spermiogenèse chez le rat ... 18
2. RÉSULTATS
2.1 ARTICLE: Architectural DNA-binding properties of the spermatidal transition proteins l and 2 Fig. l. Purification of recombinants transition protein l (TP l) and 2 (TP2) and immunoblot. .... 32analysis Fig. 2. Mobility shift assays ... 34
Fig. 3. DNA supercoiling assay wilh the bacterially-expressed TP l and TP2 fusion proteins ... 36
Fig. 4. Ligase-rnediated circularisation assay wilh recombinant TP 1 and TP2 ... 37
Fig. 5. TPl-induced DNA stiffness ... 39
Fig. 6. ln vitro phosphorylation of recombinant transition proteins b~ the cyclic AMP-dependent protein kinase catalytic subunit (PKA) and the Ca-+ -phospholipid-dependent prote in kinase (PKC) ... 40
Fig. 7. Effect of transition proteins phosphorylation on the ligase-mediated DNA oligomerisation ... 42
Fig. 8. Acrylamide gel-trapping experiment ... 43
3. DISCUSSION
Figure 8. Principe de l'essai de superenroulement. ... 54LISTE DES ABRÉVIATIONS
a.a
Al;ADN
ADNc
ARNmAlP
BSAdb
UIT EDTAH
IPTG
KDane
min
mM
ng
pb
PCRR
SC SOS1P
TRISUV
VµCi
µg
µMacide aminé
anticorps
acide désoxyribonucléique
acide désoxyribonucléique corn plémen taire
acide ribonucléique messager
adénosine 5'triphosphatc
albumine sérique bovine
doubles brins
dithiothréitol
éthylène diamine tétraacétatc de sodium
histone
isopropyl-~-D-thiogalactosideKilo Dalton
plasmide encoché
minute
millimolaire
nanogramme
paire de
baseréaction de polymérisation en chaîne
plasmide relaxé
plasmide superenroulé
sodium dodécyl sulfate
protéine de transition
hydroxyméthyl-aminométhane
ultraviolet
Volts
microCurie
micro gramme
micro molaire
,..., •' • • fj • Il d t" d . . d 1 . '
t.aracœnsationonctionne ees pro emese trans1tjouea spermmgen~
Par M. Dominique Lévesque Département de Biochimie
Université de Sherbrooke
Mémoire présenté à la Faculté de Médecine En vue de l'obtention du grade de Maître ès sciences (M.Sc.) en Biochimie
1 1 septembre 1998
Durant la phase haploïde de la spermatogenèse (spermiogcnèsc), les nucléohistones sont remplacés par des protéines hautement basiques, les protamines. Chez les mammifères, ce processus de transition est engendré par 1' apparition de protéines nucléaires abondantes dites "de transition" (TP). Les protéines de transition assureraient conséquemment une condensation importante du génome haploïde, entraînant un remodelage majeur de la chromatine de type somatique et une inactivation des enzymes impliqués dans le métabolisme de l'ADN. L'intégrité du processus de restructuration de la chromatine est maintenant considéré comme un déterminant essentiel de la fertilité chez l'homme. TPl, une des protéines de transition majeure de la spermiogenèse, est une protéine de 6 KDa riche en résidus basiques et possédant une activité déstabilisatrice de l' ADN. La protéine de transition majeure TP2, quant à elle, est une protéine basique de 13 K.Da comprenant deux structures en "doigts à zinc" situées dans sa partie N-terminale. Au contraire de TP l, TP2 est caractérisée par son potentiel stabilisateur de 1' ADN. Notre objectif initial était de déterminer les propriétés structurales de liaison à l' ADN des protéines TPI et TP2. En utilisant un système d'expression bactérien, nous avons exprimé et purifié TPl et TP2 sous forme de protéines recombinantes. Nous avons démontré que TPl se liait de façon préférentielle à l' ADN superenroulé. Des essais de superenroulement réalisés avec les protéines recombinantes ont permis de conclure que la liaison de TPl et TP2 ne produisait pas de changements topologiques sur l' ADN. Des essais de recircularisation sur un fragment d' ADN ont démontré par la suite que ces protéines n'induisent pas de courbure sur une molécule d' ADN mais stimulait plutôt l'oligomérisation de ces fragments d' ADN. Nous avons aussi démontré que TPI et TP2 sont phosphorylées in vitro autant par la protéine kinase
dépendante du Ca+2 et des phospholipides (PKC) que par la protéine kinase dépendante
del' AMPc (PKA). La capacité d'agrégation et d'oligomérisation del' ADN de TPI n'est pas régulée par sa phosphorylation alors que la phosphorylation de TP2 par la PKC abolit complètement ces propriétés. Ces résultats suggèrent fortement que les protéines de transition majeures TP l et TP2 ne modifient pas l' ADN au niveau topologique mais serait plutôt des facteurs architecturaux capable de stabiliser l' ADN dans un état non superenroulé précédant la condensation de l' ADN.
l.l LA SPERMATOGENÈSE CHEZ LES MAMMIFÈRES
L'habileté de produire des gamètes (gamétogenèse) fonctionnels est essentielle à la
survie des espèces. Chez les individus mâles, la production du gamète se nomme la
spermatogenèse. Au niveau clinique, le "facteur mâle" est responsable de plus de 50% des problèmes d'infertilité chez les couples. Le processus de condensation de la chromatine, se produisant durant la phase haploïde de la spermatogenèse (spcrmiogenèse), est un déterminant majeur de la forme de la tête du spermatozoïde. Une forme altérée de la tête du spermatozoïde, se produisant lors d'une condensation anormale ou partielle de la chromatine, diminue significativement le potentiel fertilisant du spermatozoïde (Jager,
1990).
La
condensation régulière de la chromatine du spermatozoïde durant laspermiogenèse, suivie d'une décondensation après pénétration dans l'oocyte, est un prérequis pour réussir une fécondation in vitro. Conséquemment, l'intégrité du processus de condensation de la chromatine durant la spermiogenèse est maintenant considérée comme étant un facteur clé déterminant la qualité du sperme chez l'humain. Ce paramètre vient s'ajouter au spermogramme de routine qui établie le nombre, la mobilité des spermatozoïdes et la présence de contaminants microbiens (Dadoune, 1994). Les recherches en cours sur ce sujet visent principalement à déterminer les phénomènes moléculaires régissant le processus de condensation de la chromatine durant la spermiogenèse dans le but de comprendre, et peut-être même, de contraindre les problèmes d'infertilité retrouvés chez l'homme qui sont associés à ce processus.
Chez les mammifères, les cellules germinales sont fortement dépendantes des interactions physiques et chimiques avec les cellules somatiques des tubules séminifères (Hecht, 1995). Par exemple, une relation étroite est établie entre les cellules germinales et
les cellules de Sertoli, favorisant ainsi un transport intercellulaire des nutriments et des
échanges bidirectionnels de molécules régulatrices. Au début de la spermatogenèse, les
spermatogonies prolifèrent produisant trois populations cellulaires destinées
àun rôle tout
àfait différent pour chacune. Une sous-population de spermatogonies demeure présumément
identique
àleur progénitcur et confüme de fonctionner comme cellules souches.
La majorité
des spermatogonies entrent dans une voie de différentiation et deviennent des
spermatozoïdes, un nombre limité de spermatogonies entrent en apoptose (Dym, 1994 ).
Même si l'identification de la "vraie" cellule souche n'a pas encore été déterminée, nous
savons que les mammifères mâles ont un nombre spécifique de cellules souches potentielles
(estimé à environ 10000 chez la souris) qui permettent de maintenir la fertilité tout au long
de la vie d'un individu. Une meilleure connaissance des facteurs régulateurs induisant les
spermatogonies à entrer en méiose améliorerait nos chances de pouvoir moduler
laspermatogenèse.
La méiose débute avec un cycle terminal de réplication de !'ADN
produisant un spermatocyte primaire tétraploïde, lequel subit deux divisions sans réplication
de !'ADN (Eddy et O'Brien, 1997). Durant la prophase méiotique, les chromosomes
homologues s'apparient et s'échangent du matériel génétique. L'appariement des
chromosomes est précédé par la condensation chromosomique aux stades Ieptotène et
zygotène des spermatocytes primaires concomitant avec la migration des spermatocytes de
la membrane basale des tubules séminilères vers la lumière de ces derniers (Figure l ). Ce
processus
àpour conséquence de placer ce dernier stade des cellules germinales
àl'intérieur
d'une barrière hémato-testiculaire créée par les cellules somatiques de Sertoli, isolant de
cette façon ces cellules germinales contre les effets directs des facteurs sanguins. Même si
laréduction de la ploïdie est la raison pour laquelle la méiose a été conservée dans l'évolution,
plusieurs considèrent que les échanges de matériel génétique et la réparation durant
l'intervalle de la prophase méiotique sont des facettes tout aussi importantes de la méiose.
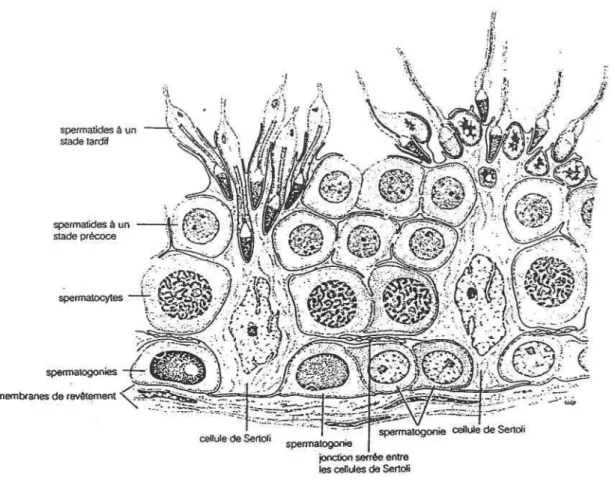
spermatides è un stade précoce ·J .J ~\ :.1 ... ~~ ,/ \ r / $. } P . .., .. . ·\ i 1 1
Figure 1: Différentiation des cellules germinales au cours de la
spermatogenèse.
Certaines spermatogonies quittent la membrane du tubule séminifère et se différentient en spermatocytes primaires. Ces derniers subissent une division méiotique pour former deux spermatocytes secondaires, dont chacun se diviseà
son tour en deux spermatides, ces dernières étant finalement transformées en spermatozoïdes (V ander et1.2 LA SPERMIOOENÈSE
1.2 1 Condensation de la chromatine chez les cellules i:eanina]es et somatiques
Après les deux divisions méiotiques successives, les spennatides circulaires et
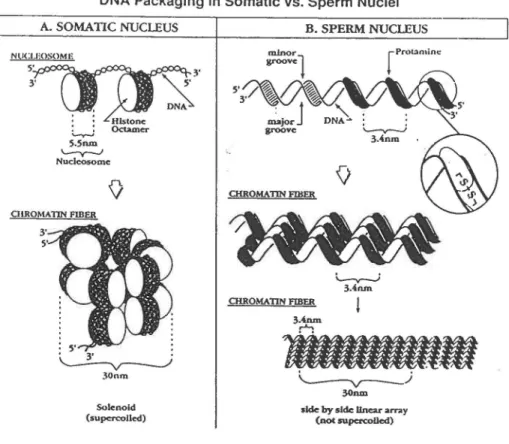
haploïdes se différencient pour produire des spermatozoïdes dont la fonne et la structure seront spécifiques à l'espèce animale. Durant cet intervalle haploïde, nommé spermiogenèse, une refonte majeure de la morphologie cellulaire se produit. Chez les mammifères, le noyau est transfonné, passant d'une structure nucléosomale à un noyau fermement compacté chez le spennatozoïde résultant du remplacement séquentiel des histones de type somatique par des protéines hautement basiques nommées "protéines de transition". À la fin de la spermiogenèse, les protéines de transition sont remplacées par les protéines nucléaires prédominantes dans le spermatozoïde, les protamines. Si l'on compare le phénomène de compaction nucléaire entre une cellule somatique et un spennatozoïde, il est apparent que le volume nucléaire du spermatozoïde est presque totalement rempli par son ADN, alors que le volume nucléaire d'une cellule somatique n'est occupé que partiellement par le contenu génétique. L'ADN des cellules somatiques est initialement compacté en nucléosomes, sur lesquels l'ADN est enroulé deux fois autour de l'octamère d'histones. à
toutes les 200 pb (McGhee et Felsenfeld, 1980).
Les
nucléosomes sont ensuite compactés en solénoïde (figure 2A). Ces deux types de compaction augmentent le volume de la chromatine, premièrement par le volume des histones ajoutés et deuxièment par le volume occupé par le centre du solénoïde. Cependant, le noyau du spennatozoïde ne possède pas le volume requis pour ce type de compaction de l'ADN. Pogany et ses collaborateurs (1981) ont mesuré la quantité d'ADN contenu dans le noyau des spermatozoïdes de souris etcomparé le volume de l'ADN avec le volume total du noyau des spermatozoïdes. Ils se sont rendu compte que les deux étaient similaires. Ils ont de plus calculé que l'ADN des spennatozoïdes ne pouvaient être compacté en nucléosomes car
DNA Packaging in Somatic vs. Sperm Nuclei A. SOMATIC NUCLEUS ;__.,...; s.snm "-v--' Nuclcosomc : S' , . 3' . ~ 30nm Solc:noid (supcrcollc:d) B. SPERM NUCLEUS OIROMATIN FIBER
...
'---v---J
30nm skie by sldc llncar array(not supcrcollc:d)
Figure 2: Structure de la chromatine dans les cellules germinales et
somatiques.
A, Diagramme illustrant comment les histones se lient à l'ADN en l'enroulant en nucléosomes, produisant par la suite une structure en solénoïde. B, Diagramme illustrant comment les protamines se lient à l'ADN pour ensuite compacter l'ADN en couches lamellaires. Au bas de la figure, les fibres de chromatine sont comparées à la même échelle (30 nm), illustrant comment l'ADN du spermatozoïde peut être condensé dans un volume plus petit par les protamines (Ward et Coffey, 1991).volume requis devrait être deux fois le volume nucléaire du spennatozoïde. Donc, un type
de compaction complètement différent devait être présent dans le noyau des spermatozoïdes
des mammifères.
l 2 2 Modèle proposé de condensation de la chromatine du spennatozoïde
Comment alors expliquer l'arrangement des prolamines dans le noyau des spermatozoïdes? Balham ( 1982) a présenté un modèle de liaison ADN-protamine tenant compte de ce manque de volume nucléaire apparent chez les spennatozoïdes. 11 proposa que les protamines se liaient à l'ADN dans le sillon mineur (figure 28), même si des études récentes démontrent la liaison des protamines dans le sillon majeur de l' ADN (Prieto et
coll., 1997). Il calcula qu'il y avait suffisamment de groupements arginine chargés
positivement dans les protamines présentes dans les noyaux des spermatozoïdes de souris pour complètement neutraliser les charges négatives des groupements phosphates présents sur l'ADN. Finalement. il proposa que le complexe ADN-protamine d'un brin pouvait s'intercaler dans le sillon majeur du brin d'ADN voisin, créant de cette façon une compaction de l'ADN en couches lamellaires. Dans les noyaux des spermatozoïdes des mammifères, la chromatine est stabilisée par les ponts disulfures covalents intennoléculaires et intramoléculaires des protamines (Bedford et Calvin, 1974).
De
cette manière, l'ADN total peut être compacté dans un petit volume. La possibilité que les brins d'ADN dans lachromatine des spennatozoïdes soient compactés de cette façon est supportée par
l'observation que !'ADN des spennatozoïdes n'est pas superenroulé négativement (Risley et
coll., 1986). Chez les eucaryotes, !'ADN est enroulé autour d'octamères d'histones formant ainsi les nucléosomes (Cook et coll., 1976). Ce processus de compaction de !'ADN induit du superenroulement négatif dans la double hélice. Par convention, le
superenroulement négatif permet de détendre la double hélice d'ADN si l'appariement
Balham, les protamines n'induisent pas de superenroulement car l'hélicité de l'ADN n'est pas modifiée. Risley et ses collaborateurs (1986) ont démontré de manière élégante que le
noyau des spennatozoïdes des amphihiens riche en histones contenait de l'ADN superenroulé, alors que l'ADN d'amphibiens contenant des protamines n'était pas superenroulé. L'absence de superenroulement dans l'ADN des spennatozoïde.s découle donc de l'incapacité des protamines à produire du superenroulemenL Une petite proportion de l'ADN des spermatozoïdes humains demeurent cependant compactée par les histones. La chromatine de ces spennatozoïdes contient environ 15% d'histones (Tanphaichitr et coll., 1978) et des séquences d'ADN isolées étaient spécifiquement associées avec ces histones (Gatewood et coll., 1987; Gardinier-Garden et coll., 1998). Ces résultats impliquent que les histones sont remplacés par les protamines de façon spécifique durant la spermiogcnèse. suggérant par le fait-même que ces deux types de chromatine dans le noyau des spermatozoïdes sont fonctionnellement distincts (Alami-Ouahabi et coll., 1996).
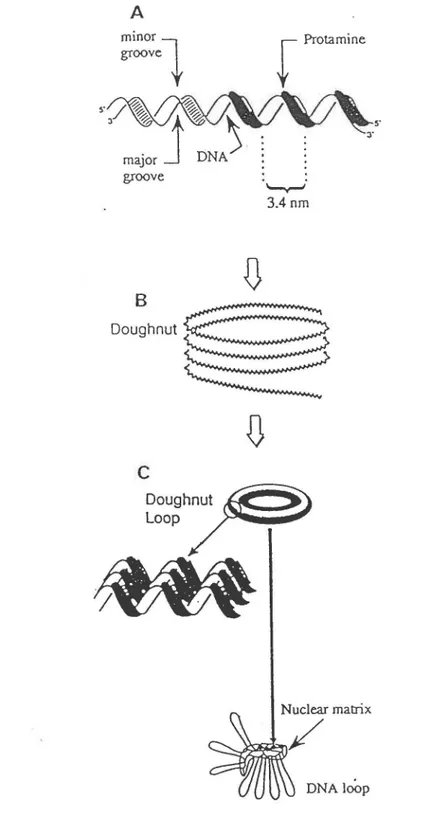
l .2 1 Ori:anisatjon nucléaire de la chromatine chez le spermatozoïde
Comment !'ADN des spermatozoïdes compacté de façon lamellaire est organisé dans le noyau? Plusieurs groupes ont démontré que les fibres de chromatines, disposées en couches parallèles, sont organisées en domaines en fonne de boucle attachés à une structure apparentée à la matrice nucléaire des cellules somatiques (Tzanev et Avramova, 1981). Chez le hamster, cette structure permet d'organiser l'ADN en domaines bouclés (Ward et coll., 1986). Chez les spermatozoïdes humains, des expériences d'hybridation in situ utilisant une
sonde spécifique au chromosome Y et des études irnmunocytochimiques sur les centromères supportent l'hypothèse que les domaines en fonne de boucle sont compactés en petits domaines dans les noyaux des spermatozoïdes. De plus, la microscopie de force atomique
réalisée
sur la chromatine des spermatozoïdes du boeuf, du rat et de la souris a révélée que la chromatine est organisée en sous-unités nodulaires de 50à
100 nm (revue parDadoune, 1995). Ces résultats ont pennis à Ward (1993) de proposer un modèle de compaction des domaines en boucle dans le noyau des spermatozoïdes. Dans ce modèle, le complexe ADN-protan1û1e est condensé, avec une légère courbure, en cercles concentriques. Ces cercles, ne contenant qu'une boucle, s'affaissent ensuite pour former une structure toroïdale, appelée boucle d'ADN en forme de beignet, dans laquelle les complexes neutres ADN-protamine sont fortement compactés par des interactions Van der Waal. Chaque beignet représente un domaine d'ADN organisé en boucle attachée
à
la matrice nucléaire du spermatozoïde (figure 3).l 2.4 Activité transcriptionnel!e durant la sperrnioeenèse
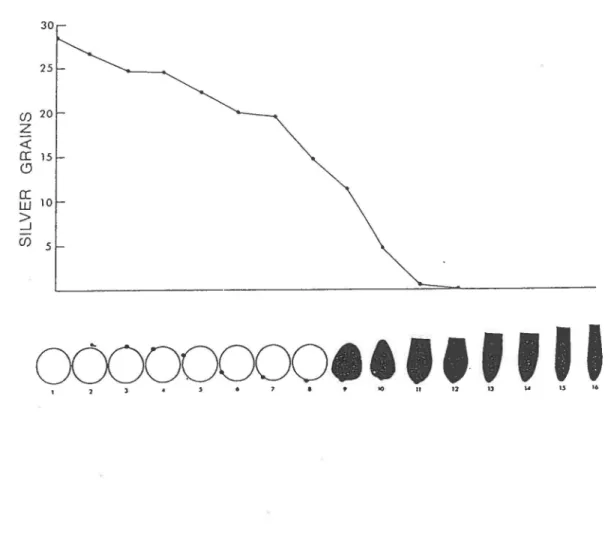
L'activité transcriptionnelle chez les eucaryotes est déterminée par les différents niveaux d'organisation de la chromatine. L'ADN des spermatozoïdes ne fait pas exception à la règle. En effet, des études au niveau de l'activité transcriptionnelle chez les spermatocytes et les spermatides immatures de la souris ont démontré, par autoradiographie après incorporation d'uridine tritiée, que la synthèse d'ARN cessait avant le processus de condensation nucléaire, alors que la spermatide possède encore sa forme ronde (figure 4; Kierszenbaum et Tres, 1975). Ces résultats suggèrent que la réorganisation initiale de l'ADN nucléaire chez la spermatide en élongation serait responsable de la cessation de la transcription. Deux facteurs contribuant au métabolisme de l'ADN sont alors ab.51.!nts: les nucléosornes et le superenroulement négatif. En effet, l'ADN n'est pas enroulé aléatoirement autour des nucléosomes mais de façon spécifique, si bien que des séquences promotrices reconnues par certains facteurs transcriptionnels sont parfois exposées à la surface des nucléosomes.
Le
superenroulement négatif. quant-à lui, permet une ouverture de l'hélice de l'ADN, résultant encore une fois en une accessibilité accrue sur l'ADN pour ces facteurs (Liu et Wang, 1987).A
r
Prolamine groove. .
."-v-'. 3.4 nmD
BDoughnut~
~
c
Doughnut LoopD
1 . . ./
. DNA loop9
Figure 3: Organisation nucléaire de la chromatine chez le spermatozoïde.
A, modèle montrant les interactions des molécules de protamine avec l'ADN. B, Le complexe ADN-protamine forme des cercles concentriques se liant ensemble pour former une structure en beignet C, Les beignets représentent des domaines bouclés attachés à la1 .2 5 Réeulation traductionnelle durant la spennioeenèse
Si la transcription est absente
àla deuxième moitié de la spenniogenèse, une
quantité importance de !'0uvelles protéines
d~it ~treexpriJnP.e durant la maturation des
spennatides. Le contrôle traductionnel joue donc un rôle essentiel dans la régulation de
l'expression génétique durant la gamétogcnèse, étant-donné l'apparition séquentielle de ces
protéines. Chez la femelle, durant le développement de l'oocyte, une grande quantité
d'ARNm est synthétisée et entreposée pour une longue période avant leur utilisation après
lafertilisation (Hecht, 1995). Chez les cellules genninales mâles. les ARNm sont aussi
entreposés durant la spermiogenèse. L'entreposage des ARNm paternels est bien
documenté pour les protéines de transition TP l et TP2 ainsi que pour les protamines
l et 2 (Kleene, 1989). L'entreposage et la traduction subséquente des ARNm testiculaires
peuvent être contrôlés
àplusieurs niveaux. Un modèle intéressant impliquerait la formation
dans les spennatides de compartiments différents pour les ARNm entreposés ou traduits.
Ce modèle a été vérifié chez le rat par la localisation des ARNm encodant pour la protéine de
transition TP2 dans les corps chromatoïdes (Saunders et coll., 1992). Cependant, une
analyse par hybridation in situ des ARNm encodant la protéine de transition TP l et les
protamines chez le même modèle animal ne suggère pas une localisation spécifique de ces
messagers pendant l'entreposagcCbu la traduction (Morales et coll., 1991 ). Un deuxième
niveau de régulation mettrait en jeu la présence de certaines protéines pouvant se lier aux
extrémités 3' des ARN m. Plusieurs études suggèrent que les interactions entre les ARNm et
les protéines liant ces ARNs peuvent moduler l'entreposage et la répression traductionnelle
(Richter, 1993; Spirin, 1994).
30 25 (f) 20
z
<{ a: 15 CJffi
10 ~ (f) 5O(X)OOCXJOe•ttf
1 1 l • J • 7 • ' 'O lt tJ 1]f
1A11
15 16Figure 4: Variation de l'activité transcriptionnelle durant la spermiogenèse.
Diagramme illustrant l'incorporation nucléaire d'uridine tritiée à différentes étapes de la
spermiogenèse chez la souris. L'ordonné indique le nombre de grains d'argent par noyau. L'abscisse représente le changement dans la structure et la condensation nucléaire durant les 16 étapes de la spermiogenèse (Kierszenbaum et Tres, 1975).
1.3
LES PROTÉINES DE TRANSITION MAJEURES DE LA SPERMIOGENÈSE
Les protéines de transition TPl et TP2 sont retrouvées chez tous les mammifères étudiés et représentent 55% et 40% respectivement des protéines nucléaires (W outers-Tyrou et coll., 1998). Étant-donné leur importance quantitative et leur niveau de conservation, ces protéines doivent avoir un rôle significatif durant le processus de restructuration de la chromatine observé
à
la spenniogenèse.l . 3. l
La
protéine de transitionIP
1La protéine de transition TP l a été isolée pour la première fois chez le rat par Kistler et ses collaborateurs (1973). Par la suite, ils ont détenniné la séquence de la protéine par dégradation d'Edman (Kistler et coll., 1975) et indirectement
à
partir d'un ADNc (Heidaran et Kistler, 1987). En 1988, Kleene et ses collaborateurs ont identifié et séquencé l'ADNc de TPl chez la souris. La séquence de TPl est très conservée chez les espèces (figure 5). TPl est une protéine de 54 a.a avec un poids moléculaire de 6 KDa.La
protéine est riche en lysine et arginine (50%) réparties de façon unifonne dans la protéine (Kleene et coll., 1988 ). Des études de dichroïsme circulaire ont démontré que TP 1 pouvait dénaturer localement !'ADN, par intercalation du groupement phénolé du résidu tyrosine situéà
la position 32 entre les bases de I'ADN db (Singh et Rao, 1987). Ce résidu tyrosine est situé tout près de deux sérines pouvantêtre
phosphorylées partiellement chez le sanglier (Akarna et coll., l 994a).La
phosphorylation de résidus sérines est reconnue pour moduler les interactions des histones et des protamines avec I'ADN (Pruslin et coll., 1987). Conséquemment, ces résidus sérines et tyrosine pourraient être impliqués dans l'interaction de TPl avec l'ADN. Chirat et ses collaborateurs ont postulé que la phosphorylation des résidus sérines de la protéine pennettrait de positionner TPl correctement sur I'ADN, etRai Mou se Boar Bull Ram Hum an Rat Mou se Boar Bull Ram Hum an 1 10 20 S T
s
R K L K T H G M R R G K N A A p H K G V K A G G Ss
Ts
A K L KT H G M A A G K N A A p H KG V K A G G Ss
Ts
R K L K S H G MA A G K N A A p H K G V K R G G Ss
Ts
A K L K SŒJ G M R R G K N R Ts
Ts
R K L KSOG(!]RRGKN A T p H K G V K p H KG V K A G C SR~S
s
Ts
R K L K S H G M R R S K S A S p H KG V KA G G S 40 50 K y A K S S L Ks
R K A GD D A RNYRSH R K y A K@fsll K S R K R K y A K G S L K S R K A K Y A K S S L K S R K A K y A K S S L K S R K R GD DA RNYRSH Rc
0 DA N RN Y R S H Rc
0 D A N R Nrn R S H Rc
0 D A N A N F A S H L K Y A K G N L K S A K A G D DA N RNYRSHL 30 K A K A K A K A K R K RFigure S: Alignement de la séquence protéique de
TPlchez les mammifères.
Les boîtes correspondent à l'idenùté de séquence de la protéine TPI entre les espèces énumérées (Wouters-Tyrou et coll., 1998)
que la déphosphorylation de TP l engendrerait un changement confonnationnel de la
protéine, ayant pour conséquence l'intercalation du résidu tyrosine (Chirat et coll., 199 l ).
De plus, il est démontré que TPl déstabilise le centre des nucléosomes
in vitro
(Singh et Rao, 1988). Par ailleurs, des études ont démontré qu'une certaine rétention de TPl au niveau nucléaire des spennatides à l'étape 14 et des spennatozoïdes de plusieurs espèces résultait en une décondensation spontanée du noyau (Courtens et coll., 1995), ce qui supporte l'hypothèse de l'activité déstabilisatrice de cette protéine. Cependant, des études réalisées chez le rat ont démontré par immunocytochimie que TP l apparaissait aux étapes 12à 15 de la spermiogenèse, coïncidant avec le début de la condensation de la chromatine (Kistler et coll., 1996). Il est donc difficile de spéculer sur la fonction de TP 1. Le dépot de TPl sur la chromatine peut expliquer la résistance à la sonication dans les noyaux de l'étape 13 de la spermiogenèse (Grimes et coll., 1977). Le rôle précis de la protéine de transition TPl durant le processus de restructuration de la chromatine de la spcnniogcnèsc reste alors à déterminer.
1 1 2 Dimérisation de la protéine de transition TP 1
Dernièrement, en étudiant le comportement électrophorétiquc de TP l du sanglier sur gel de polyacrylamide, en condition dissociative ou non, Akama et ses collaborateurs ont démontré que TP l pouvait se présenter sous forme dimérique et que cette dimérisation était indépendante du résidu cystéine pouvant produire des ponts disulfures. La forme dimérique produit par ponts disulfures présentait une activité de dénaturation de l'ADN similaire à TPl mais n'était pas retrouvée au niveau des noyaux des spermatides immatures. Ce nouveau résultat suggère que TP 1 agirait sous forme dimérique pour induire une déstabilisation locale de l'ADN (Akama et coll., 1998).
l .3 3
La
protéine de transition TP2La
protéine de transition TP2 fut isolée pour la première fois par Grimes et ses collaborateurs ( 1977). Depuis, les ADNc de TP2 chez l'humain (Nelson et Krawetz, 1993 ), le rat (Luerssen et coll., 1988) et la souris (Kleene et Flynn, 1987) ont été clonés et caractérisés. La séquence en a.a. de TP2 est très bien conservée chez les espèces étudiées (figure 6). Ayant un poids moléculaire apparent de 13 KDa, TP2 est riche en résidus sérine, praline, arginine et lysine. Au contraire de TP l, les résidus basiques de la protéine de transition TP2 sont localisés en position C-terminale de la protéine. Par dichroïsme circulaire, il a été démontré que TP2, contrairement à TP l, était une protéine stabilisatrice de l'ADN (Raskaran et Rao, 1990). De plus, TP2 possèderait une activité de condensation supérieure àTPl.
Par contre, TP2 ne peut déstabiliser le centre des nucléosomesin vitro.
Des
expériences d'immunocytochimie réalisées chez les cellules germinales du rat ont démontré que l'apparition deTP2
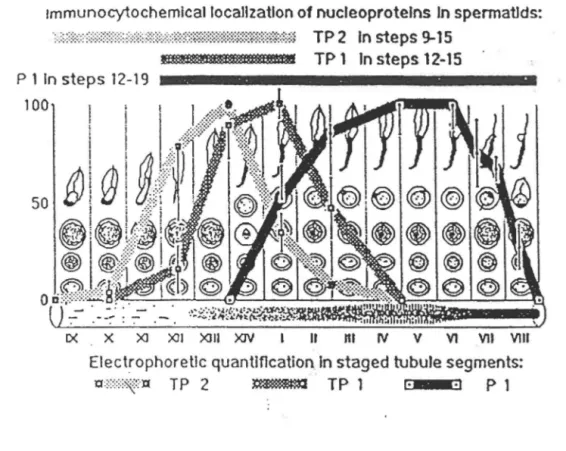
(étape 9-15 de la spermiogenèse) précédait celle de TP 1 (Kistler et coll., 1996; figure 7). Mais les histones sont encore présents à l'étape 12 de laspermiogenèse. Cependant, aucune étude n'a démontré que ces histones présents à celte étape étaient organisés en nucléosomes. Si tel est le cas, un modèle intéressant suggère que TP2 pourrait remplacer H 1 lié sur l'ADN charnière et. par la suite, l'apparition de TP 1 engendrerait le déplacement du centre des nucléosomes.
1 1 4 Motifs en doi~t à zjnc de TP2
TP2 est une métalloprotéine dépendante du zinc contenant 2 atomes de zinc par molécule (Baskaran et Rao, 1990). Les résidus cystéine et histidine situés en N-terminal de la protéine sont impliqués dans la coordination avec le zinc (Kundu et Rao, 1994).
Des
études ont démontré que TP2, en présence de zinc, condense un polynucléotide synthétique riche en GC beaucoup plus efficacement que tout autre type de polynucléotide (Kundu et
Human TP2 Rat TP2 Meuse TP2 HumanTP2 Rat TP2 MeuseTP2 HumanTP2 Rat TP2 MouseTP2 HumanTP2 Rat TP2 Meuse TP2 HumanTP2 Rat TP2 MeuseTP2 1 10 20 . M 0 T a T l:)s L p 1 T mT a L DPN s
a
p a s A T r!IT A 1:1MDTKMOSLPTT P~P SSRPOS~T NNO
MDTKMOSLPTT PIDP SSSRPOSIDT SNO
M ~ ~
m
OTFSOS9RilS RGSRSOSSSOSPAS~RN A S A S [!J S O.A G P SNO[!IT S AS~ SOAG AG
~
ro
~ PTGAIDsssGmasOSPNTSPPPKRmKKTMN sss SPSPGPPTKmP~TPMm sss SPSPGPPMKIDPKPsvru 90 100 110 S CEIS P M R P T 1 L C'.l!IAmp
K N R K N L E G K L K K K SRYSPSRPsm RGS PKNRKTLEGKVSKR SRl:)SPARPS~ RGS PKNRKTFEGKVSKR 120 130 KM A KR 1 a a V y KT KT R s s G WK s N KAVRRAKRTmRAKRRSSGRAYK KAVRARKRT~RAKRRSSGRRYKFigure 6: Alignement de la séquence protéique de TP2 chez les mammifères.
les acides aminés en noir et conservés chez toutes les espèces étudiées indiquent les résidus potentiellement impliqués dans les structures en doigt à zinc (Meetei et Rao, 1996).
Rao, 1995).
Des
séquences riches en GC, nommées ilôts CpG, sont des séquences nucléotidiques associés aux domaines 5' et 3' de tous les gènes constitutifs connus et aussi plusieurs gènes spécifiques à certains tissus (Antequera et Bird, 1993). Dans le but de déterminer si cette séquence représente la cible de TP2 in vivo, Kundu et Rao ont utilisé laséquence CpG du gène de
1'
ALA déshydratase humaine (Kundu et Rao, 1996) et démontréque TP2 se liait de façon préférentielle à cette séquence. Si TP2 possède une activité de
condensation de l'ADN, il est tentant de spéculer que ces séquences génomiques pourraient
servir de sites d'initiation de la condensation durant la spenniogenèse. Une sous-classe des ilôts CpG sont les séquences promotrices riches en GC présentes chez la plupart des gènes
constitutifs. Kundu et Rao ( 1995) ont émis comme hypothèse que l'initiation de la
condensation de la chromatine pourrait être enclenchée par la liaison de TP2 à ces séquences
promotrices. Cette liaison spécifique de TP2 à l'ADN provoquerait également une diminution de l'activité transcriptionnelle chez les spermatides. La phosphorylation de TP2 semble être aussi un mécanisme de régulation de cette protéine. Une expérience utilisant la
culture de fragments de tubules séminifères de rat a démontré, par marquage des protéines nouvellement synthétisées à l'isotope 32P, que TP2 était rapidement phosphorylée durant la
spenniogenèse (Green et coll., 1994). Cependant, l'activité de la protéine kinase impliquée dans cette phosphorylation n'a pu être caractérisée.
1.4 AUTRES PROTÉINES NUCLÉAIRES IMPLIQUÉES DURANT LA SPERMIOGENÈSE
1.4.1 Les yariants testiculaires des histones
Plusieurs variants des histones spécifiques aux cellules genninales remplacent. du moins en partie, les cinq histones de type somatique, c'est-à-dire les quatres histones
tmmunocytochemlcal locallzatlon of nucleoprotelns ln spermatlds:
·:..::.::::::::=:::::::::::=:=:::::.::::::::::::::::::o:::::~:;::::::~::::::::::::::~:::::~:::::~::::::::~:~::::;:::i TP 2 ln steps 9-15
met1Mm1m!!l!P m TP 1 ln steps 12-15
IX X Xl XII XIII XIV 1 Il nt rv V V1 Vll VIII
Electrophoretlc quantification ln staged tubule segments:
'Q:;:;:;:;::$i{xt TP 2 ~ TP 1 !· ·I P 1
Figure 7: Apparition séquentielle de TPl et TP2 durant la spermiogenèse
chez le rat. La
présence deTP2
est limitée aux étapes9-15,
alors que la présence deTPl
se limite aux étapes
12-15.
TP2 est donc la première à être exprimée au niveau nucléaire chez le spermatozoïde (Kistler et coll.,1996).
charnière (Grimes, 1986). Deux variants de Hl (Hla et Hlt). un variant de H2A (tH2A), un variant de H2B (tH2B) et un variant H3 (tH3) ont été identifiés chez le rat. La plupart de ces variants apparaissent durant la prophase méiotique. De plus, la démonstration de la
synthèse des histones dans les spermamcytes a révélé que la synthèse de ces variants des
cellules méiotiques était dissociée de la synthèse d'ADN, phénomène normalement
rencontré chez les cellules somatiques. La perte de la structure nucléosomale pendant la
phase précoce de la spermiogenèse serait engendrée par le remplacement des histones par les protéines de transition. Une protéine nucléaire auto-antigène du spermatozoïde (NASP) liant les histones fut découverte dans les testicules et les spermatozoïdes de plusieurs espèce animales, incluant l'homme. Chez le rat, cette protéine apparaît dans le noyau des spermatides précoces et est concentrée dans le nucléoplasme durant le dernier stade de la
spermatide, suggérant sa liaison avec les variants d'histoncs qui seraient remplacés par la
suite par les protéines de transition (Lee et O'Rand, 1993). D'autres protéines, spécifiques à l'espèce. peuvent participer à la réorganisation nucléaire durant la spcrmiogenèse. Par exemple, il a été démontré dernièrement que la protéine HMG l pouvait compétitionner l'histone H 1 (Zlatanova et van Holde, 1998). Dans le contexte de la spermatogenèse, on
pourrait donc attribuer un rôle similaire pour tsHMG.
La
structure du nucléosome peut êtrealtérée par des modifications post-traductionnelles des histones telles que l'acétylation ou la
phosphorylation. L'acétylation de lysines spécifiques aux domaines N-terminaux des histones, principalement H3 et H4, réduit leur charge positive, ce qui pourrait modifier l'interaction des histones avec l'ADN. Une hyperacétylation des histones H4 favorise la
condensation de l'ADN préparant le remplacement des histones par les protéines de transition. Des expériences chez le rat ont démontré qu'une hyperacétylation de H4 est associée avec le déplacement des histones dans les spermatides (Meistrich et coll., 1992). Par ailleurs, il est démontré que l'ubiquitination des histones est impliquée dans la
sont donc pas les seuls facteurs impliqués dans la déstabilisation des nucléosomes observée pendant la spermiogenèse.
1.4 2 Les protamines
Chez la plupart des mammifères, le noyau des spermatozoïdes contient seulement un seul type de protamine appelé Pl, un polypeptide riche en arginine et cystéine d'environ 50 a.a. dont la séquence est très conservée chez les espèces (Wouters-Tyrou et coll., 1998). Chez quelques espèces, incluant l'humain et la souris, une deuxième classe de protamine appelée P2 est aussi présente dans le noyau des spermatozoïdes. La prolamine P2 diffère de P 1 par son contenu en histidine et son poids moléculaire légèrement supérieur à Pl.
La
présence de formes phosphorylées de protamines chez les mammifères a été observée chez le rat et l'homme (W outers-Tyrou et coll., 1998).
Le
résidus sérine à la position IO serait la principale cible de phosphorylation de Pl. Cette phosphorylation serait impliquée dans larégulation de la liaison de Pl à l'ADN (Courtens et coll., 1995). l 4 1 Les protéines de transition TP3 et TP4
La protéine de transition TP3 a été isolée et caractérisée chez le bélier (Du pressoir et coll., 1985), le sanglier (Akama et coll., 1994b) et le rat (Unni et coll.. 1994). La séquence en a.a de TP3 est caractérisée par la présence de deux résidus tryptophane possiblement impliqués dans la déstabilisation locale de l'ADN (Akama et coll.. 1996). Chez le rat, TP3 est le produit de synthèse primaire du gène encodant la protamine P2. La protéine de transition TP4 a été caractérisée chez le rat et le sanglier. Chez le rat, TP4 est une composante mineure (2%) des protéines nucléaires solubles dans l'acide des spermatides immatures. Tout comme TP3, TP4 contient un résidu tryptophane pouvant probablement
induire une déstabilisation locale de l'ADN par l'intercalation de ce résidu entre les bases de l'ADN (Akama et coll.. 1995).
1.5 OBJECTIFS DE LA RECHERCHE
La littérature concernant l'étude des protéines de transition TP l et TP2 est très limitée. Les auteurs s'attardent à déterminer l'ordre d'apparition de ces protéines lors de la
spermiogenèse chez différentes espèces et de caractériser préliminairement. par dichroïsme circulaire, la liaison des TPs sur l'ADN. Bien que les hypothèses proposées par les auteurs
à propos du rôle potentiel de ces protéines dans le processus de réorganisation et de condensation nucléaires durant la spermiogenèse demeurent valables, aucun résultat ne démontre les conséquences possibles de la liaison de ces protéines sur la topologie de
l'ADN. Des contraintes topologiques imposées par les TPs pourraient rendre l'ADN
incapable de s'assembler en nucléosomes et de supporter les différentes transactions de l'ADN. Pour faire la lumière sur cette question, nous réaliserons des expériences
in vitro
permettant de détecter les contraintes. que ce soit de torsions ou de courbures, engendrées
par ces protéines sur l'ADN. Pour répondre à ces questions, nous nous sommes donnés les
objectifs suivants à réaliser:
1- Produire des protéines recombinantes TPl et TP2.
2-Vérifier l'activité topologiques des protéines de transition TP l et TP2.
3-Déterminer l'influence de la phosphorylation de TPl et TP2 sur leur activité de liaison à
1.6 IMPACTS DE LA RECHERCHE
Il est anticipé que cette étude concernant les protéines de transition TP 1 et TP2 nous donnera de nouvelles évidences concernant le rôle que joue ces protéines durant la
restructuration de la chromatine chez les gamètes mâles des mammifères. Par ailleurs, une meilleure caractérisation des facteurs nucléaires impliqués lors des changement-; topologiques au niveau de I'ADN de la spennatide contribuera significativement aux efforts mis pour détenniner l'influence de la dynamique de la chromatine sur l'expression génétique. De plus, l'étude de la spermiogenèsc peut nous donner beaucoup d'information au niveau des événements nucléaires se produisant chez d'autres cellules dans lesquelles les changements génétiques ne sont pas aussi extrêmes. Les problèmes d'infertilité masculine devenant de plus en plus un problème majeur dans la société, une meilleure connaissance des facteurs protéiques permettra de mieux comprendre le rôle que joue ces facteurs dans les
dérèglements des événements moléculaires régissant la réorganisation nucléaire de la
spermiogenèse. Finalement, en comprenant mieux ces éléments protéiques de base, nous pourrons peut-être les utiliser comme outils pour contrôler l'expression génique en affectant les diftërents niveaux d'organisation de la chromatine. Ces outils pourraient donc affecter de façon globale l'activité de la chromatine d'une cellule ciblée.
2 RÉSULTATS
2.1 Article:
Architectural DNA-binding properties of the spermatidal
transition proteins 1 and 2
Dominique Lévesque. Stéphane Veilleux. Nicolas Caron and Guylain Boissonneault Department of Biochemistry, Faculty of Medicine, Sherbrooke University, Sherbrooke,
Québec, CANADA JlH 5N4
August 4lh, 1998
Article soumis initialement à la revue The Journal of Biological Chemistry, puis finalement
accepté et publié sous une forme écourtée le 27 novembre 1998 à la revue Biochemical and
SUMMARY
Mamrnalian spenniogenesis is characterized by replacement of sornaùc histones by a set of basic nuclear transition oroteins thought to
be
actively ir.volvcd in the chromaùn-remodeling process. In order to get more insight into their architectural DNA-binding properties, the major transiùon proteins of the elongating spennaùds, namely TP l and TP2, were expressed and purified using a bacterial expression system. Although TP l displayed preferential binding to supercoiled plasmid DNA, both topoisomerase and ligase-mediated supcrcoiling assays demonstrated that TP l, as well as TP2, did not produce detectable changes in the twist and/or writhe of DNA molecules upon binding. Ligase-mediated circularisation assay funher demonstrated that neither of the transiùon protein under study produced bend in Iinear DNA but that they both have the capacity to stirnulate oligomerisation of linear DNA fragments. We funher cstablished that the transiùon proteins are in vitro subsu·ates for the Ca+2-phospholipid-dependcnt protcin kinase (PKC) as well asthe cAMP-dependent protein kinase (PKA). TP 1 promotcd DNA condensation regardlcss of its phosphorylation state whereas PKC-phosphorylation strongly weakens the DNA-condensing ability of TP2. Taken together, these results suggest that the major transition proteins of the elongaùng spennatids do not alter DNA topology but rather represcnt architectural factors able to stabilize DNA in a non-supercoiled state thereby promoùng DNA condensation.
INIRODUCTION
The haploid phase of germ cell development, termed spermiogenesis, is characterized by striking morphological transformations lcading to the fonnation of highly specialized spennatozoa from the round spennatids ( l ). In elongating and condensing spennatids, major restructuring of the somalie chromatin takes place with the initial replacement of the testis-specific and somalie histones by a group of basic, lysine-rich proteins tenned transition proteins (2). In the rat, the expression of the major transition proteins, namely TPI and TP2, has bcen investigated by immunohistochcmistry and found coïncident with the initiation of condensation of the fibrillar chromatin (3 ). The nuclear accumulation of the transition proteins immediately follows loss of the somalie nucleosomal structure and takes place between steps IO to 16 of spermiogenesis (4). More recent assessmenlS of the nuclear accumulation of both TP l and TP2 in the rat suggested that TP2 is the first nucleoprotein that replaces histones at steps coïncident with the onset of nuclear elongation whereas TPl appears along with chromatin compaction (5). TPl is a small 54 -amino-acid proteins with an even distribution of basic residues. Early hiophysical studies have suggested that TPl can destabilize double-strandcd DNA. This DNA-melting activity is likely due to the presence of two intercalating tyrosine residues flanked by basic amino
acids (6). In a comparative approach, a similar assessment of the DNA binding activity of
TP2 indicated that it has better DNA-stabilizing and condensing properties than TPI (7). TP2 is a L 15 amino-acid protein harboring different structural domains with a high frequency of basic residues at the carboxy-tenninal end whereas the arnino tenninal region harbors potential zinc fingers. Hence the DNA-binding activity of TP2 was shown to be zinc-dependent and the protein was found to display a higher affinity for alternating GC-containing-sequences (8, 9).
According to their stage-specific expression. the transition proteins are thought to be actively involved in the process of nuclear condensation that transfonns the somalie chromaùn into the metabolically quiescent fibrillar chromatin of the mature spennatozoon. The sequential deposition of the transition proteins and the subsequent protamination is thought to cause a general deprogramming of the chromatin in mature spennatozoon although recent evidences indicated that a small proportion of somatic-like histones
are
present in mature spennatozoon and have a conserved pattern of DNA association (l 0).These would then serve as bookmarks for the activation of selected genes during early development.
Both the removal of nucleosomes and the frcc negative supcrcoils during spcnniogenesis arc likely to represent two key factors contributing to the genetic quiescence of the spennatid nucleus. Such a striking modification in DNA topology is likely to impair any DNA transactions that would nonnally takes place in a somatic chromatin context (
11 ).
However, the topological consequences of the transition protcins binding to DNA have not yet been established. The present paper reports the bactcrial expression of both TPl and TP2 and the prcliminary assessment of selected architectural DNA-binding parametcrs. Both proteins were also demonstrated to represent in vitro substrate of the Ca+2
-phospholipid-dependent protein kinase as well as the cyclic AMP-dependent protein kinase. Hence the consequences of their phosphorylation status on these architectural DNA-binding parameters were investigated.
EXPERJMENTALPRQCEDU&ES
Production of recombinant transition proteins.
The full-length cDNA for mouse transition protein l (TPl) was purchased from ATCC (#63184). BamHl linkers were added at both cDNA ends by the polymerase chain reaction (PCR). The 177 bp TPI cDNA fragment wasinserted at the BamHl site in the prokaryotic expression vector pTrcHisB (Invitrogen) adding a polyhistidine tag at the N-tenninal. We found that ~xpression of the TPl protein, as a histidine-tagged fusion protein was necessary in order to obtain a sufficient yield of extractable protein. The TPI recombinw1t protein was therefore expressed as a lO KDa protein that includes a 33 a.a. stretch of vector-encoded N-tenninal segment. Reverse transcriptase PCR from mouse adult testis mRNA was used in order to obtain a full-length cDNA for mouse transition protein (TP2) which included BarnH l linkers in the PCR primers for in-frame cloning purposes. The 363 bp cDNA fragment was then cloned in the prokaryotic expression vector pTrcHisB at the BamH l site. The TP2 protein was therefore expressed as a l 7 KDa fusion protein thal also includes a 33 a.a. vector-encoded N-tenninal segment. Expression from this vector is driven by the inducible trc promoler under the control of a lac operon. Both plasmid conslructs were sequenced in bolh orientations at the cloning sites and then used lo transfonn E.Coli TOPlO (lnvilrogen). Expression of both fusion p:oleins was induced with isopropyl-~-lhiogalacloside (IPTG) at a final
concentration of lmM exacùy as described by the manufacturer. The TP l fusion protein in the bacterial lysate was purified by perchloric acid extraction (12). Briefly, a one-liter culture of IPTG-induced bacterial cells was centrifuged al 6000g for 15 min at 4°C. The pellet was resuspended in lO ml of cold 5% PCA and submitted to thrcc round of frcczc-thawing followed by centrifugation at lOOOOg for 15 min al 4°C. The supematant containing the soluble recombinant TPI was precipitated in 25% trichloroacetic acid for 4 h at 4°C and centrifuged at lOOOOg for 15 min at 4°C. The pellet containing TPl was dissolved overnight in 0.25M HCl and acetone-precipitated with 6.5 volume. The pellet was washed lwice in acetone: HCl (9: 1), air-dried and dissolved in 0.1 % aceûc acid. The histidine-tagged TP2 fusion protein was purified by nickel affinity column chromatography (Novagen) and dialyzed against
O.
l % acetic acid containing l 0 µM zinc sulfate. The purity of extracted proteins was analyzed by Tris-Tricine PAGE and the identity of bath fusionproteins was further ascertained by immunoblot analysis using mouse TP 1 and TP2 antisera kindly provided by Dr. S. Kistler (North Carolina University).
DNA mobility shift assays. Gel retardation of nicked circular (NC) and supercniled (SC)
pBR322 DNA was perfonned e~ntially as described by Sheflin et al. ( 13). Briefly, 200 ng of pBR322 plasmid, representing a mixture of approximately 75% SC and 25% NC molecules, were incubated for 15 min at 37°C with increasing concentrations of either TPI or TP2 recombinant protein in 20µ1 of binding buffer (50 mM Tris-HCI pH 7.5, 50mM NaCI, 1 mM EDT A, l mM OTT, 30 µg/ml BSA). For the TP2 binding assays, zinc sulfate was included in place of EDTA at a final concentration of 10 µM. The samples were then dcctrophoresed in 0.8% GTG agarose gel (FMC) at 20V for 16h in 0.5X TBE or TB buffer for TP l and TP2 respectively and the DNA visualizcd by ethidium bromide staining. The DNA mobility of both topoisomers of the circular DNA molecules was exprcssed as the ratio of the migration distance of the protcin-bound DNA ovcr that of frcc DNA.
Topoisomerase-mediated supercoiling assay. Ten µg of pBR322 plasmid were relaxed
with 5 units of topoisomerase 1 as described by the manufacturer (Gibco-BRL). The reaction was stopped by phenol:chlorofonn extraction followed by ethanol precipitation. Two hundred ng (0.08 pmole) of relaxed plasmid DNA was preincubated for 15 min at 37°C in topoisomerase 1 buffer (50 mM Tris-HCI, pH 7 .5, 50 mM NaCl, l mM EDT A, lmM DTD in the presence of increasing concentrations of the fusion protein as indicated. For the supercoiling assays using TP2, zinc sulfate was included in place of EDT A at a final concentraùon of lO µM. When indicated, the reactions were supplemented with l unit of topoisomerase 1 and allowed to proceed for 30 min al 37°C. The reactions were slopped by the addition of SOS and proteinase K at a final concentration of 1 % and 200 µg/ml respectively and incubated al 50°C for l h. The plasmid lopoisomers were resolved by
agarose gel electrophoresis as describcd previously ( 14) and visualized by ethidium bromide staining.
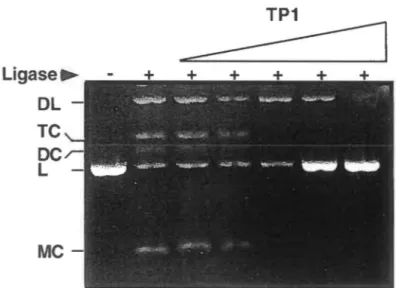
L.igase-mediated circuiùrisation assay (DNA rirtg closure uJ.>ay).
A 105-bp double-stranded fragment with cohesive ends was used as a target probe. The 105-bp fragment harbors a central 42-bp GC-rich sequence that derives from a human CpG island present in 3' downstream of the ALA dehydratase gene. GC-rich sequences werc previously been depicted as a high affinity site for the TP2 protein (8). End-labcling of the fragment was carried out using T4 polynucleotide kinase (Pharmacia). Increasing concentrations of bolh control orin
vitro-phosphorylated fusion proteins were incubated in lhe prcscnce of 2 ng ( 15000 cpm/ng) of end-labeled fragment in lO µl of binding buffcr (50 mM HEPES pH7.5, 50 mM potassium glutamate, lO mM MgOAc, l mM ATP). The binding reactions
were incubated for 30 min at 30°C followed by lhc addition of 0.8 Weiss units of T4 DNA ligase (Phannacia). The ligation rcactions were allowed to proceed for 15 min al 3ff C followed by heat inactivation of the ligase. SOS and protcinasc K werc added at a final
concentration of 0.5% and 200 µg/ml respectively and incubated at
3TC
for 30 min.Concatamcrs or circularized probe were resolved by electrophorcsis in 7% acrylamide gel electrophoresis esscntially as described by Paull et al. 1993 (15).
Protein-induced DNA stiffness.
The plasmid pBluescript was linearized by Xhol digestion. Five hundred ng of lhe linear plasmid DNA was incubated with increasing amounts of TP l for 20 min at 3Q°C . Six Weiss units of T4 DNA ligase were then added and the ligation reactions were allowed to proceed for 20 min followed by the addition of SDS and proteinase K at a final concentration of l % and 200 µg/ml respectively. Intramolecular DNA ligations (circular plasmids) were then monitored by agarose gel electrophoresis in the presencc of 0.5 µg/ml of ethidium bromide ( 16).ln vitro phosphory/ation of the fusion proreins. Ten ug of either TP l or TP2 recombinant
protein was phosphorylated in vitro with commercial preparations of the cyclic
AMP-dependent protein kinase catalytic subunit (PK.A, Sigma) or the ca•2
-phospholipid-dependent protein kinase (PKC, Boehringer). Briefly, PKA-phosphorylations of TPl or TP2 fusion proteins were carried out at 3ü°C in 25 µ1 üf PKA reaction buffer (55
mM
potassium phosphate pH 6.5, 14 mM MgOAc, 4 mM DIT) in the presence of either l 0 µCi
of [y-32P]ATP (3000 Ci/mmol; Amersham) or 55 µM ATP (cold phosphorylation). The
reactions were started by the addition of 2.5 units of the prepan1tion of PKA and allowed to proceed for 15 min. PKC phosphorylation of both fusion proteins was canied out at 30°C
for 15 min in 50 µlof PKC reaction buffer (20
mM
Tris-HCI pH 7.5, lO mM MgCl2, 500µM CaCl,, 0.25% BSA, 100 µg/ml phosphatidyl serine, 20 µg/ml diacylglycerol) in the
presence of either 15 µCi of [y-32P]ATP or 100 µM of ATP (cold phosphorylation). The
reactions were started with the addition of 0.05 mU of PKC.
Acrylamide gel-trapping experiments. Two ng (3xl05 cpm) of the double-stranded,
GC-containing probe used in the protein mediated ligation assays was incubated in the presence of increasing concentrations of control or in vitro phosphorylated recombinant proteins. The binding reaction was canied out at 25°C for 30 min in 20 µI of lO mM Tris-HCI, pH 7 .5.
5
mM MgCl2,50
mM KCI, 12.5% glycerol, 0.1 % Triton X-100. The samples were loadedon an 8% acrylamide gel containing 0.3% of the bisacrylamide crosslinker in 7 mM
Tris-HCl, pH 7.5 and 3.3 mM sodium acetate, pH 7.5 after a prerun at 20 mA for 30 min. The samples were electrophoresed for 2 h at 20 mA followed by autoradiography. TP2 binding
RESULTS
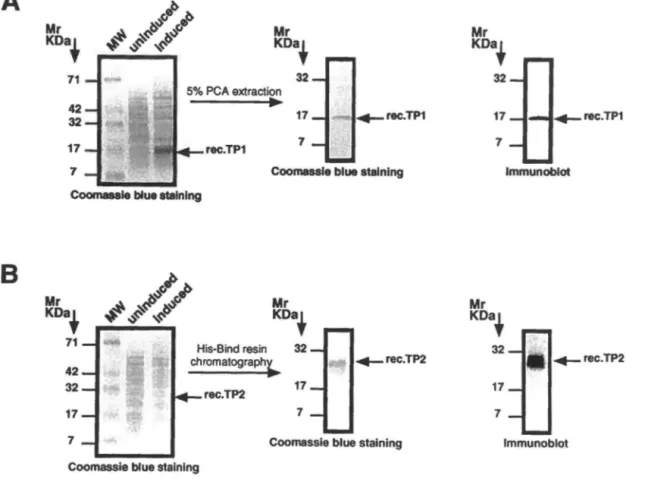
The prokaryotic expression vector pTrcHis was used to express fusion protcins from the mouse TP l and TP2 cDNAs as described under "Experirnental Procedures". As shown in
Fig. lA, IPTG-induction of TPl expression followed by perchloric acid (PCA) extraction of the induced bacterial lysate yielded a homogeneous protcin detccted as a single band when resolved by Tris-tricine PAGE (Fig. l A, middle panel). The apparent molccular weight of the protein exceeds the predicted molecular weight of the fusion protein ( l 0 KDa) duc to the persistcnce of the protein basicity in this gel system ( l 7). lmmunoreaction with the TP l antiserum confirmed the identity of the fusion protcin (Fig. l A, right panel). A similar stratcgy was used in order to express the mouse TP2 protcin cxcept that purification was carried out by nickel affinity chromatography making use of the N-terminal polyhistidine tag of the fusion protein. However, the level of TP2 expression in this system wa1t markedly lowcr than that obtained for the TPl protcin (compare Fig. lA and lB, left panels). Nickel column chromatography of the induced bacterial lysatc yielded a homogeneous preparation of the TP2 proteins (Fig. l B, middle panel) with an apparent molecular weight exceeding the predicted of the TP2 fusion protein ( 17 KDa). The identity of the fusion protcin was confirmed by immunoblot using the anti-TP2 antisemm (Fig. l B, right panel).
The putative nucleosome-destabilizing activity of the transition proteins can
be
the consequence of a capacity to induce topological modifications in the substrate DNA that would not be compatible with the nucleosome assembly or stability. Agarose gel mobility shift assay was first used to establish whether the purified fusion proteins displayed a preferential affinity for structured DNA. A preparation of pBR322 plasmid conta.ining both supercoiled (se) and nicked- circular (ne) was incubated with increasingA
B
Mr 71 32 5% PCA extraction 42 32 17 7Coomaasle blue stalnlng
17
7
Coomassle blue stalnlng
KDaf 71 42 32 17 7 His-Bind resin chromatograph .. rec.TP2 32 17 7
Coomassie blue staining Coomassie blue stalnlng
Mr KDaf 32 17 7 lmmunoblot Mr KDaf 32 17 7 lmmunoblot
Fig. 1. Purification of recombinants transition protein 1 (TPl) and 2 (TP2)
and immunoblot analyses.
Left panels, SOS-PAGE analysis of uninduced and inducedE. coli TOPlO transformed with the expression vector pTrcHisBrrPl (A) or pTrcHisBffP2
(B). Middle panels, extraction of the recombinant TPl using 5% PCA (A) and purification of the recombinant TP2 by nickel affinity chromatography (B ). Right panels, immunoblots performed with antibodies raised against TPl (A) and TP2 (B). Mr, protein size markers.
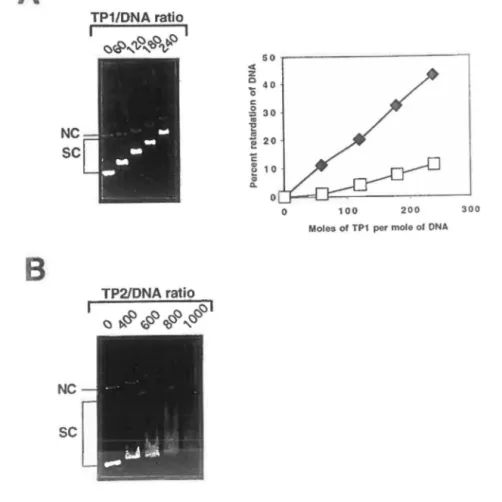
arnounts of either TP l or TP2 fusion protein up to protein I pBR322 molar ratios of 240 and l 000 respectively. As shown in Fig. 2A incrcasing concentrations of the TP l protein produces a linear rcsponse progressively retarding the mobility of the se DNA, wnereas the ne plasmià is retarded to a much lesser extent at these molar ratios (Fig. 2, right panel). The binding of TP2 protein to DNA was detected at a much higher protein to DNA ratio. Molar ratios above 400/l (l molecule/10 bp) were necessary to produce a change in
DNA mobility (Fig. 2B ). A migration pattern typical of DNA aggrcgation was howevcr observed and therefore prevented a clear assessment of relative mobility shift bctween the two plasmid topological fonns.
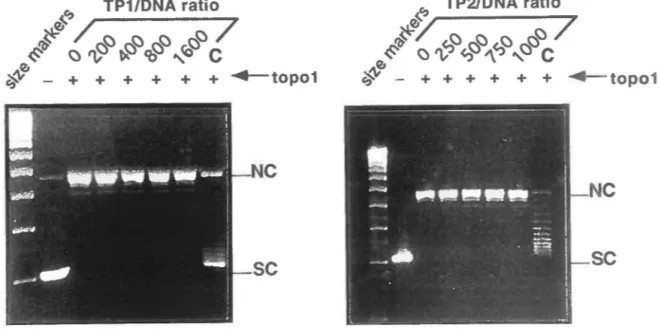
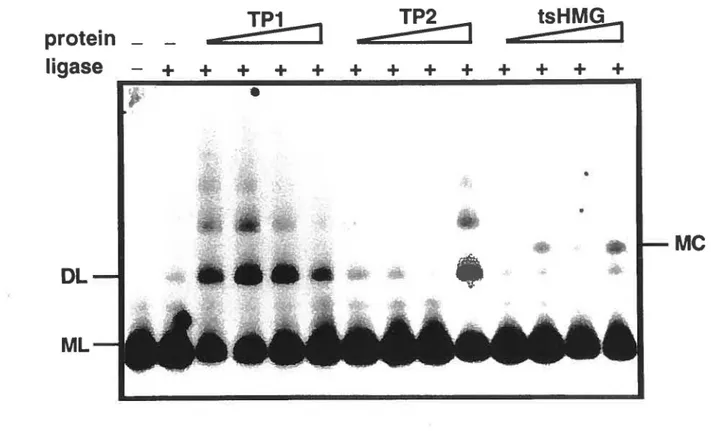
The demonstrated preference of the TPl to bind superhelical DNA in comparison with nicked circular molecules suggests that this protein might in tum change the twist and/or writhe of DNA molecules upon binding much Iike the architectural DNA -binding protein of the HMG 1/2 family (18). In order to investigate such a possibility, we tirst examined possible topoisomerase 1-mediated changes in linking number following TP 1 binding to relaxed pBR322 DNA. For comparative purposcs, the topologically active high mobility group tsHMG was used as contrai in ail assays ( 14). As shown in Fig. 3A, increasing the TPl/DNA ratio up to 1600:1 (4 molecules/10 bp) did not produce topoisomerase - dependent changes in plasmid linking number since no appeanmce of topoisomers of higher superhelical density was observed. In the same cxperimental conditions, a clear increase in plasmid superhelical density was induced by the tsHMG protein used as positive control whereas the recombinant TP2 displayed no such topological activity (Fig. 3B ). Unwinding/supercoiling activity was also not detected using the alternative "ligase-mediated supercoiling assay " (13, 19; data not shown). These experiments indicate that bath transition proteins do not produce supercoils or modification in DNA winding upon DNA binding.
A
B
NC SC NC SC TP2/DNA ratio _('\ !:) c !:)()i () ~ rc,r:s cor:s ,r:s1 ..
. ... ï;,.J ;:_,.."
z 0 40 0 i: .g..
30 "E "' ~ 20. ëë
.,
10 Q. 0 0 100 200 300Moles of TP1 per mole ol DNA